Изобретение относится к технологиям получения водорода при температурах окружающей среды из боргидридов щелочных металлов при их гидролизе в присутствии таблетированного катализатора путем добавления каталитического композитного материала к раствору боргидрида щелочного металла или же путем добавления смеси боргидрида щелочного металла с 1% раствором КОН или NaOH к композитному каталитическому материалу. Изобретение может найти применение при создании малогабаритных генераторов водорода для обеспечения работы энергоустановок, в том числе топливных элементов. Особенно это актуально для отдаленных и труднодоступных регионов, куда не осуществляется доставка газообразного водорода, а также отсутствует необходимая инфраструктура для получения водорода и заправки им баллонов высокого давления.
Известны различные способы получения чистого водорода из твердых водород-генерирующих композиций с участием воды. В большинстве случаев в их состав входят металлы, силициды металлов или гидриды металлов. При этом металлы и силициды металлов не содержат водород, и газогенерация осуществляется только за счет разложения воды, поэтому композиции на их основе называют гидрореагирующими. В качестве металлов используют Аl, Zn, Fe, Na и другие металлы.
Известен состав твердой водород-генерирующей композиции, содержащий в качестве гидрореагирующего компонента металлический магний (Пат. РФ 2241656, С01В 3/10, Способ хранения и получения водорода гидролизом магния для автономных энергетических установок с электрохимическими генераторами / Аваков В.Б., Зинин В.И., Иваницкий Б.А., Кулаков Г.В., Ландграф И.К., Хрестинин М.М. // 21.01.2003). Выделение водорода в данном случае происходит за счет гидролиза при подаче воды в виде насыщенного или перегретого пара в температурном диапазоне от 120 до 450°С. Недостатком указанной композиции является необходимость достижения высоких температур, которые сложно реализовать в переносных портативных генераторах водорода. Кроме того, образующийся гидроксид магния нерастворим, из-за чего непрореагировавший металл постепенно покрывается непористой пленкой продуктов гидролиза, что приводит к его пассивации.
Известен способ получения водорода из твердых композитов магния, алюминия или бериллия с гидроксидом натрия (до 10 мас.%), через которые пропускают воду (Пат. РФ 2544652, С01В3/08, B01J 7/02 Способ генерации водорода / Тигунцев С.Г., Тигунцев Н.С., Тигунцев П.С. // 30.07.2013). В результате химической реакции выделяется водород и тепло, а также образуется твердый шлак продуктов гидролиза, который необходимо периодически удалять. Наличие в установке нескольких реакторов, заполненных твердым композитом, позволяет осуществлять этот процесс без остановки выработки водорода. Недостатком данной композиции является сложность управления процессом.
Производительность по водороду определяется суммарной площадью поверхности активированного композита, т.к. исходные реагенты и продукты гидролиза нерастворимы в воде. Следует также отметить, что использование алюминия в качестве коммерчески доступного гидрореагирующего компонента водород-генерирующей системы осложняется наличием на его поверхности прочной непористой оксидной пленки, предотвращающей взаимодействие металла с водой. Вследствие этого, в состав твердого композита необходимо дополнительно вводить до 10 мас.% щелочи (NaOH), которая способствует удалению оксидной пленки.
Известен способ устранения прочной окисной пленки на поверхности алюминия за счет обработки порошка металла (с размером частиц не более 25 мкм) или 40% водным раствором метасиликата натрия, или водным раствором сернокислого алюминия, или водным раствором медного купороса в интервале температур от комнатной до 90°С (Пат. РФ 2417157, С01В 3/08. Гетерогенная гидрореакционная композиция для получения водорода / Милинчук В.К., Шилина А.С. // 27.10.2009). Недостатком данного изобретения является низкое содержание алюминия в твердой композиции (от 10 до 30 мас.%), что становится причиной малой емкости гидрореагирующей композиции по водороду, рассчитанной на ее массу.
Известен способ активации алюминия для получения водорода с использованием металлов III группы и сплавов на их основе, приготовленных механохимической обработкой в инертной атмосфере в течение 5-20 мин при температуре 20-80°С (Пат. РФ 2394753, С01В 3/08. Гидрореагирующая композиция для получения водорода и способ ее приготовления / Пармузинова А.В., Кравченко О.В., Булычев Б.М., Школьников Е.И., Бурлакова А.Г. // 01.04.2009; Пат. РФ 2606449, С01В 3/08 Способ активации алюминия для получения водорода / Школьников Е.И., Атманюк И.Н., Долженко А.В., Янилкин И.В. // 29.10.2014). Принцип воздействия на алюминий в этом случае заключается в проникновении жидкого сплава, преимущественно галлийсодержащего (галлама), внутрь массивного куска алюминия по границам зерен, что приводит к его быстрому охрупчиванию. При этом количество добавляемого к алюминию активирующего сплава не превышает 10% от массы гидрореагирующей композиции, что обеспечивает существенно более высокий выход водорода по сравнению с вышеописанными композициями, содержащими метасиликат натрия.
Недостатком применения сплавов галлия для модификации алюминия являются их высокая стоимость ввиду использования дорогостоящих металлов (галлия и индия), а также трудность извлечения этих металлов после генерации водорода из отработанной композиции для ее повторного использования. Более того, при хранении на воздухе реакционные свойства алюминия, обработанного галламом, ухудшаются.
Была предложена новая гидрореагирующая композиция в виде сплава алюминия с добавкой, обеспечивающей разрушение окисной пленки алюминия при взаимодействии с водой (Пат. РФ 2571131, С01В 3/08 Сплав для получения водорода на основе алюминия / Шевченко В.Г., Чупова И.А. // 01.07.2014). Роль добавки в этой композиции выполняет металлический лантан, который вводят в количестве 1,5-3,0 мас.% методом газоплазменной переконденсации в инертной атмосфере при 5000°С. Высокая химическая активность лантана позволяет активизировать процесс окисления алюминия в воде, а рост рН среды приводит к разрушению оксидной пленки, ускорению выделения водорода и увеличению степени превращения металла. Недостатками предложенного алюминий-лантанового сплава для генерирования водорода являются многостадийность и высокая энергоемкость процесса его получения.
Альтернативой алюминию в качестве гидрореагирующего компонента для твердых водород-генерирующих композиций являются силициды металлов и, в частности, силицид натрия, который не требует предварительной активации для получения чистого водорода из воды. Из-за высокой реакционной способности и пирофорности порошок силицида натрия следует предохранять от контакта с воздухом и водой. Для этой цели предложено использовать картриджи с воздухонепроницаемой мембраной (Заявка GB 2505202 А, С01В 3/06, H01M 8/06 Hydrogen generator unit and method of generating hydrogen / Mark Robert Nailis // 21.08.2012).
Известна твердая водород-генерирующая композиция для автономных портативных генераторов водорода, состоящая из гидрида магния (простой гидрид) и связующего (Пат. РФ 2345829, B01J 7/00, С01В 3/00 Композиция для получения водорода, способ ее приготовления и аппарат для генерации водорода. / Кущ С.Д., Тарасов Б.П., Булычев Б.М. // 01.11.2006). Существенными недостатками этого изобретения являются низкое содержание гидрида магния в композиции (не превышает 22,8 мас.%), а также коррозия реактора.
Анализ патентной и научной литературы показал, что наиболее часто для твердых водород-генерирующих композиций используется комплексный гидрид - (боргидрид натрия как гидрореагирующей компонент - в присутствии кислот или кислых солей, а также в присутствии катализаторов). Известны способы получения водорода путем добавления к твердому боргидриду натрия растворов кислот, как органических, таких как муравьиная, уксусная, яблочная, лимонная, щавелевая, аскорбиновая, винная, янтарная и тауриновая (Akdim О., Demirci U.B., Miele P. Acetic acid, a relatively green single-use catalyst for hydrogen generation from sodium borohydride. International Journal of Hydrogen Energy. 2009. V. 34. P. 7231-7238; Kim H.J., Shin K.-J., Kim H.-J., Han M.K., Kim H., Shul Y.-G., Jung K.T. Hydrogen generation from aqueous acid-catalyzed hydrolysis of sodium borohydride. International Journal of Hydrogen Energy. 2010. V. 35. P. 12239-12245), так и неорганических, преимущественно соляной, серной, азотной и фосфорной (Murugesan S., Subramanian V.R. Effects of acid accelerators on hydrogen generation from solid sodium borohydride using small scale devices. Journal of Power Sources. 2009. V. 187. P. 216-223; Hsu L., Huang M., Anderson G., Rubio A., Kerber M., Putnam M, Phipps, A. Evaluation of acid accelerators for an off-grid PEM fuel cell power station utilizing solid sodium borohydride for hydrogen storage. ECS Transactions. 2016. V. 75. P. 515-520; Abdul-Majeed W.S., Arslan M.T., Zimmerman W.B. Application of acidic accelerator for production of pure hydrogen from NaBН4. International Journal of Industrial Chemistry. 2014. V. 5. №15. P. 1-9). При таком способе образование водорода протекает бурно, и полная конверсия гидрида достигается в течение 1 - 4 секунд.
Снижение концентрации кислоты (Javed U., Subramanian V.(R). Hydrogen generation using a borohydride-based semi-continuous milli-scale reactor: Effects of physicochemical parameters on hydrogen yield. Energy and Fuels. 2009. V. 23. P. 408-413) или предварительная адсорбция ее на силикагеле (Manna J., Roy В., Sharma P. Efficient hydrogen generation from sodium borohydride hydrolysis using silica sulfuric acid catalyst. Journal of Power Sources. 2015. V. 275. P. 727-733) обеспечивает некоторое снижение скорости генерации водорода, и процесс завершается за несколько минут.
Именно сложность контроля скорости газогенерации является основным недостатком способа получения водорода за счет взаимодействия борогидрида натрия с кислотами. Другим недостатком является образование высокотоксичного и взрывоопасного диборана, т.к. последний при бурном протекании процесса не успевает гидролизоваться и поэтому присутствует как примесь в водородсодержащем газе (Duke B.J., Gulbert J.R., Read LA. Preparation and purification of diborane // Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 1964. P. 540-542). Еще одним недостатком этого способа является возможность частичного восстановления кислотообразующего элемента, сопровождающегося выделением его оксидов и гидридов. Так, в случае взаимодействия серной кислоты с боргидридом натрия образуются диоксид серы и сероводород, которые загрязняют получаемый газ (Хаин B.C., Мальцева Н.Н., Волков А.А. Борогидриды металлов. Том. 1. Борогидриды щелочных металлов и тетраалкил аммония - Ухта: УГТУ, 2001. 223 с.).
Известно, что впрыскивание раствора гидрокарбоната натрия в реактор с твердым боргидридом натрия позволяет получать водород после непродолжительного периода, необходимого для растворения боргидрида. С увеличением концентрации гидрокарбоната натрия в растворе до 7 мас.% скорость газогенерации возрастает, но при дальнейшем повышении содержания этой соли в дозируемой жидкости скорость выделения водорода остается постоянной. Кроме того, отмечено присутствие в газообразных продуктах монооксида и диоксида углерода (СО и СО2), для улавливания которых авторы использовали ловушку, заполненную силикагелем (Kim J.-H., Choi К.-Н., Choi Y.S. Hydrogen generation from solid NaBH4 with catalytic solution for planar air-breathing proton exchange membrane fuel cells // International Journal of Hydrogen Energy. 2010. V. 35. № 9. P. 4015-4019; Sim J.-H., Lee C.J., Kim T. Hydrogen generation from solid-state NaBH4 particles using NaHC03 agents for РЕМ fuel cell systems. Energy Procedia. 2014. V. 61. P. 2058-2061).
Недостатком этого способа получения водорода является восстановление углерода с образованием побочных продуктов реакции, частности, монооксида углерода, присутствие которого недопустимо в водородсодержащем газе, подаваемом в низкотемпературные топливные элементы с протонообменной мембраной. Избежать образования газообразных продуктов реакции, загрязняющих водород, можно только при использовании гетерогенных катализаторов (Romain P., Merland R., Mesnard R. Le borohydrure de potassium son emploi par voleseche en analyse minerale qualitative // Bull. Soc. Chim. France. 1954. V. 10. P. 1298-1303; Chandrasekhar S., Shrinidhi A. Selective aldehyde reduction in ketoaldehydes with NaBH4-Na2CO3-Н2О at room temperatures. Synthetic Communications. 2014. V. 44. P. 2051-2056).
Наиболее близким по технической сущности к заявленному решению является водород-генерирующий состав (прототип) описанный в Пат. RU (11) 2 689 587(13) C1 С01В 3/06. Композиция для получения водорода, способ ее приготовления и процесс получения водорода. / Нецкина О.В., Симагина В.И., Комова О.В., Озерова А.М. // 09.04.2018. Согласно патенту, твердая водород-генерирующая композиция для получения водорода содержит каталитическую добавку в виде борида кобальта и комплексный гидрид легких элементов, выбранный из ряда: боргидрид натрия, боргидрид калия, аминоборан. Твердая водород-генерирующая композиция может дополнительно содержать буферную добавку в виде борной кислоты. Композицию готовят механическим смешением предварительно измельченных компонентов с последующей формовкой полученной смеси путем прессования перед фасовкой в водорастворимую упаковку. Процесс получения водорода проводят при температурах окружающей среды от -40 до +80°С путем добавления к твердой водород-генерирующей композиции воды из любого природного источника или биологической жидкости. К недостаткам этого водород-генерирующего состава следует отнести: присутствие в водород-генерирующей композиции гидрида щелочного металла (источника водорода), поскольку в процессе хранения в присутствии влаги воздуха «таблетка» композиции “оплывает” за счет реакции гидролиза NaBH4 с выделением водорода, т.е. происходит несанкционированное выделение последнего в процессе хранения. Несанкционированное выделение водорода может спровоцировать его взрыв на складах хранения композитного материала.
Задача настоящего изобретения - разработка компактного твердого каталитического материала, обеспечивающего получение чистого водорода, в том числе в полевых условиях, путем добавления к водным растворам боргидридов щелочных металлов катализатора, представляющего собой твердый композитный материал.
Техническим результатом является повышение безопасности композитного материала при хранении за счет отказа от использования боргидрида натрия в составе композиции, а также удобство и простота при использовании в автономных, портативных генераторах водорода, особенно в полевых условиях.
Технический результат достигается тем, что твердый композитный материал содержит каталитический компонент в виде аморфного борида кобальта, борную кислоту (буферная добавка) и связующее - порошок ПТФЭ (тефлона), влияющий на пористость и гидрофобно-гидрофильные характеристики композитного материала.
Композитный каталитический материал содержит в качестве катализатора гидролиза гидрореагирующего компонента в расчете на взятый для гидролиза боргидрид щелочного металла: борид кобальта в количестве от 6.0 до 20 мас.%, борную кислоту (буферная добавка) в количестве не более 20 мас.%, порошок ПТФЭ (тефлона) в количестве не более 10 мас.%.
Предпочтительными боргидридами являются боргидрид натрия, боргидрид калия или их смеси.
При этом борид кобальта получают восстановлением соединений кобальта при контакте с комплексным гидридом легкого элемента, преимущественно боргидридом натрия, в том числе в твердой фазе. В качестве предшественников борида кобальта могут использоваться оксиды, гидроксиды и соли кобальта. К числу подходящих соединений кобальта относят его неорганические соли, в том числе их гидраты и аммиакаты, например борат, перборат, метаборат, хлорид, сульфат, нитрат, нитрит, гидрофосфат, дигидрофосфат, карбонат, гидрокарбонат, фосфат, ортофосфат, фосфид, иодид, иодат, бромид, фторид, нитрид, сульфид, сульфит, хлорит, ванадат, вольфрамат, алюминат, арсенит, кобальтат, титанат, молибдат, хромат, бихромат, гипохлорит, перхлорат, силикат, роданит, цианид, тиоцианат, ционат и др., а также соли кобальта органических кислот, таких как уксусная, щавелевая, муравьиная, лимонная, винная, лауриновая, пальмитиновая, салициловая, стеариновая, глутаминовая, пивалевая, коричная, валерьяновая и др. Кроме того, к кобальтсодержащим соединениям, используемым для синтеза борида кобальта, относят ацетилацетонат, гидроксид, фталоцианин и карбонил кобальта. Предпочтительным предшественником каталитически активного борида кобальта является хлорид кобальта в виде его кристаллогидрата - СoCl2⋅6Н2О.
Способ изготовления композитного каталитического материала из борида кобальта аморфной модификации, отличается тем, что композитный каталитический материал готовят механическим смешением предварительно измельченных компонентов - твердой каталитической добавки Со-В аморфной модификации, борной кислоты и порошка ПТФЭ (тефлона), осуществляют формовку полученной смеси путем прессования, в результате чего получают композитный каталитический материал в таблетированном виде.
Прессование каталитического материала осуществляют под действием пуансона, создающего в пресс-форме давление не менее 0,2 тс см-2.
Сущность предлагаемого изобретения поясняется дальнейшим описанием, примерами и фигурами, на которых изображено:
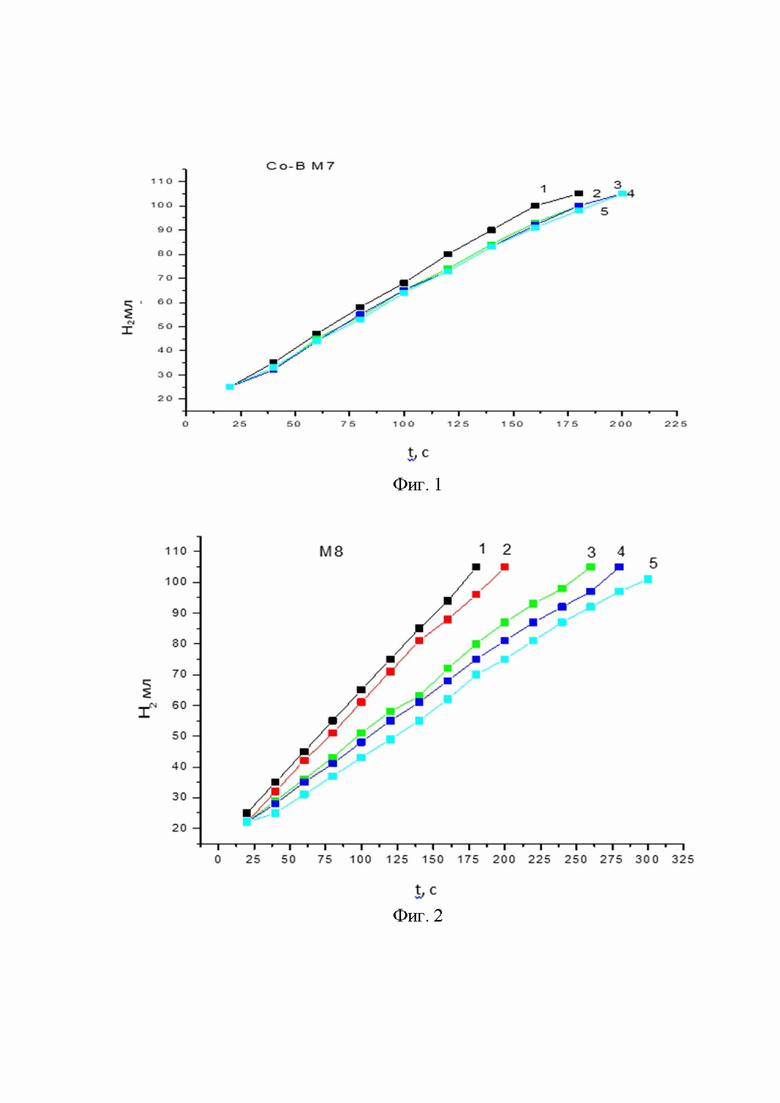
На фиг. 1 показана скорость образования водорода в процессе гидролиза NaBH4 в системе (Co-B+ NaBH4), катализатор - синтезированный Co-B (аморфный образец, высушенный при t = 90°С ). На фигуре кривыми 1-5 обозначены последовательные циклы гидролиза.
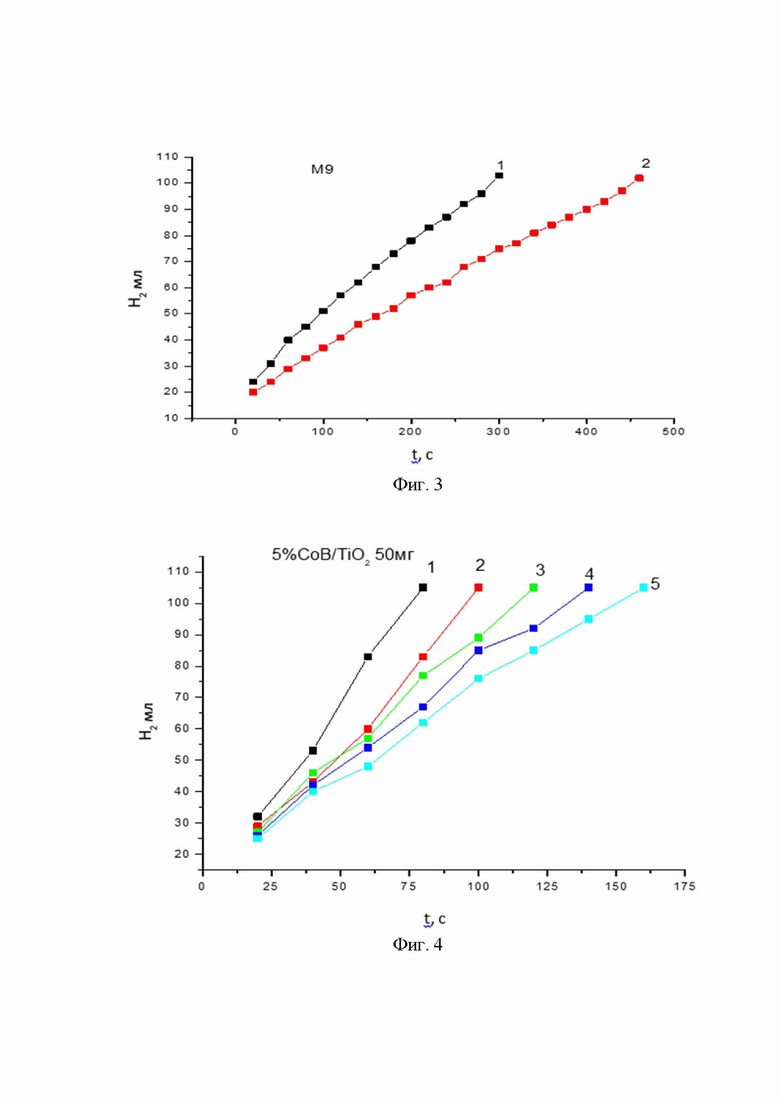
На фиг. 2 показана скорость образования водорода в процессе гидролиза NaBH4 в системе (Co-B+ NaBH4). Катализатор - синтезированный Co-B (аморфный образец, обработанный при t = 300°С). На фигуре кривыми 1-5 обозначены последовательные циклы гидролиза.
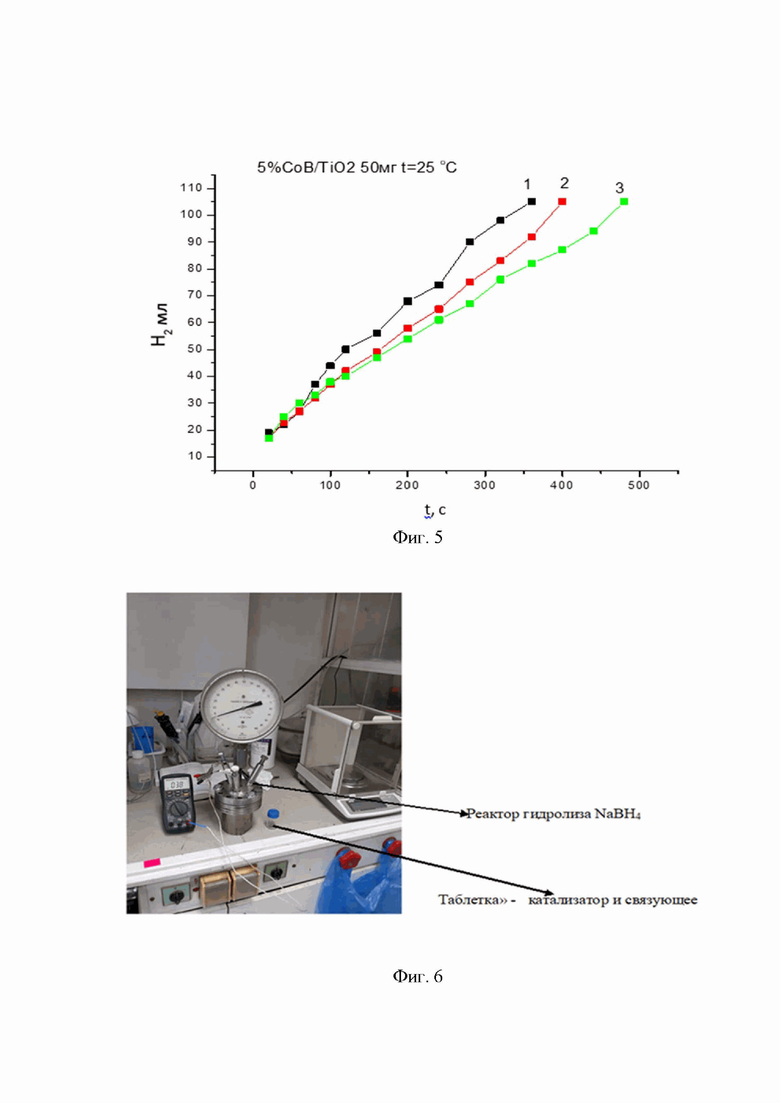
На фиг. 3 показана скорость образования водорода в процессе гидролиза NaBH4 в системе (Co-B+ NaBH4). Катализатор - синтезированный Co-B (аморфный образец, обработанный при t = 600°С). На фигуре кривыми 1-2 обозначены последовательные циклы гидролиза.
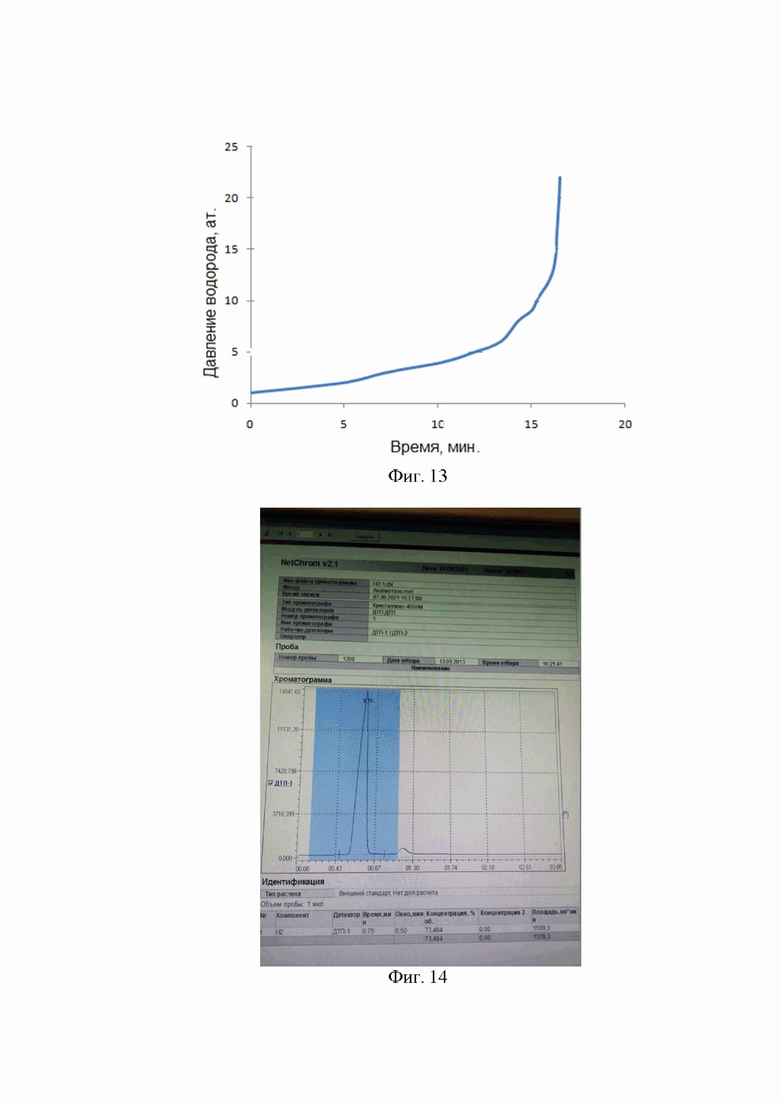
На фиг. 4 показана скорость образования водорода в процессе гидролиза NaBH4 в системе (5%Co-B/TiO2+ NaBH4) при температуре гидролиза 55°С. Катализатор - синтезированный и нанесенный на диоксид титана 5%Co-B(/TiO2). На фигуре кривыми 1-5 обозначены последовательные циклы гидролиза.
На фиг. 5 показана скорость образования водорода в процессе гидролиза NaBH4 в системе (5%Co-B/TiO2+ NaBH4) при температуре гидролиза 25°С. Катализатор - синтезированный и нанесенный на диоксид титана 5%Co-B(/TiO2). На фигуре кривыми 1-3 обозначены последовательные циклы гидролиза.
На фиг. 6 показана фотография реактора для гидролиза боргидрида натрия.
На фиг. 7 показана фотография автоматического пресса (Carver, США).
На фиг. 8 показаны агатовая ступка для приготовления механической смеси катализатора и связующего и также пресс-форма для формирования «таблеток» (а) и таблетки каталитического материала разных размеров (б).
На фиг. 9 показан реакторный блок генератора водорода с проточным реактором.
На фиг. 10 показан генератор водорода проточного типа, где:
10.1 - реакторный блок с обогреваемым корпусом;
10.2 - емкость для щелочного раствора боргидрида натрия;
10.3 - перистальтический насос для подачи раствора NaBH4 в реакторную зону гидролиза;
10.4 - цилиндр для сбора водорода и определения скорости его генерации в процессе гидролиза NaBH4.
На фиг. 11 показано загрузочное устройство для подачи таблетированного катализатора.
На фиг. 12 показан генератор водорода периодического действия.
На фиг. 13 показан график изменения давления в реакторе периодического действия во времени.
На фиг. 14 показана хроматограмма газа, полученного в результате гидролиза NaBH4.
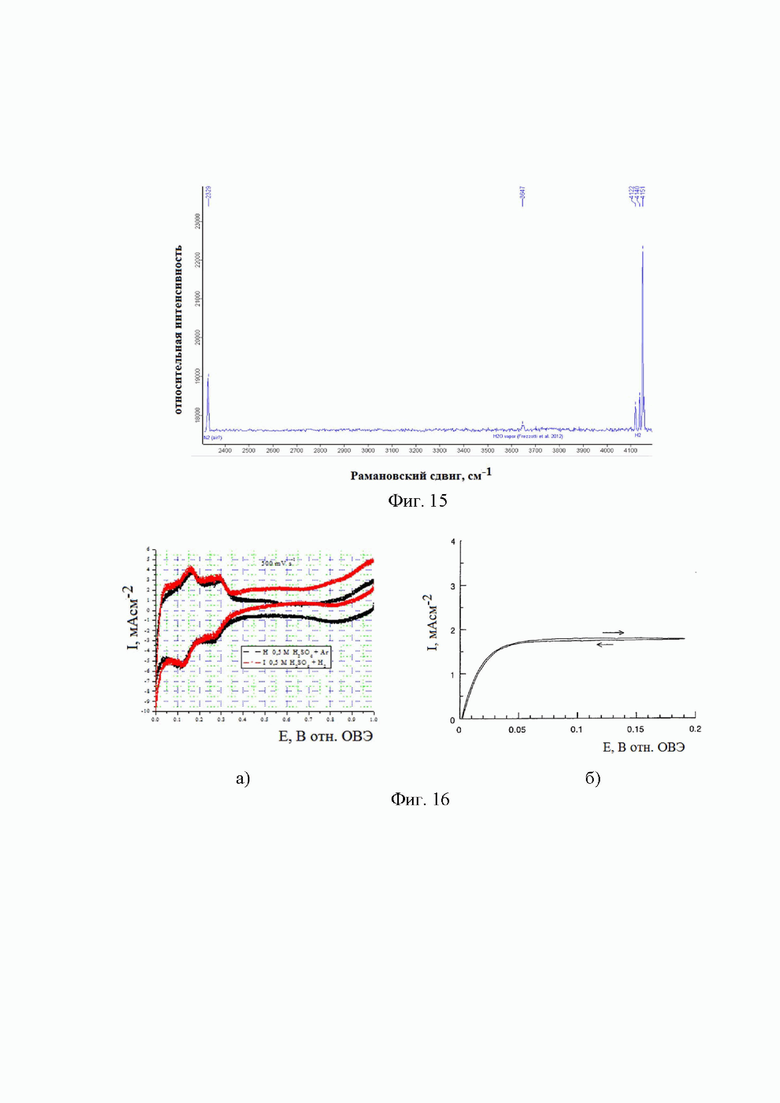
На фиг. 15 показаны данные спектроскопии комбинационного рассеивания.
На фиг. 16 приведены циклические вольтамперограммы, снятые на гладком Pt электроде в атмосфере аргона и в присутствии растворенного водорода (а); скорость вращения электрода 1000 об мин-1. Скорость развертки потенциала 5 мВ с-1 (б).
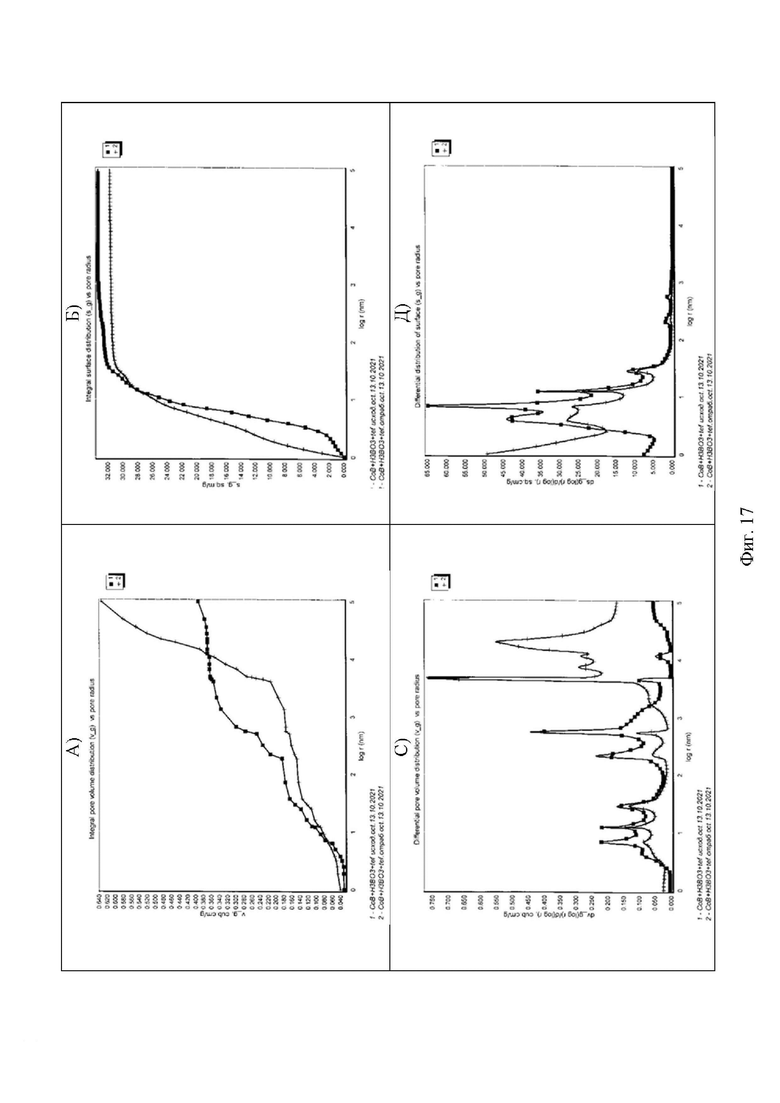
На фиг. 17 интегральные (А, Б) и дифференциальные (С, Д) кривые распределения пор по эффективным радиусам r * для таблетированного композитного катализатора (Со-В + Н3ВО3 + ПТФЭ (тефлон) до и после реакции гидролиза NaBH4 с образованием молекулярного водорода, измеренные с использованием октана, где кривая (1) с черными квадратами (исходный образец катализатора), кривая (2) с «черточками» (образец катализатора после цикла гидролиза).
Пример 1. Приготовление катализатора Со-В
Для приготовления каталитического предшественника Co-B (борида кобальта) в качестве исходных реагентов были взяты боргидрид натрия NaBH4 и хлорид кобальта CoCl2. Гидроксид натрия служил в качестве буферной добавки.
Процесс приготовления состоял в следующем. 50 мл раствора CoCl2 (0,40 моль л-1) были помещены в колбу объемом 200 мл. Затем в ту же колбу добавляли 50 мл 5% NaBH4 в 10% растворе NaOH со скоростью подачи раствора 10 мл мин-1.
2CoCl2 + 4NaBH4 + 9H2O → Co2B + 4NaCl + 12.5H 2 + 3B(OH)3 (1)
Полученный в результате реакции (1) темный осадок был тщательно промыт деионизированной водой для удаления растворимых ионов, а затем высушен в вакууме при 90°С для удаления остаточной воды и водорода. Полученный порошок имел аморфную структуру. Далее образцы этого порошка прогревали в атмосфере азота (аргона) при температуре 300°С или 600°С. Обработанные при этих температурах порошки имели кристаллическую структуру. Дальнейшее повышение температуры прогрева (до 700°С и выше) не представляется целесообразным, поскольку в этом случае в продуктах реакции обнаруживается металлический кобальт (Chuan Wu,T, Feng Wu, Ying Bai, Baolian Yic, Huamin Zhang. Cobalt boride catalysts for hydrogen generation from alkaline NaBH4 solution // Materials Letters 59 (2005) 1748- 1751).
Пример 2. Экспериментальное определение скорости гидролиза NaBH4
Условия эксперимента:
6% раствор боргидрида натрия + 1% гидроокиси натрия.
Взято в реакцию 12.5 мл раствора боргидрида натрия (содержит 0.75 г NaBH4). Количество катализатора Со-В во всех опытах составляло 20% от веса NaBH4 (0.15 г). Реакцию гидролиза проводили при температуре 25°С. Водород собирали в газометр.
Результаты эксперимента:
Со-В, высушенный при 90°С. Время гидролиза 4 мин 50 сек. Собрано 1.8 л водорода. Скорость генерации составила 2660 млН2 мин-1 г-1.
Со-В, обработанный при 300°С. Время гидролиза 2 мин 10 сек. Собрано 1.8 л водорода. Скорость генерации составила 5555 млН2 мин-1 г-1.
Со-В, обработанный при 600°С. Время гидролиза 6 мин 20 сек. Собрано 1.8 л водорода. Скорость генерации составила 2000 млН2 мин-1г-1.
Коммерческий CoB, 99% (Alfa Aesar, CAS: 12619-68-0). Время гидролиза 7 мин. при температуре 85°С. Собрано 200 мл Н2. Скорость генерации составила
190 млН2 мин-1г-1.
Таким образом, активность образца приготовленного катализатора, высушенного при температуре 90°С, составила 2660 млН2 мин-1 г-1, что выше, чем активность образца, термообработанного при температуре 600°С (2000 млН2 мин-1 г-1). Образец порошка, прогретый в атмосфере азота (аргона) при температуре 300°С, продемонстрировал наибольшую активность в реакции гидролиза боргидрида натрия (5555 млН2 мин-1 г-1), что может обеспечить работу топливного элемента (ТЭ) мощностью 830 Вт. Активность образца коммерческого катализатора СоВ оказалась существенно ниже активности всех приготовленных образцов Со-В и составила 190 млН2 мин-1 г-1 при температуре гидролиза 85°С.
Пример 3. Гидролиз боргидрида натрия в присутствии порошкового катализатора Co-B (испытания на лабораторном стенде)
На фиг. 1 - 3 представлены результаты исследования кинетики выделения водорода на образцах катализатора Со-В, полученных по описанной выше методике и термообработанных при 90°С, 300°С и 600°С, соответственно.
На фиг. 1 показана скорость образования водорода в процессе гидролиза NaBH4 в системе (Co-B+ NaBH4). Катализатор - синтезированный Co-B (аморфный образец, высушенный при t = 90°С ). Кривые 1-5 отражают скорость образования водорода в ходе последовательных циклов гидролиза. В каждом цикле гидролизу подвергается водный раствор боргидрида натрия (40 мг NaBH4 в 10 мл воды). Температура гидролиза 55°С. Содержание катализатора Со-В составляет 20% от массы NaBH4.
На фиг. 2 показана скорость образования водорода в процессе гидролиза NaBH4 в системе (Co-B+ NaBH4). Катализатор - синтезированный Co-B (аморфный образец, обработанный при t = 300°С). Кривые 1-5 отражают скорость образования водорода в ходе последовательных циклов гидролиза. В каждом цикле гидролизу подвергается водный раствор боргидрида натрия (40 мг NaBH4 в 10 мл воды). Температура гидролиза 55°С. Содержание катализатора Со-В составляет 20% от массы NaBH4.
На фиг. 3 показана скорость образования водорода в процессе гидролиза NaBH4 в системе (Co-B+ NaBH4). Катализатор - синтезированный Co-B (аморфный образец, обработанный при t = 600°С). Кривые 1, 2 отражают скорость образования водорода в ходе последовательных циклов гидролиза. В каждом цикле гидролизу подвергается водный раствор боргидрида натрия (40 мг NaBH4 в 10 мл воды). Температура гидролиза 55°С. Содержание катализатора Со-В составляет 20% от массы NaBH4.
Как видно из полученных кинетических зависимостей, активность аморфного катализатора, т.е. высушенного при температуре 90°С, и образца, полученного после обработки при температуре 300°С, практически одинакова в первом цикле гидролиза боргидрида натрия (фиг. 1 и 2). В то же время, если активность аморфного катализатора к пятому циклу снижается примерно на 10 - 20%, то активность образца катализатора Со-В с кристаллической структурой снижается более чем на 30%, что, вероятно, связано с уменьшением площади активно работающей поверхности катализатора Со-В.
Пример 4. Скорость гидролиза боргидрида натрия на катализаторе Co-B, равномерно распределенном на высокодисперсной подложке из TiO2.
Результаты исследования гидролиза боргидрида натрия на катализаторе Co-B, синтезированном по технологии, описанной выше, и равномерно распределенном на высокодисперсной подложке из диоксида титана (удельная поверхность - 74 м2 г-1, размер частиц TiO2 - 21 нм), представлены на Фиг. 4 и 5 (содержание Со-В на TiO2 составляет 5%). Нанесение СоВ на подложку из TiO2 проводили по методике описанной в ( см. Sevim Yolcular, Serdar Karaoglu. ALKU Fen Bilimleri Dergisi 2020, 2(2): 84-96)
На фиг. 4 показана скорость образования водорода в процессе гидролиза NaBH4 в системе (5%Co-B/TiO2+ NaBH4). Катализатор - синтезированный и нанесенный на диоксид титана 5%Co-B(/TiO2). Кривые 1-5 отражают скорость образования водорода в ходе последовательных циклов гидролиза. В каждом цикле гидролизу подвергается водный раствор боргидрида натрия (40 мг NaBH4 в 10 мл воды). Температура гидролиза 55°С. Содержание катализатора Со-В составляет 6,25% от массы NaBH4.
На фиг. 5 показана скорость образования водорода в процессе гидролиза NaBH4 в системе (5%Co-B/TiO2+ NaBH4). Катализатор - синтезированный и нанесенный на диоксид титана 5%Co-B(/TiO2). Кривые 1-3 отражают скорость образования водорода в ходе последовательных циклов гидролиза.. В каждом цикле гидролизу подвергается водный раствор боргидрида натрия (40 мг NaBH4 в 10 мл воды). Температура гидролиза 25°С. Содержание катализатора Со-В составляет 6,25% от массы NaBH4.
Сравнение данных по скорости генерирования водорода в присутствии катализатора Со-В при нанесении последнего на подложку из диоксида титана (Фиг. 4) и в отсутствие такой подложки (Фиг. 2) показывает, что активность 5% катализатора Со-В на высокодисперсной подложке из диоксида титана, даже при его меньшем содержании относительно взятого в реакцию боргидрида натрия (6.25% против 20%), значительно превосходит активность катализатора Со-В, не нанесенного на высокодисперсную подложку. При этом, однако, снижение температуры гидролиза до 25°С приводит к снижению скорости генерации водорода.
В некоторых экспериментах каталитический материал дополнительно содержал твердую борную кислоту в количестве не более 20 мас %. Она является слабой кислотой и выполняет роль буферной добавки, которая частично или полностью нейтрализует образующийся тетрагидроксоборат-анион.
Пример 5. Скорость генерации водорода на Со-В катализаторе, спрессованном в «таблетки»
Измерения скорости генерирования водорода при гидролизе боргидрида натрия на таблетированном катализаторе проводили в специально изготовленном автоклаве с возможностью определения давления водорода после гидролиза боргидрида натрия. Емкость реакторной зоны автоклава составляла 62 см3. Были спрессованы таблетки с катализатором на основе Сo-B следующего состава: Со-В (0.1 г), H3BO3 (0.1 г), порошок ПТФЭ (тефлона) (0.05 г). Исходя из взятого в реакцию гидролиза боргидрида натрия (0.5 г), теоретический выход водорода должен составить 1.16 л при нормальных условиях. Учитывая, что объем реакторной зоны составляет 0.062 л, давление водорода после гидролиза боргидрида должно достигнуть 19 атм.
Пример 6. В тефлоновый вкладыш автоклава объемом 62 см3 было налито 10 мл воды. Спрессованную таблетку вышеуказанного состава (100 мг СоВ (аморфный) + 100 мг Н3ВО3 + 50 мг ПТФЭ тефлона) положили на площадку внутри автоклава. Затем автоклав закрыли фланцевой крышкой. Таблетку опрокинули в воду с 500 мг NaBH4, и примерно через 3 минуты температура в автоклаве выросла до 45°С, а давление поднялось до 12.5 х 1.6 = 20 атм. Коэффициент 1.6 получен при из градуировке образцового манометра (100 делений на образцовом манометре соответствуют 160 кгс см-2).
Пример 7. Расчет давления в реакторе гидролиза NaBH4
Задано: объем тефлонового вкладыша 62 см3; объем воды - 10 мл; начальная температура - 25°С; конечная температура - 45°С.
Расчет: при гидролизе 1 моля (37.8 г) NaBH4 согласно реакции гидролиза выделяется 4 моля водорода, или 89.6 л. Соответственно, при гидролизе 0.5 г NaBH4 образуется 1.18 л Н2. Давление водорода в объеме 62 см3 (при учете объема, занимаемого подставкой для таблетки и равного ~ 2 см3) должно составить 19.6 атм, или 12.25 делений образцового манометра.
Установка для проведения соответствующего эксперимента показана на Фиг. 6, где показан реактор для гидролиза боргидрида натрия (0.5 г). Температура гидролиза - 25°С. Давление в реакторе - 19.6 атм, или 12.25 делений на образцовом манометре. Образцовый манометр рассчитан на предельное давление 160 кгс см-2.
Пример 8. Прессование «таблеток» катализатора (количество катализатора на единицу боргидрида натрия, количество связующего вещества, температура и давление прессования)
Используя результаты предварительных опытов, а также данные из литературных и патентных источников, была разработана методика прессования «таблеток» каталитического материала. Согласно этой методике, содержание катализатора, в качестве которого был выбран аморфный борид кобальта, составляет 6-20 мас.% от количества боргидрида натрия, взятого в реакцию гидролиза. Кроме того, в состав таблетированного катализатора входят 20-30 мас.% борной кислоты (буферная и нейтрализующая добавка), а также 5-10 мас.% порошкообразного ПТФЭ (тефлона) в расчете на массу боргидрида натрия. Температура прессования составляет 25°С, давление прессования в зависимости от количества исходного Со-В составляет 0.2-0.5 тс см-2. Прессование таблеток осуществляли на автоматическом прессе фирмы Carver (США), фотография которого представлена на Фиг. 7.
Ниже на Фиг. 8 показаны агатовая ступка для приготовления механической смеси катализатора и связующего, а также пресс-форма для формирования «таблеток».
Исходя из результатов проведенных экспериментов, было предложено два варианта изготовления генератора водорода оптимальной конструкции.
Первый вариант конструкции представляет собой генератор водорода (ГВ) с проточным реактором гидролиза боргидрида натрия с использованием таблетированного катализатора Co-B аморфной модификации.
Данный вариант конструкции ГВ включает в себя блок реакторной зоны в виде цилиндра из никелевой сетки, приваренной точечной сваркой к цилиндрическому остову из нержавеющей стали, с окном для загрузки таблетированного каталитического материала (Фиг. 9).
В состав проточной конструкции также входят емкость для исходного раствора боргидрида натрия в 1% щелочном растворе (стабилизатор раствора боргидрида натрия) и насос для подачи раствора боргидрида натрия в зону гидролиза (реакторную зону). Для обеспечения работы ТЭ в реактор, и непосредственно на катализатор, подается с определенной скоростью раствор боргидрида натрия. Соответствующая конструкция в сборке показана на Фиг. 10 и включает: реакторный блок с обогреваемым корпусом, емкость для щелочного раствора боргидрида натрия, перистальтический насос для подачи раствора NaBH4 в реакторную зону гидролиза.
На Фиг. 10 также показан цилиндр для сбора водорода и определения скорости его генерации в процессе гидролиза NaBH4.
После окончания работы ГВ предусмотрена его промывка для удаления жидких продуктов гидролиза, для чего нижняя зона реактора ГВ снабжена сливной пробкой. Катализатор после промывки дистиллированной водой может быть использован повторно.
Работа генератора водорода проточного типа иллюстрируется следующими примерами:
Пример 9. В емкость для исходного раствора загружено 100 мл 6% раствора NaBH4 в смеси с 1% NaOH. В реактор загружена спрессованная таблетка катализатора, содержащая 360 мг Со-В, 1.2 г Н3ВО3 и 0.3 г ПТФЭ (тефлона). Скорость подачи стабилизированного раствора боргидрида натрия в реакторную зону гидролиза непосредственно на таблетку катализатора составляла 2 мл мин-1. Температура 40°С. Выходящий из реактора газ собирали в газометр емкостью 15 л. После 50 мин насос выключен. Теоретический выход водорода 14.2 л. В газометре собрано 13.8 л. Выход составил 97.2%.
Пример 10. В емкость для исходного раствора загружено 100 мл 6% раствора NaBH4 в смеси с 1% NaOH. В реактор загружена спрессованная таблетка катализатора, содержащая 720 мг Со-В, 1.2 г Н3ВО3 и 0.3 г ПТФЭ (тефлона). Скорость подачи стабилизированного раствора боргидрида натрия в реакторную зону гидролиза непосредственно на таблетку катализатора составляла 2 мл мин-1. Температура 40°С. Выходящий из реактора газ собирали в газометр емкостью 15 л. После 50 мин насос выключен. Теоретический выход водорода 14.2 л. В газометре собрано 13.9 л водорода. Выход составил 97.8%.
Пример 11. В емкость для исходного раствора загружено 100 мл 6% раствора NaBH4 в смеси с 1% NaOH. В реактор загружена спрессованная таблетка катализатора, содержащая 1.2 г Со-В, 1.2 г Н3ВО3 и 0.3 г ПТФЭ (тефлона). Скорость подачи стабилизированного раствора боргидрида натрия в реакторную зону гидролиза непосредственно на таблетку катализатора составляла 2 мл мин-1. Температура 40°С. Выходящий из реактора газ собирали в газометр емкостью 15 л. После 50 мин насос выключен. Теоретический выход водорода 14.2 л. В газометре собрано 13.7л водорода. Выход составил 96.4%.
Проведенные эксперименты позволяют сделать вывод о том, что изменение массовой доли каталитического материала Со-В аморфной модификации в диапазоне от 6.0 до 20.0 % (от взятого в реакцию гидролиза боргидрида натрия) практически не влияет на выход водорода. Таким образом, 6% концентрация Cо-В в таблетке композита обеспечивает приемлемый выход водорода в ходе гидролиза NaBH4.
Второй вариант конструкции представляет собой ГВ с реактором периодического действия и идеологически подобен лабораторному испытательному автоклаву. Реактор этой модификации ГВ также выполнен из нержавеющей стали и содержит зону загрузки исходного таблетированного катализатора, оснащен техническим манометром для контроля давления в реакторе, рассчитанным на давление 4 МПа, и краном тонкой регулировки для подачи водорода в ТЭ (Фиг. 11).
Внутренний объем реактора периодического действия составляет 1.9 л. Технологически реактор рассчитан на давление 40 атм. Для обеспечения 3-х часовой работы ТЭ мощностью 20 Вт, в реактор единовременно загружают 18 г NaBH4 в 100 мл воды. «Таблетки», каждая из которых содержит катализатор Со-В, Н3ВО3 и порошок ПТФЭ (тефлона), после герметизации реактора опрокидывают в водный раствор боргидрида, при этом все краны ГВ в это время закрыты. При контакте «таблеток» с водой начинается реакция гидролиза. После полного гидролиза 18 г NaBH4 теоретически должно выделиться 42.6 л Н2. Учитывая, что свободный объем реактора составляет 1.9 л, давление в ГВ должно составить 22.4 атм. Генератор водорода с реактором периодического действия в сборе представлен на Фиг. 12.
Генератор водорода периодического действия в сборке после гидролиза 9 г NaBH4. Объем рабочей полости реактора гидролиза 1.9 л. Температура в реакторной зоне 40°С. Давление 11.2 атм.
В нижней зоне реактора ГВ предусмотрена сливная пробка для удаления продуктов гидролиза. После промывки реакторной зоны водой ГВ готов к последующим циклам работы. Каталитический материал, содержащийся в таблетированном виде, после многократной промывки водой может быть повторно использован для гидролиза боргидрида натрия.
Работа генератора водорода периодического действия иллюстрируется следующими примерами.
Пример 12. В реактор единовременно загружено 18 г NaBH4 в 100 мл воды. Одну «таблетку», которая содержит 1.2 г катализатора Со-В, 1.2 г Н3ВО3 и 0.9 г порошка ПТФЭ (тефлона), после герметизации реактора опрокидывают в водный раствор боргидрида, при этом все краны ГВ в это время закрыты. Температура 40°С. При контакте «таблетки» с водой начинается реакция гидролиза. После полного гидролиза 18 г NaBH4 теоретически должно выделиться 42.6 л Н2. Учитывая, что свободный объем реактора составляет 1.9 л, давление в ГВ должно составить 22.4 атм. После 16 мин гидролиза давление в реакторе достигло теоретического значения (Фиг. 13).
Пример 13. В реактор единовременно загружено 18 г NaBH4 в 100 мл воды. Две «таблетки», каждая из которых содержит 1.2 г катализатора Со-В, 1.2 г Н3ВО3 и 0.9 г порошка ПТФЭ (тефлона), после герметизации реактора опрокидывают в водный раствор, при этом все краны ГВ в это время закрыты. Температура 40°С. При контакте «таблеток» с водой начинается реакция гидролиза. После полного гидролиза 18 г NaBH4 теоретически должно выделиться 42.6 л Н2. Учитывая, что свободный объем реактора составляет 1.9 л, давление в ГВ должно составить 22.4 атм. После 12 мин гидролиза давление в реакторе достигло теоретического значения.
Пример 14. В реактор единовременно загружено 18 г NaBH4 в 100 мл воды. Три «таблетки», каждая из которых содержит 1.2 г катализатора Со-В, 1.2 г Н3ВО3 и 0.9 г порошка ПТФЭ (тефлона), после герметизации реактора опрокидывают в водный раствор, при этом все краны ГВ в это время закрыты. Температура 40°С. При контакте «таблеток» с водой начинается реакция гидролиза. После полного гидролиза 18 г NaBH4 теоретически должно выделиться 42.6 л Н2. Учитывая, что свободный объем реактора составляет 1.9 л, давление в ГВ должно составить 22.4 атм. После 8 мин гидролиза давление в реакторе достигло теоретического значения.
Таким образом, увеличивая количество катализатора в реакторной зоне удается лишь снизить время достижения максимального давления в реакторе, при этом величина давления соответствует теоретическому значению.
Каталитические материалы в виде «таблеток» после промывки водой могут быть использованы повторно для осуществления циклов гидролиза как в проточном генераторе водорода, так и в реакторе периодического действия.
Хроматограмма газа (водорода), выделившегося после гидролиза боргидрида натрия, и условия хроматографирования приведены на Фиг. 14.
Как следует из данных хроматографии, газ, выделившийся при гидролизе боргидрида натрия представляет собой водород, побочных продуктов при этом не обнаружено. Результаты хроматографического исследования согласуются с данными спектроскопии комбинационного рассеивания, что подтверждает зарегистрированный и приведенный на Фиг. 15 спектр КР.
Чистота водорода, образующегося в ходе гидролиза NaBH4, была также подтверждена методом циклической вольтамперометрии на гладком платиновом электроде в 0.5 М Н2SO4. На Фиг. 16 Циклические вольтамперограмм, снятые на гладком Pt электроде в атмосфере аргона и в присутствии растворенного водорода (а); поляризационная кривая ионизации водорода на вращающемся платиновом электроде в насыщенном Н2 из газометра 0.5 М H2SO4. Скорость вращения электрода 1000 об мин-1. Скорость развертки потенциала 5 мВ с-1 (б).
Как видно из рисунка, в присутствии растворенного водорода, подаваемого в электрохимическую ячейку из газометра, каких-либо дополнительных пиков, свидетельствующих о восстановлении/окислении возможных примесей, не обнаружено. Небольшой подьем токов в области потенциалов положительнее 0.3 В может быть связан с окислением водорода, находящегося в объеме электролита. Не обнаружено и влияния на пики адсорбции/ионизации водорода в области потенциалов 0 - 0.4 В, что свидетельствует об отсутствии в электролите примесей, которые могут адсорбироваться в двойнослойной области потенциалов платины.
Для исследования пористой структуры композитного катализатора (Со-В + Н3ВО3 + ПТФЭ (тефлон) использовали метод стандартной контактной порометрии (СКП) [1-4]. Этот метод позволяет изучать не только пористую структуру любого материала в максимально широком диапазоне радиусов пор (от 1 до 3 × 105 нм), но и их гидрофобно-гидрофильные свойства. При этом, когда в качестве измерительной жидкости используется октан, порометрические кривые описывают все имеющиеся поры; если в качестве измерительной жидкости используют воду, то измеряются только гидрофильные поры [5]. По размерам поры подразделяют на субмикропоры (средний эффективный радиус rэф< 0,2 нм), микропоры (0,2 < rэф << 1,0 нм), мезопоры (1,0 < rэф < 25 нм) и макропоры (rэф > 25 нм). Субмикро-, микро- и мезопоры присущи сорбентам и катализаторам.
На фиг. 17 показаны Интегральные (А, Б) и дифференциальные (С, Д) кривые распределения пор по эффективному радиусу для композитного материала ( Со-В + Н3ВО3 + ПТФЭ (тефлон) до и после осуществления гидролиза NaBH4, измеренные с использованием октана. Эффективный радиус пор r* = r/cosθ, где r - истинный радиус поры. Поскольку октан почти идеально смачивает все материалы с углом смачивания θ ~ 0, то в октане r * ~ r. кривая (1) с черными квадратами (исходный образец катализатора), кривая (2) с «черточками» (образец катализатора после цикла гидролиза).
Из рисунков видно, что композитный катализатор (Со-В + Н3ВО3 + ПТФЭ (тефлон) имеет максимально широкий интервал радиусов пор, варьирующихся от долей нм до 100 мкм, т.е. более 5 порядков. Следовательно, этот материал является уникальным с точки зрения диапазона радиусов пор. Микропоры ( r < 1 нм), а также широкие макропоры ( r > 103 нм) присутствуют как в исходном материале, так и в материале после реакции гидролиза. Необходимо отметить, что интегральная поверхность исходного композита (32 м2 г-1) несколько больше, чем интегральная поверхность катализатора после участия в реакции гидролиза боргидрида натрия с образованием молекулярного водорода (30 м2 г-1), вероятно, вследствие некоторого перераспределения пор с разным эффективным радиусом, а именно за счет снижения количества мезопор и увеличения доли макропор. Сложная форма зависимости θ от r связана с неравномерным распределением гидрофильных и гидрофобных частиц, обусловленным присутствием в композите тефлона.
При осуществлении изобретения достигается отсутствие примесей диборана, оксидов серы и углерода в получаемом водородсодержащем газе.
Введение в состав каталитического материала аморфного Со-В, предварительно полученного из соединений кобальта, преимущественно хлорида кобальта (гидрата). Это позволяет избежать потерь водорода из-за расходования гидрида на формирование активной фазы кобальтсодержащего катализатора непосредственно при газогенерации.
Добавление борной кислоты в состав каталитического материала в качестве буферной добавки позволяет частично или полностью нейтрализовать образующийся тетрагидроксоборат-анион.
Таблетирование каталитического материала под действием пуансона обеспечивает безопасность при его хранении и транспортировке.
Получение боридов кобальта путем восстановления соединений кобальта, преимущественно хлорида кобальта, при контакте с комплексным гидридом легкого элемента, преимущественно боргидридом натрия, в виде аморфного порошка со средним размером частиц порядка 30 нм обусловливает высокую каталитическую активность материала в процессе генерации водорода.
Измельчение и механическое смешение твердых компонентов (Со-В, борной кислоты и порошка ПТФЭ (тефлона) можно осуществлять при механохимическом воздействии в мельницах или дезинтеграторах.
Таким образом, приготовленная таблетированная композиция характеризуется безопасностью при хранении и транспортировке, а также удобством и простотой при использовании в автономных, портативных генераторах водорода, особенно в полевых условиях.
Разработанные катализаторы имеют ряд существенных отличий от прототипа:
- отсутствие в каталитическом материале боргидрида натрия позволяет хранить катализатор даже во влажной атмосфере без опасения вызвать несанкционированное выделение водорода,
- в отличие от прототипа, содержание активного каталитического материала в расчете на единицу водород-генерирующего боргидрида щелочного металла в три раза меньше при той же эффективности,
- добавление ПТФЭ (тефлона) в композиционный материал позволяет придать последнему гидрофобные свойства, а также позволяет облегчить извлечение таблетированного материала из пресс-формы,
- таблетирование каталитического материала создает удобства при хранении и транспортировке, а также простоту при использовании в автономных, портативных генераторах водорода, особенно в полевых условиях.
Таким образом, предлагаемое изобретение может найти применение в качестве источника водорода для малогабаритных генераторов водорода, являющихся неотъемлемой частью энергоустановок, в том числе на топливных элементах. Особенно это актуально для отдаленных и труднодоступных регионов, куда доставка газообразного водорода не осуществляется, а также отсутствует необходимая инфраструктура для получения водорода и заправки им баллонов высокого давления.
1. Volfkovih, Yu.M. and Bagotzky, V.S., The method of standard porosimetry 2. Investigation of the formation of porous structures, J. Power Sources, 1994, vol. 48, p. 339.
2. Volfkovich, Yu.M., Filippov, A.N., and Bagotsky, V.S., Structural properties of porous materials and powders used in different fields of science and technology, London: Springer, 2014.
3. Volfkovich, Yu.M., Sakars, A.V., and Volinsky A.A., Application of the standard porosimetry method for nanomaterials, Int. J. Nanotechnol., 2005, vol. 2, p. 292.
4. Dzyazko, Yu.S., Ponomaryova, L.N., Volfkovich, Yu.M., Trachevskii, V.V., and Palchik, A.V., Ion-exchange resin modified with aggregated nanoparticles of zirconium hydrophosphate. Morphology and functional properties, Microporous Mesoporous Mater., 2014, vol. 198, p. 55.
5. Rouquerol, J., Baron, G., Denoyel, R., Giesche, H., Groen, J., Klobes, P., Levitz, P., Neimark, A.V., Rigby, S., Skudas, R., Sing, K., Thommes, M., and Unger, K., Pure Appl. Chem., 2012, vol. 84, p. 107.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ ДЛЯ ПОЛУЧЕНИЯ ВОДОРОДА, СПОСОБ ЕЕ ПРИГОТОВЛЕНИЯ И ПРОЦЕСС ПОЛУЧЕНИЯ ВОДОРОДА | 2018 |
|
RU2689587C1 |
| Способ получения водорода из боргидрида натрия и воды в присутствии катализатора | 2016 |
|
RU2663066C2 |
| КАТАЛИЗАТОР (ВАРИАНТЫ), СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И ПРОЦЕСС ПОЛУЧЕНИЯ ВОДОРОДА ИЗ РАСТВОРОВ ГИДРИДОВ | 2007 |
|
RU2323045C1 |
| КОМПОЗИЦИЯ ДЛЯ ПОЛУЧЕНИЯ ВОДОРОДА, СПОСОБ ЕЕ ПРИГОТОВЛЕНИЯ И АППАРАТ ДЛЯ ГЕНЕРАЦИИ ВОДОРОДА | 2006 |
|
RU2345829C2 |
| КАТАЛИЗАТОР, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И СПОСОБ ФОТОКАТАЛИТИЧЕСКОГО ПОЛУЧЕНИЯ ВОДОРОДА | 2022 |
|
RU2800948C1 |
| КАТАЛИЗАТОР, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И СПОСОБ ФОТОКАТАЛИТИЧЕСКОГО ПОЛУЧЕНИЯ ВОДОРОДА | 2015 |
|
RU2603190C1 |
| КАТАЛИЗАТОР ДЛЯ ЭЛЕКТРОХИМИЧЕСКОГО ВОССТАНОВЛЕНИЯ КИСЛОРОДА | 2008 |
|
RU2431699C2 |
| Способ получения катализатора для восстановления окиси углерода водородом | 1977 |
|
SU884555A3 |
| ПОРТАТИВНЫЙ ИСТОЧНИК ТОКА НА ОСНОВЕ ПРЯМОГО ОКИСЛЕНИЯ БОРГИДРИДОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ | 2009 |
|
RU2402117C1 |
| ПОРТАТИВНЫЙ ИСТОЧНИК ТОКА | 2009 |
|
RU2396639C1 |



Изобретение относится к технологиям получения водорода из боргидридов щелочных металлов при их гидролизе в присутствии катализатора. Предложены композитный каталитический материал для получения чистого водорода, содержащий по массе из расчёта на боргидрид щелочного металла 6,0-20,0% борида кобальта, не более 20% борной кислоты и не более 10% порошка тефлона, и способ изготовления предложенного композитного каталитического материала путём механического смешения измельчённых компонентов, с дальнейшей формовкой смеси в таблетированный вид. Технический результат - повышение безопасности при хранении и транспортировке композитного материала, который используется в качестве автономного генератора водорода. 2 н. и 1 з.п. ф-лы, 17 ил., 14 пр.
1. Композитный каталитический материал для получения чистого водорода, содержащий в качестве катализатора гидролиза гидрореагирующего компонента в расчете на взятый для гидролиза боргидрид щелочного металла: борид кобальта в количестве от 6.0 до 20 мас.%, борную кислоту в количестве не более 20 мас.%, порошок ПТФЭ (тефлона) в количестве не более 10 мас.%.
2. Способ изготовления композитного каталитического материала из борида кобальта аморфной модификации, отличающийся тем, что композитный каталитический материал готовят механическим смешением предварительно измельченных компонентов - твердой каталитической добавки Со-В аморфной модификации, борной кислоты и порошка ПТФЭ (тефлона), осуществляют формовку полученной смеси путем прессования, в результате чего получают композитный каталитический материал в таблетированном виде.
3. Способ по п.2, отличающийся тем, что прессование каталитического материала осуществляют под действием пуансона, создающего в пресс-форме давление не менее 0,2 тс см-2.
| JP 2011518244 A, 23.06.2011 | |||
| КОМПОЗИЦИЯ БИТУМНОГО ВЯЖУЩЕГО И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2008 |
|
RU2458091C2 |
| US 0007592381 B2, 22.09.2009 | |||
| Устройство для облучения опухолей | 1989 |
|
SU1643016A1 |
| Полимерно-битумная композиция для кровельных материалов и блок-сополимер, входящий в её состав | 2020 |
|
RU2767536C1 |
Авторы
Даты
2023-04-25—Публикация
2022-09-20—Подача