ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Эта заявка заявляет приоритет предварительной заявки на патент США, серийный №62/320,352, поданной 8 апреля 2016 г., полное содержание которой включено в данный документ посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0002] Ретиноиды представляют собой класс соединений, структурно родственных витамину А, включающий природные и синтетические соединения. Было обнаружено, что несколько групп ретиноидов являются клинически применимыми в лечении дерматологических и онкологических заболеваний. Ретиноевая кислота и другие ее ретиноидные аналоги природного происхождения (9-цис-ретиноевая кислота, полностью транс-3,4-дидегидроретиноевая кислота, 4-оксоретиноевая кислота и ретинол) являются плейотропными регуляторными соединениями, которые модулируют структуру и функцию широкого ряда воспалительных, иммунных и структурных клеток. Они являются важными регуляторами пролиферации, дифференцировки и морфогенеза эпителиальных клеток в легких. Ретиноиды оказывают свое биологическое действие посредством ряда гормональных ядерных рецепторов, которые представляют собой индуцируемые лигандами транскрипционные факторы, принадлежащие суперсемейству стероидных/тиреоидных рецепторов.
[0003] Ретиноидные рецепторы классифицированы на два семейства - рецепторы ретиноевой кислоты (RAR) и ретиноидные Х-рецепторы (RXR), каждый из которых состоит из трех разных подтипов (α, β и γ). Каждый подтип семейства генов RAR кодирует переменное число изоформ, получаемых в результате дифференциального сплайсинга двух первичных транскриптов RNA. Полностью транс-ретиноевая кислота является физиологическим гормоном для рецепторов ретиноевой кислоты и связывается с приблизительно одинаковой аффинностью со всеми тремя подтипами RAR, но не связывается с рецепторами RXR, для которых природным лигандом является 9-цис-ретиноевая кислота. Ретиноиды имеют противовоспалительное действие, меняют ход дифференцировки эпителиальных клеток и ингибируют выработку матрикса стромальных клеток. Эти свойства привели к разработке местных и системных терапевтических средств на основе ретиноидов для дерматологических расстройств, таких как псориаз, акне и гипертрофические шрамы на коже. Другие применения включают контроль течения острого промиелоцитарного лейкоза, адено- и плоскоклеточной карциномы и фиброза печени.
[0004] Ограничение терапевтического применения ретиноидов обусловлено относительной токсичностью, наблюдаемой для ретиноидов природного происхождения, полностью транс-ретиноевой кислоты и 9-цис-ретиноевой кислоты. Эти природные лиганды являются неселективными в контексте подтипа RAR и, следовательно, оказывают плейотропное действие на весь организм, которое часто является токсичным.
[0005] Были описаны различные ретиноиды, которые избирательно или специфически взаимодействуют с рецепторами RAR или RXR или со сцецифическими подтипами (α, β, γ) в пределах класса. RARA-специфические агонисты выглядели многообещающими в отношении лечения раков и многие были взяты в клинические исследования на людях. Однако только один RARA-специфический агонист, тамибаротен, был когда-либо утвержден для лечения рака. Более того, тамибаротен утвержден только в Японии и только для лечения острого промиелоцитарного лейкоза, несмотря на клинические исследования в США и Европе. Расхождение между теоретической эффективностью агонистов RARA при раке и отсутствием утверждения таких агентов регуляторными органами поднимает вопрос о том, почему такие агонисты не являются эффективными и безопасными для людей. Следовательно, существует необходимость в лучшем понимании того, почему агонисты RARA не соответствуют своему терапевтическому потенциалу.
[0006] Недавние достижения в области геномных технологий и понимании генных регуляторных цепей привело к открытию суперэнхансеров. Тогда как многие гены в данной ткани или в данном типе рака могут регулироваться присутствием энхансеров вблизи кодирующей области гена, небольшая их часть представляет сильно ассиметричную и непропорционально большое скопление транскрипциональных меток и механизмов по сравнению со всеми другими активными генами. Недавние открытия позволяют предположить, что такие энхансеры связаны с генами, имеющими непосредственное отношение к функции и выживанию клетки, в которой они находятся. Следовательно, связь суперэнхансера с геном указывает на относительную значимость указанного гена для выживания этой клетки.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0007] В настоящем изобретении предложены технологии для выявления одного или более биомаркеров IRF8 (например, присутствия, уровня, формы и/или активности одного или более компонентов или продуктов гена IRF8, включая, например, эффективность, порядковый ранг или показатель распространенности суперэнхансера IRF8 и уровень или показатель распространенности мРНК IRF8). В нестоящем изобретении продемонстрировано, что клетки {например, раковые клетки или клетки, полученные от субъекта, страдающего от не-ОПЛ ОМЛ или МДС), содержащие один или более биомаркеров IRF8, причем биомаркер IRF8 представляет собой или включает экспрессию одного или более из повышенных уровней мРНК IRF8 или суперэнхансера, связанного с геном IRF8, являются более восприимчивыми к действию агониста RARA, такого как тамибаротен.
[0008] В различных вариантах реализации, аспектах и альтернативных вариантах этого изобретения решается задача определения, какие клеточные популяции являются чувствительными к агонистам рецептора альфа ретиноевой кислоты («RARA»), определения популяций пациентов, на которых лечение агонистами RARA оказывает благоприятное воздействие (например, путем стратификации пациентов для лечения агонистом RARA; отделения пациентов, восприимчивых к агонисту RARA, от невосприимчивых), и предоставления вариантов лечебной терапии, направленных на такие популяции пациентов. Решение основано, по меньшей мере частично, на открытии, что повышенная экспрессия одного или более биомаркеров IRF8 в определенных раковых клетках указывает на то, что такие клетки будут значительно восприимчивее, чем аналогичные клетки с отсутствием повышенного количества биомаркеров IRF8, к лечению агонистом RARA (например, тамибаротеном).
[0009] В некоторых вариантах реализации настоящее изобретение относится к способу лечения рака (например, не-ОПЛ ОМЛ или МДС) у субъекта (например, человека) на основании уровня мРНК IRF8 в раковых клетках субъекта, включающему этап введения субъекту количества агониста RARA (например, тамибаротена), эффективного для лечения заболевания. В некоторых аспектах этих вариантов реализации уровень мРНК IRF8 в раковых клетках субъекта равен или превышает предварительно определенный пороговый уровень.
[0010] В некоторых вариантах реализации настоящее изобретение относится к способу лечения рака, включающему этап введения тамибаротена субъекту, имеющему рак, причем определено, что рак характеризуется наличием биомаркера IRF8, при этом биомаркер IRF8 представляет собой или включает экспрессию одного или более из повышенных уровней мРНК IRF8 или суперэнхансера, связанного с геном IRF8.
[0011] В некоторых вариантах реализации настоящее изобретение относится к способу, включающему этап применения терапии к субъекту, у которого определено отсутствие экспрессии одного или более из повышенных уровней мРНК RARA или суперэнхансера, связанного с геном RARA; и отсутствие экспрессии одного или более из повышенных уровней мРНК IRF8 или суперэнхансера, связанного с геном IRF8, причем терапия не включает введение тамибаротена.
[0012] В некоторых вариантах реализации настоящее изобретение относится к способу лечения рака, включающему этап применения терапии к субъекту, у которого определено (а) отсутствие экспрессии одного или более из повышенных уровней мРНК RARA или отсутствует суперэнхансер, связанный с геном RARA, чьи эффективность и/или порядковый ранг превышают предварительно определенное пороговое значение; и (b) присутствие экспрессии одного или более из повышенных уровней мРНК IRF8 или суперэнхансера, связанного с геном IRF8, причем терапия представляет собой применение тамибаротена.
[0013] В некоторых вариантах реализации настоящее изобретение относится к способу лечения рака, включающему этап применения терапии к субъекту, у которого определено отсутствие экспрессии одного или более из повышенных уровней мРНК RARA или суперэнхансера, связанного с геном RARA; и присутствие экспрессии одного или более из повышенных уровней мРНК IRF8 или суперэнхансера, связанного с геном IRF8, причем терапия представляет собой применение тамибаротена.
[0014] В некоторых вариантах реализации настоящее изобретение относится к способу лечения рака, включающему этап получения информации, относящейся к уровню мРНК IRF8 у субъекта, страдающего от рака; и введение субъекту тамибаротена, если информация указывает, что уровень мРНК IRF8 или уровень суперэнхансера равен эталонному уровню или превышает его. В некоторых аспектах эталонный уровень представляет собой предварительно определенное пороговое значение. В некоторых аспектах предварительно определенное пороговое значение представляет собой предельное значение или предельный показатель распространенности.
[0015] В некоторых вариантах реализации настоящее изобретение относится к способу лечения рака, включающему этапы получения информации, относящейся к наличию суперэнхансера, связанного с геном IRF8, у субъекта, страдающего от рака; и введение субъекту тамибаротена, если информация указывает, что суперэнхансер связан с геном IRF8.
[0016] В некоторых вариантах реализации настоящее изобретение относится к способу прогнозирования эффективности агониста RARA при лечении рака, включающему этапы определения наличия клеток рака, имеющих уровень мРНК IRF8, равный эталонному уровню или превышающий его, причем уровень мРНК IRF8, равный эталонному уровню или превышающий его, является прогностическим в отношении эффективности агониста RARA при лечении. В некоторых аспектах эталонный уровень представляет собой предварительно определенное пороговое значение. В некоторых аспектах предварительно определенное пороговое значение представляет собой предельное значение или предельный показатель распространенности.
[0017] В некоторых вариантах реализации настоящее изобретение относится к способу прогнозирования эффективности агониста RARA при лечении рака, включающему этапы определения у субъекта, страдающего от рака, наличия клеток рака, характеризующихся присутствием суперэнхансера, связанного с геном IRF8, причем присутствие суперэнхансера, связанного с геном IRF8, указывает на эффективность лечения рака агонистом RARA.
[0018] В некоторых вариантах реализации настоящее изобретение относится к способу, включающему этапы получения биологического образца, содержащего раковые клетки субъекта, страдающего от рака; и выявление в биологическом образце одного или более из уровня мРНК IRF8, равного эталонному уровню или превышающего его; или суперэнхансера, связанного с геном IRF8. В некоторых аспектах эталонный уровень представляет собой предварительно определенное пороговое значение. В некоторых аспектах предварительно определенное пороговое значение представляет собой предельное значение или предельный показатель распространенности.
[0019] В некоторых вариантах реализации настоящее изобретение относится к способу диагностирования, прогнозирования или лечения субъекта, страдающего от рака, включающему этапы получения образца рака от субъекта; и определения в образце одного или более из уровня мРНК IRF8 или присутствия суперэнхансера, связанного с геном IRF8, у субъекта.
[0020] В некоторых вариантах реализации настоящее изобретение относится к способу диагностирования, прогнозирования или лечения субъекта, страдающего от рака, включающему этапы получения образца рака от субъекта; определения в образце уровня мРНК IRF8 или наличия суперэнхансера, связанного с геном IRF8, у субъекта; и введение терапевтической композиции, содержащей агонист RARA, в случае одного или более из (а) наличия уровня мРНК IRF8, равного эталонному уровню или превышающего его; или (b) наличия суперэнхансера, связанного с геном IRF8. В некоторых аспектах эталонный уровень представляет собой предварительно определенное пороговое значение. В некоторых аспектах предварительно определенное пороговое значение представляет собой предельное значение или предельный показатель распространенности.
[0021] В некоторых вариантах реализации настоящее изобретение относится к способу, включающему выявление одного или более из уровня мРНК RARA или эффективности или порядкового ранга суперэнхансера, связанного с геном RARA, в биологическом образце, полученном от субъекта с раком; и выявление одного или более из уровня мРНК IRF8 или суперэнхансера, связанного с геном IRF8, в биологическом образце, если биологический образец не экспрессирует одно или более из повышенного уровня мРНК RARA, равного эталонному уровню или превышающего его, или суперэнхансера, связанного с геном RARA, который имеет эффективность или порядковый ранг, равные предварительно определенному пороговому значению или превышающие его. В некоторых аспектах эталонный уровень представляет собой предварительно определенное пороговое значение. В некоторых аспектах предварительно определенное пороговое значение представляет собой предельное значение или предельный показатель распространенности.
[0022] В некоторых вариантах реализации настоящее изобретение относится к способу, включающему выявление одного или более из уровня мРНК RARA или эффективности или порядкового ранга суперэнхансера, связанного с геном RARA, в биологическом образце, полученном от субъекта с раком; и выявление одного или более из уровня мРНК IRF8 или суперэнхансера, связанного с геном IRF8, в биологическом образце, если биологический образец не экспрессирует одно или более из повышенного уровня мРНК RARA, равного эталонному уровню или превышающего его, или эффективность или порядковый ранг суперэнхансера, связанного с геном RARA, равные предварительно определенному пороговому значению или превышающие его.
[0023] В некоторых вариантах реализации настоящее изобретение относится к способу, включающему выявление одного или более из уровня мРНК IRF8 или суперэнхансера, связанного с геном IRF8, в биологическом образце, полученном от субъекта с раком; и выявление одного или более из уровня мРНК RARA или эффективности или порядкового ранга суперэнхансера, связанного с геном RARA, в биологическом образце, если биологический образец не экспрессирует одно или более из повышенного уровня мРНК IRF8, равного эталонному уровню или превышающего его, или суперэнхансера, связанного с геном IRF8.
[0024] В некоторых вариантах реализации настоящее изобретение относится к способу, включающему выявление одного или более из уровня мРНК IRF8 или суперэнхансера, связанного с геном IRF8, в биологическом образце, полученном от субъекта с раком; и выявление одного или более из уровня мРНК RARA или эффективности или порядкового ранга суперэнхансера, связанного с геном RARA, в биологическом образце, если биологический образец экспрессирует одно или более из повышенного уровня мРНК IRF8, равного эталонному уровню или превышающего его, или суперэнхансера, связанного с геном IRF8.
[0025] В некоторых вариантах реализации настоящее изобретение относится к способу диагностирования и лечения субъекта-человека, страдающего от заболевания, выбранного из не-ОПЛ ОМЛ и МДС, включающему:
a. диагностирование, имеет ли субъект чувствительную к тамибаротену форму заболевания на основании уровня мРНК IRF8, которая согласно предыдущему определению присутствует в образце пораженных заболеванием клеток от субъекта; и
b. введение субъекту количества тамибаротена, эффективного для лечения заболевания.
[0026] В некоторых аспектах этих вариантов реализации уровень мРНК IRF8 равен предварительно определенному пороговому значению или превышает его.
[0027] В некоторых аспектах любого из вышеприведенных вариантов реализации, которые включают лечение субъекта тамибаротеном, субъекту вводят комбинацию тамибаротена и второго терапевтического агента.
[0028] В некоторых вариантах реализации настоящее изобретение относится к способу лечения рака, выбранного из не-ОПЛ и МДС, у субъекта на основании уровня мРНК RARA или уровня мРНК IRF8 в раковых клетках субъекта, при этом лечение включает введение субъекту комбинации тамибаротена и второго терапевтического агента. В некоторых аспектах этих вариантов реализации субъект имеет уровень мРНК RARA, равный пороговому значению или превышающий его. В некоторых аспектах этих вариантов реализации субъект имеет уровень мРНК IRF8, равный пороговому значению или превышающий его. В некоторых аспектах этих вариантов реализации субъект имеет уровень мРНК RARA, равный пороговому значению или превышающий его, и уровень мРНК IRF8, равный пороговому значению или превышающий его. В некоторых аспектах этих вариантов реализации субъект страдает от не-ОПЛ ОМЛ.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0029] На фиг. 1 изображены уровни мРНК IRF8 в семи разных линиях клеток ОМЛ. Линии клеток, обозначенные красными столбиками, демонстрируют существенную восприимчивость к обработке тамибаротеном. Линии клеток, обозначенные синими столбиками, демонстрируют слабую восприимчивость к обработке тамибаротеном или ее отсутствие.
[0030] На фиг. 2 показана корреляция антипролиферативной эффективности тамибаротена (значение EC50, нМ) с уровнями мРНК IRF8, определенными посредством РНК-секвенирования. Следует отметить, что верхняя левая точка с уровнем мРНК IRF8=1 (log10) и значением ЕС50 тамибаротена, принятым за 50 (не чувствительный), представляет данные по 2 линиям клеток ОМЛ с низкими уровнями мРНК IRF8 и отсутствием антипролиферативного ответа на тамибаротен. Корреляция чувствительности к тамибаротену с уровнями мРНК IRF8 имела высокую значимость (р=0,0001, корреляция Спирмена, двусторонняя).
[0031] На фиг. 3 изображен график упорядочения по рангу уровней мРНК IRP8 в образцах ОМЛ отдельных пациентов и в линиях клеток ОМЛ, полученных посредством РНК-секвенирования. Указаны линия клеток ОМЛ PL21, которая представляла линию клеток с самым низким уровнем мРНК IRP8 среди всех восприимчивых линий, и Kasumi, которая представляла линию клеток с самым высоким уровнем мРНК IRF8 среди всех невосприимчивых к тамибаротену линий. В этой популяции предельный показатель распространенности 25% равен значению ТНМ по данным РНК-секвенирования, составляющему приблизительно log2(7).
[0032] На фиг. 4 показана корреляция между уровнем мРНК IRF8 и уровнем мРНК RARA в линиях клеток не-ОПЛ ОМЛ, которые исследовали в отношении ответа на тамибаротен.
[0033] На фиг. 5 показана корреляция между уровнем мРНК IRF8 и уровнем мРНК RARA в образцах популяции пациентов с ОМЛ. Пунктирные линии представляют предельный показатель распространенности в 25% для каждой мРНК.
[0034] На фиг. 6 показана корреляция антипролиферативной эффективности тамибаротена и эффективности энхансера IRF8 в линиях клеток ОМЛ. График чувствительности линии клеток ОМЛ к тамибаротену (значение ЕС50, нМ) в виде функции от показателя RECOMB для энхансера IRF8. Следует отметить, что самая левая точка с показателем энхансера IRF8=0 и значением ЕС50 тамибаротена, принятым за 50 пМ (невосприимчивый), представляет результаты 3 линий клеток ОМЛ с отсутствием выявляемого пика энхансера IRF8 и отсутствием антипролиферативного ответа на тамибаротен.
[0035] На фиг. 7 изображена эффективность энхансера IRF8 в образцах пациентов с ОМЛ. График упорядочения по рангу эффективности энхансера IRF8 согласно методу оценки RECOMB для образцов 66 пациентов с ОМЛ. Каждый столбик представляет эффективность энхансера IRF8 для одного пациента с ОМЛ. По оси Y отложена эффективность отдельного энхансера IRF8 в виде значения, кратного предельному значению (определенному как 1,0, показанному пунктирной линией) между суперэнхансерами (>1,0) и типичными энхансерами (≤1,0). Образцы пациентов, превышающие этот порог, отображены белым цветом, тогда как образцы ниже этого порога - черным. 14 из 66 образцов пациентов (21% популяции) превысили порог 1,0, и их посчитали содержащими СЭ IRF8.
[0036] На фиг. 8 показана корреляция уровней мРНК IRF8 с эффективностью энхансера IRF8 в образцах пациентов с ОМЛ. График представленности транскрипта мРНК IRF8 по данным РНК-секвенирования с квантильной нормализацией (log2 ТНМ; ось Y) в виде функции эффективности энхансера IRF8 RECOMB (ось X) в 49 первичных образцах пациентов (тех, для которых зарегистрированы значения для энхансера и экспрессии). Оценочный коэффициент Спирмена составляет ~0,81 с p-значением 2,2×10-12.
[0037] На фиг. 9 изображено распределение эффективности энхансера IRF8 в линиях клеток ОМЛ. График эффективности энхансера IRF8 согласно методу оценки RECOMB для 26 линий клеток ОМЛ. Каждый столбик представляет эффективность энхансера IRF8 для одной линии клеток ОМЛ. По оси Y отложена эффективность отдельного энхансера IRF8 в виде значения, кратного предельному значению (определенному как 1,0, показанному пунктирной линией) между суперэнхансерами (>1,0) и типичными энхансерами (≤1,0). Линии клеток, превышающие этот порог, отображены белым цветом, тогда как линии клеток ниже этого порога - черным. Девять из 26 линий клеток ОМЛ (34% популяции) превысили порог 1,0, и их посчитали содержащими СЭ IRF8.
[0038] На фиг. 10 показана корреляция уровней мРНК IRF8 с эффективностью энхансера IRF8 в линиях клеток ОМЛ. График представленности транскрипта мРНК IRF8 по данным ТНМ РНК-секвенирования с квантильной нормализацией (ось Y) в виде функции эффективности энхансера IRF8 RECOMB (ось X) во всех линиях клеток не-ОПЛ ОМЛ, для которых были доступны данные как РНК-секвенирования, так и ChIP-секвенирования. Оценочный коэффициент Спирмена составляет ~0,82 с p-значением ~2×10-6.
[0039] На фиг. 11 изображен ответ, выраженный в виде % клеток CD45+, на ежедневное дозирование тамибаротеном в двух мышиных моделях с полученными от пациентов ксенотрансплантатами ОМЛ. На фиг. 11 также изображен % клеток CD45+ в разных органах и биологических жидкостях, а также время выживаемости мышиных моделей.
[0040] На фиг. 12 изображен ответ, выраженный в виде % клеток CD45+, на ежедневное дозирование тамибаротеном в двух дополнительных мышиных моделях с полученными от пациентов ксенотрансплантатами ОМЛ. На фиг. 12 также изображен % клеток CD45+ в разных органах и биологических жидкостях в этих моделях, а также время выживаемости в этих моделях.
[0041] На фиг. 13 изображен уровень мРНК IRF8 и мРНК RARA в каждом из четырех образцов пациентов с ОМЛ, применяемых в экспериментах с ксенотрансплантатами, изображенных на фиг. 11 и 12. Только восприимчивый к тамибаротену АМ8096, который давал восприимчивый к тамибаротену ксенотрансплантат, демонстрировал уровень мРНК IRF8 выше порога 100 ТНМ. АМ8096 и АМ5512 (которые демонстрировали некоторую восприимчивость к тамибаротену) демонстрировали уровень мРНК RARA выше порога 10 ТНМ.
[0042] На фиг. 14 изображен ранговое упорядочение уровней мРНК IRF8, выявленных в разных линиях клеток ОМЛ, первичных образцах пациентов с ОМЛ, нормальных клетках крови и ППК ОМЛ.
[0043] На фиг. 15 изображены изоболограммы для комбинаций тамибаротена и азацитидина в различных линиях клеток ОМЛ. Звездочками указаны данные за пределами максимума изоболограммы.
[0044] На фиг. 16 изображены изоболограммы для комбинаций тамибаротена и триоксида мышьяка в различных линиях клеток ОМЛ. Звездочками указаны данные за пределами максимума изоболограммы.
[0045] На фиг. 17 изображены изоболограммы для комбинаций тамибаротена и ара-С в различных линиях клеток ОМЛ. Звездочками указаны данные за пределами максимума изоболограммы.
[0046] На фиг. 18 изображены изоболограммы для комбинаций тамибаротена и даунорубицина в различных линиях клеток ОМЛ. Звездочками указаны данные за пределами максимума изоболограммы.
[0047] На фиг. 19 изображены изоболограммы для комбинаций тамибаротена и метотрексата в различных линиях клеток ОМЛ. Звездочками указаны данные за пределами максимума изоболограммы.
[0048] На фиг. 20 изображены изоболограммы для комбинаций тамибаротена и идарубицина в различных линиях клеток ОМЛ. Звездочками указаны данные за пределами максимума изоболограммы.
[0049] На фиг. 21 изображены изоболограммы для комбинаций тамибаротена и сорафениба в различных линиях клеток ОМЛ. Звездочками указаны данные за пределами максимума изоболограммы.
ОПРЕДЕЛЕНИЯ
[0050] В этой заявке, если из контекста четко не следует иное, (i) под термином «один» может подразумеваться «по меньшей мере один»; (ii) под термином «или» может подразумеваться «и/или»; (iii) термины «содержащий» и «включающий» можно понимать как включающие перечисленные компоненты или этапы, представленные сами по себе или вместе с одним или более дополнительными компонентами или этапами; и (iv) термины «около» и «приблизительно» можно понимать как допускающие стандартное отклонение, которое понятно специалистам в данной области; и (v) в случае приведения диапазонов, в них включены конечные точки.
[0051] Специалистам в данной области очевидно, что одно или более химических соединений, чья структура приведена в данном документе, могут иметь одну или более изомерных (например, энантиомерных, диастереомерных и геометрических (или конформационных)) и/или таутомерных форм; например, R и S конфигурации для каждого асимметричного центра, Z и Е изомеры с двойной связью и Z и Е конформационные изомеры. В некоторых вариантах реализации включенные в данный документ принципы могут применяться к любой и ко всем таким формам и/или охватывать их. Следовательно, если не указано иное, одиночные стереохимические изомеры, а также энантиомерные, диастереомерные и геометрические (или конформационные) смеси представленных соединений могут все входить в объем изобретения. Аналогично, ели не указано иное, все таутомерные формы соединений согласно изобретению входят в объем изобретения. Кроме того, для специалистов в данной области очевидно, что в некоторых вариантах реализации приведенные в данном документе химические структуры могут включать соединения, которые отличаются только наличием одного или более изотопно-обогащенных атомов. Например, соединения, чья структура идентична приведенной, за исключением замещения водорода дейтерием или тритием или замещения углерода 13С- или 14С-обогащенным углеродом, входят в объем этого изобретения. В некоторых вариантах реализации такие соединения можно применять, например, в качестве аналитических инструментов, в качестве зондов в методах биологического анализа и/или в качестве терапевтических агентов в соответствии с настоящим изобретением.
[0052] Агонист: в контексте данного документа термин «агонист» может использоваться для обозначения агента, условия или явления, чьи наличие, уровень, степень, тип или форма коррелируют с повышением уровня или активности другого агента (т.е. агонизируемого агента). В общем случае агонист может представлять собой или включать агент любого химического класса, включая например, небольшие молекулы, полипептиды, нуклеиновые кислоты, углеводы, липиды, металлы и/или любые другие компоненты, которые демонстрируют релевантную активирующую активность. В некоторых вариантах реализации агонист может быть прямым (в случае чего он оказывает влияние непосредственно на свою мишень); в некоторых вариантах реализации агонист может быть непрямым (в случае чего он оказывает влияние способом, отличным от связывания своей мишени; например, путем взаимодействия с регулятором мишени так, чтобы происходило изменение уровня или активности мишени).
[0053] Терапия агонистом: в контексте данного документа термин «терапия агонистом» относится к введению агониста, который агонизирует конкретную представляющую интерес мишень для достижения желаемого терапевтического действия. В некоторых вариантах реализации терапия агонистом включает введение одной дозы агониста. В некоторых вариантах реализации терапия агонистом включает введение нескольких доз агониста. В некоторых вариантах реализации терапия агонистом включает введение агониста в соответствии со схемой дозирования, которая, как известно или как ожидается, позволит достичь терапевтического действия, например, потому что такой результат был доказан с определенной степенью статистической достоверности, например, посредством введения релевантной популяции.
[0054] Антагонист: в контексте данного документа термин «антагонист» может использоваться для обозначения агента, условия или явления, чьи наличие, уровень, степень, тип или форма коррелируют со снижением уровня или активности другого агента (т.е. ингибируемого агента или мишени). В общем случае антагонист может представлять собой или включать агент любого химического класса, включая например, небольшие молекулы, полипептиды, нуклеиновые кислоты, углеводы, липиды, металлы и/или любые другие компоненты, которые демонстрируют релевантную ингибиторную активность. В некоторых вариантах реализации антагонист может быть прямым (в случае чего он оказывает влияние непосредственно на свою мишень); в некоторых вариантах реализации агонист может быть непрямым (в случае чего он оказывает влияние способом, отличным от связывания своей мишени; например, путем взаимодействия с регулятором мишени так, чтобы происходило изменение уровня или активности мишени).
[0055] Приблизительно: в контексте данного документа термин «приблизительно» или «около», применяемый к одному или более представляющим интерес значениям, относится к значению, аналогичному установленному эталонному значению. В некоторых вариантах реализации термин «приблизительно» или «около» относится к диапазону значений, которые попадают в пределы 25%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или менее в любую сторону (больше или меньше) от установленного эталонного значения, если не указано иное или иное не очевидно из контекста (за исключением случаев, когда такое число превышало бы 100% от возможного значения).
[0056] Острый промиелоцитарный лейкоз: в контексте данного документа термин «острый промиелоцитарный лейкоз» или «ОПЛ» относится к подтипу острого миелогенного лейкоза («ОМЛ»), характеризуемому генетической транслокацией между хромосомами 15 и 17 человека. Соответственно, термин «не-ОПЛ ОМЛ» относится к любому подтипу ОМЛ, который не характеризуется такой генетической транслокацией.
[0057] Биологический образец: в контексте данного документа термин «биологический образец» относится к любому образцу, полученному от индивида, страдающего от заболевания, подлежащего лечению способами согласно этому изобретению, включая образцы тканей (такие как срезы тканей и пункционная биопсия тканей); образцы клеток (например, цитологические мазки (такие как мазки по Папаниколау или мазки крови) или образцы клеток, полученные путем микродиссекции; образцы костного мозга (как фракции цельных, полных клеток, так и субпопуляции клеток в них); или клеточные фракции, фрагменты или органеллы (например, полученные путем лизиса клеток и разделения компонентов путем центрифугирования или каким-либо другим способом). Другие примеры биологических образцов включают кровь, сыворотку, мочу, сперму, кал, цереброспинальную жидкость, интерстициальную жидкость, слизь, слезы, пот, гной, полученную с помощью биопсии ткань (например, полученную с помощью хирургической биопсии или пункционной биопсии), аспираты из сосков, молоко, вагинальную жидкость, слюну, мазки (такие как буккальные мазки) или любой материал, содержащий биомолекулы, которые получены из первого биологического образца. В некоторых аспектах биологический образец от субъекта, страдающего от не-ОПЛ ОМЛ или МДС, представляет собой аспират костного мозга. В других аспектах биологический образец от субъекта, страдающего от не-ОПЛ ОМЛ или МДС, представляет собой образец фракционированной цельной крови. В более конкретных аспектах биологический образец от субъекта, страдающего от не-ОПЛ ОМЛ или МДС, представляет собой фракцию МКПК из цельной крови субъекта («образец МКПК»). В более конкретных аспектах образец МКПК от субъекта, страдающего от не-ОПЛ ОМЛ или МДС, дополнительно обогащен специфическими бластами с помощью различных методов обогащения, таких как протоколы обогащения со связанными с антителами гранулами, сортировка клеток на основании флуоресцентных меток или другие методы, известные в данной области («образец обогащенных МКПК»). В некоторых вариантах реализации, как следует из контекста, термин «образец» относится к препарату, полученному путем обработки (например, путем удаления одного или более компонентов и/или добавления одного или более агентов) исходного образца. Такой «обработанный образец» может содержать, например, нуклеиновые кислоты или белки, выделенные из образца или полученные путем применения к исходному образцу таких методов, как амплификация или обратная транскрипция мРНК, выделение и/или очистка некоторых компонентов и т.д.
[0058] Биомаркер: в контексте данного документа термин «биомаркер» относится к соединению, чьи наличие, уровень или форма коррелируют с конкретным представляющим интерес биологическим явлением или состоянием так, что он считается «маркером» этого явления или состояния. Если приводить некоторые примеры, в некоторых вариантах реализации биомаркер может представлять собой или содержать маркер конкретного состояния или стадии заболевания или вероятности развития конкретного заболевания, расстройства или патологического состояния. В некоторых вариантах реализации биомаркер может представлять собой или содержать маркер конкретного заболевания или терапевтического результата или их вероятности. Таким образом, в некоторых вариантах реализации биомаркер является предсказательным, в некоторых вариантах реализации биомаркер является прогностическим, в некоторых вариантах реализации биомаркер является диагностическим для представляющего интерес релевантного биологического явления или состояния. Биомаркер может представлять собой соединение любого химического класса. Например, в некоторых вариантах реализации биомаркер может представлять собой или содержать нуклеиновую кислоту, полипептид, липид, углевод, небольшую молекулу, неорганический агент (например, металл или ион) или их комбинацию. В некоторых вариантах реализации биомаркер представляет собой маркер клеточной поверхности. В некоторых вариантах реализации биомаркер является внутриклеточным. В некоторых вариантах реализации биомаркер находится за пределами клеток (например, секретируется или каким-либо другим образом генерируется или находится за пределами клеток, например, в жидкости организма, такой как кровь, моча, слезы, слюна, цереброспинальныя жидкость и т.д. В некоторых вариантах реализации этот термин относится к продукту генной экспрессии, характерному для конкретной опухоли, подкласса опухоли, стадии опухоли и т.д. В альтернативных или дополнительных вариантах реализации наличие уровня конкретного маркера коррелирует с активностью (или уровнем активности) конкретного сигнального пути, например, характерного для конкретного класса или подкласса опухолей. Статистическая значимость наличия или отсутствия биомаркера может варьироваться в зависимости от конкретного биомаркера. В некоторых вариантах реализации выявление биомаркера является высокоспецифическим в том смысле, что оно отображает высокую вероятность принадлежности опухоли к конкретному подклассу. Такая специфичность может возникать за счет чувствительности (например, отрицательный результат может появляться даже если опухоль представляет собой опухоль, для которой ожидается экспрессия биомаркера). В некоторых вариантах реализации биомаркер может представлять собой или включать биомаркер IRF8 (например, наличие, уровень, форму и/или активность одного или более компонентов или продуктов гена IRF8, включая, например, эффективность, порядковый ранг или показатель распространенности суперэнхансера IRF8 и уровень или показатель распространенности мРНК IRF8). В некоторых вариантах реализации биомаркер может представлять собой или содержать биомаркер RARA (например, один или более биомаркеров RARA (например, наличие, уровень, форму и/или активность одного или более компонентов или продуктов гена RARA, включая, например, эффективность, порядковый ранг или показатель распространенности суперэнхансера RARA и уровень или показатель распространенности мРНК RARA). В некоторых вариантах реализации биомаркер относится к комбинации одного или более биомаркеров, таких как IRF8 и RARA.
[0059] Рак: в контексте данного документа термин «рак» относится к злокачественному новообразованию или опухоли (Stedman'sMedical Dictionary, 25th ed.; Hensly ed.; Williams & Wilkins: Philadelphia, 1990). Термины «новообразование» и «опухоль» взаимозаменяемо употребляются в данном документе и относятся к аномальной массе ткани, для которой рост массы превосходит рост нормальной ткани и не согласуется с ним. «Злокачественное новообразование» в общем случае является слабо дифференцированным (анаплазия) и характеризуется быстрым ростом, сопровождающимся прогрессирующей инфильтрацией, инвазией и разрушением окружающей ткани. Кроме того, злокачественное новообразование в общем случае может метастазировать в удаленные участки. В некоторых вариантах реализации рак представляет собой любое злокачественное новообразование или опухоль, для которого биомаркер IRF8 коррелирует с чувствительностью к агонисту RARA, такому как тамибаротен. В некоторых вариантах реализации рак представляет собой острый миелоцитарный лейкоз (ОМЛ). В некоторых вариантах реализации рак представляет собой не-ОПЛ ОМЛ.
[0060] Комбинированная терапия: в контексте данного документа термин «комбинированная терапия» относится к тем ситуациям, в которых субъект одновременно проходит лечение согласно двум или более терапевтическим схемам (например, двумя или более терапевтическими агентами). В некоторых вариантах реализации два или более агента можно вводить одновременно; в некоторых вариантах реализации такие агенты можно вводить последовательно; в некоторых вариантах реализации такие агенты вводят согласно перекрывающимся схемам дозирования. В некоторых вариантах реализации «применение» комбинированной терапии может включать введение одного или более агентов субъекту, получающему другие агенты в комбинации. Для ясности, комбинированная терапия не требует введения отдельных агентов вместе в одной композиции (или даже обязательно в одно время), хотя в некоторых вариантах реализации два или более активных агентов, соединений или компонентов можно вводить вместе в комбинированной композиции или даже в комбинированном соединении (например, в виде части одного химического комплекса или ковалентного соединения).
[0061] Предельное значение: в контексте данного документа термины «предел» и «предельное значение» означают значение, измеренное в анализе, которое определяет линию раздела между двумя подгруппами популяции (например, восприимчивой и невосприимчивой). Таким образом, значение, равное предельному значению или превышающее его, определяет одну подгруппу популяции; а значение, меньшее предельного значения, определяет другую подгруппу популяции.
[0062] Диагностическая информация: в контексте данного документа «диагностическая информация» или «информация для применения при постановке диагноза» представляет собой информацию, применяемую при определении того, имеет ли пациент заболевание, расстройство или патологическое состояние, и/или при классифицировании заболевания, расстройства или патологического состояния по фенотипической категории или любой категории, имеющей значимость в связи с прогнозом заболевания, расстройства или патологического состояния или вероятностью ответа на лечение (лечение в целом или любое конкретное лечение) заболевания, расстройства или патологического состояния. Аналогично, «диагноз» относится к предоставлению любого типа диагностической информации, включая, но не ограничиваясь этим, информацию о вероятности развития у субъекта заболевания, расстройства или патологического состояния, состоянии, стадировании или характеристике заболевания, расстройства или патологического состояния, проявляющегося у субъекта, информацию, касающуюся природы или классификации опухоли, информацию, касающуюся прогноза, и/или информацию, используемую при выборе соответствующего лечения. Выбор лечения может включать выбор конкретного терапевтического агента или другой процедуры лечения, такой как хирургическое вмешательство, облучение и т.д., выбор того, следует ли прекратить или продолжить терапию, выбор, касающийся схемы дозирования (например, частоты применения или уровня одной или более доз конкретного терапевтического агента или комбинации терапевтических агентов) и т.д.
[0063] Дозированная форма или единичная дозированная форма: для специалистов в данной области очевидно, что термин «дозированная форма» можно использовать для обозначения физически дискретной единицы активного агента (например, терапевтического или диагностического агента) для введения субъекту. Как правило, каждая такая единица содержит предопределенное количество активного агента. В некоторых вариантах реализации такое количество представляет собой единичное дозированное количество (или его целую долю), подходящее для введения в соответствии со схемой дозирования, которая согласно предварительному определению коррелирует с желаемым или благоприятным результатом при введении релевантной популяции (т.е. с терапевтической схемой дозирования). Для специалистов в данной области очевидно, что общее количество терапевтической композиции или агента, вводимое конкретному субъекту, определяется одним или более лечащими врачами и может включать введение нескольких дозированных форм.
[0064] Схема дозирования: для специалистов в данной области очевидно, что термин «схема дозирования» можно использовать для обозначения набора единичных доз (как правило, более одной), которые отдельно вводят субъекту, как правило, через определенные периоды времени. В некоторых вариантах реализации заданный терапевтический агент имеет рекомендуемую схему дозирования, которая может включать применение одной или более доз. В некоторых вариантах реализации схема дозирования включает применение некоторого количества доз, при этом каждая из них отделена по времени от других доз. В некоторых вариантах реализации приемы отдельных доз отделены друг от друга периодом времени одинаковой длины; в некоторых вариантах реализации схема дозирования включает применение некоторого количества доз и по меньшей мере два разных периода времени, разделяющих прием отдельных доз. В некоторых вариантах реализации все дозы в рамках схемы дозирования составляют одинаковое единичное дозированное количество. В некоторых вариантах реализации разные дозы в рамках схемы дозирования составляют разное количество. В некоторых вариантах реализации схема дозирования включает применение первой дозы в первом дозированном количестве с последующим применением одной или более дополнительных доз во втором дозированном количестве, отличном от первого дозированного количества. В некоторых вариантах реализации схема дозирования включает применение первой дозы в первом дозированном количестве с последующим применением одной или более дополнительных доз во втором дозированном количестве, таком же, как и первое дозированное количество. В некоторых вариантах реализации схема дозирования коррелирует с желаемым или благоприятным результатом при введении в рамках релевантной популяции (т.е. представляет собой терапевтическую схему дозирования).
[0065] Эффективное количество: в контексте данного документа «эффективное количество» описанного в данном документе соединения, такого как соединение формулы (I), относится к количеству, достаточному, чтобы вызвать необходимый биологический ответ, т.е. для лечения патологического состояния. Для специалистов в данной области очевидно, что эффективное количество описанного в данном документе соединения, такого как соединение формулы (I), может варьироваться в зависимости от таких факторов, как необходимый биологический конечный результат, фармакокинетика соединения, патологическое состояние, лечение которого проводят, способ введения и возраст и состояние здоровья субъекта. Эффективное количество охватывает терапевтическое и профилактическое лечение. Например, при лечении рака эффективное количество соединения согласно изобретению может снижать опухолевую нагрузку или останавливать рост или распространение опухоли.
[0066] Энхансер: в контексте данного документа термин «энхансер» относится к области геномной ДНК, действие которой состоит в регуляции генов, отстоящих от нее на расстояние до 1 м.п.о. Энхансер может перекрывать, но часто не входит в состав генных кодирующих областей. Энхансер часто связывается транскрипционными факторами и обозначается специфическими гистоновыми метками.
[0067] Гидрат: в контексте данного документа термин «гидрат» относится к соединению, которое ассоциировано с водой. Как правило, число молекул воды, содержащихся в гидрате соединения, составляет определенное соотношение с числом молекул соединения в гидрате. Следовательно, гидрат соединения может быть представлен, например, общей формулой R⋅xH2O, где R представляет собой соединение, а x представляет собой число больше 0. Заданное соединение может образовывать более одного типа гидратов, включая, например, моногидраты (x равен 1), низшие гидраты (x представляет собой число больше 0 и меньше 1, например, гемигидраты (R⋅0,5H2O)) и полигидраты (x представляет собой число больше 1, например, дигидраты (R⋅2H2O) и гексагидраты (R⋅6H2O)).
[0068] Ген IRF8: в контексте данного документа термин «ген IRF8» относится к последовательности геномной ДНК, которая кодирует белок, связывающий консенсусную последовательность интерферона или ее сплайс-вариант и, в частности, исключает генные слияния, которые содержат весь или часть гена IRF8. В некоторых вариантах реализации ген IRF8 расположен в хромосоме 16:85862582-85990086 в геномном блоке hg19.
[0069] «Улучшать», «повышать» или «снижать»: в контексте данного документа эти термины или их грамматические эквиваленты указывают значения, которые связаны с эталонным измерением, таким как измерение у того же индивида до инициации описанного в данном документе лечения или измерение у контрольного индивида (или некоторого количества контрольных индивидов) в отсутствие описанного в данном документе лечения. В некоторых вариантах реализации «контрольный индивид» представляет собой индивида, пораженного той же формой заболевания или повреждения, что и проходящий лечение индивид.
[0070] Транскрипт матричной РНК: в контексте данного документа термин «транскрипт матричной РНК» или мРНК относится к продукту транскрипции РНК с последовательности ДНК, который содержит одну или более генных кодирующих областей.
[0071] Порядковый ранг: в контексте данного документа термин «порядковый ранг» указанного значения обозначает ранговый порядок этого значения по сравнению с набором других значений. Например, порядковый ранг 100 в контексте эффективности суперэнхансера, связанного с геном RARA в исследуемой клетке, по сравнению с другими суперэнхансерами в исследуемой клетке означает, что 99 других суперэнхансеров в исследуемой клетке имеют большую эффективность, чем суперэнхансер, связанный с геном RARA.
[0072] Пациент: в контексте данного документа термин «пациент» или «субъект» относится к любому организму, которому вводят или можно вводить предложенную композицию, например, в экспериментальных, диагностических, профилактических, косметических и/или терапевтических целях. Типичные пациенты включают животных (например, млекопитающих, таких как мыши, крысы, кролики, отличные от человека приматы и/или люди). В некоторых вариантах реализации пациент является человеком. Понятие человек включает пре- и постнатальные формы. В некоторых вариантах реализации пациент страдает от одного или более расстройств или патологических состояний или предрасположен к ним. В некоторых вариантах реализации пациент демонстрирует один или более симптомов расстройства или патологического состояния. В некоторых вариантах реализации пациенту был поставлен диагноз одного или более расстройств или патологических состояний.
[0073] Фармацевтически приемлемая соль: в контексте данного документа термин «фармацевтически приемлемая соль» относится к тем солям, которые с медицинской точки зрения подходят для применения в контакте с тканями людей и низших животных без проявления излишней токсичности, раздражения, аллергических реакций и тому подобного и соответствуют рациональному соотношению польза/риск. Фармацевтически приемлемые соли хорошо известны в данной области. Например, Berge et al., подробно описывают фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 1977, 66, 119, включенной в данный документ посредством ссылки. Фармацевтически приемлемые соли соединений согласно этому изобретению включают соли, полученные из подходящих неорганических и органических кислот и оснований. Примерами фармацевтически приемлемых кислотно-аддитивных солей являются соли аминогруппы, образуемые с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или с помощью других известных в данной области методов, таких как ионный обмен. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензенсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитран, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидройодид, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталенсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, валерат и т.д. Соли, полученные из соответствующих оснований, включают соли щелочных металлов, щелочноземельных металлов, аммония и N+(C1-4 алкилов)4. Типовые соли щелочных или щелочноземельных металлов включают соли натрия, лития, калия, кальция, магния и т.д. Дополнительные фармацевтически приемлемые соли включают, в соответствующих случаях, нетоксичные катионы аммония, четвертичного аммония и аминов, образуемые с участием противоионов, такие как галид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат.
[0074] Популяция: в контексте данного документа термин «популяция» или «популяция образцов» означает достаточное количество (например, по меньшей мере 30, 40, 50 или более) разных образцов, которые объективно отображают распределение измеряемого значения в большей группе. Каждый образец в популяции образцов может представлять собой линию клеток, биологический образец, полученный от живого существа (например, образец биопсии или жидкости организма), или образец, полученный из ксенотрансплантата (например, при изучении роста опухоли у мышей посредством имплантации линии клеток или образца пациента), при этом каждый образец получен от живого существа, страдающего от того же самого заболевания, патологического состояния или расстройства, или из представляющих его клеточной линии или ксенотрансплантата.
[0075] Предельный показатель распространенности: в контексте данного документа термин «предельный показатель распространенности» для конкретного значения (например, эффективности суперэнхансера, связанного с геном IRF8) обозначает показатель распространенности, который определяет линию раздела между двумя подгруппами популяции (например, восприимчивой и невосприимчивой). Таким образом, показатель распространенности, равный или превышающий (например, меньшее процентное значение) предельный показатель распространенности, определяет одну подгруппу популяции; а показатель распространенности меньший (например, меньшее процентное значение) чем предельный показатель распространенности, определяет другую подгруппу популяции.
[0076] Показатель распространенности: в контексте данного документа термин «показатель распространенности» для конкретного значения (например, эффективности суперэнхансера, связанного с геном IRF8) обозначает процентную долю популяции, которая равна этому конкретному значению или превышает его. Например, 35% ранг распространенности для эффективности суперэнхансера, связанного с геном IRF8, в исследуемой клетке означает, что 35% популяции имеют энхансер гена IRF8 с эффективностью, равной значению для исследуемой клетки или превышающей его.
[0077] Прогностическая и предсказательная информация: в контексте данного документа термины «прогностическая информация» и «предсказательная информация» употребляют для обозначения любой информации, которую можно использовать для указания любого аспекта течения заболевания или патологического состояния в отсутствие или при наличии лечения. Такая информация может включать, но не ограничивается этим, среднюю продолжительность жизни пациента, вероятность выживания пациента в течение заданного периода времени (например, 6 месяцев, 1 года, 5 лет и т.д.), вероятность излечения пациента от заболевания, вероятность восприимчивости заболевания пациента к конкретному варианту терапии (при этом восприимчивость можно определять любым из множества способов). Прогностическая и предсказательная информация включена в широкую категорию диагностической информации.
[0078] Ранговое упорядочение: в контексте данного документа термин «ранговое упорядочение» обозначает упорядочение значений от наибольшего к наименьшему или от наименьшего к наибольшему.
[0079] Ген RARA: в контексте данного документа термин «ген RARA» относится к последовательности геномной ДНК, которая кодирует функциональный ген рецептора-α ретиноевой кислоты и, в частности, исключает генные слияния, которые содержат весь или часть гена RARA. В некоторых вариантах реализации ген RARA расположен в хромосоме 17:38458152-38516681 в геномном блоке hg19.
[0080] Эталон: в контексте данного документа описывает стандарт или контроль, относительно которого проводится сравнение. Например, в некоторых вариантах реализации представляющие интерес агент, животное, индивида, популяцию, образец, последовательность или значение сравнивают с эталонными или контрольными агентом, животным, индивидом, популяцией, образцом, последовательностью или значением. В некоторых вариантах реализации исследование и/или определение для эталона или контроля проводят практически одновременно с представляющим интерес исследованием или определением. В некоторых вариантах реализации эталон или контроль представляет собой ретроспективный эталон или контроль, необязательно, отображенный на материальном носителе. Как правило, как очевидно для специалистов в данной области, определение или получение характеристик эталона или контроля проводят в условиях или при обстоятельствах, сравнимых с теми, для которых проводится оценка. Для специалистов в данной области очевиден факт присутствия достаточного сходства для подтверждения достоверности и/или сравнения с конкретным возможным эталоном или контролем.
[0081] Восприимчивость: в контексте данного документа восприимчивость к лечению может относиться к любому благоприятному изменению в состоянии субъекта, которое происходит в результате лечения или коррелирует с ним. Такое изменение может включать стабилизацию патологического состояния (например, предотвращение ухудшения, которое могло бы иметь место в отсутствие лечения), снижение интенсивности, замедление появления и/или снижение частоты проявления одного или более симптомов патологического состояния и/или улучшение перспектив излечения патологического состояния и т.д. В некоторых вариантах реализации восприимчивость может представлять собой восприимчивость субъекта; в некоторых случаях ответ может представлять собой восприимчивость опухоли..
[0082] Сольват: в контексте данного документа термин «сольват» относится к формам соединения, которые ассоциированы с растворителем, обычно посредством реакции сольволиза. Эта физическая ассоциация может включать водородное связывание. Традиционные растворители включают воду, метанол, этанол, уксусную кислоту, ДМСО, ТГФ, диэтиловый эфир и т.д. Описанные в данном документе соединения, такие как соединения формулы (I), могут быть приготовлены, например, в кристаллической форме и могут быть сольватированы. Подходящие сольваты включают фармацевтически приемлемые сольваты и дополнительно включают как стехиометрические сольваты, так и нестехиометрические сольваты. В некоторых случаях существует возможность выделения сольвата, например, когда одна или более молекул растворителя включены в кристаллическую решетку кристаллического твердого вещества. «Сольват» включает как сольваты в фазе раствора, так и выделяемые сольваты. Типовые сольваты включают гидраты, этанолаты и метано латы.
[0083] Эффективность: в контексте данного документа термин «эффективность», относящийся к части энхансера или суперэнхансера, обозначает площадь под кривой числа H3K27Ac или других показателей геномных маркеров, построенной в зависимости от длины анализируемого сегмента геномной ДНК. Таким образом, «эффективность» представляет собой интеграцию сигнала, полученного в результате измерения метки в данной паре оснований на протяжении некоторого количества пар оснований, определяющих выбранную для измерения область.
[0084] Субъект: в контексте данного документа термин «субъект», которому предполагается осуществлять введение, представляет собой человека (например, мужчину или женщину любой группы, например, педиатрического субъекта (например, ребенка грудного возраста, ребенка или подростка) или взрослого субъекта (например, молодого взрослого, взрослого среднего возраста или взрослого преклонного возраста)).
[0085] Суперэнхансер: в контексте данного документа термин «суперэнхансер» относится к подгруппе энхансеров, которые содержат непропорционально большую долю гистоновых меток и/или транскрипционных белков по сравнению с другими энхансерами в конкретной клетке. Вследствие этого ген, регулируемый суперэнхансером, по прогнозам является очень важным для функции этой клетки. Суперэнхансеры, как правило, определяют по ранговому упорядочению всех энхансеров в клетке на основании эффективности и определения с помощью доступного программного обеспечения, такого как ROSE (https://bitbucket.org/young_computation/rose), подгруппы энхансеров, которые имеют эффективность, существенно большую, чем у медианного энхансера в клетке (смотрите, например, патент США 9181580, включенный в данный документ посредством ссылки.
[0086] Порог: в контексте данного документа термины «порог» и «пороговый уровень» обозначают уровень, который определяет линию раздела между двумя подгруппами популяции (например, восприимчивой и невосприимчивой). Порог или пороговый уровень может представлять собой предельный показатель распространенности или предельное значение.
[0087] Лечение: в контексте данного документа термины «лечение» и «лечить» относятся к обращению, облегчению, замедлению появления или ингибированию прогрессирования «патологического состояния» (например, заболевания, расстройства или патологического состояния или одного или более их симптомов), описанного в данном документе. В некоторых вариантах реализации «лечение» и «лечить» требуют, чтобы развились или наблюдались признаки или симптомы заболевания, расстройства или патологического состояния. В других вариантах реализации лечение можно применять в отсутствие признаков или симптомов заболевания или патологического состояния (например, с учетом истории симптомов и/или с учетом генетических или других факторов, влияющих на восприимчивость). Лечение также можно продолжать после купирования симптомов, например, для замедления или предотвращения повторного появления.
[0088] В контексте данного документа термины «патологическое состояние», «заболевание» и «расстройство» используются взаимозаменяемо.
ПОДРОБНОЕ ОПИСАНИЕ НЕКОТОРЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
RARA и IRF8
[0089] Рецептор ретиноевой кислоты подтипа альфа (RARA) представляет собой ядерный гормональный рецептор, который действует как репрессор транскрипции в несвязанном или связанном антагонистом состоянии и как генный активатор в связанном агонистом состоянии. Природным лигандом RARA является ретиноевая кислота, также известная как полностью транс-ретиноевая кислота (ATRA), которая вырабатывается из витамина А.
[0090] Суперэнхансеры (СЭ) представляют собой большие области хроматина с высокой активностью, которые регулируют ключевые гены клеточной идентичности, включая онкогены в злокачественных клетках. Используя платформу для управления генами, мы идентифицировали СЭ по всему геному в 60 первичных образцах пациентов с ОМЛ, чтобы можно было найти новые уязвимые места опухолей. Один из СЭ, который демонстрировал неравномерное присутствие среди образцов пациентов, был связан с геном RARA, кодирующим RARA.
[0091] Исследования продемонстрировали хорошую корреляцию между восприимчивостью к тамибаротену и любым из или обеими показателями - эффективностью суперэнхансера и уровнями мРНК RARA. При этом для каждого из этих потенциальных биомаркеров RARA существовал средний диапазон, в пределах которого восприимчивость к тамибаротену была смешанной. В настоящем изобретении предложены выводы и технологии, которые помогают разрешить такие неоднозначные результаты по восприимчивости, и предложены различные композиции и способы, применимые, помимо прочего, для получения характеристик, идентификации, отбора или стратификации пациентов на основании вероятной восприимчивости к терапии тамибаротеном. Например, в настоящем изобретении предложены технологии, которые позволяют реализовывать, определять и/или применять один или более биомаркеров IRF8 (например, наличие, уровень, форму и/или активность одного или более компонентов или продуктов гена IRF8, включая, например, эффективность, порядковый ранг, показатель распространенности суперэнхансера IRF8 или уровни мРНК IRF8) и демонстрирует их применимость в противораковой терапии.
[0092] Используя различные линии клеток ОМЛ и образцы пациентов, которые ранее анализировали в отношении эффективности и порядкового положения энхансеров RARA, уровней мРНК RARA и восприимчивости к тамибаротену, мы проводили поиск дополнительных биомаркеров, которые коррелировали бы с восприимчивостью к тамибаротену. Было обнаружено, что уровни мРНК фактора отклика интерферона 8 (IRF8) повышены в тех же популяциях пациентов, что и RARA. IRF8 представляет собой интерферон-зависимый фактор транскрипции, который, как известно, является критическим для гематопоэза и прекращение сигнализации которого приводит к аберрантному размножению незрелых миелоидных клеток. При ОМЛ наблюдается сверхэкспрессия IRF8, которая может коррелировать с неблагоприятным клиническим результатом. Несмотря на это повышение регуляции, в действительности сигнализация IRF8 нарушается репрессивными транскрипционными кофакторами и, потенциально, RARA, когда он находится в репрессивном состоянии под управлением СЭ. Кроме того, сам интерферон-α, вышерасположенный сигнальный лиганд IRF, проявляет продифференцирующее действие при ОМЛ и создает взаимные сигнальные помехи с путем RARA.
[0093] В настоящем изобретении описан полногеномный анализ экспрессии и уровня энхансеров панели образцов пациентов с ОМЛ и линий клеток ОМЛ для изучения корреляции эффективности энхансера гена IRF8, уровней мРНК IRF8 и чувствительности к тамибаротену. Панель линий клеток ОМЛ исследовали ранее и показали наличие корреляции между чувствительностью к антипролиферативному действию агониста RARA тамибаротена и эффективностью энхансера RARA и уровнями мРНК RARA. В этой заявке мы демонстрируем, что уровни мРНК IRF8 также повышены в линиях клеток ОМЛ и образцах пациентов с ОМЛ, которые характеризуются повышенными уровнями мРНК RARA, и что существует корреляция между уровнями мРНК IRF8 и восприимчивостью к агонисту RARA, такому как тамибаротен. Также мы демонстрируем, что существует корреляция между эффективностью энхансера IRF8 {например, наличием суперэнхансера, связанного с IRF8), уровнями мРНК IRF8, уровнями мРНК RARA и восприимчивостью к тамибаротену. Таким образом, эффективность энхансера IRF8 или уровни мРНК IRF8 можно использовать одни или в сочетании с эффективностью энхансера RARA и уровнями мРНК RARA для идентификации пациентов, которые были бы восприимчивы к лечению агонистом RARA, таким как тамибаротен.
Идентификаиия суперэнхансеров IRF8 и RARA и определение пороговых уровней
[0094] Идентификацию энхансера или суперэнхансера можно осуществлять различными способами, известными в данной области, например, описанными в Cell 2013, 155, 934-947 и PCT/US 2013/066957, которые обе включены в данный документ посредством ссылки. В некоторых вариантах реализации идентификацию суперэнхансера осуществляют, получая клеточный материал и ДНК из образца рака у пациента (например, из образца биопсии). Важные показатели для измерения энхансеров лежат в двух направлениях - длина ДНК, на протяжении которой происходит непрерывное выявление геномных маркеров {например, H3K27Ac), - и компилированная частота появления геномного маркера в каждой паре оснований вдоль этого участка ДНК, составляющая амплитуду. Измерение площади под кривой («ППК»), получаемой в результате интеграции анализа длины и амплитуды, определяет эффективность энхансера. Это и представляет собой эффективность суперэнхансера IRF8 или RARA по сравнению с контролем, которую используют в одном аспекте настоящего изобретения, чтобы определить, будет ли субъект восприимчив к агонисту RARA (например, тамибаротену) или нет. На основании настоящего описания для специалистов в данной области будет очевидно, что если длина ДНК, на протяжении которой происходит выявление геномных маркеров, является одинаковой для IRF8 или RARA и контроля, то отношение амплитуды суперэнхансера IRF8 или RARA по сравнению с контролем будет эквивалентно эффективности и тоже может использоваться для определения, будет ли субъект восприимчив к агонисту RARA или нет. В некоторых вариантах реализации перед сравнением с другими образцами проводят нормализацию эффективности энхансера IRF8 или RARA в клетке. Нормализацию осуществляют путем сравнения с областью в той же клетке, которая содержит универсальный суперэнхансер или энхансер, который присутствует на одинаковых уровнях во всех клетках. Одним из примеров такой области универсального суперэнхансера является локус суперэнхансера MALAT1 (xp11:65263724-65266724) (геномный блок hg19).
[0095] Методами ChIP-секвенирования H3K27Ac было определено, что существует локус суперэнхансера, связанный с геном RARA в хр17:38458152-38516681 (геномный блок hg19), и существует локус суперэнхансера, связанный с геном IRF8 в хр16:85862582-85990086 (геномный блок hg19).
[0096] ChIP-секвенирование, также известное как ChIP-seq, используют для анализа белковых взаимодействий с ДНК. В ChIP-секвенировании скомбинированы иммунопреципитация хроматина (СЫР) и массовое параллельное ДНК-секвенирование для определения участков связывания ДНК-ассоциированных белков. Это можно использовать для точного картирования глобальных участков связывания для любого представляющего интерес белка. Ранее ChIP на чипе была наиболее применяемой методикой, используемой для исследования этих взаимодействий белок-ДНК. Успешное ChIP-секвенирование зависит от многих факторов, включая эффективность и способ обработки ультразвуком, буферные композиции, качество антитела и число клеток; смотрите, например, Т. Furey, Nature Reviews Genetics 13, 840-852 (December 2012); M.L. Metzker, Nature Reviews Genetics 11, 31-46 (January 2010); и P.J Park, Nature Reviews Genetics 10, 669-680 (October 2009)). Геномные маркеры, отличные от H3K27Ac, которые можно использовать для выявления суперэнхансеров, используя ChIP-секвенирование, включают Р300, СВР, BRD2, BRD3, BRD4, компоненты медиаторного комплекса (J Loven, et al., Cell, 153(2):320-334, 2013), гистон 3 лизин 4 монометилированный (H3K4mel) или другие тканеспецифические транскрипционные факторы, связанные с энхансерами (Е Smith & A Shilatifard, Nat Struct Mol Biol, 2l(3):210-219, 2014) (S Pott & Jason Lieb, Nature Genetics, 47(1):8-12, 2015).
[0097] В некоторых вариантах реализации карты суперэнхансеров на основании данных ChIP-секвенирования H3K27Ac или другого маркера для полного генома линии клеток или образца пациента уже существуют. В некоторых вариантах реализации можно просто определить, были ли эффективность или порядковый ранг энхансера или суперэнхансера на таких картах в локусе хр17:38458152-38516681 (геномный блок hg19) равны ранее определенному пороговому уровню или превышали его. В некоторых вариантах реализации можно просто определить, были ли эффективность или порядковый ранг энхансера или суперэнхансера на таких картах в локусе хр16:85862582-85990086 (геномный блок hg19) равны ранее определенному пороговому уровню или превышали его.
[0098] Следует понимать, что точное расположение IRF8, RARA и MALAT1 в хромосоме может отличаться для разных геномных блоков и/или разных типов клеток. Однако специалист в данной области, принимая во внимание настоящее описание, может определить такое разное положение путем расположения в таких других геномных блоках конкретных последовательностей, соответствующих локусам RARA и/или MALAT1 в геномном блоке hg19.
[0099] Другие способы идентификации суперэнхансеров включают иммунопреципитацию хроматина (JE Delmore, et al., Cell, 146(6)904-917, 2011) и применение матричного чипа (ChIP-чип) и иммунопреципитацию хроматина с последующей кПЦР (ChIP-кПЦР) с применением таких же иммунопреципитированных геномных маркеров и олигонуклеотидных последовательностей, которые гибридизируются с локусом xp17:38458152-38516681 (геномный блок hg19) RARA или локусом хр16:85862582-85990086 (геномный блок hg19) IRF8. В случае ChIP-чипа сигнал, как правило, регистрируют по интенсивности флуоресценции в результате гибридизации зонда и введенного аналитического образца, как и в случае других методик на матричной основе. В случае ChIP-кПЦР для измерения амплификации матрицы используют краситель, который становится флуоресцентным только после интеркаляции двухцепочечной ДНК, создаваемой в реакции ПЦР.
[0100] В некоторых вариантах реализации определение того, имеет ли клетка эффективность суперэнхансера IRF8, равную необходимому пороговому уровню или превышающую его, проводят, сравнивая эффективность энхансера IRF8 в исследуемой клетке с соответствующей эффективностью IRF8 в популяции образцов клеток, причем каждый из образцов клеток получен из разных источников (например, от разных субъектов, из разных линий клеток, из разных ксенотрансплантатов), соответствующих одному и тому же подлежащему лечению заболеванию. В некоторых аспектах этих вариантов реализации для определения порогового уровня используют только образцы клеток первичных опухолей. В некоторых аспектах этих вариантов реализации по меньшей мере некоторые из образцов в популяции будут исследовать в отношении восприимчивости к специфическому агонисту RARA, чтобы установить: а) наименьшую эффективность энхансера IRF8 образца в популяции, который восприимчив к этому специфическому агонисту RARA («восприимчивый образец с наименьшим показателем»); и, необязательно, b) наибольшую эффективность энхансера IRF8 образца в популяции, который не восприимчив к этому специфическому агонисту RARA («невосприимчивый образец с наибольшим показателем»), В этих вариантах реализации предельное значение эффективности энхансера IRF8, при превышении которого исследуемая клетка считается восприимчивой к этому специфическому агонисту RARA, устанавливается: i) равным или большим на величину до 5% эффективности энхансера IRF8 в восприимчивом образце с наименьшим показателем в популяции; или ii) равным или большим на величину до 5% эффективности энхансера IRF8 в невосприимчивом образце с наибольшим показателем в популяции; или iii) как значение между эффективностью энхансера IRF8 восприимчивого образца с наименьшим показателем и невосприимчивого образца с наибольшим показателем в популяции.
[0101] Следует понимать, что в вышеприведенных вариантах реализации не все образцы в популяции обязательно подлежат исследованию в отношении восприимчивости к агонисту RARA, но все образцы подлежат измерению эффективности энхансера IRF8 и/или уровней мРНК IRF8. В некоторых вариантах реализации проводят ранговое упорядочение образцов на основании эффективности энхансера IRF8. Выбор того, какой из приведенных выше трех способов использовать для установления предельного значения, будет зависеть от разницы в эффективности энхансера IRF8 между восприимчивым образцом с наименьшим показателем и невосприимчивым образцом с наибольшим показателем в популяции и от того, является ли целью минимизация числа ложно-положительных результатов или минимизация возможности пропуска потенциально восприимчивого образца или субъекта. Когда разница между восприимчивым образцом с наименьшим показателем и невосприимчивым образцом с наибольшим показателем является большой (например, в случае наличия большого числа образцов, которые не исследовали в отношении восприимчивости, которые попадают в пределы между восприимчивым образцом с наименьшим показателем и невосприимчивым образцом с наибольшим показателем в ранговом упорядочении эффективности энхансера IRF8), предельное значение, как правило, устанавливают равным или большим на величину до 5% эффективности энхансера IRF8 в восприимчивом образце с наименьшим показателем в популяции. Такое предельное значение максимизирует число потенциальных восприимчивых образцов. Когда разница является маленькой (например, в случае небольшого числа или отсутствия образцов, которые не исследовали в отношении восприимчивости, которые попадают в пределы между восприимчивым образцом с наименьшим показателем и невосприимчивым образцом с наибольшим показателем в ранговом упорядочении эффективности энхансера IRF8), предельное значение, как правило, устанавливают на значение между эффективностью энхансера IRF8 восприимчивого образца с наименьшим показателем и невосприимчивого образца с наибольшим показателем. Такое предельное значение минимизирует число ложноположительных образцов. Когда невосприимчивый образец с наибольшим показателем имеет эффективность энхансера IRF8 больше, чем у восприимчивого образца с наименьшим показателем, предельное значение, как правило, устанавливают на значение, равное или большее на величину до 5% эффективности энхансера IRF8 в невосприимчивом образце с наибольшим показателем в популяции. Этот способ также минимизирует число ложноположительных образцов.
[0102] В некоторых вариантах реализации определение того, имеет ли клетка эффективность суперэнхансера IRF8 равную необходимому пороговому уровню или превышающую его, проводят, сравнивая порядковое значение эффективности энхансера IRF8 в исследуемой клетке с порядковым значением эффективности энхансера IRF8 в популяции образцов клеток, причем каждый из образцов клеток получен из разных источников (например, от разных субъектов, из разных линий клеток, из разных ксенотрансплантатов). В этих вариантах реализации по меньшей мере некоторые из образцов в популяции будут исследовать в отношении восприимчивости к специфическому агонисту RARA, чтобы установить: а) наименьшее порядковое значение эффективности энхансера IRF8 образца в популяции, который восприимчив к этому специфическому агонисту RARA («восприимчивый образец с наименьшим порядковым показателем»); и, необязательно, b) наибольшее порядковое значение эффективности энхансера IRF8 образца в популяции, который не восприимчив к этому специфическому агонисту RARA («невосприимчивый образец с наибольшим порядковым показателем»). В этих вариантах реализации предельное порядковое значение эффективности энхансера IRF8, при превышении которого исследуемая клетка считается восприимчивой к этому специфическому агонисту RARA, устанавливается: i) равным или большим на величину до 5% порядкового значения эффективности энхансера IRF8 в восприимчивом образце с наименьшим порядковым показателем в популяции; или ii) равным или большим на величину до 5% порядкового значения эффективности энхансера IRF8 в невосприимчивом образце с наибольшим порядковым показателем в популяции; или iii) как значение между порядковым значением эффективности энхансера IRF8 восприимчивого образца с наименьшим порядковым показателем и невосприимчивого образца с наибольшим порядковым показателем в популяции.
[0103] Следует понимать, что в вышеприведенных вариантах реализации, как правило, не все образцы в популяции необходимо исследовать в отношении восприимчивости к агонисту RARA, но все образцы подлежат измерению эффективности энхансера IRF8 и установлению порядкового значения эффективности энхансера IRF8 по сравнению с другими энхансерами в том же образце. Порядковое значение, как правило, получают, измеряя эффективность всех других энхансеров в клетке и определяя, какой ранг (например, порядковый) в контексте эффективности имеет энхансер IRF8 по сравнению с другими энхансерами.
[0104] В некоторых вариантах реализации проводят ранговое упорядочение образцов на основании порядкового значения эффективности энхансера IRF8. Выбор того, какой из приведенных выше трех способов использовать для установления предельного значения, будет зависеть от разницы в порядковом значении эффективности энхансера IRF8 между восприимчивым образцом с наименьшим порядковым показателем и невосприимчивым образцом с наибольшим порядковым показателем в популяции и от того, служит ли предельное значение для минимизации числа ложно-положительных образцов или максимизации числа демонстрирующих ответ образцов. Когда эта разница является большой (например, в случае наличия большого числа образцов, которые не исследовали в отношении восприимчивости, которые попадают в пределы между восприимчивым образцом с наименьшим порядковым показателем и невосприимчивым образцом с наибольшим порядковым показателем в ранговом упорядочении порядковых значений эффективности энхансера IRF8), предельное значение, как правило, устанавливают равным или большим на величину до 5% порядкового значения эффективности энхансера IRF8 в восприимчивом образце с наименьшим порядковым показателем в популяции. Когда эта разница является маленькой (например, в случае небольшого числа или отсутствия образцов, которые не исследовали в отношении восприимчивости, которые попадают в пределы между восприимчивым образцом с наименьшим порядковым показателем и невосприимчивым образцом с наибольшим порядковым показателем в ранговом упорядочении порядковых значений эффективности энхансера IRF8), предельное значение, как правило, устанавливают на значение между порядковым значением эффективности энхансера IRF8 восприимчивого образца с наименьшим порядковым показателем и невосприимчивого образца с наибольшим порядковым показателем. Когда невосприимчивый образец с наибольшим порядковым показателем имеет порядковое значение эффективности энхансера IRF8 больше, чем у восприимчивого образца с наименьшим показателем, предельное значение, как правило, устанавливают на значение, равное или большее на величину до 5% порядкового значения эффективности энхансера IRF8 в невосприимчивом образце с наибольшим порядковым показателем в популяции.
[0105] В некоторых вариантах реализации, в которых исследуемую клетку или образец сравнивают с популяцией, предельное(-ые) значение(-ия), получаемое(-ые) для популяции (например, эффективность энхансера IRF8 или порядковое значение энхансера IRF8) преобразуют в показатель распространенности и выражают предельное значение в виде процента популяции, имеющего предельное значение или больше, например, предельный показатель распространенности. Не ограничиваясь теорией, заявители полагают, что предельный показатель распространенности исследуемого образца будет одинаковым вне зависимости от методологии, применяемой для определения эффективности энхансера IRF8. Таким образом, предельный показатель распространенности, определенный для одного параметра (например, порядкового значения эффективности энхансера IRF8), можно переносить и применять к другому параметру (например, уровню мРНК IRF8) для определения предельного значения для этого другого параметра. Это позволяет проводить определение предельного значения для любого параметра без экспериментального определения корреляции между уровнями такого параметра и восприимчивостью к агонисту RARA. Все, что необходимо определить, это то, какой уровень такого другого параметра соответствует ранее определенному предельному показателю распространенности в популяции.
[0106] В некоторых вариантах реализации обсуждаемые выше способы можно применять просто для определения, имеет ли пораженная заболеванием клетка от субъекта суперэнхансер, связанный с геном IRF8. В этих вариантах реализации наличие связанного с IRF8 суперэнхансера указывает на то, что субъект будет восприимчив к агонисту RARA. В одном аспекте этих вариантов реализации определяют, что клетка имеет суперэнхансер, связанный с геном IRF8, когда связанный с IRF8 энхансер имеет эффективность, равную или большую, чем энхансер, связанный с MALAT-1. В альтернативных аспектах этих вариантов реализации определяют, что клетка имеет суперэнхансер, связанный с геном IRF8, когда связанный с IRF8 энхансер имеет эффективность, которая по меньшей мере в 10 раз больше, чем медианная эффективность всех энхансеров в клетке. В других альтернативных аспектах этих вариантов реализации определяют, что клетка имеет суперэнхансер, связанный с геном IRF8, когда связанный с IRF8 энхансер имеет эффективность, которая находится выше точки, в которой наклон касательной равен 1 на графике упорядочения по рангу эффективности каждого из энхансеров в клетке.
[0107] В некоторых вариантах реализации обсуждаемые выше способы можно применять для дополнительного определения, экспрессирует ли пораженная заболеванием клетка от субъекта суперэнхансер, связанный с геном RARA, который имеет эффективность, порядковый ранг или показатель распространенности, равный предварительно определенному пороговому уровню или превышающий его. В некоторых аспектах этих вариантов реализации определение того, что: а) или пораженная заболеванием клетка имеет суперэнхансер, связанный с геном IRF8 (или что такой суперэнхансер имеет эффективность или порядковый ранг, равный предварительно определенному пороговому уровню или превышающий его); или b) пораженная заболеванием клетка имеет суперэнхансер, связанный с геном RARA, который имеет эффективность или порядковый ранг, равный предварительно определенному пороговому уровню или превышающий его, указывает на то, что субъект будет восприимчив к агонисту RARA. В других аспектах этих вариантов реализации определение того, что: а) пораженная заболеванием клетка имеет суперэнхансер, связанный с геном IRF8 (или что такой суперэнхансер имеет эффективность или порядковый ранг, равный предварительно определенному пороговому уровню или превышающий его); или b) пораженная заболеванием клетка имеет суперэнхансер, связанный с геном RARA, который имеет эффективность или порядковый ранг, равный предварительно определенному пороговому уровню или превышающий его, указывает на то, что субъект будет восприимчив к агонисту RARA.
Определение уровня мРНК IFR8
[0108] В некоторых вариантах реализации уровни мРНК IFR8 можно использовать вместо эффективности или порядкового ранга суперэнхансера для определения чувствительности к агонисту RARA. Можно проводить количественную оценку мРНК IFR8, которая очень хорошо коррелирует с эффективностью суперэнхансера в этом локусе (фигура 10). Мы определили, что мРНК-транскрипты, кодирующие IRF8, коррелируют с чувствительностью к агонистам RARA (фигура 8) и что в некоторых вариантах реализации уровни мРНК IFR8 можно использовать для идентификации клеток, которые будут восприимчивы к агонистам RARA.
[0109] В некоторых вариантах реализации проводят оценку последовательностей одного или более биомаркеров (например, эпигенетических маркеров, таких как уровень транскрипта). В некоторых вариантах реализации можно использовать секвенирование ДНК, чтобы определить последовательность отдельных генов, более крупных генетических областей (например, кластеров генов или оперонов), целых хромосом или полных геномов. В некоторых вариантах реализации можно использовать секвенирование РНК. Специалисту в данной области известны различные способы для определения последовательностей отдельных генов, более крупных генетических областей (например, кластеров генов или оперонов), целых хромосом или полных геномов. В некоторых вариантах реализации можно использовать секвенирование нового поколения. В некоторых вариантах реализации можно использовать полногеномное секвенирование нового поколения. В некоторых вариантах реализации секвенирование можно применять для проведения количественной оценки уровня транскрипта.
[0110] В некоторых вариантах реализации проводят сравнение уровней мРНК IRF8 у субъекта (например, в опухолевом образце, в образце раковых клеток, в образце крови и т.д.), используя такой же вид анализа, с уровнями мРНК IRF8 в популяции субъектов, имеющих такое же заболевание или патологическое состояние, для выявления субъектов, восприимчивых к агонисту RARA. В этих вариантах реализации по меньшей мере некоторые из образцов в популяции будут исследовать в отношении восприимчивости к специфическому агонисту RARA, чтобы установить: а) наименьший уровень мРНК IRF8 образца в популяции, который восприимчив к этому специфическому агонисту RARA («восприимчивый образец с наименьшим показателем мРНК»); и, необязательно, b) наибольший уровень мРНК IRF8 образца в популяции, который невосприимчив к этому специфическому агонисту RARA («невосприимчивый образец с наибольшим показателем мРНК»). В этих вариантах реализации предельное значение уровня мРНК IRF8, при превышении которого исследуемая клетка считается восприимчивой к этому специфическому агонисту RARA, устанавливается: i) равным или большим на величину до 5% уровня мРНК IRF8 в восприимчивом образце с наименьшим показателем мРНК в популяции; или ii) равным или большим на величину до 5% уровня мРНК IRF8 в невосприимчивом образце с наибольшим показателем мРНК в популяции; или iii) как значение между уровнем мРНК IRF8 восприимчивого образца с наименьшим показателем мРНК и невосприимчивого образца с наибольшим показателем мРНК в популяции.
[0111] В некоторых вариантах реализации не все образцы в популяции необходимо исследовать в отношении восприимчивости к агонисту RARA, но все образцы подлежат измерению уровней мРНК IRF8. В некоторых вариантах реализации проводят ранговое упорядочение образцов на основании уровней мРНК IRF8. Выбор того, какой из приведенных выше трех способов использовать для установления предельного значения, будет зависеть от разницы в уровнях мРНК IRF8 между восприимчивым образцом с наименьшим показателем мРНК и невосприимчивым образцом с наибольшим показателем мРНК в популяции и от того, служит ли предельное значение для минимизации числа ложно-положительных образцов или максимизации потенциального числа демонстрирующих ответ образцов. Когда эта разница является большой (например, в случае наличия большого числа образцов, которые не исследовали в отношении восприимчивости, которые попадают в пределы между восприимчивым образцом с наименьшим показателем мРНК и невосприимчивым образцом с наибольшим показателем мРНК в ранговом упорядочении уровней мРНК IRF8), предельное значение, как правило, устанавливают равным или большим на величину до 5% уровня мРНК IRF8 в восприимчивом образце с наименьшим показателем мРНК в популяции. Когда эта разница является маленькой (например, в случае небольшого числа или отсутствия образцов, которые не исследовали в отношении восприимчивости, которые попадают в пределы между восприимчивым образцом с наименьшим показателем мРНК и невосприимчивым образцом с наибольшим показателем мРНК в ранговом упорядочении уровней мРНК IRF8), предельное значение, как правило, устанавливают на значение между уровнями мРНК IRF8 восприимчивого образца с наименьшим показателем мРНК и невосприимчивого образца с наибольшим показателем мРНК. Когда невосприимчивый образец с наибольшим показателем мРНК имеет уровень мРНК IRF8 больше, чем у восприимчивого образца с наименьшим показателем мРНК, предельное значение, как правило, устанавливают на значение, равное или большее на величину до 5% уровней мРНК IRF8 в невосприимчивом образце с наибольшим показателем мРНК в популяции.
[0112] В некоторых вариантах реализации проводят ранговое упорядочение популяции на основании уровня мРНК IRF8. В этих вариантах реализации измеряют уровень мРНК IRF8 в каждом образце и сравнивают с уровнями мРНК всех других мРНК в клетке, чтобы получить порядковое ранжирование по уровню мРНК IRF8. Затем определяют предельное значение на основании порядкового ранжирования мРНК IRF8 на основании образцов в популяции, которые исследовали в отношении восприимчивости к агонисту RARA таким же образом, что был описан ранее для определения порядкового предельного значения эффективности суперэнхансера IRF8. Затем определенное порядковое предельное значение мРНК IRF8 используют напрямую или для определения предельного показателя распространенности, которые затем используют для стратификации дополнительных образцов в отношении потенциальной восприимчивости к агонисту RARA.
[0113] В некоторых вариантах реализации предельное значение уровней мРНК IRF8 определяют, используя предельный показатель распространенности, установленный на основании эффективности энхансера IRF8 или порядкового значения эффективности энхансера IRF8, как описано выше. В некоторых аспектах этих вариантов реализации проводят измерения в популяции в отношении уровней мРНК и применяют к этой популяции ранее определенный предельный показатель распространенности, чтобы определить предельный уровень мРНК. В некоторых аспектах этих вариантов реализации строят стандартную кривую для рангового упорядочения уровней мРНК IRF8 в популяции и применяют к этой стандартной кривой ранее определенный предельный показатель распространенности, чтобы определить предельный уровень мРНК IRF8.
[0114] В некоторых аспектах вариантов реализации, в которых исследуемую клетку или образец сравнивают с популяцией, предельное(-ые) значение(-ия) уровней мРНК, полученное(-ые) для популяции, преобразуют в показатель распространенности, а предельное значение уровня мРНК выражают в виде процента популяции, имеющего предельное значение или больше, например, предельный показатель распространенности.
[0115] Не ограничиваясь теорией, заявители полагают, что показатель распространенности исследуемого образца и предельный показатель распространенности в популяции будут одинаковыми вне зависимости от методологии, применяемой для определения уровней мРНК IRF8.
[0116] В некоторых аспектах этих вариантов реализации субъекта определяют как восприимчивого к агонисту RARA, если его уровень мРНК IRF8 соответствует показателю распространенности в популяции, составляющему около 80%, 79%, 78%, 77%, 76%, 75%, 74%, 73%, 72%, 71%, 70%, 69%, 68%, 67%, 66%, 65%, 64%, 63%, 62%, 61%, 60%, 59%, 58%, 57%, 56%, 55%, 54%, 43%, 42%, 51%, 50%, 49%, 48%, 47%, 46%, 45%, 44%, 43%, 42%, 41%, 40%, 39%, 38%, 37%, 36%, 35%, 34%, 33%, 32%, 31%, 30%, 29%, 28%, 27%, 26%, 25%, 24%, 23%, 22%, 21% или 20% по определению уровней мРНК IRF8 в популяции. В некоторых вариантах реализации предельное значение устанавливают на основании предельного значения распространенности, установленного для эффективности энхансера IRF8. В некоторых вариантах реализации предельное значение устанавливают на основании предельного значения распространенности, установленного для порядкового значения эффективности энхансера IRF8. В некоторых вариантах реализации предельное значение устанавливают на основании уровней мРНК IRF8. В некоторых вариантах реализации предельное значение для пациентов с ОМЛ, не-ОПЛ ОМЛ или МДС устанавливают на основании значения распространенности, определенного для порядкового значения эффективности энхансера IRF8, а это значение распространенности используют для определения предельного значения для уровней мРНК IRF8. В некоторых вариантах реализации предельное значение для пациентов с ОМЛ, не-ОПЛ ОМЛ или МДС определяют, используя предельный показатель распространенности, составляющий около 20-45% (например, около 20-25%, 25-30%, 25-35%, 2540%, 20-30%, 20-35%, 20-40%, 20-45%, 21-34%, 22-34%, 25-34%, 21-25%, 22-25%, 23-25%, 24-25% или 21-22%). В некоторых вариантах реализации предельное значение для пациентов с ОМЛ, не-ОПЛ ОМЛ или МДС определяют, используя значение распространенности 34%. В некоторых вариантах реализации предельное значение для пациентов с ОМЛ, не-ОПЛ ОМЛ или МДС определяют, используя значение распространенности 25%. В некоторых вариантах реализации предельное значение для пациентов с ОМЛ, не-ОПЛ ОМЛ или МДС определяют, используя значение распространенности 22%. В некоторых вариантах реализации предельное значение для пациентов с ОМЛ, не-ОПЛ ОМЛ или МДС определяют, используя значение распространенности 21%.
[0117] В других вариантах реализации популяция может быть поделена на три группы - восприимчивые, частично восприимчивы и невосприимчивые, и устанавливают два предельных значения или предельных показателя распространенности. Частично восприимчивая группа может включать в себя восприимчивых и невосприимчивых, а также тех членов популяции, чей ответ на агонист RARA был не настолько высоким, как в восприимчивой группе. В этих вариантах реализации определяют два предельных значения или предельных показателя распространенности. Этот тип стратификации может частично применяться, когда в популяции невосприимчивый субъект с наибольшим показателем мРНК IRF8 имеет уровни мРНК IRF8 больше, чем у восприимчивого субъекта с наименьшим показателем мРНК RARA. В этом случае предельное значение или предельный показатель распространенности между восприимчивыми и частично восприимчивыми субъектами устанавливают равным или большим на величину до 5% уровня мРНК IRF8 невосприимчивого субъекта с наибольшим показателем мРНК IRF8; а предельное значение или предельный показатель распространенности между частично восприимчивыми и невосприимчивыми субъектами устанавливают равным или меньшим на величину до 5% уровня мРНК IRF8 восприимчивого субъекта с наименьшим показателем мРНК IRF8. Определение того, следует ли частично восприимчивым субъектам вводить агонист RARA, будет зависеть от решения лечащего врача и/или одобрения регуляторного органа.
[0118] Способы количественной оценки специфических последовательностей РНК в клетке или биологическом образце известны в данной области и включают, но не ограничиваются этим, флуоресцентную гибридизацию, такую как применяется в сервисах и продуктах, предоставляемых NanoString Technologies, матричную технологию (Affymetrix), кПЦР с обратной транскриптазой, например, как в случае SYBR® Green (Life Technologies) или технологии TaqMan® (Life Technologies), секвенирование РНК (например, PHK-seq), гибридизацию РНК и амплификацию сигнала, применяемую в RNAscope® (Advanced Cell Diagnostics), или нозерн-блот.
[0119] В некоторых аспектах этих вариантов реализации уровень транскрипта РНК (мРНК или другого транскрипта RARA или IRF8) как в исследуемой клетке, так и в контрольной клетке или всех представителях популяции, нормализуют перед проведением сравнения. Нормализация включает корректировку определенного уровня РНК-транскрипта IRF8 или RARA путем сравнения с другим РНК-транскриптом, который является нативным и присутствует на одинаковых уровнях в обеих клетках (например, мРНК GADPH, 18S РНК), или с фиксированным уровнем эндогенной РНК, которую «вносят» в образцы каждой из клеток перед определением эффективности суперэнхансера (J Loven et al., Cell, 151 (3):476-82 (2012); J Kanno et al., BMC Genomics 7:64 (2006); J Van de Peppel et al., EMBO Rep 4:387-93 (2003)).
Рак и другие заболевания
[0120] Способы согласно настоящему изобретению применимы для лечения любого вида рака, который характеризуется ассоциацией суперэнхансера с IRF8 или уровнем мРНК IRF8, равным пороговому уровню при таком раке или превышающим его. Связанные с суперэнхансером гены IRF8 могут быть более распространены при определенных типах рака, чем другие. В некоторых вариантах реализации связанные с суперэнхансером гены IRF8 могут быть более распространены при не-ОПЛ ОМЛ и при МДС, чем при других типах рака или предраковых состояниях.
[0121] В некоторых вариантах реализации заболевание, подлежащее лечению способами согласно изобретению, представляет собой рак. В некоторых вариантах реализации заболевание, подлежащее лечению, выбрано из не-ОПЛ ОМЛ и МДС. В некоторых вариантах реализации заболевание, подлежащее лечению, представляет собой не-ОПЛ ОМЛ и МДС, которые не характеризуются хромосомной транслокацией, включающей ген IRF8.
[0122] В некоторых вариантах реализации субъект, подлежащий лечению агонистом RARA (например, тамибаротеном), страдает от рецидивного или рефрактерного не-ОПЛ ОМЛ. Субъектов классифицируют как имеющих рецидивный или рефрактерный не-ОПЛ ОМЛ, если они: а) не демонстрируют частичный ответ после первого цикла индукционной химиотерапии; или b) не демонстрируют полный ответ после второго цикла индукционной химиотерапии; или с) демонстрируют рецидив после традиционной химиотерапии; или d) демонстрируют рецидив после прохождения одноразовой трансплантации стволовых клеток.
[0123] В некоторых вариантах реализации субъект, подлежащий лечению агонистом RARA (например, тамибаротеном), страдает от рефрактерного МДС. Субъектов классифицируют как имеющих рефрактерный МДС, если они: а) определены как имеющие высокий риск или промежуточную стадию-2 МДС (по определению Международной прогностической системы стадирования («IPPS»)) и не достигли какого-либо гематологического улучшения (по определению согласно критериям IWG 2006) после по меньшей мере 4 циклов индукционной терапии гипометилирующими агентами (например, азацитидином, децитабином) или демонстрировали рецидив после полного или частичного ответа любой длительности; или b) определены как имеющие промежуточную стадию-1 или низкий риск МДС по IPSS и зависят от трансфузии или не поддались лечению эритропоэз-стимулирующими агентами (ЭСА).
[0124] В некоторых вариантах реализации субъект, подлежащий лечению агонистом RARA (например, тамибаротеном), представляет собой пожилого, непригодного по состоянию здоровья субъекта. В контексте данного документа термин «пожилой, непригодный по состоянию здоровья» относится к субъекту, который является человеком возрастом по меньшей мере 60 лет и который по определению врача не является кандидатом для прохождения стандартной индукционной терапии.
Агонисты RARA
[0125] Выбор агониста RARA, которым предстоит лечить пациента, имеющего по определению некоторый уровень суперэнхансера, можно делать из любого агониста RARA, известного в данной области. Предпочтительно, чтобы агонист RARA, применяемый в способах согласно изобретению, был специфическим в отношении RARA и имел по существу меньшую (по меньшей мере в 10 раз меньшую, по меньшей мере в 100 раз меньшую, по меньшей мере в 1000 раз меньшую, по меньшей мере в 10000 раз меньшую, по меньшей мере в 100000 раз меньшую) агонистическую активность против других форм RaR, например, RaR-β и RaR-γ.
[0126] В некоторых вариантах реализации агонист RARA выбран из соединения, описанного в любом из следующих патентов США, или любого соединения, соответствующего классу, приведенному них: US 4703110, US 5081271, US 5089509, US 5455265, US 5759785, US 5856490, US 5965606, US 6063797, US 6071924, US 6075032, US 6187950, US 6355669, US 6358995 и US 6387950, каждый из которых включен посредством ссылки.
[0127] В некоторых вариантах реализации агонист RARA выбран из любого из следующих известных агонистов RARA, приведенных в таблице 1, или их фармацевтически приемлемой соли, или сольвата или гидрата:
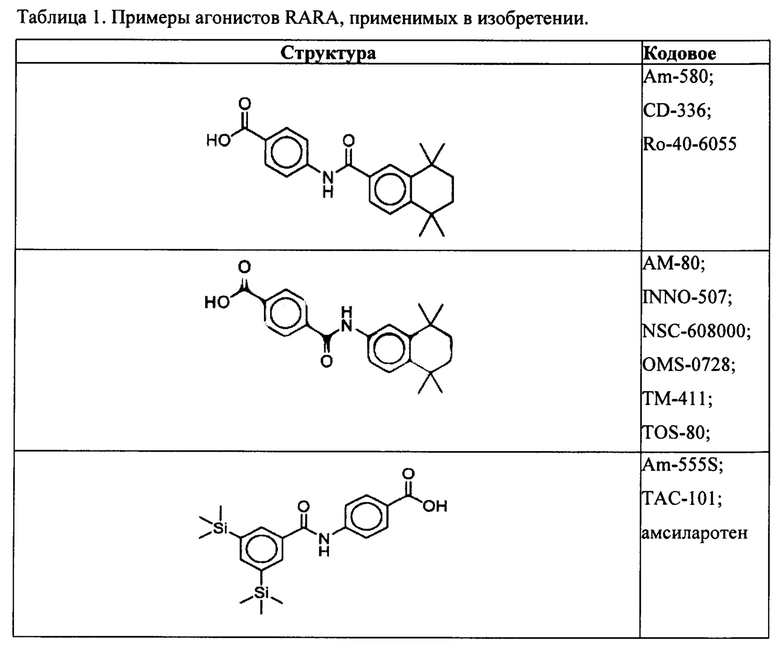
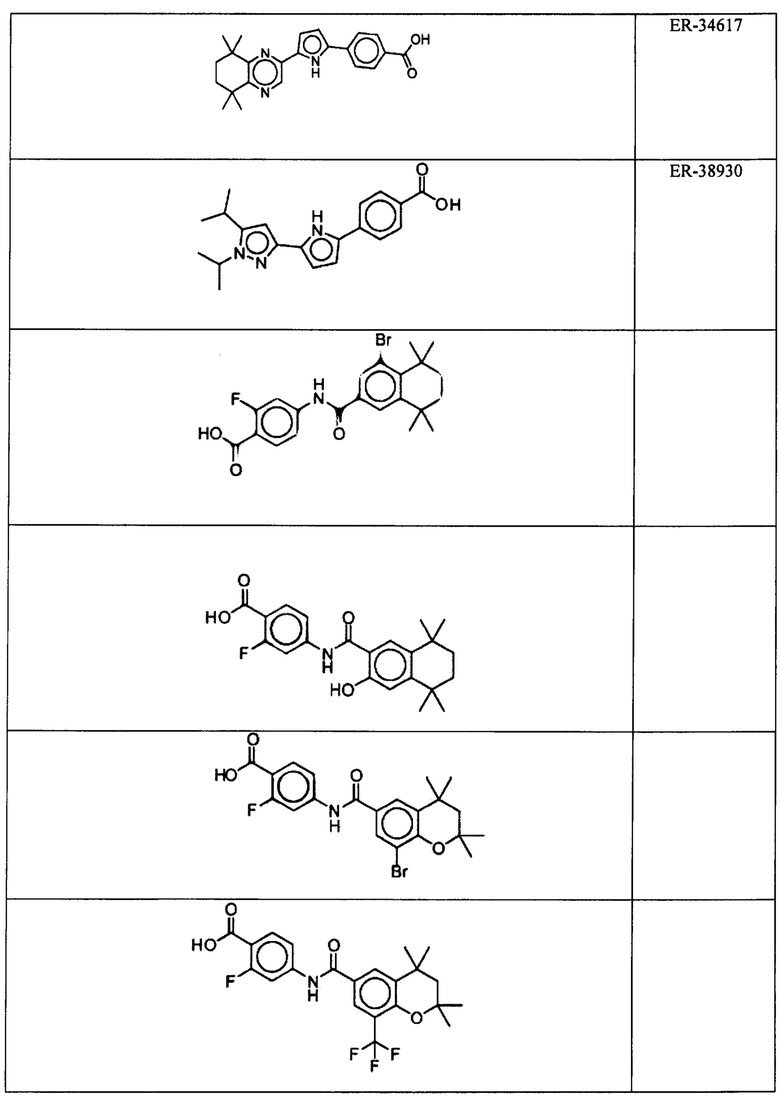
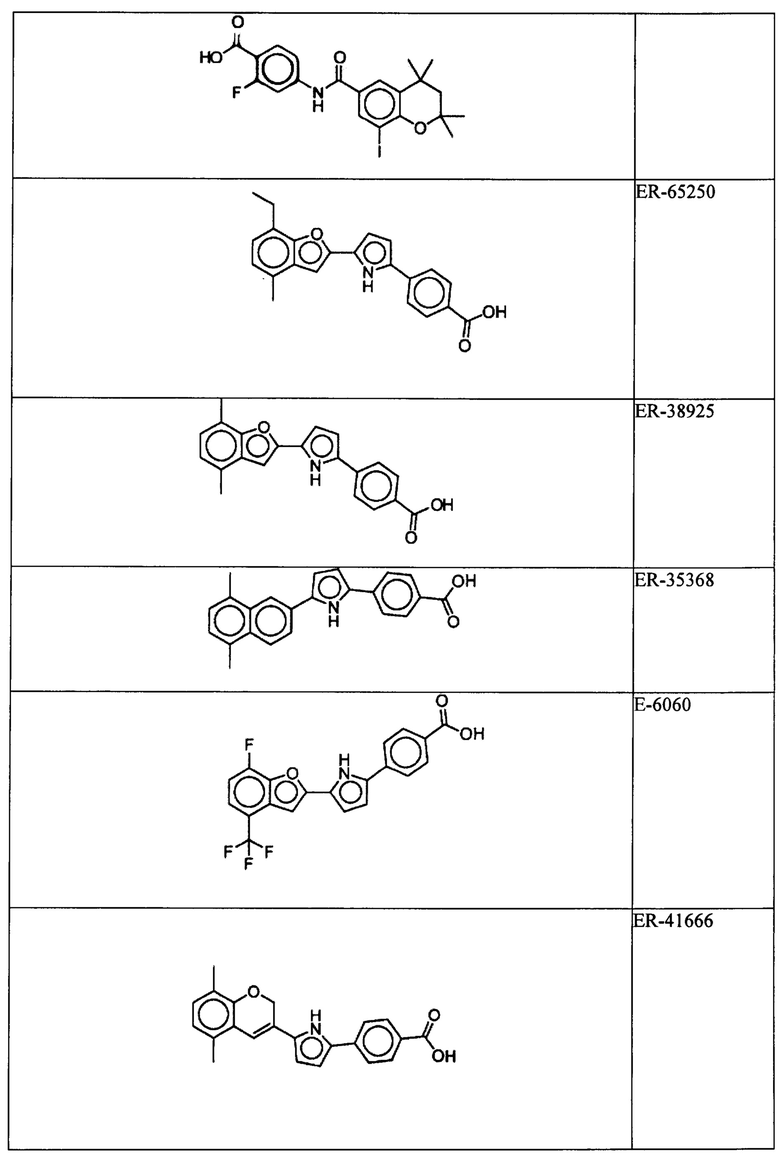
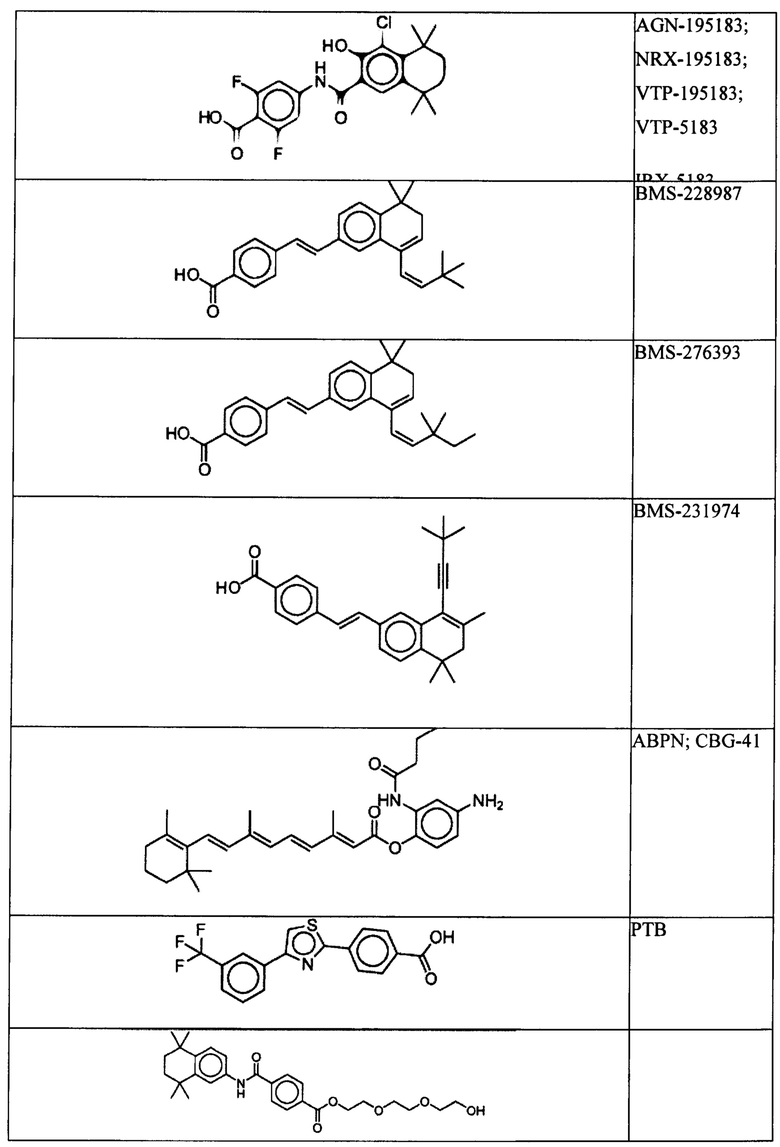
[0128] В некоторых вариантах реализации агонист RARA представляет собой тамибаротен.
Терапевтические схемы
Маркеры и получение характеристик
[0129] В некоторых вариантах реализации технологии, предложенные в настоящем изобретении, включают оценку типа рака, от которого страдает пациент. В некоторых вариантах реализации пациент страдает от не-ОПЛ острого миелоцитарного лейкоза (ОМЛ). В некоторых вариантах реализации пациент страдает от миелодиспластического синдрома (МДС).
[0130] В целом, в настоящем изобретении предложены технологии, в соответствии с которыми проводят анализ и/или оценку одного или более маркеров или характеристик субъекта; в некоторых вариантах реализации решение в отношении терапии принимают на основании такого анализа и/или оценки.
[0131] В некоторых вариантах реализации маркер представляет собой агент или соединение, чье присутствие, форма, уровень и/или активность коррелирует в релевантной популяции с релевантным признаком (например, типом или стадией рака). В некоторых вариантах реализации настоящее изобретение предполагает идентификацию, классификацию и/или получение характеристик одного или более биомаркеров, релевантных для лечения не-ОПЛ ОМЛ агонистом RARA. В некоторых вариантах реализации настоящее изобретение предполагает идентификацию, классификацию и/или получение характеристик одного или более биомаркеров, релевантных для лечения МДС агонистом RARA.
[0132] В некоторых вариантах реализации классификация пациента как страдающего от конкретного типа рака может включать оценку стадии рака. В некоторых вариантах реализации классификация пациента как страдающего от конкретного типа рака может включать оценку тяжести заболевания у пациента (например, числа раковых клеток, размера опухоли и/или количества рака в организме).
[0133] В общем случае тип рака можно оценивать в соответствии с настоящим изобретением с помощью подходящего вида анализа, как очевидно для специалистов в данной области. В данной области известно множество видов анализа для оценки типа рака, включая, например, те, в которых используется гистологическая оценка (например, образец биопсии), визуализация (например, магнитно-резонансная томография (МРТ), позитронная эмиссионная томография (ПЭТ), компьютерная томография (КТ)), ультразвуковое исследование, эндоскопия, рентгеновское излучение (например, маммограмма, исследование глотания с помощью бариевой взвеси, панорамная рентгенография), дуктограмма или остеосцинтиграфия.
[0134] В некоторых вариантах реализации терапия агонистом RARA включает оценку уровня одного или более биомаркеров, характеризующих стадию или форму не-ОПЛ ОМЛ или МДС. В некоторых вариантах реализации терапия агонистом RARA включает оценку уровня мРНК IRF8 и, необязательно, уровня мРНК RARA. В некоторых вариантах реализации терапия агонистом RARA включает наличие суперэнхансера, связанного с геном IRF8, и, необязательно, эффективности или порядкового ранга суперэнхансера, связанного с геном RARA. В некоторых вариантах реализации терапия агонистом RARA включает оценку уровня мРНК IRF8 или наличие суперэнхансера, связанного с геном IRF8, и, необязательно, уровня мРНК RARA, эффективности или порядкового ранга суперэнхансера, связанного с геном RARA.
[0135] Не ограничиваясь теорией, заявители полагают, что подгруппы МКПК, которые имеют только один из маркеров CD34 или CD117, также можно использовать для определения уровней мРНК IRF8 или суперэнхансера. Кроме того, некоторые методы анализа мРНК IRF8, такие как RNAScope®, не требуют обогащения образца МКПК перед проведением анализа, так как эти методы обеспечивают аналитическое обогащение мРНК из необходимых клеток на основании применения специальных процедур олигонуклеотидной гибридизации/амплификации.
Популяции пациентов
[0136] В некоторых вариантах реализации терапию агонистом RARA применяют в соответствии с настоящим изобретением к одному или более пациентам (например, к популяции пациентов), как описано в данном документе.
[0137] В некоторых вариантах реализации популяция пациентов включает одного или более субъектов (например, включает или состоит из субъектов), страдающих от рака. В некоторых вариантах реализации популяция пациентов включает одного или более субъектов, страдающих от не-ОПЛ ОМЛ. В некоторых вариантах реализации популяция пациентов включает одного или более субъектов, страдающих от МДС.
[0138] В некоторых вариантах реализации популяция пациентов включает одного или более субъектов (например, включает или состоит из субъектов), которые ранее получали терапию для лечения рака (например, не-ОПЛ ОМЛ или МДС). В некоторых вариантах реализации популяция пациентов включает одного или более субъектов (например, включает или состоит из субъектов), которые ранее не получали терапию для лечения рака (например, не-ОПЛ ОМЛ или МДС). В некоторых вариантах реализации популяция пациентов включает или состоит из пациентов, которые ранее не получали терапию для лечения не-ОПЛ ОМЛ или МДС.
[0139] В некоторых вариантах реализации пациент, который ранее получал терапию, мог ранее получать терапию, выбранную из группы, состоящей из химиотерапии, иммунотерапии, лучевой терапии, паллиативной помощи, хирургического вмешательства и их комбинаций. В некоторых вариантах реализации пациент проходил трансплантацию. В некоторых вариантах реализации пациент получал стандартную цитотоксическую химиотерапию. В некоторых вариантах реализации стандартная цитотоксическая химиотерапия включает применение цитарабина и/или антрациклина. В некоторых вариантах реализации стандартная цитотоксическая химиотерапия может включать дополнительную химиотерапию и/или трансплантацию гемопоэтических стволовых клеток (ТГСК). В некоторых вариантах реализации пациент получал гипометилирующие агенты. В некоторых вариантах реализации пациент получал леналидомид.
[0140] В некоторых вариантах реализации популяция пациентов включает одного или более субъектов (например, включает или состоит из субъектов), которые получали и/или получают другую терапию, например, так, что терапевтическую композицию агониста RARA (например, тамибаротена) вводят в комбинации с другим видом терапии (например, химиотерапевтическими агентами). В некоторых вариантах реализации такой другой вид терапии может включать или состоять из терапии рака (например, как описано в данном документе), боли, тошноты, запора, лечения одного или более побочных явлений (например, зуда, выпадения волос, бессонницы и т.д.), связанных с противораковой терапией, и т.д., или любой их комбинации. В настоящем изобретении предложен способ лечения не-ОПЛ ОМЛ или МДС, который включает лечение пациента, по определению имеющего не-ОПЛ ОМЛ или МДС, терапевтически эффективным количеством терапевтического средства на основе агониста RARA (например, тамибаротена) или его фармацевтически приемлемой соли.
[0141] В некоторых вариантах реализации в настоящем изобретении предложен способ предотвращения или замедления появления не-ОПЛ ОМЛ или МДС, включающий введение пациенту, по определению нуждающемуся в предотвращении или замедлении появления не-ОПЛ ОМЛ или МДС, профилактически эффективного количества терапевтического средства на основе агониста RARA (например, тамибаротена) или его фармацевтически приемлемой соли.
[0142] В некоторых вариантах реализации в настоящем изобретении предложен способ лечения пациента от не-ОПЛ ОМЛ или МДС, который ранее проходил лечение согласно схеме лечения, включающей химиотерапию, путем введения такому пациенту терапевтически эффективного количества терапевтического средства на основе агониста RARA (например, тамибаротена) или его фармацевтически приемлемой соли. В некоторых вариантах реализации в настоящем изобретении предложен способ лечения пациента от не-ОПЛ ОМЛ или МДС в случае отсутствия стандартных вариантов терапии. В некоторых вариантах реализации в настоящем изобретении предложен способ лечения пациента, который не подходит для стандартной терапии.
[0143] В некоторых вариантах реализации пациент также может иметь заболевания, связанные с МДС, такие как недостаточность костного мозга, цитопения периферической крови и связанные с ними осложнения типа анемии, инфекции или кровотечения. В некоторых вариантах реализации пациент может иметь МДС, прогрессирующий до ОМЛ.
[0144] В некоторых вариантах реализации пациент или популяция пациентов может не представлять собой (например, может исключать) пациентов, которые являются или могут быть беременными. В некоторых вариантах реализации можно проводить мониторинг пациента или популяции пациентов в отношении одного или более признаков беременности, родов и/или грудного вскармливания перед и/или во время применения терапии на основе агониста RARA. В некоторых вариантах реализации терапию на основе агониста RARA можно сокращать, временно прерывать или прекращать для пациента, который по определению демонстрирует один или более признаков беременности, родов и/или грудного вскармливания.
[0145] В некоторых вариантах реализации пациент или популяция пациентов может не представлять собой (например, может исключать) пациентов, которые имеют в анамнезе гиперчувствительность к ингредиенту тамибаротена. В некоторых вариантах реализации пациент или популяция пациентов может не представлять собой (например, может исключать) пациентов, которые получают составы на основе витамина А. В некоторых вариантах реализации пациент или популяция пациентов может не представлять собой (например, может исключать) пациентов, которые имеют гипервитаминоз А.
[0146] В некоторых вариантах реализации пациент или популяция пациентов может не представлять собой (например, может исключать) пациентов преклонного возраста. В некоторых вариантах реализации пациент или популяция пациентов может представлять собой или включать одного или более пациентов преклонного возраста. В некоторых вариантах реализации можно чаще проводить мониторинг пациентов преклонного возраста для выявления потенциальных побочных явлений (включая, например, низкие уровни сывороточного альбумина и/или повышенные концентрации свободного лекарства в плазме и т.д.) по сравнению с одним или более пациентами младшего возраста. В некоторых вариантах реализации терапию на основе агониста RARA можно сокращать, временно прерывать и/или прекращать для пациента преклонного возраста, который по определению демонстрирует один или более признаков такого побочного явления.
[0147] В некоторых вариантах реализации пациент или популяция пациентов может не представлять собой (например, может исключать) пациентов детского возраста. В некоторых вариантах реализации пациент или популяция пациентов может представлять собой или включать одного или более пациентов детского возраста. В некоторых вариантах реализации можно чаще проводить мониторинг пациентов детского возраста для выявления потенциальных побочных явлений (включая, например, повышенное внутричерепное давление и т.д.) по сравнению с одним или более пациентами старшего возраста. В некоторых вариантах реализации терапию на основе агониста RARA можно сокращать, временно прерывать и/или прекращать для пациента детского возраста, который по определению демонстрирует один или более признаков такого побочного явления.
[0148] В некоторых вариантах реализации терапию агонистом RARA в соответствии с настоящим изобретением сокращают, временно прерывают или прекращают для конкретного пациента, если и когда у пациента развивается одна или более побочных реакций, таких как, например, головная боль, сыпь, сухость кожи, экзема, эксфолиативный дерматит, боль в костях, боль в суставах, лихорадка, повышение числа лейкоцитов, снижение гемоглобина, повышение ACT, повышение АЛТ, повышение ЛДГ, повышение ЩФ, повышение ТГ, повышение ОХ, фоллицит, фолликулит, повышение СРБ и их комбинации. В альтернативных или дополнительных вариантах реализации терапию агонистом RARA в соответствии с настоящим изобретением сокращают, временно прерывают или прекращают для конкретного пациента, если и когда у пациента развивается одна или более побочных реакций, таких как, например, тромбоз (например, инфаркт головного мозга, инфаркт легкого, артериальный тромбоз, венозный тромбоз и т.д.), васкулит, делирий, токсический эпидермальный некролиз (синдром Лайелла), многоформная эритема, повышенное внутричерепное давление и их комбинации.
[0149] В некоторых вариантах реализации в настоящем изобретении предложено применение соединения (например, тамибаротена) или его фармацевтически приемлемой соли для производства лекарства, применимого для лечения, предотвращения или замедления начала не-ОПЛ ОМЛ или МДС. В некоторых вариантах реализации пациент страдает от рака (например, не-ОПЛ ОМЛ или МДС). В некоторых вариантах реализации пациент страдает от рака (например, не-ОПЛ ОМЛ или МДС), который устойчив к другим видам терапии (например, к химиотерапии). В некоторых вариантах реализации рак характеризуется наличием биомаркера IRF8, при этом биомаркер IRF8 представляет собой или включает экспрессию одного или более из повышенных уровней мРНК IRF8 или суперэнхансера, связанного с геном IRF8. В некоторых вариантах реализации рак характеризуется экспрессией одного или более из повышенных уровней мРНК RARA или суперэнхансера, связанного с геном RARA. В некоторых вариантах реализации рак характеризуется отсутствием экспрессии одного или более из повышенных уровней мРНК RARA или суперэнхансера, связанного с геном RARA.
Дозированные формы и схемы дозирования
[0150] В общем случае каждый активный агент (например, тамибаротен) для применения в соответствии с настоящим изобретением готовят, дозируют и вводят в терапевтически эффективном количестве, используя фармацевтические композиции и схемы дозирования, согласующиеся с надлежащей медицинской практикой и подходящие для релевантного(-ых) агента(-ов) и субъекта. В принципе, терапевтические композиции можно вводить любым подходящим способом, известным в данной области, включая, без ограничений, пероральный, мукозальный, ингаляционный, местный, буккальный, назальный, ректальный или парентеральный (например, внутривенный, инфузионный, внутриопухолевый, внутриузловой, подкожный, внутрибрюшинный, внутримышечный, интрадермальный, трансдермальный или другие пути введения). В некоторых вариантах реализации агонист RARA (например, тамибаротен) будут вводить перорально.
[0151] В некоторых вариантах реализации схема дозирования для конкретного активного агента может включать периодическое или непрерывное введение, например, для получения конкретного необходимого фармакокинетического профиля или другого варианта воздействия в одной или более представляющих интерес тканях или жидкостях в организме субъекта, получающего терапию.
[0152] В некоторых вариантах реализации разные агенты, вводимые в комбинации, можно вводить разными путями доставки и/или в соответствии с разными схемами. В альтернативных или дополнительных вариантах реализации одну или более доз первого активного агента вводят практически одновременно, а в некоторых вариантах реализации - таким же путем и/или в виде части одной композиции с одним или более другими активными агентами.
[0153] Факторы, которые необходимо учитывать при оптимизации путей и/или схемы дозирования для заданной терапевтической схемы, могут включать, например, конкретное подлежащее лечению показание, клиническое состояние субъекта (например, возраст, общее состояние здоровья, ранее получаемую терапию и/или восприимчивость к ней и т.д.), место доставки агента, природу агента, режим и/или путь введения агента, наличие или отсутствие комбинированной терапии и другие факторы, известные практикующим медикам. Например, при лечении рака релевантные характеристики показания, подлежащего лечению, могут включать, помимо прочего, одно или более из типа рака, стадии, локации и т.д.
[0154] В некоторых вариантах реализации одну или более характеристик конкретной фармацевтической композиции и/или применяемой схемы дозирования можно модифицировать со временем (например, повышая или снижая количество активного агента в любой отдельной дозе, увеличивая или уменьшая временные интервалы между дозами и т.д.), например, чтобы оптимизировать необходимое терапевтическое действие или ответ.
[0155] В общем случае тип, количество и частоту дозирования активных агентов в соответствии с настоящим изобретением регулируют согласно требованиям безопасности и эффективности, применимым при введении релевантного(-ых) агента(-ов) млекопитающему, предпочтительно человеку. В общем случае такие характеристики дозирования выбирают так, чтобы обеспечить конкретный и, как правило, выявляемый, терапевтический ответ по сравнению с тем, что наблюдается в отсутствие терапии. В некоторых вариантах реализации агонист RARA (например, тамибаротен) будут вводить непрерывно.
[0156] В контексте настоящего изобретения пример необходимого терапевтического ответа может включать, но не ограничивается этим, ингибирование и/или снижение роста опухоли, размера опухоли, метастазов, одного или более симптомов и побочных явлений, связанных с опухолью, а также повышение апоптоза опухолевых клеток, терапевтически релевантное снижение или повышение числа одного или более клеточных маркеров или циркулирующих маркеров и т.д. Такие критерии можно легко оценить любым или множества иммунологических, цитологических и других способов, описанных в литературе.
[0157] В некоторых вариантах реализации может существовать необходимость в составлении схем дозирования и, в частности, в разработке последовательных схем дозирования на основании времени появления и/или пороговых уровней экспрессии индуцибельных маркеров для конкретных типов опухолей, конкретных опухолей, конкретных популяций пациентов (например, несущих генетически маркеры) и/или конкретных пациентов. В некоторых таких вариантах реализации терапевтические схемы дозирования можно комбинировать или корректировать с учетом методов выявления, с помощью которых проводят оценку экспрессии одного или более индуцибельных маркеров до и/или во время терапии.
[0158] В некоторых вариантах реализации схема терапии агонистом RARA (например, тамибаротеном) включает применение по меньшей мере одной (или включает применение или состоит точно из одной) дозы, составляющей около 1 мг/м2, 2 мг/м2, 3 мг/м2, 4 мг/м2, 5 мг/м2, 6 мг/м2, 7 мг/м2, 8 мг/м2, 9 мг/м2, 10 мг/м2, 11 мг/м2, 12 мг/м2, 13 мг/м2, 14 мг/м2, 15 мг/м2, 16 мг/м2 или дозы тамибаротена, промежуточной между любыми двумя из этих значений. В некоторых вариантах реализации схема терапии тамибаротеном включает применение дозы, составляющей 6 мг/м2. В некоторых вариантах реализации схема терапии тамибаротеном включает применение дозы, составляющей 4 мг/м2. В некоторых вариантах реализации схема терапии тамибаротеном включает применение дозы, составляющей 2 мг/м2. В некоторых вариантах реализации схема терапии тамибаротеном включает применение дозы, составляющей 1 мг/м2.
[0159] В некоторых вариантах реализации схема терапии агонистом RARA (например, тамибаротеном) включает применение некоторого количества доз композиции тамибаротена. В некоторых таких вариантах реализации схема терапии тамибаротеном включает, например, применение 2, 5, 10, 20, 30, 60, 90, 180, 365 доз или числа доз, промежуточного между любыми двумя из этих значений, и/или включает повторяемую схему приема доз (например, по меньшей мере один цикл из двух суточных доз, который может повторяться, необязательно, с периодом введения альтернативного варианта, или, необязательно, с периодом без введения, который разделяет разные циклы). В некоторых вариантах реализации схему терапии тамибаротеном применяют дважды в сутки. В некоторых вариантах реализации схему терапии тамибаротеном применяют один раз в сутки. В некоторых вариантах реализации схема терапии тамибаротеном включает применение общей дозы, составляющей 6 мг/м2, разделенной на два суточных пероральных приема.
[0124] В некоторых вариантах реализации схему терапии агонистом RARA (например, тамибаротеном) можно применять к субъекту или популяции пациентов, которые принимали или не принимали некоторое количество пищи до, во время или после введения. Термины «до введения» и «после введения» по отношению к приему пищи относятся к периоду времени, составляющему около 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 14, 16, 18, 20, 22, 24, 30, 42 или 72 часов или более до или после введения. В некоторых вариантах реализации термин «введение… принимая во внимание прием пищи» подразумевает, что субъект или популяция пациентов принимают пищу до введения (например, после еды). В некоторых вариантах реализации термин «введение… принимая во внимание прием пищи» подразумевает, что субъект или популяция пациентов принимают пищу после введения. В некоторых вариантах реализации термин «введение… принимая во внимание прием пищи» подразумевает, что субъект или популяция пациентов принимают пищу во время введения. В некоторых альтернативных вариантах реализации термин «введение… принимая во внимание прием пищи» означает, что субъект или популяция пациентов находятся в состоянии натощак во время введения.
[0160] В некоторых вариантах реализации прием пищи включает пищу с высоким содержанием жиров или диету с высоким содержанием жиров. В некоторых вариантах реализации схему терапии агонистом RARA (например, тамибаротеном) применяют к субъекту в состоянии натощак. В некоторых вариантах реализации схему терапии агонистом RARA (например, тамибаротеном) применяют к субъекту после еды.
Составы
[0161] В контексте данного документа фармацевтическая композиция относится к смеси соединения, такого как тамибаротен, с другими химическими компонентами, такими как носители, стабилизаторы, разбавители, диспергирующие агенты, суспендирующие агенты, загустители и/или вспомогательные вещества. Фармацевтическая композиция облегчает введение соединения в организм. Фармацевтические композиции, содержащие соединение, можно вводить в терапевтически эффективных количествах любым традиционным образом или путем, известным в данной области, включая, но не ограничиваясь этим: внутривенное, пероральное, ректальное, аэрозольное, парентеральное, офтальмологическое, легочное, трансдермальное, вагинальное, ушное, назальное и местное введение.
[0162] Соединение можно вводить местным, а не системным образом, например, посредством инъекции соединения непосредственно в орган, часто в виде депо-состава или состава с продолжительным высвобождением. Кроме того, фармацевтическую композицию, содержащую соединение, можно вводить в направленной системе доставки лекарства, например, в липосоме, покрытой специфическим в отношении органа антителом. Липосомы будут избирательно направляться и поглощаться органом. Кроме того, фармацевтическая композиция, содержащая соединение, может быть предоставлена в форме состава с быстрым высвобождением, в форме состава с продленным высвобождением или в форме состава с промежуточным высвобождением. В некоторых вариантах реализации состав с продленным высвобождением высвобождает соединение в течение более 1 часа, более 2 часов, более 3 часов, более 4 часов, более 6 часов, более 12 часов, более 24 часов или более. В некоторых вариантах реализации состав с продленным высвобождением высвобождает соединение с постоянной скоростью в течение более 1 часа, более 2 часов, более 3 часов, более 4 часов, более 6 часов, более 12 часов, более 24 часов или более.
[0163] Для перорального введения соединение легко можно готовить, комбинируя активные соединения с фармацевтически приемлемыми носителями или вспомогательными веществами, хорошо известными в данной области. Такие носители позволяют готовить описанные в данном документе соединения в виде таблеток, порошков, пилюль, драже, капсул, жидкостей, гелей, сиропов, эликсиров, взвесей, суспензий и т.д. для глотания подлежащим лечению субъектом. В общем случае вспомогательные вещества, такие как наполнители, разрыхлители, вещества, способствующие скольжению, поверхностно-активные вещества, ингибиторы рекристаллизации, лубриканты, пигменты, связующие вещества, ароматизаторы и т.д., можно применять в общепринятых целях и в типовых количествах без воздействия на свойства композиций. В некоторых вариантах реализации вспомогательное вещество представляет собой одно или более из гидрата лактозы, кукурузного крахмала, гидроксипропилцеллюлозы и/или стеарата магния. В некоторых вариантах реализации тамибаротен можно готовить с одним или более из гидрата лактозы, кукурузного крахмала, гидроксипропилцеллюлозы и/или стеарата магния.
[0164] Определение приемлемых составов тамибаротена можно осуществлять различными способами, известными в данной области, например, описанными в US 20100048708, которая включена в данный документ посредством ссылки.
Комбинированная терапия
[0165] Специалисты в данной области, читая настоящее описание, легко поймут, что описанный в данном документе агонист RARA (например, тамибаротен) можно, в некоторых вариантах реализации, комбинировать с другими видами противораковой терапии, включая, например, применение химиотерапевтических агентов, других иммуномодулирующих агентов, лучевой терапии, высокочастотной ультразвуковой терапии, хирургического вмешательства, одобренных FDA видов терапии для лечения рака и т.д.
[0166] В некоторых вариантах реализации агонист RARA применяют в комбинации с одним или более другими терапевтическими агентами или модальностями. В некоторых вариантах реализации один или более других терапевтических агентов или модальностей также представляют собой противораковые агенты или модальности; в некоторых вариантах реализации комбинация демонстрирует синергетическое действие при лечении рака.
[0167] Известные соединения или варианты лечения, которые демонстрируют терапевтическую эффективность при лечении рака, могут включать, например, один или более алкилирующих агентов, антиметаболиты, агенты, оказывающие воздействие на микротрубочки, ингибиторы топоизомеразы, цитотоксические антибиотики, ингибиторы ангиогенеза, иммуномодуляторы, вакцины, клеточные варианты терапии, трансплантацию органов, лучевую терапию, хирургическое вмешательство и т.д.
[0168] В некоторых вариантах реализации агонист RARA (и/или другой вид терапии, с которым его комбинируют) можно комбинировать с одним или более видами паллиативной (например, облегчающей боль, противотошнотной, противорвотной и т.д.) терапии, в частности, когда происходит облегчение одного или более симптомов, связанных с релевантным видом рака или с другим заболеванием, расстройством или патологическим состоянием, к которому восприимчив конкретный раковый пациент или от которого конкретный раковый пациент страдает.
[0169] В некоторых вариантах реализации применяемые в комбинации агенты вводят в соответствии со схемой дозирования, для которой они одобрены для индивидуального применения. Однако в некоторых вариантах реализации комбинация с агонистом RARA (например, тамибаротеном) позволяет введение другого агента в соответствии со схемой дозирования, которая включает применение одной или более меньших и/или менее частых доз, и/или меньшего числа циклов по сравнению с применением агента без агониста RARA (например, тамибаротена). В альтернативных или дополнительных вариантах реализации подходящая схема дозирования включает применение больших и/или более частых доз и/или большего числа циклов по сравнению с применением агента без агониста RARA (например, тамибаротена).
[0170] В некоторых вариантах реализации одну или более доз вводимых в комбинации агентов вводят в одно и то же время; в некоторых таких вариантах реализации агенты можно вводить в одной композиции. Однако чаще агенты вводят в разных композициях и/или в разное время. В некоторых вариантах реализации тамибаротен вводят последовательно и/или одновременно с другими терапевтическими агентами (например, химиотерапией).
[0171] В некоторых вариантах реализации описанные в данном документе варианты комбинированной терапии применяют только в случае, когда субъект имеет уровень мРНК RARA, равный пороговому значению или превышающий его. В некоторых вариантах реализации описанные в данном документе варианты комбинированной терапии применяют только в случае, когда субъект имеет уровень мРНК IRF8, равный пороговому значению или превышающий его. В некоторых вариантах реализации описанные в данном документе варианты комбинированной терапии применяют только в случае, когда субъект имеет уровень мРНК RARA, равный пороговому значению или превышающий его, и уровень мРНК IRF8, равный пороговому значению или превышающий его. В некоторых аспектах любого из этих вариантов реализации субъект страдает от не-ОПЛ ОМЛ.
[0172] В некоторых вариантах реализации терапевтический агент для комбинации с агонистом RARA (например, тамибаротеном) выбран из ингибитора ДНК-метилтрансферазы, ингибитора ДНК-синтазы, ингибитора топоизомеразы, ингибитора FLT3, ингибитора фолата, ингибитора BRD4, ингибитора Zn-пальцевого фактора транскрипции, ингибитора GCR, ингибитора CDK7, ингибитора HDAC, ингибитора JMJD3/JARID1B или ингибитора EZH2. В других конкретных аспектах второй агент выбран из ингибитора LSD1, ингибитора протеасом, ингибитора репарации повреждения ДНК, ингибитора PARP, ингибитора mTOR, ингибитора DOT1L, ингибитора тубулина, ингибитора PLK или ингибитора аврора-киназы.
[0173] В некоторых вариантах реализации агонист RARA (например, тамибаротен) можно вводить с децитабином, азацитидином, ара-С, даунорубицином, идарубицином, триоксидом мышьяка и/или ингибиторами flt3. В некоторых вариантах реализации агонист RARA (например, тамибаротен) можно вводить с ингибиторами IDH, ингибиторами BRD4 (например, JQ1), ингибиторами HDAC (например, SAHA и МС1568), ингибиторами НМТ (например, EPZ6438, UNC0638, SGC707, EPZ5676, UNC037 и PFI-2) и/или ингибиторами KDM (например, GSKJ4, RN-1 и GSK-LSD1).
[0174] В некоторых вариантах реализации субъект страдает от ОМЛ, а тамибаротен вводят в комбинации со вторым агентом, выбранным из азацитидина, триоксида мышьяка, мидостаурина (только в случае тех субъектов с ОМЛ, для которых характерны высокие уровни мРНК FLT3), цитарабина, даунорубицина, метотрексата, идарубицина, сорафениба (только в случае тех субъектов с ОМЛ, для которых характерны высокие уровни мРНК FLT3), децитабина, квизартиниба (только в случае тех субъектов с ОМЛ, для которых характерны высокие уровни мРНК FLT3), JQ1 (ингибитора BRD4), АТО, преднизона (только в случае тех субъектов с ОМЛ, для которых характерны высокие уровни мРНК GCR), SAHA и GSKJ4 (только в случае тех субъектов с ОМЛ, для которых характерны высокие уровни мРНК JMJD3/JARID1В).
Наборы
[0175] Набор, содержащий один или более реагентов для выявления одного или более биомаркеров IRF8, может быть предоставлен в наборе. В некоторых случаях набор содержит упакованные фармацевтические композиции согласно настоящему изобретению, содержащие вкладыш или этикетку с написанными инструкциями по применению агониста RARA (например, тамибаротена) субъектом, страдающим от рака и который по определению имеет суперэнхансер, связанный с геном IRF8, имеющий эффективность или порядковый ранг, равный пороговому уровню или превышающий его, или уровень мРНК IRF8, равный эталонному (например, пороговому уровню) или превышающий его. Как подробно описано выше, пороговый уровень определяют в популяции образцов от любых субъектов с диагнозом того же самого заболевания или линий клеток или ксенотрансплантатных моделей того же самого заболевания, что и то, для лечения которого предписана фармацевтическая композиция. Инструкции могут быть приклеены или каким-либо другим образом присоединены к емкости, содержащей агонист RARA. В альтернативном варианте инструкции и емкость, содержащая агонист RARA, будут отделены друг от друга, но находиться вместе в одном наборе, упаковке, коробке или другом типе контейнера.
[0176] Инструкции в наборе, как правило, санкционированы или рекомендованы государственным органом, утверждающим терапевтическое применение агониста RARA. Инструкции могут включать описание конкретных способов определения, связан ли суперэнхансер с геном IRF8, а также способов количественной оценки для определения, является ли энхансер, связанный с геном IRF8, суперэнхансером, способов количественной оценки для определения уровней мРНК IRF8; и/или пороговых уровней суперэнхансеров или мРНК IRF8, при которых лечение находящимся в упаковке агонистом RARA рекомендовано и/или считается терапевтически эффективным. В некоторых аспектах в инструкциях указано, что композицию следует вводить субъекту, уровни мРНК IRF8 которого попадают в пределы по меньшей мере 30-го процентиля популяции, для которой были измерены уровни мРНК IRF8. В некоторых аспектах этих вариантов реализации субъекта определяют как восприимчивого к агонисту RARA, если показатель распространенности уровня мРНК IRF8 у него составляет около 80%, 79%, 78%, 77%, 76%, 75%, 74%, 73%, 72%, 71%, 70%, 69%, 68%, 67%, 66%, 65%, 64%, 63%, 62%, 61%, 60%, 59%, 58%, 57%, 56%, 55%, 54%, 43%, 42%, 51%, 50%, 49%, 48%, 47%, 46%, 45%, 44%, 43%, 42%, 41%, 40%, 39%, 38%, 37%, 36%, 35%, 34%, 33%, 32%, 31%, 30%, 29%, 28%, 27%, 26%, 25%, 24%, 23%, 22%, 21% или 20% в популяции, для которой были измерены уровни мРНК IRF8. В некоторых аспектах в инструкциях указано, что композицию следует вводить субъекту, уровни мРНК IRF8 которого согласно измерению посредством конкретного метода анализа
[0177] Инструкции могут, необязательно, включать информацию о дозировании, типах рака, для которых было утверждено лечение агонистом RARA, физикохимическую информацию об агонисте RARA; фармакокинетическую информацию об агонисте RARA, информацию о взаимодействии между лекарствами. В некоторых вариантах реализации в инструкциях указано, что композицию следует вводить субъекту с диагнозом ОМЛ. В некоторых вариантах реализации в инструкциях указано, что композицию следует вводить субъекту с диагнозом не-ОПЛ ОМЛ. В некоторых вариантах реализации в инструкциях указано, что композицию следует вводить субъекту с диагнозом МДС. В некоторых аспектах фармацевтическая композиция содержит тамибаротен.
ПРИМЕРЫ
[0178] Чтобы понять описанное в данном документе изобретение в более полном объеме, приведены следующие примеры. Синтетические и биологические примеры, описанные в этой заявке, предложены для иллюстрации предложенных соединений, фармацевтических композиций и способов, и их не следует воспринимать как каким-либо образом ограничивающие их объем.
Пример 1: Уровни мРНК IRF8 в линиях клеток не-ОПЛ ОМЛ коррелируют с чувствительностью к агонисту RARA
[0179] Ранее мы исследовали несколько линий клеток ОМЛ в отношении чувствительности к тамибаротену и продемонстрировали, что чувствительность очень хорошо коррелировала с каждым показателем из эффективности суперэнхансера RARA, порядковым значением эффективности суперэнхансера RARA и уровнем мРНК RARA. Это было сделано так, как описано ниже.
[0180] В день эксперимента клетки гомогенизировали, используя Accumax (EMD Millipore), подсчитывали и доводили число до 60000 клеток/мл в подходящей среде для роста. Используя Biotek EL406, 50 мкл клеток распределяли по белым (ATPlite) или черным (CyQuant) 384-луночным планшетам (Thermo). Клетки возвращали в инкубатор с температурой 37°С для адгезии. Через три часа в планшеты добавляли соединения, используя 20 нл 384-луночную многоканальную пипетирующую головку на рабочей станции Janus. Исходный материал размещали в четырех репликах для изучения 10-точечной зависимости от дозы в исходном растворе ДМСО в 384-луночных планшетах для соединений. После добавления соединения планшеты инкубировали в течение пяти или десяти суток в инкубаторе с температурой 37°С.
[0181] Жизнеспособность клеток прочитывали, используя ATPlite (Perkin Elmer) или CyQuant (Life Technologies). В случае ATPlite планшеты доставали из инкубатора и доводили до комнатной температуры перед использованием. Лиофилизированный порошок реагента ATPlite ресуспендировали в лизисном буфере и разводили 1:2 дистиллированной водой. В каждую лунку добавляли по 25 мкл этого раствора, используя жидкостный манипулятор Biotek. Планшеты инкубировали в течение 15 мин при комнатной температуре перед считыванием сигнала люминесценции на планшет-ридере Envision (Perkin Elmer). В случае CyQuant реагенты смешивали согласно инструкциям производителя в ФСБ (Gibco). Реагент добавляли, используя многоканальную пипетку, а планшеты снова помещали в инкубатор на 30 минут перед считыванием на планшет-ридере Envision (Perkin Elmer).
[0182] Полученные описанным образом данные хранили и группировали в Microsoft Excel и анализировали, используя программное обеспечение GraphPad Prism. Аппроксимацию кривых для расчета ЕС50 и Emax проводили в GraphPad Prism, версия 6.0, используя четырехпараметрическую (угловой коэффициент Хилла не принимался за 1) нелинейную регрессию с преобразованными в log 10 данными по концентрации соединений на графике зависимости от выраженной в процентах жизнеспособности клеток при нормализации относительно лунок, обработанных только ДМСО, включенных в планшет. Крайние лунки были исключены.
[0183] Мы использовали матрицу Affymetrix GeneChip® PrimeView™ Human Gene Expression Array для исследования сначала семи из этих линий клеток ОМЛ (четырех чувствительных к тамибаротену - NOMO-1, OCI-AML3, MV-4-11 и Sig-M5; и трех нечувствительных - KG1a, OCI-M1 и Kasumi-1) в отношении наличия других мРНК, уровни которых могут быть специфическим образом повышены в чувствительных к тамибаротену линиях клеток, и идентифицировали мРНК IRF8 как потенциального кандидата. Ранее мы провели количественную оценку уровней мРНК IRF8 в каждой из этих семи линий клеток ОМЛ, а также в нескольких других линиях клеток ОМЛ, исследуемых в отношении чувствительности к тамибаротену, проведя анализ методом РНК-секвенирования, как описано ниже. Результаты для первых семи линий клеток приведены на фиг. 1. Что интересно, NOMO-1 не имели высокий уровень мРНК RARA, но были чувствительны к тамибаротену. Тот факт, что NOMO-1 имели повышенные уровни мРНК IRF8, помог прояснить это кажущееся несоответствие и дополнительно подтвердить возможность использования уровней мРНК IRF8 для прогнозирования чувствительности к тамибаротену.
[0184] Приготовление РНК: Клеточную суспензию переносили в пробирки для микроцентрифуги и промывали 1 мл ФСБ. Клеточный осадок ресуспендировали в 200 мкл TRIzol. Добавляли 20 мкл добавки гомогената миРНК из набора для выделения миРНК Ambion miKVana (AM 1561), смешивали и инкубировали на льду в течение 10 минут. Добавляли 20 мкл бромхлорпропана, смешивали, инкубировали при комнатной температуре в течение 5 минут и центрифугировали при 12000 × g в течение 10 минут при 4°С. 62 мкл водной фазы добавляли в 78 мкл этанола и переносили в фильтровальную колонку. Выделение проводили в соответствии с протоколом для выделения общей РНК от Ambion. Образец исследовали для контроля качества на биоанализаторе, а затем отправляли в Whitehead Sequencing Core (Cambridge, MA) для секвенирования.
[0185] Обработка данных РНК-секвенирования: Результаты считывания выравнивали относительно транскриптомы HG19, используя программное обеспечение rsem vl.2.21 software (rsem-calculate-expression; parameters = -p 4 --samtools-sort-mem 3G --ci-memory 3072 --bowtie-chunkmbs 1024--quiet --output-genome-barn --bowtie2 --bowtie2 - path/data/devtools/bowtie2-2.0.5 --strand-specific), а затем проводили количественную оценку мРНК, используя тот же пакет rsem (rsem-parse-alignments, rsem-build-read-index, rsem-run-em) и представляли в количестве транскриптов на миллион (ТНМ). Затем проводили экстракцию всех кодирующих белки генов для каждого образца и проводили квантильную нормализацию их показателей.
[0186] Затем мы проводили сравнение чувствительности к тамибаротену с уровнями мРНК IRF8, как показано на фиг. 2 и в таблице 1.
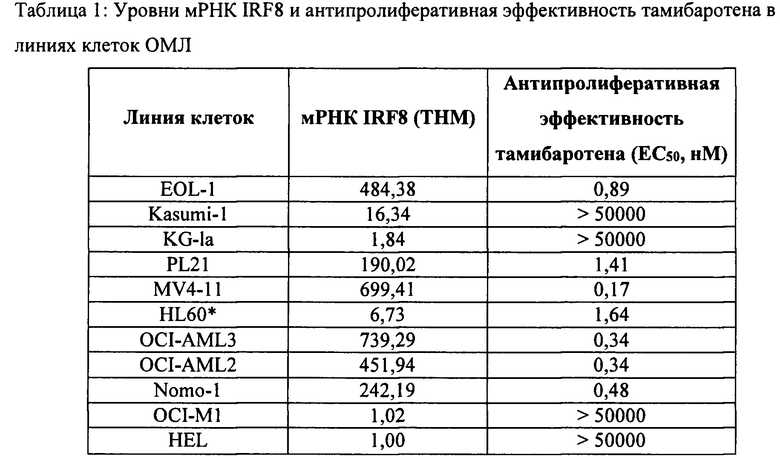
*HL60 представляет собой линию клеток APL.
[0187] Как видно из приведенной выше таблицы, все восприимчивые к тамибаротену линии клеток, за исключением HL60, имели уровень мРНК IRF8 более 190 ТНМ (log2 (7,57)) в этом анализе, тогда как все невосприимчивые линии клеток имели уровень мРНК IRF8 менее 16,5 ТНМ (log2 (4,03)). Восприимчивость HL60 к тамибаротену без сопутствующего высокого уровня мРНК IRF8 (6,73 ТНМ) позволяет предположить, что корреляция между уровнем мРНК IRF8 и чувствительностью к тамибаротену может не сохраняться в случае ОПЛ и, следовательно, может лучше подходить для стратификации субъектов, страдающих от не-ОПЛ ОМЛ. На фигуре 2 удалены данные для HL60.
[0188] Уровни мРНК IRF8 были определены для большого числа разных типов образцов - нормальных кровяных клеток, линий клеток ОМЛ, образцов пациентов с первичным ОМЛ и ППК ОМЛ. Полученные данные отображали на графике в ранговом порядке, а результаты графически представлены на фигуре 14. Как видно, на фигуре 14 не показано какой-либо корреляции между уровнями мРНК IRF8 и наличием заболевания; и оказалось, что уровни IRF8 распределены достаточно одинаковым образом в нормальных клетках по сравнению с пораженными заболеванием клетками, линиями клеток и ППК.
Пример 2: Определение пороговых значений для мРНК IRF8 для лечения агонистом RARA
[0189] Результаты для линий клеток ОМЛ позволяют предположить, что предельное значение составляет от 15,5 до 190 ТНМ (т.е. от log2 (4,03) до log2 (7,57) в анализе методом РНК-секвенирования. Мы выбрали популяцию образцов пациентов с ОМЛ (любезно предоставленных Стэнфордским университетом), чтобы исследовать распределение уровней мРНК IRF и определить предельные показатели распространенности на основании предельных значений. Мы добавили в эту популяцию линии клеток ОМЛ и построили упорядоченный по рангу график. На фиг. 3 приведено упорядоченное по рангу распределение уровней мРНК IRF8 в комбинированной популяции из образцов пациентов/линий клеток ОМЛ. Мы определили, что предельный показатель распространенности 25% соответствовал значению мРНК IRF приблизительно log2 (7).
Пример 3: Корреляция уровней мРНК IRF8 и уровней мРНК RARA
[0190] Далее мы сравнивали уровни мРНК IRF8 и RARA в линиях клеток ОМЛ и популяции пациентов, чтобы определить наличие корреляции. На фиг. 4 показано, что некоторые линии клеток, которые были восприимчивы к тамибаротену, имеют относительно низкий уровень мРНК RARA, но высокий уровень мРНК IRF8. На фиг. 5 показано, что подгруппа пациентов также демонстрирует высокие уровни мРНК IRF8, но относительно низкие уровни мРНК RARA и наоборот. Это подтверждает идею, что измерение как мРНК IRF8, так и RARA у пациента и выбор этого пациента для лечения агонистом RARA, таким как тамибаротен, если уровень мРНК превышает пороговое значение, может оптимизировать подлежащую лечению популяцию пациентов.
Пример 4: Суперэнхансер, связанный с IRF8. коррелирует с восприимчивостью к лечению агонистом RARA
[0191] Далее мы изучали эффективность энхансера IRF8 в нескольких линиях клеток и образцах пациентов следующим образом.
[0192] Фиксация клеток: в случае клеток в суспензии, как правило, 1/10 объема свежего 11% раствора формальдегида добавляли в клеточную суспензию, смешивали и оставляли смесь отстаиваться при комнатной температуре (КТ) в течение 8 мин. Затем добавляли 1/20 объема 2,5 М глицина или 1/2 объема 1 М Трис, рН 7,5, чтобы погасить формальдегид, и инкубировали в течение по меньшей мере 1 мин. Клетки 3 раза промывали 20-50 мл холодного 1х фосфатно-солевого буфера (ФСБ), центрифугировали в течение 5 мин при 1250 × g для осаждения клеток до и после каждой промывки. Затем клетки переносили в 15 мл конические пробирки и центрифугировали при 1250 × g в течение 5 мин при 4°С. Удаляли супернатант, остаточную жидкость удаляли путем промокания салфетками Kimwipe, а затем осажденные клетки быстро замораживали в жидком азоте и хранили при -80°С.
[0193] Приготовление гранул: использовали приблизительно 60 мкл гранул протеина G Dynabeads® на 2 мл иммунопреципитата (Invitrogen). Гранулы 3 раза промывали, по 5 минут каждый раз, 1,0 мл блокирующего буфера (0,5% БСА масс./об. в ФСБ) в 1,5 мл пробирке Эппендорфа. Магнит (Invitrogen) использовали для сбора гранул (и оставляли для связывания с магнитом в течение по меньшей мере 1 полной минуты) после каждой промывки, а затем отсасывали супернатант. Промытые гранулы ресуспендировали в 250 мкл блокирующего буфера, в который добавляли 6 мкг антитела и оставляли смесь для инкубации со смешиванием с переворачиванием в течение ночи (минимум 6 часов). Связанные с антителом гранулы 3 раза промывали, по 5 минут каждый раз, 1 мл блокирующего буфера и ресуспендировали в блокирующем буфере (60 мкл на IP). Эти последние промывки и ресуспендирование проводили после обработки клеток ультразвуком (см. 9.1.1.3) и непосредственно перед иммунопреципитацией в течение ночи.
[0194] Лизис клеток: ингибиторы протеаз при 1х (полные, Roche; приготовленные путем растворения одной таблетки в 1 мл Н2О для 50х раствора и хранимые в аликвотах при -20°С) добавляли во все лизисные буферы перед применением. Каждую пробирку с клетками (приблизительно 5×107 клеток) ресуспендировали в 5-10 мл лизисного буфера 1 (ЛБ1; 140 мМ NaCl, 1 мМ ЭДТК, 10% глицерина, 0,5% NP-40, 0,25% Тритон Х-100) и покачивали при 4°С в течение 10 минут. Клетки центрифугировали при 1250 × g × 5 мин на настольной центрифуге при 4°С и отсасывали супернатант. Клетки ресуспендировали в 5 мл лизисного буфера 2 (ЛБ2; 200 мМ NaCl, 1 мМ ЭДТК, 0,5 мМ ЭГТК, 10 мМ Трис, рН 8) и инкубировали с переворачиванием при 4°С в течение 10 минут. Клетки снова осаждали при 1250 × g в течение 5 мин на настольной центрифуге при 4°С и промывали в 2-5 мл буфера для обработки ультразвуком Covaris (10 мМ Трис, рН 8,0, 1 мМ ЭДТК, 0,1% ДСН). Осадок центрифугировали при 1250 × g в течение 5 мин на настольной центрифуге при 4°С. Клетки осаждали при 1250 × g в течение 5 мин на настольной центрифуге при 4°С и ресуспендировали в концентрации 20-50 миллионов клеток/1 мл буфера для обработки ультразвуком Covaris.
[0195] Иммунопреципитация хроматина: пятьдесят мкл конъюгированных с антителом гранул, приготовленных, как описано выше, добавляли в раствор очищенного клеточного экстракта (как описано выше в параграфе Лизис клеток) в 1,5 мл пробирки и покачивали в течение ночи при 4°С (минимум 8 часов) для иммунопреципитации комплексов ДНК-белок.
[0196] Промывка, элюирование и изменение поперечных сшивок: все буферы, применяемые на этих этапах, были ледяными. Для преципитации магнитных гранул использовали магнитную стойку, промывали 3 раза, по 5 минут каждый раз, с перемешиванием с аккуратным переворачиванием, 1 мл промывочного буфера 1 (50 мМ ГЭПЭС рН 7,5; 140 мМ NaCl; 1 мМ ЭДТК; 1 мМ ЭГТК; 0,75% Тритон-Х; 0,1% ДСН; 0,05% ДОХ); промывали один раз в течение 5 минут 1 мл промывочного буфера 2 (50 мМ ГЭПЭС рН 7,5; 500 мМ NaCl; 1 мМ ЭДТК; 1 мМ ЭГТК; 0,75% Тритон-Х; 0,1% ДСН; 0,05% ДОХ); и один раз в течение 5 минут 1 мл промывочного буфера 3(10 мМ Трис, рН 8,0; 1 мМ ЭДТК; 50 мМ NaCl). Отсасывали остаточный промывочный буфер и аккуратно центрифугировали гранулы при 1250 × g в течение 1 мин; пробирки снова помещали на магнит и удаляли все следы буфера. Добавляли элюирующий буфер в объеме 210 мкл (50 мМ Трис, рН 8; 10 мМ ЭДТК; 1% ДСН) и элюировали при 65°С в течение 60 минут с кратковременным вортексным перемешиванием для ресуспендирования гранул каждые 15 мин. Гранулы отделяли от супернатанта с помощью магнита, а 200 мкл супернатанта удаляли и помещали в чистую пробирку для изменения поперечной сшивки. Проводили x-сшивку обоих IP и фракций экстракта цельных клеток в течение ночи при 65°С (минимум 8 часов, но максимум 18 часов). Затем использовали нагревание для раздельного изменения поперечной сшивки для образца для иммунопреципитации и фракций экстракта цельных клеток путем инкубации в течение ночи при 65°С (минимум 8 часов, но максимум 18 часов). Нагревание облегчает гидролиз формальдегидных поперечных сшивок.
[0197] Промывка и очистка ДНК: в каждый образец добавляли буфер Трис-ЭДТК (50 мМ Трис, рН 8; 1 мМ ЭДТК) и 2,7 мкл 30 мг/мл РНКазы А (до конечной концентрации 0,2 мг/мл) в объеме 200 мкл, смешивали и инкубировали при 37°С в течение 2 часов. Затем в каждый образец добавляли 5 мкл раствора хлорида кальция (300 мМ CaCl2 в 10 мМ Трис, рН 8,0) вместе с 4 мкл 20 мг/мл протеиназы К (до конечной концентрации 0,2 мг/мл), смешивали и инкубировали при 55°С в течение 60 минут. Затем в каждую пробирку добавляли 400 мкл фенол : хлороформ : изоамиловый спирт в соотношении 25:24:1 (Sigma Aldrich #Р3803), смешивали на вортексе при нижних значениях настроек (5/10) и переворачивали каждую пробирку для дополнительного смешивания.
[0198] Пробирку PhaseLock Gel™ (Qiagen, 3 Prime) готовили для каждого образца путем центрифугирования пробирки при комнатной температуре в течение 30 секунд при 10000 об/мин. Далее в пробирку PhaseLock Gel™ добавляли образец ДНК в феноле : хлороформе : изоамиловом спирте и центрифугировали при 12000-16000 × g в течение 2 минут при комнатной температуре. Затем водный раствор переносили в новую 1,6 мл пробирку (верхнюю фракцию), добавляли 20 мкл 5 М NaCl и 1,5 мкл 20 мкг/мкл гликогена (всего 30 мкг), затем добавляли 1 мл EtOH и смешивали, используя вортекс или переворачивание. Затем образец инкубировали при -20°С в течение ночи (6-16 часов). Смесь центрифугировали при 20000 × g в течение 20 минут при 4°С для осаждения ДНК, супернатант удаляли с помощью 1 мл наконечника для пипетки, промывали осадок в 800 мкл 80% EtOH, центрифугировали при 20000 × g в течение 20 минут при 4°С и удаляли супернатант с помощью 1 мл наконечника для пипетки. Образец снова центрифугировали в течение 1 мин при 20000 × g, удаляли супернатант и оставляли осадок сушиться на воздухе на 5-20 минут. Вокруг осадка не должно быть ореола из воды и он должен быть высушен до глянцевого или слоистого вида. Затем осадок растворяли в 60 мкл воды, используя 50 мкл для секвенирования.
[0199] Обработка данных ChIP-секвенирования: проводили выравнивание результатов считывания для ChIP-секвенирования IP и IN относительно генома HG19, используя программное обеспечение Bowtie2 v.2.0.5 (parameters = -р 4 -sensitive). В результате были созданы полногеномные файлы ВАМ с обобщенным выравниванием для экспериментов по секвенированию IP и IN.
[0200] Создание универсального набора данных по показателям энхансера IRF8: создавали универсальный набор данных по показателям энхансера IRF8, который можно применять во всех последующих анализах. Пики, наблюдаемые по всему геному в данных по выровненным результатам прочитывания H3K27Ac с помощью MACS v1.4 с применением выровненных IP ВАМ, были определены как динамически изменяющиеся данные ChIP-секвенирования, а выровненные IN ВАМ - как контрольные фоновые данные. Использовали строго определенное предельное p-значение 10-9, но в остальном использовали параметры по умолчанию. Затем эти пики объединяли, если они содержали ≥12500 пар оснований между ними в эталонном человеческом геноме. Этот набор пиков называется пиками ROSE, а ранг для пика ROSE с наибольшим показателем, перекрывающего транскрипт IRF8 для данного образца, записывали в виде «ранг ГОР8 ROSE» для этого образца.
[0201] Затем набор пиков ROSE фильтровали в отношении «областей черного списка», определяемых ENCODE (https://sites.google.com/site/anshulkundaje/projects/blacklists) и ENCODE Project Consortium (2012), для удаления артефактов СЫР-секвенирования.
[0202] Затем отфильтрованные пики ROSE из первичных образцов пациентов объединяли в универсальную карту обогащения H3K27Ac, объединяя координаты каждого пика из данного образца со всеми пиками, которые перекрывают его, из других образцов. Это позволило создать универсальную карту обогащения H3K27Ac. Затем проводили количественную оценку каждой обогащенной области в пределах этой универсальной карты в каждом образце (включая линии клеток) путем суммирования для данной области числа прочтений IP, картированных в пределах области, и деления на число прочтений, картированных во всем эксперименте, умноженное на миллион («прочтений на миллион» или RPM (от англ. «reads per million»)). Рассчитывали аналогичный показатель RPM для прочтений IN. IN RPM вычитали из IP RPM, чтобы получить общий показатель для данной области в пределах универсальной карты для данного образца. Показатели для данного образца аппроксимировали с помощью отрицательного биномиального распределения, используя функцию fitdistr в библиотеке R MASS, V7.3.45. Хвост распределения был расположен в точке, в которой интегральная функция распределения этого отрицательного биномиального распределения пересекала 0,99 (что эквивалентно p-значению 0,01). Общие показатели для всех областей образца до этой точки были поделены так, что любая область обогащения с показателем, соответствующим нижним 99% аппроксимированного отрицательного биномиального распределения, имела показатель меньше 1 (считалась «типичным энхансером»), а любая область с показателем выше отметки 99% имела показатель больше 1 (считалась «типичным суперэнхансером»). Эти показатели называются показателями «RECOMB» для каждого образца на универсальной карте. Затем показатели RECOMB для каждого образца нормализовали относительно всех других образцов, используя квантильную нормализацию с наименьшим значением установленным на 0.
[0203] Визуализация данных ChIP-секвенирования: Полногеномную локализацию H3K27Ac визуализировали с помощью Integrative Genomics Viewer (IGV), версия 2.3.60, после преобразования файлов ВАМ в t-файлы формата IGV с применением MACS2 для создания наложения (extsize 200) и программного обеспечения igvtools, v2.3.9, для команды TDF. Ось Y каждого трека начинается непосредственно над уровнем шумов (0,25) и заканчивается на уровне, приблизительно равном половине уровня, необходимого, чтобы видеть всю высоту пика в контрольной области, отцентрованной в гене MALAT1.

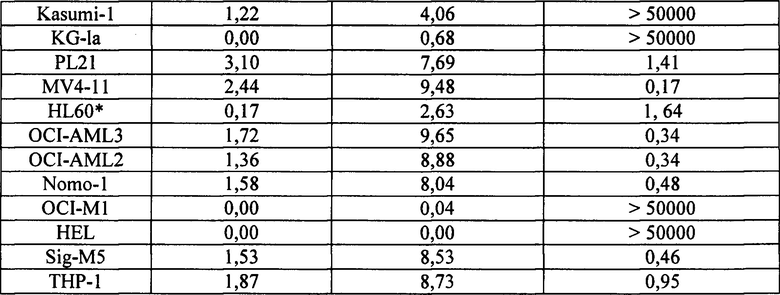
*HL60 представляет собой линию клеток APL.
[0204] Приведенные выше данные демонстрируют, что показатель RECOMB энхансера IRF8 RECOMB ≥1,0 (показатель RECOMB ≥1,0 определяет суперэнхансер) коррелирует с восприимчивостью к тамибаротену. За исключением линии клеток ОМЛ HL60, это предельное значение дало 1 ложноположительный (Kasumi-1) и один ложноотрицательный (EOL-1) результат из двенадцати исследованных линий клеток не-ОПЛ ОМЛ. Повышение предельного значения показателя RECOMB до ≥1,25 убрало бы ложноположительный результат, тогда как снижение предельного значения показателя RECOMB до ≥0,75 убрало бы ложноотрицательный результат. Эти данные также представлены в форме графика на фигуре 6. Также наблюдали аналогичную корреляцию между уровнем мРНК IRF8 и восприимчивостью к тамибаротену, при этом линии клеток имели значение THM(log2) для мРНК IRF8 больше 4,25 и все демонстрировали чувствительность к тамибаротену.
[0205] Затем мы применили профилирование энхансеров методом ChIP-секвенирования к подгруппе образцов пациентов с ОМЛ. Эффективность энхансера локуса IRF8 сильно варьировалась среди 66 образцов пациентов с ОМЛ, при этом 21% (14/66) пациентов имели СЭ, на что указывал показатель RECOMB больше 1,0 (фигура 7). Большинство образцов пациентов демонстрировали минимальную эффективность энхансеров, включая 14% (9/66) пациентов с наименьшим значением, которые не имели подлежащие количественной оценке энхансеры IRF8.
Пример 5: Корреляция мРНК IRF8 и эффективности энхансера IRF8
[0206] Количественная оценка энхансера IRF8 и корреляция данных ChIP-секвенирования и РНК-секвенирования: Квантильно-нормализованный показатель RECOMB использовали для всех пациентов для области, называемой энхансером на универсальной карте, которая перекрывала IRF8: хр16:85862582-85990086. Это коррелировало с оценкой квантильно-нормализованной экспрессии ТНМ для модели полного гена IRF8 по RSEM с применением корреляции Спирмена. Оценивали только пациентов с результатами как РНК-секвенирования, так и ChIP-секвенирования. Такой же анализ проводили в линиях клеток, но исключали линии клеток ОПЛ.
[0207] Для получения опосредованной оценки СЭ IRF8 по измерению мРНК IRF8 исследовали корреляцию между этими двумя параметрами в одной группе пациентов с ОМЛ. Уровни мРНК IRF8, измеренные с помощью РНК-секвенирования, сравнивали с измерениями для энхансера локуса IRF8 по показателю RECOMB для H3K27ac (фигура 8). Уровни мРНК IRF8 также сильно варьировались среди образцов в этой группе и уровни мРНК IRF8 сильно коррелировали с эффективностью энхансера IRF8 (коэффициент Спирмена для оценки корреляции ~0,81, p-значение 2,2×10-12).
[0208] Также мы профилировали значение эффективности энхансера IRF8 и уровней мРНК IRF8 в 26 линиях клеток ОМЛ. Некоторые из этих линий клеток исследовали ранее в отношении антипролиферативной чувствительности к тамибаротену (см. таблицу 2). Как наблюдалось и в образцах пациентов с ОМЛ, линии клеток ОМЛ демонстрировали широкое распределение эффективности энхансера IRF8 (фигура 9). Эффективность энхансера IRF8 и уровни мРНК IRF8 также сильно варьировались в 26 линиях клеток ОМЛ, 9 (34%) из которых имели значения RECOMB для IRF8 ≥1,0.
[0209] Как и в случае образцов пациентов с ОМЛ, линии клеток ОМЛ демонстрировали сильную корреляцию уровней мРНК IRF8 с эффективностью энхансера IRF8 (фигура 10; коэффициент Спирмена для оценки корреляции ~0,82, p-значение 2×10-6), подтверждая, таким образом, возможность применения мРНК IRF8 в виде опосредованного измерения эффективности энхансера IRF8.
Пример 6: Восприимчивость моделей ППК к тамибаротену и корреляция с уровнями мРНК IRF8
[0210] Полученные из разных образцов пациентов с ОМЛ (АМ8096, АМ5512, АМ7577 и АМ7440) ксенотрансплантатные модели с использованием бестимусных мышей BALB/c с иммунной недостаточностью готовили Crown Biosciences (Beijing, China), в целом, следующим образом.
[0211] Приблизительно 2×106 клеток из каждого образца пациента суспендировали в 100 мкл ФСБ и инъецировали отдельным мышам (n=3 для каждого из разных образцов пациентов и для контроля) путем в/в инъекции в хвост. Для ксенотрансплантатов АМ5512, АМ7577 и АМ7440 опухолевую нагрузку считали достаточно высокой, чтобы начать обработку, когда концентрация человеческих клеток CD45+ достигает ~1-5% в периферической крови животного. Человеческие клетки CD45+ выявляют в крови мышей (полученной посредством забора крови из глаза), используя сортер флуоресцентно-активированных клеток и ФИТЦ против человеческих CD45 (Biolegend, Кат. # 304037). Для ксенотрансплантатов АМ8096 обработку начинали через 40 дней после инъекции клеток.
[0212] Тамибаротен вводят перорально в доведенном до рН 8 ФСБ, 1% ДМСО согласно ежедневному графику с конечной дозой 6 мг на кг массы тела в объеме 10 мл/кг. Мышей в группе обработки базовым раствором обрабатывают согласно тому же графику, тем же объемом и составом, но в отсутствие тамибаротена. Уровни человеческих клеток CD45+ в периферической крови обработанных животных и контрольных животных измеряют один раз в неделю.
[0213] Ксенотрансплантаты АМ5512 и АМ8096 демонстрируют существенное снижение общего % клеток CD45+, а также % клеток CD45+ в крови, костном мозге и селезенке при обработке тамибаротеном по сравнению с контрольным базовым раствором через 35 дней обработки (фигура 11). С другой стороны, АМ7577 и АМ7440 не демонстрируют существенного снижения объема опухолей среди обработанных тамибаротеном и обработанных базовым раствором животных как в целом, так и в крови, костном мозге или селезенке (фиг.12).
[0214] Затем мы измеряли уровни мРНК как IRF8, так и RARA в каждом их четырех образцов пациентов, использовавшихся в исследовании ксенотрансплантатов (фиг. 13). Два невосприимчивых в исследовании ксенотрансплантатов образца, АМ7577 и АМ7440, имеют уровни мРНК IRF8, которые попадают значительно ниже 100 ТНМ в анализе. Один из восприимчивых образцов, АМ8096, имеет уровни мРНК IRF8, которые превышают 350 ТНМ. Другой восприимчивый образец, АМ5512, имеет очень низкий уровень мРНК IRF8. Что интересно, эти четыре образца продемонстрировали аналогичный профиль уровня мРНК RARA, причем АМ7577 и АМ7440 имели уровни мРНК RARA ниже любого определенного предельного показателя распространенности {например, 36% предельного показателя распространенности); АМ8096 был существенно выше предельного показателя распространенности, а АМ5512 также был ниже предельного показателя распространенности, но имел существенно больший уровень мРНК RARA, чем любой из невосприимчивых образцов АМ7577 или АМ7440.
Пример 7: Получение и приготовление образцов пациентов для определения уровней мРНК IRF8 и ChIP-секвенирования
[0215] Брали кровь (8 мл) у пациентов с не-ОПЛ ОМЛ и собирали в 8 мл пробирку BD Vacutainer СРТ с цитратом натрия. После сбора крови пробирку аккуратно переворачивали вручную 8-10 раз, чтобы гарантировать нормальное смешивание антикоагулянта. Пробирку хранили в вертикальном положении при комнатной температуре перед центрифугированием, которое проводили в течение двух часов от времени сбора. Затем образец крови центрифугировали при комнатной температуре (18-25°С) в течение 20 минут при 1500-1800 ОЦС (относительная центробежная сила). После центрифугирования кровь разделяли на слои. Нижние слои под гелевой пробкой представляли собой красный слой на самом дне (красные кровяные тельца) и тонкий серый слой над ним (гранулоциты и плотный раствор). Непосредственно выше гелевой пробки находился прозрачный слой плотного раствора, затем белый слой (мононуклеарные клетки и тромбоциты) и желтоватый слой (плазма) сверху. Белый слой (до 1 мл по объему), содержащий МКПК, удаляли сразу после центрифугирования с помощью пипетки Пастера. В случае необходимости МКПК можно хранить в криопробирке, содержащей 20% об./об. замораживающей среды BloodStor® (BioLife Solutions), которую добавляют по капле с последующим аккуратным переворачиванием вручную для смешивания.
[0216] Затем фракцию МКПК, полученную на предыдущем этапе (размороженную в случае предварительной заморозки), одновременно обрабатывали микрогранулами человеческого CD117 (Miltenyi Biotec) и микрогранулами человеческого CD34 (Miltenyi Biotec), следуя указаниям производителя в отношении магнитного мечения и магнитного разделения меченых клеток. Затем из выделенных клеток CD34+/CD117+ экстрагировали матричную РНК и проводили количественную оценку методом кПЦР, как описано выше.
Пример 8: Синергетический эффект между тамибаротеном и другими агентами коррелирует с уровнями мРНК RARA.
[0217] Используя Biotek EL406, 50 мкл клеточной среды, содержащей 20-60000 клеток/мл, распределяли по 384-луночным планшетам Nunc (Thermo). Затем в клетки в суспензии незамедлительно добавляли соединение, тогда как линиям адгезивных клеток давали один час для повторного присоединения к поверхности планшета перед добавлением соединения. Предназначенные для исследования тамибаротен и вторые агенты растворяли в ДМСО и распределяли по 384-луночным планшетам, содержащим соединение (Greiner). В каждый планшет с соединением добавляли тамибаротен и один второй агент, каждый в 5 разных дозах, отцентрированных приблизительно по ЕС50 данного соединения для данной линии клеток, получая в целом 25 разных комбинаций доз двух агентов.
[0218] Матрицы соединений распределяли по аналитическим планшетам, используя 20 нл 384-луночную многоканальную пипетирующую головку на рабочей станции Janus MDT (Perkin Elmer). Каждый планшет содержал по 8 реплик всех 5 на 5 концентраций соединений в дополнение к пяти дозам каждого соединения в отдельности в четырех репликах. После добавления соединений планшеты инкубировали в течение 5 суток в инкубаторе с температурой 37°С. Жизнеспособность клеток оценивали, используя ATPlite (Perkin Elmer), следуя протоколам производителя. Данные анализировали, используя коммерчески доступное программное обеспечение CalcuSyn, и визуализировали, используя программное обеспечение GraphPad Prism. Получали изоболограммы, строя графики для каждой из 25 комбинаций доз тамибаротена и вторых агентов, и анализировали в отношении синергетического эффекта. На изоболограммах прямая линия, соединяющая значения 1,0 по абсциссе и ординате, представляет ингибирование роста, добавочное для комбинации двух соединений. Графики, которые находятся ниже прямой линии, представляют синергетическое ингибирование роста, при этом графики, которые находятся ниже этой линии и линии, соединяющей значения 0,75 по абсциссе и ординате, представляют слабый синергетический эффект. Графики, которые находятся между линией, соединяющей значения 0,75 по абсциссе и ординате, и линией, соединяющей значения 0,25 по абсциссе и ординате, представляют умеренный синергетический эффект. Графики, которые находятся ниже линии, соединяющей значения 0,25 по абсциссе и ординате, представляют сильный синергетический эффект. Данные за пределами максимума на каждой изоболограмме указаны некоторым числом звездочек в верхнем правом углу изоболограммы и представляют данные с отсутствием синергетического эффекта.
[0219] Мы исследовали азацитидин, триоксид мышьяка, мидостаурин, цитарабин, даунорубицин, метотрексат, идарубицин, сорафениб, децитабин, квизартиниб, АВТ199 (ингибитор BCL2), JQ1 (ингибитор BRD4), АТО, преднизон, SAHA, GSKJ4 (ингибитор JMID3/JARID1B) и EPZ6438 (ингибитор EZH2) в качестве вторых агентов в этом анализе против различных линий клеток ОМЛ. На фигурах 15-21 изображены изоболограммы различных вторых агентов в комбинации с тамибаротеном в разных линиях клеток.
[0220] Для комбинаций азацитидина и тамибаротена наблюдали от умеренного до сильного синергетического эффекта для Sig-M5; умеренный синергетический эффект наблюдали для KG-1а и NOMO-1; и от слабого до умеренного синергетического эффекта наблюдали для MV-4-11 (см. фигуру 15). Для Kasumi-1 или OCI-M1 синергетический эффект не наблюдали (данные не показаны).
[0221] Для комбинаций триоксида мышьяка и тамибаротена наблюдали сильный синергетический эффект для Sig-M5 и MV411; и умеренный синергетический эффект наблюдали для NOMO-1 (см. фигуру 16). Для Kasumi-1 синергетический эффект не наблюдали или наблюдали слабый, и не наблюдали синергетический эффект для OCI-M1 (данные не показаны).
[0222] Для комбинаций цитарабина (ара-С) и тамибаротена наблюдали некоторый умеренный синергетический эффект для KG-1а и OCI-M1, но не наблюдали синергетический эффект для HL-60 (смотрите фигуру 17). Для MV-411 большое количество данных за пределами максимума (7 из 25) и большое количество, продемонстрировавшее сильный синергетический эффект, затрудняют интерпретацию.
[0223] Для комбинаций даунорубицина и тамибаротена наблюдали сильный синергетический эффект для Kasumi-1 и NOMO-1; и умеренный синергетический эффект наблюдали для Sig-M5 и MV-4-11 (см. фигуру 18). Для OCI-M1 синергетический эффект не наблюдали (данные не показаны).
[0224] Для комбинаций метотрексата и тамибаротена умеренный синергетический эффект наблюдали для NOMO-1, Sig-M5 и MV-4-11 (см. фигуру 19). Для Kasumi-1 синергетический эффект не наблюдали или наблюдали слабый, и не наблюдали синергетический эффект для OCI-M1 (данные не показаны).
[0225] Для комбинаций идарубицина и тамибаротена наблюдали умеренный синергетический эффект для NOMO-1, Sig-M5 и MV411 (см. фигуру 20). Для Kasumi-1 или OCI-M1 синергетический эффект не наблюдали (данные не показаны).
[0226] Неубедительные результаты наблюдали для комбинации сорафениба и тамибаротена в MV411, NOMO-1, KG-1а и Sig-M5 из-за большого количества данных за пределами максимума (смотрите фигуру 21), но синергетический эффект не наблюдали для этой комбинации в OCI-M1 (данные не показаны). Сорафениб является ингибитором FLT3, и мы также наблюдали синергетический эффект для комбинаций тамибаротена и других ингибиторов FLT3, таких как мидостаурин и квизартиниб, в некоторых из линий клеток. Не ограничиваясь теорией, мы полагаем, что для синергетического эффекта с ингибиторами FLT3 необходимы высокие уровни мРНК RARA и/или IRF8, а также высокие уровни мРНК FLT3. Этот «зависимый от условий» синергетический эффект также наблюдали с ингибитором GCR преднизоном, для которого, похоже, необходимы высокие уровни мРНК GCR, а также высокие уровни мРНК RARA и/или IRF8. Аналогичный эффект также наблюдали с ингибитором JMJD3/JARID1B GSKJ4, для которого, похоже, необходимы высокие уровни мРНК JMJD3/JARID1B, а также высокие уровни мРНК RARA и/или IRF8 для проявления синергетического эффекта.
[0227] Мы не наблюдали синергетический эффект в любой из линий клеток, исследованных для комбинации ингибитора BCL2 АВТ199 и тамибаротена. Также мы не наблюдали синергетический эффект с комбинацией ингибитора EZH2 EPZ6438 и тамибаротена.
[0228] Однако мы наблюдали синергетический эффект для комбинации ингибитора HDAC SAHA и тамибаротена в линиях клеток ОМЛ с высоким уровнем мРНК RARA и/или IRF8.
[0229] Кроме того, сильный синергетический эффект наблюдали для комбинации децитабина и тамибаротена в клетках HL-60 и KG-1a (данные не показаны).
[0230] Также мы наблюдали синергетический эффект для комбинации ингибитора Zn-пальцевого фактора транскрипции АТО и тамибаротена.
[0231] Не ограничиваясь какой-либо конкретной теорией, можно предположить, что не-ОПЛ ОМЛ, характеризуемый высокими уровнями RARA, высокими уровнями IRF8 или их комбинацией, вероятно будет синергетически восприимчив к комбинациям тамибаротена и одного или более из азацитидина, триоксида мышьяка, мидостаурина (при ОМЛ, характеризуемом высокими уровнями мРНК FLT3), цитарабина, даунорубицина, метотрексата, идарубицина, сорафениба (при ОМЛ, характеризуемом высокими уровнями мРНК FLT3), децитабина, квизартиниба (при ОМЛ, характеризуемом высокими уровнями мРНК FLT3), JQ1 (ингибитор BRD4), АТО, преднизона (при ОМЛ, характеризуемом высокими уровнями мРНК GCR), SAHA и GSKJ4 (при ОМЛ, характеризуемом высокими уровнями мРНК JMJD3/JARID1В).
ССЫЛКИ
1. Niederreither, K. & Dolle, P. Retinoic acid in development: towards an integrated view. Nat. Rev. Genet. 9, 541-553 (2008).
2. Chapuy, B. et al. Discovery and Characterization of Super-Enhancer-Associated Dependencies in Diffuse Large В Cell Lymphoma. Cancer Cell 24, 777-790 (2013).
3. Tamura, Т., Kurotaki, D. & Koizumi, S. Regulation of myelopoiesis by the transcription factor IRF8. Int. J. Hematol. 101, 342-351 (2015).
4. Yang, J. et al. Cutting Edge: IRF8 Regulates Bax Transcription In Vivo in Primary Myeloid Cells. J Immunol. 187, 4426-4430 (2011).
5. Pogosova-Agadjanyan, E. L. et al. The Prognostic Significance of IRF8 Transcripts in Adult Patients with Acute Myeloid Leukemia. PLoS ONE 8, e70812 (2013).
6. Sharma, A. et al. Constitutive IRF8 expression inhibits AML by activation of repressed immune response signaling. Leukemia 29, 157-168 (2015).
7. Smits, E.L.J.M., Anguille, S. & Berneman, Z.N. Interferon a may be back on track to treat acute myeloid leukemia. Oncolmmunology 2, e23619 (2013).
8. Chelbi-Alix, M.K. & Pelicano, L. Retinoic acid and interferon signaling cross talk in normal and RA-resistant APL cells. Leuk. 08876924 13, (1999).
9. Encode Project Consortium, An integrated encyclopedia of DNA elements in the human genome. Nature 489: 57-74 (2012).
10. SY-1425-P003: Effects of tamibarotene (SY-1425) on proliferation of Acute Myeloid Leukemia (AML) cell lines in comparison to all-trans retinoic acid (ATRA).
11. SY-1425-P006: Characterization of the RARA enhancer and RARa mRNA in AML patient samples and cell lines.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ СТРАТИФИКАЦИИ ПАЦИЕНТОВ ДЛЯ ЛЕЧЕНИЯ АГОНИСТАМИ РЕЦЕПТОРОВ-α РЕТИНОЕВОЙ КИСЛОТЫ | 2016 |
|
RU2789374C2 |
| СПОСОБЫ ЛЕЧЕНИЯ, ДИАГНОСТИКИ И ПРОГНОЗИРОВАНИЯ ГЕМАТОЛОГИЧЕСКОГО ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2015 |
|
RU2727418C2 |
| СПОСОБЫ ЛЕЧЕНИЯ НЕЙТРОПЕНИИ С ПРИМЕНЕНИЕМ РЕТИНОИДНЫХ АГОНИСТОВ | 2013 |
|
RU2650962C2 |
| ПРОГНОЗИРОВАНИЕ ОТВЕТА НА АЛЬВОЦИДИБ С ПОМОЩЬЮ АНАЛИЗА ПРОФИЛЯ МИТОХОНДРИЙ | 2016 |
|
RU2717829C2 |
| СПОСОБ ЛЕЧЕНИЯ ИHCД АГОНИСТАМИ RXR | 1996 |
|
RU2191007C2 |
| КОМПОЗИЦИИ, ПОВЫШАЮЩИЕ ЧИСЛО КОПИЙ ВЕКТОРА (ЧКВ), И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2744603C2 |
| БИСПЕЦИФИЧНЫЕ ДИАТЕЛА CD123 х CD3 ДЛЯ ЛЕЧЕНИЯ ГЕМАТОЛОГИЧЕСКИХ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2019 |
|
RU2837616C2 |
| СПОСОБЫ ВОЗДЕЙСТВИЯ НА ТРАНСКРИПЦИОННЫЙ КОНТРОЛЬ В СУПЕРЭНХАНСЕРНЫХ ОБЛАСТЯХ | 2015 |
|
RU2737508C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ТРАНСПЛАНТАЦИИ СТВОЛОВЫХ КЛЕТОК | 2019 |
|
RU2809803C2 |
| Способ диагностики острых лейкозов и наборы для его выполнения | 2021 |
|
RU2806591C2 |
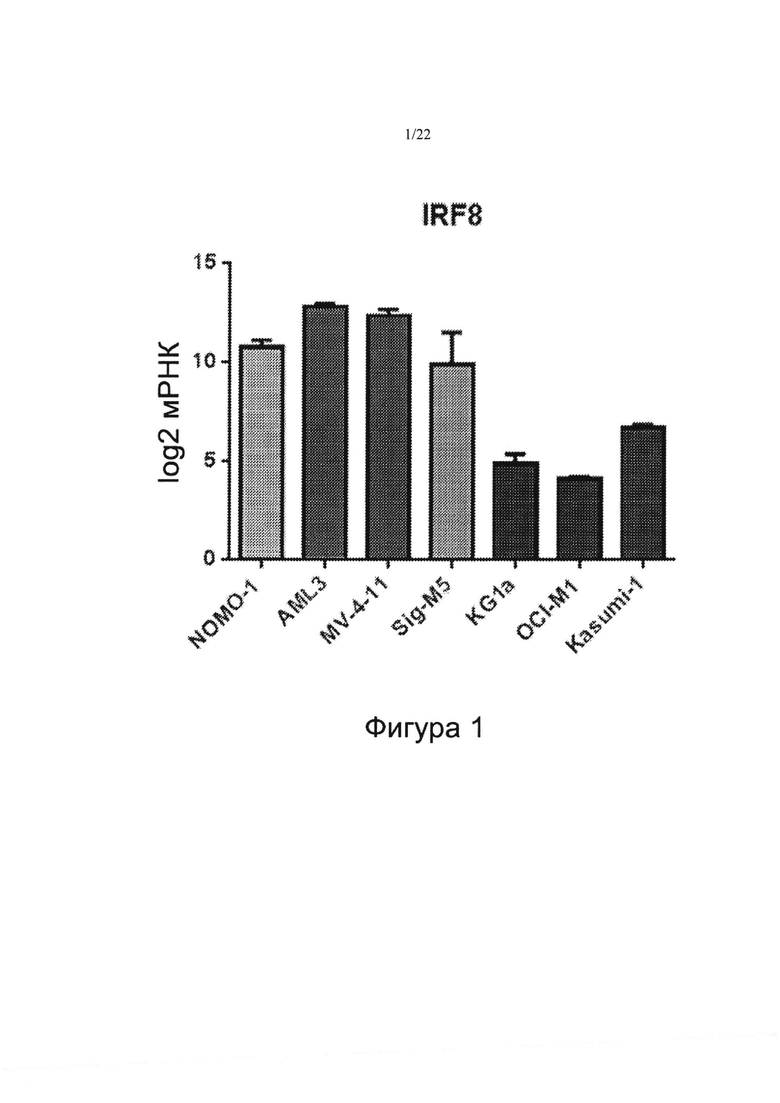
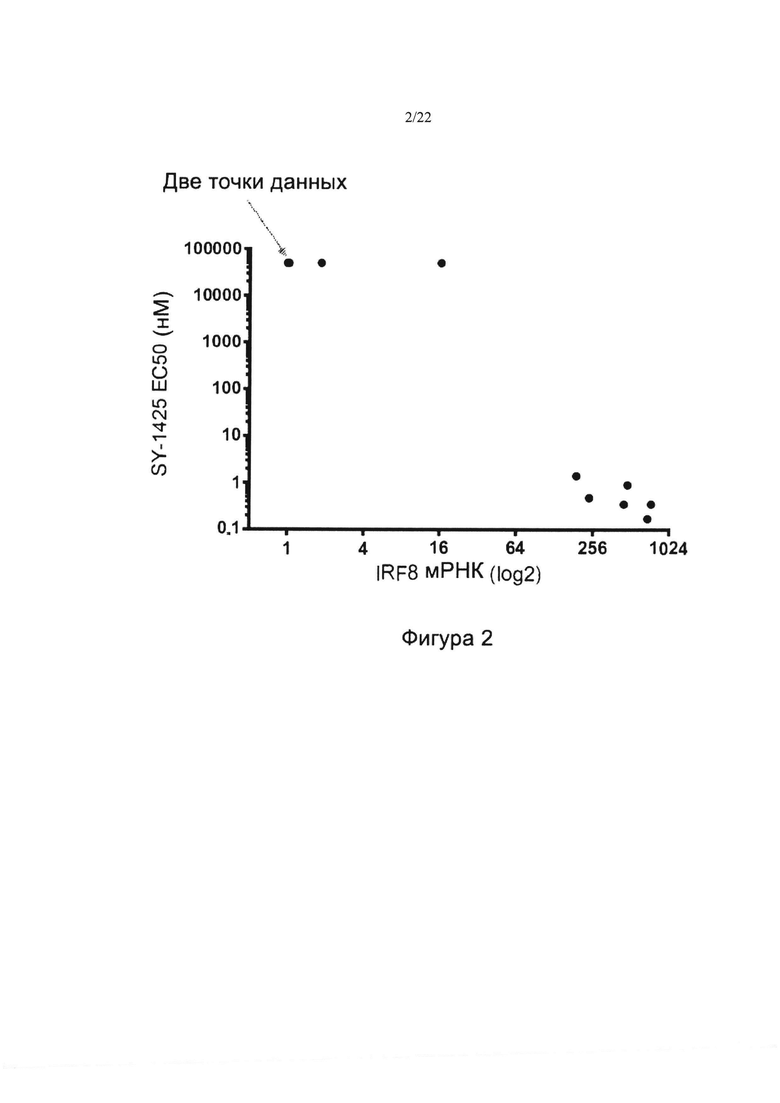
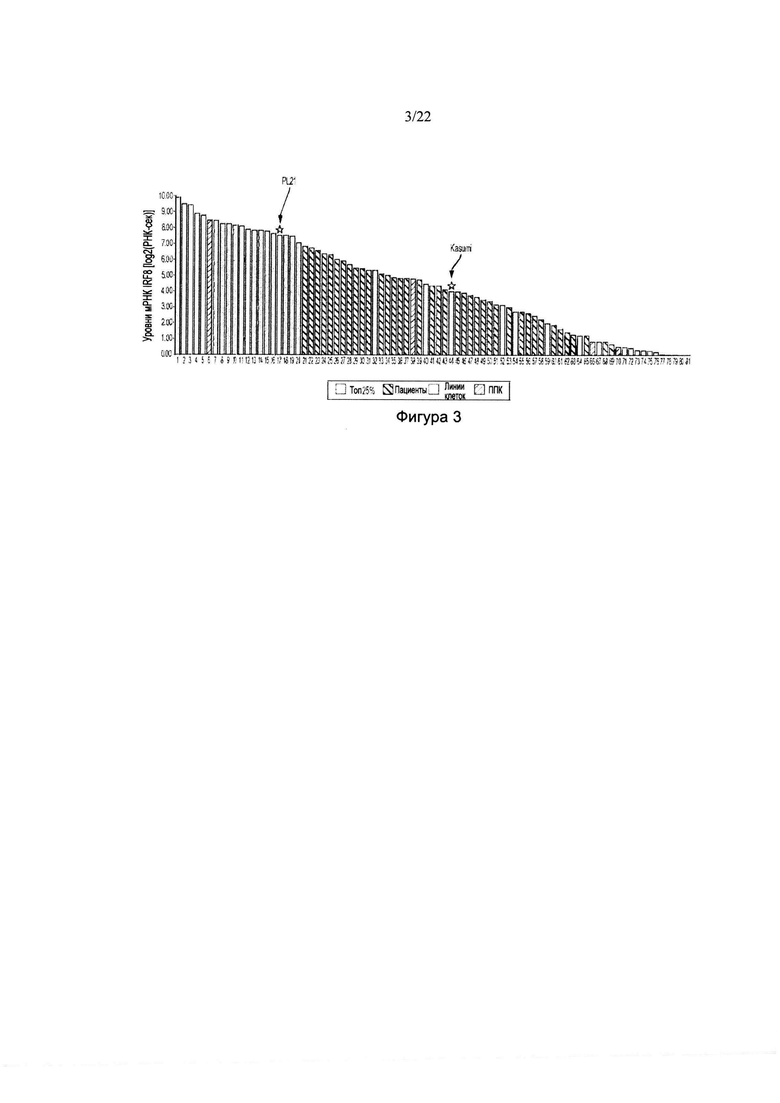
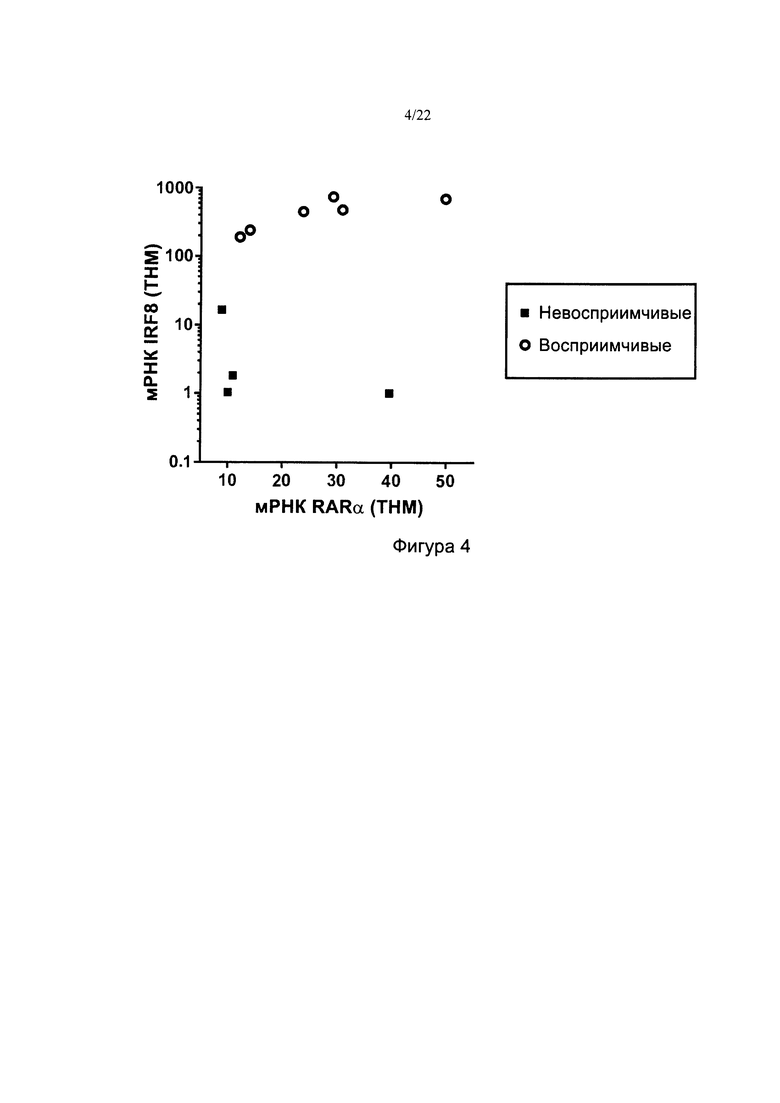
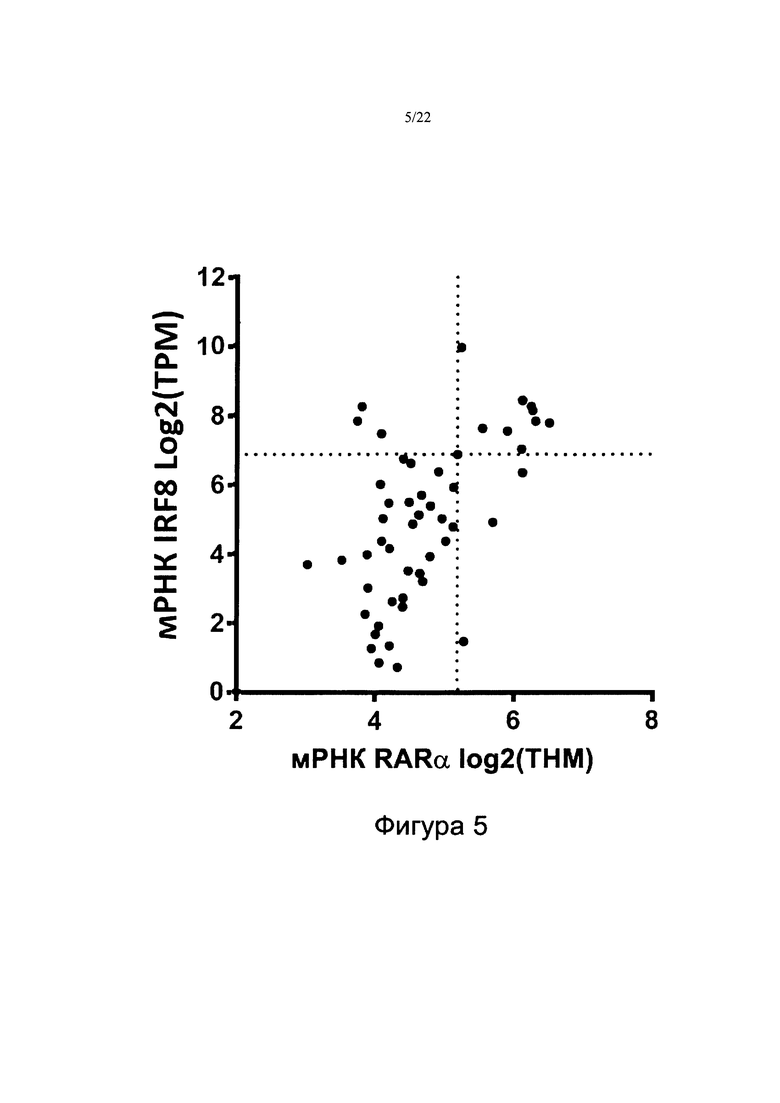
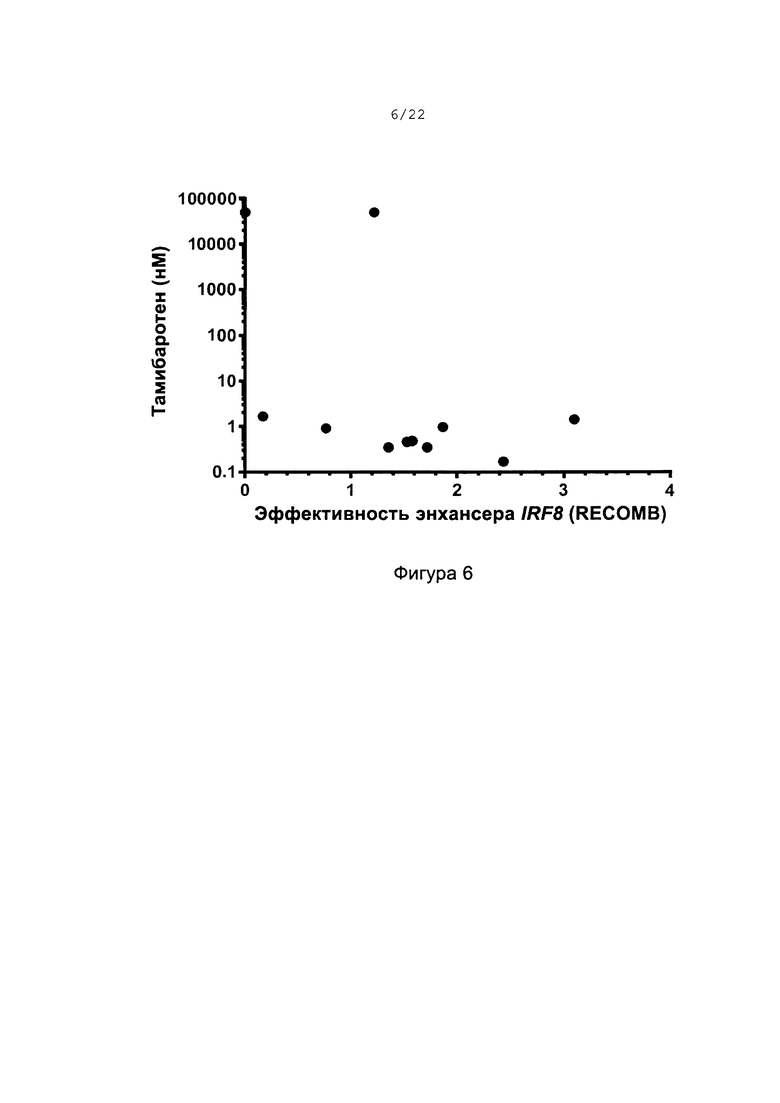
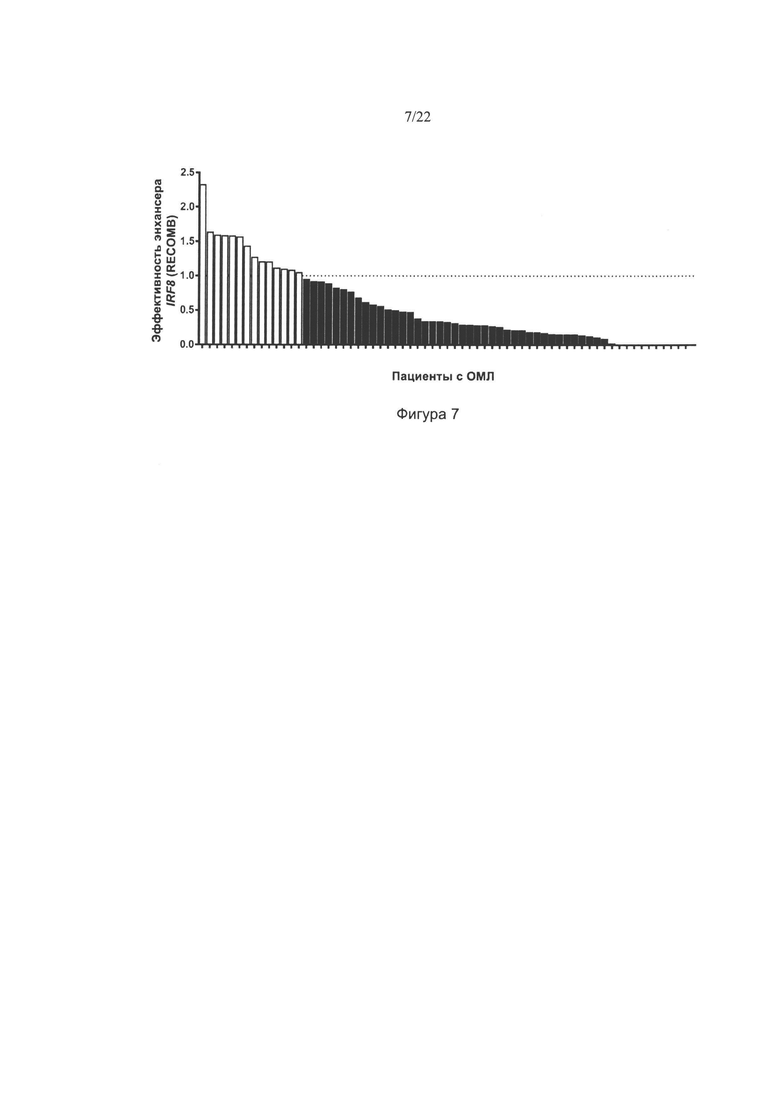
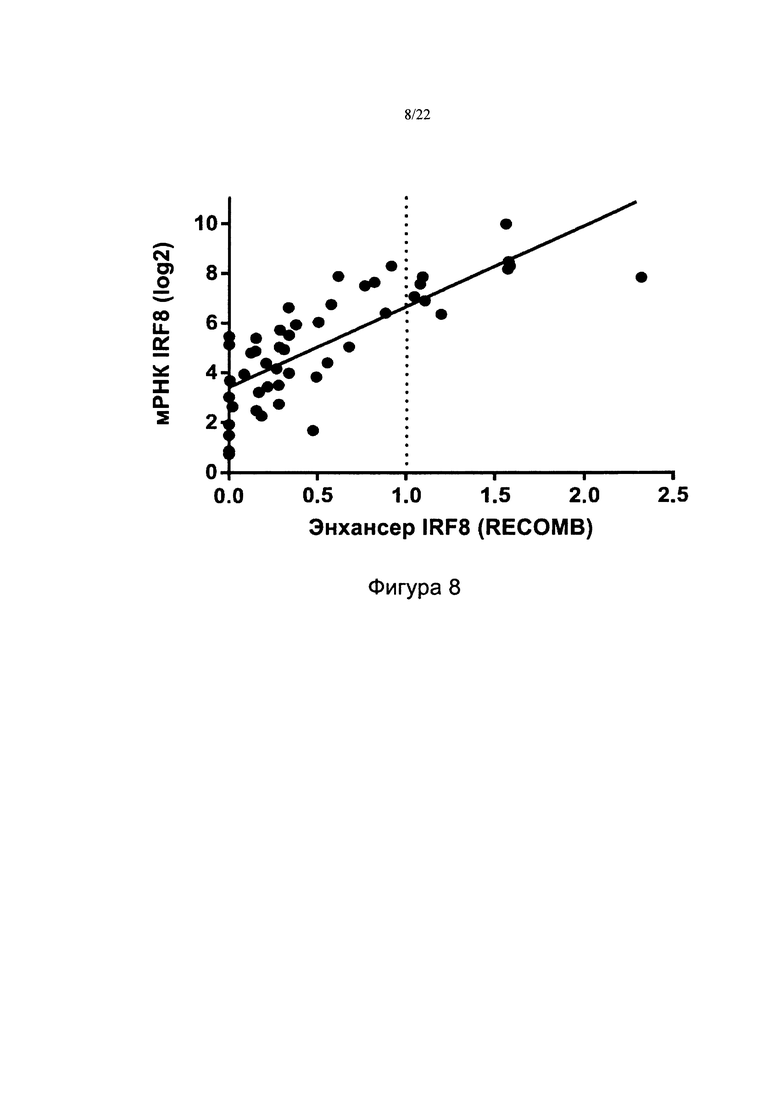
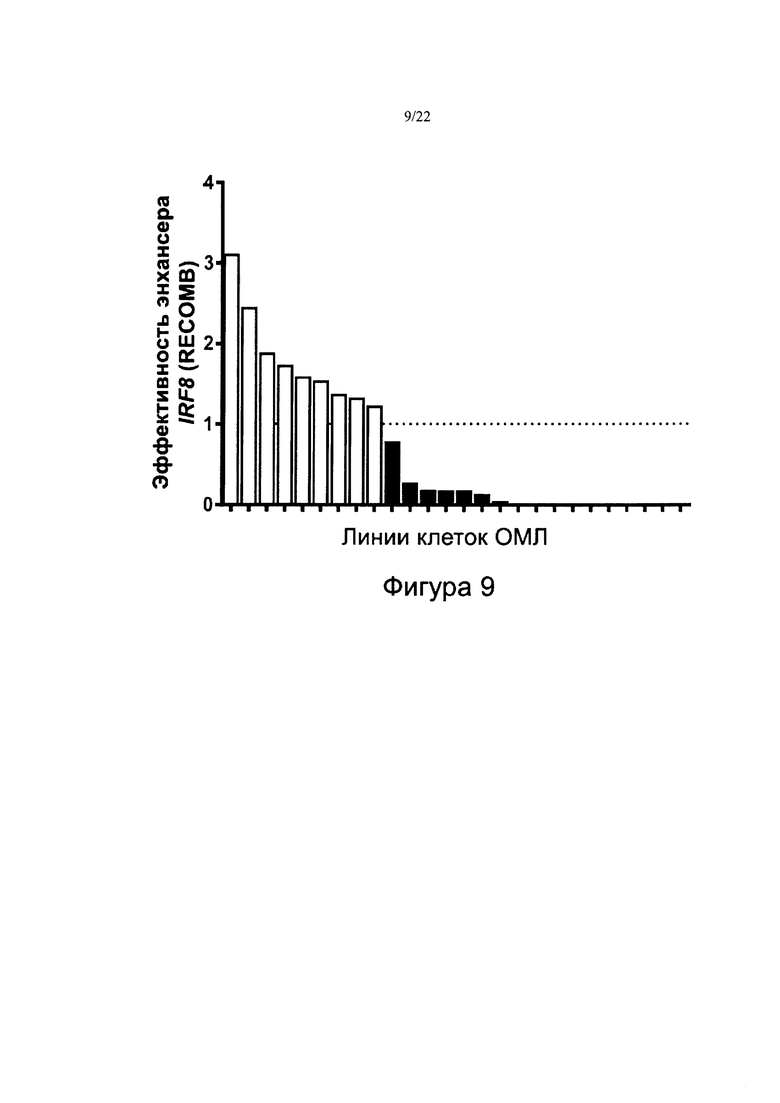
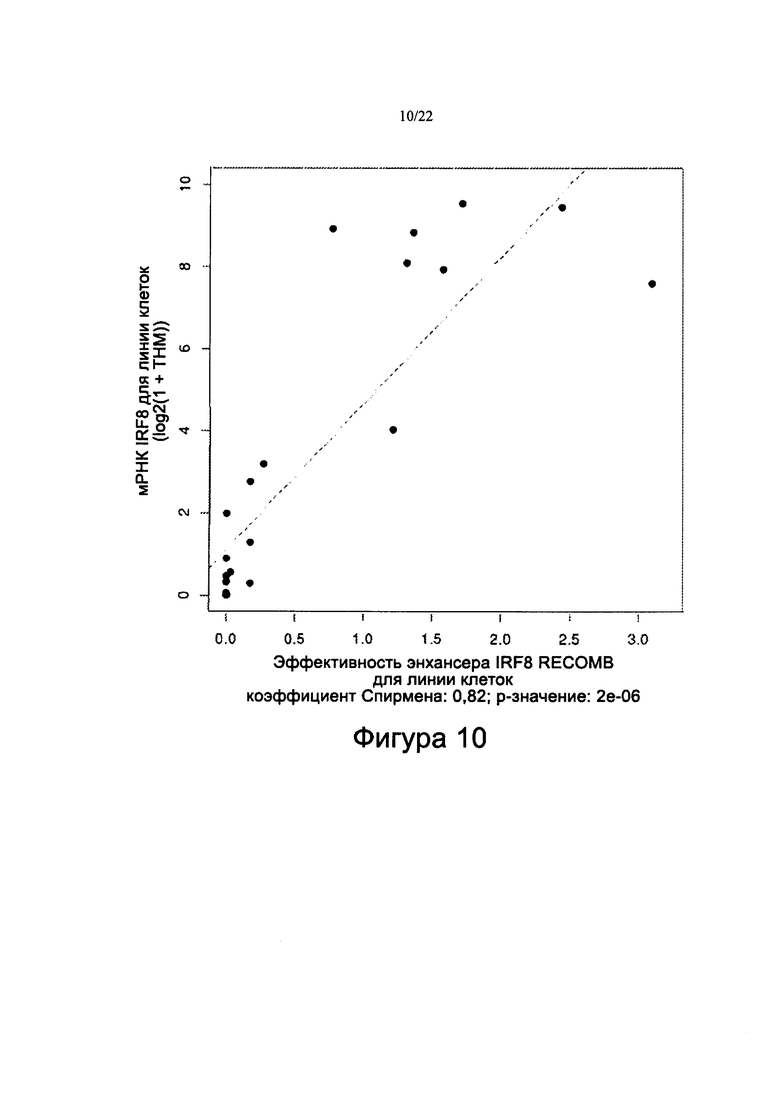
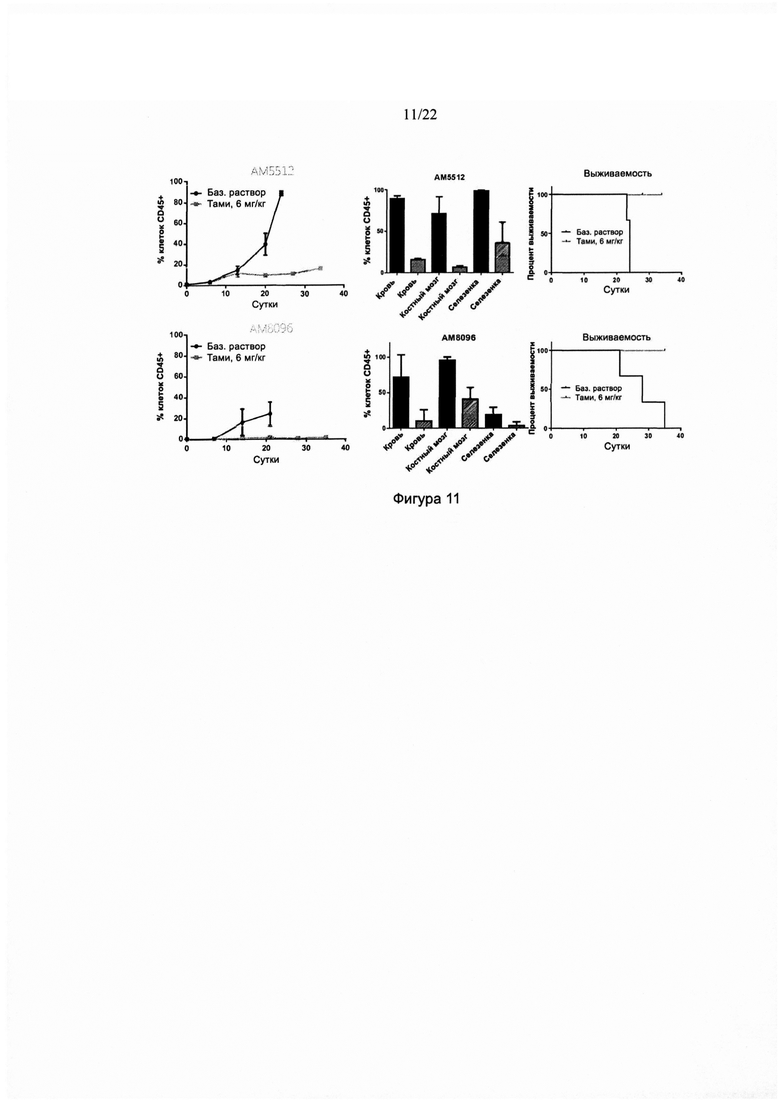
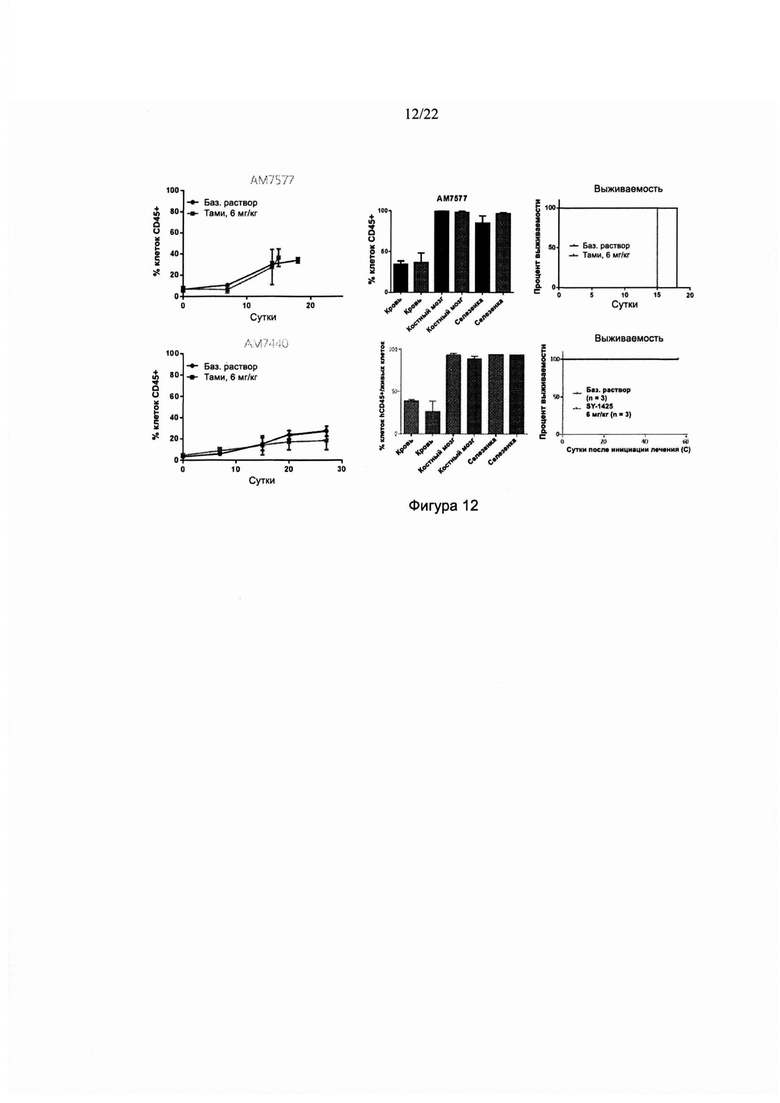
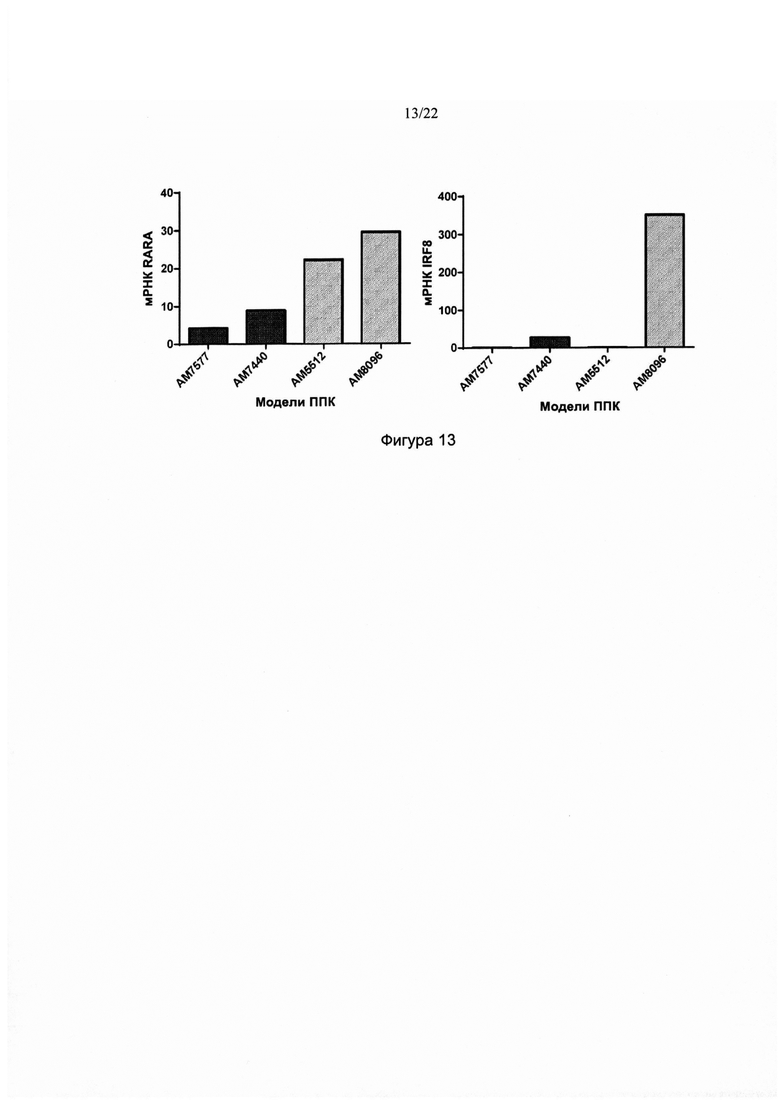
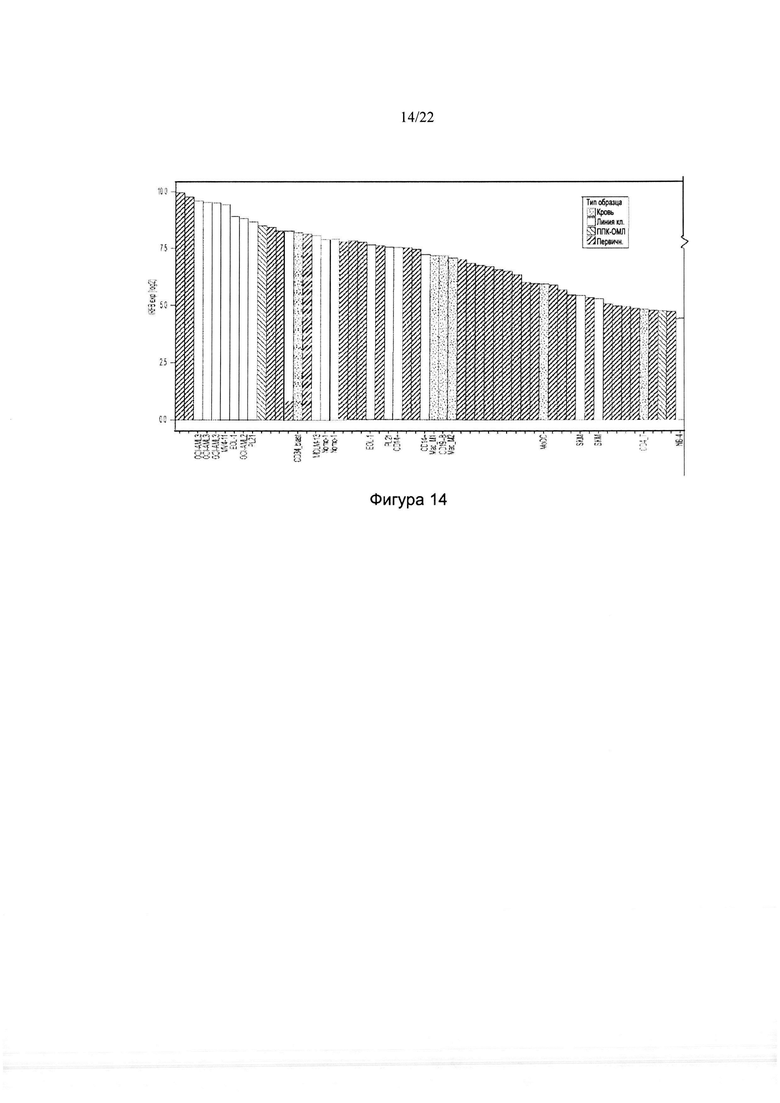
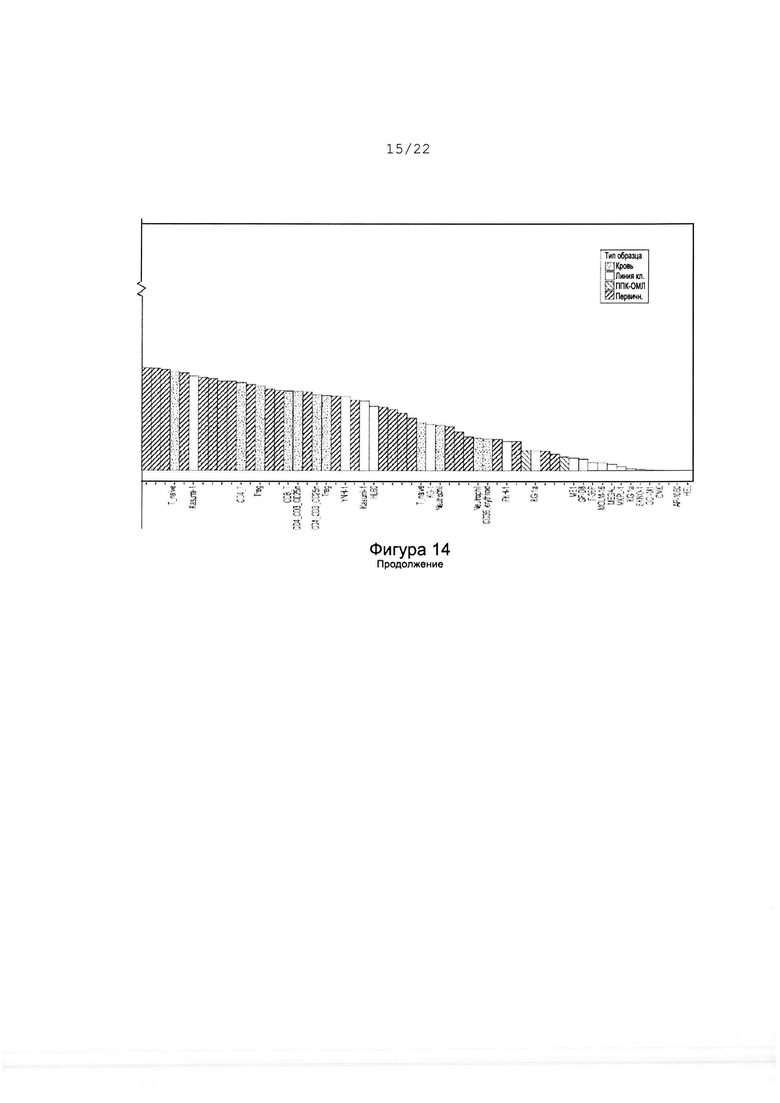
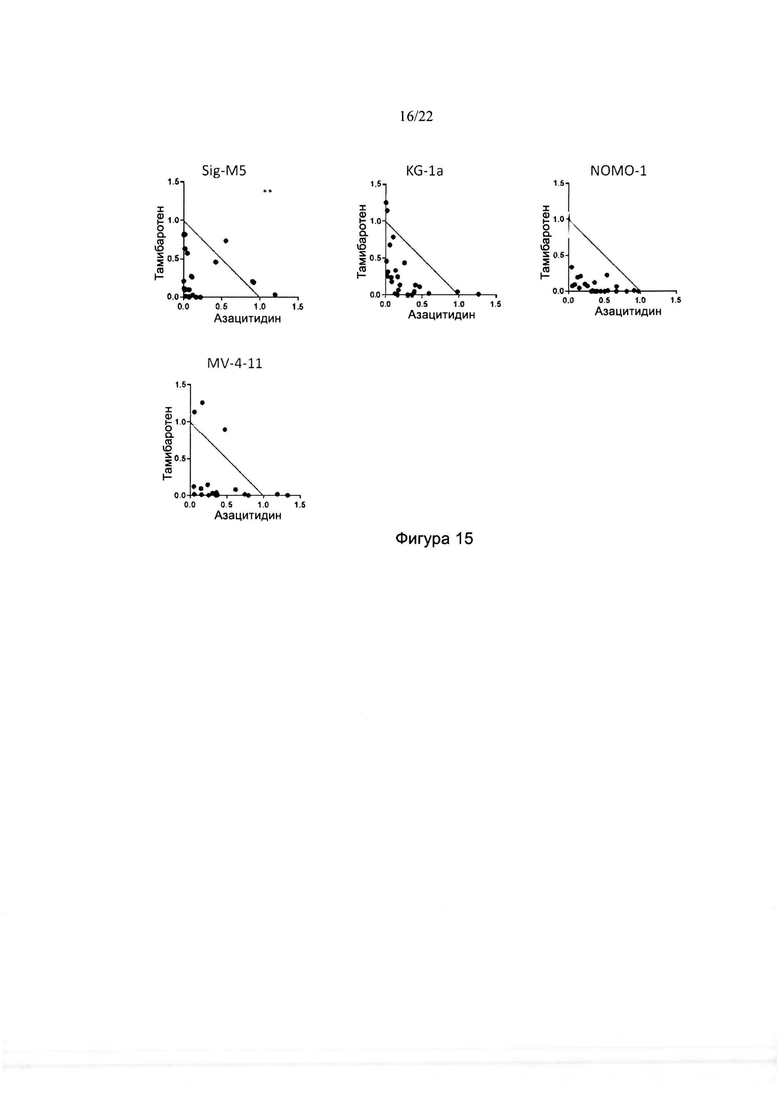
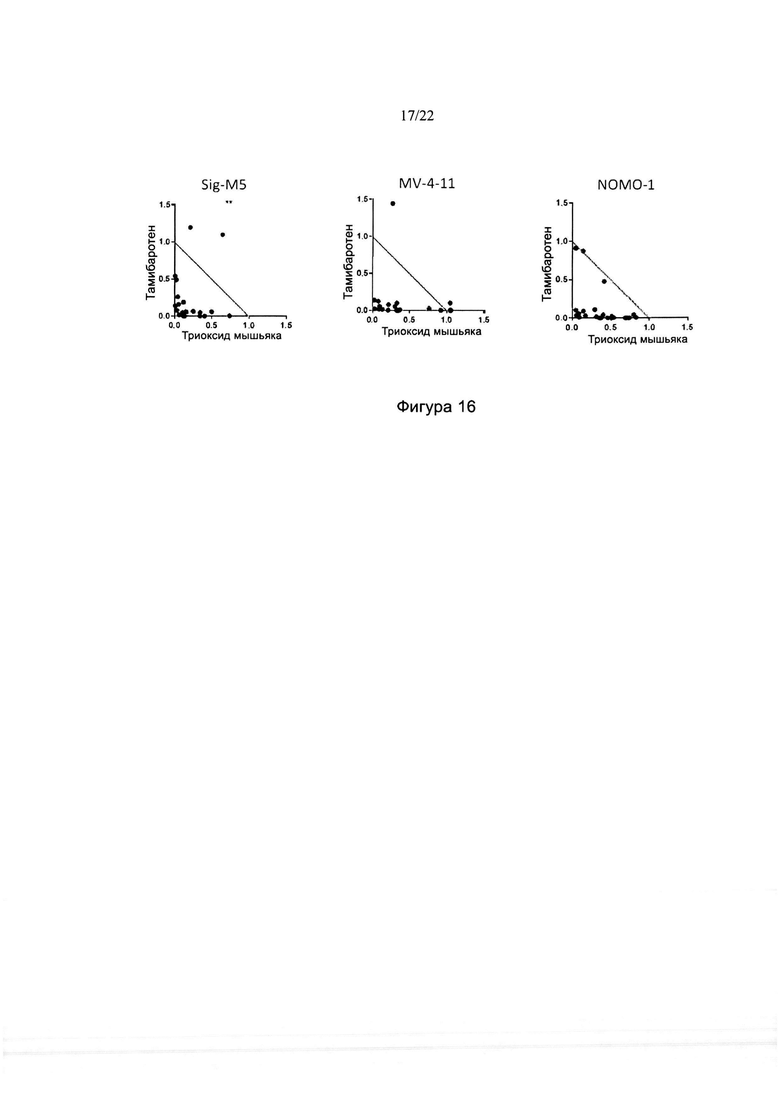
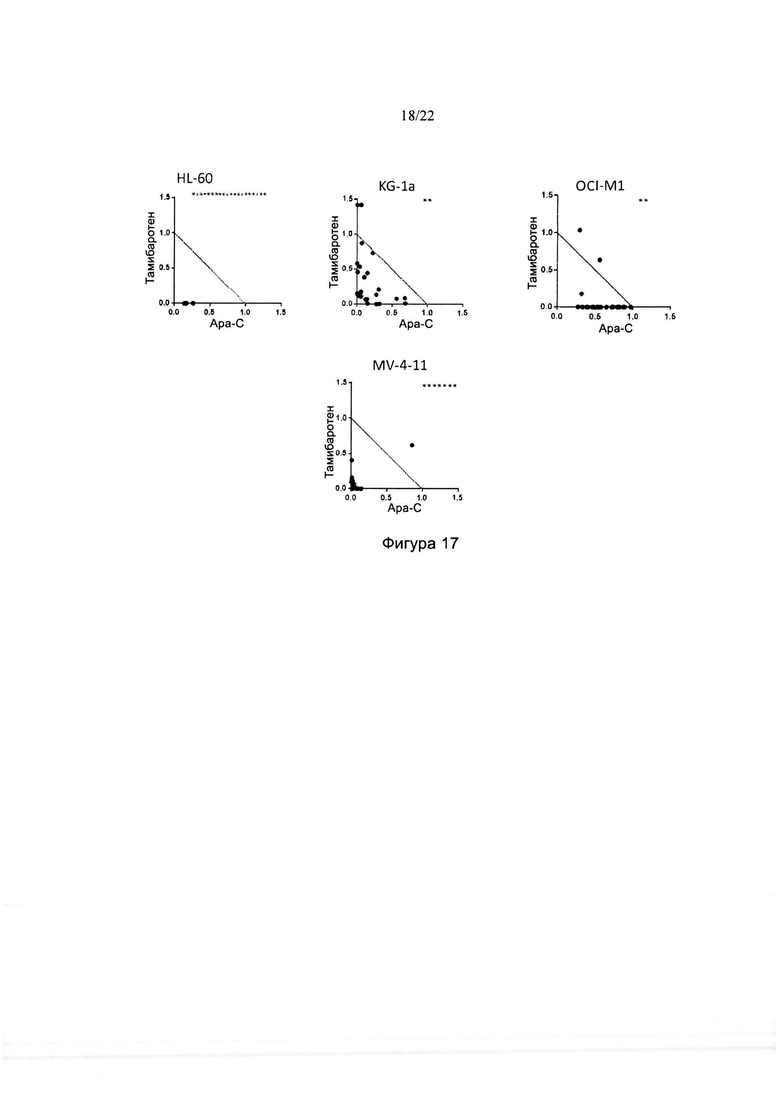
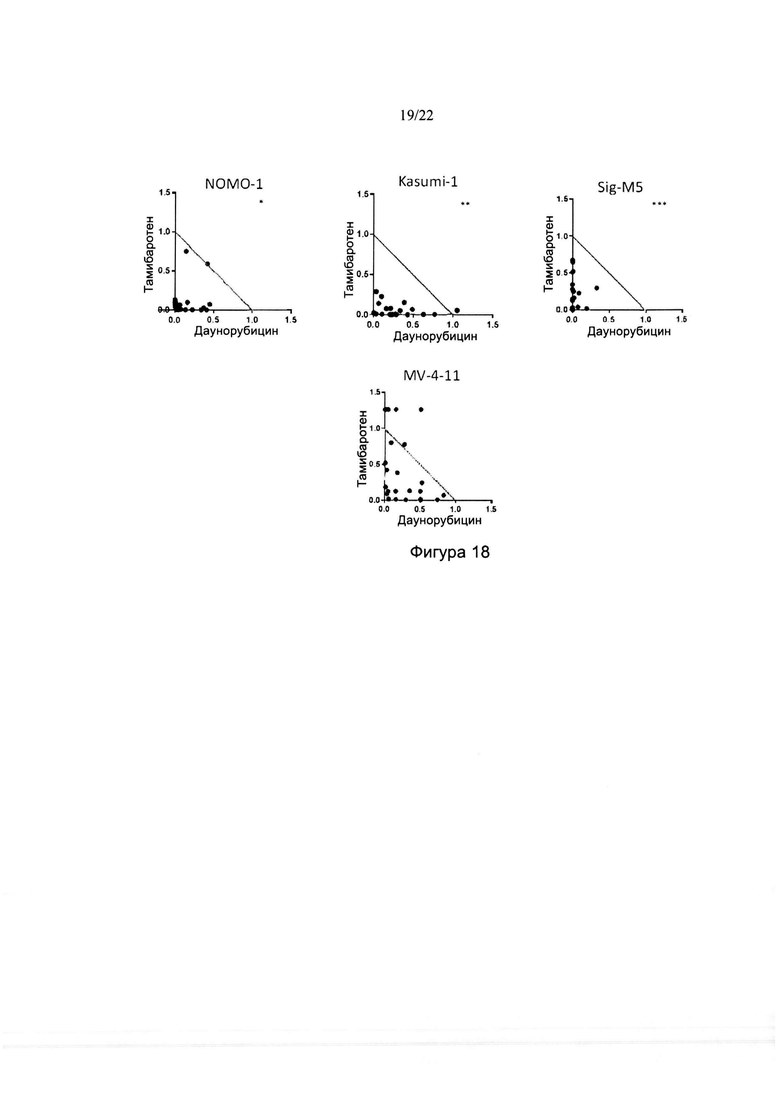
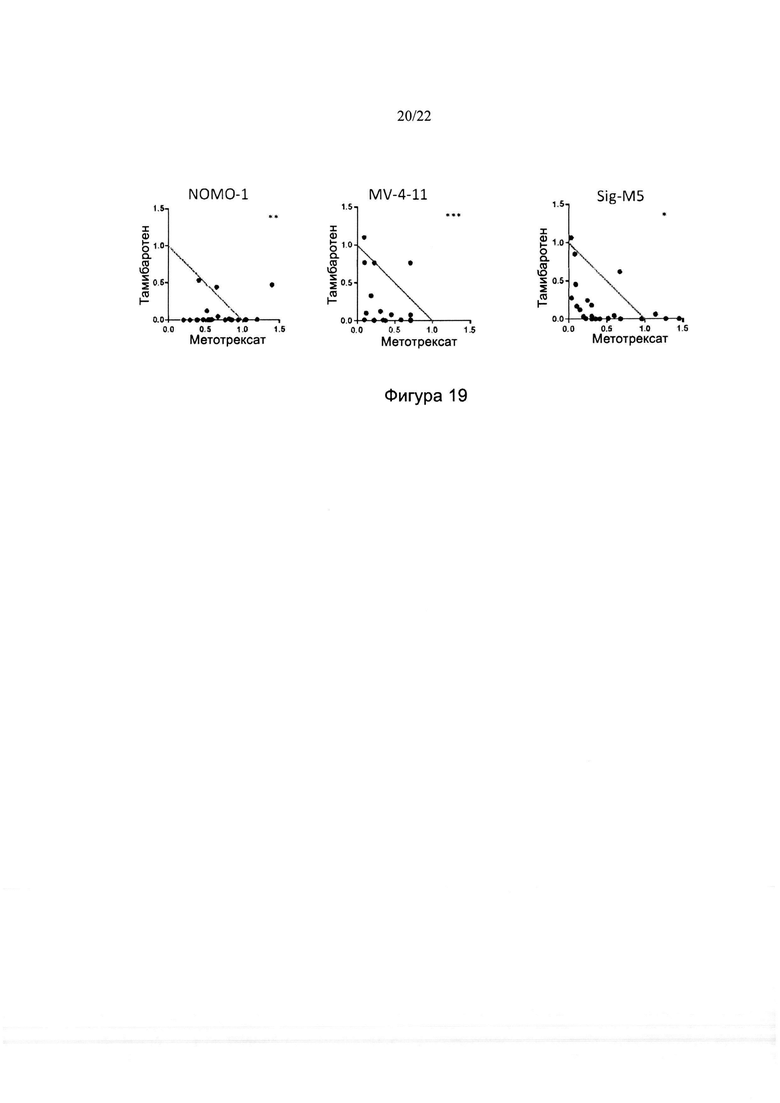
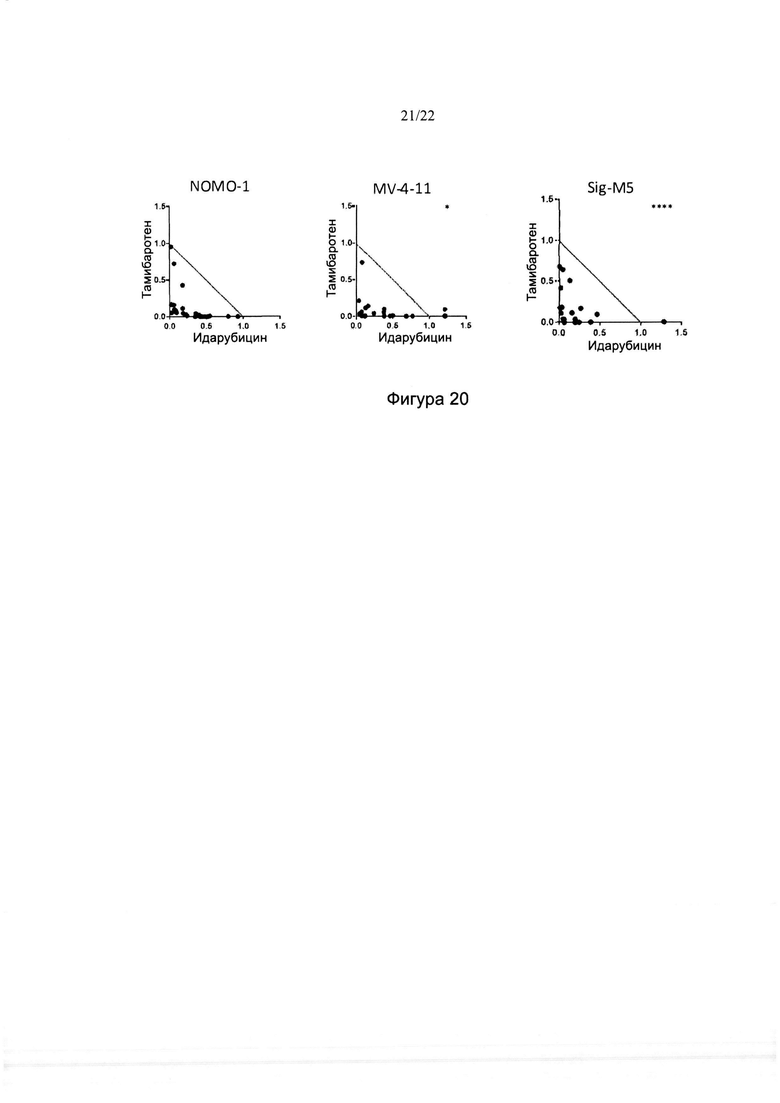
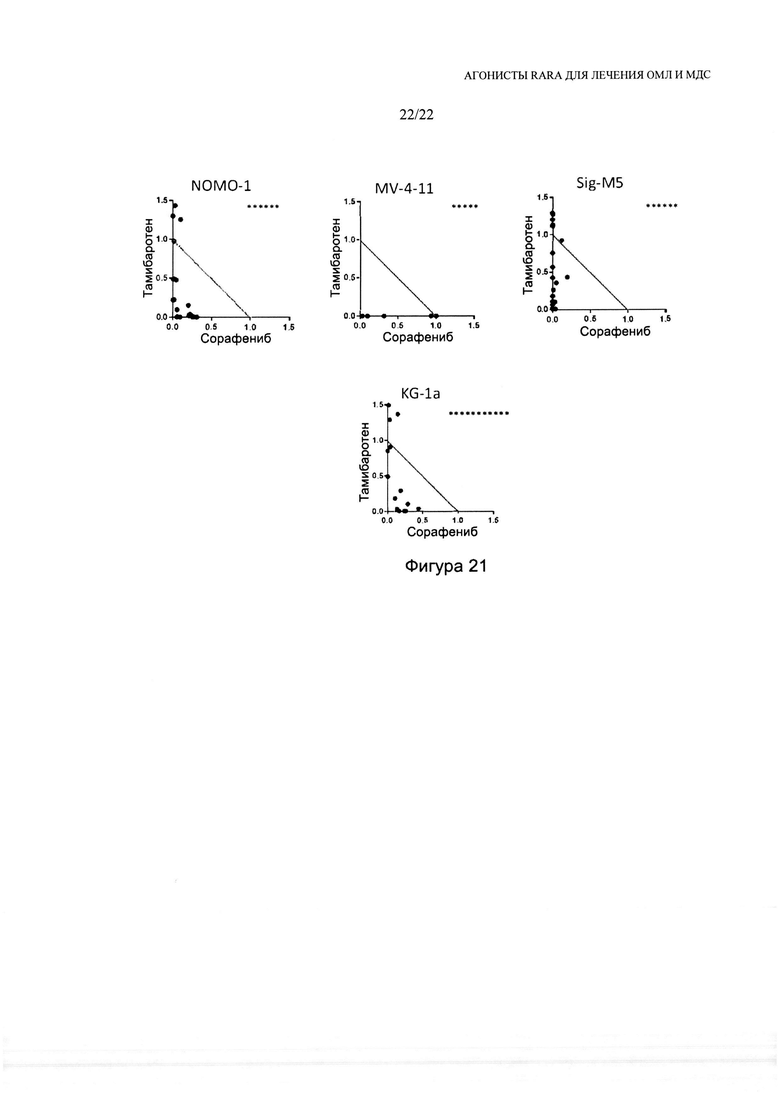
Изобретение относится к медицине, а именно к онкологии, и может быть использовано при лечении не являющегося ОПЛ (острым промиелоцитарным лейкозом) острого миелоцитарного лейкоза (не-ОПЛ ОМЛ). Способ включает введение комбинации тамибаротена и второго терапевтического агента субъекту, имеющему не-ОПЛ ОМЛ, при этом раковые клетки, содержащиеся в биологическом образце от указанного субъекта, содержат биомаркер IRF8 и/или биомаркер RARA, причем указанный второй терапевтический агент представляет собой: азацитидин, мидостаурин, цитарабин, даунорубицин, метотрексат, идарубицин, сорафениб, децитабин, квизартиниб, ABT199, JQ1, преднизон, SAHA, GSKJ4 или EPZ6438. Использование изобретения позволяет повысить эффективность лечения пациентов с не-ОПЛ ОМЛ, у которых раковые клетки экспрессируют биомаркер IRF8, за счет синергетического действия комбинации. 29 з.п. ф-лы, 21 ил., 3 табл., 8 пр.
1. Способ лечения не являющегося ОПЛ (острым промиелоцитарным лейкозом) острого миелоцитарного лейкоза (не-ОПЛ ОМЛ), включающий этап:
введения комбинации тамибаротена и второго терапевтического агента субъекту, имеющему не-ОПЛ ОМЛ, при этом раковые клетки, содержащиеся в биологическом образце от указанного субъекта, содержат биомаркер IRF8 и/или биомаркер RARA, причем:
биомаркер IRF8 представляет собой или включает уровень РНК-транскрипта IRF8, равный или выше заранее определенного порогового значения, или суперэнхансер, связанный с геном IRF8;
биомаркер RARA представляет собой или включает уровень РНК-транскрипта RARA, равный или выше заранее определенного порогового значения, или суперэнхансер, связанный с геном RARA; и
указанный второй терапевтический агент представляет собой: азацитидин, мидостаурин, цитарабин, даунорубицин, метотрексат, идарубицин, сорафениб, децитабин, квизартиниб, ABT199, JQ1, преднизон, SAHA, GSKJ4 или EPZ6438, причём:
если указанный второй терапевтический агент представляет собой мидостаурин, сорафениб или квизартиниб, такие мидостаурин, сорафениб или квизартиниб вводят только в случае, если дополнительно определено, что в биологическом образце, содержащем раковые клетки от указанного субъекта, имеется повышенный уровень мРНК FLT3;
если второй терапевтический агент представляет собой преднизон, то такой преднизон вводят только в случае, если дополнительно определено, что в биологическом образце, содержащем раковые клетки от указанного субъекта, имеется повышенный уровень мРНК GCR; и
если второй терапевтический агент представляет собой GSKJ4, то такой GSKJ4 вводят только в случае, если дополнительно определено, что в биологическом образце, содержащем раковые клетки от указанного субъекта, имеется повышенный уровень мРНК JMJD3 и/или JARID1B.
2. Способ по п. 1, отличающийся тем, что указанный второй терапевтический агент представляет собой азацитидин.
3. Способ по п. 1, отличающийся тем, что указанный второй терапевтический агент представляет собой мидостаурин.
4. Способ по п. 1, отличающийся тем, что второй терапевтический агент представляет собой цитарабин.
5. Способ по п. 1, отличающийся тем, что указанный второй терапевтический агент представляет собой даунорубицин.
6. Способ по п. 1, отличающийся тем, что указанный второй терапевтический агент представляет собой метотрексат.
7. Способ по п. 1, отличающийся тем, что указанный второй терапевтический агент представляет собой идарубицин.
8. Способ по п. 1, отличающийся тем, что указанный второй терапевтический агент представляет собой сорафениб.
9. Способ по п. 1, отличающийся тем, что указанный второй терапевтический агент представляет собой децитабин.
10. Способ по п. 1, отличающийся тем, что указанный второй терапевтический агент представляет собой квизартиниб.
11. Способ по п. 1, отличающийся тем, что указанный второй терапевтический агент представляет собой ABT199.
12. Способ по п. 1, отличающийся тем, что указанный второй терапевтический агент представляет собой JQ1.
13. Способ по п. 1, отличающийся тем, что указанный второй терапевтический агент представляет собой преднизон.
14. Способ по п. 1, отличающийся тем, что указанный второй терапевтический агент представляет собой SAHA.
15. Способ по п. 1, отличающийся тем, что указанный второй терапевтический агент представляет собой GSKJ4.
16. Способ по п. 1, отличающийся тем, что указанный второй терапевтический агент представляет собой EPZ6438.
17. Способ по п. 1, отличающийся тем, что указанный тамибаротен и второй терапевтический агент вводят одновременно.
18. Способ по п. 1, отличающийся тем, что указанный тамибаротен и второй терапевтический агент вводят последовательно.
19. Способ по п. 1, отличающийся тем, что повышенный уровень РНК-транскрипта RARA и/или повышенный уровень РНК-транскрипта IRF8 независимо определяют с использованием флуоресцентной гибридизации, ПЦР, кПЦР, кОТ-ПЦР, секвенирования РНК, гибридизации РНК и амплификации сигнала или нозерн-блоттинга.
20. Способ по п. 1, отличающийся тем, что указанный биологический образец, полученный от указанного субъекта, представляет собой аспират костного мозга или цельную кровь.
21. Способ по п. 20, отличающийся тем, что указанный аспират костного мозга или цельную кровь обрабатывают для удаления из них одного или более компонентов.
22. Способ по п. 21, отличающийся тем, что указанную цельную кровь обрабатывают для получения образца мононуклеарных клеток периферической крови (МКПК) или образца, обогащенного МКПК.
23. Способ по п. 1, отличающийся тем, что указанный биологический образец, полученный от указанного субъекта, определён как имеющий биомаркер IRF8.
24. Способ по п. 23, отличающийся тем, что указанный РНК-транскрипт IRF8 транскрибируется с последовательности геномной ДНК, которая кодирует белок, связывающий консенсусную последовательность интерферона или ее сплайс-вариант, и специфично исключает генные слияния, которые включают весь или часть гена IRF8, при этом указанный ген IRF8 расположен на хромосоме 16:85862582-85990086 в геномном блоке hg19.
25. Способ по п. 1, отличающийся тем, что указанный биологический образец, полученный от указанного субъекта, определён как имеющий биомаркер RARA.
26. Способ по п. 25, отличающийся тем, что указанный РНК транскрипт RARA транскрибируется с последовательности геномной ДНК, которая кодирует функциональный ген рецептора-α ретиноевой кислоты и специфично исключает генные слияния, которые включают весь или часть гена RARA, при этом указанный ген RARA расположен на хромосоме17:38458152-38516681.
27. Способ по п. 1, отличающийся тем, что указанный РНК-транскрипт IRF8 представляет собой мРНК IRF8.
28. Способ по п. 1, отличающийся тем, что указанный РНК-транскрипт RARA представляет собой мРНК RARA.
29. Способ по любому из пп. 1-28, отличающийся тем, что указанный субъект имеет не-ОПЛ ОМЛ.
30. Способ по п. 1, отличающийся тем, что указанный способ дополнительно включает сначала определение биомаркера IRF8 и/или биомаркера RARA в раковых клетках биологического образца от указанного субъекта.
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| TAMURA T | |||
| et al | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
Авторы
Даты
2023-07-11—Публикация
2017-04-07—Подача