Область изобретения
Настоящее изобретение относится к Fc-фрагменту IgG4, пригодному в качестве носителя лекарственного средства, и более конкретно к Fc-фрагменту IgG4, который может минимизировать эффекторные функции с помощью Fc, но не индуцирует обмена цепи с IgG in vivo и может улучшать период полувыведения конъюгированного лекарственного средства in vivo.
Предшествующий уровень техники
Развитие технологий генной инженерии привело к изготовлению и использованию различных видов белковых лекарственных препаратов. Однако белковые лекарственные средства имеют критические проблемы, заключающиеся в том, что они легко денатурируют или легко разрушаются in vivo протеазами и, таким образом, не могут сохранять свои концентрации или титры in vivo в течение длительного периода времени. Следовательно, очень важно поддерживать концентрации белковых лекарственных средств в крови и in vivo на подходящем уровне путем увеличения стабильности белка, чтобы обеспечить эффективное лечение пациентов при одновременном уменьшении у пациентов бремени частого введения белков посредством инъекций и т.д. и уменьшении расходов.
Соответственно, в течение длительного времени предпринимались различные попытки улучшения стабильности белковых лекарственных препаратов in vivo путем изменения типа белкового препарата, слияния с другими белками или присоединения подходящего полимера к поверхностям белков химическими или биологическими методами.
Одна из попыток улучшения стабильности белка путем слияния с другими белками заключается в осуществлении слиянии Fc-фрагмента иммуноглобулина с белком.
Fc-участок отвечает за эффекторные функции, такие как комплемент-зависимая цитотоксичность (CDC) и антитело-зависимая клеточная цитотоксичность (ADCC), в дополнение к антиген-связывающей способности, которая является основной функцией иммуноглобулинов. Кроме того, последовательность FcRn, присутствующая в Fc-участке, играет роль в регулировании уровня IgG в сыворотке путем увеличения времени полувыведения in vivo при конъюгации с рецептором FcRn in vivo. В связи с этим были проведены активные исследования для улучшения терапевтических белков посредством слияний Fc-участка с терапевтическими белками.
Однако, Fc-слитые белки, полученные путем генетической рекомбинации, имеют недостатки, заключающиеся в том, что слияние белка возможно только в конкретной области Fc-участка, то есть с амино-концом или карбокси-концом, и только между гликозилированными белками или между агликозилированными белками, но невозможно между гликозилированным белком и агликозилированным белком. Кроме того, Fc-слитые белки, полученные посредством генетической рекомбинации, имеют проблемы, заключающиеся в том, что может иметь место иммунный ответ из-за новой аминокислотной последовательности, созданной посредством слияния, а также возможного повышения чувствительности протеиназы к линкерной области.
Кроме того, слитые с Fc белки имеют повышенное время полужизни целевого белка в сыворотке, но в то же время они имеют проблему, заключающуюся в проявлении эффекторных функций, которыми обладает Fc-участок (патент США 5349053). Посредством эффекторных функций Fc-участка слитые белки могут фиксировать комплементы или связываться с клетками, экспрессирующими FcR, для уничтожения конкретных клеток и индукции выработки и секреции различных цитокинов, которые вызывают воспаление, тем самым вызывая воспаление. Кроме того, последовательности белка в областях слияния представляют собой новые белковые последовательности, которые не присутствуют в организме человека и, таким образом, они имеют различные недостатки, включающие возможную индукцию иммунного ответа в случае длительного введения.
Соответственно, исследования были сосредоточены на использовании иммуноглобулинов или фрагментов иммуноглобулинов, в которых были удалены эффекторные функции, при сохранении времени полужизни в сыворотке. Cole et al. ранее сообщали, что ADCC-активность была ингибирована путем замены 234-ного, 235-ного и 237-ного остатков аланином в домене CH2, который, как известно, играет важную роль в связывании с Fc-рецепторами, для продуцирования Fc-производных с пониженными аффинностями к Fc-рецепторам (Cole et al., J. Immunol. 159: 3613-3621, 1997). Однако все они имеют несоответствующие аминокислоты, которые отличаются от аминокислот в природном Fc-участке человека, и могут, таким образом, иметь более высокий иммунитет или антигенность, а предпочтительные функции Fc могут быть утеряны.
В качестве способа удаления или уменьшения нежелательных эффекторных функций при сохранении высокой концентрации иммуноглобулинов в крови изучали способ удаления сахаридов в иммуноглобулинах. В патенте США 5585097 агликозилированные производные антител получали путем замещения остатка аспарагина в положении 297 домена CH2, который представляет собой гликозилированный остаток CD3-антител, другой аминокислотой при получении CD3-антител и, в частности, производные показывали снижение эффекторных функций при сохранении силы связывания с рецепторами FcRn без изменения их времени полужизни в сыворотке. Однако этот способ также имеет проблему, заключающуюся в том, что они могут быть опознаны как инородные вещества и, как таковые, отвергнуты иммунной системой из-за получения новой рекомбинантной конструкции.
При получении слитых белков с использованием последовательностей нативного IgG Fc может быть выбран IgG4 Fc для того, чтобы минимизировать эффекторные функции Fc. Известно, что IgG4 имеет время полужизни in vivo, аналогичное времени полужизни IgG1, но обладает относительно небольшими эффекторными функциями из-за разницы в аминокислотной последовательности. Однако, несмотря на преимущества IgG4, имеющего пониженные эффекторые функции, может происходить обмен цепей in vivo между IgG4 из-за его специфической шарнирной последовательности и, таким образом, сообщалось, что возникает много сложностей при использовании слитых белков в лечебных целях (van der Neut Kolfschoten, et al., Science, 317:1554-1557, 2007). То есть существует проблема, заключающаяся в том, что при использовании Fc IgG4 в качестве носителя для слитого белка происходит обмен цепей с IgG4, присутствующим in vivo, что приводит к образованию гибрида с нативным IgG4, или он может присутствовать в форме мономеров, тем самым изменяя исходную структуру и имею структуру с низкой терапевтической активностью. Общей проблемой является можно ли продукт слияния между Fc-фрагментом IgG4 и физиологически активным материалом получить посредством генной инженерии или in vitro.
Описание изобретения
Техническая проблема
В этих условиях авторы настоящего изобретения в результате исследований при разработке Fc-фрагмента IgG, способного действовать в качестве носителя лекарственного средства с низким риском индуцирования реакции обмена Fab-области с IgG in vivo и эффекторных функций, но способного преодолеть недостатки технологии слияния посредством генетической рекомбинации, обнаружили, что может быть образован конъюгат лекарственного средства с увеличенной долговечностью, но без риска индукцирования реакции обмена Fab-области с IgG in vivo и эффекторных функций, когда шарнирная последовательность Fc-фрагмента IgG4, которая подвергнута мутации так, чтобы иметь только один остаток цистеина, продуцировалась в E. coli и была конъюгирована с лекарственным средством, тем самым осуществляя настоящее изобретение.
Техническое решение
Целью настоящего изобретения является предложение Fc-фрагмента IgG4, который имеет низкий риск индуцирования реакции обмена цепей с IgG in vivo или эффекторных функций и может действовать в качестве носителя лекарственного средства. Более конкретно, целью настоящего изобретения является предложение модифицированного Fc-фрагмента IgG4, включающего модифицированную шарнирную область, где часть шарнирной последовательности удалена так, чтобы содержался только один остаток цистеина.
Другой целью настоящего изобретения является предложение нуклеиновой кислоты, которая кодирует модифицированный Fc-фрагмент IgG4, включающий модифицированную шарнирную область, где часть шарнирной последовательности удалена так, чтобы содержался только один остаток цистеина.
Еще одной целью настоящего изобретения является предложение вектора, включающего нуклеиновую кислоту, которая кодирует модифицированный Fc-фрагмент IgG4, включающий модифицированную шарнирную область, где часть шарнирной последовательности удалена так, чтобы содержался только один остаток цистеина.
Еще одной целью настоящего изобретения является предложение микроорганизма с введенным вектором, включающим нуклеиновую кислоту, которая кодирует модифицированный Fc-фрагмент IgG4, включающий модифицированную шарнирную область, где часть шарнирной последовательности удалена так, чтобы содержался только один остаток цистеина.
Еще одной целью настоящего изобретения является предложение способа получения модифицированного Fc-фрагмента IgG4, включающего культивирование микроорганизма, в который вводят вектор, включающий нуклеиновую кислоту, которая кодирует модифицированный Fc-фрагмент IgG4.
Еще одной целью настоящего изобретения является предложение конъюгата лекарственного средства, где лекарственное средство и модифицированный Fc-фрагмент IgG4 конъюгированы с помощью линкера.
Еще одной целью настоящего изобретения является предложение фармацевтической композиции, содержащей конъюгат лекарственного средства, где лекарственное средство и модифицированный Fc-фрагмент IgG4 конъюгированы с помощью линкера.
Полезные эффекты изобретения
Настоящее изобретение может предложить модифицированный Fc-фрагмент IgG4, который обладает минимизированной эффекторной функцией без замены или добавления аминокислот или добавления гликанов, а также не имеет реакции обмена цепей с IgG4 in vivo. Модифицированный Fc-фрагмент IgG4 по настоящему изобретению, независимо от способа конъюгирования его с лекарственным средством, такого как метод генной инженерии и ковалентный метод in vitro, может ингибировать реакцию обмена цепей in vivo конъюгированного лекарственного средства, когда он конъюгирован с лекарственным средством, и может таким образом обеспечить значительное терапевтическое превосходство по сравнению с нативным Fc-фрагментом IgG4.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
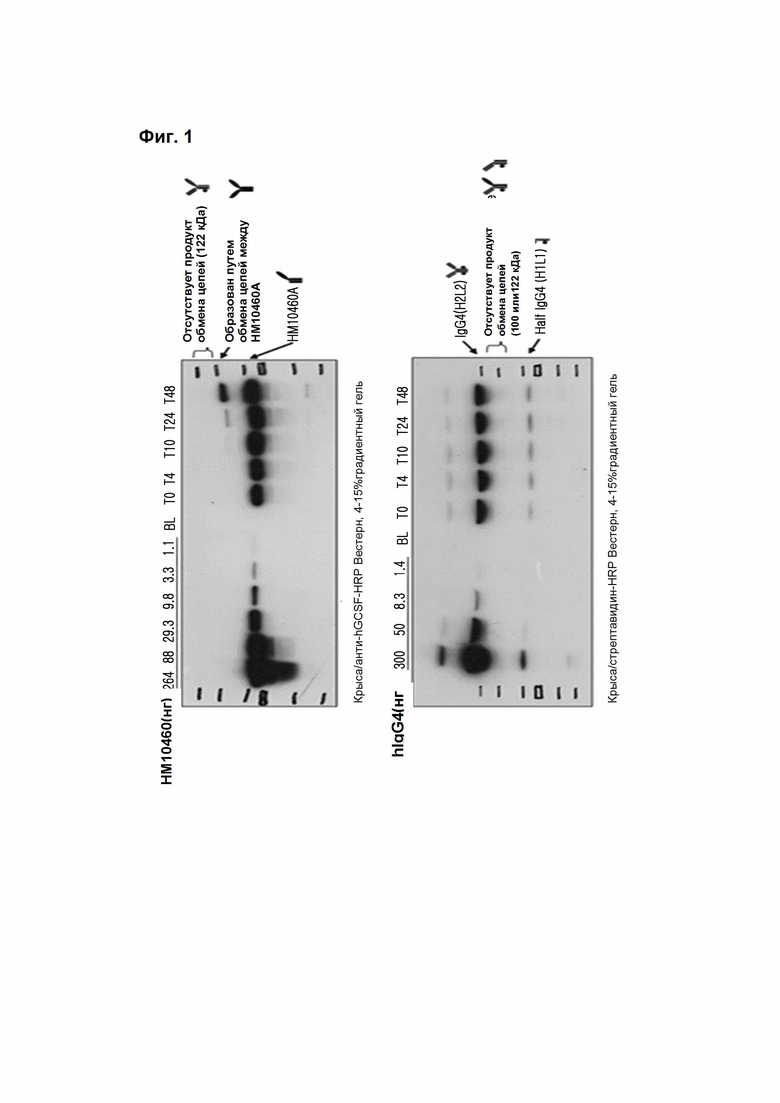
На Фиг. 1 показано присутствие/отсутствие обмена цепи человеческого IgG4 между биотинилированным hIgG4 и конъюгатом человеческий гранулоцитарный колониестимулирующий фактор-PEG (полиэтиленгликоль)-Fc-фрагмент IgG4 в крысиной крови.
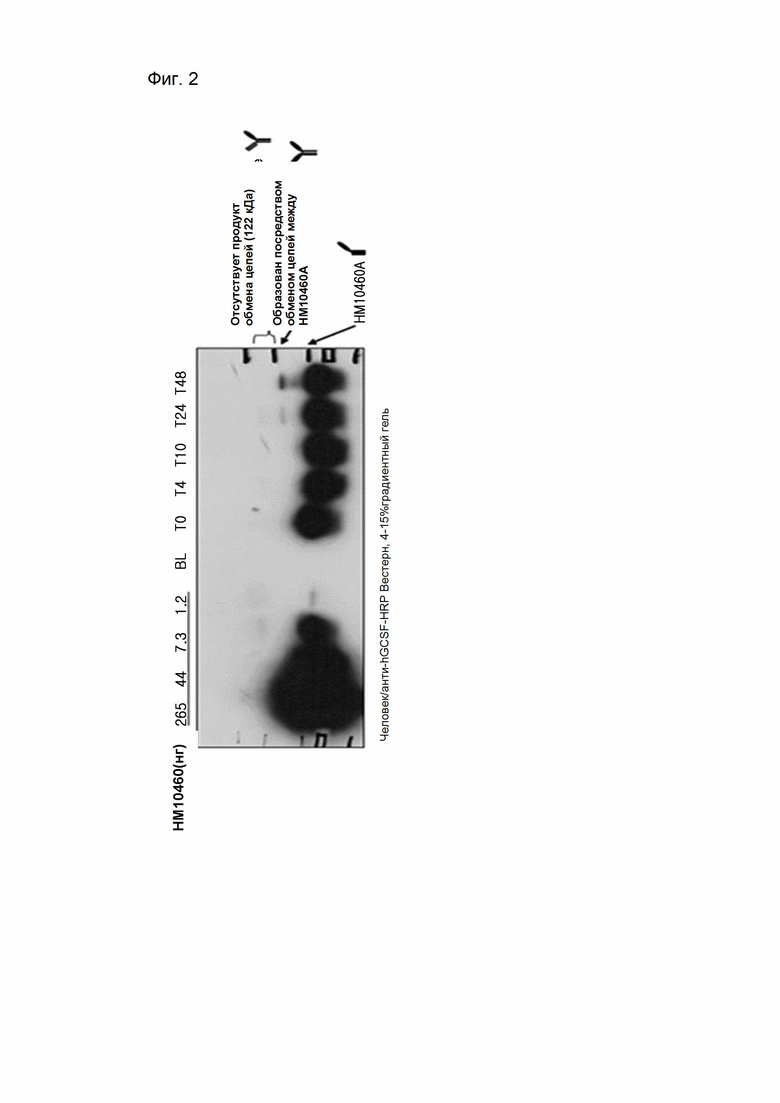
На Фиг. 2 показано присутствие/отсутствие обмена цепи человеческого IgG4 между биотинилированным hIgG4 и конъюгатом человеческий гранулоцитарный колониестимулирующий фактор-PEG (полиэтиленгликоль)-Fc-фрагмент IgG4 в человеческой крови
ЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Предпочтительные воплощения настоящего изобретения будут описаны ниже более подробно со ссылкой на сопутствующие графические материалы. Настоящее изобретение может, однако, быть воплощено в разных формах и не должно рассматриваться, как ограниченное воплощениями, изложенными в данном описании изобретения. Скорее эти воплощения представлены так, чтобы это описание было полным и всесторонни и полностью указывало объем настоящего изобретения специалистам в данной области техники.
В одном аспекте для достижения вышеуказанных задач в настоящем изобретении предложен модифицированный Fc-фрагмент IgG4, полезный в качестве носителя лекарственного средства. Более конкретно, в настоящем изобретении предложен модифицированный Fc-фрагмент IgG4, включающий модифицированную шарнирную область, где часть шарнирной последовательности удалена так, чтобы содержался только один остаток цистеина.
Модифицированный Fc-фрагмент IgG4 по настоящему изобретению включает модифицированную шарнирную область, где часть шарнирной области, представленная следующей аминокислотной последовательностью, удалена так, чтобы содержался только один остаток цистеина:
Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro-Ser-Cys-Pro (SEQ ID NO: 1).
Авторы настоящего изобретения, стремясь решить проблему Fc-участка IgG4, имеющего низкую полезность из-за реакции обмена цепей с IgG4 in vivo, несмотря на его полезность в качестве носителя для увеличения времени полужизни лекарственных средств, обнаружили, что реакция обмена цепей in vivo и образование мономера не происходит, когда Fc-фрагмент IgG4 модифицирован удалением, путем делеции, одного из двух остатков цистеина, присутствующих в шарнирной Fc-участке-фрагмента IgG4, а также части шарнирной области, тем самым подтверждая, что модифицированный Fc-фрагмент IgG4, может быть эффективно использован в качестве носителя лекарственного средства.
В одном воплощении Fc-фрагмент IgG4 по настоящему изобретению может включать шарнирную область, которая модифицирована путем делеции 1-8 аминокислот, включая остаток Cys в 8-ом положении аминокислотной последовательности SEQ ID NO: 1.
Кроме того, в одном воплощении Fc-фрагмент IgG4 по настоящему изобретению может включать шарнирную область, которая модифицирована путем делеции 1-8 аминокислот, включая остаток Cys в 11-ом положении аминокислотной последовательности SEQ ID NO: 1.
Альтернативно, в одном воплощении Fc-фрагмент IgG4 по настоящему изобретению может включать шарнирную область, которая модифицирована путем делеции 1-5 аминокислот, включая остаток Cys в 8-ом положении, или 1-5 аминокислот, включая остаток Cys в 11-ом положении аминокислотной последовательности SEQ ID NO: 1.
Альтернативно, в одном воплощении Fc-фрагмент IgG4 по настоящему изобретению может включать шарнирную область, которая модифицирована путем делеции 1-3 аминокислот, включая остаток Cys в 8-ом положении, или 1-3 аминокислот, включая остаток Cys в 11-ом положении аминокислотной последовательности SEQ ID NO: 1.
Аминокислотные остатки, удаленные как указано выше, могут быть расположены непрерывно или прерываться.
Шарнирная Fc-участок-фрагмента IgG4 по настоящему изобретению характеризуется тем, что она модифицирована так, чтобы включать только один остаток цистеина между двумя остатками цистеина в 8-ом и 11-ом положениях аминокислотной последовательности SEQ ID NO: 1, и так, чтобы оба из этих двух остатков цистеина не были удалены.
Шарнирная область, модифицированная так, чтобы включать только один остаток цистеина из двух остатков цистеина в шарнирной области, оказывает воздействие без обмена цепи in vivo, образования мономера и т.д. на модифицированном Fc-фрагменте IgG4.
При использовании здесь термин “носитель” относится к веществу, которое конъюгировано с лекарственным средством и, будучи конъюгированным с лекарственным средством, обычно увеличивает или ликвидирует физиологические активности лекарственного средства. Однако, носитель по настоящему изобретению увеличивает стабильность лекарственного средства in vivo, одновременно минимизируя снижение физиологической активности лекарственного средства, и носитель по настоящему изобретению характеризуется тем, что он не оказывает никаких фармакологических эффектов по противодействию терапевтическим активностям лекарственного средства, конъюгированного с этим носителем, таких как апоптоз или активация комплемента, и связывание с конкретным белком.
При использовании здесь термин “Fc-фрагмент IgG4” относится к константной области 2 тяжелой цепи (CH2) и константной области 3 тяжелой цепи (CH3), исключая вариабельные области тяжелой и легкой цепи, константную область 1 тяжелой цепи (CH1) и константную область 1 легкой цепи (CL1) IgG4, но включая модифицированную шарнирную область в константной области тяжелой цепь. Кроме того, Fc-фрагмент IgG4 по настоящему изобретению может относиться к удлиненному Fc-участку, включающему часть или всю константную область 1 тяжелой цепи (CH1) и/или константную область 1 легкой цепи (CL1), за исключением вариабельных областей тяжелой и легкой цепи иммуноглобулина, поскольку Fc-фрагмент IgG4 обеспечивает по существу такой же эффект или улучшенный эффект по сравнению с эффектом нативного типа.
Кроме того, Fc-фрагмент IgG4 по настоящему изобретению включает не только свою природную аминокислотную последовательность, но также производное его последовательности (мутеин). При использовании здесь термин “мутеин Fc-фрагмента IgG4” относится к Fc-фрагменту IgG4, имеющему аминокислотную последовательность, отличающуюся от его природного типа делецией, вставкой, консервативной заменой, неконсервативной заменой по меньшей мере одного аминокислотного остатка или их комбинацией в природной аминокислотной последовательности в области, не включающей его шарнирную область. Кроме того, возможны различные типы производных, у которых удалена область, способная образовывать дисульфидную связь, удалены несколько аминокислот из N-конца природного Fc или возможно добавление остатка метионина к N-концу природного Fc. Кроме того, область связывания комплемента, например C1q-связывающая область или область ADCC (антителозависимая клеточная цитотоксичность), может быть удалена для ликвидации эффекторных функций. Способы получения мутеинов Fc-участка раскрыты в международных патентных публикациях WO 97/34631, WO 96/32478 и т.д.
Ранее был описана замена аминокислот в белках или пептидах без полного изменения активности молекул (H. Neurath, R. L. Hill, The Proteins, Academic Press, New York, 1979). Самыми обычными заменами является замена аминокислотных остатков Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Thy/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu и Asp/Gly. В некоторых случаях модификация может быть осуществлена путем фосфорилирования, сульфатирования, ацилирования, гликозилирования, метилирования, фарнезилирования, ацетилирования, амидирования и т.д.
При этом Fc-фрагмент IgG4 по настоящему изобретению может быть получен от людей, крупного рогатого скота, коз, свиней, мышей, кроликов, хомячков, крыс, морских свинок и т.д., и предпочтительно от человека.
Fc-фрагмент IgG4 по настоящему изобретению может представлять собой рекомбинантный тип Fc-фрагмента IgG4, в котором Fc-участок, происходящий из людей, крупного рогатого скота, коз, свиней, мышей, кроликов, хомячков, крыс, морских свинок и т.д., был получен из микроорганизма.
Кроме того, Fc-фрагмент IgG4 может быть в форме нативных гликанов, гликанов с увеличенным количеством по сравнению с нативным гликаном или в форме без гликанов. Увеличение, уменьшение или удаление Fc-гликанов в иммуноглобулинах может быть осуществлено с использованием обычного способа, такого как химический способ, ферментативный способ, метод генной инженерии с использованием микроорганизмов и т.д. В частности, так как Fc-участок иммуноглобулина, где гликаны удалены из Fc, демонстрирует значительное ухудшение способности связывания комплемента (c1q) и уменьшение или элиминацию антителозависимой цитотоксичности или комплементзависимой цитотоксичности, ненужные иммунные ответы in vivo не индуцируются. В связи с этим более подходящим типом Fc-фрагмента IgG4, который лучше соответствует первоначальной цели использования в качестве носителя лекарственного средства, может быть агликозилированный Fc-фрагмент IgG4.
При использовании здесь термин “дегликозилирование” относится к Fc-участку, где сахариды удаляются с помощью фермента, и “агликозилирование” относится к агликозилированному Fc-фрагменту, продуцируемому в прокариотической клетке, предпочтительно в E. coli.
Кроме того, Fc-фрагмент IgG4 по настоящему изобретению может быть модифицирован непептидным полимером. Предпочтительно, Fc-фрагмент IgG4 по настоящему изобретению может быть модифицирован полиэтиленгликолем. Fc-фрагмент IgG4, модифицированный полиэтиленгликолем, может быть получен посредством взаимодействия с полиэтиленгликолем при pH 7 или выше, предпочтительно при pH 7,5 - pH 9 и более предпочтительно при pH 8,0.
При использовании здесь термин “модифицированная шарнирная область” относится к шарнирной области, в которой удален какой-либо один остаток цистеина из цистеиновых остатков в 8-ом и 11-ом положениях аминокислотной последовательности SEQ ID NO: 1, которая представляет собой последовательность шарнирной области нативного Fc-фрагмента IgG4 и кроме того дополнительно удалена часть аминокислот.
В настоящем изобретении количество аминокислотных остатков, удаленных в шарнирной области, может находиться в диапазоне от 1 до 8, и, в частности, остатки аминокислот могут быть расположены непрерывно или быть прерваны. В частности, например, модифицированная шарнирная область по настоящему изобретению может включать делецию только одного остатка цистеина в 8-ом положении или в 11-ом положении; или делецию от 2 до 8 непрерывных или прерываемых аминокислот, включающих остаток цистеина в 8-ом положении; или делецию 2-8 непрерывных или прерываемых аминокислот, включающих остаток цистеина в 11-ом положении.
Модифицированная шарнирная область по настоящему изобретению может иметь, например, по меньшей мере одну аминокислотную последовательность из аминокислотных последовательностей, показанных ниже:
Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Pro-Ser-Cys-Pro, Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro-Ser-Pro, Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro-Ser, Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro-Pro, Lys-Tyr-Gly-Pro-Pro-Cys-Pro-Ser, Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys, Glu-Lys-Tyr-Gly-Pro-Pro-Cys, Glu-Ser-Pro-Ser-Cys-Pro, Glu-Pro-Ser-Cys-Pro, Pro-Ser-Cys-Pro, Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Ser-Cys-Pro, Lys-Tyr-Gly-Pro-Pro-Pro-Ser-Cys-Pro, Glu-Ser-Lys-Tyr-Gly-Pro-Ser-Cys-Pro, Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys, Lys-Tyr-Gly-Pro-Pro-Cys-Pro, Glu-Ser-Lys-Pro-Ser-Cys-Pro, Glu-Ser-Pro-Ser-Cys-Pro, Glu-Pro-Ser-Cys.
В типичном воплощении настоящего изобретения, для того чтобы исследовать механизм обмена цепей между IgG4, присутствующим в крысиной крови и человеческой крови, и конъюгатом модифицированного Fc-фрагмента IgG4 и физиологически активного белка по настоящему изобретению, крысиную кровь и человеческую кровь соответственно смешивали с конъюгатом Fc IgG4 и физиологически активного белка и образцы собирали в соответствии с каждой временной зоной и подвергали анализу Вестерн-блоттинга, используя антитела к физиологически активному белку. В результате было подтверждено, что молекулы, которые могут образоваться в результате обмена цепей с крысиным IgG4 или IgG4 человека, не образовывались.
Соответственно, когда модифицированный Fc-фрагмент IgG4 по настоящему изобретению используют как носитель лекарственных средств, его можно эффективно использовать для увеличения времени полужизни лекарственных средств в сыворотке и улучшения физиологической активности лекарственных средств без обмена с нативными иммуноглобулинами in vivo.
Согласно другому аспекту в настоящем изобретении предлагается нуклеиновая кислота, кодирующая модифицированный Fc-фрагмент IgG4, имеющий шарнирную область, которая мутирована так, чтобы включать только один остаток цистеина, посредством удаления части аминокислот в шарнирной области, а также вектор, включающий эту нуклеиновую кислоту.
Нуклеиновая кислота, кодирующая модифицированный Fc-фрагмент IgG4 по настоящему изобретению, включает нуклеиновые кислоты, кодирующие модифицированный Fc-фрагмент IgG4, включающий аминокислотную последовательность SEQ ID NO: 2 (Pro-Ser-Cys-Pro-Ala-Pro-Glu-Phe-Leu-Gly- Gly-Pro-Ser-Val-Phe-Leu-Phe-Pro-Pro-Lys- Pro-Lys-Asp-Thr-Leu-Met-Ile-Ser-Arg-Thr- Pro-Glu-Val-Thr-Cys-Val-Val-Val-Asp-Val- Ser-Gln-Glu-Asp-Pro-Glu-Val-Gln-Phe-Asn- Trp-Tyr-Val-Asp-Gly-Val-Glu-Val-His-Asn- Ala-Lys-Thr-Lys-Pro-Arg-Glu-Glu-Gln-Phe- Asn-Ser-Thr-Tyr-Arg-Val-Val-Ser-Val-Leu- Thr-Val-Leu-His-Gln-Asp-Trp-Leu-Asn-Gly- Lys-Glu-Tyr-Lys-Cys-Lys-Val-Ser-Asn-Lys- Gly-Leu-Pro-Ser-Ser-Ile-Glu-Lys-Thr-Ile- Ser-Lys-Ala-Lys-Gly-Gln-Pro-Arg-Glu-Pro- Gln-Val-Tyr-Thr-Leu-Pro-Pro-Ser-Gln-Glu- Glu-Met-Thr-Lys-Asn-Gln-Val-Ser-Leu-Thr- Cys-Leu-Val-Lys-Gly-Phe-Tyr-Pro-Ser-Asp- Ile-Ala-Val-Glu-Trp-Glu-Ser-Asn-Gly-Gln- Pro-Glu-Asn-Asn-Tyr-Lys-Thr-Thr-Pro-Pro- Val-Leu-Asp-Ser-Asp-Gly-Ser-Phe-Phe-Leu- Tyr-Ser-Arg-Leu-Thr-Val-Asp-Lys-Ser-Arg- Trp-Gln-Glu-Gly-Asn-Val-Phe-Ser-Cys-Ser- Val-Met-His-Glu-Ala-Leu-His-Asn-His-Tyr- Thr-Gln-Lys-Ser-Leu-Ser-Leu-Ser-Leu-Gly-Lys). Например, нуклеиновая кислота по настоящему изобретению может включать нуклеотидную последовательность SEQ ID NO: 3

При использовании здесь термин “вектор” относится к рекомбинантному вектору, способному экспрессировать целевой белок в подходящей клетке-хозяине, который представляет собой генетическую конструкцию, включающую регуляторные факторы, функционально связанные так, чтобы сделать возможной экспрессию генной вставки.
При использовании здесь термин “функционально связанный” означает, что регуляторная последовательность нуклеиновой кислоты функционально связана с последовательностью нуклеиновой кислоты, кодирующей целевой белок, так что осуществляться основные функции. Функциональное связывание с вектором может быть выполнено с помощью метода генетической рекомбинации, хорошо известного в данной области техники, и сайт-специфического расщепления ДНК, а связывание может быть легко выполнено с использованием ферментов и т.д., как правило, хорошо известных в данной области. Подходящие экспрессионный векторы могут включать последовательности регуляторных элементов экспрессии, такие как промотор, стартовый кодон, терминирующий кодон, сигнал полиаденилирования и энхансер. Стартовый кодон и терминирующий кодон должны по существу оказывать свои действия в субъекте, когда в него вводится генетическая конструкция, и должны быть в рамке считывания с кодирующей последовательностью. Обычный промотор может быть конститутивным или индуцируемым. Экспрессионный вектор также может включать селективный маркер для селекции клетки-хозяина, содержащей вектор, и для реплицируемого экспрессионного вектора он может включать точку начала репликации.
В другом аспекте настоящего изобретения предложен микроорганизм, в который вводят указанный выше вектор, способный продуцировать модифицированные Fc-фрагменты IgG4.
Для целей настоящего изобретения микроорганизм предпочтительно представляет собой эукариотическую клетку. Эукариотическая клетка может представлять собой Escherichia coli, Bacillus subtilis, Streptomyces, Pseudomonas, Proteus mirabilis, Staphylococcus и т.д., и предпочтительно Escherichia coli. Escherichia coli может представлять собой E. coli XL-1 blue, E. coli BL21 (DE3), E. coli JM109, виды E. coli DH, E. coli TOP10 и E. coli HB101 и более предпочтительно E. coli BL21 (DE3), но не ограничена ими. Когда E. coli используют в качестве клетки-хозяина, Fc-участок иммуноглобулинов может быть получен в форме, где сахариды, присутствующие в домене CH2 нативных иммуноглобулинов, изначально удалены, так как E. coli не обладает системой конъюгирования гликанов с белками. Хотя сахариды, присутствующие в домене CH2 иммуноглобулинов, не влияют на структурную стабильность иммуноглобулинов, известно, что иммуноглобулины могут связываться с клетками, экспрессирующими Fc-рецептор, и вызывать антитело-зависимую клеточную цитотоксичность, индуцировать секрецию цитокинов иммунными клетками, таким образом вызывая воспалительные ответы, и связываться с элементом C1q комплементов и индуцировать комплементсвязывающие реакции. Соответственно, если Fc-участки агликозилированных иммуноглобулинов образуются и конъюгируют с терапевтическими белками, концентрация терапевтических белков в сыворотке может поддерживаться в течение длительного периода времени, не индуцируя эффекторных функций иммуноглобулинов.
Метод трансформации прокариотических клеток указанным выше вектором может включать любой метод, который может вводить нуклеиновые кислоты в клетку, и трансформацию можно выполнять путем выбора стандартной методики, подходящей для данной клетки-хозяина, известной в данной области техники. Примеры метода могут включать электропорацию, слияние протопластов, преципитацию с помощью фосфата кальция (CaPO4), преципитацию с помощью хлорида кальция (CaCl2), перемешивание с использованием волокон карбида кремния, ПЭГ (полиэтиленгликоля), декстрансульфата, липофектамина и т.д., но не ограничены ими.
Микроорганизм, с введенным рекомбинантным экспрессионным вектором можно культивировать обычным способом.
Процесс культивирования можно использовать после легкой корректировки в соответствии с выбранным микроорганизмом. Как правило, среда, используемая для культивирования, должна содержать все питательные вещества, необходимые для роста и выживания клеток. Среда может содержать различные источники углерода, источники азота и микроэлементные компоненты. Примеры источников углерода могут включать углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, мальтоза, крахмал и целлюлоза; жиры, такие как соевое масло, подсолнечное масло, касторовое масло, кокосовое масло; жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота; спирты, такие как глицерин и этанол; и органические кислоты, такие как уксусная кислота. Такие источники углерода можно использованы по отдельности или в комбинации. Примеры источников азота могут включать органические источники азота, такие как пептон, дрожжевой экстракт, мясной соус, солодовый экстракт, кукурузный экстракт (CSL) и жмых соевых бобов; и неорганические источники азота, такие как мочевина, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Эти источники азота можно использовать по отдельности или в комбинации. В указанной выше среде в качестве источников фосфора могут содержаться дигидрофосфат, гидрофосфат и соответствующие натрий-содержащие соли. Кроме того могут содержаться соли металлов, такие как сульфат магния или сульфат железа. Кроме того, могут также содержаться аминокислоты, витамины и соответствующие предшественники. Во время периода культивирования рН культуры можно корректировать путем добавления к культуре подходящим образом таких соединений, как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота и серная кислота. Кроме того, во время периода культивирования можно добавлять пеногаситель, такой как полигликолевый сложный эфир жирной кислоты, для предотвращения пенообразования. Дополнительно, для того чтобы поддерживать аэробное состояние культуры, можно вводить в культуру кислород или кислород-содержащий газ (например воздух). Температура культуры может, как правило, составлять от 20°C до 45°C и предпочтительно от 25°C до 40°C. Кроме того, может быть использован ферментатор. Когда белки получают с использованием ферментатора, следует учитывать различные факторы, включающие скорость роста и количество экспрессированных клеткой-хозяином продуктов. Экспрессия белка может быть индуцирована добавлением IPTG (изопропилтиогалактозид) или тому подобного в подходящих условиях культивирования. Модифицированный Fc-фрагмент IgG4 по настоящему изобретению может сверхэкспрессироваться в клетке-хозяине в форме агрегата или может экспрессироваться в водной форме. Независимо от типа экспрессии, белки могут быть очищены с помощью обычного способа очистки белков.
Соответственно, в другом аспекте настоящего изобретения предложен способ получения модифицированного Fc-фрагмента IgG4, и этот способ включает культивирование микроорганизма с введенной в него нуклеиновой кислотой, кодирующей модифицированный Fc-фрагмент IgG4.
В соответствии с указанным выше способом, промышленное применение указанного выше Fc-фрагмента IgG4, продуцируемого в прокариотической клетке, такой как E. coli, не имеет особых ограничений. Примером применения может быть его использование в качестве носителя для образования конъюгата с произвольным лекарственным средством.
Соответственно, в другом аспекте настоящего изобретения предлагается лекарственное средство и конъюгат лекарственного средства, в котором модифицированный Fc-фрагмент IgG4 конъюгирован с ним посредством линкера.
При использовании здесь "конъюгат лекарственного средства" или "конъюгат" означает, что по меньшей мере одно лекарственное средство объединено по меньшей мере с одним из модифицированных Fc-фрагментов IgG4.
При использовании здесь лекарственное средство относится к веществу, которое может демонстрировать терапевтические активности при введении людям или животным, и оно может включать полипептид, соединение, экстракт, нуклеиновую кислоту и т.д., но не ограничено ими. Предпочтительно, лекарственное средство представляет собой полипептидное лекарственное средство.
При использовании здесь, физиологически активное полипептидное лекарственное средство, полипептидное лекарственное средство и белковое лекарственное средство следует понимать как имеющие одинаковое значение, и они характеризуются тем, что являются физиологически активными типами, проявляющими антагонизм к различным физиологическим явлениям in vivo.
Тип конъюгата, в котором Fc-фрагмент IgG4 конъюгирован с лекарственным средством, конкретно не ограничен, и Fc-фрагмент IgG4 и лекарственное средство могут быть конъюгированы в различных соотношениях.
В настоящем изобретении линкер может относиться как к пептидному линкеру, так и к непептидному линкеру, предпочтительно к непептидному линкеру, и более предпочтительно к непептидному полимеру.
Непептидный полимер относится к биосовместимому полимеру, с которым конъюгированы по меньшей мере два повторяющихся звена, и повторяющиеся звенья соединены произвольными ковалентными связями, отличными от пептидных связей. Непептидный полимер может быть выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимера этиленгликоля и пропиленгликоля, полиоксиэтилированного полиола, поливинилового спирта, полисахарида, декстрана, поливинилэтилового эфира, биоразлагаемого полимера, такого как полимолочная кислота (PLA) и сополимер поли-молочная-гликолевая кислота (PLGA), липидного полимера, хитинов, гиалуроновой кислоты и их комбинации, и предпочтительно полиэтиленгликоля. Производные, известные в данной области, и производные, которые могут быть легко получены с использованием методик, известных в данной области техники, также включены в объем настоящего изобретения.
В настоящем изобретении непептидный полимер может иметь две или три реакционноспособные концевые группы, и концевая реакционноспособная группа непептидного полимера предпочтительно выбрана из группы, состоящей из реакционноспособной альдегидной группы, пропионовой альдегидной группы, бутилальдегидной группы, малеимидной группы и сукцинимидного производного. Примеры сукцинимидного производного могут включать сукцинимидилпропионат, гидроксилсукцинимидил, сукцинимидилкарбоксиметил и сукцинимидилкарбонат. В частности, когда непептидный полимер в качестве реакционноспособной группы содержит реакционноспособную альдегидную группу на своем конце, это может свести к минимуму неспецифические взаимодействия и является эффективным в его соответствующем связывания с физиологическим полипептидом и Fc-фрагментом иммуноглобулина. Конечный продукт, продуцируемый путем восстановительного алкилирования посредством альдегидного связывания, является более стабильным, чем присоединенный посредством амидной связи. Альдегидная реакционноспособная группа селективно взаимодействует на N-конце при низком pH, и при высоком pH, например pH 9,0, она может образовать ковалентную связь с остатком лизина.
Концевые реакционноспособные группы непептидного полимера могут быть одинаковыми или отличаться друг от друга. Например, непептидный полимер может иметь малеимидную группу на одном конце, и при этом иметь альдегидную группу, пропиональдегидную группу или бутилальдегидную группу на другом конце. При использовании полиэтиленгликоля или непептидного полимера, имеющего гидроксильную реакционноспособную группу на обоих концах, конъюгат по настоящему изобретению может быть получен путем активации гидроксильной группы с помощью различных реакционноспособных групп в соответствии с известной химической реакцией или с использованием полиэтиленгликоля, имеющего модифицированную реакционноспособную группу, который имеется в продаже.
Что касается физиологически активных полипептидов для применения путем связывания с модифицированным Fc-фрагментом IgG4 по настоящему изобретению, любой из них, требующий увеличения времени полужизни в сыворотке может быть использован без ограничения. Например, могут быть использованы различные физиологически активные полипептиды, такие как цитокины, интерлейкины, интерлейкин-связывающие белки, ферменты, антитела, факторы роста, факторы регуляции транскрипции, факторы свертывания крови, вакцины, структурные белки, лигандные белки или рецепторы, антигены клеточной поверхности, антагонисты рецептора, их производные и их аналоги.
Более конкретно, физиологически активные полипептиды могут включать гормон роста человека; гормон, высвобождающий гормон роста; пептид, высвобождающий гормон роста; интерфероны и рецепторы интерферона (например интерферон-α, -β и -γ, растворимый рецептор интерферона I типа и т.д.), колониестимулирующие факторы, интерлейкины (например интерлейкин-1, -2, -3, -4, -5, -6, -7, -8, -9, -10, -11, -12, -13, -14, -15, -16, -17, -18, -19, -20, -21, -22, -23, -24, -25, -26, -27, -28, -29, -30 и т.д.) и рецепторы интерлейкина (например рецептор IL-1, рецептор IL-4, и т.д.), ферменты (например глюкоцереброзидазу, идуронат-2-сульфатазу, α-галактозидазу-А, агалзидазу α, β, α-L-идуронидазу, бутирилхолинэстеразу, хитиназу, глутаматдекарбоксилазу, имиглюцеразу, липазу, уриказу, ацетилгидролазу фактора активации тромбоцитов, нейтральную эндопептидазу, миелопероксидазу и т.д.), интерлейкин- и цитокин -связывающие белки (например IL-18bp, TNF-связывающий белок и т.д.), фактор активации макрофагов, макрофагальный пептид, B-клеточные факторы, Т-клеточные факторы, белок A, факторы ингибирования аллергии, гликопротеины некроза, иммунотоксины, лимфотоксины, факторы некроза опухоли, опухолевые супрессоры, трансформирующие факторы роста, α-1- антитрипсин, альбумин, α-лактальбумин, аполипопротеин-Е, эритропоэтин, высокогликозилированный эритропоэтин, ангиопоэтины, гемоглобины, тромбин, пептид, активирующий рецептор тромбина, тромбомодулин, фактор коагуляции крови VII, фактор коагуляции крови VIIα, фактор коагуляции крови VIII, фактор коагуляции IX, фактор коагуляции крови XIII, активаторы плазминогена, фибрин-связывающий пептид, урокиназу, стрептокиназу, гирудин, протеин C, C-реактивный белок, ингибитор ренина, ингибитор коллагеназы, супероксиддисмутазу, лептин, тромбоцитарный фактор роста, эпителиальный фактор роста, эпидермальный фактор роста, ангиостатин, ангиотензин, костный морфогенетический фактор роста, костный морфогенетический белок, кальцитонин, инсулин и производное инсулина, атриопептин, хрящевой индуцирующий фактор, элкатонин, активирующий фактор соединительной ткани, ингибитор пути тканевого фактора, фолликулостимулирующий гормон, лютеинизирующий гормон, гормон высвобождения лютеинизирующего гормона, факторы роста нервов (например фактор роста нервов, цилиарный нейротрофический фактор, фактор аксогенезиса-1, мозговой натрийуретический пептид, нейротрофический фактор глиальных клеток, нетрин, фактор ингибирования нейтрофилов, нейротрофические факторы, неврин и т.д.), паратиреоидный гормон, релаксин, секретин, соматомедин, инсулиноподобный фактор роста, адренокортикальный гормон, глюкагон, инсулинотропные пептиды, включающие глюкагон-подобный пептид-1 и экзендин-4, инкретины, секретируемые в кишечнике, адипоциты, включающие лептоны, и нейроцитокины, эффективные для метаболического синдрома, холецистокинин, полипептиды поджелудочной железы, гастрин-высвобождающие пептиды, кортикотропин-высвобождающий фактор, тиреостимулирующий гормон, аутотаксин, лактоферрин, миостатин, рецепторы (например TNFR (P75), TNFR (P55), рецептор IL-1, рецептор VEGF, рецептор активации B-клеток и т.д.), антагонисты рецепторов (например IL1-Ra, и т.д.), антигены клеточной поверхности (например CD 2, 3, 4, 5, 7, 11a, 11b, 18, 19, 20, 23, 25, 33, 38, 40, 45, 69, и т.д.), моноклональные антитела, поликлональные антитела, фрагменты антител (например scFv, Fab, Fab', F(ab')2 и Fd), вирусный вакцинный антиген и т.д., но не ограничиваются ими. Физиологически активный полипептид, применимый в настоящем изобретении, может быть природного типа; полученным посредством генетической рекомбинации в прокариотической клетке, такой как E. coli, или в эукариотической клетке, такой как дрожжевая клетка, клетка насекомого или клетка животного; или производным, которое имеет активность, эквивалентную природному типу и мутацию по меньшей мере в одном положении аминокислоты.
Модифицированный Fc-фрагмент IgG4 по настоящему изобретению может продуцироваться в клетке после соединения его с физиологически активным полипептидом в виде одной последовательности генов с использованием метода прямой генетической рекомбинации или Fc-фрагмент IgG4 может продуцироваться независимо и конъюгирован с лекарственным средством, таким как физиологически активный полипептид, in vitro.
В еще одном аспекте настоящего изобретения предлагается фармацевтическая композиция, содержащая указанный выше конъюгат лекарственного средства по настоящему изобретению в качестве активного ингредиента.
Фармацевтическая композиция, содержащая конъюгат по настоящему изобретению, может содержать фармацевтически приемлемый носитель. Примеры фармацевтически приемлемого носителя могут включать связывающее вещество, смазывающее вещество, разрыхлитель, эксципиент, солюбилизирующий агент, диспергирующий агент, стабилизатор, суспендирующий агент, краситель, ароматизатор и т.д.; для инъекционных композиций могут быть смешаны для применения буферный агент, консервант, анальгетик, изотонический агент, стабилизатор и т.д.; и для местных композиций могут быть использованы основа, эксципиент, смазывающее вещество, консервант и т.д.
Разный тип препарата фармацевтической композиции по настоящему изобретению может быть получен путем комбинации с фармацевтически приемлемым носителем. Например, для перорального введения фармацевтическая композиция может быть приготовлена в виде таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток и т.д. Для инъекций фармацевтическая композиция может быть приготовлена в виде препарата в однодозовых ампулах или в многодозовых контейнерах. Фармацевтическая композиция может также быть приготовлена в виде растворов, суспензий, таблеток, капсул и препаратов с замедленным высвобождением.
При этом примеры подходящих носителей, эксципиентов и разбавителей могут включать лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритрит, мальтит, крахмал, гуммиарабик, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, микрокристаллическую целлюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния, минеральное масло и т.д. Кроме того, композиция по настоящему изобретению может дополнительно содержать наполнитель, антикоагулянт, смазывающее вещество, увлажнитель, ароматизатор, эмульгатор, консервант, и т.д.
В настоящем изобретении фактическая доза лекарственных средств, где Fc-фрагмент IgG4 используется в качестве носителя, будет определяться на основе типов лекарственных средств, используемых в качестве активных ингредиентов, наряду с различными факторами, такими как заболевание, подлежащее лечению, путь введения, возраст, пол и масса пациента, тяжесть заболевания и т.д. Так как фармацевтическая композиция по настоящему изобретению имеет превосходную продолжительность действия in vivo, количество и частоту введений фармацевтической композиции по настоящему изобретению можно существенно снизить.
Фармацевтическая композиция по настоящему изобретению может быть введена различными путями.
При использовании здесь термин “введение” относится к введению конкретного вещества пациенту подходящим образом и конъюгированное лекарственное средство по настоящему изобретению может быть введено любым из обычных путей, при условии, что это лекарственное средство может достигать ткани-мишени. Например, может быть осуществлено внутрибрюшинное, внутривенное, внутримышечное, подкожное, внутрикожное, пероральное, местное, интраназальное, внутрилегочное и ректальное введение, но путь введения не ограничивается ими. Однако, поскольку пептиды перевариваются при пероральном введении, активные ингредиенты композиции для перорального введения должны иметь покрытие или приготовлены в виде препарата с защитой от разрушения в желудке. Предпочтительно настоящая композиция может быть введена в инъекционной форме. Кроме того, фармацевтическую композицию можно вводить, используя определенное устройство, способного транспортировать активные ингредиенты в целевую клетку.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение будет описано более подробно со ссылкой на следующие ниже Примеры. Однако эти Примеры приведены только в иллюстративных целях и изобретение не следует ограничивать этими Примерами.
Пример 1. Получение конъюгата человеческий гранулоцитарный колониестимулирующий фактор-ПЭГ-иммуноглобулин
<1-1> Конструирование вектора, экспрессирующего Fc-домен IgG4
Для клонирования Fc-участка тяжелой цепи, включающей шарнирную область IgG4, выполняли RT-PCR с использованием клеток крови, собранных из человеческой крови, в качестве матрицы, как описано ниже. Сначала выделяли общую РНК из крови при примерно pH 6, и ген амплифицировали на основе РНК-матрицы с использованием набора Qiamp RNA blood kit (Qiagen). В частности, пару SEQ ID NO: 4 (gggcatatgc catcatgccc agcacctgag ttcctgggg) и SEQ ID NO: 5 (gggggatccc tatttaccca gagacaggga ga) использовали в качестве праймеров. Чтобы облегчить последующий процесс, домен, способный узнавать сайты рестрикции NdeI и ATG, стартовый кодон, необходимый для экспрессии белка, встраивали в праймеры, и домен, способный узнавать сайты рестрикции BamHI, встраивали в 3-праймер SEQ ID NO: 5. Продукт с Fc-участком, амплифицированный с их помощью, расщепляли с использованием NdeI и BamHI, соответственно, и субклонировали в pET22b (Novagen Co., Ltd.) с получением плазмиды. Плазмида была сконструирована таким образом, что Fc-фрагмент IgG4 мог включать шарнирную последовательность, где удалены аминокислотные остатки в 1-8-ом положениях полной аминокислотной последовательности Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro-Ser-Cys-Pro в Fc-шарнире IgG4.
Плазмиду, полученную в данном Примере, назвали “pmHMC001”, и результат анализа ее последовательности показал, что нуклеиновая кислота, кодирующая Fc-фрагмент IgG4, имеет нуклеотидную последовательность SEQ ID NO: 3 и Fc-фрагмент IgG4 имеет аминокислотную последовательность SEQ ID NO: 2 во время экспрессии.
Полученный таким образом экспрессионный вектор использовали для трансформации E. coli BL21 (DE3) и тем самым получали трансформант E. coli - E. coli BL21/pmHMC001 (HMC001).
<1-2> Экспрессия и очистка Fc-участка IgG4
Трансформант микроорганизма, полученный в Примере <1-1>, инокулировали в ферментатор (Marubishi Co., Ltd.) для ферментации и исследовали экспрессию Fc-фрагмента IgG4 .
Сначала указанные выше трансформанты, помещенные в 100 мл среды LB, культивировали на водяной бане со встряхиванием в течение ночи и затем инокулировали в ферментатор для продолжения культивирования. Ферментатор поддерживали при 35°C или 28°C и культивирование начинали путем встряхивания при 500 оборотах в минуту с подачей туда воздуха при 20 об/об/мин для предотвращения возникновения анаэробного состояния. В ходе ферментации недостаточные для роста микроорганизма источники энергии пополняли, используя глюкозу и дрожжевой экстракт, в соответствии с ферментационным состоянием микроорганизма, и экспрессию индуцировали путем добавления индуктора IPTG (изопропилтиогалактозид), когда значение OD при 600 нм достигала 80. Культивирование продолжали в течение 40-45 часов, пока значение OD при 600 нм не достигало диапазона от 100 до 120, с получением высококонцентрированной культуры.
Экспрессию Fc IgG4 в трансформанте E. coli подтверждали с помощью эксперимента, описанного ниже.
Для того чтобы подтвердить завершенную экспрессию Fc IgG4 в цитоплазме, часть ферментационной жидкости смешивали с равным количеством 2x белкового капельного буфера и подвергали электрофорезу на 15% SDS-PAGE (Criterion Gel, Bio-Rad). В результате было подтверждено, что Fc IgG сверхэкспрессируется в полученном трансформанте. Было показано, что сверхэкспрессированный белок образует коагулянты, и белок очищали посредством рефолдинга и осуществляли пропускание коагулянтов через колонку таким же образом. Сначала 10 г клеток растворяли в 100 мл лизирующего буфера (10 мМ Tris, pH 9,0, 1 мМ EDTA, 0,5% Triton X-100 и 0,2 M NaCl) и затем подвергали ультразвуковой обработке. Полученный продукт подвергали центрифугированию при 10000 оборотов в минуту в течение 20 минут для разделения на растворимую и нерастворимую фракции, и 2 г нерастворимого коагулянта растворяли в 20 мл буфера для солюбилизации (6 M гуанидин и 50 мМ Tris) и затем оставляли взаимодействовать в течение 30 минут при 4 при осторожном встряхивании. По окончании реакции полученный продукт разбавляли путем добавления 10 объемов буфера для рефолдинга (2 M мочевины, 50 мМ Tris, 0,25 M аргинина и 3 мМ цистеина, pH 9,0) и затем оставляли взаимодействовать в течение ночи при осторожном встряхивании. По завершении реакции в образце обеспечивали свежий буфер 10 мМ Tris-HCl (pH 8,0), используя Sephadex G25. Образец с замененным буфером элюировали в градиенте концентрации Tris-HCl (pH 8,0) и NaCl, используя DEAE-FF (GE healthcare), и фенил-FF (GE healthcare) элюировали градиентом концентрации сульфата аммония и 10 мМ Tris-HCl (pH 7,5), для того чтобы удалить большое количество мультимеров и мономеров. Для последующего пропускания через колонку полученный продукт обессоливали с помощью 10 мМ Tris (pH 7,5), используя Sephadex G25 (GE healthcare), и затем для получения Fc IgG4 с высокой степенью чистоты, 15Q (GE healthcare) элюировали градиентом концентрации 10 мМ Tris-HCl (pH 7,5) и NaCl, и наконец получали Fc IgG4 .
<1-3> Получение конъюгата лекарственного средства I
1) Получение конъюгата гранулоцитарных колониестимулирующих факторов и PEG
ALD-PEG-ALD (Shearwater Inc., USA), поли(этиленгликоль), имеющий молекулярную массу 3,4 кДа, с альдегидными реакционноспособными группами на обоих концах добавляли в 100 мМ фосфатный буфер, в котором были растворены гранулоцитарные колониестимулирующие факторы в концентрации 5 мг/мл, так что молярное соотношение гранулоцитарные колониестимулирующие факторы:PEG составляло 1:5. Цианоборгидрид натрия (NaCNBH3), восстанавливающий агент, добавляли до конечной концентрации 20 мМ и проводили реакцию в течение 3 часов при 4 при медленном перемешиванием. Чтобы получить конъюгат, в котором PEG селективно конъюгирован с аминоконцом гранулоцитарных колониестимулирующих факторов и PEG и гранулоцитарные колониестимулирующие факторы конъюгированы в соотношении 1:1, реакционную смесь подвергали гель-проникающей хроматографии Superdex (Superdex R, Pharmacia, USA). Колониестимулирующие факторы очищали, используя 10 мМ калий-фосфатный буфер (pH 6,0) в качестве раствора для элюирования, при этом гранулоцитарные колониестимулирующие факторы, которые не были конъюгированы с PEG, непрореагировавший PEG и димерные побочные продукты, где два гранулоцитарных колониестимулирующих фактора были конъюгированы с PEG, были удалены. Очищенный конъюгат гранулоцитарный колониестимулирующий фактор-PEG концентрировали до 5 мг/мл.
2) Образование конъюгата между конъюгатом гранулоцитарный колониестимулирующий фактор-PEG и Fc-фрагментом IgG4
Fc-фрагмент IgG4 по настоящему изобретению растворяли в 100 мМ фосфатном буфере. Для конъюгирования Fc-фрагмента IgG4 с альдегидными реакционноспособными группами очищенного выше конъюгата гранулоцитарный колониестимулирующий фактор-PEG, конъюгат гранулоцитарный колониестимулирующий фактор-PEG добавляли к буферу, содержащему Fc-фрагмент IgG4, так что молярное соотношение конъюгат гранулоцитарного колониестимулирующего фактора-PEG : Fc-фрагмент IgG4 составляло 1:5. К нему добавляли восстанавливающий агент, цианоборгидрид натрия (NaCNBH3), до конечной концентрации 20 мМ, и реакционная смесь взаимодействовала в течение 20 часов при 4 при медленном перемешивании. После завершения реакции конъюгации непрореагировавшее вещество и побочные продукты удаляли, и конъюгат гранулоцитарный колониестимулирующий фактор-PEG-иммуноглобулиновый белок очищали посредством анионообменной хроматографии. Конъюгат гранулоцитарный колониестимулирующий фактор-PEG-Fc-фрагмент IgG4 очищали путем добавления вышеприведенной реакционной смеси к DEAE колонке (Pharmacia, USA), которая была уравновешена 20 мМ Tris буфером (pH 7,5), с последующим промыванием тем же буфером, содержащим 1 M NaCl, с использованием метода линейного градиента концентрации (концентрация NaCl: 0 M → 0,5 M). Для удаления небольшого количества непрореагировавших иммуноглобулинов и гормона роста человека, смешанного в виде примесей с фракцией таким образом полученного конъюгата гранулоцитарный колониестимулирующий фактор-PEG-Fc-фрагмент IgG4, дополнительно проводили катионообменную хроматографию. Фракцию конъюгата гранулоцитарный колониестимулирующий фактор-PEG-Fc-фрагмент IgG4 вносили на polyCAT колонку (PolyLC, USA), которая была уравновешена 10 мМ ацетата натрия (pH 4,5) и дополнительно очищали путем пропускания 10 мМ натрий-ацетатного буфера (pH 4,5), содержащего 1 M NaCl, метода линейного градиента концентрации (концентрация NaCl: 0 M → 0,5 M), и посредством этого конъюгат гранулоцитарный колониестимулирующий фактор-PEG-Fc-фрагмент IgG4 (HM10460A) был получен чистым.
Пример 2. Подтверждение обмена цепей между конъюгатом человеческий гранулоцитарный колониестимулирующий фактор-PEG-иммуноглобулин и человеческим IgG4 в крови крысы
Человеческий IgG4 в количестве 2 мг метили биотином путем смешивания с 20 мг/мл раствора биотин-7-NHL в молекулярном соотношении 1:10 и очищали с помощью набора для мечения белка биотином Biotin Protein Labeling Kit (Roche). Кровь, собранную из нормальных крыс, обрабатывали гепарином для предупреждения коагуляции и добавляли пенициллин-стрептомицин (1% об/об). 1,5 мг меченого биотином IgG4 и 1,32 мг HM10460A добавляли в 3 мл крови, смешивали, и смесь аликвотировали в 6 пробирок (0,5 мл/пробирка) и инкубировали в инкубаторе при 37°C. По одной пробирке извлекали во временные точки 0 часов, 4 часа, 10 часов, 24 часа и 48 часов, соответственно, и из них отделяли плазму и хранили при -20°C. Каждый из образцов плазмы и стандартных веществ смешивали с невосстанавливающим образец белка буфере, и полученный продукт был подвергнут SDS-PAGE с использованием полиакриламидного геля с градиентом концентрации 4%-15%. Меченный биотином IgG4 и HM10460A использовали в качестве стандартных веществ. Гель после завершения электрофореза подвергали блоттингу на PVDF (поливинилиденфторидной) мембране (Immobilon-P, MILLIPORE) и анализировали с использованием антител против человеческого GCSF (гранулоцитарный колониестимулирующий фактор) и стрептавидин-HRP (пероксидаза хрена). Что касается условий связывания антител, то антитела против Fc IgG человека (Sigma) использовали в условиях блокирования - 5% обезжиренном молоке после разведения в соотношении 1:150000, антитела против GCSF человека (Human G-CSF Assay Kit. IBL) в условиях блокирования - 1% обезжиренного молока после разведения в соотношении 1:2000 и стрептавидин-HRP в условиях блокирования - 5% обезжиренном молоке после разведения в соотношении 1:5000 соответственно. Было подтверждено, что HM10460A образует димеры (94 кДа), которые имеют два G-CSF на каждый Fc-фрагмент IgG4, и Fc-фрагменты IgG4 (50 кДа), путем механизма обмена цепей между самими HM10460A.
В противоположность этому, когда HM10460A индуцирует реакцию взаимного обмена цепей между HM10460A и человеческим IgG4, ожидалось, что образуются молекулы размером 100 кДа и 122 кДа. Однако эти молекулы не наблюдались при вестерн-блоттинге. Напротив, при анализе с помощью стрептавидин-HRP, полоса 75 кДа появлялась на дорожке человеческого IgG4 и это подтверждает образование мономеров из человеческого IgG4, который сам по своей природе является димером человеческого IgG4 (Фиг. 1).
Пример 3. Подтверждение обмена цепей между конъюгатом человеческий гранулоцитарный колониестимулирующий фактор-PEG-иммуноглобулин и человеческим IgG4 в крови человека
К человеческой крови, собранной от донора, добавляли пенициллин-стрептомицин (1% об/об). 1,32 мг HM10460A, полученного в Примере 1, смешивали с 3 мл крови, и смеси аликвотировали в 6 пробирок (0,5 мл/пробирка) и инкубировали в инкубаторе при 37°C. По одной пробирке вынимали в следующие временные точки 0 часов, 4 часа, 10 часов, 24 часа и 48 часов соответственно, и из них отделяли плазму и хранили при -20°C перед анализом. Каждый из образцов плазмы, а также HM10460A и Fc-фрагмент IgG4 в различных концентрациях в качестве контрольных веществ, смешивали с невосстанавливающим образец белка буфере, и полученный продукт подвергали SDS-PAGE с использованием полиакриламидного геля с градиентом концентрации 4%-15%. Гель после завершения электрофореза подвергали блоттингу на PVDF мембране (Immobilon-P, MILLIPORE) и анализировали с использованием антител против человеческого GCSF. Антитела против человеческого GCSF (Human G-CSF Assay Kit, IBL) использовали в условиях блокирования - 1% обезжиренном молоке после разведения в соотношении 1:2000. Как и в крови крыс, молекулы размером 100 кДа и 122 kD, которые могли образоваться в результате обмена цепей с человеческим IgG4, не образовались (Фиг. 2).
Специалистам в данной области понятно, что настоящее изобретение может быть воплощено в других конкретных формах без отклонения от его сущности или существенных характеристик. Описанные воплощения следует рассматривать только как иллюстративные и не ограничивающие во всех отношениях. Объем настоящего изобретения, таким образом, определяется прилагаемой формулой изобретения, а не предшествующим описанием изобретения. Все изменения, которые подпадают под значение и диапазон эквивалентности формулы изобретения, должны быть включены в объем настоящего изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> HANMI PHARM. CO., LTD.
<120> FC-фрагмент IGG4, содержащий модифицированную шарнирную область
<130> OPA14085
<140> 10-2013-0063029
<141> 2013-05-31
<160> 21
<170> KopatentIn 2.0
<210> 1
<211> 12
<212> PRT
<213> HOMO SAPIENS
<400> 1
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro
1 5 10
<210> 2
<211> 221
<212> PRT
<213> HOMO SAPIENS
<400> 2
Pro Ser Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu
1 5 10 15
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
20 25 30
Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln
35 40 45
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
50 55 60
Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu
65 70 75 80
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
85 90 95
Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys
100 105 110
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
115 120 125
Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
130 135 140
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
145 150 155 160
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
165 170 175
Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln
180 185 190
Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
195 200 205
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
210 215 220
<210> 3
<211> 663
<212> ДНК
<213> HOMO SAPIENS
<400> 3
ccatcatgcc cagcacctga gttcctgggg ggaccatcag tcttcctgtt ccccccaaaa 60
cccaaggaca ccctcatgat ctcccggacc cctgaggtca catgcgtggt ggtggacgtg 120
agccaggaag accctgaggt ccagttcaac tggtacgtgg acggcgtgga ggtgcataat 180
gccaagacaa agccgcggga ggagcagttc aacagcacgt accgtgtggt cagcgtcctc 240
accgtcctgc accaggactg gctgaatggc aaggagtaca agtgcaaggt ctccaacaaa 300
ggcctcccat cctccatcga gaaaaccatc tccaaagcca aagggcagcc ccgagaacca 360
caggtgtaca ccctgccccc atcccaggag gagatgacca agaaccaggt cagcctgacc 420
tgcctggtca aaggcttcta tcccagcgac atcgccgtgg agtgggagag caatgggcag 480
ccggagaaca actacaagac cacgcctccc gtgctggact ccgacggctc cttcttcctc 540
tacagcaggc taaccgtgga caagagcagg tggcaggagg ggaacgtctt ctcatgctcc 600
gtgatgcatg aggctctgca caaccactac acacagaaga gcctctccct gtctctgggt 660
aaa 663
<210> 4
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области
<400> 4
Glu Ser Lys Tyr Gly Pro Pro Pro Ser Cys Pro
1 5 10
<210> 5
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области
<400> 5
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Pro
1 5 10
<210> 6
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области
<400> 6
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser
1 5 10
<210> 7
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области
<400> 7
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
1 5 10
<210> 8
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области
<400> 8
Lys Tyr Gly Pro Pro Cys Pro Ser
1 5
<210> 9
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области
<400> 9
Glu Ser Lys Tyr Gly Pro Pro Cys
1 5
<210> 10
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области
<400> 10
Glu Lys Tyr Gly Pro Pro Cys
1 5
<210> 11
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области
<400> 11
Glu Ser Pro Ser Cys Pro
1 5
<210> 12
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области
<400> 12
Glu Pro Ser Cys Pro
1 5
<210> 13
<211> 4
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области
<400> 13
Pro Ser Cys Pro
1
<210> 14
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области
<400> 14
Glu Ser Lys Tyr Gly Pro Pro Ser Cys Pro
1 5 10
<210> 15
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области
<400> 15
Lys Tyr Gly Pro Pro Pro Ser Cys Pro
1 5
<210> 16
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области
<400> 16
Glu Ser Lys Tyr Gly Pro Ser Cys Pro
1 5
<210> 17
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области
<400> 17
Glu Ser Lys Tyr Gly Pro Pro Cys
1 5
<210> 18
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области
<400> 18
Lys Tyr Gly Pro Pro Cys Pro
1 5
<210> 19
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области
<400> 19
Glu Ser Lys Pro Ser Cys Pro
1 5
<210> 20
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области
<400> 20
Glu Ser Pro Ser Cys Pro
1 5
<210> 21
<211> 4
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области
<400> 21
Glu Pro Ser Cys
1
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Жидкая композиция | 2021 |
|
RU2838973C1 |
| САЙТ-СПЕЦИФИЧЕСКАЯ КОНЪЮГАЦИЯ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО ПОСРЕДСТВОМ ГЛИКОИНЖЕНЕРИИ | 2014 |
|
RU2831409C2 |
| КОНЪЮГАТЫ АНТИТЕЛ С ЛЕКАРСТВЕННЫМИ ВЕЩЕСТВАМИ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ РАКОВЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2799547C2 |
| НОВЫЙ МОДИФИЦИРОВАННЫЙ СЛИТЫЙ БЕЛОК FC-ФРАГМЕНТА ИММУНОГЛОБУЛИНА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2800919C2 |
| Композиция для лечения гиперлипидемии, содержащая производное оксинтомодулина | 2013 |
|
RU2768853C1 |
| Слитый белок человеческого фактора свертывания IХ (FIX), способ его получения и применения | 2017 |
|
RU2736339C1 |
| ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ КОНЪЮГАТА ТРОЙНОГО АГОНИСТА ДЛИТЕЛЬНОГО ДЕЙСТВИЯ, ОБЛАДАЮЩЕГО АКТИВНОСТЯМИ В ОТНОШЕНИИ ВСЕХ ИЗ РЕЦЕПТОРОВ ГЛЮКАГОНА /GLP-1/GIP, ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ ЛЕГКОГО | 2020 |
|
RU2829342C1 |
| АНТИТЕЛА ПРОТИВ CD79b, КОНЪЮГАТЫ С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2805251C2 |
| Комплекс аналога инсулина со сниженной аффинностью к инсулиновому рецептору и его применение | 2018 |
|
RU2779462C2 |
| Слитый белок, содержащий вариант CCL3, и его применение | 2017 |
|
RU2727715C2 |
Изобретение относится к области биохимии, в частности к модифицированному Fc-фрагменту IgG4, имеющему низкий риск индуцирования обмена цепей и образования мономера in vivo, а также к нуклеиновой кислоте, его кодирующей. Также раскрыты вектор, клетка-хозяин, содержащие вышеуказанную нуклеиновую кислоту, а также способ получения Fc-фрагмента IgG4 с помощью вышеуказанной клетки. Изобретение также относится к конъюгату лекарственного средства, содержащему вышеуказанный Fc-фрагмент IgG4, конъюгированный с лекарственным средством с помощью линкера. Изобретение позволяет эффективно минимизировать эффекторную функцию IgG4 Fc и обмен цепей с IgG in vivo и может сохранять in vivo активность конъюгата лекарственного средства и улучшать его пролонгированное высвобождение in vivo. 6 н. и 6 з.п. ф-лы, 2 ил., 3 пр.
1. Модифицированный Fc-фрагмент IgG4, имеющий низкий риск индуцирования обмена цепей и образования мономера in vivo и содержащий шарнирную область, представленную любой из аминокислотных последовательностей SEQ ID NO: 4, 10, 11, 12, 14, 15, 19, 20 и 21, где указанная шарнирная область содержит только один остаток цистеина.
2. Модифицированный Fc-фрагмент IgG4 по п. 1, который является агликозилированным.
3. Нуклеиновая кислота, кодирующая Fc-фрагмент IgG4 по п. 1.
4. Экспрессионный вектор, содержащий нуклеиновую кислоту по п. 3.
5. Клетка-хозяин Е. coli для продуцирования модифицированного Fc-фрагмента IgG4 по п. 1, в которую введен вектор по п. 4.
6. Способ получения Fc-фрагмента IgG4 по п. 1 или 2, включающий культивирование микроорганизма по п. 5.
7. Конъюгат лекарственного средства, имеющий низкий риск индуцирования обмена цепей и образования мономера in vivo, где Fc-фрагмент IgG4 по п. 1 или 2 конъюгирован с лекарственным средством с помощью линкера, выбранного из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимера этиленгликоля и пропиленгликоля, полиоксиэтилированного полиола, поливинилового спирта, полисахарида, декстрана, поливинилэтилового эфира, полимолочной кислоты (PLA), сополимера полимолочная-гликолевая кислота (PLGA), липидного полимера, хитинов, гиалуроновой кислоты и их комбинации.
8. Конъюгат лекарственного средства по п. 7, где лекарственное средство выбрано из группы, состоящей из гормона роста человека; гормона, высвобождающего гормон роста; пептида, высвобождающего гормон роста; интерферонов и рецепторов интерферона; колониестимулирующего фактора; интерлейкинов и рецепторов интерлейкинов; ферментов; интерлейкин- и цитокин-связывающих белков; фактора активации макрофагов; макрофагального пептида; В-клеточного фактора; Т-клеточного фактора; белка А, фактора ингибирования аллергии, гликопротеина некроза, иммунотоксина, лимфотоксина, фактора некроза опухоли, опухолевого супрессора, трансформирующего фактора роста, α-1-антитрипсина, альбумина, α-лактальбумина, аполипопротеина-Е, эритропоэтина, высокогликозилированного эритропоэтина, ангиопоэтина, гемоглобина, тромбина; пептида, активирующего рецептор тромбина; тромбомодулина, фактора коагуляции крови VII, фактора коагуляции крови VIIα, фактора коагуляции крови VIII, фактора коагуляции IX, фактора коагуляции крови XIII, активатора плазминогена, фибрин-связывающего пептида, урокиназы, стрептокиназы, гирудина, протеина С, С-реактивного белка, ингибитора ренина, ингибитора коллагеназы, супероксиддисмутазы, лептина, тромбоцитарного фактора роста, эпителиального фактора роста, эпидермального фактора роста, ангиостатина, ангиотензина, костного морфогенетического фактора роста, костного морфогенетического белка, кальцитонина, инсулина и производного инсулина, атриопептина, хрящевого индуцирующего фактора, элкатонина, активирующего фактора соединительной ткани, ингибитора пути тканевого фактора, фолликулостимулирующего гормона, лютеинизирующего гормона, гормона высвобождения лютеинизирующего гормона, факторов роста нервов (например, фактора роста нервов, цилиарного нейротрофического фактора, фактора аксогенезиса-1, мозгового натрийуретического пептида, нейротрофического фактора глиальных клеток, нетрина, фактора ингибирования нейтрофилов, нейротрофического фактора и неврина), паратиреоидного гормона, релаксина, секретина, соматомедина, инсулиноподобного фактора роста, адренокортикального гормона, глюкагона, инсулинотропных пептидов, включающих глюкагон-подобный пептид-1 и экзендин-4, инкретинов, секретируемых в кишечнике, адипоцитов, включающих лептоны, и нейроцитокинов, эффективных для метаболического синдрома, холецистокинина, полипептидов поджелудочной железы, гастрин-высвобождающих пептидов, кортикотропин-высвобождающего фактора, тиреостимулирующего гормона, аутотаксина, лактоферрина, миостатина, рецептора, антагониста рецептора, антигена клеточной поверхности, моноклонального антитела, поликлонального антитела, фрагментов антител и вирусного вакцинного антигена.
9. Конъюгат лекарственного средства по п. 7, где лекарственное средство представляет собой гранулоцитарный колониестимулирующий фактор.
10. Конъюгат лекарственного средства по п. 7, где линкер представляет собой непептидильный полимер.
11. Конъюгат лекарственного средства по п. 10, где непептидильный полимер имеет два или три реакционноспособных конца.
12. Фармацевтическая композиция, имеющая низкий риск индуцирования обмена цепей и образования мономера in vivo и содержащая конъюгат по п. 7 и фармацевтически приемлемый носитель.
| WO 2006113665 A2, 26.10.2006 | |||
| WO 2010106180 A2, 23.09.2010 | |||
| US 2007243194 A1, 18.10.2007 | |||
| WO 2013012733 A1, 24.01.2013 | |||
| WO 2012022982 A2, 23.02.2012 | |||
| МОДИФИЦИРОВАННЫЙ ПОЛИПЕПТИД С УВЕЛИЧЕННЫМ ВРЕМЕНЕМ ПОЛУЖИЗНИ, ЕГО ПОЛУЧЕНИЕ И ИСПОЛЬЗОВАНИЕ | 1996 |
|
RU2224764C2 |
Авторы
Даты
2023-07-24—Публикация
2014-05-29—Подача