Изобретение относится к области молекулярно-генетической диагностики, молекулярной биологии и биотехнологии и может быть использовано для диагностики наличия инфекции Хеликобактер пилори (ХП) и ее устойчивости к кларитромицину и левофлоксацину.
Известными способами диагностики ХП и ее антибиотикоустойчивости, являются молекулярно-генетические методы, в частности метод секвенирования по Сэнгеру. Отличием данного метода по сравнению с другими способами является его точность. Метод предполагает прочтение нуклеотидной последовательности участков генов, специфичных для всех штаммов HP, которых нет в других видах бактерий, а также нуклеотидной последовательности участков генов, мутации в которых определяют ее антибиотикоустойчивость. Резистентность к кларитромицину ассоциирована с вариантами 2142А>С, 2142A>G и 2143A>G в гене 23S rRNA, а резистентность к левофлоксацину связывают с вариантами в 87 (259А>Т, 261T/C<G/A) и 91 (271G>A, 271G>T, 272A>G) кодонах гена gyrA [1 - Monica Oleastro et al. Real-Time PCR Assay for Rapid and Accurate Detection of Point Mutations Conferring Resistance to Clarithromycin in Helicobacter pylori // Journal of clinical microbiology, Vol. 41, No. 1. - 2003, p. 397-4025].
Данный способ принят за аналог.
Известен способ диагностики ХП и ее антибиотикоустойчивости. Изобретение представляет собой чип для обнаружения гена лекарственной устойчивости Helicobacter pylori к кларитромицину, способ его получения и применения. Техническое решение представляет собой зонды размещенные на носителе. Настоящее изобретение реализует быстрое и простое обнаружение полиморфизма генов 23SrRNA 2142, 2143 и 2182 непосредственно с образца слизистой оболочки желудка, бактериальная культура не требуется [2 - патент CN 200410073454, опубликованному 2007-01-17 «Чип для обнаружения полиморфизма гена устойчивости Хеликобактер пилори к кларитромицину»]. Данный способ принят за прототип.
Существенным недостатком данного технического решения, во-первых, является то, что данным способом можно определить только устойчивость к кларитромицину; во-вторых, для его реализации в клинической практике, необходимо наличие специального оборудования для детекции чипов и постоянное приобретение самих чипов, что экономически не выгодно для рутинной работы. Кроме того, способ гибридизации на подложке имеет такую негативную сторону, как неспецифическая гибридизация и, как следствие, неспецифическую флуоресценцию и ложные результаты.
Цель - повышение точности диагностики инфекции Хеликобактер пилори и ее устойчивости к кларитромицину и левофлоксацина.
Технический результат заключается в
способе диагностики инфекции Хеликобактер пилори и ее устойчивости к кларитромицину и левофлоксацину в биопсийном образце слизистой оболочки желудка пациента, включающим выделение ДНК, проведение ПЦР реакции с использованием тест-системы, анализ образующихся продуктов на ДНК-анализаторе, отличающимся тем, что используют реакционный раствор для ПЦР и праймеров SEQ ID NO1: 5'-TAAATACCGACCTGCATGAATG-3', SEQ ID NO 2: 5'-CTCCATAAGAGCCAAAGCCC-3', SEQ ID NO 3: 5'-GGAAACCCTGAAGC AGC A ACG-3', SEQ ID NO 4: 5'-CGCCTTCGC AATGAGTATTCCT-3', SEQ ID NO 5: 5'-АТС AT AGGGCGTGCTTT ACC-3', SEQ ID NO 6: 5'-AAAGGTTAGGCAGACGGCTT-3', очистку ПЦР продукта, сиквенсовую реакцию, очистку продукта сиквенсовой реакции, детекцию и анализ полученного результата, при этом тест-система содержит набор реагентов для проведения ПЦР, буфер, MgCl2, dNTP, Taq-полимеразу, образец ДНК и набор праймеров, SEQ ID NO 1: 5'-TAAATACCGACCTGCATGAATG-3', SEQ ID NO 2: 5'-CTCCATAAGAGCCAAAGCCC-3', SEQ ID3: 5'-GGAAACCCTGAAGC AGC A ACG-3', SEQ ID NO 4: 5'-CGCCTTCGC AATGAGTATTCCT-3', SEQ ID NO 5: 5'-АТС ATAGGGCGTGCTTTACC-3', SEQ ID NO 6: 5'-AAAGGTTAGGCAGACGGCTT-3'.
Способ по п. 1 для выявления устойчивости Хеликобактер пилори к кларитромицину и левофлоксацину, отличающийся тем, что используют праймеры: SEQ ID 1-6: SEQ ID 1: 5'-TAAATACCGACCTGCATGAATG-3', SEQ ID2: 5'-CTCCATAAGAGCCAAAGCCC-3', SEQ ID3: 5'-GGAAACCCTGAAGC AGC AACG-3', SEQ ID4: 5'-CGCCTTCGCAATGAGTATTCCT-3', SEQ ID5: 5'-ATCTAGGGCGTGCTTTACC-3', SEQ ID6: 5'-AAAGGTTAGGCAGACGGCTT-3'.
Представлены референсные нуклеотидные последовательности участков генов S23, GyrA, S16 Хеликобактер пилори.
Представлен перечень нуклеотидных последовательностей (праймеров).
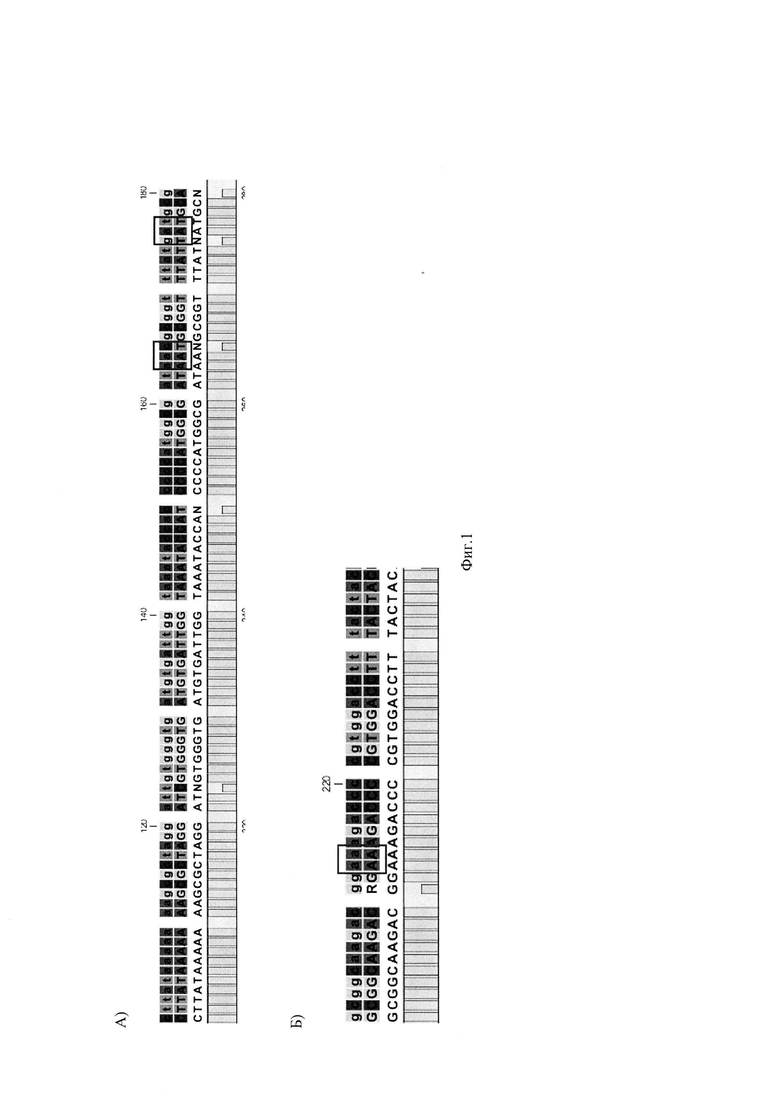
На Фиг. 1 представлено выравнивание фрагмента нуклеотидной последовательности Хеликобактер пилори, обнаруженной у пациента №1, с референсной последовательностью гена GyrA рРНК (А) и выравнивание фрагмента нуклеотидной последовательности Хеликобактер пилори, обнаруженной у пациента №1, с референсной последовательностью гена S23 рРНК Хеликобактер пилори (Б).
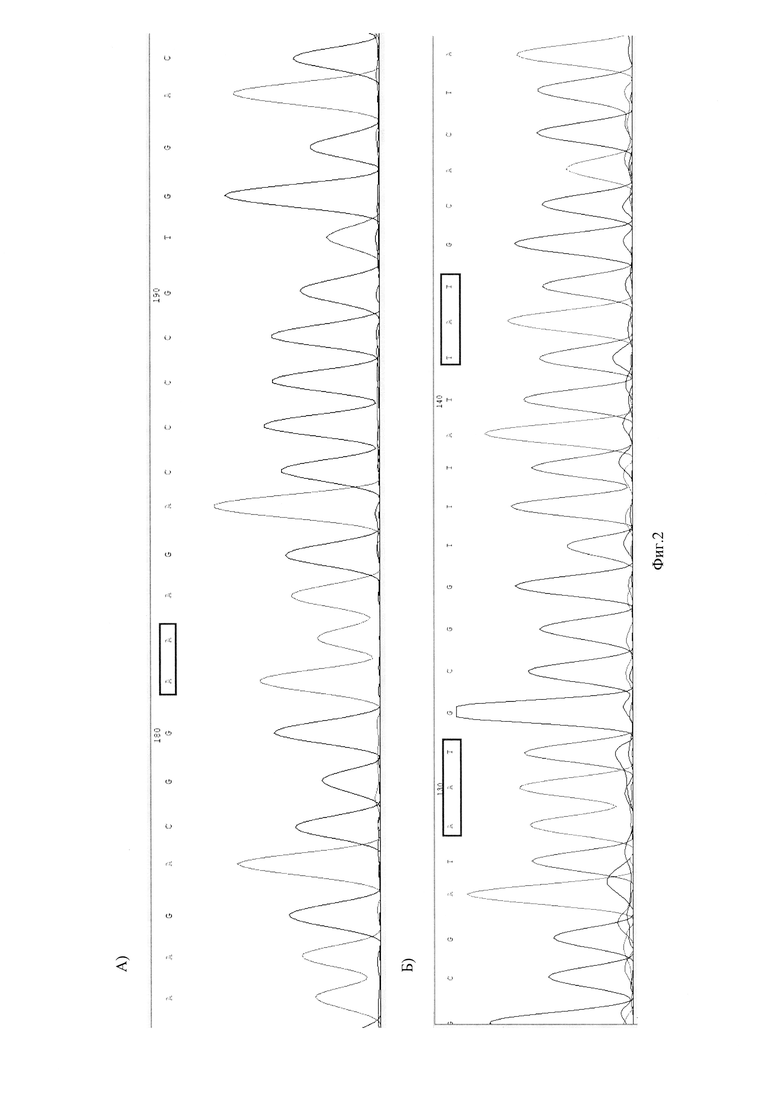
На Фиг. 2 представлены хроматограммы нуклеотидной последовательности генов S23 рРНК (А) и GyrA рРНК (Б) Хеликобактер пилори у пациента №1.
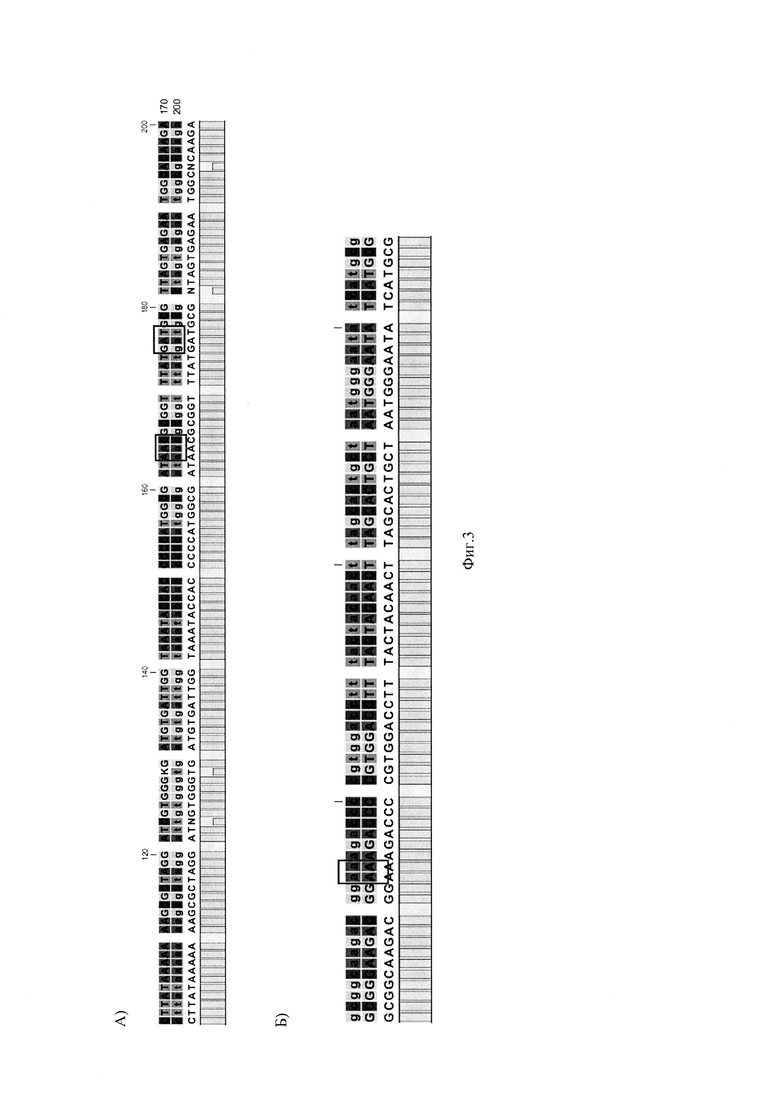
На Фиг. 3 представлено выравнивание фрагмента нуклеотидной последовательности Хеликобактер пилори, обнаруженной у пациента №2, с референсной последовательностью гена GyrA рРНК (А) и выравнивание нуклеотидной последовательности Хеликобактер пилори, обнаруженной у пациента №2, с референсной последовательностью гена S23 рРНК (Б).
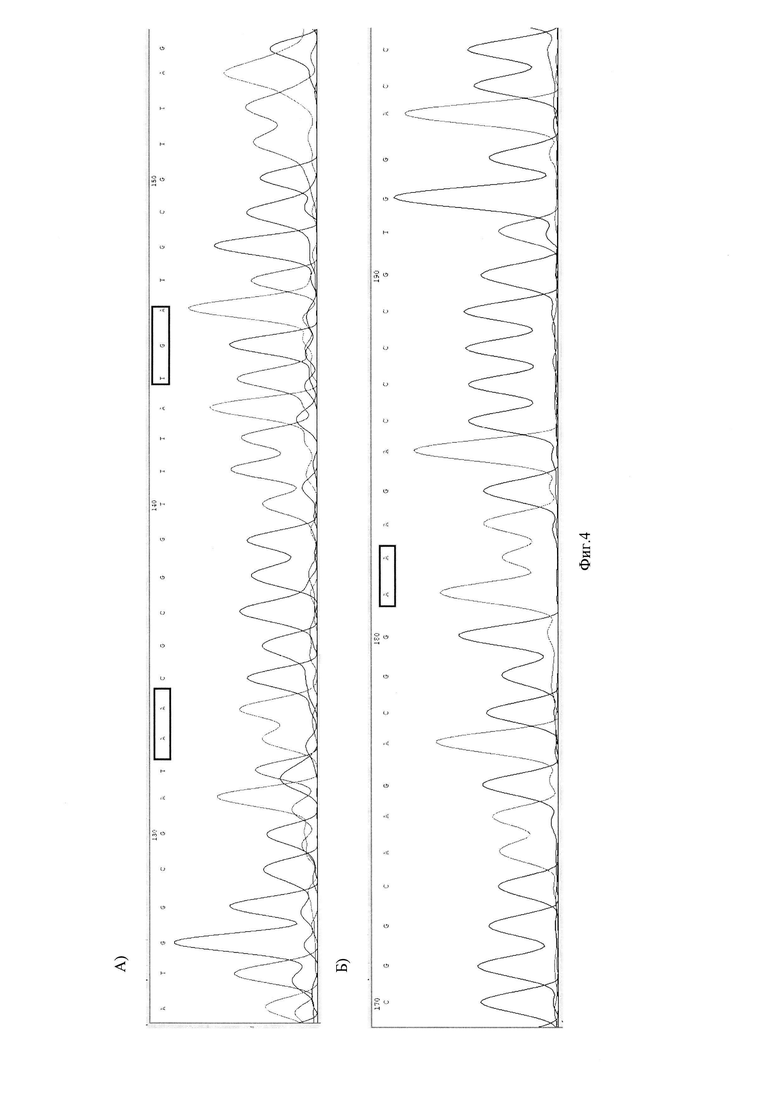
На Фиг. 4 представлены хроматограммы нуклеотидной последовательности генов GyrA рРНК (A), S23 рРНК (Б) Хеликобактер пилори у пациента №2.
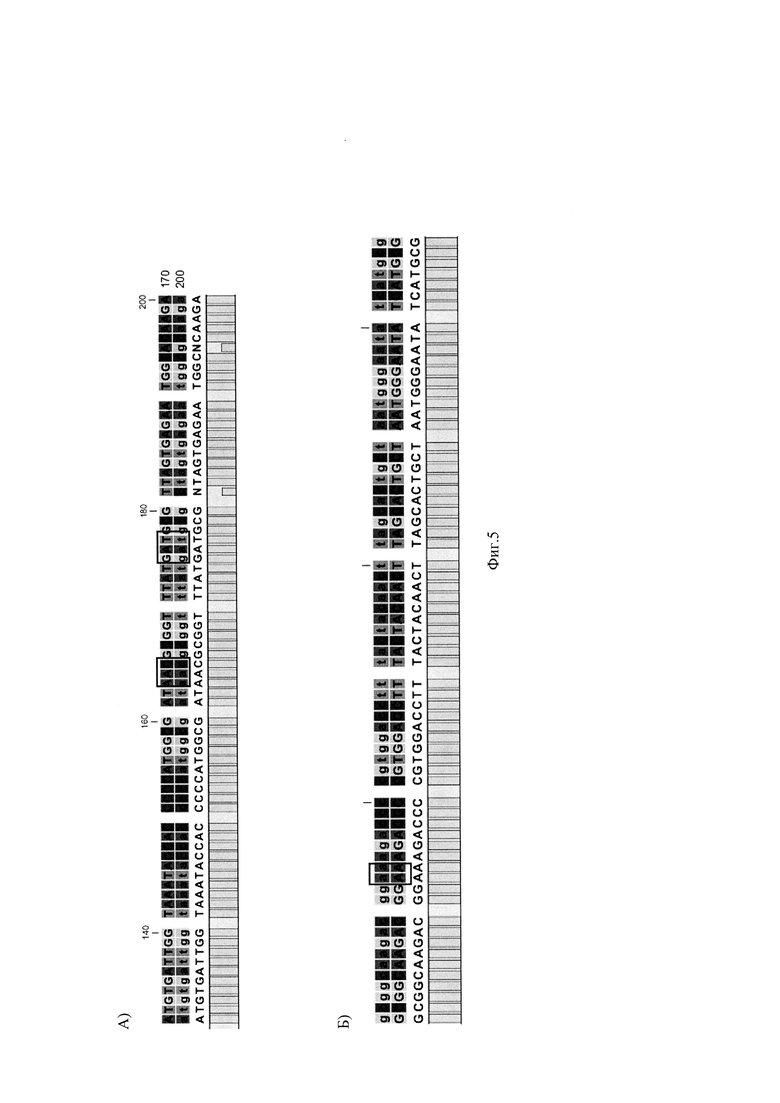
На Фиг. 5 представлено выравнивание нуклеотидной последовательности Хеликобактер пилори, обнаруженной у пациента №3, с референсными последовательностями генов GyrA рРНК (А) и S23 рРНК (Б).
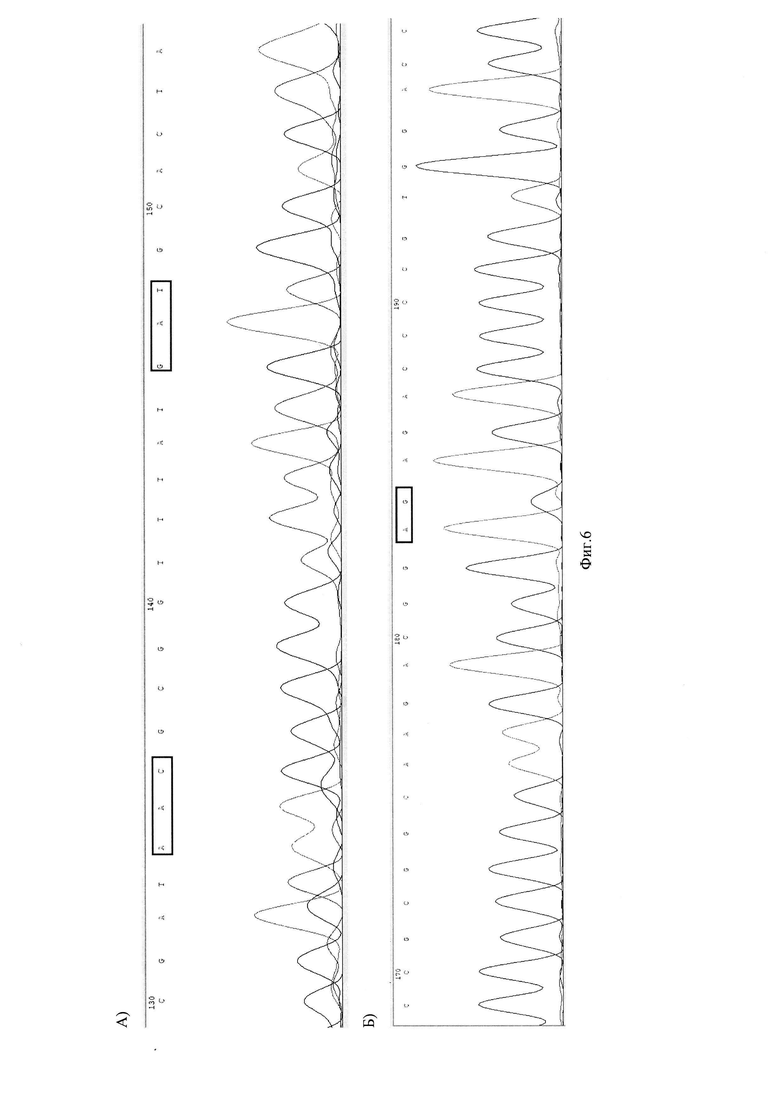
На Фиг. 6 представлены хроматограммы нуклеотидной последовательности генов и GyrA рРНК (А) и S23 рРНК (Б) Хеликобактер пилори у пациента №3.
Способ осуществляется следующим образом.
В настоящее время для Российской Федерации характерна высокая распространенность инфекции ХП. Согласно литературным данным, ХП инфицировано более 112 млн человек. Международное агентство по изучению рака отнесло ХП к канцерогенам первой группы. В рекомендациях Маастрихт V, эрадикационная терапия является стратегией, позволяющая снизить риск развития эрозивно-язвенных поражений слизистой оболочки желудка и двенадцатиперстной кишки, а также способствует профилактике предраковых состояний [3 - Степанов Ю.М., Будзак И.Я. Маастрихский консенсус - 5: аналитический обзор положений // Гастроэнтерология, т. 51, №1. - 2017., С. 36-45]. Как и другие бактерии, HP имеет региональные особенности резистентности, а количество устойчивых к антибиотикам штаммов растет из-за широкого применения препаратов, что снижает эффективность эрадикационной терапии. Например, в литературе описано, что резистентность к кларитромицину в Нидерландах составляет всего 5,6%, тогда как резистентность ХП к данному антибиотику в Австрии достигает 35,4%. Уровень устойчивости к метронидазолу в Пекине составил 63,9%, а на Юго-Восточном побережье Китая - 95,4%. В России уровень резистентности к Кларитромицину составляет - 10%, к Левофлоксацину - 20%, Метронидазолу - 34%. [4 - Андреев Д.Н., Маев И.В., Кучерявый Ю.А. Резистентность Helicobacter pylori в Российской Федерации: метаанализ исследований за последние 10 лет // Терапевтический архив, 11, 2020. - С. 24-30. Doi: 10.2644/00403660.2020.11.000795]. Устойчивость к антибиотикам HP растет во всем мире, что подчеркивает необходимость более быстрого обнаружения резистентности до назначения схем лечения ХП [5 - А. Savoldi, Е. Carrara, D.Y. Graham, М. Conti, Е. Tacconelli Prevalence of Antibiotic Resistance in Helicobacter pylori: A Systematic Review and Metaanalysis in World Health Organization Regions // Gastroenterology. - 2018. 155(5): 1372-1382].
Согласно последним рекомендациям терапией первой линии для эрадикации инфекции HP является стандартная тройная схема, включающая ингибитор протонной помпы (ИПП), кларитромицин и амоксициллин. В качестве альтернативного варианта эрадикационной терапии первой линии может быть использована классическая четырехкомпонентная схема на основе висмута трикалия дицитрата или квадротерапия без препаратов висмута, которая включает ИПП, амоксициллин, кларитромицин и метронидазол. Квадротерапию с висмута трикалия дицитратом применяют также как основную схему второй линии при неэффективности стандартной тройной терапии. Другая схема терапии второй линии включает ИПП, левофлоксацин и амоксициллин. Терапию третьей линии подбирают индивидуально на основании определения чувствительности ХП к антибактериальным препаратам. Результаты некоторых исследований указывают на то, что чтобы преодолеть резистентность к кларитромицину рекомендовано добавление висмута трикалия дицитрат к классической терапии. Так же, среди методов модификации, позволяющих повысить эффективность эрадикационной терапии инфекции H.pylori, следует отметить увеличение продолжительности лечения до 14 дней, выбор более современного ИПП или увеличение дозы ИПП, добавление висмута трикалия дицитрата или пробиотика. Важным является то, что назначение эрадикационной терапии, в случае обнаружения Н. pylori особенно актуально как эффективная мера профилактики рака желудка [3 - Степанов Ю.М., Будзак И.Я. Маастрихский консенсус - 5: аналитический обзор положений // Гастроэнтерология, т. 51, №1. - 2017., С. 36-45].
В результате антибактериальной терапии у ряда пациентов возникают побочные эффекты, такие как: диарея, тошнота, рвота, синдром избыточного бактериального роста, псевдомембранозный колит, развитие аллергических реакций и другие. Развитие побочных эффектов вынуждают пациентов преждевременно прервать эрадикационную терапию, что в свою очередь является фактором увеличения резистентности бактерии к антибиотикам и в дальнейшем снижает эффективность терапии. Таким образом, при назначении схем лечения инфекции возникает ряд трудностей. Определение резистентности в короткие сроки позволит врачам персонализировано назначать эрадикационную терапию, что способствует улучшению переносимости лекарственных средств и увеличит комплаентность пациентов к лечению.
На сегодняшний день применяется следующие методы диагностики инфекции ХП гистологический метод (при заборе биопсии) - несмотря на высокую чувствительность метода, на его точность может оказать влияние количество биоптата и место их забора, с точки зрения неравномерного распределения по слизистой оболочке желудка. В ходе быстрого уреазного теста биопсийный материал слизистой оболочки желудка помещают в специальный раствор. При наличии ХП за счет продуцируемой уреазы раствор будет менять цвет на малиновый. Результат доступен через 15-30 минут. Несмотря на то, что тест довольно быстрый, он все же обладает рядом недостатков. Возможны как ложноположительные, так и ложноотрицательные результаты. Ложноположительные результаты возможны вследствие того, что другие бактерии, которые населяют слизистую желудка, могут также продуцировать уреазу и окрашивать тестовый раствор. Ложноотрицательные результаты могут быть при малой степени обсемененности слизистой оболочки желудка ХП. Серологический метод (наличие антител к ХП в крови) мало информативен у пациентов со слабым иммунным ответом, ранней стадией инфицирования, т.к. антитела IgG появляются не ранее, чем через месяц после инфицирования. Несмотря на то, что уровень антител в процессе успешной эрадикации падает, серологическая реакция остается положительной в течение ряда лет, поэтому данный метод нельзя использовать для контроля эффективности антихеликобактерной терапии. Анализ кала на антиген ХП достаточно точный метод, но при запорах, затруднительных актах дефекации может разрушаться оболочка ХП. 13С-уреазнй дыхательный тест достаточно точный тест, тем не менее ложноотрицательные результаты могут наблюдаться у пациентов, перенесших резекцию желудка, а также при значительном снижении секреции желудка. Ложноположительные тесты могут быть вследствие расщепления мочевины бактериями во рту или бактериями, содержащими уреазу в желудке. Еще одним недостаток метода - его дороговизна. Бактериологический метод основан на идентификации возбудителя путем посева из биоптата слизистой оболочки желудка. Бактериологический метод позволяет культивировать ХП, используя биоптаты слизистой оболочки желудка, идентифицировать бактерию, изучить ее морфологические, биохимические и биологические свойства, позволяет изучить факторы патогенности ХП. Культуральный метод имеет самую высокую специфичность, но чувствительность метода снижена в виду того что требуется особая осторожность при обращении с образцами слизистой оболочки желудка. Метод достаточно дорогой, очень трудоемкий и редко используется в обычной клинической практике [6-Бордин Д.С. и др. «Методы диагностики инфекции Helicobacter pylori». Методические рекомендации. - Москва, 2019].
Способ диагностики инфекции ХП и ее устойчивости к кларитромицину и левофлоксацину включает выделение ДНК, проведение ПЦР реакции с использованием тест-системы, анализ образующихся продуктов на ДНК-анализаторе, дополнительно вносят следующие признаки: праймеры, специфичные к различным штаммам ХП, фланкирующие область точек-мишеней генов S16 рРНК (SEQ ID NO 3 - 5'-GGAAACCCTGAAGCAGCAACG-3', SEQ ID NO 4 - 5'-CGCCTTCGCAATGAGTATTCCT-3') - для диагностики наличия инфекции ХП, S23 рРНК (SEQ ID NO 1 - 5'-TAAATACCGACCTGCATGAATG-3', SEQ ID NO 2 - 5'-CTCCATAAGAGCCAAAGCCC-3') - для диагностики устойчивости к кларитромицину, GyrA рРНК (SEQ ID NO 5-5'-ATC ATAGGGCGTGCTTTACC-3', SEQ ID NO 6 - 5' - A AAGGTTAGGC AG ACGGCTT-3')-для диагностики устойчивости к левофлоксацину.
Способ поясняется следующими фигурами:
Фиг. 1 выравнивание фрагмента нуклеотидной последовательности Хеликобактер пилори, обнаруженной у пациента №1, с референсной последовательностью гена GyrA рРНК (А) и выравнивание фрагмента нуклеотидной последовательности Хеликобактер пилори, обнаруженной у пациента №1, с референсной последовательностью гена S23 рРНК Хеликобактер пилори (Б).
Фиг. 2 хроматограммы нуклеотидной последовательности генов S23 рРНК (А) и GyrA рРНК (Б) Хеликобактер пилори у пациента №1.
Фиг. 3 выравнивание фрагмента нуклеотидной последовательности Хеликобактер пилори, обнаруженной у пациента №2, с референсной последовательностью гена GyrA рРНК (А) и выравнивание нуклеотидной последовательности Хеликобактер пилори, обнаруженной у пациента №2, с референсной последовательностью гена S23 рРНК (Б).
Фиг. 4 хроматограммы нуклеотидной последовательности генов GyrA рРНК (A), S23 рРНК (Б) Хеликобактер пилори у пациента №2.
Фиг. 5 выравнивание нуклеотидной последовательности Хеликобактер пилори, обнаруженной у пациента №3, с референсными последовательностями генов GyrA рРНК (А) и S23 рРНК (Б).
Фиг. 6 хроматограммы нуклеотидной последовательности генов и GyrA рРНК (А) и S23 рРНК (Б) Хеликобактер пилори у пациента №3.
Наличие инфекции определяют по наличию продукта амплификации гена S16 рРНК. Далее полученные ампликоны подвергают сиквенсовой реакции с последующим разделением продуктов сиквенсовой реакции методом капиллярного гель-электрофореза на генетическом анализаторе. Определяют наличие или отсутствие нуклеотидных замен A2142A>G, А2142А>С и A2143A>G в гене 23S рРНК, нуклеотидных замен 259А>Т, 261T/C>G/A в 87 кодоне гена и 271G>A, 271G>T, 272A>G в 91 кодоне гена GyrA рРНК.
Таким образом, как при наличии мутации, так и без нее со 100% точностью (непосредственно «прочитывается» нуклеотидная последовательность гена) будет диагностировано наличие или отсутствие инфекции ХП и в случае ее наличия определена устойчивость ХП к кларитромицину и левофлоксацину.
Для осуществления заявленного способа предложена тест-система, содержащая реакционную смесь для ПЦР реакции и праймеры для амплификации последовательности ДНК, в которую внесены следующие новые признаки:
1. Буфер для ПЦР реакции с MgC12 - 1,5 мл.
2. Смесь dNTP (dATP, dGTP, dCTP, dTTP) - 200 мкМ.
3. Taq-полимераза - 1000-5000 ед. активности.
4. Контрольные образцы ДНК (положительный контрольный образец, отрицательный контрольный образец).
5. Праймеры (SEQ ID 1-6):
SEQ ID NO 1: 5'-TAAATACCGACCTGCATGAATG-3' (прямой)
SEQ ID NO 2: 5'-CTCCATAAGAGCCAAAGCCC-3' (обратный)
SEQ ID NO 3: 5'-GGAAACCCTGAAGCAGCAACG-3' (прямой)
SEQ ID NO 4: 5'-CGCCTTCGCAATGAGTATTCCT-3' (обратный)
SEQ ID NO 5: 5' - АТС ATAGGGCGTGCTTTACC-3' (прямой)
SEQ ID NO 6: 5'-AAAGGTTAGGCAGACGGCTT-3' (обратный)
Для решения поставленной задачи произведен индивидуальный дизайн праймеров с помощью программы Oligo.
Дизайн праймеров осуществлялся на основе следующих принципов: область отжига праймеров должна быть вне зон мутаций в пределах видовой специфичности; GC-состав 40-60%; праймеры должны иметь очень близкие температуры плавления в диапазоне 60-66°С; в последовательности праймера должны отсутствовать стабильные вторичные структуры - шпильки и димеры. Чтобы исключить амплификацию нецелевых локусов, уникальность каждого праймера была подтверждена поиском по базе данных секвенированных геномов http://wvvw.ensembl.org.
Специфичность теста подтверждена исследованием других микроорганизмов: Enterococcus faecalis, Proteus vulgaris, Klebsiella pneumoniae, Escherichia coli, Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus viridans, Pseudomonas aeruginosa, Candida albicans, Haemophilus influenzae, Campylobacter jejuni, Herpes Simpex virus, Varicella Zooster, Cytomegalovirus, Epstein Bar viruses.
Способ на основе тест системы осуществляют следующим образом:
ДНК экстрагируют из биоптата слизистой оболочки желудка, полученного в ходе эзофагогастродуоденоскопии.
Выделенную ДНК затем подвергают полимеразной цепной реакции с использованием вышеописанной тест системы. Полимеразную цепную реакцию (ПЦР) выполняют на термоциклерах в реакционной смеси объемом 25 мкл, 67 мМ трис-HCl (рН=8,8), 2,5 мМ MgCl2, 1 нг геномной ДНК, по 10 пМ прямого и обратного праймера, по 200 мкМ dATP, dGTP, dCTP, dTTP и 1 единицу активной Taq-полимеразы. Режим проведения ПЦР следующий: 1) денатурация 95°С - 5 мин.; 35 циклов: 2) денатурация 95°С - 30 сек.; отжиг праймеров: 60-66°С - 30 сек.; элонгация 72°С - 1 мин.; 3) финальная элонгация 72°С - 5 мин.
Далее проводят детекцию продуктов амплификации методом горизонтального электрофореза в 2% агарозном геле. Наличие продуктов амплификации по генам S16, GyrA, S23 рРНК свидетельствует о наличии инфекции ХП. Если ХП обнаружена, далее амплификат, наработанный при ПЦР, подвергают очистке с помощью колонок и проводят сиквенсовую реакцию с использованием дидезоксинуклеотидов (терминаторов) путем термоциклирования: денатурация 96°С - 1 мин.; 25 циклов: денатурация 96°С - 10 сек.; отжиг праймеров 60°С - 5 сек.; элонгация - 60°С - 4 мин. Далее проводят очистку амплификата любым способом, подходящим для очистки сиквенсового продукта, с последующим разделением нуклеотидов методом капиллярного гель-электрофореза на генетическом анализаторе.
Способ подтверждается следующими примерами.
Пример 1.
Пациентка Т. в возрасте 50 лет. Жалобы на боли в правом подреберье, дискомфорт в эпигастрии. Из анамнеза известно, что вышеуказанные жалобы беспокоят около полутора лет. По данным эзофагогастродулоденоскопии (ЭГДС) - антральная гастропатия. По данным серологии IgGr выявлен ХП. По данным ЭГДС от 2021 года - недостаточность кардии. Диффузный гастрит. В результате ЭГДС у пациентки был взят образец слизистой оболочки желудка. Произведено выделение ДНК стандартным методом для экстракции ДНК из тканей человека.
Далее проводили ПЦР реакцию по следующему протоколу: деонизованная вода - 12,5 мкл.; буфер - 5 мкл.; MgC12 - 2.5 мкл.; праймеры - по 1 мкл прямого и обратного (SEQ ID NO 1-6: SEQ ID 1: 5'-TAAATACCGACCTGCATGAATG-3', SEQ ID NO 2: 5'-CTCCATAAGAGCCAAAGCCC-3', SEQ ID NO 3: 5'-GGAAACCCTGAAGCAGCAACG-3', SEQ ID NO 4: 5'-CGCCTTCGC AATGAGTATTCCT-3', SEQ ID NO 5: 5'-ATCATAGGGCGTGCTTTACC-3', SEQ ID NO 6: 5'-AAAGGTTAGGCAGACGGCTT-3', Прил.1); dNTP - 0.5 мкл.; Taq-полимераза - 0.5 мкл.; ДНК - 2 мкл. Режим ПЦР: 1) денатурация 95°С - 5 мин.; 35 циклов: 2) денатурация 95°С - 30 сек.; отжиг праймеров: 60-66°С - 30 сек.; элонгация 72°С - 1 мин.; 3) финальная элонгация 72°С - 5 мин.
Далее проверяли наличие продуктов амплификации с помощью горизонтального электрофореза в 2% агарозном геле. Было зарегистрирована свечение полос во всех лунках, содержащих ПЦР продукт, что свидетельствует о наличии инфекции ХП. Амплификат очищали на колонках согласно инструкции фирмы производителя.
Далее выполняли сиквенсовую реакцию по следующему протоколу: деонизованная вода - 5,5 мкл.; терминатор - 0,5 мкл.; 5х буффер - 1 мкл.; праймер - по 1 мкл. прямого или обратного (SEQ ID NO 1-6: SEQ ID NO 1: 5'-TAAATACCGACCTGCATGAATG-3', SEQ ID NO 2: 5'-CTCCATAAGAGCC AAAGCCC-3', SEQ ID NO 3: 5'-GGAAACCCTGAAGC AGC AACG-3', SEQ ID NO 4: 5'-CGCCTTCGC AATGAGT ATTCCT-3', SEQ ID NO 5: 5'-ATCATAGGGCGTGCTTTACC-3', SEQ ID NO 6: 5'-AAAGGTT AGGC AG ACGGCTT-3', Прил. 1); ПЦР-продукт - 2 мкл. Режим сиквенсовой реакции: денатурация 96°С - 1 мин.; 25 циклов: денатурация 96°С - 10 сек.; отжиг праймеров 60°С - 5 сек.; элонгация - 60°С - 4 мин.
Далее проводили очистку амплификата сорбентным методом. Последующее разделение нуклеотидов осуществляли методом капиллярного гель-электрофореза на генетическом анализаторе. Для определения нуклеотидных замен в точках-мишенях проводят выравнивание полученных сиквенсов с референсной последовательностью. Выравнивание сиквенсов образца ДНК пациентки №1 с референсными последовательностями представлены на Фиг. 1.
В результате исследования у пациентки обнаружена инфекция ХП - S16+, не обнаружено устойчивости к кларитромицину - S23 (2142А, 2143А) - дикий тип (wt), обнаружена устойчивость к левофлоксоцину - GyrA 87 кодон (259А, 261Т) - дикий тип (wt); GyrA 91 кодон (27IT - мутация (mut), 272А - дикий тип (wt) (Фиг. 2).
Пример 2.
Пациент С. в возрасте 57 лет. В анамнезе рак слизистой оболочки альвеолярного отростка левой верхней челюсти. Выполнена биопсия новообразования слизистой альвеолярного отростка левой верхней челюсти, по данным гистологического исследования, выполненного в 2021 г. - плоскоклеточная ороговевающая карцинома высокой степени дифференцировки слизистой оболочки верхней челюсти. Рекомендована ЭГДС. По данным серологии IgGr выявлен ХП.
В результате ЭГДС у пациента был взят образец слизистой оболочки желудка. Произведено выделение ДНК стандартным методом, подходящим для экстракции ДНК из тканей человека.
Далее проводили ПЦР реакцию по следующему протоколу: деонизованная вода - 12,5 мкл.; буфер - 5 мкл.; MgCl2 - 2.5 мкл.; праймеры - по 1 мкл. прямого и обратного (SEQ ID NO 1-6: SEQ ID NO 1: 5'-TAAATACCGACCTGCATGAATG-3', SEQ ID NO 2: 5'-CTCC AT AAGAGCC AAAGCCC-3', SEQ ID NO 3: 5'-GGAAACCCTGAAGC AGC AACG-3', SEQ ID NO 4: 5'-CGCCTTCGC AATGAGTATTCCT-3', SEQ ID NO 5: 5'-ATCATAGGGCGTGCTTTACC-3', SEQ ID NO 6: 5'-AAAGGTTAGGCAGACGGCTT-3', Прил.1); dNTP - 0.5 мкл.; Taq-полимераза - 0.5 мкл.; ДНК - 2 мкл. Режим ПЦР: 1) денатурация 95°С - 5 мин.; 35 циклов: 2) денатурация 95°С - 30 сек.; отжиг праймеров: 60-66°С - 30 сек.; элонгация 72°С - 1 мин.; 3) финальная элонгация 72°С - 5 мин.
Далее проверяли наличие продуктов амплификации с помощью горизонтального электрофореза в 2% агарозном геле. Было зарегистрирована свечение полос во всех лунках, содержащих ПЦР продукт, что свидетельствует о наличии инфекции ХП. Амплификат очищали на колонках согласно инструкции фирмы производителя.
Далее выполняли сиквенсовую реакцию по следующему протоколу: деонизованная вода - 5,5 мкл.; терминатор - 0,5 мкл.; 5х буффер - 1 мкл.; праймер - по 1 мкл прямого или обратного (SEQ ID 1-6: SEQ ID NO 1: 5'-TAAATACCGACCTGCATGAATG-3', SEQ ID NO 2: 5'-CTCC AT AAGAGCC AAAGCCC-3', SEQ ID NO 3: 5'-GGAAACCCTGAAGC AGC AACG-3', SEQ ID NO 4: 5'-CGCCTTCGC AATGAGT ATTCCT-3', SEQ ID NO 5: 5' - АТС ATAGGGCGTGCTTT ACC-3', SEQ ID NO 6: 5'-AAAGGTTAGGCAGACGGCTT-3', Прил. 1); ПЦР-продукт - 2 мкл. Режим сиквенсовой реакции: денатурация 96°С - 1 мин.; 25 циклов: денатурация 96°С - 10 сек.; отжиг праймеров 60°С - 5 сек.; элонгация - 60°С - 4 мин.
Далее проводили очистку амплификата сорбентным методом. Последующее разделение нуклеотидов осуществляли методом капиллярного гель-электрофореза на генетическом анализаторе. Для определения нуклеотидных замен в точках-мишенях проводили выравнивание полученных сиквенсов с референсной последовательностью. Выравнивание сиквенсов образца ДНК пациента №2 с референсными последовательностями представлены на Фиг. 3.
В результате исследования у пациентки обнаружена инфекция ХП - S16+, не обнаружено устойчивости к кларитромицину - S23 (2142А, 2143 А) - дикий тип (wt), не обнаружена устойчивость к левофлоксоцину - GyrA 87 кодон (259А, 261С) - дикий тип (wt); GyrA 91 кодон (271G, 272А)- дикий тип (wt) (Фиг. 4).
Пример 3.
Пациентка К. в возрасте 60 лет. Диагноз: гастрит. Жалобы на боли в эпигастрии с иррадиацией в спину, дискомфорт за грудиной, частые запоры. Анамнез заболевания: пациентка длительно страдает запорами, периодически при погрешностях в питании боли в эпигастрии с иррадиацией в спину КТ ОБП от 30.11.21 - признаков объемных образований, конкрементов нет. РЭА 4.89 нг/мл. Дважды успешная эрадикация ХП, положительный С13 уреазный ЭГДС от 17.04.21 - состояние после фундопликации, антральный гастрит КС от 17.04.21 - патологии не выявлено. Пациентка длительно страдает запорами, использует различные группы слабительных препаратов. По данным ЭГДС от 2022 г. единичная венэктазия средней трети пищевода. Эпителиальное образование пищевода (верификация по результатам морфологического исследования). Состояние после фундопликации в 2010 г. - поверхностный гастрит.
В результате ЭГДС у пациента был взят образец слизистой оболочки желудка. Произведено выделение ДНК стандартным методом, подходящим для экстракции ДНК из тканей человека.
Далее проводили ПЦР реакцию по следующему протоколу: деонизованная вода - 12,5 мкл.; буфер - 5 мкл.; MgCl2 - 2.5 мкл.; праймеры - по 1 мкл. прямого и обратного (SEQ ID NO 1-6: SEQ ID NO 1: 5'-TAAATACCGACCTGCATGAATG-3', SEQ ID NO 2: 5'-CTCC AT AAGAGCC AAAGCCC-3', SEQ ID NO 3: 5'-GGAAACCCTGAAGC AGC AACG-3', SEQ ID NO 4: 5'-CGCCTTCGC AATGAGTATTCCT-3', SEQ ID NO 5: 5'-ATCATAGGGCGTGCTTTACC-3', SEQ ID NO 6: 5'-AAAGGTTAGGCAGACGGCTT-3', Прил.1); dNTP - 0.5 мкл.; Taq-полимераза - 0.5 мкл.; ДНК - 2 мкл. Режим ПЦР: 1) денатурация 95°С - 5 мин.; 35 циклов: 2) денатурация 95°С - 30 сек.; отжиг праймеров: 60-66°С - 30 сек.; элонгация 72°С - 1 мин.; 3) финальная элонгация 72°С - 5 мин.
Далее проверяли наличие продуктов амплификации с помощью горизонтального электрофореза в 2% агарозном геле. Было зарегистрирована свечение полос во всех лунках, содержащих ПЦР продукт, что свидетельствует о наличии инфекции ХП. Амплификат очищают на колонках согласно инструкции фирмы производителя.
Далее выполняли сиквенсовую реакцию по следующему протоколу: деонизованная вода - 5,5 мкл.; терминатор - 0,5 мкл.; 5х буффер - 1 мкл.; праймер - по 1 мкл прямого или обратного (SEQ ID NO 1-6: SEQ ID NO 1: 5'-TAAATACCGACCTGCATGAATG-3', SEQ ID NO 2: 5'-CTCCATAAGAGCCAAAGCCC-3', SEQ ID NO 3: 5'-GGAAACCCTGAAGC AGC AACG-3', SEQ ID NO 4: 5'-CGCCTTCGC AATGAGT ATTCCT-3', SEQ ID NO 5: 5'-ATC ATAGGGCGTGCTTTACC-3', SEQ ID NO 6: 5'-AAAGGTT AGGC AG ACGGCTT-3', Прил. 1); ПНР-продукт - 2 мкл. Режим сиквенсовой реакции: денатурация 96°С - 1 мин.; 25 циклов: денатурация 96°С - 10 сек.; отжиг праймеров 60°С - 5 сек.; элонгация - 60°С - 4 мин.
Далее проводили очистку амплификата сорбентным методом. Последующее разделение нуклеотиднов осуществляют методом капиллярного гель-электрофореза на генетическом анализаторе. Для определения нуклеотидных замен в точках-мишенях проводят выравнивание полученных сиквенсов с референсной последовательностью. Выравнивание сиквенсов образца ДНК пациента №3 с референсными последовательностями представлены на Фиг. 5.
В результате исследования у пациентки обнаружена инфекция ХП - S16+, обнаружена устойчивость к кларитромицину - S23 (2142A, 2143G) - (mut), не обнаружена устойчивость к левофлоксоцину - GyrA 87 кодон (259А, 261С) - дикий тип (wt); GyrA 91 кодон (271G, 272А) - дикий тип (wt) (Фиг. 6.).
Согласно предложенному способу, было проведено исследование на наличие ХП и ее устойчивости к кларитромицину и левофлоксацину у 16 пациентов. Установленная данным способом чувствительность ХП к исследуемым антибиотикам позволила провести успешную эрадикационную терапию.
Источники информации:
1. Oleastro М., et al. Real-Time PCR Assay for Rapid and Accurate Detection of Point Mutations Conferring Resistance to Clarithromycin in Helicobacter pylori // Journal of clinical microbiology, Vol. 41, No. 1. - 2003, p. 397-4025.
2. патент CN 200410073454, опубликованному 2007-01-17 «Чип для обнаружения полиморфизма гена устойчивости Хеликобактер пилори к кларитромицину».
3. Степанов Ю.М., Будзак И.Я. Маастрихский консенсус - 5: аналитический обзор положений // Гастроэнтерология, т. 51, №1. - 2017., С. 36-45.
4. Андреев Д.Н., Маев И.В., Кучерявый Ю.А. Резистентность Helicobacter pylori в Российской Федерации: метаанализ исследований за последние 10 лет // Терапевтический архив, 11, 2020. - С. 24-30. Doi: 10.2644/00403660.2020.11.000795.
5. Savoldi A., et al. Prevalence of Antibiotic Resistance in Helicobacter pylori: A Systematic Review and Meta-analysis in World Health Organization Regions // Gastroenterology. - 2018. 155(5): 1372-1382.
6. Бордин Д.С. и др. «Методы диагностики инфекции Helicobacter pylori». Методические рекомендации. - Москва, 2019.
--->
Перечень нуклеотидных последовательностей (праймеров)
<110> ГБУЗ МКНЦ им. А.С. Логинова
<120> Способ диагностики инфекции Хеликобактер пилори и ее устойчивости к
кларитромицину и левофлоксацину
<160> SEQ ID NO 1 primer forward
<210> SEQ ID NO 1
<211> 22
<212> DNA
<213> Helicobacter pylori
<400> Sequence
taaataccgacctgcatgaatg
<160> SEQ ID NO 2 primer reverse
<210> SEQ ID NO 2
<211> 20
<212> DNA
<213> Helicobacter pylori
<400> Sequence
ctccataagagccaaagccc
<160> SEQ ID NO 3 primer forward
<210> SEQ ID NO 3
<211> 21
<212> DNA
<213> Helicobacter pylori
<400> Sequence
ggaaaccctgaagcagcaacg
<160> SEQ ID NO 4 primer reverse
<210> SEQ ID NO 4
<211> 22
<212> DNA
<213> Helicobacter pylori
<400> Sequence
cgccttcgcaatgagtattcct
<160> SEQ ID NO 5 primer forward
<210> SEQ ID NO 5
<211> 20
<212> DNA
<213> Helicobacter pylori
<400> Sequence
atcatagggcgtgctttacc
<160> SEQ ID NO 6 primer reverse
<210> SEQ ID NO 6
<211> 20
<212> DNA
<213> Helicobacter pylori
<400> Sequence
aaaggttaggcagacggctt
Перечень референсных нуклеотидных последовательностей генов S23, GyrA, S16
<110> ГБУЗ МКНЦ им. А.С. Логинова
<120> Способ диагностики инфекции Хеликобактер пилори и ее устойчивости к
кларитромицину и левофлоксацину
<160> SEQ ID NO ref S23
<210> SEQ ID NO 1
<211> 264
<212> DNA
<213> Helicobacter pylori
<400> Sequence 1
Aggttaagaggatgcgtcagtcgcaagatgaagcgttgaattgaagcccgagtaaacggc 60
ggccgtaactataacggtcctaaggtagcgaaattccttgtcggttaaataccgaccatg 120
aatggcgtaacgagatgggagctgtctcaaccagagattcagtgaaattgtagtggaggt 180
gaaaattcctcctacccgcggcaagacggaaagaccccgtggacctttactacaacttag 240
cactgctaatgggaatatcatgcg 300
<160> SEQ ID NO ref GyrA
<210> SEQ ID NO 2
<211> 415
<212> DNA
<213> Helicobacter pylori
<400> Sequence 2
atcatagggcgtgctttaccggacgctagagatggcttaaagcccgtgcataggcgtatt 60
ttgtatgcgatgcatgaattaggcctcacttccaaagtcgcttataaaaaaagcgctagg 120
attgtgggtgatgtgattggtaaataccacccccatggcgataacgcggtttatgatgcg 180
ctagtgagaatggcgcaagatttttctatgcgtttggaattagtggatgggcaaggcaac 240
tttggctctattgatggcgataacgctgcagcgatgcgttacactgaagccagaatgacc 300
aaggcgagtgaagaaattttaagagatattgataaagacaccattgattttgtgcctaat 360
tacgatgacaccttaaaagagcccgatattttaccaagccgtctgcctaaccttt 520
<160> SEQ ID NO ref S16
<210> SEQ ID NO 3
<211> 330
<212> DNA
<213> Helicobacter pylori
<400> Sequence 3
ggaaaccctgaagcagcaacgccgcgtggaggatgaaggttttaggattgtaaactcctt 60
ttgttagagaagataatgacggtatctaacgaataagcaccggctaactccgtgccagca 120
gccgcggtaatacggagggtgcaagcgttactcggaatcactgggcgtaaagagcgcgta 180
ggcgggatagtcagtcaggtgtgaaatcctatggcttaaccatagaactgcatttgaaac 240
tactattctagagtgtgggagaggtaggtggaattcttggtgtaggggtaaaatccgtag 300
agatcaagaggaatactcattgcgaaggcg 360
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения Helicobacter pylori | 2017 |
|
RU2744190C1 |
| ДНК-ЧИП ДЛЯ ИДЕНТИФИКАЦИИ ГЕНЕТИЧЕСКИХ ДЕТЕРМИНАНТ АНТИБИОТИКОРЕЗИСТЕНТНОСТИ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИЙ, ПРИВОДЯЩИХ К НАРУШЕНИЮ РЕПРОДУКТИВНЫХ ФУНКЦИЙ ЧЕЛОВЕКА, НАБОР ОЛИГОНУКЛЕОТИДОВ ДЛЯ ИММОБИЛИЗАЦИИ НА ДНК-ЧИПЕ | 2016 |
|
RU2685188C2 |
| ОЛИГОНУКЛЕОТИДНЫЙ БИОЧИП ДЛЯ ИДЕНТИФИКАЦИИ ГЕНЕТИЧЕСКИХ ДЕТЕРМИНАНТ РЕЗИСТЕНТНОСТИ Neisseria gonorrhoeae К АНТИМИКРОБНЫМ ПРЕПАРАТАМ, НАБОР ОЛИГОНУКЛЕОТИДОВ, ИСПОЛЬЗУЕМЫХ ДЛЯ ИММОБИЛИЗАЦИИ НА БИОЧИПЕ | 2016 |
|
RU2636457C2 |
| РЕУТЕРИН-ВЫРАБАТЫВАЮЩИЕ LACTOBACILLUS BREVIS | 2011 |
|
RU2577994C1 |
| Наборы олигонуклеотидов для выявления ДНК бактерии Helicobacter pylori в клиническом материале методом полимеразной цепной реакции в режиме реального времени | 2024 |
|
RU2839157C1 |
| АНТИГЕН HELICOBACTER PYLORI И ВАКЦИННАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2195463C2 |
| СПОСОБ ВЫЯВЛЕНИЯ МУТАЦИЙ В СЛОЖНЫХ СМЕСЯХ ДНК | 2014 |
|
RU2613489C2 |
| ТЕСТ-ШТАММ МИКРООРГАНИЗМА Helicobacter pylori ГКПМ-Оболенск В-7215 ДЛЯ ИНДИКАЦИИ И ИДЕНТИФИКАЦИИ Helicobacter pylori В ОБРАЗЦАХ БИОПТАТОВ СЛИЗИСТОЙ ОБОЛОЧКИ ЖЕЛУДКА ИЛИ ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ | 2015 |
|
RU2595422C1 |
| СПОСОБ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДЕТЕКЦИИ УСТОЙЧИВОСТИ МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА К ПРОТИВОТУБЕРКУЛЕЗНЫМ ПРЕПАРАТАМ ВТОРОГО РЯДА (ФТОРХИНОЛОНАМ, АМИНОГЛИКОЗИДАМ И КАПРЕОМИЦИНУ) | 2015 |
|
RU2633507C2 |
| Способ анализа крови ВИЧ-инфицированных пациентов | 2024 |
|
RU2830447C1 |
Изобретение относится к области молекулярной биологии. Описан способ выявления инфекции Хеликобактер пилори и ее устойчивости к кларитромицину и левофлоксацину в биопсийном образце слизистой оболочки желудка пациента. Способ включает проведение полимеразной цепной реакции с использованием реакционного раствора для ПЦР и праймеров, очистку ПЦР продукта, сиквенсовую реакцию, очистку продукта сиквенсовой реакции, детекцию и анализ полученного результата, при этом тест-система содержит набор реагентов для проведения ПЦР, буфер, MgCl2, dNTP, Taq-полимеразу, образец ДНК и набор праймеров. Технический результат заключается в повышении точности диагностики инфекции Хеликобактер пилори и ее устойчивости к кларитромицину и левофлоксацину. 6 ил., 3 пр.
Способ выявления инфекции Хеликобактер пилори и ее устойчивости к кларитромицину и левофлоксацину в биопсийном образце слизистой оболочки желудка пациента, включающий проведение полимеразной цепной реакции с использованием реакционного раствора для ПЦР и праймеров SEQ ID NO 1: 5'-TAAATACCGACCTGCATGAATG-3', SEQ ID NO 2: 5'-CTCCATAAGAGCCAAAGCCC-3', SEQ ID NO 3: 5'-GGAAACCCTGAAGCAGCAACG-3', SEQ ID NO 4: 5'-CGCCTTCGCAATGAGTATTCCT-3', SEQ ID NO 5: 5'-АТСATAGGGCGTGCTTTACC-3', SEQ ID NO 6: 5'-AAAGGTTAGGCAGACGGCTT-3', очистку ПЦР продукта, сиквенсовую реакцию, очистку продукта сиквенсовой реакции, детекцию и анализ полученного результата, при этом тест-система содержит набор реагентов для проведения ПЦР, буфер, MgCl2, dNTP, Taq-полимеразу, образец ДНК и набор праймеров, SEQ ID NO 1: 5'-TAAATACCGACCTGCATGAATG-3', SEQ ID NO 2: 5'-CTCCATAAGAGCCAAAGCCC-3', SEQ ID NO 3: 5'-GGAAACCCTGAAGCAGC AACG-3', SEQ ID NO 4: 5'-CGCCTTCGCAATGAGTATTCCT-3', SEQ ID NO 5: 5'-ATCATAGGGCGTGCTTTACC-3', SEQ ID NO 6: 5'-AAAGGTTAGGCAGACGGCTT-3'.
| RU 2012113773 A, 20.10.2013 | |||
| WO 2017134627 A1, 10.08.2017 | |||
| ИСАЕВА Г.Ш | |||
| Резистентность H | |||
| pylori к антибактериальным препаратам и методы ее определения | |||
| КМАХ | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
Авторы
Даты
2023-11-01—Публикация
2022-06-23—Подача