ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит перечень последовательностей, который был подан в электронном виде в формате ASCII и включен в данный документ посредством ссылки во всей своей полноте. Указанная копия в формате ASCII, созданная 16 сентября 2019 года, имеет название PAT058251_ST25.txt, и ее размер составляет 147551 байта.
ОБЛАСТЬ ТЕХНИКИ
[001] Настоящее изобретение предусматривает антитела, которые связываются с белком, представляющим собой триггерный рецептор 2 человека, экспрессируемый на миелоидных клетках (TREM2), и стабилизируют его, и способы применения этих антител.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[002] Триггерные рецепторы, экспрессируемые на миелоидных клетках, или "TREM", представляют собой группу трансмембранных гликопротеинов, которые экспрессируются на различных типах миелоидных клеток, таких как макрофаги, дендритные клетки, остеокласты, клетки микроглии, тучные клетки, моноциты, эпителиальные клетки легких, клетки Лангерганса кожи, клетки Купфера и нейтрофилы (Takaki, R. et al., Immunol. Rev., 2006, 214: 118-29). TREM имеют характерную для иммуноглобулинов (Ig) укладку в своем внеклеточном домене и, таким образом, принадлежат к суперсемейству иммуноглобулинов (IgSF). Рецепторы TREM содержат короткий внутриклеточный домен, но у них отсутствуют стыковочные мотивы для медиаторов передачи сигнала, и им необходимы адаптерные белки, такие как DAP12 (DNAX-активирующий белок с массой 12 кДа), для клеточной активации. Сообщалось о двух представителях TREM: TREM1 и TREM2, оба из которых играют важную роль в иммунных и воспалительных ответах. Гены, кодирующие TREM человека, локализуются в хромосоме 6p21.1, несущей кластер генов, кодирующих TREM1, TREM2, TREM3, TREM4 и TREM5, а также TREM-подобные гены.
[003] TREM2 представляет собой гликопротеин с массой приблизительно 40 кДа, которая уменьшается до 26 кДа после N-дегликозилирования. Весь белок TREM2 состоит из ведущего сигнального пептида (аминокислоты 1-18), одной внеклеточной области IgSF типа V (аминокислоты 19-132), "стеблевой" области (аминокислоты 133-172), положительно заряженного трансмембранного домена (аминокислоты 173-197) и цитозольного хвоста (аминокислоты 198-230) (Kober et al., Elife 5 (2016); Kober et al., J. Mol. Biol. 429 (2017) 1607-1629). Внеклеточная область, кодируемая экзоном 2, состоит из одного домена IgSF типа V, содержащего три потенциальных сайта N-гликозилирования. Предполагаемая трансмембранная область содержит заряженный остаток лизина. Цитоплазматический хвост TREM2 лишен сигнальных мотивов и, как полагают, передает сигнал через сигнальную адаптерную молекулу DAP12/TRYROBP.
[004] TREM2 физически связывается с DAP12, который выполняет функцию сигнального адаптерного белка для TREM2 и ряда других рецепторов клеточной поверхности. Цитоплазматический домен DAP12 содержит иммунорецепторный тирозиновый активирующий мотив (ITAM) (Wunderlich, J. Biol. Chem. 288, 33027-33036, 2013). После активации взаимодействующего рецептора, DAP12 подвергается фосфорилированию по консервативным тирозиновым остаткам ITAM с помощью Src-киназ. Последующее рекрутирование и активация протеинкиназы Syk запускает последующие сигнальные пути, в том числе активацию митоген-активируемой протеинкиназы (MAPK), PI3K, NFκB и фосфолипазы Cγ (PLCγ).
[005] TREM2 может быть активирован липополисахаридами (LPS), белком 60 теплового шока, нейритным дебрисом, бактериями, аполипопротеином E и широким спектром анионных и цвиттер-ионных липидов, например фосфатидной кислотой (PA), фосфатидилглицеролом (PG), фосфатидилсерином (PS), фосфатидилинозитолом (PI), фосфатидилхолином (PC), кардиолипином и сфингомиелином. Активация TREM2 повышает фагоцитарную способность микроглии и макрофагов, снижает высвобождение провоспалительных цитокинов и ограничивает передачу сигнала с помощью TLR. TREM2 обеспечивает выживаемость микроглии путем синергизма с передачей сигнала с помощью рецептора CSF-1. Кроме того, TREM2 взаимодействует с плексином A1, регулируя клеточную адгезию и подвижность. TREM2 также обогащен на тех областях клеточной поверхности микроглии, которые контактируют с Aβ-бляшками или нейронным дебрисом (Yuan et al., Neuron 90 (2016) 724-739). Некоторые из лигандов, которые распознаются TREM2 в этой среде, были недавно идентифицированы, например фосфолипиды и липиды миелина (Poliani et al., J. Clin. Invest. 125 (2015): 2161-2170), а также ApoE (Atagi et al., J. Biol. Chem. 290 (2015): 26043-26050; Bailey et al., J. Biol. Chem. 290 (2015): 26033-26042). Другие лиганды могут представлять собой связанный с Aβ и бляшками нейронный дебрис, поскольку TREM2 участвует в поглощении Aβ в клетках микроглии (Xiang et al., EMBO Mol. Med. 8 (2016): 992-1004). Также было показано, что TREM2 играет роль в клиренсе апоптотических клеток (Takahashi et al., J. Exp. Med. 201 (2005), 647-657), миелинового дебриса (Poliani et al., J. Clin. Invest. 125 (2015): 2161-2170) и бактериальных гранул (Cen et al., Am. J. Respir. 188 (2013) 201-212). Передача сигнала с помощью TREM2 облегчает разрушение поглощенного объекта и имеет решающее значение для метаболизма липидов, поглощения миелина и внутриклеточного распада.
[006] TREM2 подвергается последовательной протеолитической обработке посредством шеддинга эктодомена и внутримембранного протеолиза (Wunderlich, J. Biol. Chem. 288, 33027-33036, 2013). Во время шеддинга эктодомена эктодомен TREM2 высвобождается с помощью протеаз, таких как представители семейств ADAM (белок, содержащий домены дизинтегрина и металлопротеиназы) или BACE (фермент, расщепляющий бета-сайт APP) (Kleinberger, Sci. Transl. Med. 2014; 6(243):243ra86).
[007] После удаления эктодомена оставшийся удерживаемый мембраной фрагмент дополнительно подвергается внутримембранному протеолизу, опосредованному γ-секретазой. Растворимые фрагменты TREM2 (sTREM2), полученные посредством шеддинга эктодомена, были обнаружены в супернатантах культур дендритных клеток, а также в образцах плазмы крови и CSF (спинномозговой жидкости) пациентов с невоспалительными неврологическими заболеваниями и рассеянным склерозом (Kleinberger, 2014). Подвергнутый шеддингу эктодомен TREM2, т.е. sTREM2, в CSF человека был оценен как потенциальный биомаркер болезни Альцгеймера (AD) и было показано, что его уровень повышается во время старения в целом (Suarez-Calvet, EMBO Mol. Med. 8, 466-476, 2016). Подробный анализ при AD выявил, что уровень sTREM2 повышается в начале AD до появления клинических симптомов, достигает пика при MCI-AD и остается повышенным, но с более низкими уровнями по сравнению со стадией MCI-AD при деменции, обусловленной AD (Suarez-Calvet, 2016).
[008] Увеличение экспрессии TREM2 на пике заболевания способствует устранению нарушения (например, при перитоните, заживлении ран) (Turnbull, 2006; Gawish, 2015). При хронических воспалительных состояниях, таких как нейровоспаление, TREM2 постоянно подвергается шеддингу и не может выполнять свою сигнальную функцию в микроглии и макрофагах. Следовательно, стабилизация и/или предотвращение шеддинга TREM2 с клеточной поверхности будет восстанавливать экспрессию функционального, способного к передаче сигналов TREM2 в микроглии и макрофагах.
[009] Генетические исследования на людях показывают, что потеря поверхностного TREM2, а не отсутствие sTREM2, повышает риск заболевания. Например, аминокислотная мутация в положении 47 от R до H в белке TREM2, например в SEQ ID NO: 1, вызывает незначительное снижение экспрессии на клеточной поверхности (Kleinberger 2014) и снижение способности TREM2 связывать лиганд (Wang 2015, Atagi 2015, Bailey 2015). Аминокислотная мутация T66M в TREM2 приводит к отсутствию экспрессии TREM2 на клеточной поверхности (Kleinberger 2014) и, следовательно, не образуется растворимый TREM2. Мутация в сайте расщепления TREM2: H157Y усиливает экспрессию sTREM2 и снижает уровень полноразмерного связанного с мембраной TREM2, а также ассоциирована с повышенным риском AD (Thornton 2017, Schlepckow 2017). Следовательно, эти генетические исследования позволяют предположить, что стабилизация TREM2 на клеточной поверхности необходима как для снижения уровня sTREM2, так и для повышения уровня связанного с плазматической мембраной TREM2.
[0010] Haass et al. (WO 18015573) получали антитела, связывающиеся с пептидом из 10 аминокислот (AHVEHSISRS SEQ ID NO: 132), охватывающим аминокислоты 152-161, расположенные в "стеблевой" области TREM2, и ингибирующие расщепление TREM2. Такие антитела предотвращают расщепление TREM2 путем прямого связывания и тем самым блокирования сайта расщепления. Schwabe et al. (WO 17062672) раскрывают связывание антител с TREM2. Однако ни для одного из раскрытых антител не указывается стабилизирующий эффект. Напротив, в отношении некоторых антител, описанных в WO 17062672, сообщается о дестабилизирующем эффекте (пример 15).
[0011] Следовательно, существует потребность в идентификации и разработке антител к hTREM2, которые бы стабилизировали TREM2 и активировали и/или способствовали функциям, связанным с TREM2, которые имеют хорошие характеристики в отношении возможности разработки и которые подходят для лечения пациентов, страдающих нейродегенеративным заболеванием, для которых стабилизация TREM2 является благоприятной.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0012] Опубликованная литература нацелена на "стеблевую" область TREM2 для получения антител, которые стабилизируют TREM2, поскольку сайт расщепления для ADAM17 находится внутри "стеблевой" области. Действительно, ожидается, что большая молекула, такая как антитело (или его связывающий фрагмент), будет стерически препятствовать доступу шеддазы к относительно небольшой "стеблевой" области (аминокислоты 133-172). Следовательно, неудивительно, что предыдущие попытки получить стабилизирующие антитела к TREM2 были нацелены на "стеблевую" область TREM2. Область IgSF TREM2 (аминокислоты 19-132 любой из SEQ ID NO: 1, 2 или 3), расположена дальше от сайта расщепления (H157) и является частью эктодомена. До сих пор область IgSF не рассматривалась в качестве потенциальной мишени для антител, которые могли бы стабилизировать TREM2, поскольку не ожидается, что антитела к области IgSF TREM2 будут стерически препятствовать доступу шеддазы к сайту расщепления TREM2.
[0013] Неожиданно авторы настоящего изобретения обнаружили, что описанные в данном документе антитела связываются с областью IgSF и способны эффективно стабилизировать TREM2 на поверхности клетки. Авторы настоящего изобретения также показали, что такие антитела способны проявлять функциональные последующие эффекты, такие как способствование TREM2-зависимому фагоцитозу в макрофагах M2A человека. Кроме того, такие антитела могут также усиливать TREM2-зависимые функции in vivo, например за счет увеличения фагоцитарной способности микроглии или макрофагов в головном мозге.
[0014] Соответственно, в данном документе предусмотрены антитела или их антигенсвязывающие фрагменты, например моноклональные антитела или их антигенсвязывающие фрагменты, которые специфически связываются с доменом IgSF TREM2 человека (hTREM2) и стабилизируют белок hTREM2. Такое антитело в данном документе называется "антителом кhTREM2 или его антигенсвязывающим фрагментом". Эти антитела к hTREM2 или их антигенсвязывающие фрагменты могут (i) снижать или ингибировать шеддинг эктодомена TREM2, (ii) стабилизировать белок TREM2 на клеточной поверхности и/или (iii) поддерживать или усиливать функции TREM2, такие как связывание с родственными ему лигандами, внутриклеточная передача сигналов, усиление фагоцитоза, способствование разрушению фагоцитарного материала и стимулирование TREM2-зависимых последующих регуляторных функций. Поскольку дисфункциональный TREM2 или отсутствие поверхностного TREM2 ассоциированы с нейровоспалительными и нейродегенеративными патологиями человека, антитело к hTREM2 или его антигенсвязывающий фрагмент, описанные в данном документе, можно использовать для лечения, предупреждения или диагностики нейровоспалительного или нейродегенеративного заболевания, такого как болезнь Альцгеймера, лобно-височная деменция, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Насу-Хакола, рассеянный склероз, боковой амиотрофический склероз (ALS), энцефалит с антителами к NMDA-рецепторам, аутизм, волчанка головного мозга (NP-SLE), индуцированная химиотерапией периферическая нейропатия (CIPN), постгерпетическая невралгия, хроническая воспалительная демиелинизирующая полинейропатия (CIDP), эпилепсия, синдром Гийена-Барре (GBS), миозит с тельцами включения, лизосомные болезни накопления, например сфингомиелинлипидоз (Ниманна-Пика C) и мукополисахаридоз II/ IIIB, метахроматическая лейкодистрофия, мультифокальная моторная нейропатия, миастения гравис, болезнь Бехчета с вовлечением нервных структур, оптиконейромиелит (NMO), неврит зрительного нерва, полимиозит, дерматомиозит, энцефалит Расмуссена, синдром Ретта, инсульт, поперечный миелит, травматическое повреждение головного мозга, повреждение спинного мозга, вирусный энцефалит или бактериальный менингит. Антитела к hTREM2 или их антигенсвязывающий фрагмент, описанные в данном документе, также подходят для лечения, предупреждения или диагностики аутоиммунных, воспалительных или злокачественных нарушений, опосредованных избыточным протеолитическим расщеплением TREM2 или клетками, экспрессирующими нарушенные или мутантные варианты рецептора TREM2, или ассоциированных с ними. В некоторых предпочтительных вариантах осуществления антитело к hTREM2 или его антигенсвязывающий фрагмент, описанные в данном документе, можно использовать для лечения, предупреждения или диагностики заболевания, выбранного из болезни Альцгеймера, лобно-височной деменции, болезни Паркинсона, бокового амиотрофического склероза или болезни Насу-Хакола. В данном документе также предусмотрены способы диагностики и/или лечения заболеваний, ассоциированных с TREM2, с использованием TREM2-связывающих антител или антигенсвязывающих фрагментов, раскрытых в данном документе.
[0015] В одном аспекте в данном документе предусмотрены антитела или их антигенсвязывающие фрагменты, которые специфически связываются с доменом IgSF белка TREM2 и стабилизируют белок TREM2. В некоторых предпочтительных вариантах осуществления эти антитела или их антигенсвязывающие фрагменты стабилизируют белок TREM2 на клеточной поверхности клетки, экспрессирующей TREM2, такой как макрофаг, дендритная клетка, остеокласт, клетка микроглии, тучные клетки, моноциты, эпителиальные клетки легких, клетки Лангерганса кожи, клетки Купфера, нейтрофилы или клетки гепатокарциномы. В некоторых вариантах осуществления эти антитела или их антигенсвязывающие фрагменты снижают протеолитический шеддинг эктодомена белка TREM2.
[0016] В некоторых вариантах осуществления в данном документе предусмотрены антитела или их антигенсвязывающие фрагменты, которые специфически связываются с доменом IgSF TREM2 человека. Например, такие антитела или их антигенсвязывающие фрагменты связываются с доменом IgSF TREM2 человека, который содержит аминокислотные остатки 19-132 из SEQ ID NO: 1, аминокислотные остатки 19-132 из SEQ ID NO: 2 или аминокислотные остатки 19-132 из SEQ ID NO: 3. В некоторых вариантах осуществления антитела к TREM2 представляют собой человеческие или гуманизированные антитела. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой Fab-, F(ab')2-, Fv-фрагменты, scFv, миниантитело или диатело.
[0017] В некоторых вариантах осуществления антитело к TREM2 представляет собой биспецифическое антитело. В некоторых вариантах осуществления биспецифическое антитело специфически связывается с TREM2 и DAP12 человека.
[0018] В некоторых вариантах осуществления антитело к TREM2 содержит Fc-область. В некоторых вариантах осуществления Fc-область представляет собой модифицированную Fc-область IgG1, которая имеет одну или несколько мутаций и характеризуется пониженной активностью антителозависимой клеточной цитотоксичности (ADCC) или комплементзависимой цитотоксичности (CDC) по сравнению с исходным антителом. В некоторых вариантах осуществления Fc-область выбрана из Fc-области IgG2, Fc-области IgG4 или гибридной Fc-области IgG2/IgG4.
[0019] В некоторых вариантах осуществления антитела к hTREM2 или их антигенсвязывающие фрагменты являются моноклональными. В данном документе предусмотрены нуклеиновые кислоты, кодирующие такие моноклональные антитела или их антигенсвязывающие фрагменты, а также векторы и клетки-хозяева, содержащие нуклеиновые кислоты, кодирующие такие моноклональные антитела или их антигенсвязывающие фрагменты.
[0020] В другом аспекте в данном документе предусмотрены фармацевтические композиции, содержащие одно или несколько антител к TREM2 или их антигенсвязывающих фрагментов, описанных в данном документе, или нуклеиновые кислоты, кодирующие такие антитела или антигенсвязывающие фрагменты, или клетки, содержащие такие нуклеиновые кислоты, и фармацевтически приемлемый носитель.
[0021] В другом аспекте в данном документе предусмотрены способы лечения заболевания, ассоциированного с потерей функции TREM2, у нуждающегося в этом субъекта путем введения субъекту терапевтически эффективного количества любого из антител к TREM2 или их антигенсвязывающих фрагментов, описанных в данном документе. Такие способы могут включать одну или несколько следующих стадий: (1) анализ уровня TREM2 на клеточной поверхности в образце, полученном от субъекта; (2) выбор субъекта, у которого уровень TREM2 на клеточной поверхности ниже эталонного уровня, где эталонный уровень представляет собой уровень TREM2 на клеточной поверхности в образце, полученном от здорового субъекта; и (3) введение субъекту терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента, которое специфически связывается с доменом IgSF белка TREM2 и стабилизирует белок TREM2. В некоторых вариантах осуществления такие способы дополнительно включают введение второго средства субъекту. Уровень TREM2 на клеточной поверхности в образце можно определить с помощью анализа, выбранного из проточной цитометрии, иммуногистохимического исследования, вестерн-блоттинга, иммунофлуоресцентного анализа, радиоиммуноанализа (RIA), твердофазного иммуноферментного анализа (ELISA), гомогенной флуоресценции с временным разрешением (HTRF) или позитронно-эмиссионной томографии (PET). В некоторых вариантах осуществления образец содержит спинномозговую жидкость и ее клеточные компоненты. В некоторых вариантах осуществления заболевание, ассоциированное с потерей функции TREM2, представляет собой нейровоспалительное или нейродегенеративное заболевание, такое как болезнь Альцгеймера, лобно-височная деменция, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Насу-Хакола, рассеянный склероз, боковой амиотрофический склероз (ALS), энцефалит с антителами к NMDA-рецепторам, аутизм, волчанка головного мозга (NP-SLE), индуцированная химиотерапией периферическая нейропатия (CIPN), постгерпетическая невралгия, хроническая воспалительная демиелинизирующая полинейропатия (CIDP), эпилепсия, синдром Гийена-Барре (GBS), миозит с тельцами включения, лизосомные болезни накопления, например сфингомиелинлипидоз (Ниманна-Пика C) и мукополисахаридоз II/IIIB, метахроматическая лейкодистрофия, мультифокальная моторная нейропатия, миастения гравис, болезнь Бехчета с вовлечением нервных структур, оптиконейромиелит (NMO), неврит зрительного нерва, полимиозит, дерматомиозит, энцефалит Расмуссена, синдром Ретта, инсульт, поперечный миелит, травматическое повреждение головного мозга, повреждение спинного мозга, вирусный энцефалит или бактериальный менингит. В некоторых предпочтительных вариантах осуществления заболевание, ассоциированное с потерей функции TREM2, представляет собой нейродегенеративное заболевание, выбранное из болезни Альцгеймера, лобно-височной деменции, болезни Паркинсона, бокового амиотрофического склероза или болезни Насу-Хакола. В дополнительном предпочтительном варианте осуществления заболевание представляет собой болезнь Альцгеймера. В некоторых вариантах осуществления антитела к TREM2 или их антигенсвязывающие фрагменты стабилизируют белок TREM2 на клеточной поверхности клетки, экспрессирующей TREM2, выбранной из макрофага, дендритной клетки, остеокласта, клетки микроглии, тучных клеток, моноцитов, эпителиальных клеток легких, клеток Лангерганса кожи, клеток Купфера, нейтрофилов или клеток гепатокарциномы. В некоторых вариантах осуществления антитело к TREM2 или его антигенсвязывающий фрагмент вводят субъекту пероральным, внутривенным, внутричерепным, интратекальным, подкожным или интраназальным путем.
[0022] В другом аспекте в данном документе предусмотрены антитела к TREM2 или их антигенсвязывающие фрагменты для использования при лечении заболевания, ассоциированного с потерей функции TREM2. В некоторых предпочтительных вариантах осуществления эти антитела или их антигенсвязывающие фрагменты специфически связываются с доменом IgSF белка TREM2 (т.е. с аминокислотными остатками 19-132 из SEQ ID NO: 1, аминокислотными остатками 19-132 из SEQ ID NO: 2 или аминокислотными остатками 19-132 из SEQ ID NO: 3) и стабилизируют белок TREM2. В некоторых предпочтительных вариантах осуществления антитела или их антигенсвязывающие фрагменты стабилизируют белок TREM2 на клеточной поверхности клетки, экспрессирующей TREM2, выбранной из макрофага, дендритной клетки, остеокласта, клетки микроглии, тучных клеток, моноцитов, эпителиальных клеток легких, клеток Лангерганса кожи, клеток Купфера, нейтрофилов или клеток гепатокарциномы. В некоторых вариантах осуществления заболевание, ассоциированное с потерей функции TREM2, представляет собой нейровоспалительное или нейродегенеративное заболевание, такое как болезнь Альцгеймера, лобно-височная деменция, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Насу-Хакола, рассеянный склероз, боковой амиотрофический склероз (ALS), энцефалит с антителами к NMDA-рецепторам, аутизм, волчанка головного мозга (NP-SLE), индуцированная химиотерапией периферическая нейропатия (CIPN), постгерпетическая невралгия, хроническая воспалительная демиелинизирующая полинейропатия (CIDP), эпилепсия, синдром Гийена-Барре (GBS), миозит с тельцами включения, лизосомные болезни накопления, например сфингомиелинлипидоз (Ниманна-Пика C) и мукополисахаридоз II/ IIIB, метахроматическая лейкодистрофия, мультифокальная моторная нейропатия, миастения гравис, болезнь Бехчета с вовлечением нервных структур, оптиконейромиелит (NMO), неврит зрительного нерва, полимиозит, дерматомиозит, энцефалит Расмуссена, синдром Ретта, инсульт, поперечный миелит, травматическое повреждение головного мозга, повреждение спинного мозга, вирусный энцефалит или бактериальный менингит. В некоторых предпочтительных вариантах осуществления заболевание, ассоциированное с потерей функции TREM2, представляет собой нейродегенеративное заболевание, выбранное из болезни Альцгеймера, лобно-височной деменции, болезни Паркинсона, бокового амиотрофического склероза или болезни Насу-Хакола. В дополнительном предпочтительном варианте осуществления заболевание представляет собой болезнь Альцгеймера. В некоторых вариантах осуществления антитела к TREM2 или их антигенсвязывающие фрагменты стабилизируют белок TREM2 на клеточной поверхности клетки, экспрессирующей TREM2, выбранной из макрофага, дендритной клетки, остеокласта, клетки микроглии, тучных клеток, моноцитов, эпителиальных клеток легких, клеток Лангерганса кожи, клеток Купфера, нейтрофилов или клеток гепатокарциномы.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0023] На фиг. 1A показано иллюстративное выравнивание аминокислотных последовательностей изоформы 1 TREM2 человека (SEQ ID NO: 1), изоформы 2 (SEQ ID NO: 2) и изоформы 3 (SEQ ID NO: 3).
[0024] На фиг. 1B проиллюстрированы структура TREM2 и его взаимодействие с сигнальным адаптерным белком DAP12. Зрелый TREM2 включает один домен иммуноглобулина (IgSF), "стеблевую" область, трансмембранный (TM) домен и цитоплазматический домен.
[0025] На фиг. 2 показана стабилизация TREM2 в клетках CHO-hDAP12-hTREM2 посредством обработки антителом.
[0026] На фиг. 3 показано связывание антител к TREM2 с макрофагами M2A человека до и после обработки с помощью PMA.
[0027] На фиг. 4 показано связывание антител с химерными белками WT-TREM2 (4A) и TREM2-TREM1, рекомбинантно экспрессируемыми в клетках CHO-hDAP12 (4B, C).
[0028] На фиг. 5 показана стабилизация TREM2 на клеточной поверхности hM2A с помощью антител к TREM2.
[0029] На фиг. 6 (A, B) показано, что антитела, которые стабилизируют TREM2 на клеточной поверхности, также повышают фагоцитарную способность M2A человека. Статистические данные рассчитывали с использованием T-критерия Стьюдента, *p-значение<0,05, **p-значение<0,01, ***p-значение<0,001 по сравнению с изотипическим контролем.
[0030] На фиг. 7 (A, B) показано определение самой низкой эффективной дозы в анализе фагоцитоза в hM2A. Статистические данные рассчитывали с использованием T-критерия Стьюдента, *p-значение<0,05, **p-значение<0,01, ***p-значение<0,001 по сравнению с изотипическим контролем.
[0031] На фиг. 8 показано, что связанные с планшетом антитела к TREM2 индуцируют TREM2-зависимую транскрипцию гена, зависимую от промотора NFAT.
[0032] На фиг. 9 (A, B) показано, что антитела к TREM2 увеличивают фосфорилирование Syk в макрофагах M2A человека. На (B) показано количественное определение pSyk в различных условиях в корреляции с общим количеством Syk из вестерн-блоттинга, показанного на (A).
[0033] На фиг. 10 показан фагоцитоз биочастиц S. aureus в течение 0-3 часов макрофагами M2A человека.
[0034] На фиг. 11 показан фагоцитоз клеток SH-SY5Y в течение 3-12 часов макрофагами M2A человека.
[0035] На фиг. 12 показано, что антитела к TREM2 способствуют хемотаксису макрофагов M2A человека.
[0036] На фиг. 13 показано, что антитела к TREM2 способствуют фагоцитозу в клетках микроглии, полученных из iPS человека, с использованием апоптотических меченных клеток SH-SY5Y, меченных с помощью pHrodo, и кумулятивного фагоцитоза в качестве регистрируемых данных.
[0037] На фиг. 14 показано, что антитела к TREM2 способствуют хемотаксису клеток микроглии, полученных из iPS человека.
[0038] На фиг. 15 (A-E) показаны результаты профилактического/сопутствующего и терапевтического лечения с помощью антитела к TREM2 в купризоновой модели.
[0039] На фиг. 16 показаны результаты анализа изображения (A) модели MPTP у мышей с гуманизированным TREM2 и репрезентативное изображение, полученное с помощью микроскопа, для каждой группы (B).
[0040] На фиг. 17 (A-C) показаны результаты экспериментов по перекрестному блокированию Fab MOR041877, MOR041895 и MOR042596 с полным IgG MOR041877, MOR41895, MOR042596, MOR044698 и MOR03207 в клетках CHO-hDAP12-hTREM2.
[0041] На фиг. 18 показано повышение фагоцитарной способности hM2A после обработки с помощью MOR042596.
[0042] На фиг. 19 показан эпитоп связывания TREM2 с MOR042596, определенный с помощью рентгеновской кристаллографии. Остов белка TREM2 показан на графическом изображении, а боковые цепи остатков TREM2 в пределах 5 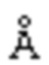 от Fab показаны в виде полосок. Тяжелая цепь Fab показана в виде темно-серой поверхности, а легкая цепь показана в виде светло-серой поверхности.
от Fab показаны в виде полосок. Тяжелая цепь Fab показана в виде темно-серой поверхности, а легкая цепь показана в виде светло-серой поверхности.
[0043] На фиг. 20 показан крупный план области контакта TREM2-Fab (ср. фиг. 19), сравнивающий MOR042596 (кристаллическая структура) и MOR044698 (гомологичная модель). Остатки TREM2 в пределах 5 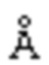 от Fab показаны в виде полосок, а остатки, проксимальные к LCDR3 (D39-K42), выделены. Тяжелая цепь (темно-серая, вверху справа), а также LCDR1 и LCDR2 легкой цепи (светло-серая, вверху слева) идентичны для обоих Fab. LCDR3 имеет несколько общих ключевых остатков (положения 90, 93, 95), сохраняя конформацию остовной петли LCDR3 одинаковой для обоих Fab. Имеют место изменения в положениях 89, 91, 92, 94, 96 и имеет место одна дополнительная вставка в MOR044698 (S95a). Общий эпитоп является консервативным между MOR042596 и MOR044698.
от Fab показаны в виде полосок, а остатки, проксимальные к LCDR3 (D39-K42), выделены. Тяжелая цепь (темно-серая, вверху справа), а также LCDR1 и LCDR2 легкой цепи (светло-серая, вверху слева) идентичны для обоих Fab. LCDR3 имеет несколько общих ключевых остатков (положения 90, 93, 95), сохраняя конформацию остовной петли LCDR3 одинаковой для обоих Fab. Имеют место изменения в положениях 89, 91, 92, 94, 96 и имеет место одна дополнительная вставка в MOR044698 (S95a). Общий эпитоп является консервативным между MOR042596 и MOR044698.
[0044] На фиг. 21 показан эпитоп связывания TREM2 с MOR041877, определенный с помощью рентгеновской кристаллографии. Остов белка TREM2 показан на графическом изображении, а боковые цепи остатков TREM2 в пределах 5 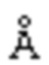 от Fab показаны в виде полосок. Тяжелая цепь Fab показана в виде темно-серой поверхности, а легкая цепь показана в виде светло-серой поверхности.
от Fab показаны в виде полосок. Тяжелая цепь Fab показана в виде темно-серой поверхности, а легкая цепь показана в виде светло-серой поверхности.
[0045] На фиг. 22 (A, B) показана кора головного мозга мышей hTREM2-KI, обработанных с помощью купризона и с помощью либо MOR044698-mu, либо антитела изотипического контроля, вместе с необработанными мышами в качестве контроля, окрашенными для определения TREM2 и Iba1 (A). Предоставляется количественный анализ нормализованной площади, положительный в отношении hTREM2 (B).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0046] В данном документе предусмотрены антитела и их антигенсвязывающие фрагменты, которые специфически связываются с внеклеточным доменом TREM2 человека и стабилизируют белок TREM2. Эти антитела к TREM2 и их антигенсвязывающие фрагменты могут снижать или ингибировать шеддинг эктодомена TREM2, могут стабилизировать белок TREM2 на клеточной поверхности и могут необязательно поддерживать или усиливать функции TREM2, такие как связывание с родственными ему лигандами, внутриклеточная передача сигналов, усиление фагоцитоза и способствование разрушению фагоцитарного материала. Поскольку дисфункциональный TREM2 или отсутствие поверхностного TREM2 ассоциированы с нейровоспалительными и нейродегенеративными патологиями человека, антитела, стабилизирующие TREM2, и их антигенсвязывающие фрагменты, описанные в данном документе, можно использовать для лечения, предупреждения или диагностики нейровоспалительного или нейродегенеративного заболевания, такого как болезнь Альцгеймера, лобно-височная деменция, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Насу-Хакола, рассеянный склероз, боковой амиотрофический склероз (ALS), энцефалит с антителами к NMDA-рецепторам, аутизм, волчанка головного мозга (NP-SLE), индуцированная химиотерапией периферическая нейропатия (CIPN), постгерпетическая невралгия, хроническая воспалительная демиелинизирующая полинейропатия (CIDP), эпилепсия, синдром Гийена-Барре (GBS), миозит с тельцами включения, лизосомные болезни накопления, например сфингомиелинлипидоз (Ниманна-Пика C) и мукополисахаридоз II/ IIIB, метахроматическая лейкодистрофия, мультифокальная моторная нейропатия, миастения гравис, болезнь Бехчета с вовлечением нервных структур, оптиконейромиелит (NMO), неврит зрительного нерва, полимиозит, дерматомиозит, энцефалит Расмуссена, синдром Ретта, инсульт, поперечный миелит, травматическое повреждение головного мозга, повреждение спинного мозга, вирусный энцефалит или бактериальный менингит. TREM2-связывающие антитела и их антигенсвязывающие фрагменты, описанные в данном документе, также подходят для лечения, предупреждения или диагностики аутоиммунных, воспалительных или злокачественных нарушений, опосредованных избыточным протеолитическим расщеплением TREM2 или клетками, экспрессирующими нарушенные или мутантные варианты рецептора TREM2, или связанных с ними. В некоторых предпочтительных вариантах осуществления антитело к hTREM2 или его антигенсвязывающий фрагмент, описанные в данном документе, можно использовать для лечения, предупреждения или диагностики заболевания, выбранного из болезни Альцгеймера, лобно-височной деменции, болезни Паркинсона, бокового амиотрофического склероза или болезни Насу-Хакола. В данном документе также представлены способы диагностики и/или лечения заболеваний, ассоциированных с TREM2, с использованием TREM2-связывающих антител и их антигенсвязывающих фрагментов, раскрытых в данном документе.
[0047] TREM2 опосредует невоспалительный фагоцитоз бактерий и погибающих клеток и ослабляет воспалительные ответы. Гомозиготная потеря функции TREM2 вызывает болезнь Насу-Хакола (поликистозную липомембранную остеодисплазию со склерозирующей лейкоэнцефалопатией, "PLOSL"), или синдром, подобный лобно-височной деменции (FTD), заболевания, характеризующиеся костными кистами, нейровоспалением, прогрессирующей нейродегенерацией и пресенильной деменцией. Гетерозиготная потеря функциональной мутации R47H TREM2 представляет собой также важный фактор риска в отношении болезни Альцгеймера (AD) с поздним началом, с величиной эффекта, которая подобна величине эффекта аллеля аполипопротеина E ε4. TREM2 экспрессируется в клетках микроглии, обнаруженной в белом веществе, гиппокампе и неокортексе, что частично согласуется с патологическими признаками, об обнаружении которых в головном мозге сообщалось при AD, подтверждая возможное участие TREM2 в патогенезе AD. С помощью генетических скринингов в настоящий момент также идентифицированы гетерозиготные миссенс-мутации в TREM2 как факторы риска в отношении болезни Паркинсона (PD), бокового амиотрофического склероза (ALS) и лобно-височной деменции (FTD), в дополнение к AD (Kleinberger, Sci Transl Med. 2014 Jul 2; 6(243):243ra86). Таким образом, функциональный TREM2 необходим для защиты против связанных со старением нейровоспалительных и нейродегенеративных заболеваний, которые вызывают тяжелое когнитивное нарушение и деменцию.
[0048] Из-за альтернативного сплайсинга у человека присутствуют три изоформы TREM2, при этом изоформа 1 является самой длинной изоформой. Выравнивание аминокислотных последовательностей изоформы 1 TREM2 человека (SEQ ID NO: 1), изоформы 2 TREM2 человека (SEQ ID NO: 2) и изоформы 3 TREM2 человека (SEQ ID NO: 3) представлено на фигуре 1А. На фигуре 1B проиллюстрированы структура TREM2 и его взаимодействие с сигнальным адаптерным белком DAP12.
Определения
[0049] Используемая в описании и формуле изобретения форма единственного числа включает ссылки на форму множественного числа, если контекст явно не указывает на иное. Например, термин "клетка" включает множество клеток, в том числе их смеси.
[0050] Все числовые обозначения, например, pH, температура, время, концентрация и молекулярная масса, в том числе диапазоны, являются приближенными значениями, которые варьируются в сторону (+) или (-) с шагом 0,1. Следует понимать, хотя это не всегда указано в явной форме, что всем числовым обозначениям предшествует термин "приблизительно". Термин "приблизительно" по отношению к числовому значению X означает, например, X ± 15%, включая все значения в этом диапазоне. Также следует понимать, хотя это не всегда указано в явной форме, что реагенты, описанные в данном документе, представляют собой лишь примеры и что соответствующие им эквиваленты известны из уровня техники.
[0051] Во всем данном описании и нижеследующей формуле изобретения, если контекст не требует иного, слово "содержать" и его варианты, такие как "содержит" и "содержащий", используются в данном документе в их открытом и неограничивающем смысле, если не указано иное.
[0052] При использовании в данном документе "состоящий из" исключает любые элемент, стадию или ингредиент, не указанные в аспекте, варианте осуществления и/или элементе формулы изобретения. При использовании в данном документе "состоящий по сути из" не исключает материалы или стадии, которые существенно не влияют на основные и новые характеристики аспекта, варианта осуществления и/или пункта формулы изобретения.
[0053] Используемый в данном документе термин "TREM2" (также известный как "триггерный рецептор 2, экспрессируемый на миелоидных клетках", TREM2, TREM2a, TREM2b или TREM2c) означает трансмембранный гликопротеин, который принадлежит к суперсемейству иммуноглобулинов (IgSF). Весь белок TREM2 (SEQ ID NO: 1) состоит из ведущего сигнального пептида (аминокислоты 1-18), одной внеклеточной области IgSF типа V (аминокислоты 19-132), "стеблевой" области (аминокислоты 133-172), положительно заряженного трансмембранного домена (аминокислоты 173-197) и цитозольного хвоста (аминокислоты 198-230) (Feuerbach et al., Neurosci. Lett. 660 (2017): 109-114). Ген TREM2 человека картирован на хромосоме в местоположении 6p21,1 и геномную последовательность гена TREM2 можно найти в GenBank (Gene ID: 54209). Из-за альтернативного сплайсинга у человека присутствуют три изоформы TREM2 (белковые последовательности доступны в ENSEMBL под ID ENSP00000362205, ENSP00000342651 и ENSP00000362214). Термин "TREM2" используют для обозначения всех изоформ TREM2. Последовательности белка и mRNA для самой длинной изоформы TREM2 человека представляют собой приведенное ниже.
Предшественник изоформы 1 предшественника триггерного рецептора 2, экспрессируемого на миелоидных клетках [Homo sapiens] (NP_061838.1)
MEPLRLLILLFVTELSGAHNTTVFQGVAGQSLQVSCPYDSMKHWGRRKAWCRQLGEKGPCQRVVSTHNLWLLSFLRRWNGSTAITDDTLGGTLTITLRNLQPHDAGLYQCQSLHGSEADTLRKVLVEVLADPLDHRDAGDLWFPGESESFEDAHVEHSISRSLLEGEIPFPPTSILLLLACIFLIKILAASALWAAAWHGQKPGTHPPSELDCGHDPGYQLQTLPGLRDT
(SEQ ID NO: 1)
Триггерный рецептор 2 Homo sapiens, экспрессируемый на миелоидных клетках (TREM2), вариант транскрипта 1, mRNA (эталонная последовательность NCBI: NM_018965.3)
gggcagcgcc tgacatgcct gatcctctct tttctgcagt tcaagggaaa gacgagatct tgcacaaggc actctgcttc tgcccttggc tggggaaggg tggcatggag cctctccggc tgctcatctt actctttgtc acagagctgt ccggagccca caacaccaca gtgttccagg gcgtggcggg ccagtccctg caggtgtctt gcccctatga ctccatgaag cactggggga ggcgcaaggc ctggtgccgc cagctgggag agaagggccc atgccagcgt gtggtcagca cgcacaactt gtggctgctg tccttcctga ggaggtggaa tgggagcaca gccatcacag acgataccct gggtggcact ctcaccatta cgctgcggaa tctacaaccc catgatgcgg gtctctacca gtgccagagc ctccatggca gtgaggctga caccctcagg aaggtcctgg tggaggtgct ggcagacccc ctggatcacc gggatgctgg agatctctgg ttccccgggg agtctgagag cttcgaggat gcccatgtgg agcacagcat ctccaggagc ctcttggaag gagaaatccc cttcccaccc acttccatcc ttctcctcct ggcctgcatc tttctcatca agattctagc agccagcgcc ctctgggctg cagcctggca tggacagaag ccagggacac atccacccag tgaactggac tgtggccatg acccagggta tcagctccaa actctgccag ggctgagaga cacgtgaagg aagatgatgg gaggaaaagc ccaggagaag tcccaccagg gaccagccca gcctgcatac ttgccacttg gccaccagga ctccttgttc tgctctggca agagactact ctgcctgaac actgcttctc ctggaccctg gaagcaggga ctggttgagg gagtggggag gtggtaagaa cacctgacaa cttctgaata ttggacattt taaacactta caaataaatc caagactgtc atatttagct ggataaaaaa aaaaaaaaaa aaaaaa
(SEQ ID NO: 133)
[0054] Аминокислотные последовательности изоформы 2 TREM2 человека (SEQ ID NO: 2) и изоформы 3 (SEQ ID NO: 3) показаны на фиг. 1A. Используемый в данном документе термин "белок TREM2 человека" также охватывает белки, которые по всей длине последовательности на по меньшей мере приблизительно 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичны любой из SEQ ID NO: 1, 2 или 3, где такие белки все еще имеют способность к связыванию лиганда, внутриклеточной передаче сигналов, облегчению фагоцитоза и разрушению фагоцитарного материала и другим регуляторным функциям TREM2. Последовательности белков TREM2 мыши, яванского макака (cyno) и других животных известны из уровня техники (например, NP_112544.1 и NP_001259007.1 для мышиного белка TREM2).
[0055] Термин "внеклеточный домен" означает часть трансмембранного белка, которая расположена на внеклеточной стороне липидного бислоя клетки. Способы определения эктодомена белка известны из уровня техники (Singer (1990); High et al. (1993), и программное обеспечение McVector, Oxford Molecular). Например, внеклеточный домен белка TREM2 человека может включать аминокислотные остатки от 19 до 172 из SEQ ID NO: 1.
[0056] Термин "эктодомен" TREM2 означает часть внеклеточного домена TREM2, которая высвобождается после расщепления шеддазой. Сообщается, что сайт расщепления находится между аминокислотами H157 и S158 (Feuerbach et al., Neurosci. Lett. 660 (2017): 109-114). Следовательно, эктодомен hTREM2 будет состоять из аминокислот 19-157 любой из SEQ ID NO: 1, 2 или 3.
[0057] Термин "домен IgSF" относится к части внеклеточного домена TREM2, имеющей характерную для иммуноглобулинов (Ig) укладку и, таким образом, принадлежащей к суперсемейству иммуноглобулинов. У человека, например, домен IgSF состоит из аминокислотных остатков 19-132 из любой из SEQ ID NO: 1, 2 и 3.
[0058] Термин "стеблевая" область TREM2 означает часть внеклеточного домена TREM2, которая соединяет домен иммуноглобулина V-типа (IgSF) и трансмембранный домен. Например, "стеблевая" область изоформы 1 белка TREM2 человека может включать аминокислоты 133-172 из SEQ ID NO: 1.
[0059] Термин "трансмембранный домен" означает часть трансмембранного белка, которая охватывает липидный бислой клетки. Способы определения трансмембранного домена белка известны из уровня техники (Elofsson et al., Annu. Rev. Biochem. 76 (2007):125-140; Bernsel et al., Protein Science 14 (2005):1723-1728).
[0060] Термины "цитоплазматический домен" и "цитоплазматический хвост" используют взаимозаменяемо, и они означают часть трансмембранного белка, которая находится на цитоплазматической стороне липидного бислоя клетки. Способы определения цитоплазматического хвоста белка известны из уровня техники (Elofsson et al. (2007) and Bernsel et al. (2005)).
[0061] Термин "стабилизировать", используемый в данном документе, относится к поддержанию, восстановлению или повышению уровня TREM2 на клеточной поверхности в клетке, экспрессирующей TREM2, например до уровня TREM2 в соответствующей клетке, экспрессирующей TREM2, у здорового субъекта без воспалительного или нейродегенеративного заболевания. Это может быть достигнуто, например, за счет снижения или ингибирования шеддинга эктодомена TREM2 или за счет повышения экспрессии TREM2 на клеточной поверхности. Уровень TREM2 на клеточной поверхности можно оценить с помощью проточной цитометрии/FACS или с помощью иммунопреципитации TREM2 на клеточной поверхности, или по снижению растворимого TREM2 с течением времени. Экспрессия TREM2 на клеточной поверхности также может быть обнаружена с помощью твердофазного иммуноферментного анализа (ELISA), радиоиммуноанализа (RIA), биологических анализов (например, повышение фагоцитоза), вестерн-блот-анализа, проточной цитометрии, иммуногистохимического исследования, иммунофлуоресцентного анализа, гомогенной флуоресценции с временным разрешением (HTRF) или позитронно-эмиссионной томографии (PET).
[0062] Термин "активировать" в данном документе относится к инициированию или сохранению последующей передачи сигнала TREM2, экспрессируемого на клеточной поверхности, например в клетках, экспрессирующих TREM2, у здоровых субъектов или индивидов с воспалительными или нейродегенеративными заболеваниями, у которых нарушены соответствующие TREM2-зависимые активности. Это может быть выполнено без ограничения посредством фосфорилирования TREM2-ассоциированного DAP12 или DAP10, ведущего через различные внутриклеточные сигнальные каскады к усилению фосфорилирования Syk, фагоцитозу, усилению направленной на мишень клеточной подвижности (хемотаксиса), увеличению выживаемости клеток, модуляции высвобождения цитокинов или хемокинов клеток, экспрессирующих TREM2, увеличивая разрушение внутриклеточного фагоцитированного материала, или к изменению в экспрессии генов. Повышенное TREM2-зависимое фосфорилирование DAP12 или Syk можно оценить с помощью вестерн-блоттинга, ELISA или проточной цитометрии/FACS. Направленную подвижность клеток, например хемотаксис, можно оценить с помощью биологических анализов. Модуляцию высвобождения цитокинов можно оценить с помощью твердофазного иммуноферментного анализа (ELISA), радиоиммуноанализа (RIA) или проточной цитометрии/FACS. Изменения в экспрессии генов можно оценить с помощью количественной RT-PCR на уровне mRNA, или с помощью вестерн-блоттинга или проточной цитометрии на уровне белка.
[0063] Термин "способствовать" в данном документе относится к усилению или восстановлению нарушенных болезнью TREM2-зависимых активностей. Эти активности могут включать фагоцитоз, повышенную направленную на мишень клеточную подвижность (хемотаксис), повышенную выживаемость клеток, модуляцию высвобождения цитокинов или хемокинов клетками, экспрессирующими TREM2, усиление разрушения внутриклеточного фагоцитированного материала, модуляцию клеточных ответов соседних клеток (астроцитов/нейронов) или изменения в экспрессии генов.
[0064] Используемый в данном документе термин "антитело" относится к последовательности белка или полипептида, полученной из молекулы иммуноглобулина, которая специфически связывается с антигеном. Антитела могут являться поликлональными или моноклональными, многоцепочечными или одноцепочечными или интактными иммуноглобулинами и могут быть получены из природных источников или из рекомбинантных источников. Встречающееся в природе "антитело" представляет собой гликопротеин, содержащий по меньшей мере две тяжелые (H) цепи и две легкие (L) цепи, соединенные между собой посредством дисульфидных связей. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно обозначаемой в данном документе как VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов - CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно обозначаемой в данном документе как VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена - CL. VH- и VL-области могут быть дополнительно подразделены на области гипервариабельности, называемые областями, определяющими комплементарность (CDR), которые чередуются с более консервативными областями, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбоксильному концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, в том числе с различными клетками иммунной системы (например, эффекторными клетками) и первым компонентом (C1q) классического пути активации системы комплемента. Антитело может представлять собой моноклональное антитело, человеческое антитело, гуманизированное антитело, камелизированное антитело или химерное антитело. Антитела могут относиться к любому изотипу (например, IgG, IgE, IgM, IgD, IgA и IgY), классу (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассу. В данном документе термин "антитело" или "молекула антитела" также включает любые их фрагменты и любые их производные, если в контексте не указано иное.
[0065] Термин "фрагмент антитела" или "антигенсвязывающий фрагмент" относится к по меньшей мере одной части антитела, которая сохраняет способность специфически взаимодействовать (например, посредством связывания, стерического несоответствия, стабилизации/дестабилизации, пространственного распределения) с эпитопом антигена. Примеры фрагментов антител включают без ограничения Fab-, Fab'-, F(ab')2-, Fv-фрагменты, scFv-фрагменты антител, Fv, стабилизированные дисульфидными связями (sdFv), Fd-фрагмент, состоящий из VH- и CH1-доменов, линейные антитела, однодоменные антитела, такие как sdAb (либо VL, либо VH), VHH-домены верблюдовых, полиспецифические антитела, образованные из фрагментов антител, таких как бивалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области, и выделенную CDR или другие эпитопсвязывающие фрагменты антитела. Антигенсвязывающий фрагмент также может быть включен в состав однодоменных антител, максиантител, миниантител, нанотел, интрател, диател, триател, тетрател, v-NAR и бис-scFv (см., например, Hollinger and Hudson, Nature Biotechnology 23:1126-1136, 2005). Антигенсвязывающие фрагменты также могут быть привиты на остовы на основе полипептидов, таких как фибронектин III типа (Fn3) (см. патент США №6703199, в котором описаны миниантитела на основе полипептида фибронектина). Термин "scFv" относится к слитому белку, который содержит по меньшей мере один фрагмент антитела, содержащий вариабельную область легкой цепи, и по меньшей мере один фрагмент антитела, содержащий вариабельную область тяжелой цепи, где вариабельные области легкой и тяжелой цепей непрерывно связаны друг с другом, например посредством синтетического линкера, например короткого гибкого полипептидного линкера, и способны экспрессироваться в виде одноцепочечного полипептида, и где scFv сохраняет специфичность интактного антитела, из которого он получен. Если не указано иное, то используемый в данном документе scFv может иметь вариабельные VL- и VH-области в любом порядке, например, относительно N-конца и С-конца полипептида scFv может содержать VL-линкер-VH или может содержать VH-линкер-VL.
[0066] Термины "область, определяющая комплементарность" или "CDR", используемые в данном документе, относятся к последовательностям из аминокислот в вариабельных областях антитела, которые придают антигенную специфичность и аффинность связывания. Например, как правило, три CDR находятся в каждой вариабельной области тяжелой цепи (например, HCDR1, HCDR2 и HCDR3), и три CDR находятся в каждой вариабельной области легкой цепи (LCDR1, LCDR2 и LCDR3). Точные границы аминокислотной последовательности указанной CDR можно определить с применением любой из ряда широко известных схем, в том числе описанных в Kabat et al. (1991), "Sequences of Proteins of Immunological Interest," 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (схема нумерации по "Kabat"), Al-Lazikani et al., (1997) JMB 273, 927-948 (схема нумерации по "Chothia") или их комбинации и схемы нумерации ImMunoGenTics (IMGT) (Lefranc, M.-P., The Immunologist, 7, 132-136 (1999); Lefranc, M.-P. et al., Dev. Comp. Immunol., 27, 55-77 (2003); Lefranc et al., (2015) Nucleic Acids Res. 43, D413-422) (схема нумерации "IMGT"). Согласно комбинированной схеме нумерации по Kabat и Chothia для указанной CDR-области (например, HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 или LCDR3) в некоторых вариантах осуществления CDR соответствуют аминокислотным остаткам, которые определены как часть CDR по Kabat, вместе с аминокислотными остатками, которые определены как часть CDR по Chothia. Как используется в данном документе, CDR, определенные в соответствии со схемой нумерации "по Chothia", также иногда называют "гипервариабельными петлями". Согласно IMGT CDR-области антитела можно определять с помощью программы IMGT/DomainGap Align. Как правило, если конкретно не указано иное, молекулы антител могут содержать любую комбинацию из одной или нескольких CDR по Kabat и/или CDR по Chothia.
[0067] Термин "эпитоп" включает любую белковую детерминанту, способную специфично связываться с иммуноглобулином или иным образом взаимодействовать с молекулой. Эпитопные детерминанты обычно состоят из химически активных поверхностных групп молекул, таких как аминокислоты или углеводные или сахарные боковые цепи, и могут обладать специфическими характеристиками трехмерной структуры, а также специфическими характеристиками заряда. Эпитоп может быть "линейным" или "конформационным". Конформационные и линейные эпитопы отличаются, например, тем, что связывание с первым, но не с последним, утрачивается в присутствии денатурирующих растворителей.
[0068] "Связывает тот же эпитоп, что и" означает способность антитела, фрагмента антитела или другого антигенсвязывающего фрагмента связываться со специфическим антигеном и связываться с тем же эпитопом, что и приведенное в качестве примера антитело, при использовании той же методики картирования эпитопа для сравнения антител. Эпитопы приведенного в качестве примера антитела и других антител можно определить с использованием методик картирования эпитопов. Методики картирования эпитопов хорошо известны в данной области техники. Например, конформационные эпитопы с легкостью идентифицируют путем определения пространственной конформации аминокислот, как, например, с помощью водород/дейтериевого обмена, рентгеновской кристаллографии и двумерного ядерного магнитного резонанса.
[0069] В другом варианте осуществления настоящее изобретение относится к антителу или фрагменту антитела, которые перекрестно конкурируют с антителом, описанным в таблице 1.
[0070] В одном варианте осуществления настоящее изобретение относится к антителу или фрагменту антитела, где указанные антитело или фрагмент антитела перекрестно конкурируют с антителом или фрагментом антитела, содержащим 6 CDR, определенных любым из способов по Kabat, Chothia, IMGT или комбинированным способом по Kabat/Chothia, одного или нескольких антител из таблицы 1.
[0071] В другом варианте осуществления настоящее изобретение относится к антителу или фрагменту антитела, которые связываются (например, путем связывания и/или стабилизации) с тем же эпитопом, что и одно из антител из таблицы 1.
[0072] В дополнительном варианте осуществления указанное антитело или его антигенсвязывающий фрагмент связываются (например, путем связывания и/или стабилизации) с эпитопом, перекрывающим эпитоп антитела или фрагмента антитела, содержащего 6 CDR, определенных любым из способов по Kabat, Chothia, IMGT или комбинированным способом по Kabat/Chothia, любого антитела из таблицы 1.
[0073] Термин "одновалентное антитело", используемый в данном документе, относится к антителу, которое связывается с одним эпитопом в молекуле-мишени.
[0074] Термин "двухвалентное антитело", используемый в данном документе, относится к антителу, которое связывается с двумя эпитопами в по меньшей мере двух идентичных молекулах-мишенях. Двухвалентное антитело может также перекрестно связывать молекулы-мишени друг с другом. "Двухвалентное антитело" также относится к антителу, которое связывается с двумя разными эпитопами в по меньшей мере двух идентичных молекулах-мишенях.
[0075] Термин "поливалентное антитело" относится к отдельной связывающей молекуле с "валентностью", превышающей единицу, где "валентность" описывается как количество антигенсвязывающих компонентов на молекулу конструкции антитела. Таким образом, отдельная связывающая молекула может связываться с более чем одним связывающим участком в молекуле-мишени. Примеры поливалентных антител включают без ограничения бивалентные антитела, тривалентные антитела, тетравалентные антитела, пентавалентные антитела и т.п., так же как биспецифические антитела и бипаратопные антитела. Например, в случае с TREM2 поливалентное антитело (например, бипаратопное антитело к TREM2) имеет связывающий компонент для двух доменов TREM2 соответственно.
[0076] Термин "поливалентное антитело" также относится к отдельной связывающей молекуле, которая имеет более одного антигенсвязывающего компонента для двух отдельных молекул-мишеней. Например, антитело, которое связывается с TREM2 и со второй молекулой-мишенью, которая не является TREM2. В одном варианте осуществления поливалентное антитело представляет собой четырехвалентное антитело, которое имеет четыре эпитопсвязывающих домена. Четырехвалентная молекула может быть биспецифической и двухвалентной для каждого связывающего участка в данной молекуле-мишени.
[0077] Термин "биспецифическое антитело", используемый в данном документе, относится к антителу, которое связывается с двумя или более разными эпитопами. В некоторых вариантах осуществления биспецифическое антитело связывается с двумя разными мишенями. В некоторых вариантах осуществления биспецифическое антитело связывается с двумя разными эпитопами в одной молекуле-мишени. Антитело, которое связывается с двумя разными эпитопами в одной молекуле-мишени, также известно как "бипаратопное антитело".
[0078] Фразы "моноклональное антитело" или "композиция на основе моноклональных антител", используемые в данном документе, относятся к полипептидам, в том числе антителам, биспецифическим антителам и т.д., которые имеют по существу идентичную аминокислотную последовательность или получены из одного и того же генетического источника. Данный термин также охватывает препараты на основе молекул антител одного молекулярного состава. Композиция на основе моноклональных антител проявляет один тип специфичности и аффинности связывания в отношении конкретного эпитопа.
[0079] Используемая в данном документе фраза "человеческое антитело" охватывает антитела, имеющие вариабельные области, в которых как каркасные области, так и CDR-области получены из последовательностей человеческого происхождения. Константная область также получена из человеческих последовательностей, например, человеческих последовательностей зародышевого типа, или мутантных вариантов человеческих последовательностей зародышевого типа, или антитела, содержащего консенсусные последовательности каркасных областей, полученные в результате анализа последовательностей человеческих каркасных областей, например, как описано в Knappik, et al. (2000. J Mol Biol 296, 57-86). Структуры и местоположения вариабельных доменов иммуноглобулина, например CDR, можно определить с помощью хорошо известных схем нумерации, например схемы нумерации по Kabat, схемы нумерации по Chothia или комбинации схем нумерации по Kabat и Chothia и схемы нумерации ImMunoGenTics (IMGT) (см., например, Sequences of Proteins of Immunological Interest, U.S. Department of Health and Human Services (1991), eds. Kabat et al.; Al Lazikani et al., (1997) J. Mol. Bio. 273:927-948; Kabat et al., (1991) Sequences of Proteins of Immunological Interest, 5th edit., NIH Publication no. 91-3242 U.S. Department of Health and Human Services; Chothia et al., (1987) J. Mol. Biol. 196:901-917; Chothia et al., (1989) Nature 342:877-883; та Al-Lazikani et al., (1997) J. Mal. Biol. 273:927-948; Lefranc, M.-P., The Immunologist, 7, 132-136 (1999); Lefranc, M.-P. et al., Dev. Comp. Immunol., 27, 55-77 (2003); Lefranc et al., (2015) Nucleic Acids Res. 43, D413-422.
[0080] Человеческие антитела по настоящему изобретению могут содержать аминокислотные остатки, которые не закодированы в человеческих последовательностях (например, мутации, введенные посредством случайного или сайт-специфического мутагенеза in vitro или благодаря соматическим мутациям in vivo, или консервативную замену, которая содействует стабильности или изготовлению). Однако подразумевается, что используемый в данном документе термин "человеческое антитело" не включает антитела, в которых последовательности CDR, полученные из последовательностей зародышевого типа от другого вида млекопитающего, такого как мышь, были привиты на последовательности человеческих каркасных областей.
[0081] Фраза "рекомбинантное человеческое антитело", используемая в данном документе, включает все человеческие антитела, полученные, экспрессированные, созданные или выделенные посредством рекомбинантных способов, такие как антитела, выделенные из животного (например, мыши), которое является трансгенным или трансхромосомным по генам человеческих иммуноглобулинов, или гибридомы, полученной из него, антитела, выделенные из клетки-хозяина, трансформированной для экспрессии человеческого антитела, например из трансфектомы, антитела, выделенные из рекомбинантной комбинаторной библиотеки человеческих антител, и антитела, полученные, экспрессированные, созданные или выделенные с помощью любых других способов, которые включают сплайсинг всех последовательностей гена человеческого иммуноглобулина или их части с получением других последовательностей ДНК. Такие рекомбинантные человеческие антитела имеют вариабельные области, в которых каркасные области и CDR-области получены из последовательностей человеческого иммуноглобулина зародышевого типа. Однако в определенных вариантах осуществления такие рекомбинантные человеческие антитела могут быть подвергнуты мутагенезу in vitro (или, в случае использования животного, трансгенного по последовательностям человеческого Ig, соматическому мутагенезу in vivo), и, таким образом, аминокислотные последовательности VH- и VL-областей рекомбинантных антител представляют собой последовательности, которые, хотя и получены из человеческих последовательностей VH и VL зародышевого типа и являются родственными им, могут не существовать в естественных условиях в репертуаре человеческих антител зародышевого типа in vivo.
[0082] Термин "Fc-область", используемый в данном документе, относится к полипептиду, содержащему CH3, CH2 и по меньшей мере часть шарнирной области константного домена антитела. Fc-область может необязательно содержать CH4-домен, присутствующий в некоторых классах антител. Fc-область может содержать всю шарнирную область константного домена антитела. В одном варианте осуществления в настоящем изобретении предусмотрены Fc-область и CH1-область антитела. В одном варианте осуществления в настоящем изобретении предусмотрена CH3-область Fc-области антитела. В другом варианте осуществления в настоящем изобретении предусмотрены Fc-область, CH1-область и C-каппа/лямбда-область константного домена антитела. В одном варианте осуществления связывающая молекула по настоящему изобретению содержит константную область, например, константную область тяжелой цепи. В одном варианте осуществления такая константная область является модифицированной по сравнению с константной областью дикого типа. Иными словами, полипептиды по настоящему изобретению, раскрытые в данном документе, могут содержать изменения или модификации одного или нескольких из трех константных доменов тяжелой цепи (CH1, CH2 или CH3) и/или домена константной области легкой цепи (CL). Примеры модификаций включают добавления, делеции или замены одной или нескольких аминокислот в одном или нескольких доменах. Такие изменения могут быть включены с целью оптимизации эффекторной функции, периода полужизни и т.д.
[0083] Используемый в данном документе термин "аффинность" относится к силе взаимодействия между антителом и антигеном в отдельных антигенных сайтах. В пределах каждого антигенного сайта вариабельные области антитела взаимодействуют с антигеном посредством слабых сил нековалентного взаимодействия во многих сайтах; при этом чем больше взаимодействий, тем сильнее аффинность. Используемый в данном документе термин "высокая аффинность" в отношении IgG или его фрагмента (например, Fab-фрагмента) относится к антителу, которое характеризуется аффинностью, составляющей 10-8 M или меньше, 10-9 M или меньше, или 10-10 M, или 10-11 M или меньше, или 10-12 M или меньше, или 10-13 M или меньше, в отношении целевого антигена. Однако, высокоаффинное связывание может варьироваться в случае с другими изотипами антител. Например, высокоаффинное связывание для изотипа IgM относится к антителу, которое характеризуется аффинностью, составляющей 10-7 М или меньше или 10-8 М или меньше.
[0084] Предполагается, что используемые в данном документе термины "Kассоц.", "Ka" или "Kon" относятся к скорости ассоциации для конкретного взаимодействия антитело-антиген, тогда как термины "Kдисс.", "Kd" или "Koff", как предполагается, относятся к скорости диссоциации для конкретного взаимодействия антитело-антиген. В одном варианте осуществления предполагается, что используемый в данном документе термин "KD" (или "KD") относится к константе диссоциации, которую получают из отношения Kd к Ka (т.е. Kd/Ka) и которая выражена в виде молярной концентрации (M). Значения KD для антител можно определить с помощью способов, хорошо известных в данной области техники. Способ определения KD антитела осуществляют с помощью поверхностного плазмонного резонанса или с помощью биосенсорной системы, такой как система Biacore®.
[0085] Используемый в данном документе термин "авидность" относится к информативной мере общей стабильности или прочности комплекса антитело-антиген. Она контролируется тремя основными факторами: аффинностью антитела к эпитопу; валентностью как антигена, так и антитела; а также структурным расположением взаимодействующих частей. В конечном итоге данные факторы определяют специфичность антитела, другими словами, вероятность того, что конкретное антитело свяжется с определенным антигенным эпитопом.
[0086] Термин "специфичность связывания" или "специфически связывается", используемый в данном документе, относится к способности отдельного антигенсвязывающего центра антитела вступать в реакцию с одной антигенной детерминантой, а не с другой антигенной детерминантой. Антигенсвязывающий центр антитела располагается в Fab-части молекулы и сформирован из гипервариабельных областей тяжелой и легкой цепей. Аффинность связывания антитела представляет собой силу реакции между одной антигенной детерминантой и одним антигенсвязывающим центром антитела. Она представляет собой сумму сил притяжения и отталкивания, действующих между антигенной детерминантой и антигенсвязывающим центром антитела.
[0087] Термины "лечить" и "лечение" относятся к терапевтическому лечению, где целью является замедление нежелательного физиологического изменения или нарушения. Для целей настоящего изобретения благоприятные или необходимые клинические результаты включают без ограничения выявляемое или невыявляемое ослабление симптомов, уменьшение степени выраженности заболевания, стабилизацию (т.е. отсутствие ухудшения) состояния заболевания, задержку или замедление прогрессирования заболевания, облегчение или смягчение болезненного состояния и ремиссию (частичную либо полную). "Лечение" может также означать продление выживаемости по сравнению с ожидаемой выживаемостью при отсутствии получения лечения.
[0088] Термины "предупреждение", "предупреждать" и "осуществление предупреждения" любого конкретного заболевания или нарушения относятся к профилактическим или предупредительным мерам, таким как введение соединения по настоящему изобретению субъекту до того, как станут очевидными какие-либо симптомы этого заболевания или нарушения.
[0089] Термин "субъект" относится к животному, являющемуся человеком или отличному от человека, для которого проводят лечение в соответствии со способами по настоящему изобретению. Предусматриваются ветеринарные и неветеринарные пути применения. Данный термин включает без ограничения млекопитающих, например, людей, других приматов, свиней, грызунов, таких как мыши и крысы, кроликов, морских свинок, хомяков, коров, лошадей, кошек, собак, овец и коз. Типичные субъекты включают людей, сельскохозяйственных животных и домашних питомцев, таких как кошки и собаки. В некоторых предпочтительных вариантах осуществления субъектом является человек.
[0090] "Эффективное количество" относится к количеству, достаточному для достижения благоприятных или необходимых результатов. Например, терапевтическое количество представляет собой такое количество, при котором достигается необходимый терапевтический эффект. Данное количество может быть таким же, как и профилактически эффективное количество, которое представляет собой количество, необходимое для предупреждения начала проявления заболевания или симптомов заболевания, или отличным от него. Эффективное количество можно вводить посредством одного или нескольких введений, применений или доз. "Терапевтически эффективное количество" терапевтического соединения (т.е. эффективная доза) зависит от выбранных терапевтических соединений. Композиции можно вводить от одного или нескольких раз в день до одного или нескольких раз в неделю; в том числе один раз в два дня. Специалист в данной области поймет, что на дозу и временные рамки, требуемые для эффективного лечения субъекта, могут влиять определенные факторы, в том числе без ограничения тяжесть заболевания или нарушения, предыдущие виды лечения, общее состояние здоровья и/или возраст субъекта и наличие других заболеваний. Более того, лечение субъекта терапевтически эффективным количеством терапевтических соединений, описанных в данном документе, может включать одну процедуру лечения или курс лечения.
[0091] Термин "нуклеиновая кислота" или "полинуклеотид" относится к дезоксирибонуклеиновым кислотам (ДНК) или рибонуклеиновым кислотам (РНК) и их полимерам в однонитевой или двухнитевой форме. Если конкретно не ограничено, термин охватывает нуклеиновые кислоты, содержащие известные аналоги природных нуклеотидов, которые имеют свойства связывания, подобные свойствам эталонной нуклеиновой кислоты, и метаболизируются способом, подобным способу для встречающихся в природе нуклеотидов. Если не указано иное, конкретная последовательность нуклеиновой кислоты также в неявной форме охватывает ее варианты с консервативными модификациями (например, с заменами кодонов вырожденными кодонами), аллели, ортологи, SNP и комплементарные последовательности, а также указанную в явной форме последовательность. В частности, замены вырожденными кодонами можно осуществлять посредством создания последовательностей, в которых в третьем положении одного или нескольких выбранных (или всех) кодонов произведена замена любым из канонических оснований и/или дезоксиинозиновыми остатками (Batzer et al., Nucleic Acid Res. 19:5081 (1991); Ohtsuka et al., J. Biol. Chem. 260:2605-2608 (1985); и Rossolini et al., Mol. Cell. Probes 8:91-98 (1994)).
[0092] Термины "пептид", "полипептид" и "белок" используются взаимозаменяемо и относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должен содержать по меньшей мере две аминокислоты, и не установлено ограничение на максимальное количество аминокислот, которые может содержать последовательность белка или пептида. Полипептиды включают любой пептид или белок, содержащий две или более аминокислоты, соединенные друг с другом пептидными связями. Используемый в данном документе термин относится как к коротким цепям, которые также, как правило, называются в данной области техники, например, пептидами, олигопептидами и олигомерами, так и к более длинным цепям, которые обычно называются в данной области техники белками, которых существует множество типов. "Полипептиды" включают, например, среди прочего, биологически активные фрагменты, по существу гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, слитые белки. Полипептид включает природный пептид, рекомбинантный пептид или их комбинацию.
[0093] Термин "консервативные модификации последовательности" относится к аминокислотным модификациям, которые не оказывают значительного влияния на характеристики связывания антитела или фрагмента антитела, содержащих данную аминокислотную последовательность, или значительно не изменяют их. Такие консервативные модификации включают аминокислотные замены, добавления и делеции. Модификации могут быть введены в антитело или фрагмент антитела по настоящему изобретению с помощью стандартных методик, известных из уровня техники, таких как сайт-направленный мутагенез и ПЦР-опосредованный мутагенез. Консервативные аминокислотные замены представляют собой замены, при которых аминокислотный остаток заменяется аминокислотным остатком, имеющим сходную боковую цепь. Семейства аминокислотных остатков, имеющих сходные боковые цепи, были определены в уровне техники. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или несколько аминокислотных остатков в антителе или его антигенсвязывающем фрагменте по настоящему изобретению можно заменить другими аминокислотными остатками из того же семейства боковых цепей, и измененное антитело или антигенсвязывающий фрагмент можно протестировать с использованием функциональных анализов, описанных в данном документе.
[0094] Термины "гомологичный" или "идентичный" относятся к идентичности последовательностей субъединиц двух полимерных молекул, например двух молекул нуклеиновой кислоты, таких как две молекулы ДНК или две молекулы РНК, или двух молекул полипептидов. Если положение субъединицы в обеих из двух молекул занимает одна и та же мономерная субъединица, например, если положение в каждой из двух молекул ДНК занято аденином, то они являются гомологичными или идентичными по данному положению. Гомология между двумя последовательностями находится в прямой зависимости от количества совпадающих или гомологичных положений; например, если половина (например, пять положений в полимере длиной десять субъединиц) положений в двух последовательностях являются гомологичными, то эти две последовательности являются гомологичными на 50%; если 90% положений (например, 9 из 10) являются совпадающими или гомологичными, то эти две последовательности являются гомологичными на 90%. Процент "идентичности последовательностей" можно определить путем сравнения двух оптимально выровненных последовательностей в пределах окна сравнения, при этом для оптимального выравнивания этих двух последовательностей фрагмент аминокислотной последовательности в окне сравнения может содержать добавления или делеции (например, гэпы или выступы) по сравнению с эталонной последовательностью (которая не содержит добавлений или делеций). Процент можно рассчитать путем определения количества положений, в которых в обеих последовательностях встречается идентичный аминокислотный остаток, с получением количества совпадающих положений, деления количества совпадающих положений на общее количество положений в окне сравнения и умножения результата на 100 с получением процента идентичности последовательностей. Результатом является процент идентичности рассматриваемой последовательности относительно запрашиваемой последовательности.
[0095] Термин "выделенный" означает измененный относительно природного состояния или извлеченный из него. Например, нуклеиновая кислота или пептид, в естественных условиях присутствующие в живом животном, не являются "выделенными", однако те же нуклеиновая кислота или пептид, частично или полностью отделенные от материалов, сопутствующих им в их природном состоянии, являются "выделенными". Выделенные нуклеиновая кислота или белок могут находиться в по существу очищенной форме или могут находиться в ненативной среде, такой как, например, клетка-хозяин. Выделенное антитело по существу не содержит других антител, имеющих другие типы антигенной специфичности (например, выделенное антитело, которое специфически связывается с TREM2, по существу не содержит антител, которые специфически связываются с антигенами, отличными от TREM2). Выделенное антитело, которое специфически связывается с молекулой-мишенью, может, однако, характеризоваться перекрестной реактивностью с теми же антигенами из других видов, например выделенное антитело, которое специфически связывается с TREM2, может связываться с молекулами TREM2 из других видов. Выделенное антитело может представлять собой моноклональное антитело. Выделенное антитело может представлять собой рекомбинантное моноклональное антитело. Более того, выделенное антитело может по существу не содержать других клеточного материала и/или химических веществ.
[0096] Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понятно специалисту обычной квалификации в области техники, к которой относится настоящее изобретение. Хотя при осуществлении на практике настоящего изобретения можно применять способы и материалы, подобные или эквивалентные тем, которые описаны в данном документе, ниже описаны подходящие способы и материалы. Все публикации, заявки на патент, патенты и другие литературные источники, упомянутые в данном документе, включены посредством ссылки во всей своей полноте. В случае противоречия настоящее описание, включая определения, имеет преимущественную силу. Кроме того, материалы, способы и примеры являются исключительно иллюстративными и не предполагаются как ограничивающие.
[0097] Подробности одного или нескольких вариантов осуществления настоящего изобретения изложены в прилагаемых графических материалах и описании ниже. Другие признаки, цели и преимущества настоящего изобретения будут очевидны из описания и графических материалов, а также из формулы изобретения.
Антитела, стабилизирующие функциональный TREM2
[0098] В данном документе предусмотрены антитела и их антигенсвязывающие фрагменты, которые стабилизируют TREM2 на клеточной поверхности. Эти антитела или их антигенсвязывающие фрагменты могут достигать стабилизации TREM2, препятствуя протеолитическому расщеплению TREM2 и/или уменьшая шеддинг эктодомена белка TREM2. В некоторых предпочтительных вариантах осуществления эти антитела или их антигенсвязывающие фрагменты специфически связываются с доменом IgSF TREM2 человека, например с аминокислотными остатками 19-132 из любой из SEQ ID NO: 1, 2 или 3.
[0099] Поскольку снижение или отсутствие TREM2 на клеточной поверхности ассоциированы с нейровоспалительными и нейродегенеративными патологиями человека, антитела, стабилизирующие TREM2, или их антигенсвязывающие фрагменты, описанные в данном документе, можно использовать для лечения, предупреждения или диагностики нейровоспалительных и нейродегенеративных заболеваний, таких как болезнь Альцгеймера, лобно-височная деменция, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Насу-Хакола, рассеянный склероз, боковой амиотрофический склероз (ALS), энцефалит с антителами к NMDA-рецепторам, аутизм, волчанка головного мозга (NP-SLE), индуцированная химиотерапией периферическая нейропатия (CIPN), постгерпетическая невралгия, хроническая воспалительная демиелинизирующая полинейропатия (CIDP), эпилепсия, синдром Гийена-Барре (GBS), миозит с тельцами включения, лизосомные болезни накопления, например сфингомиелинлипидоз (Ниманна-Пика C) и мукополисахаридоз II/IIIB, метахроматическая лейкодистрофия, мультифокальная моторная нейропатия, миастения гравис, болезнь Бехчета с вовлечением нервных структур, оптиконейромиелит (NMO), неврит зрительного нерва, полимиозит, дерматомиозит, энцефалит Расмуссена, синдром Ретта, инсульт, поперечный миелит, травматическое повреждение головного мозга, повреждение спинного мозга, вирусный энцефалит или бактериальный менингит. В некоторых предпочтительных вариантах осуществления антитело к hTREM2 или его антигенсвязывающий фрагмент, описанные в данном документе, можно использовать для лечения, предупреждения или диагностики заболевания, выбранного из болезни Альцгеймера, лобно-височной деменции, болезни Паркинсона, бокового амиотрофического склероза или болезни Насу-Хакола.
[00100] Из-за своих фармакологических профилей антитела к hTREM2 или их антигенсвязывающие фрагменты, описанные в данном документе, будут применимы для лечения таких разнообразных заболеваний или состояний, как заболевания, связанные с ЦНС, заболевания, связанные с ПНС, системное воспаление и другие заболевания, связанные с воспалением, болью и синдромом отмены, вызванными злоупотреблением химическими веществами. Заболевания или нарушения, связанные с CNS, включают генерализованные тревожные расстройства, когнитивные расстройства, дефициты и дисфункции обучения и памяти, болезнь Альцгеймера (легкой, умеренной и тяжелой степени), синдром дефицита внимания и гиперактивности, болезнь Паркинсона, деменцию при болезни Паркинсона, болезнь Хантингтона, ALS, прионные нейродегенеративные нарушения, такие как болезнь Крейтцфельдта-Якоба и болезнь куру, синдром Жиля де ла Туретта, психоз, депрессию и депрессивные расстройства, манию, маниакальную депрессию, шизофрению, когнитивные дефициты при шизофрении, обсессивно-компульсивные расстройства, панические расстройства, расстройства пищевого поведения, нарколепсию, ноцицепцию, ассоциированную со СПИДом деменцию, сенильную деменцию, легкое когнитивное нарушение, связанное с возрастом (MCI), нарушение памяти, связанное с возрастом, аутизм, дислексию, позднюю дискинезию, эпилепсию и судорожные расстройства, посттравматические стрессовые расстройства, временную гипоксию, псевдодеменцию, предменструальный синдром, синдром поздней лютеиновой фазы, синдром хронической усталости и синдром смены часовых поясов.
[00101] Антитела к hTREM2 или их антигенсвязывающие фрагменты, описанные в данном документе, особенно подходят для лечения, предупреждения или диагностики аутоиммунных, воспалительных или злокачественных нарушений, опосредованных или связанных с избыточным протеолитическим расщеплением TREM2, или с клетками, экспрессирующими нарушенные или мутантные варианты рецептора TREM2. Примеры аутоиммунных заболеваний включают без ограничения артрит (например, ревматоидный артрит, хронический прогрессирующий артрит и деформирующий артрит) и ревматические заболевания, включающие воспалительные состояния, и ревматические заболевания, включающие потерю костной массы, боль при воспалительном процессе, спондилоартропатии, в том числе анкилозирующий спондилоартрит, болезнь Рейтера, реактивный артрит, псориатический артрит и энтеропатический артрит, гиперчувствительность (включающая как гиперчувствительность дыхательных путей, так и кожную гиперчувствительность) и виды аллергии. Аутоиммунные заболевания включают аутоиммунные гематологические нарушения (в том числе, например, гемолитическую анемию, апластическую анемию, эритробластопению и идиопатическую тромбоцитопению), системную красную волчанку, воспалительные мышечные нарушения, полихондрию, склеродермию, гранулематоз Вегенера, дерматомиозит, хронический активный гепатит, миастению гравис, псориаз, синдром Стивенса-Джонсона, идиопатический синдром мальабсорбции, эндокринную офтальмопатию, болезнь Грейвса, саркоидоз, рассеянный склероз, первичный билиарный цирроз, ювенильный диабет (сахарный диабет I типа), увеит (передний и задний), синдром сухого глаза и весенний кератоконъюнктивит, интерстициальный фиброз легких, псориатический артрит и гломерулонефрит (с нефротическим синдромом и без него, например, в том числе подагру, гистиоцитоз клеток Лангерганса, идиопатический нефротический синдром или нефропатию минимальных изменений), опухоли, воспалительное заболевание кожи и роговицы, миозит, потерю костных имплантатов, метаболические нарушения, такие как атеросклероз, диабет и дислипидемия.
[00102] Антитела к hTREM2 или их антигенсвязывающие фрагменты, описанные в данном документе, также являются применимыми для лечения, предупреждения или облегчения астмы, бронхита, пневмокониоза, эмфиземы легких и других обструктивных или воспалительных заболеваний дыхательных путей, включая идиопатический фиброз легких или COPD.
[00103] Антитела к hTREM2 или их антигенсвязывающие фрагменты, описанные в данном документе, могут быть использованы для лечения злокачественного нарушения, затрагивающего органы кроветворения или печень, такого как острый миелоидный лейкоз, хронический миелоидный лейкоз, миелопролиферативные нарушения, миелодиспластические синдромы, множественная миелома, пароксизмальная ночная гемоглобинурия, анемия Фанкони, большая талассемия, синдром Вискотта-Олдрича, гемофагоцитарный лимфогистиоцитоз.
[00104] Антитела к hTREM2 или их антигенсвязывающие фрагменты, описанные в данном документе, можно использовать для лечения любого заболевания или расстройства, прямо или косвенно связанного с нарушенной активностью и/или экспрессией TREM2. Связанные с TREM2 нарушения включают: иммунологические нарушения, особенно включающие воспалительные нарушения (например, бактериальная инфекция, грибковая инфекция, вирусная инфекция, инфекция, вызванная простейшими, или другая паразитарная инфекция, псориаз, септицемия, церебральная малярия, воспалительное заболевание кишечника, артрит, такой как ревматоидный артрит, фолликулит, импетиго, гранулемы, липоидные пневмонии, васкулит и остеоартрит), аутоиммунные нарушения (например, ревматоидный артрит, тиреоидит, такой как тиреоидит Хашимото и болезнь Грейвса, инсулинорезистентный диабет, пернициозная анемия, болезнь Аддисона, пузырчатка, витилиго, язвенный колит, системная красная волчанка (SLE), синдром Шегрена, рассеянный склероз, дерматомиозит, смешанное заболевание соединительной ткани, склеродермия, полимиозит, отторжение трансплантата, такое как отторжение аллотрансплантата), T-клеточные нарушения (например, AIDS), аллергические воспалительные нарушения (например, виды кожной аллергии и/или виды аллергии с вовлечением слизистых оболочек, такие как аллергический ринит, астма, псориаз), неврологические нарушения, нарушения со стороны органов зрения, эмбриональные нарушения или любые другие нарушения (например, опухоли, виды рака, лейкоз, миелоидные заболевания и травмы), которые непосредственно или опосредованно ассоциированы с нарушенной активностью и/или экспрессией TREM2.
[00105] В некоторых вариантах осуществления связанное с TREM2 нарушение выбрано из астмы, энцефалита, воспалительного заболевания кишечника, хронического обструктивного заболевания легких (COPD), аллергических нарушений, септического шока, фиброза легких, недифференцированной спондилоартропатии, недифференцированной артропатии, артрита, воспалительного остеолиза или хронического воспаления в результате хронических вирусных или бактериальных инфекций.
[00106] В некоторых вариантах осуществления связанное с TREM2 нарушение выбрано из деменции, лобно-височной деменции, болезни Альцгеймера, сосудистой деменции, смешанной деменции, болезни Крейтцфельдта-Якоба, нормотензивной гидроцефалии, бокового амиотрофического склероза, болезни Хантингтона, таупатии, болезни Насу-Хакола, инсульта, острой травмы, хронической травмы, волчанки, острого и хронического колита, нарушения заживления ран, болезни Крона, воспалительного заболевания кишечника, язвенного колита, ожирения, малярии, эссенциального тремора, волчанки центральной нервной системы, болезни Бехчета, болезни Паркинсона, деменции с тельцами Леви, множественной системной атрофии, синдрома Шая-Дрейджера, прогрессирующего надъядерного паралича, кортикальной базальной ганглионарной дегенерации, острого рассеянного энцефаломиелита, гранулематозных нарушений, саркоидоза, заболеваний, связанных со старением, пароксизмальных судорог, повреждения спинного мозга, травматического повреждения головного мозга, возрастной макулярной дегенерации, глаукомы, пигментной дистрофии сетчатки, дегенерации сетчатки, инфекции дыхательных путей, сепсиса, глазной инфекции, системной инфекции, волчанки, артрита, рассеянного склероза, низкой плотности костной ткани, остеопороза, нарушения остеогенеза, остеопетроза, костной болезни Педжета и рака. В некоторых предпочтительных вариантах осуществления связанное с TREM2 нарушение выбрано из списка, состоящего из болезни Альцгеймера, лобно-височной деменции, болезни Паркинсона, бокового амиотрофического склероза или болезни Насу-Хакола.
[00107] В некоторых предпочтительных вариантах осуществления связанное с TREM2 нарушение выбрано из деменции, лобно-височной деменции, болезни Альцгеймера, болезни Насу-Хакола и рассеянного склероза. В некоторых предпочтительных вариантах осуществления связанное с TREM2 нарушение представляет собой деменцию, такую как лобно-височная деменция, болезнь Альцгеймера, сосудистая деменция, семантическая деменция или деменция с тельцами Леви. В более предпочтительном варианте осуществления связанное с TREM2 нарушение представляет собой болезнь Альцгеймера. В другом предпочтительном варианте осуществления нарушение представляет собой болезнь Паркинсона.
Антитела и их антигенсвязывающие фрагменты, которые специфически связываются с TREM2 человека
[00108] В одном аспекте в данном документе предусмотрены антитела или их антигенсвязывающие фрагменты, например моноклональные антитела или их антигенсвязывающие фрагменты, которые специфически связываются с доменом IgSF белка TREM2 человека ("антитела к hTREM2 или их антигенсвязывающие фрагменты"). Эти антитела или антигенсвязывающие фрагменты могут стабилизировать белок TREM2 на клеточной поверхности и/или уменьшать шеддинг эктодомена белка TREM2.
[00109] В некоторых вариантах осуществления антитела к hTREM2 или их антигенсвязывающие фрагменты, предусмотренные в данном документе, содержат CDR1 тяжелой цепи (HCDR1), CDR2 тяжелой цепи (HCDR2), CDR3 тяжелой цепи (HCDR3), а также CDR1 легкой цепи (LCDR1), CDR2 легкой цепи (LCDR2) и CDR3 легкой цепи (LCDR3). В некоторых вариантах осуществления антитела к hTREM2 или антигенсвязывающие фрагменты, предусмотренные в данном документе, содержат вариабельную область тяжелой цепи (VH), содержащую CDR1, CDR2 и CDR3, и вариабельную область легкой цепи (VL), содержащую CDR1, CDR2 и CDR3. В некоторых вариантах осуществления антитела к hTREM2 или антигенсвязывающие фрагменты, предусмотренные в данном документе, содержат последовательность полноразмерной тяжелой цепи (HC) и последовательность полноразмерной легкой цепи (LC).
[00110] В таблице 1 перечислены последовательности иллюстративных антител к TREM2 или антигенсвязывающих фрагментов, которые специфически связываются с белком TREM2 человека. По всему тексту настоящей заявки может быть несоответствие между текстом описания (например, в таблице 1) и перечнем последовательностей, при этом текст описания имеет преимущественную силу.
Таблица 1. Последовательности иллюстративных моноклональных антител, которые связываются с TREM2 человека
[00111] В некоторых вариантах осуществления антитело к hTREM2 или его антигенсвязывающий фрагмент содержат VH-домен, имеющий аминокислотную последовательность любого VH-домена, описанного в таблице 1. Другие подходящие антитела к hTREM2 или их антигенсвязывающие фрагменты могут содержать аминокислоты, которые были подвергнуты мутации, но при этом они характеризуются по меньшей мере 80-, 85-, 90-, 95-, 96-, 97-, 98- или 99-процентной идентичностью в VH-домене с VH-областями, показанными в последовательностях, описанных в таблице 1. В определенных вариантах осуществления в настоящем изобретении также предусмотрены антитела или их антигенсвязывающие фрагменты, которые специфически связываются с TREM2 человека, где антитела или фрагменты антител (например, антигенсвязывающие фрагменты) содержат CDR VH, имеющую аминокислотную последовательность любой из HCDR, перечисленных в таблице 1. В конкретных вариантах осуществления в настоящем изобретении предусмотрены антитела или фрагменты антител (например, антигенсвязывающие фрагменты), которые специфически связываются с TREM2 человека, содержащие одну, две, три, четыре, пять или больше CDR VH, имеющих аминокислотную последовательность любой из HCDR, перечисленных в таблице 1 (или, в качестве альтернативы, состоящие из них).
[00112] В некоторых вариантах осуществления антитело к hTREM2 или фрагмент антитела (например, антигенсвязывающий фрагмент) содержат VL-домен, имеющий аминокислотную последовательность любого VL-домена, описанного в таблице 1. Другие подходящие антитела или фрагменты антител (например, антигенсвязывающие фрагменты) к TREM2 человека могут содержать аминокислоты, которые были подвергнуты мутации, но при этом они характеризуются по меньшей мере 80-, 85-, 90-, 95-, 96-, 97-, 98- или 99-процентной идентичностью в VL-домене с VL-областями, показанными в последовательностях, описанных в таблице 1. В настоящем изобретении также предусмотрены антитела или фрагменты антител (например, антигенсвязывающие фрагменты), которые специфически связываются с TREM2 человека, при этом антитела или фрагменты антител (например, антигенсвязывающие фрагменты) содержат CDR VL, имеющую аминокислотную последовательность любой из LCDR, перечисленных в таблице 1. В частности, в настоящем изобретении предусмотрены антитела или фрагменты антител (например, антигенсвязывающие фрагменты), которые специфически связываются с TREM2 человека, содержащие одну, две, три или больше CDR VL, имеющих аминокислотную последовательность любой из LCDR, перечисленных в таблице 1 (или, в качестве альтернативы, состоящие из них).
[00113] Другие антитела или фрагменты антител (например, антигенсвязывающий фрагмент) к TREM2 человека, раскрытые в данном документе, содержат аминокислоты, которые были подвергнуты мутации, но при этом они характеризуются по меньшей мере 80-, 85-, 90-, 95-, 96-, 97-, 98- или 99-процентной идентичностью в CDR-областях с CDR-областями, показанными в последовательностях, описанных в таблице 1. В некоторых вариантах осуществления они содержат мутантные аминокислотные последовательности, в которых не более 1, 2, 3, 4 или 5 аминокислот были подвергнуты мутации в CDR-областях по сравнению с CDR-областями, показанными в последовательности, описанной в таблице 1.
[00114] В данном документе также предусмотрены последовательности нуклеиновых кислот, которые кодируют VH, VL, полноразмерную тяжелую цепь и полноразмерную легкую цепь антител и их антигенсвязывающих фрагментов, которые специфически связываются с TREM2 человека, например, последовательности нуклеиновых кислот из таблицы 1. Такие последовательности нуклеиновых кислот могут быть оптимизированы для экспрессии в предполагаемых клетках-хозяевах, например клетках млекопитающих.
[00115] Другие антитела к TREM2 человека, раскрытые в данном документе, включают антитела, в которых аминокислоты или нуклеиновые кислоты, кодирующие аминокислоты, были подвергнуты мутации, но при этом они характеризуются по меньшей мере 80-, 85-, 90-, 95-, 96-, 97-, 98- или 99-процентной идентичностью с последовательностями, описанными в таблице 1. В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты содержат мутантные аминокислотные последовательности, где не более 1, 2, 3, 4 или 5 аминокислот были подвергнуты мутации в вариабельных областях по сравнению с вариабельными областями, показанными в последовательности, описанной в таблице 1, при этом они сохраняют по существу такую же терапевтическую активность.
[00116] Поскольку каждое предусмотренное антитело связывается с TREM2 человека, последовательности (аминокислотные последовательности и нуклеотидные последовательности, кодирующие аминокислотные последовательности) VH, VL, полноразмерной легкой цепи и полноразмерной тяжелой цепи можно подвергать "смешиванию и подбору" для создания других TREM2-связывающих антител, раскрытых в данном документе. Такие подвергнутые "смешиванию и подбору" TREM2-связывающие антитела можно тестировать с применением анализов связывания, известных из уровня техники (например, разновидностей ELISA, анализов, описанных в иллюстративных примерах). В случае, когда цепи подвергают смешиванию и подбору, последовательность VH из конкретной пары VH/VL следует заменить структурно сходной последовательностью VH. Последовательность полноразмерной тяжелой цепи из конкретной пары полноразмерная тяжелая цепь/полноразмерная легкая цепь следует заменить структурно сходной последовательностью полноразмерной тяжелой цепи. Последовательность VL из конкретной пары VH/VL следует заменить структурно сходной последовательностью VL. Последовательность полноразмерной легкой цепи из конкретной пары полноразмерная тяжелая цепь/полноразмерная легкая цепь следует заменить структурно сходной последовательностью полноразмерной легкой цепи.
[00117] Соответственно, в одном варианте осуществления в настоящем изобретении предусмотрены выделенные моноклональное антитело или его антигенсвязывающий фрагмент, имеющие: вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность, выбранную из любой из SEQ ID NO: 13 и 50; и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность, выбранную из любой из SEQ ID NO: 24 и 61; где антитело специфически связывается с TREM2 человека.
[00118] В другом варианте осуществления в настоящеи изобретении предусмотрены (i) выделенное моноклональное антитело, имеющее полноразмерную тяжелую цепь (HC), содержащую аминокислотную последовательность, выбранную из любой из SEQ ID NO: 15, 29, 33, 35, 37, 39, 52, 66, 70, 72, 74, 76; и полноразмерную легкую цепь (LC), содержащую аминокислотную последовательность, выбранную из любой из SEQ ID NO: 26 и 63; или (ii) функциональный белок, содержащий его антигенсвязывающую часть.
[00119] В другом варианте осуществления в настоящем изобретении предусмотрены связывающиеся с TREM2 человека антитела или их фрагменты антител, которые содержат CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи, описанные в таблице 1, или их комбинации. Аминокислотные последовательности HCDR1 антител показаны под SEQ ID NO: 4, 7, 8, 10, 41, 44, 45, 47. Аминокислотные последовательности HCDR2 антител показаны под SEQ ID NO: 5, 9, 11, 42, 46, 48. Аминокислотные последовательности HCDR3 антител показаны под SEQ ID NO: 6, 12, 43, 49. Аминокислотные последовательности LCDR1 антител показаны под SEQ ID NO: 17, 20, 23, 54, 57, 60. Аминокислотные последовательности LCDR2 антител показаны под SEQ ID NO: 18, 21, 55, 58. Аминокислотные последовательности LCDR3 антител показаны под SEQ ID NO: 19, 22, 56, 59, 56.
[00120] С учетом того, что каждое из антител связывается с TREM2 человека и что специфичность связывания с антигеном обеспечивается преимущественно CDR1-, CDR2- и CDR3-областями, последовательности CDR1, CDR2 и CDR3 VH и последовательности CDR1, CDR2 и CDR3 VL можно подвергнуть "смешиванию и подбору" (т.е. CDR из различных антител можно подвергнуть смешиванию и подбору), при том что каждое антитело должно содержать CDR1, CDR2 и CDR3 VH и CDR1, CDR2 и CDR3 VL, для создания других антител, связывающихся с TREM2 человека, раскрытых в данном документе. Такие подвергнутые "смешиванию и подбору" связывающие TREM2 антитела можно тестировать с применением анализов связывания, известных из уровня техники и описанных в разделе "Примеры" (например, разновидностей ELISA). В случае, когда последовательности CDR VH подвергают смешиванию и подбору, последовательность CDR1, CDR2 и/или CDR3 из конкретной последовательности VH следует заменить структурно сходной (сходными) последовательностью (последовательностями) CDR. Аналогичным образом, в случае, когда последовательности CDR VL подвергают смешиванию и подбору, последовательность CDR1, CDR2 и/или CDR3 из конкретной последовательности VL следует заменить структурно сходной (сходными) последовательностью (последовательностями) CDR. Специалисту обычной квалификации в данной области будет совершенно очевидно, что новые последовательности VH и VL можно создавать путем замены одной или нескольких последовательностей CDR-областей VH и/или VL структурно сходными последовательностями из последовательностей CDR, показанных в данном документе для моноклональных антител по настоящему изобретению.
[00121] Соответственно, в настоящем изобретении представлены выделенные моноклональное антитело или его антигенсвязывающая область, содержащие CDR1 тяжелой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 4, 7, 8, 10, 41, 44, 45, 47; CDR2 тяжелой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5, 9, 11, 42, 46, 48; CDR3 тяжелой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 6, 12, 43, 49; CDR1 легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 17, 20, 23, 54, 57, 60; CDR2 легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 18, 21, 55, 58; и CDR3 легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 19, 22, 56, 59, 56; где антитело специфически связывается с TREM2 человека.
[00122] В определенных вариантах осуществления антитело, которое специфически связывается с TREM2 человека, представляет собой антитело или фрагмент антитела (например, антигенсвязывающий фрагмент), которые описаны в таблице 1. В некоторых вариантах осуществления антитело или его антигенсвязывающая область, которая специфически связывается с TREM2 человека, включает область 1, определяющую комплементарность тяжелой цепи (HCDR1), содержащую аминокислотную последовательность под SEQ ID NO: 4, 7, 8 или 10; область 2, определяющую комплементарность, тяжелой цепи (HCDR2), содержащую аминокислотную последовательность под SEQ ID NO: 5, 9 или 11; область 3, определяющую комплементарность, тяжелой цепи (HCDR3), содержащую аминокислотную последовательность под SEQ ID NO: 6 или 12; область 1, определяющую комплементарность, легкой цепи (LCDR1), содержащую аминокислотную последовательность под SEQ ID NO: 17, 20 или 23; область 2, определяющую комплементарность, легкой цепи (LCDR2), содержащую аминокислотную последовательность под SEQ ID NO: 18 или 21; и область 3, определяющую комплементарность, легкой цепи (LCDR3), содержащую аминокислотную последовательность под SEQ ID NO: 19 или 22.
[00123] В некоторых вариантах осуществления антитело или его антигенсвязывающая область, которые специфически связываются с TREM2 человека, содержат HCDR1, содержащую аминокислотную последовательность под SEQ ID NO: 41, 44, 45 или 47; HCDR2, содержащую аминокислотную последовательность под SEQ ID NO: 42, 46 или 48; HCDR3, содержащую аминокислотную последовательность под SEQ ID NO: 43 или 49; LCDR1, содержащую аминокислотную последовательность под SEQ ID NO: 54, 57 или 60; LCDR2, содержащую аминокислотную последовательность под SEQ ID NO: 55 или 58; и LCDR3, содержащую аминокислотную последовательность под SEQ ID NO: 56 или 59.
[00124] В некоторых вариантах осуществления антитело или его антигенсвязывающая область, которые специфически связываются с TREM2 человека, содержат вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность под SEQ ID NO: 13 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации), и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность под SEQ ID NO: 24 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации).
[00125] В некоторых вариантах осуществления антитело или его антигенсвязывающая область, которые специфически связываются с TREM2 человека, содержат вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность под SEQ ID NO: 50 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации), и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность под SEQ ID NO: 61 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации).
[00126] В некоторых вариантах осуществления антитело, которое специфически связывается с TREM2 человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 15 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации), и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 26 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации).
[00127] В некоторых вариантах осуществления антитело, которое специфически связывается с TREM2 человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 29 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации), и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 26 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации).
[00128] В некоторых вариантах осуществления антитело, которое специфически связывается с TREM2 человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 33 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации), и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 26 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации).
[00129] В некоторых вариантах осуществления антитело, которое специфически связывается с TREM2 человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 35 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации), и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 26 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации).
[00130] В некоторых вариантах осуществления антитело, которое специфически связывается с TREM2 человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 37 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации), и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 26 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации).
[00131] В некоторых вариантах осуществления антитело, которое специфически связывается с TREM2 человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 39 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации), и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 26 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации).
[00132] В некоторых вариантах осуществления антитело, которое специфически связывается с TREM2 человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 52 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации), и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 63 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации).
[00133] В некоторых вариантах осуществления антитело, которое специфически связывается с TREM2 человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 66 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации), и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 63 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации).
[00134] В некоторых вариантах осуществления антитело, которое специфически связывается с TREM2 человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 70 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации), и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 63 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации).
[00135] В некоторых вариантах осуществления антитело, которое специфически связывается с TREM2 человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 72 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации), и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 63 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации).
[00136] В некоторых вариантах осуществления антитело, которое специфически связывается с TREM2 человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 74 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации), и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 63 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации).
[00137] В некоторых вариантах осуществления антитело, которое специфически связывается с TREM2 человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 76 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации), и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 63 (или последовательность, на по меньшей мере приблизительно 90%, 95%, 99% или больше идентичную ей и/или имеющую одну, две, три или более замены, вставки, делеции или модификации).
[00138] В некоторых вариантах осуществления в настоящем изобретении предусмотрены антитело или его антигенсвязывающий фрагмент, которые связываются с доменом IgSF белка TREM2 с константой диссоциации (KD), составляющей менее 200 пМ, например, с KD, составляющей менее 150 пМ, менее 120 пМ, менее 100 пМ, менее 90 пМ, менее 70 пМ, менее 50 пМ, менее 40 пМ, менее 30 пМ, менее 20 пМ или меньше 10 пМ, например, согласно измерению с помощью поверхностного плазмонного резонанса (SPR). В некоторых предпочтительных вариантах осуществления антитела или их антигенсвязывающие фрагменты, предусмотренные в данном документе, связываются с доменом IgSF белка TREM2 с константой диссоциации (KD), составляющей менее 50 пМ. В некоторых предпочтительных вариантах осуществления антитела или их антигенсвязывающие фрагменты, предусмотренные в данном документе, связываются с доменом IgSF белка TREM2 с константой диссоциации (KD), составляющей менее 5 пМ.
[00139] После определения необходимого эпитопа в антигене можно создавать антитела к этому эпитопу, например, с помощью методик, описанных в настоящем изобретении. В качестве альтернативы в ходе процесса разработки при создании антител и определения их характеристик может выясняться информация о необходимых эпитопах. На основании этой информации можно затем провести конкурентный скрининг антител в отношении связывания с одним и тем же эпитопом. Подход к достижению этого заключается в проведении исследований перекрестной конкуренции с целью обнаружения антител, которые конкурентно связываются друг с другом, например, антител, конкурирующих за связывание с антигеном. Высокопроизводительный способ "сортировки" антител на основании их перекрестной конкуренции описан в международной заявке на патент № WO 2003/48731. Эпитоп может содержать те остатки, с которыми связывается антитело.
[00140] В целом, антитела, специфичные в отношении конкретного антигена-мишени, будут преимущественно распознавать эпитоп в антигене-мишени в сложной смеси белков и/или макромолекул.
[00141] Области данного полипептида, которые содержат эпитоп, могут быть идентифицированы с помощью множества методик картирования эпитопов, хорошо известных из уровня техники. См., например, Epitope Mapping Protocols in Methods in Molecular Biology, Vol. 66 (Glenn E. Morris, Ed., 1996, Humana Press, Totowa, N.J). Например, линейные эпитопы могут быть определены, например, посредством параллельного синтеза большого количества пептидов на твердых подложках, при этом пептиды соответствуют частям молекулы белка, и осуществления реакции пептидов с антителами, когда пептиды все еще прикреплены к подложкам. Такие методики известны из уровня техники и описаны, например, в патенте США. №4708871; Geysen et al., (1984) Proc. Natl. Acad. Sci. USA 8:3998-4002; Geysen et al., (1985) Proc. Natl. Acad. Sci. USA 82:78-182; Geysen et al., (1986) Mol. Immunol. 23:709-715. Аналогичным образом, конформационные эпитопы без труда идентифицируют путем определения пространственной конформации аминокислот, как, например, с помощью рентгеновской кристаллографии и двумерного ядерного магнитного резонанса. См., например, Epitope Mapping Protocols выше. Антигенные области белков также могут быть идентифицированы с помощью стандартных графиков антигенности и гидропатичности, таких как графики, построенные с помощью, например, программы из системы программного обеспечения Omiga версии 1.0, доступной от Oxford Molecular Group. В этой компьютерной программе используются способ Хоппа-Вудса, Hopp et al., (1981) Proc. Natl. Acad. Sci USA 78:3824-3828; для определения профилей антигенности и методика Кайта-Дулиттла, Kyte et al., (1982) J. Mol. Biol. 157:105-132; для построения графиков гидропатичности. В некоторых вариантах осуществления антитело к TREM2 специфически связывается с эпитопом в домене IgSF TREM2 человека. Например, антитело к TREM2 может специфически связываться с эпитопом в пределах аминокислотных остатков 19-132 из любой из SEQ ID NO: 1, 2 или 3.
[00142] Молекула антитела может представлять собой поликлональное или моноклональное антитело. Моноклональное антитело может быть получено с помощью гибридомной технологии или с помощью других способов, таких как фаговый дисплей или комбинаторные способы.
[00143] Фаговый дисплей и комбинаторные способы для создания антител известны из уровня техники (как описано, например, в Ladner et al., патент США №5223409; Kang et al., международная публикация № WO 92/18619; Dower et al., международная публикация № WO 91/17271; Winter et al., международная публикация WO 92/20791; Markland et al., международная публикация № WO 92/15679; Breitling et al., международная публикация WO 93/01288; McCafferty et al., международная публикация № WO 92/01047; Garrard et al., международная публикация № WO 92/09690; Ladner et al., международная публикация № WO 90/02809; Fuchs et al. (1991) Bio/Technology 9:1370-1372; Hay et al. (1992) Hum Antibod Hybridomas 3:81-85; Huse et al. (1989) Science 246:1275-1281; Griffiths et al. (1993) EMBO J 12:725-734; Hawkins et al. (1992) J Mol Biol 226:889-896; Clackson et al. (1991) Nature 352:624-628; Gram et al. (1992) PNAS 89:3576-3580; Garrard et al. (1991) Bio/Technology 9:1373-1377; Hoogenboom et al. (1991) Nuc Acid Res 19:4133-4137 и Barbas et al. (1991) PNAS 88:7978-7982).
[00144] В одном варианте осуществления антитело представляет собой антитело человека (например, антитело, полученное в организме трансгенной мыши, которая была модифицирована методами генной инженерии для продуцирования антитела из последовательности иммуноглобулина человека) или антитело, не являющееся человеческим, например, антитело грызуна (мыши или крысы), козы, примата (например, обезьяны), верблюда.
[00145] Химерные и/или гуманизированные антитела могут быть сконструированы для минимизации иммунного ответа пациента-человека на антитела, продуцируемые у субъектов, отличных от человека, или полученные в результате экспрессии генов, кодирующих антитела, отличные от человеческих. Химерные антитела содержат вариабельную область антитела животного, отличного от человека, и константную область человеческого антитела. Такие антитела сохраняют специфичность связывания с эпитопом исходного моноклонального антитела, но могут быть менее иммуногенными при введении людям и, следовательно, с большей вероятностью будут переносимыми для пациента. Например, каждая из одной или всех (например, одной, двух или трех) вариабельных областей легкой (легких) цепи (цепей) и/или одной или всех (например, одной, двух или трех) вариабельных областей тяжелой (тяжелых) цепи (цепей) антитела мыши (например, моноклонального антитела мыши) могут быть соединены с человеческой константной областью, такой как без ограничения человеческая константная область IgG1. Химерные моноклональные антитела могут быть получены с помощью методик рекомбинантных ДНК, известных из уровня техники. Например, ген, кодирующий константную область молекулы антитела, отличного от человеческого, может быть заменен геном, кодирующим человеческую константную область (см. Robinson et al., PCT-заявка на патент PCT/US86/02269; Akira, et al., заявка на европейский патент 184187; или Taniguchi, M., заявка на европейский патент 171496). Кроме того, другие подходящие методики, которые можно применять для получения химерных антител, описаны, например, в патентах США №№4816567; 4,978,775; 4975369 и 4816397.
[00146] Химерное антитело может быть дополнительно "гуманизировано" путем замены частей вариабельной области, не участвующих в связывании с антигеном, эквивалентными частями из человеческих вариабельных областей. Гуманизированные антитела содержат в вариабельной области тяжелой и/или легкой цепи одну или несколько человеческих каркасных областей вместе с областями, определяющими комплементарность (CDR), отличными от человеческих (например, из мыши, крысы или хомяка). В некоторых вариантах осуществления гуманизированное антитело содержит последовательности, являющиеся полностью человеческими, за исключением CDR-областей. Гуманизированные антитела, как правило, являются менее иммуногенными для людей по сравнению с негуманизированными антителами и, таким образом, обеспечивают благоприятные терапевтические эффекты в определенных ситуациях. Гуманизированные антитела к TREM2 могут быть получены с помощью способов, известных из уровня техники. См., например, Hwang et al., Methods 36:35, 2005; Queen et al., Proc. Natl. Acad. Sci. U.S.A. 86:10029-10033, 1989; Jones et al., Nature 321:522-25, 1986; Riechmann et al., Nature 332:323-27, 1988; Verhoeyen et al., Science 239:1534-36, 1988; Orlandi et al., Proc. Natl. Acad. Sci. U.S.A. 86:3833-3837, 1989; патенты США №№5225539; 5530101; 5585089; 5693761; 5693762 и 6180370; а также WO 90/07861.
[00147] Человеческие антитела к TREM2 могут быть получены с помощью способов, известных из уровня техники. Например, технологию "гуманиринга" применяют для превращения антител, отличных от человеческих, в сконструированные человеческие антитела. В публикации заявки на патент США №20050008625 описан осуществляемый in vivo способ замены вариабельной области антитела, отличного от человеческого, человеческой вариабельной областью в антителе с сохранением тех же или обеспечением лучших характеристик связывания по сравнению с таковыми у антитела, отличного от человеческого. Способ основывается на определяемой эпитопом замене вариабельных областей эталонного антитела, отличного от человеческого, таковыми из полностью человеческого антитела. Полученное в результате человеческое антитело в целом является структурно неродственным эталонному антителу, отличному от человеческого, но связывается с тем же эпитопом в том же антигене, что и эталонное антитело. Вкратце, подход с последовательной определяемой эпитопом комплементарной заменой обеспечивается благодаря созданию в клетках конкуренции между "конкурентом" и библиотекой разнообразных гибридных форм эталонного антитела ("тестируемых антител") за связывание с антигеном, находящимся в ограниченных количествах, в присутствии репортерной системы, которая реагирует на связывание тестируемого антитела с антигеном. Конкурентом может быть эталонное антитело или его производное, такое как одноцепочечный Fv-фрагмент. Конкурентом также может быть природный или искусственный лиганд антигена, который связывается с тем же эпитопом, что и эталонное антитело. Единственные требования к конкуренту заключаются в том, чтобы он связывался с тем же эпитопом, что и эталонное антитело, и чтобы он конкурировал с эталонным антителом за связывание с антигеном. Тестируемые антитела имеют одну общую антигенсвязывающую V-область из эталонного антитела, отличного от человеческого, и другую V-область, отобранную случайным образом из иного источника, такого как репертуарная библиотека человеческих антител. Общая V-область из эталонного антитела служит в качестве указателя, располагая тестируемые антитела на одном и том же эпитопе в антигене и в одной и той же ориентации для того, чтобы отбор склонялся в сторону наиболее высокого качества связывания с антигеном относительно эталонного антитела.
[00148] Много типов репортерных систем можно применять для выявления необходимых взаимодействий между тестируемыми антителами и антигеном. Например, дополняющие друг друга репортерные фрагменты могут быть связаны соответственно с антигеном и тестируемым антителом для того, чтобы активация репортера при дополнении фрагментов происходила только тогда, когда тестируемое антитело связывается с антигеном. Если продукты слияния антитело-репортерный фрагмент и антиген-репортерный фрагмент экспрессируются совместно с конкурентом, то активация репортера становится зависимой от способности тестируемого антитела конкурировать с конкурентом, которая является пропорциональной аффинности тестируемого антитела в отношении антигена. Другие репортерные системы, которые можно применять, включают реактиватор самоингибируемой системы реактивации репортера (RAIR), раскрытый в заявке на патент США №10/208730 (публикация №20030198971), или систему конкурентной активации, раскрытую в заявке на патент США №10/076845 (публикация №20030157579).
[00149] При использовании системы последовательной определяемой эпитопом комплементарной замены проводят отбор для идентификации клеток, экспрессирующих одно тестируемое антитело вместе с конкурентом, антигеном и компонентами репортера. В этих клетках каждое тестируемое антитело конкурирует индивидуально с конкурентом за связывание с антигеном, находящимся в ограниченном количестве. Активность репортера является пропорциональной количеству антигена, связавшегося с тестируемым антителом, которое, в свою очередь, является пропорциональным аффинности тестируемого антитела в отношении антигена и стабильности тестируемого антитела. Тестируемые антитела изначально отбирают на основании их активности по сравнению с активностью эталонного антитела при экспрессии в качестве тестируемого антитела. Результатом первого цикла отбора является набор "гибридных" антител, каждое из которых состоит из одной и той же V-области, отличной от человеческой, из эталонного антитела и человеческой V-области из библиотеки, и каждое из которых связывается с тем же эпитопом в антигене, что и эталонное антитело. Одно или несколько гибридных антител, отобранных в первом цикле, будут характеризоваться аффинностью в отношении антигена, сравнимой с таковой у эталонного антитела или превышающей ее.
[00150] На второй стадии замены V-области человеческие V-области, отобранные на первой стадии, используют в качестве указателя для отбора человеческих заменяющих фрагментов для остальной части V-области эталонного антитела, отличного от человеческого, с использованием разнообразной библиотеки когнатных человеческих V-областей. Гибридные антитела, отобранные в первом цикле, также можно применять в качестве конкурентов для второго цикла отбора. Результатом второго цикла отбора является набор полностью человеческих антител, которые структурно отличаются от эталонного антитела, но которые конкурируют с эталонным антителом за связывание с одним и тем же антигеном. Некоторые из отобранных человеческих антител связываются с тем же эпитопом в том же антигене, что и эталонное антитело. Среди этих отобранных человеческих антител одно или несколько связываются с одним и тем же эпитопом с аффинностью, которая является сравнимой с таковой у эталонного антитела или превышает ее.
[00151] В некоторых вариантах осуществления настоящее изобретение предусматривает антитело или его антигенсвязывающий фрагмент, которые связываются с белком TREM2 человека и способствуют TREM2-зависимой физиологической активности, например усиливают фагоцитоз (например, в макрофагах hM2A, или в микроглиеподобных клетках, полученных из iPS человека, или в микроглии/макрофагах в головном мозге), усиливают хемотаксис в микроглиеподобных клетках, полученных из iPS человека, повышают управляемую NFAT активность репортерного гена в линии моноцитарных клеток человека или повышают фосфорилирование Syk в макрофагах hM2A. Это способствование и/или улучшение может составлять, например, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90%.
Сконструированные и модифицированные антитела
[00152] Антитело по настоящему изобретению можно получить при использовании антитела, имеющего одну или несколько из последовательностей VH и/или VL, описанных в таблице 1, в качестве исходного материала для конструирования модифицированного антитела, при этом данное модифицированное антитело может иметь измененные свойства по сравнению с исходным антителом. Антитело может быть сконструировано посредством модификации одного или нескольких остатков в пределах одной или обеих вариабельных областей (т.е. VH и/или VL), например, в пределах одной или нескольких CDR-областей и/или в пределах одной или нескольких каркасных областей. Дополнительно или в качестве альтернативы, антитело может быть сконструировано посредством модификации остатков в пределах константной (константных) области (областей), например, для изменения эффекторной (эффекторных) функции (функций) антитела.
[00153] Один тип конструирования вариабельной области, который можно осуществлять, представляет собой прививание CDR. Антитела взаимодействуют с антигенами-мишенями преимущественно посредством аминокислотных остатков, которые расположены в шести областях, определяющих комплементарность (CDR), тяжелой и легкой цепей. По этой причине аминокислотные последовательности в пределах CDR являются более разнообразными среди отдельных антител, чем последовательности за пределами CDR. Поскольку последовательности CDR отвечают за большинство взаимодействий антитело-антиген, можно экспрессировать рекомбинантные антитела, которые имитируют свойства конкретных встречающихся в природе антител, посредством конструирования векторов экспрессии, которые содержат последовательности CDR из конкретного встречающегося в природе антитела, привитые на последовательности каркасных областей из другого антитела с другими свойствами (см., например, Riechmann, L. et al., 1998 Nature 332:323-327; Jones, P. et al., 1986 Nature 321:522-525; Queen, C. et al., 1989 Proc. Natl. Acad., U.S.A. 86:10029-10033; патент США №5225539 авторства Winter и патенты США №№5530101; 5585089; 5693762 и 6180370 авторства Queen et al.).
[00154] Такие последовательности каркасных областей можно получить из общедоступных баз данных ДНК или опубликованных литературных источников, которые содержат последовательности генов антител зародышевого типа или перегруппированные последовательности антител. Например, последовательности ДНК зародышевой линии для генов вариабельной области тяжелой и легкой цепей человека можно найти в базе данных последовательностей зародышевой линии человека "VBase" (доступной в сети Интернет по адресу www.mrc-cpe.cam.ac.uk/vbase), а также в Kabat, E.A., et al., 1991 Sequences of Proteins of Immunological Interest, Fifth Edition, Министерство здравоохранения и социальных служб США, публикация NIH №91-3242; Tomlinson, I.M., et al., 1992 J. fol. Biol. 227:776-798; и Cox, J.P.L. et al., 1994 Eur. J Immunol. 24:827-836; содержание каждого из которых прямо включено в данный документ посредством ссылки. Например, последовательности ДНК зародышевого типа для генов вариабельной области человеческих тяжелой и легкой цепей и перегруппированные последовательности антител можно найти в базе данных "IMGT" (доступной в сети Интернет по адресу www.imgt.org; см. Lefranc, M.P. et al., 1999 Nucleic Acids Res. 27:209-212; содержание каждого из которых прямо включено в данный документ посредством ссылки.).
[00155] Примером каркасных последовательностей для применения в антителах и их антигенсвязывающих фрагментах по настоящему изобретению являются последовательности, которые являются структурно подобными каркасным последовательностям, применяемым в выбранных антителах и их антигенсвязывающих фрагментах по настоящему изобретению, например, консенсусные последовательности и/или каркасные последовательности, применяемые в моноклональных антителах по настоящему изобретению. Последовательности CDR1, 2 и 3 VH и последовательности CDR1, 2 и 3 VL могут быть привиты на каркасные области, которые имеют последовательность, идентичную той, что обнаруживается в гене иммуноглобулина зародышевого типа, из которого получена последовательность каркасной области, или последовательности CDR могут быть привиты на каркасные области, которые содержат одну или несколько мутаций по сравнению с последовательностями зародышевого типа. Например, было обнаружено, что в определенных случаях благоприятной является мутация остатков в пределах каркасных областей для сохранения или повышения способности антитела к связыванию с антигеном (см., например, патенты США №№5530101; 5585089; 5693762 и 6180370 авторства Queen et al.).
[00156] Другой тип модификации вариабельной области заключается в мутации аминокислотных остатков в пределах областей CDR1, CDR2 и/или CDR3 VH и/или VL, с улучшением таким образом одного или нескольких свойств связывания (например, аффинности) антитела, представляющего интерес, что известно как "созревание аффинности". Для введения мутации(-й) можно осуществлять сайт-направленный мутагенез или ПЦР-опосредованный мутагенез, и эффект в отношении связывания антитела или другого функционального свойства, представляющего интерес, можно оценивать в анализах in vitro или in vivo, описанных в данном документе и представленных в примерах. Можно вводить консервативные модификации (которые обсуждались выше). Мутации могут представлять собой аминокислотные замены, добавления или делеции. Более того, как правило, изменяют не более одного, двух, трех, четырех или пяти остатков в пределах CDR-области.
[00157] Можно использовать широкий спектр каркасов или остовов антитела/иммуноглобулина при условии, что полученный в результате полипептид содержит по меньшей мере одну связывающую область, которая специфически связывается с TREM2. Такие каркасные структуры или остовы включают 5 основных идиотипов человеческих иммуноглобулинов, их антигенсвязывающих фрагментов и включают иммуноглобулины других видов животных, предпочтительно имеющие гуманизированные признаки. Антитела с одной тяжелой цепью, такие как идентифицированные у верблюдовых, представляют особый интерес в этом отношении. Специалисты в данной области продолжают обнаруживать и разрабатывать новые каркасные структуры, остовы и фрагменты.
[00158] В одном аспекте настоящее изобретение относится к способу получения неиммуноглобулиновых антител с использованием неиммуноглобулиновых остовов, на которые можно привить CDR по настоящему изобретению. Можно использовать известные или будущие неиммуноглобулиновые каркасные структуры и остовы, при условии, что они содержат связывающую область, специфичную в отношении белка-мишени TREM2. Известные неиммуноглобулиновые каркасные структуры или остовы включают без ограничения фибронектин (Compound Therapeutics, Inc., Уолтем, Массачусетс), анкирин (Molecular Partners AG, Цюрих, Швейцария), доменные антитела (Domantis, Ltd., Кембридж, Массачусетс и Ablynx NV, Звейнарде, Бельгия), липокалин (Pieris Proteolab AG, Фрайзинг, Германия), небольшие модульные иммунофармацевтические средства (Trubion Pharmaceuticals Inc., Сиэтл, Вашингтон), максиантитела (Avidia, Inc., Маунтин-Вью, Калифорния), белок A (Affibody AG, Швеция) и аффилин (гамма-кристаллин или убиквитин) (Scil Proteins GmbH, Галле, Германия).
[00159] Фибронектиновые остовы имеют в своей основе домен фибронектина III типа (например, десятый модуль фибронектина III типа (10 домен Fn3)). Домен фибронектина III типа имеет 7 или 8 бета-тяжей, которые распределены между двумя бета-складчатыми слоями, которые сами упакованы внахлест друг с другом с образованием сердцевины белка и при этом дополнительно содержат петли (аналогичные CDR), которые соединяют бета-тяжи друг с другом и являются доступными для растворителя. По меньшей мере три такие петли присутствуют на каждом краю сэндвича из бета-складчатых слоев, где край представляет собой границу белка, перпендикулярную направлению бета-тяжей (см. патент США №6818418). Эти остовы на основе фибронектина не относятся к иммуноглобулинам, хотя их общая укладка близко сходна с таковой у наименьшего функционального фрагмента антитела - вариабельной области тяжелой цепи, которая содержит полную антигенраспознающую единицу в IgG верблюда и ламы. Благодаря этой структуре неиммуноглобулиновое антитело имитирует свойства связывания с антигеном, которые являются сходными по своей природе и аффинности со свойствами антител. Эти остовы можно применять в стратегии случайного выбора и перетасовки петель in vitro, которая является сходной с процессом созревания аффинности антител in vivo. Эти молекулы на основе фибронектина можно применять в качестве остовов, при этом петлевые области молекулы могут быть заменены на CDR по настоящему изобретению с помощью стандартных методик клонирования.
Антитела верблюдовых
[00160] У белков, представляющих собой антитела, полученные из представителей семейства, к которому относятся двугорбые верблюды и одногорбые верблюды (Camelus bactrianus и Camelus dromaderius), в том числе представителей из Нового Света, таких как виды лам (Lama pacos, Lama glama и Lama vicugna), были определены характеристики размера, сложности структуры и антигенности у субъектов-людей. В определенных антителах IgG из этого семейства млекопитающих, которые обнаруживаются в природе, отсутствуют легкие цепи, и, следовательно, они по своей структуре отличаются от типичной четырехцепочечной четвертичной структуры, имеющей две тяжелые и две легкие цепи, в антителах от других животных. См. PCT/EP93/02214 (WO 94/04678, опубликованная 3 марта 1994 г.).
[00161] Область антитела верблюдовых, которая представляет собой небольшой отдельный вариабельный домен, идентифицированный как VHH, можно получить с помощью генной инженерии с получением небольшого белка, характеризующегося высокой аффинностью в отношении мишени, что дает в результате полученный из антитела низкомолекулярный белок, известный как "нанотело верблюдовых". См. патент США №5759808, выданный 2 июня 1998 г.; см. также Stijlemans, B. et al., 2004 J Biol Chem 279: 1256-1261; Dumoulin, M. et al., 2003 Nature 424: 783-788; Pleschberger, M. et al. 2003 Bioconjugate Chem 14: 440-448; Cortez-Retamozo, V. et al. 2002 Int J Cancer 89: 456-62; и Lauwereys, M. et al. 1998 EMBO J 17: 3512-3520. Сконструированные библиотеки антител и фрагментов антител верблюдовых являются коммерчески доступными, например, от Ablynx, Гент, Бельгия. Как и в случае с другими антителами и их антигенсвязывающими фрагментами, происходящими из организма, отличного от человека, аминокислотную последовательность антитела верблюдовых можно изменить рекомбинантным путем с получением последовательности, которая более близко напоминает человеческую последовательность, т.е. нанотело можно "гуманизировать". Таким образом можно дополнительно снижать природную низкую антигенность антител верблюдовых у людей.
[00162] Нанотело верблюдовых имеет молекулярную массу, составляющую примерно одну десятую от массы молекулы IgG человека, и данный белок имеет физический диаметр, составляющий лишь несколько нанометров. Одним следствием небольшого размера является способность нанотел верблюдовых связываться с антигенными сайтами, которые являются функционально невидимыми для белков, представляющих собой антитела, большего размера, т.е. нанотела верблюдовых являются применимыми в качестве реагентов для выявления антигенов, которые в ином случае являются скрытыми при использовании классических иммунологических методик, и в качестве возможных терапевтических средств. Таким образом, еще одним следствием небольшого размера является то, что нанотело верблюдовых может осуществлять ингибирование в результате связывания с конкретным сайтом в бороздке или узкой щели белка-мишени и, следовательно, может служить в роли, которая более близко напоминает функцию классического низкомолекулярного лекарственного средства, чем таковую у классического антитела.
[00163] Низкая молекулярная масса и компактный размер дополнительно приводят к тому, что нанотела верблюдовых являются чрезвычайно термостабильными, стабильными к экстремальным значениям pH и к протеолитическому расщеплению и характеризуются слабой антигенностью. Другим следствием является то, что нанотела верблюдовых легко перемещаются из кровеносной системы в ткани и даже пересекают гематоэнцефалический барьер и могут обеспечивать лечение нарушений, которые поражают нервную ткань. Нанотела могут дополнительно способствовать транспорту лекарственных средств через гематоэнцефалический барьер. См. заявку на патент США 20040161738, опубликованную 19 августа 2004 г. Эти признаки в сочетании с низкой антигенностью у людей указывают на большой терапевтический потенциал. Кроме того, эти молекулы могут полностью экспрессироваться в прокариотических клетках, таких как E. coli, и они экспрессируются в виде слитых белков с белками бактериофага и являются функциональными.
[00164] Соответственно, признаком настоящего изобретения является антитело или нанотело верблюдовых, характеризующееся высокой аффинностью в отношении TREM2. В одном варианте осуществления в данном документе антитело или нанотело верблюдовых продуцируется в естественных условиях у животного из семейства верблюдовых, т.е. оно продуцируется верблюдовыми после иммунизации с помощью TREM2 или его пептидного фрагмента с применением методик, описанных в данном документе для других антител. В качестве альтернативы TREM2-связывающее нанотело верблюдовых конструируют, т.е. получают посредством отбора, например, из фаговой библиотеки, в которой отображены подвергнутые соответствующему мутагенезу белки, представляющие собой нанотела верблюдовых, с применением процедур пэннинга с TREM2 в качестве мишени, как описано в примерах в данном документе. Сконструированные нанотела можно дополнительно адаптировать к конкретным требованиям с помощью генной инженерии так, чтобы они имели период полужизни у получающего их субъекта, составляющий от 45 минут до двух недель. В конкретном варианте осуществления антитело или нанотело верблюдовых получают посредством прививания последовательностей CDR тяжелой или легкой цепей человеческих антител по настоящему изобретению на последовательности каркасных областей нанотела или однодоменного антитела, как описано, например, в PCT/EP93/02214.
Биспецифические молекулы и поливалентные антитела
[00165] В другом аспекте настоящее изобретение относится к биспецифическим или полиспецифическим молекулам, содержащим TREM2-связывающее антитело или его фрагмент по настоящему изобретению. Антитело по настоящему изобретению или его антигенсвязывающие области можно дериватизировать или связать с другой функциональной молекулой, например, с другим пептидом или белком (например, другим антителом или лигандом рецептора) с получением биспецифической молекулы, которая связывается с по меньшей мере двумя различными связывающими участками или молекулами-мишенями. Антитело по настоящему изобретению фактически можно дериватизировать или связать с более чем одной другой функциональной молекулой с получением полиспецифических молекул, которые связываются с более чем двумя различными связывающими участками и/или молекулами-мишенями; также предполагается, что такие полиспецифические молекулы охватываются используемым в данном документе термином "биспецифическая молекула". Для создания биспецифической молекулы по настоящему изобретению антитело по настоящему изобретению можно функционально связать (например, посредством химического связывания, генетического слияния, нековалентной ассоциации или иным образом) с одной или несколькими другими связывающими молекулами, такими как другое антитело, фрагмент антитела, пептид или связывающий миметик, в результате чего получают биспецифическую молекулу.
[00166] Соответственно, настоящее изобретение включает биспецифические молекулы, содержащие по меньшей мере один первый элемент, обеспечивающий специфичность связывания с TREM2, и второй элемент, обеспечивающий специфичность связывания со вторым эпитопом-мишенью. Например, второй эпитоп-мишень представляет собой другой эпитоп TREM2, отличающийся от первого эпитопа-мишени.
[00167] Кроме того, в настоящем изобретении, в котором биспецифическая молекула является полиспецифической, молекула может дополнительно содержать третий элемент, обеспечивающий специфичность связывания, в дополнение к таковым для первого и второго эпитопов-мишеней.
[00168] В одном варианте осуществления биспецифические молекулы по настоящему изобретению содержат в качестве элемента, обеспечивающего специфичность связывания, по меньшей мере одно антитело или его фрагмент антитела, в том числе, например, Fab, Fab', F(ab')2, Fv или одноцепочечный Fv. Антитело также может представлять собой димер легких цепей или тяжелых цепей или любой их минимальный фрагмент, такой как Fv или одноцепочечная конструкция, которая описана в Ladner et al., патент США №4946778.
[00169] Диатела представляют собой двухвалентные биспецифические молекулы, в которых VH- и VL-домены экспрессируются в одной полипептидной цепи и соединены линкером, который является слишком коротким, чтобы обеспечивать возможность спаривания между двумя доменами в одной и той же цепи. VH- и VL-домены спариваются с комплементарными доменами другой цепи, создавая таким образом два антигенсвязывающих участка (см., например, Holliger et al., 1993 Proc. Natl. Acad. Sci. USA 90:6444-6448; Poljak et al., 1994 Structure 2:1121-1123). Диатела можно получать посредством экспрессии двух полипептидных цепей со структурой VHA-VLB и VHB-VLA (конфигурация VH-VL) либо VLA-VHB и VLB-VHA (конфигурация VL-VH) в одной и той же клетке. Большинство из них могут экспрессироваться в растворимой форме у бактерий. Одноцепочечные диатела (scDb) получают путем соединения двух полипептидных цепей, образующих диатело, с линкером размером примерно 15 аминокислотных остатков (см. Holliger and Winter, 1997 Cancer Immunol. Immunother., 45 (3-4):128-30; Wu et al., 1996 Immunotechnology, 2 (1):21-36). scDb могут экспрессироваться у бактерий в растворимой активной мономерной форме (см. Holliger and Winter, 1997 Cancer Immunol. Immunother., 45 (34): 128-30; Wu et al., 1996 Immunotechnology, 2 (1):21-36; Pluckthun and Pack, 1997 Immunotechnology, 3 (2): 83-105; Ridgway et al., 1996 Protein Eng., 9 (7):617-21). Диатело можно сливать с Fc с получением "дидиатела" (см. Lu et al., 2004 J. Biol. Chem., 279 (4):2856-65).
[00170] Другие антитела, которые могут использоваться в биспецифических молекулах по настоящему изобретению, представляют собой мышиные, химерные и гуманизированные моноклональные антитела.
[00171] Биспецифические молекулы по настоящему изобретению можно получить посредством конъюгирования составляющих элементов, обеспечивающих специфичность связывания, с помощью способов, известных из уровня техники. Например, каждый элемент, обеспечивающий специфичность связывания, в биспецифической молекуле можно получить отдельно, а затем конъюгировать с другими. Если элементы, обеспечивающие специфичность связывания, представляют собой белки или пептиды, то для ковалентного конъюгирования можно применять ряд связывающих или сшивающих средств. Примеры сшивающих средств включают белок A, карбодиимид, N-сукцинимидил-5-ацетилтиоацетат (SATA), 5,5'-дитиобис(2-нитробензойную кислоту) (DTNB), о-фенилендималеимид (oPDM), N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) и сульфосукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (сульфо-SMCC) (см., например, Karpovsky et al., 1984 J. Exp. Med. 160:1686; Liu, M A et al., 1985 Proc. Natl. Acad. Sci. USA 82:8648). Другие способы включают способы, описанные в Paulus, 1985 Behring Ins. Mitt. No. 78, 118-132; Brennan et al., 1985 Science 229:81-83, и Glennie et al., 1987 J. Immunol. 139: 2367-2375. Конъюгирующие средства представляют собой SATA и сульфо-SMCC, оба из которых доступны от Pierce Chemical Co. (Рокфорд, Иллинойс).
[00172] Если элементы, обеспечивающие специфичность связывания, представляют собой антитела, их можно конъюгировать посредством образования связей между сульфгидрильными группами C-концевых шарнирных областей двух тяжелых цепей. В конкретном варианте осуществления шарнирную область модифицируют таким образом, чтобы она содержала нечетное количество остатков с сульфгидрильной группой, например, один, перед конъюгированием.
[00173] В качестве альтернативы оба элемента, обеспечивающие специфичность связывания, могут быть закодированы в одном и том же векторе и могут экспрессироваться и собираться в одной и той же клетке-хозяине. Этот способ является особенно применимым в случае, когда биспецифическая молекула представляет собой слитый белок mAb X mAb, mAb X Fab, Fab X F(ab')2 или лиганд X Fab. Биспецифическая молекула по настоящему изобретению может представлять собой одноцепочечную молекулу, содержащую одно одноцепочечное антитело и детерминанту связывания, или одноцепочечную биспецифическую молекулу, содержащую две детерминанты связывания. Биспецифические молекулы могут содержать по меньшей мере две одноцепочечные молекулы. Способы получения биспецифических молекул описаны, например, в патенте США №5260203; патенте США №5455030; патенте США №4881175; патенте США №5132405; патенте США №5091513; патенте США №5476786; патенте США №5013653; патенте США №5258498 и патенте США №5482858.
[00174] Связывание биспецифических молекул со своими специфическими мишенями можно подтвердить, например, с помощью твердофазного иммуноферментного анализа (ELISA), радиоиммунологического анализа (REA), FACS-анализа, биологического анализа (например, ингибирования роста) или вестерн-блот-анализа. В каждом из этих анализов обычно выявляют наличие комплексов белок-антитело, представляющих особый интерес, путем использования меченого реагента (например, антитела), специфичного в отношении комплекса, представляющего интерес.
[00175] В другом аспекте в настоящем изобретении предусмотрены поливалентные соединения, содержащие по меньшей мере две идентичные или отличающиеся антигенсвязывающие части антител и их антигенсвязывающих фрагментов по настоящему изобретению, связывающиеся с TREM2. Антигенсвязывающие части могут быть связаны друг с другом посредством слияния белков или ковалентной или нековалентной связи. В качестве альтернативы способы связывания были описаны для биспецифических молекул. Четырехвалентные соединения можно получить, например, путем сшивания антител и их антигенсвязывающих фрагментов по настоящему изобретению с антителом или антигенсвязывающим фрагментом, которые связываются с константными областями антител и их антигенсвязывающих фрагментов по настоящему изобретению, например, Fc или шарнирной областью.
[00176] Тримеризующий домен описан, например, в патенте EP 1012280B1. Пентамеризующие модули описаны, например, в PCT/EP97/05897.
[00177] В некоторых вариантах осуществления TREM2-связывающая молекула представляет собой биспецифическое антитело, которое связывается как с TREM2, так и с DAP12. В некоторых вариантах осуществления TREM2-связывающая молекула представляет собой биспецифическое антитело, которое распознает первый антиген и второй антиген. В некоторых вариантах осуществления первый антиген представляет собой TREM2 человека или его встречающийся в природе вариант. В некоторых вариантах осуществления второй антиген представляет собой DAP12 человека или его встречающийся в природе вариант. В некоторых вариантах осуществления второй антиген представляет собой DAP10 или Siglec (иммуноглобулин-подобный лектин, связывающий сиаловую кислоту) человека. В некоторых вариантах осуществления второй антиген представляет собой вызывающий заболевание белок, выбранный из бета-амилоида или его фрагментов, тау-белка, IAPP, альфа-синуклеина, TDP-43, белка FUS, прионного белка, PrPSc, хантингтина, кальцитонина, супероксиддисмутазы, атаксина, тельца Леви, предсердного натрийуретического фактора, островкового амилоидного полипептида, инсулина, аполипопротеина AI, сывороточного амилоида А, медина, пролактина, транстиретина, лизоцима, бета-2-микроглобулина, гельсолина, кератоэпителина, цистатина, легкой цепи иммуноглобулина AL, белка S-IBM, продуктов не-ATG трансляции, связанной с повторами (RAN), пептидов с повторами дипептидов (DPR), пептидов с повторами глицин-аланин (GA), пептидов с повторами глицин-пролин (GP), пептидов с повторами глицин-аргинин (GR), пептидов с повторами пролин-аланин (PA) и пептидов с повторами пролин-аргинин (PR). В некоторых вариантах осуществления второй антиген представляет собой белок, нацеленный на гематоэнцефалический барьер, выбранный из рецептора трансферрина, рецептора инсулина, рецептора инсулиноподобного фактора роста, LRP-1 и LRP1; или лигандов и/или белков, экспрессируемых на иммунных клетках, где лиганды и/или белки выбраны из группы, состоящей из: CD40, OX40, ICOS, CD28, CD137/4-1BB, CD27, GITR, PD-L1, CTLA4, PD-L2, PD-1, B7-H3, B7-H4, HVEM, BTLA, KIR, GAL9, TIM3, A2AR, LAG и фосфатидилсерина. Альтернативным образом, второй антиген может представлять собой белок, экспрессирующийся на одной или нескольких опухолевых клетках.
Антитела с удлиненным периодом полужизни
[00178] В настоящем изобретении предусмотрены антитела, которые специфически связываются с TREM2 и которые характеризуются увеличенным периодом полужизни in vivo.
[00179] Многие факторы могут влиять на период полужизни белка in vivo. Например, к ним относятся фильтрация в почках, метаболизм в печени, разрушение посредством протеолитических ферментов (протеаз) и иммунные ответы (например, нейтрализация белка посредством антител и поглощение макрофагами и дендритными клетками). Для продления периода полужизни антител и их антигенсвязывающих фрагментов по настоящему изобретению можно применять ряд стратегий. Например, это можно осуществлять посредством химического связывания с полиэтиленгликолем (PEG), PEG ReCODE, остовом антитела, полисиаловой кислотой (PSA), гидроксиэтилкрахмалом (HES), альбуминсвязывающими лигандами и углеводными защитными фрагментами; посредством генетического слияния с белками, связывающимися с белками сыворотки крови, такими как альбумин, IgG, FcRn и трансферрин; посредством связывания (генетического или химического) с другими связывающими компонентами, которые связываются с белками сыворотки крови, такими как нанотела, Fab, дарпины, авимеры, аффитела и антикалины; посредством генетического слияния с rPEG, альбумином, доменом альбумина, альбуминсвязывающими белками и Fc; или посредством включения в наноносители, составы с медленным высвобождением или медицинские устройства.
[00180] Для продления циркуляции антител в сыворотке крови in vivo молекулы инертного полимера, такого как высокомолекулярный PEG, могут быть присоединены к антителам или их фрагментам с использованием или без использования линкера с несколькими функциональными группами посредством сайт-специфического конъюгирования PEG с N- или С-концом антител либо посредством эпсилон-аминогрупп, присутствующих в лизиновых остатках. Для пегилирования антитела, как правило, осуществляют реакцию антитела, его антигенсвязывающего фрагмента с полиэтиленгликолем (PEG), таким как реакционноспособный сложный эфир или альдегидное производное PEG, в условиях, при которых одна или несколько групп PEG присоединяются к антителу или фрагменту антитела. Пегилирование можно осуществлять посредством реакции ацилирования или реакции алкилирования с реакционноспособной молекулой PEG (или аналогичным реакционноспособным водорастворимым полимером). Предполагается, что используемый в данном документе термин "полиэтиленгликоль" охватывает любую из форм PEG, которые применяли для дериватизации других белков, как, например, моно(C1-C10)алокси- или арилоксиполиэтиленгликоль или полиэтиленгликоль-малеимид. В одном варианте осуществления антитело, которое должно быть пегилировано, представляет собой агликозилированное антитело. Будет применяться дериватизация с помощью линейного или разветвленного полимера, которая приводит к минимальной потере биологической активности. Степень конъюгирования можно тщательно контролировать посредством SDS-PAGE и масс-спектрометрии для обеспечения надлежащего конъюгирования молекул PEG с антителами. Непрореагировавший PEG можно отделить от конъюгатов антитело-PEG посредством эксклюзионной или ионообменной хроматографии. PEG-дериватизированные антитела можно тестировать в отношении активности связывания, а также в отношении эффективности in vivo с применением способов, хорошо известных специалистам в данной области, например, посредством иммунологических анализов, описанных в данном документе. Способы пегилирования белков известны из уровня техники и могут применяться по отношению к антителам и их антигенсвязывающим фрагментам по настоящему изобретению. См., например, EP 0154316 авторства Nishimura et al. и EP 0401384 авторства Ishikawa et al.
[00181] Другие модифицированные технологии пегилирования включают преобразующую технологию химически ортогонального направленного конструирования (PEG ReCODE), при которой химически определенные боковые цепи включаются в состав биосинтетических белков посредством преобразующей системы, которая содержит тРНК-синтетазу и тРНК. Данная технология позволяет включать более чем 30 новых аминокислот в состав биосинтетических белков в клетках E. coli, дрожжей и млекопитающих. тРНК включает стандартную аминокислоту в любом месте, где расположен янтарный стоп-кодон, преобразовывая янтарный стоп-кодон в кодон, который сигнализирует о включении химически определенной аминокислоты.
[00182] Технология рекомбинантного пегилирования (rPEG) также может применяться для удлинения периода полужизни в сыворотке крови. Данная технология предусматривает генетическое слияние неструктурированного белкового хвоста из 300-600 аминокислот с существующим фармацевтическим белком. Поскольку кажущаяся молекулярная масса такой неструктурированной белковой цепи в приблизительно 15 раз превышает ее фактическую молекулярную массу, период полужизни белка в сыворотке крови значительно увеличивается. В отличие от традиционного пегилирования, для которого требуется химическое конъюгирование и повторная очистка, способ изготовления значительно упрощается, и продукт является однородным.
[00183] Полисиалирование представляет собой другую технологию, в которой используется природный полимер полисиаловая кислота (PSA) для продления периода активности и улучшения стабильности терапевтических пептидов и белков. PSA представляет собой полимер сиаловой кислоты (сахара). При применении для доставки лекарственных средств на основе белков и терапевтических пептидов полисиаловая кислота обеспечивает защитную микросреду при конъюгировании. Это увеличивает период активности терапевтического белка в кровотоке и предотвращает его распознавание иммунной системой. Полимер PSA в естественных условиях обнаруживается в организме человека. Его начали использовать некоторые бактерии, которые эволюционировали на протяжении миллионов лет, для покрытия им своих клеточных стенок. Эти полисиалированные в естественных условиях бактерии вследствие этого были способны благодаря молекулярной мимикрии противодействовать защитной системе организма. PSA, которую можно отнести к совершенной природной технологии малозаметности, можно с легкостью получать из таких бактерий в больших количествах и с заданными физическими характеристиками. Бактериальная PSA является полностью неиммуногенной, даже в случае, когда она связана с белками, так как она является химически идентичной PSA в организме человека.
[00184] Другая технология предусматривает применение производных гидроксиэтилкрахмала ("HES"), связанных с антителами. HES представляет собой модифицированный природный полимер, полученный из крахмала восковидной кукурузы, и может метаболизироваться посредством ферментов организма. Растворы HES обычно вводят для восполнения недостающего объема крови и улучшения реологических свойств крови. Модификация антитела с помощью HES позволяет продлить период полужизни в кровотоке благодаря увеличению стабильности молекулы, а также благодаря снижению почечного клиренса, что приводит к увеличению биологической активности. Изменяя различные параметры, такие как молекулярная масса HES, можно адаптировать к конкретным требованиям широкий спектр конъюгатов HES-антитело.
[00185] Антитела, характеризующиеся увеличенным периодом полужизни in vivo, также можно получать путем введения одной или нескольких аминокислотных модификаций (т.е. замен, вставок или делеций) в константный домен IgG или его FcRn-связывающий фрагмент (предпочтительно Fc или фрагмент домена шарнирная область-Fc). См., например, международную публикацию № WO 98/23289; международную публикацию № WO 97/34631 и патент США №6277375.
[00186] Кроме того, антитела можно конъюгировать с альбумином, чтобы сделать антитело или фрагмент антитела более стабильными in vivo или чтобы они характеризовались более длительным периодом полужизни in vivo. Методики являются хорошо известными из уровня техники, см., например, международные публикации №№ WO 93/15199, WO 93/15200 и WO 01/77137 и европейский патент № EP 413622.
[00187] Стратегии по увеличению периода полужизни являются особенно применимыми для нанотел, связывающих средств на основе фибронектина и других антител или белков, для которых необходим увеличенный период полужизни in vivo.
Конъюгаты антител
[00188] В настоящем изобретении предусмотрены антитела или их антигенсвязывающие фрагменты, которые специфически связываются с доменом IgSF TREM2 человека, рекомбинантно слитые или химически конъюгированные (в том числе посредством как ковалентного, так и нековалентного конъюгирования) с гетерологичным белком или полипептидом (или его антигенсвязывающим фрагментом, предпочтительно с полипептидом размером по меньшей мере 10, по меньшей мере 20, по меньшей мере 30, по меньшей мере 40, по меньшей мере 50, по меньшей мере 60, по меньшей мере 70, по меньшей мере 80, по меньшей мере 90 или по меньшей мере 100 аминокислот) с получением слитых белков. В частности, в настоящем изобретении предусмотрены слитые белки, содержащие антигенсвязывающий фрагмент антитела, описанного в данном документе (например, Fab-фрагмент, Fd-фрагмент, Fv-фрагмент, F(ab)2-фрагмент, VH-домен, CDR VH, VL-домен или CDR VL) и гетерологичный белок, полипептид или пептид. Способы слияния или конъюгирования белков, полипептидов или пептидов с антителом или фрагментом антитела известны из уровня техники. См., например, патенты США №№5336603, 5622929, 5359046, 5349053, 5447851 и 5112946; европейские патенты №№ EP 307434 и EP 367166; международные публикации №№ WO 96/04388 и WO 91/06570; Ashkenazi et al., 1991, Proc. Natl. Acad. Sci. USA 88: 10535-10539; Zheng et al., 1995, J. Immunol. 154:5590-5600; и Vil et al., 1992, Proc. Natl. Acad. Sci. USA 89:11337-11341.
[00189] Дополнительные слитые белки можно получать посредством методик перетасовки генов, перетасовки мотивов, перетасовки экзонов и/или перетасовки кодонов (в совокупности называемых "перетасовкой ДНК"). Перетасовку ДНК можно использовать для изменения форм активности антител и их антигенсвязывающих фрагментов по настоящему изобретению (например, для получения антител и их антигенсвязывающих фрагментов с более высокими значениями аффинности и более низкими значениями скорости диссоциации). См. в целом патенты США №№5605793, 5811238, 5830721, 5834252 и 5837458; Patten et al., 1997, Curr. Opinion Biotechnol. 8:724-33; Harayama, 1998, Trends Biotechnol. 16 (2):76-82; Hansson, et al., 1999, J. Mol. Biol. 287:265-76; и Lorenzo and Blasco, 1998, Biotechniques 24 (2):308-313 (каждый из данных патентов и публикаций включены в данный документ посредством ссылки во всей своей полноте). Антитела и их антигенсвязывающие фрагменты или кодируемые антитела и их антигенсвязывающие фрагменты можно изменять посредством воздействия на них случайного мутагенеза с помощью ПЦР с внесением ошибок, случайной вставки нуклеотидов или других способов перед рекомбинацией. Полинуклеотид, кодирующий антитело, его антигенсвязывающий фрагмент, которые специфически связываются с IgSF-областью TREM2, может быть подвергнут рекомбинации с одним или несколькими компонентами, мотивами, секциями, частями, доменами, фрагментами и т.д. одной или нескольких гетерологичных молекул.
[00190] Более того, антитела и их антигенсвязывающие фрагменты можно слить с маркерными последовательностями, такими как пептид, для облегчения очистки. В одном варианте осуществления маркерная аминокислотная последовательность представляет собой гексагистидиновый пептид, такой как, среди прочих, метка, представленная в векторе pQE (QIAGEN, Inc., 9259 Eton Avenue, Чатсворт, Калифорния, 91311), многие из которых являются коммерчески доступными. Как описано в Gentz et al., 1989, Proc. Natl. Acad. Sci. USA 86:821-824, например, гексагистидин обеспечивает удобную очистку слитого белка. Другие пептидные метки, применимые для очистки, включают без ограничения гемагглютининовую ("HA") метку, которая соответствует эпитопу, происходящему из белка гемагглютинина вируса гриппа (Wilson et al., 1984, Cell 37:767), и метку "FLAG" (Hopp et al., Bio/Technology 6 (1988): 1204-1210).
[00191] В одном варианте осуществления антитела и их антигенсвязывающие фрагменты по настоящему изобретению конъюгированы с диагностическим или выявляемым средством. Такие антитела могут быть применимыми для контроля или прогнозирования начала проявления, развития, прогрессирования и/или степени тяжести заболевания или нарушения в рамках процедуры клинического тестирования, такой как определение эффективности конкретной терапии. Такую диагностику и выявление можно осуществлять посредством связывания антитела с выявляемыми веществами, в том числе без ограничения с различными ферментами, такими как без ограничения пероксидаза хрена, щелочная фосфатаза, бета-галактозидаза или ацетилхолинэстераза; простетическими группами, такими как без ограничения стрептавидин/биотин и авидин/биотин; флуоресцентными материалами, такими как без ограничения умбеллиферон, флуоресцеин, флуоресцеинизотиоцианат, родамин, дихлортриазиниламинофлуоресценин, дансилхлорид или фикоэритрин; люминесцентными материалами, такими как без ограничения люминол; биолюминесцентными материалами, такими как без ограничения люцифераза, люциферин и экворин; радиоактивными материалами, такими как без ограничения йод (131I, 125I, 123I и 121I), углерод (14C), сера (35S), тритий (3H), индий (115In, 113In, 112In и 111In), технеций (99Tc), таллий (201Ti), галлий (68Ga, 67Ga), палладий (103Pd), молибден (99Mo), ксенон (133Xe), фтор (18F), 153Sm, 177Lu, 159Gd, 149Pm, 140La, 175Yb, 166Ho, 90Y, 47Sc, 186Re, 188Re, 142Pr, 105Rh, 97Ru, 68Ge, 57Co, 65Zn, 85Sr, 32P, 153Gd, 169Yb, 51Cr, 54Mn, 75Se, 113Sn и олово-117; и позитронно-активными металлами, применяющимися в различных методах позитронно-эмиссионной томографии, а также ионами нерадиоактивных парамагнитных металлов.
[00192] Кроме того, антитело или его антигенсвязывающий фрагмент могут быть конъюгированы с терапевтическим компонентом или компонентом, представляющим собой лекарственное средство. Терапевтические компоненты или компоненты, представляющие собой лекарственные средства, не следует рассматривать как ограниченные классическими химическими терапевтическими средствами. Например, компонент, представляющий собой лекарственное средство, может представлять собой белок, пептид или полипептид, обладающие необходимой биологической активностью. Такие белки могут включать, например, токсин, такой как абрин, рицин A, экзотоксин синегнойной палочки, холерный токсин или дифтерийный токсин; белок, такой как фактор некроза опухоли, интерферон альфа, интерферон бета, фактор роста нервов, фактор роста тромбоцитов, тканевой активатор плазминогена, проапоптотическое средство, антиангиогенное средство или модификатор биологического ответа, такой как, например, лимфокин.
[00193] Более того, антитело можно конъюгировать с терапевтическими компонентами, такими как ион радиоактивного металла, как, например, излучатель альфа-частиц, такой как 213Bi, или с макроциклическими хелаторами, применимыми для конъюгирования ионов радиоактивных металлов, в том числе без ограничения 131In, 131Lu, 131Y, 131Ho, 131Sm, с полипептидами. В одном варианте осуществления макроциклический хелатор представляет собой 1,4,7,10-тетраазациклододекан-N,N',N'',N'''-тетрауксусную кислоту (DOTA), которая может быть присоединена к антителу посредством линкерной молекулы. Такие линкерные молекулы являются широко известными из уровня техники и описаны в Denardo et al., 1998, Clin Cancer Res. 4 (10):2483-90; Peterson et al., 1999, Bioconjug. Chem. 10 (4):553-7; и Zimmerman et al., 1999, Nucl. Med. Biol. 26 (8):943-50, каждая из которых включена посредством ссылки во всей своей полноте.
[00194] Методики конъюгирования терапевтических компонентов с антителами являются хорошо известными, см., например, Amon et al., "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy", в Monoclonal Antibodies And Cancer Therapy, Reisfeld et al. (eds.), pp. 243-56 (Alan R. Liss, Inc. 1985); Hellstrom et al., "Antibodies For Drug Delivery", в Controlled Drug Delivery (2nd Ed.), Robinson et al. (eds.), pp. 623-53 (Marcel Dekker, Inc. 1987); Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", в Monoclonal Antibodies 84: Biological And Clinical Applications, Pinchera et al. (eds.), pp. 475-506 (1985); "Analysis, Results, And Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy", в Monoclonal Antibodies For Cancer Detection And Therapy, Baldwin et al. (eds.), pp. 303-16 (Academic Press 1985), и Thorpe et al., 1982, Immunol. Rev. 62:119-58.
[00195] Антитела также могут быть прикреплены к твердым подложкам, которые являются особенно применимыми для иммунологических анализов или очистки антигена-мишени. Такие твердые подложки включают без ограничения стекло, целлюлозу, полиакриламид, нейлон, полистирол, поливинилхлорид или полипропилен.
Нуклеиновые кислоты, кодирующие антитела
[00196] Также в данном документе предусмотрены нуклеиновые кислоты, кодирующие антитело или его антигенсвязывающий фрагмент, описанные в данном документе. Такие нуклеиновые кислоты могут кодировать полипептиды, содержащие сегменты или домены антител к hTREM2 или их антигенсвязывающих фрагментов, описанных в данном документе. Такие нуклеиновые кислоты или полинуклеотиды могут кодировать по меньшей мере одну CDR-область и обычно все три CDR-области из тяжелой или легкой цепи антител к hTREM2, описанных в данном документе. Такие нуклеиновые кислоты или полинуклеотиды также могут кодировать всю или по существу всю последовательность вариабельной области тяжелой цепи и/или легкой цепи антител к hTREM2, описанных в данном документе. Такие нуклеиновые кислоты или полинуклеотиды также могут кодировать как вариабельную область, так и константную область антитела. Вследствие вырожденности генетического кода каждая из аминокислотных последовательностей иммуноглобулинов будет кодироваться рядом последовательностей нуклеиновых кислот. Например, настоящее изобретение относится к первой и второй нуклеиновой кислоте, кодирующей вариабельные области тяжелой и легкой цепи, соответственно, антитела к hTREM2 или его антигенсвязывающего фрагмента, выбранных из одного или нескольких антител, раскрытых в данном документе. Нуклеиновая кислота может содержать нуклеотидную последовательность, представленную в таблице 1, или последовательность, по существу идентичную ей (например, последовательность, которая характеризуется по меньшей мере приблизительно 85%, 90%, 95% или 99% идентичностью последовательности по отношению к ней или которая отличается на не более чем 3, 6, 15, 30 или 45 нуклеотидов от последовательностей, показанных в таблице 1). Нуклеиновая кислота может содержать более чем одну нуклеотидную последовательность, представленную в таблице 1 (например, последовательность вариабельного домена легкой цепи и последовательность вариабельного домена тяжелой цепи, или, например, последовательность легкой цепи или последовательность тяжелой цепи), или последовательность, по существу идентичную ей (например, последовательность, которая характеризуется по меньшей мере приблизительно 85%, 90%, 95% или 99% идентичностью последовательности по отношению к ней или которая отличается на не более чем 3, 6, 15, 30 или 45 нуклеотидов от последовательностей, показанных в таблице 1).
[00197] В определенных вариантах осуществления нуклеиновая кислота может содержать нуклеотидную последовательность, кодирующую по меньшей мере одну, две или три CDR или гипервариабельные петли из вариабельной области тяжелой цепи, имеющей аминокислотную последовательность, представленную в таблице 1, или последовательность, по существу гомологичную ей (например, последовательность, которая характеризуется по меньшей мере приблизительно 85%, 90%, 95% или 99% идентичностью последовательности по отношению к ней и/или которая имеет одну или несколько замен, например, консервативных замен). В других вариантах осуществления нуклеиновая кислота может содержать нуклеотидную последовательность, кодирующую по меньшей мере одну, две или три CDR или гипервариабельные петли из вариабельной области легкой цепи, имеющей аминокислотную последовательность, представленную в таблице 1, или последовательность, по существу гомологичную ей (например, последовательность, которая характеризуется по меньшей мере приблизительно 85%, 90%, 95% или 99% идентичностью последовательности по отношению к ней и/или которая имеет одну или несколько замен, например, консервативных замен). В еще одном другом варианте осуществления нуклеиновая кислота может содержать нуклеотидную последовательность, кодирующую по меньшей мере одну, две, три, четыре, пять или шесть CDR или гипервариабельных петель из вариабельных областей тяжелой и легкой цепей, имеющих аминокислотную последовательность, представленную в таблице 1, или последовательность, по существу гомологичную ей (например, последовательность, которая характеризуется по меньшей мере приблизительно 85%, 90%, 95% или 99% идентичностью последовательности по отношению к ней и/или которая имеет одну или несколько замен, например, консервативных замен).
[00198] В определенных вариантах осуществления нуклеиновая кислота может содержать нуклеотидную последовательность, кодирующую по меньшей мере одну, две или три CDR или гипервариабельные петли из вариабельной области тяжелой цепи, имеющую нуклеотидную последовательность, представленную в таблице 1, или последовательность, по существу гомологичную ей (например, последовательность, которая характеризуется по меньшей мере приблизительно 85%, 90%, 95% или 99% идентичностью последовательности по отношению к ней). В другом варианте осуществления нуклеиновая кислота может содержать нуклеотидную последовательность, кодирующую по меньшей мере одну, две или три CDR или гипервариабельные петли из вариабельной области легкой цепи, имеющую нуклеотидную последовательность, представленную в таблице 1, или последовательность, по существу гомологичную ей (например, последовательность, которая характеризуется по меньшей мере приблизительно 85%, 90%, 95% или 99% идентичностью последовательности по отношению к ней). В еще другом варианте осуществления нуклеиновая кислота может содержать нуклеотидную последовательность, кодирующую по меньшей мере одну, две, три, четыре, пять или шесть CDR или гипервариабельные петли из вариабельных областей тяжелой и легкой цепей, имеющую нуклеотидную последовательность, представленную в таблице 1, или последовательность, по существу гомологичную ей (например, последовательность, которая характеризуется по меньшей мере приблизительно 85%, 90%, 95% или 99% идентичностью последовательности по отношению к ней).
[00199] Полинуклеотидные последовательности можно получать с помощью синтеза de novo (например, твердофазного синтеза ДНК) или с помощью ПЦР-мутагенеза существующей последовательности, кодирующей антитело к hTREM2 или его антигенсвязывающий фрагмент. Прямой химический синтез нуклеиновых кислот можно осуществлять с помощью способов, известных из уровня техники, таких как фосфотриэфирный способ из Narang et al., 1979, Meth. Enzymol. 68:90; фосфодиэфирный способ из Brown et al., Meth. Enzymol. 68:109, 1979; диэтилфосфорамидитный способ из Beaucage et al., Tetra Lett., 22:1859, 1981; и способ с использованием твердой подложки из патента США №4458066. Введение мутаций в полинуклеотидную последовательность с помощью ПЦР можно осуществлять, как описано, например, в PCR Technology: Principles and Applications for DNA Amplification, H.A. Erlich (Ed.), Freeman Press, NY, N.Y., 1992; PCR Protocols: A Guide to Methods and Applications, Innis et al. (Ed.), Academic Press, San Diego, Calif., 1990; Mattila et al., Nucleic Acids Res. 19:967, 1991; и Eckert et al., PCR Methods and Applications 1:17, 1991.
[00200] Также в данном документе предусмотрены векторы (например, векторы экспрессии), содержащие полинуклеотид, кодирующий полипептид, содержащий сегмент или домен антител к hTREM2 или их антигенсвязывающих фрагментов, описанных в данном документе. Такие векторы можно использовать для экспрессии и/или продуцирования или воздействия на экспрессию антитела к hTREM2 или антигенсвязывающих фрагментов (например, как описано в данном документе), например, в клетках ex vivo или в клетках in vivo, например в ткани или тканях, представляющих интерес, в организме. Различные векторы экспрессии можно использовать для экспрессии полинуклеотидов, кодирующих антитела к hTREM2 или их связывающие фрагменты. Как вирусные, так и невирусные векторы экспрессии можно применять для продуцирования антител или их фрагментов в клетке, например клетке млекопитающего. Невирусные векторы и системы включают плазмиды, эписомные векторы, как правило, с кассетой экспрессии для экспрессии белка или РНК и искусственные хромосомы человека (см., например, Harrington et al., Nat Genet. 15:345, 1997).). Такие невирусные векторы могут быть доставлены в представляющую интерес клетку с использованием способов трансфекции или трансдукции, известных в данной области техники, например с использованием липидов (например, липофектамина), электропорации, механического искажения клеточной мембраны и т.п. Термин "вектор экспрессии" относится к молекуле нуклеиновой кислоты-переносчика, в которую может быть вставлена необходимая кодирующая последовательность для введения в клетку, где она может экспрессироваться. Вектор может представлять собой ДНК-вектор, РНК-вектор, плазмиду, космиду, или вирусный вектор, или искусственные хромосомы (см., например, Harrington et al., Nat Genet 15:345, 1997). Например, невирусные векторы, применимые для экспрессии антител к hTREM2 или их антигенсвязывающих фрагментов в клетках млекопитающих (например, человека), включают pThioHis A, B и C, pcDNA3.1/His, pEBVHis A, B и C (Invitrogen, Сан-Диего, Калифорния, США), векторы на основе MPSV и многочисленные другие векторы, известные из уровня техники, для экспрессии белков. Например, в одном классе векторов используются ДНК-элементы, которые получены из вирусов животных, таких как, например, вирус папилломы крупного рогатого скота, вирус полиомы, аденовирус, вирус осповакцины, бакуловирус, ретровирусы (вирус саркомы Рауса, MMTV или MOMLV) или вирус SV40. В другом классе векторов используются РНК-элементы, полученные из РНК-содержащих вирусов, таких как вирус леса Семлики, вирус восточного энцефалита лошадей и флавивирусы. Применимые вирусные векторы включают векторы на основе любых из следующих вирусов: ретровирусов (например, лентивирус), лентивирусов, аденовирусов, аденоассоциированных вирусов, вирусов герпеса (например, вируса простого герпеса (HSV)), векторов на основе SV40, вируса папилломы, вируса Эпштейна-Барр HBP, вируса осповакцины, вируса Синдбис, вируса гриппа, реовируса, вируса ньюкаслской болезни (NDV), вируса кори, вируса везикулярного стоматита (VSV), парвовируса, полиовируса, поксвируса, вируса Сенека-Валли, вируса Коксаки, энтеровируса, вируса миксомы, вируса Мараба или вируса леса Семлики (SFV). См. Brent et al., выше; Smith, Annu. Rev. Microbiol. 49:807, 1995; и Rosenfeld et al., Cell 68:143, 1992.
[00201] В некоторых вариантах осуществления вектор представляет собой ретровирусный вектор. В некоторых вариантах осуществления вектор представляет собой лентивирусный вектор. Векторы, полученные из ретровирусов, таких как лентивирус, являются подходящими инструментами для осуществления долговременного переноса генов, поскольку они обеспечивают долговременную стабильную интеграцию трансгена и его размножение в дочерних клетках. Лентивирусные векторы обладают дополнительным преимуществом по сравнению с векторами, полученными из онкоретровирусов, таких как вирусы лейкоза мышей, заключающимся в том, что ими можно трансдуцировать непролиферирующие клетки, такие как гепатоциты. Они также обладают дополнительным преимуществом, заключающимся в низкой иммуногенности. Ретровирусный вектор также может представлять собой, например, гамма-ретровирусный вектор. Гамма-ретровирусный вектор может содержать, например, промотор, сигнал упаковки (ψ), сайт связывания праймера (PBS), один или несколько (например, два) длинных концевых повторов (LTR) и трансген, представляющий интерес, например, ген, кодирующий CAR. В гамма-ретровирусном векторе могут отсутствовать структурные гены вирусов, такие как gag, pol и env. Иллюстративные гамма-ретровирусные векторы включают вирус лейкоза мышей (MLV), вирус некроза селезенки (SFFV) и вирус миелопролиферативной саркомы (MPSV), а также векторы, полученные из них. Другие гамма-ретровирусные векторы описаны, например, в Tobias Maetzig et al., "Gammaretroviral Vectors: Biology, Technology and Application" Viruses. 2011 Jun; 3(6): 677-713.
[00202] В некоторых вариантах осуществления вектор представляет собой вектор на основе аденоассоциированного вируса (AAV), например, вектор на основе рекомбинантного AAV (rAAV). "AAV" представляет собой аббревиатуру для аденоассоциированного вируса и может применяться в отношении самого вируса или его производных. Термин охватывает все подтипы как встречающихся в природе, так и рекомбинантных форм, за исключением случаев, когда требуется иное. Аббревиатура "rAAV" относится к рекомбинантному аденоассоциированному вирусу, также называемому вектором на основе рекомбинантного AAV (или "вектором на основе rAAV"). Термин "AAV" включает, например, AAV 1 типа (AAV1), AAV 2 типа (AAV2), AAV 3 типа (AAV3), AAV 4 типа (AAV4), AAV 5 типа (AAV5), AAV 6 типа (AAV6), AAV 7 типа (AAV7), AAV 8 типа (AAV8), AAV 9 типа (AAV9), AAV 10 типа (AAV10, в том числе AAVrh10), AAV 12 типа (AAV12), AAV птиц, AAV крупного рогатого скота, AAV собак, AAV лошадей, AAV приматов, AAV млекопитающих, отличных от приматов, и AAV овец. "AAV приматов" относится к AAV, который инфицирует приматов, "AAV млекопитающих, отличных от приматов" относится к AAV, который инфицирует млекопитающих, отличных от приматов, "AAV крупного рогатого скота" относится к AAV, который инфицирует млекопитающих, относящихся к крупному рогатому скоту, и т.д.
[00203] Геномные последовательности различных серотипов AAV, а также последовательности нативных инвертированных концевых повторов (ITR), белков Rep и субъединиц капсида известны из уровня техники. Такие последовательности можно найти в литературе или в общедоступных базах данных, таких как GenBank. См., например, №№ доступа в GenBank NC-002077 (AAV1), AF063497 (AAV1), NC-001401 (AAV2), AF043303 (AAV2), NC-001729 (AAV3), NC-001829 (AAV4), U89790 (AAV4), NC-006152 (AAV5), AF513851 (AAV7), AF513852 (AAV8) и NC-006261 (AAV8) или в публикациях, таких как WO 2005033321 (AAV1-9), раскрытия которых включены в данный документ посредством ссылки. См. также, например, Srivastava et al. (1983) J. Virology 45:555; Chiorini et al. (1998) J. Virology 71:6823; Chiorini et al. (1999) J. Virology 73: 1309; Bantel-Schaal et al. (1999) J. Virology 73:939; Xiao et al. (1999) J. Virology 73:3994; Muramatsu et al. (1996) Virology 221:208; Shade et al. (1986) J. Virol. 58:921; Gao et al. (2002) Proc. Nat. Acad. Sci. USA 99: 11854; Moris et al. (2004) Virology 33:375-383; публикации международных заявок на патент WO 00/28061, WO 99/61601, WO 98/11244 и патент США №6156303.
[00204] Используемый в данном документе термин "вектор на основе rAAV" относится к вектору на основе AAV, содержащему полинуклеотидную последовательность, происходящую не от AAV (т.е. полинуклеотид, гетерологичный по отношению к AAV), как правило, последовательность, представляющую интерес для генетической трансформации клетки. В некоторых вариантах осуществления гетерологичный полинуклеотид может быть фланкирован по меньшей мере одной и иногда двумя последовательностями инвертированных концевых повторов (ITR) AAV. Термин "вектор на основе rAAV" охватывает как векторные частицы на основе rAAV, так и векторные плазмиды на основе rAAV. Вектор на основе rAAV может быть однонитевым (ssAAV) либо самокомплементарным (scAAV). "Вирус AAV", или "вирусная частица AAV", или "векторная частица на основе rAAV" относится к вирусной частице, состоящей из по меньшей мере одного капсидного белка AAV (как правило, из всех капсидных белков AAV дикого типа или полученных из одного или более AAV дикого типа) и заключенного в капсид полинуклеотидного вектора на основе rAAV. Если частица содержит гетерологичный полинуклеотид (т.е. полинуклеотид, отличный от генома AAV дикого типа, такой как трансген, который должен быть доставлен в клетку млекопитающего), она, как правило, называется "векторной частицей на основе rAAV" или просто "вектором на основе rAAV". Таким образом, получение частицы rAAV обязательно включает получение вектора на основе rAAV, такого как вектор, содержащийся в частице rAAV.
[00205] В некоторых вариантах осуществления вектор может представлять собой рекомбинантную молекулу ДНК, содержащую нуклеиновую кислоту, кодирующую антитело к hTREM2 или его антигенсвязывающий фрагмент, например как описано в данном документе. Используемый в данном документе термин "рекомбинантный" означает, что вектор, полинуклеотид, полипептид или клетка представляют собой продукт различных комбинаций стадий клонирования, рестрикции или лигирования (например, в отношении полинуклеотида или полипептида, содержащегося в них) и/или других процедур, которые приводят к получению конструкции, отличающейся от продукта, обнаруживаемого в природе. Рекомбинантный вирус или вектор представляет собой вирусную частицу, содержащую рекомбинантный полинуклеотид. Данные термины соответственно включают продукты репликации исходной полинуклеотидной конструкции и дочерние продукты исходной вирусной конструкции.
[00206] Рекомбинантный вектор, как правило, содержит одну или несколько регуляторных последовательностей, функционально связанных с последовательностью нуклеиновой кислоты, которая должна экспрессироваться. Термин "регуляторная последовательность" включает промоторы, энхансеры и другие элементы, контролирующие экспрессию (например, сигналы полиаденилирования). Регуляторные последовательности включают последовательности, которые управляют конститутивной экспрессией нуклеотидной последовательности, а также тканеспецифичные регуляторные и/или индуцируемые последовательности. Векторы экспрессии могут также содержать элементы, предназначенные для оптимизации стабильности матричной РНК и ее способности к трансляции в клетках-хозяевах, и/или маркеры для отбора по чувствительности к лекарственному средству для создания постоянных стабильных клеточных клонов, экспрессирующих антитело к hTREM2 или его антигенсвязывающий фрагмент, например как описано в данном документе. Конструкция вектора экспрессии может зависеть от таких факторов, как выбор клетки-хозяина, которая должна быть трансформирована, необходимый уровень экспрессии белка и т.п. Общие способы создания таких рекомбинантных векторов экспрессии можно найти в Sambrook and Russell eds. (2001) Molecular Cloning: A Laboratory Manual, 3rd edition; сериях Ausubel et al. eds. (2007 г., с дополнениями и исправлениями до 2010 г.) Current Protocols in Molecular Biology, среди других, известных из уровня техники.
[00207] Для эффективной трансляции кодирующих последовательностей также может требоваться специфический сигнал инициации. Такие сигналы включают инициирующий кодон ATG или смежные последовательности. Может быть необходимым обеспечение наличия экзогенных сигналов контроля трансляции, в том числе инициирующего кодона ATG. Специалист обычной квалификации в данной области легко сможет определить это и обеспечить наличие необходимых сигналов. Хорошо известно, что инициирующий кодон должен быть "внутрирамочным" по отношению к рамке считывания необходимой кодирующей последовательности для обеспечения трансляции всей вставки. Экзогенные сигналы контроля трансляции и инициирующие кодоны могут быть природными либо синтетическими. Эффективность экспрессии можно усилить посредством включения подходящих элементов, представляющих собой энхансеры транскрипции.
[00208] Для экспрессии можно использовать любые подходящие клетки-хозяева, известные из уровня техники, например, клетки-хозяева, являющиеся клетками млекопитающих, бактериальные клетки-хозяева, дрожжевые клетки-хозяева, клетки-хозяева, являющиеся клетками насекомых, и т.д. Как прокариотические, так и эукариотические системы экспрессии являются широко доступными. В некоторых вариантах осуществления система экспрессии представляет собой систему экспрессии в клетках млекопитающих, такую как система экспрессии в клетках CHO. В некоторых вариантах осуществления нуклеиновая кислота может быть кодон-оптимизированной для облегчения экспрессии в необходимой клетке-хозяине. Будет важно использовать промотор и/или энхансер, который эффективно управляет экспрессией сегмента ДНК в типе клеток, органелле и организме, выбранных для экспрессии. Специалисты в области молекулярной биологии обычно знают об использовании комбинаций промоторов, энхансеров и типов клеток для экспрессии белков, например, см. Sambrook et al. (2001).
[00209] Большинство транскрибируемых эукариотических молекул РНК будут подвергаться сплайсингу РНК для удаления интронов из первичных транскриптов. При использовании векторов, содержащих геномные эукариотические последовательности, могут требоваться донорные и/или акцепторные сайты сплайсинга для обеспечения надлежащего процессинга транскрипта для экспрессии белка (см. Chandler et al., 1997, Proc. Natl. Acad. Sci. USA, 94(8):3596-601).
[00210] Векторы или конструкции по настоящему изобретению обычно будут содержать по меньшей мере один сигнал терминации. "Сигнал терминации" или "терминатор" состоит из последовательностей ДНК, участвующих в специфической терминации РНК-транскрипта РНК-полимеразой. Таким образом, в определенных вариантах осуществления предусматривается сигнал терминации, который завершает продуцирование РНК-транскрипта. Терминатор может быть необходим in vivo для достижения необходимых уровней первичного транскрипта. В эукариотических системах терминаторная область может также содержать специфические последовательности ДНК, которые позволяют осуществлять сайт-специфическое расщепление нового транскрипта таким образом, чтобы сделать доступным сайт полиаденилирования. Данные сигналы необходимы специализированной эндогенной полимеразе для добавления фрагмента из приблизительно 200 остатков A (поли-A) к 3'-концу транскрипта. Молекулы РНК, модифицированные с помощью данного поли-A-хвоста, по-видимому, являются более стабильными и транслируются более эффективно. Таким образом, в других вариантах осуществления, предусматривающих эукариот, предпочтительно, чтобы терминатор содержал сигнал для расщепления РНК, и более предпочтительно, чтобы сигнал терминатора способствовал полиаденилированию первичного транскрипта. Элементы терминатора и/или сайта полиаденилирования могут служить для повышения уровней первичного транскрипта и/или для сведения к минимуму сквозного прочитывания с переходом от кассеты к другим последовательностям. Терминаторы, предусмотренные для применения в настоящем изобретении, включают любой известный терминатор транскрипции, описанный в данном документе или известный специалисту обычной квалификации в данной области, в том числе без ограничения, например, терминирующие последовательности генов, такие как, например, терминатор гена гормона роста крупного рогатого скота или вирусные терминирующие последовательности, такие как, например, терминатор SV40. В определенных вариантах осуществления сигналом терминации может являться отсутствие транскрибируемой или транслируемой последовательности, например, вследствие усечения последовательности.
[00211] При экспрессии, в частности при эукариотической экспрессии, как правило, будет включен сигнал полиаденилирования для осуществления надлежащего полиаденилирования транскрипта. Считается, что природа сигнала полиаденилирования не имеет решающего значения для успешного осуществления настоящего изобретения на практике, и/или можно использовать любую такую последовательность. Предпочтительные варианты осуществления включают сигнал полиаденилирования SV40 и/или сигнал полиаденилирования гена гормона роста крупного рогатого скота, удобные и/или известные как хорошо функционирующие в различных клетках-мишенях. Полиаденилирование может увеличивать стабильность транскрипта или может облегчать цитоплазматический транспорт.
[00212] Для размножения вектора в клетке-хозяине он может содержать одну или несколько точек начала репликации (часто называемых "ori"), которые представляют собой специфическую последовательность нуклеиновой кислоты, в которой инициируется репликация. В качестве альтернативы можно использовать автономно реплицирующуюся последовательность (ARS), если клетка-хозяин представляет собой дрожжевую клетку.
[00213] В определенных вариантах осуществления настоящего изобретения клетки, содержащие конструкцию нуклеиновой кислоты по настоящему изобретению, можно идентифицировать in vitro или in vivo посредством включения маркера в вектор экспрессии. Такие маркеры будут придавать клетке идентифицируемое изменение, позволяющее легко идентифицировать клетки, содержащие вектор экспрессии. Обычно селектируемый маркер представляет собой маркер, который придает свойство, которое обеспечивает возможность отбора. Положительный селектируемый маркер представляет собой такой маркер, при котором наличие маркера обеспечивает возможность его отбора, тогда как отрицательный селектируемый маркер представляет собой такой маркер, при котором его наличие предотвращает его отбор. Пример положительного селектируемого маркера представляет собой маркер устойчивости к лекарственному средству.
[00214] Обычно включение селектируемого маркера для отбора по чувствительности к лекарственному средству способствует клонированию и идентификации трансформантов, например, гены, которые придают устойчивость к неомицину, пуромицину, гигромицину, DHFR, GPT, зеоцину и гистидинолу, являются применимыми селектируемыми маркерами. В дополнение к маркерам, придающим фенотип, который обеспечивает возможность установления различий между трансформантами на основе реализации условий, также предусматриваются другие типы маркеров, в том числе маркеры для скрининга, такие как GFP, применение которых основано на колориметрическом анализе. В качестве альтернативы можно использовать ферменты для скрининга, такие как тимидинкиназа вируса простого герпеса (HSV-tk) или хлорамфениколацетилтрансфераза (CAT). Специалист в данной области также будет знать, как использовать иммунологические маркеры, возможно в сочетании с FACS-анализом. Считается, что используемый маркер не важен при условии, что он способен экспрессироваться одновременно с нуклеиновой кислотой, кодирующей продукт гена. Дополнительные примеры селектируемых маркеров и маркеров для скрининга хорошо известны специалисту в данной области.
[00215] Выбор вектора экспрессии зависит от предполагаемых клеток, в которых должны экспрессироваться один или несколько компонентов вектора. Как правило, векторы содержат одну или несколько регуляторных последовательностей, таких как промотор, и другую регуляторную последовательность (например, энхансеры), которые функционально связаны с полинуклеотидами, кодирующими антитело к hTREM2 или его антигенсвязывающий фрагмент.
[00216] "Промотор" представляет собой контролирующую последовательность, которая представляет собой область последовательности нуклеиновой кислоты, с помощью которой контролируются инициация и скорость транскрипции. Он может содержать генетические элементы, с которыми могут связываться регуляторные белки и молекулы, такие как РНК-полимераза, и другие факторы транскрипции. Фразы "функционально расположенный", "функционально связанный", "под контролем" и "под транскрипционным контролем" означают, что промотор находится в надлежащих функциональных местоположении и/или ориентации по отношению к последовательности нуклеиновой кислоты для контроля инициации транскрипции и/или экспрессии этой последовательности. Промотор можно использовать или не использовать в сочетании с "энхансером", который относится к цис-действующей регуляторной последовательности, участвующей в активации транскрипции последовательности нуклеиновой кислоты.
[00217] Промотор может быть естественным образом связан с геном или последовательностью, а также может быть получен посредством выделения 5'-некодирующих последовательностей, расположенных выше кодирующего сегмента и/или экзона. Такой промотор может называться "эндогенным". Аналогичным образом, энхансер может быть естественным образом связан с последовательностью нуклеиновой кислоты и быть расположенным ниже или выше данной последовательности. В качестве альтернативы, определенные преимущества будут достигнуты посредством расположения кодирующего сегмента нуклеиновой кислоты под контролем рекомбинантного или гетерологичного промотора, который относится к промотору, обычно не связанному с последовательностью нуклеиновой кислоты в своей естественной среде. Рекомбинантный или гетерологичный энхансер также относится к энхансеру, обычно не связанному с последовательностью нуклеиновой кислоты в своей естественной среде. Такие промоторы или энхансеры могут включать промоторы или энхансеры из других генов, а также промоторы или энхансеры, выделенные из любой другой прокариотической клетки, вируса или эукариотической клетки, и промоторы или энхансеры, "не встречающиеся в природе", т.е. содержащие другие элементы других областей регуляции транскрипции и/или мутации, которые изменяют экспрессию. В дополнение к получению последовательностей нуклеиновых кислот промоторов и энхансеров синтетическим путем, последовательности можно получать с помощью технологии рекомбинантного клонирования и/или амплификации нуклеиновых кислот, например, ПЦР, совместно с композициями, раскрытыми в данном документе (см. US 4683202, US 5928906). Кроме того, предусматривается, что также можно использовать контролирующие последовательности, которые управляют транскрипцией и/или экспрессией последовательностей в неядерных органеллах, таких как митохондрии, хлоропласты и т.п.
[00218] Используемые промоторы могут быть конститутивными, индуцируемыми, синтетическими, ткане- или клеточноспецифичными и/или применимыми в подходящих условиях для управления экспрессией введенного сегмента ДНК на высоком уровне, что является преимущественным при крупномасштабном получении рекомбинантных белков и/или пептидов. Кроме того, также могут быть включены другие регуляторные элементы для улучшения экспрессии нуклеиновой кислоты, кодирующей антитело, которое связывается с белком TREM2 человека (т.е. hTREM2), например, энхансеры, сайт связывания рибосомы, последовательности терминации транскрипции и т.п.
[00219] В некоторых вариантах осуществления конститутивный промотор применяют для обеспечения постоянной экспрессии антитела к hTREM2 или его антигенсвязывающего фрагмента. Примеры конститутивного промотора включают без ограничения немедленно-ранний промотор цитомегаловируса (CMV), ранний промотор вируса обезьян 40 (SV40), промотор вируса опухоли молочной железы мышей (MMTV), промотор длинного концевого повтора (LTR) вируса иммунодефицита человека (HIV), промотор MoMuLV, промотор вируса лейкоза птиц, немедленно-ранний промотор вируса Эпштейна-Барр, промотор вируса саркомы Рауса, а также промоторы человеческих генов, такие как без ограничения промотор гена актина, промотор гена миозина, промотор гена фактора элонгации 1α, промотор гена гемоглобина и промотор гена креатинкиназы.
[00220] В одном варианте осуществления индуцируемый промотор используют для предотвращения экспрессии вставленных последовательностей в условиях, отличающихся от индуцирующих. Использование индуцируемого промотора обеспечивает наличие молекулярного переключателя, способного включать экспрессию полинуклеотидной последовательности, с которой он функционально связан, если такая экспрессия требуется, или отключать экспрессию, если экспрессия не требуется. Примеры индуцируемых промоторов включают без ограничения металлотионеин-индуцируемый промотор.
[00221] Индуцируемые промоторы включают без ограничения, например, промотор арабинозы, промотор lacZ, тетрациклин-индуцируемый промотор, промотор гена металлотионеинов, глюкокортикоид-индуцируемый промотор, прогестерон-индуцируемый промотор или промотор гена белка теплового шока.
[00222] Дополнительно к промоторам другие регуляторные элементы также могут быть необходимыми или требуемыми для эффективной экспрессии антитела к hTREM2 или его антигенсвязывающего фрагмента. Эти элементы включают инициаторный кодон ATG и смежный сайт связывания рибосомы или другие последовательности. Кроме того, эффективность экспрессии можно повысить путем включения энхансеров, соответствующих применяемой клеточной системе (см., например, Scharf et al., Results Probl. Cell Differ. 20:125, 1994; и Bittner et al., Meth. Enzymol., 153:516, 1987). Например, для увеличения экспрессии в клетках-хозяевах, представляющих собой клетки млекопитающих, можно применять энхансер SV40 или энхансер CMV.
[00223] В некоторых вариантах осуществления промотор, специфический в отношении типа ткани или клеток, применяют для обеспечения экспрессии антитела к hTREM2 или его антигенсвязывающего фрагмента только в специфических тканях или клетках. Характерные особенности ткане- или клеточноспецифичных промоторов или элементов, а также анализы для определения характеристик их форм активности хорошо известны специалистам в данной области. Примеры включают промотор гена LIMK2 человека (Nomoto et al. 1999, Gene, 236(2):259-271), гена рецептора соматостатина 2 типа (Kraus et al., 1998, FEES Lett., 428(3): 165-170), гена эпидидимального белка, связывающего ретиноевую кислоту, мыши (Lareyre et al., 1999, J. Biol. Chem., 274(12):8282-8290), гена CD4 человека (Zhao-Emonet et al., 1998, Biochim. Biophys. Acta, 1442(2-3): 109-119), гена альфа-2-цепи коллагена (XI типа) мыши (Tsumaki, et al., 1998, J. Biol. Chem., 273(36):22861-22864), гена дофаминового рецептора D1A (Lee, et al., 1997, J. Auton. Nerv. Syst., 74(2-3):86-90), гена инсулиноподобного фактора роста II (Wu et al., 1997, Biochem. Biophys. Res. Commun., 233(1):221-226), гена тромбоцитарно-эндотелиальной молекулы 1 клеточной адгезии человека (Almendro et al., 1996, J. Immunol., 157(12):5411-5421), гена мышечной креатинкиназы (MCK) (Wang et al., Gene Ther. 2008 Nov;15(22):1489-99).
[00224] В некоторых вариантах осуществления синтетический промотор применяют для обеспечения экспрессии антитела к hTREM2 или его антигенсвязывающего фрагмента. Синтетические промоторы могут значительно превосходить природные промоторы по активности транскрипции. Например, можно выбрать синтетические промоторы, активность которых не отключается или не снижается под действием эндогенных клеточных механизмов или факторов. Другие элементы, в том числе сайты связывания транс-действующих факторов и энхансеры, могут быть вставлены в синтетический промотор для улучшения эффективности транскрипции. Синтетические промоторы можно рационально разработать и синтезировать химическим путем с объединением лучших признаков как синтетических, так и биологических промоторов. Синтетические олигонуклеотиды отжигают и лигируют посредством нескольких способов для создания полноразмерного химически синтезированного промотора. Синтетические промоторы могут представлять собой индуцируемые промоторы или промоторы, специфичные для типа клеток.
[00225] В предпочтительном варианте осуществления вектор представляет собой вектор на основе аденоассоциированного вируса. В вариантах осуществления вектор на основе AAV содержит полинуклеотид, кодирующий антитело к hTREM2 или его антигенсвязывающий фрагмент, например как описано в данном документе. В типичных вариантах осуществления вектор на основе AAV содержит полинуклеотид, кодирующий антитело к hTREM2 или его связывающий фрагмент, который фланкирован с одной или обеих сторон последовательностью инвертированного концевого повтора (ITR). Полинуклеотид может дополнительно содержать один или несколько дополнительных элементов, таких как, например, промотор, энхансер, одна или несколько интронных последовательностей, последовательность поли(A) и их комбинации. В некоторых вариантах осуществления вектор содержит полинуклеодит, при этом векторная плазмида на основе AAV содержит полинуклеотид, кодирующий антитело к hTREM2 или его антигенсвязывающий фрагмент, например как описано в данном документе, заключенный в капсид AAV.
[00226] В некоторых вариантах осуществления вектор содержит полинуклеотид, кодирующий антитело к hTREM2 или его антигенсвязывающий фрагмент, например как описано в данном документе, функционально связанный с по меньшей мере одной совместимой с клеткой-мишенью регуляторной последовательностью, например промотором.
[00227] В некоторых вариантах осуществления ITR в векторе на основе AAV получены из одного серотипа AAV. В некоторых вариантах осуществления ITR в векторе на основе AAV получены из разных серотипов AAV. В некоторых вариантах осуществления ITR в частице AAV являются одинаковыми. В некоторых вариантах осуществления ITR в частице AAV являются различными.
[00228] В некоторых вариантах осуществления ITR в векторе на основе AAV получены из того же серотипа AAV, что и капсид AAV. В некоторых вариантах осуществления ITR в векторе на основе AAV получены из серотипов, отличных от тех, из которых получен капсид AAV. В одном варианте осуществления ITR получены из AAV2, а капсид AAV получен из серотипа, отличного от AAV2, например AAV9.
[00229] В векторах экспрессии также может быть предусмотрено положение последовательности сигнала секреции для образования слитого белка с полипептидами, кодируемыми вставленными последовательностями антитела к hTREM2 или его антигенсвязывающего фрагмента. Вставляемые последовательности антитела к hTREM2 или его антигенсвязывающего фрагмента чаще связывают с сигнальной последовательностью до включения в вектор. Векторы, которые должны использоваться для получения последовательностей, кодирующих вариабельные домены легкой и тяжелой цепей антитела к hTREM2, иногда также кодируют константные области или их части. Такие векторы обеспечивают возможность экспрессии вариабельных областей в виде слитых белков с константными областями, что таким образом приводит к продуцированию интактных антител и их антигенсвязывающих фрагментов. Как правило, такие константные области являются человеческими.
[00230] При создании вектора экспрессии можно использовать вектор, содержащий сайт множественного клонирования (MCS), который представляет собой область нуклеиновой кислоты, содержащую несколько сайтов для рестрикционных ферментов, любой из которых можно использовать в сочетании со стандартной рекомбинантной технологией для расщепления вектора. См. Carbonelli et al., 1999, Levenson et al., 1998, и Cocea, 1997. "Расщепление рестрикционным ферментом" относится к каталитическому расщеплению молекулы нуклеиновой кислоты с помощью фермента, который функционирует только в конкретных местоположениях молекулы нуклеиновой кислоты. Множество таких рестрикционных ферментов являются коммерчески доступными. Применение таких ферментов широко известно специалистам в данной области. Часто вектор линеаризуют или фрагментируют с помощью рестрикционного фермента, который производит разрез в пределах MCS, для обеспечения лигирования экзогенных последовательностей с вектором. "Лигирование" относится к способу образования фосфодиэфирных связей между двумя фрагментами нуклеиновой кислоты, которые могут быть или не быть смежными друг с другом. Методики, предусматривающие рестрикционные ферменты и реакции лигирования, хорошо известны специалистам в области рекомбинантной технологии.
[00231] Способы введения векторов экспрессии, содержащих полинуклеотидные последовательности, представляющие интерес, варьируются в зависимости от типа клетки-хозяина. Например, трансфекцию с использованием хлорида кальция обычно используют для прокариотических клеток, тогда как обработку фосфатом кальция или электропорацию можно применять для других клеток-хозяев (см. в общих чертах Sambrook et al., выше). Другие способы включают, например, электропорацию, обработку фосфатом кальция, трансформацию, опосредованную липосомами, инъекцию и микроинъекцию, баллистические способы/генную пушку, виросомы, иммунолипосомы, конъюгаты поликатион:нуклеиновая кислота, "голую" ДНК, искусственные вирионы, слияние со структурным белком VP22 вируса герпеса, усиленное средством поглощение ДНК, трансдукцию ex vivo, слияние протопластов, ретровирусную трансдукцию, вирусную трансфекцию, липидную трансфекцию или другие традиционные методики. В случае слияния протопластов клетки выращивают в среде и подвергают скринингу в отношении соответствующей активности. Для долговременного получения рекомбинантных белков с высоким выходом зачастую будет необходима стабильная экспрессия. Например, линии клеток, которые стабильно экспрессируют полипептиды, можно получать с помощью векторов экспрессии, которые содержат вирусные точки начала репликации или эндогенные экспрессионные элементы и ген селектируемого маркера. После введения вектора клеткам можно предоставлять возможность роста в течение 1-2 дней в обогащенной среде перед их переносом в селективную среду. Задачей селектируемого маркера является придание устойчивости к факторам отбора, и его присутствие обеспечивает возможность роста клеток, которые успешно экспрессируют введенные последовательности, в селективной среде. Пролиферацию устойчивых стабильно трансфицированных клеток можно обеспечивать с применением методик культивирования тканей, соответствующих типу клеток. Способы и условия культивирования полученных в результате трансфицированных клеток и извлечения продуцированного антитела известны специалистам в данной области техники и могут быть изменены или оптимизированы в зависимости от конкретных используемых вектора экспрессии и клетки-хозяина, являющейся клеткой млекопитающего, исходя из настоящего описания.
[00232] Также в данном документе предусмотрены клетки, которые содержат любой из векторов экспрессии, описанных в данном документе. В некоторых вариантах осуществления настоящее изобретение относится к клетке-хозяину, которая содержит молекулу нуклеиновой кислоты, описанную в данном документе. Такие клетки могут представлять собой клетку-хозяина или терапевтическую клетку. Термины "клетка-хозяин" и "рекомбинантная клетка-хозяин" используются в данном документе взаимозаменяемо и относятся не только к конкретной рассматриваемой клетке, но и к потомству или потенциальному потомству такой клетки. Поскольку в последующих поколениях могут происходить определенные модификации из-за мутаций либо из-за влияний окружающей среды, такое потомство может в действительности не быть идентичным родительской клетке, но по-прежнему включаться в объем термина, используемого в данном документе.
[00233] В одном варианте осуществления клетки-хозяева модифицированы методами генной инженерии таким образом, что они содержат нуклеиновые кислоты, кодирующие антитело к hTREM2 или его антигенсвязывающий фрагмент. В одном варианте осуществления клетки-хозяева модифицированы методами генной инженерии путем применения кассеты экспрессии. Фраза "кассета экспрессии" относится к нуклеотидным последовательностям, которые способны влиять на экспрессию гена у хозяев, совместимых с такими последовательностями. Такие кассеты могут содержать промотор, открытую рамку считывания с интронами или без них и сигнал терминации. Также можно применять дополнительные факторы, необходимые или полезные при осуществлении экспрессии, такие как, например, индуцируемый промотор.
[00234] Клетки-хозяева, которые должны нести и экспрессировать цепи антитела к hTREM2 или его антигенсвязывающего фрагмента, могут представлять собой без ограничения эукариотическую клетку или прокариотическую клетку, такую как бактериальная клетка, клетка насекомого или клетка человека. E. coli является одним прокариотическим хозяином, применимым для клонирования и экспрессии полинуклеотидов по настоящему изобретению. Другие подходящие для применения микробные хозяева включают бацилл, таких как Bacillus subtilis, и других энтеробактерий, таких как Salmonella, Serratia и различные виды Pseudomonas. Для этих прокариотических хозяев также можно создать векторы экспрессии, которые, как правило, содержат последовательности, контролирующие экспрессию, совместимые с клеткой-хозяином (например, точку начала репликации). Кроме того, будет присутствовать любое количество разнообразных хорошо известных промоторов, как, например, лактозная промоторная система, триптофановая (trp) промоторная система, бета-лактамазная промоторная система или промоторная система из фага лямбда. Как правило, промоторы контролируют экспрессию, необязательно с помощью операторной последовательности, и имеют последовательности сайта связывания рибосомы и т.п. для инициации и завершения транскрипции и трансляции. Для экспрессии антител к hTREM2 или их антигенсвязывающих фрагментов по настоящему изобретению также можно использовать другие микроорганизмы, такие как дрожжи. Также можно использовать клетки насекомых в комбинации с бакуловирусными векторами. Подходящие клетки насекомых включают без ограничения клетки Sf9.
[00235] В одном варианте осуществления клетки-хозяева, являющиеся клетками млекопитающих, используют для экспрессии и получения антител к hTREM2 или их антигенсвязывающих фрагментов по настоящему изобретению. Например, они могут представлять собой гибридомную линию клеток, экспрессирующих эндогенные гены иммуноглобулинов (например, клетку гибридомы из миеломы 1D6.C9), либо линию клеток млекопитающих, несущих экзогенный вектор экспрессии (например, клетку миеломы SP2/0). Они включают любую нормальную мортальную или нормальную или аномальную иммортальную клетку животного или человека. Например, был разработан ряд подходящих линий клеток-хозяев, способных секретировать интактные иммуноглобулины, в том числе линии клеток CHO, различные линии клеток Cos, клетки HeLa, линии клеток миеломы, трансформированные B-клетки и гибридомы. Применение тканевой культуры клеток млекопитающих для экспрессии полипептидов в общих чертах обсуждается, например, в Winnacker, From Genes to Clones, VCH Publishers, N.Y., N.Y., 1987. Векторы экспрессии для клеток-хозяев, являющихся клетками млекопитающих, могут содержать последовательности, контролирующие экспрессию, такие как точка начала репликации, промотор и энхансер (см., например, Queen, et al., Immunol. Rev. 89:49-68, 1986), а также необходимые сайты процессинга информации, такие как сайты связывания рибосомы, сайты сплайсинга РНК, сайты полиаденилирования и последовательности терминаторов транскрипции. Эти векторы экспрессии обычно содержат промоторы, полученные из генов млекопитающих или из вирусов млекопитающих. Подходящие промоторы могут быть конститутивными, специфичными для типа клеток, специфичными для стадии развития и/или модулируемыми или регулируемыми. Применимые промоторы включают без ограничения промотор гена металлотионеина, конститутивный большой поздний промотор аденовируса, дексаметазон-индуцируемый промотор MMTV, промотор SV40, промотор pol III MRP, конститутивный промотор MPSV, тетрациклин-индуцируемый промотор CMV (такой как немедленно-ранний промотор CMV человека), конститутивный промотор CMV и комбинации промотор-энхансер, известные из уровня техники.
[00236] Клетка-хозяин может использоваться для получения или экспрессии антитела, которое связывается с белком TREM2 человека (т.е. hTREM2). Соответственно, настоящее изобретение также относится к способам получения антитела к hTREM2 или его антигенсвязывающего фрагмента с применением клетки-хозяина. В одном варианте осуществления способ включает культивирование клетки-хозяина (в которую был введен рекомбинантный вектор экспрессии, кодирующий антитело) в подходящей среде таким образом, чтобы продуцировалось антитело к hTREM2 или его антигенсвязывающий фрагмент. В другом варианте осуществления способ дополнительно включает выделение антитела из среды или клетки-хозяина. Подходящие эукариотические клетки включают без ограничения клетки Vero, клетки HeLa, клетки COS, клетки CHO, клетки HEK293, клетки BHK и клетки MDCKII. Способы введения векторов экспрессии, содержащих полинуклеотидные последовательности, представляющие интерес, варьируются в зависимости от типа клетки-хозяина. Например, трансфекцию с использованием хлорида кальция обычно используют для прокариотических клеток, тогда как обработку фосфатом кальция или электропорацию можно применять для других клеток-хозяев. (См., в целом, Sambrook, et al., выше). Другие способы включают, например, электропорацию, обработку фосфатом кальция, трансформацию, опосредованную липосомами, инъекцию и микроинъекцию, баллистические способы, виросомы, иммунолипосомы, конъюгаты поликатион:нуклеиновая кислота, депротеинизированную ДНК, искусственные вирионы, слияние со структурным белком VP22 вируса герпеса (Elliot and O'Hare, Cell 88:223, 1997), усиленное средством поглощение ДНК и трансдукцию ex vivo. Для долговременного получения рекомбинантных белков с высоким выходом зачастую будет необходима стабильная экспрессия. Например, линии клеток, которые стабильно экспрессируют цепи антитела к hTREM2 или антигенсвязывающие фрагменты, можно получить с применением векторов экспрессии по настоящему изобретению, которые содержат вирусные точки начала репликации или эндогенные экспрессионные элементы и селектируемый маркерный ген. После введения вектора клеткам можно предоставлять возможность роста в течение 1-2 дней в обогащенной среде перед их переносом в селективную среду. Задачей селектируемого маркера является придание устойчивости к факторам отбора, и его присутствие обеспечивает возможность роста клеток, которые успешно экспрессируют введенные последовательности, в селективной среде. Пролиферацию устойчивых стабильно трансфицированных клеток можно обеспечивать с применением методик культивирования тканей, соответствующих типу клеток.
Регуляторная последовательность
[00237] Специалист в данной области техники может понять, что для экспрессии одного или нескольких компонентов вектора в клетке-мишени может потребоваться регуляторная последовательность.
[00238] В одном варианте осуществления векторная плазмида на основе AAV содержит регуляторную последовательность, эффективную для экспрессии антитела к hTREM2 или его антигенсвязывающего фрагмента, например как описано в данном документе.
[00239] В одном варианте осуществления векторная плазмида на основе AAV содержит регуляторную последовательность, эффективную для управления экспрессией в клетке-мишени.
[00240] В одном варианте осуществления векторная плазмида на основе AAV содержит регуляторную последовательность, такую как без ограничения промоторы. В качестве неограничивающего примера промотор может представлять собой (1) промотор CMV, (2) промотор CBA, (3) промотор FRDA или FXN, (4) промотор UBC, (5) промотор GUSB, (6) промотор NSE, (7) промотор синапсина, (8) промотор MeCP2, (9) промотор GFAP, (10) промотор HI, (11) промотор U6, (12) промотор NFL, (13) промотор NFH, (14) промотор SCN8A или (15) промотор PGK.
Промоторы
[00241] Специалист в данной области техники может понять, что для экспрессии антитела к hTREM2 или его антигенсвязывающего фрагмента, например как описано в данном документе, в клетке-мишени может потребоваться специфический промотор, включая без ограничения промотор, который является видоспецифичным, индуцируемым, тканеспецифичным или специфичным в отношении клеточного цикла (Parr et al., Nat. Med. 3: 1145-9 (1997); содержание которго включено в данный документ посредством ссылки во всей своей полноте).
[00242] В одном варианте осуществления векторная плазмида на основе AAV содержит промотор, эффективный для экспрессии антитела к hTREM2 или его антигенсвязывающего фрагмента, например как описано в данном документе.
[00243] В одном варианте осуществления векторная плазмида на основе AAV содержит промотор, эффективный для управления экспрессией в клетке-мишени.
[00244] В одном варианте осуществления промотор обеспечивает экспрессию антитела к hTREM2 или его антигенсвязывающего фрагмента, например как описано в данном документе, в течение определенного периода времени в тканях-мишенях, таких как без ограничения ткани нервной системы. Экспрессия антитела к hTREM2 или его антигенсвязывающего фрагмента, например как описано в данном документе, может продолжаться в течение 1 часа, 2, часов, 3 часов, 4 часов, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 13 часов, 14 часов, 15 часов, 16 часов, 17 часов, 18 часов, 19 часов, 20 часов, 21 часа, 22 часов, 23 часов, 1 дня, 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 1 недели, 8 дней, 9 дней, 10 дней, 11 дней, 12 дней, 13 дней, 2 недель, 15 дней, 16 дней, 17 дней, 18 дней, 19 дней, 20 дней, 3 недель, 22 дней, 23 дней, 24 дней, 25 дней, 26 дней, 27 дней, 28 дней, 29 дней, 30 дней, 31 дня, 1 месяца, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 1 года, 13 месяцев, 14 месяцев, 15 месяцев, 16 месяцев, 17 месяцев, 18 месяцев, 19 месяцев, 20 месяцев, 21 месяца, 22 месяцев, 23 месяцев, 2 лет, 3 лет, 4 лет, 5 лет, 6 лет, 7 лет, 8 лет, 9 лет, 10 лет, 11 лет, 12 лет, 13 лет, 14 лет, 15 лет, 16 лет, 17 лет, 18 лет, 19 лет, 20 лет, 21 года, 22 лет, 23 лет, 24 лет, 25 лет, 26 лет, 27 лет, 28 лет, 29 лет, 30 лет, 31 года, 32 лет, 33 лет, 34 лет, 35 лет, 36 лет, 37 лет, 38 лет, 39 лет, 40 лет, 41 года, 42 лет, 43 лет, 44 лет, 45 лет, 46 лет, 47 лет, 48 лет, 49 лет, 50 лет, 55 лет, 60 лет, 65 лет или более 65 лет. Экспрессия антитела к hTREM2 или его антигенсвязывающего фрагмента, например как описано в данном документе, может продолжаться в течение 1-5 часов, 1-12 часов, 1-2 дней, 1-5 дней, 1-2 недель, 1-3 недель, 1-4 недель, 1-2 месяцев, 1-4 месяцев, 1-6 месяцев, 2-6 месяцев, 3-6 месяцев, 3-9 месяцев, 4-8 месяцев, 6-12 месяцев, 1-2 лет, 1-5 лет, 2-5 лет, 3-6 лет, 3-8 лет, 4-8 лет, или 5-10 лет, или 10-15 лет, или 15-20 лет, или 20-25 лет, или 25-30 лет, или 30-35 лет, или 35-40 лет, или 40-45 лет, или 45-50 лет, или 50-55 лет, или 55-60 лет, или 60-65 лет.
[00245] В одном варианте осуществления векторная плазмида на основе AAV содержит область, расположенную приблизительно на 5 т.о. выше в 3'-5' направлении от первого экзона кодируемого антитела к hTREM2 или его антигенсвязывающего фрагмента, например как описано в данном документе; более конкретно, существует область длиной 17 п.о., расположенная приблизительно на 4,9 т.о. выше в 3'-5' направлении от первого экзона кодируемого гена фратаксина, чтобы обеспечить экспрессию с промотором FRDA (см., например, Puspasari et al. Long Range Regulation of Human FXN Gene Expression, PLOS ONE, 2011; содержание которой включено в данный документ посредством ссылки во всей своей полноте).
[00246] В одном варианте осуществления длина промотора составляет менее 1 т.о. Промотор может иметь длину 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800 или более 800 нуклеотидов. Промотор может иметь длину 200-300, 200- 400, 200-500, 200-600, 200-700, 200-800, 300-400, 300-500, 300-600, 300-700, 300-800, 400- 500, 400-600, 400-700, 400-800, 500-600, 500-700, 500-800, 600-700, 600-800 или 700-800. нуклеотидов.
[00247] В одном варианте осуществления промотор может представлять собой комбинацию двух или более компонентов, областей или последовательностей одного и того же или разных промоторов, таких как без ограничения CMV и CBA. Каждый компонент может иметь длину 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800 или более 800 нуклеотидов. Каждый компонент может иметь длину 200-300, 200-400, 200-500, 200-600, 200-700, 200-800, 300-400, 300-500, 300-600, 300-700, 300-800, 400-500, 400-600, 400-700, 400-800, 500-600, 500-700, 500-800, 600-700, 600-800 или 700-800. нуклеотидов.
[00248] В одном варианте осуществления промотор представляет собой комбинацию последовательности CMV-энхансера, например последовательности немедленно/раннего энхансера CMV (например, 382-нуклеотидной последовательности CMV-энхансера) и последовательности промотора куриного бета-актина (CBA) (например, 260-нуклеотидной последовательности промотора CBA).
[00249] В одном варианте осуществления промотор представляет собой комбинацию 280-нуклеотидного фрагмента последовательности CMV-энхансера и 266-нуклеотидного фрагмента последовательности промотора куриного бета-актина (CBA). В некоторых вариантах осуществления последовательность энхансера CMV содержит, например состоит из:
cgttacat aacttacggt aaatggcccg cctggctgac cgcccaacga cccccgccca ttgacgtcaa taatgacgta tgttcccata gtaacgccaa tagggacttt ccattgacgt caatgggtgg agtatttacg gtaaactgcc cacttggcag tacatcaagt gtatcatatg ccaagtacgc cccctattga cgtcaatgac ggtaaatggc ccgcctggca ttatgcccag tacatgacct tatgggactt tcctacttgg cagtacatct ac
(SEQ ID NO: 134).
[00250] В некоторых вариантах осуществления последовательность промотора CBA содержит, например состоит из:
cc acgttctgct tcactctccc catctccccc ccctccccac ccccaatttt gtatttattt attttttaat tattttgtgc agcgatgggg gcgggggggg ggggggggcg cgcgccaggc ggggcggggc ggggcgaggg gcggggcggg gcgaggcgga gaggtgcggc ggcagccaat cagagcggcg cgctccgaaa gtttcctttt atggcgaggc ggcggcggcg gcggccctat aaaaagcgaa gcgcgcggcg ggcg
(SEQ ID NO: 135)
[00251] В одном варианте осуществления вектор на основе AAV содержит гибрид энхансера CMV/промотора куриного бета-актина, содержащий последовательность, например состоящий из, последовательности:
cgttacat aacttacggt aaatggcccg cctggctgac cgcccaacga cccccgccca ttgacgtcaa taatgacgta tgttcccata gtaacgccaa tagggacttt ccattgacgt caatgggtgg agtatttacg gtaaactgcc cacttggcag tacatcaagt gtatcatatg ccaagtacgc cccctattga cgtcaatgac ggtaaatggc ccgcctggca ttatgcccag tacatgacct tatgggactt tcctacttgg cagtacatct actcgaggcc acgttctgct tcactctccc catctccccc ccctccccac ccccaatttt gtatttattt attttttaat tattttgtgc agcgatgggg gcgggggggg ggggggggcg cgcgccaggc ggggcggggc ggggcgaggg gcggggcggg gcgaggcgga gaggtgcggc ggcagccaat cagagcggcg cgctccgaaa gtttcctttt atggcgaggc ggcggcggcg gcggccctat aaaaagcgaa gcgcgcggcg ggcg
(SEQ ID NO: 136)
[00252] В одном варианте осуществления векторная плазмида на основе AAV содержит универсальный промотор. Неограничивающие примеры универсальных промоторов включают CMV, CBA (включая производные CAG, CBh и т.д.), EF-1a, PGK, UBC, GUSB (hGBp) и UCOE (промотор HNRPA2B1-CBX3). В одном варианте осуществления в настоящем изобретении можно использовать любой из промоторов, предложенных Yu, Soderblom, Gill, Husain, Passini, Xu, Drews или Raymond. Yu et al. (Molecular Pain 2011, 7:63; содержание которого включено в данный документ посредством ссылки во всей своей полноте) оценили экспрессию eGFP под контролем промоторов CAG, EF-1a, PGK и UBC в клетках DRG крыс и первичных клетках DRG с использованием лентивирусных векторов и обнаружили, что UBC показывает более слабую экспрессию, чем другие 3 промотора, и что для всех промоторов наблюдается только 10-12% экспрессия глии.
[00253] Soderblom et al. (E. Neuro 2015; содержание которого включено в данный документ посредством ссылки во всей своей полноте) оценили экспрессию eGFP в AAV8 с промоторами CMV и UBC и AAV2 с промотором CMV после инъекции в моторную кору. Интраназальное введение плазмиды, содержащей промотор UBC или EF-1a, показало устойчивую экспрессию в дыхательных путях, превышающую экспрессию с промотором CMV (см., например, Gill et al., Gene Therapy 2001, Vol. 8, 1539-1546; содержание которого включено в данный документ посредством ссылки во всей своей полноте). Husain et al. (Gene Therapy 2009; содержание которой включено в данный документ посредством ссылки во всей своей полноте) оценили конструкцию HβH с промотором hGUSB, промотором HSV-1LAT и промотором NSE и обнаружили, что конструкция HβH показала более слабую экспрессию, чем NSE, в головном мозге мышей. Passini и Wolfe (J. Virol. 2001, 12382-12392, содержание которого включено в данный документ посредством ссылки во всей своей полноте) оценили долгосрочные эффекты вектора HβH после внутрижелудочковой инъекции новорожденным мышам и обнаружили, что экспрессия сохраняется в течение по меньшей мере 1 года. Низкий уровень экспрессии во всех областях головного мозга был обнаружен Xu et al. (Gene Therapy 2001, 8, 1323-1332; содержание которого включено в данный документ посредством ссылки во всей своей полноте), когда использовались промоторы NF-L и NF-H, при сравнении с CMV-lacZ, CMV-luc, EF, GFAP, hENK, nAChR, PPE, PPE+wpre, NSE (0,3 т.о.), NSE (1,8 т.о.) и NSE (1,8 т.о. + wpre). Xu et al. обнаружили, что активность промотора в порядке убывания была следующей: NSE (1,8 т.о.), EF, NSE (0,3 т.о.), GFAP, CMV, hENK, PPE, NFL и NFH. NFL представляет собой промотор длиной 650 нуклеотидов, а NFH представляет собой промотор длиной 920 нуклеотидов, которые оба отсутствуют в печени, но NFH в большом количестве присутствует в сенсорных проприоцептивных нейронах, головном и спинном мозге, и NFH присутствует в сердце. SCN8A представляет собой промотор длиной 470 нуклеотидов, который экспрессируется в DRG, спинном и головном мозге с особенно высоким уровнем экспрессии, наблюдаемым в нейронах гиппокампа и клетках Пуркинье мозжечка, коре, таламусе и гипоталамусе (см., например, Drews et al. Identification of evolutionary conserved, functional noncoding elements in the promoter region of the sodium channel gene SCN8A, Mamm Genome (2007) 18:723-731; и Raymond et al., Expression of Alternatively Spliced Sodium Channel a-subunit genes, Journal of Biological Chemistry (2004) 279(44) 46234-4624; содержание каждого из которых включено в данный документ посредством ссылки во всей своей полноте).
[00254] В одном варианте осуществления векторная плазмида на основе AAV содержит промотор, который не является клеточно-специфичным. В одном варианте осуществления промотор представляет собой слабый промотор (классифицированный в соответствии с его аффинностью и аффинностью других промоторов к РНК-полимеразе и/или сигма-фактору) для устойчивой экспрессии антитела к hTREM2 или его антигенсвязывающего фрагмента, например как описано в данном документе, в нервных тканях. В одном варианте осуществления промотор представляет собой слабый промотор для устойчивой экспрессии фратаксина в ткани нервной системы, такой как без ограничения нервная ткань и глиальная ткань.
[00255] В одном варианте осуществления векторная плазмида на основе AAV содержит промотор, полученный из организма с атаксией Фридрейха (FRDA).
[00256] В одном варианте осуществления векторная плазмида на основе AAV содержит промотор убиквитина С (UBC). Промотор UBC может иметь размер 300-350 нуклеотидов. В качестве неограничивающего примера промотор UBC имеет длину 332 нуклеотида.
[00257] В одном варианте осуществления векторная плазмида на основе AAV содержит промотор β-глюкуронидазы (GUSB). Промотор GUSB может иметь размер 350-400 нуклеотидов. В качестве неограничивающего примера промотор GUSB имеет длину 378 нуклеотидов. В качестве неограничивающего примера векторная плазмида на основе AAV может представлять собой 5'-промотор-CMV/глобиновый интрон-hFXN-RBG-3', где векторная плазмида на основе AAV может быть самокомплементарной, а капсид может принадлежать к серотипу DJ.
[00258] В одном варианте осуществления векторная плазмида на основе AAV содержит промотор белков нейрофиламентов (NFL). Промотор NFL может иметь размер 600-700 нуклеотидов. В качестве неограничивающего примера промотор NFL имеет длину 650 нуклеотидов. В качестве неограничивающего примера векторная плазмида на основе AAV может представлять собой 5'-промотор-CMV/глобиновый интрон-hFXN-RBG-3', где векторная плазмида на основе AAV может быть самокомплементарной, а капсид может принадлежать к серотипу DJ.
[00259] В одном варианте осуществления векторная плазмида на основе AAV содержит промотор тяжелых белков нейрофиламентов (NFL). Промотор NFH может иметь размер 900-950 нуклеотидов. В качестве неограничивающего примера промотор NFH имеет длину 920 нуклеотидов. В качестве неограничивающего примера векторная плазмида на основе AAV может представлять собой 5'-промотор-CMV/глобиновый интрон-hFXN-RBG-3', где векторная плазмида на основе AAV может быть самокомплементарной, а капсид может принадлежать к серотипу DJ.
[00260] В одном варианте осуществления векторная плазмида на основе AAV содержит промотор SCN8A. Промотор SCN8A может иметь размер 450-500 нуклеотидов. В качестве неограничивающего примера промотор SCN8A имеет длину 470 нуклеотидов. В качестве неограничивающего примера векторная плазмида на основе AAV может представлять собой 5'-промотор-CMV/глобиновый интрон-hFXN-RBG-3', где векторная плазмида на основе AAV может быть самокомплементарной, а капсид может принадлежать к серотипу DJ.
[00261] В одном варианте осуществления векторная плазмида на основе AAV содержит промотор фратаксина (FXN).
[00262] В одном варианте осуществления векторная плазмида на основе AAV содержит промотор фосфоглицераткиназы 1 (PGK).
[00263] В одном варианте осуществления векторная плазмида на основе AAV содержит промотор куриного β-актина (CBA).
[00264] В одном варианте осуществления векторная плазмида на основе AAV содержит немедленно-ранний промотор цитомегаловируса (CMV).
[00265] В одном варианте осуществления векторная плазмида на основе AAV содержит промотор H1.
[00266] В одном варианте осуществления векторная плазмида на основе AAV содержит промотор U6.
[00267] В одном варианте осуществления векторная плазмида на основе AAV содержит промотор, активный в печени или скелетных мышцах. Неограничивающие примеры промоторов, активных в печени, включают hAAT и TBG. Неограничивающие примеры промоторов, активных в скелетных мышцах, включают Desmin, MCK и C5-12.
[00268] В одном варианте осуществления векторная плазмида на основе AAV содержит сконструированный промотор, например промотор, полученный из промотора, описанного в данном документе, но не идентичный ему.
Энхансерный элемент
[00269] В одном варианте осуществления векторная плазмида на основе AAV может содержать по меньшей мере один энхансерный и/или экспрессионный элемент. Энхансерный или экспрессионный элемент можно использовать в комбинации с регуляторной последовательностью (например, промотором). В одном варианте осуществления векторная плазмида на основе AAV содержит трансгенный энхансер, промотор и/или 5'UTR-интрон. Трансгенный энхансер, также называемый в данном документе "энхансером", может представлять собой без ограничения энхансер CMV (или его фрагмент, например как описано в данном документе). Промотор может представлять собой без ограничения промотор CMV, CBA, UBC, GUSB, NSE, Synapsin, MeCP2 и GFAP. 5'UTR/интрон может представлять собой без ограничения, SV40 и CBA-MVM.
[00270] В одном варианте осуществления вектор на основе AAV содержит интрон, необязательно расположенный между промоторным элементом и полинуклеотидом, кодирующим антитело к hTREM2 или его антигенсвязывающий фрагмент (например, как описано в данном документе). Не ограничиваясь какой-либо теорией, было показано, что включение 5'-интрона повышает уровень и равновесное состояние mRNA, кодирующей антитело к hTREM2 или его антигенсвязывающий фрагмент (например, как описано в данном документе). В вариантах осуществления энхансер представляет собой 5'-интрон, полученный из SV40. В одном варианте осуществления интрон SV40 включает, например состоит из последовательности:
gtaagtt tagtcttttt gtcttttatt tcaggtcccg gatccggtgg tggtgcaaat caaagaactg ctcctcagtg gatgttgcct ttacttctag
(SEQ ID NO: 137).
[00271] В одном варианте осуществления векторная плазмида на основе AAV (например, вектора на основе AAV) содержит комбинацию энхансера, промотора и/или интрона, такую как без ограничения (1) энхансер CMV, промотор CMV, 5'UTR-интрон SV40 (например, как описано в данном документе); (2) энхансер CMV, промотор CBA, 5'UTR-интрон SV40 (например, как описано в данном документе); (3) энхансер CMV, промотор CBA, 5'UTR-интрон CBA-MVM (например, как описано в данном документе).
Усиление экспрессии трансгена
[00272] В одном варианте осуществления векторная плазмида на основе AAV содержит по меньшей мере один трансгенный энхансерный элемент, который может усилить специфичность и экспрессию трансгена-мишени (см., например, Powell et al. Viral Expression Cassette Elements to Enhance Transgene Target Specificity and Expression in Gene Therapy, 2015; содержание которого включено в данный документ посредством ссылки во всей своей полноте). Неограничивающие примеры трансгенных энхансерных элементов для усиления специфичности и экспрессии трансгена-мишени включают промоторы, эндогенные miRNA, посттранскрипционные регуляторные элементы (PRE), сигнальные последовательности полиаденилирования (Poly A) и энхансеры в направлении 3'-5' (USE), энхансеры CMV и интроны.
[00273] В одном варианте осуществления векторная плазмида на основе AAV содержит по меньшей мере один трансгенный энхансерный элемент, который представляет собой энхансер CMV. В одном варианте осуществления векторная плазмида на основе AAV содержит по меньшей мере один трансгенный энхансерный элемент, который представляет собой промотор.
[00274] В одном варианте осуществления векторная плазмида на основе AAV содержит по меньшей мере один трансгенный энхансерный элемент, который представляет собой интрон.
[00275] В одном варианте осуществления векторная плазмида на основе AAV содержит по меньшей мере один трансгенный энхансерный элемент, который представляет собой эндогенные miRNA.
[00276] В одном варианте осуществления векторная плазмида на основе AAV содержит по меньшей мере один трансгенный энхансерный элемент, который представляет собой посттранскрипционные регуляторные элементы (PRE).
[00277] В одном варианте осуществления векторная плазмида на основе AAV содержит по меньшей мере один трансгенный энхансерный элемент, который представляет собой сигнальные последовательности полиаденилирования (Poly A). В вариантах осуществления векторная плазмида на основе AAV вектора на основе AAV содержит сигнал поли-А гормона роста. В одном варианте осуществления сигнал поли-А гормона роста получен из сигнала поли-А бычьего гормона роста (BGH). Пример сигнальной последовательности поли-A BGH:
ctagagct cgctgatcag cctcgactgt gccttctagt tgccagccat ctgttgtttg cccctccccc gtgccttcct tgaccctgga aggtgccact cccactgtcc tttcctaata aaatgaggaa attgcatcgc attgtctgag taggtgtcat tctattctgg ggggtggggt ggggcaggac agcaaggggg aggattggga agacaatagc aggcatgctg ggga
(SEQ ID NO: 138)
[00278] В вариантах осуществления векторная плазмида на основе AAV содержит сигнал поли-A (например, сигнал поли-A BGH) ниже (например, в нправлении 3') полинуклеотида, кодирующего антитело к hTREM2 или его антигенсвязывающий фрагмент, например как описано в данном документе.
[00279] В одном варианте осуществления векторная плазмида на основе AAV содержит по меньшей мере один трансгенный энхансерный элемент, который представляет собой энхансеры в направлении 3'-5' (USE).
Тканеспецифичная экспрессия
[00280] В одном варианте осуществления геном вектора может содержать тканеспецифичный экспрессионный элемент для стимуляции экспрессии антитела к hTREM2 или его антигенсвязывающего фрагмента, например как описано в данном документе, в тканях и/или клетках. В качестве неограничивающего примера промоторы, которые могут быть тканеспецифичными экспрессионными элементами, включают без ограничения промотор 1a-субъединицы человеческого фактора элонгации (EF-1a), немедленно-ранний промотор цитомегаловируса (CMV), промотор куриного β-актина (CBA) и его производное CAG, промотор β-глюкуронидазы (GUSB) и убиквитина C (UBC).
[00281] В одном варианте осуществления геном вектора может содержать тканеспецифичные экспрессионные элементы, которые можно использовать для ограничения экспрессии в определенных типах клеток, такие как без ограничения промоторы, активные в нервной системе, которые можно использовать для ограничения экспрессии в нейронах, астроцитах или олигодендроцитах.
[00282] В одном варианте осуществления геном вектора может содержать тканеспецифичные экспрессионные элементы для нейронов, такие как без ограничения промоторы нейрон-специфической энолазы (NSE), тромбоцитарного фактора роста (PDGF), B-цепи тромбоцитарного фактора роста (PDGF-β), синапсина (Syn), метил-CpG-связывающего белка 2 (MeCP2), Ca<2+>/кальмодулин-зависимой протеинкиназы II (CaMKII), метаботропного рецептора глутамата 2 (mGluR2), NFL, NFH, ηβ2, PPE, Enk и EAAT2.
[00283] В одном варианте осуществления геном вектора может содержать тканеспецифичные экспрессионные элементы для астроцитов, такие как без ограничения промоторы глиального фибриллярного кислого белка (GFAP) и EAAT2.
[00284] В одном варианте осуществления геном вектора может содержать тканеспецифичные экспрессионные элементы для олигодендроцитов, такие как без ограничения промотор основного белка миелина (MBP).
Интроны
[00285] В одном варианте осуществления векторная плазмида на основе AAV содержит по меньшей мере один элемент для усиления экспрессии трансгена, такой как один или несколько интронов или их частей.
[00286] В одном варианте осуществления конструкция полезной нагрузки содержит по меньшей мере один элемент для усиления экспрессии трансгена, такой как один или несколько интронов или их частей.
[00287] Неограничивающие примеры интронов включают MVM (67-97 п.о.), усеченный интрон 1 FIX (300 п.о.), β-глобин SD/акцептор сплайсинга тяжелой цепи иммуноглобулина (250 п.о.), донор сплайсинга аденовируса/акцептор сплайсинга иммуноглобина (500 п.о.), донор сплайсинга позднего SV40/акцептор сплайсинга (19S/16S) (180 п.о.) и донор сплайсинга гибридного аденовируса/акцептор сплайсинга IgG (230 п.о.).
[00288] В одном варианте осуществления интрон или часть интрона могут иметь длину 100-500 нуклеотидов. Интрон может иметь длину 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490 или 500 нуклеотидов. Интрон может иметь длину 80-100, 80-120, 80-140, 80-160, 80-180, 80-200, 80- 250, 80-300, 80-350, 80-400, 80-450, 80-500, 200-300, 200-400, 200-500, 300-400, 300-500, или 400-500. нуклеотидов.
[00289] В одном варианте осуществления вектор на основе AAV содержит интрон, необязательно расположенный между промоторным элементом и полинуклеотидом, кодирующим антитело к hTREM2 или его антигенсвязывающий фрагмент (например, как описано в данном документе). Не ограничиваясь какой-либо теорией, было показано, что включение 5'-интрона повышает уровень и равновесное состояние mRNA, кодирующей антитело к hTREM2 или его антигенсвязывающий фрагмент (например, как описано в данном документе). В вариантах осуществления энхансер представляет собой 5'-интрон, полученный из SV40. В одном варианте осуществления интрон SV40 включает, например состоит из последовательности:
gtaagtt tagtcttttt gtcttttatt tcaggtcccg gatccggtgg tggtgcaaat caaagaactg ctcctcagtg gatgttgcct ttacttctag
(SEQ ID NO: 137)
[00290] В одном варианте осуществления векторная плазмида на основе AAV вектора основе AAV содержит (1) энхансер CMV (например, SEQ ID NO: 134), (2) промотор CBA (например, SEQ ID NO: 135), (3) интрон SV40 (например, SEQ ID NO: 137), (4) полинуклеотид, кодирующий антитело к hTREM2 или его антигенсвязывающий фрагмент (например, как описано в данном документе), и (5) сигнал поли-A BGH (например, SEQ ID NO: 138). В одном варианте осуществления элементы (1)-(5) расположены в векторной плазмиде на основе AAV в направлении от 5' до 3'. В вариантах осуществления элементы (1)-(5) расположены в векторной плазмиде на основе AAV, которая дополнительно содержит ITR (например, 5'-ITR и 3'-ITR). В вариантах осуществления ITR получены из ITR AAV2.
[00291] В одном варианте осуществления векторная плазмида на основе AAV представляет собой самокомплементарную векторную плазмиду на основе AAV. "Самокомплементарный" или аббревиатура "sc" относится к самокомплементарному. "Самокомплементарный AAV" или "scAAV" относится к конструкции, в которой кодирующая область, которую несет рекомбинантная последовательность нуклеиновой кислоты AAV, была сконструирована для образования внутримолекулярной двухнитевой ДНК-матрицы. Не ограничиваясь какой-либо теорией, после инфицирования, вместо того, чтобы ждать клеточно-опосредованного синтеза второй нити, две комплементарные половины scAAV будут ассоциировать с образованием одной единицы двухнитевой ДНК (dsDNA), готовой к немедленной репликации и транскрипции. См., например, D M McCarty et al, "Self-complementary recombinant adeno-associated virus (scAAV) vectors promote efficient transduction independently of DNA synthesis", Gene Therapy, (August 2001), Vol 8, Number 16, Pages 1248-1254 (которое включено в данный документ посредством ссылки во всей своей полноте). Самокомплементарные AAV описаны, например, в патентах США №№6596535; 7125717 и 7456683, каждый из которых включен в данный документ посредством ссылки во всей своей полноте. Например, 5'-ITR может быть подвергнут мутации, например путем удаления сайта концевого разрешения, чтобы обеспечить формирование шпилечной структуры генома.
Капсиды и серотипы капсидов
[00292] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут быть упакованы в капсидную структуру или могут быть без капсида. Такие донорные и/или акцепторные последовательности вирусного вектора, такого как AAV, без капсида описаны, например, в публикации США 2014/0107186, содержание которой включено в данный документ посредством ссылки во всей своей полноте.
[00293] В некоторых вариантах осуществления частицы AAV, полученные в соответствии с настоящим изобретением, могут включать гибридные серотипы с усиленной трансдукцией в отношении конкретных типов клеток, представляющих интерес, в центральной нервной системе, длительной экспрессией трансгена и/или профилем безопасности. Гибридные серотипы могут быть получены путем транскапсидирования, адсорбции биспецифического антитела на поверхности капсида, мозаичного капсида и химерного капсида и/или других модификаций белка капсида.
[00294] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут быть дополнительно модифицированы для конкретного терапевтического применения путем рационального мутагенеза белков капсида (см., например, Pulicherla et al, Mol Ther, 201 1, 19: 1070-1078), включения в капсид пептидных лигандов, например пептида, полученного из агониста рецептора NMDA, для усиленного ретроградного транспорта (Xu et al., Virology, 2005, 341: 203-214), и направленной эволюции, чтобы получить новые варианты AAV, например для усиления трансдукции в отношении ЦНС.
[00295] В некоторых вариантах осуществления частицы AAV, полученные в соответствии с настоящим изобретением, могут содержать различные капсидные белки, встречающиеся в природе и/или рекомбинантные, включая без ограничения серотипы капсида AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV 8, AAV9, AAV 10, AAV11, AAV 12, AAVrh8, AAVrh10, AAV-DJ и AAV-DJ/8 или их варианты (например, AAV3A и AAV3B). Последовательности нуклеиновых кислот, кодирующие один или несколько капсидных белков AAV, применимые в настоящем изобретении, раскрыты в международной публикации № WO 2015191508, содержание которой включено в данный документ посредством ссылки во всей своей полноте.
[00296] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать любой природный или рекомбинантный серотип AAV или происходить из него. Согласно настоящему изобретению частицы AAV могут использовать серотип или основываться на серотипе, выбранном из любого из следующих: AAV1, AAV2, AAV2G9, AAV3, AAV3a, AAV3b, AAV3-3, AAV4, AAV4-4, AAV5, AAV6, AAV6.1, AAV6.2, AAV6.1.2, AAV7, AAV7.2, AAV8, AAV9, AAV9.11, AAV9.13, AAV9.16, AAV9.24, AAV9.45, AAV9.47, AAV9.61, AAV9.68, AAV9.84, AAV9.9, AAV10, AAV11, AAV 12, AAV16.3, AAV24.1, AAV27.3, AAV42.12, AAV42-1b, AAV42-2, AAV42-3a, AAV42-3b, AAV42-4, AAV42-5a, AAV42-5b, AAV42-6b, AAV42-8, AAV42-10, AAV42-11, AAV42-12, AAV42-13, AAV42-15, AAV42-aa, AAV43-1, AAV43-12, AAV43-20, AAV43-21, AAV43-23, AAV43-25, AAV43-5, AAV44.1, AAV44.2, AAV44.5, AAV223.1, AAV223.2, AAV223.4, AAV223.5, AAV223.6, AAV223.7, AAVl-7/rh.48, AAVl-8/rh.49, AAV2-15/rh.62, AAV2-3/rh.61, AAV2-4/rh.50, AAV2-5/rh.51, AAV3.1/hu.6, AAV3.1/hu.9, AAV3-9/rh.52, AAV3-1 1/rh.53, AAV4-8/r 11.64, AAV4-9/rh.54, AAV4-19/rh.55, AAV5-3/rh.57, AAV5-22/rh.58, AAV7.3/hu.7, AAV16.8/hu.10, AAV16.12/hu.11, AAV29.3/bb.1, AAV29.5/bb.2, AAV106.1/hu.37, AAV114.3/hu.40, AAV127.2/hu.41, AAV127.5/hu.42, AAV128.3/hu.44, AAV130.4/hu.48, AAV145.1/hu.53, AAV145.5/hu.54, AAV145.6/hu.55, AAV161.10/hu.60, AAV161.6/hu.61, AAV33.12/hu.17, AAV33.4/hu.15, AAV33.8/hu.16, AAV52/hu.19, AAV52.1/hu.20, AAV58.2/hu.25, AAV A3.3, AAV A3.4, AAV A3.5, AAV A3.7, AAVC1, AAVC2, AAVC5, AAV-DJ, AAV-DJ8, AAVF3, AAVF5, AAVH2, AAVrh.72, AAVhu.8, AAVrh.68, AAVrh.70, AAVpi.1, AAVpi.3, AAVpi.2, AAVrh.60, AAVrh.44, AAVrh.65, AAVrh.55, AAVrh.47, AAVrh.69, AAVrh.45, AAVrh.59, AAVhu.12, AAVH6, AAVLK03, AAVH-1/hu.1, AAVH-5/hu.3, AAVLG-10/rh.40, AAVLG-4/rh.38, AAVLG-9/hu.39, AAVN721-8/rh.43, AAVCh.5, AAVCh.5Rl, AAVcy.2, AAVcy.3, AAVcy.4, AAVcy.5, AAVCy.5Rl, AAVCy.5R2, AAVCy.5R3, AAVCy.5R4, AAVcy.6, AAVhu.1, AAVhu.2, AAVhu.3, AAVhu.4, AAVhu.5, AAVhu.6, AAVhu.7, AAVhu.9, AAVhu.10, AAVhu.11, AAVhu.13, AAVhu.15, AAVhu.16, AAVhu.17, AAVhu.18, AAVhu.20, AAVhu.21, AAVhu.22, AAVhu.23.2, AAVhu.24, AAVhu.25, AAVhu.27, AAVhu.28, AAVhu.29, AAVhu.29R, AAVhu.31, AAVhu.32, AAVhu.34, AAVhu.35, AAVhu.37, AAVhu.39, AAVhu.40, AAVhu.41, AAVhu.42, AAVhu.43, AAVhu.44, AAVhu.44Rl, AAVhu.44R2, AAVhu.44R3, AAVhu.45, AAVhu.46, AAVhu.47, AAVhu.48, AAVhu.48Rl, AAVhu.48R2, AAVhu.48R3, AAVhu.49, AAVhu.51, AAVhu.52, AAVhu.54, AAVhu.55, AAVhu.56, AAVhu.57, AAVhu.58, AAVhu.60, AAVhu.61, AAVhu.63, AAVhu.64, AAVhu.66, AAVhu.67, AAVhu.14/9, AAVhu.t 19, AAVrh.2, AAVrh.2R, AAVrh.8, AAVrh.8R, AAVrh.10, AAVrh.12, AAVrh.13, AAVrh.13R, AAVrh.14, AAVrh.17, AAVrh.18, AAVrh.19, AAVrh.20, AAVrh.21, AAVrh.22, AAVrh.23, AAVrh.24, AAVrh.25, AAVrh.31, AAVrh.32, AAVrh.33, AAVrh.34, AAVrh.35, AAVrh.36, AAVrh.37, AAVrh.37R2, AAVrh.38, AAVrh.39, AAVrh.40, AAVrh.46, AAVrh.48, AAVrh.48.1, AAVrh.48.1.2, AAVrh.48.2, AAVrh.49, AAVrh.51, AAVrh.52, AAVrh.53, AAVrh.54, AAVrh.56, AAVrh.57, AAVrh.58, AAVrh.61, AAVrh.64, AAVrh.64Rl, AAVrh.64R2, AAVrh.67, AAVrh.73, AAVrh.74, AAVrh8R, мутант AAVrh8R A586R, мутант AAVrh8R R533A, AAAV, BAAV, козий AAV, бычий AAV, AAVhE1.1, AAVhEr1.5, AAVhER1.14, AAVhEr1.8, AAVhEr1.16, AAVhEr1.18, AAVhEr1.35, AAVhEr1.7, AAVhEr1.36, AAVhEr2.29, AAVhEr2.4, AAVhEr2.16, AAVhEr2.30, AAVhEr2.31, AAVhEr2.36, AAVhER1.23, AAVhEr3.1, AAV2.5T , AAV-PAEC, AAV-LK01, AAV-LK02, AAV-LK03, AAV-LK04, AAV-LK05, AAV-LK06, AAV-LK07, AAV-LK08, AAV-LK09, AAV-LK10, AAV-LK11, AAV-LK12, AAV-LK13, AAV-LK14, AAV-LK15, AAV-LK16, AAV-LK17, AAV-LK18, AAV-LK19, AAV-PAEC2, AAV-PAEC4, AAV-PAEC6, AAV-PAEC7, AAV-PAEC8, AAV-PAEC11, AAV-PAEC 12, AAV-2-pre-miRNA-lOl , AAV-8h, AAV-8b, AAV-h, AAV-b, AAV SM 10-2 , AAV Shuffle 100-1 , AAV Shuffle 100-3, AAV Shuffle 100-7, AAV Shuffle 10-2, AAV Shuffle 10-6, AAV Shuffle 10-8, AAV Shuffle 100-2, AAV SM 10-1, AAV SM 10-8 , AAV SM 100-3, AAV SM 100-10, BNP61 AAV, BNP62 AAV, BNP63 AAV, AAVrh.50, AAVrh.43, AAVrh.62, AAVrh.48, AAVhu.19, AAVhu. l, AAVhu.53, AAV4-8/rh.64, AAVLG-9/hu.39, AAV54.5/hu.23, AAV54.2/hu.22, AAV54.7/hu.24, AAV54.1/hu.21, AAV54.4R/hu.27, AAV46.2/hu.28, AAV46.6/hu.29, AAV128.1/hu.43, AAV подлиннго типа (ttAAV), UPEN AAV 10 и/или японский AAV 10 и их варианты.
[00297] В качестве неограничивающего примера капсид рекомбинантного вируса AAV представляет собой капсид AAV2. В качестве неограничивающего примера капсид рекомбинантного вируса AAV представляет собой капсид AAVrh10. В качестве неограничивающего примера капсид рекомбинантного вируса AAV представляет собой капсид AAV9 (hul4). В качестве неограничивающего примера капсид рекомбинантного вируса AAV представляет собой капсид AAV-DJ. В качестве неограничивающего примера капсид рекомбинантного вируса AAV представляет собой капсид AAV9.47. В качестве неограничивающего примера капсид рекомбинантного вируса AAV представляет собой капсид AAV-DJ8.
[00298] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать серотип или происходить из серотипа AAV, который может быть представлен последовательностью или может предусматривать последовательность, как описано в публикации США № US 20030138772, содержание которой включено в данный документ посредством ссылки во всей своей полноте, например без ограничения AAV1 (SEQ ID NO: 6 и 64 из US 20030138772), AAV2 (SEQ ID NO: 7 и 70 из US 20030138772), AAV3 (SEQ ID NO: 8 и 71 из US 20030138772), AAV4 (SEQ ID NO: 63 из US 20030138772), AAV5 (SEQ ID NO: 114 из US 20030138772), AAV6 (SEQ ID NO: 65 из US 20030138772), AAV7 (SEQ ID NO: 1-3 из US 20030138772), AAV 8 (SEQ ID NO: 4 и 95 из US 20030138772), AAV9 (SEQ ID NO: 5 и 100 из US 20030138772), AAV10 (SEQ ID NO: 117 из US 20030138772), AAV11 (SEQ ID NO: 118 из US 20030138772), AAV 12 (SEQ ID NO: 119 из US 20030138772), AAVrhlO (аминокислоты 1-738 из SEQ ID NO: 81 из US 20030138772), AAV16.3 (US 20030138772 SEQ ID NO: 10), AAV29.3/bb. l (US 20030138772 SEQ ID NO: 11), AAV29.4 (US 20030138772 SEQ ID NO: 12), AAV29.5/bb.2 (US 20030138772 SEQ ID NO: 13), AAV1.3 (US 20030138772 SEQ ID NO: 14), AAV13.3 (US 20030138772 SEQ ID NO: 15), AAV24.1 (US 20030138772 SEQ ID NO: 16), AAV27.3 (US 20030138772 SEQ ID NO: 17), AAV7.2 (US 20030138772 SEQ ID NO: 18), AAVC1 (US 20030138772 SEQ ID NO: 19), AAVC3 (US 20030138772 SEQ ID NO: 20), AAVC5 (US 20030138772 SEQ ID NO: 21), AAVF1 (US 20030138772 SEQ ID NO: 22), AAVF3 (US 20030138772 SEQ ID NO: 23), AAVF5 (US 20030138772 SEQ ID NO: 24), AAVH6 (US 20030138772 SEQ ID NO: 25), AAVH2 (US 20030138772 SEQ ID NO: 26), AAV42-8 (US 20030138772 SEQ ID NO: 27), AAV42-15 (US 20030138772 SEQ ID NO: 28), AAV42-5b (US 20030138772 SEQ ID NO: 29), AAV42-lb (US 20030138772 SEQ ID NO: 30), AAV42-13 (US 20030138772 SEQ ID NO: 31), AAV42-3a (US 20030138772 SEQ ID NO: 32), AAV42-4 (US 20030138772 SEQ ID NO: 33), AAV42-5a (US 20030138772 SEQ ID NO: 34), AAV42-10 (US 20030138772 SEQ ID NO: 35), AAV42-3b (US 20030138772 SEQ ID NO: 36), AAV42-11 (US 20030138772 SEQ ID NO: 37), AAV42-6b (US 20030138772 SEQ ID NO: 38), AAV43-1 (US 20030138772 SEQ ID NO: 39), AAV43-5 (US 20030138772 SEQ ID NO: 40), AAV43-12 (US 20030138772 SEQ ID NO: 41), AAV43-20 (US 20030138772 SEQ ID NO: 42), AAV43-21 (US 20030138772 SEQ ID NO: 43), AAV43-23 (US 20030138772 SEQ ID NO: 44), AAV43-25 (US 20030138772 SEQ ID NO: 45), AAV44.1 (US 20030138772 SEQ ID NO: 46), AAV44.5 (US 20030138772 SEQ ID NO: 47), AAV223.1 (US 20030138772 SEQ ID NO: 48), AAV223.2 (US 20030138772 SEQ ID NO: 49), AAV223.4 (US 20030138772 SEQ ID NO: 50), AAV223.5 (US 20030138772 SEQ ID NO: 51), AAV223.6 (US 20030138772 SEQ ID NO: 52), AAV223.7 (US 20030138772 SEQ ID NO: 53), AAV A3.4 (US 20030138772 SEQ ID NO: 54), AAV A3.5 (US 20030138772 SEQ ID NO: 55), AAV A3.7 (US 20030138772 SEQ ID NO: 56), AAV A3.3 (US 20030138772 SEQ ID NO: 57), AAV42.12 (US 20030138772 SEQ ID NO: 58), AAV44.2 (US 20030138772 SEQ ID NO: 59), AAV42-2 (US 20030138772 SEQ ID NO: 9) или их варианты.
[00299] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать серотип или происходить из серотипа AAV, который может быть представлен последовательностью или может предусматривать последовательность, как описано в публикации США № US 20150159173, содержание которой включено в данный документ посредством ссылки во всей своей полноте, например без ограничения AAV2 (SEQ ID NO: 7 и 23 из US 20150159173), rh20 (SEQ ID NO: 1 из US 20150159173), rh32/33 (SEQ ID NO: 2 из US 20150159173), rh39 (SEQ ID NO: 3, 20 и 36 из US 20150159173), rh46 (SEQ ID NO: 4 и 22 из US 20150159173), rh73 (SEQ ID NO: 5 из US 20150159173), rh74 (SEQ ID NO: 6 из US 20150159173), AAV6.1 (SEQ ID NO: 29 из US 20150159173), rh.8 (SEQ ID NO: 41 из US 20150159173), rh.48.1 (SEQ ID NO: 44 из US 20150159173), hu.44 (SEQ ID NO: 45 из US 20150159173), hu.29 (SEQ ID NO: 42 из US 20150159173), hu.48 (SEQ ID NO: 38 из US 20150159173), rh54 (SEQ ID NO: 49 из US 20150159173), AAV2 (SEQ ID NO: 7 из US 20150159173), cy.5 (SEQ ID NO: 8 и 24 из US 20150159173), rh.10 (SEQ ID NO: 9 и 25 из US 20150159173), rh.13 (SEQ ID NO: 10 и 26 из US 20150159173), AAV1 (SEQ ID NO: 11 и 27 из US 20150159173), AAV3 (SEQ ID NO: 12 и 28 из US 20150159173), AAV6 (SEQ ID NO: 13 и 29 из US 20150159173), AAV7 (SEQ ID NO: 14 и 30 из US 20150159173), AAV 8 (SEQ ID NO: 15 и 31 из US 20150159173), hu.13 (SEQ ID NO: 16 и 32 из US 20150159173), hu.26 (SEQ ID NO: 17 и 33 из US 20150159173), hu.37 (SEQ ID NO: 18 и 34 из US 20150159173), hu.53 (SEQ ID NO: 19 и 35 из US 20150159173), rh.43 (SEQ ID NO: 21 и 37 из US 20150159173), rh2 (SEQ ID NO: 39 из US 20150159173), rh.37 (SEQ ID NO: 40 из US 20150159173), rh.64 (SEQ ID NO: 43 из US 20150159173), rh.48 (SEQ ID NO: 44 из US 20150159173), ch.5 (SEQ ID NO 46 US 20150159173), rh.67 (SEQ ID NO: 47 из US 20150159173), rh.58 (SEQ ID NO: 48 из US 20150159173) или их варианты, включая без ограничения Cy5R1, Cy5R2, Cy5R3, Cy5R4, rh.13R, rh.37R2, rh.2R, rh.8R, rh.48.1, rh.48.2, rh.48.1.2, hu.44Rl, hu.44R2, hu.44R3, hu.29R, ch.5R1, rh64R1, rh64R2, AAV6.2, AAV6.1, AAV6.12, hu.48R1, hu.48R2 и hu.48R3.
[00300] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать серотип или происходить из серотипа AAV, который может быть представлен последовательностью или может предусматривать последовательность, как описано в патенте США № US 7198951, содержание которого включено в данный документ посредством ссылки во всей своей полноте, например без ограничения AAV9 (SEQ ID NO: 1-3 из US 7198951), AAV2 (SEQ ID NO: 4 из US 7198951), AAV1 (SEQ ID NO: 5 из US 7198951), AAV3 (SEQ ID NO: 6 из US 7198951) и AAV 8 (SEQ ID NO: 7 из US 7198951).
[00301] В некоторых вариантах осуществления векторы на основе AAV содержат серотип или происходят из серотипа AAV, который может представлять собой или содержать мутацию в последовательности AAV9, как описано N Pulicherla et al. (Molecular Therapy 19(6): 1070-1078 (2011), которое включено в данный документ посредством ссылки во всей своей полноте), например без ограничения AAV9.9, AAV9.11, AAV9.13, AAV9.16, AAV9.24, AAV9.45, AAV9.47, AAV9.61, AAV9.68, AAV9.84. В некоторых вариантах осуществления капсид AAV содержит одну или несколько последовательностей, сконструированных для доставки вектора через гематоэнцефалический барьер (см., например, B.E. Deverman et al, Nature Biotech, Vol. 34, No. 2, p 204-211 (опубликованую онлайн 1 февраля 2016 г.) и пресс-релиз Caltech, A. Wetherston, www.neurology-cenfrd.com/2016/02/10/successfd/brain-barrier; см. также WO 2016/0492301 и US 8734809 (содержание каждой из них включено в данный документ посредством ссылки во всей своей полноте).
[00302] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать серотип или происходить из серотипа AAV, который может быть представлен последовательностью или может предусматривать последовательность, как описано в патенте США № US 6156303, содержание которого включено в данный документ посредством ссылки во всей своей полноте, например без ограничения AAV3B (SEQ ID NO: 1 и 10 из US 6156303), AAV6 (SEQ ID NO: 2, 7 и 11 из US 6156303), AAV2 (SEQ ID NO: 3 и 8 из US 6156303), AAV3A (SEQ ID NO: 4 и 9 из US 6156303) или их производные.
[00303] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать серотип или происходить из серотипа AAV, который может быть представлен последовательностью или может предусматривать последовательность, как описано в публикации США № US 20140359799, содержание которой включено в данный документ посредством ссылки во всей своей полноте, например без ограничения AAV 8 (SEQ ID NO: 1 из US 20140359799), AAVDJ (SEQ ID NO: 2 и 3 из US 20140359799) или их варианты.
[00304] В некоторых вариантах осуществления частица AAV может содержать капсид такого серотипа, как без ограничения AAVDJ или его вариант, такой как AAVDJ8 (или AAV-DJ8), как описано Grimm et al. (Journal of Virology 82(12): 5887-5911 (2008), включенной в данный документ посредством ссылки во всей своей полноте). Аминокислотная последовательность AAVDJ8 может содержать две или более мутаций для удаления гепарин-связывающего домена (HBD). В качестве неограничивающего примера последовательность AAV-DJ, описанная как SEQ ID NO: 1 в патенте США №7588772, содержание которого включено в данный документ посредством ссылки во всей своей полноте, может включать две мутации: (1) R587Q, где аргинин (R; Arg) в положении 587 заменен на глутамин (Q; Gln), и (2) R590T, где аргинин (R; Arg) в положении 590 заменен на треонин (T; Thr). В качестве другого неограничивающего примера могут быть включены три мутации: (1) K406R, где лизин (K; Lys) в положении 406 заменен на аргинин (R; Arg), (2) R587Q, где аргинин (R; Arg) в положении 587 заменен на глутамин (Q; Gln) и (3) R590T, где аргинин (R; Arg) в положении 590 заменен на треонин (T; Thr).
[00305] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать серотип или происходить из серотипа AAV, который может быть представлен последовательностью или может предусматривать последовательность AAV4, как описано в международной публикации № WO 1998011244, содержание которой включено в данный документ посредством ссылки во всей своей полноте, например без ограничения AAV4 (SEQ ID NO: 1-20 из WO 1998011244).
[00306] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать серотип или происходить из серотипа AAV, который быть представлен мутацией или может предусматривать мутацию в последовательности AAV2 для получения AAV2G9, как описано в международной публикации № WO 2014144229, включенной в данный документ посредством ссылки во всей своей полноте.
[00307] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать серотип или происходить из серотипа AAV, который может быть представлен последовательностью или может предусматривать последовательность, как описано в международной публикации № WO 2005033321, содержание которой включено в данный документ посредством ссылки во всей своей полноте, например без ограничения AAV3-3 (SEQ ID NO: 217 из WO 2005033321), AAV1 (SEQ ID NO: 219 и 202 из WO 2005033321), AAV106.1/hu.37 (SEQ ID No: 10 из WO 2005033321), AAV114.3/hu.40 (SEQ ID No: 11 из WO 2005033321), AAV127.2/hu.41 (SEQ ID NO: 6 и 8 из WO 2005033321), AAV128.3/hu.44 (SEQ ID No: 81 из WO 2005033321), AAV130.4/hu.48 (SEQ ID NO: 78 из WO 2005033321), AAV145.1/hu.53 (SEQ ID No: 176 и 177 из WO 2005033321), AAV145.6/hu.56 (SEQ ID NO: 168 и 192 из WO 2005033321), AAV16.12/hu.11 (SEQ ID NO: 153 и 57 из WO 2005033321), AAV16.8/hu.10(SEQ ID NO: 156 и 56 из WO 2005033321), AAV161.10/hu.60 (SEQ ID No: 170 из WO 2005033321), AAV161.6/hu.61 (SEQ ID No: 174 из WO 2005033321), AAV1-7/rh.48 (SEQ ID NO: 32 из WO 2005033321), AAV1-8/rh.49 (SEQ ID NOs: 103 и 25 из WO 2005033321), AAV2 (SEQ ID NO: 211 и 221 из WO 2005033321), AAV2-15/rh.62 (SEQ ID No: 33 и 114 из WO 2005033321), AAV2-3/rh.61 (SEQ ID NO: 21 из WO 2005033321), AAV2-4/rh.50 (SEQ ID No: 23 и 108 из WO 2005033321), AAV2-5/rh.51 (SEQ ID NO: 104 и 22 из WO 2005033321), AAV3.1/hu.6 (SEQ ID NO: 5 и 84 из WO 2005033321), AAV3.1/hu.9 (SEQ ID NO: 155 и 58 из WO 2005033321), AAV3-l l/rh.53 (SEQ ID NO: 186 и 176 из WO 2005033321), AAV3-3 (SEQ ID NO: 200 из WO 2005033321), AAV33.12/hu.17 (SEQ ID NO:4 из WO 2005033321), AAV33.4/hu.15 (SEQ ID No: 50 из WO 2005033321), AAV33.8/hu.16 (SEQ ID No: 51 из WO 2005033321), AAV3-9/rh.52 (SEQ ID NO: 96 и 18 из WO 2005033321), AAV4-19/rh.55 (SEQ ID NO: 117 из WO 2005033321), AAV4-4 (SEQ ID NO: 201 и 218 из WO 2005033321), AAV4-9/rh.54 (SEQ ID NO: 116 из WO 2005033321), AAV5 (SEQ ID NO: 199 и 216 из WO 2005033321), AAV52.1/hu.20 (SEQ ID NO: 63 из WO 2005033321), AAV52/hu. 19 (SEQ ID NO: 133 из WO 2005033321), AAV5-22/rh.58 (SEQ ID No: 27 из WO 2005033321), AAV5-3/rh.57 (SEQ ID NO: 105 из WO 2005033321), AAV5-3/rh.57 (SEQ ID No: 26 из WO 2005033321), AAV58.2/hu.25 (SEQ ID No: 49 из WO 2005033321), AAV6 (SEQ ID NO: 203 и 220 из WO 2005033321), AAV7 (SEQ ID NO: 222 и 213 из WO 2005033321), AAV7.3/hu.7 (SEQ ID No: 55 из WO 2005033321), AAV 8 (SEQ ID NO: 223 и 214 из WO 2005033321), AAVH-1/hu.1 (SEQ ID No: 46 из WO 2005033321), AAVH-5/hu.3 (SEQ ID No: 44 из WO 2005033321), AAVhu.1 (SEQ ID NO: 144 из WO 2005033321), AAVhu.10 (SEQ ID NO: 156 из WO 2005033321), AAVhu.11 (SEQ ID NO: 153 из WO 2005033321), AAVhu.12 (WO 2005033321 SEQ ID NO: 59), AAVhu.13 (SEQ ID NO: 129 из WO 2005033321), AAVhu.14/AAV9 (SEQ ID NO: 123 и 3 из WO 2005033321), AAVhu.15 (SEQ ID NO: 147 из WO 2005033321), AAVhu.16 (SEQ ID NO: 148 из WO 2005033321), AAVhu.17 (SEQ ID NO: 83 из WO 2005033321), AAVhu.18 (SEQ ID NO: 149 из WO 2005033321), AAVhu.19 (SEQ ID NO: 133 из WO 2005033321), AAVhu.2 (SEQ ID NO: 143 из WO 2005033321), AAVhu.20 (SEQ ID NO: 134 из WO 2005033321), AAVhu.21 (SEQ ID NO: 135 из WO 2005033321), AAVhu.22 (SEQ ID NO: 138 из WO 2005033321), AAVhu.23.2 (SEQ ID NO: 137 из WO 2005033321), AAVhu.24 (SEQ ID NO: 136 из WO 2005033321), AAVhu.25 (SEQ ID NO: 146 из WO 2005033321), AAVhu.27 (SEQ ID NO: 140 из WO 2005033321), AAVhu.29 (SEQ ID NO: 132 из WO 2005033321), AAVhu.3 (SEQ ID NO: 145 из WO 2005033321), AAVhu.31 (SEQ ID NO: 121 из WO 2005033321), AAVhu.32 (SEQ ID NO: 122 из WO 2005033321), AAVhu.34 (SEQ ID NO: 125 из WO 2005033321), AAVhu.35 (SEQ ID NO: 164 из WO 2005033321), AAVhu.37 (SEQ ID NO: 88 из WO 2005033321), AAVhu.39 (SEQ ID NO: 102 из WO 2005033321), AAVhu.4 (SEQ ID NO: 141 из WO 2005033321), AAVhu.40 (SEQ ID NO: 87 из WO 2005033321), AAVhu.41 (SEQ ID NO: 91 из WO 2005033321), AAVhu.42 (SEQ ID NO: 85 из WO 2005033321), AAVhu.43 (SEQ ID NO: 160 из WO 2005033321), AAVhu.44 (SEQ ID NO: 144 из WO 2005033321), AAVhu.45 (SEQ ID NO: 127 из WO 2005033321), AAVhu.46 (SEQ ID NO: 159 из WO 2005033321), AAVhu.47 (SEQ ID NO: 128 из WO 2005033321), AAVhu.48 (SEQ ID NO: 157 из WO 2005033321), AAVhu.49 (SEQ ID NO: 189 из WO 2005033321), AAVhu.51 (SEQ ID NO: 190 из WO 2005033321), AAVhu.52 (SEQ ID NO: 191 из WO 2005033321), AAVhu.53 (SEQ ID NO: 186 из WO 2005033321), AAVhu.54 (SEQ ID NO: 188 из WO 2005033321), AAVhu.55 (SEQ ID NO: 187 из WO 2005033321), AAVhu.56 (SEQ ID NO: 192 из WO 2005033321), AAVhu.57 (SEQ ID NO: 193 из WO 2005033321), AAVhu.58 (SEQ ID NO: 194 из WO 2005033321), AAVhu.6 (SEQ ID NO: 84 из WO 2005033321), AAVhu.60 (SEQ ID NO: 184 из WO 2005033321), AAVhu.61 (SEQ ID NO: 185 из WO 2005033321), AAVhu.63 (SEQ ID NO: 195 из WO 2005033321), AAVhu.64 (SEQ ID NO: 196 из WO 2005033321), AAVhu.66 (SEQ ID NO: 197 из WO 2005033321), AAVhu.67 (SEQ ID NO: 198 из WO 2005033321), AAVhu.7 (SEQ ID NO: 150 из WO 2005033321), AAVhu.8 (WO 2005033321 SEQ ID NO: 12), AAVhu.9 (SEQ ID NO: 155 из WO 2005033321), AAVLG-10/rh.40 (SEQ ID No: 14 из WO 2005033321), AAVLG-4/rh.38 (SEQ ID NO: 86 из WO 2005033321), AAVLG-4/rh.38 (SEQ ID No: 7 из WO 2005033321), AAVN721-8/rh.43 (SEQ ID NO: 163 из WO 2005033321), AAVN721-8/rh.43 (SEQ ID No: 43 из WO 2005033321), AAVpi.1 (WO 2005033321 SEQ ID NO: 28), AAVpi.2 (WO 2005033321 SEQ ID NO: 30), AAVpi.3 (WO 2005033321 SEQ ID NO: 29), AAVrh.38 (SEQ ID NO: 86 из WO 2005033321), AAVrh.40 (SEQ ID NO: 92 из WO 2005033321), AAVrh.43 (SEQ ID NO: 163 из WO 2005033321), AAVrh.44 (WO 2005033321 SEQ ID NO: 34), AAVrh.45 (WO 2005033321 SEQ ID NO: 41), AAVrh.47 (WO 2005033321 SEQ ID NO: 38), AAVrh.48 (SEQ ID NO: 115 из WO 2005033321), AAVrh.49 (SEQ ID NO: 103 из WO 2005033321), AAVrh.50 (SEQ ID NO: 108 из WO 2005033321), AAVrh.51 (SEQ ID NO: 104 из WO 2005033321), AAVrh.52 (SEQ ID NO: 96 из WO 2005033321), AAVrh.53 (SEQ ID NO: 97 из WO 2005033321), AAVrh.55 (WO 2005033321 SEQ ID NO: 37), AAVrh.56 (SEQ ID NO: 152 из WO 2005033321), AAVrh.57 (SEQ ID NO: 105 из WO 2005033321), AAVrh.58 (SEQ ID NO: 106 из WO 2005033321), AAVrh.59 (WO 2005033321 SEQ ID NO: 42), AAVrh.60 (WO 2005033321 SEQ ID NO: 31), AAVrh.61 (SEQ ID NO: 107 из WO 2005033321), AAVrh.62 (SEQ ID NO: 114 из WO 2005033321), AAVrh.64 (SEQ ID NO: 99 из WO 2005033321), AAVrh.65 (WO 2005033321 SEQ ID NO: 35), AAVrh.68 (WO 2005033321 SEQ ID NO: 16), AAVrh.69 (WO 2005033321 SEQ ID NO: 39), AAVrh.70 (WO 2005033321 SEQ ID NO: 20), AAVrh.72 (WO 2005033321 SEQ ID NO: 9) или их варианты, включая без ограничения AAVcy.2, AAVcy.3, AAVcy.4, AAVcy.5, AAVcy.6, AAVrh.12, AAVrh.17, AAVrh.18, AAVrh.19, AAVrh.21, AAVrh.22, AAVrh.23, AAVrh.24, AAVrh.25, AAVrh.25/42 15, AAVrh.31, AAVrh.32, AAVrh.33, AAVrh.34, AAVrh.35, AAVrh.36, AAVrh.37, AAVrhl4. Неограничивающие примеры вариантов включают SEQ ID NO: 13, 15, 17, 19, 24, 36, 40, 45, 47, 48, 51-54, 60-62, 64-77, 79, 80, 82, 89, 90, 93-95, 98, 100, 101, 109-113, 118-120, 124, 126, 131, 139, 142, 151,154, 158, 161, 162, 165-183, 202, 204-212, 215, 219, 224-236 из WO 2005033321, содержание которой включено в данный документ посредством ссылки во всей своей полноте.
[00308] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать серотип или происходить из серотипа AAV, который может быть представлен последовательностью или может предусматривать последовательность, как описано в международной публикации № WO 2015168666, содержание которой включено в данный документ посредством ссылки во всей своей полноте, например без ограничения AAVrh8R (SEQ ID NO: 9 из WO 2015168666), мутант AAVrh8R A586R (SEQ ID NO: 10 из WO 2015168666), мутант AAVrh8R R533A (SEQ ID NO: 11 из WO 2015168666) или их варианты.
[00309] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать серотип или происходить из серотипа AAV, который может быть представлен последовательностью или может предусматривать последовательность, как описано в международной публикации № WO 2018/160582, содержание которой включено в данный документ посредством ссылки во всей своей полноте, например без ограничения AAVhu68 (например, SEQ ID NO: 2 из WO 2018160582) или их варианты.
В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать серотип или происходить из серотипа AAV, который может быть представлен последовательностью или может предусматривать последовательность, как описано в патенте США № US 9233131, содержание которого включено в данный документ посредством ссылки во всей своей полноте, такого как без ограничения AAVhE1.1 (SEQ ID NO: 44 из US 9233131), AAVhEr1.5 (SEQ ID NO: 45 из US 9233131), AAVhER1.14 (SEQ ID NO:46 из US 9233131), AAVhEr1.8 (SEQ ID NO: 47 из US 9233131), AAVhEr1.16 (SEQ ID NO: 48 из US 9233131), AAVhEr1.18 (SEQ ID NO: 49 из US 9233131), AAVhEr1.35 (SEQ ID NO: 50 из US 9233131), AAVhEr1.7 (SEQ ID NO: 51 из US 9233131), AAVhEr1.36 (SEQ ID NO: 52 из US 9233131), AAVhEr2.29 (SEQ ID NO: 53 из US 9233131), AAVhEr2.4 (SEQ ID NO: 54 из US 9233131), AAVhEr2.16 (SEQ ID NO: 55 из US 9233131), AAVhEr2.30 (SEQ ID NO: 56 из US 9233131), AAVhEr2.31 (SEQ ID NO: 58 из US 9233131), AAVhEr2.36 (SEQ ID NO: 57 из US 9233131), AAVhER1.23 (SEQ ID NO: 53 из US 9233131), AAVhEr3.1 (SEQ ID NO: 59 из US 9233131), AAV2.5T (SEQ ID NO: 42 из US 9233131) или их варианты.
[00310] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать серотип или происходить из серотипа AAV, который может быть представлен последовательностью или может предусматривать последовательность, как описано в патентной публикации США № US 20150376607, содержание которой включено в данный документ посредством ссылки во всей своей полноте, например без ограничения AAV-PAEC (SEQ ID NO: 1 из US 20150376607), AAV-LKOl (SEQ ID NO:2 из US 20150376607), AAV-LK02 (SEQ ID NO: 3 из US 20150376607), AAV-LK03 (SEQ ID NO: 4 из US 20150376607), AAV-LK04 (SEQ ID NO: 5 из US 20150376607), AAV-LK05 (SEQ ID NO: 6 из US 20150376607), AAV-LK06 (SEQ ID NO: 7 из US 20150376607), AAV-LK07 (SEQ ID NO: 8 из US 20150376607), AAV-LK08 (SEQ ID NO: 9 из US 20150376607), AAV-LK09 (SEQ ID NO: 10 из US 20150376607), AAV-LK10 (SEQ ID NO: 1 из US 20150376607), AAV-LK11 (SEQ ID NO: 12 из US 20150376607), AAV-LK12 (SEQ ID NO: 13 из US 20150376607), AAV-LK13 (SEQ ID NO: 14 из US 20150376607), AAV-LK14 (SEQ ID NO: 15 из US 20150376607), AAV-LK15 (SEQ ID NO: 16 из US 20150376607), AAV-LK16 (SEQ ID NO: 17 из US 20150376607), AAV-LK17 (SEQ ID NO: 18 из US 20150376607), AAV-LK18 (SEQ ID NO: 19 из US 20150376607), AAV-LK19 (SEQ ID NO: 20 из US 20150376607), AAV-PAEC2 (SEQ ID NO: 21 из US 20150376607), AAV-PAEC 4 (SEQ ID NO: 22 из US 20150376607), AAV-PAEC6 (SEQ ID NO: 23 из US 20150376607), AAV-PAEC7 (SEQ ID NO: 24 из US 20150376607), AAV-PAEC 8 (SEQ ID NO: 25 из US 20150376607), AAV-PAEC11 (SEQ ID NO: 26 из US 20150376607), AAV-PAEC 12 (SEQ ID NO: 27, из US 20150376607) или их варианты.
[00311] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать серотип или происходить из серотипа AAV, который может быть представлен последовательностью или может предусматривать последовательность, как описано в патенте США № US 9163261, содержание которого включено в данный документ посредством ссылки во всей своей полноте, например без ограничения AAV-2-pre-miRNA-101 (SEQ ID NO: 1 из US 9163261) или его варианты.
[00312] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать серотип или происходить из серотипа AAV, который может быть представлен последовательностью или может предусматривать последовательность, как описано в патентной публикации США № US 20150376240, содержание которой включено в данный документ посредством ссылки во всей своей полноте, например без ограничения AAV-8h (SEQ ID NO: 6 из US 20150376240), AAV-8b (SEQ ID NO: 5 из US 20150376240), AAV-h (SEQ ID NO: 2 из US 20150376240), AAV-b (SEQ ID NO: 1 из US 20150376240) или их варианты. [00161] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать серотип или происходить из серотипа AAV, который может быть представлен последовательностью или может предусматривать последовательность, как описано в патентной публикации США № US 20160017295, содержание которой включено в данный документ посредством ссылки во всей своей полноте, например без ограничения AAV SM 10-2 (SEQ ID NO: 22 из US 20160017295), AAV Shuffle 100-1 (SEQ ID NO: 23 из US 20160017295), AAV Shuffle 100-3 (SEQ ID NO: 24 из US 20160017295), AAV Shuffle 100-7 (SEQ ID NO: 25 из US 20160017295), AAV Shuffle 10-2 (SEQ ID NO: 34 из US 20160017295), AAV Shuffle 10-6 (SEQ ID NO: 35 из US 20160017295), AAV Shuffle 10-8 (SEQ ID NO: 36 из US 20160017295), AAV Shuffle 100-2 (SEQ ID NO: 37 из US 20160017295), AAV SM 10-1 (SEQ ID NO: 38 из US 20160017295), AAV SM 10-8 (SEQ ID NO: 39 из US 20160017295), AAV SM 100-3 (SEQ ID NO: 40 из US 20160017295), AAV SM 100-10 (SEQ ID NO: 41 из US 20160017295) или их варианты.
[00313] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать серотип или происходить из серотипа AAV, который может быть представлен последовательностью или может предусматривать последовательность, как описано в патентной публикации США № US 20150238550, содержание которой включено в данный документ посредством ссылки во всей своей полноте, например без ограничения BNP61 AAV (SEQ ID NO: 1 из US 20150238550), BNP62 AAV (SEQ ID NO: 3 из US 20150238550), BNP63 AAV (SEQ ID NO: 4 из US 20150238550) или их варианты.
[00314] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать серотип или происходить из серотипа AAV, который быть представлен последовательностью или может предусматривать последовательность, как описано в патентной публикации США № US 20150315612, содержание которой включено в данный документ посредством ссылки во всей своей полноте, например без ограничения AAVrh.50 (SEQ ID NO: 108 из US 20150315612), AAVrh.43 (SEQ ID NO: 163 из US 20150315612), AAVrh.62 (SEQ ID NO: 114 из US 20150315612), AAVrh.48 (SEQ ID NO: 115 из US 20150315612), AAVhu.19 (SEQ ID NO: 133 из US 20150315612), AAVhu. l l (SEQ ID NO: 153 из US 20150315612), AAVhu.53 (SEQ ID NO: 186 из US 20150315612), AAV4-8/rh.64 (SEQ ID No: 15 из US 20150315612), AAVLG-9/hu.39 (SEQ ID No: 24 из US 20150315612), AAV54.5/hu.23 (SEQ ID No: 60 из US 20150315612), AAV54.2/hu.22 (SEQ ID No: 67 из US 20150315612), AAV54.7/hu.24 (SEQ ID No: 66 из US 20150315612), AAV54.1/hu.21 (SEQ ID No: 65 из US 20150315612), AAV54.4R/hu.27 (SEQ ID No: 64 из US 20150315612), AAV46.2/hu.28 (SEQ ID No: 68 из US 20150315612), AAV46.6/hu.29 (SEQ ID No: 69 из US 20150315612), AAV128.1/hu.43 (SEQ ID No: 80 из US 20150315612) или их варианты.
[00315] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут предусматривать серотип или происходить из серотипа AAV, который может быть представлен последовательностью или может предусматривать последовательность, как описано в международной публикации № WO 2015121501, содержание которой включено в данный документ посредством ссылки во всей своей полноте, например без ограничения AAV подлинного типа (ttAAV)(SEQ ID NO: 2 из WO 2015121501), "UPenn AAV10" (SEQ ID NO: 8 из WO 2015121501), "японский AAV10" (SEQ ID NO: 9 из WO 2015121501) или их варианты.
[00316] Согласно настоящему изобретению частица AAV может предусматривать серотип капсида AAV, который может быть выбран из множества видов или происходить из них. В одном варианте осуществления AAV может представлять собой птичий AAV (AAAV). Серотип AAAV может быть представлен последовательностью или предусматривать последовательность, как описано в патенте США № US 9238800, содержание которого включено в данный документ посредством ссылки во всей своей полноте, например без ограничения AAAV (SEQ ID NO: 1, 2, 4, 6, 8, 10, 12 и 14 из US 9238800) или их варианты.
[00317] В одном варианте осуществления частица AAV может предусматривать серотип капсида AAV, который может представлять собой бычий AAV (BAAV) или происходить из него. Серотип BAAV быть представлен последовательностью или предусматривать последовательность, как описано в патенте США № US 9193769, содержание которого включено в данный документ посредством ссылки во всей своей полноте, например без ограничения BAAV (SEQ ID NO: 1 и 6 из US 9193769) или его варианты. Серотип BAAV быть представлен последовательностью или предусматривать последовательность, как описано в патенте США № US7427396, содержание которого включено в данный документ посредством ссылки во всей своей полноте, например без ограничения BAAV (SEQ ID NO: 5 и 6 из US 7427396) или его варианты.
[00318] В одном варианте осуществления частица AAV может предусматривать серотип капсида AAV, который может представлять собой козий AAV или происходить из него. Козий серотип AAV быть представлен последовательностью или предусматривать последовательность, как описано в патенте США № US7427396, содержание которого включено в данный документ посредством ссылки во всей своей полноте, например без ограничения козий AAV (SEQ ID NO: 3 из US 7427396) или их варианты.
[00319] В других вариантах осуществления частица AAV может предусматривать серотип капсида AAV, который может быть сконструирован в виде гибридного капсида AAV из двух или более исходных серотипов. В одном варианте осуществления AAV может представлять собой AAV2G9, который содержит последовательности из AAV2 и AAV9. Серотип AAV AAV2G9 быть представлен последовательностью или предусматривать последовательность, как описано в патентной публикации США № US 20160017005, содержание которого включено в данный документ посредством ссылки во всей своей полноте.
[00320] В одном варианте осуществления частица AAV может предусматривать серотип капсида AAV, который может быть получен с помощью библиотеки капсидов AAV9 с мутациями в аминокислотах 390-627 (нумерация VP1), как описано Pulicherla et al. (Molecular Therapy 19(6): 1070-1078 (2011), содержание которого включено в данный документ посредством ссылки во всей своей полноте. Серотип и соответствующие замены нуклеотидов и аминокислот могут представлять собой без ограничения AAV9,1 (G1594C; D532H), AAV6,2 (T1418A и T1436X; V473D и I479K), AAV9,3 (T1238A; F413Y), AAV9,4 (T1250C и A1617T; F417S), AAV9,5 (A1235G, A1314T, A1642G, C1760T; Q412R, T548A, A587V), AAV9,6 (T1231A; F411I), AAV9,9 (G1203A, G1785T; W595C), AAV9,10 (A1500G, T1676C; M559T), AAV9,11 (A1425T, A1702C, A1769T; T568P, Q590L), AAV9,13 (A1369C, A1720T; N457H, T574S), AAV9,14 (T1340A, T1362C, T1560C, G1713A; L447H), AAV9,16 (A1775T; Q592L), AAV9,24 (T1507C, T1521G; W503R), AAV9,26 (A1337G, A1769C; Y446C, Q590P), AAV9,33 (A1667C; D556A), AAV9,34 (A1534G, C1794T; N512D), AAV9,35 (A1289T, T1450A, C1494T, A1515T, C1794A, G1816A; Q430L, Y484N, N98K, V606I), AAV9,40 (A1694T, E565V), AAV9,41 (A1348T, T1362C; T450S), AAV9,44 (A1684C, A1701T, A1737G; N562H, K567N), AAV9,45 (A1492T, C1804T; N498Y, L602F), AAV9,46 (G1441C, T1525C, T1549G; G481R, W509R, L517V), 9,47 (G1241A, G1358A, A1669G, C1745T; S414N, G453D, K557E, T582I), AAV9,48 (C1445T, A1736T; P482L, Q579L), AAV9,50 (A1638T, C1683T, T1805A; Q546H, L602H), AAV9,53 (G1301A, A1405C, C1664T, G1811T; R134Q, S469R, A555V, G604V), AAV9,54 (C1531A, T1609A; L511I, L537M), AAV9,55 (T1605A; F535L), AAV9,58 (C1475T, C1579A; T492I, H527N), AAV.59 (T1336C; Y446H), AAV9,61 (A1493T; N498I), AAV9,64 (C1531A, A1617T; L511I), AAV9,65 (C1335T, T1530C, C1568A; A523D), AAV9,68 (C1510A; P504T), AAV9,80 (G1441A,;G481R), AAV9,83 (C1402A, A1500T; P468T, E500D), AAV9,87 (T1464C, T1468C; S490P), AAV9,90 (A1196T; Y399F), AAV9,91 (T1316G, A1583T, C1782G, T1806C; L439R, K528I), AAV9,93 (A1273G, A1421G, A1638C, C1712T, G1732A, A1744T, A1832T; S425G, Q474R, Q546H, P571L, G578R, T582S, D611V), AAV9,94 (A1675T; M559L) и AAV9,95 (T1605A; F535L).
[00321] В одном варианте осуществления частицы AAV по настоящему изобретению могут содержать капсидные белки, имеющие последовательности под SEQ ID NO: 1 и 3, которые имеют повышенный тропизм к головному мозгу, из международной публикации № WO 2014160092, содержание которой включено в данный документ посредством ссылки во всей своей полноте.
[00322] В одном варианте осуществления частицы AAV по настоящему изобретению могут содержать капсидные белки, которые могут нацеливаться на олигодендроциты в центральной нервной системе. Капсидные белки могут содержать кодирующую последовательность капсида AAV под SEQ ID NO: 1 или капсидные белки AAV, содержащие аминокислотные последовательности под SEQ ID NO: 2-4 из международной публикации № WO 2014052789, содержание которой включено в данный документ посредством ссылки во всей своей полноте.
[00323] В одном варианте осуществления частицы AAV по настоящему изобретению могут содержать капсидные белки, обладающие повышенной способностью проходить через гематоэнцефалический барьер в ЦНС, как раскрыто в патенте США №8927514, содержание которого включено в данный документ посредством ссылки во всей своей полноте. Аминокислотные последовательности и последовательности нуклеиновых кислот таких капсидных белков могут включать без ограничения SEQ ID NO: 2-17 и SEQ ID NO: 25-33 соответственно из патента США №8927514.
[00324] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут содержать капсидные белки AAV2 или их варианты. Было показано, что частицы AAV с капсидными белками AAV2 эффективно доставляют гены к нейронам головного мозга, сетчатки и спинного мозга. В одном варианте осуществления капсидные белки AAV2 могут быть дополнительно модифицированы, например посредством добавления нацеливающего на капсидные белки пептида, который нацеливает частицу AAV на эндотелий сосудов головного мозга, как описано в патентах США №6691948 и 8299215, содержание каждого из которых включено в данный документ посредством ссылки во всей своей полноте. Такие частицы AAV можно использовать для доставки функционального антитела к hTREM2 или его антигенсвязывающего фрагмента, например как описано в данном документе.
[00325] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут содержать капсидные белки AAV5 или их варианты. Частицы AAV с капсидными белками AAV5 могут трансдуцировать нейроны в различных областях ЦНС, включая кору, гиппокамп (HPC), мозжечок, черную субстанцию (SN), полосатое тело, бледный шар и спинной мозг (Burger C et al, Mol Ther., 2004, 10(2): 302-317; Liu G et al, Mol Ther. 2007, 15(2): 242-247; и Colle M et al, Hum, Mol. Genet. 2010, 19(1): 147-158). В одном варианте осуществления частицы AAV, содержащие капсидные белки AAV 5 с повышенной трансдукцией в отношении клеток ЦНС, могут представлять собой частицы из патента США №7056502, содержание которого включено в данный документ посредством ссылки во всей своей полноте.
[00326] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут содержать капсидные белки AAV6 или их варианты. Рекомбинантный серотип AAV6 может нацеливаться на двигательные нейроны в спинном мозге после интрацеребровентрикулярной (ICV) инъекции (Dirren E et al., Hum Gene Ther., 2014, 25(2): 109-120). Кроме того, исследование, проведенное San Sebastian et al, показало, что серотип AAV6 может ретроградно переноситься от терминалей к телам нейронных клеток в головном мозге крысы (San Sebastian et al, Gen Ther., 2014, 20(12): 1178-1183).
[00327] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут содержать капсидные белки AAV8 или их варианты. Частицы AAV с капсидными белками AAV8 могут трансдуцировать нейроны, например, в гиппокампе (Klein RL et al, Mol Ther., 2006, 13(3): 517-527). В одном варианте осуществления капсидные белки AAV8 могут содержать аминокислотную последовательность под SEQ ID NO: 2 из патента США №8318480, содержание которого включено в данный документ посредством ссылки во всей своей полноте.
[00328] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут содержать капсидные белки AAV9 или их варианты. Доставка гена, опосредованная серотипом капсида AAV9, наблюдалась в головном мозге с эффективной и долговременной экспрессией трансгена после внутрипаренхимальных инъекций в ЦНС (Klein RL et al, Eur J Neurosci., 2008, 27: 1615-1625). Серотип AAV9 может вызывать устойчивую и обширную нейрональную трансдукцию во всей ЦНС после периферического, системного (например, внутривенного) введения новорожденным субъектам (Foust KD et al, Nat. Biotechnol, 2009, 27: 59-65; и Duque S et al, Mol Ther., 2009, 17: 1187-1196). Интратекальное введение (пути введения в мозжечко-мозговую цистерну) серотипов AAV9 также может вызывать обширную экспрессию в спинном мозге. В одном варианте осуществления серотип AAV9 может включать капсидный белок AAV, имеющий аминокислотную последовательность под SEQ ID NO: 2 из патента США №7198951, содержание которого включено в данный документ посредством ссылки во всей своей полноте. В другом аспекте серотип AAV9 может предусматривать капсидные белки VP1 под SEQ ID NO: 2, 4 или 6, в которых по меньшей мере один из находящихся на поверхности остатков тирозина в аминокислотной последовательности заменен другим аминокислотным остатком, как описано в патентной публикации США № US 20130224836, содержание которой включено в данный документ посредством ссылки во всей своей полноте. В вариантах осуществления вектор на основе AAV, содержащий капсид AAV9, вводят системно, например внутривенно. В вариантах осуществления вектор на основе AAV, содержащий капсид AAV9, вводят в головной мозг, позвоночник или спинномозговую жидкость (CSF), например интратекально.
[00329] В некоторых вариантах осуществления вектор на основе AAV содержит вариант капсидного белка, сконструированный для приобретения определенного свойства. Такие способы получения сконструированных капсидов описаны, например, в патентной публикации WO 2011038187, содержание которой включено в данный документ посредством ссылки во всей своей полноте. Такие методы и векторы также описаны, например, в патентной публикации WO 2012112832 и публикации заявки на патент WO 2015054653, содержание которых включено в данный документ посредством ссылки во всей своей полноте. Такие варианты капсидов включают, например, SEQ ID NO: 23 из WO 2015054653, или ее варианты. Дополнительные варианты капсидов включают, например, те последовательности капсидов, которые описаны в патентной публикации WO 2017/019994, содержание которой включено в данный документ посредством ссылки во всей своей полноте. В вариантах осуществления вектор на основе AAV содержит капсид, представленный последовательностью капсида AAV Anc80 (например, под SEQ ID NO: 1 из WO 2017019994), например Anc80L65 (например, под SEQ ID NO: 23 из WO 2017019994), или например Anc110 (например, под SEQ ID NO: 42 из WO 2017019994).
[00330] В некоторых вариантах осуществления частицы AAV по настоящему изобретению могут содержать капсидные белки AAVrh10 или их варианты. Частицы AAV, содержащие капсидные белки AAVrh10, могут нацеливаться на нейроны, а также другие клетки в спинном мозге после интратекального (IT) введения. В одном варианте осуществления капсидные белки AAVrh10 могут содержать аминокислотную последовательность под SEQ ID NO: 81 из патента EP №2341068. [00188] В некоторых вариантах осуществления AAV по настоящему изобретению могут содержать капсидные белки AAVDJ, капсидные белки AAVDJ/8 или их варианты. Holehonnur et al. показали, что серотип AAVDJ/8 может нацеливаться на нейроны в базальной и латеральной миндалине (BLA) (Holehonnur R et al., BMC Neurosci, 2014, Feb 18: 15:28). В одном варианте осуществления капсидные белки AAVDJ и/или капсидные белки AAVDJ/8 могут содержать аминокислотную последовательность, содержащую первую область, которая происходит от первого серотипа AAV (например, AAV2), вторую область, которая происходит от второго серотипа AAV (например, AAV8), и третью область, которая происходит от третьего серотипа AAV (например, AAV 9), где первая, вторая и третья области могут включать любые аминокислотные последовательности, раскрытые в данном описании.
[00331] В одном варианте осуществления частицы AAV по настоящему изобретению могут содержать капсидные белки, которые, как было показано или как известно, трансдуцируют ганглии задних корешков (DRG).
[00332] В одном варианте осуществления частицы AAV по настоящему изобретению могут содержать капсидные белки, которые, как было показано или как известно, трансдуцируют двигательные нейроны.
[00333] В одном варианте осуществления частицы AAV содержат самокомплементарный (SC) геном вектора.
[00334] В одном варианте осуществления частицы AAV содержат однонитевый (SS) геном.
[00335] В одном варианте осуществления частица AAV, содержащая самокомплементарный (sc) вектор, может использоваться для получения более высокого уровня экспрессии, чем частица AAV, содержащая соответствующий однонитевый геном вектора.
[00336] В одном варианте осуществления серотип частиц AAV, описанных в данном документе, может зависеть от необходимого распределения, эффективности трансдукции и требуемого нацеливания на клетки. Как описано Sorrentino et al. (comprehensive map of CNS transduction by eight adeno-associated virus serotypes upon cerebrospinal fluid administration in pigs, Molecular Therapy accepted article preview online 07 December 2015; doi: 10.1038/mt.2015.212; содержание которого включено в данный документ посредством ссылки во всей своей полноте), серотипы AAV обеспечивали различное распределение, эффективность трансдукции и нацеливание на клетки. Чтобы обеспечить необходимую эффективность, необходимо выбрать серотип AAV, который наилучшим образом соответствует не только клеткам-мишеням, но также необходимой эффективности трансдукции и распределению.
[00337] В одном варианте осуществления вектор на основе AAV содержит капсид AAV9 (как описано в данном документе) и векторную плазмиду на основе AAV, содержащую (1) ITR, полученные из AAV2, (2) энхансер CMV (например, SEQ ID NO: 134), (3) промотор CBA (например, SEQ ID NO: 135), (4) интрон SV40 (например, SEQ ID NO: 137), (5) полинуклеотид, кодирующий антитело к hTREM2 или его антигенсвязывающий фрагмент (например, как описано в данном документе), и (6) сигнал поли-A BGH (например, SEQ ID NO: 138). В одном варианте осуществления элементы (2)-(6) расположены в векторной плазмиде на основе AAV в направлении от 5' до 3'. В вариантах осуществления элементы (2)-(6) расположены в векторной плазмиде на основе AAV между 5'-ITR и 3'-ITR. В одном варианте осуществления вектор на основе AAV представляет собой вектор на основе scAAV.
Получение моноклональных антител
[00338] Моноклональные антитела (mAb) можно получать с помощью ряда методик, в том числе традиционного способа получения моноклональных антител, например, стандартной методики гибридизации соматических клеток по Kohler and Milstein, 1975 Nature 256: 495. Можно использовать множество методик получения моноклонального антитела, например, вирусную или онкогенную трансформацию B-лимфоцитов.
[00339] Животная система для получения гибридом представляет собой мышиную систему. Получение гибридомы в организме мыши является хорошо отработанной процедурой. Протоколы иммунизации и методики выделения иммунизированных спленоцитов для слияния известны из уровня техники. Партнеры по слиянию (например, клетки миеломы мыши) и процедуры слияния также являются известными.
[00340] В некоторых вариантах осуществления антитела по настоящему изобретению представляют собой гуманизированные моноклональные антитела. Химерные или гуманизированные антитела и их антигенсвязывающие фрагменты по настоящему изобретению можно получить, исходя из последовательности моноклонального антитела мыши, полученного согласно описанному выше. ДНК, кодирующую тяжелую и легкую цепи иммуноглобулинов, можно получить из мышиной гибридомы, представляющей интерес, и сконструировать таким образом, чтобы она содержала последовательности иммуноглобулинов, отличные от мышиных (например, человеческие), с применением стандартных методик молекулярной биологии. Например, для создания химерного антитела мышиные вариабельные области можно связать с человеческими константными областями с применением способов, известных из уровня техники (см., например, патент США №4816567 авторства Cabilly et al.). Для создания гуманизированного антитела мышиные CDR-области мыши можно вставить в человеческую каркасную область с применением способов, известных из уровня техники. См., например, патент США №5225539 авторства Winter и патенты США №№5530101; 5585089; 5693762 и 6180370 авторства Queen et al.
[00341] В некоторых вариантах осуществления антитела по настоящему изобретению представляют собой человеческие моноклональные антитела. Такие человеческие моноклональные антитела, направленные против TREM2, можно получать с использованием трансгенных или трансхромосомных мышей, несущих части человеческой иммунной системы вместо мышиной системы. Эти трансгенные и трансхромосомные мыши включают мышей, называемых в данном документе соответственно мыши HuMAb и мыши KM, и их совокупно называют в данном документе "мышами с Ig человека"
[00342] Мышь HuMAb® (Medarex, Inc.) содержит минилокусы генов человеческих иммуноглобулинов, которые кодируют не подвергшиеся перегруппировке последовательности тяжелых цепей (мю и гамма) и каппа-легкой цепи иммуноглобулина человека, вместе с целенаправленными мутациями, которые инактивируют эндогенные локусы мю- и каппа-цепей (см., например, Lonberg, et al., 1994 Nature 368 (6474): 856-859). Соответственно, мыши проявляют сниженную экспрессию IgM или K мыши, и в ответ на иммунизацию введенные трансгены, кодирующие человеческие тяжелые и легкие цепи, подвергаются переключению класса и соматической мутации с получением высокоаффинного моноклонального IgG-каппа человека (Lonberg, N. et al., 1994, выше; обзор в Lonberg, N., 1994 Handbook of Experimental Pharmacology 113:49-101; Lonberg, N. and Huszar, D., 1995 Intern. Rev. Immunol. 13: 65-93, и Harding, F. and Lonberg, N., 1995 Ann. N.Y. Acad. Sci. 764:536-546). Получение и использование мышей HuMAb, а также геномные модификации, которые несут такие мыши, дополнительно описываются в Taylor, L. et al., 1992 Nucleic Acids Research 20:6287-6295; Chen, J. et al., 1993 International Immunology 5: 647-656; Tuaillon et al., 1993 Proc. Natl. Acad. Sci. USA 94:3720-3724; Choi et al., 1993 Nature Genetics 4:117-123; Chen, J. et al., 1993 EMBO J. 12: 821-830; Tuaillon et al., 1994 J. Immunol. 152:2912-2920; Taylor, L. et al., 1994 International Immunology 579-591; и Fishwild, D. et al., 1996 Nature Biotechnology 14: 845-851, содержание всех из которых конкретно включено в данный документ посредством ссылки во всей их полноте. См. также патенты США №№5545806; 5569825; 5625126; 5633425; 5789650; 5877397; 5661016; 5814318; 5874299 и 5770429; все авторства Lonberg и Kay; патент США №5545807 авторства Surani et al.; PCT-публикации №№ WO 92103918, WO 93/12227, WO 94/25585, WO 97113852, WO 98/24884 и WO 99/45962, все авторства Lonberg и Kay; и PCT-публикацию № WO 01/14424 авторства Korman et al.
[00343] В некоторых вариантах осуществления продуцирование человеческих антител по настоящему изобретению можно осуществлять с использованием мыши, которая несет последовательности человеческих иммуноглобулинов в трансгенах и трансхромосомах, как, например, мыши, которая несет трансген, кодирующий человеческую тяжелую цепь, и трансхромосому, кодирующую человеческую легкую цепь. Такие мыши, называемые в данном документе "мышами KM", подробно описаны в PCT-публикации WO 02/43478 авторства Ishida et al.
[00344] Более того, альтернативные трансгенные животные системы, экспрессирующие гены человеческих иммуноглобулинов, являются доступными из уровня техники, и их можно использовать для продуцирования TREM2-связывающих антител и их антигенсвязывающих фрагментов. Например, можно использовать альтернативную трансгенную систему, называемую Xenomouse (Abgenix, Inc.). Такие мыши описаны, например, в патентах США №№5939598; 6075181; 6114598; 6150584 и 6162963 авторства Kucherlapati et al.
[00345] Более того, альтернативные трансхромосомные животные системы, экспрессирующие гены человеческих иммуноглобулинов, являются доступными из уровня техники, и их можно использовать для продуцирования TREM2-связывающих антител по настоящему изобретению. Например, можно использовать мышей, несущих как трансхромосому, кодирующую человеческую тяжелую цепь, так и трансхромосому, кодирующую человеческую легкую цепь, называемых "мышами TC"; такие мыши описаны в Tomizuka et al., 2000 Proc. Natl. Acad. Sci. USA 97:722-727. Кроме того, коровы, несущие трансхромосомы тяжелой и легкой цепей человека, были описаны в уровне техники (Kuroiwa et al., 2002 Nature Biotechnology 20:889-894), и их можно использовать для получения TREM2-связывающих антител по настоящему изобретению.
[00346] Человеческие моноклональные антитела также можно получать с применением способов фагового дисплея для скрининга библиотек генов человеческих иммуноглобулинов. Такие способы фагового дисплея для выделения человеческих антител определены в уровне техники или описаны в примерах ниже. См., например, патенты США №№5223409; 5403484 и 5571698 авторства Ladner et al; патенты США №№5427908 и 5580717 авторства Dower et al; патенты США №№5969108 и 6172197 авторства McCafferty et al. и патенты США №№5885793; 6521404; 6544731; 6555313; 6582915 и 6593081 авторства Griffiths et al.
[00347] Человеческие моноклональные антитела по настоящему изобретению также можно получать с использованием мышей SCID, которым были перенесены человеческие иммунные клетки таким образом, что после иммунизации может формироваться ответ с образованием человеческих антител. Такие мыши описаны, например, в патентах США №№5476996 и 5698767 авторства Wilson et al.
Конструирование каркасной области или Fc
[00348] Сконструированные антитела и их антигенсвязывающие фрагменты по настоящему изобретению включают те, в которых были осуществлены модификации в остатках каркасных областей в пределах VH и/или VL, например, для улучшения свойств антитела. Как правило, такие модификации каркасных областей осуществляют для уменьшения иммуногенности антитела. Например, один подход заключается в осуществлении "обратной мутации" одного или нескольких остатков каркасных областей с восстановлением соответствующей последовательности зародышевого типа. Более конкретно, антитело, которое подверглось соматической мутации, может содержать остатки каркасных областей, которые отличаются от последовательности зародышевого типа, из которой получено антитело. Такие остатки могут быть идентифицированы посредством сравнения последовательностей каркасных областей антитела с последовательностями зародышевого типа, из которых получено антитело. Для возвращения последовательностей каркасных областей к их конфигурации зародышевого типа можно осуществлять "обратные" соматические мутации с восстановлением последовательности зародышевого типа посредством, например, сайт-направленного мутагенеза. Также предполагается, что такие "подвергнутые обратной мутации" антитела охватываются настоящим изобретением.
[00349] Другой тип модификации каркасной области предусматривает мутацию одного или нескольких остатков в пределах каркасной области или даже в пределах одной или нескольких CDR-областей для удаления T-клеточных эпитопов со снижением таким образом потенциальной иммуногенности антитела. Данный подход также называется "деиммунизацией" и более подробно описан в публикации заявки на патент США №20030153043 авторства Carr et al.
[00350] В качестве дополнения или альтернативы модификациям, осуществляемым в пределах каркасных или CDR-областей, антитела по настоящему изобретению можно конструировать таким образом, чтобы они содержали модификации в пределах Fc-области, как правило, для изменения одного или нескольких функциональных свойств антитела, таких как период полужизни в сыворотке крови, фиксация комплемента, связывание с Fc-рецептором и/или антигензависимая клеточная цитотоксичность. Кроме того, антитело по настоящему изобретению может быть химически модифицировано (например, к антителу могут быть присоединены один или несколько химических компонентов), или оно может быть модифицировано с изменением характера его гликозилирования, опять-таки для изменения одного или нескольких функциональных свойств антитела. Каждый из этих вариантов осуществления более подробно описан ниже. Нумерация остатков в Fc-области производится согласно EU-индексу по Kabat.
[00351] В одном варианте осуществления шарнирную область CH1 модифицируют таким образом, что изменяется число цистеиновых остатков в шарнирной области, например, увеличивается или уменьшается. Этот подход дополнительно описан в патенте США №5677425 авторства Bodmer et al. Число цистеиновых остатков в шарнирной области CH1 изменяют, например, с целью облегчения сборки легких и тяжелых цепей или с целью увеличения или уменьшения стабильности антитела.
[00352] В другом варианте осуществления фрагмент Fc-шарнирная область антитела подвергают мутации для уменьшения биологического периода полужизни антитела. Более конкретно, одну или несколько аминокислотных мутаций вводят в область контакта между доменами CH2-CH3 фрагмента Fc-шарнирная область, вследствие чего антитело характеризуется нарушенным связыванием с белком A стафилококка (SpA) по сравнению со связыванием нативного домена Fc-шарнирная область с SpA. Этот подход описан более подробно в патенте США №6165745 авторства Ward et al.
[00353] В другом варианте осуществления антитело модифицируют для увеличения его биологического периода полужизни. Возможны различные подходы. Например, можно вводить одну или несколько из следующих мутаций: T252L, T254S, T256F, как описано в патенте США №6277375 авторства Ward. В качестве альтернативы для увеличения биологического периода полужизни антитело можно изменить в пределах CH1- или CL-области таким образом, чтобы оно содержало эпитоп связывания рецептора реутилизации, образованный двумя петлями CH2-домена Fc-области IgG, как описано в патентах США №№5869046 и 6121022 авторства Presta et al.
[00354] В одном варианте осуществления Fc-область изменяют посредством замены по меньшей мере одного аминокислотного остатка другим аминокислотным остатком с целью изменения эффекторных функций антитела. Например, одну или несколько аминокислот можно заменить другим аминокислотным остатком таким образом, чтобы антитело характеризовалось измененной аффинностью в отношении эффекторного лиганда, но сохраняло способность к связыванию с антигеном исходного антитела. Эффекторный лиганд, аффинность в отношении которого изменяют, может представлять собой, например, Fc-рецептор или компонент C1 системы комплемента. Этот подход описан более подробно в патентах США №№5624821 и 5648260, оба авторства Winter et al.
[00355] В другом варианте осуществления одну или несколько аминокислот, выбранных из аминокислотных остатков, можно заменить другим аминокислотным остатком таким образом, чтобы антитело характеризовалось измененным связыванием с C1q и/или сниженной или устраненной комплементзависимой цитотоксичностью (CDC). Этот подход описан более подробно в патенте США №6194551 авторства Idusogie et al.
[00356] В другом варианте осуществления один или несколько аминокислотных остатков изменяют, чтобы таким образом изменить способность антитела к фиксации комплемента. Этот подход дополнительно описан в PCT-публикации WO 94/29351 авторства Bodmer et al.
[00357] В некоторых вариантах осуществления TREM2-связывающая молекула содержит константную область IgG1 человека. В некоторых вариантах осуществления константная область IgG1 человека включает Fc-область.
[00358] В некоторых вариантах осуществления Fc-область TREM2-связывающих молекул содержит одну или несколько мутаций, опосредующих сниженную или отсутствующую антителозависимую клеточную цитотоксичность (ADCC) или комплементзависимую цитотоксичность (CDC). В некоторых вариантах осуществления аминокислотные остатки L234 и L235 в константной области IgG1 заменены на A234 и A235. В некоторых вариантах осуществления аминокислотный остаток N267 в константной области IgG1 заменен на A267. В некоторых вариантах осуществления аминокислотные остатки D265 и P329 в константной области IgG1 заменены на A265 и A329. В определенных вариантах осуществления Fc-область необязательно содержит мутацию или комбинацию мутаций, обусловливающих сниженную эффекторную функцию, выбранных из любой из D265A, P329A, P329G, N297A, D265A/P329A, D265A/N297A, L234/L235A, P329A/L234A/L235A и P329G/L234A/L235A. В некоторых вариантах осуществления Fc-область содержит мутацию или комбинацию мутаций, обусловливающих сниженную эффекторную функцию, выбранных из любой из D265A, P329A, P329G, N297A, D265A/P329A, D265A/N297A, L234/L235A, P329A/L234A/L235A и P329G/L234A/L235A (все положения согласно нумерации EU).
[00359] В еще одном варианте осуществления Fc-область модифицируют для увеличения способности антитела опосредовать антителозависимую клеточную цитотоксичность (ADCC) и/или для увеличения аффинности антитела в отношении Fc-гамма-рецептора посредством модификации одной или нескольких аминокислот. Этот подход дополнительно описан в PCT-публикации WO 00/42072 авторства Presta. Более того, связывающие участки в IgG1 человека для Fc-гамма RI, Fc-гамма RII, Fc-гамма RIII и FcRn были картированы, и были описаны варианты с улучшенным связыванием (см. Shields, R.L. et al., 2001 J. Biol. Chem. 276:6591-6604). Например, Fc-область может содержать мутацию или комбинацию мутаций, обусловливающих повышенную эффекторную функцию, выбранных из любой из S239D, I332E, A330L, S298A, E333A, E333S, K334A, K236A, K236W, F243L, P247I, D280H, K290S, R292P, S298D, S298V, Y300L, V305I, A339D, A339Q, A339T, P396L (все положения согласно нумерации EU).
[00360] В еще одном варианте осуществления модифицируют характер гликозилирования антитела. Например, может быть получено агликозилированное антитело (т.е. антитело без гликозилирования). Характер гликозилирования можно изменять, например, для увеличения аффинности антитела в отношении антигена. Такие модификации углеводов можно осуществлять, например, посредством изменения одного или нескольких сайтов гликозилирования в пределах последовательности антитела. Например, можно произвести одну или несколько аминокислотных замен, которые приводят к устранению одного или нескольких сайтов гликозилирования в каркасной части вариабельной области, устраняя таким образом гликозилирование в этом сайте. Такое агликозилирование может увеличивать аффинность антитела в отношении антигена. Такой подход описан более подробно в патентах США №№5714350 и 6350861 авторства Co et al.
[00361] Дополнительно или в качестве альтернативы может быть получено антитело, которое характеризуется измененным типом гликозилирования, как, например, гипофукозилированное антитело, имеющее уменьшенные количества фукозильных остатков, или антитело, имеющее увеличенное содержание структур с остатком GlcNAc в точке ветвления. Было продемонстрировано, что такие измененные паттерны гликозилирования увеличивают способность антител к ADCC. Такие модификации углеводов можно осуществлять, например, посредством экспрессии антитела в клетке-хозяине с измененным механизмом гликозилирования. Клетки с измененным механизмом гликозилирования были описаны в уровне техники, и их можно использовать в качестве клеток-хозяев, в которых экспрессируются рекомбинантные антитела по настоящему изобретению, с получением таким образом антитела с измененным характером гликозилирования. Например, в EP 1176195 авторства Hang et al. описывается линия клеток с функциональным нарушением гена FUT8, который кодирует фукозилтрансферазу, вследствие чего антитела, экспрессирующиеся в такой линии клеток, демонстрируют гипофукозилирование. В PCT-публикации WO 03/035835 авторства Presta описывается вариант линии клеток CHO - клетки Lecl3 с пониженной способностью к присоединению фукозы к углеводам, связанным с Asn(297), что также приводит к гипофукозилированию антител, экспрессирующихся в такой клетке-хозяине (см. также Shields, R.L. et al., 2002 J. Biol. Chem. 277:26733-26740). В PCT-публикации WO 99/54342 авторства Umana et al. описываются линии клеток, сконструированные для экспрессии гликозилтрансфераз, модифицирующих гликопротеины (например, бета-(1,4)-N-ацетилглюкозаминилтрансферазы III (GnTIII)), благодаря чему антитела, экспрессирующиеся в сконструированных линиях клеток, демонстрируют увеличенное содержание структур с остатком GlcNAc в точке ветвления, что приводит к увеличению активности ADCC у антител (см. также Umana et al., 1999 Nat. Biotech. 17:176-180).
[00362] В некоторых вариантах осуществления TREM2-связывающая молекула представляет собой антитело. В некоторых вариантах осуществления антитело относится к изотипу IgG1 с одной или несколькими мутациями (например, по сравнению с Fc-областью дикого типа того же изотипа). В некоторых вариантах осуществления одна или несколько мутаций выбраны из N297A, N297Q (BoltS et al. (1993) Eur J Immunol 23:403-411), D265A, L234A, L235A (McEarchern et al., (2007) Blood, 109:1185-1192), C226S, C229S (McEarchern et al., (2007) Blood, 109:1185-1192), P238S (Davis et al., (2007) J Rheumatol, 34:2204-2210), E233P, L234V (McEarchern et al., (2007) Blood, 109:1185-1192), P238A, A327Q, A327G, P329A (Shields RL. et al., (2001) J Biol Chem. 276(9):6591-604), K322A, L234F, L235E (Hezareh, et al., (2001) J Viral 75, 12161-12168; Oganesyan et al., (2008). Acta Crystallographica 64, 700-704), P331S (Oganesyan et al., (2008) Acta Crystallographica 64, 700-704), T394D (Wilkinson et al. (2013) MAbs 5(3): 406-417), A330L, M252Y, S254T и/или T256E, где положение аминокислоты указано в соответствии с системой нумерации EU или Kabat. В определенных вариантах осуществления Fc-область дополнительно содержит аминокислотную делецию в положении, соответствующем глицину 236 в соответствии с системой нумерации EU или Kabat.
[00363] В некоторых вариантах осуществления антитело относится к изотипу IgG1 и имеет константную область тяжелой цепи, которая содержит мутацию C220S в соответствии с системой нумерации EU или Kabat.
[00364] В некоторых вариантах осуществления Fc-область дополнительно содержит одну или несколько дополнительных мутаций, выбранных из A330L, L234F; L235E и/или P331S в соответствии с системой нумерации EU или Kabat.
[00365] В определенных вариантах осуществления антитело относится к изотипу IgG2. В некоторых вариантах осуществления антитело содержит константную область IgG2 человека. В некоторых вариантах осуществления константная область IgG2 человека включает в себя Fc-область. В некоторых вариантах осуществления Fc-область содержит одну или несколько модификаций. Например, в некоторых вариантах осуществления Fc-область содержит одну или несколько мутаций (например, по сравнению с Fc-областью дикого типа того же изотипа). В некоторых вариантах осуществления одна или несколько мутаций выбраны из V234A, G237A, H268E, V309L, N297A, N297Q, A330S, P331S, C232S, C233S, M252Y, S254T и/или T256E, где положение аминокислоты соответствует системе нумерации EU или Kabat.
[00366] В определенных вариантах осуществления антитело относится к изотипу IgG4. В некоторых вариантах осуществления антитело содержит константную область IgG4 человека. В некоторых вариантах осуществления константная область IgG4 человека включает в себя Fc-область. В некоторых вариантах осуществления Fc-область содержит одну или несколько модификаций. Например, в некоторых вариантах осуществления Fc-область содержит одну или несколько мутаций (например, по сравнению с Fc-областью дикого типа того же изотипа). В некоторых вариантах осуществления одна или несколько мутаций выбраны из E233P, F234V, L235A, G237A, E318A (Hutchins et al. (1995) Proc Nat/ A cad Sci USA, 92:11980-11984), S228P, L236E, S241P, L248E (Reddy et al., (2000) J Immuno/,164:1925-1933; Angal et al., (1993) Mol Immunol. 30(1):105-8; US 8614299 B2), T394D, M252Y, S254T, T256E, N297A и/или N297Q, где положение аминокислот соответствует системе нумерации EU или Kabat.
[00367] В некоторых вариантах осуществления Fc-область дополнительно содержит одну или несколько дополнительных мутаций, выбранных из M252Y, S254T и/или T256E, где положение аминокислоты указано в соответствии с системой нумерации EU или Kabat.
[00368] В некоторых вариантах осуществления один или несколько вариантов IgG1, описанных в данном документе, можно использовать в комбинации с мутацией A330L (Lazar et al., (2006) Proc Natl Acad Sci USA, 103:4005-4010) или одной или несколькими из мутаций L234F, L235E и/или P331S (Sazinsky et al., (2008) Proc Natl Acad Sci USA, 105:20167-20172), где положение аминокислоты указано в соответствии с системой нумерации EU или Kabat, для устранения активации комплемента. В некоторых вариантах осуществления варианты IgG, описанные в данном документе, можно использовать в комбинации с одной или несколькими мутациями для улучшения периода полужизни антитела в сыворотке крови человека (например, мутациями M252Y, S254T, T256E в соответствии с системой нумерации EU или Kabat) (Dall' Acqua et al., (2006) J Biol Chem, 281:23514-23524; and Strohl e al., (2009) Current Opinion in Biotechnology, 20:685-691).
[00369] В некоторых вариантах осуществления вариант IgG4 по настоящему изобретению можно использовать в комбинации с мутацией S228P в соответствии с системой нумерации EU или Kabat (Angal et al., (1993) Mol Immunol, 30:105-108) и/или с одной или несколькими мутациями, описанными в Peters et al., (2012) J Biol Chem. 13;287(29):24525-33) для усиления стабилизации антител.
[00370] В некоторых вариантах осуществления антитело имеет Fc-область, выбранную из Fc-области IgG2, Fc-области IgG4 или гибридной Fc-области IgG2/IgG4.
Способы конструирования измененных антител
[00371] Как обсуждается выше, TREM2-связывающие антитела, имеющие последовательности VH и VL или последовательности полноразмерной тяжелой и легкой цепей, показанные в данном документе, можно использовать для создания новых TREM2-связывающих антител путем модификации последовательностей полноразмерной тяжелой цепи и/или легкой цепи, последовательностей VH и/или VL или константной(-ых) области(-ей), присоединенной(-ых) к ним. Таким образом, в другом аспекте настоящего изобретения структурные признаки TREM2-связывающего антитела по настоящему изобретению используются для создания структурно родственных TREM2-связывающих антител, которые сохраняют по меньшей мере одно функциональное свойство антител и их антигенсвязывающих фрагментов по настоящему изобретению, такое как связывание с TREM2 человека и его стабилизация.
[00372] Например, одну или несколько CDR-областей антител и их антигенсвязывающих фрагментов по настоящему изобретению или их мутантных вариантов можно объединить рекомбинантным путем с известными каркасными областями и/или другими CDR с созданием дополнительных сконструированных рекомбинантным путем TREM2-связывающих антител и их антигенсвязывающих фрагментов по настоящему изобретению, как обсуждается выше. Другие типы модификаций включают модификации, описанные в предыдущем разделе. Исходным материалом для способа конструирования является одна или несколько из последовательностей VH и/или VL, предусмотренных в данном документе, или одна или несколько их CDR-областей. Для создания сконструированного антитела не обязательно фактически получать (т.е. экспрессировать в виде белка) антитело, имеющее одну или несколько последовательностей VH и/или VL, предусмотренных в данном документе, или одну или несколько их CDR-областей. Скорее, информацию, содержащуюся в последовательности(-ях), применяют в качестве исходного материала для создания последовательности(-ей) "второго поколения", полученных из исходной(-ых) последовательности(-ей), а затем последовательность(-и) "второго поколения" получают и экспрессируют в виде белка.
[00373] Измененную последовательность антитела также можно получить посредством скрининга библиотек антител, имеющих фиксированные последовательности CDR3 или минимальные необходимые детерминанты связывания, которые описаны в US 20050255552, и разнообразные последовательности CDR1 и CDR2. Скрининг можно осуществлять согласно любой технологии скрининга, подходящей для скрининга антител из библиотек антител, как, например, технологии фагового дисплея.
[00374] Стандартные методики молекулярной биологии можно применять для получения и экспрессии измененной последовательности антитела. Антитело, кодируемое измененной(-ыми) последовательностью(-ями) антитела, представляет собой антитело, которое сохраняет одно, некоторые или все из функциональных свойств TREM2-связывающих антител, описанных в данном документе, при этом данные функциональные свойства включают без ограничения специфичное связывание с белком TREM2 человека и его стабилизацию.
[00375] Функциональные свойства измененных антител можно оценить с помощью стандартных анализов, доступных из уровня техники и/или описанных в данном документе, таких как анализы, изложенные в разделе "Примеры" (например, разновидности ELISA).
[00376] В некоторых вариантах осуществления способов конструирования антител и их антигенсвязывающих фрагментов по настоящему изобретению мутации можно вводить произвольным или избирательным образом по всей последовательности, кодирующей TREM2-связывающее антитело, или ее части, и полученные модифицированные TREM2-связывающие антитела можно подвергнуть скринингу в отношении активности связывания и/или других функциональных свойств, описанных в данном документе. Способы введения мутаций были описаны в уровне техники. Например, в публикации согласно PCT WO 02/092780 за авторством Short описываются способы создания и скрининга мутантных вариантов антител с применением насыщающего мутагенеза, сборки с лигированием синтезированных фрагментов или их комбинации. В качестве альтернативы в публикации согласно PCT WO 03/074679 за авторством Lazar et al. описываются способы применения способов компьютерного скрининга для оптимизации физико-химических свойств антител.
Определение характеристик антител по настоящему изобретению
[00377] Характеристики антител и их антигенсвязывающих фрагментов по настоящему изобретению могут быть определены с помощью различных функциональных анализов. Например, их можно характеризовать по их способности к связыванию и стабилизации TREM2.
[00378] Способность антитела к связыванию с TREM2 можно выявить посредством непосредственного мечения антитела, представляющего интерес, или антитело может быть немеченым, и связывание выявляют косвенно с применением различных форматов сэндвич-анализов, известных из уровня техники.
[00379] В некоторых вариантах осуществления TREM2-связывающие антитела и их антигенсвязывающие фрагменты по настоящему изобретению блокируют связывание эталонного TREM2-связывающего антитела с полипептидом TREM2 или конкурируют с ним за связывание. Они могут представлять собой полностью человеческие или гуманизированные TREM2-связывающие антитела, описанные выше. Они также могут представлять собой другие человеческие, мышиные, химерные или гуманизированные TREM2-связывающие антитела, которые связываются с тем же эпитопом, что и эталонное антитело. Способность к блокированию связывания эталонного антитела или конкуренции с ним за это связывание указывает на то, что тестируемое TREM2-связывающее антитело связывается с тем же или сходным эпитопом по сравнению с эпитопом, определяемым эталонным антителом, или с эпитопом, который расположен достаточно близко к эпитопу, с которым связывается эталонное TREM2-связывающее антитело. Особенно вероятно, что такие антитела обладают преимущественными свойствами, идентифицированными для эталонного антитела. Способность к блокированию эталонного антитела или конкуренции с ним можно определить, например, с помощью конкурентного анализа связывания. В конкурентном анализе связывания тестируемое антитело оценивают в отношении способности к ингибированию специфического связывания эталонного антитела с общим антигеном, таким как полипептид TREM2. Тестируемое антитело конкурирует с эталонным антителом за специфичное связывание с антигеном, если избыток тестируемого антитела осуществляет значительное ингибирование связывания эталонного антитела. Значительное ингибирование означает, что тестируемое антитело обычно снижает специфичное связывание эталонного антитела на по меньшей мере 10%, 25%, 50%, 75% или 90%.
[00380] Существует ряд известных конкурентных анализов связывания, которые можно применять для оценки конкуренции антитела с эталонным антителом за связывание с конкретным белком, в данном случае с TREM2. Они включают, например, твердофазный прямой или непрямой радиоиммунологический анализ (RIA), твердофазный прямой или непрямой иммуноферментный анализ (EIA), конкурентный сэндвич-анализ (см. Stahli et al., Methods in Enzymology 9:242-253, 1983); твердофазный прямой EIA с использованием комплекса биотин-авидин (см. Kirkland et al., J. Immunol. 137:3614-3619, 1986); твердофазный анализ с прямым мечением, твердофазный сэндвич-анализ с прямым мечением (см. Harlow & Lane, выше); твердофазный RIA с прямым мечением с использованием метки I-125 (см. Morel et al., Mol. Immunol. 25:7-15, 1988); твердофазный прямой EIA с использованием комплекса биотин-авидин (Cheung et al., Virology 176:546-552, 1990) и RIA с прямым мечением (Moldenhauer et al., Scand. J. Immunol. 32:77-82, 1990). Как правило, такой анализ включает применение очищенного антигена, связанного с твердой поверхностью, или клеток, несущих любой из них, немеченого тестируемого TREM2-связывающего антитела и меченого эталонного антитела. Конкурентное ингибирование измеряют путем определения количества метки, связавшейся с твердой поверхностью или клетками в присутствии тестируемого антитела. Обычно тестируемое антитело присутствует в избытке. Антитела, идентифицируемые с помощью конкурентного анализа (конкурирующие антитела), включают в себя антитела, связывающиеся с тем же эпитопом, что и эталонное антитело, и антитела, связывающиеся со смежным эпитопом, который расположен достаточно близко к эпитопу, с которым связывается эталонное антитело, чтобы имело место стерическое несоответствие.
[00381] Для определения того, связываются ли выбранные TREM2-связывающие моноклональные антитела с уникальными эпитопами, каждое антитело можно биотинилировать с помощью коммерчески доступных реагентов (например, реагентов от Pierce, Рокфорд, Иллинойс, США). Конкурентные исследования с применением немеченых моноклональных антител и биотинилированных моноклональных антител можно осуществлять с применением покрытых полипептидом TREM2 планшетов для ELISA. Связывание биотинилированного MAb можно выявить с помощью зонда на основе стрептавидина и щелочной фосфатазы. Для определения изотипа очищенного TREM2-связывающего антитела можно выполнять разновидности ELISA с определением изотипа. Например, лунки микротитровальных планшетов можно покрывать 1 мкг/мл антитела к IgG человека в течение ночи при 4 градусах C. После блокирования с помощью 1% BSA планшеты приводят в реакцию с моноклональным TREM2-связывающим антителом в концентрации 1 мкг/мл или меньше или очищенными изотипическими контролями при температуре окружающей среды в течение одного-двух часов. Затем содержимое лунок можно приводить в реакцию со специфическими в отношении IgG1 человека либо IgM человека зондами, конъюгированными со щелочной фосфатазой. Планшеты затем проявляют и анализируют таким образом, чтобы можно было определить изотип очищенного антитела.
[00382] Для демонстрации связывания моноклональных TREM2-связывающих антител с живыми клетками, экспрессирующими полипептид TREM2, можно использовать проточную цитометрию. Вкратце, линии клеток, экспрессирующие TREM2 (выращиваемые при стандартных условиях выращивания), можно смешивать с различными концентрациями TREM2-связывающего антитела в PBS, содержащем 0,1% BSA и 10% фетальной телячьей сыворотки, и инкубировать при 37 градусах °C в течение 1 часа. После промывания клетки приводят в реакцию с меченым флуоресцеином антителом к IgG человека при тех же условиях, что и при окрашивании первичным антителом. Образцы можно анализировать с помощью прибора FACScan с использованием свойств светорассеяния и бокового рассеяния в целях гейтирования по отдельным клеткам. Можно применять альтернативный анализ с использованием флуоресцентной микроскопии (в дополнение к анализу или вместо анализа) методом проточной цитометрии. Клетки можно окрашивать точно так же, как описано выше, и исследовать с помощью флуоресцентной микроскопии. Этот способ позволяет визуализировать отдельные клетки, однако может характеризоваться сниженной чувствительностью в зависимости от плотности антигена.
[00383] TREM2-связывающие антитела и их антигенсвязывающие фрагменты по настоящему изобретению можно дополнительно тестировать в отношении реакционной способности в отношении полипептида TREM2 или антигенного фрагмента с помощью вестерн-блоттинга. Вкратце, очищенные полипептиды TREM2 или слитые белки на его основе или клеточные экстракты из клеток, экспрессирующих TREM2, могут быть получены и подвергнуты электрофорезу в полиакриламидном геле с додецилсульфатом натрия. После электрофореза разделенные антигены переносят на нитроцеллюлозные мембраны, блокированные 10% фетальной телячьей сывороткой крови, и зондируют с помощью моноклональных антител, подлежащих тестированию. Связывание с IgG человека можно выявить с помощью антитела к IgG человека, конъюгированного с щелочной фосфатазой, и проявить с помощью субстрата BCIP/NBT в виде таблеток (Sigma Chem. Co., Сент-Луис, Миссури).
[00384] Примеры функциональных анализов также описаны в разделе Примеры ниже.
Способы лечения
[00385] В данном документе предусмотрены способы лечения заболевания, ассоциированного с потерей функции TREM2, с использованием описанных в данном документе TREM2-связывающих молекул. В некоторых вариантах осуществления заболевание, ассоциированное с потерей функции TREM2, представляет собой нейровоспалительное или нейродегенеративное заболевание, такое как болезнь Альцгеймера, лобно-височная деменция, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Насу-Хакола, рассеянный склероз, боковой амиотрофический склероз (ALS), энцефалит с антителами к NMDA-рецепторам, аутизм, волчанка головного мозга (NP-SLE), индуцированная химиотерапией периферическая нейропатия (CIPN), постгерпетическая невралгия, хроническая воспалительная демиелинизирующая полинейропатия (CIDP), эпилепсия, синдром Гийена-Барре (GBS), миозит с тельцами включения, лизосомные болезни накопления, например сфингомиелинлипидоз (Ниманна-Пика C) и мукополисахаридоз II/IIIB, метахроматическая лейкодистрофия, мультифокальная моторная нейропатия, миастения гравис, болезнь Бехчета с вовлечением нервных структур, оптиконейромиелит (NMO), неврит зрительного нерва, полимиозит, дерматомиозит, энцефалит Расмуссена, синдром Ретта, инсульт, поперечный миелит, травматическое повреждение головного мозга, повреждение спинного мозга, вирусный энцефалит или бактериальный менингит. В некоторых предпочтительных вариантах осуществления заболевание, ассоциированное с потерей функции TREM2, выбрано из списка, состоящего из болезни Альцгеймера, лобно-височной деменции, болезни Паркинсона, бокового амиотрофического склероза или болезни Насу-Хакола.
[00386] В данном документе также предусмотрены способы лечения связанного с TREM2 нарушения, прямо или косвенно ассоциированного с нарушенной активностью и/или экспрессией TREM2, с использованием описанных в данном документе TREM2-связывающих молекул. Связанные с TREM2 нарушения включают заболевания, связанные с ЦНС, заболевания, связанные с ПНС, системное воспаление и другие заболевания, связанные с воспалением, болью и симптомами синдрома отмены, вызванными злоупотреблением химическими веществами, заболевания или нарушения, связанные с ЦНС, включают генерализованные тревожные расстройства, когнитивные расстройства, дефициты и дисфункции обучения и памяти, болезнь Альцгеймера (легкой, умеренной и тяжелой степени), синдром дефицита внимания и гиперактивности, болезнь Паркинсона, деменцию при болезни Паркинсона, болезнь Хантингтона, ALS, прионные нейродегенеративные нарушения, такие как болезнь Крейтцфельдта-Якоба и болезнь куру, синдром Жиля де ла Туретта, психоз, депрессию и депрессивные расстройства, манию, маниакальную депрессию, шизофрению, когнитивные дефициты при шизофрении, обсессивно-компульсивные расстройства, панические расстройства, расстройства пищевого поведения, нарколепсию, ноцицепцию, ассоциированную со СПИДом деменцию, сенильную деменцию, легкое когнитивное нарушение, связанное с возрастом (MCI), нарушение памяти, связанное с возрастом, аутизм, дислексию, позднюю дискинезию, эпилепсию и судорожные расстройства, посттравматические стрессовые расстройства, временную гипоксию, псевдодеменцию, предменструальный синдром, синдром поздней лютеиновой фазы, синдром хронической усталости и синдром смены часовых поясов. В некоторых предпочтительных вариантах осуществления связанные с TREM2 нарушения выбраны из списка, состоящего из болезни Альцгеймера, лобно-височной деменции, болезни Паркинсона, бокового амиотрофического склероза или болезни Насу-Хакола.
[00387] Связанные с TREM2 нарушения также включают: иммунологические нарушения, особенно включающие воспалительные нарушения (например, бактериальная инфекция, грибковая инфекция, вирусная инфекция, инфекция, вызванная простейшими, или другая паразитарная инфекция, псориаз, септицемия, церебральная малярия, воспалительное заболевание кишечника, артрит, такой как ревматоидный артрит, фолликулит, импетиго, гранулемы, липоидные пневмонии, васкулит и остеоартрит), аутоиммунные нарушения (например, ревматоидный артрит, тиреоидит, такой как тиреоидит Хашимото и болезнь Грейвса, инсулинорезистентный диабет, пернициозная анемия, болезнь Аддисона, пузырчатка, витилиго, язвенный колит, системная красная волчанка (SLE), синдром Шегрена, рассеянный склероз, дерматомиозит, смешанное заболевание соединительной ткани, склеродермия, полимиозит, отторжение трансплантата, такое как отторжение аллотрансплантата), T-клеточные нарушения (например, AIDS), аллергические воспалительные нарушения (например, виды кожной аллергии и/или виды аллергии с вовлечением слизистых оболочек, такие как аллергический ринит, астма, псориаз), неврологические нарушения, нарушения со стороны органов зрения, эмбриональные нарушения или любые другие нарушения (например, опухоли, виды рака, лейкоз, миелоидные заболевания и травмы), которые непосредственно или опосредованно ассоциированы с нарушенной активностью и/или экспрессией TREM2.
[00388] В некоторых вариантах осуществления связанное с TREM2 нарушение представляет собой аутоиммунное, воспалительное или злокачественное нарушение, опосредованное или ассоциированное с избыточным протеолитическим расщеплением TREM2, или с клетками, экспрессирующими нарушенные или мутантные варианты рецептора TREM2. Примеры аутоиммунных заболеваний включают без ограничения артрит (например, ревматоидный артрит, хронический прогрессирующий артрит и деформирующий артрит) и ревматические заболевания, включающие воспалительные состояния, и ревматические заболевания, включающие потерю костной массы, боль при воспалительном процессе, спондилоартропатии, в том числе анкилозирующий спондилоартрит, болезнь Рейтера, реактивный артрит, псориатический артрит и энтеропатический артрит, гиперчувствительность (включающая как гиперчувствительность дыхательных путей, так и кожную гиперчувствительность) и виды аллергии. Аутоиммунные заболевания включают аутоиммунные гематологические нарушения (в том числе, например, гемолитическую анемию, апластическую анемию, эритробластопению и идиопатическую тромбоцитопению), системную красную волчанку, воспалительные мышечные нарушения, полихондрию, склеродермию, гранулематоз Вегенера, дерматомиозит, хронический активный гепатит, миастению гравис, псориаз, синдром Стивенса-Джонсона, идиопатический синдром мальабсорбции, эндокринную офтальмопатию, болезнь Грейвса, саркоидоз, рассеянный склероз, первичный билиарный цирроз, ювенильный диабет (сахарный диабет I типа), увеит (передний и задний), синдром сухого глаза и весенний кератоконъюнктивит, интерстициальный фиброз легких, псориатический артрит и гломерулонефрит (с нефротическим синдромом и без него, например, в том числе подагру, гистиоцитоз клеток Лангерганса, идиопатический нефротический синдром или нефропатию минимальных изменений), опухоли, воспалительное заболевание кожи и роговицы, миозит, потерю костных имплантатов, метаболические нарушения, такие как атеросклероз, диабет и дислипидемия.
[00389] В некоторых вариантах осуществления связанное с TREM2 нарушение выбрано из астмы, бронхита, пневмокониоза, эмфиземы легких, других обструктивных или воспалительных заболеваний дыхательных путей, включая идиопатический фиброз легких или COPD.
[00390] В некоторых вариантах осуществления связанное с TREM2 нарушение представляет собой злокачественное нарушение, затрагивающее органы кроветворения или печень, такое как острый миелоидный лейкоз, хронический миелоидный лейкоз, миелопролиферативные нарушения, миелодиспластические синдромы, множественная миелома, пароксизмальная ночная гемоглобинурия, анемия Фанкони, большая талассемия, синдром Вискотта-Олдрича, гемофагоцитарный лимфогистиоцитоз.
[00391] В некоторых вариантах осуществления связанное с TREM2 нарушение выбрано из астмы, энцефалита, воспалительного заболевания кишечника, хронического обструктивного заболевания легких (COPD), аллергических нарушений, септического шока, фиброза легких, недифференцированной спондилоартропатии, недифференцированной артропатии, артрита, воспалительного остеолиза или хронического воспаления в результате хронических вирусных или бактериальных инфекций.
[00392] В некоторых вариантах осуществления связанное с TREM2 нарушение выбрано из деменции, лобно-височной деменции, болезни Альцгеймера, сосудистой деменции, смешанной деменции, болезни Крейтцфельдта-Якоба, нормотензивной гидроцефалии, бокового амиотрофического склероза, болезни Хантингтона, таупатии, болезни Насу-Хакола, инсульта, острой травмы, хронической травмы, волчанки, острого и хронического колита, нарушения заживления ран, болезни Крона, воспалительного заболевания кишечника, язвенного колита, ожирения, малярии, эссенциального тремора, волчанки центральной нервной системы, болезни Бехчета, болезни Паркинсона, деменции с тельцами Леви, множественной системной атрофии, синдрома Шая-Дрейджера, прогрессирующего надъядерного паралича, кортикальной базальной ганглионарной дегенерации, острого рассеянного энцефаломиелита, гранулематозных нарушений, саркоидоза, заболеваний, связанных со старением, пароксизмальных судорог, повреждения спинного мозга, травматического повреждения головного мозга, возрастной макулярной дегенерации, глаукомы, пигментной дистрофии сетчатки, дегенерации сетчатки, инфекции дыхательных путей, сепсиса, глазной инфекции, системной инфекции, волчанки, артрита, рассеянного склероза, низкой плотности костной ткани, остеопороза, нарушения остеогенеза, остеопетроза, костной болезни Педжета и рака. В некоторых предпочтительных вариантах осуществления связанное с TREM2 нарушение выбрано из списка, состоящего из болезни Альцгеймера, лобно-височной деменции, болезни Паркинсона, бокового амиотрофического склероза или болезни Насу-Хакола.
[00393] В некоторых вариантах осуществления связанное с TREM2 нарушение выбрано из деменции, лобно-височной деменции, болезни Альцгеймера, болезни Насу-Хакола и рассеянного склероза. В некоторых предпочтительных вариантах осуществления связанное с TREM2 нарушение представляет собой деменцию, такую как лобно-височная деменция, болезнь Альцгеймера, болезнь Паркинсона, сосудистая деменция, семантическая деменция или деменция с тельцами Леви.
[00394] В некоторых вариантах осуществления такие способы включают введение нуждающемуся в лечении субъекту терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента, которые специфически связываются с доменом IgSF белка TREM2, например с аминокислотными остатками 19-132 из любой из SEQ ID NO: 1, 2 и 3, и стабилизируют белок TREM2.
[00395] В некоторых вариантах осуществления такие способы лечения заболевания, ассоциированного с потерей функции TREM2, включают: (1) анализ уровня TREM2 на клеточной поверхности в образце, полученном от субъекта, например образце спинномозговой жидкости, полученной от субъекта; (2) выбор субъекта, у которого уровень TREM2 на клеточной поверхности ниже эталонного уровня, где эталонный уровень представляет собой уровень TREM2 на клеточной поверхности в образце, полученном от здорового субъекта, например в образце спинномозговой жидкости, полученном от здорового субъекта; и (3) введение субъекту терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента, которое специфически связывается с доменом IgSF белка TREM2 и стабилизирует белок TREM2. Антитело или его антигенсвязывающий фрагмент, которые специфически связываются с доменом IgSF белка TREM2, могут стабилизировать белок TREM2 на клеточной поверхности и/или уменьшать шеддинг эктодомена белка TREM2. Эти антитела или их антигенсвязывающие фрагменты можно вводить субъекту пероральным, внутривенным, внутричерепным, интратекальным, подкожным или интраназальным путем. Уровень TREM2 на клеточной поверхности в образце можно определить с помощью анализа, известного из уровня техники, например с помощью проточной цитометрии, иммуногистохимического исследования, вестерн-блоттинга, иммунофлуоресцентного анализа, радиоиммуноанализа (RIA), твердофазного иммуноферментного анализа (ELISA), гомогенной флуоресценции с временным разрешением (HTRF), позитронно-эмиссионной томографии (PET) или любого другого иммунного выявления с антителом или фрагментом антитела к TREM2.
Виды комбинированной терапии
[00396] Различные способы лечения, описанные выше, можно объединять с другими способами лечения, такими как современный стандарт терапии ассоциированного с потерей функции TREM2 заболевания, например современный стандарт терапии болезни Альцгеймера, лобно-височной деменции, болезни Паркинсона, бокового амиотрофического склероза или болезни Насу-Хакола. Например, антитела к hTREM2 или их антигенсвязывающие фрагменты, описанные в данном документе, можно объединять с одним или несколькими из ингибиторов ВАСЕ, антител к тау-белку, антител к бета-амилоиду, финголимода, BG12, бета-интерферона или тисабри. Соответственно, способы лечения ассоциированного с потерей функции TREM2 заболевания, описанные в данном документе, могут дополнительно включать введение второго средства субъекту, нуждающемуся в лечении.
[00397] Термин "комбинация" означает либо фиксированную комбинацию в виде одной дозированной единицы, либо комбинированное введение, где соединение по настоящему изобретению и партнер по комбинации (например, другое лекарственное средство, которое поясняется ниже, также называемое "терапевтическим средством" или "совместно применяемым средством") можно вводить независимо в одно и то же время или по отдельности в пределах промежутков времени, особенно когда эти промежутки времени обеспечивают партнерам по комбинации возможность проявления кооперативного, например синергического, эффекта. Отдельные компоненты могут быть упакованы в набор или предоставлены по отдельности. Один или оба компонента (например, порошки или жидкости) могут быть восстановлены или разбавлены до необходимой дозы перед введением. Термины "совместное введение" или "комбинированное введение" или им подобные, используемые в данном документе, подразумеваются как охватывающие введение выбранного партнера по комбинации одному субъекту, нуждающемуся в этом (например, пациенту), и предполагают включение режимов лечения, в которых средства не обязательно вводят одним и тем же путем введения или в одно и то же время. Термин "фармацевтическая комбинация", используемый в данном документе, означает продукт, полученный в результате смешивания или комбинирования более чем одного терапевтического средства, который включает как фиксированные, так и нефиксированные комбинации терапевтических средств. Термин "фиксированная комбинация" означает, что оба терапевтические средства, например, соединение по настоящему изобретению и партнера по комбинации, вводят пациенту одновременно в виде единого объекта или дозы. Термин "нефиксированная комбинация" означает, что терапевтические средства, например соединение по настоящему изобретению и партнер по комбинации, оба вводят пациенту как отдельные объекты либо одновременно, параллельно либо последовательно без конкретных сроков, при этом такое введение обеспечивает терапевтически эффективные уровни двух соединений в организме пациента. Последнее также применяется в отношении "смешанной терапии", например при введении трех или более терапевтических средств.
[00398] Используемый в данном документе термин "фармацевтическая комбинация" относится к фиксированной комбинации в одной единичной лекарственной форме либо нефиксированной комбинации или набору из частей для комбинированного введения, где два или более терапевтических средства можно вводить независимо в одно и то же время или по отдельности в пределах временных промежутков, особенно если эти временные промежутки обеспечивают партнерам по комбинации возможность проявления кооперативного, например, синергического, эффекта.
[00399] Термин "комбинированная терапия" относится к введению двух или более терапевтических средств для лечения терапевтического состояния или нарушения, описанного в настоящем изобретении. Такое введение охватывает совместное введение данных терапевтических средств по существу одновременно, как, например, в одной капсуле, имеющей фиксированное соотношение активных ингредиентов. В качестве альтернативы такое введение охватывает совместное введение в нескольких или в отдельных контейнерах (например, таблетках, капсулах, порошках и жидкостях) для каждого активного ингредиента. Порошки и/или жидкости могут быть восстановлены или разбавлены до требуемой дозы перед введением. Кроме того, такое введение также охватывает применение каждого типа терапевтического средства последовательно примерно в одно и то же время либо в разное время. В любом случае режим лечения будет обеспечивать благоприятные эффекты комбинации лекарственных средств при лечении состояний или нарушений, описанных в данном документе.
Получение образцов
[00400] Образцы, используемые в способах, описанных в данном документе, можно получать от субъекта с применением любого из способов, известных из уровня техники, например с помощью биопсии или хирургического вмешательства. Например, образец, содержащий спинномозговую жидкость, можно получать с помощью люмбальной пункции, при который тонкую иглу, присоединенную к шприцу, вводят в люмбальную область позвоночного канала и вакуум создается таким образом, чтобы спинномозговую жидкость можно было засосать посредством иглы и собрать в шприц. Для управления данным типом процедуры можно применять визуализацию с помощью CT, ультразвуковое исследование или эндоскоп. Образец можно подвергнуть мгновенной заморозке и хранить при -80°C для последующего применения. Образец также можно фиксировать с помощью фиксирующего средства, такого как формальдегид, параформальдегид или смесь уксусная кислота/этанол. РНК или белок можно экстрагировать из свежего, замороженного или фиксированного образца для анализа.
Фармацевтические композиции, дозы и способы введения
[00401] Также в данном документе предусмотрены композиции, например, фармацевтические композиции, для применения в лечении ассоциированного с TREM2 заболевания. Такие композиции включают одно или несколько антител к hTREM2 или их антигенсвязывающие фрагменты, как описано в данном документе. Такие композиции могут дополнительно содержать другое средство, например, современный стандарт оказания медицинской помощи при заболевании, которое подлежит лечению.
[00402] Фармацевтические композиции, как правило, содержат фармацевтически приемлемый носитель. Используемая в данном документе формулировка "фармацевтически приемлемый носитель" включает солевой раствор, растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические средства и средства, замедляющие всасывание, и т.п., совместимые с фармацевтическим введением. Фармацевтические композиции, как правило составляют таким образом, чтобы они были совместимы с предполагаемым путем их введения. Примеры путей введения включают парентеральное (например, внутривенное, внутриартериальное, внутрибрюшинное), пероральное, внутричерепное, интратекальное или интраназальное (например, ингаляция), внутрикожное, подкожное или чреcслизистое введение. В некоторых вариантах осуществления фармацевтические композиции составлены для доставки антител к hTREM2 или их антигенсвязывающих фрагментов через гематоэнцефалический барьер.
[00403] В некоторых вариантах осуществления фармацевтические композиции содержат один или несколько фармацевтически приемлемых носителей, включающих, например, ионообменные материалы, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протаминсульфат, гидрофосфат динатрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрий-карбоксиметилцеллюлозу, полиакрилаты, воски, блок-сополимеры полиэтилена и полиоксипропилена, полиэтиленгликоль и ланолин.
[00404] Способы составления подходящих фармацевтических композиций известны из уровня техники, см., например, Remington: The Science and Practice of Pharmacy. 21st ed., 2005; и книги серии Drugs and the Pharmaceutical Sciences: a Series of Textbooks and Monographs (Dekker, NY). Например, растворы или суспензии, применяемые для парентерального, внутрикожного или подкожного применения могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекции, солевой раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие средства, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и средства для регуляции тонуса, такие как хлорид натрия или декстроза. Уровень pH можно регулировать с помощью кислот или оснований, таких как хлористоводородная кислота или гидроксид натрия. Препарат для парентерального введения можно заключить в ампулы, одноразовые шприцы или флаконы многоразового использования, сделанные из стекла или пластика.
[00405] Фармацевтические композиции, подходящие для инъекционного применения, могут включать стерильные водные растворы (в случае растворимости в воде) или дисперсии и стерильные порошки для получения стерильных инъекционных растворов или дисперсии для немедленного приема. Подходящие носители для внутривенного введения включают физиологический раствор, бактериостатическую воду, Cremophor EL™ (BASF, Парсиппани, Нью-Джерси) или фосфатно-солевой буферный раствор (PBS). Во всех случаях композиция должна быть стерильной и должна быть текучей до такой степени, чтобы ее можно было легко вводить через шприц. Она должна быть стабильной в условиях изготовления и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может представлять собой растворитель или дисперсионную среду, содержащие, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.) и их подходящие смеси. Надлежащую текучесть можно поддерживать, например, посредством применения покрытия, такого как лецитин, посредством поддержания требуемого размера частиц в случае дисперсии и посредством применения поверхностно-активных веществ. Предотвращения действия микроорганизмов можно достичь с помощью различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и т.п. Во многих случаях предпочтительным будет включение в композицию изотонических средств, например, сахаров, полиспиртов, таких как маннит, сорбит, или хлорида натрия. Длительное всасывание инъекционных композиций можно обеспечить посредством включения в композицию средства, которое замедляет всасывание, например, моностеарата алюминия и желатина.
[00406] Стерильные инъекционные растворы можно получать посредством включения активного соединения в требуемом количестве в подходящий растворитель с одним ингредиентом или комбинацией ингредиентов, перечисленных выше, при необходимости с последующей стерилизующей фильтрацией.
[00407] Обычно дисперсии получают посредством включения активного соединения в стерильную среду-носитель, которая содержит основную дисперсионную среду и другие требуемые ингредиенты из тех, которые перечислены выше. В случае стерильных порошков для получения стерильных инъекционных растворов предпочтительными способами получения являются вакуумная сушка и сублимационная сушка, которые позволяют получить порошкообразный активный ингредиент с любым дополнительным необходимым ингредиентом из их раствора, предварительно подвергнутого стерилизующей фильтрации.
[00408] Составы для парентерального введения могут представлять собой однократную болюсную дозу, инфузионную форму или нагрузочную болюсную дозу с последующей поддерживающей дозой. Такие композиции можно вводить с определенными фиксированными или варьирующимися промежутками, например, один раз в день или "при необходимости".
[00409] Подходящие фармацевтические композиции для инъекций могут содержать буфер (например, ацетатный, фосфатный или цитратный буфер), поверхностно-активное вещество (например, полисорбат), необязательно стабилизирующее средство (например, человеческий альбумин) и т.д. Препараты для периферического введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъекционные органические сложные эфиры, такие как этилолеат. Водные носители включают, например, воду, спиртовые/водные растворы, эмульсии или суспензии, в том числе солевой раствор и буферные среды. В некоторых вариантах осуществления фармацевтическая композиция содержит 0,01-0,1 M фосфатный буфер или 0,8% солевой раствор. Другие распространенные среды-носители для парентерального введения включают растворы фосфата натрия, раствор Рингера с декстрозой, декстрозу и хлорид натрия, раствор Рингера с лактатом или нелетучие масла. Среды-носители для внутривенного введения включают средства для восполнения жидкости и питательных веществ, средства для восполнения электролитов, такие как средства на основе раствора Рингера с декстрозой, и т.п. Также могут присутствовать консерванты и другие добавки, такие как, например, противомикробные средства, антиоксиданты, хелатирующие средства и инертные газы и т.п.
[00410] Композиции для перорального введения обычно включают инертный разбавитель или съедобный носитель. Если целью является пероральное терапевтическое введение, активное соединение можно включать со вспомогательными веществами и применять в виде таблеток, пастилок или капсул, например желатиновых капсул. Композиции для перорального введения также можно получать с применением жидкого носителя для применения в качестве ополаскивателя для полости рта. Фармацевтически совместимые связывающие средства и/или вспомогательные материалы можно включать в качестве части композиции. Таблетки, пилюли, капсулы, пастилки и т.п., могут содержать любое из следующих ингредиентов или соединений подобной природы: связывающее средство, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; вспомогательное вещество, такое как крахмал или лактоза, разрыхляющее средство, такое как альгиновая кислота, Primogel или кукурузный крахмал; смазывающее средство, такое как стеарат магния или Sterotes; способствующее скольжению вещество, такое как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или ароматизатор, такой как мята перечная, метилсалицилат или апельсиновый ароматизатор.
[00411] Для введения посредством ингаляции соединения можно доставлять в виде аэрозоля, распыляемого из контейнера под давлением или устройства-дозатора, который содержит подходящий пропеллент, например газ, такой как диоксид углерода, или небулайзера. Такие способы включают способы, описанные в патенте США №6468798. Системное введение терапевтического соединения, описанного в данном документе, можно осуществлять чресслизистым или трансдермальным путем. Для чресслизистого или трансдермального введения в составе применяют смачивающие вещества, подходящие для прохождения через барьер, который необходимо преодолеть. Такие смачивающие вещества обычно известны из уровня техники и включают, например, для чресслизистого введения, детергенты, соли желчных кислот и производные фузидиевой кислоты. Чресслизистое введение можно осуществлять посредством применения назальных спреев или суппозиториев. Для трансдермального введения активные соединения составляют в виде мазей, бальзамов, гелей или кремов, которые обычно известны из уровня техники.
[00412] В одном варианте осуществления терапевтические соединения получают с носителями, которые будут защищать терапевтические соединения от быстрого выведения из организма, как, например, в составе с контролируемым высвобождением, в том числе в имплантатах и микроинкапсулированных системах доставки.
[00413] Фармацевтические композиции можно включать в контейнер, упаковку или дозатор вместе с инструкциями по введению.
[00414] В неограничивающих примерах фармацевтическую композицию, содержащую по меньшей мере одно фармацевтическое средство, составляют в виде жидкости (например, термоотверждающейся жидкости), в виде компонента твердого препарата (например, порошка или биоразлагаемого биосовместимого полимера (например, катионного биоразлагаемого биосовместимого полимера)) или в виде компонента геля (например, биоразлагаемого биосовместимого полимера). В некоторых вариантах осуществления по меньшей мере композиция, содержащая по меньшей мере одно фармацевтическое средство, составлена в виде геля, выбранного из группы, включающей альгинатный гель (например, альгинат натрия), гель на основе целлюлозы (например, карбоксиметилцеллюлоза или карбоксиэтилцеллюлоза) или гель на основе хитозана (например, глицерофосфат хитозана). Дополнительные неограничивающие примеры полимеров для элюирования лекарственного средства, которые можно применять для составления любой из фармацевтических композиций, описанных в данном документе, включают каррагинан, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, декстран в комбинации с поливиниловым спиртом, декстран в комбинации с полиакриловой кислотой, полигалактуроновую кислоту, галактуроновый полисахарид, полимолочную кислоту, полигликолевую кислоту, тамариндовую камедь, ксантановую камедь, целлюлозную камедь, гуаровую камедь (карбоксиметилгуар), пектин, полиакриловую кислоту, полиметакриловую кислоту, N-изопропилполиакриламид, полиоксиэтилен, полиоксипропилен, плюроновую кислоту, полимолочную кислоту, циклодекстрин, циклоамилозу, резилин, полибутадиен, сополимер N-(2-гидроксипропил)метакриламида (HP MA), алкилвиниловый эфир малеинового ангидрида, полидепсипептид, полигидроксибутират, поликапролактон, полидиоксанон, полиэтиленгликоль, полиорганофосфазен, сложный полиортоэфир, поливинилпирролидон, сополимер полимолочной и гликолевой кислот (PLGA), полиангидриды, полисиламин, поли-N-винилкапролактам и геллан.
[00415] "Эффективное количество" представляет собой количество, достаточное для достижения благоприятных или необходимых результатов. Например, терапевтическое количество представляет собой такое количество, при котором достигается необходимый терапевтический эффект. Данное количество может быть таким же, как и профилактически эффективное количество, которое представляет собой количество, необходимое для предупреждения начала проявления заболевания или симптомов заболевания, или отличным от него. Эффективное количество можно вводить посредством одного или нескольких введений, применений или доз. "Терапевтически эффективное количество" терапевтического соединения (т.е. эффективная доза) зависит от выбранных терапевтических соединений. Композиции можно вводить от одного или нескольких раз в день до одного или нескольких раз в неделю; в том числе один раз в два дня. Специалист в данной области поймет, что на дозу и временные рамки, требуемые для эффективного лечения субъекта, могут влиять определенные факторы, в том числе без ограничения тяжесть заболевания или нарушения, предыдущие виды лечения, общее состояние здоровья и/или возраст субъекта и наличие других заболеваний. Более того, лечение субъекта терапевтически эффективным количеством терапевтических соединений, описанных в данном документе, может включать одну процедуру лечения или курс лечения.
[00416] Дозу, токсичность и терапевтическую эффективность терапевтических соединений можно определять с помощью стандартных фармацевтических процедур в культурах клеток или у экспериментальных животных, например, для определения LD50 (дозы, смертельной для 50% особей в популяции) и ED50 (дозы, терапевтически эффективной для 50% особей в популяции). Соотношение доз между токсичным и терапевтическим эффектами представляет собой терапевтический индекс и может быть выражено как соотношение LD50/ED50. Соединения, которые демонстрируют высокие терапевтические индексы, являются предпочтительными. Хотя соединения, которые демонстрируют токсичные побочные эффекты, можно применять, но следует позаботиться о разработке системы доставки, которая направляет такие соединения в очаг поражения ткани, с целью сведения к минимуму потенциального повреждения неинфицированных клеток и снижения таким образом побочных эффектов.
[00417] Данные, полученные из анализов культур клеток и исследований на животных, можно использовать для составления диапазона доз для применения у людей. Доза таких соединений предпочтительно находится в пределах диапазона циркулирующих концентраций, который включает ED50 с небольшой или отсутствующей токсичностью. Доза может варьироваться в пределах данного диапазона в зависимости от используемой лекарственной формы и используемого пути введения. Для любого соединения, применяемого в способе по настоящему изобретению, терапевтически эффективную дозу можно вначале оценить с помощью анализов культур клеток. Дозу можно составлять в животных моделях с достижением диапазона циркулирующих концентраций в плазме крови, который включает IC50 (т.е. концентрацию тестируемого соединения, при которой достигается полумаксимальное ингибирование симптомов), определенную в культуре клеток. Такую информацию можно использовать для более точного определения применимых доз у людей. Уровни в плазме крови можно измерить, например, с помощью высокоэффективной жидкостной хроматографии.
Наборы
[00418] Также в данном документе предусмотрены наборы, содержащие одно или несколько из композиций, предусмотренных в данном документе, и инструкций по применению. Инструкции по применению могут включать инструкции в отношении установления наличия или лечения ассоциированного с TREM2 заболевания. Наборы, предусмотренные в данном документе, можно применять в соответствии с любым из способов, описанных в данном документе. Специалистам в данной области будут известны другие подходящие пути применения наборов, предусмотренных в данном документе, и они смогут использовать эти наборы для таких путей применения. Наборы, предусмотренные в данном документе, также могут содержать оболочку почтового отправления (например, конверт с предварительно оплаченным почтовым сбором или почтовую упаковку), которая может использоваться для возвращения образца для анализа, например, в лабораторию. Набор может содержать один или несколько контейнеров для образца, или образец может находиться в стандартном флаконе для сбора крови. Набор также может содержать одно или несколько из формы информированного согласия, формы заявки на тестирование и инструкций по применению набора в способе, описанном в данном документе. Способы применения таких наборов также включены в данный документ. Одна или несколько из форм (например, форма заявки на тестирование) и контейнер, содержащий образец, могут быть закодированы, например, штрих-кодом для идентификации субъекта, который предоставил образец.
[00419] Специалисту в данной области будут понятны многие способы и материалы, подобные или эквивалентные описанным в данном документе, которые можно применять при осуществлении на практике настоящего изобретения. Следует отметить, что настоящее изобретение никоим образом не ограничено описанными способами и материалами.
Варианты осуществления
1. Антитело или его антигенсвязывающий фрагмент, которые связываются с доменом суперсемейства иммуноглобулинов (IgSF) белка, представляющего собой триггерный рецептор 2 человека, экспрессируемый на миелоидных клетках (hTREM2), и стабилизируют белок hTREM2 (например, SEQ ID NO: 1, 2 или 3).
2. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент связывают один или несколько остатков hTREM2, выбранных из группы, состоящей из D39, S40, M41, K42, W44, G45, R46, R47, H67, N68, L69, W70, L71, L72, F74, L75, R77, D87, T88, L89 и G90.
3. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент связывают один или несколько остатков hTREM2, выбранных из группы, состоящей из D39, S40, M41, K42, W44, G45, R46 и R47, один или несколько остатков, выбранных из группы, состоящей из H67, N68, L69, W70, L71, L72, F74, L75 и R77, и один или нескольких остатков, выбранных из группы, состоящей из D87, T88, L89 и G90.
4. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент связывают пять или более остатков hTREM2, выбранных из группы, состоящей из D39, S40, M41, K42, W44, G45, R46 и R47, четыре или более остатков, выбранных из группы, состоящей из H67, N68, L69, W70, L71, L72, F74, L75 и R77, и три или более остатков, выбранных из группы, состоящей из D87, T88, L89 и G90.
5. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент связывают семь или более остатков hTREM2, выбранных из группы, состоящей из D39, S40, M41, K42, W44, G45, R46 и R47, четыре или более остатков, выбранных из группы, состоящей из H67, N68, L69, W70, L71, L72, F74, L75 и R77, и три или более остатков, выбранных из группы, состоящей из D87, T88, L89 и G90.
6. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент связывают пять или более остатков hTREM2, выбранных из группы, состоящей из D39, S40, M41, K42, W44, G45, R46 и R47, все остатки из H67, N68, L69, W70, L71, L72, F74, L75 и R77, и три или более остатков, выбранных из группы, состоящей из D87, T88, L89 и G90.
7. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент связывают один или несколько остатков hTREM2, выбранных из группы, состоящей из S40, M41, W44, G45, W70, L71, L72, F74, T88 и L89.
8. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент связывают два или более остатков hTREM2, выбранных из группы, состоящей из S40, M41, W44, G45, W70, L71, L72, F74, T88 и L89.
9. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент связывают три или более остатков hTREM2, выбранных из группы, состоящей из S40, M41, W44, G45, W70, L71, L72, F74, T88 и L89.
10. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент связывают четыре или более остатков hTREM2, выбранных из группы, состоящей из S40, M41, W44, G45, W70, L71, L72, F74, T88 и L89.
11. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент связывают пять или более остатков hTREM2, выбранных из группы, состоящей из S40, M41, W44, G45, W70, L71, L72, F74, T88 и L89.
12. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент связывают шесть или более остатков hTREM2, выбранных из группы, состоящей из S40, M41, W44, G45, W70, L71, L72, F74, T88 и L89.
13. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент связывают семь или более остатков hTREM2, выбранных из группы, состоящей из S40, M41, W44, G45, W70, L71, L72, F74, T88 и L89.
14. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент связывают восемь или более остатков hTREM2, выбранных из группы, состоящей из S40, M41, W44, G45, W70, L71, L72, F74, T88 и L89.
15. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент связывают девять или более остатков hTREM2, выбранных из группы, состоящей из S40, M41, W44, G45, W70, L71, L72, F74, T88 и L89.
16. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент связывают все остатки hTREM2 из S40, M41, W44, G45, W70, L71, L72, F74, T88 и L89.
17. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 7-16, где антитело или его антигенсвязывающий фрагмент связывают один или несколько остатков hTREM2, выбранных из группы, состоящей из D39, K42, R46 и G90.
18. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 7-16, где антитело или его антигенсвязывающий фрагмент связывают два или более остатков hTREM2, выбранных из группы, состоящей из D39, K42, R46 и G90.
19. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 7-16, где антитело или его антигенсвязывающий фрагмент связывают три или более остатков hTREM2, выбранных из группы, состоящей из D39, K42, R46 и G90.
20. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 7-15, где антитело или его антигенсвязывающий фрагмент связывают все остатки hTREM2 из D39, K42, R46 и G90.
21. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент связывают все остатки hTREM2 из S40, M41, W44, G45, W70, L71, L72, F74, T88, L89, D39, K42, R46 и G90.
22. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 7-16, где антитело или его антигенсвязывающий фрагмент связывают один или несколько остатков hTREM2, выбранных из группы, состоящей из R47, H67, N68, L69, L75, R77 и D87.
23. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 7-16, где антитело или его антигенсвязывающий фрагмент связывают два или более остатков hTREM2, выбранных из группы, состоящей из R47, H67, N68, L69, L75, R77 и D87.
24. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 7-16, где антитело или его антигенсвязывающий фрагмент связывают три или более остатков hTREM2, выбранных из группы, состоящей из R47, H67, N68, L69, L75, R77 и D87.
25. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 7-16, где антитело или его антигенсвязывающий фрагмент связывают четыре или более остатков hTREM2, выбранных из группы, состоящей из R47, H67, N68, L69, L75, R77 и D87.
26. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 7-16, где антитело или его антигенсвязывающий фрагмент связывают пять или более остатков hTREM2, выбранных из группы, состоящей из R47, H67, N68, L69, L75, R77 и D87.
27. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 7-15, где антитело или его антигенсвязывающий фрагмент связывают шесть или более остатков hTREM2, выбранных из группы, состоящей из R47, H67, N68, L69, L75, R77 и D87.
28. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент связывают все остатки hTREM2 из S40, M41, W44, G45, W70, L71, L72, F74, T88, L89, R47, H67, N68, L69, L75, R77 и D87.
29. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-28, где антитело или его антигенсвязывающий фрагмент активируют hTREM2.
30. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-29, где антитело или его антигенсвязывающий фрагмент способствуют одной или более hTREM2-зависимым физиологическим активностям в клетке, экспрессирующей TREM2.
31. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-30, где антитело или его антигенсвязывающий фрагмент:
a) усиливают фагоцитоз, например в экспрессирующей hTREM2 клетке, например, где экспрессирующая TREM2 клетка представляет собой макрофаг hM2A или микроглиеподобную клетку, полученную из iPS человека;
b) усиливают хемотаксис, например в экспрессирующей hTREM2 клетке, например, где экспрессирующая TREM2 клетка представляет собой макрофаг hM2A или микроглиеподобную клетку, полученную из iPS человека;
c) повышают управляемую NFAT активность репортерного гена в линии моноцитарных клеток человека;
d) повышают фосфорилирование Syk, например в экспрессирующей hTREM2 клетке, например, где экспрессирующая TREM2 клетка представляет собой макрофаг hM2A, или
e) усиливают любую комбинацию двух или более из указанного в a)-d).
32. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-31, где антитело или его антигенсвязывающий фрагмент связывают hTREM2, например на клеточной поверхности, с полумаксимальной эффективной концентрацией (EC50), составляющей 1 нМ или менее, например как измерено с помощью анализа FACS на макрофагах hM2a.
33. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-32, где антитело или его антигенсвязывающий фрагмент связывают hTREM2, например на клеточной поверхности, с полумаксимальной эффективной концентрацией (ЕС50), составляющей 0,59 нМ или меньше, например как измерено с помощью анализа FACS на макрофагах hM2a.
34. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-33, где антитело или его антигенсвязывающий фрагмент связывают hTREM2 с константой диссоциации (KD), составляющей 150 пМ или менее, например как измерено с помощью поверхностного плазмонного резонанса (SPR).
35. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-34, где антитело или его антигенсвязывающий фрагмент связывают hTREM2 с константой диссоциации (KD), составляющей 50 пМ или менее, например как измерено с помощью поверхностного плазмонного резонанса (SPR).
36. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-35, где антитело или его антигенсвязывающий фрагмент стабилизируют белок hTREM2 на клеточной поверхности клетки, экспрессирующей hTREM2.
37. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 36, где экспрессирующая hTREM2 клетка представляет собой макрофаг, например макрофаг M2a, дендритную клетку, остеокласт, клетку микроглии, тучную клетку, моноцит, эпителиальную клетку легких, клетку Лангерганса кожи, клетку Купфера, нейтрофил или клетку гепатокарциномы.
38. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-37, где антитело или его антигенсвязывающий фрагмент снижают шеддинг эктодомена белка hTREM2 при концентрации 100 нМ или ниже в макрофагах hM2A.
39. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-38, где экспрессия TREM2 на клеточной поверхности увеличивается в 3 раза или больше.
40. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-39, где домен IgSF hTREM2 содержит аминокислотные остатки 19-132 из любой из SEQ ID NO: 1, 2 и 3.
41. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-40, где указанные антитело или его антигенсвязывающий фрагмент содержат:
a) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 41, или SEQ ID NO: 44, или SEQ ID NO: 45, или SEQ ID NO: 47; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 42, или SEQ ID NO: 46, или SEQ ID NO: 48; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 43 или SEQ ID NO: 49; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 54, или SEQ ID NO: 57, или SEQ ID NO: 60; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 55 или SEQ ID NO: 58; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 56 или SEQ ID NO: 59;
b) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 4, или SEQ ID NO: 7, или SEQ ID NO: 8, или SEQ ID NO: 10; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 5, или SEQ ID NO: 9, или SEQ ID NO: 11; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 6 или SEQ ID NO: 12; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 17, или SEQ ID NO: 20, или SEQ ID NO: 23; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 18 или SEQ ID NO: 21; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 19 или SEQ ID NO: 22;
c) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 4, или SEQ ID NO: 7, или SEQ ID NO: 8, или SEQ ID NO: 10; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 5, или SEQ ID NO: 9, или SEQ ID NO: 11; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 6 или SEQ ID NO: 12; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 17, или SEQ ID NO: 20, или SEQ ID NO: 23; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 18 или SEQ ID NO: 21; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 78 или SEQ ID NO: 79; или
d) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 84, или SEQ ID NO: 87, или SEQ ID NO: 88, или SEQ ID NO: 90; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 85, или SEQ ID NO: 89, или SEQ ID NO: 91; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 86 или SEQ ID NO: 92; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 97, или SEQ ID NO: 100, или SEQ ID NO: 103; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 98 или SEQ ID NO: 101; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 99 или SEQ ID NO: 102.
42. Антитело или его антигенсвязывающий фрагмент, которые связываются с доменом IgSF белка hTREM2, где указанные антитело или его антигенсвязывающий фрагмент содержат:
a) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 41, или SEQ ID NO: 44, или SEQ ID NO: 45, или SEQ ID NO: 47; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 42, или SEQ ID NO: 46, или SEQ ID NO: 48; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 43 или SEQ ID NO: 49; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 54, или SEQ ID NO: 57, или SEQ ID NO: 60; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 55 или SEQ ID NO: 58; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 56 или SEQ ID NO: 59;
b) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 4, или SEQ ID NO: 7, или SEQ ID NO: 8, или SEQ ID NO: 10; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 5, или SEQ ID NO: 9, или SEQ ID NO: 11; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 6 или SEQ ID NO: 12; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 17, или SEQ ID NO: 20, или SEQ ID NO: 23; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 18 или SEQ ID NO: 21; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 19 или SEQ ID NO: 22;
c) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 4, или SEQ ID NO: 7, или SEQ ID NO: 8, или SEQ ID NO: 10; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 5, или SEQ ID NO: 9, или SEQ ID NO: 11; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 6 или SEQ ID NO: 12; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 17, или SEQ ID NO: 20, или SEQ ID NO: 23; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 18 или SEQ ID NO: 21; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 78 или SEQ ID NO: 79; или
d) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 84, или SEQ ID NO: 87, или SEQ ID NO: 88, или SEQ ID NO: 90; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 85, или SEQ ID NO: 89, или SEQ ID NO: 91; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 86 или SEQ ID NO: 92; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 97, или SEQ ID NO: 100, или SEQ ID NO: 103; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 98 или SEQ ID NO: 101; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 99 или SEQ ID NO: 102.
43. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-42, где антитело или его антигенсвязывающий фрагмент содержат:
a) полипептидную последовательность VH, характеризующуюся по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 13 или с SEQ ID NO: 50, и полипептидную последовательность VL, характеризующуюся по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 24 или с SEQ ID NO: 61; или
b) полипептидную последовательность VH, характеризующуюся по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 13 или с SEQ ID NO: 93, и полипептидную последовательность VL, характеризующуюся по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 80 или с SEQ ID NO: 104.
44. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-43, содержащие:
a) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 7; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 5; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 6; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 17; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 18; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 19;
b) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 44; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 42; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 43; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 54; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из SEQ ID NO: 55; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 56;
c) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 7; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 5; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 6; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 17; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 18; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 78; или
d) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 87; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 85; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 86; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 97; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 98; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 99.
45. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-43, содержащие:
a) CDR1 вариабельной области тяжелой цепи под SEQ ID NO: 8; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 9; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 6; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 20; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 21; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 22;
b) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 45; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 46; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 43; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 57; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 58; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 59;
c) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 8; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 9; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 6; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 20; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 21; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 79; или
d) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 88; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 89; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 86; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 100; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 101; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 102.
46. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-43, содержащие:
a) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 10; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 11; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 12; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 23; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 21; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 19;
b) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 47; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 48; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 49; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 60; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 58; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 56;
c) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 10; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 11; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 12; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 23; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 21; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 78; или
d) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 90; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 91; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 92; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 103; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 101; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 99.
47. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-43, содержащие:
a) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 4; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 5; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 6; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 17; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 18; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 19;
b) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 41; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 42; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 43; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 54; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 55; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 56;
c) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 4; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 5; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 6; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 17; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 18; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 78; или
d) CDR1 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 84; CDR2 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 85; CDR3 вариабельной области тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 86; CDR1 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 97; CDR2 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 98; и CDR3 вариабельной области легкой цепи, содержащую, например состоящую из, SEQ ID NO: 99.
48. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-47, где антитело или его антигенсвязывающий фрагмент содержат:
a) VH, содержащую, например состоящую из, SEQ ID NO: 13, и VL, содержащую, например состоящую из, SEQ ID NO: 24; или
b) VH, содержащую, например состоящую из, SEQ ID NO: 50, и VL, содержащую, например состоящую из, SEQ ID NO: 61; или
c) VH, содержащую, например состоящую из, последовательность, характеризующуюся по меньшей мере 95% гомологией с SEQ ID NO: 13, и VL, содержащую, например состоящую из, последовательность, характеризующуюся по меньшей мере 95% гомологией с SEQ ID NO: 24; или
d) VH, содержащую, например состоящую из, последовательность, характеризующуюся по меньшей мере 95% гомологией с SEQ ID NO: 50, и VL, содержащую, например состоящую из, последовательность, характеризующуюся по меньшей мере 95% гомологией с SEQ ID NO: 61; или
e) VH, содержащую, например состоящую из, последовательность, которая отличается на по меньшей мере 1, 2, 3, 4, 5 или 6 аминокислот от SEQ ID NO: 13, и VL, содержащую, например состоящую из, последовательность, которая отличается на по меньшей мере 1, 2, 3, 4, 5 или 6 аминокислот от SEQ ID NO: 24; или
f) VH, содержащую, например состоящую из, последовательность, которая отличается на по меньшей мере 1, 2, 3, 4, 5 или 6 аминокислот от SEQ ID NO: 50, и VL, содержащую, например состоящую из, последовательность, которая отличается на по меньшей мере 1, 2, 3, 4, 5 или 6 аминокислот от SEQ ID NO: 61;
g) VH, содержащую, например состоящую из, SEQ ID NO: 13, и VL, содержащую, например состоящую из, SEQ ID NO: 80; или
h) VH, содержащую, например состоящую из, SEQ ID NO: 93, и VL, содержащую, например состоящую из, SEQ ID NO: 104; или
i) VH, содержащую, например состоящую из, последовательность, характеризующуюся по меньшей мере 95% гомологией с SEQ ID NO: 13, и VL, содержащую, например состоящую из, последовательность, характеризующуюся по меньшей мере 95% гомологией с SEQ ID NO: 80; или
j) VH, содержащую, например состоящую из, последовательность, характеризующуюся по меньшей мере 95% гомологией с SEQ ID NO: 93, и VL, содержащую, например состоящую из, последовательность, характеризующуюся по меньшей мере 95% гомологией с SEQ ID NO: 104; или
k) VH, содержащую, например состоящую из, последовательность, которая отличается на по меньшей мере 1, 2, 3, 4, 5 или 6 аминокислот от SEQ ID NO: 13, и VL, содержащую, например состоящую из, последовательность, которая отличается на по меньшей мере 1, 2, 3, 4, 5 или 6 аминокислот от SEQ ID NO: 80; или
l) VH, содержащую, например состоящую из, последовательность, которая отличается на по меньшей мере 1, 2, 3, 4, 5 или 6 аминокислот от SEQ ID NO: 93, и VL, содержащую, например состоящую из, последовательность, которая отличается на по меньшей мере 1, 2, 3, 4, 5 или 6 аминокислот от SEQ ID NO: 104.
49. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-48, где антитело или его антигенсвязывающий фрагмент содержат:
a) аминокислотную последовательность тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 15, SEQ ID NO: 29, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37 или SEQ ID NO: 39, и аминокислотную последовательность легкой цепи, содержащую, например состоящую из, SEQ ID NO: 26;
b) аминокислотную последовательность тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 52, SEQ ID NO: 66, SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74 или SEQ ID NO: 76, и аминокислотную последовательность легкой цепи, содержащую, например состоящую из, SEQ ID NO: 63;
c) аминокислотную последовательность тяжелой цепи, характеризующуюся по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 15, SEQ ID NO: 29, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37 или SEQ ID NO: 39, и аминокислотную последовательность легкой цепи, характеризующуюся по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 26;
d) аминокислотную последовательность тяжелой цепи, характеризующуюся по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 52, SEQ ID NO: 66, SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74 или SEQ ID NO: 76, и аминокислотную последовательность легкой цепи, характеризующуюся по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 63;
e) аминокислотную последовательность тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 15, и аминокислотную последовательность легкой цепи, содержащую, например состоящую из, SEQ ID NO: 82;
f) аминокислотную последовательность тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 95, и аминокислотную последовательность легкой цепи, содержащую, например состоящую из, SEQ ID NO: 106;
g) аминокислотную последовательность тяжелой цепи, характеризующуюся по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 15, и аминокислотную последовательность легкой цепи, характеризующуюся по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 82; или
h) аминокислотную последовательность тяжелой цепи, характеризующуюся по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 95, и аминокислотную последовательность легкой цепи, характеризующуюся по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 106.
50. Антитело или его антигенсвязывающий фрагмент, которые связываются с доменом суперсемейства иммуноглобулинов (IgSF) триггерного рецептора 2 человека, экспрессируемого на миелоидных клетках (hTREM2), содержащие:
a) последовательность тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 15, и последовательность легкой цепи, содержащую, например состоящую из, SEQ ID NO: 26;
b) последовательность тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 29, и последовательность легкой цепи, содержащую, например состоящую из, SEQ ID NO: 26;
c) последовательность тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 33, и последовательность легкой цепи, содержащую, например состоящую из, SEQ ID NO: 26;
d) последовательность тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 35, и последовательность легкой цепи, содержащую, например состоящую из, SEQ ID NO: 26;
e) последовательность тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 37, и последовательность легкой цепи, содержащую, например состоящую из, SEQ ID NO: 26;
f) последовательность тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 39, и последовательность легкой цепи, содержащую, например состоящую из, SEQ ID NO: 26;
g) последовательность тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 52, и последовательность легкой цепи, содержащую, например состоящую из, SEQ ID NO: 63;
h) последовательность тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 66, и последовательность легкой цепи, содержащую, например состоящую из, SEQ ID NO: 63;
i) последовательность тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 70, и последовательность легкой цепи, содержащую, например состоящую из, SEQ ID NO: 63;
j) последовательность тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 72, и последовательность легкой цепи, содержащую, например состоящую из, SEQ ID NO: 63;
k) последовательность тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 74, и последовательность легкой цепи, содержащую, например состоящую из, SEQ ID NO: 63;
l) последовательность тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 76, и последовательность легкой цепи, содержащую, например состоящую из, SEQ ID NO: 63;
m) последовательность тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 15, и последовательность легкой цепи, содержащую, например состоящую из, SEQ ID NO: 82; или
n) последовательность тяжелой цепи, содержащую, например состоящую из, SEQ ID NO: 95, и последовательность легкой цепи, содержащую, например состоящую из, SEQ ID NO: 106.
51. Антитело или его антигенсвязывающий фрагмент, которые конкурируют с любым антителом или его антигенсвязывающим фрагментом по любому из вариантов осуществления 1-50 за связывание с белком hTREM2.
52. Антитело или его антигенсвязывающий фрагмент, которые связываются с эпитопом, который перекрывается с эпитопом любого антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-51.
53. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-52, где антитело относится к изотипу IgG1, IgG2, IgG3 или IgG4.
54. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-52, где антитело или его антигенсвязывающий фрагмент содержат Fc-область, выбранную из Fc-области IgG1, Fc-области IgG2, Fc-области IgG4 или гибридной Fc-области IgG2/IgG4.
55. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-49 или 51-54, где антитело или его антигенсвязывающий фрагмент содержат модифицированную Fc-область, которая характеризуется сниженной активностью антителозависимой клеточной цитотоксичности (ADCC) или комплементзависимой цитотоксичности (CDC) по сравнению с исходным антителом.
56. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-55, где антитело или его антигенсвязывающий фрагмент представляют собой человеческое или гуманизированное антитело или его фрагмент.
57. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-56, где антитело или его антигенсвязывающий фрагмент конъюгированы с дополнительным компонентом.
58. Антитело по любому из вариантов осуществления 1-57, где указанное антитело относится к изотипу IgG1.
59. Антитело по любому из вариантов осуществления 1-56, где указанное антитело представляет собой человеческое или гуманизированное антитело.
60. Антигенсвязывающий фрагмент антитела по любому из вариантов осуществления 1-57, где антигенсвязывающий фрагмент выбран из Fab-, F(ab')2-, Fv-фрагментов, scFv, миниантитела или диатела.
61. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-60, где указанное антитело или его антигенсвязывающий фрагмент являются моноклональными.
62. Антитело по любому из вариантов осуществления 1-61, где антитело представляет собой полиспецифическое антитело, например биспецифическое антитело.
63. Антитело по варианту осуществления 62, где полиспецифическое антитело, например биспецифическое антитело, специфически связывается с hTREM2 и DAP12 человека (DNAX-активирующим белком с массой 12 кДа).
64. Антитело в соответствии с любым из вариантов осуществления 1-63, где указанное антитело имеет измененную эффекторную функцию в результате мутации Fc-области.
65. Молекула нуклеиновой кислоты или набор молекул нуклеиновой кислоты, кодирующие любое из антител или их антигенсвязывающие фрагменты, согласно любому из вариантов осуществления 1-64.
66. Молекула нуклеиновой кислоты согласно варианту осуществления 65, где нуклеиновая кислота представляет собой ДНК.
67. Молекула нуклеиновой кислоты или набор молекул нуклеиновой кислоты согласно варианту осуществления 65 или 66, содержащие одну или несколько из SEQ ID NO: 14, 28, 51, 65, 16, 30, 34, 36, 38, 40, 53, 67, 71, 73, 75, 77, 25, 31, 62, 68, 27, 32, 64, 69, 13, 93, 15, 95, 80, 104, 82 или 106.
68. Вектор, содержащий молекулы нуклеиновой кислоты согласно любому из вариантов осуществления 65-67.
69. Вектор по варианту осуществления 68, где вектор представляет собой клонирующий вектор или вектор экспрессии.
70. Вектор согласно варианту осуществления 68 или 69, где указанный вектор содержит одну или несколько из SEQ ID NO: 14, 28, 51, 65, 16, 30, 34, 36, 38, 40, 53, 67, 71, 73, 75, 77, 25, 31, 62, 68, 27, 32, 64, 69, 13, 93, 15, 95, 80, 104, 82 или 106 или их фрагмент, кодирующий по меньшей мере одну CDR-область.
71. Вектор согласно любому из вариантов осуществления 68-70, где вектор способен реплицироваться в прокариотической и/или эукариотической клетке.
72. Вектор согласно любому из вариантов осуществления 68-71, где вектор выбран из ДНК-вектора, РНК-вектора, плазмиды, космиды или вирусного вектора.
73. Вектор согласно любому из вариантов осуществления 68-72, дополнительно содержащий выявляемый и/или селектируемый маркер.
74. Набор из двух векторов экспрессии согласно любому из вариантов осуществления 68-73, при этом один вектор кодирует а) по меньшей мере один VH-домен, содержащий SEQ ID NO: 13 или 50, а другой вектор кодирует по меньшей мере один VL-домен, содержащий SEQ ID NO: 24 или 61; или
b) по меньшей мере один VH-домен, содержащий SEQ ID NO: 13 или 93, а другой вектор кодирует по меньшей мере один VL-домен, содержащий SEQ ID NO: 80 или 104.
75. Вектор согласно любому из вариантов осуществления 68-74, где вектор представляет собой вирусный вектор, необязательно где вирусный вектор представляет собой вектор на основе лентивируса, аденовируса, аденоассоциированного вируса (AAV), вируса простого герпеса (HSV), парвовируса, ретровируса, вируса осповакцины, вируса Синдбис, вируса гриппа, реовируса, вируса ньюкаслской болезни (NDV), вируса кори, вируса везикулярного стоматита (VSV), полиовируса, поксвируса, вируса Сенека-Валли, вируса Коксаки, энтеровируса, вируса миксомы или вируса Мараба.
76. Вектор согласно варианту осуществления 75, где вектор представляет собой вектор на основе AAV.
77. Вектор согласно любому из вариантов осуществления 68-76, где вектор дополнительно содержит промотор.
78. Вектор согласно любому из вариантов осуществления 68-77, где вектор содержит капсид AAV9 и векторную плазмиду на основе AAV, содержащую (1) ITR, полученные из AAV2, (2) энхансер CMV (например, содержащий SEQ ID NO: 134), (3) промотор CBA (например, содержащий SEQ ID NO: 135), (4) интрон SV40 (например, содержащий SEQ ID NO: 137), (5) полинуклеотид, кодирующий антитело к hTREM2 или его антигенсвязывающий фрагмент (например, как описано в данном документе), и (6) сигнал поли-A BGH (например, содержащий SEQ ID NO: 138).
79. Вектор по варианту осуществления 78, где элементы (2)-(6) расположены в векторной плазмиде на основе AAV в направлении от 5' до 3'.
80. Вектор по варианту осуществления 78 или 79, где любые из элементов (2)-(6) расположены в векторной плазмиде на основе AAV между 5'-ITR и 3'-ITR.
81. Вектор по любому из вариантов осуществления 78-80, где вектор на основе AAV представляет собой вектор на основе scAAV.
82. Вектор согласно любому из вариантов осуществления 68-75, где вектор представляет собой лентивирусный вектор.
83. Клетка, содержащая молекулу нуклеиновой кислоты или набор молекул нуклеиновой кислоты согласно любому из вариантов осуществления 64-66 или вектор по любому из вариантов осуществления 68-82.
84. Способ получения антитела к hTREM2 или его антигенсвязывающего фрагмента, предусматривающий: (i) культивирование клетки согласно варианту осуществления 83 и (ii) выделение антитела к hTREM2 или его антигенсвязывающего фрагмента из культуры.
85. Фармацевтическая композиция, содержащая антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-64, молекулу нуклеиновой кислоты или набор молекул нуклеиновой кислоты по любому из вариантов осуществления 65-67, вектор по любому из вариантов осуществления 68-82 или клетку по варианту осуществления 83 и фармацевтически приемлемый носитель.
86. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-64, молекула нуклеиновой кислоты или набор молекул нуклеиновой кислоты по любому из вариантов осуществления 65-67, вектор по любому из вариантов осуществления 68-82, клетка по варианту осуществления 83 или фармацевтическая композиция по варианту осуществления 85 для применения в качестве лекарственного препарата.
87. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-64, молекула нуклеиновой кислоты или набор молекул нуклеиновой кислоты по любому из вариантов осуществления 65-67, вектор по любому из вариантов осуществления 68-82, клетка по варианту осуществления 83 или фармацевтическая композиция по варианту осуществления 85 для применения при лечении заболевания, ассоциированного с потерей функции hTREM2.
88. Применение антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-64, молекулы нуклеиновой кислоты или набора молекул нуклеиновой кислоты по любому из вариантов осуществления 65-67, вектора по любому из вариантов осуществления 68-82, клетки по варианту осуществления 83 или фармацевтической композиции по варианту осуществления 85 в изготовлении лекарственного препарата для лечения заболевания, ассоциированного с потерей функции hTREM2.
89. Антитело или его антигенсвязывающий фрагмент, молекула нуклеиновой кислоты или набор молекул нуклеиновой кислоты, вектор, клетка или фармацевтическая композиция по варианту осуществления 87 или применение по варианту осуществления 88, где заболевание представляет собой нейровоспалительное или нейродегенеративное заболевание, где необязательно нейровоспалительное или нейродегенеративное заболевание представляет собой болезнь Альцгеймера, лобно-височную деменцию, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Насу-Хакола, рассеянный склероз, боковой амиотрофический склероз (ALS), энцефалит с антителами к NMDA-рецепторам, аутизм, волчанку головного мозга (NP-SLE), индуцированную химиотерапией периферическую нейропатию (CIPN), постгерпетическую невралгию, хроническую воспалительную демиелинизирующую полинейропатию (CIDP), эпилепсию, синдром Гийена-Барре (GBS), миозит с тельцами включения, лизосомные болезни накопления, сфингомиелинлипидоз (Ниманна-Пика C), мукополисахаридоз II/IIIB, метахроматическую лейкодистрофию, мультифокальную моторную нейропатию, миастению гравис, болезнь Бехчета с вовлечением нервных структур, оптиконейромиелит (NMO), неврит зрительного нерва, полимиозит, дерматомиозит, энцефалит Расмуссена, синдром Ретта, инсульт, поперечный миелит, травматическое повреждение головного мозга, повреждение спинного мозга, вирусный энцефалит или бактериальный менингит.
90. Антитело или его антигенсвязывающий фрагмент, молекула нуклеиновой кислоты или набор молекул нуклеиновой кислоты, вектор, клетка или фармацевтическая композиция по варианту осуществления 87 или применение по варианту осуществления 88, где заболевание представляет собой болезнь Альцгеймера.
91. Антитело или его антигенсвязывающий фрагмент, молекула нуклеиновой кислоты или набор молекул нуклеиновой кислоты, вектор, клетка или фармацевтическая композиция по варианту осуществления 87 или применение по варианту осуществления 88, где заболевание представляет собой болезнь Паркинсона.
92. Антитело или его антигенсвязывающий фрагмент, молекула нуклеиновой кислоты или набор молекул нуклеиновой кислоты, вектор, клетка или фармацевтическая композиция по варианту осуществления 87 или применение по варианту осуществления 88, где заболевание представляет собой рассеянный склероз.
93. Антитело или его антигенсвязывающий фрагмент, молекула нуклеиновой кислоты или набор молекул нуклеиновой кислоты, вектор, клетка или фармацевтическая композиция по варианту осуществления 87 или применение по варианту осуществления 88, где заболевание представляет собой лобно-височную деменцию.
94. Антитело или его антигенсвязывающий фрагмент, молекула нуклеиновой кислоты или набор молекул нуклеиновой кислоты, вектор, клетка или фармацевтическая композиция по варианту осуществления 87 или применение по варианту осуществления 88, где антитело или его антигенсвязывающий фрагмент, молекула нуклеиновой кислоты или набор молекул нуклеиновой кислоты, вектор, клетка или фармацевтическая композиция вводятся субъекту пероральным, внутривенным, внутричерепным, интратекальным, подкожным или интраназальным путем.
95. Антитело или его антигенсвязывающий фрагмент, молекула нуклеиновой кислоты или набор молекул нуклеиновой кислоты, вектор, клетка или фармацевтическая композиция по варианту осуществления 87 или применение по варианту осуществления 88, где антитело или его антигенсвязывающий фрагмент, молекула нуклеиновой кислоты или набор молекул нуклеиновой кислоты, вектор, клетка или фармацевтическая композиция вводятся субъекту в комбинации с по меньшей мере одним дополнительным терапевтическим средством или процедурой.
96. Антитело или его антигенсвязывающий фрагмент, молекула нуклеиновой кислоты или набор молекул нуклеиновой кислоты, вектор, клетка или фармацевтическая композиция по варианту осуществления 87 или применение по варианту осуществления 88, где антитело или его антигенсвязывающий фрагмент, молекула нуклеиновой кислоты или набор молекул нуклеиновой кислоты, вектор, клетка или фармацевтическая композиция вводятся субъекту в комбинации с по меньшей мере одним дополнительным терапевтическим средством, где указанное средство включает одно или несколько из ингибиторов ВАСЕ, антител к тау-белку, антисмысловых олигонуклеотидов против тау-белка, антител к бета-амилоиду, финголимода, BG12 или диметилфумарата, бета-интерферона или тисабри.
97. Способ лечения заболевания, ассоциированного с потерей функции hTREM2 у субъекта, нуждающегося в этом, при этом способ включает введение субъекту терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-64, молекулы нуклеиновой кислоты или набора молекул нуклеиновой кислоты по любому из вариантов осуществления 65-67, вектора по любому из вариантов осуществления 68-82, клетки по варианту осуществления 83 или фармацевтической композиции по варианту осуществления 85.
98. Способ по варианту осуществления 97, где способ предусматривает:
a) проведение анализа уровня hTREM2 на клеточной поверхности в образце, полученном от субъекта;
b) выбор субъекта, у которого уровень hTREM2 на клеточной поверхности ниже эталонного уровня, где эталонный уровень представляет собой уровень hTREM2 на клеточной поверхности в образце, полученном от здорового субъекта; и
c) введение выбранному субъекту терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-64, молекулы нуклеиновой кислоты или набора молекул нуклеиновой кислоты по любому из вариантов осуществления 65-67, вектора по любому из вариантов осуществления 68-82, клетки по варианту осуществления 83 или фармацевтической композиции по варианту осуществления 85.
99. Способ по варианту осуществления 98, где образец предусматривает спинномозговую жидкость.
100. Способ по варианту осуществления 98 или 99, где уровень TREM2 на клеточной поверхности в указанном образце определяют с помощью анализа, выбранного из проточной цитометрии, иммуногистохимического исследования, вестерн-блоттинга, иммунофлуоресцентного анализа, радиоиммуноанализа (RIA), твердофазного иммуноферментного анализа (ELISA), гомогенной флуоресценции с временным разрешением (HTRF) или позитронно-эмиссионной томографии (PET).
101. Способ по любому из вариантов осуществления 97-100, где ассоциированное с потерей функции TREM2 заболевание представляет собой нейровоспалительное или нейродегенеративное заболевание, где необязательно нейровоспалительное или нейродегенеративное заболевание представляет собой болезнь Альцгеймера, лобно-височную деменцию, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Насу-Хакола, рассеянный склероз, боковой амиотрофический склероз (ALS), энцефалит с антителами к NMDA-рецепторам, аутизм, волчанку головного мозга (NP-SLE), индуцированную химиотерапией периферическую нейропатию (CIPN), постгерпетическую невралгию, хроническую воспалительную демиелинизирующую полинейропатию (CIDP), эпилепсию, синдром Гийена-Барре (GBS), миозит с тельцами включения, лизосомные болезни накопления, сфингомиелинлипидоз (Ниманна-Пика C), мукополисахаридоз II/IIIB, метахроматическую лейкодистрофию, мультифокальную моторную нейропатию, миастению гравис, болезнь Бехчета с вовлечением нервных структур, оптиконейромиелит (NMO), неврит зрительного нерва, полимиозит, дерматомиозит, энцефалит Расмуссена, синдром Ретта, инсульт, поперечный миелит, травматическое повреждение головного мозга, повреждение спинного мозга, вирусный энцефалит или бактериальный менингит.
102. Способ по любому из вариантов осуществления 97-101, где заболевание представляет собой болезнь Альцгеймера.
103. Способ по любому из вариантов осуществления 97-101, где заболевание представляет собой болезнь Паркинсона.
104. Способ по любому из вариантов осуществления 97-101, где заболевание представляет собой рассеянный склероз.
105. Способ по любому из вариантов осуществления 97-101, где заболевание представляет собой лобно-височную деменцию.
106. Способ по любому из вариантов осуществления 97-105, где указанные антитело или его антигенсвязывающий фрагмент, молекулу нуклеиновой кислоты или набор молекул нуклеиновой кислоты, вектор, клетку или фармацевтическую композицию вводят субъекту посредством перорального, внутривенного, внутричерепного, интратекального, подкожного или интраназального путей.
107. Способ стабилизации белка hTREM2 у субъекта, при этом способ включает введение субъекту антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-64, молекулы нуклеиновой кислоты или набора молекул нуклеиновой кислоты по любому из вариантов осуществления 65-67, вектора по любому из вариантов осуществления 68-82, клетки по варианту осуществления 83 или фармацевтической композиции по варианту осуществления 85 в количестве, эффективном для стабилизации hTREM2.
108. Способ по любому из вариантов осуществления 97-107, при этом способ дополнительно включает введение по меньшей мере одного дополнительного терапевтического средства субъекту или выполнение по меньшей мере одной дополнительной терапевтической процедуры.
109. Способ по варианту осуществления 108, где указанное дополнительное терапевтическое средство включает одно или несколько из ингибиторов ВАСЕ, антител к тау-белку, антисмысловых олигонуклеотидов против тау-белка, антител к бета-амилоиду, финголимода, BG12 или диметилфумарата, бета-интерферона или тисабри.
110. Способ по варианту осуществлениия 108 или 109, где антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-64, молекулу нуклеиновой кислоты или набор молекул нуклеиновой кислоты по любому из вариантов осуществления 65-67, вектор по любому из вариантов осуществления 68-82, клетку по варианту осуществления 83 или фармацевтическую композицию по варианту осуществления 85 вводят параллельно с дополнительным терапевтическим средством, до него или после него.
111. Способ по любому из вариантов осуществления 97-110, где введение антитела или его антигенсвязывающего фрагмента, молекулы нуклеиновой кислоты или набора молекул нуклеиновой кислоты, вектора, клетки или фармацевтической композиции обеспечивает один или несколько из следующих эффектов a-d:
а) повышение TREM2-зависимой клеточной активности, такой как фагоцитоз и хемотаксис;
b) запуск TREM2-зависимой транскрипции гена;
c) усиление TREM2-зависимых внутриклеточных сигнальных путей посредством Syk-фосфорилирования;
d) усиление очистки от клеточного дебриса.
ПРИМЕРЫ
[00420] Настоящее изобретение дополнительно описано в следующих примерах, которые не ограничивают объем настоящего изобретения, описанный в формуле изобретения.
Пример 1. Получение антител к TREM2 человека
Материалы и способы
Реагенты
[00421] Для отбора антител, распознающих TREM2 человека, мыши и яванского макака, применяли несколько стратегий пэннинга. Антитела к белкам TREM2 получали путем отбора клонов, обладающих высокой аффинностью связывания, с использованием фагмидных библиотек HuCAL PLATINUM®, основанных на HuCAL® (Prassler et al. 2011; Rothe et al. 2008; Knappik et al. 2000). В библиотеках фагового дисплея MorphoSys используется технология CysDisplay™ для отображения Fab на поверхности фага (WO 01/05950). Для выделения антител к TREM2 выполняли стандартные стратегии, а также стратегию RapMAT пэннинга для созревания аффинности, с использованием подходов твердофазного пэннинга, пэннинга в растворе, цельноклеточного и дифференциального цельноклеточного пэннинга.
Первоначальный пэннинг
[00422] Для получения первоначальных кандидатов, связывающихся с раствором с антигеном TREM2, выполняли пэннинг с захватом Fc и дифференциальный цельноклеточный пэннинг.
Таблица 2. Стратегии первоначального и резервного пэннинга и применяемые концентрации антигенов.
(100 нМ)
(20 нМ)
(4 нМ)
(2 мкг/мл) hTREM2 IgSF-стеблевая область hTREM1-hFc для предварительной очистки (2 мкг/мл)
(обработанный NVP-10-17) CHO-hDAP12 после адсорбции hTREM2-IgSF-hFc для предварительной очистки
(100 нМ) блокирующий hTREM2-IgSF-hFc (500 нМ)
(обработанный NVP-10-17)
Пэннинг с захватом Fc
[00423] Перед процессом выбора антигена обязательно выполнение ELISA для проверки покрытия, чтобы определить оптимальную концентрацию антигенного покрытия. Для пэннинга с захватом антиген (hTREM1 IgSF-стеблевая область hTREM2-hFc, hTREM2 ECD (19-174)-hFc или hTREM2 ECD-His) иммобилизовали на 96-луночном планшете с помощью соответствующего захватывающего антитела, которое зависело от метки, слитой с соответствующим антигеном (козьи и мышиные антитела к Fc человека для Fc-меченого антигена, подробности см. в таблице 2).
[00424] Количество лунок зависело от количества используемых пулов подбиблиотек. Параллельно с подготовкой лунок фаги блокировали с помощью Chemiblocker, содержащего 0,05% Tween-20; к блокирующему буферу добавляли дополнительные блокирующие реагенты, чтобы избежать отбора антител к метке или захватывающего антитела (гамма-глобулин человека, козы и мыши для пэннинга с захватом Fc). Для предварительной очистки от блокированных фагов соответствующее количество лунок 96-луночного планшета покрывали с помощью hTREM2-IgSF-стеблевая область hTREM1-hFc. Добавляли фаги и инкубировали в течение 30 мин при комнатной температуре. Супернатант переносили в другую лунку, покрытую немишенью, и инкубацию повторяли три раза. После процедуры блокирования и предварительной очистки смесь фагов добавляли в соответствующие лунки, покрытые антигеном, и антителам на фагах позволяли связываться с антигеном в течение 1,5 часа при комнатной температуре. Промывание с использованием PBS/Tween 20 и PBS гарантировало удаление неспецифически связанного фага с последующим элюированием специфически связанного фага с использованием DTT. Элюат переносили в культуру TG1 E. coli для инфицирования фагом. После инкубации при 37°C в течение 45 мин культуры центрифугировали, осадки бактерий ресуспендировали в свежей среде и высевали на чашки с агаром. После разрастания колонии соскабливали с чашек и использовали для "спасения" фага, поликлональной амплификации отобранных клонов и получения фага, как описано ниже. При наличии очищенного фага начинали следующий цикл пэннинга.
[00425] Второй и третий циклы пэннинга с захватом проводили согласно тому же протоколу, что и для первого цикла пэннинга. Количества антигена уменьшали и применяли условия промывки с повышенной жесткостью.
[00426] Исходное связывающее вещество MOR041874 получали в результате этой стратегии пэннинга.
Пэннинг в растворе с магнитными гранулами, связанными со стрептавидином
[00427] Необходимым условием для пэннинга в растворе было биотинилирование антигена и подтверждение сохраняющейся активности биотинилированного антигена. Во время пэннинга в растворе фаг, отображающий Fab, и биотинилированный антиген инкубировали в растворе, что облегчало доступ фага к антигену.
[00428] Соответствующее количество гранул стрептавидина блокировали с помощью Chemiblocker. Параллельно соответствующее количество фагов блокировали с помощью Chemiblocker, содержащего 0,05% Tween-20 и гамма-глобулин №1 человека (0,05 мг/мл), чтобы избежать отбора клонов, связывающих hFc. Для удаления фага, связывающегося со стрептавидином или гранулами, проводили предварительную адсорбцию блокированных фаговых частиц с использованием блокированных гранул со стрептавидином. Затем биотинилированный TREM2 добавляли к предварительно адсорбированным и блокированным фаговым частицам и антителам на фаге предоставляли возможность связывания с антигеном в растворе в течение 1 часа при комнатной температуре. Комплексы фаг-антиген захватывали с помощью блокированных гранул со стрептавидином, и фаговые частицы, связавшиеся с гранулами со стрептавидином, собирали с помощью магнитного сепаратора. Неспецифически связанные фаги промывали в несколько стадий промывки. Специфически связанные фаги элюировали с гранул со стрептавидином посредством добавления DTT. Элюат переносили в культуру TG1 E. coli для инфицирования фагом. После инкубации при 37°C в течение 45 мин культуры центрифугировали, осадки бактерий ресуспендировали в свежей среде и высевали на чашки с агаром. После разрастания колонии соскабливали с чашек и использовали для "спасения" фага, поликлональной амплификации отобранных клонов и получения фага, как описано ниже. При наличии очищенного фага начинали следующий цикл пэннинга.
[00429] Второй и третий циклы пэннинга в растворе на основе гранул проводили согласно тому же протоколу, что и для первого цикла пэннинга. Применяли условия промывки с повышенной жесткостью. Исходные связывающие вещества MOR042492, MOR042493 и MOR042556 получали в результате этой стратегии пэннинга.
Дифференциальный цельноклеточный пэннинг (dWCP)
[00430] За день до пэннинга клетки предварительно обрабатывали в течение ночи с помощью 5 мкМ DPC333 (Qian et al. 2007. Drug Metab and Disp 35:1916-1925) для увеличения поверхностной экспрессии TREM2. Для каждого пэннинга соответствующее количество фагов блокировали промывочным буфером (DPBS+ / 5% FCS/0,02% NaN3) и предварительно очищали в соответствии со способами, описанными выше для пэннинга с захватом Fc. Параллельно с этим подходящее количество клеток-мишеней, экспрессирующих антиген TREM2 (1×107 клеток/субкод), и подходящее количество адсорбированных клеток без экспрессии антигена TREM2 на пул фага блокировали промывочным буфером. Блокированные клетки-мишени осаждали путем центрифугирования, ресуспендировали в растворе предварительно блокированных фаговых частиц и антителам на фаге предоставляли возможность связывания с антигеном, представленным на клетке, при 4°C в течение 2 часов, чтобы избежать интернализации рецепторов. Комплексы фаг-клетка промывали несколько раз. Специфически связанные фаги элюировали из клеток-мишеней посредством центрифугирования клеток и ресуспендирования осадка в 50 мМ цитратном буфере pH 3,5/150 мМ NaCl и инкубировали в течение 10 мин при комнатной температуре. После центрифугирования супернатант (элюат) нейтрализовали с помощью 2 М Tris-основания и наносили на адсорбированные клетки для удаления фага, связывающегося с молекулами клеточной поверхности, отличными от антигена-мишени (после адсорбции). Специфически связанные фаги элюировали из клеток-мишеней с использованием DTT и конечный супернатант переносили в культуру TG1 E. coli для инфицирования фагом, как описано выше.
[00431] Второй цикл пэннинга проводили в соответствии с пэннингом в растворе, описанным выше. Третий цикл цельноклеточного пэннинга проводили согласно тому же протоколу, что и для первого цикла пэннинга.
[00432] Исходные связывающие вещества MOR042596, MOR042752 и MOR042765 получали в результате этой стратегии пэннинга.
Получение Fab-презентирующих фаговых частиц
[00433] Новые фаговые частицы, представляющие Fab-фрагменты на своей поверхности, получали для каждого цикла отбора. Для каждого фагового препарата 12 мл 2x среды YT/Cam/Glc инокулировали бактериями из исходного раствора соответствующей библиотеки в глицерине, в результате чего значение OD600 составляло 0,1-0,2. Культуры встряхивали в течение 30-90 мин при 120 об/мин и 37°C до достижения OD600 0,45-0,55. Затем к бактериальной культуре добавляли хелперный фаг при множественности заражения 10 с последующей инкубацией в течение 30 мин при 37°C без встряхивания, а затем в течение 30 мин при 37°C при встряхивании при 160 об/мин. Бактерии центрифугировали и супернатант, содержащий хелперный фаг, отбрасывали. Инфицированные фагом бактерии ресуспендировали в 400 мл 2x среды YT/Cam/Kan/IPTG и инкубировали в течение ночи при 22°C со встряхиванием при 120 об/мин. На следующий день бактерии из ночной культуры осаждали и собирали супернатант, содержащий Fab-презентирующий фаг. Осаждение фага проводили посредством добавления 1/5 общего объема предварительно охлажденного PEG/NaCl к фагосодержащему супернатанту. Образец инкубировали в течение не менее 30 мин на льду, пока облака осаждающегося фага не становились видимыми. Осажденные фаги центрифугировали и ресуспендировали в PBS. Титры фагов определяли с помощью точечного титрования.
Удаление PTM до созревания аффинности
[00434] Поскольку исходный кандидат MOR042492 включал критическую посттрансляционную модификацию (PTM) в свой HCDR3, этот кандидат восстанавливали перед тем, как перейти к определению аффинности. Таким образом, три восстановленных варианта получали путем замены олигонуклеотидов, а успешное выполнение замены олигонуклеотидов подтверждали с помощью секвенирования. Восстановленные варианты тестировали как Fab-содержащие неочищенные бактериальные лизаты на hTREM2-ECD (19-174)-hFc. Варианты, демонстрирующие аналогичные профили связывания, объединяли для созревания аффинности (MOR043962 и MOR043963).
Создание библиотек созревания аффинности HuCAL PLATINUM® и библиотек HuCAL PLATINUM® RapMAT
[00435] Для увеличения аффинности и биологической активности выбранных антител области CDR-L3 и CDR-H2 оптимизировали путем кассетного мутагенеза с применением тринуклеотид-направленного мутагенеза, оставляя при этом неизменными каркасные области ( et al. (1994) Nucleic Acids Res 22, 5600-5607).
et al. (1994) Nucleic Acids Res 22, 5600-5607).
[00436] Клонирование библиотек созревания аффинности выполняли в векторе CysDisplay™, кодирующем исходные Fab-фрагменты. Если они еще не присутствовали в векторе CysDisplay™, последовательности ДНК, кодирующие исходные Fab-фрагменты, переносили в соответствующий вектор посредством рестрикционного расщепления и лигирования перед клонированием библиотеки.
[00437] Создание библиотек для созревания аффинности HuCAL PLATINUM® выполняли для каждого кандидата на созревание аффинности индивидуально или перед созданием библиотеки объединяли набор различных исходных антител. Для оптимизации CDR-L3 фрагмент ДНК размером ~400 п.о., кодирующий CDR-L3, каркасную область 4, а также константную область легкой цепи, удаляли из последовательности, кодирующей исходные антитела, путем рестрикционного расщепления и заменяли репертуаром фрагментов ДНК, кодирующих диверсифицированные области CDR-L3 вместе с каркасной областью 4 и константным доменом.
[00438] Во втором библиотечном наборе была диверсифицирована последовательность, кодирующая CDR-H2, при этом соединительные каркасные области оставались неизменными. С целью снижения влияния генетического окружения исходной недиверсифицированной последовательности фрагмент ДНК размером ~ 150 п.о., содержащий исходные последовательности CDR-H2 и каркасной области 3, заменяли имитационной последовательностью размером ~590 п.о. посредством рестрикционного расщепления и лигирования перед тем, как диверсифицированную кассету CDR-H2 (включая каркасную область 3) вставляли также посредством рестрикционного расщепления и лигирования. Этот способ применяли для всех кандидатов на созревание аффинности, кроме MOR042556.
[00439] Создание библиотек HuCAL PLATINUM® RapMAT выполняли для выбранных клонов (исходный кандидат MOR042556). Следовательно, фрагмент ДНК размером ~370 п.о., нарушающий последовательность ДНК от сигнала phoA до каркасной области 3 (включая H-CDR1 и CDR-H2), удаляли посредством рестрикционного расщепления и заменяли репертуаром фрагментов ДНК, кодирующих диверсифицированные области CDR-H2 и недиверсифицированную каркас-специфичную область CDR-H1. Электропорацию смесей для лигирования проводили в клетках MC1061F' с получением примерно 108-109 в > 5×106 независимых колоний. Амплификацию библиотеки проводили, как описано ранее (Rauchenberger et al. 2003). Для контроля качества примерно 10-20 отдельных клонов на библиотеку произвольным образом отбирали и секвенировали.
Пэннинг для созревания аффинности
[00440] Для повышения аффинности и биологической активности ранее выбранных фрагментов антител области CDR-L3 и CDR-H2 заменяли параллельно с помощью диверсифицированных кассет/модулей (Prassler et al. 2009), как описано выше. При необходимости исходные Fab-фрагменты переносили из соответствующего вектора экспрессии в вектор CysDisplay™ до клонирования библиотеки для созревания аффинности.
[00441] Для отбора кандидатов с улучшенной аффинностью фаги, полученные из библиотек для созревания аффинности, подвергали трем циклам пэннинга для созревания аффинности. Пэннинг в растворе и dWCP выполняли, как описано выше, и в соответствии с условиями, описанными в таблице 3.
[00442]
Таблица 3. Стратегии пэннинга для созревания аффинности и применяемые концентрации антигенов.
MOR043963
[00443] Жесткость пэннинга повышали путем снижения концентрации антигена в каждом цикле пэннинга (Low et al. 1996). В дополнение к снижению количества антигена, в третьем цикле пэннинга проводили отбор по скорости диссоциации (Hawkins et al. 1992): комплекс антиген-фаг инкубировали с избытком небиотинилированного антигена TREM2 для обогащения только высокоаффинных связывающих веществ; ожидали, что слабые связывающие вещества будут предпочтительно связывать избыток антигена в растворе и, следовательно, могут быть удалены. Это объединили со стадиями интенсивной промывки. Элюирование высокоаффинных фагов из TREM2, связанного с магнитными гранулами, выполняли с помощью DTT.
Субклонирование из дисплейного вектора в вектор для экспрессии Fab у E. coli
[00444] Для способствования быстрой экспрессии растворимого Fab в E. coli кодирующие Fab вставки выбранного фага HuCAL PLATINUM® субклонировали из дисплейного вектора pMORPH®30 в вектор для экспрессии Fab pMORPH®x11_Fab-FH. Субклонирование выполняли посредством тройного расщепления с помощью EcoRI | XbaI | BmtI.
Субклонирование в вектор экспрессии IgG и FabCys для клеток HKB11
[00445] Для экспрессии полноразмерного IgG или моновалентного FabCys в клетках HKB11 отобранные кандидаты или пулы кандидатов клонировали в соответствующий вектор экспрессии, содержащий необходимые признаки/ метки. Сводные данные о форматах IgG и FabCys, а также о соответствующих доступных векторах приведена в таблице 4.
[00446] Субклонирование проводили в виде двухстадийного способа удобного и эффективного преобразования большого количества клонов Fab с уникальными последовательностями в формат IgG.
Таблица 4. Серия векторов экспрессии для IgG и FabCys pMorph4 HuCAL PLATINUM®
Субклонирование из HuCAL PLATINUM® RapCLONE®
[00447] На первой стадии клонирования эукариотическую кассету экспрессии вводили в дисплейный вектор или вектор для экспрессии Fab в E. coli посредством расщепления с помощью BsiWI | MfeI (для пулов κ) или HpaI | MfeI (для пулов λ) и последующего лигирования. После этого следовала вторая стадия клонирования, на которой пулы Fab, содержащие кассету экспрессии, расщепляли с помощью EcoRV | BlpI (пулы κ и λ) и затем клонировали в акцепторный вектор для экспрессии в клетках млекопитающих.
Получение в E. coli
Получение Fab-содержащих неочищенных бактериальных лизатов
[00448] Инокулировали 96-луночные/384-луночные титрационные микропланшеты, предварительно заполненные питательной средой (2xYT, содержащая хлорамфеникол, IPTG и низкий уровень глюкозы). Планшеты инкубировали при 37°C для разрастания бактерий и встряхивали в течение ночи при 22°C для экспрессии Fab. На следующий день экспрессионные культуры лизировали посредством добавления буфера BEL, содержащего боратный буфер, EDTA и лизоцим. EDTA не применяли, если лизаты использовались для скрининга чувствительных клеток.
Получение His-меченных Fab-фрагментов в исследовательских масштабах
[00449] Экспрессию Fab-фрагментов, кодируемых бактериальным вектором экспрессии, в клетках TG1 F- E. coli осуществляли в культурах во встряхиваемых колбах с использованием 500 мл 2x среды YT, дополненной 0,1% глюкозой и 34 мкг/мл хлорамфеникола. Культуры встряхивали до достижения значения OD600, составляющего 0,5. Экспрессию Fab индуцировали посредством добавления IPTG (изопропил-β-D-тиогалактопиранозид) и дальнейшего культивирования в течение 20 ч. Клетки собирали и разрушали с использованием лизоцима. His6-меченные Fab-фрагменты выделяли с помощью IMAC (Bio-Rad) и элюировали с использованием имидазола. Замену буфера на 1x PBS Дульбекко (pH 7,2) проводили с использованием колонок 'PD10' (GE Healthcare). Образцы подвергали стерилизующей фильтрации (0,2 мкм). Концентрации белков определяли с помощью UV-спектрофотометрии и показатели чистоты IgG анализировали в денатурирующих, восстанавливающих и невосстанавливающих условиях с использованием CE-SDS (LabChip GXII, Perkin Elmer). Для анализа препаратов IgG в нативном состоянии проводили HP-SEC.
Получение IgG в клетках HKB11
Продвинутое мелкомасштабное получение IgG
[00450] Эукариотические клетки HKB11 трансфицировали ДНК-вектором экспрессии в клетках млекопитающих, кодирующим как тяжелую, так и легкую цепи IgG. Супернатанты культуры клеток собирали через 7 дней после трансфекции и подвергали аффинной хроматографии с белком A (MabSelect SURE™, GE Healthcare). Образцы оставались в нейтрализованном буфере для элюирования (NaPS: 137 мМ фосфат Na, 81 мМ NaCl, pH 7). Образцы подвергали стерилизующей фильтрации (0,2 мкм). Концентрации белков определяли с помощью UV-спектрофотометрии и показатели чистоты IgG анализировали в денатурирующих, восстанавливающих условиях с использованием CE-SDS (LabChip GXII™, Perkin Elmer). Для анализа препаратов IgG в нативном состоянии проводили HP-SEC.
Получение IgG в исследовательских масштабах
[00451] Эукариотические клетки HKB11 трансфицировали ДНК-вектором экспрессии в клетках млекопитающих, кодирующим как тяжелую, так и легкую цепи IgG. Супернатанты культуры клеток собирали в день 3 или 6 после трансфекции и подвергали стандартной аффинной хроматографии с белком A (MabSelect SURE, GE Healthcare). Проводили замену буфера на 1x PBS Дульбекко (pH 7,2, Invitrogen) и образцы подвергали стерилизующей фильтрации (0,2 мкм). Концентрации белков определяли с помощью UV-спектрофотометрии и показатели чистоты IgG анализировали в денатурирующих, восстанавливающих и невосстанавливающих условиях с использованием CE-SDS (LabChip GXII, Perkin Elmer). Для анализа препаратов IgG в нативном состоянии проводили HP-SEC.
Получение материалов для определения характеристик in vivo
[00452] Эукариотические клетки HKB11 трансфицировали ДНК-вектором экспрессии в клетках млекопитающих, кодирующим как тяжелую, так и легкую цепи IgG. Супернатанты культуры клеток собирали в день 6 после трансфекции и подвергали аффинной хроматографии с белком A (MabSelect SURE, GE Healthcare). При необходимости выполняли вторую стадию очистки (препаративная SEC, Superdex 200, GE Healthcare) для удаления агрегатов. Проводили замену буфера на 1x PBS Дульбекко (pH 7,2, Invitrogen) и образцы подвергали стерилизующей фильтрации (0,2 мкм). Концентрации белков определяли с помощью UV-спектрофотометрии и показатели чистоты IgG анализировали в денатурирующих, восстанавливающих и невосстанавливающих условиях с использованием CE-SDS (LabChip GXII, Perkin Elmer). Для анализа препаратов IgG в нативном состоянии проводили HP-SEC. Уровни эндотоксина определяли с помощью анализа KQCL (Lonza). Идентичность белков подтверждали с помощью масс-спектрометрического анализа.
Получение FabCys в клетках HKB11
Получение немеченых FabCys в исследовательских масштабах
[00453] Эукариотические клетки HKB11 трансфицировали ДНК-вектором экспрессии в клетках млекопитающих, кодирующим как тяжелую, так и легкую цепи FabCys с дисульфидными мостиками. Супернатанты культуры клеток собирали в день 3 или 7 после трансфекции и подвергали аффинной хроматографии с CH1 (Capture Select IgG-CH1, Thermo Scientific). Проводили замену буфера на 1x PBS Дульбекко (pH 7,2, Invitrogen) и образцы подвергали стерилизующей фильтрации (размер пор 0,2 мкм). Концентрации белков определяли с помощью UV-спектрофотометрии и показатели чистоты FabCys анализировали в денатурирующих, восстанавливающих и невосстанавливающих условиях с использованием CE-SDS (LabChip GXII, Perkin Elmer). Для анализа препаратов FabCys в нативном состоянии проводили HP-SEC.
Получение AviHis-меченных FabCys в исследовательских масштабах
[00454] Эукариотические клетки HKB11 трансфицировали ДНК-вектором экспрессии в клетках млекопитающих, кодирующим как тяжелую, так и легкую цепи FabCysAviHis с дисульфидными мостиками. Супернатанты культуры клеток собирали в день 3 или 7 после трансфекции и подвергали аффинной хроматографии с ионами металлов (Protino Ni-NTA, Macherey Nagel). Проводили замену буфера на 1x PBS Дульбекко (pH 7,2, Invitrogen) и образцы подвергали стерилизующей фильтрации (размер пор 0,2 мкм).
[00455] Концентрации белков определяли с помощью UV-спектрофотометрии и показатели чистоты FabCysAviHis анализировали в денатурирующих, восстанавливающих и невосстанавливающих условиях с использованием CE-SDS (LabChip GXII, Perkin Elmer). Для анализа препаратов FabCysAviHis в нативном состоянии проводили HP-SEC.
Сводные данные о стратегиях пэннинга
[00456] Стратегии первоначального и резервного пэннинга направлены на отбор антител к обоим внеклеточным доменам TREM2, домену IgSF и "стеблевой" области. Поэтому включили стратегии для полного ECD TREM2, а также более специфические стратегии для отбора "стеблевой" области и даже клонов, специфических в отношении сайта расщепления шеддазой. Для каждой целевой специфичности в отношении домена TREM2 применяли 3 различных режима презентации антигена: пэннинг в растворе с использованием биотинилированного антигена, пэннинг с захватом Fc и дифференциальный цельноклеточный пэннинг с антиген-экспрессирующими клетками в 1м и 3м циклах пэннинга и рекомбинантным антигеном во 2м цикле пэннинга. Специфичность в отношении "стеблевой" области может быть достигнута путем использования перестановочных конструкций, состоящих из домена IgSF TREM1 в комбинации со "стеблевой" областью TREM2 или наоборот, в качестве антигена для пэннинга (hTREM1 IgSF-стеблевая область hTREM2) или для блокирования (hTREM2 IgSF-стеблевая область hTREM1). На основании экспериментов по картированию участок сайта расщепления шеддазой содержит 20 а.к. в прилегающей к мембране части "стеблевой" области TREM2; соответствующий пептид 78 использовали для обогащения клонов, специфических в отношении сайта расщепления.
[00457] Антитела ко всем целевым областям ECD TREM2 можно было идентифицировать. Однако отобрали только небольшое количество клонов с наиболее многообещающим профилем стабилизирующей активности (т.е. специфичностью в отношении "стеблевой" области в сочетании с перекрестной реактивностью в отношении белка яванского макака и клеточным связыванием).
Сводные данные о результатах скрининга
Первичный скрининг
[00458] Все субкоды первоначальных пэннингов подвергали скринингу на биотинилированном hTREM2, mTREM2, hTREM1 IgSF-стеблевая область hTREM2, hTREM2 IgSF-стеблевая область hTREM1 и hTREM1 в подходе мультиплексирования с использованием устройства Intellicyt (368 клонов на субкод). Всего скринингу подвергли 9200 клонов из первоначальных пэннингов и в результате отбирали 736 первичных совпадений. Большинство клонов, специфических по отношению к домену IgSF, происходит в результате пэннинга в растворе на hTREM2, тогда как большинство антител, специфических в отношении "стеблевой" области, получают в результате дифференциального цельноклеточного пэннинга.
[00459] Резервные пэннинги подвергали скринингу аналогично первоначальным пэннингам. Параллельно все субкоды, включающие цикл(ы) клеточного пэннинга, подвергали скринингу на исходных клетках CHO-DAP12, а также на клетках CHO-DAP12-hTREM2. Кроме того, в зависимости от типа клеток, используемых в цикле клеточного пэннинга, некоторые субкоды дополнительно подвергали скринингу на клетках CHO-DAP12-cyTREM2, CHO-DAP12-mTREM2, CHO-DAP12-hTREM1 IgSF-стеблевая область hTREM2, HEK-DAP12-слитой белок hTREM2 и THP1-NFAT-luc. Всего подвергли скринингу 10304 клона и в результате чего отбирали 402 первичных совпадения.
Вторичный скрининг и определение разнообразия
[00460] На основании вторичного скрининга 736 первичных совпадений из первоначальных пэннингов (связывание с hu/cy/mu TREM2 с использованием различных рекомбинантных белков и клеточных линий, доменная специфичность с использованием перестановочных конструкций TREM2/TREM1 и пептид 78 сайта расщепления, контр-скрининг TREM1), отбирали 284 клона для секвенирования VH. Среди них 104 клона имели уникальные последовательности HCDR3. Аналогичным образом, 402 первичных совпадения из резервных пэннингов подвергали вторичному скринингу и секвенированию VH для отобранных клонов, в результате чего получали 186 новых клонов с уникальными HDR3. Идентифицировали только 5 последовательностей, которые уже были известны из первоначальной кампании.
Подтверждение и дальнейшее определение характеристик уникальных клонов
[00461] Посредством дополнительных подтверждающих скрининговых анализов 81/104 уникальных клонов из первоначальной кампании и 165/186 уникальных клонов из резервной кампании определили как клоны специфичных к hTREM2 антител и отбирали для последующего определения функциональных характеристик (всего 246 клонов). По характеру связывания эти клоны можно разделить на разные профильные группы. Большинство клонов были специфическими в отношении домена IgSF (173 клона, 70%). Большинство этих клонов специфически связываются с клетками, сверхэкспрессирующими TREM2, и обладают перекрестной реактивностью с TREM2 яванского макака (157 клонов). Кроме того, идентифицировали 53 (22%) антитела, специфических в отношении "стеблевой" области. 19/53 клонов не связывались с пептидом 78 сайта расщепления, и поэтому их называют антителами "стеблевой области (вне сайта расщепления)"; 14 из этих клонов демонстрируют TREM2-специфическое связывание с клетками. 34/53 клонов связывают TREM2 в области его сайта расщепления (антитела "стеблевой области (в сайте расщепления")). Остальные 20 клонов (8%) связывают TREM2-ECD, но ни одну из двух перестановочных конструкций, и, таким образом, их определяли как антитела, связывающие "неустановленный домен в пределах ECD"; 10/20 клонов действительно специфически связывают клетки, сверхэкспрессирующие TREM2.
Отбор кандидатов на созревание аффинности
[00462] Отбор кандидатов на созревание аффинности в основном основывался на функциональных характеристиках идентифицированных антител. Поскольку TREM2 принадлежит к семейству рецепторов врожденного иммунитета, известно, что он взаимодействует с LPS и другими поверхностными белками бактерий. Следовательно, было важно переключиться с бактеральной платформы на платформу млекопитающих для получения антител к TREM2, чтобы получить материал, который подходит для соответствующих функциональных анализов.
Определение характеристик IgG
[00463] Помимо характеристик связывания (доменная специфичность, межвидовая перекрестная реактивность, специфическое связывание клеток, нецелевое связывание, аффинность, эпитоп-специфическая сортировка) рассматривали различные функциональные аспекты (стабилизация уровня TREM2 на клеточной поверхности в различных клеточных системах, активация сигнала в NFAT RGA, интернализация, конкуренция за связывание лиганда, фагоцитоз).
[00464] Оказалось, что только несколько антител обладают стабилизирующим TREM2 действием, т.е. защищают от шеддинга эктодомена TREM2. Учитывая все остальные критерии, идентифицировали пять многообещающих антител, стабилизирующих TREM2: MOR042492, MOR042493 и MOR042589, MOR042596, MOR042556.
[00465] В дополнение к стабилизирующим кандидатам можно было идентифицировать антитела, активирующие сигнал TREM2. Опять же, учитывая остальные соответствующие критерии, наиболее интересными кандидатами были MOR041874, MOR042785, MOR042752, MOR042765.
[00466] Эти девять кандидатов представлены в таблице 5.
Таблица 5. Кандидаты на созревание аффинности.
(кратное изменение в RGA)
Mph-FACS
* гетерогенное связывание; ** слабое связывание, быстрая диссоциация; *** нет специфического связывания до 300 нМ
Удаление PTM
[00467] Поскольку два из девяти кандидатов на созревание аффинности (MOR042492, MOR042589) включали посттрансляционные модификации (PTM) в их HCDR3, эти клоны восстанавливали до созревания аффинности. Таким образом, получили три восстановленных варианта на каждый кандидат на созревание аффинности путем замены олигонуклеотидов, а успешное выполнение замены олигонуклеотидов подтверждали с помощью секвенирования. Восстановленные варианты дополнительно проверяли на функциональность с помощью скрининга с использованием BEL. Варианты, демонстрирующие аналогичные профили связывания, объединяли для созревания аффинности. Исходный MOR042589 дополнительно использовали для созревания аффинности, поскольку варианты демонстрировали более низкую интенсивность связывания, чем их исходный клон.
Создание библиотек для созревания аффинности
[00468] Наконец, девять библиотек для созревания аффинности (см. таблицу 6), состоящие из шести ведущих кандидатов, вступали в созревание отдельно. Выборка также включала три пула до трех клонов каждый. Это были либо клоны с идентичными каркасными областями, нацеленные на один и тот же эпитоп, либо дочерние клоны, полученные от одного исходного клона путем удаления PTM.
Таблица 6. Отобранные кандидаты на созревание аффинности и состав библиотеки.
Сводные данные о пэннингах для созревания аффинности
[00469] Поскольку большинство кандидатов на созревание аффинности получали из пэннингов в растворе или дифференциальных цельноклеточных пэннингов во время первоначальных пэннингов, в основном проводили пэннинги в растворе при высокой жесткости, а также клеточные пэннинги для идентификации улучшенных связывающих веществ после создания библиотеки. Следовательно, пэннинг в растворе, который представлял собой наиболее успешную стратегию из первоначальных пэннингов, проводили в течение трех циклов с каждой библиотекой VH и VL каждого клона отдельно. Кроме того, результаты пэннинга, полученные из пэннинга в растворе 1го цикла, объединяли. Таким образом, созревшие субкоды VH и VL каждой библиотеки пэннинга, а также библиотеки VH и VL клонов, демонстрирующих аналогичные профили связывания, объединяли до того, как они вошли во 2й цикл пэннинга. Пулы входили в клеточные пэннинги с использованием клеток CHO-DAP12-cyTREM2 без обработки с помощью DPC333, чтобы снизить уровни TREM2 и тем самым повысить жесткость данных клеточных пэннингов. Данные пэннинги должны гарантировать получение высокоаффинных связывающих клетки веществ, в то время как пэнниги с использованием мышиных клеток BV2, примененные к пулам из нескольких кандидатов, проводили для получения перекрестно-реактивных hu/m/cy клонов. Повышения жесткости в течение трех циклов пэннинга достигали за счет снижения концентраций антигена, а также отбора по koff во время 3го цикла путем конкуренции с небиотинилированным антигеном в растворе. Кроме того, последующая корректировка концентраций антигена во время пэннингов в соответствии с результатами предыдущих циклов пэннинга обеспечивала подходящие результаты пэннинга и обогащение высокоаффинных связывающих веществ. Таким образом, идентифицировали клоны, перечисленные в таблице 7.
Таблица 7. Обзор предокончательных кандидатов.
Скрининги и определение характеристик
ELISA
[00470] Методики ELISA использовали как для скрининга одиночных клонов Fab, идентифицированных по результатам пэннинга на антигенах-мишенях, так и для определения характеристик очищенных антител.
Прямое покрытие антигена
[00471] Антигены иммобилизовали на титрационных микропланшетах (см. таблицу 8). Планшеты блокировали и инкубировали с антителами, такими как Fab, содержащими неочищенные лизаты E. coli или очищенные образцы Fab или IgG. Связанные антитела выявляли с использованием соответствующих вторичных антител, связанных с щелочной фосфатазой (AP), в сочетании с субстратом для флуоресценции 'AttoPhos'. Между отдельными стадиями анализа проводили множество стадий промывки.
Таблица 8. Антигены и покрытие для прямого ELISA.
ELISA захвата антигена
[00472] При других настройках ELISA антиген (cyTREM2-ECD (19-174)-hFc, 1,0 мкг/мл) захватывался на планшетах с помощью специфического к метке антитела, нанесенного на титрационные микропланшеты (например, антитела к Fc). Связанные антитела выявляли с использованием соответствующих вторичных антител, связанных с щелочной фосфатазой (AP), в сочетании с субстратом для флуоресценции 'AttoPhos'. Между отдельными стадиями анализа проводили множество стадий промывки.
Проверка экспрессии Fab
[00473] Для подтверждения экспрессии Fab в неочищенных бактериальных лизатах планшеты покрывали антителами, специфическими к Fd-фрагменту. Связанные Fab выявляли с использованием соответствующих специфических антител к Fab, связанных с щелочной фосфатазой (AP), в сочетании с субстратом для флуоресценции 'AttoPhos'. Между отдельными стадиями анализа проводили множество стадий промывки.
Мультиплексирование с помощью IntelliCyt
[00474] Для одновременной оценки видовой перекрестной реактивности и/или нежелательного нецелевого связывания проводили скрининг в формате 384-луночного планшета с использованием платформы для скрининга HTFC/iQue (IntelliCyt).
Скрининг гранул, покрытых рекомбинантным белком
[00475] Гранулы с различным уровнем собственной флуоресценции связывали с антигенами, физически объединяли в единую суспензию и инкубировали с тестируемыми антителами. Индивидуальные антигены идентифицировали по флуоресценции соответствующей покрытой гранулы. Флуоресцентные частицы со стрептавидином SPHERO использовали в сочетании с биотинилированными антигенами, и оптимальные плотности покрытия тестировали в предварительных экспериментах с использованием инструментальных антител. Неочищенные лизаты бактериальных клеток объединяли с покрытыми антигеном (см. таблицу 9) и блокированными гранулами и инкубировали в течение 1 часа при комнатной температуре в темноте, осторожно встряхивая. После последующей инкубации с флуоресцентно меченным вторичным антителом измерение проводили с помощью устройства IntelliCyt HTFC/iQue. Между стадиями инкубации промывание не требовалось. Исходные данные оценивали с помощью программы ForeCyt.
Таблица 9. Антигены и гранулы для мультиплексных скринингов.
Определение EC50 на основе гранул, покрытых рекомбинантным белком
[00476] Анализы на основе гранул использовали для оценки значений EC50 очищенных антител, в том числе для нескольких антигенов параллельно. Таким образом, гранулы с различным уровнем собственной флуоресценции связывали с антигенами, физически объединяли в единую суспензию и инкубировали с различными концентрациями тестируемых антител. Индивидуальные антигены идентифицировали по флуоресценции соответствующей покрытой гранулы. Флуоресцентные частицы со стрептавидином SPHERO использовали в сочетании с биотинилированными антигенами (см. таблицу 10) и оптимальные плотности покрытия тестировали в предварительных экспериментах с использованием инструментальных антител. После инкубации с антителом и детекторным антителом проводили стадии промывки.
Таблица 10. Связывание антигенов и гранул для определения характеристик IgG и определения EC50.
FACS
[00477] С использованием проточной цитометрии идентифицировали события связывания с антигеном, экспрессируемым на клеточной поверхности, с использованием неочищенных лизатов E. coli из результатов пэннинга, а также очищенных антител в различных концентрациях для оценки значений EC50. Линии клеток, используемые для анализа FACS, перечислены в таблице 11.
Таблица 11. Линии клеток, используемые в анализе FACS.
[00478] В зависимости от настроек клетки предварительно обрабатывали посредством DPC333 в течение 24 часов перед инкубацией с антителами. Все стадии проводили в буфере FACS, включающем FCS и азид, для предупреждения интернализации рецептора. Суспензии клеток переносили в титрационные микропланшеты и добавляли образцы антител с последующей инкубацией планшетов в течение 1 часа при 4°C при осторожном встряхивании. После инкубации клетки центрифугировали и промывали буфером FACS. Вторичные реагенты, конъюгированные с флуорофором, использовали для обнаружения связанных антител. Содержимое планшетов измеряли с использованием системы Intellicyt HTFC/iQue, и данные анализировали с использованием соответствующего программного обеспечения.
Скрининг на клетках
[00479] Систему скрининга HTFC/iQue также использовали для оценки связывания с несколькими линиями клеток-мишеней или оценки нежелательного/неспецифического связывания параллельно. Различные популяции клеток выделяли путем предварительного мечения различными количествами флуоресцентных красителей, таких как Calcein или Cell-Tracker Green, что позволило установить уникальную сигнатуру интенсивности флуоресценции для каждой популяции клеток = штрих-кодирование флуоресценции. Затем линии клеток с цветовым кодированием физически объединяли и смешивали вместе с Fab-содержащими неочищенными бактериальными лизатами для тестирования. Индивидуальные линии клеток идентифицировали по флуоресценции соответствующей предварительно меченной линии клеток. Неочищенные лизаты бактериальных клеток объединяли с клетками (CHO-hDAP12-hTREM2 и CHO-DAP12) и инкубировали в течение 1 ч при 4°C в темноте, осторожно встряхивая. Измерение флуоресценции проводили с помощью устройства IntelliCyt HTFC/iQue. Между стадиями инкубации промывание не требовалось. Исходные данные оценивали с помощью программы ForeCyt. После сбора данных линии клеток из каждого образца идентифицировали в соответствии с их сигнатурой флуоресценции и индивидуально оценивали в отношении связывания антител. Результаты представлены в виде титров IgG на клетках CHO-hDAP12-hTREM2 и CHO-hDAP12-mTREM2, которые использовали для определения значений EC50.
Эпитоп-специфическая сортировка
Эпитоп-специфическая сортировка с временным разрешением с помощью Octet
[00480] Эпитоп-специфическую сортировку с временным разрешением на инструментах Octet (QK384 или HTX) проводили для классификации образцов IgG на группы идентичных или существенно перекрывающихся эпитопов, т.е. антител, которые были способны ингибировать связывание друг друга. Те же необходимые условия для образцов, что и для определения KD, применялись, как описано для определения KD с помощью кинетики без метки с помощью SPR (Biacore). От исходной семьи выбирали один иллюстративный кандидат.
[00481] Образцы антител тестировали попарно в анализе с полнофакторным планом, например для двух образцов антител A и B требовались следующие события попарного связывания: A-A, A-B, B-A, B-B. Для эпитоп-специфической сортировки в "сэндвичной" установке анализа сенсорные наконечники Octet модифицировали с использованием всех различных образцов антител, присутствующих в наборе образцов. Применяли от среднего до высокого уровня иммобилизации. Сенсоры, несущие различные антитела, загружали мономерным антигеном, а затем подвергали обработке одним из образцов антител для проверки связывания с захваченным антигеном. Ожидали, что дополнительное связывание произойдет только в том случае, если второе антитело распознает другой эпитоп.
[00482] Для оценки отслеживали сигналы в конце загрузки антигеном и связывания вторичного антитела, а кривые проверяли с точки зрения достаточной загрузки антигеном и возможной диссоциации антигена. Для контролей, т.е. стадий двойного связывания идентичных антител (A-A, B-B); для второго антитела не ожидали дополнительного связывания. События двойного связывания всех различных пар образцов антител сравнивали на предмет согласованности, например, если дополнительное связывание B наблюдали в порядке образцов A-B (разные эпитопы), то ожидали, что порядок образцов B-A также приведет к дополнительному связыванию A. Возможными причинами создания таких несогласованностей были, например, частичное перекрытие эпитопов или недостаточная загрузка антигеном. Результаты показаны в таблице 12.
Таблица 12. Эпитоп-специфическая сортировка.
Анализ интернализации
[00483] Для анализа интернализации комплекса антитело-рецептор использовали человеческий Fc-специфический Fab, меченный с помощью pHrodo ("MorpHin"). MorpHin связывается с анализируемым антителом, и после распознавания мишени и интернализации комплекс антител можно обнаружить с помощью сигналов флуоресценции в красном спектре (максимумы эмиссии: 566-590 нм), которые возникают в кислой среде (лизосомных компартментах).
[00484] Клетки CHO-hDAP12-hTREM2 высевали в 96-луночный планшет (50 мкл/лунка, 4,0E+05 клеток/мл) и оставляли для прикрепления в течение ночи при 37°C и 5% CO2. На следующий день планшеты охлаждали на льду в течение 30-60 мин. IgG (40 нМ в культуральной среде) предварительно инкубировали с 200 нМ Fab MorpHin (по 70 мкл каждого), меченного с помощью pHrodo, в течение 30 мин при 37°C, а затем охлаждали на льду в течение 15 мин, после чего добавляли 50 мкл каждой смеси к клеткам и инкубировали при 37°C и 5% CO2 в течение 6 ч. После двукратной промывки клеток с помощью DPBS (100 мкл/лунка) клетки отделяли с помощью аккутазы (50 мкл/лунка, 20-30 мин, 37°C, 5% CO2). После добавления 150 мкл промывочного буфера (DPBS+/3% FBS/0,02% NaN3) клетки центрифугировали и ресуспендировали в 100 мкл промывочного буфера. Флуоресценцию измеряли с помощью устройства FACS Array (96 лунок, 532 нм, желтый/PE-канал), а результаты анализировали с помощью программного обеспечения FlowJo. MOR03207 использовали в качестве отрицательного контроля. Результаты показаны в таблице 13.
Таблица 13. Интернализация TREM2 после связывания антитела через 6 ч по сравнению с контролем (MOR03207) или соответствующим исходным IgG.
Анализ стабилизации - PMA-индуцированный шеддинг на CHO-hDAP12-hTREM2
[00485] Чтобы исследовать способность разработанных IgG стабилизировать рецептор TREM2 на клеточных поверхностях для предупреждения PMA-индуцированного шеддинга, клетки CHO-hDAP12-hTREM2 использовали для анализа стабилизации на основе FACS. Чтобы избежать инактивации PMA антитела и контроли разводили в аналитическом буфере без азидов (конечная концентрация 200 нМ и 20 нМ) и инкубировали с предварительно охлажденными клетками (5,0×104 клеток на лунку, разведенных в аналитическом буфере без азидов) в течение 45 мин при 30°C, встряхивая при 300 об/мин. Стимулятор шеддазы РМА добавляли до конечной концентрации 50 нг/мл и инкубировали со смесью клетка-антитело в течение 30 мин при 4°C, встряхивая при 300 об/мин. После промывки связанные IgG обнаруживали путем инкубации с флуоресцентно меченными антителами для обнаружения (козье антитело к человеческому IgG-Alexa 647; мышиное антитело к козьему IgG-Alexa 647) в течение 1 ч при 4°C. Флуоресценцию измеряли с помощью программного обеспечения ForeCyt на устройстве iQUE (384 лунки, ~37 мкл, sip-время 1 с).
Анализ стабилизации - конститутивный шеддинг на CHO-hDAP12-hTREM2
[00486] Чтобы исследовать способность разработанных IgG стабилизировать рецептор TREM2 на клеточных поверхностях клетки CHO-hDAP12-hTREM2, а также исходную линию клеток CHO-hDAP12 использовали для анализа стабилизации на основе FACS. 3,0×104 клеток на лунку переносили в лунки 96-луночных планшетов для культивирования клеток и оставляли для прикрепления в течение ~5-6 ч при 37°C и 5% CO2. IgG и контрольные антитела (MOR03207, поликлональное козье антитело к hTREM2 (R&D Systems; AF1828)) разводили в культуральной среде и добавляли к клеткам до конечных концентраций 100 нМ и 10 нМ. Ингибитор шеддазы DPC 333 использовали в качестве положительного контроля (5 мкМ в культуральной среде). Планшеты для культивирования клеток инкубировали в течение ночи при 37°C и 5% CO2.
[00487] На следующий день супернатант удаляли и адгезивные клетки отделяли с использованием 50 мкл аккутазы на лунку в течение ~20-30 мин при 37°C и 5% CO2. После промывки связанные IgG обнаруживали путем инкубации с флуоресцентно меченными антителами для обнаружения (козье антитело к человеческому IgG-Alexa 647; мышиное антитело к козьему IgG-Alexa 647) в течение 1 ч при 4°C. Флуоресценцию измеряли с помощью программного обеспечения ForeCyt на устройстве iQUE (384 лунки, ~37 мкл, sip-время 2 с).
Ведущие кандидаты
[00488] После углубленного определения характеристик 57 созревших IgG, 23 клона отобрали в качестве ведущих кандидатов. Обзор 23 отобранных кандидатов представлен в таблице 14.
Таблица 14. Ведущие кандидаты.
(кратное изменение в RGA)
Mph-FACS
* Ограничение KD из-за выбросов или высокой концентрации применяемого IgG
Для столбцов "Стабилизация Mph-FACS" и "Усиление фагоцитоза" умеренное и сильное исполнение желаемых критериев обозначено + и ++ соответственно.
Пример 2. Стабилизация TREM2 на клеточной поверхности с помощью антитела к TREM2
Материалы и способы
Равновесное титрование в растворе (SET)
[00489] Определение аффинности в растворе в основном выполняли, как описано в литературе (Friguet, B et al. J Immunol Methods, 1985. 77(2): p. 305-319). Чтобы повысить чувствительность и точность способа SET, его перенесли с классического ELISA на технологию на основе ECL (Haenel, C et al. Anal Biochem, 2005. 339(1): p. 182-184).
[00490] 1 мг/мл козьих специфических антител к Fab-фрагменту человека (Bethyl) метили с помощью MSD Sulfo TAGTM NHS-Ester (Meso Scale Discovery | Гейтерсберг | штат Мэриленд | США) в соответствии с инструкциями производителя.
[00491] Эксперименты проводили в полипропиленовых титрационных микропланшетах и PBS (GIBCO 14190 | pH 7,0-7,2), содержащем 0,5% BSA и 0,02% Tween20, в качестве аналитического буфера. Готовили серийные разведения немеченого антигена, начиная с концентрации, по меньшей мере в 10 раз превышающей ожидаемую KD. Лунки без антигена использовали для определения значений Bmax; лунки, содержащие только аналитический буфер, использовали для определения фона. После добавления соответствующего количества связывающего вещества (концентрация антитела, подобная ожидаемой KD или ниже, конечный объем 60 мкл) смесь инкубировали в течение ночи при RT.
[00492] Планшеты MSD блокировали с помощью 3% BSA в PBS и покрывали биотинилированным антигеном (hTREM2 ECD (19-174)-hFc-bio) на планшетах со стрептавидином (30 мкл на лунку). После промывания планшета с помощью PBS с 0,05% Tween 20 уравновешенные образцы переносили в планшеты и инкубировали в течение 20 мин. После инкубации 30 мкл на лунку меченного посредством MSD-Sulfo-tag антитела для обнаружения (антитела к Fab человека | конечное разведение обычно 1:2000) добавляли в промытый планшет MSD и инкубировали в течение 60 мин при RT на шейкере Eppendorf (700 об/мин).
[00493] После промывки планшета MSD и добавления 30 мкл/лунка MSD буфера для считывания T с поверхностно-активным веществом, сигналы электрохемилюминесценции обнаруживали с помощью Sector Imager 6000 (Meso Scale Discovery, Гейтерсберг, штат Мэриленд, США).
[00494] Данные оценивали с помощью программного обеспечения XLfit (IDBS) с применением индивидуальных подгоночных моделей. Для определения KD молекул Fab использовали подгоночную модель согласно Haenel, 2005 (Haenel, C et al. Anal Biochem, 2005. 339(1): p. 182-184). Для определения KD молекул IgG и мономерных антигенов использовали подгоночную модель для IgG, модифицированную в соответствии с (Piehler, J et al. J Immunol Methods, 1997. 201: p. 189-206)). В отношении уравнений также см. (Della Ducata, D et al. J Biomol Screening, 2015. 20(10): p. 1256-1267). SET-скрининг (Della Ducata, D et al. J Biomol Screening, 2015. 20(10): p. 1256-1267) в принципе выполняли, как описано выше. Для ранжирования созревших связывающих веществ с помощью равновесного титрования в растворе применяли модель, основанную на принципах, описанных Haenel и соавторами (Haenel, C et al. Anal Biochem, 2005. 339(1): p. 182-184). Постоянное количество разбавленного экстракта BEL (содержащего боратный буфер, EDTA и лизоцим) уравновешивали в течение ночи с различными концентрациями антигена.
[00495] Затем смесь переносили на планшеты MSD, которые предварительно покрывали антигеном, и после инкубации и промывки добавляли подходящее антитело для обнаружения, меченное посредством MSD-Sulfo-tag.
[00496] Затем концентрацию несвязанного Fab определяли количественно посредством определения ECL с использованием Sector Imager 6000 (Meso Scale Discovery | Гейтерсберг| штат Мэриленда | США).
[00497] Результаты обрабатывали с использованием программного обеспечения XLfit (IDBS), применяя соответствующую подгоночную модель, как описано выше, для оценки аффинности и, таким образом, идентификации клонов, наиболее улучшенных вследствие созревания аффинности.
Определение KD с помощью кинетики без метки с помощью SPR (Biacore)
[00498] Для процедцр определения KD использовали фракции мономера белка антитела (IgG) (по меньшей мере 90% содержание мономера, как анализировали с помощью аналитической SEC).
[00499] Определение аффинности путем определения кинетических констант скоростей выполняли с помощью инструментов SPR (Biacore T200), как описано ниже.
Определение KD с помощью настройки захвата антител
[00500] Получали подходящую поверхность захвата с высокой емкостью, например путем ковалентной иммобилизации соответствующего лиганда захвата на чипе CM5 (Biacore, GE Healthcare) с использованием химии EDC/NHS. Примеры подходящих систем захвата представляли собой антитело к hu-Fc (Biacore | GE Healthcare) или лиганд MabSelect SuRe Ligand (GE Healthcare).
[00501] Для определения KD Fab-фрагментов, hTREM2 ECD (19-174)-hFc захватывали в качестве лиганда и использовали Fab-фрагменты в качестве аналитов в растворе. Для определения KD образцов IgG, IgG захватывали в качестве лиганда и мономерные белки TREM2 использовали в качестве аналитов в растворе (например, hTREM2 ECD (19-174)-His, mTREM2 ECD (19-168)-His или cyTREM2 ECD (19-174)-APP-Avi).
[00502] От шести до восьми различных концентраций аналита (например, 2-кратное серийное разведение) использовали для анализа во время кинетических экспериментов. После каждого цикла поверхность сенсора восстанавливали для удаления захваченных комплексов антитело/антиген при сохранении целостности поверхности захвата. Для эталона использовали холостую инъекцию рабочим буфером.
Оценка данных
[00503] Сенсограммы оценивали с помощью соответствующего программного обеспечения прибора для оценки, например Biacore T200 Evaluation Software 2.x или 3.x соответственно (Biacore, GE Healthcare). Все сенсограммы подгоняли к модели связывания 1:1 для определения констант скоростей kon и koff, которые использовали для расчета KD).
Профилирование панели белков (3P)
[00504] Для профилирования панели белков (Frese, K. et al. mAbs, 2013. 5(2): p. 279-287), 32 различных белка и контроля наносили на два 384-луночных стандартных планшета MSD в концентрации 1,0 мкг/мл при 4°C на ночь.
[00505] Раствор для покрытия отбрасывали и планшеты блокировали с помощью 50 мкл 3% (мас./об.) BSA в PBS в течение одного часа при RT на шейкере для титрационных микропланшетов (~500 об/мин) с последующими тремя стадиями промывки с помощью 50 мкл промывочного буфера (PBS с 0,05% (об./об.) Tween 20).
[00506] Образцы антител (Fab-фрагмент или IgG) разбавляли до 100 нМ и 10 нМ в аналитическом буфере (PBS с 0,5% (мас./об.) BSA, 0,05% (об./об.) Tween 20). В качестве контролей использовали эталонное mAb MOR к лизоциму MOR03207 Fab или IgG (в зависимости от формата образца) и аналитический буфер. Образцы и контроли добавляли в количестве 30 мкл/лунку и инкубировали в течение трех часов при RT на шейкере для титрационных микропланшетов.
[00507] Планшеты промывали три раза, и добавляли 30 мкл антитела для обнаружения (ECL-меченное антитело к Fab человека) на лунку, и инкубировали в течение одного часа на шейкере для титрационных микропланшетов (~500 об/мин). После промывки планшета MSD и добавления 35 мкл/лунка MSD буфера для считывания T с поверхностно-активным веществом, сигналы электрохемилюминесценции обнаруживали с помощью Sector Imager 6000 (Meso Scale Discovery, Гейтерсберг, штат Мэриленд, США).
[00508] Для оценки сигналы образца антитела к определенному белку разделяли на соответствующие сигналы эталонного mAb MOR03207, что привело к получению соотношения связывания (BR). Затем рассчитывали кумулятивное соотношение связывания (CBR) всех белков, кроме контролей (всего 25).
Оценка профиля связывания с использованием клеточных чипов на основе белков плазматической мембраны человека
Фоновый скрининг
[00509] Клетки HEK293 человека выращивали на предметных стеклах и фиксировали. Тестовые антитела добавляли в концентрации 2 мкг/мл. Затем предметные стекла инкубировали с AlexaFluor647-меченным антителом для обнаружения к Fc IgG человека с последующей флуоресцентной визуализацией. Данное антитело для обнаружения было одобрено ранее для использования в системе Retrogenix для обнаружения IgG человека и Fc-слитых белков человека.
Первичный скрининг
[00510] 4955 бицистронных экспрессионных векторов, каждый из которых кодирует ZsGreen1 и полноразмерный белок плазматической мембраны человека, наносили в дубликатах на предметные стекла и клетки HEK293 человека подвергали обратной трансфекции (14 наборов предметных стекол на антитело). Из 4955 проверенных белков плазматической мембраны человека более 3500 кодируются уникальными генами.
[00511] Тестовые антитела добавляли на каждое предметное стекло после фиксации клеток и определение связывания выполняли с использованием того же флуоресцентного вторичного антитела, которое использовали в предварительном скрининге. Сигнал флуоресценции ZsGreen1 использовали для подтверждения правильности трансфекции и локализации пятен трансфицированных клеток. "Совпадение" белка определяется как повторяющееся пятно, показывающее повышенный сигнал по сравнению с фоновыми уровнями (канал Alexa 647). Это достигается путем визуального осмотра с использованием изображений с координатной сеткой впрограмном обеспечении ImageQuant. Совпадения классифицировались как "сильные", "средние", "слабые" или "очень слабые" в зависимости от интенсивности повторяющихся пятен.
Линии клеток
[00512] Линию клеток СНО, экспрессирующую белок hTREM2 и hDAP12, получили в соответствии со стандартными процедурами культивирования клеток. Клетки СНО последовательно трансфицировали эукариотическими векторами экспрессии, содержащими cDNA для hDAP12 и hTREM2 человека. Полученные дважды трансфицированные клетки CHO-hTREM2/hDAP12 (CHO-hTREM2) выращивали в среде DMEM/F12 с добавлением 10% фетальной бычьей сыворотки, 0,2 мг/мл G418 и 0,2 мг/мл гигромицина. Конфлюэнтные клетки СНО собирали с помощью буфера для диссоциации клеток (Gibco 13151-014) и TREM2 клеточной поверхности количественно определяли посредством проточной цитометрии, как описано ниже. Аналогичным образом получали линии клональных клеток СНО, которые рекомбинантно экспрессируют hDAP12 и мышиные TREM2 или hDAP12 и TREM2 яванского макака.
[00513] Химерные конструкции человеческого TREM2-человеческого TREM1 получали с использованием стандартных процедур клонирования. Конструкция TREM2-IGSF-стеблевая область TREM1 содержала домен IGSF TREM2, "стеблевую" область TREM1, за которой следует TM, и внутриклеточный домен TREM2. Конструкция TREM1-IGSF-стеблевая область TREM2 содержала домен IGSF TREM1, "стеблевую" область TREM2, за которой следует TM, и внутриклеточный домен TREM2. Доменные границы определяли с использованием uniprot Q9NZC2 для TREM2 и Q9NP99 для TREM1. Из каждой конструкции получали стабильную линию клональных клеток, которая стабильно экспрессировала химерную конструкцию и hDAP12. Конфлюэнтные адгезивные клоны клетки СНО собирали с помощью буфера для диссоциации клеток (Gibco 13151-014) и химеры стеблевая область hTREM2-hTREM1-IGSF или TREM1-IGSF-стеблевая область TREM2, экспрессируемые на клеточной поверхности, количественно определяли посредством проточной цитометрии, как описано ниже.
[00514] Клеточную линию HEK, стабильно экспрессирующую химерный рецептор, состоящий из TREM2-внеклеточного домена и DAP12, впервые описали Kleinberger et al. 2014 (Kleinberger, G et al. Sci Transl Med, 2014. 6(243): p. 243ra86). По аналогии, линию клеток, экспрессирующую химерный рецептор человеческий TREM2/DAP12, получали ученые Novartis в соответствии со стандартными процедурами культивирования клеток.
[00515] Клетки THP1 представляют собой моноцитарные клетки человека, которые эндогенно экспрессируют TREM2 и DAP12. Эти клетки трансфицировали в соответствии со стандартными процедурами культивирования клеток геном люциферазы, управляемым промотором NFAT. После ограниченного разведения клоны стимулировали посредством PMA/иономицина и выбрали один клон (THP1-B5), который показал более чем 10-кратное увеличение активности репортерного гена (RGA).
Получение макрофагов
[00516] Моноциты человека выделяли из полностью анонимных лейкоцитарных пленок путем отрицательной селекции с использованием набора easySep™ Human Monocyte Isolation Kit (Stemcell technologies) в соответствии с протоколом производителя. Моноциты дифференцировались в течение 5-6 дней в hM2A в RPMI (среда для дифференцировки, дополненная 10% фетальной бычьей сыворотки, глутамаксом (1x, Gibco, 61870-044), пируватом натрия (Gibco, 11360-070), заменимыми аминокислотами, HEPES) с MCSF 40 нг/мл (R&D systems, 216-MC-025) и 50 нг/мл IL4 (R&D systems, 204-IL-050)). Макрофаги M2A собирали с помощью буфера для диссоциации клеток (Gibco 13151-014) и TREM2 клеточной поверхности определяли посредством проточной цитометрии, как описано ниже. Для большинства экспериментов антитела оценивали параллельно на лейкоцитарных пленках от двух разных доноров.
FACS
[00517] Чтобы определить клеточную ЕС50 антител к hM2A, клетки CHO-hTREM2 или CHO-cynoTREM2 обрабатывали в течение ночи с помощью 5 мкМ DPC333 (ингибитор ADAM10 и 17; Qian, M et al. Drug Metab Dispos, 2007. 35: p. 1916-1925). Макрофаги отделяли с помощью аккутазы (Biolegend, 423201) с последующим ресуспендированием в буфере для FACS (PBS, 2% FBS, 0,5 мМ EDTA, pH 8,0) с добавлением 50 мкг/мл средства блокировки Fc (BD, 564220) и инкубировали в течение по меньшей мере 20 мин на льду. Затем клетки окрашивали в течение 1 ч при 4°C в том же буфере с широким диапазоном концентраций различных антител к TREM2 с последующей стадией промывки с помощью PBS (250 г, 4°C, 3 мин). Далее клетки инкубировали в блокирующем буфере для FACS/Fc с AlexaFluor® 647 AffiniPure F(ab')2-фрагментом, козьим антителом к IgG человека, специфическим в отношении F(ab')2-фрагмента (Jackson Immuno Research, 109-606-097), и набором для окрашивания клеток LIVE/DEAD® Fixable Aqua Dead Cell Stain Kit, для возбуждения при 405 нм (Molecular Probes, L34966) в течение 30 мин при 4°C. После второй стадии промывки с помощью PBS (250 г, 4°C, 3 мин) клетки фиксировали с помощью фиксирующего буфера (Biolegend, 420801) в течение 15 мин при RT, снова промывали и оценивали флуоресценцию с использованием BD FACS Canto II (BD, V96300323) или проточного цитометра FacsCalibur. Значения медианной интенсивности флуоресценции, соответствующие степени связывания антитела к TREM2 с клетками, оценивали с использованием программного обеспечения FlowJo (Millipore INC).
Анализ стабилизации - конститутивный шеддинг на CHO-hDAP12-hTREM2
[00518] Чтобы исследовать способность разработанных IgG стабилизировать рецептор TREM2 на клеточной поверхности клеток CHO-hDAP12-hTREM2, а также исходную линию клеток CHO-hDAP12 использовали для анализа стабилизации на основе FACS. 3,0×10^4 клеток на лунку переносили в лунки 96-луночного планшета для культивирования клеток и оставляли для прикрепления в течение ~5-6 ч при 37°C в инкубаторе для клеточных культур. Изотипические контроли IgG и контрольные антитела (MOR03207, поликлональное козье антитело к hTREM2 (R&D Systems; AF1828)) разводили в культуральной среде и добавляли к клеткам до конечных концентраций, как показано на фигурах. Ингибитор шеддазы DPC333 использовали в качестве положительного контроля (5 мкМ в культуральной среде). Планшеты для культивирования клеток инкубировали в течение ночи при 37°C в инкубаторе для клеточных культур.
[00519] На следующий день супернатант удаляли и адгезивные клетки отделяли с использованием 50 мкл аккутазы на лунку в течение ~20-30 мин при 37°C и 5% CO2. После промывки связанные IgG обнаруживали путем инкубации с флуоресцентно меченными антителами для обнаружения (козье антитело к человеческому IgG-Alexa 647; мышиное антитело к козьему IgG-Alexa 647) в течение 1 ч при 4°C. Флуоресценцию измеряли с помощью программного обеспечения ForeCyt на устройстве iQUE (384 лунки, ~37 мкл, sip-время 2 с). В качестве альтернативы, прямого обнаружения TREM2, независимого от стабилизирующего антитела, достигали с использованием не перекрестно блокирующего Fab-фрагмента MOR041895.
Стабилизация TREM2, экспрессированного на hM2A, антителами к TREM2
[00520] Макрофаги, дифференцированные до M2A, отделяли с помощью аккутазы (Biolegend, 423201), промывали один раз с помощью PBS с последующим ресуспендированием в буфере для FACS (PBS, 2% FBS, 0,5 мМ EDTA, pH 8,0), дополненном 50 мкг/мл средства блокировки Fc (Fab-фрагмент, связывающий Fc рецепторы, производства Novartis), и инкубировали в течение по меньшей мере 20 мин при комнатной температуре. Затем к клеткам добавляли антитела к TREM2 (концентрации указаны на фигурах) с последующей 24-часовой инкубацией в инкубаторе для клеточных культур при 37°C. На следующий день клетки подвергали FACS-анализу. Окрашивание для FACS проводили либо путем прямого окрашивания антитела к TREM2, использованного для стабилизации, либо путем окрашивания фрагментом Fab-His к TREM2 (MOR041895), который распознавал отличный неперекрывающийся эпитоп на TREM2 по отношению к антителу, используемому для стабилизации. Макрофаги M2A дважды промывали с помощью PBS/1 мМ EDTA для удаления избытка сыворотки крови и один раз с помощью буфера FACS с последующим добавлением 50 мкг/мл средства блокировки Fc (BD, 564220). Для обнаружения связанных антител к TREM2, которые использовали для стабилизации, добавляли AlexaFluor® 647 AffiniPure F(ab')2, козье антитело к IgG человека, специфичное в отношении F(ab')2-фрагмента (Jackson Immuno Research, 109-606-097), и краситель для клеток LIVE/DEAD® Fixable Aqua Dead Cell Stain (Molecular Probes, L34966) на 30 мин на льду. Для прямого окрашивания TREM2 отличный образец обрабатывали His-меченным Fab-фрагментом MOR041895 (100 нМ) в течение 10 мин на льду с последующим добавлением Anti-His PE (Miltenyi, 130-092-691) и красителя для клеток LIVE/DEAD® Fixable Aqua Dead Cell Stain (Molecular Probes, L34966). Через 30 мин на льду клетки промывали один раз буфером FACS, затем фиксировали буфером для фиксации (Biolegend, 420801) в течение 15 мин при RT, снова промывали и флуоресценцию оценивали с помощью BD FACS Canto II (BD, V96300323) или проточного цитометра FacsCalibur. Значения медианной интенсивности флуоресценции, соответствующие степени связывания Fab-фрагмента антитела к TREM2 с клетками, оценивали с использованием программного обеспечения FlowJo (Millipore INC).
Анализ фагоцитоза (FACS)
[00521] Макрофаги, дифференцированные до M2A, отделяли с помощью аккутазы (Biolegend, 423201) и высевали в среду для дифференцировки, дополненную средством блокировки Fc (20 мкг/мл), в планшеты для культивирования тканей. Через 2,5 часа в увлажненном инкубаторе для культур клеток при 37°C антитела добавляли к макрофагам в концентрациях, указанных на фигурах, и инкубировали еще 18 ч в увлажненном инкубаторе для культур клеток при 37°C. Среду для культивирования клеток удаляли, макрофаги дважды промывали с помощью PBS и ресуспендировали в среде для дифференцировки. Затем добавляли такой же объем среды для дифференцировки, дополненной биочастицами S. aureus, меченными с помощью pHrodo Red (конъюгат для фагоцитоза, Molecular Probes, A10010), и раствор подвергали центрифугированию (1 мин, 500 g) для синхронизации фагоцитоза с последующей инкубацией в течение 2,5 ч в увлажненном инкубаторе для культур клеток при 37°C. Клетки дважды промывали с помощью PBS, отделяли аккутазой, снова промывали на льду буфером для FACS и ресуспендировали на льду в буфере для FACS с последующим FACS-анализом на FACS Canto II (BD). Значения медианной интенсивности флуоресценции, соответствующие степени фагоцитоза, поглощаемого клетками, оценивали с использованием программного обеспечения FlowJo (Millipore INC). Эксперименты всегда включали антитело изотипического контроля (MOR03207) с идентичными мутациями сайленсинга Fc. Данное антитело не распознает эпитопы на макрофагах hM2A.
Анализ фагоцитоза (Incucyte)
[00522] Макрофаги, дифференцированные до M2A человека, или клетки микроглии, полученные из iPS человека, отделяли с помощью аккутазы StemPro (Gibco № A11105-01, партия №1648949) и суспендировали в полной среде макрофагов M2a. Среду для культивирования клеток удаляли и клетки ресуспендировали в RPMI+0,5% FCS. 50 мкл полученной клеточной суспензии помещали в каждую вставку 96-луночного черного прозрачного планшета, покрытого поли-D-лизином, планшет BD (7500 (M2A) - 10000 (клетки микроглии, полученные из iPS) клеток/лунка), и оставляли для адгезии в течение 3 часов при 37°С. Добавляли биочастицы, меченные с помощью pHrodo (либо биочастицы S. aureus, меченные с помощью pHrodoGreen - Essen Bioscience №4620, либо апоптотические клетки SH-SY5Y, меченные с помощью pHrodoGreen (1,2×10^5 клеток/лунка)), и планшеты переносили на платформу IncuCyte ZOOM, которая была размещена внутри инкубатора для клеток при 37°C/5% CO2 до конца анализа. Два изображения на лунку из трех технических повторностей получали каждые 30 мин в течение 20 часов с использованием 10-кратного объектива, а затем анализировали с помощью базового программного обеспечения IncuCyteTM.
Анализ хемотаксиса (Incucyte)
[00523] Макрофаги, дифференцированные до M2A, или клетки микроглии, полученные из iPS человека, высевали в полную среду в количестве 5000 (макрофаги M2A) или 7500 (клетки микроглии, полученные из iPS) клеток/лунка в планшеты Transwell (Essen Bioscience) с предварительно нанесенным покрытием Matrigel (GFR -Corning №354230, партия 631008). Для анализов миграции с обработкой антителом в микроглию каждое антитело к TREM2 добавляли в концентрации 100 нМ или соответствующий изотипический контроль в концентрации 100 нМ. Transwell помещали в планшет-резервуар, содержащий 200 мкл полной среды с 20 нг/мл рекомбинантного C5a или 100 нг/мл рекомбинантного C5a. Миграцию Transwell отслеживали и анализировали с помощью программного обеспечения Incucyte S3® (Essen Bioscience).
Анализ с применением репортерного гена
[00524] Для стимуляции активности RGA полноразмерные антитела наносили в концентрации 10 мкг/мл на планшеты для культивирования клеток с высоким уровнем связывания белка (Greiner №781094) на 8-16 часов. После промывки планшетов клетки THP-B5, обработанные в течение 16 ч с помощью DPC333 в полной культуральной среде, высевали на 384-луночные планшеты, покрытые антителами, на 16 ч. Затем активность люциферазы определяли с использованием системы steadylite plus в соответствии с протоколом производителя (реагент для обнаружения люциферазы Steadylite plus, Perkin Elmer, №6066751). Результаты выражены как кратное изменение стимуляции по сравнению с контрольным Ab (изотип IgG).
Анализ фосфорилирования Syk
[00525] 2×106 макрофагов M2A человека на лунку высевали в 6-луночные чашки в культуральную среду, содержащую 2 мкМ DPC333. Через 24 ч клетки один раз промывали с помощью PBS и добавляли аналитический буфер (RPMI, дополненная 1% FCS, 10 мМ HEPES, 2 мкМ DPC333 и 50 мкг/мл средства блокировки Fab, связывающего Fc). Клетки инкубировали в течение 4 ч при 37°C. Затем клетки удаляли из инкубатора, помещали на лед и один раз промывали ледяным PBS. Затем добавляли 1 мл аналитического буфера, содержащего антитело изотипического контроля или антитело к TREM2 (100 нМ). Также было включено коммерчески доступное антитело к TREM2 (крысиный моноклональный IgG2B, R&D, MAB17291). Инкубацию на льду продолжали 18 мин. После этого среду удаляли и клетки промывали ледяным PBS для удаления избыточного несвязанного антитела к TREM2. Затем добавляли 1 мл предварительно нагретого аналитического буфера без средства блокировки, связывающего Fc, но дополненного 100 нМ перекрестно связывающего антитела (для первого крысиного антитела к TREM2: Jackson Immuno Research №112005008, козье антитело к Fc-гамма-фрагменту IgG крысы; для человеческого антитела к TREM2: Jackson Immuno Research №109-005-008, козье антитело к Fc-гамма-фрагменту IgG человека). Инкубацию продолжали в течение 10 мин при 37°C. Затем планшеты помещали на лед, промывали один раз холодным PBS и холодным буфером для лизиса (800 мкл/лунка; Thermo Scientific, №78501, реагент для экстракции белков млекопитающих M-PER), дополненным смесью протеаза/phosphostop (Thermo Scientific, №1861281, смесь ингибиторов протеазы и фосфатазы Halt; 1:100). Лизис клеток проводили в течение 5 мин с последующим центрифугированием в течение 20 мин при 10000 g и 4 градусах. Супернатант инкубировали с антителом к syk (Cell Signaling, клон D3Z1E -XP, №13198; 2,45 мкг/мл) при RT в течение 1 ч при осторожном перемешивании. К каждому образцу добавляли 50 мкл гранул протеина A/G (Thermo Scientific, №88802) и продолжали инкубацию в течение 1 ч при RT при осторожном перемешивании. Затем образцы помещали в магнит (Thermo Scientific) и удаляли супернатант. Гранулы промывали 3 раза с помощью PBS-T (PBS+0,1% Tween20) и связанные белки элюировали с помощью 30 мкл 1х WB загрузочного красителя (NuPAGE, буфер для образцов LDS Novex, NP0008).
[00526] Затем образцы нагревали в течение 10 минут при 70°C, разделяли магнитом и 25 мкл каждого образца загружали в 4-12% гель (NuPAGE 4-12% Bis-Tris миди-гели для электрофореза белков, 10 лунок, Novex, WG1403BOX) с использованием MES (NuPAGE MES, Novex, NP0002) в качестве рабочего буфера. Белки переносили на мембраны из PVDF и мембраны блокировали в течение 1 ч 3% буфером TopBlock (LuBio, в PBS-T 0,1%) с последующей инкубацией с AB 4G10 к фосфотирозину (мышиное моноклональное, Millipore №05-1050) при температуре 4 градуса Цельсия в течение ночи. Мембраны промывали и инкубировали при RT в течение 1 ч с антителами clean blot (Clean-Blot, IP Detection Reagent (HRP), 21230) с последующей стадией промывки и обнаружением с помощью ECL (ECL Select reagent, GE Healthcare, RPN 2235) в соответствии с протоколом производителя.
[00527] Для обнаружения общего количества Syk мембраны обрабатывали буфером для удаления Restore с последующим обнаружением общего количества Syk с использованием кроличьих антител к Syk человека (Cell Signaling №2712) и реагента для обнаружения clean blot.
CRISPR-нокин (KI) человеческого TREM2 (hTREM2 KI)
[00528] Мышей с гуманизированным TREM2 получают путем введения cDNA TREM2 человека (изоформа 1, UniProt: Q9NZC2-1), включая сигнал поли-A бычьего гормона роста, в ATG гена TREM2 мыши в экзоне 1 с помощью CRISPR. Животных-основателей подвергают скринингу с помощью ПЦР в отношении экспрессии hTREM2 и разводят до гомозиготности. Макрофаги, происходящие из костного мозга, получают от различных животных-основателей, и экспрессия hTREM2, а также отсутствие мышиного TREM2 подтверждают FACS-анализом. Выбирают одну основную линию и подвергают анализу последовательности локуса TREM2 для проверки правильности вставки cDNA TREM2 в геном.
Купризоновая модель у мышей с гуманизированным посредством Crispr-нокина TREM2
Профилактическое/сопутствующее лечение муринизированным антителом MOR44698 к TREM2 в купризоновой модели
[00529] Купризоновая модель представляет собой модель индуцированной токсином демиелинизации для изучения процессов миелинизации в ЦНС с незначительным участием периферической иммунной системы. Купризон, хелатор меди, вызывает повреждение митохондрий и, в конечном итоге, гибель олигодендроцитов, в то время как клетки-предшественники олигодендроцитов не затрагиваются и все еще могут выполнять свои надлежащие функции (пролиферировать, созревать и ремиелинизировать). Интоксикация, вызванная купризоном у грызунов, вызывает нейровоспаление, повреждение нейронов и демиелинизацию с последующим выздоровлением. Купризоновая модель хорошо подходит для тестирования парадигм регенеративного лечения демиелинизирующих заболеваний, таких как, например, MS, которые усиливают ремиелинизацию независимо от вторгающихся периферических иммунных клеток.
[00530] Мышей с гуманизированным посредством Crispr-нокина TREM2 (hTREM-KI) обрабатывали (0,2% в пище) купризоном (бис(циклогексанон)оксальдигидразон, Sigma-Aldrich) в течение 7 недель с 1 днем до и два раза в неделю после этого с помощью 44698 и изотипического контроля MOR03207 (коротко: 3207) i.p., 30 мг/кг. Во время исследования проводили продольную неинвазивную магнитно-резонансную томографию (MRI), измеряющую отношение переноса намагниченности (MTR) и интенсивность/контраст, которые считаются показателями наличия миелина и нейровоспаления соответственно. После 7 недель профилактического/сопутствующего лечения антителом и купризоном животных умерщвляли и выполняли гистологическое исследование на фронтальных парафиновых срезах головного мозга. Антитело Iba1 использовали для оценки количества и морфологии клеток микроглии, а окрашивание люксолом прочным синим использовали для анализа содержания миелина.
Терапевтическое лечение муринизированным антителом MOR44698 к TREM2 в купризоновой модели
[00531] Мышей hTREM-KI обрабатывали купризоном (0,2% в пище) в течение 5 недель, затем переводили на нормальную пищу и дважды в неделю обрабатывали с помощью 44698 и изотипического контроля 3207 i.p., 30 мг/кг в течение 2 недель. Во время исследования проводили продольную неинвазивную магнитно-резонансную томографию (MRI), измеряющую отношение переноса намагниченности (MTR) и интенсивность/контраст. После 2 недель терапевтического лечения антителом после 5-недельной интоксикации купризоном животных умерщвляли и выполняли гистологическое исследование на фронтальных парафиновых срезах головного мозга. Антитело Iba1 использовали для оценки количества и морфологии клеток микроглии, окрашивание люксолом прочным синим использовали для анализа содержания миелина.
[00532] MRI. Измерения выполняли с помощью спектрометра Biospec 70/30 (Bruker Medical Systems, Эттлинген, Германия), работающего при 7 Тл. Операционное программное обеспечение сканера представляет собой Paravision 5.1 (Bruker). Изображения получают от анестезированных, самопроизвольно дышащих животных с помощью циркулярно поляризованной катушки головного мозга мыши (Bruker, модель 1P T20063 V3; внутренний диаметр 23 мм) для радиочастотного возбуждения и обнаружения. Ни сердечный, ни респираторный триггеры не применяли. После короткого периода введения в бокс, животных держат под анестезией 1,5% изофлураном (Abbott, Хам, Швейцария) в кислороде, вводимым через дыхательный контур. Во время регистрации сигнала MRI животных помещают в положение лежа в платформу из оргстекла, температуру тела поддерживают на уровне 37 ± 1°C с помощью грелки и контролируют дыхание. AT2-взвешенную двумерную мультисрезовую последовательность RARE (быстрое получение с улучшением релаксации) используют для определения анатомической ориентации и оценки интенсивностей сигнала. За этим следует получение изображения с использованием двумерной мультисрезовой последовательности с применением градиент-восстановленного эха FLASH (быстрая экспозиция с малым углом отклонения) для оценки MTR. Поскольку обе последовательности имеют одинаковые анатомические параметры, выбор интересующих областей для оценки выполняется на изображениях RARE, а затем переносится на изображения FLASH. Изображения MRI анализируют с помощью программного обеспечения ParaVision. Параметры получения изображений следующие: (а) последовательность RARE: эффективное время появления эхо-сигнала 80 миллисекунд (мс), время повторения 3280 мс, фактор RARE 16, 12 средних значений, поле зрения 20×18 мм2, размер матрицы 213×192, размер пикселя 0,094×0,094 мм2, толщина среза 0,5 мм, 15 смежных срезов. Импульсы Эрмита длительностью/шириной полосы пропускания 1 мс/5400 Гц и 0,64 мс/5344 Гц используют для радиочастотного возбуждения и перефокусировки соответственно. Подавление жира достигается с помощью импульса gauss512 с длительностью/шириной полосы пропускания 2,61 мс/1051 Гц, за которым следует градиентный импульс длительностью 2 мс. Общее время получения изображения составляет 7 мин 52,3 с; (b) последовательность FLASH: время появления эхо-сигнала 2,8 мс, время повторения 252,8 мс, 4 средних значения, поле зрения 20×18 мм2, размер матрицы 213×192, размер пикселя 0,094×0,094 мм2, толщина среза 0,5 мм, 15 смежных срезов. Импульс Эрмита длительностью/шириной полосы пропускания 0,9 мс/6000 Гц и углом наклона 30° используют для радиочастотного возбуждения. Контраст MTR создается гауссовым импульсом длительностью/шириной полосы пропускания 15 мс/182,7 Гц, применяемым с пиковой амплитудой радиочастоты 7,5 мкТл и смещением излучения 2500 Гц. Затем получение изображений повторяется с теми же параметрами, но без введения контраста MTR. Затем MTR вычисляется по формуле MTR = (S0-SMTR)/S0, где S0 и SMTR представляют соответственно интенсивности сигналов при получении изображений FLASH без введения контраста MTR и с его введением. Общее время получения изображения для обоих наборов данных составляет 6 минут 31,6 с.
[00533] Перед умерщвлением животных перфузируют транскардиально физиологическим раствором с фосфатным буфером (PBS) и в некоторых случаях затем 4% параформальдегидом (PFA). Затем образцы головного мозга или половины головного мозга изолируют и фиксируют в 4% PFA в течение 48 ч при 4°C. Некоторые образцы половины головного мозга глубоко заморожены.
[00534] Гистология. После фиксации образцы головного мозга обрабатывали для заливки парафином посредством обезвоживания путем серии возрастающих конценраций этанола. Автоматизированную иммуногистохимию парафиновых срезов выполняли на парафиновых срезах 3 мкм, установленных на предметных стеклах SuperFrost+ (Thermo Fisher Scientific) и автоматически иммуноокрашенных с использованием технологии Discovery XT (Ventana, Roche Diagnostics). Срезы депарафинизируют, регидратируют, подвергают извлечению антигена путем нагревания с буферным раствором для кондиционирования клеток CC1 в течение 28-68 мин в зависимости от антитела, инкубируют в течение 1-3 ч в соответствии с антителом при комнатной температуре с первичным антителом, разведенным в разбавителе для антитела (Ventana), инкубируют с соответствующим биотинилированным вторичным антителом, разведенным в разбавителе для антитела, подвергают реакции с набором DAB-Mab и контрастно окрашивают гематоксилином II и реагентом Bluing (Ventana). Срезы промывают с мылом в горячей водопроводной воде и ополаскивают под струей холодной воды, чтобы удалить мыло, затем обезвоживают и заливают с помощью Pertex. Для окрашивания LFB срезы депарафинизируют и регидратируют до 95% этанола. Затем срезы инкубируют в растворе LFB (Solvent Blue 38 (Sigma S3382) в 95% этаноле и 10% уксусной кислоте (Sigma 695092)) в течение ночи при 60°C, промывают в 95% этаноле в течение 1 мин, затем в дистиллированной воде в течение 2 мин и в 0,05% карбонате лития в течение 5 с. Затем срезы ополаскивают в 70% этаноле дважды по 10 с, затем в дистиллированной воде в течение 2 мин. Промывание повторяют в свежеприготовленном 0,05% карбонате лития (Merck 105680), 70% этаноле и дистиллированной воде до тех пор, пока не появится резкий контраст между синим цветом белого вещества (миелин) и бесцветным серым веществом. Наконец, срезы обезвоживают, начиная с 95% этанола, и помещают в Pertex.
[00535] Антитела. Первичные антитела: кроличье антитело к МВР мыши (Dako A0623) 1:1000; кроличье антитело к  мыши (MBL 312) 1:500; кроличье антитело к Iba1 (Wako 019-19741, 50 мкг/100 мкл) 1:500; кроличье антитело к GFAP (Dako Z0334) 1:5000; кроличье антитело к MOG (abcam ab32760) 1:100; кроличье антитело к dMBP (Millipore AB5864) 1:3000; мышиное антитело к нейрофиламенту (Covance SMI312) 1:5000; кроличье антитело к ALDH1L1 мыши (abcam ab87117) 1:1000; кроличье антитело к NeuN мыши (Millipore ABN78) 1:2000; крысиное антитело к CD107a мыши (Biorad MCA4707T) 1:200; кроличье антитело к NG2 мыши (abcam ab129051) 1:200; козье антитело к Iba1 (Thermo Fisher Scientific PA5-18039) 1:250. Вторичные антитела для обнаружения. Биотинилированное козье антитело к IgG кролика (Jackson ImmunoResearch 111-065-144) 1:1000; биотинилированное козье антитело к IgG кролика (Vector BA-1000) 1:200 или 1:1000; биотинилированное козье антитело к IgG мыши (Vector BA-9200) 1:1000; биотинилированное козье антитело к крысе (Vector BA-9400) 1:200.
мыши (MBL 312) 1:500; кроличье антитело к Iba1 (Wako 019-19741, 50 мкг/100 мкл) 1:500; кроличье антитело к GFAP (Dako Z0334) 1:5000; кроличье антитело к MOG (abcam ab32760) 1:100; кроличье антитело к dMBP (Millipore AB5864) 1:3000; мышиное антитело к нейрофиламенту (Covance SMI312) 1:5000; кроличье антитело к ALDH1L1 мыши (abcam ab87117) 1:1000; кроличье антитело к NeuN мыши (Millipore ABN78) 1:2000; крысиное антитело к CD107a мыши (Biorad MCA4707T) 1:200; кроличье антитело к NG2 мыши (abcam ab129051) 1:200; козье антитело к Iba1 (Thermo Fisher Scientific PA5-18039) 1:250. Вторичные антитела для обнаружения. Биотинилированное козье антитело к IgG кролика (Jackson ImmunoResearch 111-065-144) 1:1000; биотинилированное козье антитело к IgG кролика (Vector BA-1000) 1:200 или 1:1000; биотинилированное козье антитело к IgG мыши (Vector BA-9200) 1:1000; биотинилированное козье антитело к крысе (Vector BA-9400) 1:200.
[00536] Анализ гистологических изображений. Чтобы проводить количественную оценку количества и морфологии клеток микроглии/астроцитов на основе анализа изображений из гистологически окрашенных срезов головного мозга, разработали проприетарную платформу анализа изображений (ASTORIA, автоматизированный анализ сохраненных изображений, Novartis Pharma AG) на основе MS Visual Studio 2010 и многих функций из библиотек Matrox MIL V9 (Matrox Inc) Для обнаружения и анализа сомы, проксимальных и дистальных отростков выполняют приведенную ниже последовательность стадий. 1. Препараты со срезами головного мозга для оценки (коричневой) иммуногистохимически окрашенной сомы микроглии (Iba1) или астроцитов (GFAP) и их проксимальных и дистальных отростков сканировали с помощью Aperio's Scanscope (Leica Biosystems AG) при 20-кратном увеличении. 2. Каждое изображение обрабатывали с помощью программного обеспечения ImageScope (V12.1.0.5029, Aperio, Leica Biosystems AG) в соответствии с приведенными ниже стадиями. A: деконволюция цвета для получения коричневого окрашивания без синего; B: сегментация ткани головного мозга на белом фоне посредством определения порога, морфологического закрытия, заполнения отверстий, открытия и удаления слишком мелких объектов, что приводит к бинарной маске действительной ткани и области образца; C: адаптивное определение порога для индивидуальной сегментации сомы, основанное на среднем значении серого синего канала коричневого изображения после цветной деконволюции в достаточно темных областях (показательно для сомы). Вычисленный порог используют для бинаризации, и после того, как фильтрация по размеру в результате дает изображение маски сомы (в пределах допустимой области выборки); D: сегментация отростков посредством морфологического преобразования tophat с размером для выбора тонких отростков. Адаптивное определение порога применяют снова для сегментирования отростков (с использованием ранее определенного среднего серого для коричневых объектов) с последующей бинаризацией изображения top-hat и фильтрацией по размеру результирующих объектов; E: вычитание сомы (которую также могли выбрать с помощью определения порога top hat) для получения маски изображения истинных отростков; F: окончательное прореживание отростков для вычисления длины; G: проксимальные отростки: заранее определенное количество расширений сомы используют для определения эталонной (маркерной) области для проксимальной сомы, используя круг вокруг центра сомы, чтобы определить границу отсечения для проксимальных отростков. Затем реконструируют истонченные проксимальные отростки с маркером в расширенной соме и ограниченные круговой зоной воздействия (набор "проксимальных истонченных отростков") вокруг центра сомы. "Окончательные проксимальные отростки" собирают путем реконструкции всех отростков, имеющих маркеры в наборе "проксимальных утонченных отростков"; H: сому добавляют к проксимальным отросткам для получения набора "видимой микроглии"; I: дистальные отростки: реконструкция отростков только из проксимальных отростков (т.е. игнорирование отростков на фоне или от сомы в другой фокусной плоскости), затем вычитание круговой области, определяющей проксимальные отростки, чтобы получить набор дистальных отростков; J: при вычислении оптической плотности для сомы, а также для "видимой микроглии" (комплекс индивидуальная сома+проксимальные отростки в круговой эталонной области), локальный фон (невидимую микроглию) используют для сравнения; K: морфометрические признаки (размер, форм-фактор, длина) вычисляют для сомы, проксимальных и дистальных отростков.
Истощение и репопуляция микроглии с помощью ингибитора киназы CSF1R BLZ945
[00537] Модель истощения BLZ945 позволяет оценить эффективность антител к TREM2 для поддержки видов трофической активности TREM2.
[00538] Сигнальный путь рецептора колониестимулирующего фактора 1 (CSF1R) важен для выживания микроглии. Ингибитор киназы CSF1R BLZ945 вызывает истощение микроглии, и после удаления BLZ945 микроглия восстанавливает популяцию клеток в головном мозге. Обработку с помощью BLZ945 и анализ выполняют, как описано ранее (Beckmann, N et al., Acta Neuropathol Commun, 2018. 6(1)).
[00539] Животных обрабатывали с помощью 169 мг/кг BLZ945 один раз в день (qd), перорально (p.o.). 10 мл/кг в течение по меньшей мере 5 дней. BLZ945 получали в 0,5% метилцеллюлозе в воде и 0,1% Tween-80. Животным давали доступ к пище и воде ad libitum.
[00540] Животных обрабатывали 30 мг/кг i.p. один раз в неделю антителом или изотипичным контролем до (по меньшей мере 1 день), во время (в течение по меньшей мере 5 дней) или после обработки с помощью BLZ945 в течение по меньшей мере 3 дней. Перед умерщвлением животных перфузировали транскардиально физиологическим раствором с фосфатным буфером (PBS) и в некоторых случаях затем 4% параформальдегидом (PFA). Затем образцы головного мозга или половины головного мозга изолировали и фиксировали в 4% PFA в течение 48 ч при 4°C. Некоторые образцы половины головного мозга глубоко замораживали или помещали свежими в холодный PBS.
[00541] Гистология. После фиксации образцы головного мозга обрабатывали для заливки парафином посредством обезвоживания путем серии возрастающих конценраций этанола. Автоматизированную иммуногистохимию парафиновых срезов выполняли на парафиновых срезах 3 мкм, установленных на предметных стеклах SuperFrost+ (Thermo Fisher Scientific) и автоматически иммуноокрашенных с использованием технологии Discovery XT (Ventana, Roche Diagnostics). Срезы депарафинизировали, регидратировали, подвергали извлечению антигена путем нагревания с буферным раствором для кондиционирования клеток CC1 в течение 28-68 мин в зависимости от антитела, инкубировали в течение 1-3 ч в соответствии с антителом при комнатной температуре с первичным антителом, разведенным в разбавителе для антитела (Ventana), инкубировали с соответствующим биотинилированным вторичным антителом, разведенным в разбавителе для антитела, подвергали реакции с набором DAB-Mab и контрастно окрашивали гематоксилином II и реагентом Bluing (Ventana). Срезы промывали с мылом в горячей водопроводной воде и ополаскивали под струей холодной воды, чтобы удалить мыло, затем обезвоживали и заливали с помощью Pertex. Для окрашивания LFB срезы депарафинизировали и регидратировали до 95% этанола. Затем срезы инкубировали в растворе LFB (Solvent Blue 38 (Sigma S3382) в 95% этаноле и 10% уксусной кислоте (Sigma 695092)) в течение ночи при 60°C, промывали в 95% этаноле в течение 1 мин, затем в дистиллированной воде в течение 2 мин и в 0,05% карбонате лития в течение 5 с. Затем срезы ополаскивали в 70% этаноле дважды по 10 с, затем в дистиллированной воде в течение 2 мин. Промывание повторяли в свежеприготовленном 0,05% карбонате лития (Merck 105680), 70% этаноле и дистиллированной воде до тех пор, пока не появится резкий контраст между синим цветом белого вещества (миелин) и бесцветным серым веществом. Наконец, срезы обезвоживали, начиная с 95% этанола, и помещали в Pertex.
[00542] Антитела. Первичные антитела: кроличье антитело к Iba1 (Wako 019-19741, 50 мкг/100 мкл) 1:500; кроличье антитело к GFAP (Dako Z0334) 1:5000; мышиное антитело к нейрофиламенту (Covance SMI312) 1:5000; кроличье антитело к ALDH1L1 мыши (abcam ab87117) 1:1000; кроличье антитело к NeuN мыши (Millipore ABN78) 1:2000; крысиное антитело к CD107a мыши (Biorad MCA4707T) 1:200; козье антитело к Iba1 (Thermo Fisher Scientific PA5-18039) 1:250. Вторичные антитела для обнаружения. Биотинилированное козье антитело к IgG кролика (Jackson ImmunoResearch 111-065-144) 1:1000; биотинилированное козье антитело к IgG кролика (Vector BA-1000) 1:200 или 1:1000; биотинилированное козье антитело к IgG мыши (Vector BA-9200) 1:1000; биотинилированное козье антитело к крысе (Vector BA-9400) 1:200.
[00543] Анализ гистологических изображений. Чтобы проводить количественную оценку количества и морфологии клеток микроглии/астроцитов на основе анализа изображений из гистологически окрашенных срезов головного мозга, разрабатывали проприетарную платформу анализа изображений (ASTORIA, автоматизированный анализ сохраненных изображений, Novartis Pharma AG) на основе MS Visual Studio 2010 и многих функций из библиотек Matrox MIL V9 (Matrox Inc) Для обнаружения и анализа сомы, проксимальных и дистальных отростков выполняли приведенную ниже последовательность стадий. 1. Препараты со срезами головного мозга для оценки (коричневой) иммуногистохимически окрашенной сомы микроглии (Iba1) или астроцитов (GFAP) и их проксимальных и дистальных отростков сканировали с помощью Aperio's Scanscope (Leica Biosystems AG) при 20-кратном увеличении. 2. Каждое изображение обрабатывали с помощью программного обеспечения ImageScope (V12.1.0.5029, Aperio, Leica Biosystems AG) в соответствии с приведенными ниже стадиями. A: деконволюция цвета для получения коричневого окрашивания без синего; B: сегментация ткани головного мозга на белом фоне посредством определения порога, морфологического закрытия, заполнения отверстий, открытия и удаления слишком мелких объектов, что приводит к бинарной маске действительной ткани и области образца; C: адаптивное определение порога для индивидуальной сегментации сомы, основанное на среднем значении серого синего канала коричневого изображения после цветной деконволюции в достаточно темных областях (показательно для сомы). Вычисленный порог использовали для бинаризации, и после того, как фильтрация по размеру в результате давала изображение маски сомы (в пределах допустимой области выборки); D: сегментация отростков посредством морфологического преобразования tophat с размером для выбора тонких отростков. Адаптивное определение порога применяли снова для сегментирования отростков (с использованием ранее определенного среднего серого для коричневых объектов) с последующей бинаризацией изображения top-hat и фильтрацией по размеру результирующих объектов; E: вычитание сомы (которую также могли выбрать с помощью определения порога top hat) для получения маски изображения истинных отростков; F: окончательное прореживание отростков для вычисления длины; G: проксимальные отростки: Заранее определенное количество расширений сомы использовали для определения эталонной (маркерной) области для проксимальной сомы, используя круг вокруг центра сомы, чтобы определить границу отсечения для проксимальных отростков. Затем реконструировали истонченные проксимальные отростки с маркером в расширенной соме и ограниченные круговой зоной воздействия (набор "проксимальных истонченных отростков") вокруг центра сомы. "Окончательные проксимальные отростки" собирали путем реконструкции всех отростков, имеющих маркеры в наборе "проксимальных утонченных отростков"; H: сому добавляли к проксимальным отросткам для получения набора "видимой микроглии"; I: дистальные отростки: реконструкция отростков только из проксимальных отростков (т.е. игнорирование отростков на фоне или от сомы в другой фокусной плоскости), затем вычитание круговой области, определяющей проксимальные отростки, чтобы получить набор дистальных отростков; J: при вычислении оптической плотности для сомы, а также для "видимой микроглии" (комплекс индивидуальная сома+проксимальные отростки в круговой эталонной области), локальный фон (невидимую микроглию) использовали для сравнения; K: морфометрические признаки (размер, форм-фактор, длина) вычисляли для сомы, проксимальных и дистальных отростков.
Модель MPTP у мышей с гуманизированным посредством Crispr-нокина TREM2
[00544] 1-Метил-4-фенил-1,2,3,6-тетрагидропиридин (MPTP) представляет собой токсин, который может вызывать у людей симптомы, похожие на болезнь Паркинсона. MPTP метаболизируется астроцитарной моноаминоксидазой-B с образованием активного метаболита 1-метил-4-фенилпиридиния (MPP+), который затем поглощается нейронами через переносчики дофамина (DA) (DAT). Среди прочего, MPP+ накапливается в митохондриальном матриксе и ингибирует комплекс I дыхательной цепи, что нарушает выработку митохондриального ATP. Это истощение ATP вместе с образованием избыточных активных форм кислорода (ROS) из-за ингибирования комплекса I приводит к гибели клеток. Системное введение MPTP специфически вызывает гибель дофаминергических клеток у мышей, что сопровождается усилением нейровоспаления. Модель MPTP была описана ранее (Ren, M et al., Exp Neurol, 2018. 302: p. 205-213).
[00545] Мышей с гуманизированным посредством Crispr-нокина TREM2 (hTREM-KI) обрабатывали с помощью MPTP 4 раза в течение 1 дня с инъекциями 15 мг/кг i.p. с интервалом 2 часа. Инъекции 44698 и изотипического контроля MOR03207 (коротко: 3207) i.p., 30 мг/кг выполняли за день до MPTP, через два дня и четыре дня после обработки с помощью MPTP. Через семь дней после обработки с помощью MPTP животных умерщвляли и проводили иммунофлуоресцентный анализ на свободно плавающих фронтальных срезах головного мозга. Тирозингидроксилазу (TH) окрашивали антителом, делали микроскопические снимки (с 10-кратным объективом) и площадь, окрашенную в полосатом теле, определяли количественно с помощью программного обеспечения Fiji.
[00546] Перед умерщвлением животных перфузировали транскардиально физиологическим раствором с фосфатным буфером (PBS) и в некоторых случаях затем 4% параформальдегидом (PFA). Затем образцы головного мозга или половины головного мозга изолировали и фиксировали в 4% PFA в течение 24-48 ч при 4°C. Некоторые образцы половины головного мозга глубоко замораживали или помещали свежими в холодный PBS.
[00547] Гистология. После фиксации головной мозг помещали в 2% агарозу в PBS и получали свободно плавающие срезы (толщиной по меньшей мере 20-30 мкм). Срезы переносили в 24-луночный планшет, промывали с помощью PBS и инкубировали в течение 1 ч в 2% (об./об.) нормальной козьей или лошадиной сыворотке крови (Vector Laboratories) в PBS с добавлением 1% (мас./об.) бычьего сывороточного альбумина (BSA) и 0,3% (об./об.) Triton X-100 (называемого в данном документе буфером дня 1). Затем срезы помещали на ночь в буфер дня 1, содержащий соответствующие первичные антитела (кроличье антитело к тирозингидроксилазе (TH), Millipore AB152). На следующий день срезы дважды промывали с помощью PBS, дополненным 0,3% BSA и 0,1% Triton X-100 (называемого в данном документе буфером дня 2), инкубировали в течение 1 часа с соответствующими вторичными флуоресцентно-меченными антителами в буфере дня 2, промывали дважды буфером дня 2, трижды в PBS, а затем помещали на предметные стекла и закрывали покровным стеклом. Иммуноокрашенные срезы анализировали с помощью ImageJ.
Исследование PK на яванских макаках
[00548] Для оценки PK антител у приматов, отличных от человека, и для обеспечения возможности моделирования PK у людей, провели исследование PK на яванских макаках. 4 группы по 3 животных в каждой обрабатывали средой-носителем, 10, 30 или 100 мг/кг MOR044698 в день 1 и день 106. CSF отбирали перед введением дозы и через 48 и 168 часов после введения дозы. Кровь отбирали перед введением дозы и через 0,5, 4, 8, 24, 48, 72, 96 и 168 часов после введения дозы и в последующие дни 15, 29, 43, 57, 71, 85 и 99 после введения дозы.
[00549] Концентрацию антитела в CSF и крови будут оценивать с помощью ELISA, а также связывания антитела с sTREM2 в обоих компартментах.
Результаты
Свойства антител, полученных в результате первоначального и резервного пэннингов
[00550] Усилия по скринингу, которые следовали за экспериментами по пэннингу, идентифицировали антитела, которые in vitro связывались с нМ значениями аффинности с внеклеточным доменом человеческого TREM2 (таблица 15). Чтобы определить, распознают ли антитела "стеблевую" область TREM2 или домен IgSF, антитела оценивали в анализах ELISA с использованием двух разных химерных белков TREM2-TREM1. Одна конструкция содержала домен IgSF TREM2, за которым следовала "стеблевая" область TREM1, другой белок был собран из домена IgSF TREM1, за которым следовала "стеблевая" область TREM2. Большинство антител распознают конструкцию TREM2-IgSF-стеблевая область TREM1. MOR041874 связывается со "стеблевой" областью TREM2 и не распознает "стеблевой" белок hTREM2 IgSF-T1. MOR041895 связывается только с полноразмерным TREM2.
[00551] Антитела также связываются с рекомбинантно экспрессируемым человеческим TREM2 в клетках CHO с нМ значениями аффинности и активируют TREM2-зависимую передачу сигналов через промотор NFAT в клетках THP1-B5 (таблица 15).
[00552] Антитела также связываются с TREM2, эндогенно экспрессируемым в макрофагах M2A человека (таблица 15, последний столбец).
Таблица 15.
[00553] Для оценки стабилизирующих свойств антител к TREM2 клетки CHO-hDAP12-hTREM2 обрабатывали в течение примерно 16 ч с помощью 100 нМ антител. После этого экспрессию TREM2 на клеточной поверхности оценивали с помощью FACS-анализа.
[00554] Как показано на фигуре 2, некоторые из связывающих IgSF веществ увеличивают экспрессию TREM2 на клеточной поверхности, что указывает на нарушение шеддинга TREM2 с помощью ADAM17 (например, MOR042492, MOR042493, MOR042556, MOR042589, MOR042596, MOR042752, MOR042765).
[00555] На следующей стадии удаляли PTM для антител MOR042492 и MOR042589 и проводили созревание аффинности для нескольких стабилизирующих антител.
Таблица 16. Определение KD с помощью SET-скрининга.
[00556] В качестве приблизительной оценки аффинности связывания антител с созревшей аффинностью человеческого TREM2 проводили скрининговые эксперименты SET с использованием hTREM2 ECD (19-174). Некоторые антитела обладают субнаномолярной аффинностью связывания с рекомбинантно экспрессируемым человеческим TREM2 в этом анализе in vitro (таблица 16).
Таблица 17. Активность антител в отношении hM2A и селективность в отношении рекомбинантно экспрессируемых белков и клеточных линий.
[00557] Затем антитела подвергали скринингу в отношении связывания с эндогенно экспрессируемым TREM2 в макрофагах hM2A от разных доноров с использованием FACS-анализа. Некоторые антитела демонстрируют ЕС50 связывания ниже 2 нМ. Кроме того, большинство антител не связывались с исходными (нетрансфицированными) клетками СНО или с клетками THP-1, которые генетически сконструировали с помощью CRISPR, чтобы не иметь экспрессии TREM2 (таблица 17).
Таблица 18. Определение клеточного EC50 для человеческого TREM2, эндогенно экспрессируемого в макрофагах hM2A, полученных от разных доноров.
[00558] В отличие от рекомбинантных систем экспрессии макрофаги M2A человека эндогенно экспрессируют TREM2 и DAP12. В этой клеточной системе белок TREM2 посттрансляционно процессируется и экспрессируется очень похожим образом, если сравнивать с ситуацией in vivo у людей.
[00559] ЕС50 антител определяли для эндогенно экспрессируемого человеческого TREM2 в макрофагах hM2A (таблица 18). n обозначает количество различных экспериментов, и в каждом эксперименте макрофаги, которые были дифференцированы от моноцитов CD14+, получали от разных доноров. Результаты показывают субнаномолярную аффинность связывания антител большинства антител к человеческому M2A с использованием FACS-анализа. Приведены индивидуальные значения для каждого донора. Наиболее удивительно то, что некоторые антитела демонстрируют высокую вариабельность аффинности связывания между разными донорами, например 44724, 44713, 44735 и 44716, в то время как другие демонстрируют постоянный характер связывания среди различных протестированных доноров, например MOR044746 и MOR44698.
Таблица 19. Определение домена TREM2, распознаваемого антителами, и связывание с TREM2 яванского макака.
[00560] Используя рекомбинантно полученные белки, исследовали какой белковый домен TREM2 (IGSF или "стеблевая" область) распознается антителами к TREM2 (таблица 19). Все антитела связываются с полноразмерной внеклеточной конструкцией TREM2 с более чем 5x соотношением сигнал:фон. Антитела MOR044743, MOR044741, MOR0044742 и MOR044744 сильно взаимодействуют со "стеблевой" областью TREM2, в то время как большинство других антител связывают IGSF.
[00561] Эти эксперименты также показывают перекрестную реактивность этих антител с ECD TREM2 яванского макака (таблица 19).
Таблица 20. Исследовательское определение физико-химических свойств антител.
[00562] Для дальнейшей характеристики биохимических и биофизических свойств антител оценивали содержание мономеров, изоэлектрическую точку, температуру плавления и гидрофобность антител (таблица 20).
[00563] Некоторые антитела проявляли превосходные биохимические и биофизические свойства (т.е. содержание мономера > 94%, pI>7,1, TM>75 и гидрофобность >0,4), например MOR044746, MOR044698, MOR044724, MOR044722, MOR044716, MOR044705, MOR044713.
Таблица 21. Определение KD по кинетике без метки с помощью SPR.
[00564] Для точной оценки значений аффинности связывания антител определение аффинности путем измерения констант кинетических скоростей выполняли с помощью SPR. Кроме того, проводили сравнение с TREM2 яванского макака (таблица 21). Перед проведением этих экспериментов проанализировали количество фракций мономера белка антитела (IgG) (по меньшей мере 90% содержание мономера с помощью аналитической SEC).
[00565] Определение KD антител в рекомбинантно экспрессируемом домене ECD TREM2 яванского макака или человека выявляет пМ значения аффинности. Данные значения аффинности сходны при сравнении TREM2 человека и яванского макака.
[00566] Для дальнейшей оценки специфичности антител к TREM2 макрофаги M2A человека обрабатывали с помощью PMA и связывание антител с данными макрофагами оценивали с помощью FACS анализа (фигура 3). Было показано, что PMA активирует протеазы, такие как ADAM17, что приводит к шеддингу ECD TREM2 из hM2A (Feuerbach, D et al. Neurosci Lett, 2017. 92: p. 202-209). После обработки с помощью PMA Ab AF1828 больше не связывается с макрофагами M2A (сравните первый и второй столбцы).
[00567] Однако некоторые антитела все еще связываются со структурами на клеточной поверхности макрофагов M2A человека (например, MOR44728, MOR46021, MOR46022, MOR46023, MOR46025, MOR46026, MOR46028, MOR46029 и MOR46030), что указывает на неспецифическое связывание. Некоторые антитела не связываются с макрофагами M2A человека после обработки с помощью PMA (например, MOR44694, MOR44698, MOR44705, MOR44746).
[00568] Для дальнейшего исследования свойств связывания антител, не связанных с мишенью, выбранный набор антител подвергали профилированию панели белков. Результаты показывают, что кумулятивные соотношения связывания антител ниже 150, что представляет IgG без детектируемого неспецифического связывания (таблица 22).
Таблица 22. Определение неспецифического связывания в профилировании панели белков (3P).
[00569] Клетки СНО, которые рекомбинантно экспрессируют химерные конструкции TREM2-TREM1, использовали для идентификации сайта связывания антител в белке TREM2. С помощью FACS-анализа показано, что все антитела связываются с полноразмерным TREM2 человека дикого типа (фигура 4A). Антитела MOR044698, MOR044713, MOR044716, MOR044724 и MOR044746 связываются с линиями клеток, экспрессирующими TREM2-IgSF-стеблевой белок TREM1 (рисунок 4B), но не TREM1-IgSF-стеблевой белок TREM2 (фигура 4C). Антитела MOR44743 и MOR041874 показали обратный характер связывания, т.е. эти антитела связывались с линиями клеток, экспрессирующими TREM1-IgSF-стеблевой белок TREM2, но не TREM2-IgSF-стеблевой белок TREM1. MOR3207 представляет собой антитело изотипического контроля, а антитело к IgG человека является только вторичным FACS-окрашивающим антителом.
[00570] В следующей серии экспериментов оценивали активность антител с использованием рекомбинантной клеточной системы экспрессии. ЕС50 антител определяли с использованием анализа FACS на клетках СНО, рекомбинантно экспрессирующих TREM2 яванского макака или человека (таблица 23). В клетках СНО, экспрессирующих человеческий TREM2, было показано, что антитела проявляют субнаномолярные значения аффинности связывания. В линиях клеток, экспрессирующих TREM2 яванского макака, значения аффинности связывания находится в аналогичном диапазоне по сравнению с клетками, экспрессирующими человеческий TREM2.
Таблица 23. Определение клеточных ЕС50 в линиях клеток, экспрессирующих CHO-cynoTREM2 и CHO-human TREM2, с использованием анализа FACS.
[00571] hM2A от разных доноров обрабатывали в течение ночи с помощью 100 нМ антител к TREM2. Затем экспрессию TREM2 на клеточной поверхности оценивали с использованием не перекрестно блокирующего Fab-фрагмента MOR041895. Инкубация с антителами MOR044746, MOR044698, MOR044713, MOR044716 и MOR044724 вызвала стабилизацию TREM2 на клеточной поверхности в отличие от антител MOR044741, MOR044743. Все антитела проявляют субнаномолярные значения аффинност и сходный Bmax с TREM2 (как определено ранее). Однако MOR044746, MOR044698, MOR044713, MOR044716 и MOR044724 связываются с доменом IgSF, тогда как MOR044741 и MOR044743 связываются со "стеблевой" областью TREM2 (фигура 5). В таблице 24 показано кратное увеличение экспрессии TREM2 на клеточной поверхности по сравнению с изотипическим контролем (MOR03207). n представляет количество различных экспериментов, и в каждом эксперименте макрофаги получали от разных доноров.
[00572] Эти данные показывают, что антитела, которые связываются с доменом IgSF TREM2, ингибируют высвобождение эктодомена шеддазами, такими как ADAM17, и увеличивают экспрессию TREM2 на клеточной поверхности.
Таблица 24. Количественная оценка стабилизации TREM2 на клеточной поверхности в hM2A антителами к TREM2.
[00573] hM2A от разных доноров обрабатывали с помощью 100 нМ (фигура 6A) или 10 нМ (фигура 6B) антител к TREM2. Через 16-20 ч клетки подвергали анализу на фагоцитоз с использованием в качестве "жертвы" биочастиц золотистого стафилококка, меченных с помощь pHrodo. Антитела, которые стабилизировали экспрессию TREM2 на клеточной поверхности (MOR044746, MOR044698, MOR044713, MOR044716 и MOR044724), способствуют фагоцитозу в hM2A. Напротив, MOR044741 и MOR044743, которые не увеличивают экспрессию на клеточной поверхности, также не усиливают поглощение биочастиц золотистого стафилококка, меченных с помощью pHrodo. Антитела MOR044746, MOR044698, MOR044713, MOR044716 и MOR044724 были эффективны в анализе фагоцитоза также при 10 нМ (фигура 6B). Эти данные показывают, что антитела, которые связываются с доменом IgSF TREM2, увеличивают фагоцитарную способность hM2A.
[00574] Затем различные концентрации стабилизирующих TREM2 антител инкубировали с макрофагами hM2A с последующим анализом фагоцитоза через 16-20 ч. Антитела 44698 и 44716 усиливали поглощение биочастиц золотистого стафилококка, меченных с помощью pHrodo, в hM2A даже при самой низкой протестированной концентрации (1 нМ) у обоих доноров по сравнению с изотипическим контролем. Самая низкая активная концентрация для антител 44746 и 44713 также составляла 1 нМ, но только у одного донора. Самая низкая активная концентрация 44694 составляла 3 нМ, но также только у одного донора (фигура 7A, B).
[00575] На фигуре 8 показано, что активация эндогенно экспрессируемого TREM2 в клетках THP1-B5 антителами индуцирует активность люциферазы, управляемую промотором NFAT. Планшеты покрывали изотипическим контролем или различными антителами к TREM2. Антитела MOR044746, MOR044698, MOR044713, MOR044716 и MOR044724 активируют транскрипцию TREM2-зависимого гена.
[00576] На фигуре 9 (A, B) показано фосфорилирование Syk, определенное с помощью вестерн-блоттинга макрофагов M2A человека после обработки антителом изотипического контроля (MOR03207 или ratIC) или антителом к TREM2 (MOR044698 или rathT2). Где указано (X-link: +), что за этим следовала обработка перекрестно связывающим антителом к Fc (x-link).
[00577] Как показано на фигуре 9A, антитело к TREM2 44698 увеличивает вызванное TREM2 фосфорилирование Syk в макрофагах M2A человека. MOR044698, а также коммерчески доступное крысиное антитело к человеческому TREM2 от R&D усиливают фосфорилирование syk даже в отсутствие перекрестно связывающего антитела к Fc (сравните дорожки 1 и 2 и дорожки 5 и 6 на фигуре 9A). Данный эффект сильно усиливается при добавлении перекрестно связывающего антитела (сравните дорожки 3 и 4 и дорожки 7 и 8). После добавления перекрестно связывающего антитела MOR044698 наблюдается более сильный эффект в отношении фосфорилирования syk по сравнению с крысиным антителом к человеческому TREM2 (см. дорожки 4 и 8).
[00578] Эти эксперименты показывают, что Ab MOR044698 одновременно со стабилизирующей TREM2 активностью проявляет также агонистическую в отношении TREM2 активность в клеточной системе человека с эндогенной экспрессией TREM2.
[00579] В следующей серии экспериментов оценивали присутствие соединений с высокой молекулярной массой, соединений с низкой молекулярной массой, а также чистоту очищенных антител (таблица 25). Эксклюзионную хроматографию (SEC) использовали для разделения вариантов моноклональных антител разного размера в нативных условиях. Кратковременная агрегация представленаобразованием соединений с низкой молекулярной массой (LMW). Кратковременная агрегация представлена образованием соединений с низкой молекулярной массой (LMW). Соединения с высокой молекулярной массой (HMW) измеряют с помощью эксклюзионной хроматографии (SEC) и капиллярного гель-электрофореза с использованием додецилсульфата натрия (CE-SDS) и указывают на склонность антитела к образованию агрегатов, которые нежелательны по причинам иммуногенности, среди прочего. Соединения с высокой молекулярной массой (HMW) представляют собой нежелательное свойство очищенного материала. Капиллярный гель-электрофорез с использованием додецилсульфата натрия (CE-SDS) использовали для разделения белка на основе различий в молекулярной массе, и его можно проводить в невосстанавливающих или восстанавливающих условиях. Содержание продуктов разложения, соединений с низкой молекулярной массой (LMW), включая продукты отсекания, и побочных продуктов (HMW) указывает на качество очищенного материала. Как показано ниже, все молекулы демонстрируют благоприятные качественные характеристики в отношении возможности разработки.
Таблица 25. Окончательная аналитическая характеристика: чистота и соединения с высокой/низкой молекулярной массой очищенных антител.
Комментарии:
* Восстановленный CE-SDS. Сообщенные LMW включают потенциальные негликозилированные HC.
** Невосстановленный CE-SDS. Сообщенные LMW включают потенциальные фрагменты антител.
[00580] В дальнейших экспериментах исследовали молекулярную массу, гликирование, гликозилирование, продукты отсекания и варианты последовательностей очищенных антител (таблица 26). Гликирование белков представляет собой неферментативную реакцию гликозилирования между восстанавливающим сахаром (например, глюкозой, галактозой и фруктозой) и аминогруппами белка. Для терапевтических белков потенциальные эффекты гликирования включают блокирование биологически функционального сайта или дальнейшее разрушение, которое вызывает агрегацию. Гликозилирование, как обычная форма посттрансляционных модификаций белков, представляет собой иной опосредованный ферментами процесс, с помощью которого боковые цепи олигосахаридов ковалентно присоединяются либо к боковой цепи аспарагина (N-связанное), либо к серину/треонину (O-связанное). Углеводный компонент терапевтического гликопротеина часто является ключевым при определении его фармакологических свойств, включая стабильность, растворимость/биодоступность, активность in vivo, фармакокинетику и иммуногенность. Отсекание (фрагментация) является распространенным типом биохимических разрушений рекомбинантных терапевтических белков. Оно часто связано с активностями протеаз в линии клеток-хозяев и влияет на качество, физическую стабильность и потенциальную иммуногенность белковых фармацевтических препаратов. Как показано ниже, все молекулы демонстрируют благоприятные качественные профили MS в отношении возможности разработки.
Таблица 26. Окончательная аналитическая характеристика: масса антител, гликирование, гликозилирование, отсекание и варианты последовательностей очищенных антител.
HC: тяжелая цепь
LC: легкая цепь
LOD: предел обнаружения
[00581] С помощью следующей серии экспериментов оценивали биофизические свойства (т.е. параметр дифференциального взаимодействия, вязкость, гидрофобность, температуру плавления и изоэлектрическую точку) очищенных антител (таблица 27). Параметр дифференциального взаимодействия (DIP) является мерой коллоидной стабильности, которая представляет собой склонность молекул к ассоциации из-за слабых сил притяжения, связанных с гидрофобными поверхностными остатками и т.д. Это может коррелировать с вязкостью молекулы. Вязкость представляет собой сопротивление потоку из-за сил внутреннего трения, возникающих при движении жидкости. Она оказывает сильное влияние на возможность разработки и введение молекулы. Прямым способом измерения поверхностной гидрофобности белка является определение времени его удерживания во время элюирования сульфатом аммония. Гидрофобность является ключевым фактором риска агрегации белков и неблагоприятных эффектов во время процессов концентрирования. Дифференциальная сканирующая флуориметрия (DSF) определяет температуру конформационного перехода с разворачиванием белков путем применения возрастающего температурного градиента. Термическая стабильность (температура плавления Tm, измеренная с помощью дифференциальной сканирующей флуориметрии DSF при pH 5,5) представляет собой склонность белка к агрегации и/или разворачиванию при изменении температуры, как правило, из-за воздействия на гидрофобное ядро. Термоиндуцированное разворачивание является типичной моделью с двумя состояниями с резким конформационным переходом между свернутым и развернутым состояниями, где значение Tm определяется как средняя точка температуры конформационного перехода с разворачиванием белка. Приводится Tm Fab, которая является индикатором термической стабильности молекулы. Начало разворачивания является дополнительным индикатором термической стабильности молекулы, определяющим температуру, при которой белок начинает разворачиваться. Изоэлектрическая точка (pI) представляет собой pH, при котором антитело не имеет чистого электрического заряда, и его значение зависит от заряженных аминокислот, содержащихся в антителе. Это влияет на процесс очистки молекул. Известно, что pI mAb оказывает существенное влияние на характер PK независимо от рециклирования, опосредованного неонатальным Fc-рецептором, FcRn. Терапевтические антитела со значениями pI в диапазоне 8-9 адекватно поглощаются после введения, поскольку физиологический pH равен 7,4. Как показано ниже, все молекулы демонстрируют благоприятные биофизические свойства в отношении возможности разработки.
Таблица 27. Окончательная аналитическая характеристика: биофизические свойства очищенных антител.
при 50 мг/мл (cP)
[00582] Антитела к TREM2 профилировали на клеточном чипе, связывающем белки плазматической мембраны человека, для проверки их селективности (таблица 28). MOR044716 связывался с клетками, экспрессирующими TYRO3, SEZ6L2 и TGM2. Фоновый сигнал для MOR044716 нетрансфицированным клеткам может быть связан с эндогенной экспрессией одной из этих немишеней. В отличие от SEZL2 и TGM2, TYRO3 часто идентифицируется на экранах Retrogenix и рассматривается как "липкий" рецептор на этой платформе. Тем не менее, интенсивность сигнала (слабая/средняя) достаточно высока, чтобы рассматривать его как потенциальную немишень. MOR044724 связывался с клетками, экспрессирующими CD36 и CRHBP.
[00583] TREM2 был единственной специфической мишенью для MOR044746, MOR044698 и MOR044713, что свидетельствует о высоком уровне селективности этих антител. В дополнение к своей основной цели MOR044716 и MOR044724 распознают 3 и 2 релевантных нецелевых объекта соответственно.
Таблица 28. Оценка профиля связывания антител к TREM2 с использованием клеточных чипов на основе белков плазматической мембраны человека.
[00584] Эксперименты по фагоцитозу проводили на макрофагах M2A человека после предварительной обработки антителами к TREM2 с использованием технологии, не зависящей от FACS-анализа (фигура 10). Кроме того, использовали два различных антитела изотипического контроля (MOR3207 и ACE27716), а также коммерчески доступную антисыворотку к TREM2 (TREM2 от R&D). В отличие от анализа фагоцитоза на основе FACS, за фагоцитозом наблюдали в течение 3 часов и оценивали площадь под кривой накопления внутриклеточных биочастиц pHrodo. MOR044746 и MOR044698 показали статистически значимое способствование фагоцитозу по сравнению с антителами изотипического контроля hIgG.
[00585] Было продемонстрировано способствование фагоцитозу в макрофагах hM2A с использованием коммерчески доступного золотистого стафилококка, меченного с помощью pHrodo, в качестве "жертвы" (см. фигуры 6, 7 и 10). Фосфатидилсерин был описан как лиганд, который связывается с TREM2 (Kober, C and Bret, TJ J Mol Biol, 2017. 429(11): p. 1607-1629) и экспонируется в апоптических клетках на плазматической мембране. Кроме того, in vivo TREM2, по-видимому, участвует в удалении клеточного дебриса. Поэтому апоптические клетки SH-SY5Y метили чувствительным к pH красителем pHrodo и использовали в качестве фагоцитарной "жертвы" (фигура 11). Аналогично результатам, полученным с золотистым стафилококком, меченным с помощью pHrodo, предварительная инкубация с антителами MOR044698 и MOR044746 к TREM2 усиливала фагоцитарную способность макрофагов M2A в течение 3-12 ч по сравнению с двумя антителами изотипического контроля MOR03207 и ACE27716.
[00586] Таким образом, на фигурах 6, 7, 10 и 11 продемонстрировано, что антитела MOR044698 и MOR044746 к TREM2 усиливают фагоцитарную способность макрофагов M2A при использовании двух разных "жертв" и двух разных экспериментальных считываний.
[00587] Было показано, что TREM2 участвует в хемотаксических ответах остеокластов (Humphrey et al. J Bone Min Res, 2006. 21:237-245. 201(4):p.647-657). Поэтому влияние антител к TREM2 на хемотаксический ответ оценивали в макрофагах M2a человека. При использовании 20 нг/мл хемоаттрактанта C5a в комбинации со 100 нМ MOR044698 или MOR044746 наблюдали статистически значимое усиление хемотаксиса по сравнению с двумя антителами изотипического контроля MOR03207 и ACE27716 (см. фигуру 12).
[00588] Данный эксперимент показывает, что MOR044698 и MOR044746 проявляют эффективность в макрофагах M2A человека при втором TREM2-зависимом физиологическом считывании клеток (хемотаксис).
[00589] Аналогично результатам, полученным с макрофагами M2A человека, предварительная инкубация микроглиеподобных клеток, полученных из iPS человека, с антителами MOR044698 и MOR044746 к TREM2 усиливала фагоцитарную способность апоптических клеток SH-SY5Y, меченных с помощью pHrodo, в течение 20 часов по сравнению с двумя антителами изотипического контроля MOR03207 и ACE27716 (см. фигуру 13).
[00590] Было показано, что TREM2 участвует в хемотаксических ответах клеток микроглии (Takahashi, K et al. J Exp Med, 2005. 201(4): p. 647-657). Поэтому влияние антител к TREM2 на хемотаксический ответ оценивали в микроглиеподобных клетках, полученных из iPS человека. При использовании 20 нг/мл хемоаттрактанта C5a в комбинации со 100 нМ MOR044698 или MOR044746 наблюдали статистически значимое усиление хемотаксиса по сравнению с двумя антителами изотипического контроля MOR03207 и ACE27716 (см. фигуру 14).
[00591] Из данных экспериментов видно, что MOR044698 или MOR044746 усиливают фагоцитозную эффективность в другой клеточной системе человеческого происхождения (в клетках микроглии) и на втором TREM2-зависимом физиологическом считывании клеток (хемотаксис).
Купризоновая модель у мышей с гуманизированным посредством Crispr-нокина TREM2
Профилактическое/сопутствующее лечение муринизированным антителом MOR44698 к TREM2 в купризоновой модели
[00592] Как показано на фиг. 15A, окрашивание люксолом прочным синим не продемонстрировало разницы в миелине в мозолистом теле (CC). Это соответствует данным MRI (фиг. 15B), которые также не показали очевидной разницы в MTR в CC. Количественный иммуногистологический анализ маркера микроглии Iba1 показал пониженное количество (фиг. 15C) и более низкий статус активации (фиг. 15D) в CC у обработанных с помощью 44698 мышей, по сравнению с изотипическим контролем. Это соответствовало данным MRI, из которых видно снижение интенсивности MRI в CC (фиг. 15E).
Терапевтическое лечение муринизированным антителом MOR44698 к TREM2 в купризоновой модели
[00593] Как показано на фиг. 15A, окрашивание люксолом прочным синим не продемонстрировало значительного увеличения содержания миелина в CC по сравнению с 3207. Это соответствует данным MRI, из которых также видно увеличение в MTR в CC при обработке с помощью 44698 (фиг. 15B). Количественный иммуногистологический анализ маркера микроглии Iba1 не показал разницы в количестве (фиг. 15C) и статусе активации (фиг. 15D) в CC у обработанных с помощью 44698 мышей, по сравнению с изотипическим контролем. Это соответствовало данным MRI, из которых не видно изменение интенсивности MRI в CC между группами обработки (фиг. 15E).
[00594] Из этих данных видно, что антитело 44698 к TREM2 оказывает положительное влияние на процессы миелинизации при терапевтическом применении и изменяет количество и активацию клеток микроглии, что подразумевает потенциальную терапевтическую пользу антитела к TREM2 при любом заболевании, при котором происходит демиелинизация или желательна ремиелинизация, как в центральной, так и периферической нервной системе, включая без ограничения: рассеянный склероз, включая клинически изолированный синдром, первично-прогрессирующий MS, рецидивирующе-ремиттирующий MS, рассеянный склероз Марбурга и вторично-прогрессирующий MS, синдром Гийена-Барре и его хронический аналог, хроническую воспалительную демиелинизирующую полинейропатию, периферическую нейропатию с антителами к MAG, болезнь Шарко-Мари-Тута и ее аналог, наследственную нейропатию со склонностью к параличу от сдавления, виды нейропатии, ассоциированные с дефицитом витамина B12, концентрический склероз Бало, диффузный склероз Шильдера и болезнь Девича, центральный понтинный миелинолиз, такие виды миелопатии, как сухотка спинного мозга (сифилитическая миелопатия), виды лейкоэнцефалопатии, такие как прогрессирующая мультифокальная лейкоэнцефалопатия (вызванная активацией вируса JC), виды лейкодистрофии, неврит зрительного нерва, поперечный миелит, оптический нейромиелит, ассоциированные с дефицитом меди состояния (периферическая нейропатия, миелопатия и оптическая нейропатия), прогрессирующую воспалительную периферическую нейропатию, хроническую воспалительную демиелинизирующую полинейропатию (CIDP) и другие расстройства с вовлечением иммунной системы, обобщенные термином воспалительные демиелинизирующие заболевания.
Модель MPTP у мышей с гуманизированным посредством Crispr-нокина TREM2
[00595] Через семь дней после обработки с помощью MPTP животных умерщвляли и проводили иммунофлуоресцентный анализ на свободно плавающих фронтальных срезах головного мозга. Тирозингидроксилазу (TH) окрашивали антителом, делали микроскопические снимки и площадь, окрашенную в полосатом теле, определяли количественно с помощью программного обеспечения Fiji. TH специфически экспрессируется дофаминергическими нейронами, и после их смерти снижение TH может наблюдаться в полосатом теле, куда дофаминергические клетки, которые находятся в черной субстанции, проецируются своими длинными аксонами.
[00596] Как показано на фиг. 16A, животные, получавшие MPTP и изотипический контроль 3207, показали значительно меньшее TH-положительное окрашивание в полосатом теле (% площади) по сравнению с наивными животными (необработанные контрольные дикие типы), в то время как мыши, обработанные с помощью 44698, демонстрировали значительно большее TH-окрашивание по сравнению с животными с изотипическим контролем. На фиг. 16B представлены репрезентативные полученные с помощью микроскопии флуоресцентные изображения (10-кратное увеличение) полосатого тела из различных групп обработки.
[00597] Эти данные указывают на потенциальный нейропротекторный эффект антитела к TREM2, который подразумевает общую потенциальную пользу при нейродегенеративных заболеваниях, включая без ограничения: болезнь Паркинсона, множественную системную атрофия, прогрессирующий надъядерный паралич, кортикобазальную дегенерацию и деменцию с тельцами Леви (DLB), виды синуклеинопатии, виды таупатии, болезнь Вильсона, нейродегенерацию с накоплением железа в головном мозге, идиопатическую кальцификацию базальных ядер, лобно-височную деменцию и связанный с хромосомой 17 паркинсонизм, тремор/атаксию, ассоциированные с ломкой Х-хромосомой, ишемический инсульт, геморрагический инсульт, транзиторную ишемическую атаку, боковой амиотрофический склероз (ALS), также известный как болезнь двигательных нейронов (MND) или болезнь Лу Герига, первичный боковой склероз (PLS), прогрессирующую мышечную атрофию (PMA), прогрессирующий бульбарный паралич, псевдобульбарный паралич и мономерную амиотрофию (MMA), лобно-височную деменцию (FTD), поведенческий вариант FTD, семантический вариант первичной прогрессирующей афазии, нефлюентный аграмматический вариант первичной прогрессирующей афазии, кортикобазальный синдром, прогрессирующий надъядерный паралич и ассоциированную с заболеванием двигательных нейронов FTD, болезнь Пика, лобно-височные лобарные дегенерации, алкогольную деменция, сосудистую деменцию, кортикобазальную дегенерацию и болезнь Крейтцфельдта-Якоба.
Пример 3. Эксперимент с перекрестной блокировкой
Материалы и способы
[00598] Клетки CHO-hDAP12-hTREM2 использовали для оценки активности перекрестного блокирования Fab MOR041877, или Fab MOR041895, или Fab MOR042596 с полным IgG MOR041877 (связывающее IgSF вещество), MOR41895 (требуется "стеблевая" область и IgSF для связывания), MOR042596 (связывающее IgSF вещество и исходный клон MOR044698), MOR044698 и MOR03207 (изотипический контроль). Клетки CHO-hDAP12-hTREM2 культивировали в течение ночи в культуральной среде с добавлением 5 мкМ DPC333 для увеличения экспрессии TREM2 на клеточной поверхности. На следующий день клетки CHO-hDAP12-hTREM2 отделяли с помощью аккутазы, один раз промывали с помощью PBS и ресуспендировали в буфере для FACS (PBS, 2% FBS, 0,5 мМ EDTA, pH 8,0) в концентрации 4×106 клеток/мл. Fab-фрагменты MOR041877, MOR041895 и MOR042596 помечали с помощью Alexa Fluor 647 (AF647) в соответствии с протоколом производителя MAN0006869 от Invitrogen. 100 нМ полных антител IgG смешивали в общем объеме 30 мкл с 15 мкл клеточной суспензии и инкубировали в течение 30 мин на льду. Клетки промывали один раз с помощью PBS и инкубировали со 100 нМ Fab-фрагментов, меченных с помощью AF647, в течение 30 мин на льду, дважды промывали с помощью PBS, фиксировали буфером для фиксации клеток (Biolegend) и ресуспендировали в буфере для FACS. Получение данных проводили на аппарате BD FACS canto.
Результаты
[00599] На связывание Fab-фрагмента MOR041877 не влияет предварительная инкубация с MOR041895 (фиг. 17A), поскольку достигается аналогичный сигнал, как и при предварительной инкубации с изотипическим контролем MOR03207 или без какой-либо предварительной обработки (последний столбец). Предварительная инкубация с MOR042596 и MOR044698 сильно снижает связывание Fab MOR041877, что указывает на перекрывающиеся эпитопы для этих трех антител. Степень связывания Fab MOR41895 снижается путем предварительной инкубации с полным IgG, из которого происходит этот Fab, но не с MOR041877, MOR044698 или MOR042596. Связывание полных IgG MOR041877, MOR044698 и MOR042596 с TREM2, по-видимому, облегчает доступ Fab41895, что приводит к увеличению интенсивности сигнала (фиг. 17B). Наконец, предварительное связывание полного IgG MOR041877, MOR044698 или MOR042596 полностью ингибирует последующее связывание Fab MOR042596, демонстрируя, что MOR041877 и MOR044698 имеют один и тот же эпитоп с MOR042596 (фиг. 17C). Таким образом, из данных экспериментов видно, что MOR044698 с созревшей аффинностью связывается с тем же эпитопом, что и исходное антитело MOR042596.
Пример 4. Определение характеристик MOR041877 и MOR042596
[00600] Антитела MOR041877 и MOR042596 связываются с человеческим TREM2, рекомбинантно экспрессируемым в клетках CHO-hDAP12-hTREM2, а также с TREM2, экспрессируемым в макрофагах M2A человека, и активируют TREM2-зависимую активность репортерного гена в клетках THP-B5 (см. таблицу 29). Эти данные показывают, что оба антитела проявляют высокую аффинность к TREM2 и непосредственно активируют TREM2.
Таблица 29. Определение характеристик MOR041877 и MOR042596 в различных клеточных системах.
[00601] Кроме того, макрофаги hM2A обрабатывали с помощью 100 нМ антител к TREM2 MOR042596 или изотипического контроля (MOR03207). Через 16-20 ч клетки подвергали анализу в отношении фагоцитоза с использованием различных концентраций Staphylococcus aureus, меченного с помощью pHrodo, в качестве фагоцитарной "жертвы". MOR042596 сильно увеличивал фагоцитарную способность макрофагов hM2A во всем диапазоне концентраций используемого S. aureus (фиг. 18). Это указывает на то, что MOR042596 увеличивает передачу сигналов TREM2 и зависимые от TREM2 эффекторные функции в макрофагах M2A.
Пример 5. Рентгеновская кристаллическая структура комплекса человеческого TREM2/Fab MOR042596
[00602] Определяли кристаллическую структуру человеческого TREM2 (остатки 19-174 из SEQ ID NO: 1, за которыми следует His-tag; SEQ ID NO: 139), связанного с Fab-фрагментом MOR042596 (остатки 1-222 из SEQ ID NO: 15 и остатки 1-214 из SEQ ID NO: 82). Как подробно описано ниже, отдельные компоненты комплекса получали с использованием отдельных систем экспрессии и объединяли для получения очищенного комплекса. Затем использовали рентгеновскую кристаллографию для получения данных дифракции для TREM2, связанного с MOR042596, для выявления антигенсвязывающего сайта.
SEQ ID NO: 139
HNTTVFQGVA GQSLQVSCPY DSMKHWGRRK AWCRQLGEKG PCQRVVSTHN LWLLSFLRRW NGSTAITDDT LGGTLTITLR NLQPHDAGLY QCQSLHGSEA DTLRKVLVEV LADPLDHRDA GDLWFPGESE SFEDAHVEHS ISRSLLEGEI PFPPTSHHHH HH
Получение белка
[00603] Человеческий TREM-2 (остатки 19-174 из SEQ ID NO: 1, за которыми следует His-tag; SEQ ID NO: 139) экспрессировали в клетках млекопитающих с помощью крупномасштабной временной трансфекции. Вкратце, плазмидную ДНК смешивали в соотношении 1:2 с полиэтиленамином (PEI 25k, PolyScience) и давали возможность образовывать мицеллярные комплексы в течение 30 мин. Исходная посевная культура содержала 2 мг ДНК и 4 мг PEI на 1 л культуры. Трансфекции достигали путем добавления этих смесей к клеткам HEK 293-6E (Invitrogen) в соотношении 2 мкг ДНК: 3×106 клеток. Клеткам давали возможность расти в среде V3 (Bioconcept Ltd. Amimed) при встряхивании в вентилируемых колбах при 37°C и 5% CO2. Супернатанты культур собирали через 130 ч после трансфекции, модифицировали путем добавления 50 мМ Tris pH 8,5, 300 мМ NaCl, 5% глицерина и 10 мМ имидазола, а затем очищали с помощью NiNTA-аффинной хроматографии. Белки промывали на колонке с использованием того же буфера, содержащего 20 мМ имидазола, и элюировали в 250 мМ имидазола. TREM2 дополнительно очищали с помощью эксклюзионной хроматографии (superdex 75) с буфером, содержащим 50 мМ Tris pH 7,5, 150 мМ NaCl, 10% глицерина. Полученные белки характеризовались чистотой >90% по оценке с помощью SDS-PAGE.
[00604] Для получения MOR042596 эукариотические клетки HEK293-T трансфицировали ДНК-вектором экспрессии в клетках млекопитающих, кодирующим как тяжелую, так и легкую цепи FabCys с дисульфидными мостиками. Супернатанты культуры клеток собирали в день 7 после трансфекции и подвергали аффинной хроматографии с CH1 (Capture Select IgG-CH1, Thermo Scientific). Проводили замену буфера на 20 мМ Tris, 100 мМ NaCl, pH 7,5 и образцы подвергали стерилизующей фильтрации (размер пор 0,2 мкм). Концентрации белков определяли с помощью UV-спектрофотометрии и показатели чистоты FabCys анализировали в денатурирующих, восстанавливающих и невосстанавливающих условиях с использованием SDS-PAGE. Для анализа препаратов FabCys в нативном состоянии проводили HP-SEC.
Восстановление комплекса TREM2 - Fab MOR042596 in vitro
[00605] Очищенный TREM2 затем смешивали с Fab MOR042596 в молярном соотношении 1:1 (концентрация, измеренная с помощью OD A280). Затем комплекс концентрировали перед загрузкой на колонку Superdex 75 (GE Healthcare Life Sciences), уравновешенную с помощью 50 мМ Tris pH 7,5, 150 мМ NaCl, 5% глицерина. Пиковые фракции подвергали анализу с помощью SDS-PAGE, и выбранные фракции объединяли для испытаний в отношении кристаллизации.
Кристаллизация и определение структуры
[00606] Комплекс TREM2-Fab MOR042596 концентрировали до 7,5 мг/мл с последующим центрифугированием при 20000 × g в течение 10 мин перед распределением скрининга кристаллизации. Кристаллы выращивали при 20°C с использованием установки для диффузии пара из сидящей капли. 0,2 мкл комплекса TREM2-MOR42596 смешивали с 0,2 мкл резервуарного раствора, содержащего 20% PEG3350, 0,2 М тартрата калия-натрия, и каплю уравновешивали против 80 мкл резервуарного раствора. Кристаллы собирали из их исходного раствора с 20% глицерином в качестве криопротектора и сразу мгновенно замораживали в жидком азоте.
[00607] Наборы данных собирали при длине волны 1000  с помощью детектора PILATUS 6M на канале синхротронного излучения Swiss Light Source X10SA (Филлиген, Швейцария). Дифракционные изображения, записанные при клиньях угла отклонения 0,25°, обрабатывали и масштабировали с помощью XDS и XSCALE (Kabsch W, 1993. Automatic processing of rotation diffraction data from crystals of initially unknown symmetry and cell constants J. Appl. Cryst. 26: 795-800), соответственно, в программном наборе APRV (Kroemer M, Dreyer MK, Wendt KU 2004. APRV - a program for automated data processing, refinement and visualization. Acta Cryst. D60: 1679-82). Первоначальную структуру получали путем молекулярной замены с использованием Phaser (McCoy AJ, Grosse-Kunstleve RW, Adams PD et al. 2007. Phaser crystallographic software. J. Appl. Cryst. 40: 658-74.) и моделей гомологии Fab и Ig домена TREM2 в качестве поисковых моделей. Перестройка модели вручную и последующее уточнение структуры выполняли в Coot (Emsley P, Cowtan K (2004) Coot: model-building tools for molecular graphics. Acta Cryst. D60: 2126-32.) и autoBuster (Bricogne G, Blanc E, Brandl M et al. (2009) BUSTER, версия 2.8.0. Кембридж, Великобритания, Global Phasing Ltd.) соответственно.
с помощью детектора PILATUS 6M на канале синхротронного излучения Swiss Light Source X10SA (Филлиген, Швейцария). Дифракционные изображения, записанные при клиньях угла отклонения 0,25°, обрабатывали и масштабировали с помощью XDS и XSCALE (Kabsch W, 1993. Automatic processing of rotation diffraction data from crystals of initially unknown symmetry and cell constants J. Appl. Cryst. 26: 795-800), соответственно, в программном наборе APRV (Kroemer M, Dreyer MK, Wendt KU 2004. APRV - a program for automated data processing, refinement and visualization. Acta Cryst. D60: 1679-82). Первоначальную структуру получали путем молекулярной замены с использованием Phaser (McCoy AJ, Grosse-Kunstleve RW, Adams PD et al. 2007. Phaser crystallographic software. J. Appl. Cryst. 40: 658-74.) и моделей гомологии Fab и Ig домена TREM2 в качестве поисковых моделей. Перестройка модели вручную и последующее уточнение структуры выполняли в Coot (Emsley P, Cowtan K (2004) Coot: model-building tools for molecular graphics. Acta Cryst. D60: 2126-32.) и autoBuster (Bricogne G, Blanc E, Brandl M et al. (2009) BUSTER, версия 2.8.0. Кембридж, Великобритания, Global Phasing Ltd.) соответственно.
Выявление MOR042596-связывающего эпитопа на hTREM2
[00608] Авторы настоящего изобретения получали рентгеновскую сокристаллическую структуру комплекса человеческого TREM2/Fab MOR042596, как описано выше. На фигуре 19 показан обзор остатков TREM2, взаимодействующих с MOR042596.
[00609] Из структуры комплекса TREM2/MOR042596-Fab авторы настоящего изобретения вывели эпитоп TREM2, который охватывает три отдельные области последовательности на huTREM, представленные в таблице 30. Все изоформы hTREM2 (SEQ ID NO: 1-3) характеризуются первыми 161 общими остатками, которые включают сигнальный пептид и весь домен IgSF; поэтому эпитопы и нумерация остатков в этом диапазоне (т.е. до остатка R161 включительно), как указано ниже (например, таблицы 30, 31 и 33), одинаковы для всех трех изоформ hTREM2.
Таблица 30. Эпитоп связывания TREM2 с MOR042596.
Сходство между MOR044698 и MOR042596 и связывание эпитопа hTREM2 с MOR044698
[00610] Как показано на фигуре 19, hTREM2 взаимодействует как с тяжелой, так и с легкой цепью MOR042596. Близкородственный Fab MOR044698 имеет идентичную последовательность в пяти из шести TREM2-связывающих петель с MOR042596, а именно HCDR1, HCDR2, HCDR2, LCDR1 и LCDR2, при этом отличается только LCDR3. Последовательности этих петель, а также остатки TREM2 на расстоянии 5  в структуре комплекса TREM2/Fab MOR042596 приведены в таблице 31, а сравнение последовательностей LCDR3 MOR042596 и MOR044698 приведено в таблице 32.
в структуре комплекса TREM2/Fab MOR042596 приведены в таблице 31, а сравнение последовательностей LCDR3 MOR042596 и MOR044698 приведено в таблице 32.
Таблица 31. Последовательности HCDR и LCDR для MOR042596 и взаимодействующих остатков на TREM2 в пределах 5
 .
.
Таблица 32. Последовательности LCDR3 MOR042596 и MOR044698.
[00611] Чтобы оценить структурные последствия различий в LCDR3 между обоими Fab, авторы настоящего изобретения построили модель гомологии для MOR044698. Авторы настоящего изобретения использовали кристаллическую структуру MOR042596 в качестве шаблона и построили модель с помощью CCG MOE версии 2018.01 в качестве программного обеспечения для моделирования при стандартных настройках [Molecular Operating Environment (MOE), 2018.01; Chemical Computing Group ULC: Монреаль, Квебек, Канада, 2018]. На фигуре 20 показана область контакта обоих Fab с TREM2. Поскольку HCDR1-3 и LCDR1-2 идентичны, обсуждаются только различия в LCDR3. Существует несколько консервативных остатков (например, Pro95, который решающим образом влияет на конформацию петли LCDR3), как можно понять из таблицы 32. В области контакта TREM2 и двух Fab есть три положения, в которых происходят серьезные изменения/мутации при сравнении MOR042596 и MOR044698: изменение глицина 92 на аргинин, серина 94 на метионин и вставка серина в положение 95a для MOR044698. Вставка серина 95a не вызывает серьезных конформационных изменений, а скорее вызывает небольшую адаптацию белкового остова. Оставшиеся два серьезных аминокислотных изменения в положениях 92 и 94, представляя серьезные изменения в боковых цепях, могут быть встроены в уже существующую петлевую структуру LCDR3, как это наблюдается в кристаллической структуре MOR042596, без каких-либо конфликтов или неблагоприятных контактов с TREM2. Есть и другие отличия в положениях 89, 91 и 96. Положения 89 и 96 не вовлечены в какие-либо контакты с TREM2, и мутация гистидина на тирозин в положении 91 допустима, вызывая только небольшую адаптацию конформации боковой цепи. В целом, поскольку тяжелые цепи идентичны, легкие цепи идентичны в LCDR1, и LCDR2, и LCDR3, при этом, по-видимому, имея неизмененную конформацию петли и сохраненные контакты с TREM2 в MOR044698, авторы настоящего изобретения делают вывод, что эпитоп TREM2 идентичен между двумя Fab MOR042596 и MOR044698.
Рентгеновская кристаллическая структура комплекса человеческого TREM2/Fab MOR041877
[00612] Определяли кристаллическую структуру человеческого TREM2 (остатки 19-174 из SEQ ID NO: 1, за которыми следует His-tag; SEQ ID NO: 139), связанного с Fab-фрагментом MOR041877 (остатки 1-224 из SEQ ID NO: 95 и по остаткам 1-216 из SEQ ID NO: 106). Как подробно описано ниже, отдельные компоненты комплекса получали с использованием отдельных систем экспрессии и объединяли для получения очищенного комплекса. Затем использовали рентгеновскую кристаллографию для получения данных дифракции для TREM2, связанного с MOR041877, для выявления антигенсвязывающего сайта.
Получение белка
[00613] Человеческий белок TREM-2 экспрессировали и очищали, как описано выше для MOR042596.
[00614] Для получения MOR041877 эукариотические клетки HKB11 трансфицировали ДНК-вектором экспрессии в клетках млекопитающих, кодирующим как тяжелую, так и легкую цепи FabCys с дисульфидными мостиками. Супернатанты культуры клеток собирали в день 3 или 7 после трансфекции и подвергали аффинной хроматографии с CH1 (Capture Select IgG-CH1, Thermo Scientific). Проводили замену буфера на 1X PBS Дульбекко (pH 7,2, Invitrogen) и образцы подвергали стерилизующей фильтрации (размер пор 0,2 мкм). Концентрации белков определяли с помощью UV-спектрофотометрии и показатели чистоты FabCys анализировали в денатурирующих, восстанавливающих и невосстанавливающих условиях с использованием CE-SDS (LabChip GXII, Perkin Elmer). Для анализа препаратов FabCys в нативном состоянии проводили HP-SEC.
Восстановление комплекса TREM2 - Fab MOR041877 in vitro
[00615] Очищенный TREM2 затем смешивали с Fab MOR042596 в молярном соотношении 1:1 (концентрация, измеренная с помощью OD A280). Затем комплекс концентрировали перед загрузкой на колонку Superdex 75 (GE Healthcare Life Sciences), уравновешенную с помощью 50 мМ Tris pH 7,5, 150 мМ NaCl, 5% глицерина. Пиковые фракции подвергали анализу с помощью SDS-PAGE, и выбранные фракции объединяли для испытаний в отношении кристаллизации.
Кристаллизация и определение структуры
[00616] Комплекс TREM2-MOR042596 концентрировали до 7,5 мг/мл с последующим центрифугированием при 20000 × g в течение 10 мин перед распределением скрининга кристаллизации. Кристаллы выращивали при 20°C с использованием установки для диффузии пара из сидящей капли. 0,2 мкл комплекса TREM2-MOR41877 смешивали с 0,2 мкл резервуарного раствора, содержащего 20% PEG3350, 0,2 М тартрата калия-натрия, и каплю уравновешивали против 80 мкл резервуарного раствора. Кристаллы собирали из их исходного раствора с 20% глицерином в качестве криопротектора и сразу мгновенно замораживали в жидком азоте.
[00617] Наборы данных собирали при длине волны 1000  с помощью детектора PILATUS 6M на канале синхротронного излучения Swiss Light Source X10SA (Филлиген, Швейцария). Дифракционные изображения, записанные при клиньях угла отклонения 0,25°, обрабатывали и масштабировали с помощью XDS и XSCALE (Kabsch WJ 1993), соответственно, в наборе программного обеспечения APRV (Kroemer M et al. 2004). Исходную структуру получали путем молекулярной замены с использованием Phaser (McCoy AJ et al., 2007) и моделей гомологии Fab и Ig домена TREM2 в качестве поисковых моделей. Перестройка модели вручную и последующее уточнение структуры выполняли в Coot (Emsley P et al. 2004) и autoBuster (G et al. 2009) соответственно.
с помощью детектора PILATUS 6M на канале синхротронного излучения Swiss Light Source X10SA (Филлиген, Швейцария). Дифракционные изображения, записанные при клиньях угла отклонения 0,25°, обрабатывали и масштабировали с помощью XDS и XSCALE (Kabsch WJ 1993), соответственно, в наборе программного обеспечения APRV (Kroemer M et al. 2004). Исходную структуру получали путем молекулярной замены с использованием Phaser (McCoy AJ et al., 2007) и моделей гомологии Fab и Ig домена TREM2 в качестве поисковых моделей. Перестройка модели вручную и последующее уточнение структуры выполняли в Coot (Emsley P et al. 2004) и autoBuster (G et al. 2009) соответственно.
Выявление MOR041877-связывающего эпитопа на hTREM2
[00618] Авторы настоящего изобретения получали рентгеновскую сокристаллическую структуру комплекса человеческого TREM2/Fab MOR041877, как описано выше. На фигуре 21 показан обзор остатков TREM2, взаимодействующих с MOR041877.
[00619] Из структуры комплекса TREM2/Fab MOR041877 авторы настоящего изобретения вывели связывание эпитопа TREM2 с MOR041877, как показано в таблице 33.
Таблица 33. Эпитоп связывания TREM2 с MOR041877.
[00620] Последовательности петель HCDR и LCDR, а также остатки TREM2 на расстоянии 5  в структуре комплекса TREM2/Fab MOR041877 приведены в таблице 34.
в структуре комплекса TREM2/Fab MOR041877 приведены в таблице 34.
Таблица 34. Последовательности HCDR и LCDR для MOR041877 и взаимодействующих остатков на TREM2 в пределах 5
 .
.
Пример 6. Профилактическое/сопутствующее лечение муринизированным антителом к TREM2 (MOR044698-mu) в 3-недельной купризоновой модели
[00621] Купризоновая модель представляет собой модель индуцированной токсином демиелинизации для изучения процессов миелинизации в ЦНС с незначительным участием периферической иммунной системы. Купризон, хелатор меди, вызывает повреждение митохондрий и, в конечном итоге, гибель олигодендроцитов, в то время как клетки-предшественники олигодендроцитов не затрагиваются и все еще могут выполнять свои надлежащие функции (пролиферировать, созревать и ремиелинизировать). Купризоновая модель хорошо подходит для тестирования парадигм регенеративного лечения демиелинизирующих заболеваний, таких как, например, MS, которые усиливают ремиелинизацию независимо от вторгающихся периферических иммунных клеток.
[00622] Мышей с гуманизированным TREM2 получали путем введения cDNA TREM2 человека, включая сигнальную последовательность поли-А бычьего гормона роста, в ATG гена TREM2 мыши с помощью технологии CRISPR/Cas. Линии-основатели характеризовались экспрессией hTREM2 в макрофагах, происходящих из костного мозга, и в клетках микроглии головного мозга. Затем интеграцию трансгена подтверждали посредством амплификации целевого локуса (TLA).
[00623] Мышей с гуманизированным посредством Crispr-нокина TREM2 (hTREM-KI) обрабатывали купризоном (0,2% в пище) в течение 3 недель, с одним днем до и два раза в неделю после этого с MOR044698-mu (включающим последовательность легкой цепи под SEQ ID NO: 140 и последовательность тяжелой цепи под SEQ ID NO: 141) и изотипическим контролем MOR03207 (коротко: 3207) i.p., 30 мг/кг. После 3 недель профилактического/сопутствующего лечения антителом и купризоном животных умерщвляли и выполняли гистологическое исследование на свободно плавающих фронтальных срезах головного мозга (толщиной 20-30 мкм). Антитела TREM2 и Iba1 использовали для оценки уровней hTREM2 в клетках микроглии.
[00624] Как показано на фиг. 22A, B уровни hTREM2 в Iba1-положительных клетках микроглии в коре головного мозга были примерно в 3 раза выше у животных, получавших MOR044698-mu, по сравнению с изотипическим контролем в 3-недельной купризоновой модели. Количественная оценка hTREM2 (окрашенного антителом AF1828) выполняли путем количественной оценки флуоресцентных изображений tiff (стек развернут и экспортирован как снимок tiff без корректировки изображения, 20X) на Fiji (преобразование в 8-бит) с порогом (Iba1, зеленый: 10, TREM2, красный: 15). Регистрируемые показания. %Площади; %площади TREM2 нормализован к %площади Iba1 (x100), в среднем по двум стекам изображений коры на одно животное, по 2 среза мозга на окрашенное животное, по 1 стеку изображений на срез мозга.
Вывод
[00625] Эти данные показывают, что системное лечение с помощью MOR044698 стабилизирует TREM2 в головном мозге в клетках микроглии и, таким образом, увеличивает его уровни и может привести к усилению передачи сигналов и функции TREM2.
Резюме
[00626] Таким образом, использовали стратегию для идентификации антител к TREM2, которые способствуют функции TREM2 в клеточной системе человека (т.е. в макрофагах или клетках микроглии) за счет снижения конститутивного или вызванного воспалением выведения TREM2 и, таким образом, увеличения клеточной активности TREM2. Такие антитела полезны для лечения множества нейродегенеративных заболеваний.
[00627] Идентифицировали антитела к TREM2 (антитела к hTREM2), они связываются с субнаномолярными значениями клеточной аффинности с макрофагами M2A человека и демонстрируют очень небольшую изменчивость от донора к донору. Антитела по настоящему изобретению связываются с доменом IgSF человеческого TREM2, а также распознают TREM2 яванского макака. Это было продемонстрировано как в ELISA in vitro, так и в линиях клеток. Неожиданно связывание данных антител с TREM2 ингибирует шеддинг эктодомена TREM2 из макрофагов M2A человека и, как следствие, увеличивает экспрессию TREM2 на клеточной поверхности. Функционально антитела к TREM2 по настоящему изобретению также увеличивают фагоцитарную способность, а также усиливают C5a-опосредованный хемотаксис как в макрофагах человека, так и в микроглиеподобных клетках, полученных из iPS человека. Кроме того, антитела по настоящему изобретению также усиливают хемотаксис человеческих макрофагов, а также микроглиеподобных клеток, полученных из iPS человека. Настоящие антитела также непосредственно активируют TREM2, как показывает NFAT-зависимый клеточный анализ с применением репортерного гена, а также повышенное фосфорилирование syk в макрофагах человека после стимуляции TREM2.
[00628] Антитела по настоящему изобретению проявляют высокую специфичность к TREM2, не связываются с какой-либо другой мишенью и являются полностью человеческими антителами. Антитела по настоящему изобретению демонстрируют связывание с новым эпитопом на TREM2 в области IgSF и, как показано, стабилизируют и активируют TREM2.
[00629] Антитела по настоящему изобретению также были выбраны на основе их пригодности для разработки: например, в антителах по настоящему изобретению отсутствуют посттрансляционные модификации в CDR, они не образуют агрегатов, они продуцируются в больших количествах клеточными системами, они не демонстрируют продуктов отсечения и показывают хорошо-определенную температуру плавления и изоэлектрическую точку. Наконец, их увеличенный период полужизни приводит к более длительному эффекту в мозге, позволяя оптимизировать дозу для достижения желаемого клинического эффекта и уменьшать частоту введения доз, тем самым повышая приверженность пациента к лечению.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> NOVARTIS AG
<120> Антитела, стабилизирующие TREM2
<130> PAT058251
<160> 141
<170> PatentIn версия 3.5
<210> 1
<211> 230
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Met Glu Pro Leu Arg Leu Leu Ile Leu Leu Phe Val Thr Glu Leu Ser
1 5 10 15
Gly Ala His Asn Thr Thr Val Phe Gln Gly Val Ala Gly Gln Ser Leu
20 25 30
Gln Val Ser Cys Pro Tyr Asp Ser Met Lys His Trp Gly Arg Arg Lys
35 40 45
Ala Trp Cys Arg Gln Leu Gly Glu Lys Gly Pro Cys Gln Arg Val Val
50 55 60
Ser Thr His Asn Leu Trp Leu Leu Ser Phe Leu Arg Arg Trp Asn Gly
65 70 75 80
Ser Thr Ala Ile Thr Asp Asp Thr Leu Gly Gly Thr Leu Thr Ile Thr
85 90 95
Leu Arg Asn Leu Gln Pro His Asp Ala Gly Leu Tyr Gln Cys Gln Ser
100 105 110
Leu His Gly Ser Glu Ala Asp Thr Leu Arg Lys Val Leu Val Glu Val
115 120 125
Leu Ala Asp Pro Leu Asp His Arg Asp Ala Gly Asp Leu Trp Phe Pro
130 135 140
Gly Glu Ser Glu Ser Phe Glu Asp Ala His Val Glu His Ser Ile Ser
145 150 155 160
Arg Ser Leu Leu Glu Gly Glu Ile Pro Phe Pro Pro Thr Ser Ile Leu
165 170 175
Leu Leu Leu Ala Cys Ile Phe Leu Ile Lys Ile Leu Ala Ala Ser Ala
180 185 190
Leu Trp Ala Ala Ala Trp His Gly Gln Lys Pro Gly Thr His Pro Pro
195 200 205
Ser Glu Leu Asp Cys Gly His Asp Pro Gly Tyr Gln Leu Gln Thr Leu
210 215 220
Pro Gly Leu Arg Asp Thr
225 230
<210> 2
<211> 219
<212> БЕЛОК
<213> Homo sapiens
<400> 2
Met Glu Pro Leu Arg Leu Leu Ile Leu Leu Phe Val Thr Glu Leu Ser
1 5 10 15
Gly Ala His Asn Thr Thr Val Phe Gln Gly Val Ala Gly Gln Ser Leu
20 25 30
Gln Val Ser Cys Pro Tyr Asp Ser Met Lys His Trp Gly Arg Arg Lys
35 40 45
Ala Trp Cys Arg Gln Leu Gly Glu Lys Gly Pro Cys Gln Arg Val Val
50 55 60
Ser Thr His Asn Leu Trp Leu Leu Ser Phe Leu Arg Arg Trp Asn Gly
65 70 75 80
Ser Thr Ala Ile Thr Asp Asp Thr Leu Gly Gly Thr Leu Thr Ile Thr
85 90 95
Leu Arg Asn Leu Gln Pro His Asp Ala Gly Leu Tyr Gln Cys Gln Ser
100 105 110
Leu His Gly Ser Glu Ala Asp Thr Leu Arg Lys Val Leu Val Glu Val
115 120 125
Leu Ala Asp Pro Leu Asp His Arg Asp Ala Gly Asp Leu Trp Phe Pro
130 135 140
Gly Glu Ser Glu Ser Phe Glu Asp Ala His Val Glu His Ser Ile Ser
145 150 155 160
Arg Ala Glu Arg His Val Lys Glu Asp Asp Gly Arg Lys Ser Pro Gly
165 170 175
Glu Val Pro Pro Gly Thr Ser Pro Ala Cys Ile Leu Ala Thr Trp Pro
180 185 190
Pro Gly Leu Leu Val Leu Leu Trp Gln Glu Thr Thr Leu Pro Glu His
195 200 205
Cys Phe Ser Trp Thr Leu Glu Ala Gly Thr Gly
210 215
<210> 3
<211> 222
<212> БЕЛОК
<213> Homo sapiens
<400> 3
Met Glu Pro Leu Arg Leu Leu Ile Leu Leu Phe Val Thr Glu Leu Ser
1 5 10 15
Gly Ala His Asn Thr Thr Val Phe Gln Gly Val Ala Gly Gln Ser Leu
20 25 30
Gln Val Ser Cys Pro Tyr Asp Ser Met Lys His Trp Gly Arg Arg Lys
35 40 45
Ala Trp Cys Arg Gln Leu Gly Glu Lys Gly Pro Cys Gln Arg Val Val
50 55 60
Ser Thr His Asn Leu Trp Leu Leu Ser Phe Leu Arg Arg Trp Asn Gly
65 70 75 80
Ser Thr Ala Ile Thr Asp Asp Thr Leu Gly Gly Thr Leu Thr Ile Thr
85 90 95
Leu Arg Asn Leu Gln Pro His Asp Ala Gly Leu Tyr Gln Cys Gln Ser
100 105 110
Leu His Gly Ser Glu Ala Asp Thr Leu Arg Lys Val Leu Val Glu Val
115 120 125
Leu Ala Asp Pro Leu Asp His Arg Asp Ala Gly Asp Leu Trp Phe Pro
130 135 140
Gly Glu Ser Glu Ser Phe Glu Asp Ala His Val Glu His Ser Ile Ser
145 150 155 160
Arg Pro Ser Gln Gly Ser His Leu Pro Ser Cys Leu Ser Lys Glu Pro
165 170 175
Leu Gly Arg Arg Asn Pro Leu Pro Thr His Phe His Pro Ser Pro Pro
180 185 190
Gly Leu His Leu Ser His Gln Asp Ser Ser Ser Gln Arg Pro Leu Gly
195 200 205
Cys Ser Leu Ala Trp Thr Glu Ala Arg Asp Thr Ser Thr Gln
210 215 220
<210> 4
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 4
Gly Tyr Thr Phe Thr Gly Tyr His Met Ser
1 5 10
<210> 5
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 5
Val Ile Asn Pro Val Ser Gly Asn Thr Val Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 6
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 6
Ile Pro Ser Tyr Thr Tyr Ala Phe Asp Tyr
1 5 10
<210> 7
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 7
Gly Tyr His Met Ser
1 5
<210> 8
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 8
Gly Tyr Thr Phe Thr Gly Tyr
1 5
<210> 9
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 9
Asn Pro Val Ser Gly Asn
1 5
<210> 10
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 10
Gly Tyr Thr Phe Thr Gly Tyr His
1 5
<210> 11
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 11
Ile Asn Pro Val Ser Gly Asn Thr
1 5
<210> 12
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 12
Ala Arg Ile Pro Ser Tyr Thr Tyr Ala Phe Asp Tyr
1 5 10
<210> 13
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 13
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
His Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Val Ser Gly Asn Thr Val Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ile Pro Ser Tyr Thr Tyr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 14
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 14
caggtgcaat tggtgcagag cggtgcggaa gtgaaaaaac cgggtgccag cgtgaaagtt
60
agctgcaaag cgtccggata taccttcact ggttaccata tgtcttgggt gcgccaggcc
120
ccgggccagg gcctcgagtg gatgggcgtt atcaacccgg tttctggcaa cacggtttac
180
gcgcagaaat ttcagggccg ggtgaccatg acccgtgata ccagcattag caccgcgtat
240
atggaactga gccgtctgcg tagcgaagat acggccgtgt attattgcgc gcgtatcccg
300
tcttacactt acgctttcga ttactggggc caaggcaccc tggtgactgt tagctca
357
<210> 15
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 15
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
His Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Val Ser Gly Asn Thr Val Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ile Pro Ser Tyr Thr Tyr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 16
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 16
caggtgcaat tggtgcagag cggtgcggaa gtgaaaaaac cgggtgccag cgtgaaagtt
60
agctgcaaag cgtccggata taccttcact ggttaccata tgtcttgggt gcgccaggcc
120
ccgggccagg gcctcgagtg gatgggcgtt atcaacccgg tttctggcaa cacggtttac
180
gcgcagaaat ttcagggccg ggtgaccatg acccgtgata ccagcattag caccgcgtat
240
atggaactga gccgtctgcg tagcgaagat acggccgtgt attattgcgc gcgtatcccg
300
tcttacactt acgctttcga ttactggggc caaggcaccc tggtgactgt tagctcagcc
360
tccaccaagg gtccatcggt cttccccctg gcaccctcct ccaagagcac ctctgggggc
420
acagcggccc tgggctgcct ggtcaaggac tacttccccg aaccggtgac ggtgtcgtgg
480
aactcaggcg ccctgaccag cggcgtgcac accttcccgg ctgtcctaca gtcctcagga
540
ctctactccc tcagcagcgt ggtgaccgtg ccctccagca gcttgggcac ccagacctac
600
atctgcaacg tgaatcacaa gcccagcaac accaaggtgg acaagagagt tgagcccaaa
660
tcttgtgaca aaactcacac atgcccaccg tgcccagcac ctgaagcagc ggggggaccg
720
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag
780
gtcacatgcg tggtggtgga cgtgagccac gaagaccctg aggtcaagtt caactggtac
840
gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gtacaacagc
900
acgtaccggg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa tggcaaggag
960
tacaagtgca aggtctccaa caaagccctc ccagccccca tcgagaaaac catctccaaa
1020
gccaaagggc agccccgaga accacaggtg tacaccctgc ccccatcccg ggaggagatg
1080
accaagaacc aggtcagcct gacctgcctg gtcaaaggct tctatcccag cgacatcgcc
1140
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg
1200
gactccgacg gctccttctt cctctacagc aagctcaccg tggacaagag caggtggcag
1260
caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacgcag
1320
aagagcctct ccctgtctcc gggtaaa
1347
<210> 17
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 17
Arg Ala Ser Gln Asp Ile Ser Asn Tyr Leu Ala
1 5 10
<210> 18
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 18
Arg Ala Ser Ser Leu Gln Ser
1 5
<210> 19
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 19
Phe Gln Tyr Arg His Met Pro Ser Gln Thr
1 5 10
<210> 20
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 20
Ser Gln Asp Ile Ser Asn Tyr
1 5
<210> 21
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 21
Arg Ala Ser
1
<210> 22
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 22
Tyr Arg His Met Pro Ser Gln
1 5
<210> 23
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 23
Gln Asp Ile Ser Asn Tyr
1 5
<210> 24
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 24
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Phe Gln Tyr Arg His Met Pro Ser
85 90 95
Gln Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 25
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 25
gatatccaga tgacccagag cccgagcagc ctgagcgcca gcgtgggcga tcgcgtgacc
60
attacctgca gagccagcca ggacatttct aactacctgg cttggtacca gcagaaaccg
120
ggcaaagcgc cgaaactatt aatctaccgt gcttcttctc tgcaaagcgg cgtgccgagc
180
cgctttagcg gcagcggatc cggcaccgat ttcaccctga ccattagctc tctgcaaccg
240
gaagactttg cgacctatta ttgcttccag taccgtcata tgccgtctca gacctttggc
300
cagggcacga aagttgaaat taaa
324
<210> 26
<211> 215
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 26
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Phe Gln Tyr Arg His Met Pro Ser
85 90 95
Gln Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 27
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 27
gatatccaga tgacccagag cccgagcagc ctgagcgcca gcgtgggcga tcgcgtgacc
60
attacctgca gagccagcca ggacatttct aactacctgg cttggtacca gcagaaaccg
120
ggcaaagcgc cgaaactatt aatctaccgt gcttcttctc tgcaaagcgg cgtgccgagc
180
cgctttagcg gcagcggatc cggcaccgat ttcaccctga ccattagctc tctgcaaccg
240
gaagactttg cgacctatta ttgcttccag taccgtcata tgccgtctca gacctttggc
300
cagggcacga aagttgaaat taaacgtacg gtggccgctc ccagcgtgtt catcttcccc
360
cccagcgacg agcagctgaa gagcggcacc gccagcgtgg tgtgcctgct gaacaacttc
420
tacccccggg aggccaaggt gcagtggaag gtggacaacg ccctgcagag cggcaacagc
480
caggaaagcg tcaccgagca ggacagcaag gactccacct acagcctgag cagcaccctg
540
accctgagca aggccgacta cgagaagcac aaggtgtacg cctgcgaggt gacccaccag
600
ggcctgtcca gccccgtgac caagagcttc aaccggggcg agtgt
645
<210> 28
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 28
caagtgcaac tcgtgcagtc aggagccgaa gtcaagaagc ctggagcctc ggtcaaggtg
60
tcctgcaagg ccagcggata cactttcact ggataccaca tgtcgtgggt cagacaggct
120
cctggccaag ggctggagtg gatgggcgtc atcaacccgg tgtcgggtaa taccgtgtac
180
gcccagaagt tccagggtcg cgtgaccatg acccgggata cctccattag caccgcgtac
240
atggagctca gccggttgag atccgaggat accgccgtgt actactgtgc gcggatcccg
300
tcctacactt acgccttcga ctattggggc caggggactc ttgtcaccgt gtcctcg
357
<210> 29
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 29
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
His Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Val Ser Gly Asn Thr Val Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ile Pro Ser Tyr Thr Tyr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 30
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 30
caagtgcaac tcgtgcagtc aggagccgaa gtcaagaagc ctggagcctc ggtcaaggtg
60
tcctgcaagg ccagcggata cactttcact ggataccaca tgtcgtgggt cagacaggct
120
cctggccaag ggctggagtg gatgggcgtc atcaacccgg tgtcgggtaa taccgtgtac
180
gcccagaagt tccagggtcg cgtgaccatg acccgggata cctccattag caccgcgtac
240
atggagctca gccggttgag atccgaggat accgccgtgt actactgtgc gcggatcccg
300
tcctacactt acgccttcga ctattggggc caggggactc ttgtcaccgt gtcctcggcc
360
tccactaagg gcccaagtgt gtttcccctg gcccccagca gcaagtctac ttccggcgga
420
actgctgccc tgggttgcct ggtgaaggac tacttccccg agcccgtgac agtgtcctgg
480
aactctgggg ctctgacttc cggcgtgcac accttccccg ccgtgctgca gagcagcggc
540
ctgtacagcc tgagcagcgt ggtgacagtg ccctccagct ctctgggaac ccagacctat
600
atctgcaacg tgaaccacaa gcccagcaac accaaggtgg acaagagagt ggagcccaag
660
agctgcgaca agacccacac ctgccccccc tgcccagctc cagaactgct gggagggcct
720
tccgtgttcc tgttcccccc caagcccaag gacaccctga tgatcagcag gacccccgag
780
gtgacctgcg tggtggtgga cgtgtcccac gaggacccag aggtgaagtt caactggtac
840
gtggacggcg tggaggtgca caacgccaag accaagccca gagaggagca gtacaacagc
900
acctacaggg tggtgtccgt gctgaccgtg ctgcaccagg actggctgaa cggcaaagaa
960
tacaagtgca aagtctccaa caaggccctg ccagccccaa tcgaaaagac aatcagcaag
1020
gccaagggcc agccacggga gccccaggtg tacaccctgc cccccagccg ggaggagatg
1080
accaagaacc aggtgtccct gacctgtctg gtgaagggct tctaccccag cgatatcgcc
1140
gtggagtggg agagcaacgg ccagcccgag aacaactaca agaccacccc cccagtgctg
1200
gacagcgacg gcagcttctt cctgtacagc aagctgaccg tggacaagtc caggtggcag
1260
cagggcaacg tgttcagctg cagcgtgatg cacgaggccc tgcacaacca ctacacccag
1320
aagtccctga gcctgagccc cggcaag
1347
<210> 31
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 31
gacattcaga tgacccagtc cccgtcgtcc ctgtccgcat ccgtgggcga cagagtcacc
60
atcacttgcc gggcctcaca ggatatttcc aactacctgg cctggtatca gcagaagcct
120
ggaaaggccc cgaagctgct gatctaccgg gcgtcctcct tgcaatcggg agtgccaagc
180
cgcttttctg gttccgggag cgggactgac ttcaccctga ctattagcag cctgcagccc
240
gaagatttcg ctacctacta ctgcttccag taccggcaca tgccctcaca aaccttcgga
300
cagggcacca aagtcgagat caag
324
<210> 32
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 32
gacattcaga tgacccagtc cccgtcgtcc ctgtccgcat ccgtgggcga cagagtcacc
60
atcacttgcc gggcctcaca ggatatttcc aactacctgg cctggtatca gcagaagcct
120
ggaaaggccc cgaagctgct gatctaccgg gcgtcctcct tgcaatcggg agtgccaagc
180
cgcttttctg gttccgggag cgggactgac ttcaccctga ctattagcag cctgcagccc
240
gaagatttcg ctacctacta ctgcttccag taccggcaca tgccctcaca aaccttcgga
300
cagggcacca aagtcgagat caagcgtacg gtggccgctc ccagcgtgtt catcttcccc
360
cccagcgacg agcagctgaa gagcggcacc gccagcgtgg tgtgcctgct gaacaacttc
420
tacccccggg aggccaaggt gcagtggaag gtggacaacg ccctgcagag cggcaacagc
480
caggagagcg tcaccgagca ggacagcaag gactccacct acagcctgag cagcaccctg
540
accctgagca aggccgacta cgagaagcat aaggtgtacg cctgcgaggt gacccaccag
600
ggcctgtcca gccccgtgac caagagcttc aacaggggcg agtgc
645
<210> 33
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 33
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
His Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Val Ser Gly Asn Thr Val Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ile Pro Ser Tyr Thr Tyr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Ala Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Ala Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 34
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 34
caagtgcaac tcgtgcagtc aggagccgaa gtcaagaagc ctggagcctc ggtcaaggtg
60
tcctgcaagg ccagcggata cactttcact ggataccaca tgtcgtgggt cagacaggct
120
cctggccaag ggctggagtg gatgggcgtc atcaacccgg tgtcgggtaa taccgtgtac
180
gcccagaagt tccagggtcg cgtgaccatg acccgggata cctccattag caccgcgtac
240
atggagctca gccggttgag atccgaggat accgccgtgt actactgtgc gcggatcccg
300
tcctacactt acgccttcga ctattggggc caggggactc ttgtcaccgt gtcctcggcc
360
tccactaagg gcccgtcagt gttccccctt gcgccatcct cgaagtcaac ctccggagga
420
actgccgcac tgggttgcct cgtgaaagac tatttcccgg aacccgtcac tgtctcctgg
480
aactcaggag cgctcaccag cggagtgcat acctttcctg cggtgctgca gtccagcggc
540
ctgtactccc tgagctccgt cgtgaccgtc ccctcgtcgt ccctgggaac ccaaacctac
600
atttgcaacg tcaatcacaa gccaagcaac actaaggtgg acaagagagt ggagcccaag
660
tcctgcgata agacccacac ctgtcctccc tgtccggcac ctgaactgct tggtggacct
720
tccgtgttcc tgttcccgcc caagccaaaa gacaccctga tgatctcccg cactccggaa
780
gtcacttgcg tggtcgtggc cgtgtcccac gaggaccccg aggtcaagtt taattggtac
840
gtggacggag tggaagtgca caacgccaag accaagccgc gggaagaaca gtacaactcc
900
acctaccgcg tggtgtccgt cctgactgtg ctccaccagg actggctgaa cggaaaggag
960
tacaagtgca aagtgtccaa caaggcactg gctgccccta tcgaaaagac tatctccaag
1020
gccaagggcc aacctaggga gccccaggtg tacacgttgc ctccttcccg cgaagaaatg
1080
actaagaacc aggtgtcgct gacctgtctc gtgaaagggt tctacccctc tgacatcgcc
1140
gtggaatggg agtcaaacgg acagcctgag aacaactata agaccacacc acctgtcctg
1200
gactccgacg gctccttctt cctgtactca aagttgaccg tggacaagtc gcggtggcaa
1260
cagggcaacg tgttctcttg ctccgtgatg cacgaagccc tgcacaacca ctacacccaa
1320
aagtcgctca gcctctcccc cggaaag
1347
<210> 35
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 35
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
His Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Val Ser Gly Asn Thr Val Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ile Pro Ser Tyr Thr Tyr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Leu His Glu
420 425 430
Ala Leu His Ser His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 36
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 36
caagtgcaac tcgtgcagtc aggagccgaa gtcaagaagc ctggagcctc ggtcaaggtg
60
tcctgcaagg ccagcggata cactttcact ggataccaca tgtcgtgggt cagacaggct
120
cctggccaag ggctggagtg gatgggcgtc atcaacccgg tgtcgggtaa taccgtgtac
180
gcccagaagt tccagggtcg cgtgaccatg acccgggata cctccattag caccgcgtac
240
atggagctca gccggttgag atccgaggat accgccgtgt actactgtgc gcggatcccg
300
tcctacactt acgccttcga ctattggggc caggggactc ttgtcaccgt gtcctcggcc
360
tccactaagg gcccgtcagt gttccccctt gcgccatcct cgaagtcaac ctccggagga
420
actgccgcac tgggttgcct cgtgaaagac tatttcccgg aacccgtcac tgtctcctgg
480
aactcaggag cgctcaccag cggagtgcat acctttcctg cggtgctgca gtccagcggc
540
ctgtactccc tgagctccgt cgtgaccgtc ccctcgtcgt ccctgggaac ccaaacctac
600
atttgcaacg tcaatcacaa gccaagcaac actaaggtgg acaagagagt ggagcccaag
660
tcctgcgata agacccacac ctgtcctccc tgtccggcac ctgaactgct tggtggacct
720
tccgtgttcc tgttcccgcc caagccaaaa gacaccctga tgatctcccg cactccggaa
780
gtcacttgcg tggtcgtgga cgtgtcccac gaggaccccg aggtcaagtt taattggtac
840
gtggacggag tggaagtgca caacgccaag accaagccgc gggaagaaca gtacaactcc
900
acctaccgcg tggtgtccgt cctgactgtg ctccaccagg actggctgaa cggaaaggag
960
tacaagtgca aagtgtccaa caaggcactg ccagccccta tcgaaaagac tatctccaag
1020
gccaagggcc aacctaggga gccccaggtg tacacgttgc ctccttcccg cgaagaaatg
1080
actaagaacc aggtgtcgct gacctgtctc gtgaaagggt tctacccctc tgacatcgcc
1140
gtggaatggg agtcaaacgg acagcctgag aacaactata agaccacacc acctgtcctg
1200
gactccgacg gctccttctt cctgtactca aagttgaccg tggacaagtc gcggtggcaa
1260
cagggcaacg tgttctcttg ctccgtgctg cacgaagccc tgcacagcca ctacacccaa
1320
aagtcgctca gcctctcccc cggaaag
1347
<210> 37
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 37
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
His Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Val Ser Gly Asn Thr Val Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ile Pro Ser Tyr Thr Tyr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Ala Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Ala Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Leu His Glu
420 425 430
Ala Leu His Ser His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 38
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 38
caagtgcaac tcgtgcagtc aggagccgaa gtcaagaagc ctggagcctc ggtcaaggtg
60
tcctgcaagg ccagcggata cactttcact ggataccaca tgtcgtgggt cagacaggct
120
cctggccaag ggctggagtg gatgggcgtc atcaacccgg tgtcgggtaa taccgtgtac
180
gcccagaagt tccagggtcg cgtgaccatg acccgggata cctccattag caccgcgtac
240
atggagctca gccggttgag atccgaggat accgccgtgt actactgtgc gcggatcccg
300
tcctacactt acgccttcga ctattggggc caggggactc ttgtcaccgt gtcctcggcc
360
tccactaagg gcccgtcagt gttccccctt gcgccatcct cgaagtcaac ctccggagga
420
actgccgcac tgggttgcct cgtgaaagac tatttcccgg aacccgtcac tgtctcctgg
480
aactcaggag cgctcaccag cggagtgcat acctttcctg cggtgctgca gtccagcggc
540
ctgtactccc tgagctccgt cgtgaccgtc ccctcgtcgt ccctgggaac ccaaacctac
600
atttgcaacg tcaatcacaa gccaagcaac actaaggtgg acaagagagt ggagcccaag
660
tcctgcgata agacccacac ctgtcctccc tgtccggcac ctgaactgct tggtggacct
720
tccgtgttcc tgttcccgcc caagccaaaa gacaccctga tgatctcccg cactccggaa
780
gtcacttgcg tggtcgtggc cgtgtcccac gaggaccccg aggtcaagtt taattggtac
840
gtggacggag tggaagtgca caacgccaag accaagccgc gggaagaaca gtacaactcc
900
acctaccgcg tggtgtccgt cctgactgtg ctccaccagg actggctgaa cggaaaggag
960
tacaagtgca aagtgtccaa caaggcactg gctgccccta tcgaaaagac tatctccaag
1020
gccaagggcc aacctaggga gccccaggtg tacacgttgc ctccttcccg cgaagaaatg
1080
actaagaacc aggtgtcgct gacctgtctc gtgaaagggt tctacccctc tgacatcgcc
1140
gtggaatggg agtcaaacgg acagcctgag aacaactata agaccacacc acctgtcctg
1200
gactccgacg gctccttctt cctgtactca aagttgaccg tggacaagtc gcggtggcaa
1260
cagggcaacg tgttctcttg ctccgtgctg cacgaagccc tgcacagcca ctacacccaa
1320
aagtcgctca gcctctcccc cggaaag
1347
<210> 39
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 39
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
His Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Val Ser Gly Asn Thr Val Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ile Pro Ser Tyr Thr Tyr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Tyr Ile Thr
245 250 255
Arg Glu Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 40
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 40
caagtgcaac tcgtgcagtc aggagccgaa gtcaagaagc ctggagcctc ggtcaaggtg
60
tcctgcaagg ccagcggata cactttcact ggataccaca tgtcgtgggt cagacaggct
120
cctggccaag ggctggagtg gatgggcgtc atcaacccgg tgtcgggtaa taccgtgtac
180
gcccagaagt tccagggtcg cgtgaccatg acccgggata cctccattag caccgcgtac
240
atggagctca gccggttgag atccgaggat accgccgtgt actactgtgc gcggatcccg
300
tcctacactt acgccttcga ctattggggc caggggactc ttgtcaccgt gtcctcggcc
360
tccactaagg gcccgtcagt gttccccctt gcgccatcct cgaagtcaac ctccggagga
420
actgccgcac tgggttgcct cgtgaaagac tatttcccgg aacccgtcac tgtctcctgg
480
aactcaggag cgctcaccag cggagtgcat acctttcctg cggtgctgca gtccagcggc
540
ctgtactccc tgagctccgt cgtgaccgtc ccctcgtcgt ccctgggaac ccaaacctac
600
atttgcaacg tcaatcacaa gccaagcaac actaaggtgg acaagagagt ggagcccaag
660
tcctgcgata agacccacac ctgtcctccc tgtccggcac ctgaactgct tggtggacct
720
tccgtgttcc tgttcccgcc caagccaaaa gacaccctgt atatcactcg cgaaccggaa
780
gtcacttgcg tggtcgtgga cgtgtcccac gaggaccccg aggtcaagtt taattggtac
840
gtggacggag tggaagtgca caacgccaag accaagccgc gggaagaaca gtacaactcc
900
acctaccgcg tggtgtccgt cctgactgtg ctccaccagg actggctgaa cggaaaggag
960
tacaagtgca aagtgtccaa caaggcactg ccagccccta tcgaaaagac tatctccaag
1020
gccaagggcc aacctaggga gccccaggtg tacacgttgc ctccttcccg cgaagaaatg
1080
actaagaacc aggtgtcgct gacctgtctc gtgaaagggt tctacccctc tgacatcgcc
1140
gtggaatggg agtcaaacgg acagcctgag aacaactata agaccacacc acctgtcctg
1200
gactccgacg gctccttctt cctgtactca aagttgaccg tggacaagtc gcggtggcaa
1260
cagggcaacg tgttctcttg ctccgtgatg cacgaagccc tgcacaacca ctacacccaa
1320
aagtcgctca gcctctcccc cggaaag
1347
<210> 41
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 41
Gly Asp Ser Val Ser Ser Ser Ser Ala Ala Trp Asn
1 5 10
<210> 42
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 42
His Ile Gly Tyr Arg Ser Lys Trp Tyr Asn Glu Tyr Ala Val Ser Val
1 5 10 15
Lys Ser
<210> 43
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 43
Gly Met Tyr Gly Ser Val Pro Tyr Lys Glu Gly Tyr Tyr Phe Asp Ile
1 5 10 15
<210> 44
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 44
Ser Ser Ser Ala Ala Trp Asn
1 5
<210> 45
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 45
Gly Asp Ser Val Ser Ser Ser Ser Ala
1 5
<210> 46
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 46
Gly Tyr Arg Ser Lys Trp Tyr
1 5
<210> 47
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 47
Gly Asp Ser Val Ser Ser Ser Ser Ala Ala
1 5 10
<210> 48
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 48
Ile Gly Tyr Arg Ser Lys Trp Tyr Asn
1 5
<210> 49
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 49
Ala Arg Gly Met Tyr Gly Ser Val Pro Tyr Lys Glu Gly Tyr Tyr Phe
1 5 10 15
Asp Ile
<210> 50
<211> 128
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 50
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Ser
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly His Ile Gly Tyr Arg Ser Lys Trp Tyr Asn Glu Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Gly Met Tyr Gly Ser Val Pro Tyr Lys Glu Gly
100 105 110
Tyr Tyr Phe Asp Ile Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 51
<211> 384
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 51
caggtgcaat tgcagcagag cggtccgggc ctggtgaaac cgagccagac cctgagcctg
60
acctgcgcga tttccggaga tagcgtgagc tcttcttctg ctgcttggaa ctggattcgt
120
cagagcccga gccgtggcct cgagtggctg ggccatatcg gttaccgtag caaatggtac
180
aacgaatatg ccgtgagcgt gaaaagccgc attaccatta acccggatac ttcgaaaaac
240
cagtttagcc tgcaactgaa cagcgtgacc ccggaagata cggccgtgta ttattgcgcg
300
cgtggtatgt acggttctgt tccctacaaa gaaggttact acttcgatat ttggggccaa
360
ggcaccctgg tgactgttag ctca
384
<210> 52
<211> 458
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 52
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Ser
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly His Ile Gly Tyr Arg Ser Lys Trp Tyr Asn Glu Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Gly Met Tyr Gly Ser Val Pro Tyr Lys Glu Gly
100 105 110
Tyr Tyr Phe Asp Ile Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
130 135 140
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
145 150 155 160
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
165 170 175
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
180 185 190
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
195 200 205
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
210 215 220
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
225 230 235 240
Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
245 250 255
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
260 265 270
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
275 280 285
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
290 295 300
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
305 310 315 320
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
325 330 335
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
340 345 350
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
355 360 365
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
370 375 380
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
385 390 395 400
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
405 410 415
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
420 425 430
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
435 440 445
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 53
<211> 1374
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 53
caggtgcaat tgcagcagag cggtccgggc ctggtgaaac cgagccagac cctgagcctg
60
acctgcgcga tttccggaga tagcgtgagc tcttcttctg ctgcttggaa ctggattcgt
120
cagagcccga gccgtggcct cgagtggctg ggccatatcg gttaccgtag caaatggtac
180
aacgaatatg ccgtgagcgt gaaaagccgc attaccatta acccggatac ttcgaaaaac
240
cagtttagcc tgcaactgaa cagcgtgacc ccggaagata cggccgtgta ttattgcgcg
300
cgtggtatgt acggttctgt tccctacaaa gaaggttact acttcgatat ttggggccaa
360
ggcaccctgg tgactgttag ctcagcctcc accaagggtc catcggtctt ccccctggca
420
ccctcctcca agagcacctc tgggggcaca gcggccctgg gctgcctggt caaggactac
480
ttccccgaac cggtgacggt gtcgtggaac tcaggcgccc tgaccagcgg cgtgcacacc
540
ttcccggctg tcctacagtc ctcaggactc tactccctca gcagcgtggt gaccgtgccc
600
tccagcagct tgggcaccca gacctacatc tgcaacgtga atcacaagcc cagcaacacc
660
aaggtggaca agagagttga gcccaaatct tgtgacaaaa ctcacacatg cccaccgtgc
720
ccagcacctg aagcagcggg gggaccgtca gtcttcctct tccccccaaa acccaaggac
780
accctcatga tctcccggac ccctgaggtc acatgcgtgg tggtggacgt gagccacgaa
840
gaccctgagg tcaagttcaa ctggtacgtg gacggcgtgg aggtgcataa tgccaagaca
900
aagccgcggg aggagcagta caacagcacg taccgggtgg tcagcgtcct caccgtcctg
960
caccaggact ggctgaatgg caaggagtac aagtgcaagg tctccaacaa agccctccca
1020
gcccccatcg agaaaaccat ctccaaagcc aaagggcagc cccgagaacc acaggtgtac
1080
accctgcccc catcccggga ggagatgacc aagaaccagg tcagcctgac ctgcctggtc
1140
aaaggcttct atcccagcga catcgccgtg gagtgggaga gcaatgggca gccggagaac
1200
aactacaaga ccacgcctcc cgtgctggac tccgacggct ccttcttcct ctacagcaag
1260
ctcaccgtgg acaagagcag gtggcagcag gggaacgtct tctcatgctc cgtgatgcat
1320
gaggctctgc acaaccacta cacgcagaag agcctctccc tgtctccggg taaa
1374
<210> 54
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 54
Arg Ala Ser Gln Gly Ile Ser Ser Asp Leu Asn
1 5 10
<210> 55
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 55
Ala Ala Ser Asn Leu Gln Ser
1 5
<210> 56
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 56
Gln Gln Tyr Thr Asp Glu Ser Met Thr
1 5
<210> 57
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 57
Ser Gln Gly Ile Ser Ser Asp
1 5
<210> 58
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 58
Ala Ala Ser
1
<210> 59
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 59
Tyr Thr Asp Glu Ser Met
1 5
<210> 60
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 60
Gln Gly Ile Ser Ser Asp
1 5
<210> 61
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 61
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Asp
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Asn Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Thr Asp Glu Ser Met
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 62
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 62
gatatccaga tgacccagag cccgagcagc ctgagcgcca gcgtgggcga tcgcgtgacc
60
attacctgca gagccagcca gggtatttct tctgacctga actggtacca gcagaaaccg
120
ggcaaagcgc cgaaactatt aatctacgct gcttctaacc tgcaaagcgg cgtgccgagc
180
cgctttagcg gcagcggatc cggcaccgat ttcaccctga ccattagctc tctgcaaccg
240
gaagactttg cgacctatta ttgccagcag tacactgacg aatctatgac ctttggccag
300
ggcacgaaag ttgaaattaa a
321
<210> 63
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 63
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Asp
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Asn Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Thr Asp Glu Ser Met
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 64
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 64
gatatccaga tgacccagag cccgagcagc ctgagcgcca gcgtgggcga tcgcgtgacc
60
attacctgca gagccagcca gggtatttct tctgacctga actggtacca gcagaaaccg
120
ggcaaagcgc cgaaactatt aatctacgct gcttctaacc tgcaaagcgg cgtgccgagc
180
cgctttagcg gcagcggatc cggcaccgat ttcaccctga ccattagctc tctgcaaccg
240
gaagactttg cgacctatta ttgccagcag tacactgacg aatctatgac ctttggccag
300
ggcacgaaag ttgaaattaa acgtacggtg gccgctccca gcgtgttcat cttccccccc
360
agcgacgagc agctgaagag cggcaccgcc agcgtggtgt gcctgctgaa caacttctac
420
ccccgggagg ccaaggtgca gtggaaggtg gacaacgccc tgcagagcgg caacagccag
480
gaaagcgtca ccgagcagga cagcaaggac tccacctaca gcctgagcag caccctgacc
540
ctgagcaagg ccgactacga gaagcacaag gtgtacgcct gcgaggtgac ccaccagggc
600
ctgtccagcc ccgtgaccaa gagcttcaac cggggcgagt gt
642
<210> 65
<211> 384
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 65
caagtgcaac tccagcagtc aggaccgggg ttggtcaagc cttcgcagac cctgtccctc
60
acttgcgcca ttagcggaga ttcggtgtcg tcgtcgtcag ccgcctggaa ctggattaga
120
cagtcccctt cccgagggct ggagtggctg ggccacatcg gataccgcag caagtggtac
180
aacgaatacg ccgtcagcgt gaagtcacgc atcaccatca acccggatac tagcaagaac
240
cagttcagcc tccagttgaa ctccgtgacc ccggaggata ccgccgtgta ctactgtgcg
300
cggggcatgt acggatccgt gccgtacaag gagggatact acttcgacat ttggggccag
360
gggactcttg tcaccgtgtc ctcg
384
<210> 66
<211> 458
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 66
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Ser
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly His Ile Gly Tyr Arg Ser Lys Trp Tyr Asn Glu Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Gly Met Tyr Gly Ser Val Pro Tyr Lys Glu Gly
100 105 110
Tyr Tyr Phe Asp Ile Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
130 135 140
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
145 150 155 160
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
165 170 175
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
180 185 190
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
195 200 205
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
210 215 220
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
225 230 235 240
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
245 250 255
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
260 265 270
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
275 280 285
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
290 295 300
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
305 310 315 320
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
325 330 335
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
340 345 350
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
355 360 365
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
370 375 380
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
385 390 395 400
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
405 410 415
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
420 425 430
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
435 440 445
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 67
<211> 1374
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 67
caagtgcaac tccagcagtc aggaccgggg ttggtcaagc cttcgcagac cctgtccctc
60
acttgcgcca ttagcggaga ttcggtgtcg tcgtcgtcag ccgcctggaa ctggattaga
120
cagtcccctt cccgagggct ggagtggctg ggccacatcg gataccgcag caagtggtac
180
aacgaatacg ccgtcagcgt gaagtcacgc atcaccatca acccggatac tagcaagaac
240
cagttcagcc tccagttgaa ctccgtgacc ccggaggata ccgccgtgta ctactgtgcg
300
cggggcatgt acggatccgt gccgtacaag gagggatact acttcgacat ttggggccag
360
gggactcttg tcaccgtgtc ctcggcctcc actaagggcc caagtgtgtt tcccctggcc
420
cccagcagca agtctacttc cggcggaact gctgccctgg gttgcctggt gaaggactac
480
ttccccgagc ccgtgacagt gtcctggaac tctggggctc tgacttccgg cgtgcacacc
540
ttccccgccg tgctgcagag cagcggcctg tacagcctga gcagcgtggt gacagtgccc
600
tccagctctc tgggaaccca gacctatatc tgcaacgtga accacaagcc cagcaacacc
660
aaggtggaca agagagtgga gcccaagagc tgcgacaaga cccacacctg ccccccctgc
720
ccagctccag aactgctggg agggccttcc gtgttcctgt tcccccccaa gcccaaggac
780
accctgatga tcagcaggac ccccgaggtg acctgcgtgg tggtggacgt gtcccacgag
840
gacccagagg tgaagttcaa ctggtacgtg gacggcgtgg aggtgcacaa cgccaagacc
900
aagcccagag aggagcagta caacagcacc tacagggtgg tgtccgtgct gaccgtgctg
960
caccaggact ggctgaacgg caaagaatac aagtgcaaag tctccaacaa ggccctgcca
1020
gccccaatcg aaaagacaat cagcaaggcc aagggccagc cacgggagcc ccaggtgtac
1080
accctgcccc ccagccggga ggagatgacc aagaaccagg tgtccctgac ctgtctggtg
1140
aagggcttct accccagcga tatcgccgtg gagtgggaga gcaacggcca gcccgagaac
1200
aactacaaga ccaccccccc agtgctggac agcgacggca gcttcttcct gtacagcaag
1260
ctgaccgtgg acaagtccag gtggcagcag ggcaacgtgt tcagctgcag cgtgatgcac
1320
gaggccctgc acaaccacta cacccagaag tccctgagcc tgagccccgg caag
1374
<210> 68
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 68
gacattcaga tgacccagtc cccgtcgtcc ctgtccgcat ccgtgggcga cagagtcacc
60
atcacttgcc gggcctcaca gggaatttcc tccgacctga actggtatca gcagaagcct
120
ggaaaggccc cgaagctgct gatctacgcc gcgtccaact tgcaatcggg agtgccaagc
180
cgcttttctg gttccgggag cgggactgac ttcaccctga ctattagcag cctgcagccc
240
gaagatttcg ctacctacta ctgccaacag tacacagatg aatccatgac cttcggacag
300
ggcaccaaag tcgagatcaa g
321
<210> 69
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 69
gacattcaga tgacccagtc cccgtcgtcc ctgtccgcat ccgtgggcga cagagtcacc
60
atcacttgcc gggcctcaca gggaatttcc tccgacctga actggtatca gcagaagcct
120
ggaaaggccc cgaagctgct gatctacgcc gcgtccaact tgcaatcggg agtgccaagc
180
cgcttttctg gttccgggag cgggactgac ttcaccctga ctattagcag cctgcagccc
240
gaagatttcg ctacctacta ctgccaacag tacacagatg aatccatgac cttcggacag
300
ggcaccaaag tcgagatcaa gcgtacggtg gccgctccca gcgtgttcat cttccccccc
360
agcgacgagc agctgaagag cggcaccgcc agcgtggtgt gcctgctgaa caacttctac
420
ccccgggagg ccaaggtgca gtggaaggtg gacaacgccc tgcagagcgg caacagccag
480
gagagcgtca ccgagcagga cagcaaggac tccacctaca gcctgagcag caccctgacc
540
ctgagcaagg ccgactacga gaagcataag gtgtacgcct gcgaggtgac ccaccagggc
600
ctgtccagcc ccgtgaccaa gagcttcaac aggggcgagt gc
642
<210> 70
<211> 458
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 70
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Ser
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly His Ile Gly Tyr Arg Ser Lys Trp Tyr Asn Glu Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Gly Met Tyr Gly Ser Val Pro Tyr Lys Glu Gly
100 105 110
Tyr Tyr Phe Asp Ile Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
130 135 140
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
145 150 155 160
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
165 170 175
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
180 185 190
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
195 200 205
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
210 215 220
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
225 230 235 240
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
245 250 255
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
260 265 270
Val Val Val Ala Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
275 280 285
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
290 295 300
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
305 310 315 320
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
325 330 335
Lys Ala Leu Ala Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
340 345 350
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
355 360 365
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
370 375 380
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
385 390 395 400
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
405 410 415
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
420 425 430
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
435 440 445
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 71
<211> 1374
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 71
caagtgcaac tccagcagtc aggaccgggg ttggtcaagc cttcgcagac cctgtccctc
60
acttgcgcca ttagcggaga ttcggtgtcg tcgtcgtcag ccgcctggaa ctggattaga
120
cagtcccctt cccgagggct ggagtggctg ggccacatcg gataccgcag caagtggtac
180
aacgaatacg ccgtcagcgt gaagtcacgc atcaccatca acccggatac tagcaagaac
240
cagttcagcc tccagttgaa ctccgtgacc ccggaggata ccgccgtgta ctactgtgcg
300
cggggcatgt acggatccgt gccgtacaag gagggatact acttcgacat ttggggccag
360
gggactcttg tcaccgtgtc ctcggcctcc actaagggcc cgtcagtgtt cccccttgcg
420
ccatcctcga agtcaacctc cggaggaact gccgcactgg gttgcctcgt gaaagactat
480
ttcccggaac ccgtcactgt ctcctggaac tcaggagcgc tcaccagcgg agtgcatacc
540
tttcctgcgg tgctgcagtc cagcggcctg tactccctga gctccgtcgt gaccgtcccc
600
tcgtcgtccc tgggaaccca aacctacatt tgcaacgtca atcacaagcc aagcaacact
660
aaggtggaca agagagtgga gcccaagtcc tgcgataaga cccacacctg tcctccctgt
720
ccggcacctg aactgcttgg tggaccttcc gtgttcctgt tcccgcccaa gccaaaagac
780
accctgatga tctcccgcac tccggaagtc acttgcgtgg tcgtggccgt gtcccacgag
840
gaccccgagg tcaagtttaa ttggtacgtg gacggagtgg aagtgcacaa cgccaagacc
900
aagccgcggg aagaacagta caactccacc taccgcgtgg tgtccgtcct gactgtgctc
960
caccaggact ggctgaacgg aaaggagtac aagtgcaaag tgtccaacaa ggcactggct
1020
gcccctatcg aaaagactat ctccaaggcc aagggccaac ctagggagcc ccaggtgtac
1080
acgttgcctc cttcccgcga agaaatgact aagaaccagg tgtcgctgac ctgtctcgtg
1140
aaagggttct acccctctga catcgccgtg gaatgggagt caaacggaca gcctgagaac
1200
aactataaga ccacaccacc tgtcctggac tccgacggct ccttcttcct gtactcaaag
1260
ttgaccgtgg acaagtcgcg gtggcaacag ggcaacgtgt tctcttgctc cgtgatgcac
1320
gaagccctgc acaaccacta cacccaaaag tcgctcagcc tctcccccgg aaag
1374
<210> 72
<211> 458
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 72
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Ser
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly His Ile Gly Tyr Arg Ser Lys Trp Tyr Asn Glu Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Gly Met Tyr Gly Ser Val Pro Tyr Lys Glu Gly
100 105 110
Tyr Tyr Phe Asp Ile Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
130 135 140
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
145 150 155 160
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
165 170 175
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
180 185 190
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
195 200 205
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
210 215 220
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
225 230 235 240
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
245 250 255
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
260 265 270
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
275 280 285
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
290 295 300
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
305 310 315 320
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
325 330 335
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
340 345 350
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
355 360 365
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
370 375 380
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
385 390 395 400
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
405 410 415
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
420 425 430
Val Phe Ser Cys Ser Val Leu His Glu Ala Leu His Ser His Tyr Thr
435 440 445
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 73
<211> 1374
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 73
caagtgcaac tccagcagtc aggaccgggg ttggtcaagc cttcgcagac cctgtccctc
60
acttgcgcca ttagcggaga ttcggtgtcg tcgtcgtcag ccgcctggaa ctggattaga
120
cagtcccctt cccgagggct ggagtggctg ggccacatcg gataccgcag caagtggtac
180
aacgaatacg ccgtcagcgt gaagtcacgc atcaccatca acccggatac tagcaagaac
240
cagttcagcc tccagttgaa ctccgtgacc ccggaggata ccgccgtgta ctactgtgcg
300
cggggcatgt acggatccgt gccgtacaag gagggatact acttcgacat ttggggccag
360
gggactcttg tcaccgtgtc ctcggcctcc actaagggcc cgtcagtgtt cccccttgcg
420
ccatcctcga agtcaacctc cggaggaact gccgcactgg gttgcctcgt gaaagactat
480
ttcccggaac ccgtcactgt ctcctggaac tcaggagcgc tcaccagcgg agtgcatacc
540
tttcctgcgg tgctgcagtc cagcggcctg tactccctga gctccgtcgt gaccgtcccc
600
tcgtcgtccc tgggaaccca aacctacatt tgcaacgtca atcacaagcc aagcaacact
660
aaggtggaca agagagtgga gcccaagtcc tgcgataaga cccacacctg tcctccctgt
720
ccggcacctg aactgcttgg tggaccttcc gtgttcctgt tcccgcccaa gccaaaagac
780
accctgatga tctcccgcac tccggaagtc acttgcgtgg tcgtggacgt gtcccacgag
840
gaccccgagg tcaagtttaa ttggtacgtg gacggagtgg aagtgcacaa cgccaagacc
900
aagccgcggg aagaacagta caactccacc taccgcgtgg tgtccgtcct gactgtgctc
960
caccaggact ggctgaacgg aaaggagtac aagtgcaaag tgtccaacaa ggcactgcca
1020
gcccctatcg aaaagactat ctccaaggcc aagggccaac ctagggagcc ccaggtgtac
1080
acgttgcctc cttcccgcga agaaatgact aagaaccagg tgtcgctgac ctgtctcgtg
1140
aaagggttct acccctctga catcgccgtg gaatgggagt caaacggaca gcctgagaac
1200
aactataaga ccacaccacc tgtcctggac tccgacggct ccttcttcct gtactcaaag
1260
ttgaccgtgg acaagtcgcg gtggcaacag ggcaacgtgt tctcttgctc cgtgctgcac
1320
gaagccctgc acagccacta cacccaaaag tcgctcagcc tctcccccgg aaag
1374
<210> 74
<211> 458
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 74
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Ser
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly His Ile Gly Tyr Arg Ser Lys Trp Tyr Asn Glu Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Gly Met Tyr Gly Ser Val Pro Tyr Lys Glu Gly
100 105 110
Tyr Tyr Phe Asp Ile Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
130 135 140
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
145 150 155 160
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
165 170 175
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
180 185 190
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
195 200 205
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
210 215 220
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
225 230 235 240
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
245 250 255
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
260 265 270
Val Val Val Ala Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
275 280 285
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
290 295 300
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
305 310 315 320
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
325 330 335
Lys Ala Leu Ala Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
340 345 350
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
355 360 365
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
370 375 380
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
385 390 395 400
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
405 410 415
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
420 425 430
Val Phe Ser Cys Ser Val Leu His Glu Ala Leu His Ser His Tyr Thr
435 440 445
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 75
<211> 1374
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 75
caagtgcaac tccagcagtc aggaccgggg ttggtcaagc cttcgcagac cctgtccctc
60
acttgcgcca ttagcggaga ttcggtgtcg tcgtcgtcag ccgcctggaa ctggattaga
120
cagtcccctt cccgagggct ggagtggctg ggccacatcg gataccgcag caagtggtac
180
aacgaatacg ccgtcagcgt gaagtcacgc atcaccatca acccggatac tagcaagaac
240
cagttcagcc tccagttgaa ctccgtgacc ccggaggata ccgccgtgta ctactgtgcg
300
cggggcatgt acggatccgt gccgtacaag gagggatact acttcgacat ttggggccag
360
gggactcttg tcaccgtgtc ctcggcctcc actaagggcc cgtcagtgtt cccccttgcg
420
ccatcctcga agtcaacctc cggaggaact gccgcactgg gttgcctcgt gaaagactat
480
ttcccggaac ccgtcactgt ctcctggaac tcaggagcgc tcaccagcgg agtgcatacc
540
tttcctgcgg tgctgcagtc cagcggcctg tactccctga gctccgtcgt gaccgtcccc
600
tcgtcgtccc tgggaaccca aacctacatt tgcaacgtca atcacaagcc aagcaacact
660
aaggtggaca agagagtgga gcccaagtcc tgcgataaga cccacacctg tcctccctgt
720
ccggcacctg aactgcttgg tggaccttcc gtgttcctgt tcccgcccaa gccaaaagac
780
accctgatga tctcccgcac tccggaagtc acttgcgtgg tcgtggccgt gtcccacgag
840
gaccccgagg tcaagtttaa ttggtacgtg gacggagtgg aagtgcacaa cgccaagacc
900
aagccgcggg aagaacagta caactccacc taccgcgtgg tgtccgtcct gactgtgctc
960
caccaggact ggctgaacgg aaaggagtac aagtgcaaag tgtccaacaa ggcactggct
1020
gcccctatcg aaaagactat ctccaaggcc aagggccaac ctagggagcc ccaggtgtac
1080
acgttgcctc cttcccgcga agaaatgact aagaaccagg tgtcgctgac ctgtctcgtg
1140
aaagggttct acccctctga catcgccgtg gaatgggagt caaacggaca gcctgagaac
1200
aactataaga ccacaccacc tgtcctggac tccgacggct ccttcttcct gtactcaaag
1260
ttgaccgtgg acaagtcgcg gtggcaacag ggcaacgtgt tctcttgctc cgtgctgcac
1320
gaagccctgc acagccacta cacccaaaag tcgctcagcc tctcccccgg aaag
1374
<210> 76
<211> 458
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 76
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Ser
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly His Ile Gly Tyr Arg Ser Lys Trp Tyr Asn Glu Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Gly Met Tyr Gly Ser Val Pro Tyr Lys Glu Gly
100 105 110
Tyr Tyr Phe Asp Ile Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
130 135 140
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
145 150 155 160
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
165 170 175
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
180 185 190
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
195 200 205
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
210 215 220
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
225 230 235 240
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
245 250 255
Lys Pro Lys Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val Thr Cys
260 265 270
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
275 280 285
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
290 295 300
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
305 310 315 320
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
325 330 335
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
340 345 350
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
355 360 365
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
370 375 380
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
385 390 395 400
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
405 410 415
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
420 425 430
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
435 440 445
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 77
<211> 1374
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 77
caagtgcaac tccagcagtc aggaccgggg ttggtcaagc cttcgcagac cctgtccctc
60
acttgcgcca ttagcggaga ttcggtgtcg tcgtcgtcag ccgcctggaa ctggattaga
120
cagtcccctt cccgagggct ggagtggctg ggccacatcg gataccgcag caagtggtac
180
aacgaatacg ccgtcagcgt gaagtcacgc atcaccatca acccggatac tagcaagaac
240
cagttcagcc tccagttgaa ctccgtgacc ccggaggata ccgccgtgta ctactgtgcg
300
cggggcatgt acggatccgt gccgtacaag gagggatact acttcgacat ttggggccag
360
gggactcttg tcaccgtgtc ctcggcctcc actaagggcc cgtcagtgtt cccccttgcg
420
ccatcctcga agtcaacctc cggaggaact gccgcactgg gttgcctcgt gaaagactat
480
ttcccggaac ccgtcactgt ctcctggaac tcaggagcgc tcaccagcgg agtgcatacc
540
tttcctgcgg tgctgcagtc cagcggcctg tactccctga gctccgtcgt gaccgtcccc
600
tcgtcgtccc tgggaaccca aacctacatt tgcaacgtca atcacaagcc aagcaacact
660
aaggtggaca agagagtgga gcccaagtcc tgcgataaga cccacacctg tcctccctgt
720
ccggcacctg aactgcttgg tggaccttcc gtgttcctgt tcccgcccaa gccaaaagac
780
accctgtata tcactcgcga accggaagtc acttgcgtgg tcgtggacgt gtcccacgag
840
gaccccgagg tcaagtttaa ttggtacgtg gacggagtgg aagtgcacaa cgccaagacc
900
aagccgcggg aagaacagta caactccacc taccgcgtgg tgtccgtcct gactgtgctc
960
caccaggact ggctgaacgg aaaggagtac aagtgcaaag tgtccaacaa ggcactgcca
1020
gcccctatcg aaaagactat ctccaaggcc aagggccaac ctagggagcc ccaggtgtac
1080
acgttgcctc cttcccgcga agaaatgact aagaaccagg tgtcgctgac ctgtctcgtg
1140
aaagggttct acccctctga catcgccgtg gaatgggagt caaacggaca gcctgagaac
1200
aactataaga ccacaccacc tgtcctggac tccgacggct ccttcttcct gtactcaaag
1260
ttgaccgtgg acaagtcgcg gtggcaacag ggcaacgtgt tctcttgctc cgtgatgcac
1320
gaagccctgc acaaccacta cacccaaaag tcgctcagcc tctcccccgg aaag
1374
<210> 78
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 78
Gln Gln His Gly His Ser Pro Thr Thr
1 5
<210> 79
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 79
His Gly His Ser Pro Thr
1 5
<210> 80
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 80
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Gly His Ser Pro Thr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 81
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 81
gatatccaga tgacccagag cccgagcagc ctgagcgcca gcgtgggcga tcgcgtgacc
60
attacctgca gagccagcca ggacatttct aactacctgg cttggtacca gcagaaaccg
120
ggcaaagcgc cgaaactatt aatctaccgt gcttcttctc tgcaaagcgg cgtgccgagc
180
cgctttagcg gcagcggatc cggcaccgat ttcaccctga ccattagctc tctgcaaccg
240
gaagactttg cgacctatta ttgccagcag catggtcatt ctccgactac ctttggccag
300
ggcacgaaag ttgaaattaa a
321
<210> 82
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 82
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Gly His Ser Pro Thr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 83
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 83
gatatccaga tgacccagag cccgagcagc ctgagcgcca gcgtgggcga tcgcgtgacc
60
attacctgca gagccagcca ggacatttct aactacctgg cttggtacca gcagaaaccg
120
ggcaaagcgc cgaaactatt aatctaccgt gcttcttctc tgcaaagcgg cgtgccgagc
180
cgctttagcg gcagcggatc cggcaccgat ttcaccctga ccattagctc tctgcaaccg
240
gaagactttg cgacctatta ttgccagcag catggtcatt ctccgactac ctttggccag
300
ggcacgaaag ttgaaattaa acgtacggtg gccgctccca gcgtgttcat cttccccccc
360
agcgacgagc agctgaagag cggcaccgcc agcgtggtgt gcctgctgaa caacttctac
420
ccccgggagg ccaaggtgca gtggaaggtg gacaacgccc tgcagagcgg caacagccag
480
gaaagcgtca ccgagcagga cagcaaggac tccacctaca gcctgagcag caccctgacc
540
ctgagcaagg ccgactacga gaagcacaag gtgtacgcct gcgaggtgac ccaccagggc
600
ctgtccagcc ccgtgaccaa gagcttcaac cggggcgagt gt
642
<210> 84
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 84
Gly Phe Ser Leu Ser Thr Ser Gly Val Gly Val Ser
1 5 10
<210> 85
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 85
Leu Ile Phe Ser Asp His Asp Lys Ile Tyr Ser Thr Ser Leu Lys Thr
1 5 10 15
<210> 86
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 86
Thr Leu Ile Asp Arg Ser Val Tyr Phe Asp Tyr
1 5 10
<210> 87
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 87
Thr Ser Gly Val Gly Val Ser
1 5
<210> 88
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 88
Gly Phe Ser Leu Ser Thr Ser Gly Val
1 5
<210> 89
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 89
Phe Ser Asp His Asp
1 5
<210> 90
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 90
Gly Phe Ser Leu Ser Thr Ser Gly Val Gly
1 5 10
<210> 91
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 91
Ile Phe Ser Asp His Asp Lys
1 5
<210> 92
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 92
Ala Arg Thr Leu Ile Asp Arg Ser Val Tyr Phe Asp Tyr
1 5 10
<210> 93
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 93
Gln Val Gln Leu Lys Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Val Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Leu Ile Phe Ser Asp His Asp Lys Ile Tyr Ser Thr Ser
50 55 60
Leu Lys Thr Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Thr Leu Ile Asp Arg Ser Val Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 94
<211> 363
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 94
caggtgcaat tgaaagaaag cggtccggcg ctggtgaaac cgacccagac cctgaccctg
60
acgtgcacct tttccggatt cagcctgtct acttccggtg ttggtgtgag ctggattcgc
120
cagccgccgg gcaaagcgct cgagtggctg gcgctgatct tctctgacca tgacaagatc
180
tatagcacca gcctgaaaac ccgtctgacc attagcaaag atacttcgaa aaaccaggtg
240
gtgctgacca tgaccaacat ggacccggtg gataccgcga cctattattg cgcgcgtact
300
ctgatcgacc gttctgttta cttcgattac tggggccaag gcaccctggt gactgttagc
360
tca
363
<210> 95
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 95
Gln Val Gln Leu Lys Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Val Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Leu Ile Phe Ser Asp His Asp Lys Ile Tyr Ser Thr Ser
50 55 60
Leu Lys Thr Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Thr Leu Ile Asp Arg Ser Val Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 96
<211> 1353
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 96
caggtgcaat tgaaagaaag cggtccggcg ctggtgaaac cgacccagac cctgaccctg
60
acgtgcacct tttccggatt cagcctgtct acttccggtg ttggtgtgag ctggattcgc
120
cagccgccgg gcaaagcgct cgagtggctg gcgctgatct tctctgacca tgacaagatc
180
tatagcacca gcctgaaaac ccgtctgacc attagcaaag atacttcgaa aaaccaggtg
240
gtgctgacca tgaccaacat ggacccggtg gataccgcga cctattattg cgcgcgtact
300
ctgatcgacc gttctgttta cttcgattac tggggccaag gcaccctggt gactgttagc
360
tcagcctcca ccaagggtcc atcggtcttc cccctggcac cctcctccaa gagcacctct
420
gggggcacag cggccctggg ctgcctggtc aaggactact tccccgaacc ggtgacggtg
480
tcgtggaact caggcgccct gaccagcggc gtgcacacct tcccggctgt cctacagtcc
540
tcaggactct actccctcag cagcgtggtg accgtgccct ccagcagctt gggcacccag
600
acctacatct gcaacgtgaa tcacaagccc agcaacacca aggtggacaa gagagttgag
660
cccaaatctt gtgacaaaac tcacacatgc ccaccgtgcc cagcacctga agcagcgggg
720
ggaccgtcag tcttcctctt ccccccaaaa cccaaggaca ccctcatgat ctcccggacc
780
cctgaggtca catgcgtggt ggtggacgtg agccacgaag accctgaggt caagttcaac
840
tggtacgtgg acggcgtgga ggtgcataat gccaagacaa agccgcggga ggagcagtac
900
aacagcacgt accgggtggt cagcgtcctc accgtcctgc accaggactg gctgaatggc
960
aaggagtaca agtgcaaggt ctccaacaaa gccctcccag cccccatcga gaaaaccatc
1020
tccaaagcca aagggcagcc ccgagaacca caggtgtaca ccctgccccc atcccgggag
1080
gagatgacca agaaccaggt cagcctgacc tgcctggtca aaggcttcta tcccagcgac
1140
atcgccgtgg agtgggagag caatgggcag ccggagaaca actacaagac cacgcctccc
1200
gtgctggact ccgacggctc cttcttcctc tacagcaagc tcaccgtgga caagagcagg
1260
tggcagcagg ggaacgtctt ctcatgctcc gtgatgcatg aggctctgca caaccactac
1320
acgcagaaga gcctctccct gtctccgggt aaa
1353
<210> 97
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 97
Ser Gly Ser Ser Ser Asn Ile Gly His His Tyr Val Ser
1 5 10
<210> 98
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 98
Asp Asn Thr Asn Arg Pro Ser
1 5
<210> 99
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 99
Ala Thr Trp Asp Gly Leu Met Asn Ser Ile Val
1 5 10
<210> 100
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 100
Ser Ser Ser Asn Ile Gly His His Tyr
1 5
<210> 101
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 101
Asp Asn Thr
1
<210> 102
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 102
Trp Asp Gly Leu Met Asn Ser Ile
1 5
<210> 103
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 103
Ser Ser Asn Ile Gly His His Tyr
1 5
<210> 104
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 104
Asp Ile Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly His His
20 25 30
Tyr Val Ser Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Asp Asn Thr Asn Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Thr Trp Asp Gly Leu Met
85 90 95
Asn Ser Ile Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 105
<211> 330
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 105
gatatcgtgc tgacccagcc gccgagcgtg agcggtgcac cgggccagcg cgtgaccatt
60
agctgtagcg gcagcagcag caacattggt catcattacg tgtcttggta ccagcagctg
120
ccgggcacgg cgccgaaact gctgatctac gacaacacta accgcccgag cggcgtgccg
180
gatcgcttta gcggatccaa aagcggcacc agcgccagcc tggcgattac cggcctgcaa
240
gcagaagacg aagcggatta ttactgcgct acttgggacg gtctgatgaa ctctatcgtg
300
tttggcggcg gcacgaagtt aaccgtccta
330
<210> 106
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 106
Asp Ile Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly His His
20 25 30
Tyr Val Ser Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Asp Asn Thr Asn Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Thr Trp Asp Gly Leu Met
85 90 95
Asn Ser Ile Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105 110
Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu
115 120 125
Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr
130 135 140
Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys
145 150 155 160
Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr
165 170 175
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
180 185 190
Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
195 200 205
Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 107
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 107
gatatcgtgc tgacccagcc gccgagcgtg agcggtgcac cgggccagcg cgtgaccatt
60
agctgtagcg gcagcagcag caacattggt catcattacg tgtcttggta ccagcagctg
120
ccgggcacgg cgccgaaact gctgatctac gacaacacta accgcccgag cggcgtgccg
180
gatcgcttta gcggatccaa aagcggcacc agcgccagcc tggcgattac cggcctgcaa
240
gcagaagacg aagcggatta ttactgcgct acttgggacg gtctgatgaa ctctatcgtg
300
tttggcggcg gcacgaagtt aaccgtccta ggtcagccca aggctgcccc ctcggtcact
360
ctgttcccgc cctcctctga ggagcttcaa gccaacaagg ccacactggt gtgtctcata
420
agtgacttct acccgggagc cgtgacagtg gcctggaagg cagatagcag ccccgtcaag
480
gcgggagtgg agaccaccac accctccaaa caaagcaaca acaagtacgc ggccagcagc
540
tatctgagcc tgacgcctga gcagtggaag tcccacagaa gctacagctg ccaggtcacg
600
catgaaggga gcaccgtgga gaagacagtg gcccctacag aatgttca
648
<210> 108
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 108
Gly Phe Thr Phe Ser Ser Tyr Ala Met Asp
1 5 10
<210> 109
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 109
Arg Ile Lys Ser Lys Ala Asp Ser Tyr Thr Ala Asp Tyr Ala Ala Pro
1 5 10 15
Val Lys Gly
<210> 110
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 110
Ser His Tyr Ser Ala Phe Ala Tyr
1 5
<210> 111
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 111
Ser Tyr Ala Met Asp
1 5
<210> 112
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 112
Gly Phe Thr Phe Ser Ser Tyr
1 5
<210> 113
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 113
Lys Ser Lys Ala Asp Ser Tyr Thr
1 5
<210> 114
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 114
Gly Phe Thr Phe Ser Ser Tyr Ala
1 5
<210> 115
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 115
Ile Lys Ser Lys Ala Asp Ser Tyr Thr Ala
1 5 10
<210> 116
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 116
Ala Arg Ser His Tyr Ser Ala Phe Ala Tyr
1 5 10
<210> 117
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 117
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Ala Asp Ser Tyr Thr Ala Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Ser His Tyr Ser Ala Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 118
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 118
gaggtgcaat tggtggaaag cggcggtggc ctggtgaaac caggcggcag cctgcgcctg
60
agctgcgccg cctccggatt caccttttct tcttacgcta tggactgggt gcgccaggcc
120
ccgggcaaag gtctcgagtg ggtgggccgt atcaaatcta aagctgactc ttacactgct
180
gactatgccg ccccagtgaa aggccgcttt accattagcc gcgatgattc gaaaaacacc
240
ctgtatctgc aaatgaacag cctgaaaacc gaagatacgg ccgtgtatta ttgcgcgcgt
300
tctcattact ctgctttcgc ttactggggc caaggcaccc tggtgactgt tagctca
357
<210> 119
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 119
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Ala Asp Ser Tyr Thr Ala Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Ser His Tyr Ser Ala Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 120
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 120
gaggtgcaat tggtggaaag cggcggtggc ctggtgaaac caggcggcag cctgcgcctg
60
agctgcgccg cctccggatt caccttttct tcttacgcta tggactgggt gcgccaggcc
120
ccgggcaaag gtctcgagtg ggtgggccgt atcaaatcta aagctgactc ttacactgct
180
gactatgccg ccccagtgaa aggccgcttt accattagcc gcgatgattc gaaaaacacc
240
ctgtatctgc aaatgaacag cctgaaaacc gaagatacgg ccgtgtatta ttgcgcgcgt
300
tctcattact ctgctttcgc ttactggggc caaggcaccc tggtgactgt tagctcagcc
360
tccaccaagg gtccatcggt cttccccctg gcaccctcct ccaagagcac ctctgggggc
420
acagcggccc tgggctgcct ggtcaaggac tacttccccg aaccggtgac ggtgtcgtgg
480
aactcaggcg ccctgaccag cggcgtgcac accttcccgg ctgtcctaca gtcctcagga
540
ctctactccc tcagcagcgt ggtgaccgtg ccctccagca gcttgggcac ccagacctac
600
atctgcaacg tgaatcacaa gcccagcaac accaaggtgg acaagagagt tgagcccaaa
660
tcttgtgaca aaactcacac atgcccaccg tgcccagcac ctgaagcagc ggggggaccg
720
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag
780
gtcacatgcg tggtggtgga cgtgagccac gaagaccctg aggtcaagtt caactggtac
840
gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gtacaacagc
900
acgtaccggg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa tggcaaggag
960
tacaagtgca aggtctccaa caaagccctc ccagccccca tcgagaaaac catctccaaa
1020
gccaaagggc agccccgaga accacaggtg tacaccctgc ccccatcccg ggaggagatg
1080
accaagaacc aggtcagcct gacctgcctg gtcaaaggct tctatcccag cgacatcgcc
1140
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg
1200
gactccgacg gctccttctt cctctacagc aagctcaccg tggacaagag caggtggcag
1260
caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacgcag
1320
aagagcctct ccctgtctcc gggtaaa
1347
<210> 121
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 121
Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn Ser Val Asn
1 5 10
<210> 122
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 122
Arg Asn Ser Asn Arg Pro Ser
1 5
<210> 123
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 123
Ser Ala Phe Asp Glu Ser Thr Lys Gly Val Val
1 5 10
<210> 124
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 124
Ser Ser Ser Asn Ile Gly Ser Asn Ser
1 5
<210> 125
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 125
Arg Asn Ser
1
<210> 126
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 126
Phe Asp Glu Ser Thr Lys Gly Val
1 5
<210> 127
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 127
Ser Ser Asn Ile Gly Ser Asn Ser
1 5
<210> 128
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 128
Asp Ile Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Ser Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Arg Asn Ser Asn Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ala Phe Asp Glu Ser Thr
85 90 95
Lys Gly Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 129
<211> 330
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 129
gatatcgtgc tgacccagcc gccgagcgtg agcggtgcac cgggccagcg cgtgaccatt
60
agctgtagcg gcagcagcag caacattggt tctaactctg tgaactggta ccagcagctg
120
ccgggcacgg cgccgaaact gctgatctac cgtaactcta accgcccgag cggcgtgccg
180
gatcgcttta gcggatccaa aagcggcacc agcgccagcc tggcgattac cggcctgcaa
240
gcagaagacg aagcggatta ttactgctct gctttcgacg aatctactaa aggtgttgtg
300
tttggcggcg gcacgaagtt aaccgtccta
330
<210> 130
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 130
Asp Ile Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Ser Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Arg Asn Ser Asn Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ala Phe Asp Glu Ser Thr
85 90 95
Lys Gly Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105 110
Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu
115 120 125
Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr
130 135 140
Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys
145 150 155 160
Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr
165 170 175
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
180 185 190
Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
195 200 205
Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 131
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 131
gatatcgtgc tgacccagcc gccgagcgtg agcggtgcac cgggccagcg cgtgaccatt
60
agctgtagcg gcagcagcag caacattggt tctaactctg tgaactggta ccagcagctg
120
ccgggcacgg cgccgaaact gctgatctac cgtaactcta accgcccgag cggcgtgccg
180
gatcgcttta gcggatccaa aagcggcacc agcgccagcc tggcgattac cggcctgcaa
240
gcagaagacg aagcggatta ttactgctct gctttcgacg aatctactaa aggtgttgtg
300
tttggcggcg gcacgaagtt aaccgtccta ggtcagccca aggctgcccc ctcggtcact
360
ctgttcccgc cctcctctga ggagcttcaa gccaacaagg ccacactggt gtgtctcata
420
agtgacttct acccgggagc cgtgacagtg gcctggaagg cagatagcag ccccgtcaag
480
gcgggagtgg agaccaccac accctccaaa caaagcaaca acaagtacgc ggccagcagc
540
tatctgagcc tgacgcctga gcagtggaag tcccacagaa gctacagctg ccaggtcacg
600
catgaaggga gcaccgtgga gaagacagtg gcccctacag aatgttca
648
<210> 132
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 132
Ala His Val Glu His Ser Ile Ser Arg Ser
1 5 10
<210> 133
<211> 1076
<212> ДНК
<213> Homo sapiens
<400> 133
gggcagcgcc tgacatgcct gatcctctct tttctgcagt tcaagggaaa gacgagatct
60
tgcacaaggc actctgcttc tgcccttggc tggggaaggg tggcatggag cctctccggc
120
tgctcatctt actctttgtc acagagctgt ccggagccca caacaccaca gtgttccagg
180
gcgtggcggg ccagtccctg caggtgtctt gcccctatga ctccatgaag cactggggga
240
ggcgcaaggc ctggtgccgc cagctgggag agaagggccc atgccagcgt gtggtcagca
300
cgcacaactt gtggctgctg tccttcctga ggaggtggaa tgggagcaca gccatcacag
360
acgataccct gggtggcact ctcaccatta cgctgcggaa tctacaaccc catgatgcgg
420
gtctctacca gtgccagagc ctccatggca gtgaggctga caccctcagg aaggtcctgg
480
tggaggtgct ggcagacccc ctggatcacc gggatgctgg agatctctgg ttccccgggg
540
agtctgagag cttcgaggat gcccatgtgg agcacagcat ctccaggagc ctcttggaag
600
gagaaatccc cttcccaccc acttccatcc ttctcctcct ggcctgcatc tttctcatca
660
agattctagc agccagcgcc ctctgggctg cagcctggca tggacagaag ccagggacac
720
atccacccag tgaactggac tgtggccatg acccagggta tcagctccaa actctgccag
780
ggctgagaga cacgtgaagg aagatgatgg gaggaaaagc ccaggagaag tcccaccagg
840
gaccagccca gcctgcatac ttgccacttg gccaccagga ctccttgttc tgctctggca
900
agagactact ctgcctgaac actgcttctc ctggaccctg gaagcaggga ctggttgagg
960
gagtggggag gtggtaagaa cacctgacaa cttctgaata ttggacattt taaacactta
1020
caaataaatc caagactgtc atatttagct ggataaaaaa aaaaaaaaaa aaaaaa
1076
<210> 134
<211> 280
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 134
cgttacataa cttacggtaa atggcccgcc tggctgaccg cccaacgacc cccgcccatt
60
gacgtcaata atgacgtatg ttcccatagt aacgccaata gggactttcc attgacgtca
120
atgggtggag tatttacggt aaactgccca cttggcagta catcaagtgt atcatatgcc
180
aagtacgccc cctattgacg tcaatgacgg taaatggccc gcctggcatt atgcccagta
240
catgacctta tgggactttc ctacttggca gtacatctac
280
<210> 135
<211> 266
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 135
ccacgttctg cttcactctc cccatctccc ccccctcccc acccccaatt ttgtatttat
60
ttatttttta attattttgt gcagcgatgg gggcgggggg gggggggggg cgcgcgccag
120
gcggggcggg gcggggcgag gggcggggcg gggcgaggcg gagaggtgcg gcggcagcca
180
atcagagcgg cgcgctccga aagtttcctt ttatggcgag gcggcggcgg cggcggccct
240
ataaaaagcg aagcgcgcgg cgggcg
266
<210> 136
<211> 552
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 136
cgttacataa cttacggtaa atggcccgcc tggctgaccg cccaacgacc cccgcccatt
60
gacgtcaata atgacgtatg ttcccatagt aacgccaata gggactttcc attgacgtca
120
atgggtggag tatttacggt aaactgccca cttggcagta catcaagtgt atcatatgcc
180
aagtacgccc cctattgacg tcaatgacgg taaatggccc gcctggcatt atgcccagta
240
catgacctta tgggactttc ctacttggca gtacatctac tcgaggccac gttctgcttc
300
actctcccca tctccccccc ctccccaccc ccaattttgt atttatttat tttttaatta
360
ttttgtgcag cgatgggggc gggggggggg ggggggcgcg cgccaggcgg ggcggggcgg
420
ggcgaggggc ggggcggggc gaggcggaga ggtgcggcgg cagccaatca gagcggcgcg
480
ctccgaaagt ttccttttat ggcgaggcgg cggcggcggc ggccctataa aaagcgaagc
540
gcgcggcggg cg
552
<210> 137
<211> 97
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 137
gtaagtttag tctttttgtc ttttatttca ggtcccggat ccggtggtgg tgcaaatcaa
60
agaactgctc ctcagtggat gttgccttta cttctag
97
<210> 138
<211> 232
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 138
ctagagctcg ctgatcagcc tcgactgtgc cttctagttg ccagccatct gttgtttgcc
60
cctcccccgt gccttccttg accctggaag gtgccactcc cactgtcctt tcctaataaa
120
atgaggaaat tgcatcgcat tgtctgagta ggtgtcattc tattctgggg ggtggggtgg
180
ggcaggacag caagggggag gattgggaag acaatagcag gcatgctggg ga
232
<210> 139
<211> 162
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Остатки hTREM2 19-174 плюс гистидиновая метка
<400> 139
His Asn Thr Thr Val Phe Gln Gly Val Ala Gly Gln Ser Leu Gln Val
1 5 10 15
Ser Cys Pro Tyr Asp Ser Met Lys His Trp Gly Arg Arg Lys Ala Trp
20 25 30
Cys Arg Gln Leu Gly Glu Lys Gly Pro Cys Gln Arg Val Val Ser Thr
35 40 45
His Asn Leu Trp Leu Leu Ser Phe Leu Arg Arg Trp Asn Gly Ser Thr
50 55 60
Ala Ile Thr Asp Asp Thr Leu Gly Gly Thr Leu Thr Ile Thr Leu Arg
65 70 75 80
Asn Leu Gln Pro His Asp Ala Gly Leu Tyr Gln Cys Gln Ser Leu His
85 90 95
Gly Ser Glu Ala Asp Thr Leu Arg Lys Val Leu Val Glu Val Leu Ala
100 105 110
Asp Pro Leu Asp His Arg Asp Ala Gly Asp Leu Trp Phe Pro Gly Glu
115 120 125
Ser Glu Ser Phe Glu Asp Ala His Val Glu His Ser Ile Ser Arg Ser
130 135 140
Leu Leu Glu Gly Glu Ile Pro Phe Pro Pro Thr Ser His His His His
145 150 155 160
His His
<210> 140
<211> 215
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 140
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Phe Gln Tyr Arg His Met Pro Ser
85 90 95
Gln Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Asp Ala
100 105 110
Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser
115 120 125
Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp
130 135 140
Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val
145 150 155 160
Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met
165 170 175
Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser
180 185 190
Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys
195 200 205
Ser Phe Asn Arg Asn Glu Cys
210 215
<210> 141
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 141
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
His Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Val Ser Gly Asn Thr Val Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ile Pro Ser Tyr Thr Tyr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Lys Thr Thr Ala Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Val Cys Gly Asp Thr Thr Gly Ser Ser Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Leu Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Thr Ser Ser
180 185 190
Thr Trp Pro Ser Gln Ser Ile Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Glu Pro Arg Gly Pro Thr Ile Lys
210 215 220
Pro Cys Pro Pro Cys Lys Cys Pro Ala Pro Asn Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Ile Phe Pro Pro Lys Ile Lys Asp Val Leu Met Ile Ser
245 250 255
Leu Ser Pro Ile Val Thr Cys Val Val Val Ala Val Ser Glu Asp Asp
260 265 270
Pro Asp Val Gln Ile Ser Trp Phe Val Asn Asn Val Glu Val His Thr
275 280 285
Ala Gln Thr Gln Thr His Arg Glu Asp Tyr Asn Ser Thr Leu Arg Val
290 295 300
Val Ser Ala Leu Pro Ile Gln His Gln Asp Trp Met Ser Gly Lys Glu
305 310 315 320
Phe Lys Cys Lys Val Asn Asn Lys Asp Leu Ala Ala Pro Ile Glu Arg
325 330 335
Thr Ile Ser Lys Pro Lys Gly Ser Val Arg Ala Pro Gln Val Tyr Val
340 345 350
Leu Pro Pro Pro Glu Glu Glu Met Thr Lys Lys Gln Val Thr Leu Thr
355 360 365
Cys Met Val Thr Asp Phe Met Pro Glu Asp Ile Tyr Val Glu Trp Thr
370 375 380
Asn Asn Gly Lys Thr Glu Leu Asn Tyr Lys Asn Thr Glu Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Tyr Phe Met Tyr Ser Lys Leu Arg Val Glu Lys
405 410 415
Lys Asn Trp Val Glu Arg Asn Ser Tyr Ser Cys Ser Val Val His Glu
420 425 430
Gly Leu His Asn His His Thr Thr Lys Ser Phe Ser Arg Thr Pro Gly
435 440 445
Lys
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАРИАНТЫ TREM2, УСТОЙЧИВЫЕ К ДЕЙСТВИЮ ШЕДДАЗЫ | 2018 |
|
RU2790661C2 |
| АНТИТЕЛА К ENTPD2, ВИДЫ КОМБИНИРОВАННОЙ ТЕРАПИИ И СПОСОБЫ ПРИМЕНЕНИЯ АНТИТЕЛ И ВИДОВ КОМБИНИРОВАННОЙ ТЕРАПИИ | 2019 |
|
RU2790991C2 |
| РЕКОМБИНАНТНЫЕ ВИРУСНЫЕ ВЕКТОРЫ С МОДИФИЦИРОВАННЫМ ТРОПИЗМОМ И ПУТИ ИХ ПРИМЕНЕНИЯ ДЛЯ НАЦЕЛЕННОГО ВВЕДЕНИЯ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА В КЛЕТКИ ЧЕЛОВЕКА | 2018 |
|
RU2809246C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ИНТЕРНАЛИЗАЦИИ ФЕРМЕНТОВ | 2018 |
|
RU2806021C2 |
| ПРОКОАГУЛЯНТНЫЕ АНТИТЕЛА | 2018 |
|
RU2810094C2 |
| ИММУНОЦИТОКИНЫ И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2818371C1 |
| АНТИ-PCSK9 АНТИТЕЛО, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2016 |
|
RU2739208C2 |
| ТЕРАПЕВТИЧЕСКИЕ АНТИТЕЛА ПРОТИВ ЛИГАНДА CD40 | 2018 |
|
RU2770209C2 |
| АНТИТЕЛО К B7-H4, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2792748C2 |
| АНТИТЕЛА, НАПРАВЛЕННЫЕ ПРОТИВ ЛЕЙКОТОКСИНОВ STAPHYLOCOCCUS AUREUS | 2019 |
|
RU2805969C2 |
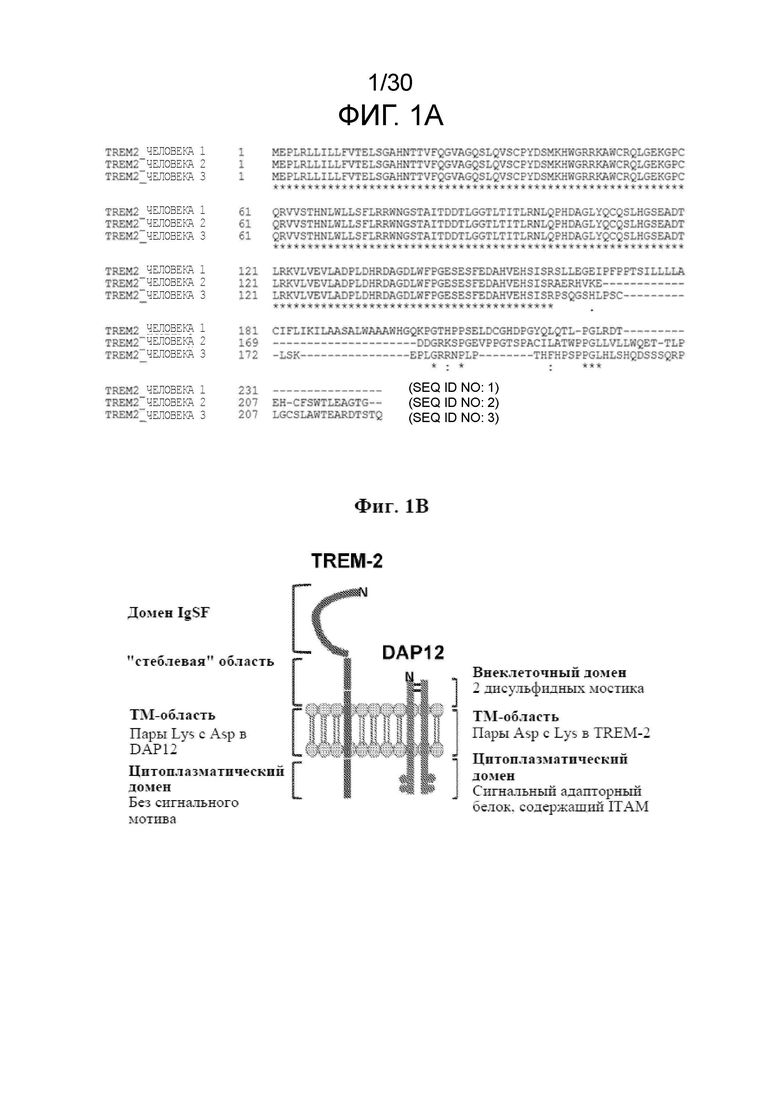
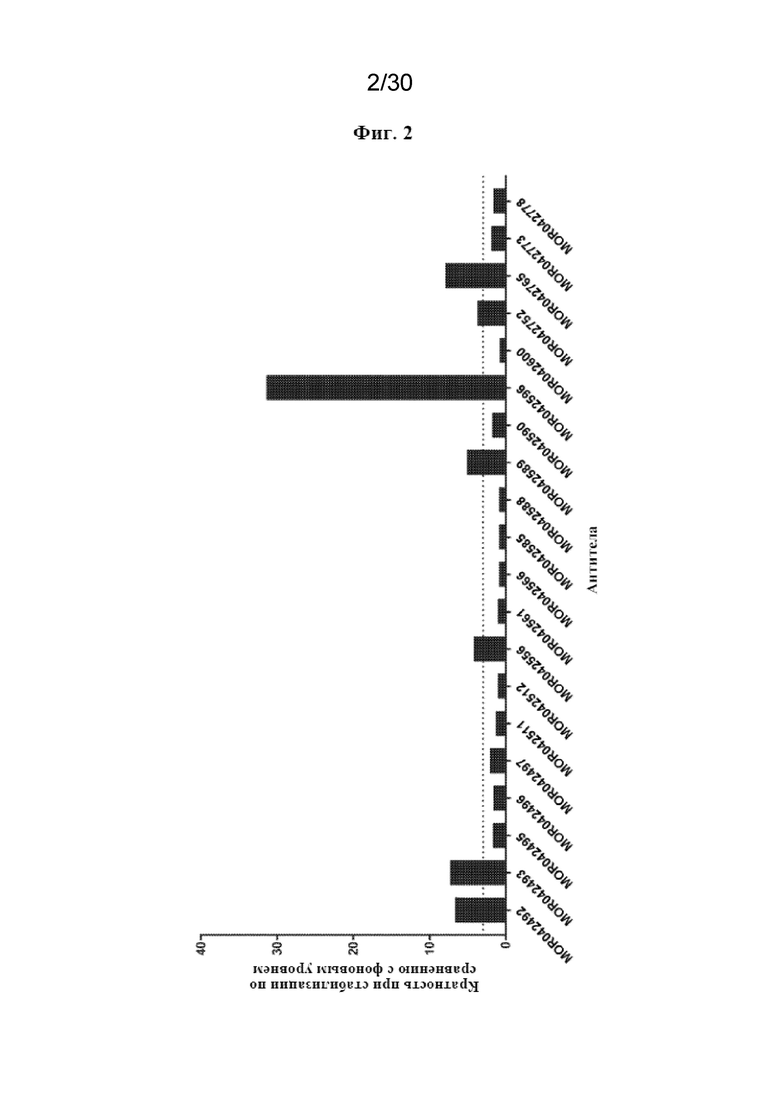
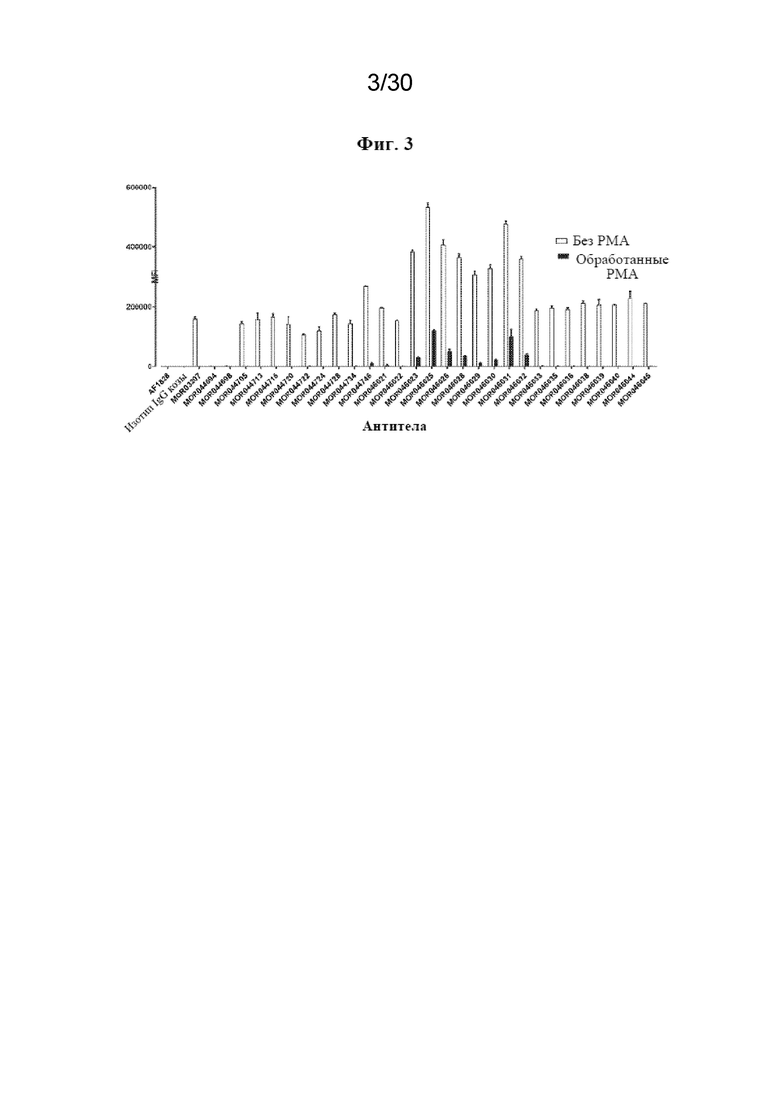

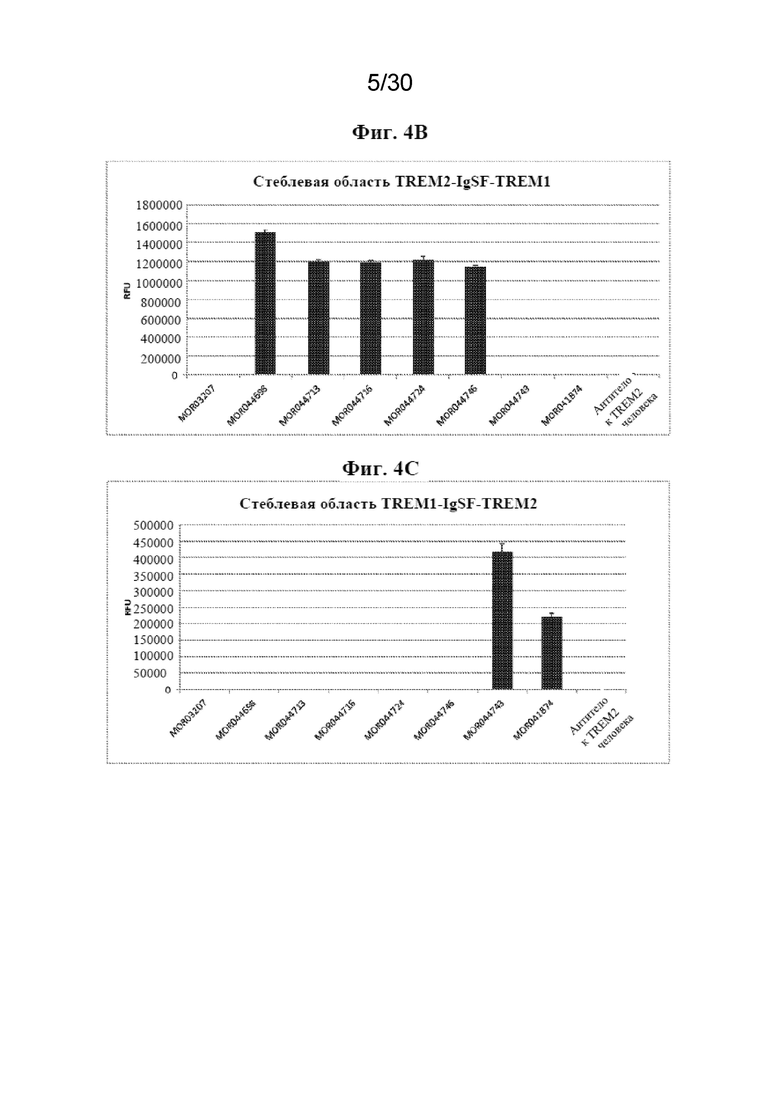
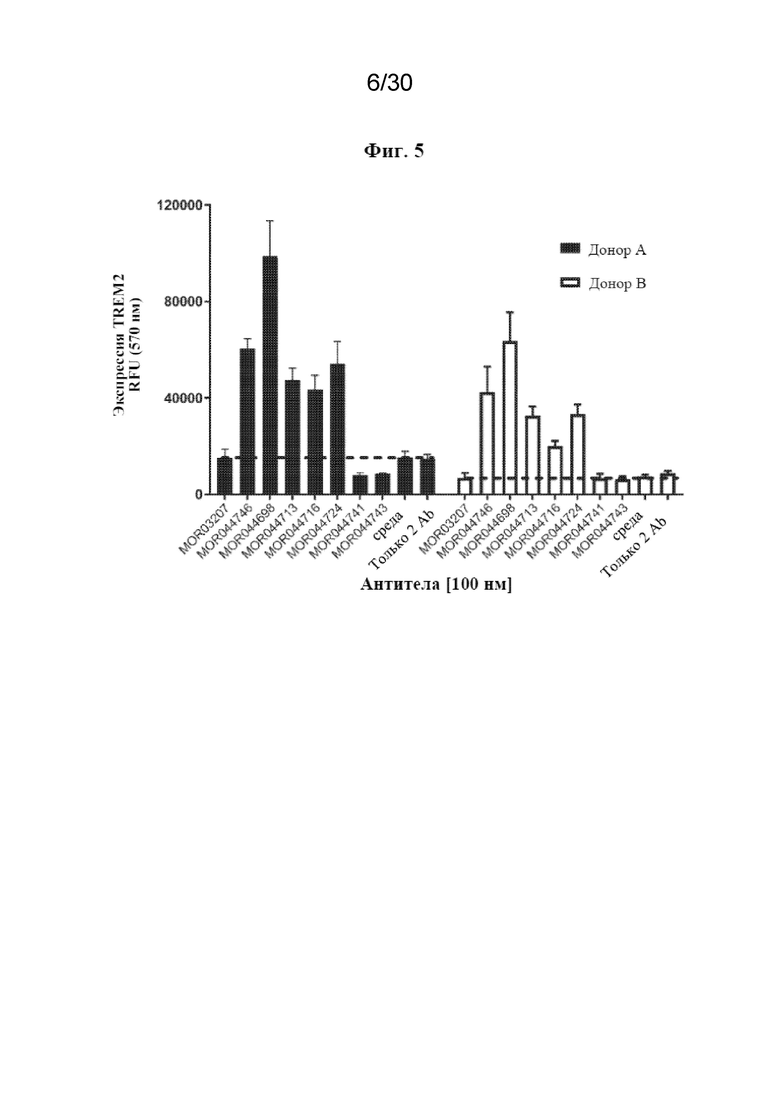
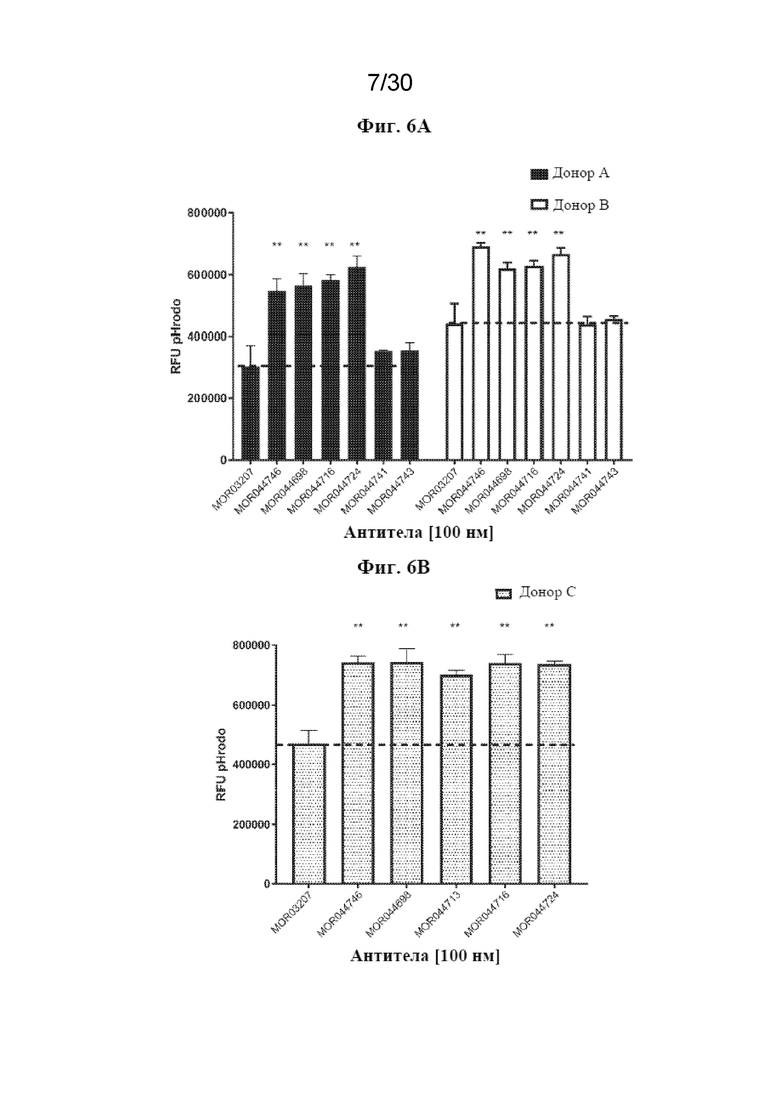
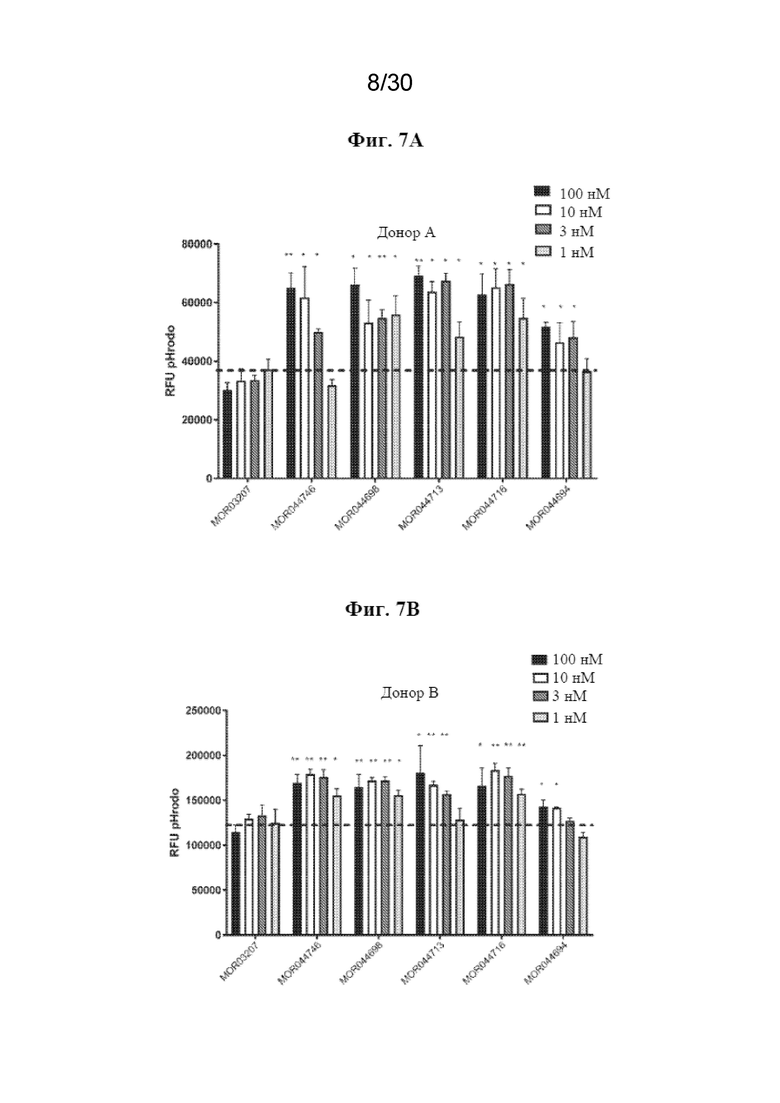
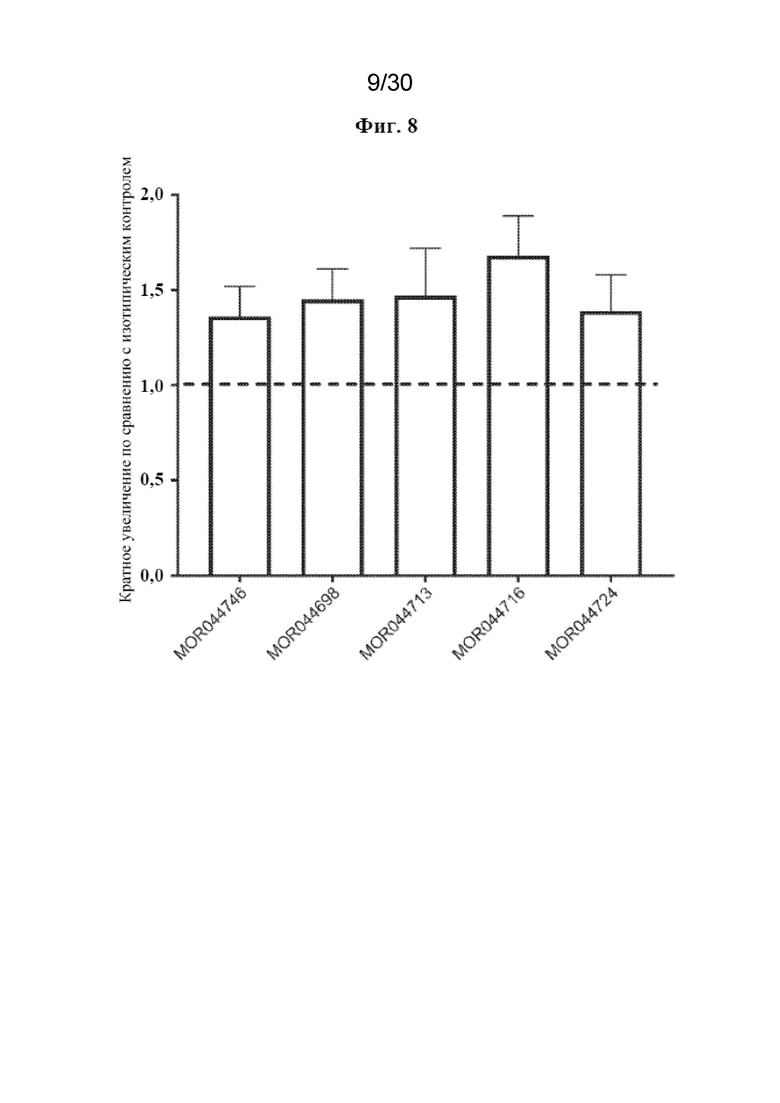
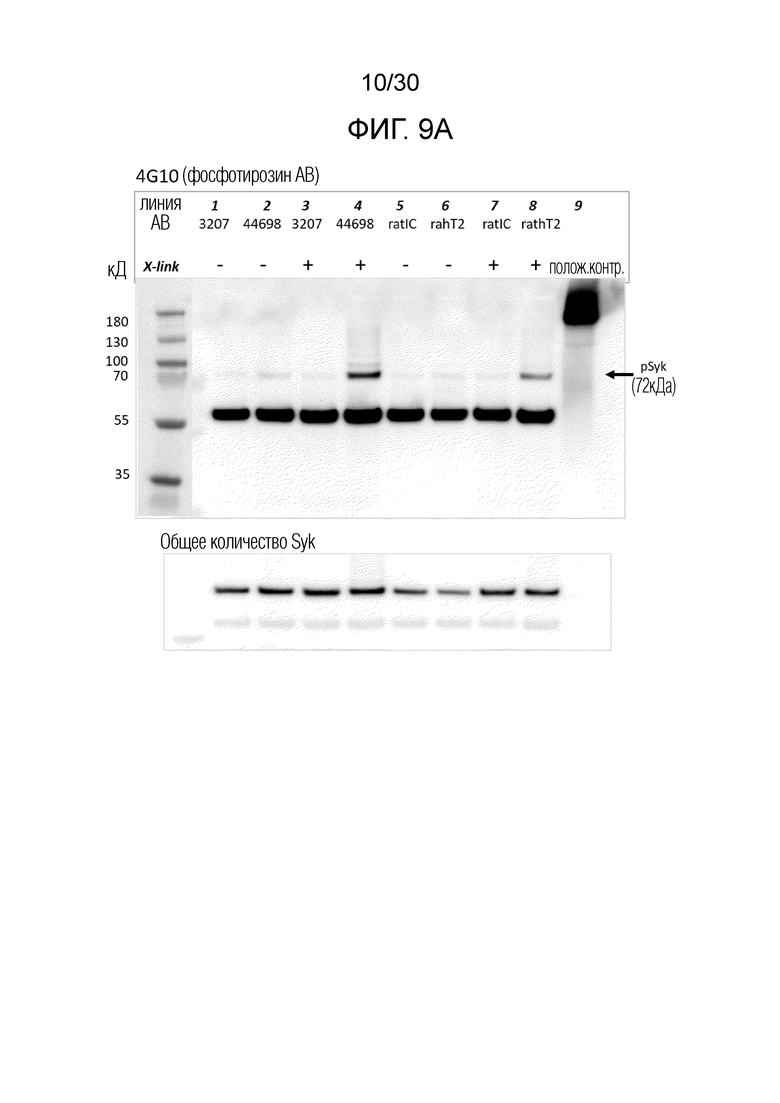
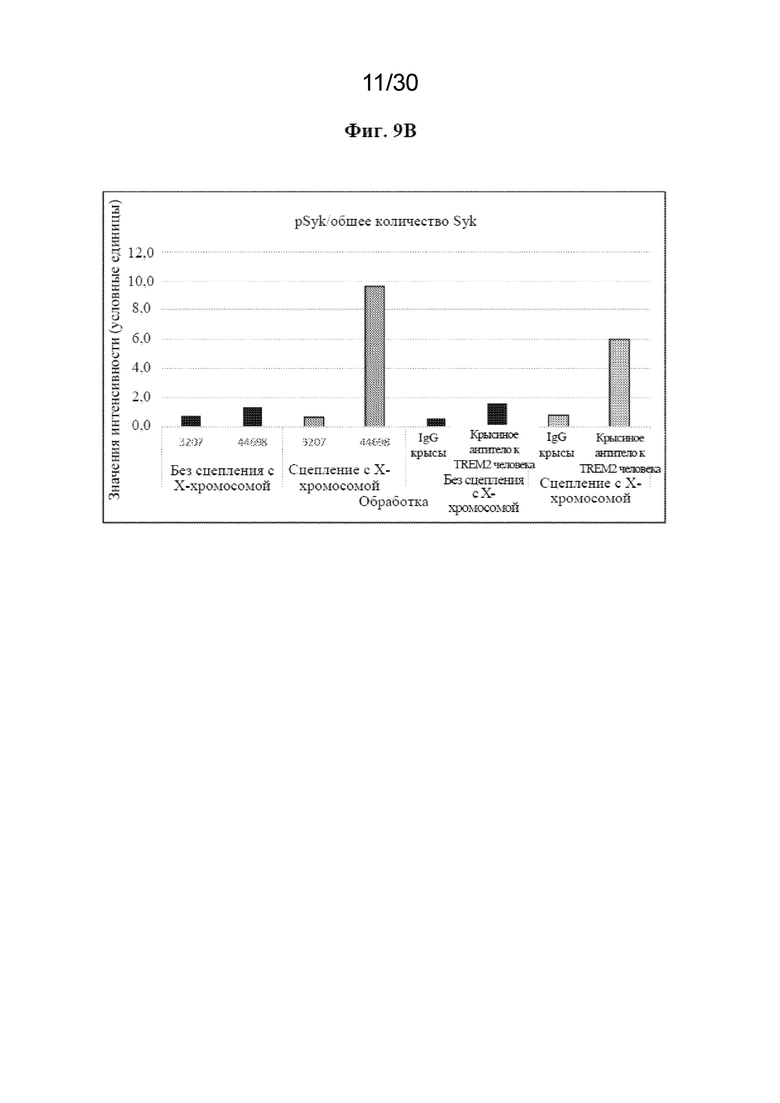
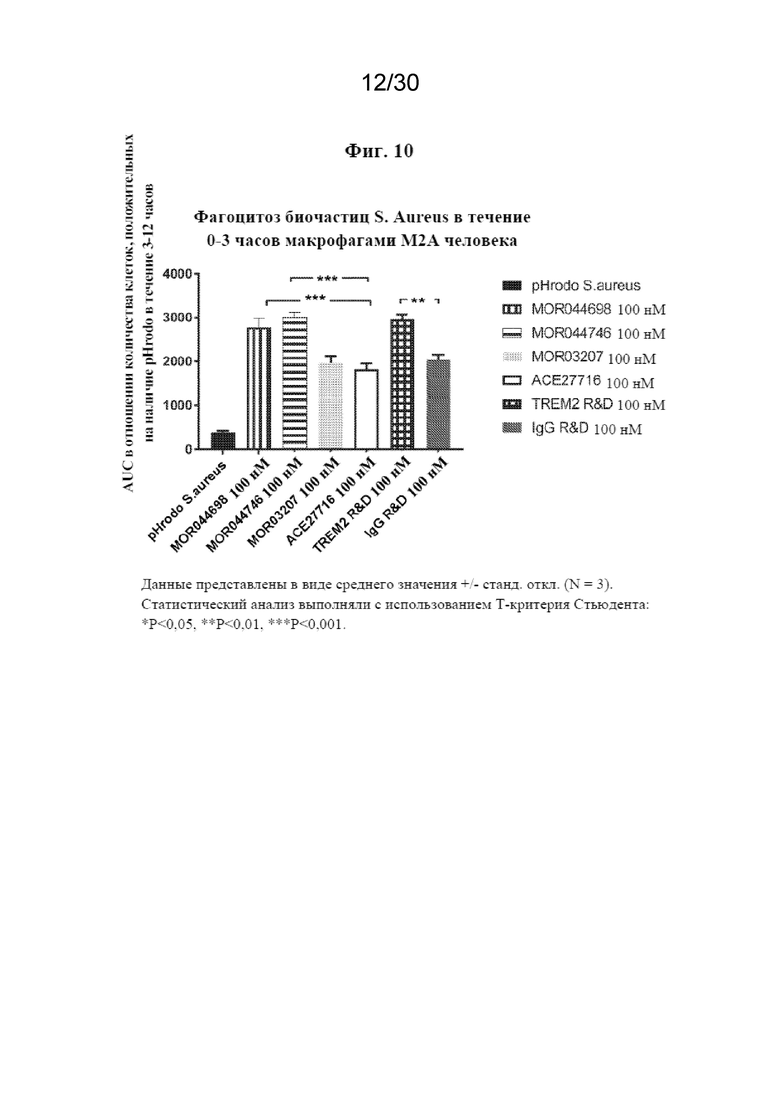
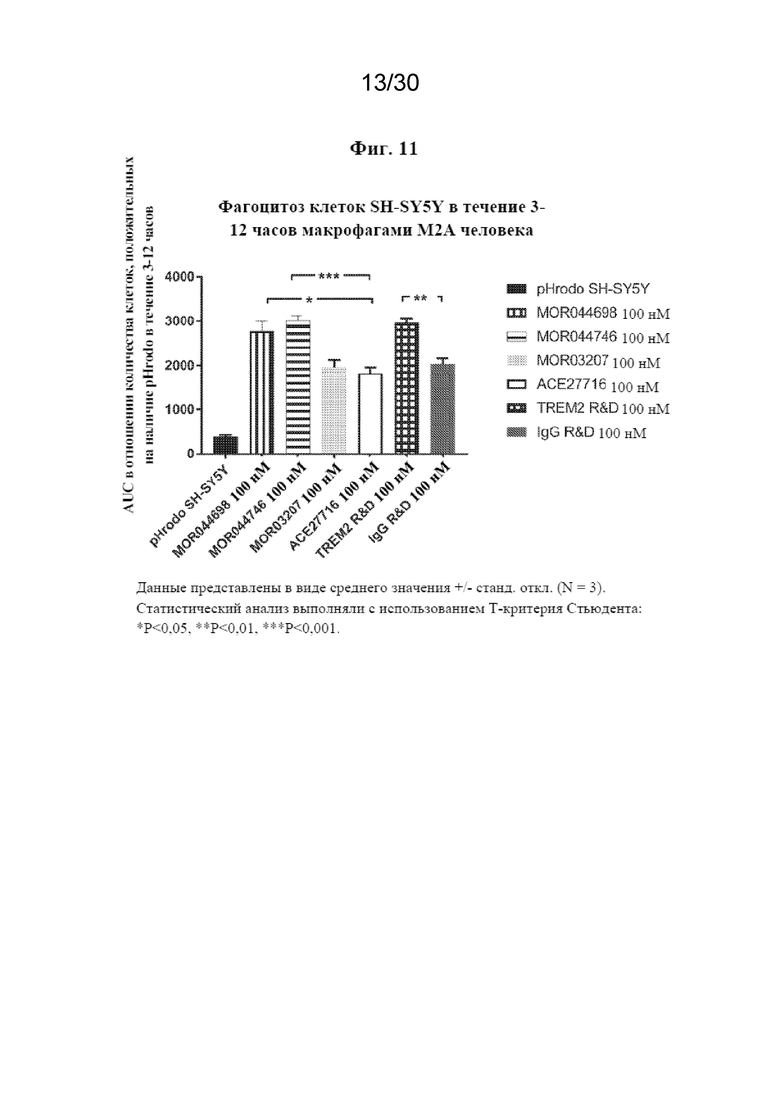
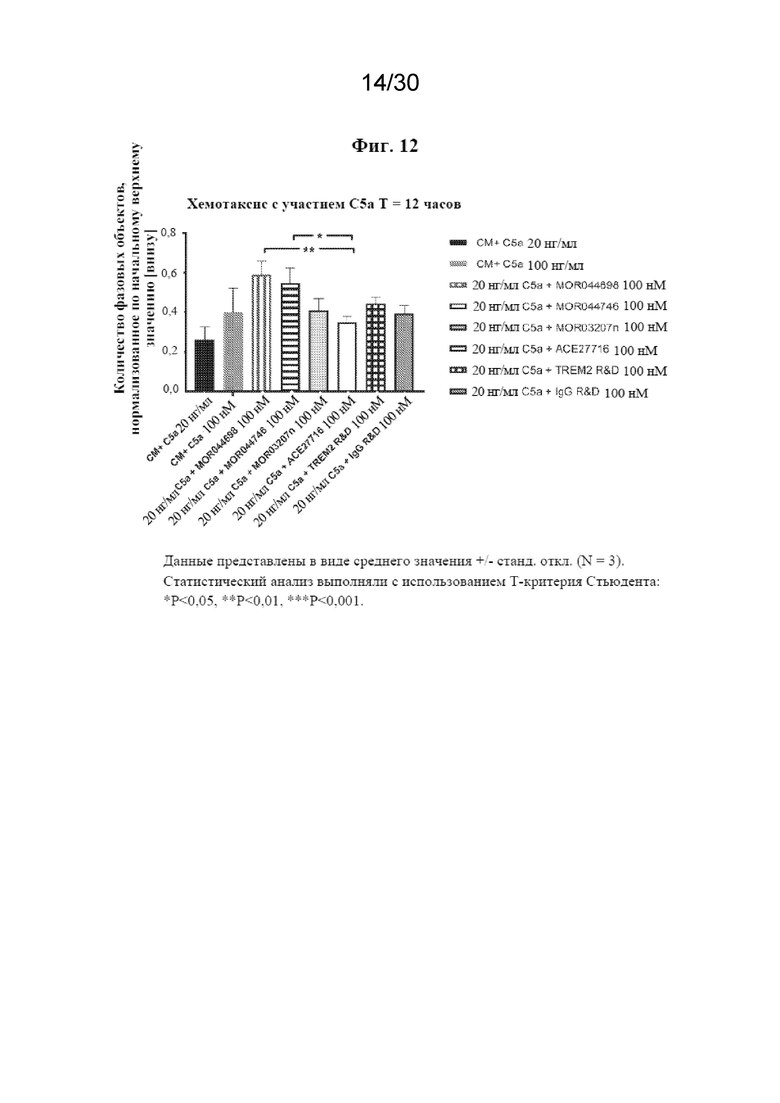
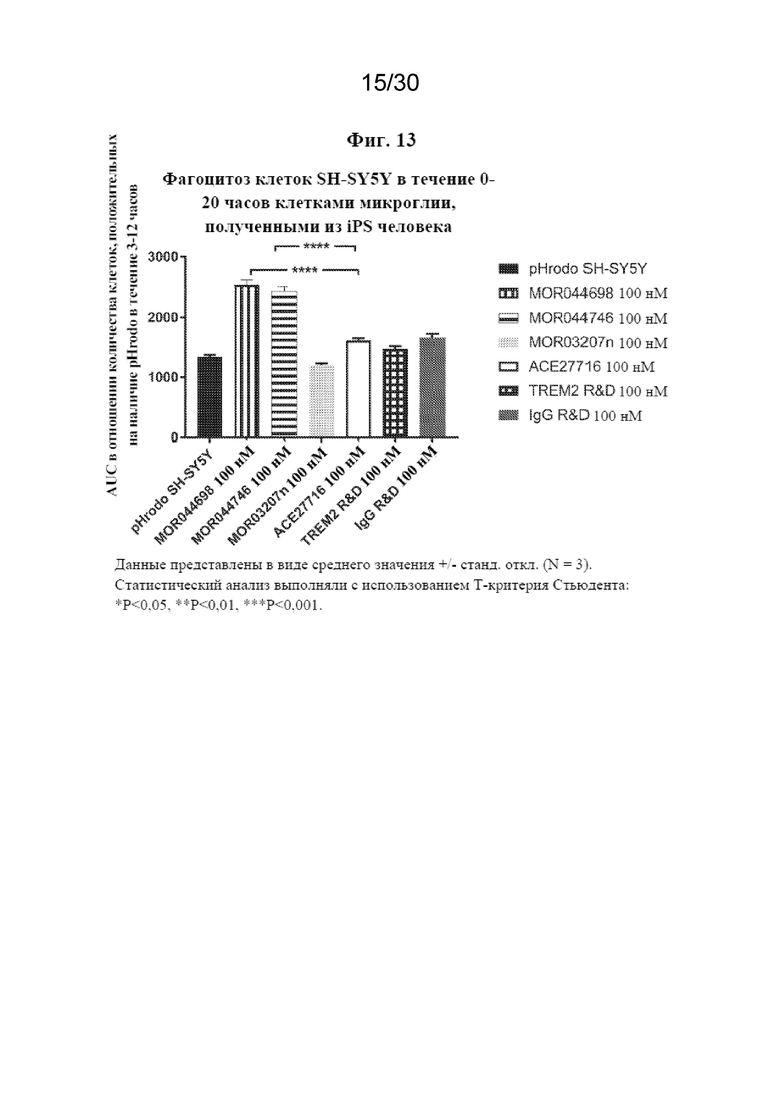
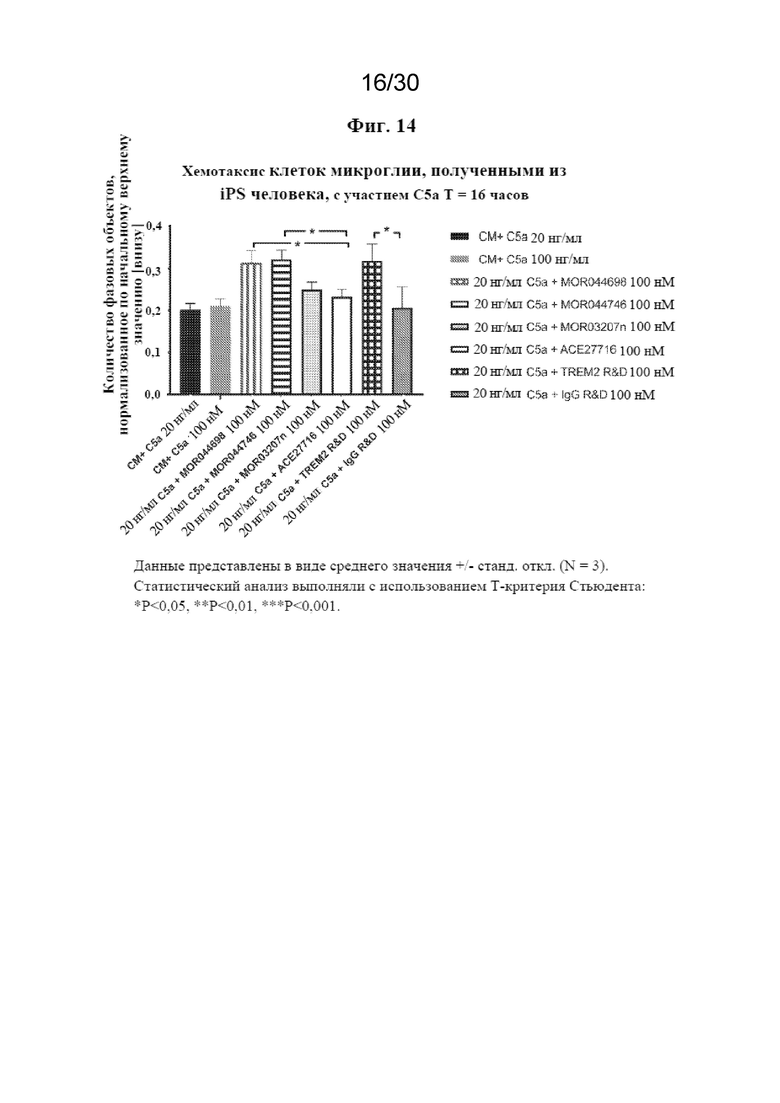
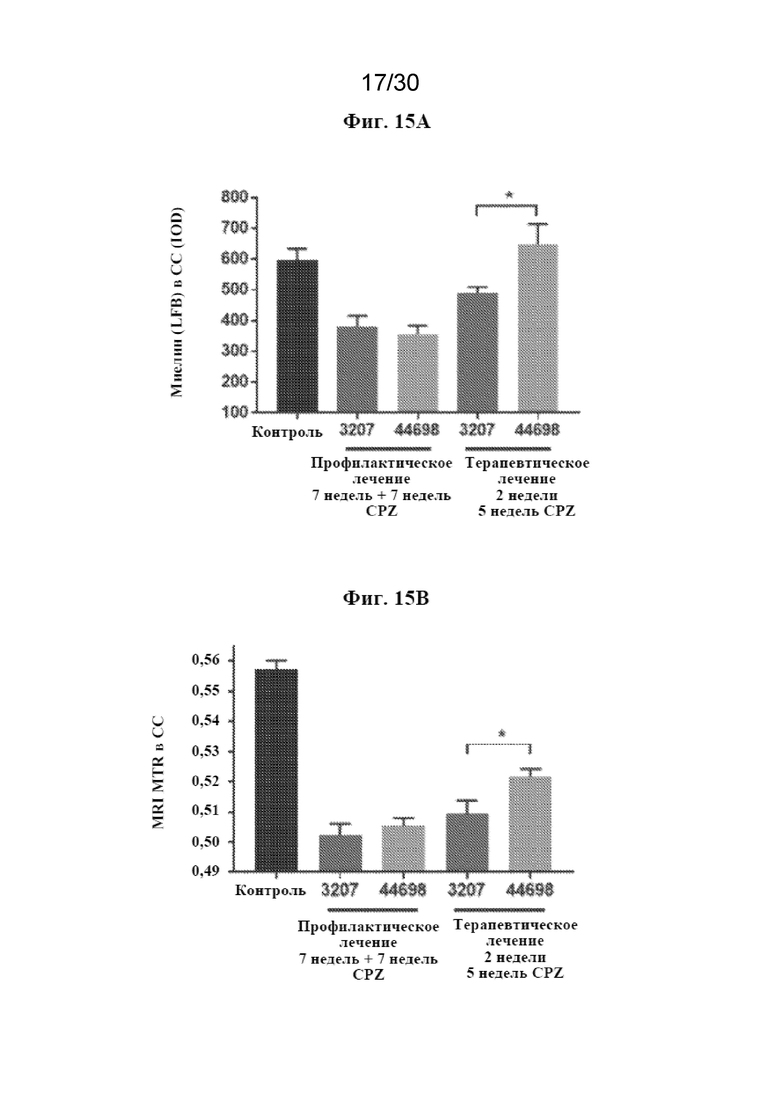
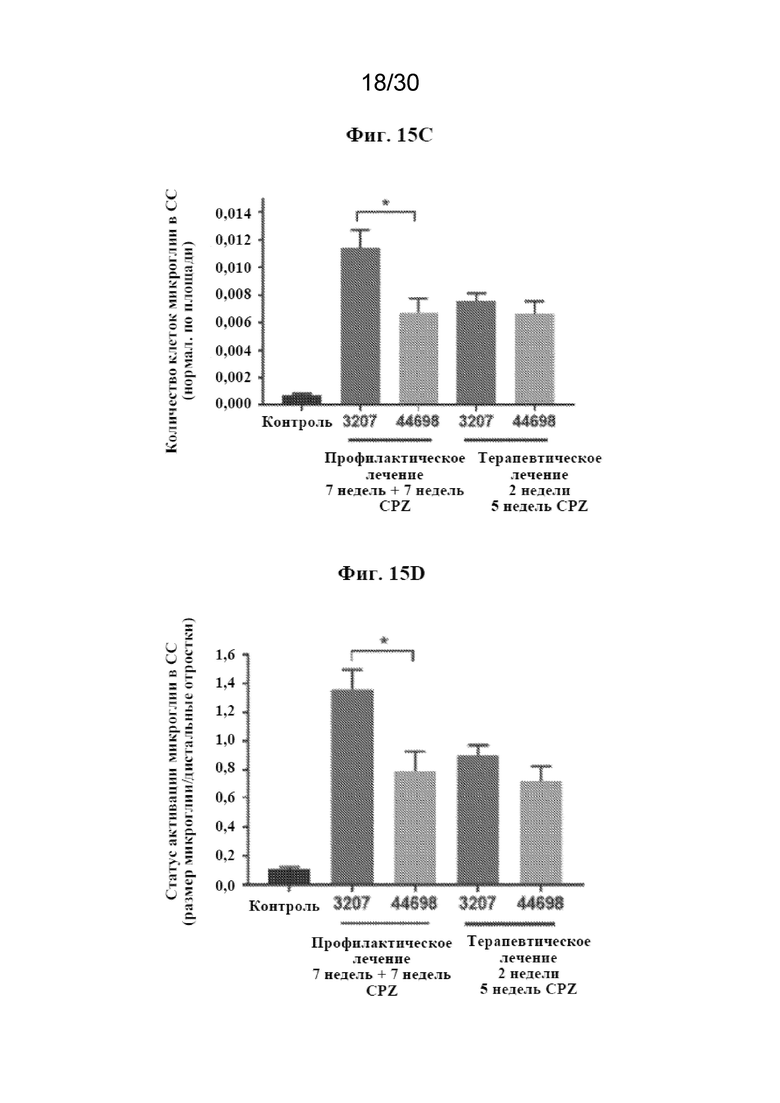
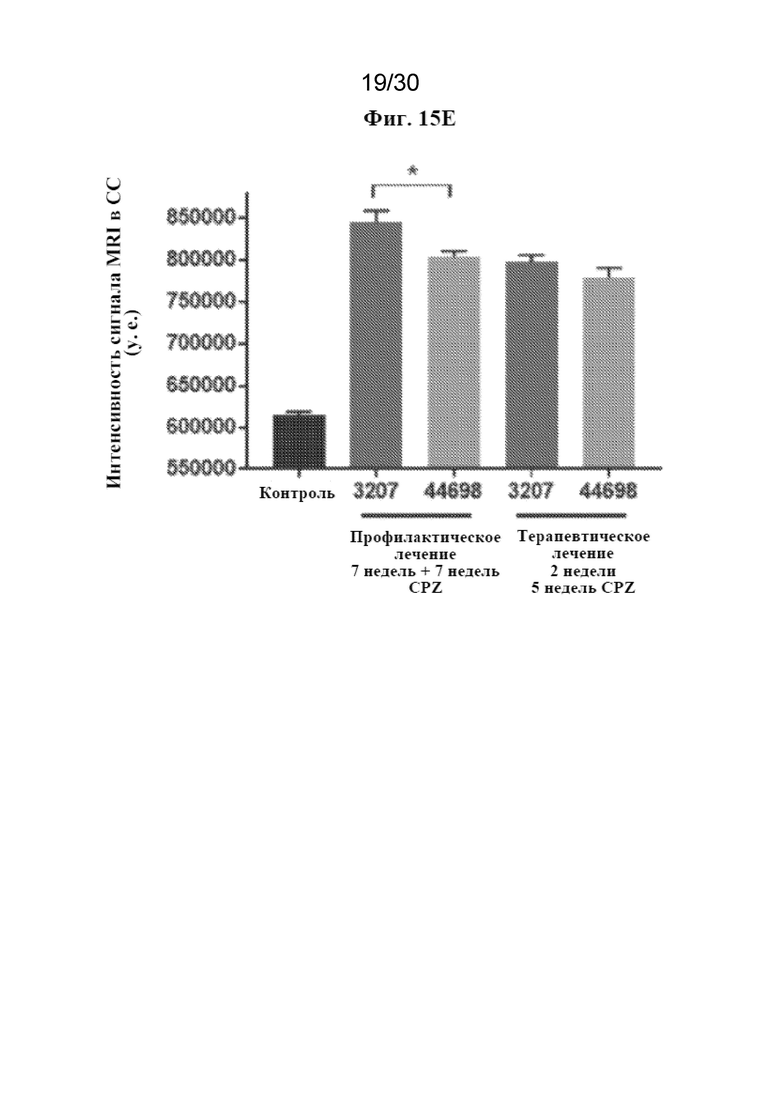
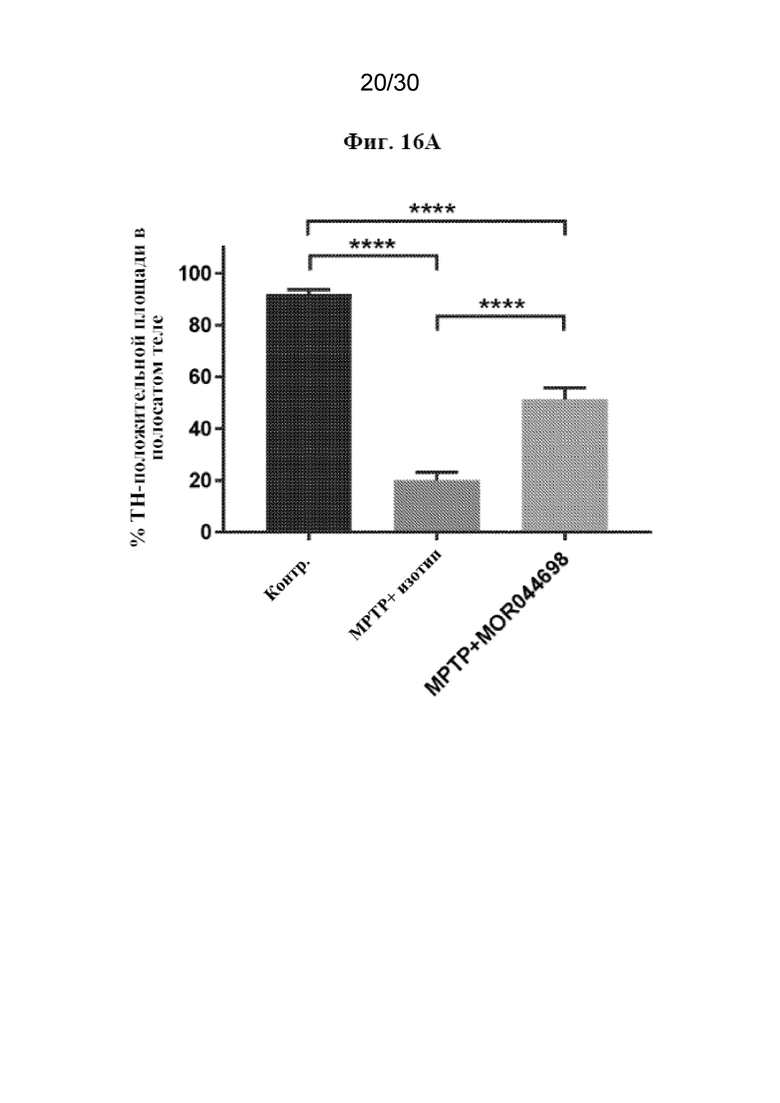
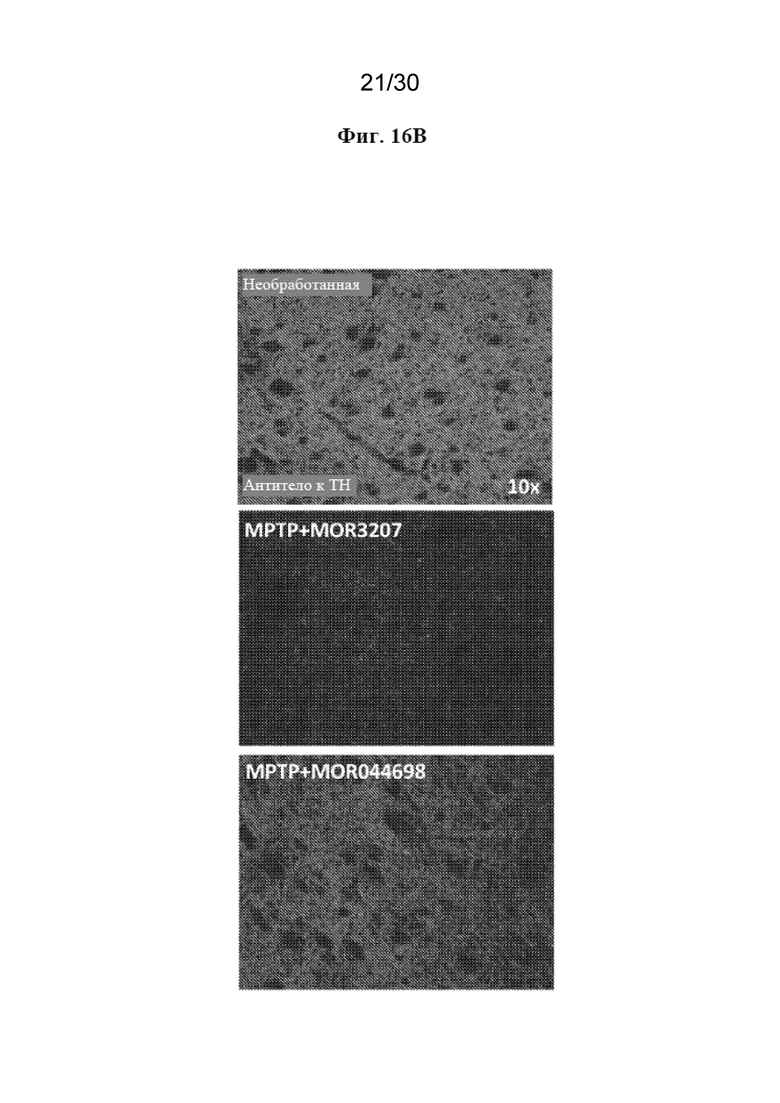
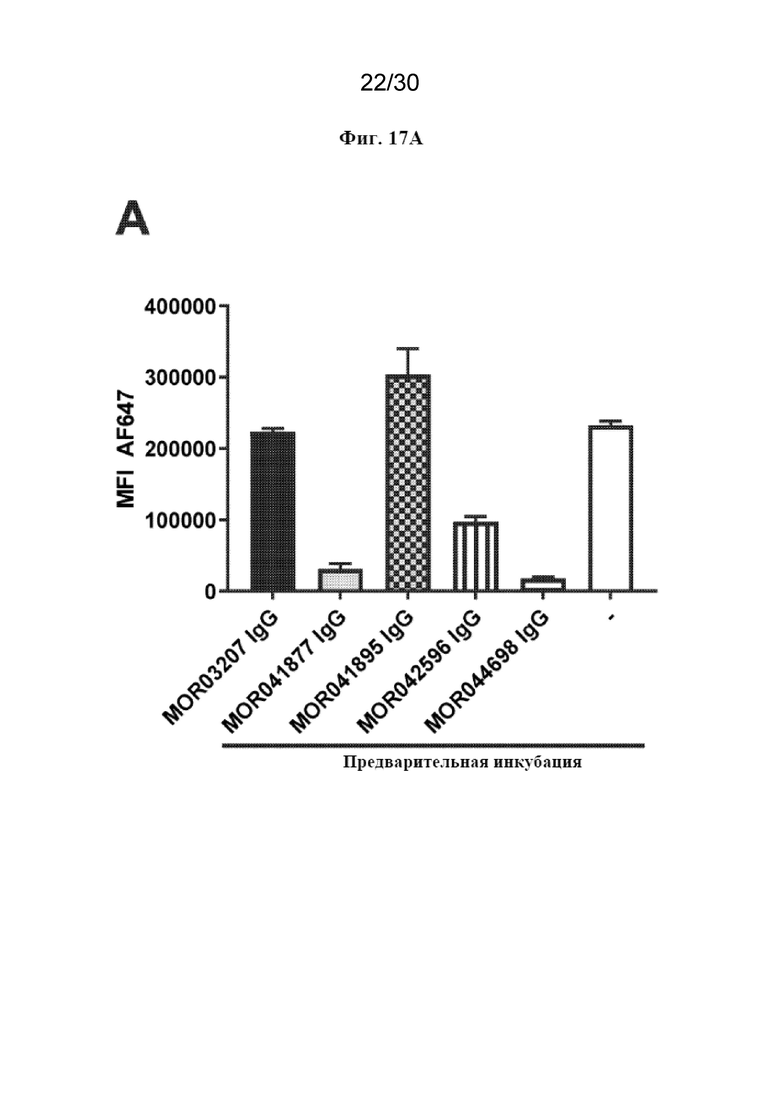
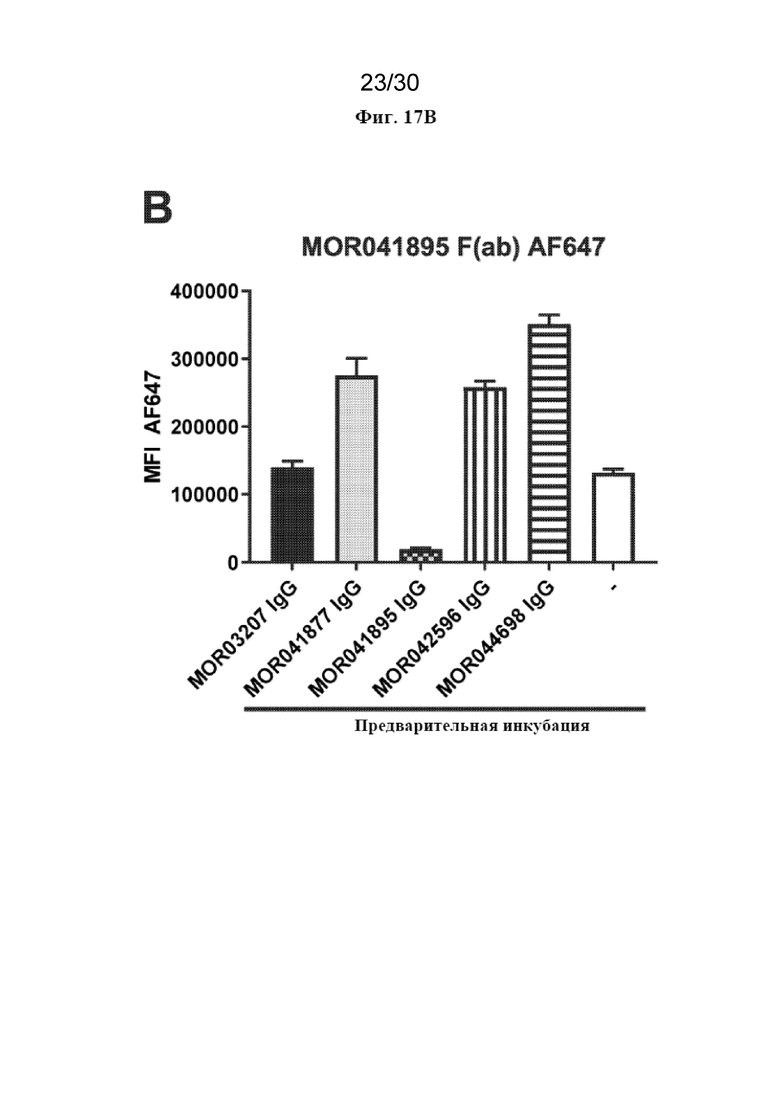
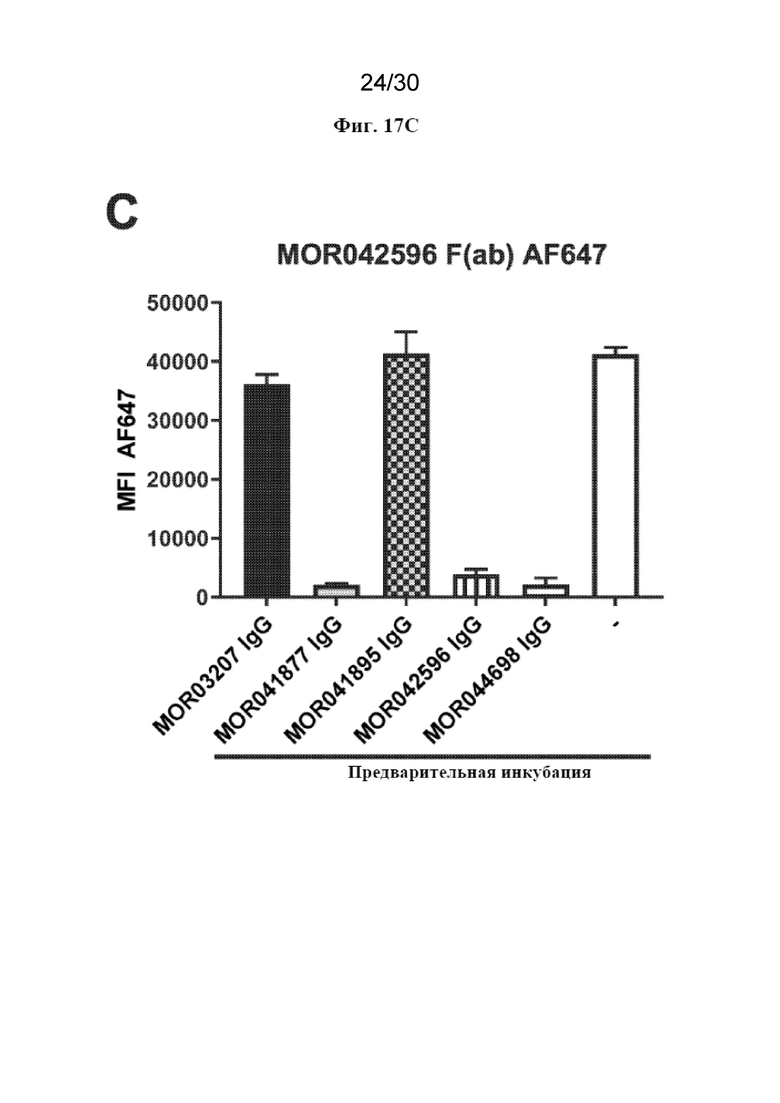
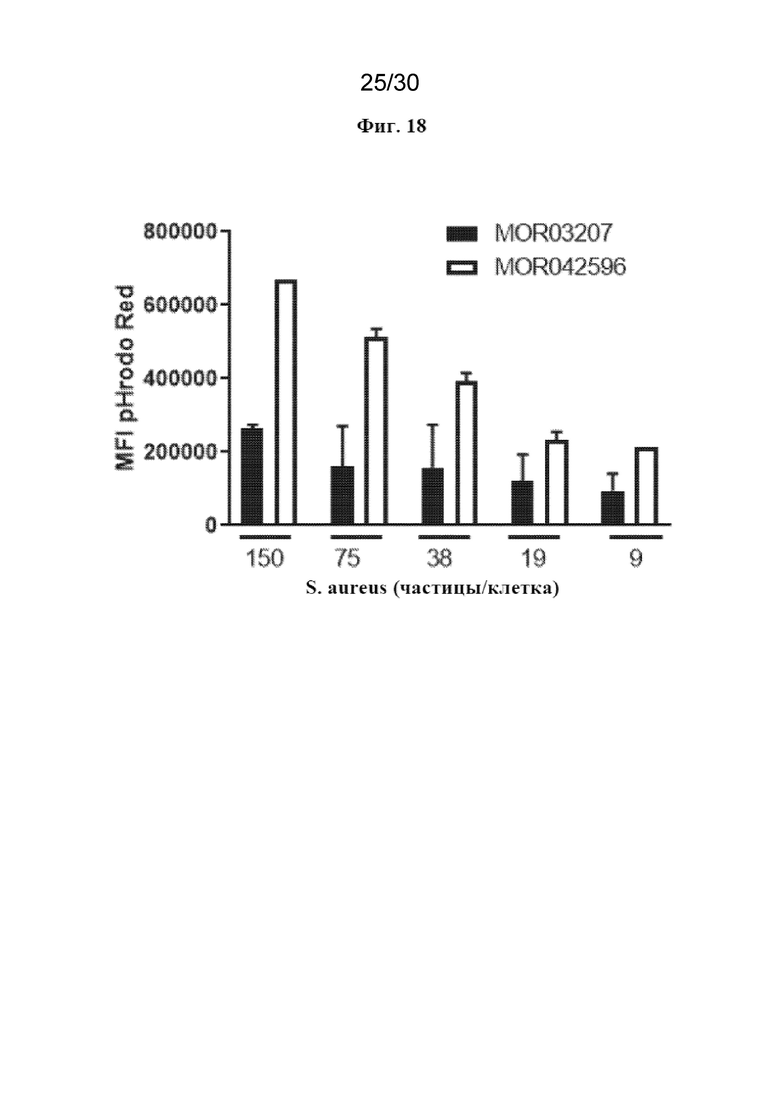
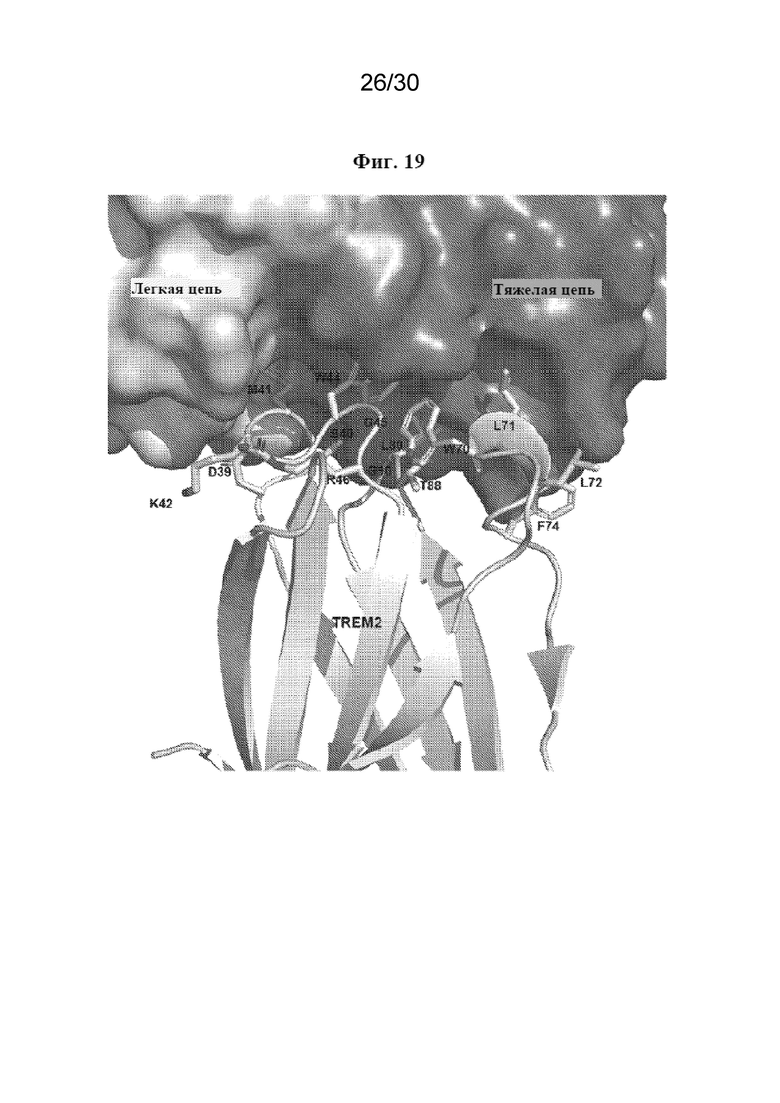
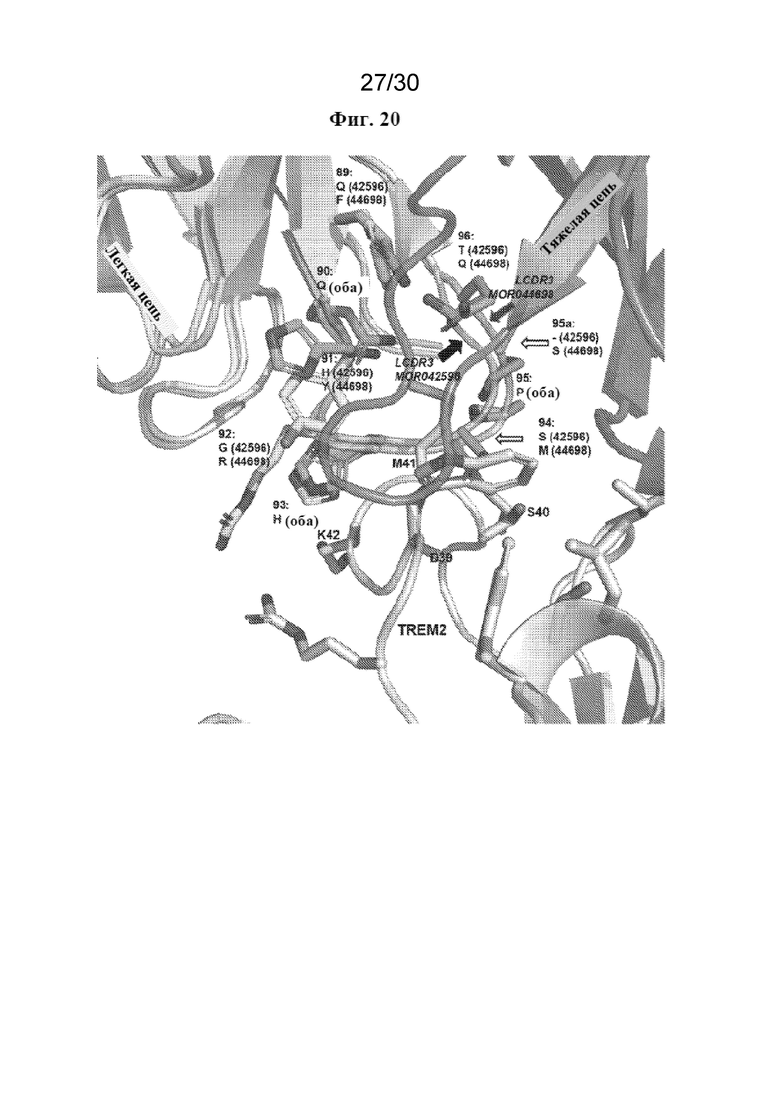
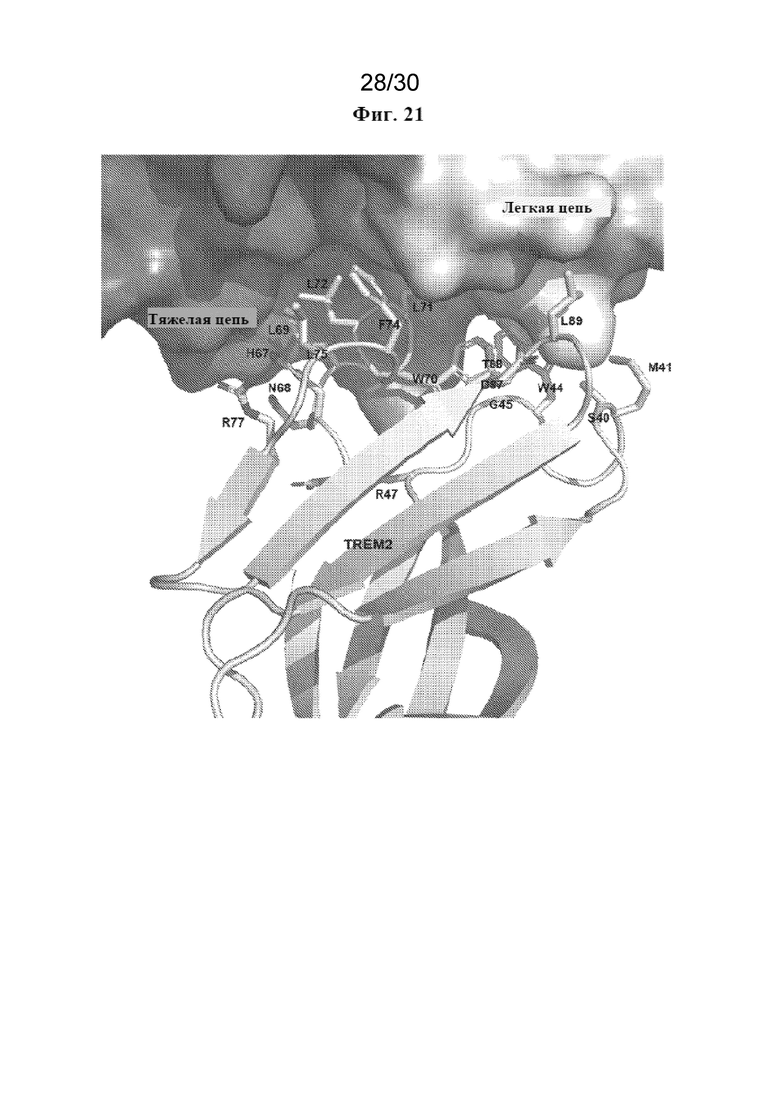
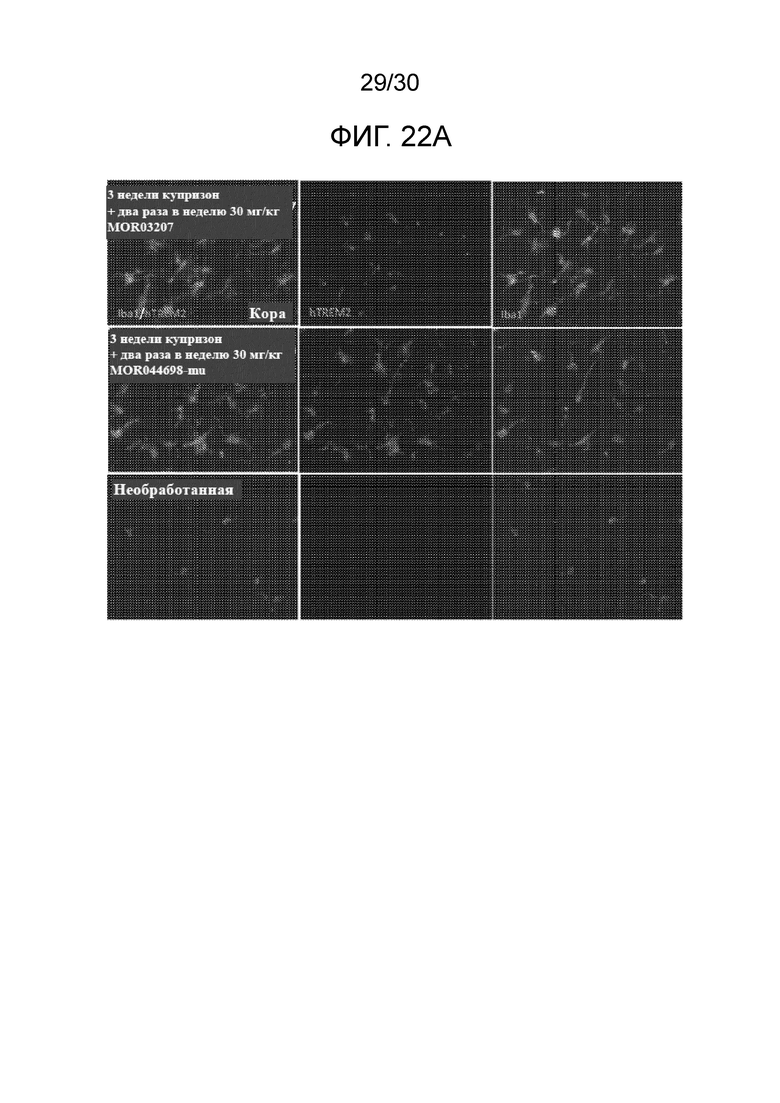
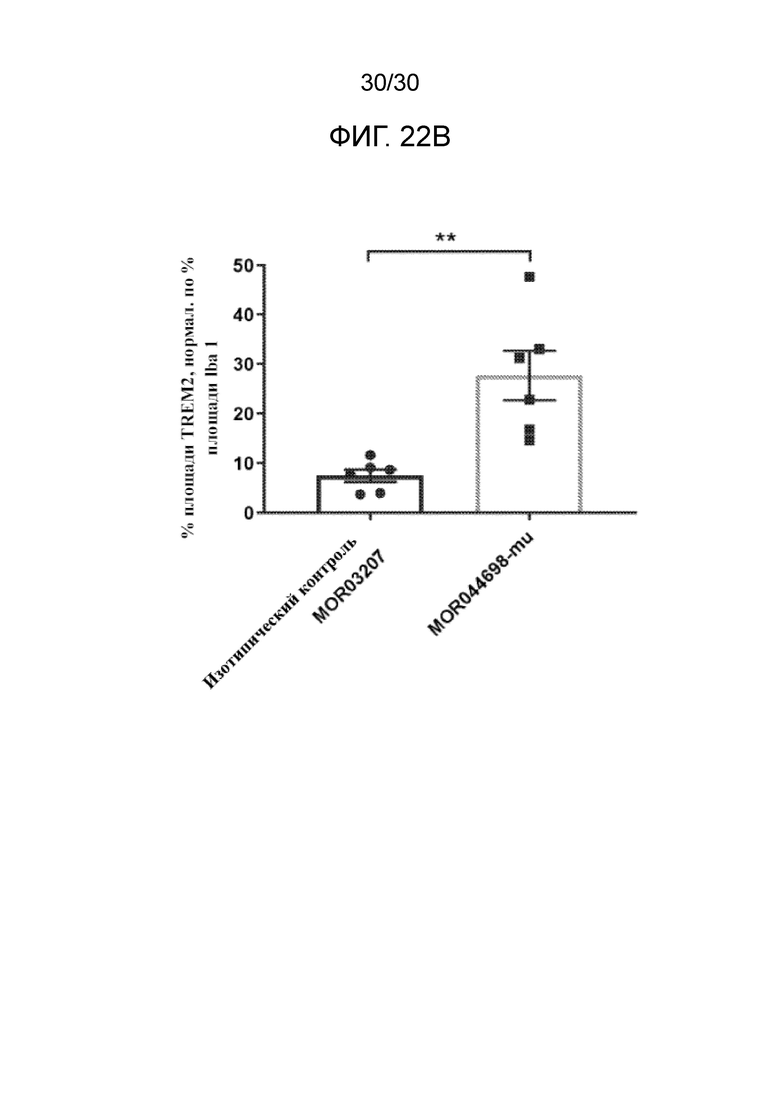
Изобретение относится к области биотехнологии. Предложены антитело или его антигенсвязывающий фрагмент, которые связываются с доменом суперсемейства иммуноглобулинов белка триггерного рецептора 2, экспрессируемого на миелоидных клетках человека (hTREM2), и стабилизируют его. Также предложены способы применения антитела для лечения заболеваний, связанных с потерей функции hTREM2. Кроме того, изобретение раскрывает нуклеиновую кислоту, вектор экспрессии, клетку для получения антитела по изобретению. Изобретение обеспечивает эффективную стабилизацию TREM2 на поверхности клетки, что способствует TREM2-зависимому фагоцитозу в макрофагах M2A человека и усилению TREM2-зависимых функций in vivo. 7 н. и 21 з.п. ф-лы, 36 ил., 34 табл., 6 пр.
1. Антитело или его антигенсвязывающий фрагмент, которые связываются с доменом суперсемейства иммуноглобулинов (IgSF) белка триггерного рецептора 2, экспрессируемого на миелоидных клетках человека (hTREM2), и стабилизируют белок hTREM2 с последовательностью SEQ ID NO: 1, 2 или 3,
где антитело или антигенсвязывающий фрагмент содержат:
CDR1 вариабельной области тяжелой цепи, содержащий или состоящий из SEQ ID NO: 4, или SEQ ID NO: 7, или SEQ ID NO: 8, или SEQ ID NO: 10;
CDR2 вариабельной области тяжелой цепи, содержащий или состоящий из SEQ ID NO: 5, или SEQ ID NO: 9, или SEQ ID NO: 11;
CDR3 вариабельной области тяжелой цепи, содержащий или состоящий из SEQ ID NO: 6 или SEQ ID NO: 12;
CDR1 вариабельной области легкой цепи, содержащий или состоящий из SEQ ID NO: 17, или SEQ ID NO: 20, или SEQ ID NO: 23;
CDR2 вариабельной области легкой цепи, содержащий или состоящий из SEQ ID NO: 18 или SEQ ID NO: 21; и
CDR3 вариабельной области легкой цепи, содержащий или состоящий из SEQ ID NO: 19 или SEQ ID NO: 22.
2. Антитело или его антигенсвязывающий фрагмент по п. 1, где антитело или его антигенсвязывающий фрагмент связывают один или несколько остатков hTREM2, выбранных из группы, состоящей из D39, S40, M41, K42, W44, G45, R46, R47, H67, N68, L69, W70, L71, L72, F74, L75, R77, D87, T88, L89 и G90.
3. Антитело или его антигенсвязывающий фрагмент по п. 1 или 2, где антитело или его антигенсвязывающий фрагмент активируют hTREM2.
4. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-3, где антитело или его антигенсвязывающий фрагмент:
a) усиливают фагоцитоз в экспрессирующей hTREM2 клетке, где экспрессирующая TREM2 клетка представляет собой макрофаг hM2A или микроглиеподобную клетку, полученную из iPS человека;
b) усиливают хемотаксис в экспрессирующей hTREM2 клетке, где экспрессирующая TREM2 клетка представляет собой макрофаг hM2A или микроглиеподобную клетку, полученную из iPS человека;
c) повышают управляемую NFAT активность репортерного гена в линии моноцитарных клеток человека;
d) повышают фосфорилирование Syk в экспрессирующей hTREM2 клетке, где экспрессирующая TREM2 клетка представляет собой макрофаг hM2A, или
e) усиливают любую комбинацию двух или более из указанного в a)-d).
5. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-4, где антитело или его антигенсвязывающий фрагмент связывают hTREM2 на поверхности клетки с полумаксимальной эффективной концентрацией (ЕС50), равной 1 нМ или меньше.
6. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-5, где антитело или его антигенсвязывающий фрагмент связывают hTREM2 с константой диссоциации (KD), составляющей 50 пМ или меньше, например, как измерено с помощью поверхностного плазмонного резонанса (SPR).
7. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-6, где антитело или его антигенсвязывающий фрагмент стабилизируют белок hTREM2 на поверхности клетки, экспрессирующей hTREM2.
8. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-7, где домен IgSF hTREM2 содержит аминокислотные остатки 19-132 любой из SEQ ID NO: 1, 2 и 3.
9. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-8, где антитело или его антигенсвязывающий фрагмент содержат:
a) VH, содержащую или состоящую из SEQ ID NO: 13, и
VL, содержащую или состоящую из SEQ ID NO: 24; или
b) VH, содержащую или состоящую из последовательности, которая по меньшей мере на 95% гомологична SEQ ID NO: 13, и
VL, содержащую или состоящую из последовательности, которая по меньшей мере 95% гомологична SEQ ID NO: 24; или
c) VH, содержащую или состоящую из последовательности, которая отличается по меньшей мере 1, 2, 3, 4, 5 или 6 аминокислотами от SEQ ID NO: 13, и
VL, содержащую или состоящую из последовательности, которая отличается по меньшей мере 1, 2, 3, 4, 5 или 6 аминокислотами от SEQ ID NO: 24.
10. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-9, где антитело или его антигенсвязывающий фрагмент содержат:
a) аминокислотную последовательность тяжелой цепи, содержащую или состоящую из SEQ ID NO: 15, SEQ ID NO: 29, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37 или SEQ ID NO: 39, и
аминокислотную последовательность легкой цепи, содержащую или состоящую из SEQ ID NO: 26; или
b) аминокислотную последовательность тяжелой цепи, которая по меньшей мере на 95% идентична последовательности SEQ ID NO: 15, SEQ ID NO: 29, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37 или SEQ ID NO: 39, и
аминокислотную последовательность легкой цепи, которая по меньшей мере на 95% идентична последовательности SEQ ID NO: 26.
11. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-10, содержащие:
a) последовательность тяжелой цепи, содержащую или состоящую из SEQ ID NO: 15, и
последовательность легкой цепи, содержащую или состоящую из SEQ ID NO: 26;
b) последовательность тяжелой цепи, содержащую или состоящую из SEQ ID NO: 29, и
последовательность легкой цепи, содержащую или состоящую из SEQ ID NO: 26;
c) последовательность тяжелой цепи, содержащую или состоящую из SEQ ID NO: 33, и
последовательность легкой цепи, содержащую или состоящую из SEQ ID NO: 26;
d) последовательность тяжелой цепи, содержащую или состоящую из SEQ ID NO: 35, и
последовательность легкой цепи, содержащую или состоящую из SEQ ID NO: 26;
e) последовательность тяжелой цепи, содержащую или состоящую из SEQ ID NO: 37, и
последовательность легкой цепи, содержащую или состоящую из SEQ ID NO: 26;
f) последовательность тяжелой цепи, содержащую или состоящую из SEQ ID NO: 39, и
последовательность легкой цепи, содержащую или состоящую из SEQ ID NO: 26.
12. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-10, где антитело или его антигенсвязывающий фрагмент содержат модифицированную Fc-область, которая характеризуется сниженной активностью антителозависимой клеточной цитотоксичности (ADCC) или комплементзависимой цитотоксичности (CDC) по сравнению с исходным антителом.
13. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-12, где антитело или его антигенсвязывающий фрагмент представляют собой человеческое или гуманизированное антитело или его фрагмент.
14. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-13, где антитело или его антигенсвязывающий фрагмент конъюгированы с еще одной молекулой.
15. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-14, где указанное антитело относится к изотипу IgG1.
16. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-15, где указанное антитело представляет собой антитело человека.
17. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-15, где указанное антитело представляет собой гуманизированное антитело.
18. Антитело по любому из пп. 1-17, где указанное антитело обладает измененной эффекторной функцией в результате мутации Fc-области.
19. Молекула нуклеиновой кислоты, кодирующая любое антитело или его антигенсвязывающий фрагмент по любому из пп. 1-18.
20. Молекула нуклеиновой кислоты по п. 19, где нуклеиновая кислота представляет собой ДНК.
21. Молекула нуклеиновой кислоты по п. 19 или 20, содержащая одну или несколько SEQ ID NO: 14, 28, 16, 30, 34, 36, 38, 40, 31, 27 или 32.
22. Вектор экспрессии, содержащий молекулы нуклеиновой кислоты по любому из пп. 19-21.
23. Клетка для получения антитела или его антигенсвязывающего фрагмента по любому из пп. 1-18, где клетка содержит молекулу нуклеиновой кислоты по любому из пп. 19-21 или вектор по п. 22.
24. Способ получения антитела к hTREM2 или его антигенсвязывающего фрагмента по любому из пп. 1-18, где способ включает:
(i) культивирование клетки по п. 23 и
(ii) выделение антитела к hTREM2 или его антигенсвязывающего фрагмента из культуры стадии (i).
25. Фармацевтическая композиция для лечения заболевания, связанного с потерей функции hTREM2, содержащая антитело или его антигенсвязывающий фрагмент по любому из пп. 1-18 и фармацевтически приемлемый носитель.
26. Применение антитела или его антигенсвязывающего фрагмента по любому из пп. 1-18 или фармацевтической композиции по п. 25 для производства лекарственного средства для лечения заболевания, связанного с потерей функции hTREM2.
27. Применение по п. 26, где заболевание представляет собой нейровоспалительное или нейродегенеративное заболевание.
28. Применение по п. 27, где необязательно нейровоспалительное или нейродегенеративное заболевание представляет собой болезнь Альцгеймера, лобно-височную деменцию, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Насу-Хакола, рассеянный склероз, боковой амиотрофический склероз (ALS), энцефалит с антителами к NMDA-рецепторам, аутизм, волчанку головного мозга (NP-SLE), индуцированную химиотерапией периферическую нейропатию (CIPN), постгерпетическую невралгию, хроническую воспалительную демиелинизирующую полинейропатию (CIDP), эпилепсию, синдром Гийена-Барре (GBS), миозит с тельцами включения, лизосомные болезни накопления, сфингомиелинлипидоз (Ниманна-Пика C), мукополисахаридоз II/IIIB, метахроматическую лейкодистрофию, мультифокальную моторную нейропатию, миастению гравис, болезнь Бехчета с вовлечением нервных структур, оптиконейромиелит (NMO), неврит зрительного нерва, полимиозит, дерматомиозит, энцефалит Расмуссена, синдром Ретта, инсульт, поперечный миелит, травматическое повреждение головного мозга, повреждение спинного мозга, вирусный энцефалит или бактериальный менингит.
| WO 2017062672 A2, 13.04.2017 | |||
| QINGWEN CHENG et al., TREM2-activating antibodies abrogate the negative pleiotropic effects of the Alzheimer's disease variant Trem2 R47H on murine myeloid cell function, JOURNAL OF BIOLOGICAL CHEMISTRY, March 29, 2018, vol | |||
| ПРИСПОСОБЛЕНИЕ ДЛЯ ПОДАЧИ УГЛЯ В ТЕНДЕР ПАРОВОЗА | 1920 |
|
SU293A1 |
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| ТАЛАЕВ В | |||
| Ю., Механизмы управления миграцией миелоидных | |||
Авторы
Даты
2023-11-21—Публикация
2019-10-15—Подача