Изобретение относится к ветеринарной вирусологии, к средствам молекулярной диагностики, а именно к дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green.
В настоящее время исследование генетических вариаций между полевыми изолятами и вакцинными штаммами микроорганизмов является важной задачей в области молекулярной биологии [1].
На протяжении последних десятилетий большой интерес на уровне генетических исследований представляет вирус бешенства. Заболевание, вызванное данным инфекционным агентом, является одним из опасных зоонозов, которое приводит к поражению центральной нервной системы, энцефаломиелитам, параличам с последующим неизбежным летальным исходом. Вирус бешенства относится к порядку Mononegavirales, семейству Rhabdoviridae, роду Lyssavirus, виду Rabies lyssavirus [2].
Геном возбудителя бешенства представлен несегментированной одноцепочечной негативной молекулой РНК длиной около 11800 - 12000 н.о. Нуклеиновая кислота кодирует 5 основных белков, расположенных в консервативном линейном порядке: нуклеопротеин (N-белок), фосфопротеин (Р-белок), матриксный белок (М-белок), гликопротеин (G-белок), РНК-зависимую РНК-полимеразу (L-белок) [3].
Пять генов в нуклеиновой кислоте вируса бешенства окружены двумя короткими участками нуклеотидов на 3'- и 5'-концах: лидерная область (leader) и трейлерная область (trailer), соответственно. Эти последовательности инициируют и завершают транскрипцию и репликацию генома [4].
Вирионы вируса бешенства имеют пулевидную форму диаметром около 75 нм и длиной 100-300 нм в зависимости от штамма/изолята. Один конец конический, а другой плоский. Вирусная РНК инкапсидируется N-белком (нуклеопротеином) (450 а.о.) с образованием спирального нуклеокапсида, в котором каждый N-протомер связывается с девятью нуклеотидами [5]. Нуклеокапсид связан со значительным количеством Р-белка (фосфопротеина) (297 а.о.). L-белок (РНК-зависимая РНК-полимераза) - белок с наибольшей длиной (2130 а.о.). Вирион состоит из следующих функциональных структур: рибонуклеопротеина (РНП), расположенный внутри вириона, и внешней белково-липидной составляющей. РНК, N-, Р- и L-белок образуют РНП, который является важнейшим иммуногенным компонентом, активно участвующим в транскрипции и репликации. Рибонуклеопротеин покрыт липидным бислоем, полученным из плазматической мембраны клетки-хозяина в процессе зарождения. М-белок (матричный) (202 а.о.) и G-белок (гликопротеин) (505 а.о.) являются мембраносвязанными белками. М-белок расположен под вирусной мембраной и соединяет нуклеокапсид и липидный бислой. G-белок - интегральный трансмембранный белок, который участвует в проникновении вируса в клетку [4].
Бешенство приводит к серьезным экономическим потерям, которые связаны с гибелью животных, ликвидацией последствий вспышек болезни, введением строгих ограничений, налагаемых на внутреннюю и международную торговлю продукцией животноводства, проведением профилактических и карантинных мероприятий и др. [6].
В соответствии с Кодексом наземных животных и Руководством МЭБ (OIE) по диагностическим тестам и вакцинам для борьбы с бешенством должен применяться следующий комплекс мер по вакцинопрофилактике диких плотоядных животных: программа по оральной вакцинации; вакцинопрофилактика домашних животных; современная лечебно-профилактическая вакцинация людей, обратившихся за антирабической помощью, профилактическая вакцинация людей групп риска, прежде всего, профессионального риска; контроль проводимых антирабических мероприятий, включающих в себя блок задач и методик [2].
Инактивированные вакцины, изготовленные на основе вируса бешенства, широко применяются для профилактики данного заболевания. В Российской Федерации применяют инактивированную культуральную вакцину против бешенства, разработанную с применением штамма «ВНИИЗЖ» [7].
В связи с этим, в настоящее время важно использовать диагностические инструменты, которые могут быстро и специфически дифференцировать вакцинный штамм «ВНИИЗЖ» и вирулентные полевые изоляты вируса бешенства, подтверждая, что именно данный вакцинный штамм не является причиной инфекционный процесс у животного в случае его заболевания. Исходя из этого, возникает потребность в разработке анализа, позволяющего проводить дифференциацию генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства.
В связи с этим целесообразно провести разработку способа дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства. Для решения поставленной задачи требуется провести молекулярно-биологический анализ генома вируса бешенства вакцинного штамма «ВНИИЗЖ» и полевых изолятов, представленных в базе данных GenBank [8], что даст возможность разработать уникальный способ для исследования образцов тканей биологического материала при вспышке заболевания для дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green.
В настоящее время методы молекулярно-биологического анализа находят широкое применение в диагностике различных инфекционных заболеваний [9, 10]. Благодаря созданию нового поколения флуоресцирующих красителей и возможности проведения анализа пиков температур для ампликонов стал важным и перспективным методом генотипирования микроорганизмов, который возможно применять для дифференциации вакцинных штаммов от полевых изолятов вирусов [9, 10, 11].
Анализ пиков температур плавления ампликонов является методом, который предполагает детальный сбор данных для установления небольших различий в последовательностях фрагментов ПНР только путем прямого плавления. Кривые плавления можно использовать для сканирования мутаций, сопоставления последовательностей и проведения генотипирования [12, 13, 14].
Сущность метода анализа пика температур плавления заключается в следующем: после проведения реакции амплификации в режиме реального времени с асимметричным интеркалирующим красителем смесь ампликонов постепенно нагревают, и при достижении определенной температуры двухцепочечные молекулы кДНК разделяются, флуорофор постепенно высвобождается, и интенсивность флуоресценции снижается. Изменения степени свечения детектируются оптической системой термоциклера. Ампликоны, имеющие мутации, «плавятся» при разной температуре. Преимуществом данного метода является то, что чувствительность метода достигает одного нуклеотида, благодаря чему с помощью данного теста можно проводить дифференциацию штаммов и полевых изолятов возбудителя заболеваний [15, 16, 17].
Прототипным вариантом проведения дифференциального анализа является постановка полимеразной цепной реакции с горизонтальным гель-электрофорезом с оригинальными праймерами и с последующим секвенированием по Сенгеру [18]. Однако, данный метод является очень дорогостоящим, слишком продолжительным во времени, поскольку предполагает проведение множества этапов работы с последующим расшифровыванием нуклеотидной последовательности и анализом их с биоинформатических программ. В условиях, при которых требуется осуществлять исследования полевых образцов биоматериала, экономически нецелесообразно использовать данный метод по указанным выше причинам. Таким образом, требуется разработать альтернативный способ дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green.
Задачей настоящего изобретения является разработка чувствительного и специфичного, экспрессного способа дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green с целью устранения вышеуказанных недостатков.
Данная задача решена благодаря разработки способа дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green.
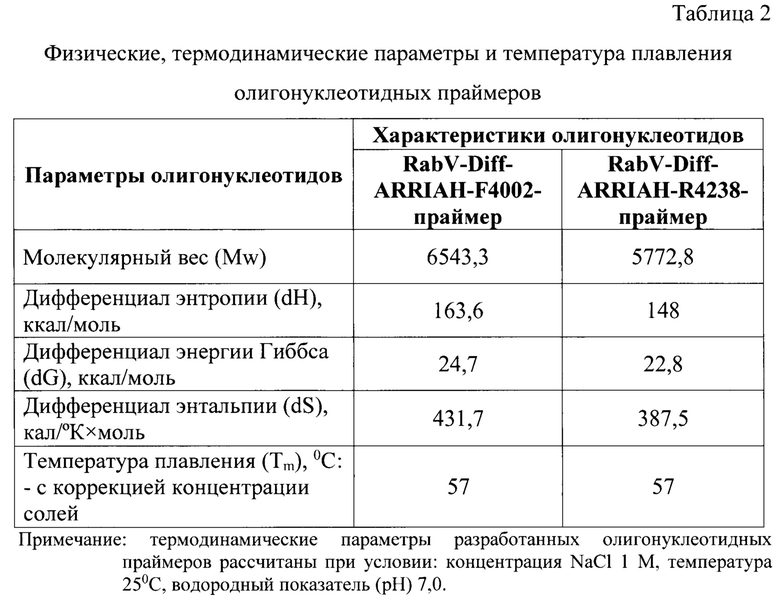
Разработанный способ дает возможность: 1) сократить время проведения анализа до 2,5 ч; 2) применять эффективный асимметричный краситель SYBR Green; 3) увеличить чувствительность и специфичность анализа за счет использования высокоспецифичных оригинальных олигонуклеотидных праймеров RabV-Diff-ARRIAH-F4002 и RabV-Diff-ARRIAH-R4238, рассчитанных для участка кДНК вируса бешенства в диапазоне 4002…4238 п.н., поскольку именно данная область содержит уникальные мутации для вакцинного штамма «ВНИИЗЖ» вируса бешенства для однозначной дифференциации вакцинного штамма «ВНИИЗЖ» и полевых изолятов вируса бешенства.
Сущность изобретения отражена на графических изображениях:
Фиг. 1 - Дизайн оригинальных олигонуклеотидных праймеров для разработки способа дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green. Примечание: А - прямой праймер, Б - обратный праймер (показана прямая направленность и «revers/complement»).
Фиг. 2 - Множественные выравнивания последовательностей полевых изолятов «RabV Tver 2009», «RabV Tula 2009», «RabV Omsk 2012», «RabV Krasnodar 2013», «RabV Kirov 2014», «RabV Novosibirsk 2014», «RabV Ivanovo 2010», «RabV Krasnoyarsk 2009», «RabV Lipetsk 2016», «RabV Voroneg 2018», «RabV Tver 2022», «RabV Kirov 2021», «RabV Primorskij 2022», «RabV Novgorod 2020» и вакцинного штамма «ВНИИЗЖ» (обозначение - «ARRIAH») вируса бешенства. Примечание: А - первые три мутации (позиции 4037, 4058, 4086 п. н. в кДНК вируса бешенства), Б - двойная парная мутация (4194-4195 п.н. в кДНК вируса бешенства).
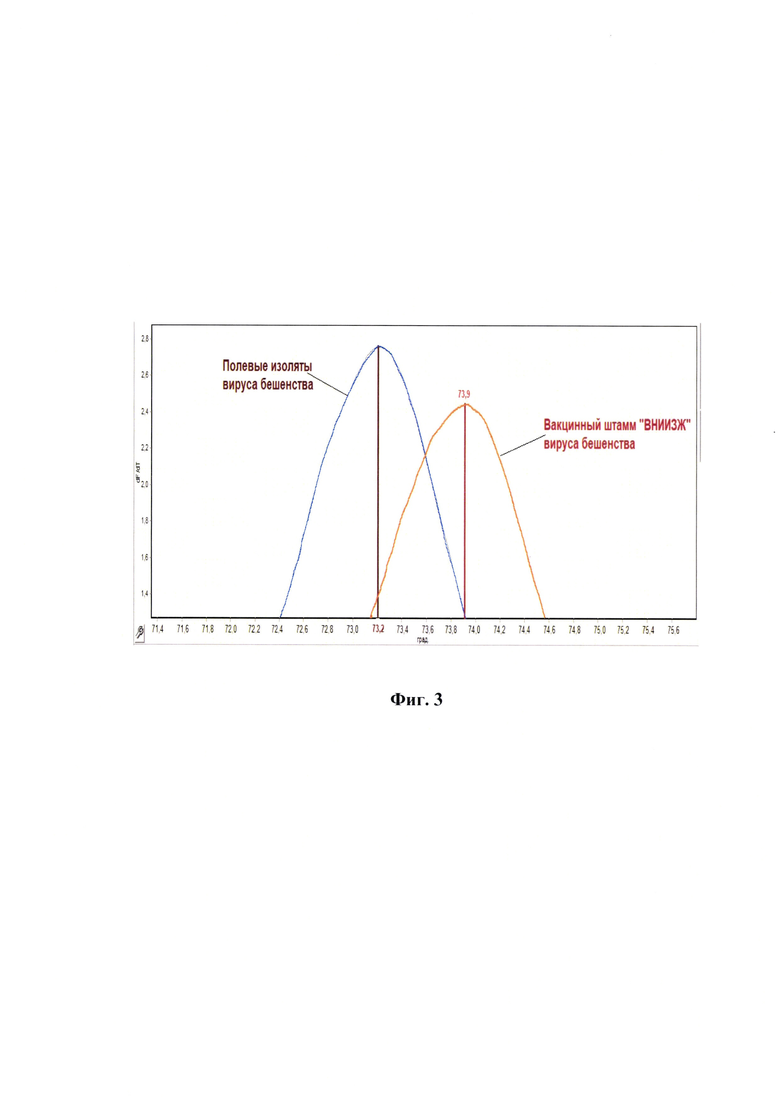
Фиг. 3 - Пики температур плавления ампликонов кДНК вируса бешенства для дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green. Представлен график для штамма «ВНИИЗЖ» вируса бешенства и один график для полевых изолятов (для всех исследуемых полевых изолятов вид и топология графика одинакова, они наложены друг на друга, по этой причине продемонстрирован один эталонный график).
Сущность изобретения пояснена в перечне последовательностей, в котором:
SEQ ID NO:1 представляет последовательность нуклеотидов G-гена кДНК вируса бешенства штамма «ВНИИЗЖ». Примечание: в данный ген входит участок нуклеотидной последовательности в диапазоне 4002…4238 п.н.
SEQ ID NO:2 представляет последовательность аминокислот, которые кодируются G-гена кДНК вируса бешенства штамма «ВНИИЗЖ». Примечание: в данный ген входит участок аминокислотной последовательности в диапазоне 1334…1412 п.н.
Сущность изобретения заключается в подходе по дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green.
Заявляемый способ основан на: 1) элюировании РНК вируса бешенства из исследуемого биологического материала; 2) проведении амплификации специфического фрагмента кДНК вируса бешенства в диапазоне 4002…4238 п.н. с применением разработанных оригинальных олигонуклеотидных специфических праймеров RabV-Diff-ARRIAH-F4002 и RabV-Diff-ARRIAH-R4238; 3) проведении плавления полученных ампликонов в разработанном режиме с использованием асимметричного красителя SYBR Green; 4) детекции результатов анализа с определением максимального значения температуры плавления ампликонов и проведении инструментального дифференциального анализа генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства.
В научных публикациях показана необходимость проведения дифференциации вакцинных штаммов и полевых изолятов вируса бешенства [19, 20, 21]. В настоящее время доступно несколько анализов для индикации вируса бешенства с помощью молекулярно-биологических методов исследования [22-26], но при этом ни один из них не предназначен для дифференциации вакцинного штамма «ВНИИЗЖ» от полевых изолятов. Сведений об аналогах предлагаемого способа дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green авторами не обнаружено.
Разработанный способ дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green по сравнению с прототипом отличается не меньшей точностью, при этом имеет явные преимущества - экономическая выгода, высокая скорость и простота выполнения анализа.
В отличие от прототипа разработанный способ позволяет провести анализ выравнивания множественных нуклеотидных последовательностей геномов вакцинного штамма «ВНИИЗЖ» и полевых изолятов вируса бешенства и идентифицировать следующие области с уникальными заменами нуклеотидов в вакцинном штамме «ВНИИЗЖ»: 4037 п.н. - замена Т на С, 4058 п.н. - А на G, 4086 п.н. - С на А, парная замена в позициях 4194-4195-ТТ на GG.
Разработанный способ предусматривает проведение реакции амплификации специфического фрагмента кДНК вируса бешенства в диапазоне 4002…4238 п.н. с применением разработанных оригинальных олигонуклеотидных специфических праймеров RabV-Diff-ARRIAH-F4002 и RabV-Diff-ARRIAH-R4238 для амплификации фрагмента размером 237 п.н., содержащего указанные выше замены.
Разработанный способ предусматривает проведение плавления ампликонов в разработанном режиме с использованием эффективного асимметричного интеркалирующего красителя SYBR Green, а также детекцию результатов анализа с определением максимального значения температуры плавления и проведением инструментального дифференциального анализа генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температуры плавления ампликонов. Таким образом, актуально применять предложенный способ для дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства.
Ключевым элементом заявляемого способа является определение максимальных температур плавления ампликонов кДНК виурса бешенства после реакции амплификации с разработанными оригинальными олигонуклеотидными праймерами и использованием асимметричного интеркалирующего красителя SYBR Green для дифференциация генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства.
Сопоставительный анализ с прототипом позволяет сделать вывод, что новизна и изобретательский уровень заявляемого изобретения заключается в применении разработанного способа с применением оригинальных специфичных олигонуклеотидных праймеров RabV-Diff-ARRIAH-F4002 и RabV-Diff-ARRIAH-R4238 (фиг.1), рассчитанных для амплификации участка кДНК вируса бешенства в диапазоне 4002…4238 п.н., асимметричного красителя SYBR Green и технологии анализа пиков температур плавления ампликонов.
Технический результат изобретения заключается в том, что разработанный способ дает возможность: 1) повысить чувствительность и специфичность за счет применения высокоспецифичных оригинальных праймеров, рассчитанных для целевого участка G-гена вируса бешенства, содержащего в диапазоне 4002…4238 п.н. уникальные для вакцинного штамма «ВНИИЗЖ» вируса бешенства мутации; 2) увеличить достоверность проводимого анализа благодаря применению эффективного асимметричного красителя SYBR Green; 3) проводить дифференциацию генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов.
Сущность предлагаемого изобретения пояснена на графическом материале - Пики температур плавления ампликонов кДНК вируса бешенства для дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green (фиг.3).
На первом этапе исследования проводят выделение нуклеиновой кислоты из анализируемых образцов, содержащих вирус бешенства, с помощью набора «РНК-сорб» в соответствии с инструкцией производителя («Ampli Sens»). Сведения о дизайне праймеров и их термодинамических характеристиках представлены на фиг.1, в таблицах 1 и 2.
Проводят обратную транскрипцию с применением следующих реагентов: деионизированная вода - 45 мкл, буфер 5-кратный - 20 мкл, дезоксирибонуклеозидтрифосфаты - 10 мкл, олигонуклеотидыне праймеры - по 7 мкл, MMLV-ревертаза - 3 мкл, элюат РНК - 13 мкл.
Для постановки П1ДР в режиме реального времени готовят реакционную смесь, которая включает в свой состав следующие компоненты: PCR buffer 10х - 5 мкл, хлорид магния 25 мМ - 5 мкл, олигонуклеотидыне праймеры - по 3 мкл, краситель SYBR Gold - 2 мкл, Taq ДНК-полимераза - 1 мкл, кДНК - 5 мкл, деионизированная вода - 1 мкл. Итоговый объем смеси для проведения одной реакции составляет 25 мкл.
При проведении реакции применяют положительный контроль (культуральная лиофильно высушенная суспензия вируса бешенства штамма «ВНИИЗЖ» с титром инфекционной активности не ниже 7,0 lg ККИД50/см3) и отрицательный контроль (деионизированная вода без нуклеаз MilliQ вместо кДНК-матрицы).
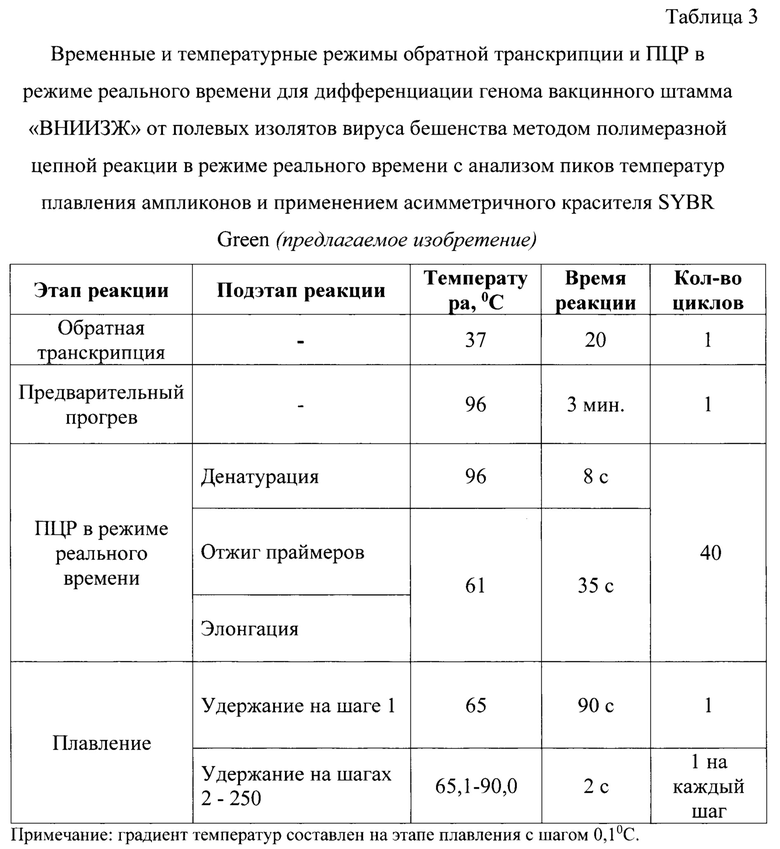
Постановку реакции осуществляют в детектирующем термоциклере CFX 96, или аналоге, при температурных и временных параметрах, сведения о которых представлены в таблице 3. Обратную транскрипцию проводят при температуре 42°С в течение 20 минут. Предварительную денатурацию осуществляют при температуре 96°С в течение 3 минут. ПЦР в режиме реального времени включает в себя 3 подэтапа: денатурацию, отжиг олигонуклеотидов, элонгацию. Денатурацию проводят при температуре 96°С в течение 8 секунд, отжиг олигонуклеотидов и элонгацию - при температуре 61°С в течение 35 секунд. Далее следует важный этап для осуществления дифференциального анализа - плавление, который проводят начиная с 65 до 90°С. Увеличение температуры составляет - 0,1°С за каждый шаг. При этом после первого шага плавления требуется ждать 90 секунд при температуре первого шага. Для каждого последующего шага время ожидания составляет 2 секунды.
Для детекции сигнала устанавливают канал детекции на амплификаторе HRM, для которого длина волны источника составляет 460 нм, детектора - 610 нм. В качестве красителя применяется SYBR Green с длиной волны излучения 520 нм.
Исследование кривой детекции температуры плавления ампликонов для исследуемых образцов выполняют с использованием программного обеспечения для сканирования генов на амплификаторе марки CFX 96, или аналоге. Инструментально осуществляются построение кривых плавления в виде графиков параболы и детектируются пики данных температур для полученных ампликонов. Выявляют, что для вакцинного штамма «ВНИИЗЖ» вируса бешенства в отличии от полевых изолятов характерен очень узкий индивидуальный диапазон температуры плавления, по данным которого можно судить о принадлежности исследуемого образца к вакцинному штамму «ВНИИЗЖ» или полевым изолятам вируса бешенства.
Сущность предлагаемого изобретения пояснена примерами его использования, которые не ограничивают объем изобретения.
Пример 1. Определение пиков температур плавления ампликонов для разработки способа дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green.
Для определения показателей, позволяющих проводить дифференциацию генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green, осуществляли этапы работы, представленные ниже.
Проводили выделение нуклеиновой кислоты из анализируемых образцов, содержащих вирус бешенства, с применением твердофазного способа с использованием набора «РНК-сорб» в соответствии с инструкцией производителя («Ampli Sens»). Обратную транскрипцию осуществляли с применением следующих реагентов: деионизированная вода - 45 мкл, буфер 5-кратный - 20 мкл, дезоксирибонуклеозидтрифосфаты - 10 мкл, олигонуклеотидыне праймеры - по 7 мкл, MMLV-ревертаза - 3 мкл, элюат РНК - 13 мкл.
Для постановки ПНР в режиме реального времени готовили реакционную смесь, которая включала в свой состав следующие компоненты: PCR buffer 10х - 5 мкл, хлорид магния 25 мМ - 5 мкл, олигонуклеотидыне праймеры - по 3 мкл, краситель SYBR Gold - 2 мкл, Taq ДНК-полимераза - 1 мкл, кДНК - 5 мкл, деионизированная вода - 1 мкл. Итоговый объем смеси для проведения одной реакции составляет 25 мкл.
При осуществлении анализа применяли положительный контроль (культуральная лиофильно высушенная суспензия вируса бешенства штамма «ВНИИЗЖ» с титром инфекционной активности не ниже 7,0 lg ККИД50/см3) и отрицательный контроль (деионизированная вода без нуклеаз MilliQ вместо кДНК-матрицы).
Постановку реакции осуществляли в детектирующем амплификаторе CFX 96, или аналоге, при температурных и временных параметрах, сведения о которых представлены в таблице 3. Для детекции сигнала устанавливали канал детекции HRM, для которого длина волны источника составляет 460 нм, детектора - 610 нм. В качестве красителя применяется SYBR Green с длиной волны излучения 520 нм.
Исследование кривой детекции температуры плавления для исследуемых образцов выполняли с использованием программного обеспечения для сканирования генов на амплификаторе марки CFX 96, или аналоге. Инструментально осуществляли построение кривых плавления в виде графиков параболы и детектировали пики температур плавления для полученных ПЦР-продуктов размером 237 п.н.
Тестировали кДНК вируса бешенства вакцинного штамма «ВНИИЗЖ» и 14 следующих полевых изолятов: «RabV Tver 2009», «RabV Tula 2009», «RabV Omsk 2012», «RabV Krasnodar 2013», «RabV Kirov 2014», «RabV Novosibirsk 2014», «RabV Ivanovo 2010», «RabV Krasnoyarsk 2009», «RabV Lipetsk 2016», «RabV Voroneg 2018», «RabV Tver 2022», «RabV Kirov 2021», «RabV Primorskij 2022», «RabV Novgorod 2020». Выравнивания последовательностей нуклеотидов указанных штаммов представлены на фиг.2.
Выявили, что для вакцинного штамма «ВНИИЗЖ» вируса бешенства характерен очень узкий индивидуальный за счет уникальных мутаций диапазон пика температуры плавления ампликонов, полученных в реакции амплификации с использованием оригинальных олигонуклеотидных праймеров RabV-Diff-ARRIAH-F4002 и RabV-Diff-ARRIAH-R4238 и асимметричного красителя SYBR Green, равный 73,90±0,02°С (n=30, р<0,005). Для полевых изолятов вируса бешенства «RabV Tver 2009», «RabV Tula 2009», «RabV Omsk 2012», «RabV Krasnodar 2013», «RabV Kirov 2014», «RabV Novosibirsk 2014», «RabV Ivanovo 2010», «RabV Krasnoyarsk 2009», «RabV Lipetsk 2016», «RabV Voroneg 2018», «RabV Tver 2022», «RabV Kirov 2021», «RabV Primorskij 2022», «RabV Novgorod 2020» - 73,20±0,05°C (n=30, p<0,005) (фиг. 3).
Таким образом, для вакцинного штамма «ВНИИЗЖ» и 14 исследуемых полевых изолятов вируса бешенства, взятых из разных регионов РФ, характерны индивидуальные отличающиеся пики температур плавления ампликонов, что дало возможность проводить дифференциацию генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green.
Пример 2. Исследование аналитической специфичности разработанного способа дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green.
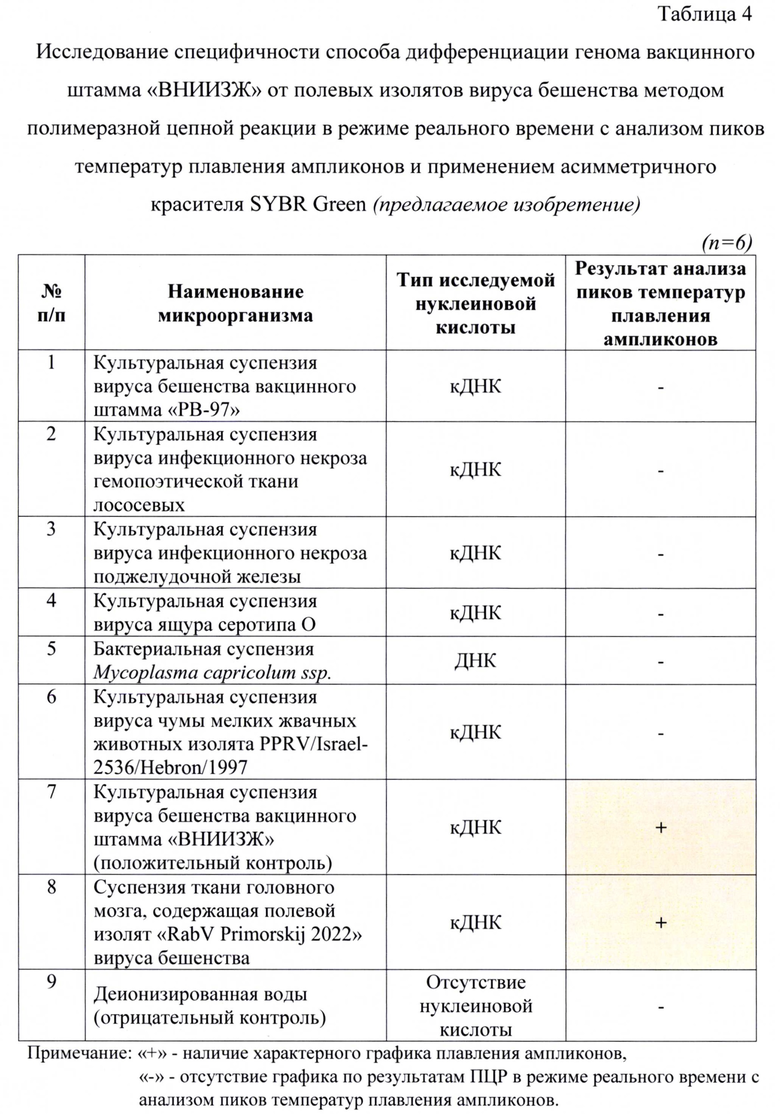
Специфичность анализа дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green оценивали путем тестирования следующих образцов: культуральных суспензий вируса бешенства вакцинного штамма «РВ-97», вируса инфекционного некроза гемопоэтической ткани лососевых, вируса инфекционного некроза поджелудочной железы, вируса ящура серотипа О, вируса чумы мелких жвачных животных изолята «PPRV/Israel-2536/Hebron/1997», бактериальной суспензии Mycoplasma capricolum ssp.
В качестве положительных контролей использовали культуральную лиофильно высушенную суспензию вакцинного штамма «ВНИИЗЖ» вируса бешенства и патологический материал мозга собаки, содержащей полевой изолят «RabV Primorskij 2022». В качестве отрицательного контроля использовали деионизированную воду. Для проведения исследования использовали детектирующий термоциклер марки CFX-96. В результате исследования амплификация с неспецифичными нуклеиновыми кислотами других инфекционных агентов не была обнаружена (табл.4).
В результате исследования обнаружили, что для проб, не содержащих нуклеиновую кислоту вируса бешенства, и для отрицательного контроля не были сформированы графики плавления и не были обнаружены пиковые значения температур плавления ампликонов. При исследовании положительных контролей - культуральной лиофильно высушенной суспензии вируса бешенства вакцинного штамма «ВНИИЗЖ» и патологического материла мозга собаки, содержащей полевой изолят «RabV Primorskij 2022» (лиофилизат), получили следующие пиковые значения температур плавления: 73,90±0,01°С и 73,18±0,02°С (n=22, р<0,005), соответственно.
Таким образом, полученные результаты свидетельствовали о 100%-ной специфичности разработанного способа дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green.
Пример 3. Определение диагностических показателей разработанного способа дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green.
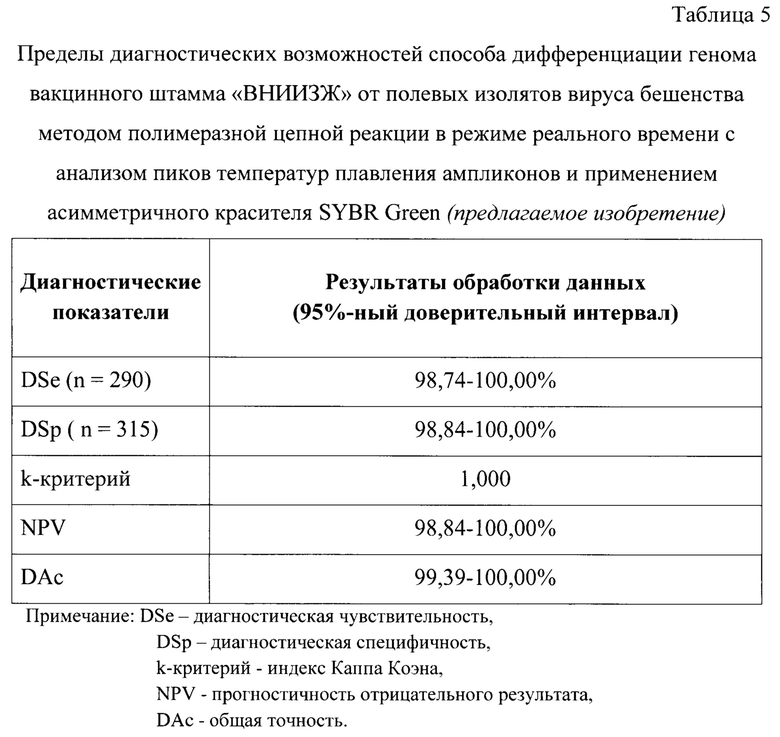
Для разработанного способа исследовали стандартные диагностические показатели. Для определения диагностической чувствительности разработанного способа анализировали 290 культуральных суспензий вакцинного штамма «ВНИИЗЖ» вируса бешенства с разными титрами инфекционной активности (7,00-9,75 lg ККИД50/см3), полученных в течение 2018-2023 гг.в рамках производственного процесса изготовления антирабической вакцины. Данные пробы являлись заведомо положительными. Постановку обратной транскрипции и ПЦР в режиме реального времени с последующим плавлением ампликонов проводили, как отражено выше. С помощью разработанного способа (предлагаемое изобретение) определили, что из 290 исследуемых культуральных суспензий вируса бешенства вакцинного штамма «ВНИИЗЖ» все определены в качестве положительных (пиковые значения температуры плавления составили 73,91±0,05°С) и подтверждено наличие именно того штамма, который содержался в анализируемых суспензиях. Данные результаты были подтверждены с помощью секвенирования по Сенгеру [18].
Для исследования специфичности метода тестировали 315 суспензий полевых изолятов вируса бешенства, полученных из суспензий ткани головного мозга больных животных. В результате исследования с помощью разработанного способа (предлагаемое изобретение) определили, что все 315 проб содержали геном вируса бешенства (пиковые значения температуры плавления составили 73,17±0,09°С), при этом не содержали вакцинный штамм «ВНИИЗЖ», что было подтверждено с помощью секвенирования. Пользуясь представленными выше статистическими методами анализа определили, что в 95%-ном доверительном интервале диагностическая чувствительность (DSe) составила 98,74-100,00%, диагностическая специфичность (DSp) - 98,84-100,0%, k-критерий - 1,000; прогностичность отрицательного результата (NPV) - 98,84-100,00%, общая точность (DAc) - 99,39-100,00% (табл.5).
Основными преимуществами предлагаемого изобретения является возможность проводить за короткий промежуток времени (2,5 ч) дифференциацию генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green.
Разработанный способ впервые применили для решения данной задачи в отношении вакцинного штамма «ВНИИЗЖ» вируса бешенства. Выявили, что в анализируемом участке кДНК вируса бешенства штамма «ВНИИЗЖ» в диапазоне 4002…4238 п. н. амплифицируемого ПЦР-продукта имеются следующие нуклеотидные замены: 4037 п.н. - замена Т на С, 4058 п. н. - А на G, 4086 п.н. - С на А, парная замена в позициях 4194-4195 - ТТ на GG, которые характерны для вакцинного штамма «ВНИИЗЖ» и отсутствует в полевых изолятах данного вируса, что позволило разработать следующие специфические олигонуклеотидные праймеры: RabV-Diff-ARRIAH-F4002 и RabV-Diff-ARRIAH-R4238, рассчитанные для амплификации участка кДНК вируса бешенства в диапазоне 4002…4238 п. н. и применения технологии анализа пиков температур плавления ампликонов. Разработанный способ дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green характеризуется аналитической специфичностью, равной 100%. В 95%-ном доверительном интервале диагностическая чувствительность для данного способа составляет 98,74-100,00%, диагностическая специфичность - 98,84-100,0%.
Источники информации, принятые во внимание при составлении описания изобретения к заявке на выдачу патента РФ на изобретение «Способ дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green»:
1. Aitman TJ, Petretto E, Behmoaras J. Genetic mapping and positional cloning. Methods Mol Biol. 2010;597:13-32. doi: 10.1007/978-1 -60327-389-3_2. PMID: 20013223.
2. OIE. Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. - 7th ed. - Paris, 2022. - Vol.1, Chap.2.1.17/
3. Finke S., Conzelmann K.K. (August 2005). «Replication strategies of rabies virus». Virus Res. 111(2): 120-131. doi:10.1016/j.virusres.2005.04.004. PMID 15885837.
4. Hooper DC, Roy A, Barkhouse DA, Li J, Kean RB. Rabies virus clearance from the central nervous system. Adv Virus Res. 2011;79:55-71. doi: 10.1016/B978-0-12-387040-7.00004-4. PMID: 21601042.
5. Gomme EA, Wanjalla CN, Wirblich C, Schnell MJ. Rabies virus as a research tool and viral vaccine vector. Adv Virus Res. 2011;79:139-64. doi: 10.1016/В978-0-12-387040-7.00009-3. PMID: 21601047; PMCID: PMC7150175.
6. Orłowsks A, Żmudziński JF. Genetic characterisation of the rabies virus vaccine strains used for oral immunization of foxes in Poland to estimate the effectiveness of vaccination. Arch Virol. 2015 Feb;160(2):509-15. doi: 10.1007/s00705-014-2269-y. Epub 2014 Nov 19. PMID: 25408374; PMCID: PMC4315525.
7. Вирусвакцина для оральной иммунизации диких плотоядных животных против бешенства Синраб URL: https://www.vettorg.ru/catalog/item-588.html. (Дата обращения: 11.06.2023).
8. Rabies complete genome - Nucleotide - NCBI. URL: https://www.ncbi.nlm.nih.gov/nuccore/?term=rabies+virus. (Дата обращения: 13 03.2023).
9. Er TK, Chang JG. High-resolution melting: applications in genetic disorders. Clin Chim Acta. 2012 Dec 24;414:197-201.
10. Hussmann D, Hansen LL. Methylation-Sensitive High Resolution Melting (MS-HRM). Methods Mol Biol. 2018;1708:551-571.
11.Nikodem D, Cłapa T, Narożna D. Technologia HRM-PCR w diagnostyce medycznej [HRM-PCR in medical diagnostic]. Postepy Biochem. 2021 Mar 4;67(l):59-63. Polish, doi: 10.18388/pb.2021_373. PMID: 34378898.
12. Pakbin B, Basti AA, Khanjari A, Brück WM, Azimi L, Karimi A. Development of high-resolution melting (HRM) assay to differentiate the species of Shigella isolates from stool and food samples. Sci Rep.2022 Jan 10; 12(1):473.
13. Robinson CV, Uren Webster TM, Consuegra S. Data on optimisation of a multiplex HRM-qPCR assay for native and invasive crayfish as well as the crayfish plague in four river catchments. Data Brief. 2018 May 29;19:1092-1109.
14.Rojas A, Rojas D, Montenegro VM, Baneth G. Detection of Dirofilaria immitis and other arthropod-borne filarioids by an HRM real-time qPCR, blood-concentrating techniques and a serological assay in dogs from Costa Rica. Parasit Vectors. 2015 Mar 23; 8:170.
15.Schiwek S, Beule L, Vinas M, Pfordt A, von Tiedemann A, Karlovsky P. High-Resolution Melting (HRM) Curve Assay for the Identification of Eight Fusarium Species Causing Ear Rot in Maize. Pathogens. 2020 Apr 7; 9(4):270.
16. Zhang L, Ma X, You G, Zhang X, Fu Q. A Novel Multiplex HRM Assay to Detect Clopidogrel Resistance. Sci Rep.2017 Nov 22; 7(1): 16021.
17. Zhang L, Zhang X, You G, Yu Y, Fu Q. A novel dNTP-limited PCR and HRM assay to detect Williams-Beuren syndrome. Clin Chim Acta. 2018 Jun; 481:171-176.
18. Crossley BM, Bai J, Glaser A, Maes R, Porter E, Killian ML, Clement T, Toohey-Kurth K. Guidelines for Sanger sequencing and molecular assay monitoring. J Vet Diagn Invest. 2020 Nov; 32(6):767-775.
19. Davis BM, Rall GF, Schnell MJ. Everything You Always Wanted to Know About Rabies Virus (But Were Afraid to Ask). Annu Rev Virol. 2015 Nov; 2(1):451-71. doi: 10.1146/annurev-virology-100114-055157. Epub 2015 Jun 24. PMID: 26958924; PMCID: PMC6842493.
20. Takahashi T, Inukai M, Sasaki M, Potratz M, Jarusombuti S, Fujii Y, Nishiyama S, Finke S, Yamada K, Sakai H, Sawa H, Nishizono A, Sugiyama M, Ito N. Genetic and Phenotypic Characterization of a Rabies Virus Strain Isolated from a Dog in Tokyo, Japan in the 1940s. Viruses. 2020 Aug 20;12(9):914. doi: 10.3390/v12090914. PMID: 32825306; PMCID: PMC7552007.
21. de Almeida Campos AC, Romano CM, Melo FL, Araújo DB, Cunha EMS, Sacramento DRV, Durigon EL, Lazarini SRF. Phylogenetic analysis of near full-length sequences of the Desmodus rotundus genetic lineage of rabies virus. Infect Genet Evol. 2020 Jun; 80:104179. doi: 10.1016/j.meegid.2020.104179. Epub 2020 Jan 7. PMID: 31917361.
22. Ciabatti E, González-Rueda A, Mariotti L, Morgese F, Tripodi M. Life-Long Genetic and Functional Access to Neural Circuits Using Self-Inactivating Rabies Virus. Cell. 2017 Jul 13; 170(2):382-392.e14. doi: 10.1016/j.cell.2017.06.014. Epub 2017 Jul 6. PMID: 28689641; PMCID: PMC5509544.
23. Li Y, Zhao H, Wilkins K, Hughes C, Damon IK. Real-time PCR assays for the specific detection of monkeypox virus West African and Congo Basin strain DNA. J Virol Methods. 2010 Oct; 169(1): 223-7. doi: 10.1016/j.jviromet.2010.07.012. Epub 2010 Jul 17. PMID: 20643162; PMCID: PMC9628942.
24. Yang DK, Kim HH, Lee S, Yoo JY. Establishment of multiplex RT-PCR for differentiation between rabies virus with and that without mutation at position 333 of glycoprotein. J Vet Sci. 2020 Mar; 21(2):e22. doi: 10.4142/jvs.2020.21.e22. PMID: 32233130; PMCID: PMC7113577.
25. Wadhwa A, Wilkins K, Gao J, Condori Condori RE, Gigante CM, Zhao H, Ma X, Ellison JA, Greenberg L, Velasco-Villa A, Orciari L, Li Y. A Pan-Lyssavirus Taqman Real-Time RT-PCR Assay for the Detection of Highly Variable Rabies virus and Other Lyssaviruses. PLoS Negl Trop Dis. 2017 Jan 12; 11(1):e0005258. doi: 10.1371/journal.pntd.0005258. PMID: 28081126; PMCID: PMC5230753.
26. David D, Yakobson B, Rotenberg D, Dveres N, Davidson I, Stram Y. Rabies virus detection by RT-PCR in decomposed naturally infected brains. Vet Microbiol. 2002 Jun 20;87(2):111-8. doi: 10.1016/s0378-1135(02)00041-х. PMID: 12034539.

--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="1.xml"
softwareName="WIPO Sequence" softwareVersion="2.1.2"
productionDate="2024-03-12">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2024-03-12</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>519</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2023-07-04</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">ФГБУ "Федеральный центр охраны
здоровья животных" (ФГБУ "ВНИИЗЖ")</ApplicantName>
<ApplicantNameLatin>Federal State-Financed Institution Federal
Centre for Animal Health (FGBI ARRIAH)</ApplicantNameLatin>
<InventorName languageCode="ru">Доронин Максим
Игоревич</InventorName>
<InventorNameLatin>Doronin Maksim Igorevich </InventorNameLatin>
<InventionTitle languageCode="ru">Способ дифференциации генома
вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства
методом полимеразной цепной реакции в режиме реального времени с
анализом пиков температур плавления ампликонов и применением
асимметричного красителя SYBR Green</InventionTitle>
<SequenceTotalQuantity>4</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>1572</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1572</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q1">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>RabV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atggttcctcaggctcttttgtttgtaccctttctgggtttttcattgt
gtttcgggaaattccctatttacacgataccggacaaacttggtccctggagcccgattgatatacatca
tctcagttgcccaaacaatttggtcgtggaggatgaaggatgcaccaacctgtcagggttctcctacctg
gaacttaaagttggacacatctctgctataaaggtgaacggattcacttgcacaggcgttgtgacagagg
cagagacctacactaactttgttggttatgtcaccaccacgttcaaaagaaagcatttccgcccgacacc
agatgcatgtagagccgcatacaactggaagacggctggtgatcccagatatgaagagtctttacaaaat
ccgtaccctgactaccagtggctccgaactgtaagaaccaccaaggagtctctcgttatcatatccccaa
gtgcggcagatttggacccatatgacaaatcccttcactcgagggtcttccctagcggaaagtgctcagg
aataacggtgtcctctgtttactgctcaacaaaccacgattacaccatttggatgcctgagaatccgaga
caagggatgtcttgtgacattttcaccaatagtagagggaagagagcatccaaggagagaaagacctgcg
gctttgtggatgaaagaggcctgtataagtctctaagaggctcatgcaaactcaagttatgtggagttct
tggacttagacttatggatggaacatgggtcgcgatgcagacatcaaatgagaccaaatggtgttcccct
gatcagttggttaatctgcacgactttcactcagatgaaattgagcaaaatgttgtagaggagttggtca
agaaacgacccgagtgtctggatgcactagagtccaacatgaccaccaaaacagtaagtttcagacgtct
cagtcatttaagaaaacttgtccctgggttcggaaaagcatataccataatcaacaagactttgatggag
gctgaggctcactacaagtcagtccggacttggaatgagatcgtcccctcaaaagggtgtttaagagtcg
aagggaggtgtcatcctcatgtaaacggggtatttttcaatggtataatattagggcctgacggccatgt
tctaatcccagagatgcaatcatccctcctccagcaacatatggagttattggaatcctcagttattccc
ctgatgcacccccttgcagacccgtccacggttttcaaggaaggcgatgaggcggaggactttgtagaag
ttcactttccagatgtgcataaaaaggtctcagaggttgacctgggtctcccgaactggggagagtatgt
attactgagtgcagggaccctgattgccttgatgttgataattttcctaatgatatgtcgtagaagagtc
aatagaccagaatctacgcaacgcagtctcagagggacagagatgaaggtgtcggtcaccccccaaagcg
ggaaattcaaatcttcatgggaatcatataaaagtggggatgaagctagactg</INSDSeq_sequenc
e>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>524</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..524</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>FMDV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MVPQALLFVPFLGFSLCFGKFPIYTIPDKLGPWSPIDIHHLSCPNNLVV
EDEGCTNLSGFSYLELKVGHISAIKVNGFTCTGVVTEAETYTNFVGYVTTTFKRKHFRPTPDACRAAYNW
KTAGDPRYEESLQNPYPDYQWLRTVRTTKESLVIISPSAADLDPYDKSLHSRVFPSGKCSGITVSSVYCS
TNHDYTIWMPENPRQGMSCDIFTNSRGKRASKERKTCGFVDERGLYKSLRGSCKLKLCGVLGLRLMDGTW
VAMQTSNETKWCSPDQLVNLHDFHSDEIEQNVVEELVKKRPECLDALESNMTTKTVSFRRLSHLRKLVPG
FGKAYTIINKTLMEAEAHYKSVRTWNEIVPSKGCLRVEGRCHPHVNGVFFNGIILGPDGHVLIPEMQSSL
LQQHMELLESSVIPLMHPLADPSTVFKEGDEAEDFVEVHFPDVHKKVSEVDLGLPNWGEYVLLSAGTLIA
LMLIIFLMICRRRVNRPESTQRSLRGTEMKVSVTPQSGKFKSSWESYKSGDEARL</INSDSeq_seque
nce>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>21</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..21</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q3">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>RabV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>ggatgaaagaggcctgtataa</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="4">
<INSDSeq>
<INSDSeq_length>19</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..19</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q4">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>RabV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gactctagtgcatccagac</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---


Изобретение относится к ветеринарной вирусологии. Описан способ молекулярной диагностики, а именно к дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов и применением асимметричного красителя SYBR Green. Основными преимуществами предлагаемого изобретения является возможность проводить за короткий промежуток времени - 2,5 ч - дифференциацию генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства с помощью разработанного способа. Изобретение характеризуется аналитической специфичностью, равной 100%, в 95%-ном доверительном интервале диагностическая чувствительность для данного способа составляет 98,74-100,00%, диагностическая специфичность - 98,84-100,0%. 3 з.п. ф-лы, 3 ил., 5 табл., 3 пр.
1. Способ дифференциации генома вакцинного штамма «ВНИИЗЖ» вируса бешенства от полевых изолятов вируса бешенства методом полимеразной цепной реакции в режиме реального времени с анализом пиков температур плавления ампликонов, включающий применение асимметричного красителя SYBR Green и олигонуклеотидных праймеров со следующим дизайном: RabV-Diff-ARRIAH-F4002-праймер с дизайном 5'-GGATGAAAGAGGCCTGTATAA-3' и RabV-Diff-ARRIAH-R4238-праймер с дизайном 5'-GACTCTAGTGCATCCAGAC-3', содержащий следующие этапы:
- элюирование РНК из положительного и отрицательного контролей и исследуемых проб;
- проведение обратной транскрипции и ПЦР в режиме реального времени с олигонуклеотидными праймерами и асимметричным красителем SYBR Green;
- осуществление плавления полученных ампликонов в диапазоне температур с 65 до 90°С для анализа графиков детекции пика температур плавления;
- проведение дифференциации генома вакцинного штамма «ВНИИЗЖ» от полевых изолятов вируса бешенства по пикам температур плавления ампликонов, предполагающим, что максимум температуры плавления фрагмента кДНК размером 237 п.н. в пределах 4002…4238 п.н. составляет значения 73,90±0,02°С, что соответствует вакцинному штамму «ВНИИЗЖ»; для полевых изолятов вируса бешенства данный параметр имеет значения 73,20±0,05°С.
2. Способ по п. 1, где идентифицируют следующие области с уникальными заменами нуклеотидов в вакцинном штамме «ВНИИЗЖ» вируса бешенства: 4037 п.н. - замена Т на С, 4058 п.н. - замена А на G, 4086 п.н. - замена С на А, парная замена в позициях 4194-4195 - ТТ на GG.
3. Способ по п. 1, где аналитическая специфичность составляет 100%, диагностическая чувствительность в 95%-ном доверительном интервале - 98,74-100,00%, диагностическая специфичность - 98,84-100,0%.
4. Способ по п. 1, где дифференциацию осуществляют за 2,5 ч.
| Crossley BM, Bai J, Glaser A, Maes R, Porter E, Killian ML, Clement T, Toohey-Kurth K | |||
| Guidelines for Sanger sequencing and molecular assay monitoring | |||
| J Vet Diagn Invest | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| НАБОР СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ ДЛЯ ВЫЯВЛЕНИЯ РНК ВИРУСА БЕШЕНСТВА И СПОСОБ ВЫЯВЛЕНИЯ РНК ВИРУСА БЕШЕНСТВА С ПОМОЩЬЮ СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ В ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ С ОБРАТНОЙ ТРАНСКРИПЦИЕЙ (ОТ-ПЦР) | 2014 |
|
RU2575088C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ФИКСИРОВАННОГО ВИРУСА БЕШЕНСТВА ШТАММА "МОСКВА 3253" | 2012 |
|
RU2511440C2 |
| WO 2019051318 A1, 14.03.2019. | |||
Авторы
Даты
2024-06-28—Публикация
2023-08-28—Подача