Изобретение относится к области ветеринарной вирусологии и биотехнологии, в частности, созданию тест-системы для определения титра антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018» с помощью жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА.
Вирус ящура является представителем рода Aphthovirus семейства Picornaviridae и имеет 7 различных серотипов: О, А, Азия-1, С, SAT-1, SAT-2, SAT-3. Вирион представляет собой частицу с коэффициентом седиментации 146S, состоящую из одноцепочечного позитивного генома в виде РНК и 60 копий каждого из четырех структурных белков (VP1 [1D-ген], VP2 [1B-ген], VP3 [1С-ген] и VP4 [1А-ген]) [1]. Каждый серотип генетически разделен на различные топотипы, генетические линии и сублинии. Различия между ними определяют при анализе нуклеотидной последовательности 1D-гена (белок VP1), который характеризуется высокой геномной и антигенной вариабельностью.
В пределах семи серотипов были описаны более 60 генетических линий и сублиний. Антитела против одного серотипа не обеспечивают иммунную защиту против другого серотипа и даже многих других генетических линий [2].
Белок VP1 является наиболее вариабельным, поскольку на него приходится около 90% мутаций всех структурных генов. Самыми вариабельными областями являются участки 40-60, 130-160 и 190-213 а.о. [3]. Участок поверхностного белка VP1 в регионе 130-160 а.о. отличается высокой вариабельностью, поскольку участвует в процессе связывания с рецепторами клетки-хозяина [4]. Изменчивость данного региона дает возможность вирусу ящура взаимодействовать с рецепторами клеток разных типов и облегчает переход от одного вида хозяина к другому. Серотипы вируса ящура в среднем на 86% имеют идентичные последовательностей, хотя VP1 значительно более вариабелен. Нуклеотидные последовательности кодирующей области VP1 используются для генетической характеристики штаммов ящура из-за их значимости для прикрепления и проникновения вируса в клетку, защитного иммунитета и специфичности серотипа. Филогенетический анализ на основе последовательности VP1 широко используется для вывода эволюционной динамики, эпидемиологических отношений между генетическими линиями и для отслеживания происхождения и перемещения штаммов вируса ящура [5].
По данным WRLFMD [6] в серотип Азия-1 вируса ящура входят 1 топотип ASIA, включающий в себя 8 охарактеризованных генетических линий и некоторые изоляты, которые в настоящее время еще не отнесли ни к одной линии. Подразделения на сублинии не отмечается в настоящее время. В топотип ASIA входят следующие генетические линии: G-I, G-II, G-III, G-IV, G-V, G-VI, G-VIII, Sindh-08.
Основной стратегией, принятой мировым сообществом против ящура, является обязательная массовая вакцинация сельскохозяйственных животных [7]. Известно, что эффективность кампаний вакцинации зависит, среди прочего, от многих факторов, таких как эффективность вакцины, стратегия вакцинации и охват вакцинацией. Из-за размера и территориальной неоднородности многих стран, а также масштабов поголовья сельскохозяйственных животных кампании вакцинации против ящура столкнулись с рядом оперативных проблем. При этом абсолютно всеми доказано, что единственным способом профилактики ящура является массовая вакцинация против того генотипа ящура, который циркулирует в рассматриваемом регионе. Важным аспектом контроля проведенной вакцинации является исследование наличия и определение титра поствакцинальных антител у животных с помощью серологических методов, одними из которых являются реакция микронейтрализации (РМН) и ИФА [8].
На территории Российской Федерации вспышки ящура имеют спорадический характер и вызваны заносом возбудителя с территории сопредельных стран. Регионы РФ, граничащие с Китаем, Монголией, Азербайджаном и Грузией подвержены очень высокой степени риска заноса ящура. Очень важны также в этом отношения транспортные связи на юге России со странами Ближнего Востока [9].
Известны производственные штаммы вируса ящура серотипа Азия-1, которые применялись для специфической профилактики ящура на территории России:
- штамм вируса ящура «Азия-1 №2145/Таджикистан/2011»,
- штамм вируса ящура «Азия-1 №1987/Амурский/2005»
- штамм вируса ящура «Азия-1 №1946/ Шамир 3/89».
В ФГБУ «ВНИИЗЖ» в 2018 г. из проб патологического материала от крупного рогатого скота, отобранных на территории Пакистана, был выделен изолят вируса ящура типа Азия-1.
По результатам сравнительного анализа нуклеотидных последовательностей выделенный изолят принадлежит к топотипу ASIA, генетической линии Sindh-08 вируса ящура серотипа Азия-1, который значительно отличается от производственных штаммов вируса ящура серотипа Азия-1 (фиг. 1).
Учитывая интенсивные торговые связи между Российской Федерацией и странами Западной и Центральной Азии, вероятность риска заноса ящура на территорию нашей страны остается очень высокой. Возникла задача провести исследования по изучению биологических свойств данного штамма и применить его для изготовления чувствительных и высокоспецифичных диагностических тест-систем и высоко иммуногенных вакцинных препаратов.
Изолят, послуживший источником для получения штамма «Азия-1 №2356/14/2018» вируса ящура, был выделен в 2018 году от больных ящуром КРС на территории Пакистана. Производственный штамм «Азия-1 №2356/14/2018» вируса ящура получен путем последовательных пассажей на чувствительных гетеро- и гомологичных культурах клеток.
В настоящее время в качестве производственного штамма вируса ящура генотипа Asia-1/ASIA/Sindh-08 применяют данный штамм - «Азия-1 №2356/14/2018», который имеет высокое нуклеотидное и аминокислотное родство со всеми штаммами и изолятами данного генотипа, которые циркулируют в мире (фиг. 1).
Штамм «Азия-1 №2356/14/2018» вируса ящура депонирован во Всероссийской государственной коллекции экзотических типов вирусов ящура и других патогенов животных (ГКШМ) ФГБУ «ВНИИЗЖ» под регистрационным номером: №176 - деп / 19-66 - ГКШМ ФГБУ «ВНИИЗЖ».
Экспериментально подтверждена возможность использования штамма «Азия-1 №2356/14/2018» вируса ящура для изготовления средств диагностики и профилактики ящура генотипа Asia-1/ASIA/Sindh-08.
Филогенетическое дерево выведено с использованием программы MEGA и алгоритма Neighbor-Joining. Процент повторяющихся ветвей, в которых связанные таксоны сгруппированы вместе в тесте начальной загрузки (100 повторов), показан рядом с ветвями. Эволюционные расстояния были рассчитаны с использованием метода Maximum Composite Likelihood и выражены в единицах количества замен оснований на сайт. Этот анализ включал 24 нуклеотидных последовательностей. Все позиции, содержащие пробелы и отсутствующие данные, были удалены (вариант полного удаления). В окончательном наборе данных было всего 633 позиций. Эволюционный анализ проводился в MEGA X.
В связи с циркуляцией вируса ящура генотипа Asia-1/ASIA/Sindh-08 и необходимостью защиты животных от него в ФГБУ «ВНИИЗЖ» разработали вакцину, в состав которой входит антиген вируса ящура данного штамма.
Возникла необходимость создания диагностической тест-системы для определения титра антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018» с помощью жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА.
Защита от ящура после вакцинации оценивается количеством специфических антител в сыворотке крови животных [10, 11]. Уровень гуморального иммунитета вакцинированного поголовья определяется путем выявления антител, специфичных к структурным белкам вируса ящура. В соответствии с рекомендациями МЭБ (OIE) [8], для определения иммунного статуса животных применяют реакцию РМН и ИФА.
РМН считается чувствительной и специфичной, однако проведение анализа имеет ряд следующих ограничений: 1) большая продолжительность времени постановки реакции (не менее 72 ч), 2) высокая себестоимость процедуры, связанная с применением чувствительной клеточной линии, CO2-инкубатора и другого оборудования, 3) использование неинактивированного вируса ящура, который является биологическим агентом II группы опасности и предполагает проведение работ только в лабораториях уровня BSL-3.
В свою очередь, ИФА обладает многими преимуществами, включая экспрессность, высокую специфичность и чувствительность, пригодность для крупномасштабного скрининга полевых образцов и отсутствие требований к специальным лабораторным условиям, например, культуре клеток или среде углекислого газа, а также не предполагает проведение работ с микроорганизмами повышенного уровня опасности [12]. Исходя из этого, ИФА целесообразно применять для определения титра антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018».
Особым вариантом проведения ИФА является «сэндвич»-вариант, который обычно предполагает применение пар подобранных антител, где каждое антитело специфично для другого, неперекрывающегося эпитопа антигена. Первые антитела принято называть сенсибилизирующими и предназначены они для захвата антигена. Вторые антитела - детекторные, необходимы для обнаружения антигена. Указанный вариант ИФА имеет следующие преимущества: 1) высокая специфичность реакции; 2) подходит для скринингового анализа полевых образцов разной степени очистки; 3) высокая чувствительность реакции [13].
Отдельное место среди вариантов ИФА отводится жидкофазному блокирующему непрямому «сэндвич»-варианту ИФА, который характеризуется рядом преимуществ:
1) данный анализ максимально приближен к классической реакции нейтрализации, поскольку формирование иммунного комплекса происходит в жидкой фазе как наиболее естественных условиях;
2) эпитопы антигена наиболее доступны в пространстве для специфичных антител, что позволяет повысить чувствительность и специфичность реакции [14].
Sharma G.K. и др. (2015) предложили тест-систему для выявления антител против вируса ящура типов А, О, Азия-1 с помощью жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА [15]. Данная методика позволяла идентифицировать широкий спектр противоящурных антител, но при этом специфичность по отношению к антигену вируса ящура генотипа Asia-1/ASIA/Sindh-08 не более 48%, а, следовательно, точное выявление иммуноглобулинов G не представляется возможным. Авторы тест-системы применяли моноклональные антитела, использование которых увеличивало спектр выявления различных генотипов вируса ящура в рамках одного серотипа, но при этом существенно снижалась специфичность относительно выявления антител против изолятов/штаммов конкретного генотипа, в частности генотипа Asia-1/ASIA/Sindh-08.
Указанная выше тест-система не представлена на рынке в качестве наборов для детекции противоящурных антител в сыворотках крови животных и остается в качестве недоступной для широкого потребителя. В свою очередь, на мировом рынке в настоящее время имеются европейские наборы для детекции антител против вируса ящура серотипа Asia-1 - IZSLER (Италия) и PrioCHECK (Нидерланды).
Тест-система в наборе IZSLER предназначена для детекции противоящурных антител с помощью твердофазного прямого «сэндвич»-варианта ИФА [16]. Достоинством данного набора является применение моноклональных антител, однако они были получены гораздо раньше 2018 года (период, когда появился производственный штамм «Азия-1 №2356/14/2018») и не могут с высокой достоверностью и точностью детектировать специфические антитела в сыворотках крови животных. Специфичность и чувствительность указанной тест-системы для выявления антител против вируса ящура генотипа Asia-1/ASIA/Sindh-08 ниже 45%, что подтверждают данные РМН. Таким образом, тест-система IZSLER на серотип Азия-1 не позволяет получать достоверных результатов в отношении изолятов и штаммов вируса ящура широко распространенного в Азии и Ближнего Востока генотипа Asia-1/ASIA/Sindh-08.
Наиболее близким прототипом для разработанной нами тест-системы является тест-система PrioCHECK (Prionics Lelystad B.V., Netherlands) для выявления антител к антигену вирусу ящура серотипа Азия-1 [17].
Комплектующие для соответствующего набора представлены ниже:
Компонент 1 - Планшеты иммунологические.
Компонент 2 - Конъюгат (30х). Разбавленный конъюгат не стабилен, готовят непосредственно перед применением.
Компонент 3 - Буфер для разведения (5х).
Компонент 4 - Неиммунная сыворотка крови лошади.
Компонент 5 - Деминерализованная вода.
Компонент 6 - Промывочный буфер (200х).
Компонент 7 - Референтная сыворотка 1 (позитивная) (жидкая).
Компонент 8 - Референтная сыворотка 2 (менее позитивная) (жидкая).
Компонент 9 - Референтная сыворотка 3 (еще менее позитивная) (жидкая).
Компонент 10 - Референтная сыворотка 4 (отрицательный контроль) (жидкая).
Компонент 11 - Субстрат хромогена (ТМВ).
Компонент 12 - Стоп-раствор (1 N раствор серной кислоты). Данные отражены в инструкции производителя.
Тест-система PrioCHECK включает в себя конъюгат, который представляет собой меченые моноклональные антитела против вируса ящура серотипа Азия-1, исходя из этого является типоспецифичной, но без более узкой дифференциации. Прототипная тест-система разработана была еще в конце 90-гг XX в. В ней применяются антитела против антигенов вируса ящура различных генотипов серотипа Азия-1, кроме появившихся позднее, в частности штамма «Азия-1 №2356/14/2018». Изоляты и штаммы данной линии имеют существенные отличия от других линий серотипа Азия-1 (фиг. 1). Анализируя нуклеотидную и аминокислотную последовательность высоко вариабельного белка VP1 вируса ящура, ученые пришли к выводу о наличии достаточного количества существенных замен, позволяющих отнести вирус к иному генотипу.
Исходя из выше представленного, прототипная тест-система не является высокочувствительной и специфичной по отношению к вирусу ящура генотипа Asia-1/ASIA/Sindh-08. Данная тест-система выявляет антитела к антигену вируса ящура указанного генотипа не более, чем на 48%. Исходя из этого требуется разработать чувствительную, специфичную тест-систему для определения титра антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018» с помощью жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА.
Прототипная тест-система основана на твердофазном конкурентном «сэндвич»-варианте ИФА [17], однако эта форма отдалена по своей чувствительности и специфичности от РМН относительно возможностей улавливания антигенных сайтов по сравнению с жидкофазным блокирующим непрямым «сэндвич»-вариантом ИФА.
Прототипный вариант предполагает наличие в своем составе контрольных сывороток крови животных в жидком виде, что снижает сохранность компонентов тест-системы в течение длительного периода времени и создает риски контаминации микроорганизмами.
Для прототипного варианта рабочий раствор конъюгата, который используется в процессе анализа, не стабилен и быстро разрушается. В составе набора он представлен в виде 30-кратного концентрата. В таком состоянии в отличии от лиофилизированного компонента срок хранения заметно сокращается.
В прототипной тест-системе применяется прямой конъюгат, что удобно в применении, однако при этом повышается вероятность шумовых фоновых явлений, что может негативно отражаться на конечных результатах определения титра антител.
Учитывая найденные ограничения в применении имеющихся тест-систем, в том числе прототипной, для проведения точного количественного анализа уровня гуморального иммунитета животных после инокуляции противоящурными вакцинами, содержащими инактивированный вирус ящура штамма «Азия-1 №2356/14/2018», актуальной является разработка тест-системы для определения титра антител против структурных белков вируса ящура указанного штамма с помощью жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА с учетом приведенных выше недостатков.
В РФ на сегодняшний день существует тест-система на основе жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА для определения титра антител против вируса ящура штамма «А №2269/ВНИИЗЖ/2015» генотипа A/ASIA/G-VII в сыворотках крови животных после иммунизации [18].
При этом в мире не запатентована тест-система на основе жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА, которая позволила бы с высокой достоверностью количественно определять титр антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018».
Целью изобретения является создание тест-системы для определения титра антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018» с помощью жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА.
Поставленная цель достигается тем, что предлагаемая тест-система содержит следующие лиофильно высушенные иммуноспецифические компоненты с высокой степенью активности:
1) культуральный инактивированный лиофилизированный вирус ящура штамма «Азия-1 №2356/14/2018»;
2) сенсибилизирующие антитела - иммуноглобулины G кролика против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018»;
3) детекторные антитела - иммуноглобулины G морской свинки против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018»;
4) контроль 1 (сильноположительный контроль) - положительная сыворотка крови телят к антигену вируса ящура штамма «Азия-1 №2356/14/2018» с процентом ингибиции 80-100%;
5) контроль 2 (положительный контроль) - положительная сыворотка крови телят к антигену вируса ящура штамма «Азия-1 №2356/14/2018» с процентом ингибиции от 50,0% до 79,9%;
6) контроль 3 (отрицательный контроль) - сыворотка крови телят, не содержащая антитела к антигену вирусу ящура;
7) фетальная сыворотка крови;
8) антивидовой конъюгат - иммуноглобулины кролика против Ig G морской свинки, конъюгированные с пероксидазой хрена.
Предлагаемая тест-система содержит неспецифические компоненты: карбонатно-бикарбонатный буферный раствор (КББР) (рН 9,5-9,7), 20-кратный концентрат буферного раствора, хромогенный субстрат - AzBTS-диаммоний (diammonium 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonate), «стоп»-раствор - 1,0%-ный раствор лаурилсульфата натрия (SLS).
Цель достигается благодаря тому, что метод жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА наиболее приближен к классической РМН в культуре клеток IB-RS-2, поскольку все антигенные сайты полных частиц вируса ящура штамма «Азия-1 №2356/14/2018» находятся в свободном состоянии в жидкой фазе, открыты для связывания со специфическими сенсибилизирующими и детекторными антителами. Реакция основана на взаимодействии иммуноглобулинов G исследуемой сыворотки крови животного и инактивированного вируса ящура штамма «Азия-1 №2356/14/2018» в жидкой фазе с образованием иммунных комплексов. Параллельно с этим проводится сенсибилизация лунок плоскодонного планшета антителами кролика против вируса ящура того же штамма.
Сенсибилизированные лунки подвергают обработке с помощью фетальной сыворотки крови, добавляют полученные иммунные комплексы из круглодонного планшета, инкубируют, вносят восстановленную из лиофильного высушенного состояния суспензию детекторных антител. Образовавшийся сложный иммунный комплекс выявляют с помощью антител против иммуноглобулинов G морской свинки, конъюгированных с пероксидазой хрена и хромогенного субстрата.
Технический результат от изобретения заключается в разработке современной, специфической против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018» и чувствительной тест-системы, предназначенной для определения антител против указанного антигена методом жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА на основе применения антигена вируса ящура штамма «Азия-1 №2356/14/2018» и при получении иммуноспецифических компонентов реакции.
В отличии от прототипа в разработанной тест-системе применяется культуральный концентрированный в 500 раз инактивированный вирус ящура штамма «Азия-1 №2356/14/2018», который представлен в виде лиофильно высушенной суспензии. Данный факт дает возможность количественно определять гуморальный иммунитет против структурных белков вируса ящура указанного штамма с высокими показателями чувствительности (более 99%) и специфичности (100%), что более чем на 52% выше по сравнению с наиболее близким прототипом. Кроме того, лиофилизированный компонент остается стабильным не менее 4 лет по сравнению с антигеном в нативном состоянии, что является преимуществом в использовании данной тест-системы. Активность полученного антигена вируса ящура штамма «Азия-1 №2356/14/2018» составляет 1:3000.
В отличии от прототипа применяются сенсибилизирующие и детекторные антитела кролика и морской свинки, соответственно, высокоспецифичные по отношению к структурным белкам, представляющим собой антиген, вируса ящура штамма «Азия-1 №2356/14/2018». Указанные в тест-системе ИФА иммуноглобулины G кролика и морской свинки против указанного штамма вируса ящура получены в виде лиофильного компонента, что позволяет JgG находится в стабильном состоянии не менее 4 лет с активностью не менее 1:10000 и 1:4000, соответственно.
В отличии от прототипа сыворотки крови телят, сильно положительный и положительный контроли получены против высокоочищенного концентрированного инактивированного вируса ящура штамма «Азия-1 №2356/14/2018», что позволяет достичь высокой специфичности и чувствительности при контроле работы тест-системы. Указанные компоненты представлены в виде лиофильно высушенных суспензий, что позволяет хранить их не менее 4 лет с сохранением высокой активности в ИФА. Для контроля 1 активность составляет не менее 1:5000, для контроля 2 - не менее 1:5000. Активность компонентов высокая, что позволяет экономно расходовать компоненты реакции.
В отличии от прототипа для блокирования открытых сайтов связывания применяется очищенная фетальная сыворотка телят, белковые составляющие которой обеспечивают полное закрытие пустых участков на дне иммунологического планшета. Данный компонент также представлен в лиофильном виде, что позволяет хранить его в данном состоянии не менее 4 лет.
В отличии от прототипного варианта представленная тест-система предусматривает контроль антигена и конъюгата, что дает возможность учитывать фоновые значения и, тем самым, получать достоверные данные по значениям оптической плотности и титру антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018».
В отличии от прототипа в предложенной тест-системе применяются антитела кроличьи к иммуноглобулину G морской свинки H&L (HRP), что позволяет повышать специфичность анализа и получать более достоверные результаты определения титра антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018» в сыворотках крови животных. Активность конъюгата составляет 1:4000.
Разработанная тест-система основана на специфическом блокировании антигена (структурных белков) вируса ящура штамма «Азия-1 №2356/14/2018» антителами, содержащимися в исследуемой пробе сыворотки в жидкой фазе. Смесь «исследуемая сыворотка/антиген» переносится в лунки планшета, предварительно иммобилизованного сенсибилизирующими антителами кролика против штамма «Азия-1 №2356/14/2018». Наличие антител к структурным белкам вируса ящура данного генотипа в исследуемой пробе будет выражаться в формировании иммунного комплекса и уменьшении количества свободного антигена, который связывается сенсибилизирующими антителами. Фиксированный в лунках антиген взаимодействует с детекторными антителами морской свинки, которые выявляются в реакции с иммунопероксидазным конъюгатом против иммуноглобулинов G морской свинки и последующим окрашиванием с помощью хромогенного субстрата. Интенсивность окрашивания обратно пропорциональна титру антител. Интенсивность цветной реакции учитывают с помощью спектрофотометра.
Сущность изобретения отражена на графических изображениях:
Фиг. 1 - Филогенетическая принадлежность штамма «Азия-1 №2356/14/2018» вируса ящура.
Фиг. 2 - Седиментационный профиль фракций антигена вируса ящура штамма «Азия-1 №2356/14/2018».
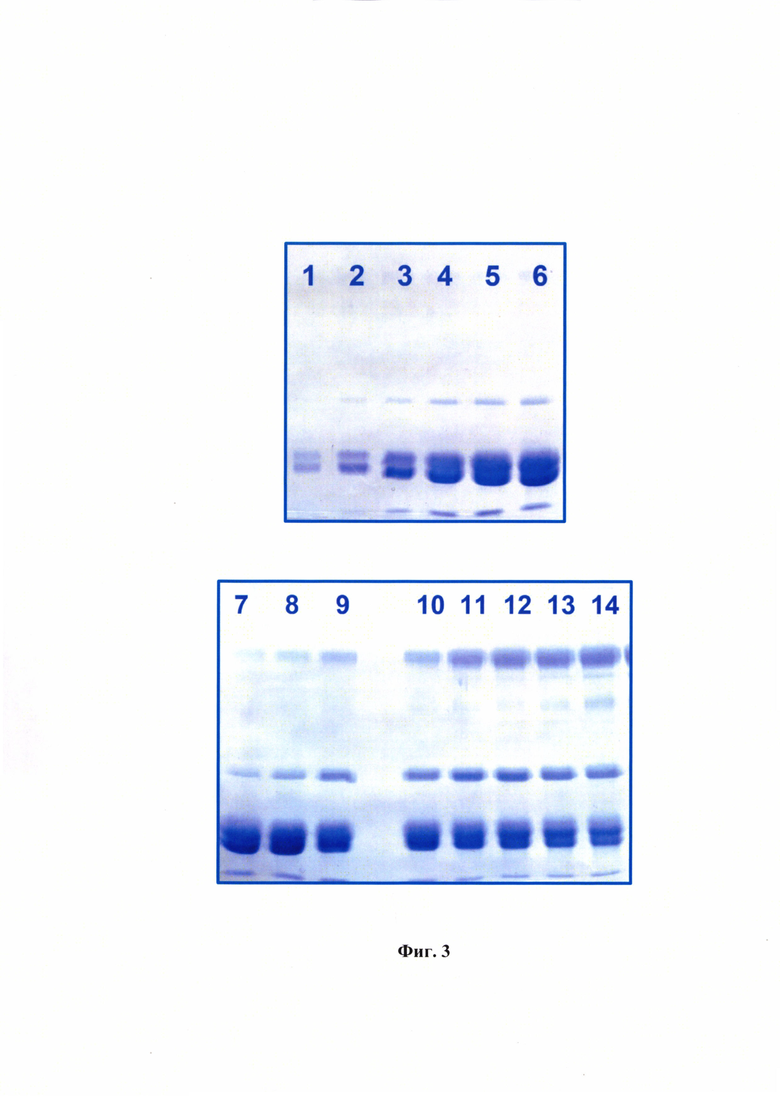
Фиг. 3 - Электрофореграмма для антигена вируса ящура штамма «Азия-1 №2356/14/2018» в 12% полиакриламидном геле. Примечание: 1 - фракция с 50% сахарозы, 2-6 - фракции с 40% сахарозы, 7-11 - фракции с 30% сахарозы, 12-14 -фракции с 20% сахарозы.
Сущность изобретения пояснена в перечне последовательностей, в котором:
SEQ ID NO: 1 представляет последовательность нуклеотидов гена, кодирующего белок VP1 штамма «Азия-1 №2356/14/2018» вируса ящура;
SEQ ID NO: 2 представляет последовательность аминокислот белка VP1 штамма «Азия-1 №2356/14/2018»вируса ящура.
На подготовительном этапе исследования лиофилизированные иммуноспецифические компоненты тест-системы (антиген вируса ящура штамма «Азия-1 №2356/14/2018», иммунопероксидазный конъюгат, положительные и отрицательный контроли, сенсибилизирующие и детекторные антитела) восстанавливают до необходимого объема деионизированной водой.
Проводят приготовление рабочих растворов.
Раствор №1 (КББР). Готовят по стандартной методике 50 мл раствора с водородным показателем 9,5-9,7.
Раствор №2 (Wash-раствор). Готовят 2 л стандартного буферного раствора TBS с добавлением 0,1% tween-20 с водородным показателем 7,5-7,6. Рабочий Wash-раствор готовят разведением концентрата в 20 раз.
Раствор №3 (буфер для восстановления антител и конъюгата). Рабочий буферный раствор для разведения антител и иммунопероксидазного конъюгата готовится непосредственно перед использованием из рабочего Wash-раствора с добавлением 10% фетальной сыворотки телят.
Этапы проведения жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА для определения титра антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018» представлены ниже.
1. Иммобилизация сенсибилизирующих антител против структурных белков вируса ящура. Восстановленную суспензию сенсибилизирующих антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018» готовят в разведении 1:10 000 в КББР (раствор №1). Во все лунки иммунологического 96-луночного планшета вносят по 100 мкл суспензии данных антител, накрывают крышкой и инкубируют в течение 18-20 ч при температуре (2-4)°С.
2. Промывание лунок планшета осуществляют с использованием Wash-раствора 2 раза.
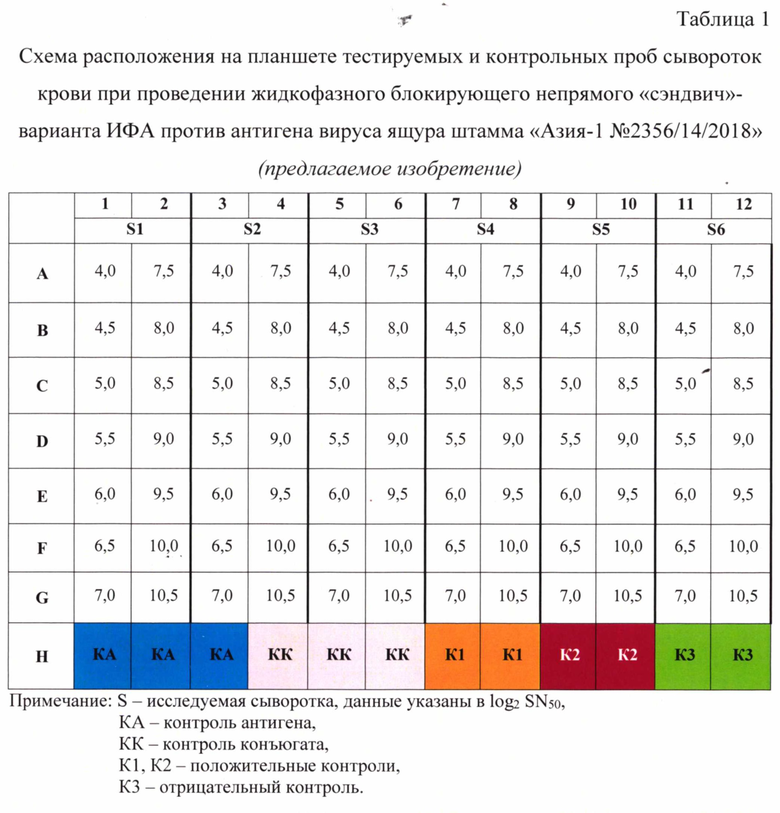
3. Образование иммунного комплекса в жидкой фазе. Параллельно с иммобилизацией планшета проводят серологическую реакцию связывания антигена с испытуемыми и контрольными пробами сыворотки крови животных. Готовят следующие разведения сывороток крови животных: 4,0; 4,5; 5,0; 5,5; 6,0; 6,5; 7,0; 7,5; 8,0; 8,5; 9,0; 9,5; 10,0; 10,5 log2 SN50 (1:16-1:1448) в растворе №2. Для этого во все лунки планшета за исключением лунок Н1-6, которые оставляют для контроля антигена (КА) и контроля конъюгата (КК), вносят по 0,047 см3 (47 мкл) буферного раствора и 0,003 см3 (3 мкл) пробы. В лунки HI-6 вносят по 0,05 см3 (50 мкл) буферного раствора. Испытуемые и контрольные пробы располагают на планшете согласно таблице 1. Положительной считается сыворотка при титре антител ≥ 5,0 log2 SN50 (≥1:32).
В качестве контроля 1 используют сильно положительную сыворотку крови КРС/свиней против вируса ящура штамма «Азия-1 №2356/14/2018» - процент ингибиции (PI) 80-100%, контроля 2 - положительную сыворотку крови КРС/свиней против вируса ящура штамма «Азия-1 №2356/14/2018» - PI=50,0-79,9%, контроля 3 - нормальную сыворотку КРС/свиней - PI<50%.
Во все лунки планшета добавляют по 0,05 см3 рабочего разведения антигена в растворе №2 в соответствии с разведением 1:3000. После перемешивания содержимого лунок планшета проводят в течение 1 часа при температуре (2-4)°С.
4. Улавливание антигена. В промытые лунки иммобилизованного планшета вносят по 0,05 см3 смеси контрольных и испытуемых проб и антигена, планшет закрывают крышкой и инкубируют в течение 60±2 мин при температуре (37±1)°С.
5. Промывание лунок планшета. Проводят, как представлено выше (п. 2). Процедуру повторяют 3 раза.
6. Внесение детекторных антител. Во все лунки планшета, за исключением лунок с КК (контроль конъюгата), куда добавляют по 0,05 см3 раствора №3, вносят по 0,05 см3 рабочего разведения детекторных антител (1:4000) в растворе №3. Планшет накрывают крышкой и инкубируют в течение 60±2 мин при температуре (37±1)°С.
7. Промывание лунок планшета. Проводят, как представлено выше (п. 2). Процедуру повторяют 3 раза.
8. Внесение конъюгата. Во все лунки планшета вносят по 0,05 см3 рабочего разведения конъюгата (1:4000) в растворе №3. Планшет накрывают крышкой и инкубируют в течение 60±2 мин при температуре (37±1)°С.
9. Промывание лунок планшета. Проводят, как представлено выше (п. 2). Процедуру повторяют 4 раза.
10. Проявление цветной реакции. Во все лунки планшета вносят по 0,05 см3 хромогенного субстрата AzBTS-диаммоний, закрывают крышкой и выдерживают 15-20 минут при температуре (20±2)°С.
11. Торможение реакции. Реакцию останавливают добавлением в каждую лунку планшета 0,05 см3 1,0%-ного раствора SLS.
12. Определение значения молярной экстинкции и титра антител по данным ИФА. Результаты анализа учитывают инструментальным способом. Сразу после остановки реакции измеряют молярную экстинкцию (ε(λ)) продуктов реакции в каждой лунке при длине волны 420 нм, используя спектрофотометр для микропланшетов с вертикальным лучом света. Значения ε(λ) переводят в значение процента ингибиции (PI, %) по формуле:
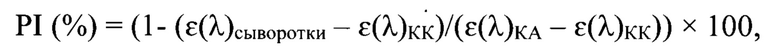
где  - среднее значение оптической плотности смеси сыворотки с инактивированным вирусом ящура штамма «Азия-1 №2356/14/2018»;
- среднее значение оптической плотности смеси сыворотки с инактивированным вирусом ящура штамма «Азия-1 №2356/14/2018»;
 - среднее значение оптической плотности контроля антигена;
- среднее значение оптической плотности контроля антигена;
 - среднее значение оптической плотности контроля конъюгата.
- среднее значение оптической плотности контроля конъюгата.
Достоверность проводимого анализа с помощью предложенной тест-системы определяется при удовлетворении следующим критериям:
- разница между значениями  и
и 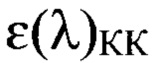 не менее 0,4 оптических единиц (о.е.);
не менее 0,4 оптических единиц (о.е.);
- контроль 1 имеет значение PI>75%;
- контроль 2 имеет значение PI в пределах 50,0-74,9%;
- контроль 3 имеет значение PI<50%.
Сыворотки крови, для которых значение PI≥50%, считают положительными и содержащими антитела к структурным белкам вируса ящура штамма «Азия-1 №2356/14/2018». Значение PI<50% в сыворотке крови обследуемых животных является отрицательным. Исходя из полученных данных берут последнее разведение сыворотки, для которого процент ингибиции составляет ≥ 50%. Данное разведение считают титром антител против ящура, вызванного вирусом ящура штамма «Азия-1 №2356/14/2018» и выражают в log2SN50.
В результате проведенных экспериментов были оттитрованы оригинальные компоненты реакции. Активность детекторных антител в ИФА составила 1:4000, сенсибилизирующих антител - 1:10000, антивидового конъюгата - 1:4000; антигена вируса ящура штамма «Азия-1 №2356/14/2018» - 1:3000, контроля 1 - 1:5000, контроля 2 - 1:5000. С использованием разработанной тест-системы проведено исследование образцов сывороток крови животных с определением антител и проведен сравнительный анализ с результатами РМН в чувствительной перевиваемой монослойной клеточной линии почки свиньи (IB-RS-2) [8].
Разработанная тест-система дает возможность тестировать одновременно в формате одного 96-луночного планшета 6 проб сывороток в следующих разведениях, выраженных в двоичном логарифме: 4,0; 4,5; 5,0; 5,5; 6,0;.6,5; 7,0; 7,5; 8,0; 8,5; 9,0: 9,5; 10,0; 10,5 log2 SN50 (1:16-1:1448).
Для работы применяли антиген (структурные белки, 146S компонент) вируса ящура штамма «Азия-1 №2356/14/2018».
Контроль штамма «Азия-1 №2356/14/2018» вируса ящура на специфичность.
Специфичность штамма «Азия-1 №2356/14/2018» генотипа Asia-1/ASIA/Sindh-08 вируса ящура определена с помощью ОТ-ПЦР с последующим секвенированием 1D-гена, соответствующего белку VP1, в котором наиболее часто возникают мутации. По результатам исследования нуклеотидной последовательности указанного гена была выявлена принадлежность штамма «Азия-1 №2356/14/2018» к генотипу Asia-1/ASIA/Sindh-08. Расчет проводился в соответствии с Байесовской теорией вероятности. Специфичность подтверждена также в реакции связывания комплемента со штаммоспецифической сывороткой. Концентрация общего вирусного белка в исследуемом антигене вируса ящура штамма «Азия-1 №2356/14/2018» составила 3,95 мкг/мл, концентрация 146S компонента - 2,92 мкг/мл (74%), 146S+75S компонента - 3,79 мкг/мл (96%), 12 S частиц - 0,16 мкг/мл (4%). Экспериментально подтверждена возможность использования штамма «Азия-1 №2356/14/2018» генотипа Asia-1/ASIA/Sindh-08 вируса ящура для разработки диагностических тест-систем.
Морфологические признаки.
Штамм «Азия-1 №2356/14/2018» вируса ящура относится к семейству Picornaviridae, роду Aphthovirus, серотипу А, генотипу Asia-1/ASIA/Sindh-08 и обладает морфологическими признаками, характерными для возбудителя ящура: форма вириона икосаэдрическая, размер 25 нм. Вирион состоит из молекулы РНК, заключенной в белковую оболочку, которая состоит из 32 капсомеров с кубическим типом симметрии.
Антигенные свойства.
По своим антигенным свойствам штамм «Азия-1 №2356/14/2018» вируса ящура стабильно нейтрализуется гомологичной антисывороткой. У переболевших животных в сыворотке крови образуются антитела, выявляемые в ИФА и РМН.
При гипериммунизации морских свинок концентрированный антиген из инактивированного вируса ящура штамма «Азия-1 №2356/14/2018» индуцирует образование вирусоспецифических антител, выявляемых в РСК в разведении не менее 1:4000.
Антигенное родство штамма «Азия-1 №2356/14/2018» вируса ящура с имеющимися производственными штаммами вируса ящура серотипа Asia-1 исследовано серологическим методом в перекрестной РМН. Штамм «Азия-1 №2356/14/2018» антигенно отличается от производственных штаммов «Азия-1 №2145/Таджикистан/2011», «Азия-1 №1987/Амурский/2005», штамм вируса ящура «Азия-1 №1946/ Шамир 3/89».
Антигенное соответствие (r1) для штамма «Азия-1 №2145/Таджикистан/2011» составило 0,29, «Азия-1 №1987/Амурский/2005» - 0,29, «Азия-1 №1946/ Шамир 3/89» - 0,18. При значении r1≥0,3 полевой изолят и производственный штамм являются родственными, и вакцина из производственного штамма будет защищать от эпизоотического полевого вируса, при значении r1<0,3 полевой изолят отличается от производственного штамма, и вакцина из данного штамма не защищает от эпизоотического полевого вируса.
Биотехнологические характеристики.
Штамм «Азия-1 №2356/14/2018» репродуцируется в перевиваемых монослойных клеточных линиях почки сибирского горного козерога (ПСГК-30), почки свиньи IB-RS-2, почки новорожденного сирийского хомячка ВНК-21/SUSP/ARRIAH, и в течение 12-15 часов инкубирования вирус в указанных культурах клеток накапливается от 6,90 до 8,85 lg ТЦД50/см3.
Генотаксономическая характеристика.
Штамм «Азия-1 №2356/14/2018» вируса ящура серотипа Азия-1 является РНК (+) - содержащим вирусом. Нуклеиновая кислота представлена одноцепочной линейной молекулой с молекулярной массой 2,85×106 Да. Вирион имеет белковую оболочку, состоящую из четырех структурных белков VP1, VP2, VP3 и VP4.
Основным антигенным белком является VP1. В вирионе содержится приблизительно 31,5% РНК и 68,5% белка. Вирионная РНК является инфекционной и участвует в образовании белков-предшественников в инфицированных клетках. Предшественники расщепляются с образованием более стабильных структурных и неструктурных полипептидов. Из 8 неструктурных полипептидов, накапливающихся в инфицированных клетках, один является РНК-зависимой РНК-полимеразой, участвующей в репликации РНК новых вирионов.
Физические свойства.
Для данного вируса при константе седиментации полных вирусных частиц 146 S, константе диффузии 1,40 см2/с молекулярная масса составляет 8,08×106Д. Размер вириона 25 нм, масса составляет 8,42×10-18 г.
Устойчивость к внешним факторам.
Штамм «Азия-1 №2356/14/2018» устойчив к эфиру, хлороформу, ацетону и другим органическим растворителям и детергентам. Наиболее стабилен при рН 7,5-7,8. Сдвиги водородного показателя как в кислую, так и в щелочную сторону ведут к инактивации вируса. Вирусная частица чувствительна к формальдегиду, УФ-облучению, γ-облучению, высоким температурам.
Дополнительные признаки и свойства.
Иммуногенная активность - иммуногенен в составе инактивированной вакцины.
Антигенная активность - введение инактивированного вируса ящура штамма «Азия-1 №2356/14/2018» морским свинкам, кроликам, свиньям, овцам, КРС индуцирует образование вирусспецифических антител.
Реактогенность - реактогенными свойствами не обладает.
Патогенность - антиген не патогенен для парнокопытных животных, новорожденных мышат, морских свинок.
Вирулентность - антиген не вирулентен для естественно-восприимчивых животных при контактном, аэрозольном и парентеральном заражении.
Стабильность - не инактивированный вирус сохраняет исходные биологические свойства при культивировании в чувствительных биологических системах в течение 5 пассажей (срок наблюдения).
Сущность изобретения пояснена примерами его использования, которые не ограничивают объем изобретения.
Пример 1. Получение антигена вируса ящура штамма «Азия-1 №2356/14/2018».
Для получения антигена вируса ящура штамма «Азия-1 №2356/14/2018» для диагностических целей проводили суспензионное культивирование вируса в клеточной линии BHK-21/SUSP/ARPJAH в течение 8-9 ч с получением вирусной суспензии с титром инфекционной активности не ниже 6,5 lg ТЦД50/см3. Полученную вирусную суспензию инактивировали с помощью аминоэтилэтиленимина и осветляли полигексаметиленгуанидином.
Инактивированную культуральную суспензию, содержащую антиген вирус ящура, осветляли в течение 30 мин. при 6000 об/мин и 4°С. Надосадочную жидкость отбирали и добавляли в нее полиэтиленгликоль с молекулярным весом 6000 Д (ПЭГ-6000) до конечной концентрации 8,5% и хлорид натри (сухой) до конечной концентрации 0,85%, интенсивно перемешивали и выдерживали при температуре 2±1°С в течение 18-24 часов. Вирусную суспензию осаждали при 6000 об/мин в течение 60 мин., осадок растворяли в 1/15 М растворе фосфатно-солевого буфера, концентрируя в 500 раз (1/500 от первоначального объема).
К полученному преципитату добавляли 50% хлороформа, интенсивно перемешивали и фракционировали с помощью центрифуги в течение 30 мин. при 3000 об/мин. Отбирали верхнюю водную фракцию, содержащую антиген вируса ящура штамма «Азия-1 №2356/14/2018». Отбирали 100 мкл образца для последующего электрофоретического анализа в 12% полиакриламидном геле в денатурирующих условиях.
На следующем этапе проводили получение 146S частиц вируса ящура штамма «Азия-1 №2356/14/2018» (данный компонент является структурным, состоит из структурных белков вируса, является иммуногенным).
Для выделения полных частиц с коэффициентом седиментации 146S готовили линейный градиент сахарозы с концентрациями 50, 40, 30, 20% (по направлению слоев в центрифужной пробирке снизу вверх). Суспензию антигена вируса ящура штамма «Азия-1 №2356/14/2018» вносили по 15 мл в центрифужные пробирки, затем последовательно подслаивали растворы сахарозы, начиная с 20%-го и заканчивая 50%-м раствором. Пробирки помещали в металлические центрифужные стаканы и после тщательно выполненного уравновешивания центрифугировали при скорости 30000 об/мин и температуре 2±1°С в течение 4 часов. Фракционирование градиента сахарозы производили с помощью перистальтического насоса, отбирая фракции по 1,0 мл в отдельные пробирки. Начало и конец пика 146S компонента определяли по спектральному профилю на спектрограмме, объединяя фракции, входящие в этот диапазон.
При использовании перистальтического насоса сначала оценивали визуально пробирку с градиентом сахарозы. Опалесцирующий слой, содержащий 146S компонент, располагается приблизительно в 30%-м слое сахарозы. 146S компонент переосаждали с помощью ультрацентрифугирования в течение 4 часов при скорости 25000 об/мин. и температуре 2±1°С и ресуспендировали осадок в 1/15 М фосфатно-солевом буферном растворе.
Результаты спектрометрического исследования полученных фракций антигена вируса ящура штамма «Азия-1 №2356/14/2018» в виде антигенного профиля представлены на фиг. 2. Анализ проводили для 16 фракций, пики наблюдали для фракций №4-7. Проведен электрофорез полученных фракций в 12% полиакриламидном геле в денатурирующих условиях фракций, в которых возможно нахождение 146S компонента вируса ящура данного штамма (фиг. 3). Данные гель-электрофореза подтверждают результаты спектрального профиля.
Пример 2. Получение гипериммунной сыворотки крови кроликов (сенсибилизирующие антитела) против антигена вируса ящура штамма «Азия-1 №2356/14/2018».
Для получения специфических сывороток крови против вируса ящура штамма «Азия-1 №2356/14/2018» использовали клинически здоровых кроликов средней упитанности массой 2,5-3,0 кг.
Для гипериммунизации животных применяли концентрированный очищенный антиген вируса ящура штамма «Азия-1 №2356/14/2018», полученный как описано в примере 1, из которого готовили эмульсию с использованием масляного адъюванта Montanide ISA-201 R VG (в соотношении адъювант/антиген = 70/30 по массе). Полученную вакцину вводили в мышцу задних конечностей кролика на 0, 14 и 28 дни в объеме 0,5 см3. Через 7 дней после последней иммунизации у кроликов отбирали кровь, содержащую сенсибилизирующие антитела, которую лиофильно высушивали и хранили при температуре (1-3)°С.
Пример 3. Получение гипериммунной сыворотки крови морских свинок (детекторные антитела) против антигена вируса ящура штамма «Азия-1 №2356/14/2018».
Для гипериммунизации морских свинок использовали эмульсию очищенного препарата концентрированного антигена вируса ящура штамма «Азия-1 №2356/14/2018», полученного как описано в примере 1. Приготовление вакцины и схема иммунизации такая, как в примере 2.
Пример 4. Определение активности в ИФА антигена вируса ящура штамма «Азия-1 №2356/14/2018», сенсибилизирующих и детекторных антител к нему.
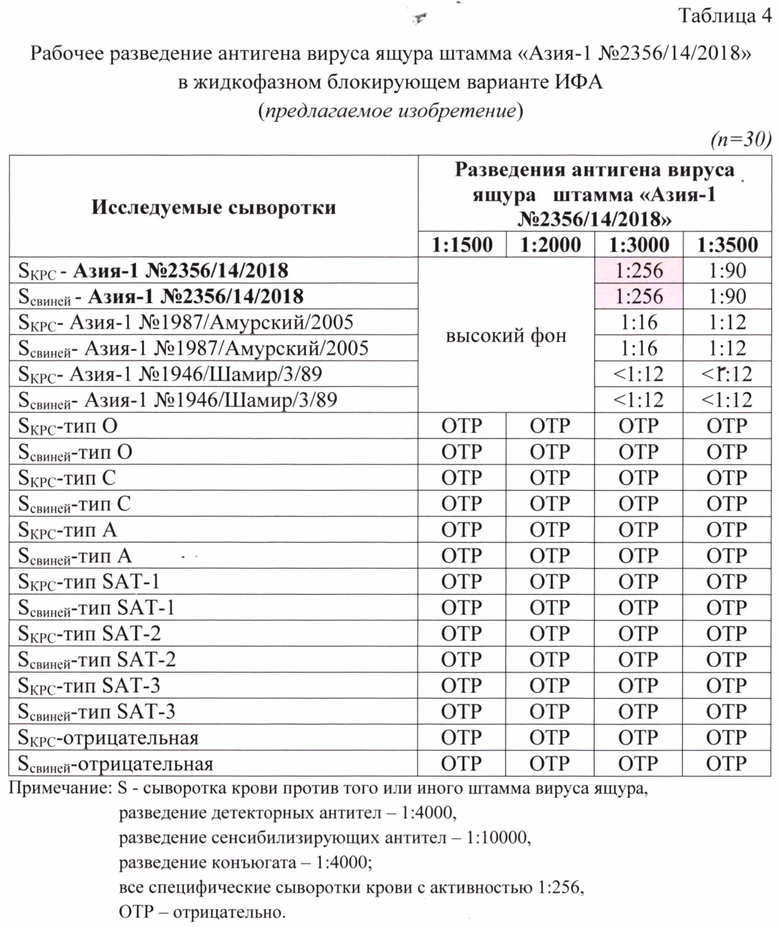
Образцы сывороток крови животных проверяли на активность и специфичность в жидкофазном блокирующем непрямом «сэндвич»-варианте ИФА. Проведен подбор оптимальных рабочих разведений указанных компонентов для получения достоверных результатов в ИФА. Полученные данные анализа представлены в таблицах 2, 3, 4.
Для анализа исследовали следующие разведения сенсибилизирующих антител: 1:8000, 1:9000, 1:10000, 1:11000. Разведения остальных компонентов были постоянны: для антигена - 1:3000, для детекторных антител - 1:4000, конъюгата - 1:4000. В качестве контрольных сывороток для анализа применяли сыворотки, специфичные к определенным штаммам вируса ящура с активностью 8,0 log2 SN50. Их таблицы 2 следует, что при разведении сенсибилизирующих антител 1:10000 достигалось получение достоверного результата (1:256 или 8,0 log2 SN50). При меньших разведений антител наблюдали высокие фоновые значения, что не позволяло получить корректный результат.При большем разведении отмечали снижение детектируемых значений уровня гуморального иммунитета в сыворотках крови животных. При исследовании неспецифических и отрицательных сывороток получали отрицательные результаты, что свидетельствовало о высокой специфичности разработанного способа.
Для анализа исследовали следующие разведения детекторных антител: 1:3000, 1:3500, 1:4000, 1:4500. Разведения остальных компонентов были постоянны: для антигена - 1:3000, для сенсибилизирующих антител - 1:10000, конъюгата - 1:4000. В качестве контрольных сывороток для анализа применяли сыворотки, специфичные к определенным штаммам вируса ящура с активностью 8,0 log2 SN50. Их таблицы 3 следует, что при разведении детекторных антител 1:4000 достигалось получение достоверного результата (1:256 или 8,0 log2 SN50). При меньших разведений антител наблюдали высокие фоновые значения, что не позволяло получить корректный результат.При большем разведении наблюдали снижение детектируемого значения титра антител в сыворотках крови животных. При исследовании неспецифических и отрицательных сывороток отмечали отрицательные результаты, что свидетельствовало о высокой специфичности разработанного способа.
Для анализа исследовали следующие разведения антигена: 1:1500, 1:2000, 1:2500, 1:3000. Разведения остальных компонентов были постоянны: для детекторных антител - 1:4000, для сенсибилизирующих антител - 1:10000, конъюгата - 1:4000. В качестве контрольных сывороток для анализа применяли сыворотки, специфичные к определенным штаммам вируса ящура с активностью 8,0 log2 SN50. Их таблицы 4 следует, что при разведении антигена 1:3000 достигалось получение достоверного результата (1:256 или 8,0 log2 SN50). При меньших разведениях наблюдали высокие фоновые значения, что не позволяло получить корректный результат. При большем разведении наблюдали снижение детектируемого значения титра антител в сыворотках крови животных.
При исследовании неспецифических и отрицательных сывороток отмечали отрицательные результаты, что свидетельствовало о высокой специфичности разработанной тест-системы.
Таким образом, в ходе лабораторных исследований доказано, что рабочие разведения антигена вируса ящура штамма «Азия-1 №2356/14/2018», сенсибилизирующих и детекторных антител составили 1:3000, 1:10000, 1:4000, соответственно.
Пример 5. Применение тест-системы для определения титра антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018» с помощью жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА.
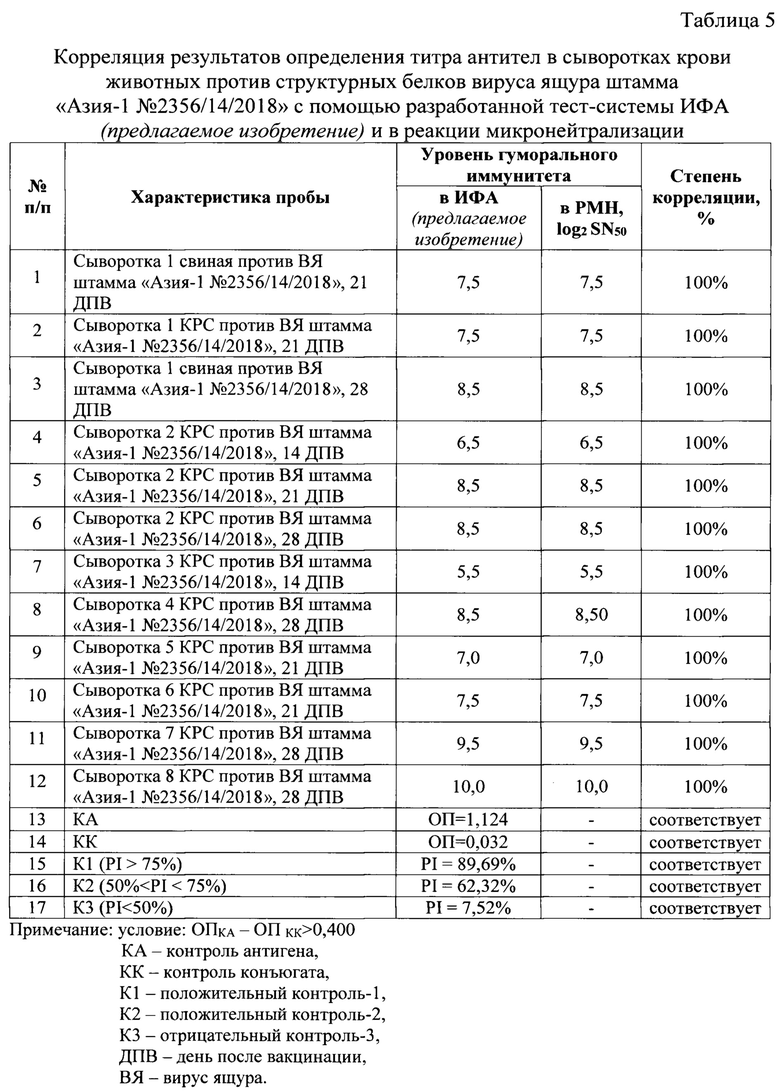
Исследовали 12 сывороток крови животных, полученных после иммунизации инактивированными сорбированными вакцинами против ящура, содержащими антиген вируса ящура штамма «Азия-1 №2356/14/2018». Определены значения титра антител против структурных белов вируса ящура с применением разработанной тест-системы ИФА, а также данные сыворотки были исследованы в РМН в чувствительной перевиваемой монослойной клеточной линии IB-RS-2, рекомендованной МЭБ (OIE) [8]. Полученные результаты отражены в таблице 5, из которой следует, что степень корреляции результатов разработанной тест-системы ИФА (предлагаемое изобретение) и классического метода РМН высокая (приближено к 100%).
Пример 6. Определение диагностических показателей разработанной тест-системы для определения титра антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018» с помощью жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА (предлагаемое изобретение).
Для исследования представленной тест-системы (предлагаемое изобретение) для определения титра антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018» с помощью жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА исследовали стандартные диагностические показатели. Для определения чувствительности предложенной тест-системы анализировали 625 сывороток крови животных, которые являлись заведомо положительными по данным РМН в чувствительной перевиваемой монослойной клеточной линии почки свиньи IB-RS-2. Уровень антител для данных сывороток крови находилась в диапазоне 5,5-10,5 log2 SN50. Постановку ИФА проводили, как отражено выше. Разработанной тест-системой (предлагаемое изобретение) определили, что из 625 образцов сывороток крови 623 определены в качестве положительных, а 2 - в качестве отрицательных (титр антител по данным ИФА составил 1:22). Для исследования специфичности метода тестировали 202 отрицательных сывороток крови животных. В результате исследования с помощью ИФА (предлагаемое изобретение) определили, что из 202 отрицательных проб - 202 определены в качестве отрицательных. Определили, что в 95%-ном доверительном интервале диагностическая чувствительность (DSe) составила 98,85-99,96%, диагностическая специфичность (DSp) - 98,19-100,00%, k-критерий - 0,993; прогностичность отрицательного результата (NPV) - 96,50-99,88%, общая точность (DAc) - 99,13-99,97% (таблица 6).
Таким образом предлагаемая «Тест-система для определения титра антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018» с помощью жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА» является специфичной и чувствительной, позволяющей быстро в течение 4 часов провести анализ сывороток крови животных с определением титра антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018». Генотип Asia-1/ASIA/Sindh-08 и именно данная его модификация в виде штамма «Азия-1 №2356/14/2018» является актуальным и быстро распространяющимся на территории Азии, а также в странах Ближнего Востока. Разработанная тест-система будет направлена на подтверждение высокой эффективности производимых в РФ противоящурных инактивированных вакцин, содержащих антиген данного генотипа, и, тем самым, на защиту территории России и граничащих с ней на юге стран от распространения вируса ящура генотипа Asia-1/ASIA/Sindh-08.
Источники информации, принятые во внимание при составлении описания изобретения к заявке на выдачу патента РФ на изобретение «Тест-система для определения титра антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018» с помощью жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА»:
1. Poonsuk K, Giménez-Lirola L, Zimmerman JJ. A review of foot-and-mouth disease virus (FMDV) testing in livestock with an emphasis on the use of alternative diagnostic specimens. Anim Health Res Rev. 2018 Dec; 19(2): 100-112. doi: 10.1017/S1466252318000063. Epub 2018 Oct 22. PMID: 30345947.
2. Ijaz M, Ali MM, Awan F, Ishaq M, Ahmad A. FMD virus spillover from domestic livestock caused outbreak in captive wild ungulates: First report from Pakistan. Acta Trop. 2022 Jul; 231:106439. doi: 10.1016/j.actatropica.2022.106439. Epub 2022 Apr 1. PMID: 35378060.
3. Zhang L, Zhang J, Chen HT, Zhou JH, Ma LN, Ding YZ, Liu YS. Research in advance for FMD novel vaccines. Virol J. 2011 Jun 3;8:268. doi: 10.1186/1743-422X-8-268. PMID: 21635788; PMCID: PMC3118361.
4. Nguyen NH, Nguyen TQ, Lai DC, Nguyen Thi MD, Nguyen MN. Phylogenetic and genotypic characteristics of the foot-and-mouth disease virus from outbreaks in southern Vietnam, 2019. Virology. 2023 May; 582:43-47. doi: 10.1016/j.virol.2023.03.010. Epub 2023 Mar 23. PMID: 37004382.
5. Hassan AM, Zaher MR, Hassanien RT, Abd-E1-Moniem MI, Habashi AR, Ibraheem EM, Shahein MA, El Zowalaty ME, Hagag NM. Molecular detection, phylogenetic analysis and genetic diversity of recently isolated foot-and-mouth disease virus serotype A African topotype, Genotype IV. Virol J. 2022 Jan 3; 19(1): 1. doi: 10.1186/s12985-021-01693-y. PMID: 34980196; PMCID: PMC8722054.
6. Reference Laboratory Reports. Quarterly Reports from the WRLFMD. URL: https://www.wrlfmd.org/ref-lab-reports. (Дата обращения: 05.04.2023).
7. Sirdar MM, Fosgate GT, Blignaut B, Mampane LR, Rikhotso OB, Du Plessis B, Gummow B. Spatial distribution of foot-and-mouth disease (FMD) outbreaks in South Africa (2005-2016). Trop Anim Health Prod. 2021 Jun 28; 53(3):376. doi: 10.1007/s 11250-021-02807-y. PMID: 34181093.
8. OIE. Manual of diagnostic tests and vaccines for terrestrial animals. - Paris, 2018. - Chapter 2.1.8.
9. Fana EM, Mpoloka SW, Leteane M, Seoke L, Masoba K, Mokopasetso M, Rapharing A, Kabelo T, Made P, Hyera J. A Five-Year Retrospective Study of Foot-and-Mouth Disease Outbreaks in Southern Africa, 2014 to. 2018. Vet Med Int. 2021 Dec 31;2021:7438809. doi: 10.1155/2021/7438809. PMID: 35003620; PMCID: PMC8741390.
10. Kenney M, Waters RA, Rieder E, Pega J, Perez-Filguera M, Golde WT. Enhanced sensitivity in detection of antiviral antibody responses using biotinylation of foot-and-mouth disease virus (FMDV) capsids. J Immunol Methods. 2017 Nov; 450:1-9. doi: 10.1016/j.jim.2017.07.001. Epub 2017 Jul 6. PMID: 28689695.
11. Sørensen KJ, de Strieker K, Dyrting КС, Grazioli S, Haas B. Differentiation of foot-and-mouth disease virus infected animals from vaccinated animals using a blocking ELISA based on baculovirus expressed FMDV 3ABC antigen and a 3ABC monoclonal antibody. Arch Virol. 2005 Apr; 150(4):805-14. doi: 10.1007/s00705-004-0455-z. Epub 2005 Jan 13. PMID: 15645377.
12. Oem J.K., Park J.H., Lee K.N., Kim Y.J., Kye S.J., Park J.Y., Song H.J. Characterization of recombinant foot-and-mouth disease virus pentamer-like structures expressed by baculovirus and their use as diagnostic antigens in a blocking ELISA // Vaccine. - 2007. - V. 25(20). - P. 4112-412.
13. Cao Y., Lu Z., Sun J., Bai X., Sun P., Bao H., Chen Y., Guo J., Li D., Liu X., Liu Z. Synthesis of empty capsid-like particles of Asia I foot-and-mouth disease virus in insect cells and their immunogenicity in guinea pigs // Vet. Microbiol. - 2009. - V. 137 (1-2). - P. 10-17.
14. Hamblin C., Barnett I.T., Hedger R.S. A new enzyme-linked immunosorbent assay (ELISA) for the detection of antibodies against foot-and-mouth disease virus. I. Development and method of ELISA // J. Immunol. Methods. - 1986. - V. 93(1). - P. 115-121.
15. Sharma GK, Mahajan S, Matura R, Subramaniam S, Mohapatra JK, Pattnaik B. Quantitative single dilution liquid phase blocking ELISA for sero-monitoring of foot-and-mouth disease in India. Biologicals. 2015 May; 43(3):158-164.
16. IZSLER ELISA. URL: https://www.fao.org/fileadmin/user_upload/eufmd/docs/Open_Session2012/Appendices/75_New_Elisa_for_diagnosis_Brocchi_.pdf (Дата обращения: 18.04.2023).
17. PrioCHECK ELISA. URL: http://vetprofilab.ru/f/priocheck_fmdv_antibody_elisa_kit_cut.pdf (Дата обращения: 20.03.2023).
18. Патент РФ №2787714, 11.01.2023. Тест-система на основе жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА для определения титра антител против вируса ящура штамма А №2269/ВНИИЗЖ/2015 генотипа A/ASIA/G-VII в сыворотках крови животных после иммунизации // Заявка №2022108324 / Луговская Н.Н., Доронин М.И., Михалишин Д.В., Гочмурадов Ы.М., Оковытая Т.В., Борисов А.В.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="ELISA FMDV SAT-2
VII.xml" softwareName="WIPO Sequence" softwareVersion="2.1.2"
productionDate="2023-05-05">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2023-05-05</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>505</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2023-05-05</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">ФГБУ "Федеральный центр охраны
здоровья животных" (ФГБУ "ВНИИЗЖ")</ApplicantName>
<ApplicantNameLatin>FGBI "ARRIAH"</ApplicantNameLatin>
<InventorName languageCode="ru">Доронин Максим
Игоревич</InventorName>
<InventorNameLatin>Doronin Maksim Igorevich </InventorNameLatin>
<InventionTitle languageCode="ru">Тест-система для определения титра
антител против структурных белков вируса ящура штамма «Азия-1
№2356/14/2018» с помощью жидкофазного блокирующего непрямого
«сэндвич»-варианта ИФА</InventionTitle>
<SequenceTotalQuantity>2</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>633</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..633</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q1">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>FMDV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>actaccaccactggcgagtcggcagacccagtcacaaccacggttgaga
actacggaggagagacccagacggctagacggctccacaccgacgtcggttttgttcttgacaggtttgt
gagactcacgcaacctaaggccacccagactcttgacctcatgcagatccccccatacacgttggttggg
gcgttgcttcggtctgcgacgtactacttctcagacctggaggttgcgctcgtccacacaggcccggtca
cgtgggtgcccaacggcgcgcccaagaccgccttggactgccagaccaacccaactgcttaccagaagca
gcccatcacacgcctggccctcccttacaccgccccccaccgtgtgctggcgacagtgtacaacgggaaa
acagcctacggggcggaggccccaaggcgcggtgaccttgcagccattgcgcagagggtgagcgccagct
tgcctacttccttcaactacggcgcagttaaggccgaaaacatcactgagctgttgatccgcatgaaacg
cgcggagacatactgccccaggcctttgctggctcttgacaccacccaagaccgccgcaagcaggagatc
attgcacctgaaaagcaggtgtta</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>211</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..211</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>FMDV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>TTTTGESADPVTTTVENYGGETQTARRLHTDVGFVLDRFVRLTQPKATQ
TLDLMQIPPYTLVGALLRSATYYFSDLEVALVHTGPVTWVPNGAPKTALDCQTNPTAYQKQPITRLALPY
TAPHRVLATVYNGKTAYGAEAPRRGDLAAIAQRVSASLPTSFNYGAVKAENITELLIRMKRAETYCPRPL
LALDTTQDRRKQEIIAPEKQVL</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Тест-система для определения антител к структурным белкам вируса ящура генотипа A/ASIA/Iran-05 с помощью жидкофазного блокирующего иммуноферментного анализа | 2024 |
|
RU2834234C1 |
| Тест-система на основе жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА для определения титра антител против вируса ящура штамма "О-N2356/Пакистан/2018" генотипа O/ME-SA/PanAsia2 в сыворотках крови животных | 2023 |
|
RU2812210C1 |
| Тест-система для определения уровня антител против антигена вируса ящура генотипа A/ASIA/SEA-97 с помощью жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА | 2023 |
|
RU2804845C1 |
| Тест-система для определения титра антител против структурных белков вируса ящура штамма "А/Танзания/2013" с помощью жидкофазного иммуноферментного анализа | 2023 |
|
RU2818811C1 |
| Тест-система на основе жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА для определения титра антител против вируса ящура штамма А N2269/ВНИИЗЖ/2015 генотипа A/ASIA/G-VII в сыворотках крови животных после иммунизации | 2022 |
|
RU2787714C1 |
| Способ быстрого количественного определения уровня гуморального иммунитета животных к штамму О N2311/Забайкальский/2016 генотипа О/ME-SA/Ind-2001 вируса ящура после вакцинации с помощью жидкофазного "сэндвич"-варианта ИФА | 2022 |
|
RU2796393C1 |
| Тест-система для выявления антител к структурным белкам вируса ящура штамма "SAT-1/Кения/2017" с помощью жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА | 2023 |
|
RU2821044C1 |
| Тест-система для количественного определения антител к структурным белкам вируса ящура генотипа SAT-2/VII с помощью жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА | 2023 |
|
RU2815531C1 |
| Тест-система для определения титра антител против структурных белков вируса ящура штамма "О N2212/Приморский/2014" генотипа O/SEA/Mya-98 в сыворотках крови животных на основе жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА | 2023 |
|
RU2815540C1 |
| Тест-система для детекции антител к структурным белкам штамма "SAT-2/Eritrea/1998" вируса ящура в жидкофазном варианте иммуноферментного анализа | 2023 |
|
RU2825453C1 |

Изобретение относится к области биохимии, в частности к тест-системе для определения титра антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018». Изобретение расширяет арсенал средств для чувствительного определения антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018». 1 з.п. ф-лы, 3 ил., 6 табл., 6 пр.
1. Тест-система для определения титра антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018» с помощью жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА, содержащая:
- иммуноспецифические лиофилизированные составляющие: культуральный инактивированный вирус ящура штамма «Азия-1 №2356/14/2018» с активностью в ИФА 1:3000; сенсибилизирующие антитела - иммуноглобулины G кролика против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018» с активностью в ИФА 1:10000; детекторные антитела - иммуноглобулины G морской свинки против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018» с активностью в ИФА 1:4000; контроль 1 - сильно положительная сыворотка крови телят к структурным белкам вируса ящура штамма «Азия-1 №2356/14/2018» с процентом ингибиции 80-100%; контроль 2 - положительная сыворотка крови телят к структурным белкам вируса ящура штамма «Азия-1 №2356/14/2018» с процентом ингибиции от 50% до 79,9%; контроль 3 - отрицательная сыворотка крови телят, не содержащая антитела к вирусу ящура; фетальная сыворотка крови крупного рогатого скота; антивидовой конъюгат - иммуноглобулины кролика против иммуноглобулинов G морской свинки, конъюгированные с пероксидазой хрена, с активностью в ИФА 1:4000;
- неспецифические составляющие: карбонатно-бикарбонатный буферный раствор КББР с рН 9,5-9,7, 20-кратный концентрат буферного раствора, хромогенный субстрат - AzBTS-диаммноний, «стоп»-раствор - 1,0%-ный раствор лаурилсульфата натрия (SLS);
отличающаяся тем, что в качестве антигена вируса ящура содержит культуральный инактивированный вирус ящура штамма «Азия-1 №2356/14/2018» и для определения процента ингибиции используется модифицированная формула:  при этом титр противоящурных антител определяется как максимальное разведение сыворотки крови, для которой значение процента ингибиции составляет ≥ 50% и выражается в log2 SN50.
при этом титр противоящурных антител определяется как максимальное разведение сыворотки крови, для которой значение процента ингибиции составляет ≥ 50% и выражается в log2 SN50.
2. Тест-система по п. 1, является специфичной и чувствительной, позволяющей быстро в течение 4 часов провести анализ сывороток крови животных с определением титра антител против структурных белков вируса ящура штамма «Азия-1 №2356/14/2018» и количественно определить уровень гуморального иммунитета в диапазоне разведений сыворотки 4,0-10,5 log2 SN50 или 1:16-1:1448.
| Тест-система на основе жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА для определения титра антител против вируса ящура штамма А N2269/ВНИИЗЖ/2015 генотипа A/ASIA/G-VII в сыворотках крови животных после иммунизации | 2022 |
|
RU2787714C1 |
| ДОРОНИН М | |||
| И и др., ОПРЕДЕЛЕНИЕ ТИТРА АНТИТЕЛ ПРОТИВ ВИРУСА ЯЩУРА ШТАММА А No2269/ВНИИЗЖ/2015 ГЕНОТИПА A/ASIA/G-VII С ПОМОЩЬЮ ЖИДКОФАЗНОГО БЛОКИРУЮЩЕГО НЕПРЯМОГО ВАРИАНТА ИФА, Актуальные вопросы ветеринарной биологии, 2022, n.3 (55), стр.75-83 | |||
| Тест-система для количественного определения уровня гуморального иммунитета животных против антигена вируса ящура A N 2205/G-IV генотипа A/AFRICA/G-IV с помощью жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА | 2022 |
|
RU2798510C1 |
| WO 2011112945 A2, 15.09.2011. | |||
Авторы
Даты
2024-01-25—Публикация
2023-07-03—Подача