Изобретение относится к области ветеринарной вирусологии и биотехнологии, в частности, созданию тест-системы для определения титра антител против структурных белков вируса ящура штамма «А/Танзания/2013» с помощью жидкофазного иммуноферментного анализа.
Вирус ящура является представителем рода Aphthovirus семейства Picornaviridae и включает в себя семь следующих сильно различающихся серотипов: О, А, Азия-1, С, SAT-1, SAT-2, SAT-3 [1]. При этом серотип А в антигенном отношении весьма разнообразен. Полные частицы вируса с коэффициентом седиментации 146S состоят из одноцепочечного позитивного генома в виде РНК и 60 копий каждого из четырех следующих структурных белков: VP1 (1D-ген), VP2 (1B-ген), VP3 (1С-ген) и VP4 (1А-ген) [2].
Для возбудителя ящура, который является представителем РНК-содержащих вирусов, вариациям в геноме благоприятствуют высокие частоты мутаций во время процесса репликации, а возникающие генотипы обусловлены мутациями и рекомбинацией. В результате этого происходит обмен генетическим материалом и образование новых антигенных вариантов, которые могут избежать иммунного давления и привести к изменениям тропизма клеток и диапазона хозяев [3-11].
Самым вариабельным белком вируса ящура является VP1, на который приходится более 90% мутаций всех структурных генов. Наиболее высокая частота мутационных процессов отмечается для 40-60, 130-160 и 190-213 а.о. [12-16].
Для изолятов вируса ящура серотипа А характерно наибольшее генетическое разнообразие. Серотип А включает в себя 3 охарактеризованных прототипа ASIA, AFRICA, EURO-SA и одну пока еще малоизученную группу изолятов. Генетическое и антигенное разнообразие вируса ящура серотипа А приводит к проблемам в специфической профилактике ящура при применении культуральных инактивированных противоящурных вакцин, а также затрудняет штаммоспецифическую диагностику выделенных изолятов вируса ящура [17]. В результате возникает необходимость создания новых средств диагностики и специфической иммунопрофилактики в отношении вируса ящура серотипа А и, в частности, нового генотипа A/AFRICA/G-I, представители которого стали распространяться на территории Восточной Африки и за ее пределами.
На территории Восточной Африки, в частности, в Кении, Танзании, Эфиопии вспышки ящура генотипа A/AFRICA/G-I имеют яркий спорадический характер. При усилении торгово-экономических связей со странами Африканского континента, в частности, с Восточной Африкой, имеются риски заноса изолятов данного генотипа вируса ящура на территорию Российской Федерации.
Анализируя вспышки, которые регистрировались на территории Африки, обнаружено, что в Кении и Танзании в период с 2003 по 2013 гг.были выявлены изоляты вируса ящура, которые принадлежат к генотипу A/AFRICA/G-I. Со вспышками удалось справиться, применяя серьезные меры по борьбе, однако, в последние годы в Эфиопии, Танзании, Кении вновь стали регистрировать вспышки ящура, вызванные вирусом того же генотипа. Данное явление представляется опасным и требует исследования штаммов данного генотипа для создания средств диагностики и специфической профилактики ящура генотипа A/AFRICA/G-I.
Известны производственные штаммы вируса ящура серотипа А, которые применяются для производства средств специфической профилактики ящура:
- штамм «А22/Ирак/64» (генотип A/ASIA/Iraq-64),
- штамм «А/Турция/06» (генотип A/ASIA/Iran-05),
- штамм «А/Краснодарский/2013» (генотип A/ASIA/Iran-05SIS-10),
- штамм «А/Забайкальский/2013» (генотип A/ASIA/Sea-97),
- штамм «А/ВНИИЗЖ/2015» (генотип A/ASIA/G-VII),
- штамм «A/KEN/42/66» (генотип A/AFRICA/G-I).
Изолят «A/TAN/5/2013» вируса ящура был выделен от крупного рогатого скота на территории Объединенной Республики Танзания в 2013 году и поступил в ФГБУ «ВНИИЗЖ» из Всемирной справочной лаборатории института Пирбрайта (the World Reference Laboratory for Foot-and-Mouth Disease, the Pirbright institute, Великобритания) для проведения научных исследований. В результате данной работы путем адаптации к культурам клеток получен штамм «А/Танзания/2013» вируса ящура.
По результатам сравнительного анализа нуклеотидных последовательностей выделенный изолят принадлежит к серотипу А, топотипу AFRICA, генетической линии G-I вируса ящура, который значительно отличается от производственных штаммов вируса ящура серотипа А.
Штамм вируса ящура «А/Танзания/2013» депонирован во Всероссийской государственной коллекции экзотических типов вирусов ящура и других патогенов животных (ГКШМ) ФГБУ «ВНИИЗЖ» под регистрационным номером: №410 - деп / 22-44 - ГКШМ ФГБУ «ВНИИЗЖ».
Экспериментально подтверждена возможность использования штамма «А/Танзания/2013» вируса ящура для изготовления средств диагностики и профилактики ящура, вызванного вирусом генотипа A/AFRICA/G-I.
Филогенетическое дерево выведено с использованием программы MEGA и алгоритма Neighbor-Joining [18]. Процент повторяющихся ветвей, в которых связанные таксоны сгруппированы вместе в тесте начальной загрузки (100 повторов), показан рядом с ветвями [19]. Эволюционные расстояния были рассчитаны с использованием метода Maximum Composite Likelihood [20] и выражены в единицах количества замен оснований на сайт.Этот анализ включал 32 нуклеотидной последовательности. Все позиции, содержащие пробелы и отсутствующие данные, были удалены (вариант полного удаления). В окончательном наборе данных было всего 663 позиции. Эволюционный анализ проводился в MEGA X [21].
Учитывая интенсивные торговые связи между Российской Федерацией и странами Африки, вероятность риска заноса ящура на территорию нашей страны остается очень высокой. Иммунизация является эффективным инструментом борьбы с болезнью. В связи с появлением представителя данного генотипа вируса ящура и необходимостью защиты животных от него в ФГБУ «ВНИИЗЖ» разработали вакцину, в состав которой входит антиген вируса ящура данного штамма.
Возникла необходимость создания диагностической тест-системы для определения титра антител против структурных белков вируса ящура штамма «А/Танзания/2013» с помощью жидкофазного иммуноферментного анализа.
Защита от ящура после вакцинации определяется уровнем специфических антител в сыворотке крови животных [22-24]. Уровень гуморального иммунитета вакцинированного поголовья определяется путем выявления антител, специфичных к структурным белкам вируса ящура. В соответствии с рекомендациями МЭБ (OIE) [2], для определения иммунного статуса животных применяют реакцию микронейтрализации (РМН) и иммуноферментный анализ (ИФА). Реакция микронейтрализации считается чувствительной и специфичной, однако проведение анализа имеет ряд следующих ограничений: 1) большая продолжительность времени постановки реакции (не менее 72 ч), 2) высокая себестоимость процедуры, связанная с применением чувствительной клеточной линии, наличием CO2-инкубатора и другого оборудования, 3) использование неинактивированного вируса ящура, который является биологическим агентом II группы опасности и предполагает проведение работ только в лабораториях уровня BSL-3.
В свою очередь, ИФА обладает многими преимуществами, включая экспрессность, высокую специфичность и чувствительность, пригодность для крупномасштабного скрининга полевых образцов и отсутствие требований к специальным лабораторным условиям, например, культуре клеток или среде углекислого газа, а также не предполагает проведение работ с микроорганизмами повышенного уровня опасности [2]. Исходя из этого, ИФА целесообразно применять для исследования уровня гуморального иммунитета у вакцинированных животных.
В зависимости от фазы, в которой находятся иммунные комплексы различают твердофазный и жидкофазные варианты ИФА. Особое внимание следует уделить жидкофазному блокирующему непрямому «сэндвич»-варианту ИФА, который характеризуется рядом преимуществ: 1) данный анализ максимально приближен к классической реакции нейтрализации, поскольку формирование иммунного комплекса происходит в жидкой фазе как наиболее естественных условиях; 2) эпитопы антигена наиболее доступны в пространстве для специфичных антител, что позволяет повысить чувствительность и специфичность реакции.
Robiolo В., La Torre J., Duffy S., Leon E., Seki C, Torres A., Mattion N. (2010) разработали способ определения титра антител против антигенов вируса ящура штаммов A24/Cruzeiro, A/Argentina/01, O1/Campos и С3/Indaial [25]. Против указанных представителей вируса достоверность определения уровня антител составляла не менее 96%, при этом данная тест-система позволяла выявлять антитела против штамма «А/Танзания/2013» (генотип A/AFRICA/G-I) с диагностической чувствительностью не более 29% и специфичностью - не более 50%.
Sharma G.K. и др. (2015) предложили тест-систему для выявления антител против вируса ящура типов А, О, Азия-1 с помощью жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА [26]. Данная методика позволяла идентифицировать широкий спектр противоящурных антител, но при этом специфичность по отношению к антигену вируса ящура генотипа A/AFRICA/G-I не более 43%, а, следовательно, точное выявление иммуноглобулинов G не представляется возможным. Авторы тест-системы применяли моноклональные антитела, использование которых увеличивало спектр выявления различных генотипов вируса ящура в рамках одного серотипа, но при этом существенно снижалась специфичность относительно выявления антител против изолятов/штаммов конкретного генотипа, в частности «А/Танзания/2013» (генотип A/AFRICA/G-I).
Учитывая представленное, актуально разработать тест-систему для определения титра антител против структурных белков вируса ящура штамма «А/Танзания/2013» с помощью жидкофазного иммуноферментного анализа.
Указанные выше тест-системы не представлены на рынке в качестве наборов для детекции противоящурных антител в сыворотках крови животных и остаются в качестве недоступных для широкого потребителя. В свою очередь, на мировом рынке в настоящее время имеются европейские наборы для детекции антител против вируса ящура типа А - IZSLER (Италия) и PrioCHECK (Нидерланды).
Тест-система в наборе IZSLER предназначена для детекции противоящурных антител с помощью твердофазного прямого «сэндвич»-варианта ИФА [27]. Достоинством данного набора является применение моноклональных антител, однако они были получены ранее 2013 года (период, когда появился производственный штамм «А/Танзания/2013») и не могут с высокой достоверностью и точностью детектировать специфические антитела в сыворотках крови животных. Специфичность и чувствительность указанной тест-системы для выявления антител против вируса ящура генотипа A/AFRICA/G-I ниже 44%, что подтверждают данные реакции микронейтрализации в чувствительной перевиваемой монослойной клеточной линии почки свиньи IB-RS-2. Иными словами, применяемая тест-система не позволяет получать достоверных результатов именно в отношении изолятов и штаммов вируса ящура генотипа A/AFRICA/G-I.
Наиболее близким прототипом для разработанной нами тест-системы является тест-система PrioCHECK (Prionics Lelystad B.V., Netherlands) для выявления антител к вирусу ящура типа А [28].
Комплектующие для соответствующего набора представлены ниже:
Компонент 1 - Планшеты иммунологические.
Компонент 2 - Конъюгат (30х). Разбавленный конъюгат не стабилен, готовят непосредственно перед применением.
Компонент 3 - Буфер для разведения (5х).
Компонент 4 - Неиммунная сыворотка крови лошади.
Компонент 5 - Деминерализованная вода.
Компонент 6 - Промывочный буфер (200х).
Компонент 7 - Референтная сыворотка 1 (позитивная) (жидкая).
Компонент 8 - Референтная сыворотка 2 (менее позитивная) (жидкая).
Компонент 9 - Референтная сыворотка 3 (еще менее позитивная) (жидкая).
Компонент 10 - Референтная сыворотка 4 (отрицательный контроль) (жидкая).
Компонент 11 - Субстрат хромогена (ТМВ).
Компонент 12 - Стоп-раствор (1 N раствор серной кислоты). Данные отражены в инструкции производителя.
Данная тест-система включает в себя конъюгат, который представляет собой меченые моноклональные антитела против вируса ящура серотипа А, исходя из этого является типоспецифичной, но без более узкой дифференциации. Прототипная тест-система разработана была еще в конце 90-гг XX в. В ней применяются антитела против антигенов вируса ящура различных генотипов типа А, кроме вновь появившихся, в частности A/AFRICA/G-I. Изоляты и штаммы данной линии имеют существенные отличия от других линий серотипа А. Анализируя нуклеотидную и аминокислотную последовательность высоко вариабельного белка VP1 вируса ящура, ученые пришли к выводу о наличии достаточного количества существенных замен, позволяющих отнести вирус к иному генотипу. Исходя из выше отраженного, прототипная тест-система не является высокочувствительной и специфичной по отношению к вирусу ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I. Данная тест-система выявляет антитела к данному штамму не более, чем на 41%.
На сегодняшний день с помощью жидкофазного блокирующего «сэндвич»-варианта ИФА с особенностями проведения реакции и определенным составом компонентов реакции разработаны «Тест-система на основе жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА для определения титра антител против вируса ящура штамма А №2269/ВНИИЗЖ/2015 генотипа A/ASIA/G-VII в сыворотках крови животных после иммунизации», «Тест-система на основе жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА для определения титра антител против вируса ящура штамма О №2047/Саудовская Аравия/2008 генотипа О/МЕ-SA/PanAsia2 в сыворотках крови животных после иммунизации» и «Способ быстрого количественного определения уровня гуморального иммунитета животных к штамму О №2311/Забайкальский/2016 генотипа O/ME-SA/Ind-2001 вируса ящура после вакцинации с помощью жидкофазного «сэндвич»-варианта ИФА» [29-31].
Исходя из этого требуется разработать чувствительную, специфичную тест-систему для определения титра антител против структурных белков вируса ящура штамма «А/Танзания/2013» с помощью жидкофазного иммуноферментного анализа с определенными особенностями в проведении анализа и компонентного состава.
Прототипная тест-система основана на твердофазном конкурентном «сэндвич»-варианте ИФА, однако эта форма значительно отдалена от реакции микронейтрализации по возможностям улавливания антигенных сайтов по сравнению с жидкофазным блокирующим непрямым «сэндвич»-вариантом ИФА.
Прототипный вариант предполагает наличие в своем составе контрольных сывороток крови животных в жидком нативном виде, что не позволяет длительное время хранить данный компонент в составе тест-системы.
Прототипный вариант имеет также некоторое ограничение в применении, а именно, рабочий раствор конъюгата не стабилен и быстро разрушается. В составе набора он представлен в виде 30-кратного концентрата. В таком состоянии в отличии от лиофилизированного компонента срок хранения заметно сокращается. Следует также отметить, что данная тест-система не предусматривает контроля конъюгата, что не позволяет получать более достоверные данные по оптическим плотностям и уровню гуморального иммунитета против антигена вируса ящура.
В прототипной тест-системе применяется прямой конъюгат, что удобно в применении, однако при этом повышается вероятность шумовых фоновых явлений, что может негативно отражаться на конечных результатах количественного исследования сывороток крови животных.
Учитывая найденные ограничения в применении имеющихся тест-систем, в том числе прототипной, для проведения точного количественного анализа уровня гуморального иммунитета животных после инокуляции противоящурными вакцинами, содержащими инактивированный вирус ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I, актуальной является разработка тест-системы для определения титра антител против структурных белков вируса ящура штамма «А/Танзания/2013» с помощью жидкофазного иммуноферментного анализа с учетом выше приведенных недостатков.
В настоящее время ветеринарная служба Российской Федерации не располагает современной отечественной тест-системой, которая позволила бы с высокой достоверностью количественно определять титр антител против структурных белков вируса ящура штамма «А/Танзания/2013» с помощью ИФА.
Целью изобретения является создание тест-системы для определения титра антител против структурных белков вируса ящура штамма «А/Танзания/2013» с помощью жидкофазного иммуноферментного анализа.
Поставленная цель достигается тем, что предлагаемая тест-система содержит следующие лиофильно высушенные иммуноспецифические компоненты с высокой степенью активности:
1) культуральный инактивированный лиофилизированный вирус ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I;
2) сенсибилизирующие антитела - иммуноглобулины G кролика против структурных белков вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I;
3) детекторные антитела - иммуноглобулины G морской свинки против структурных белков вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I;
4) контроль 1 (положительный контроль) - положительная сыворотка крови телят к структурным белкам вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I с процентом ингибиции 75-100%;
5) контроль 2 (положительный контроль) - положительная сыворотка крови телят к структурным белкам вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I с процентом ингибиции от 50,0% до 74,9%;
6) контроль 3 (отрицательный контроль) - сыворотка крови телят, не содержащая антитела к антигену вируса ящура;
7) блокирующий компонент;
8) антивидовой иммунопероксидазный конъюгат - иммуноглобулины кролика против Ig G морской свинки, конъюгированные с пероксидаза хрена.
Предлагаемая тест-система содержит также неспецифические компоненты: буферный раствор на основе карбоната и гидрокарбоната натрия (рН 9,5-9,7); 20-кратный концентрат буферного раствора; хромогенный субстрат - ABTS; «стоп»-раствор - 1,0%-ный раствор кокосульфата натрия.
Цель достигается благодаря тому, что метод жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА наиболее приближен к классической реакции микронейтрализации в культуре клеток IB-RS-2, поскольку все антигенные сайты структурных белков вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I находятся в свободном состоянии в жидкой фазе, открыты для связывания со специфическими сенсибилизирующими и детекторными антителами. Реакция основана на взаимодействии иммуноглобулинов G исследуемой сыворотки крови животного и инактивированного вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I в жидкой фазе с образованием иммунных комплексов. Параллельно с этим проводится сенсибилизация лунок плоскодонного планшета антителами кролика против вируса ящура того же генотипа. После этого сенсибилизированные лунки подвергают обработке с помощью блокирующей сыворотки крови, добавляют полученные иммунные комплексы из круглодонного планшета, инкубируют, вносят восстановленную из лиофильного высушенного состояния суспензию детекторных антител. Образовавшийся сложный иммунный комплекс выявляют с помощью антител против иммуноглобулинов G морской свинки, конъюгированных с пероксидазой хрена и хромогенного субстрата.
Технический результат от изобретения заключается в разработке современной, специфической против структурных белков вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I и чувствительной тест-системы, предназначенной для определения титра антител против структурных белков указанного штамма вируса ящура методом жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА на основе применения инактивированного вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I и при получении иммуноспецифических компонентов реакции.
В отличии от прототипа в разработанной тест-системе применяется культуральный концентрированный в 700 раз инактивированный вирус ящура штамма «А/Танзания/2013», который представлен в виде лиофильно высушенной суспензии. Данный факт дает возможность количественно определять гуморальный иммунитет против вируса ящура указанного штамма с высокими показателями чувствительности (более 99%) и специфичности (100%), что на 59% выше по сравнению с наиболее близким прототипом. Кроме того, лиофилизированный компонент остается стабильным не менее 3 лет по сравнению с антигеном в нативном состоянии, что является преимуществом в использовании данной тест-системы. Активность полученного антигена вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I составляет 1:2500.
В отличии от прототипа применяются сенсибилизирующие и детекторные антитела кролика и морской свинки, соответственно, высокоспецифичные по отношению к структурным белкам вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I. Указанные в тест-системе ИФА иммуноглобулины G кролика и морской свинки против указанного штамма вируса ящура представлены в виде лиофильного компонента, что позволяет иммуноглобулинам G находится в стабильном состоянии не менее 3 лет с активностью не менее 1:10000 и 1:5000, соответственно.
Для контроля 1 активность составляет не менее 1:3500, для контроля 2 -не менее 1:4000. Данная активность удобна для получения большого объема контролей в рабочем нативном состоянии для непосредственного проведения ИФА.
В отличии от прототипного варианта представленная тест-система предусматривает контроль антигена и конъюгата, что дает возможность учитывать фоновые значения и, тем самым, получать достоверные данные по значениям оптической плотности и титру антител против структурных белков вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I. Активность конъюгата составляет 1:2500.
Разработанная тест-система основана на специфическом блокировании антигена (структурных белков) вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I (фиг.3) антителами, содержащимися в исследуемой пробе сыворотки в жидкой фазе. Смесь «исследуемая сыворотка/антиген» переносится в лунки планшета, предварительно иммобилизованного сенсибилизирующими антителами кролика против штамма «А/Танзания/2013» генотипа A/AFRICA/G-I.
Наличие антител к вирусу ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I в исследуемой пробе будет выражаться в формировании иммунного комплекса и уменьшении количества свободного антигена, который связывается сенсибилизирующими антителами. Фиксированный в лунках антиген взаимодействует с детекторными антителами морской свинки, которые выявляются в реакции с иммунопероксидазным конъюгатом против Ig G морской свинки и последующим окрашиванием с помощью хромогенного субстрата. Интенсивность окрашивания обратно пропорциональна количественному значению выявленного уровня гуморального иммунитета животного. Интенсивность окраски в результате реакции учитывают с помощью спектрофотометра.
Сущность изобретения отражена на графических изображениях: Фиг. 1 - Седиментационный профиль фракций антигена вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I.
Фиг. 2 - Электрофореграмма для антигена вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I в 12% полиакриламидном геле. Примечание: 1 - фракция 146S компонента очищенного для иммунизации животных и получения антигена вируса данного штамма, М - маркер молекулярного веса.
Фиг. 3 - Филогенетическая принадлежность штамма «А/Танзания/2013» генотипа A/AFRICA/G-I.
Сущность изобретения пояснена в перечне последовательностей, в котором:
SEQ ID NO:l представляет последовательность нуклеотидов ID-гена, кодирующего белок VP1 штамма «А/Танзания/2013» генотипа A/AFRICA/G-I вируса ящура;
SEQ ID NO:2 представляет последовательность аминокислот белка VP1 штамма «А/Танзания/2013» генотипа A/AFRICA/G-I вируса ящура.
На подготовительном этапе исследования лиофилизированные иммуноспецифические компоненты тест-системы (антиген (структурные белки) вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I, иммунопероксидазный конъюгат, положительные и отрицательный контроли, сенсибилизирующие и детекторные антитела) восстанавливают до необходимого объема деионизированной водой.
Проводят приготовление рабочих растворов.
Раствор №1 (солевой буферный раствор карбоната и гидрокарбоната натрия). Готовят по стандартной методике 50 мл раствора с водородным показателем 9,5-9,7.
Раствор №2 (Washing solution). Готовят 2 л стандартного буферного раствора TBS с добавлением 0,1% tween-20 с водородным показателем 7,5-7,7. Рабочий раствор №2 готовят разведением концентрата в 20 раз.
Раствор №3 (буфер для восстановления антител и конъюгата). Рабочий буферный раствор для разведения антител и иммунопероксидазного конъюгата готовится непосредственно перед использованием из рабочего раствора №2 с добавлением 10% раствора блокирующего компонента (эмбриональная сыворотка телят).
Этапы проведения жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА для определения титра антител против структурных белков вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I представлены ниже.
1. Иммобилизация антител кролика против структурных белков вируса ящура. Восстановленную суспензию сенсибилизирующих антител против структурных белков вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I готовят в разведении 1:10000 в солевом буферном растворе карбоната и гидрокарбоната натрия (раствор №1). Во все лунки иммунологического 96-луночного планшета вносят по 100 мкл суспензии данных антител, накрывают крышкой и инкубируют в течение 18-20 ч при температуре (2-8)°С.
2. Промывание лунок планшета осуществляют с использованием раствора №2 дважды.
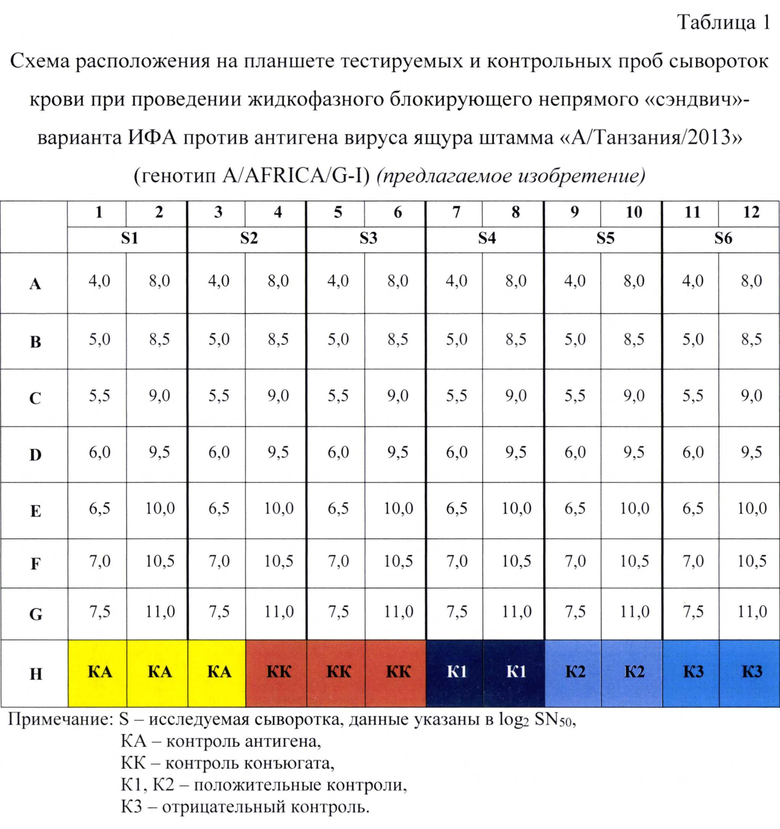
3. Образование иммунного комплекса в жидкой фазе. Параллельно с иммобилизацией планшета проводят серологическую реакцию связывания антигена с испытуемыми и контрольными пробами сыворотки крови животных. Готовят следующие разведения сывороток крови животных: 4,0; 5,0; 5,5; 6,0; 6,5; 7,0; 7,5; 8,0; 8,5; 9,0; 9,5; 10,0; 10,5; 11,0 log2 SN50 (1:16-1:2048) в растворе №2. Для этого во все лунки планшета за исключением лунок H1-6, которые оставляют для контроля антигена (КА) и контроля конъюгата (КК), вносят по 0,047 см3 (47 мкл) буферного раствора и 0,003 см3 (3 мкл) пробы. В лунки H1-6 вносят по 0,05 см3 (50 мкл) буферного раствора. Испытуемые и контрольные пробы располагают на планшете согласно таблице 1. Положительной сыворотка считается при уровне антител против структурных белков вируса ящура ≥5,0 log2SN50 (≥1:32).
В качестве контроля 1 используют положительную сыворотку крови КРС/свиней против структурных белков вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I - процент ингибиции (PI) 75-100%, контроля 2 - положительную сыворотку крови КРС/свиней против структурных белков вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I -PI=50,0-74,9%, контроля 3 - нормальную сыворотку КРС/свиней - процент ингибиции <50%.
Во все лунки планшета добавляют по 0,05 см3 рабочего разведения антигена в растворе №2 в соответствии с разведением 1:2500. После перемешивания содержимого лунок планшета проводят в течение 1 часа при температуре (2-8)°С.
4. Улавливание антигена. В промытые лунки иммобилизованного планшета вносят по 0,05 см3 смеси контрольных и испытуемых проб и антигена, планшет закрывают крышкой и инкубируют в течение 60±2 мин при температуре (37±0,2)°С.
5. Промывание лунок планшета. Проводят, как представлено выше (п. 2). Процедуру повторяют 3 раза.
6. Внесение детекторных антител. Во все лунки планшета, за исключением лунок с КК (контроль конъюгата), куда добавляют по 0,05 см3 раствора №3, вносят по 0,05 см3 рабочего разведения детекторных антител (1:5000) в растворе №3. Планшет накрывают крышкой и инкубируют в течение 60°2 мин при температуре (3±0,2)°С.
7. Промывание лунок планшета. Проводят, как представлено выше (п. 2). Процедуру повторяют 3 раза.
8. Внесение конъюгата. Во все лунки планшета вносят по 0,05 см3 рабочего разведения конъюгата (1:2500) в растворе №3. Планшет накрывают крышкой и инкубируют в течение 60±2 мин при температуре (37±0,2)°С.
9. Промывание лунок планшета. Проводят, как представлено выше (п.2). Процедуру повторяют 4 раза.
10. Проявление цветной реакции. Во все лунки планшета вносят по 0,05 см3 хромогенного субстрата ABTS, закрывают крышкой и выдерживают 20 минут при температуре (20±0,2)°С.
11. Торможение реакции. Реакцию останавливают добавлением в каждую лунку планшета 0,05 см3 1% раствора кокосульфата натрия.
12. Определение значения абсорбционности и уровня гуморального иммунитета по данным ИФА. Результаты анализа учитывают инструментальным способом. Сразу после остановки реакции измеряют значение абсорбционности (А) продуктов реакции в каждой лунке при длине волны 415 нм, используя спектрофотометр для микропланшетов с вертикальным лучом света. Значения А переводят в значение процента ингибиции (PI, %) по формуле:
PI(%)=(1-(Асыворотки-АКК)/(АКА-АКК))×100,
где, А сыворотки - среднее значение абсорбционности смеси сыворотки с инактивированным вирусом ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I;
Ака - среднее значение абсорбционности контроля антигена;
Акк - среднее значение абсорбционности контроля конъюгата.
Достоверность проводимого анализа с помощью предложенной тест-системы определяется при удовлетворении следующим критериям:
- разница между значениями Ака и Акк не менее 0,4 оптических единиц (о.е.);
- контроль 1 имеет значение PI>75,0%;
- контроль 2 имеет значение PI в пределах 50,0-74,9%;
- контроль 3 имеет значение PI<50,0%.
Сыворотки крови, для которых значение ≥50%, считают положительными, а животные, от которых они получены, иммунными к ящуру, вызванного вирусом штамма «А/Танзания/2013» генотипа A/AFRICA/G-I. Значение PI≤50% в сыворотке крови обследуемых животных является отрицательным, что свидетельствует об отсутствии специфических антител к структурным белкам вируса ящура «А/Танзания/2013» генотипа A/AFRICA/G-I. Исходя из полученных данных берут последнее разведение сыворотки, для которого процент ингибиции составляет ≥50%. Данное разведение считают титром антител против вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I и выражают в log2 SN50.
В результате проведенных экспериментов были оттитрованы оригинальные компоненты реакции. Активность детекторных антител в ИФА составила 1:5000, сенсибилизирующих антител - 1:10000, антивидового конъюгата - 1:2500; антигена вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I - 1:2500, контроля 1 - 1:3500, контроля 2 - 1:4000. С использованием разработанной тест-системы проведено исследование образцов сывороток крови животных с количественным определением уровня гуморального иммунитета и проведен сравнительный анализ с результатами РМН в чувствительной перевиваемой монослойной клеточной линии почки свиньи (IB-RS-2) [2].
Разработанная тест-система дает возможность тестировать одновременно в формате одного 96-луночного планшета 6 проб сывороток в следующих разведениях: 4,0; 5,0; 5,5; 6,0; 6,5; 7,0; 7,5; 8,0; 8,5; 9,0: 9,5; 10,0; 10,5; 11,0 log2 SN50 (1:16-1:2048).
Для работы применяли инактивированный антиген вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I. Данный штамм применяют для разработки серологических тест-систем в настоящее время исключительно в РФ.
Контроль штамма «А/Танзания/2013» генотипа A/AFRICA/G-I вируса ящура на специфичность.
Вирусный изолят, послуживший источником для получения штамма «А/Танзания/2013» генотипа A/AFRICA/G-I вируса ящура, был выделен от крупного рогатого скота на территории Объединенной Республики Танзания. Специфичность определена с помощью ОТ-ПЦР с последующим секвенированием ID-гена, соответствующего белку VP1, в котором наиболее часто возникают мутации. По результатам исследования нуклеотидной последовательности указанного гена была выявлена принадлежность штамма «А/Танзания/2013» к генотипу A/AFRICA/G-I. Расчет проводился в соответствии с Байесовской теорией вероятности. Специфичность подтверждена также в реакции связывания комплемента со штаммоспецифической сывороткой. Концентрация общего вирусного белка в исследуемом антигене вируса ящура штамма «А/Танзания/2013» составила 3,02 мкг/мл, концентрация 146S компонента - 2,05 мкг/мл, 146+75S компонента - 2,90 мкг/мл, 12S частиц - 0,12 мкг/мл. Экспериментально подтверждена возможность использования штамма «А/Танзания/2013» вируса ящура для разработки диагностических тест-систем.
Морфологические признаки
Штамм «А/Танзания/2013» вируса ящура серотипа А относится к семейству Picornaviridae, роду Aphthovirus, виду Foot-and-Mouth Disease Virus и обладает морфологическими признаками, характерными для возбудителя ящура: форма вириона иксаэдрическая, размер 25 нм. Вирион состоит из молекулы одноцепочечной молекулы РНК с позитивным смыслом, заключенной в белковую оболочку. Она состоит из 32 капсомеров, расположенных в кубической симметрии.
Антигенные свойства
По антигенным свойствам штамм «А/Танзания/2013» вируса ящура относится к серотипу А. Вирус стабильно нейтрализуется гомологичной антисывороткой. Вирус не проявляет гемагглютинирующей активности. У переболевших животных в сыворотке крови образуются типоспецифические антитела, выявляемые в иммуноферментном анализе и реакции микронейтрализации (РМН).
Методом нуклеотидного секвенирования была определена первичная структура ID-гена белка VP1 штамма «А/Танзания/2013» вируса ящура. Сравнительный анализ нуклеотидных последовательностей показал, что штамм «А/Танзания/2013» вируса ящура принадлежит к генотипу A/AFRICA/G-I (Фиг. 3).
Антигенное родство (r1) штамма «А/Танзания/2013» вируса ящура изучено в перекрестном исследовании штамма со специфическими сыворотками, полученными на следующие производственные штаммы вируса ящура:
- штамм «А22/Ирак/64» (генотип A/ASIA/Iraq-64),
- штамм «А/Турция/06» (генотип A/ASIA/Iran-05),
- штамм «А/Краснодарский/2013» (генотип A/ASIA/Iran-05S1S-10),
- штамм «А/Забайкальский/2013» (генотип A/ASIA/Sea-97),
- штамм «А/ВНИИЗЖ/2015» (генотип A/ASIA/G-VII),
- штамм «A/KEN/42/66» (генотип A/AFRICA/G-I) в РМН.
Титр референтных сывороток крови КРС, полученных путем иммунизации животных моновалентными вакцинами из производственных штаммов вируса ящура серотипа А, против 102 ТЦД50 гомологичного и гетерологичного вируса определяли в РМН при перекрестном титровании, рассчитывая значения с использованием уравнения линейной регрессии, и выражали в lg. Значение r1 определяли, как антилогарифм разности lg титров сыворотки против гетерологичного и гомологичного вируса [7, 8, 9].
Значение r1 в РМН интерпретировали следующим образом:
при ≥0,3 - исследуемый и производственный штаммы вируса ящура являются близкородственными;
при <0,3 - исследуемый образец штамма вируса ящура отличается от производственного штамма.
Показатели антигенного родства при изучении штамма «А/Танзания/2013» составили r1 от 0,03 до 0,20, а именно, для штамма «А22/Ирак/64» - 0,11, для штамма «А/Турция/06» - 0,03, для штамм «А/Краснодарский/2013» - 0,05, для штамма «А/Забайкальский/2013» - 0,09, для штамма «А/ВНИИЗЖ/2015» - 0,14, для штамма «A/KEN/42/66» - 0,20, что свидетельствует об отсутствии антигенного родства с производственными штаммами вируса ящура серотипа А. Гено- и хемотаксономическая характеристики
Штамм «А/Танзания/2013» вируса ящура является РНК (+) - содержащим вирусом с молекулярной массой 7,01Х106 Д. Нуклеиновая кислота представлена одноцепочной линейной молекулой молекулярной массой 2,85×106 Д. Вирион имеет белковую оболочку, состоящую только из четырех белков VP1, VP2, VP3 и VP4. Выделяют следующие основные неструктурные функциональные белки вируса ящура: 2А, 2 В, 2С, 3А, 3 В1 3 В2, 3 В3, 3С, 3D (РНК-зависимая РНК-полимераза).
Основным антигенным белком является VP1. В вирионе содержится приблизительно 31,5% РНК и 68,5% белка. Вирусная РНК (+) является инфекционной и участвует в образовании белков-предшественников в инфицированных клетках.
Физические свойства
Масса вириона составляет 8,43×10-18 г. Плавучая плотность 1,43 г/см3.
Устойчивость к внешним факторам
Штамм «А/Танзания/2013» вируса ящура устойчив к эфиру, хлороформу, и ацетону. Наиболее стабилен при рН 7,45-7,65. Сдвиги рН в кислую и сильно щелочную сторону ведут к инактивации вируса. Чувствителен к формальдегиду, УФ-облучению, γ-облучению, высоким температурам (выше 37,8°С).
Дополнительные признаки и свойства
Реактогенность - реактогенными свойствами не обладает.
Патогенность - патогенен для парнокопытных животных.
Вирулентность - вирулентен для естественно-восприимчивых животных при контактном, аэрозольном и парентеральном заражении.
Стабильность - сохраняет исходные биологические свойства при пассировании в чувствительных биологических системах в течение 5 пассажей (срок наблюдения) на перевиваемых культурах.
Сущность изобретения пояснена примерами его использования, которые не ограничивают объем изобретения.
Пример 1. Получение антигена вируса ящура штамма «А/Танзания/2013».
Для получения антигена вируса ящура штамма «А/Танзания/2013» для диагностических целей проводили суспензионное культивирование вируса в клеточной линии BHK-21/SUSP/ARRIAH в течение 9-11 ч с получением вирусной суспензии с титром инфекционной активности не ниже 6,5 lg ТЦД50/СМ3. Полученную вирусную суспензию инактивировали с помощью аминоэтилэтиленимина и осветляли полигексаметиленгуанидином.
Инактивированную культуральную суспензию, содержащую антиген вирус ящура, осветляли в течение 30 мин. при 6000 об/мин и 4±0,2°С. Надосадочную жидкость отбирали и добавляли в нее полиэтиленгликоль с молекулярным весом 6000 Д (ПЭГ-6000) до конечной концентрации 8% и хлорид натри (сухой) до конечной концентрации 0,85%, интенсивно перемешивали и выдерживали при температуре 4±2°С в течение 18-24 часов. Вирусную суспензию осаждали при 6000 об/мин в течение 60 мин., осадок растворяли в 1/15 М растворе фосфатно-солевого буферного раствора, концентрируя в 700 раз (1/700 от первоначального объема).
К полученному преципитату добавляли 50% хлороформа, интенсивно перемешивали и фракционировали с помощью центрифуги в течение 30 мин. при 3000 об/мин. Отбирали верхнюю водную фракцию, содержащую антиген вируса ящура штамма «А/Танзания/2013». Отбирали 100 мкл образца для последующего электрофоретического анализа в 12% полиакриламидном геле в денатурирующих условиях.
На следующем этапе проводили получение 146S частиц вируса ящура штамма «А/Танзания/2013» (структурные белки вируса ящура, данный компонент является иммуногенным и наиболее важным в иммунизации животных).
Для выделения полных частиц с коэффициентом седиментации 146S готовили линейный градиент сахарозы с концентрациями 50, 40, 30, 20, и 10% (по направлению слоев в центрифужной пробирке снизу вверх). Суспензию антигена вируса ящура штамма «А/Танзания/2013» вносили по 15 мл в центрифужные пробирки, затем последовательно подслаивали растворы сахарозы, начиная с 10%-го и заканчивая 50%-м раствором. Пробирки помещали в металлические центрифужные стаканы и после тщательно выполненного уравновешивания центрифугировали при скорости 30000 об/мин и температуре 4±0,2°С в течение 4 часов. Фракционирование градиента сахарозы производили с помощью перистальтического насоса, отбирая фракции по 1,0 мл в отдельные пробирки.
146S компонент переосаждали с помощью ультрацентрифугирования в течение 4 часов при скорости 25000 об/мин. и температуре 4±0,2°С и ресуспендировали осадок в 1/15 М фосфатно-солевом буферном растворе.
Результаты спектрометрического исследования полученных фракций антигена вируса ящура штамма «А/Танзания/2013» в виде антигенного профиля представлены на фиг. 1. Проведен электрофорез фракции 146S компонента очищенного в 12% полиакриламидном геле в денатурирующих условиях (фиг. 2).
Пример 2. Получение гипериммунной сыворотки крови кроликов (сенсибилизирующие антитела) против структурных белков вируса ящура штамма «А/Танзания/2013».
Для получения специфических сывороток крови против структурных белков вируса ящура штамма «А/Танзания/2013» применяли клинически здоровых кроликов средней упитанности массой 2,5-3,0 кг.
Для гипериммунизации животных применяли концентрированный очищенный инактивированный антиген вируса ящура штамма «А/Танзания/2013», полученный как описано в примере 1, из которого изготовили эмульсию с использованием масляного адъюванта Montanide ISA-61 VG (в соотношении адъювант/антиген=60/40 по массе). Полученную вакцину вводили в мышцу задних конечностей кролика на 0, 14 и 28 дни в объеме 0,5 см3. Через 7 дней после последней иммунизации у кроликов отбирали кровь, содержащую сенсибилизирующие антитела, которую лиофильно высушивали и хранили при температуре (4-8)°С.
Пример 3. Получение гипериммунной сыворотки крови морских свинок (детекторные антитела) против структурных белков вируса ящура штамма «А/ТАНЗАНИЯ/2013».
Для гипериммунизации морских свинок использовали эмульсию очищенного препарата концентрированного инактивированного вируса ящура штамма «А/Танзания/2013», полученного как описано в примере 1. Приготовление вакцины и схема иммунизации такая, как в примере 2.
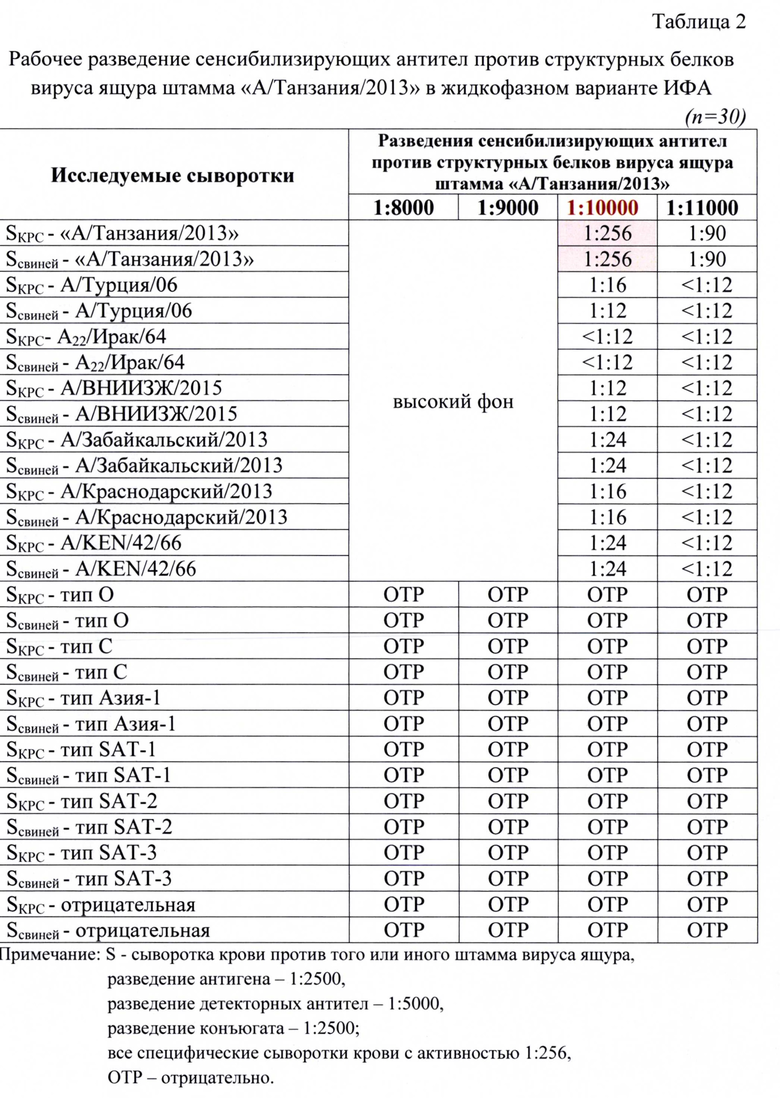
Пример 4. Определение активности в ИФА антигена вируса ящура штамма «А/Танзания/2013», сенсибилизирующих и детекторных антител к структурным белкам.
Образцы сывороток крови животных проверяли на активность и специфичность в жидкофазном блокирующем непрямом «сэндвич»-варианте ИФА. Был проведен подбор оптимальных рабочих разведений указанных компонентов для получения достоверных результатов в ИФА. Полученные данные анализа представлены в таблицах 2, 3, 4.
Для анализа исследовали следующие разведения сенсибилизирующих антител: 1:8000, 1:9000, 1:10000, 1:11000. Разведения остальных компонентов были постоянны: для антигена - 1:2500, для детекторных антител - 1:5000, конъюгата - 1:2500. В качестве контрольных сывороток для анализа применяли сыворотки, специфичные к определенным штаммам вируса ящура с активностью 8,0 log2 SN50. Из таблицы 2 следует, что при разведении сенсибилизирующих антител 1:10000 достигалось получение достоверного результата (1:256 или 8,0 log2 SN50). При меньших разведений антител наблюдали высокие фоновые значения, что не позволяло получить корректный результат. При большем разведении отмечали снижение детектируемых значений уровня гуморального иммунитета в сыворотках крови животных. При исследовании неспецифических и отрицательных сывороток получали отрицательные результаты, что свидетельствовало о высокой специфичности разработанного способа.
Для анализа исследовали следующие разведения детекторных антител: 1:3000, 1:4000, 1:5000, 1:6000. Разведения остальных компонентов были постоянны: для антигена - 1:2500, для сенсибилизирующих антител - 1:10000, конъюгата - 1:2500. В качестве контрольных сывороток для анализа применяли сыворотки, специфичные к определенным штаммам вируса ящура с активностью 8,0 log2 SN50. Из таблицы 3 следует, что при разведении детекторных антител 1:5000 достигалось получение достоверного результата (1:256 или 8,0 log2 SN50). При меньших разведений антител наблюдали высокие фоновые значения, что не позволяло получить корректный результат. При большем разведении наблюдали снижение детектируемого значения титра антител в сыворотках крови животных. При исследовании неспецифических и отрицательных сывороток отмечали отрицательные результаты, что свидетельствовало о высокой специфичности разработанного способа.
Для анализа исследовали следующие разведения антигена: 1:1500, 1:2000, 1:2500, 1:3000. Разведения остальных компонентов были постоянны: для детекторных антител - 1:5000, для сенсибилизирующих антител - 1:10000, конъюгата - 1:2500. В качестве контрольных сывороток для анализа применяли сыворотки, специфичные к определенным штаммам вируса ящура с активностью 8,0 log2 SN50. Из таблицы 4 следует, что при разведении антигена 1:2500 достигалось получение достоверного результата (1:256 или 8,0 log2 SN50). При меньших разведениях наблюдали высокие фоновые значения, что не позволяло получить корректный результат. При большем разведении наблюдали снижение детектируемого значения титра антител в сыворотках крови животных.
При исследовании неспецифических и отрицательных сывороток отмечали отрицательные результаты, что свидетельствовало о высокой специфичности разработанной тест-системы.
Таким образом, в ходе лабораторных исследований доказано, что рабочие разведения антигена вируса ящура штамма «А/Танзания/2013», сенсибилизирующих и детекторных антител составили 1:2500, 1:10000, 1:5000, соответственно.
Пример 5. Применение тест-системы для определения титра антител против структурных белков вируса ящура штамма «А/Танзания/2013» с помощью жидкофазного ИФА
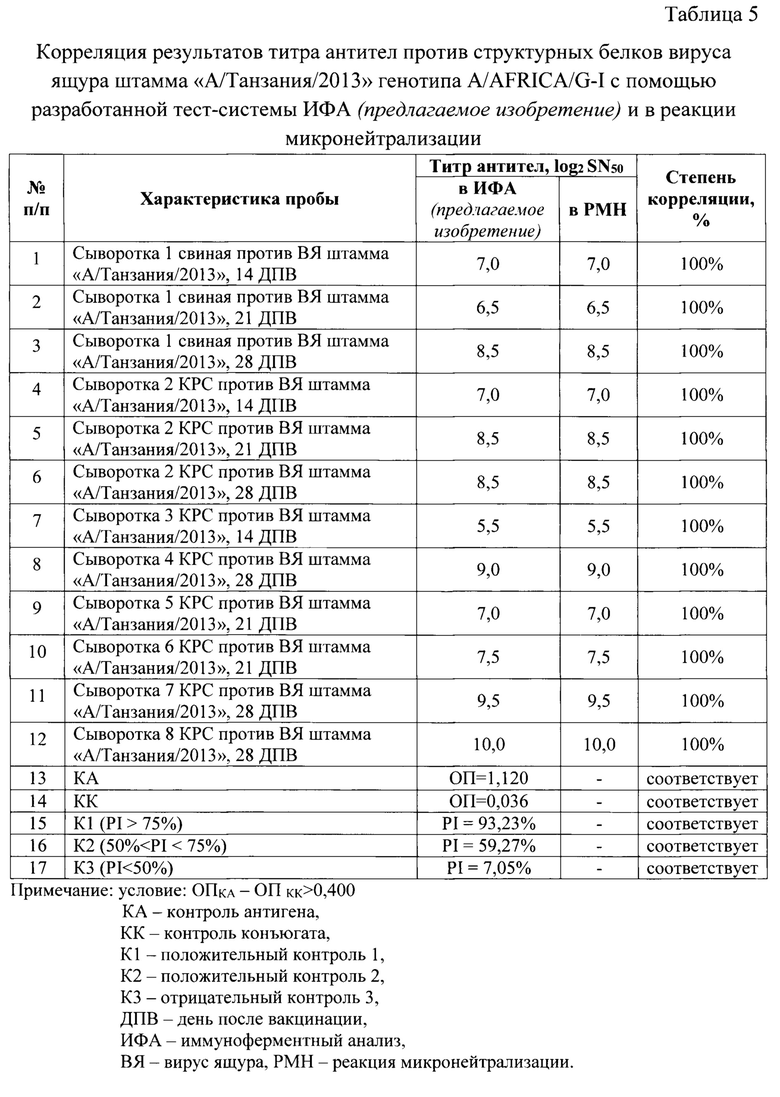
Исследовали 12 сывороток крови животных, полученных после иммунизации инактивированными сорбированными вакцинами против ящура, содержащими антиген вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I. Определены значения уровня гуморального иммунитета с применением разработанной тест-системы ИФА (предлагаемое изобретение), а также данные сыворотки были исследованы в реакции микронейтрализации (РМН) в чувствительной перевиваемой монослойной клеточной линии IB-RS-2, рекомендованной МЭБ (OIE) [2]. Полученные результаты отражены в таблице 5, из которой следует, что степень корреляции результатов разработанной тест-системы ИФА (предлагаемое изобретение) и классического метода РМН высокая (приближено к 100%).
Пример 6. Определение диагностических показателей разработанной тест-системы для определения титра антител против структурных белков вируса ящура штамма «А/Танзания/2013» с помощью жидкофазного иммуноферментного анализа (предлагаемое изобретение).
Представленную тест-систему по определению титра антител против структурных белков вируса ящура штамма «А/Танзания/2013» с помощью жидкофазного иммуноферментного анализа (предлагаемое изобретение) исследовали на стандартные диагностические показатели. Для определения чувствительности предложенной тест-системы анализировали 450 сывороток крови животных, которые являлись заведомо положительными по данным реакции микронейтрализации в чувствительной перевиваемой монослойной клеточной линии почки свиньи IB-RS-2. Уровень антител для данных сывороток крови находилась в диапазоне 5,5-10,0 log2 SN50. Постановку ИФА проводили, как отражено выше. Разработанной тест-системой (предлагаемое изобретение) определили, что из 450 образцов сывороток крови 448 определены в качестве положительных, а 2 - в качестве отрицательных (уровень гуморального иммунитета по данным ИФА составил 1:24).
Для исследования специфичности метода тестировали 185 отрицательных сывороток крови животных. В результате исследования с помощью ИФА (предлагаемое изобретение) определили, что все 185 определены в качестве отрицательных.
Определили, что в 95%-ном доверительном интервале диагностическая чувствительность (DSe) составила 98,41-99,95%, диагностическая специфичность (DSp) - 98,03-100,00%, k-критерий - 0,992; прогностичность отрицательного результата (NPV) - 96,19-99,87%, общая точность (DAc) - 98,87-99,96% (табл.6).
Таким образом предлагаемая «Тест-система для определения титра антител против структурных белков вируса ящура штамма «А/Танзания/2013» с помощью жидкофазного иммуноферментного анализа» является специфичной и чувствительной, позволяющей провести анализ сывороток крови животных с количественным определением титра антител против структурных белков вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA-I. Данный штамм и соответствующий ему генотип является актуальным и быстро распространяющимся на территории Африканского континента, а также в странах Ближнего Востока. Разработанная тест-система будет направлена на подтверждение высокой эффективности производимых в РФ противоящурных инактивированных вакцин, содержащих антиген данного штамма, и, тем самым, на защиту территории России и граничащих с ней на юге стран от распространения вируса ящура генотипа A/AFRICA/G-I.
Источники информации, принятые во внимание при составлении описания изобретения к заявке на выдачу патента РФ на изобретение «Тест-система для определения титра антител против структурных белков вируса ящура штамма «А/Танзания/2013» с помощью жидкофазного иммуноферментного анализа»:
1. Груздев, К.Н. Программа совместных действий по профилактике и борьбе с ящуром животных в странах СНГ / К.Н. Груздев, В.М. Захаров, A.M. Рахманов // Труды Федерального центра охраны здоровья животных. -Владимир, 2005. - Т. 3. - С.3-13.
2. OIE. Manual of diagnostic tests and vaccines for terrestrial animals. -Paris, 2018.-Chapter 2.1.8.
3. Гуленкин, В.М. Экономическая эффективность проведения профилактической вакцинации животных против ящура на территории Российской Федерации / В.М. Гуленкин // Труды Федерального центра охраны здоровья животных. - Владимир, 2012. - Т. 10. - С. 31-41.
4. Brooksby, J. В. 1982. Portraits of viruses: foot-and-mouth disease virus. Intervirology 18:1-23.
5. Rueckert, R. R., and E. Wimmer. 1984. Systematic nomenclature of picornavirus proteins. J. Virol. 50:957-959.
6. Grubman, M. J. 1980. The 5' end of foot-and-mouth disease virion RNA contains a protein covalently linked to the nucleotide pUp.Arch. Virol. 63:311-315.
7. Domingo, E., C. Escarmis, E. Baranowski, С.M. Ruiz-Jarabo, E. Carrillo, J. I. Nunez, and F. Sobrino. 2003. Evolution of foot-and-mouth disease virus. Virus Res. 91:47-63.
8. Sobrino, F., M. Davila, J. Ortin, and E. Domingo. 1983. Multiple genetic variants arise in the course of replication of foot-and-mouth disease virus in cell culture. Virology 128:310-318.
9. Динамика развития противоящурного гуморального иммунитета у крупного рогатого скота, иммунизированного трехвалентной сорбированной вакциной типов А, О, Азия-1 / Д.В. Михалишин, Т.Н. Лезова // Труды Федерального центра охраны здоровья животных. - Владимир, 2007. - Т. 5. - С. 75-82.
10. Wong C.L., Yong C.Y., Ong Н.К., Но K.L., Tan W.S. Advances in the Diagnosis of Foot-and-Mouth Disease // Front Vet Sci. - 2020 Aug 21. - V. 7. - P. 477.
11. Curry S., Abu-Ghazaleh R., Blakemore W., Fry E., Jackson Т., King A., Lea S., Logan D., Newman J., Stuart D. Crystallization and preliminary X-ray analysis of three serotypes of foot-and-mouth disease virus // J. Mol Biol. - 1992. - V. 228(4). -P. 1263-1268.
12. King, A. M., D. McCahon, K. Saunders, J. W. Newman, and W. R. Slade. 1985. Multiple sites of recombination within the RNA genome of foot-and-mouth disease virus. Virus Res. 3:373-384.
13. Tosh, C, D. Hemadri, and A. Sanyal. 2002. Evidence of recombination in the capsid-coding region of type A foot-and-mouth disease virus. J. Gen. Virol. 83:2455-2460.
14. Fry E.E., Stuart D.I., Rowlands D.J. The structure of foot-and-mouth disease virus // Curr Top Microbiol Immunol - 2005. - V. 288. - P. 71-101.
15. Palmenberg A.C. Proteolytic processing of picornaviral polyprotein // Annu Rev Microbiol. - 1990. - V. 44. - P. 603-623.
16. Curry S., Fry E., Blakemore W., Abu-Ghazaleh R., Jackson Т., King A., Lea S., Newman J., Stuart D. Dissecting the roles of VP0 cleavage and RNA packaging in picornavirus capsid stabilization: the structure of empty capsids of foot-and-mouth disease virus // J. Virol. - 1997. - V. 71(12). - P. 9743-9752.
17. Anon N. Global Strategy for control of foot-and-mouth disease. - In, Bangkok, Thailand, - 2012. - P. 27-29.
18. Saitou N. and Nei M. (1987). The neighbor-joining method: A new method for reconstructing phylogenetic trees. Molecular Biology and Evolution 4:406-425.
19. Felsenstein J. (1985). Confidence limits on phylogenies: An approach using the bootstrap.Evolution 39:783-791.
20. Tamura K., Nei M., and Kumar S. (2004). Prospects for inferring very large phylogenies by using the neighbor-joining method. Proceedings of the National Academy of Sciences (USA) 101:11030-11035.
21. Kumar S., Stecher G., Li M., Knyaz C, and Tamura K. (2018). MEGA X: Molecular Evolutionary Genetics Analysis across computing platforms. Molecular Biology and Evolution 35:1547-1549.
22. Oem J.K., Park J.FL, Lee K.N., Kim Y.J., Kye S.J., Park J.Y., Song H.J. Characterization of recombinant foot-and-mouth disease virus pentamer-like structures expressed by baculovirus and their use as diagnostic antigens in a blocking ELISA // Vaccine. - 2007. - V. 25(20). - P. 4112-412.
23. Lewis S.A., Morgan D.O., Grubman M.J. Expression, processing, and assembly of foot-and-mouth disease virus capsid structures in heterologous systems: induction of a neutralizing antibody response in guinea pigs // J. Virol. - 1991. - V. 65(12). -P.6572-6580.
24. Cao Y., Lu Z., Sun J., Bai X., Sun P., Bao H., Chen Y., Guo J., Li D., Liu X., Liu Z. Synthesis of empty capsid-like particles of Asia I foot-and-mouth disease virus in insect cells and their immunogenicity in guinea pigs // Vet. Microbiol. - 2009. -V. 137(1-2). - P. 10-17.
25. Sharma GK, Mahajan S, Matura R, Subramaniam S, Mohapatra JK, Pattnaik B. Quantitative single dilution liquid phase blocking ELISA for sero-monitoring of foot-and-mouth disease in India. Biologicals. 2015 May;43(3): 158-64.
26. Robiolo B, La Torre J, Duffy S, Leon E, Seki C, Torres A, Mattion N. Quantitative single serum-dilution liquid phase competitive blocking ELISA for the assessment of herd immunity and expected protection against foot-and-mouth disease virus in vaccinated cattle. J Virol Methods. 2010 Jun;166(l-2):21-7.
27. IZSLER ELISA. URL: https://www.fao.org/fileadmin/useruploaoVeufmd/docs/Open_Session2012/Appendices/75_New_Elisa_for_diagnosis_Brocchi_.pdf (Дата обращения: 15.05.2023).
28. PrioCHECK ELISA. URL: http://vetprofilab.ru/f/priocheck_fmdv_antibody_elisa_kit_cut.pdf (Дата обращения: 14.05.2023).
29. Патент РФ №2787714, 11.01.2023. Тест-система на основе жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА для определения титра антител против вируса ящура штамма А №2269/ВНИИЗЖ/2015 генотипа A/ASIA/G-VII в сыворотках крови животных после иммунизации // Заявка №2022108324.
30. Патент РФ №2791614, 13.03.2023. Тест-система на основе жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА для определения титра антител против вируса ящура штамма О №2047/Саудовская Аравия/2008 генотипа O/ME-SA/PanAsia2 в сыворотках крови животных после иммунизации // Заявка №2022119118.
31. Патент РФ №2796393,23.05.2023. Способ быстрого количественного определения уровня гуморального иммунитета животных к штамму О №2311/Забайкальский/2016 генотипа O/ME-SA/Ind-2001 вируса ящура после вакцинации с помощью жидкофазного «сэндвич»-варианта ИФА // Заявка №2022113420.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="FMDV Strain A
Tanzania 2013 ELISA.xml" softwareName="WIPO Sequence"
softwareVersion="2.1.2" productionDate="2023-06-08">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2023-06-08</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>510</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2023-06-08</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">ФГБУ "Федеральный центр охраны
здоровья животных" (ФГБУ "ВНИИЗЖ")</ApplicantName>
<ApplicantNameLatin>FGBI "ARRIAH"</ApplicantNameLatin>
<InventorName languageCode="ru">Доронин Максим
Игоревич</InventorName>
<InventorNameLatin>Doronin Maksim Igorevich </InventorNameLatin>
<InventionTitle languageCode="ru">Тест-система для определения титра
антител против структурных белков вируса ящура штамма
«А/Танзания/2013» с помощью жидкофазного иммуноферментного
анализа</InventionTitle>
<SequenceTotalQuantity>2</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>663</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..663</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q1">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>FMDV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>accacatcggcgggtgaaggcgcagagcccgtgactaccgatgcatcac
agcatggcggtgggcgccgcgccacgcgcaggcaacacactgacgtggctttcctccttgaccggttcac
cctggtcgggaagactgctggcaacagattgacactggacctgctccagaccaaggagaaagcactggtg
ggcgcaatcctgcgcgctgccacgtactacttctcggacttggaggtggcttgtgttggtacgaacaagt
gggtcggctggacgccgaacggcgcgccagaactcagtgaggtcggcgacaacccagtcgtcttctctca
caacgggaccacacgctttgctctaccatacactgccccacacagatgtcttgctactgcctacaacggc
gactgcaagtacaaaccaaccagtgaggcaccgcggacgcacatccgtggggaccttgcggcactcgctg
agcgcatcgctagcgagacacacatcccaaccacctttaactatggcaggatctacacagaggcggaagt
cgacgtgtatgtgaggatgaagcgggcggagctctactgcccacgcccggtgctgactcactatgaccac
caggacaaggaccgctacaaagtggccctgacaaagcctgccaaacaactgtgc</INSDSeq_sequen
ce>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>221</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..221</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>FMDV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>TTSAGEGAEPVTTDASQHGGGRRATRRQHTDVAFLLDRFTLVGKTAGNR
LTLDLLQTKEKALVGAILRAATYYFSDLEVACVGTNKWVGWTPNGAPELSEVGDNPVVFSHNGTTRFALP
YTAPHRCLATAYNGDCKYKPTSEAPRTHIRGDLAALAERIASETHIPTTFNYGRIYTEAEVDVYVRMKRA
ELYCPRPVLTHYDHQDKDRYKVALTKPAKQLC</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Тест-система для количественного определения уровня гуморального иммунитета животных против антигена вируса ящура A N 2205/G-IV генотипа A/AFRICA/G-IV с помощью жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА | 2022 |
|
RU2798510C1 |
| Тест-система для выявления антител к структурным белкам вируса ящура штамма "SAT-1/Кения/2017" с помощью жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА | 2023 |
|
RU2821044C1 |
| Тест-система для определения антител к структурным белкам вируса ящура генотипа A/ASIA/Iran-05 с помощью жидкофазного блокирующего иммуноферментного анализа | 2024 |
|
RU2834234C1 |
| Вакцина против ящура генотипа A/AFRICA/G-I из штамма "А/Танзания/2013" культуральная инактивированная сорбированная | 2023 |
|
RU2815536C1 |
| Тест-система для определения уровня антител против антигена вируса ящура генотипа A/ASIA/SEA-97 с помощью жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА | 2023 |
|
RU2804845C1 |
| Штамм "А/Кения/G-VII" вируса ящура Aphtae epizooticae серотипа А для изготовления биопрепаратов для диагностики и специфической профилактики ящура | 2024 |
|
RU2837722C1 |
| Тест-система для определения титра антител против структурных белков вируса ящура штамма "Азия-1 N 2356/14/2018" с помощью жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА | 2023 |
|
RU2812211C1 |
| Тест-система для определения титра антител против 146S частиц вируса ящура генотипа SAT-2/IV с помощью жидкофазного ИФА | 2023 |
|
RU2811996C1 |
| Штамм "А/Египет/Africa G-IV/2022" вируса ящура Aphtae epizooticae генотипа А/AFRICA/G-IV для изготовления биопрепаратов для диагностики и специфической профилактики ящура | 2024 |
|
RU2831181C1 |
| Тест-система на основе жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА для определения титра антител против вируса ящура штамма А N2269/ВНИИЗЖ/2015 генотипа A/ASIA/G-VII в сыворотках крови животных после иммунизации | 2022 |
|
RU2787714C1 |

Изобретение относится к области биотехнологии. Описана тест-система для определения титра антител против структурных белков вируса ящура штамма «А/Танзания/2013» с помощью жидкофазного иммуноферментного анализа. Технический результат заключается в разработке современной, специфической против структурных белков вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I и чувствительной тест-системы, предназначенной для определения титра антител против структурных белков указанного штамма вируса ящура методом жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА на основе применения инактивированного вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I и при получении иммуноспецифических компонентов реакции. 1 з.п. ф-лы, 3 ил., 6 табл., 6 пр.
1. Тест-система для определения титра антител против структурных белков вируса ящура штамма «А/Танзания/2013» с помощью жидкофазного иммуноферментного анализа, содержащая:
- иммуноспецифические компоненты: антиген вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I лиофилизированный с активностью в ИФА 1:2500; сенсибилизирующие антитела - иммуноглобулины G кролика против структурных белков вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I лиофилизированные с активностью в ИФА 1:10000; детекторные антитела - иммуноглобулины G морской свинки против структурных белков вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I лиофилизированные с активностью в ИФА 1:5000; контроль 1 - положительная сыворотка крови телят к структурным белкам вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I лиофилизированная с процентом ингибиции 75-100%; контроль 2 - положительная сыворотка крови телят к структурным белкам вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I лиофилизированная с процентом ингибиции от 50% до 74,9%; контроль 3 - отрицательная сыворотка крови телят, не содержащая антитела к вирусу ящура; блокирующий компонент; антивидовой иммунопероксидазный конъюгат - иммуноглобулины кролика против Ig G морской свинки, конъюгированные с пероксидазой хрена, с активностью в ИФА 1:2500;
- неспецифические компоненты: буферный раствор на основе карбоната и гидрокарбоната натрия с рН 9,5-9,7; 20-кратный концентрат буферного раствора; хромогенный субстрат - ABTS, «стоп»-раствор - 1,0%-ный раствор кокосульфата натрия; отличающаяся тем, что для изготовления иммуноспецифических компонентов применяется культуральный инактивированный вирус ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I; и для определения процента ингибиции используются данные абсорбционности, при этом титр антител против структурных белков вируса ящура штамма «А/Танзания/2013» определяется как максимальное разведение исследуемого материала, для которой значение процента ингибиции составляет ≥50%.
2. Тест-система по п. 1, отличающаяся тем, что является специфичной и чувствительной, позволяющей определять титр антител против структурных белков вируса ящура штамма «А/Танзания/2013» генотипа A/AFRICA/G-I в течение 3 часов и количественно определять уровень гуморального иммунитета в широком диапазоне 4,0-11,0 log2 SN50.
| Штамм А 2205/G IV вируса ящура Aphtae epizooticae типа А для изготовления биопрепаратов для диагностики и специфической профилактики ящура типа А | 2021 |
|
RU2773659C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ТИТРОВ АНТИТЕЛ МЕТОДОМ ИММУНОФЕРМЕНТНОГО АНАЛИЗА ПРИ ДИАГНОСТИКЕ ВИРУСНЫХ ИНФЕКЦИЙ | 2002 |
|
RU2212038C1 |
| Goris N, Willems T, Diev VI, Merkelbach-Peters P, Vanbinst T, Van der Stede Y, Kraft HP, Zakharov VM, Borisov VV, Nauwynck HJ, Haas B, De Clercq K | |||
| Indirect foot-and-mouth disease vaccine potency testing based on a serological alternative | |||
| Vaccine | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| doi: | |||
Авторы
Даты
2024-05-06—Публикация
2023-07-31—Подача