ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается приоритет предварительной заявки США № 62/772001, поданной 27 ноября 2018 года, содержание которой включено в настоящее описание посредством ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
[0002] Изобретение относится к способам применения дантролена, пролекарств дантролена или их фармацевтически приемлемых солей для лечения радиационного воздействия.
УРОВЕНЬ ТЕХНИКИ
[0003] Острый лучевой синдром (ARS), также известный как радиационная токсичность или лучевая болезнь, представляет собой острое медицинское состояние, вызываемое радиационным облучением всего организма (или значительной части организма) посредством высокой дозы проникающей радиации за короткий период времени, как правило, минуты. Основной причиной ARS является истощение плюрипотентных клеток в определенных тканях. Как правило, после ARS следует прогнозируемое клиническое течение, и он характеризуется признаками и симптомами, которые являются проявлениями клеточного дефицита и реакций различных тканей и органов на ионизирующее излучение. Воздействие ионизирующей радиации в высокой дозе на целый организм или значительные его части часто приводит у угрожающим жизни повреждениям, в основном повреждениям радиочувствительных самообновляющихся тканей, но наиболее значительно гемопоэтической системы. Выживаемость пациентов с гемопоэтическим синдромом уменьшается при повышении радиационного воздействия. Основной причиной смерти является разрушение костного мозга, вызывающее инфекцию и кровотечения.
[0004] Являются необходимыми способы лечения радиационного воздействия.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0005] Изобретение относится к способам лечения индивидуума, который подвергнут или будет подвергнут радиационному излучению, включающим введение индивидууму фармацевтической композиции, содержащей терапевтически эффективное количество дантролена или его фармацевтически приемлемой соли.
[0006] Изобретение также относится к способам лечения индивидуума, который подвергнут или будет подвергнут радиационному воздействию, включающим введение индивидууму фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I
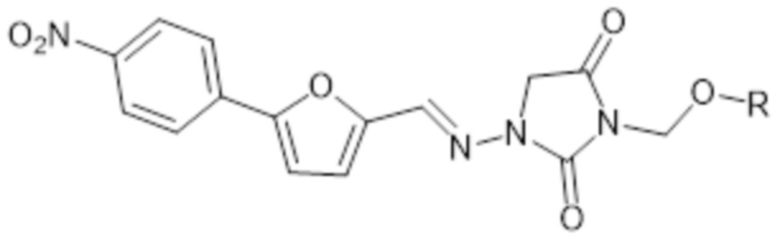 I
I
где R представляет собой -P(O)(OH)2 или -P(O)(OR1)(OR2); R1 представляет собой H, -C1-26алкил, арил, C1-6алкC(O)O-C1-26алкил, -C1алкOC(O)C1-26алкил или C1алкOC(O)OC1-26алкил; и R2 представляет собой -C1-26алкил, арил, C1-6алкC(O)O-C1-26алкил, -C1алкOC(O)C1-26алкил или C1алкOC(O)OC1-26алкил; или его фармацевтически приемлемой соли.
[0007] Также изобретение относится к способам лечения индивидуума, который подвергнут или будет подвергнут радиационному воздействию, включающим введение индивидууму фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы II
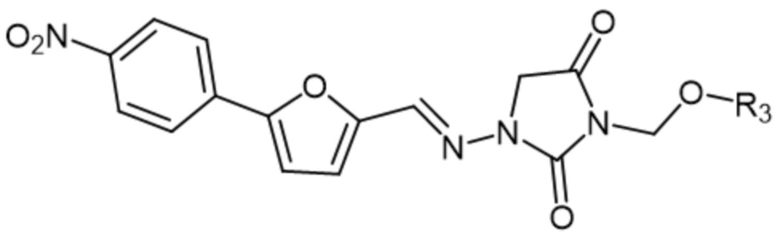 II
II
где R3 представляет собой H, -C(O)-Z-N(R4)(R5), -C(O)Z-C(O)-OH или -C(O)-NH-Y-CH2-OC(O)-Z-C(O)-OH; Z представляет собой C1-6алк; Y представляет собой арилен; C1-6алкил; R5 представляет собой H или C1-6алкил; или R4 и R5, вместе с азотом, к которому они присоединены, образуют гетероциклоалкил; а также его фармацевтически приемлемых солей.
[0008] Также изобретение относится к способам лечения индивидуума, который подвергнут или будет подвергнут радиационному воздействию, включающим введение индивидууму фармацевтической композиции, содержащей терапевтически эффективное количество комбинации любого из дантролена, соединения формулы I, соединения формулы II или его фармацевтически приемлемой соли.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0009] Краткое, а также приведенное ниже подробное описание, станет более понятным при его прочтении с прилагаемыми чертежами. Для иллюстрации описанных устройств, систем и способов на чертежах представлены иллюстративные варианты осуществления устройств, систем и способов; однако устройства, системы и способы не ограничиваются конкретными описанными вариантами осуществления. На чертежах:
[0010] На фиг.1 представлена гистограмма, изображающая процентное изменение эритроцитов (RBC) между 7 сутками и 30 сутками у животных, которым вводили Ryanodex, группы 1-4. Группы 1: контроль; 2: Ryanodex до облучения; 3: Ryanodex в однократной дозе после облучения; и 4: Ryanodex посредством многократных доз после облучения (сутки 1-5).
[0011] На фиг.2 представлена гистограмма, на которой изображено процентное изменение лейкоцитов (WBC) между 7 сутками и 30 сутками у животных, которым вводили Ryanodex, группы 1-4. Группы 1: контроль; 2: Ryanodex до облучения; 3: Ryanodex в однократной дозе после облучения; и 4: Ryanodex посредством многократных доз после облучения (сутки 1-5). Группы 1: контроль; 2: Ryanodex до облучения; 3: Ryanodex в однократной дозе после облучения; и 4: Ryanodex посредством многократных доз после облучения (сутки 1-5).
[0012] На фиг.3 представлена гистограмма, на которой показано процентное изменение нейтрофилов в крови между 7 сутками и 30 сутками у животных, которым вводили Ryanodex, группы 1-4. Группы 1: контроль; 2: Ryanodex до облучения; 3: Ryanodex в однократной дозе после облучения; и 4: Ryanodex посредством многократных доз после облучения (сутки 1-5).
[0013] На фиг.4 представлена гистограмма, на которой показано процентное изменение лимфоцитов в крови между 7 сутками и 30 сутками у животных, которым вводили Ryanodex, группы 1-4. Группы 1: контроль; 2: Ryanodex до облучения; 3: Ryanodex в однократной дозе после облучения; и 4: Ryanodex посредством многократных доз после облучения (сутки 1-5).
[0014] На фиг.5 представлена гистограмма, на которой представлено процентное изменение тромбоцитов крови между 7 сутками и 30 сутками у животных, которым вводили Ryanodex, группы 1-4. Группы 1: контроль; 2: Ryanodex до облучения; 3: Ryanodex в однократной дозе после облучения; и 4: Ryanodex посредством многократных доз после облучения (сутки 1-5).
[0015] На фиг.6 представлена серия гистограмм, на которых представлено измерение гемоглобина (HgB) на 7 сутки и 30 сутки у животных, которым вводили Ryanodex, группы 1-4. Группы 1: контроль; 2: Ryanodex до облучения; 3: Ryanodex в однократной дозе после облучения; и 4: Ryanodex посредством многократных доз после облучения (сутки 1-5).
[0016] На фиг.7 представлена серия гистограмм, на которых представлено измерение гематокрита (HCT) на 7 сутки и 30 сутки у животных, которым вводили Ryanodex, группы 1-4. Группы 1: контроль; 2: Ryanodex до облучения; 3: Ryanodex в однократной дозе после облучения; и 4: Ryanodex посредством многократных доз после облучения (сутки 1-5).
[0017] На фиг.8A-8C представлена серия графиков, на которых изображено среднее процентное изменение массы тела от исходного уровня с 3 суток до 30 суток после облучения для групп 1-4. Фиг.8A: общее изменение массы тела. Фиг.8B: изменение массы тела для подгруппы A. Фиг.8C: изменение массы тела для подгруппы B. Группы 1: контроль; 2: Ryanodex до облучения; 3: Ryanodex в однократной дозе после облучения; и 4: Ryanodex посредством многократных доз после облучения (сутки 1-5).
[0018] На фиг.9A-9C представлена серия графиков, изображающих среднегрупповой показатель смертности с 1 суток по 30 сутки после облучения для животных, которым вводили контрольный носитель (стерильная вода), Ryanodex за 1 ч до облучения, Ryanodex на 1 сутки после облучения и Ryanodex на 1-5 сутки после облучения. Фиг.9A: Общие средние показатели смертности. Фиг.9B: Средние показатели смертности для подгруппы A. Фиг. 9C: Средние показатели смертности для подгруппы B.
ПОДРОБНОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0019] Настоящее изобретение может стать более понятным с помощью следующего подробного описания совместно с прилагаемыми чертежами и примерами, которые составляют часть настоящего описания. Следует понимать, что настоящее изобретение не ограничивается конкретными композициями или способами, описанными и/или показанными в настоящем описании, и что терминология, используемая в настоящем описании, предназначена для описания конкретных вариантов осуществления только в качестве примера и не предназначена для ограничения заявленного изобретения. Также, как используют в описании, включая прилагаемую формулу изобретения, форма единственного числа включает множественное, и указание на конкретную числовую величину включает по меньшей мере эту конкретную величину, если контекст явно не указывает на иное. Все диапазоны являются инклюзивными и комбинируемыми.
[0020] Определение "приблизительно" следует считать раскрывающим диапазон, определяемый абсолютными величинами двух конечных значений. Например, выражение "от приблизительно 2 до приблизительно 4" также описывает диапазон "от 2 до 4". При использовании для определения одного числа термин "приблизительно" может относиться к плюс или минус 10% от указанного числа и включает указанное число. Например, "приблизительно 10%" может указывать на диапазон от 9% до 11%, и "приблизительно 1" означает от 0,9 до 1,1.
[0021] Должно быть понятно, что определенные признаки изобретения, которые для ясности описаны в настоящем описании в контексте отдельных вариантов осуществления, могут быть предоставлены в комбинации в одном варианте осуществления. Напротив, различные признаки изобретения, которые для краткости описаны в контексте одного варианта осуществления, также могут предусматриваться отдельно или в любой подкомбинации. Кроме того, указание на величины, приведенные в диапазонах, включает каждую величину в этом диапазоне.
[0100] Как используют в рамках изобретения, термин "фармацевтическая композиция" означает композицию, пригодную для введения человеку, и он включает фармацевтически приемлемые эксципиенты, например, но не ограничиваясь ими, стабилизаторы, объемообразующие агенты, буферы, носители, разбавители, наполнители, солюбилизаторы и связующие вещества. Как используют в рамках изобретения, фармацевтическая композиция включает, но не ограничивается ими, жидкую форму, готовую для подкожной инъекции или инфузии и внутримышечной инъекции.
[0101] "Терапевтически эффективное количество" относится к количеству активного фармацевтического средства, описанного в настоящем описании, которое является достаточным для ингибирования, остановки или обеспечения улучшения нарушения или состояния, подвергаемого лечению, у конкретного индивидуума или в популяции индивидуумов. В определенных вариантах осуществления у человека или другого животного терапевтически эффективное количество может быть определено экспериментально в лабораторных или клинических условиях, или может представлять собой количество, требуемое правительственными правилами для конкретного заболевания и подвергаемого лечению индивидуума.
[0102] Как используют в рамках изобретения, "смягчать" относится к уменьшению тяжести нарушения или состояния, подвергаемого лечению, у конкретного индивидуума или в популяции индивидуумов.
[0103] Как используют в рамках изобретения, под "пациентом" или "индивидуумом" подразумевают млекопитающее. Таким образом, способы, описанные в настоящем описании, применимы для человека и не являющихся человеком индивидуумов. Способы, описанные в настоящем описании, особенно применимы для человека.
[0022] Термин "фармацевтически приемлемый", как используют в рамках изобретения, означает, что данный материал является фармацевтически приемлемым, например, компоненты, включая контейнеры, фармацевтической композиции, не вызывают неприемлемого снижения фармакологической активности или неприемлемых неблагоприятных побочных эффектов. Примеры фармацевтически приемлемых компонентов приведены в The United States Pharmacopeia (USP), The National Formulary (NF), утвержденной на Фармакопейной конвенции США, проведенной в Rockville, Md. в 1990 и FDA Inactive Ingredient Guide 1990, 1996, выпущенном Управлением США по санитарному надзору за качеством пищевых продуктов и медикаментов (оба из которых включены в настоящее описание в качестве ссылок, включая любые чертежи). Также можно использовать другие категории растворов или компонентов, которые удовлетворяют необходимым пределам и/или спецификациям, не входящим в USP/NF.
[0023] Термин "фармацевтически приемлемая соль", как используют в рамках изобретения, означает соль соединения по изобретению, которая является фармацевтически приемлемой и которая обладает требуемой фармакологической активностью исходного соединения. В частности, такие соли являются нетоксичными и могут представлять собой неорганические или органические кислотно-аддитивные соли и основно-аддитивные соли. В частности, такие соли включают: соли, образованные, когда кислотная часть, присутствующая в исходном соединении, либо заменена ионом металла, например ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия; либо скоординирована с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, N-метилглюкамин и т.п. Кроме того, соли включают, только в качестве примера, натрий, калий, кальций, магний, аммоний, тетраалкиламмоний и т.п.; и, когда соединение содержит основную функциональную группу, соли нетоксичных органических или неорганических кислот, такие как гидрохлорид, гидробромид, тартрат, мезилат, ацетат, малеат, оксалат и т.п.
[0024] Как используют в рамках изобретения, выражения "в результате радиационного воздействия" и "вследствие радиационного воздействия" относятся к эффектам, которые являются прямым последствием радиационного воздействия, а также к эффектам, которые являются вторичным последствием радиационного воздействия, а также к эффектам, которые являются непрямым последствием радиационного воздействия.
[0025] Термин "C1-C6алк" относится к алифатическому линкеру, имеющему 1, 2, 3, 4, 5 или 6 атомов углерода, и он включает, например, -CH2-, -CH(CH3)-, -CH(CH3)-CH2- и -C(CH3)2-. Термин "-C0алк-" относится к связи.
[0026] Термин "алкил" относится к прямой или разветвленной углеводородной группе, имеющей от 1 до 12 атомов углерода ("C1-C12"), предпочтительно от 1 до 6 атомов углерода ("C1-C6"), в группе. Примеры алкильных групп включают метил (Me, C1алкил), этил (Et, C2алкил), н-пропил (C3алкил), изопропил (C3алкил), бутил (C4алкил), изобутил (C4алкил), втор-бутил (C4алкил), трет-бутил (C4алкил), пентил (C5алкил), изопентил (C5алкил), трет-пентил (C5алкил), гексил (C6алкил), изогексил (C6алкил) и т.п.
[0027] Термин "гетероциклоалкил" относится к любой трех-десяти-членной моноциклической или бициклической насыщенной кольцевой структуре, содержащей по меньшей мере один гетероатом, выбранный из группы, состоящей из O, N и S. Примеры подходящих гетероциклоалкильных групп включают, но не ограничиваются ими, азепанил, азиридинил, азетидинил, пирролидинил, пиперазинил, пиперидинил, морфолинил, тиоморфолинил и т.п.
[0028] Термин "арил", когда его используют отдельно или в качестве части группы заместителя, относится к моно- или бициклической ароматической углеводородной кольцевой структуре, имеющей 6 или 10 атомов углерода в кольце. Предпочтительные арильные части включают фенил и нафтил.
[0029] Термин "арилен" относится к моно- или бициклической ароматической углеводородной кольцевой структуре, имеющей 6 или 10 атомов углерода в кольце. Предпочтительные ариленовые части включают фенилен и нафтилен. Соединения по изобретению могут быть хиральными и в результате могут существовать в качестве одного энантиомера или смеси энантиомеров. Все энантиомеры и их смеси охватываются настоящим изобретением.
[0030] Помимо прочего, изобретение относится к способам лечения индивидуума, подвергнутого радиационному воздействию, посредством введения фармацевтической композиции, содержащей дантролен или его фармацевтически приемлемую соль. В других аспектах изобретение относится к способам лечения индивидуума, который будет подвергнут радиационному излучению, посредством введения фармацевтической композиции, содержащей дантролен или его фармацевтически приемлемую соль.
[0031] Помимо прочего, изобретение относится к способам лечения индивидуума, подвергнутого воздействию радиационного излучения, посредством введения фармацевтической композиции, содержащей соединение формулы I:
 I
I
где
R представляет собой -P(O)(OH)2 или -P(O)(OR1)(OR2);
R1 представляет собой H, -C1-26алкил, арил, C1-6алкC(O)O-C1-26алкил, -C1алкОC(O)C1-26алкил или C1алкОC(O)OC1-26алкил; и
R2 представляет собой -C1-26алкил, арил, C1-6алкC(O)O-C1-26алкил, -C1алкОC(O)C1-26алкил или C1алкОC(O)OC1-26алкил,
или его фармацевтически приемлемую соль.
[0032] Также изобретение относится к способам лечения индивидуума, подвергнутого воздействию радиационного излучения, посредством введения фармацевтической композиции, содержащей соединение формулы II
 II
II
где
R3 представляет собой H, -C(O)-Z-N(R4)(R5), -C(O)Z-C(O)-OH или -C(O)-NH-Y-CH2-OC(O)-Z-C(O)-OH;
Z представляет собой C1-6алк;
Y представляет собой арилен; C1-6алкил;
R5 представляет собой H или C1-6алкил; или R4 и R5 вместе с азотом, к которому они присоединены, образуют гетероциклоалкил;
или его фармацевтически приемлемая соль.
[0033] Соединения формулы I и II представляют собой пролекарства дантролена, и они описаны в международной патентной заявке № PCT/US2018/056713, поданной 19 октября 2018 года, полное содержание которой включено в настоящем описании в качестве ссылки.
[0034] В других аспектах изобретение относится к способам лечения индивидуума, который будет подвергнут воздействию радиационного излучения, посредством введения фармацевтической композиции, содержащей дантролен или его фармацевтически приемлемую соль. В других аспектах изобретение относится к способам лечения индивидуума, который будет подвергнут воздействию радиационного излучения, посредством введения фармацевтической композиции, содержащей соединение формулы I или его фармацевтически приемлемую соль. В других аспектах изобретение относится к способам лечения индивидуума, который будет подвергнут воздействию радиационного излучения, посредством введения фармацевтической композиции, содержащей соединение формулы II или его фармацевтически приемлемую соль.
[0035] В других аспектах изобретение относится к способам лечения индивидуума, который будет подвергнут воздействию радиационного излучения, посредством введения фармацевтической композиции, содержащей дантролен, соединение формулы I, соединение формулы II или их фармацевтически приемлемую соль, или их комбинацию.
[0036] В некоторых аспектах пролекарства дантролена по изобретению представляют собой те, в которых R представляет собой -P(O)(OH)2 и которые имеют формулу I-A:
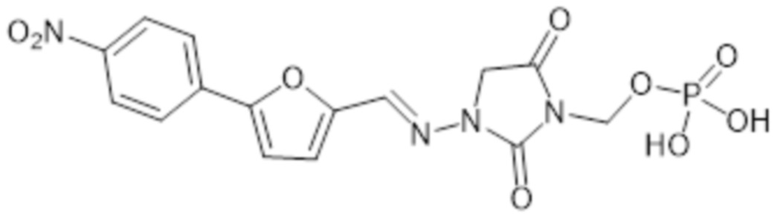 I-A
I-A
[0037] Также в объем изобретения входят фармацевтически приемлемые соли соединений формулы I-A. Предпочтительные соли включают, например, натриевые соли соединений формулы I-A. Также в объем изобретения входят литиевые, магниевые, кальциевые и калиевые соли соединений формулы I-A. Альтернативные солевые формы включают соли аммония, холина и трометамина. Предпочтительной солью соединения формулы I-A представляет собой мононатриевая соль. Другой предпочтительной солью соединения формулы I-A является динатриевая соль. Другой предпочтительной солью соединения формулы I-A является монотрометаминовая соль. Другой предпочтительной солью соединения формулы I-A является трометаминовая соль. Также в объем изобретения входят фармацевтически приемлемые органические соли соединений формулы I-A.
[0038] В некоторых аспектах пролекарства дантролена, используемые в способах по изобретению, представляют собой те, в которых R представляет собой -P(O)(OR1)(OR2) и которые имеют формулу I-B:
 I-B
I-B
[0039] В некоторых аспектах R1 представляет собой H. В этих аспектах R2 представляет собой -C1-26алкил, арил, C1-6алкC(O)O-C1-26алкил, -C1алкОC(O)C1-26алкил или C1алкОC(O)OC1-26алкил. Также в объем изобретения входят фармацевтически приемлемые соли таких соединений формулы I-B. Предпочтительные соли включают, например, натриевые соли соединений формулы I-B. Другие соли включают литиевые, магниевые, кальциевые и калиевые соли соединений формулы I-B. Альтернативные солевые формы включают аммониевые, холиновые и трометаминовые соли. Также в объем изобретения входят фармацевтически приемлемые органические соли соединений формулы I-B.
[0040] В некоторых аспектах соединений формулы I-B R1 представляет собой H и R2 представляет собой -C1-26алкил. Например, в некоторых аспектах R1 представляет собой H и R2 представляет собой -C1-6алкил. В других аспектах R1 представляет собой H и R2 представляет собой -C1-12алкил. В других аспектах R1 представляет собой H и R2 представляет собой -C13-26алкил. В других аспектах R1 представляет собой H и R2 представляет собой -C18-26алкил. В других аспектах R1 представляет собой H и R2 представляет собой -C20-26алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C1алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C2алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C3алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C4алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C5алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C6алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C7алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C8алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C9алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C10алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C11алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C12алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C13алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C14алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C15алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C16алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C17алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C18алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C19алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C20алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C21алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C22алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C23алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C24алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C25алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C26алкил.
[0041] В некоторых аспектах соединений формулы I-B R1 представляет собой H и R2 представляет собой арил. Например, в некоторых аспектах соединений формулы I-B R1 представляет собой H и R2 представляет собой фенил.
[0042] В некоторых аспектах соединений формулы I-B R1 представляет собой H и R2 представляет собой C1-6алкC(O)O-C1-26алкил. Например, в некоторых аспектах R1 представляет собой H и R2 представляет собой C1алкC(O)O-C1-26алкил. В других аспектах R1 представляет собой H и R2 представляет собой C2алкC(O)O-C1-26алкил. В других аспектах R1 представляет собой H и R2 представляет собой C3алкC(O)O-C1-26алкил. В других аспектах R1 представляет собой H и R2 представляет собой C4алкC(O)O-C1-26алкил. В других аспектах R1 представляет собой H и R2 представляет собой C5алкC(O)O-C1-26алкил. В других аспектах R1 представляет собой H и R2 представляет собой C6алкC(O)O-C1-26алкил. В других аспектах R1 представляет собой H и R2 представляет собой C1-6алкC(O)O-C1-6алкил. В других аспектах R1 представляет собой H и R2 представляет собой C1-6алкC(O)O-C1-12алкил. В других аспектах R1 представляет собой H и R2 представляет собой C1-6алкC(O)O-C13-26алкил. В других аспектах R1 представляет собой H и R2 представляет собой C1-6алкC(O)O-C18-26алкил. В других аспектах R1 представляет собой H и R2 представляет собой C1-6алкC(O)O-C20-26алкил.
[0043] В некоторых аспектах соединений формулы I-B R1 представляет собой H и R2 представляет собой -C1алкОC(O)C1-26алкил. Например, в некоторых аспектах R1 представляет собой H и R2 представляет собой -C1алкОC(O)C1-6алкил. В других аспектах R1 представляет собой H и R2 представляет собой -C1алкОC(O)C1-12алкил. R1 представляет собой H и R2 представляет собой -C1алкОC(O)C13-16алкил. R1 представляет собой H и R2 представляет собой -C1алкОC(O)C18-26алкил. R1 представляет собой H и R2 представляет собой -C1алкОC(O)C20-26алкил.
[0044] В некоторых аспектах соединений формулы I-B R1 представляет собой H и R2 представляет собой -C1алкОC(O)OC1-26алкил. Например, в некоторых аспектах R1 представляет собой H и R2 представляет собой -C1алкОC(O)OC1-6алкил. В других аспектах R1 представляет собой H и R2 представляет собой -C1алкОC(O)OC1-12алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C1алкОC(O)OC13-16алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C1алкОC(O)OC18-26алкил. В некоторых аспектах R1 представляет собой H и R2 представляет собой -C1алкОC(O)OC20-26алкил.
[0045] В других аспектах соединений формулы I-B R1 представляет собой -C1-26алкил, арил, C1-6алкC(O)O-C1-26алкил, -C1алкОC(O)C1-26алкил или C1алкОC(O)OC1-26алкил и R2 представляет собой -C1-26алкил, арил, C1-6алкC(O)O-C1-26алкил, -C1алкОC(O)C1-26алкил или C1алкОC(O)OC1-26алкил.
[0046] В некоторых аспектах соединений формулы I-B R1 представляет собой -C1-26алкил и R2 представляет собой -C1-26алкил, арил, C1-6алкC(O)O-C1-26алкил, -C1алкОC(O)C1-26алкил или C1алкОC(O)OC1-26алкил. Например, в этих аспектах R1 может представлять собой -C1-6алкил. В других аспектах R1 представляет собой -C1-12алкил. В других аспектах R1 представляет собой -C13-26алкил. В других аспектах R1 представляет собой -C18-26алкил. В других аспектах R1 представляет собой -C20-26алкил. В некоторых аспектах R1 представляет собой -C1алкил. В некоторых аспектах R1 представляет собой -C2алкил. В некоторых аспектах R1 представляет собой -C3алкил. В некоторых аспектах R1 представляет собой -C4алкил. В некоторых аспектах R1 представляет собой -C5алкил. В некоторых аспектах R1 представляет собой -C6алкил. В некоторых аспектах R1 представляет собой -C7алкил. В некоторых аспектах R1 представляет собой -C8алкил. В некоторых аспектах R1 представляет собой -C9алкил. В некоторых аспектах R1 представляет собой -C10алкил. В некоторых аспектах R1 представляет собой -C11алкил. В некоторых аспектах R1 представляет собой -C12алкил. В некоторых аспектах R1 представляет собой -C13алкил. В некоторых аспектах R1 представляет собой -C14алкил. В некоторых аспектах R1 представляет собой -C15алкил. В некоторых аспектах R1 представляет собой -C16алкил. В некоторых аспектах R1 представляет собой -C17алкил. В некоторых аспектах R1 -C18алкил. В некоторых аспектах R1 представляет собой -C19алкил. В некоторых аспектах R1 представляет собой -C20алкил. В некоторых аспектах R1 представляет собой -C21алкил. В некоторых аспектах R1 представляет собой -C22алкил. В некоторых аспектах R1 представляет собой -C23алкил. В некоторых аспектах R1 представляет собой -C24алкил. В некоторых аспектах R1 представляет собой -C25алкил. В некоторых аспектах R1 представляет собой -C26алкил.
[0047] В некоторых аспектах соединения формулы I-B R1 представляет собой арил и R2 представляет собой -C1-26алкил, арил, C1-6алкC(O)O-C1-26алкил, -C1алкОC(O)C1-26алкил или C1алкОC(O)OC1-26алкил. Например, в некоторых аспектах R1 представляет собой фенил и R2 представляет собой -C1-26алкил, арил, C1-6алкC(O)O-C1-26алкил, -C1алкОC(O)C1-26алкил или C1алкОC(O)OC1-26алкил.
[0048] В некоторых аспектах соединения формулы I-B R1 представляет собой C1-6алкC(O)O-C1-26алкил и R2 представляет собой -C1-26алкил, арил, C1-6алкC(O)O-C1-26алкил, -C1алкОC(O)C1-26алкил или C1алкОC(O)OC1-26алкил. Например, в некоторых аспектах R1 представляет собой C1алкC(O)O-C1-26алкил. В других аспектах R1 представляет собой C2алкC(O)O-C1-26алкил. В других аспектах R1 представляет собой C3алкC(O)O-C1-26алкил. В других аспектах R1 представляет собой C4алкC(O)O-C1-26алкил. В других аспектах R1 представляет собой C5алкC(O)O-C1-26алкил. В других аспектах R1 представляет собой C6алкC(O)O-C1-26алкил. В других аспектах R1 представляет собой C1-6алкC(O)O-C1-6алкил. В других аспектах R1 представляет собой C1-6алкC(O)O-C1-12алкил. В других аспектах R1 представляет собой C1-6алкC(O)O-C13-26алкил. В других аспектах R1 представляет собой C1-6алкC(O)O-C18-26алкил. В других аспектах R1 представляет собой C1-6алкC(O)O-C20-26алкил.
[0049] В некоторых аспектах соединения формулы I-B R1 представляет собой -C1алкОC(O)C1-26алкил и R2 представляет собой -C1-26алкил, арил, C1-6алкC(O)O-C1-26алкил, -C1алкОC(O)C1-26алкил или C1алкОC(O)OC1-26алкил. Например, в некоторых аспектах R1 представляет собой C1алкОC(O)C1-6алкил. В других аспектах R1 представляет собой -C1алкОC(O)C1-12алкил. В других аспектах R1 представляет собой -C1алкОC(O)C13-16алкил. В других аспектах R1 представляет собой -C1алкОC(O)C18-26алкил. В других аспектах R1 представляет собой -C1алкОC(O)C20-26алкил.
[0050] В некоторых аспектах соединения формулы I-B R1 представляет собой -C1алкОC(O)OC1-26алкил и R2 представляет собой -C1-26алкил, арил, C1-6алкC(O)O-C1-26алкил, -C1алкОC(O)C1-26алкил или C1алкОC(O)OC1-26алкил. Например, в некоторых аспектах R1 представляет собой C1алкОC(O)OC1-6алкил. В других аспектах R1 представляет собой -C1алкОC(O)OC1-12алкил. В других аспектах R1 представляет собой -C1алкОC(O)OC13-16алкил. В других аспектах R1 представляет собой -C1алкОC(O)OC18-26алкил. В других аспектах R1 представляет собой -C1алкОC(O)OC20-26алкил.
[0051] В некоторых аспектах R1 представляет собой -C1-26алкил и R2 представляет собой -C1-26алкил. Например, в некоторых аспектах каждый из R1 и R2 независимо представляет собой -C1-6алкил, -C1-12алкил, -C13-26алкил, -C18-26алкил, -C20-26алкил, -C1алкил, -C2алкил, -C3алкил, -C4алкил, -C5алкил, -C6алкил, -C7алкил, -C8алкил, -C9алкил, -C10алкил, -C11алкил, -C12алкил, -C13алкил, -C14алкил, -C15алкил, -C16алкил, -C17алкил, -C18алкил, -C19алкил, -C20алкил, -C21алкил, -C22алкил, -C23алкил, -C24алкил, -C25алкил или -C26алкил.
[0052] В некоторых аспектах R1 представляет собой арил (например, фенил) и R2 представляет собой арил (например, фенил).
[0053] В некоторых аспектах R1 представляет собой C1-6алкC(O)O-C1-26алкил и R2 представляет собой C1-6алкC(O)O-C1-26алкил. Например, в некоторых аспектах каждый из R1 и R2 независимо представляет собой C1алкC(O)O-C1-26алкил, C2алкC(O)O-C1-26алкил, C3алкC(O)O-C1-26алкил, C4алкC(O)O-C1-26алкил, C5алкC(O)O-C1-26алкил, C6алкC(O)O-C1-26алкил, C1-6алкC(O)O-C1-6алкил, C1-6алкC(O)O-C1-12алкил, C1-6алкC(O)O-C13-26алкил, C1-6алкC(O)O-C18-26алкил или C1-6алкC(O)O-C20-26алкил.
[0054] В некоторых аспектах R1 представляет собой -C1алкОC(O)C1-26алкил и R2 представляет собой -C1алкОC(O)C1-26алкил. Например, в некоторых аспектах каждый из R1 и R2 независимо представляет собой C1алкОC(O)C1-6алкил, -C1алкОC(O)C1-12алкил, -C1алкОC(O)C13-16алкил, -C1алкОC(O)C18-26алкил или -C1алкОC(O)C20-26алкил.
[0055] В некоторых аспектах R1 представляет собой -C1алкОC(O)OC1-26алкил и R2 представляет собой -C1алкОC(O)OC1-26алкил. Например, в некоторых аспектах каждый из R1 и R2 независимо представляет собой C1алкОC(O)OC1-6алкил, -C1алкОC(O)OC1-12алкил, -C1алкОC(O)OC13-16алкил, -C1алкОC(O)OC18-26алкил или -C1алкОC(O)OC20-26алкил.
[0056] Соединения формулы I, которые включают соединения формулы I-A и I-B, могут быть предоставлены в качестве фармацевтически приемлемых солей, когда это применимо. Эти соли включают натриевые соли. Также предусматриваются калиевые, литиевые, кальциевые и магниевые соли. Альтернативные солевые формы включают аммониевые, холиновые и трометаминовые соли.
[0057] Также в объем изобретения входят способы с использованием пролекарств дантролена формулы II
 II
II
где
R3 представляет собой H, -C(O)-Z-N(R4)(R5), -C(O)Z-C(O)-OH или -C(O)-Y-CH2-OC(O)-Z-C(O)-OH;
Z представляет собой C1-6алк;
Y представляет собой арил;
R4 представляет собой H или C1-6алкил;
R5 представляет собой H или C1-6алкил;
или R4 и R5, вместе с азотом, к которому они присоединены, образуют гетероциклоалкил;
или их фармацевтически приемлемых солей.
[0058] В предпочтительных аспектах R3 представляет собой H и соединение формулы II представляет собой соединение формулы II-A
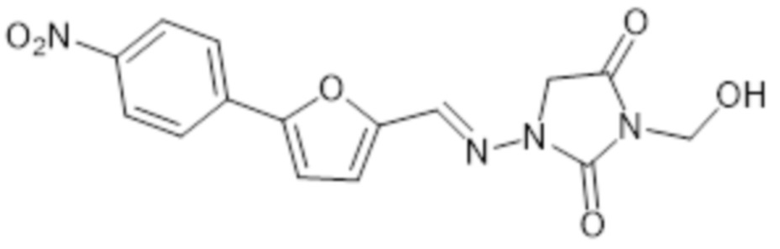 II-A
II-A
или его фармацевтически приемлемую соль.
[0059] В других аспектах формулы II R3 представляет собой C(O)-Z-N(R4)(R5) и соединение формулы II представляет собой соединение формулы II-B
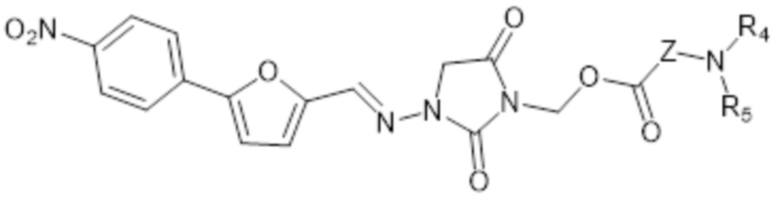 II-B
II-B
где
Z представляет собой C1-6алк;
R4 представляет собой H или C1-6алкил;
R5 представляет собой H или C1-6алкил;
или R4 и R5, вместе с азотом, к которому они присоединены, образуют гетероциклоалкил;
или его фармацевтически приемлемую соль.
[0060] В этих аспектах формулы II-B Z может представлять собой C1алк, C2алк, C3алк, C4алк, C5алк или C6алк. В некоторых аспектах Z представляет собой C1-2алк. В некоторых аспектах Z представляет собой C1алк.
[0061] В этих аспектах формулы II-B R4 представляет собой H. В других аспектах R4 представляет собой C1-6алкил, например, C1алкил, C2алкил, C3алкил, C4алкил, C5алкил или C6алкил. В предпочтительных аспектах R4 представляет собой метил, этил или изопропил.
[0062] В этих аспектах формулы II-B R5 представляет собой H. В других аспектах R5 представляет собой C1-6алкил, например, C1алкил, C2алкил, C3алкил, C4алкил, C5алкил или C6алкил. В предпочтительных аспектах R5 представляет собой метил, этил или изопропил.
[0063] В некоторых из этих аспектов формулы II-B R4 представляет собой H и R5 представляет собой H. В других аспектах R4 представляет собой H и R5 представляет собой C1-6алкил, например, C1алкил, C2алкил, C3алкил, C4алкил, C5алкил или C6алкил. В других аспектах каждый из R4 и R5 независимо представляет собой C1-6алкил, например, C1алкил, C2алкил, C3алкил, C4алкил, C5алкил или C6алкил.
[0064] В некоторых из этих аспектов формулы II-B R4 и R5 вместе с азотом, к которому они присоединены, образуют гетероциклоалкил. Предпочтительные гетероциклоалкильные части включают, например, морфолинил, пиперазинил, пиперидинил, пирролидинил, азетидинил и азиридинил.
[0065] Предпочтительные соединения формулы II-B включают, например,
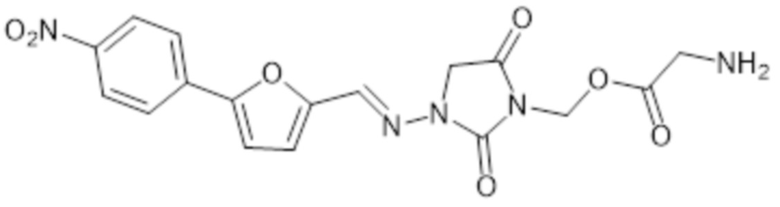
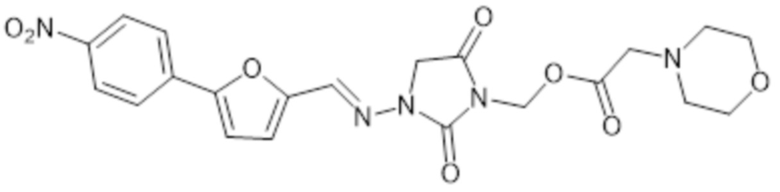
и их фармацевтически приемлемые соли.
[0066] В других аспектах формулы II, R3 представляет собой C(O)-Z-C(O)-OH и соединение формулы II представляет собой соединение формулы II-C
 II-C
II-C
где
Z представляет собой C1-6алк;
или его фармацевтически приемлемую соль.
[0067] В этих аспектах формулы II-C Z может представлять собой C1алк, C2алк, C3алк, C4алк, C5алк или C6алк. В некоторых аспектах Z представляет собой C1-2алк. В некоторых аспектах Z представляет собой C1алк. В некоторых аспектах Z представляет собой C2алк.
[0068] Предпочтительным соединением формулы II-C является
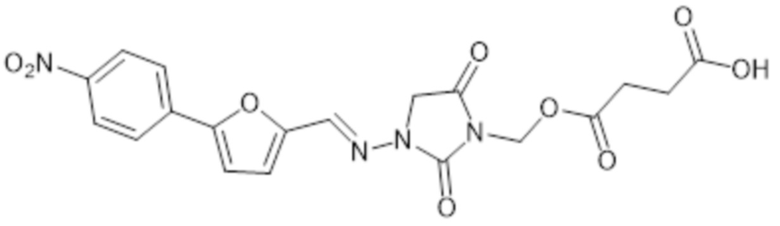
и его фармацевтически приемлемые соли.
[0069] В других аспектах формулы II R3 представляет собой -C(O)-NH-Y-CH2-OC(O)-Z-C(O)-OH и соединение формулы II представляет собой соединение формулы II-D
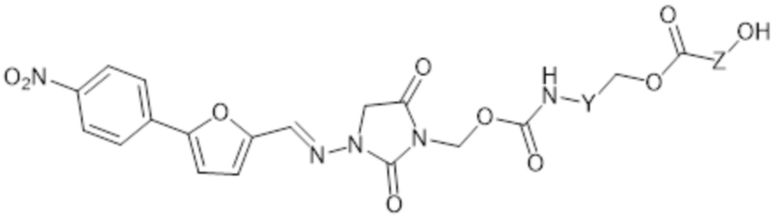 II-D
II-D
где
Y представляет собой арилен; и
Z представляет собой C1-6алк;
или его фармацевтически приемлемую соль.
[0070] В этих аспектах формулы II-D Y может представлять собой фенилен или нафтилен, предпочтительно фенилен.
[0071] В этих аспектах формулы II-D Z может представлять собой C1алк, C2алк, C3алк, C4алк, C5алк или C6алк. В некоторых аспектах Z представляет собой C1-2алк. В некоторых аспектах Z представляет собой C1алк. В некоторых аспектах Z представляет собой C2алк.
[0072] Предпочтительным соединением формулы II-D является
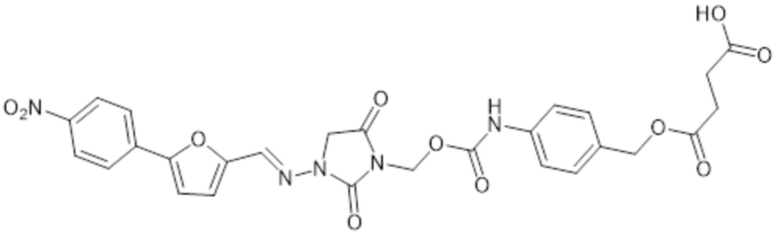
и его фармацевтически приемлемые соли.
[0073] В других аспектах R3 представляет собой -C(O)-O-Y-CH2-OC(O)-Z-C(O)-OH и соединение формулы II представляет собой соединение формулы II-E
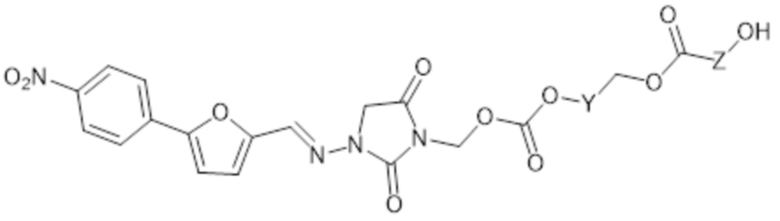 II-E
II-E
где
Y представляет собой арилен; и
Z представляет собой C1-6алк;
или его фармацевтически приемлемую соль.
[0074] В этих аспектах формулы II-E Y может представлять собой фенилен или нафтилен, предпочтительно фенилен.
[0075] В этих аспектах формулы II-E Z может представлять собой C1алк, C2алк, C3алк, C4алк, C5алк или C6алк. В некоторых аспектах Z представляет собой C1-2алк. В некоторых аспектах Z представляет собой C1алк. В некоторых аспектах Z представляет собой C2алк.
[0076] Соединения формулы II, которые включают соединения формулы II-A, II-B, II-C, II-D и II-E, могут быть предоставлены в форме фармацевтически приемлемых солей в соответствующих случаях. Эти соли включают натриевые соли. Также предусматриваются калиевые, литиевые, кальциевые и магниевые соли. Альтернативные солевые формы включают аммониевые, холиновые и трометаминовые соли. Также в объем изобретения входят фармацевтически приемлемые органические соли соединений формулы II.
[0077] Соединения формулы I и II, которые включают соединения формулы I-A, I-B, II-A, II-B, II-C, II-D и II-E и их фармацевтически приемлемые соли, можно получать в виде фармацевтических композиций путем комбинирования соединения с фармацевтически приемлемым эксципиентом. В некоторых вариантах осуществления один или несколько дополнительных фармацевтически приемлемых эксципиентов выбраны из группы, состоящей из консервантов, антиоксидантов или их смесей. В следующих вариантах осуществления изобретения дополнительный фармацевтически приемлемый эксципиент представляет собой консервант, такой как, но не ограничиваясь ими, фенол, крезол, сложный эфир п-гидроксибензойной кислоты, хлорбутанол или их смеси. В следующих вариантах осуществления изобретения дополнительный фармацевтически приемлемый эксципиент представляет собой антиоксидант, такой как, но не ограничиваясь ими, аскорбиновая кислота, пиросульфит натрия, пальмитиновая кислота, бутилированный гидроксианизол, бутилированный гидрокситолуол, токоферолы или их смеси.
[0078] Фармацевтические композиции по изобретению могут быть предоставлены в качестве суспензий. В других вариантах осуществления фармацевтические композиции по изобретению могут быть предоставлены в качестве растворов.
[0079] Фармацевтические композиции, используемые в способах по изобретению, могут иметь соединение по изобретению, присутствующее в концентрации от приблизительно 1 мг/мл до приблизительно 400 мг/мл, например, от 1 мг/мл до приблизительно 200 мг/мл, от 1 мг/мл до приблизительно 300 мг/мл, предпочтительно от 5 мг/мл до приблизительно 125 мг/мл, предпочтительно при физиологических значениях pH. В конкретных вариантах осуществления изобретения соединение по изобретению присутствует в концентрации, равной или превышающей приблизительно 5 мг/мл. В следующих вариантах осуществления соединение по изобретению присутствует в концентрации приблизительно от 10 до 25 мг/мл. В следующих вариантах осуществления соединение по изобретению присутствует в концентрации приблизительно 1 мг/мл, 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл, 25 мг/мл, 30 мг/мл, 35 мг/мл, 40 мг/мл, 45 мг/мл или 50 мг/мл. В следующих вариантах осуществления соединение по изобретению присутствует в концентрации приблизительно 125 мг/мл, 150 мг/мл, 175 мг/мл, 200 мг/мл, 225 мг/мл, 250 мг/мл, 275 мг/мл, 300 мг/мл, 325 мг/мл, 350 мг/мл, 375 мг/мл или приблизительно 400 мг/мл.
[0080] В определенных вариантах осуществления соединение по изобретению присутствует в концентрации, равной или превышающей приблизительно 55 мг/мл. В следующих вариантах осуществления соединение по изобретению присутствует в концентрации приблизительно от 55 до 125 мг/мл. В конкретных вариантах осуществления соединение по изобретению присутствует в концентрации приблизительно 75 мг/мл, 80 мг/мл, 85 мг/мл, 90 мг/мл, 95 мг/мл, 100 мг/мл, 105 мг/мл, 110 мг/мл, 115 мг/мл, 120 мг/мл или 125 мг/мл. В других вариантах осуществления соединение по изобретению присутствует в концентрации приблизительно от 75 мг/мл до 95 мг/мл, от 80 мг/мл до 100 мг/мл, от 90 мг/мл до 110 мг/мл, от 95 мг/мл до 105 мг/мл, от 95 мг/мл до 115 мг/мл, от 100 мг/мл до 110 мг/мл, от 110 мг/мл до 125 мг/мл, включая все диапазоны и поддиапазоны между ними.
[0081] В аспектах, направленных на способы лечения индивидуума, который "будет" подвергнут радиационному воздействию, вероятность радиационного воздействия на индивидуума в ближайшем будущем (т.е. в течение приблизительно 1 месяца, в течение приблизительно 2 недель, в течение приблизительно 7 суток, в течение приблизительно 6 суток, в течение приблизительно 5 суток, в течение приблизительно 4 суток, в течение приблизительно 3 суток, в течение приблизительно 2 суток, в течение приблизительно 1 суток), является повышенной. В некоторых аспектах вероятность радиационного воздействия на индивидуума в ближайшем будущем является абсолютной, т.е. вероятность радиационного воздействия на индивидуума в ближайшем будущем составляет 100%. В некоторых аспектах вероятность радиационного воздействия на индивидуума в ближайшем будущем составляет менее 100%, например, 90% или более. В некоторых аспектах вероятность радиационного воздействия на индивидуума в ближайшем будущем составляет 80% или более. В некоторых аспектах вероятность радиационного воздействия на индивидуума в ближайшем будущем составляет 70% или более. В некоторых аспектах вероятность радиационного воздействия на индивидуума в ближайшем будущем составляет 60% или более. В некоторых аспектах вероятность радиационного воздействия на индивидуума в ближайшем будущем составляет 70% или более. В некоторых аспектах вероятность радиационного воздействия на индивидуума в ближайшем будущем составляет 60% или более. В некоторых аспектах вероятность радиационного воздействия на индивидуума в ближайшем будущем составляет 50% или более. В некоторых аспектах вероятность радиационного воздействия на индивидуума в ближайшем будущем составляет 40% или более. В некоторых аспектах вероятность радиационного воздействия на индивидуума в ближайшем будущем составляет 30% или более. В некоторых аспектах вероятность радиационного воздействия на индивидуума в ближайшем будущем составляет 20% или более. В некоторых аспектах вероятность радиационного воздействия на индивидуума в ближайшем будущем составляет 10% или более. В некоторых аспектах вероятность радиационного воздействия на индивидуума в ближайшем будущем составляет 5% или более.
[0082] В определенных вариантах осуществления фармацевтические композиции по изобретению, кроме того, могут включать стабилизатор или два или более стабилизаторов. В следующих вариантах осуществления изобретения стабилизатор выбран из группы, состоящей из поверхностно-активных веществ, полимеров, сшитых полимеров, буферных средств, электролитов и неэлектролитов. В следующих вариантах осуществления изобретения композиция содержит комбинацию из двух или более стабилизаторов, выбранных из группы, состоящей из поверхностно-активных веществ, полимеров, сшитых полимеров, буферных веществ, электролитов и неэлектролитов. В следующих вариантах осуществления изобретения стабилизатор представляет собой поверхностно-активное вещество, такое как, но не ограничиваясь ими, полиэтиленоксид (PEO), производное PEO, полисорбат 80, полисорбат 20, полоксамер 188, полиэтоксилированные растительные масла, лецитин, сывороточный альбумин человека и их смеси. В конкретных вариантах осуществления изобретения стабилизатор представляет собой полимер, такой как, но не ограничиваясь ими, поливинилпирролидон (такой как, но не ограничиваясь ими, повидон K12, повидон K17 и их смеси), полиэтиленгликоль 3350 и их смеси. В других вариантах осуществления изобретения стабилизатор представляет собой электролит, такой как, но не ограничиваясь ими, хлорид натрия, хлорид кальция и их смеси. В других вариантах осуществления изобретения стабилизатор представляет собой неэлектролит, такой как, но не ограничиваясь ими, декстроза, глицерин, маннит или их смеси. В других вариантах осуществления изобретения стабилизатор представляет собой сшитый полимер, такой как, но не ограничиваясь ими, карбоксиметилцеллюлоза натрий (CMC). В некоторых вариантах осуществления изобретения стабилизатор представляет собой CMC 7LF, CMC 7MF, CMC 7HF или их смеси.
[0083] В следующих вариантах осуществления изобретения можно использовать комбинации неэлектролитных и электролитных стабилизаторов. В некоторых вариантах осуществления комбинация стабилизаторов может включать два или более неэлектролитных стабилизаторов. В других вариантах осуществления комбинация стабилизаторов может включать два или более электролитных стабилизаторов. В следующих вариантах осуществления комбинация стабилизаторов может включать один или несколько неэлектролитных стабилизаторов и один или несколько электролитных стабилизаторов. В следующих вариантах осуществления комбинация стабилизаторов может включать два или более из маннита, декстрозы и хлорида натрия.
[0084] В определенных вариантах осуществления изобретения можно использовать комбинации стабилизаторов в форме поверхностно-активных веществ и полимерных стабилизаторов. В некоторых вариантах осуществления комбинация стабилизаторов может содержать два или более стабилизаторов в форме поверхностно-активных веществ. В других вариантах осуществления комбинация стабилизаторов может содержать два или более полимерных стабилизатора. В следующих вариантах осуществления комбинация стабилизаторов может содержать один или несколько стабилизаторов в форме поверхностно-активных веществ и один или несколько полимерных стабилизаторов. В следующих вариантах осуществления комбинация стабилизаторов может содержать два или более из полисорбата 80, полисорбата 20 и полоксамера 188. В следующих вариантах осуществления комбинация стабилизаторов может содержать один или несколько из полисорбата 80, полисорбата 20 и полоксамера 188 и один или несколько из повидона K12, повидона K17 и полиэтиленгликоля 3350.
[0085] В определенных вариантах осуществления изобретения композиция содержит от приблизительно 0,2 мг/мл до приблизительно 75 мг/мл одного или нескольких стабилизаторов, и все диапазоны и поддиапазоны между ними. В конкретных вариантах осуществления изобретения композиция содержит приблизительно от 0,2 до 0,7 мг/мл, от 0,5 до 1 мг/мл, от 1 до 5 мг/мл, от 2 до 8 мг/мл, от 5 до 6 мг/мл, от 5 до 10 мг/мл, от 8 до 12 мг/мл, от 10 до 15 мг/мл, от 15 до 20 мг/мл, от 20 до 30 мг/мл, от 30 до 40 мг/мл, от 40 до 50 мг/мл, от 45 до 55 мг/мл, от 50 до 60 мг/мл или от 60 до 75 мг/мл одного или нескольких стабилизаторов, и все диапазоны и поддиапазоны между ними. В следующих вариантах осуществления изобретения композиция содержит приблизительно 0,2 мг/мл, 0,5 мг/мл, 1 мг/мл, 2 мг/мл, 3mg/мл, 4 мг/мл, 5 мг/мл, 5,5 мг/мл, 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл, 10 мг/мл, 12 мг/мл, 15 мг/мл, 17 мг/мл, 20 мг/мл, 25 мг/мл, 30 мг/мл, 35 мг/мл, 40 мг/мл, 45 мг/мл, 50 мг/мл, 55 мг/мл, 60 мг/мл, 65 мг/мл, 70 мг/мл или 75 мг/мл одного или нескольких стабилизаторов.
[0086] В конкретных вариантах осуществления изобретения композиция, кроме того, содержит одно или несколько буферных веществ, таких как, но не ограничиваясь ими, NaH2PO4·H2O, NaH2PO4·2H2O, безводный NaH2PO4, цитрат натрия, лимонная кислота, Tris, гидроксид натрия, HCl или их смеси. В определенных вариантах осуществления изобретения композиция содержит приблизительно от 1 мМ до 20 мМ одного или нескольких буферных средств, и все диапазоны и поддиапазоны между ними. В конкретных вариантах осуществления изобретения композиция содержит приблизительно от 1 до 2 мМ, от 1 до 3 мМ, от 1 до 5 мМ, от 2 до 8 мМ, от 5 до 6 мМ, от 5 до 10 мМ, от 8 до 12 мМ, от 10 до 15 мМ или от 15 до 20 мМ одного или нескольких буферных средств, и все диапазоны и поддиапазоны между ними. В следующих вариантах осуществления изобретения композиция содержит приблизительно 1 мМ, 2 мМ, 3 мМ, 4 мМ, 5 мМ, 6 мМ, 7 мМ, 8 мМ, 9 мМ, 10 мМ, 11 мМ, 12 мМ, 13 мМ, 14 мМ, 15 мМ, 16 мМ, 17 мМ, 18 мМ, 19 мМ или 20 мМ одного или нескольких буферных средств.
[0087] В определенных вариантах осуществления изобретения фармацевтическая композиция имеет pH приблизительно от 3 до 10, например, 3, 4, 5, 6, 7, 8, 9 или 10. В следующих вариантах осуществления изобретения композиция имеет pH приблизительно от 5 до 9. В следующих вариантах осуществления изобретения композиция имеет pH приблизительно от 6 до 9. В следующих вариантах осуществления изобретения композиция имеет pH приблизительно от 6 до 7. В следующих вариантах осуществления изобретения композиция имеет pH приблизительно от 6 до 8,5. В следующих вариантах осуществления изобретения композиция имеет pH приблизительно 7-8,5. В следующих вариантах осуществления изобретения композиция имеет pH от более чем 7 до 8,5. В определенных вариантах осуществления изобретения композиция имеет pH приблизительно от 6,0 до 8,0. В конкретных вариантах осуществления изобретения композиция имеет pH приблизительно от 6,0 до 7,0, от 6,5 до 7,0, от 6,5 до 7,5, от 6,7 до 7,2, от 7,0 до 7,2, от 7,0 до 7,5, от 7,0 до 8,0 или от 7,0 до 8,5.
[0088] В определенных вариантах осуществления изобретения фармацевтическая композиция имеет осмолярность от приблизительно 280 мосм/л до приблизительно 310 мосм/л, например, приблизительно 280, 285, 290, 300, 305 или приблизительно 310 мосм/л. В следующих вариантах осуществления изобретения композиция имеет осмолярность от приблизительно 290 мосм/л до приблизительно 300 мосм/л. В следующих вариантах осуществления изобретения композиция имеет осмолярность приблизительно 290 мосм/л. В некоторых вариантах осуществления осмолярность может быть установлена с использованием соответствующих количеств одного или нескольких стабилизаторов, которые выступают в качестве регуляторов тоничности в композиции, таких как, но не ограничиваясь ими, неэлектролитные стабилизаторы и электролитные стабилизаторы, описанные в настоящем описании. В некоторых вариантах осуществления осмолярность может быть установлена с использованием соответствующих количеств одного или нескольких буферных средств, которые выступают в качестве регуляторов тоничности в композиции, таких как, но не ограничиваясь ими, буферные средства, описанные в настоящем описании.
[0089] В аспектах, относящихся к способам лечения индивидуума, который "будет" подвергнут радиационному воздействию, вероятность радиационного воздействия в ближайшем будущем (т.е. в течение приблизительно 1 месяца, в течение приблизительно 2 недель, в течение приблизительно 7 суток, в течение приблизительно 6 суток, в течение приблизительно 5 суток, в течение приблизительно 4 суток, в течение приблизительно 3 суток, в течение приблизительно 2 суток, в течение приблизительно 1 суток), является результатом радиационного воздействия при лечении злокачественной опухоли.
[0090] В аспектах, которые относятся к способам лечения индивидуума, который "будет" подвергнут радиационному воздействию, вероятность радиационного воздействия на индивидуума в ближайшем будущем (т.е. приблизительно в течение 1 месяца, приблизительно в течение 2 недель, приблизительно в течение 7 суток, приблизительно в течение 6 суток, приблизительно в течение 5 суток, приблизительно в течение 4 суток, приблизительно в течение 3 суток, приблизительно в течение 2 суток, приблизительно в течение 1 суток) является результатом воздействия утечки с атомной электростанции. В этих аспектов целостность атомной электростанции является такой, что вероятность утечки в ближайшем будущем повышена. В некоторых аспектах индивидуум находится в радиусе 100 миль (161 километра) от места утечки с атомной электростанции. В некоторых аспектах индивидуум находится в радиусе 75 миль (121 километра) от места утечки с атомной электростанции. В некоторых аспектах индивидуум находится в радиусе 50 миль (80,5 километра) от места утечки с атомной электростанции. В некоторых аспектах индивидуум находится в радиусе 40 миль (64 километров) от места утечки с атомной электростанции. В некоторых аспектах индивидуум находится в радиусе 30 миль (48 километров) от места утечки с атомной электростанции. В некоторых аспектах индивидуум находится в радиусе 20 миль (32 километров) от места утечки с атомной электростанции. В некоторых аспектах индивидуум находится в радиусе 10 миль (16 километров) от места утечки с атомной электростанции. В некоторых аспектах индивидуум находится в радиусе 9 миль (14,5 километра) от места утечки с атомной электростанции. В некоторых аспектах индивидуум находится в радиусе 8 миль (13 километров) от места утечки с атомной электростанции. В некоторых аспектах индивидуум находится в радиусе 7 миль (11 километров) от места утечки с атомной электростанции. В некоторых аспектах индивидуум находится в радиусе 6 миль (9,5 километров) от места утечки с атомной электростанции. В некоторых аспектах индивидуум находится в радиусе 5 миль (8 километров) от места утечки с атомной электростанции. В некоторых аспектах индивидуум находится в радиусе 4 миль (6,5 километра) от места утечки с атомной электростанции. В некоторых аспектах индивидуум находится в радиусе 3 миль (5 километров) от места утечки с атомной электростанции. В некоторых аспектах индивидуум находится в радиусе 2 миль (3,5 километра) от места утечки с атомной электростанции. В некоторых аспектах индивидуум находится в радиусе 1 мили (1,6 километра) от места утечки с атомной электростанции. В некоторых аспектах индивидуум находится в месте утечки с атомной электростанции.
[0091] В аспектах, относящихся к способам лечения индивидуума, который "будет подвергнут" радиационному воздействию, вероятность радиационного воздействия на индивидуума в ближайшем будущем (т.е. приблизительно в течение 1 месяца, приблизительно в течение 2 недель, приблизительно в течение 7 суток, приблизительно в течение 6 суток, приблизительно в течение 5 суток, приблизительно в течение 4 суток, приблизительно в течение 3 суток, приблизительно в течение 2 суток, приблизительно в течение 1 суток) является результатом детонации ядерного оружия. В этих аспектах вероятность детонации ядерного оружия повышена. В некоторых аспектах вероятность детонации ядерного оружия может быть повышена в результате террористических угроз. В некоторых аспектах вероятность детонации ядерного оружия может быть повышена вследствие обнаружения запуска ядерного оружия. В некоторых аспектах индивидуум находится в радиусе 100 миль (161 километра) от места детонации ядерного оружия. В некоторых аспектах индивидуум находится в радиусе 75 миль (121 километра) от места детонации ядерного оружия. В некоторых аспектах индивидуум находится в радиусе 50 миль (80,5 километра) от места детонации ядерного оружия. В некоторых аспектах индивидуум находится в радиусе 40 миль (64 километров) от места детонации ядерного оружия. В некоторых аспектах индивидуум находится в радиусе 30 миль (48 километров) от места детонации ядерного оружия. В некоторых аспектах индивидуум находится в радиусе 20 миль (32 километров) от места детонации ядерного оружия. В некоторых аспектах индивидуум находится в радиусе 10 миль (16 километров) от места детонации ядерного оружия. В некоторых аспектах индивидуум находится в радиусе 9 миль (14,5 километра) от места детонации ядерного оружия. В некоторых аспектах индивидуум находится в радиусе 8 миль (13 километров) от места детонации ядерного оружия. В некоторых аспектах индивидуум находится в радиусе 7 миль (11 километров) от места детонации ядерного оружия. В некоторых аспектах индивидуум находится в радиусе 6 миль (9,5 километров) от места детонации ядерного оружия. В некоторых аспектах индивидуум находится в радиусе 5 миль (8 километров) от места детонации ядерного оружия. В некоторых аспектах индивидуум находится в радиусе 4 миль (6,5 километра) от места детонации ядерного оружия. В некоторых аспектах индивидуум находится в радиусе 3 миль (5 километров) от места детонации ядерного оружия. В некоторых аспектах индивидуум находится в радиусе 2 миль (3,5 километра) от места детонации ядерного оружия. В некоторых аспектах индивидуум находится в радиусе 1 мили (1,6 километра) от места детонации ядерного оружия.
[0092] Способы по изобретению предпочтительно используют для лечения млекопитающих. В более предпочтительных аспектах способы по изобретению используют для лечения человека.
[0093] Радиационное воздействие, от которого можно проводить лечение (либо до воздействия, либо после воздействия) включает любой тип радиационного воздействия, который превышает нормальное радиационное воздействие. В некоторых аспектах радиационное воздействие представляет собой дозу проникающей радиации. В некоторых аспектах радиационное воздействие представляет собой дозу проникающей радиации на протяжении периода времени, который составляет 60 минут или менее, например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55 или приблизительно 60 минут. В некоторых аспектах радиационное воздействие является достаточным для обеспечения истощения незрелых паренхимных стволовых клеток у контрольного индивидуума, которого не подвергали лечению в соответствии с описанными способами. В некоторых аспектах радиационное воздействие представляет собой дозу проникающей радиации на протяжении периода времени, превышающего 60 минут, например, 2, 3, 4, 5, 6, 7, 8 часов или более.
[0094] В некоторых аспектах индивидуум подвергнут химиорадиации. В некоторых аспектах у индивидуума диагностирована злокачественная опухоль и он подвергнут радиационному воздействию на уровне, достаточном для лечения злокачественной опухоли индивидуума. В некоторых аспектах индивидуум будет подвергнут химиорадиации. В некоторых аспектах у индивидуума диагностирована злокачественная опухоль и он будет подвергнут радиационному воздействию на уровне, достаточном для лечения злокачественной опухоли индивидуума.
[0095] В некоторых аспектах индивидуум подвергнут радиационному воздействию в результате утечки с атомной электростанции. В некоторых аспектах индивидуум будет подвергнут радиационному воздействию в результате утечки с атомной электростанции.
[0096] В некоторых аспектах индивидуум подвергнут радиационному воздействию в результате воздействия ядерного оружия. В некоторых аспектах индивидуум будет подвергнут радиационному воздействию в результате воздействия ядерного оружия.
[0097] В некоторых аспектах радиация представляет собой рентгеновское излучение, гамма-излучение, нейтронное излучение или их комбинацию. В некоторых аспектах радиация представляет собой рентгеновскую радиацию. В некоторых аспектах радиация представляет собой гамма-излучение. В некоторых аспектах радиация представляет собой нейтронное излучение.
[0098] В некоторых аспектах индивидуум подвергнут дозе радиационного излучения, превышающей нормальный уровень. В некоторых аспектах индивидуум подвергнут дозе радиационного излучения по меньшей мере 0,3 Гр. В некоторых аспектах индивидуум подвергнут дозе радиационного излучения по меньшей мере 0,7 Гр. В некоторых аспектах индивидуум подвергнут дозе радиационного излучения по меньшей мере 6 Гр. В некоторых аспектах индивидуум подвергнут дозе радиационного излучения по меньшей мере 10 Гр. В некоторых аспектах индивидуум подвергнут дозе радиационного излучения по меньшей мере 50 Гр. В некоторых аспектах индивидуум подвергнут дозе радиационного излучения, которая составляет от 0,3 Гр до 50 Гр. В некоторых аспектах индивидуум подвергнут дозе радиационного излучения, которая составляет от 0,7 Гр до 50 Гр. В некоторых аспектах индивидуум подвергнут дозе радиационного излучения, которая составляет от 0,3 Гр до 0,7 Гр. В некоторых аспектах индивидуум подвергнут дозе радиационного излучения, которая составляет от 0,3 Гр до 6 Гр. В некоторых аспектах индивидуум подвергнут дозе радиационного излучения, которая составляет от 0,3 Гр до 10 Гр. В некоторых аспектах индивидуум подвергнут дозе радиационного излучения, которая составляет от 0,7 Гр до 6 Гр. В некоторых аспектах индивидуум подвергнут дозе радиационного излучения, которая составляет от 0,7 Гр до 10 Гр. В некоторых аспектах индивидуум подвергнут дозе радиационного излучения, которая составляет от 0,7 Гр до 50 Гр. В некоторых аспектах индивидуум подвергнут дозе радиационного излучения, которая составляет 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или приблизительно 50 Гр.
[0099] В некоторых аспектах индивидуум будет подвергнут дозе радиационного излучения, которая превышает нормальный уровень. В некоторых аспектах индивидуум будет подвергнут дозе радиационного излучения по меньшей мере 0,3 Гр. В некоторых аспектах индивидуум будет подвергнут дозе радиационного излучения по меньшей мере 0,7 Гр. В некоторых аспектах индивидуум будет подвергнут дозе радиационного излучения по меньшей мере 6 Гр. В некоторых аспектах индивидуум будет подвергнут дозе радиационного излучения по меньшей мере 10 Гр. В некоторых аспектах индивидуум будет подвергнут дозе радиационного излучения по меньшей мере 50 Гр. В некоторых аспектах индивидуум будет подвергнут дозе радиационного излучения, которая составляет от 0,3 Гр до 50 Гр. В некоторых аспектах индивидуум будет подвергнут дозе радиационного излучения, которая составляет от 0,7 Гр до 50 Гр. В некоторых аспектах индивидуум будет подвергнут дозе радиационного излучения, которая составляет от 0,3 Гр до 0,7 Гр. В некоторых аспектах индивидуум будет подвергнут дозе радиационного излучения, которая составляет от 0,3 Гр до 6 Гр. В некоторых аспектах индивидуум будет подвергнут дозе радиационного излучения, которая составляет от 0,3 Гр до 10 Гр. В некоторых аспектах индивидуум будет подвергнут дозе радиационного излучения, которая составляет от 0,7 Гр до 6 Гр. В некоторых аспектах индивидуум будет подвергнут дозе радиационного излучения, которая составляет от 0,7 Гр до 10 Гр. В некоторых аспектах индивидуум будет подвергнут дозе радиационного излучения, которая составляет от 0,7 Гр до 50 Гр. В некоторых аспектах индивидуум будет подвергнут дозе радиационного излучения, которая составляет 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или приблизительно 50 Гр.
[0104] Количество дантролена, пролекарства дантролена или его фармацевтически приемлемой соли, которое является терапевтически эффективным для лечения индивидуума согласно любому из описанных способов, должно определяться практикующим специалистом в данной области. Терапевтически эффективное количество может представлять собой количество, требуемое для лечения индивидуума посредством однократной дозы. Альтернативно терапевтически эффективное количество может представлять собой совокупное количество дантролена, требуемое для лечения индивидуума посредством более чем одной дозы, например, множества доз, на протяжении длительного или пролонгированного курса лечения.
[0105] В некоторых аспектах терапевтически эффективное количество дантролена, пролекарства дантролена или их фармацевтически приемлемой соли составляет от 1 мг/кг до приблизительно 30 мг/кг, вводимые за одну или две дозы. В других аспектах терапевтически эффективное количество дантролена, пролекарства дантролена или их фармацевтически приемлемой соли составляет от 1 мг/кг до приблизительно 20 мг/кг. В других аспектах терапевтически эффективное количество дантролена, пролекарства дантролена или их фармацевтически приемлемой соли составляет от приблизительно 5 мг/кг до приблизительно 30 мг/кг. В других аспектах терапевтически эффективное количество дантролена, пролекарства дантролена или их фармацевтически приемлемой соли составляет от приблизительно 10 мг/кг до приблизительно 30 мг/кг. В других аспектах терапевтически эффективное количество дантролена, пролекарства дантролена или их фармацевтически приемлемой соли составляет от приблизительно 15 мг/кг до приблизительно 30 мг/кг. В других аспектах терапевтически эффективное количество дантролена, пролекарства дантролена или их фармацевтически приемлемой соли составляет от приблизительно 20 мг/кг до приблизительно 30 мг/кг. В других аспектах терапевтически эффективное количество дантролена, пролекарства дантролена или их фармацевтически приемлемой соли составляет от приблизительно 5 мг/кг до приблизительно 20 мг/кг. В других аспектах терапевтически эффективное количество дантролена, пролекарства дантролена или их фармацевтически приемлемой соли составляет от приблизительно 5 мг/кг до приблизительно 15 мг/кг. В других аспектах терапевтически эффективное количество дантролена, пролекарства дантролена или их фармацевтически приемлемой соли составляет от приблизительно 5 мг/кг до приблизительно 10 мг/кг. В других аспектах терапевтически эффективное количество дантролена, пролекарства дантролена или их фармацевтически приемлемой соли составляет от приблизительно 10 мг/кг до приблизительно 20 мг/кг. В других аспектах терапевтически эффективное количество дантролена, пролекарства дантролена или их фармацевтически приемлемой соли составляет от приблизительно 2 мг/кг до приблизительно 10 мг/кг, предпочтительно от приблизительно 2 мг/кг до приблизительно 6 мг/кг. В других аспектах терапевтически эффективное количество дантролена, пролекарства дантролена или их фармацевтически приемлемой соли составляет от приблизительно 15 мг/кг до приблизительно 20 мг/кг. В других аспектах терапевтически эффективное количество дантролена, пролекарства дантролена или их фармацевтически приемлемой соли составляет приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или приблизительно 30 мг/кг. В некоторых вариантах осуществления терапевтически эффективное количество дантролена, пролекарства дантролена или их фармацевтически приемлемой соли составляет более 30 мг/кг, например, от 30 мг/кг до приблизительно 100 мг/кг, вводимые за одну или две дозы. В некоторых аспектах терапевтически эффективное количество дантролена, пролекарства дантролена или их фармацевтически приемлемой соли составляет приблизительно 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или приблизительно 100 мг/кг.
[0106] В некоторых аспектах изобретение время введения фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль индивидууму после воздействия радиации может влиять на лечение.
[0107] Композиции, содержащие дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, можно вводить индивидууму длительно, за две или более доз, т.е. в течение двух или более недель, например, 2, 3, 4, 5, 6, 7, 8 или более недель после радиационного воздействия на индивидуума. Композиции, содержащие дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, можно вводить индивидууму быстро, за одну или несколько доз, т.е. в течение менее чем двух недель, например, в течение часов или суток, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 часов или более 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или 13 суток после воздействия на индивидуума радиационного излучения.
[0108] Что касается времени введения фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, в некоторых аспектах фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, по меньшей мере одну дозу вводят индивидууму через 24 часа или менее после радиационного воздействия на индивидуума. В некоторых аспектах фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, по меньшей мере одну дозу вводят индивидууму через 20 часов или менее после радиационного воздействия на индивидуума. В некоторых аспектах фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, по меньшей мере одну дозу вводят индивидууму через 16 часов или менее после радиационного воздействия на индивидуума. В некоторых аспектах фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, по меньшей мере одну дозу вводят индивидууму через 12 часов или менее после радиационного воздействия на индивидуума. В некоторых аспектах фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, по меньшей мере одну дозу вводят индивидууму через 8 часов или менее после радиационного воздействия на индивидуума. В некоторых аспектах фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, по меньшей мере одну дозу вводят индивидууму через 4 часа или менее после радиационного воздействия на индивидуума. В некоторых аспектах фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, по меньшей мере одну дозу вводят индивидууму через 2 часа или менее после радиационного воздействия на индивидуума. В некоторых аспектах фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, по меньшей мере одну дозу вводят индивидууму через 1 час или менее после радиационного воздействия на индивидуума. В некоторых аспектах фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, по меньшей мере одну дозу вводят индивидууму в течение приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или в течение приблизительно 24 часов после радиационного воздействия на индивидуума.
[0109] Что касается времени введения фармацевтической композиции, содержащей пролекарство дантролена или его фармацевтически приемлемую соль, в некоторых аспектах фармацевтической композиции, содержащей пролекарство дантролена или его фармацевтически приемлемую соль, по меньшей мере одну дозу вводят индивидууму за 24 часа или более до радиационного воздействия на индивидуума. В некоторых аспектах фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, по меньшей мере одну дозу вводят индивидууму за 20 часов или более до радиационного воздействия на индивидуума. В некоторых аспектах фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, по меньшей мере одну дозу вводят индивидууму за 16 часов или более до радиационного воздействия на индивидуума. В некоторых аспектах фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, по меньшей мере одну дозу вводят индивидууму за 12 часов или более до радиационного воздействия на индивидуума. В некоторых аспектах фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, по меньшей мере одну дозу вводят индивидууму за 8 часов или более до радиационного воздействия на индивидуума. В некоторых аспектах фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, по меньшей мере одну дозу вводят индивидууму за 4 часа или более до радиационного воздействия на индивидуума. В некоторых аспектах фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, по меньшей мере одну дозу вводят индивидууму за 2 часа или более до радиационного воздействия на индивидуума. В некоторых аспектах фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, по меньшей мере одну дозу вводят индивидууму за 1 час или более до радиационного воздействия на индивидуума. В некоторых аспектах фармацевтической композиции, содержащей дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, по меньшей мере одну дозу вводят индивидууму приблизительно за 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или приблизительно за 24 часа до радиационного воздействия на индивидуума.
[0110] Между тем, в некоторых аспектах фармацевтическая композиция, содержащая дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, может доставлять терапевтически эффективное количество дантролена (или метаболита дантролена, такого как 5-гидроксидантролен) подвергнутому радиационному воздействию индивидууму за одну дозу. В других аспектах может быть необходимо две или более доз фармацевтической композиции для доставки терапевтически эффективного количества дантролена подвергнутому радиационному воздействию индивидууму. Например, может быть необходимо 2, 3, 4, 5, 6, 7, 8, 9 или 10 доз фармацевтической композиции для доставки терапевтически эффективного количества дантролена подвергнутому радиационному воздействию индивидууму. Эти дополнительные дозировки можно вводить по существу одновременно с первой дозой. В других аспектах дополнительные дозировки отделены во времени от первой дозы. В тех аспектах, где вводят 3 или более доз, каждая доза может быть отделена во времени от введения любой другой дозы.
[0111] В некоторых аспектах изобретения введение дантролена подвергнутому радиационному воздействию индивидууму является вспомогательной терапией радиационного воздействия. Индивидуумам, подвергнутым радиационному воздействию, также может быть проведена одна или несколько лучевых терапий.
[0112] Фармацевтическую композицию, содержащую дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, можно вводить внутривенно. В других аспектах фармацевтическую композицию, содержащую дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, можно вводить трансдермальным путем. В других аспектах фармацевтическую композицию, содержащую дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, можно вводить внутримышечно. В других аспектах фармацевтическую композицию, содержащую дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, можно вводить внутрикостным путем. В других аспектах фармацевтическую композицию, содержащую дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, можно вводить подкожно.
[0113] Предпочтительные фармацевтические композиции для применения в описанных способах включают дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, и один или несколько фармацевтически приемлемых эксципиентов. Предпочтительные фармацевтические композиции содержат дантролен, пролекарство дантролена или их фармацевтически приемлемую соль, маннит, полисорбат (например, полисорбат 80), повидон (например, повидон K12), необязательное средство для коррекции pH (например, NaOH или HCl) и воду.
[0114] Особенно предпочтительной фармацевтической композицией, содержащей дантролен или его фармацевтически приемлемую соль, является RYANODEX® (дантролен натрия, Eagle Pharmaceuticals, Woodcliff Lake, NJ). RYANODEX® представляет собой инъекционную суспензию, предоставляемую в качестве стерильного лиофилизированного порошка. Он предоставляется в 20-мл флаконах, содержащих 250 мг дантролена натрия, 125 мг маннита, 25 мг полисорбата 80, 4 мг повидона K12 и достаточное количество гидроксида натрия или хлористоводородной кислоты для коррекции pH. При восстановлении 5 мл стерильной воды для инъекций USP образуется суспензия.
[0115] Способы по изобретению приводят к более низкой смертности индивидуума в результате радиационного воздействия по сравнению с контрольным индивидуумом, которого не лечат в соответствии с каким-либо из описанных способов.
[0116] В некоторых аспектах лечение в соответствии со способом лечения по изобретению улучшает по меньшей мере один гематологический параметр у индивидуума по сравнению с контрольным индивидуумом, которого не лечат в соответствии с каким-либо из описанных способов. Гематологические параметры включают, например, уровень лейкоцитов, уровень эритроцитов, уровень гемоглобина, гематокрит, среднюю гематокритную величину, средний эритроцитарный гемоглобин, среднюю концентрацию эритроцитарного гемоглобина, ширину распределения эритроцитов по объему, уровень тромбоцитов, средний объем тромбоцитов, лейкоцитарную формулу (абсолютную), уровень нейтрофилов абсолютный, уровень лимфоцитов абсолютный, уровень моноцитов абсолютный, уровень эозинофилов абсолютный, уровень базофилов абсолютный, процент ретикулоцитов и абсолютное количество ретикулоцитов.
[0117] В некоторых аспектах лечение в соответствии со способом по изобретению является эффективным для лечения гемопоэтического синдрома, возникшего у индивидуума в результате радиационного воздействия.
[0118] В некоторых аспектах лечение в соответствии со способом по изобретению является эффективным для лечения желудочно-кишечного синдрома, возникшего у индивидуума в результате радиационного воздействия.
[0119] В некоторых аспектах лечение в соответствии со способом по изобретению является эффективным для лечения сердечно-сосудистого синдрома, возникшего у индивидуума в результате радиационного воздействия.
[0120] В некоторых аспектах лечение в соответствии со способом по изобретению является эффективным для лечения синдрома центральной нервной системы, возникшего у индивидуума в результате радиационного воздействия.
[0121] Также в объем изобретения входят изотопные варианты соединений по изобретению. Как используют в рамках изобретения, термин "изотопный вариант" относится к соединению, которое содержит доли изотопов одного или нескольких атомов, составляющих соединение, с содержанием, превышающим природное. Например, "изотопный вариант" соединения может быть радиоактивно меченным, т.е. содержит один или несколько радиоактивных изотопов, или может быть меченным посредством нерадиоактивных изотопов, например, таких как дейтерий (2H или D), углерод-11 (11C), углерод-13 (13C), азот-15 (15N), фторид-18 (18F) и т.п. Будет понятно, что в соединении, где внесена такая изотопная замена, следующие атомы, когда они присутствуют, могут варьироваться: например, любой водород может представлять собой 2H/D, любой углерод может представлять собой 11C или 13C, любой азот может представлять собой 15N, или любой фторид (при наличии) может представлять собой 18F, и что присутствие и размещение таких атомов может быть определено специалистом в данной области.
ПРИМЕРЫ
[0122] Приведенные ниже примеры предоставлены для иллюстрации некоторых идей, описанных в описании. В то время как считается, что каждый пример соответствует конкретным индивидуальным вариантам осуществления изобретения, ни один из примеров не должен считаться ограничивающим более общие варианты осуществления, описанные в настоящем описании. В приведенных ниже примерах были приложены усилия для обеспечения точности использованных чисел (например, количества, температуры и т.д.), однако следует учитывать некоторую экспериментальную ошибку и погрешность.
Пример 1. Исследование дозирования радиационного излучения
[0123] Задача исследования. Оценить эффективность внутривенного введения Ryanodex для предупреждения или смягчения острого лучевого синдрома в гемопоэтической модели на самцах мышей C57BL/6 с тотальным облучением организма.
[0124] Радиационное облучение и дозиметрия. В качестве дозы тотального облучения организма животных облучали в рентгеновском биологическом облучателе RS-2000 (Rad Source, Suwanee, GA) в соответствии с SNBL USA SOP.
Целевая доза. 6,0 Гр (вычисленная Ld50/30 на основе установленного профиля летальности)
Целевая мощность дозы. Приблизительно 1,325 Гр/мин
Энергия. 160 кВ при 25 мА (на дне камеры RS-2000 с кольцевым RAD+)
Размер медного фильтра. 0,3 мм Cu
Ионизационная камера. Дозиметр ионизационной камеры RadCal 2086
Вычисление. Доза (Гр) = мощность дозы (Гр/мин) * Время (мин)
Тестируемые и контрольные образцы
[0125] Тестируемый образец. RYANODEX® (дантролен натрия) для инъекционной суспензии (Eagle Pharmaceutical, Inc.). Хранение при комнатной температуре (от 15 до 25°C).
[0126] Контрольный образец/носитель. Стерильная вода для инъекций (без бактериостатического средства). Хранение при комнатной температуре (от 15 до 25°C)
[0127] Получение. С использованием асептической процедуры каждый флакон тестируемого образца восстанавливали добавлением 5 мл стерильной воды для инъекций (контрольный образец/носитель) без бактериостатического средства. Восстановленная суспензия содержала дантролен натрий 250 мг/5 мл (50 мг/мл). После восстановления флакон перемешивали посредством переворачивания, чтобы обеспечить однородную суспензию оранжевого цвета. Полученный тестируемый образец хранили при комнатной температуре (от 15 до 25°C) и вводили в пределах 6 часов после восстановления.
Тест-система
[0128] Вид и линия. Мыши C57BL/6 (Mus musculus). Наивные животные. Самцы. (Charles River Laboratories).
Диапазон массы тела. От 20 до 30 г в начале акклиматизации
Возрастной диапазон. От 10 до 11 недель в начале акклиматизации
Количество животных для акклиматизации. 120 самцов
Количество животных для дозирования. 108 самцов
Уход за животными
[0129] Содержание. Животных содержали в среде с контролируемой температурой и влажностью. Целевой диапазон температуры и относительной влажности составляет от 20 до 26°C и от 30 до 70%, соответственно. Отклонения от целевого диапазона влажности менее чем на 4 часов считались несущественными и не описаны. Автоматическая система освещения была установлена для обеспечения 12-часового цикла свет/темнота.
[0130] Животных в социальном плане содержали (не более 3 на клетку) в клетках, которые соответствуют Закону о благополучии животных и рекомендациям, приведенным в Руководстве по содержанию и использованию лабораторных животных (National Research Council 2011) и SNBL USA SOP. Животных из установившегося блока содержания группы не помещали в новую социальную группу в ходе исследования. Животных в ходе исследования содержали по-отдельности, если они демонстрировали признаки агрессии. Подстилку и корм заменяли два раза в неделю и так, чтобы мыши вернулись в чистые клетки после облучения.
[0131] Рацион и кормление. Животным предоставлялся рацион PMI LabDiet® Certified Rodent Diet 5002 без ограничений. Корм был проанализирован стандартным образом в отношении примесей и было обнаружено, что он соответствовал спецификациям производителя. Не ожидается присутствие примесей на уровнях, которые могут исказить результат испытания. Данные анализа корма хранятся в записях объекта испытания. Начиная с 1 суток после облучения, порцию корма помещали на дно клетки.
[0132] Питьевая вода. Подкисленную питьевую воду (pH от 2,5 до 3,0) приготавливали в соответствии с SNBL USA SOP и предоставляли всем животным без ограничений. Источник воды стандартным образом анализировали в отношении примесей. Не ожидается присутствие примесей на уровнях, которые могут исказить результат испытания. Данные анализа воды хранятся в записях объекта испытания.
[0133] Улучшение внешней среды. Животным предоставляли пищевые добавки и устройства для улучшения условий в клетке в ходе исследования в соответствии с SNBL USA SOP.
[0134] Ветеринарное лечение. Ветеринарная оценка проводилась, однако животным не проводилось ветеринарное лечение. Клинические проявления определяли с использованием критериев оценки облученных мышей SOP.
Схема эксперимента
[0135] Выбор животных. Перед приемом животных изучались и одобрялись ветеринаром данные о превентивных мерах в отношении здоровья, предоставляемые поставщиком. После получения животные не извлекались из тары и исследовались техническими специалистами животноводства и в области исследований. Животных, у которых отмечались какие-либо клинические аномалии, оценивались ветеринарами. Сто десять (110) исследуемых самцов мышей C57BL/6 случайным образом отбирали для исследования. Случайным образом отбиралось десять (10) запасных самцов мышей C57BL/6. Запасные животные возвращались в исходную группу на после 0 суток.
[0136] Рандомизация. Для распределения животных на исследуемые группы использовали схему стратифицированной Г
[0137] Период акклиматизации. Все животные акклиматизировались к исследовательскому помещению в течение 14 суток перед облучением. Данные фазы акклиматизации получали для всех животных, включая запасных. Распределенных животных заменяли запасными животными при необходимости, исходя из результатов, полученных в ходе фазы акклиматизации. Запасных животных исключали из исследования на или после 0 суток. Животные получали подкисленную питьевую воду не позднее чем на вторые сутки акклиматизации.
[0138] Схема исследования. Животных распределяли на группы, и им проводили введение, как указано в таблице 1.
Таблица 1. Распределение на группы
a Общий объем дозы (мл) вычисляется на основе самой последней массы тела
b Промежуточная некропсия, 7 сутки после облучения
с Терминальная некропсия, 30 сутки после облучения
d Промежуточная некропсия, 2 сутки после облучения
e Промежуточная некропсия, 6 сутки после облучения
SID: один раз в сутки
Подготовка и процедура облучения
[0139] Удерживание животного. Животных в сознании помещали в округлую клетку, находящуюся на дне камеры RS-2000.
[0140] Уровень дозы облучение и дозиметрия. Животных в группах 1-4 подвергали воздействию вычисленного уровня LD50/30 6,0 Гр, обеспечиваемому рентгеновским излучателем. Карты доз получали каждые день облучения перед облучением животных и вновь после завершения всех облучений за день. Карты доз хранятся с данными исследования.
[0141] Частота введения. Радиационное облучение проводили один раз для каждого животного в группах 1-4 на 0 сутки утром.
Введение тестируемых и контрольных образцов
[0142] Уровень дозы. 0, 20 или 30 мг/кг.
[0143] Путь введения. Всем группам проводили дозирование посредством внутривенной (в/в) болюсной инъекции в хвостовую вену или через временный катетер в хвостовой вене после промывания 0,2 мл носителя. Область дозирования, время начала дозирования и объем дозы документировали.
[0144] Частота введения. Тестируемый образец вводили, как описано в таблице 1 в тексте. Введение дозы проводили на 0 сутки (группа 2, 1 ч до облучения), 1 сутки (группы 1, 3 и 5) и сутки 1-5 (группы 4 и 6).
[0145] Длительность введения. Как описано в таблице 1.
Наблюдение и обследование
[0146] Наблюдательная оценка ARS. Оценку параметров позы, шерсти и поведения проводили и регистрировали в соответствии с SNBL USA SOP один раз в ходе акклиматизации (сутки -1), один раз до облучения на 0 сутки, два раза в сутки на 1-29 сутки, и один раз на 30 сутки. На 1-29 сутки первая оценка ARS начиналась утром и вторая оценка ARS начиналась через 4-6 часов после завершения оценки ARS утром. Оценка ARS на 30 сутки происходила утром перед некропсией. На основе оценки ARS согласно SOP, если сумма трех оценок параметров составляла 8 или выше, начиная через 24 часа после последней дозы тестируемого образца, животное считалось умирающим, и с ним обращались в соответствии с SOP для умирающих животных. Животные, имеющие оценку ARS 8 или выше вплоть до 24 часов после введения тестируемого образца, не считались умирающими.
[0147] Проверка смертности. Проверку смертности в клетках проводили в соответствии с SOP, два раза в сутки на 1-29 сутки, начиная через 2-3 часа после завершения соответствующей оценки ARS утром и днем. Индивидуальную оценку документировали только для животных, кажущихся умирающими, посредством повторной оценки, или для найденных мертвыми животных путем удаления. При необходимости проводили дополнительную проверку смертности.
[0148] Масса тела. Каждое животное взвешивали в ходе акклиматизации, один раз на 0 сутки перед облучением и каждые 3 суток после этого. При необходимости проводили дополнительное взвешивание.
Методики взятия крови
Таблица 2. Получение образцов
[0149] Взятие и обработка крови. Взятие крови проводили при запланированной промежуточной некропсии, как описано в таблице 2.
Клиническая патология
Гематология
Животные/Группы. Первые 3 животных на подгруппу для групп 1-4.
Минимальный объем образца. 0,3 мл крови
Тип пробирки. 0,5-мл пробирки BD MAP с K2EDTA
Способ анализа. Параметры гематологии определяли с использованием автоматического анализатора Advia. Параметры гематологии оценивали на 7 сутки и 30 сутки после облучения.
Параметры.
Лейкоциты
Эритроциты
Гемоглобин
Гематокрит
Средняя гематокритная величина
Средний эритроцитарный гемоглобин
Средняя концентрация эритроцитарного гемоглобина
Ширина распределения эритроцитов по объему
Тромбоциты
Средний объем тромбоцитов
Лейкоцитарная формула (абсолютная):
- Нейтрофилы, абсолютная величина
- Лимфоциты, абсолютная величина
- Моноциты, абсолютная величина
- Эозинофилы, абсолютная величина
- Базофилы, абсолютная величина
Процент ретикулоцитов
Абсолютное количество рецикулцитов
[0150] Утилизация. Оставшиеся обработанные EDTA образцы хранили вплоть до 24 часов при 2-8ºC до анализа и выбрасывали после анализа.
Терминальные процедуры и патология
[0151] Запланированная некропсия. В день некропсии выжившим животным в группах 1-4 проводили конечную регистрацию массы тела, и их подвергали анестезии в соответствии с SNBL USA SOP, а затем проводили взятие крови в соответствии со способами, описанными в настоящем описании. Животных умерщвляли путем обескровливания и подвергали некропсии. Животных в группах 5-6 умерщвляли и выбрасывали без некропсии.
[0152] Незапланированная некропсия. Животным в группах 1-4, которых было решено умертвить, проводили конечную регистрацию массы тела, и их подвергали анестезии в соответствии с SNBL USA SOP. Животных умерщвляли путем обескровливания, при возможности, и подвергали некропсии. При необходимости животных умерщвляли и хранили в холодильнике перед некропсией. Животных в группах 5-6, которых было решено умертвить, умерщвляли и выбрасывали без некропсии.
[0153] Найденные мертвыми животные. Найденных мертвыми животных взвешивали и подвергали некропсии в течение 24 часов. При необходимости перед некропсией животных хранили в холодильнике.
[0154] Макропатология. Всех животных подвергали полной макроскопической оценке в ходе некропсии. От всех животных с запланированным и незапланированным исследование получали два мазка костного мозга бедренной кости. Мазки костного мозга не получали от животных, которые были найдены мертвыми, или от животных, которых охлаждали в холодильнике перед некропсией. Исследование мазков костного мозга при необходимости вносили в протоколы исследования.
[0155] Масса органов. Массу органов регистрировали только у животных с запланированной некропсией. Относительную массу органов вычисляли в качестве процента от конечной массы тела и массы головного мозга. См. таблицу 3 для перечня взвешиваемых тканей.
[0156] Сбор и хранение тканей. Ткани, приведенные в таблице 3, получали от всех животных и фиксировали для возможной гистопатологической оценки. Все ткани фиксировали в 10% NBF, за исключением семенников, которые фиксировали в модифицированной жидкости Дэвидсона (MDF).
Таблица 3. Сбор тканей
- = Не применимо
√ = Применимо
a Органы получают, взвешивают и/или исследуют в паре
Составление отчета
[0157] Статистический анализ. Сводная статистика (среднее значение и стандартное отклонение) для всех числовых данных, полученных от животных в соответствии с планом, была предоставлена SNBL USA. Вычисления проводили с использованием полной точности исходной данных. Данные для моментов времени, когда количество животных в соответствии с планом составляло менее трех на группу, статистическому анализу не подвергали. Данные для моментов времени без контрольных данных в соответствии с планом статистическому анализу не подвергали. Выживаемость вычисляли в целом и для каждой группы дозирования в ходе исследования с использованием формулы оценки Каплана-Мейера.
Результаты
[0158] Параметры гематологии достигли наименьших величин через 7 суток после тотального облучения организма вследствие подавления костного мозга и токсичности в отношении клеток крови. Выздоровление оценивали через 30 суток после облучения.
[0159] В целом, животные, которым вводили Ryanodex, жили дольше, чем контроли, и продемонстрировали улучшенное абсолютное количество WBC, нейтрофилов, лимфоцитов и тромбоцитов, чем у животных, которым не проводили введение (см. фиг.1-5).
[0160] Также, как показано на фиг.6-7, для животных, которым вводили Ryanodex, получали показатели гемоглобина (HgB) и гематокрита (HCT) на 7 сутки и 30 сутки.
[0161] Среднее процентное изменение массы тела оценивали с 3 суток по 30 сутки после облучения для животных, которым вводили контроль (например, стерильная вода); Ryanodex до облучения; Ryanodex в однократной дозе после облучения; и Ryanodex многократными дозами после облучения на 1-5 сутки (см. фиг.8A-8C).
[0162] Среднегрупповой показатель смертности оценивали с 1 сутки по 30 сутки после облучения для животных, которым вводили контрольный носитель (стерильная вода), Ryanodex за 1 ч до облучения, Ryanodex на 1 сутки после облучения и Ryanodex на 1-5 сутки после облучения. См. фиг.9A-9C.
Пример 2
[0163] Дантролен натрия (1 экв.) растворяли в безводном диметилформамиде. Добавляли реагент 3 (1 экв.) и реакционную смесь перемешивали при 60°C в атмосфере азота. Через 4 ч добавляли другой эквивалент реагента 3 и реакционную смесь перемешивали при 60°C в течение ночи. Затем реакционную смесь разбавляли этилацетатом и промывали два раза насыщенным раствором хлорида натрия. Слои разделяли. Органические слои сушили над сульфатом натрия и концентрировали в вакууме. Неочищенный продукт очищали с использованием хроматографии на силикагеле. Требуемый продукт выделяли с чистотой 90-95%. 1H-ЯМР соответствовал спрогнозированному для требуемого продукта.
[0164] Пример 2, способ A: 1a сушили посредством P2O5 в течение ночи. К смеси 1a (500 мг, 1,48 ммоль) в DMF (10 мл) добавляли 3 (0,84 мл, 3,72 ммоль), а затем NaI (245 мг, 1,63 ммоль) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 64 ч. Смесь разбавляли EtOAc (30 мл) и рассолом (20 мл). Органический слой отделяли, промывали водой (2×15 мл), сушили над безводным Na2SO4, фильтровали и упаривали. Неочищенный остаток очищали флэш-хроматографией (два раза), элюируя 0-10% MeOH/CH2Cl2, с получением требуемого соединения 4 (355 мг, 45%) в виде желтого твердого вещества.
[0165] Пример 2, способ B: 1a сушили посредством P2O5 в течение ночи. К смеси 1a (8,0 г, 23,8 ммоль) в DMF (160 мл) добавляли 3 (6,5 мл, 28,79 ммоль), а затем NaI (4,28 г, 28,55 ммоль) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 40 ч. Смесь разбавляли EtOAc (250 мл) и рассолом (60 мл). Органический слой отделяли, промывали водой (2×75 мл), сушили над безводным Na2SO4, фильтровали и упаривали. Остаток растирали с CH2Cl2-гексаном с получением желтого твердого вещества (~7 г). Это твердое вещество очищали флэш-хроматографией (два раза, дезактивированный SiO2), элюируя 0-10% MeOH/CH2Cl2, с получением требуемого соединения 4 (1,92 г, 15%) в виде желтого твердого вещества.
Пример 3
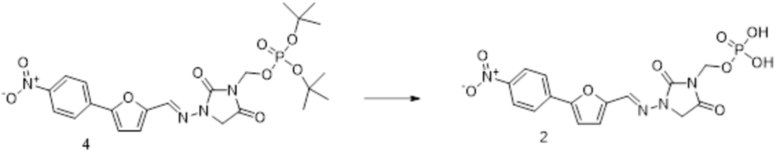
[0166] Образец соединения 4 обрабатывали 1 мл смеси трифторуксусная кислота/вода 9/1 в течение 20-30 мин при температуре окружающей среды. Избыток TFA сразу удаляли с использованием высокого вакуума, и полученное твердое вещество собирали фильтрацией, промывали водой (5 мл) и сушили воздухом. Исходный материал, реакционную смесь и конечный продукт анализировали посредством LC/MS для определения того, конвертируется ли 2 обратно в дантролен в условиях удаления защитной группы. Не наблюдалось обратного конвертирования 2 в дантролен. Данные 1H-ЯМР продукта согласовывались с тем, что было спрогнозировано для требуемого продукта.
[0167] Пример 3, способ A: К смеси 4 (886 мг, 1,65 ммоль) в CH2Cl2 (9 мл) добавляли TFA (9 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 ч. Растворитель выпаривали на роторном испарителе до сухого состояния. Полученный остаток растирали с гексаном в течение 1 ч, и желтое твердое вещество фильтровали и сушили с получением требуемого соединения 2 (660 мг, 94%).
Пример 4
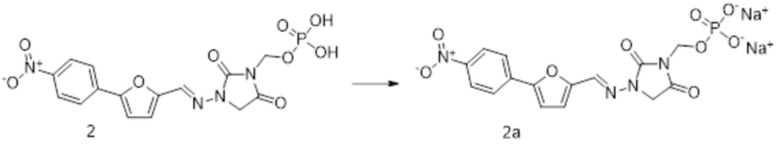
[0168] 50 мг 2 смешивали с 3 мл метанола (полное растворения) и наносили на 1-г Na+ ионообменную колонку. Соединение элюировали метанолом и после лиофилизации получали 18 мг (выход 36%) оранжевого твердого вещества. Этот материал растворяли в воде и осторожно титровали до pH 8,5 добавлением небольших аликвот 0,1 M NaOH при перемешивании. Затем раствор лиофилизировали с получением оранжевого твердого вещества, соединение 2a. Данные LC/MS образца до и после лиофилизации были идентичными, что указывает на то, что в ходе ионного обмена не происходило обратного конвертирования в дантролен. Данные 1H-ЯМР продукта согласовывались с теми, что были спрогнозированы для требуемого продукта.
[0169] Пример 4, способ A: К перемешиваемой суспензии 2 (500 мг, 1,17 ммоль) в воде (63 мл, категория ВЭЖХ) добавляли 0,1 Н NaOH (23,6 мл, 2,34 ммоль) при комнатной температуре аликвотами 650 мкл, после чего быстро проводили встряхивание до достижения pH 8,5. Раствор фильтровали и фильтрат лиофилизировали в течение ночи с получением указанного в заголовке соединения 2a (530 мг, 96%) в виде желтого твердого вещества. MS (CI) m/z=424,9 [M]+. 1H-ЯМР (300 МГц, D2O): δ 8,08 (д, J=8,8 Гц, 2H), 7,72 (д, J=8,8 Гц, 2H), 7,59 (с, 1H), 6,98 (д, J=3,6 Гц, 1H), 6,86 (д, J=3,6 Гц, 1H), 5,19 (д, J=6,0 Гц, 2H), 4,32 (с, 2H).
Пример 5. Получение 2b
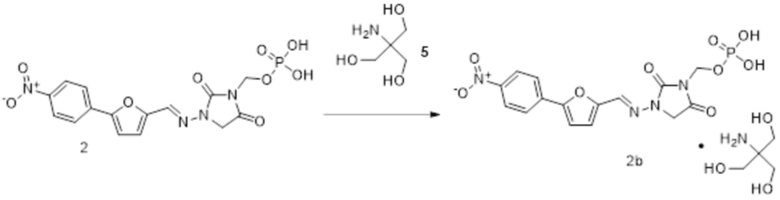
[0170] К перемешиваемой суспензии 2 (100 мг, 0,23 ммоль) в воде (12 мл, категория ВЭЖХ) капельно добавляли Tris (5, 57 мг, 0,47 ммоль), растворенный в воде (5 мл), при комнатной температуре. Значение pH конечного раствора составляло 6,6. Раствор фильтровали и фильтрат лиофилизировали в течение ночи с получением указанного в заголовке соединения 2b (150 мг, 95%) в виде желтого твердого вещества. MS (CI) m/z=424,9 [M]+. 1H-ЯМР (300 МГц, DMSO-d6): δ 8,24 (м, 2H), 7,93 (м, 2H), 7,73 (м, 1H), 7,12 (м, 1H), 6,97 (м, 1H), 5,20 (м, 2H), 4,40 (м, 2H), 3,63 (м, 15 H).
Пример 6.
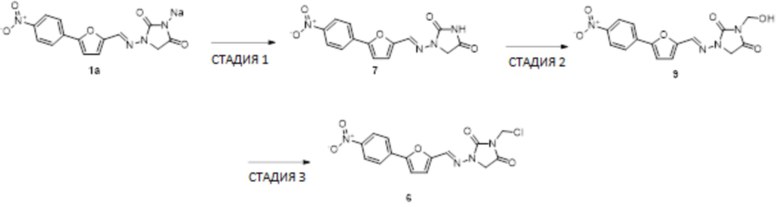
[0171] СТАДИЯ 1: 1a сушили посредством P2O5 в течение ночи. К смеси 1a (1,0 г, 2,97 ммоль) в DMF (20 мл) добавляли ледяную уксусную кислоту (340 мкл, 5,95 ммоль) при комнатной температуре. Смесь перемешивали в течение ночи при комнатной температуре. Смесь перевали на дробленый лед, твердое вещество фильтровали и промывали водой. Полученное влажное твердое вещество сушили над безводным P2O5 в течение ночи с получением требуемого соединения 7 (920 мг, 98%) в виде желтого твердого вещества.
[0172] СТАДИЯ 2: к суспензии 7 (1,35 г, 4,29 ммоль) в воде (45 мл) добавляли формалин (4,35 мл, 57,45 ммоль, 37% формальдегид в воде), а затем K2CO3 (51 мг, 0,37 ммоль). Смесь перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь фильтровали и желтое твердое вещество промывали 3% водным раствором формальдегида и сушили воздухом в течение 24 ч с получением требуемого соединения 9 (1,2 г, 82%).
[0173] СТАДИЯ 3: к раствору 9 (615 мг, 1,78 ммоль) в смеси DMF:ацетон (40 мл, 15:25 мл) медленно добавляли PCl3 (1,2 мл, 13,71 ммоль) при 0°C. Реакционную смесь перемешивали в течение 10 мин при 0°C и 2 ч при комнатной температуре. Затем смесь переливали на дробленый лед, и полученное желтое твердое вещество фильтровали, промывали водой (3×50 мл) и сушили над P2O5 в вакууме в течение 16 ч с получением требуемого соединения 6 (600 мг, 92%). 1H-ЯМР (300 МГц, DMSO-d6): δ 8,33 (д, J=8,5 Гц, 2H), 8,03 (д, J=8,8 Гц, 2H), 7,87 (с,1H), 7,48 (д, J=3,3 Гц, 1H), 7,11 (д, J=3,6 Гц, 1H), 5,42 (с, 2H), 4,53 (с, 2H).
Пример 7
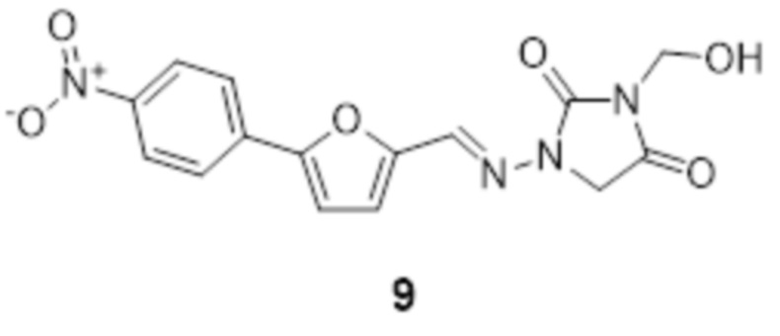
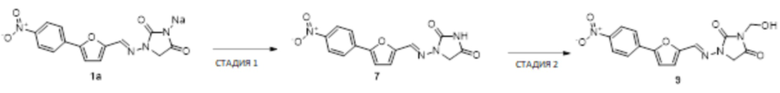
[0174] СТАДИЯ 1: 1a сушили с P2O5 в течение ночи. К смеси 1a (1,0 г, 2,97 ммоль) в DMF (20 мл) добавляли ледяную уксусную кислоту (340 мкл, 5,95 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре. Смесь переливали на дробленый лед, полученное твердое вещество фильтровали и промывали водой. Влажное твердое вещество сушили над безводным P2O5 в течение ночи с получением требуемого соединения 7 (920 мг, 98%) в виде желтого твердого вещества.
[0175] СТАДИЯ 2: к суспензии 7 (90 мг, 0,28 ммоль) в воде (2,6 мл) добавляли формалин (0,29 мл, 3,83 ммоль, 37% формальдегид в воде), а затем K2CO3 (3,4 мг, 0,02 ммоль). Смесь перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь фильтровали и желтое твердое вещество промывали 3% водным раствором формальдегида и сушили в течение 24 ч с получением требуемого соединения 9 (86 мг, 88%). MS (CI) m/z=343 [M]-. 1H-ЯМР (300 МГц, DMSO-d6): δ 8,32 (д, J=9,0 Гц, 2H), 8,03 (д, J=9,1 Гц, 2H), 7,83 (с,1H), 7,47 (д, J=3,6 Гц, 1H), 7,08 (д, J=3,6 Гц, 1H), 6,52 (t, 1H), 4,85 (д, J=7,1 Гц, 2H), 4,45 (с, 2H).
Пример 8
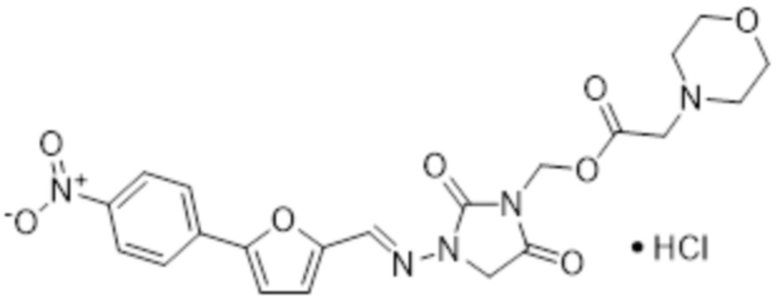 10c
10c

[0176] СТАДИЯ 1: Безводный DMF (0,8 мл, 10,33 ммоль) растворяли в безводном тетрагидрофуране (13 мл). Раствор капельно добавляли к перемешиваемому раствору тионилхлорида (0,75 мл, 10,33 ммоль), растворенному в тетрагидрофуране (9 мл), и охлаждали на ледяной бане. После завершения добавления и 30 минут на льду ледяную баню удаляли и добавляли твердый N-гидроксисукцинимид (832 мг, 7,23 ммоль) (который полностью растворялся), а затем сразу добавляли твердую предварительно порошкованную морфолинуксусную кислоту (1,0 г, 6,88 ммоль). Морфолинуксусная кислота растворялась медленно, обеспечивая однородный раствор, который быстро становился мутным. Реакционную смесь оставляли энергично перемешиваться в течение ночи при комнатной температуре. Белое твердое вещество промывали тетрагидрофураном и сушили в вакууме с получением требуемого соединения соединение 11 (1,6 г, 96%) в виде белого твердого вещества.
[0177] СТАДИЯ 2: к раствору 9 (660 мг, 1,92 ммоль) и 11 (928 мг, 3,83 ммоль) в безводном DMF (12 мл) добавляли триэтиламин (0,39 мл, 2,8 ммоль). Полученную смесь перемешивали в течение ночи при 60°C. Реакционную смесь охлаждали до комнатной температуры и очищали обращено-фазовой колоночной хроматографией с использованием смеси ацетонитрил-вода в качестве элюента. Фракции колонки анализировали посредством ВЭЖХ и фракции, содержавшие продукт, лиофилизировали с получением неочищенного соединения с чистотой 50%. Этот неочищенный продукт вновь очищали посредством препаративной ВЭЖХ с использованием смеси ацетонитрил-вода. Лиофилизация очищенных фракций дала указанное в заголовке соединение 10 (100 мг, 10%) в виде желтого твердого вещества.
[0178] СТАДИЯ 3: к перемешиваемому раствору 10 (75 мг, 0,16 ммоль) в безводном 1,4-диоксане (4 мл) добавляли HCl (0,3 мл, 4 Н в 1,4-диоксане) при комнатной температуре и полученную смесь перемешивали в течение 2 ч. Растворители выпаривали на роторном испарителе до сухого состояния. Полученный остаток растворяли в воде и лиофилизировали в течение ночи с получением 10c (75 мг, 94%).
[0179] MS (CI) m/z=472,1 [M]+. 1H-ЯМР (300 МГц, DMSO-d6): δ 8,33 (д, J=8,8 Гц, 2H), 8,03 (д, J=9,1 Гц, 2H), 7,89 (с, 1H), 7,49 (д, J=3,6 Гц, 1H), 7,11 (д, J=4,1 Гц, 1H), 5,60 (с, 2H), 4,54 (с, 2H), 3,32-3,81 (м, 10H). 1H-ЯМР (300 МГц, D2O): δ 8,17 (д, J=8,5 Гц, 2H), 7,81 (д, J=8,8 Гц, 2H), 7,60 (с, 1H), 6,93-7,02 (м, 1H), 6,88-6,92 (м, 1H), 5,73 (с, 2H), 4,39 (с, 2H), 4,26 (с, 2H), 3,90-4,09 (м, 4H), 3,30-3,52 (м, 4H).
Пример 9
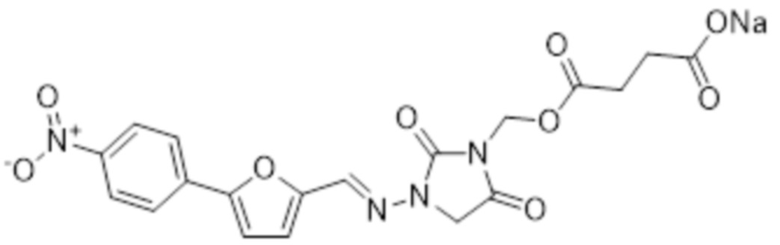 12a
12a
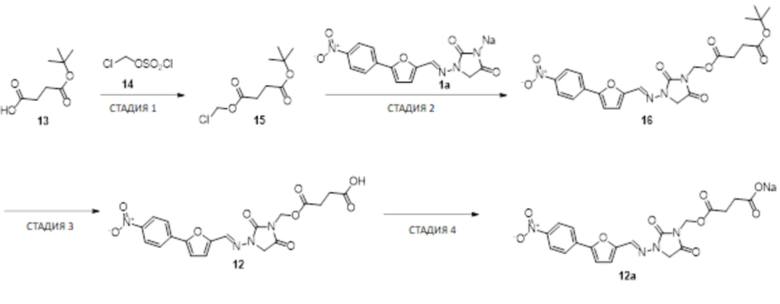
[0180] СТАДИЯ 1: к смеси K2CO3 (4,0 г, 28,94 ммоль) и TBAHSO4 (240 мг, 0,70 ммоль) в воде (8 мл) добавляли 13 (2,0 г, 11,48 ммоль) в CH2Cl2 (8 мл) при 0°C. Полученную смесь перемешивали в течение 20 мин при 0°C, а затем добавляли 14 (1,3 мл, 12,85 ммоль) и вновь перемешивали в течение 3 ч. Органический слой отделяли и промывали водой (2×5 мл) и насыщенным водным рассолом (5 мл). Слой CH2Cl2 сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный остаток очищали флэш-хроматографией, элюируя 0-100% EtOAc/гексаном с получением требуемого соединения 15 (2,2 г, 86%) в виде бесцветной камеди.
[0181] СТАДИЯ 2: 1a сушили посредством P2O5 в течение ночи. К смеси 15 (2,2 г, 9,87 ммоль) в DMF (35 мл) добавляли 1a (1,66 г, 4,93 ммоль) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 20 ч. Смесь разбавляли EtOAc (50 мл) и промывали водой (2×25 мл) и насыщенным водным рассолом (15 мл). Слой EtOAc сушили над безводным Na2SO4, фильтровали и упаривали в вакууме. Неочищенный остаток очищали флэш-хроматографией, элюируя 0-100% EtOAc/CH2Cl2 (два раза), а затем растирали с CH2Cl2-гексаном с получением требуемого соединения 16 (500 мг, 20%) в виде желтого твердого вещества.
[0182] СТАДИЯ 3: к смеси 16 (340 мг, 0,68 ммоль) в CH2Cl2 (18 мл) добавляли TFA (1,8 мл). Полученную смесь перемешивали в течение ночи при комнатной температуре. Растворители выпаривали на роторном испарителе до сухого состояния. Полученный остаток растирали с гексаном в течение 1 ч и желтое твердое вещество фильтровали и сушили с получением требуемого в заголовке соединения 12 (300 мг, 99%).
[0183] СТАДИЯ 4: к перемешиваемой суспензии 6 (260 мг, 0,58 ммоль) вводе (36 мл, категория ВЭЖХ) добавляли 0,1 Н NaOH (5,85 мл, 0,58 ммоль) при комнатной температуре аликвотами объемом 400 мкл, а затем сразу проводили быстрое встряхивание. Значение pH конечного раствора составляло 6,73. Раствор фильтровали и фильтрат лиофилизировали в течение ночи с получением указанного в заголовке соединения 12a (150 мг, 55%) в виде желтого твердого вещества. MS (CI) m/z=445,1 [M]+. 1H-ЯМР (300 МГц, DMSO-d6): δ 8,34 (д, J=8,8 Гц, 2H), 8,04 (д, J=8,8 Гц, 2H), 7,87 (с, 1H), 7,49 (д, J=3,6 Гц, 1H), 7,11 (д, J=3,8 Гц, 1H), 5,43 (с, 2H), 4,51 (с, 2H), 2,40 (м, 2H), 2,15 (м, 2H).
Пример 10
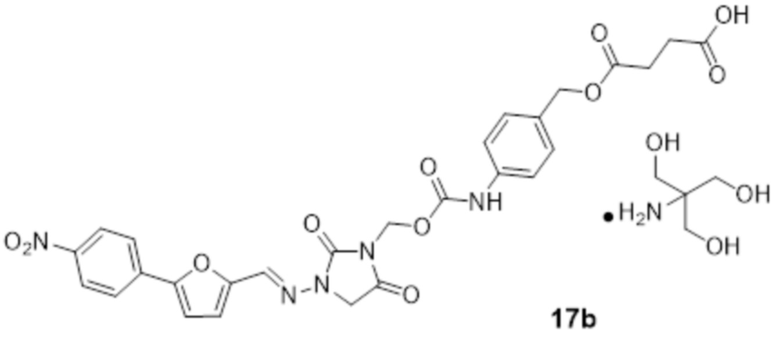
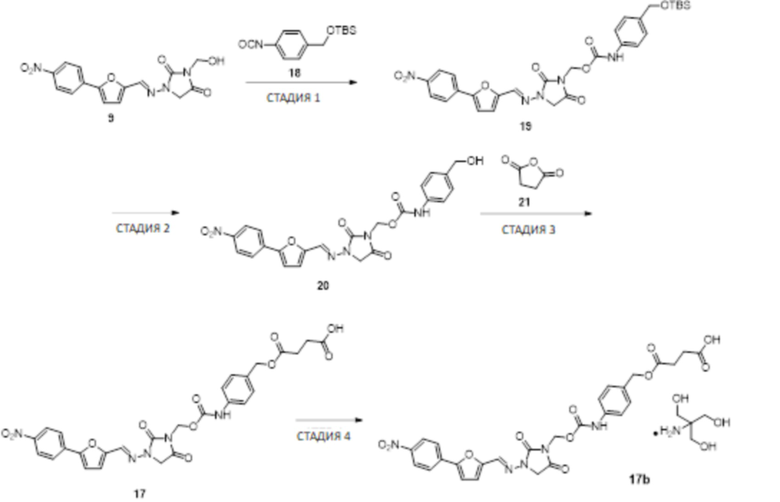
[0184] СТАДИЯ 1: к раствору соединения 9 (500 мг, 1,45 ммоль) в безводном DMF (10 мл) добавляли соединение 18 (488 мг, 1,85 ммоль) в DMF (2 мл), а затем TEA (0,3 мл, 2,2 ммоль). Полученную смесь перемешивали в течение 16 ч при комнатной температуре. Смесь разбавляли EtOAc (50 мл), промывали водой (2×15 мл). Органический слой сушили над безводным Na2SO4, фильтровали и упаривали до сухого состояния. Неочищенный продукт очищали два раза флэш-хроматографией, элюируя 0-10% MeOH/CH2Cl2, с получением требуемого соединения 19 (350 г, 40%) в виде желтого твердого вещества.
[0185] СТАДИЯ 2: к раствору соединения 19 (200 мг, 0,32 ммоль) в MeOH:1,4-диоксане (1:1, 6 мл) добавляли моногидрат п-толуолсульфоновой кислоты (63 мг, 0,32 ммоль). Прозрачный раствор перемешивали в течение 16 ч при комнатной температуре. Растворители выпаривали на роторном испарителе до сухого состояния. Остаток очищали флэш-хроматографией, элюируя 0-10% MeOH/CH2Cl2, с получением требуемого соединения 20 (125 г, 77%) в виде желтого твердого вещества.
[0186] СТАДИЯ 3: к раствору соединения 20 (120 мг, 0,24 ммоль) и соединения 21 (26,4 мг, 0,26 ммоль) в м-ксилоле:1,4-диоксане (1:1, 16 мл) добавляли моногидрат п-толуолсульфоновой кислоты (15 мг, 0,07 ммоль) и 4Å молекулярные сита (100 мг). Полученную смесь кипятили с обратным холодильником в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли 1,4-диоксаном (30 мл) и фильтровали. Фильтрат упаривали и неочищенный остаток очищали два раза флэш-хроматографией, элюируя 0-10% MeOH/CH2Cl2, с получением требуемого соединения 17 (16 мг, 11%) в виде желтого твердого вещества.
[0187] СТАДИЯ 4: к перемешиваемой суспензии 17 (5 мг, 8,4 мкмоль) в воде (3 мл, категория ВЭЖХ) капельно добавляли 0,1 Н Tris (90 мкл, 8,9 мкмоль) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 3 ч. Раствор фильтровали и фильтрат лиофилизировали в течение ночи с получением указанного в заголовке соединения 17b (6 мг, 100%) в виде желтого твердого вещества. MS (CI) m/z=594,1 [M]+. 1H-ЯМР (300 МГц, DMSO-d6): δ 9,96 (ушир.с, 1H), 8,34 (д, J=8,8 Гц, 2H), 8,05 (д, J=8,5 Гц, 2H), 7,89 (с, 1H), 7,5 (д, J=3,2 Гц, 1H), 7,46 (д, J=8,8 Гц, 2H), 7,29 (д, J=8,5 Гц, 2H), 7,12 (д, J=3,5 Гц, 1H), 5,57 (с, 2H), 4,99 (с, 2H), 4,55 (с, 2H), 3,23-3,32 (м, 9H), 2,33-2,36 (м, 4H).
Пример 11
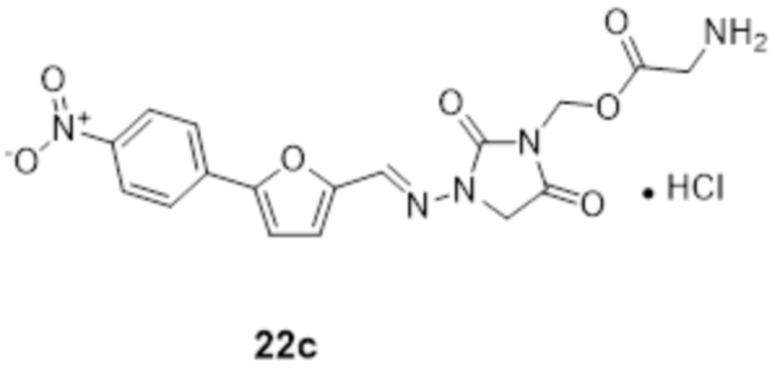
[0188] СТАДИЯ 1: к смеси 23 (2,5 г, 14,28 ммоль) в DMF (30 мл) добавляли триэтиламин (3,47 мл, 24,93 ммоль), а затем 24 (3,92 мл, 53,9 ммоль) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 40 ч. Смесь разбавляли EtOAc (100 мл) и водой (50 мл). Слой EtOAc промывали водой (2×25 мл), 5% NaHCO3 (25 мл) и насыщенным водным рассолом (15 мл). Слой EtOAc сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенный остаток очищали флэш-хроматографией, элюируя 0-100% EtOAc/гексаном, с получением требуемого соединения 25 (657 мг, 21%) в виде бесцветного масла.
[0189] СТАДИЯ 2: 1a сушили посредством P2O5 в течение ночи. К смеси 1a (647 мг, 1,92 ммоль) в DMF (12 мл) добавляли 25 (647 мг, 2,89 ммоль) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 110 ч. Смесь разбавляли EtOAc (40 мл), промывали водой (2×15 мл) и насыщенным водным рассолом (15 мл). Слой EtOAc сушили над безводным Na2SO4, фильтровали и упаривали в вакууме. Неочищенный остаток очищали флэш-хроматографией, элюируя 0-100% EtOAc/CH2Cl2, с получением требуемого соединения 26 (260 мг, 27%) в виде желтого твердого вещества.
[0190] СТАДИЯ 3: к перемешиваемому раствору 26 (210 мг, 0,41 ммоль) в безводном 1,4-диоксане (4 мл) добавляли HCl (4 мл, 4 Н в 1,4-диоксане) при комнатной температуре и полученную смесь перемешивали в течение ночи. Растворители выпаривали на роторном испарителе до сухого состояния. Полученный остаток растирали с гексаном в течение 1 ч и желтое твердое вещество отфильтровывали и сушили с получением указанного в заголовке соединения 22c (153 мг, 83%). MS (CI) m/z=402,1 [M]+. 1H-ЯМР (300 МГц, DMSO-d6): δ 8,47 (ушир.с, 3H), 8,34 (д, J=8,8 Гц, 2H), 8,04 (д, J=8,8 Гц, 2H), 7,91 (с, 1H), 7,50 (д, J=3,6 Гц, 1H), 7,12 (д, J=3,6 Гц, 1H), 5,61 (с, 2H), 4,56 (с, 2H), 3,85 (с, 2H).
[0191] Описание каждого патента, патентной заявки и публикации, цитированных в настоящем описании, включено в настоящее описание в качестве ссылки в полном объеме.
[0192] Специалистам в данной области будет понятно, что в предпочтительные варианты осуществления могут быть внесены многочисленные изменения и модификации, и что такие изменения и модификации могут быть внесены без отклонения от сущности изобретения. Таким образом, подразумевается, что прилагаемая формула изобретения охватывает все такие эквивалентные отклонения как входящие в рамки истинной сущности и объема изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОЛЕКАРСТВА ДАНТРОЛЕНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2815017C2 |
| СПОСОБЫ ПРИМЕНЕНИЯ ДАНТРОЛЕНА ДЛЯ ЛЕЧЕНИЯ ВОЗДЕЙСТВИЯ НЕРВНО-ПАРАЛИТИЧЕСКОГО ВЕЩЕСТВА | 2018 |
|
RU2817851C2 |
| КОМПОЗИЦИИ ДАНТРОЛЕНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2809143C2 |
| КОМБИНАЦИЯ ИНГИБИТОРОВ ГИСТОНДЕАЦЕТИЛАЗЫ И ИЗЛУЧЕНИЯ | 2006 |
|
RU2436572C2 |
| ВОДНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ДАНТРОЛЕН | 2016 |
|
RU2729043C2 |
| ПРОЛЕКАРСТВА КАРБИДОПА И L-DOPA И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2015 |
|
RU2743347C2 |
| ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ТРИ-ЗАМЕЩЕННОГО ГЛИЦЕРИНА ДЛЯ ЛЕЧЕНИЯ РАДИАЦИОННЫХ ПОРАЖЕНИЙ | 2007 |
|
RU2448973C2 |
| КОМПОЗИЦИИ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ОСТРОЙ ЛУЧЕВОЙ БОЛЕЗНИ | 2018 |
|
RU2841262C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМБИНАЦИИ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2017 |
|
RU2726367C2 |
| ИНГИБИТОРЫ IBAT ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПЕЧЕНИ | 2011 |
|
RU2591188C2 |
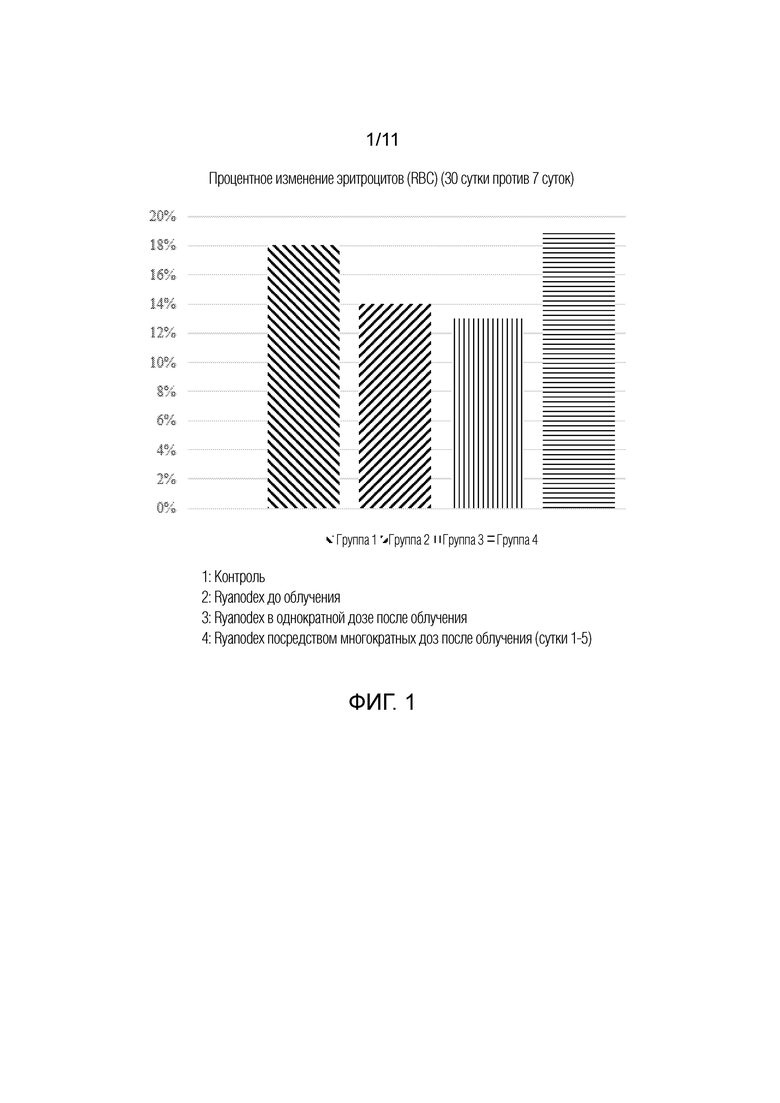
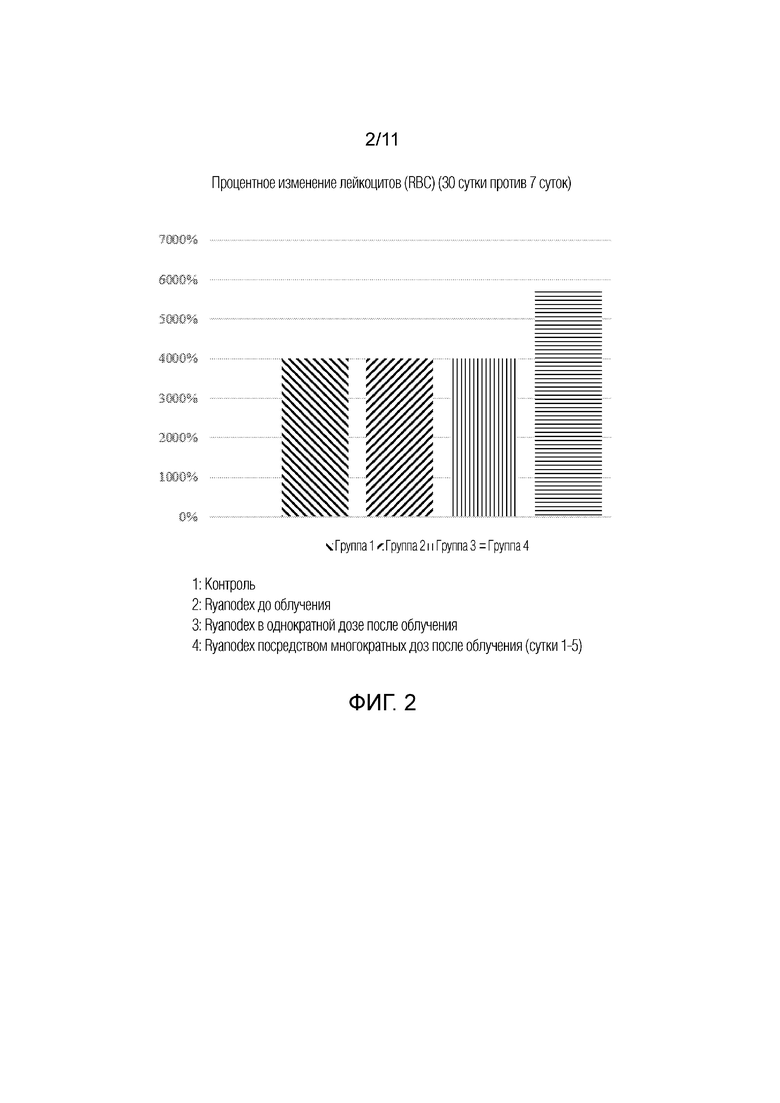
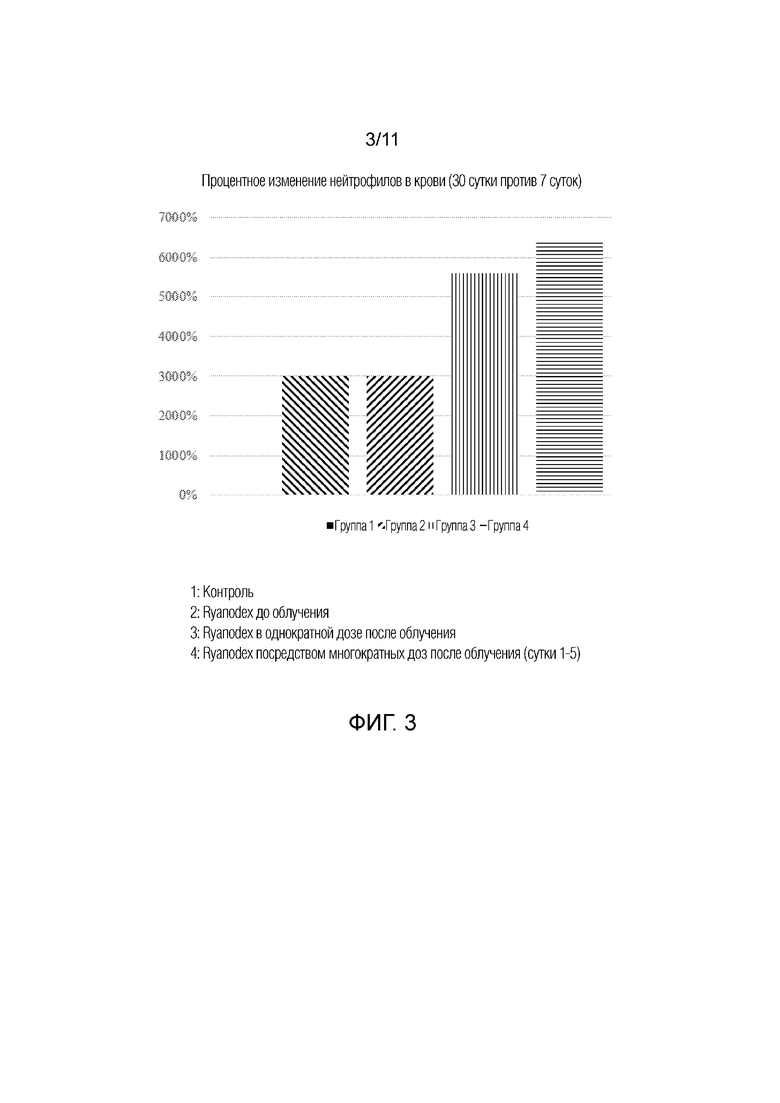
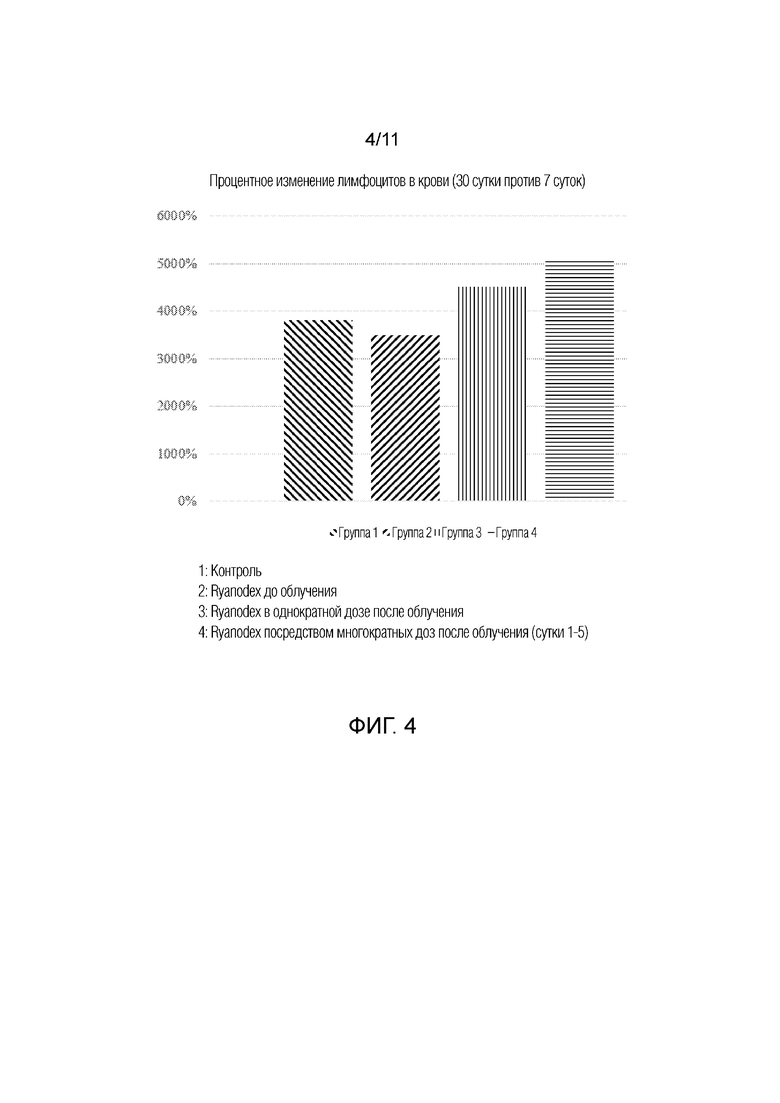
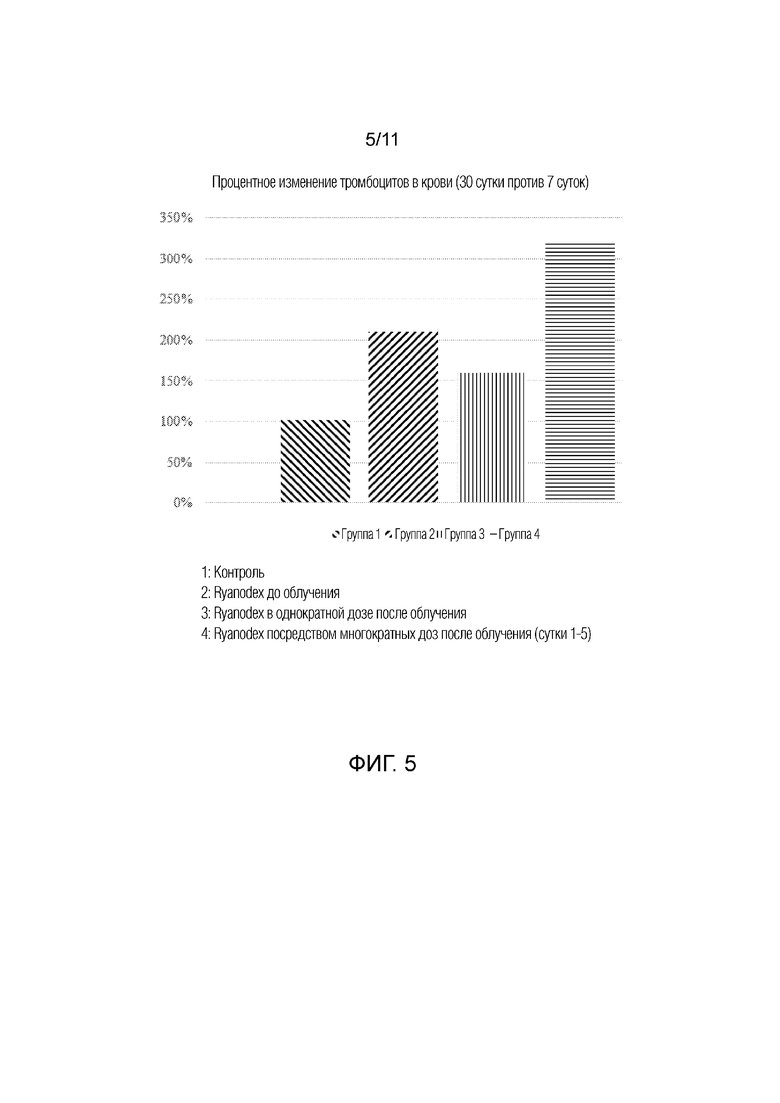
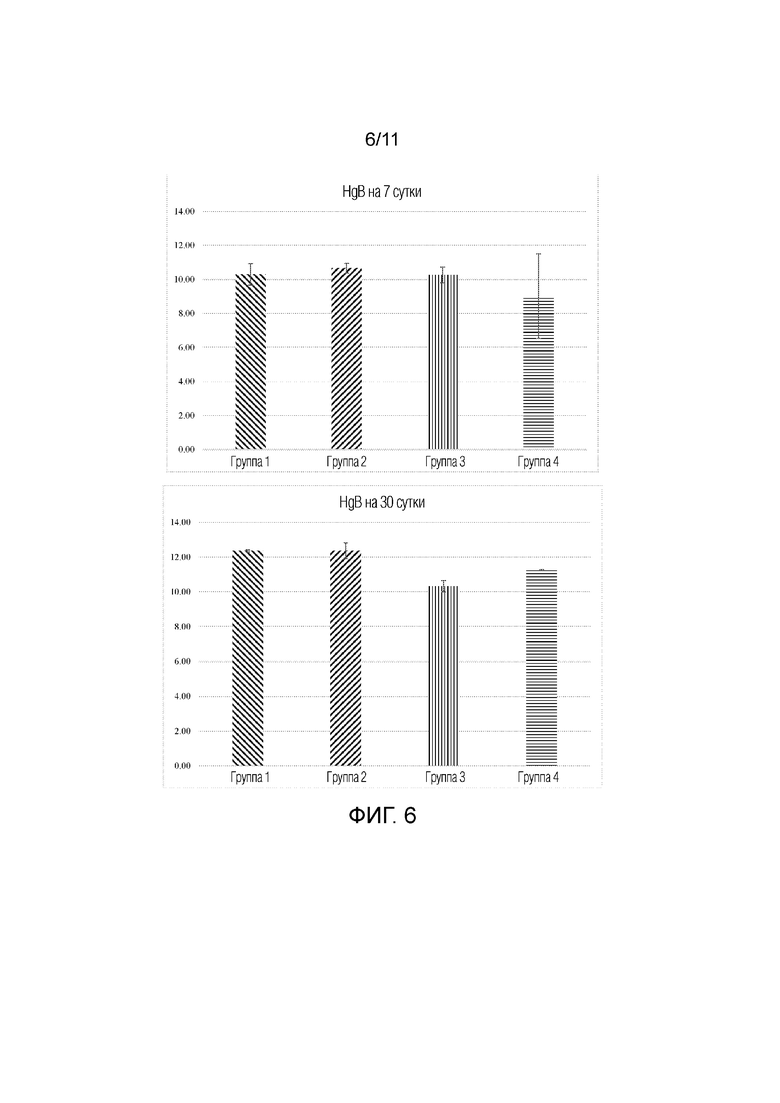
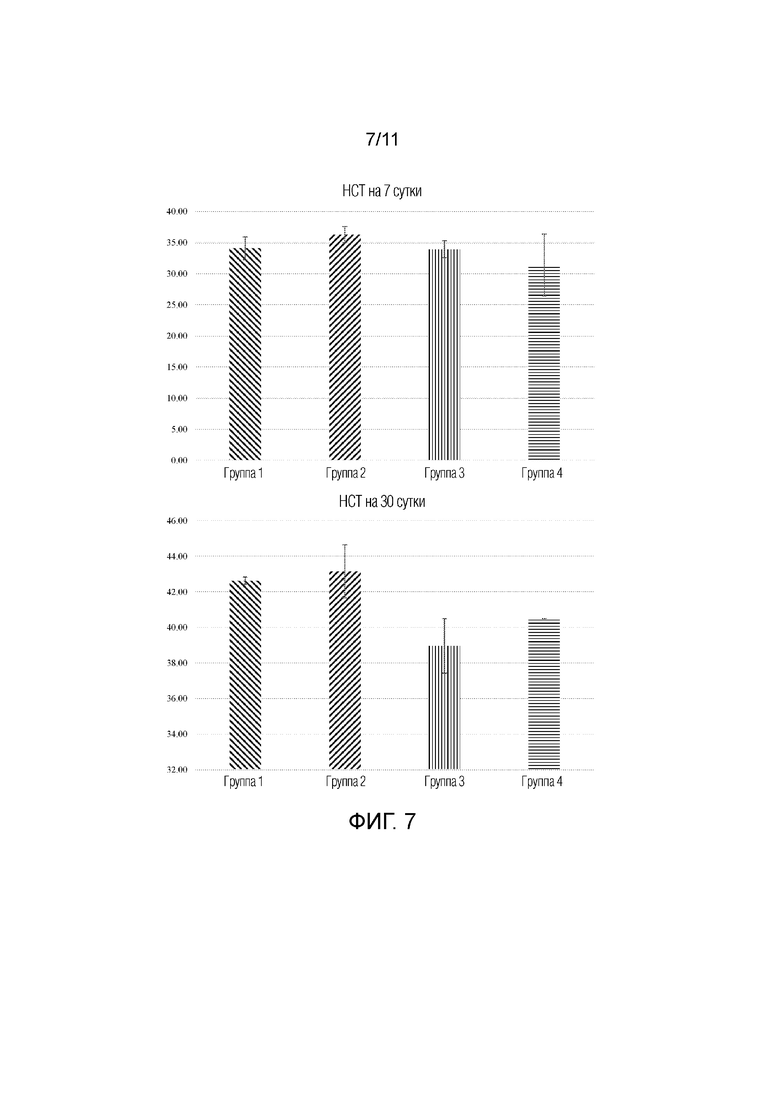
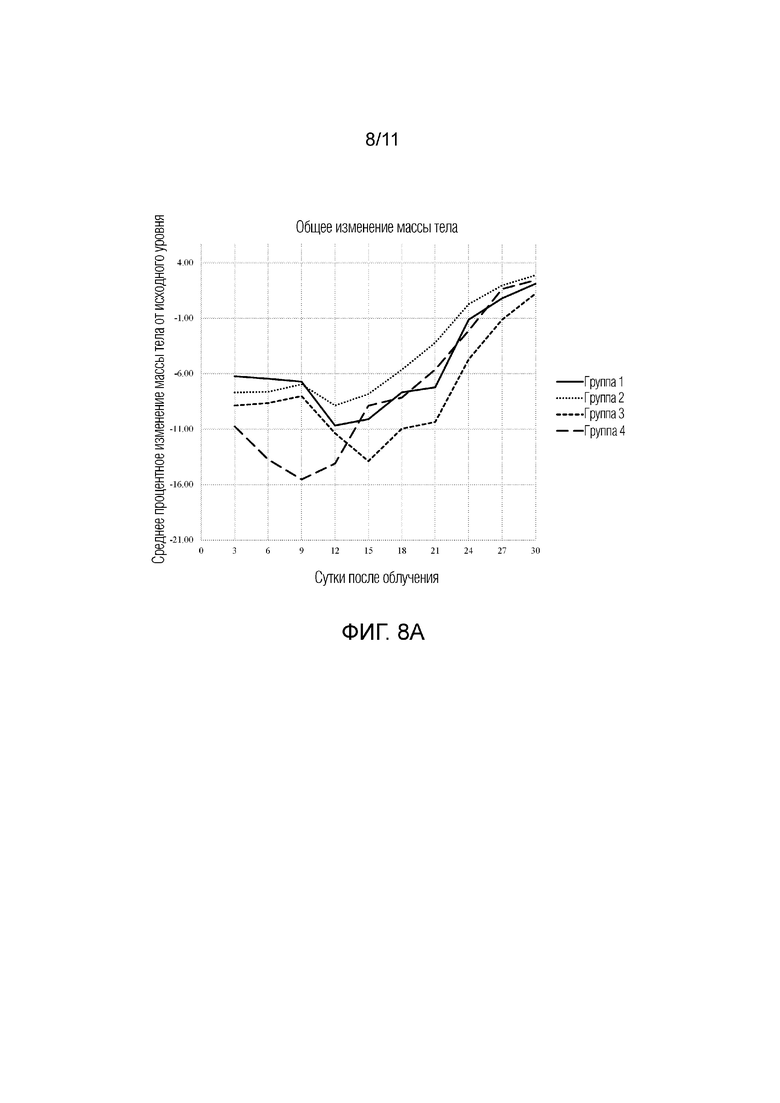
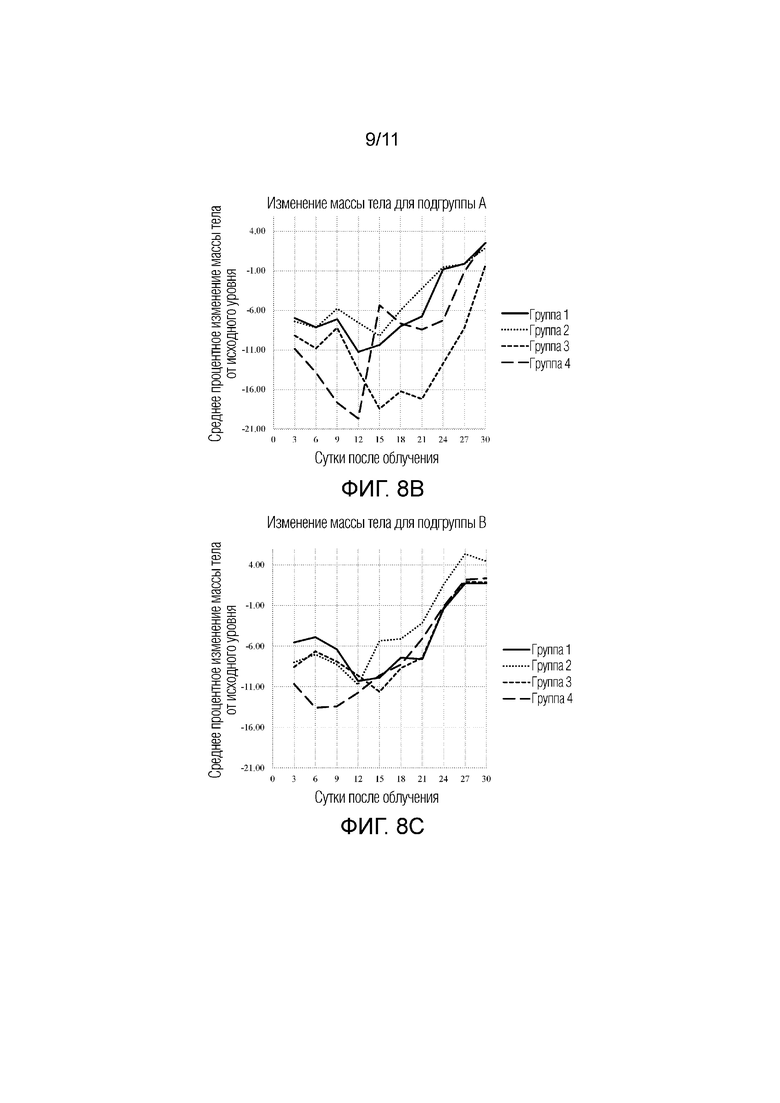
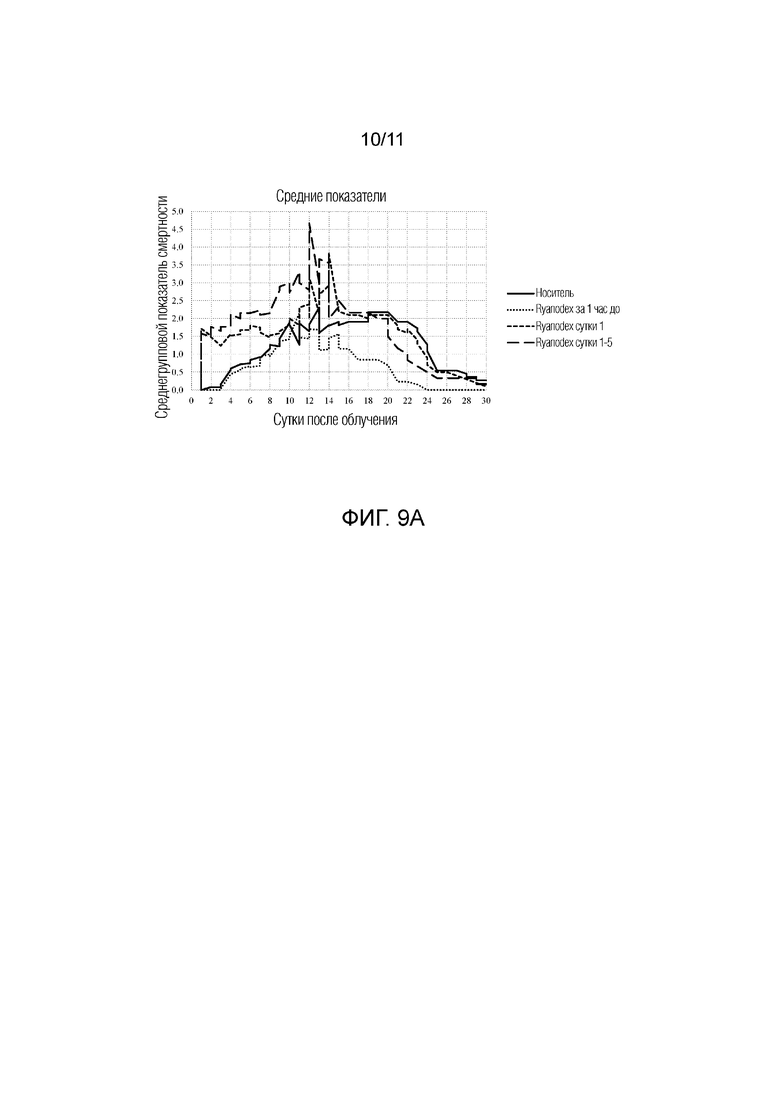
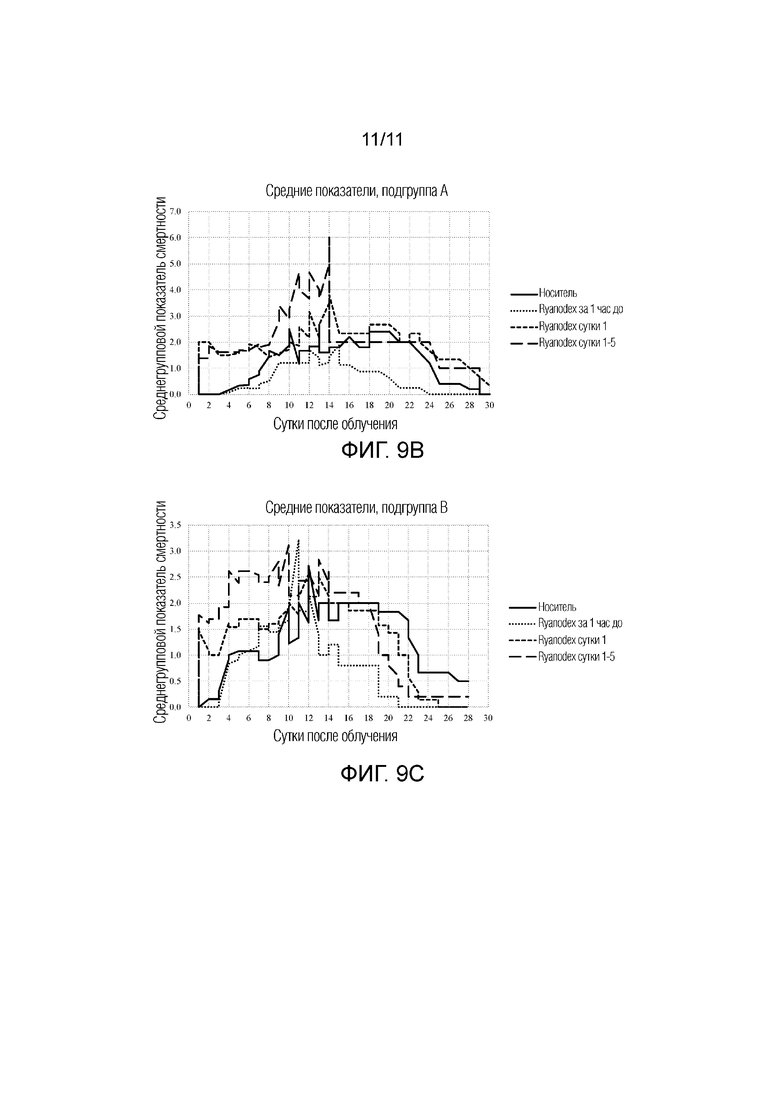
Изобретение относится к фармацевтической промышленности и медицине, а именно к способу лечения радиационного воздействия. Способ лечения радиационного воздействия на индивидуума, который подвергнут или будет подвергнут радиационному воздействию, включающий введение индивидууму фармацевтической композиции, содержащей от 1 мг/кг до 30 мг/кг количества соединения формулы I, соединения формулы II, или их фармацевтически приемлемой соли, или их комбинации:
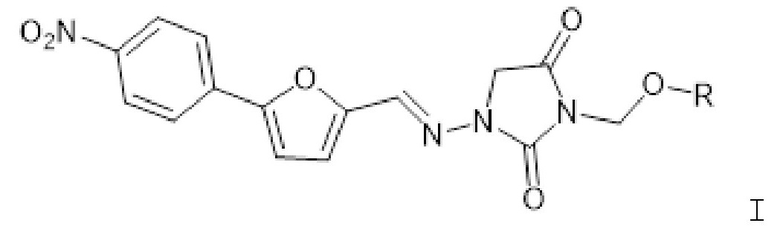
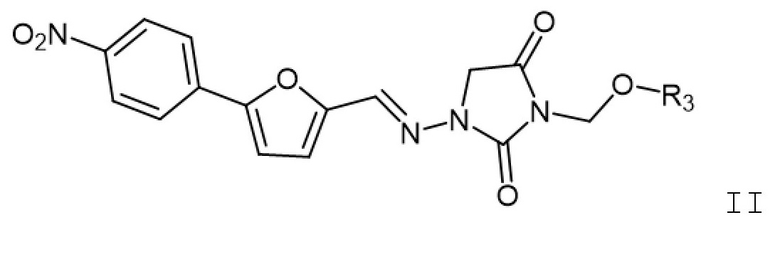
где R представляет собой -Р (О) (ОН)2 или -Р (О) (OR1) (OR2); R1 представляет собой Н или -C1-26алкил; и R2 представляет собой -C1-26алкил; R3 представляет собой Н, -С(О)-Z-N(R4)(R5), -С(О)Z-C(О)-ОН или -С(О)-NH-Y-CH2-OC(О)-Z-C(О)-ОН; Z представляет собой С1-6алк; Y представляет собой арилен; R4 представляет собой Н или C1-6алкил; R5 представляет собой Н или C1-6алкил; или R4 и R5 вместе с азотом, к которому они присоединены, образуют гетероциклоалкил; или их фармацевтически приемлемая соль. Вышеописанный способ эффективен для лечения радиационного воздействия на индивидуума, который подвергнут или будет подвергнут радиационному воздействию. 20 з.п. ф-лы, 9 ил., 3 табл., 11 пр.
1. Способ лечения радиационного воздействия на индивидуума, который подвергнут или будет подвергнут радиационному воздействию, включающий введение индивидууму фармацевтической композиции, содержащей от 1 мг/кг до 30 мг/кг количества соединения формулы I, соединения формулы II, или их фармацевтически приемлемой соли, или их комбинации:
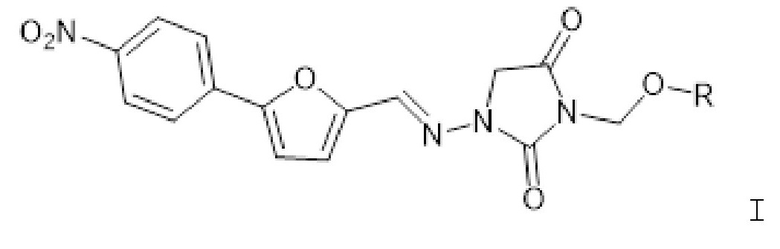
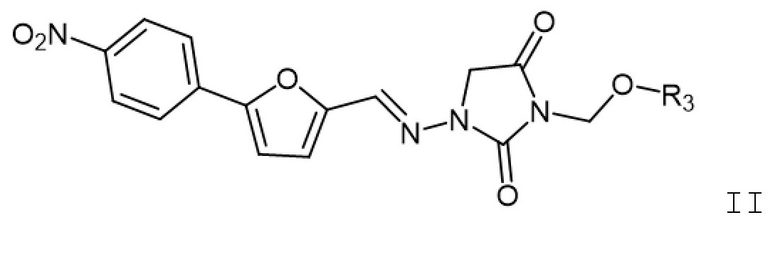
где R представляет собой -Р (О) (ОН)2 или -Р (О) (OR1) (OR2);
R1 представляет собой Н или -C1-26алкил; и
R2 представляет собой -C1-26алкил;
R3 представляет собой Н, -С(О)-Z-N(R4)(R5), -С(О)Z-C(О)-ОН или -С(О)-NH-Y-CH2-OC(О)-Z-C(О)-ОН; Z представляет собой С1-6алк; Y представляет собой арилен; R4 представляет собой Н или C1-6алкил; R5 представляет собой Н или C1-6алкил; или R4 и R5 вместе с азотом, к которому они присоединены, образуют гетероциклоалкил;
или их фармацевтически приемлемая соль.
2. Способ по п. 1, где R представляет собой -Р(О)(ОН)2-.
3. Способ по п. 1, где R представляет собой Р(О)(OR1) (OR2).
4. Способ по п. 3, где R1 представляет собой Н.
5. Способ по п. 3, где R1 представляет собой -C1-26алкил.
6. Способ по любому из предшествующих пунктов, где соединение формулы I и/или соединение формулы II находится в форме фармацевтически приемлемой соли.
7. Способ по любому из предшествующих пунктов, где индивидууму вводят фармацевтическую композицию, содержащую соединение формулы I или его фармацевтически приемлемую соль.
8. Способ по любому из предшествующих пунктов, где индивидууму вводят фармацевтическую композицию, содержащую соединение формулы II или его фармацевтически приемлемую соль.
9. Способ по любому из предшествующих пунктов, где индивидуум подвергнут или будет подвергнут дозе радиации от 0,3 Гр до 50 Гр.
10. Способ по любому из предшествующих пунктов, где индивидуум подвергнут или будет подвергнут дозе радиации по меньшей мере 0,7 Гр.
11. Способ по любому из предшествующих пунктов, где индивидуум подвергнут или будет подвергнут дозе радиации по меньшей мере 6 Гр, по меньшей мере 10 Гр или по меньшей мере 50 Гр.
12. Способ по любому из предшествующих пунктов, где радиация представляет собой рентгеновское излучение, гамма-излучение, нейтронное излучение или их комбинацию.
13. Способ по любому из предшествующих пунктов, где радиационное воздействие представляет собой воздействие химиорадиации.
14. Способ по любому из пп. 1-12, где радиационное воздействие представляет собой воздействие утечки с атомной электростанции.
15. Способ по любому из пп. 1-12, где радиационное воздействие представляет собой воздействие ядерного оружия.
16. Способ по любому из предшествующих пунктов, где фармацевтическую композицию вводят индивидууму через 24 часа или менее после радиационного воздействия на индивидуума.
17. Способ по любому из предшествующих пунктов, где индивидуумом является млекопитающее.
18. Способ по любому из предшествующих пунктов, где индивидуумом является человек.
19. Способ по любому из предшествующих пунктов, где фармацевтическую композицию вводят индивидууму до воздействия на индивидуума радиационного излучения.
20. Способ по любому из предшествующих пунктов, где фармацевтическую композицию вводят внутривенно, подкожно, внутримышечно, внутрикостным путем или трансдермальным путем.
21. Способ по любому из предшествующих пунктов, где фармацевтическая композиция содержит соединение формулы I, соединение формулы II или его фармацевтически приемлемую соль, маннит, полисорбат, повидон, необязательное средство для коррекции рН и воду.
| MEHMET EMIN et al | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| DANIELA HARTMANN JORNADA et al | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| US 2015231093 A1, 20.08.2015 | |||
| Медицина неотложных | |||
Авторы
Даты
2024-01-25—Публикация
2019-11-27—Подача