Область техники, к которой относится изобретение
Изобретение относится к биотехнологии, а именно к набору векторов экспрессии для получения белков в клетках млекопитающих. Группа изобретений представлена набором векторов экспрессии на основе вирусной частицы аденоассоциированного вируса (AAV), который может найти свое применение в медицине, в частности для терапии врожденной дисфункции коры надпочечников.
Уровень техники
Врожденная дисфункция коры надпочечников (ВДКН; врожденная гиперплазия надпочечников) - это группа заболеваний, связанных с дефицитом кортизола и/или альдостерона (стероидных гормонов). Дефицит вызван генетическими мутациями в ферменте, участвующем в образовании кортизола и альдостерона из холестерина. Фермент может полностью отсутствовать или производиться в недостаточном количестве. Самые известные формы врожденной гиперплазии коры надпочечников - дефицит фермента 21-гидроксилазы и дефицит 11-бета-гидроксилазы. Дефицит 21-гидроксилазы (CYP21A2) может вызывать снижение уровня кортизола/альдостерона и повышать концентрацию андрогенов. Избыток андрогенов приводит к изменению наружных половых органов по мужскому типу у новорожденных девочек (т.н. вирилизация). Мальчики с данным генетическим дефектом при рождении не показывают характерной клинической симптоматики, но подвержены раннему половому созреванию из-за избытка андрогенов. У людей с таким генетическим дефектом могут рано появиться волосы на лице и теле, акне, а также наблюдаться нарушения менструального цикла. Патология также может привести к бесплодию. Дефицит фермента 21-гидроксилазы возникает из-за мутаций в гене CYP21A2. Больные могут иметь классический (более тяжелый) и неклассический вариант заболевания.
Классический дефицит может быть:
1. Сольтеряющим - тяжелая форма болезни, которая обусловлена чрезвычайно низкой активностью фермента, что вызывает дефицит кортизола и альдостерона. Дефицит альдостерона приводит к патологическому снижению натрия (гипонатриемия) и повышению калия (гиперкалиемия) в организме. При отсутствии лечения может привести к острой надпочечниковой недостаточности и шоку.
2. Простым - активность фермента снижена, но при этом остается достаточной для того, чтобы поддерживать синтез альдостерона на нормальном или немного пониженном уровне.
Неклассический вариант патологии - наиболее распространенный вариант, который вызывает менее тяжелую форму заболевания. Встречается примерно у одного из полутора тысяч новорожденных в европеоидной популяции.
При этом варианте развития патологии активность фермента составляет примерно 50%, что позволяет избежать критического дефицита натрия и тяжелых последствий. Концентрация андрогенов повышена незначительно.
Лечение ВДКН согласно Федеральным клиническим рекомендациям [Федеральные клинические рекомендации - протоколы по ведению пациентов с врожденной дисфункцией коры надпочечников в детском возрасте, Проблемы эндокринологии, 2014;60(2): 42 50] осуществляется консервативными методами.
Так препаратом выбора для лечения детей с ВДКН является таблетированный гидрокортизон (1+++). Применение сиропа гидрокортизона и пролонгированных форм глюкокортикоидов у детей в период активного роста не показано (1++). Всем детям с сольтеряющей формой ВДКН показано назначение флудрокортизона, детям грудного возраста - дополнительное введение в пищевой рацион поваренной соли (1++).
Основным принципом терапии всех форм ВДКН является назначение глюкокортикоидов, которые позволяют заместить дефицит кортизола и тем самым подавить избыточную секрецию адренокортикотропного гормона (АКТГ). В результате снижается продукция надпочечниками тех стероидов, которые синтезируются в избытке при конкретном ферментативном блоке.
Существуют различные медикаментозные препараты, обладающие глюкокортикоидной активностью: преднизолон, кортизон, дексаметазон. Пролонгированные синтетические глюкортикоидные препараты (преднизолон, дексаметазон) негативно влияют на рост. Для детей с открытыми зонами роста, особенно младшего возраста, наиболее оптимальными препаратами следует считать таблетированные аналоги гидрокортизона. Первоначальная суточная доза гидрокортизона, необходимая для подавления секреции АКТГ у детей 1-го года жизни, может достигать 20 мг/м2. В среднем суточная доза гидрокортизона у детей старше 1 года должна составлять 10-15 мг/м2. Препарат дается 3 раза в день в равных дозах (в 7.00, 15.00 и 22.00).
При сольтеряющей форме ВДКН необходима терапия препаратом минералокортикоидов - флудрокортизоном, который назначается в дозе 0,05-0,15 мг в сутки (1-2 раза в день). У детей грудного возраста потребность в минералокортикоидах выше и может достигать 0,3 мг в сутки; дозу можно разделить на 3 приема. У детей без клинических проявлений сольтеряющего синдрома может отмечаться субклинический дефицит минералокортикоидов, критерием которого является повышенный уровень ренина. В таких случаях также показана терапия флудрокортизоном.
Альтернативой консервативному лечению может стать генетическая терапия.
Аденоассоциированный вирус (AAV) является перспективным для использования в генной терапии человека. AAV обладает способностью эффективно инфицировать как делящиеся, так и неделящиеся клетки человека, при этом геном AAV интегрирует в единичный сайт хромосомы в геном клетки-хозяина. При этом наличие AAV в организме человека не связывают с каким-либо заболеванием.
Известны AAV векторы для генетической терапии, решающие задачу создания средств и способов, при которых возможно получение стабильного и высокого крупномасштабного выхода векторов AAV в клетках насекомых [RU2457252 С2, 27.07.2012]. Таким образом, известные векторы являются универсальными, то есть подходящими для использования их вне зависимости от конкретного заболевания. Однако конкретные задачи зачастую требуют конкретных решений, поэтому под каждую задачу приходится создавать свою оптимальную конструкцию.
Из уровня техники известен AAV вектор, содержащий гРНК и Cas9, где молекула Cas9 представляет собой активную или неактивную Cas9 S. pyogenes. Вектор используется для противоопухолевой терапии, в том числе надпочечников [RU2019133280 A, 22.04.2021]. Однако данное решение не предназначено для терапии врожденной дисфункции коры надпочечников. Также известен AAV вектор, содержащий Cas9, NLS, HA [KR1020150056539 А, 26.05.2015].
Кроме того, известен вектор AAV, содержащий Cas9, SV40 NLS, HA [US20210054405 А, 25.02.2021] и AAV вектор, в том числе серотипа 2, содержащий гидовую РНК, ITR, предназначенный для терапии надпочечников [WO2020082047 А1, 23.04.2020]. Однако ни один из этих векторов не решает задачу терапии врожденной дисфункции коры надпочечников.
Известно применение векторов для нацеливания на ген CYP21A2 в геноме человека, содержащих гидовую РНК и Streptococcus pyogenes Cas9. NLS, фактор элонгации эукариот EF1 альфа [Neville E. Sanjana, Ophir Shalem and Feng Zhang, Improved vectors and genome-wide libraries for CRISPR screening, Nat Methods. 2014 Aug; 11(8): 783-784]. Данное решение является наиболее близким к заявляемому решению. Однако данное решение касается лентивирусного вектора, что не подходит для лечения врожденной дисфункции коры надпочечников.
Техническая проблема, решаемая заявляемой группой изобретений, заключается в создании набора векторов, содержащих оптимизированные последовательности, включая Cas9 S. pyogenes, обеспечивающих высокий уровень экспрессии трансгена для терапии врожденной дисфункции коры надпочечников.
Раскрытие сущности изобретения
При реализации заявленной группы изобретений достигаются следующие технические результаты:
1. достаточно легкое производство;
2. степень неспецифического разрезания 0,01%;
3. широкий тропизм к разным тканям;
4. высокий уровень экспрессии трансгена: количество вирусных геномов на клетку - от 1 до 100, экспрессия - от 10-4 до 10-1 относительно контрольного гена GAPDH.
Данные технические результаты достигаются за счёт следующего.
Изобретение представляет собой набор векторов, где один из векторов экспрессии представляет собой вектор pAAV-nEFCas9.
Данный вектор представляет собой вирусные частицы аденоассоциированных вирусов, белки капсида природных серотипов (1, 2, 3, 4, 5, 7, 8, 9hu14, rh10 и других) или серотипов, полученных методами синтетической биологии (DJ/8, DJ, anc32 и другие).
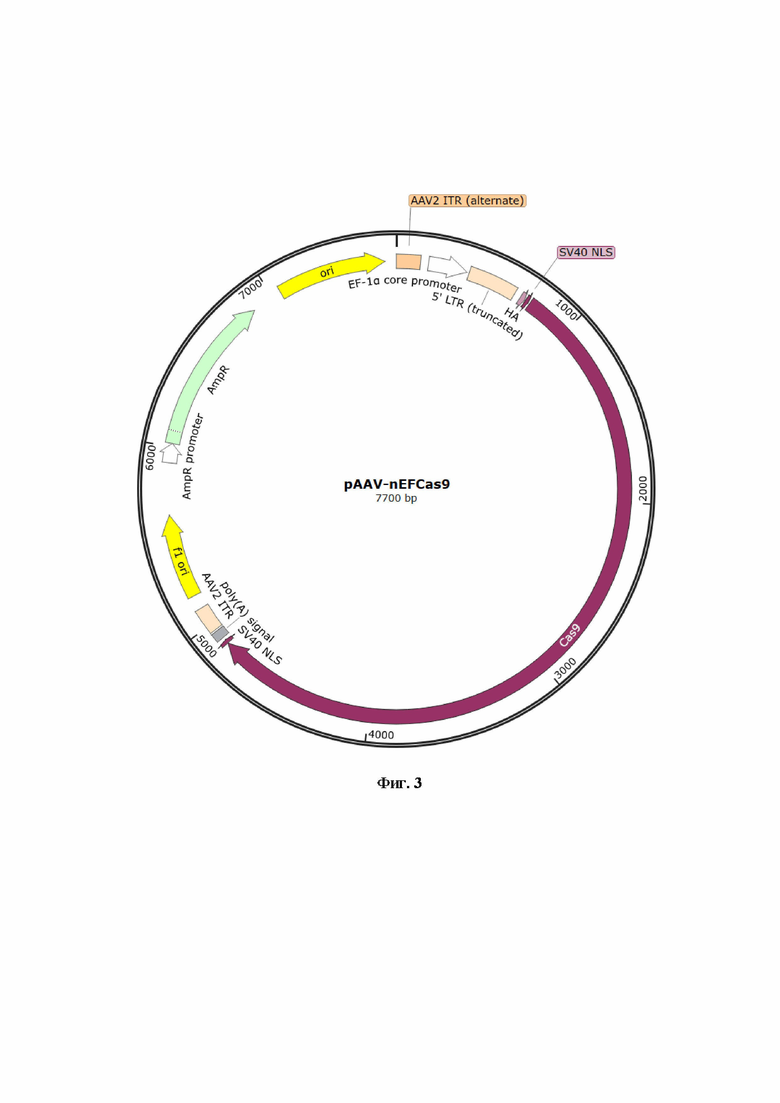
В качестве генома в частицы упакована одноцепочечная молекула ДНК, на концах которой расположены ITR (internal terminal repeats) вируса AAV, в предпочтительном варианте серотипа 2. Данные ITRs AAV хорошо изучены, их использование даёт стабильный ожидаемый эффект. Однако возможно использование других ITRs AAV, поскольку в уровне техники отсутствуют сведения, указывающие на то, что ITRs из других серотипов AAV при использовании будут давать некорректный результат. Внутри ITRs AAV последовательно расположены промотор первого фактора элонгации эукариот EF1 альфа. Выбор именно этого промотора является результатом серии экспериментов, в которых было показано, что он дает высокий уровень экспрессии трансгена в конструкции вектора по настоящему изобретению. При этом он является эукариотическим, а не вирусным, следовательно, не будет метилироваться и ингибироваться, что также является дополнительным преимуществом настоящего изобретения. Кроме того, промотор является конститутивным, т.е. он будет работать во всех типах клеток. После упомянутого промотора расположена последовательность гистидиновой метки (HA (human influenza hemagglutinin) epitopetag), которая служит для легкой идентификации трансгена методами вестерн-блота, цитометрии и иммуногистохимии. После метки следует сигнал внутриклеточной локализации в ядре 5’-SV40 NLS. Преимуществом данного ядерного сигнала является небольшой размер и, высокая степень трансфера белка в ядро. Далее идет кодон-оптимизированная последовательность гена Cas9 Streptococcus pyogenes. Эффектор Cas9 обладает сравнительно небольшим размером, способен вносить двуцепочечный разрыв в целевой локус в геноме. Система геномного редактирования на базе CRISPR/Cas9 проста в использовании и дизайне, степень неспецифического разрезания составляет 0,01% с необходимостью подбора такого специфичного РНК гида, который легко синтезировать. Это является основной задачей, от решения которой зависит достижение указанной специфичности. Был разработан оптимальный РНК гид, который позволяет максимально использовать все преимущества системы геномного редактирования на базе CRISPR/Cas9. Неверно подобранный РНК гид приведёт к снижению эффектов от использованиятакой системы. Для более эффективного бактериального синтеза этого белка в клетках человека проведена кодон-оптимизация (последовательность SEQ ID NO: 5), что также позволило получить указанные выше эффекты. Однако возможны и другие варианты кодон-оптимизации, поэтому использованный в данной разработке вариант является демонстративным, показывает принципиальную возможность достижения эффектов по изобретению при оптимизации данной последовательности. После кодон-оптимизированной последовательности расположен еще один сигнал внутриклеточной локализации в ядре 3’-SV40 NLS. В качестве терминатора транскрипции использован синтетический полиА сигнал.
Второй вектор экспрессии представляет собой вектор AAV-hCYP21A2.
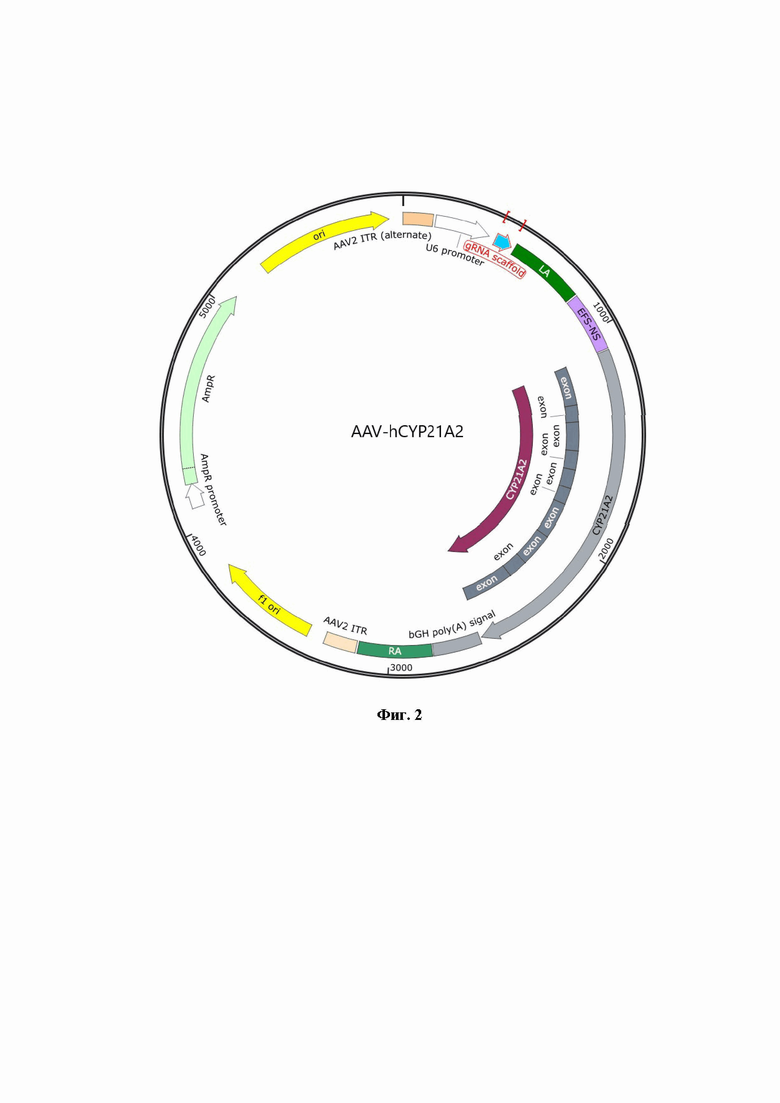
В качестве генома в частицы упакована одноцепочечная молекула ДНК, на концах которой расположены ITR (internal terminal repeats) AAV, в предпочтительном варианте серотипа 2. Данные ITRs AVV хорошо изучены, их использование даёт стабильный ожидаемый эффект. Однако возможно использование других ITRs AAV, поскольку в уровне техники отсутствуют сведения, указывающие на то, что ITRs из других серотипов AAV при использовании будут давать некорректный результат. Внутри вектора последовательно расположен эукариотический промотор полимеразы III - U6. Данный промотор U6 продемонстрировал высокий уровень транскрипции трансгена в конструкции вектора по изобретению. Он является эукариотическим, а не вирусным, значит, не будет ингибироваться в клетке человека, при этом обладает сравнительно не большим размером, что позволяет упаковать кассету транскрипции РНК-гида в геном AAV. После промотора U6 расположена последовательность РНК-гида в формате crRNA. Это уникальная последовательность в 20 нуклеотидов, комплементарная таргетируемому локусу, сшитая с последовательностью trackRNA (скаффолд). Следом за кассетой экспрессии РНК гида расположена область гомологии с локусом человеческого генома AAVS1 (левое гомологичное плечо). Данный локус был выбран, так как во многих экспериментах показано отсутствие влияния интеграции в него на работу остального генома, что обеспечивает безопасную интеграцию. При этом трансген, интегрированный в этот локус, эффективно транскрибируется в любом типе клеток. Кассета экспрессии траснгена: промотор EFS-NS, именно этот промотор показывает высокий уровень экспрессии трансгена, является эукариотическим, а не вирусным, следовательно, не будет метилироваться и ингибироваться, также это конститутивный промотор, т.е. работает во всех типах клеток, под контролем которого расположена белок-кодирующая кодон-оптимизированная последовательность гена hCYP21A2. При этом кодон-оптимизация позволила увеличить эффективность трансляции гена, оптимизация проведена относительно соответствующей референсной последовательности NG_007941.3. В качестве терминатора транскрипции использован полиА сигнал гена β-глобина человека (human β-globin polyadenylation signal). Следом за полиА сигналом расположена область гомологии с локусом человеческого генома AAVS1 (правое гомологичное плечо).
Набор дополнительно может содержать буфер и/или физиологический раствор. Не ограничивающими примерами буферов, которые могут быть использованы в настоящем решении, являются: фосфатный, фосфатно-цитратный, трис-буфер, карбонатный, бикарбонатный, боратный, ацетатный, глицериновый, фосфатно-глицериновый, трис-глицериновый, цитратный буфер.
Краткое описание чертежей
Изобретение поясняется следующим иллюстративным материалом.
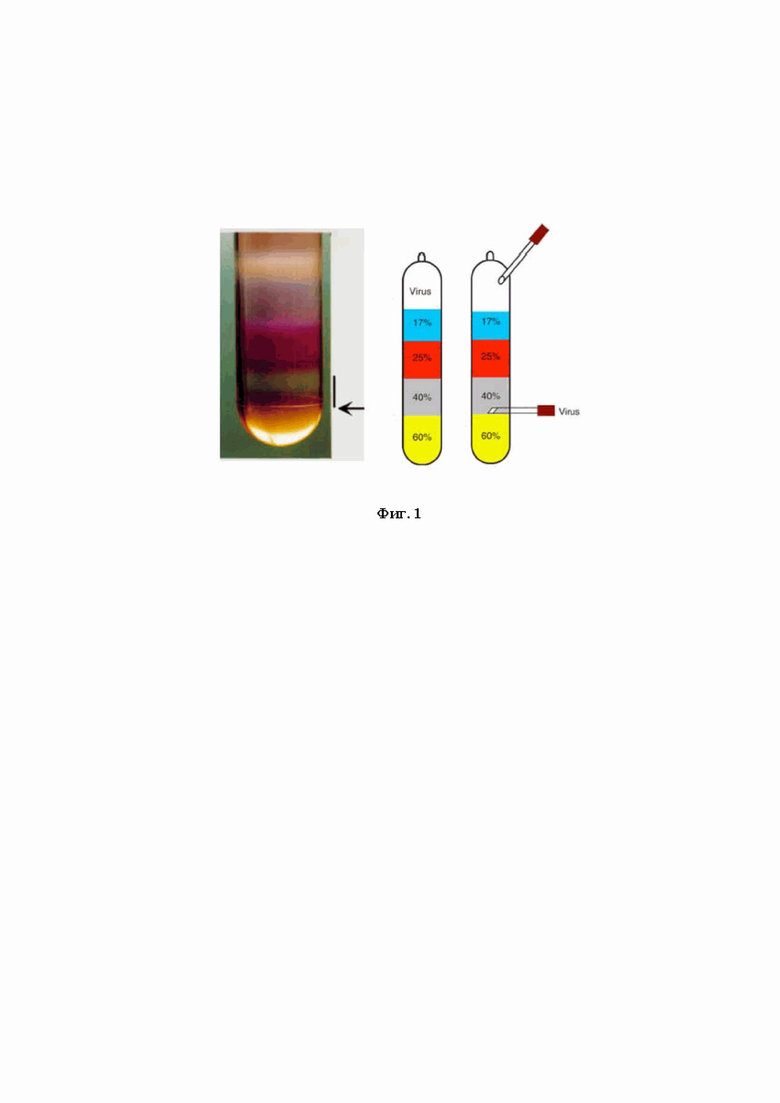
Фиг. 1 - схема расположения слоев растворов йодиксанола в центрифужном стакане. 40% фракции отбирают после центрифугирования пробирок QuickSeal, при этом сначала протыкают отдельной иглой самый верх пробирки для доступа воздуха, а необходимую фракцию отбирают другой иглой со шприцем, при этом отверстие иглы направлено вверх, а острие иглы расположено горизонтально примерно на 2 мм ниже 40-60% интерфазы. Таким образом аспирировали 40% градиента, не задевая интерфазу 25% слоя.
Фиг. 2 - карта AAV-hCYP21A2.
Фиг. 3 - карта pAAV-nEFCas9.
Осуществление изобретения
Изобретение представляет собой набор векторов экспрессии на основе аденоассоциированных вирусов, белки капсида природных серотипов (1, 2, 3, 4, 5, 7, 8, 9hu14, rh10 и других) или серотипов, полученных методами синтетической биологии (DJ/8, DJ, anc32 и другие). В качестве генома в частицы упакована одноцепочечная молекула ДНК, на концах которой расположены ITR (internal terminal repeats) вируса серотипа 2, внутри последовательно расположены промотор первого фактора элонгации эукариот EF1 альфа, после расположена последовательность гистидиновой метки (HA (humanin fluenza hemagglutinin) epitopetag), после которой следует сигнал внутриклеточной локализации в ядре 5’-SV40 NLS, далее кодон-оптимизированная последовательность гена Cas9 Streptococcuspyogenes. Затем расположен еще один сигнал внутриклеточной локализации в ядре 3’-SV40 NLS. В качестве терминатора транскрипции использован синтетический полиА сигнал. Примером осуществления изобретения может служить SEQ ID NO:1.
Второй вектор, входящий в набор представляет собой вектор экспрессии на основе аденоассоциированных вирусов, белки капсидаприродных серотипов (1, 2, 3, 4, 5, 7, 8, 9hu14, rh10 и других) или серотипов, полученных методами синтетической биологии (DJ/8, DJ, anc32 и другие).
В качестве генома в частицы упакована одноцепочечная молекула ДНК, на концах которой расположены ITR (internal terminal repeats) вируса серотипа 2, внутри последовательно расположены эукариотический промотор полимеразы III - U6, после которого расположена последовательность РНК -гида в формате crRNA (уникальная последовательность в 20 нуклеотидов, комплементарная таргетируемому локусу, сшитая с последовательностью trackRNA (скаффолд)). Следом за кассетой экспрессии РНК гида расположена область гомологии с локусом человеческого генома AAVS1 (левое гомологичное плечо) кассета экспрессии траснгена: промотор EFS-NS, под которым расположена белок-кодирующая последовательность гена hCYP21A2, соответствующая референсной последовательности NG_007941.3. В качестве терминатора транскрипции использован полиА сигнал гена β-глобина человека (human β-globin polyadenylation signal). Следом за полиА сигналом расположена область гомологии с локусом человеческого генома AAVS1 (правое гомологичное плечо). Примером реализации является SEQ ID NO: 2.
SEQ ID NO: 3 представляет собой последовательность гена CYP21A2 дикого типа NG_007941.3.
SEQ ID NO: 4 представляет собой вариант оптимизированной последовательности SEQIDNO: 3.
SEQ ID NO: 5 представляет собой кодон оптимизированную последовательность гена Cas9 Streptococcus pyogenes.
Ниже представлено более подробное описание заявляемого изобретения. Настоящее изобретение может подвергаться различным изменениям и модификациям, понятным специалисту на основе прочтения данного описания. Такие изменения не ограничивают объем притязаний.
Для получения вирусных частиц использовали плазмидные конструкции, несущие нуклеотидные последовательности геномов векторов, а также последовательности репликации и селекции этих плазмид в бактериальных системах. Получение указанных плазмид осуществляли методами молекулярного клонирования и синтеза генов.
Также использовали плазмиды, несущие гены капсида вирусных части AAV и хелперные гены.
Вирусные вектора собирали в системе адгезионных или суспензионных клеток/специализированных клеточных линий, основанных на клетках HEK293.
ПРИМЕР 1
Выделение и очистка плазмид
Разморозили клетки E.coli, которые хранили при температуре -80°С. Разморозку осуществили на твердую среду. Для этого в 400 мкл жидкой среды LB внесли замороженные клетки (на кончике наконечника), ресуспендировали и перенесли на твердую среду LB содержащую карбенициллин в концентрации 100 мг/л.
Для получения суспензионной культуры в колбу на 250 мл добавили 100 мл среды LB. Внесли 1 колонию на кончике наконечника, E. coli инкубировали 16-20 часов при 37°C в термостатируемом шейкере при постоянном перемешивании 170 об/мин.
Далее выделили плазмидную ДНК набором Plasmid Midiprep 2.0 (Евроген) согласно протоколу производителя. Количество колонок брали из расчета 1 колонка на 1 г клеточного осадка (емкость колонки 500 мкг ДНК). С одной колонки элюировали двукратно в 4 мл воды.
После выделения измеряли концентрацию плазмид и проводили рестрикционный анализ, используя рестриктазы согласно таблице 1.
Для каждого образца были поставлены следующие реакции: рестрикция с каждой из указанных в таблице 1 рестриктаз по отдельности, для всех рестриктаз в одной пробирке, К-реакция без рестриктаз.
Приготовили смесь:
10XBuf - 2,5 мкл;
рестриктазы - по 0,5 мкл;
плазмидная ДНК - 600 нг;
вода до 25 мкл.
Инкубировали 1 час при 37° С, визуализировали в 1% агарозном геле.
Количество вирусных геномов на клетку - от 1 до 100.
Экспрессия - от 10-4 до 10-1 относительно контрольного гена GAPDH.
ПРИМЕР 2
Подготовка клеточной культурой НЕК293
Все объемы сред, растворов и проч. даны из расчета на одну 15 см культуральную чашку.
Приготовили среды для наращивания клеточной массы (GM) и трансфекции (ТМ). Для приготовления GM к 450 мл среды DMEM с содержанием глюкозы 4,5 г/л добавили 50 мл FBS (Gibco), 5 ml x100 GlutaMax (Gibco) и 500 мкл антибиотика х1000 Гентамицин (ПанЭко). Для приготовления ТМ к 490 мл среды DMEM с содержанием глюкозы 4,5 г/л добавили 10 мл FBS (Gibco), 5 ml x 100 GlutaMax (Gibco) и 500 мкл антибиотика х 1000 Гентамицин (ПанЭко).
Разаликвотили растворы Версена и Трипсина 0,25% по 50 мл. Аликвоту раствора Версена хранили при комнатной температуре, аликвоты раствора Трипсина 0,25% хранили при -20°С. Перед началом работы с клетками раствор трипсина перенесли на комнатную температуру, среду GM/TM перенесли в водяную баню на температуру +37°С.
Осуществили пассаж клеточной линии. Пассаж клеточной линии не должен превышал 12.
Разморозили клеточную культуры HEK293.
Перед разморозкой криовиалы прогрели 25 мл GM на водяной бане при температуре +37°С.
Криовиалу поместили в водяную баню при температуре +37°С до полного оттаивания. Сразу после оттаивания все содержимое криовиалы перенесли в пробирку на 15 мл, добавили 10 мл прогретой GM. Центрифугировали при 230 g в течение 3 минут. Сбросили супернатант, клеточный осадок ресуспендировали в 1 мл GM, перенесли на клеточный фласк Т75, добавили 14 мл GM. Инкубировали фласк в СО2 инкубаторе, 5% СО2, +37°С до достижения 70% конфлюентности клеток.
Заморозили клеточную культуру HEK293. Перед заморозкой клеточного банка провели тест на отсутствие микоплазмы в клетках по протоколу MycoReport (Евроген).
Отобрали всю среду с чашки, добавили 5 мл раствора Версена, инкубировали 1 минуту в ламинарном боксе. Отобрали раствор Версена, добавили 3 мл раствора Трипсина 0,25%, инкубировали 3 мин в ламинарном боксе. Добавили 3 мл GM, аккуратно и тщательно ресуспендировали клетки, отобрали 10 мкл клеточной суспензии в пробирку 0,2 мл. Остальные клетки перенесли в пробирку на 15 мл.
Подсчитали количество клеток и определили их жизнеспособность на автоматическом счетчике клеток TC-20 (BioRad): к 10 мкл хорошо перемешанной клеточной суспензии добавили 10 мкл 0,4% раствора трипанового синего, перемешали; 10 мкл полученной суспензии нанесли на слайд для подсчёта клеток, провели измерение.
Клетки в пробирке 15 мл центрифугировали при 230 g в течение 3 мин.
Подсчитали необходимое количество криовиал так, чтобы в одной криовиале находилось 5 млн клеток в 1 мл раствора для заморозки. Подписали каждую криовиалу: название линии, количество клеток, дата, оператор.
Приготовили раствор для заморозки: на одну криовиалу необходимо 700 мкл FBS (Gibco), 200 мкл Дмем с содержанием глюкозы 4,5 г/л (ПанЭко), 100 мкл ДМСО (ПанЭко).
Ресуспендировали клеточный осадок из пробирки 15 мл центрифугированной при 230 g в течение 3 мин в среде для заморозки, разаликвотили по 1 мл в криовиалу. Криовиалы инкубировали 1 сутки в кельвинаторе при -80°С, далее переносили в жидкий азот при -196°С.
Осуществили пассирование клеточной культуры HEK293. Отобрали всю среду, добавили 5 мл раствора Версена в чашку. Инкубировали 1 мин в ламинарном боксе, отобрали раствор Версена. Затем добавили Трипсин 0,25% 3 мл на чашку, инкубировали 3 минуты в ламинарном боксе, добавили равный объем среды GM, аккуратно ресуспендировали клетки, перенесли в фалькон на 15 мл.
Подсчитали количество клеток и определили их жизнеспособность на автоматическом счетчике клеток TC-20 (BioRad): к 10 мкл хорошо перемешанной клеточной суспензии добавили 10 мкл 0,4% растворатрипанового синего, перемешали; 10 мкл полученной суспензии нанесли на слайд для подсчёта клеток, провели измерение.
6 млн клеток перенесли на новую чашку, добавили 24 мл GM, инкубировали +37°С, 5% СО2 до следующего пассажа.
ПРИМЕР 3
Трансфекция клеточной культуры HEK293
Трансфецирующую смесь составили из лактатного буфера, линейного полиэтилен амина и плазмидной ДНК.
Приготовление лактатного буфера рН 4 (20 мМ натрия лактата, 150 мМ натрия хлорида).
Для приготовления 300 мл лактатного буфера к 290 мл 150 мМ натрия хлорида добавили 1,35 мл 40 % молочной кислоты. Используя 1N раствор гидроксида натрия довели до рН 4. Полученный раствор довели до 300 мл 150 мМ хлоридом натрия. Стерилизовали через 0,2 мкм фильтр, хранили при температуре 4°С.
Приготовление раствора полиэтиленимина (l-PEI 25) 5 мг/мл.
Навеску 1 г сухого линейного полиэтиленимина (25 кДа) растворили в 190 мл 0,2N раствора соляной кислоты при длительном перемешивании. Довели объем соляной кислотой до 200 мл. Конечный раствор имел рН 1-2. Аликвоты раствора хранили при температуре минус 80°С.
Подсчет необходимого количества плазмид и полиэтиленамина (PEI) для трансфекции.
Для трансфекции 1 чашки 15 см использовали 38 мкг плазмидной ДНК, при соотношении количества копий плазмид хелперная:упаковочная:трансферная = 1:1:1.
За сутки до трансфекции клетки пересеяли на новые чашки по 10 млн клеток на чашку. Добавили 24 мл среды GM, инкубировали +37°С, 5% СО2.
Трансфекция клеточной культуры HEK293: приготовили смеси ДНК и PEI согласно таблице 2.
Схема приготовления трансфицирующей смеси из расчета 40 чашек
0,53 мг плазмиды, несущей ген-эквивалент
нуклеокапсида
0,53 мг хелперной плазмиды
Добавили 80 мл смеси DNA-l-PEI 25 в 1 л среды ТМ и перемешали. Отобрали всю среду GM с чашек. Добавили по 27 мл смеси ТМ-ДНК-PEI на чашку. Аккуратно размешали. Инкубировали чашки в инкубаторе +37°С, 5% СО2, 72 часа.
Эффективность трансфекции составляла 95-98%.
Лизис клеток.
Приготовили лизирующий буфер, содержащий: 150 mM NaCl, 50 mM Tris-HCl, 1 mM MgCl2, pH 8,5, 0,5% Triton X-100, бензоназа 50 U/ml. Стерилизовали фильтрацией, а не автоклавированием. Хранили при +4°С.
Отобрали всю среду с чашки в серологическую пипетку 25 мл, ею смыли все клетки с чашки. Клеточную суспензию перенесли в пробирку на 50 мл, итерацию повторили со всеми чашками. Пробирку с клеточной суспензией центрифугировали при 400 g в течение 5 мин, супернатант отобрали по мере надобности, хранили при -80°С. Весь клеточный осадок с 40 чашек ресуспендировали в 60 мл лизирующего буфера. Инкубировали при +37°С в течение 1 часа.
Центрифугировали при 4000 g в течение 15 минут, осветленный супернатант переместили в чистую пробирку.
ПРИМЕР 4
Выделение и очистка ААВ
Приготовили буферы 1M NaCl/PBS-MK buffer и 1x PBS-MK buffer.
Для приготовления 1M NaCl/PBS-MK buffer растворили 5.84 г NaCl, 26.3 мг MgCl2 (56,0 мг 6 H2О X MgCl2) и 14.91 мг KCl в 1×PBS до конечного объема 100 мл. Фильтровали через 0,22 мкм, хранили на +4°С.
Для приготовления 1x PBS-MK buffer растворили 26.3 мг MgCl2 (56,0 мг 6 H2О X MgCl2) и 14.91 мг KCl в 1×PBS до конечного объема 100 мл. Профильтровали через 0,22 мкм, хранили на +4°С.
Для каждого ультрацентрифугирования использовали только растворы йодиксанола приготовленные в соответствии с таблицей 3.
Расчет для приготовления растворов йодаксанола на 2 пробирки Quick-Seal (39 ml)
Ультрацентрифугирование.
Добавили в центрифужный стакан слои растворов йодиксанола в порядке согласно таблице 4 с использованием шприца 10 мл и иглы Зельдигера.
QuickSeal
Градиент наносили с верхних слоев, чтобы не нарушать целостность градиента.
При заполнении пробирки QuickSeal, пробирку доверху заполнили клеточным лизатом, без пузырей сверху. Пробирки уравновесили PBS до 0,0005 гр на аналитических весах. Центрифугировали при 360 000 g (59 000 rpm для ротора Ti 70 Beckman Coulter) в течение 1 ч 30 мин, +10°С.
После центрифугирования пробирок QuickSeal сначала проткнули отдельной иглой самый верх пробирки для доступа воздуха, затем другой иглой со шприцем отобрали фракцию 40%, как показано на фиг. 1. Отверстие иглы смотрит вверх, острие иглы расположено горизонтально примерно на 2 мм ниже 40-60% интерфазы. Аспирировали 40% градиента, не задевая интерфазу 25% слоя.
Перенесли отобранную фракцию в фалькон на 50 мл.
Ультрафильтрация.
Разбавили отобранную после ультрацентрифугирования фракцию 40% йодиксанола в 5 раз раствором PBS/Pluronic F68 (0,001%), профильтровали через фильтр с размером пор 0,22 мкм. В фильтр Amicon Ultra-15 добавили 3 мл H2O, центрифугировали при 2000 g в течение 1 мин, затем удалили полностью всю жидкость из пробирки и из фильтра. Добавили в фильтр 3 мл раствора PBS/Pluronic F68 (0,001%) центрифугировали при 2000 g в течение 1 мин, удалили полностью всю жидкость из пробирки и из фильтра. Добавили 15 мл разбавленного вируса в фильтр Amicon Ultra-15, центрифугировали при 2500 g в течение 10 минут в бакетном роторе. Отбросили прошедшую через колонку жидкость и заполнили пробирку Amicon Ultra-15 до использования всего раствора вектора. Далее раствором вируса хорошо омыли мембрану пипеткой 100-1000 мкл. Центрифугировали при 2500 g в течение 10 минут.
После центрифугирования суспензию вектора осталась в верхней части концентратора (объем 500 мкл), повторили центрифугирование в течение 3 минут.
После прохождения всего раствора вирусных частиц промыли концентрированный вирус PBS/Pluronic F68 (0,001%) комнатной температуры 2 раза. В фильтр-кассете должно осталось около 500 мкл вирусной суспензии.
Хорошо омыли мембраны, после чего вирус разаликвотили по 20 мкл в 0,2 мл пробирки, оставили 5 мкл для определения титра.
AAV-CYP21 - 7.80E+12 вирусных частиц в 1 мл. AAV-Cas9 - 1.93E+12 вирусных частиц в 1 мл.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="3.xml"
softwareName="WIPO Sequence" softwareVersion="2.2.0"
productionDate="2023-05-05">
<ApplicantFileReference>3</ApplicantFileReference>
<ApplicantName languageCode="ru">Общество с ограниченной
ответственностью «Генетические технологии»</ApplicantName>
<ApplicantNameLatin>Limited Liability Company Genetic
Technologies</ApplicantNameLatin>
<InventorName languageCode="ru">Глазова Ольга
Владимировна</InventorName>
<InventorNameLatin>Glazova Olga Vladimirovna</InventorNameLatin>
<InventionTitle languageCode="ru">Набор векторов экспрессии на
основе аденоассоциированного вируса</InventionTitle>
<SequenceTotalQuantity>5</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>4774</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..4774</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q1">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>cctgcaggcagctgcgcgctcgctcgctcactgaggccgcccgggcgtc
gggcgacctttggtcgcccggcctcagtgagcgagcgagcgcgcagagagggagtggccaactccatcac
taggggttcctgcggcctctagaaaggatctgcgatcgctccggtgcccgtcagtgggcagagcgcacat
cgcccacagtccccgagaagttggggggaggggtcggcaattgaacgggtgcctagagaaggtggcgcgg
ggtaaactgggaaagtgatgtcgtgtactggctccgcctttttcccgagggtgggggagaaccgtatata
agtgcagtagtcgccgtgaacgttctttttcgcaacgggtttgccgccagaacacagctgaagcttcgaa
tgtcgccgaagaaaaagcgcaaggtcgaagcgtccgacaaaaaatactccatcggtctggacattggtac
taactctgtaggctgggccgttatcacggacgagtacaaagtacctagcaaaaagttcaaagtattgggg
aatactgacaggcattccataaagaagaatctcataggagcattgctgtttgattccggagagacagcag
aagctactcgactcaagagaaccgcacgacgccgatatacacgccgaaaaaaccgaatctgctacctgca
ggagatcttctccaatgaaatggctaaggtagacgacagcttctttcatcgacttgaagaatcttttctt
gttgaggaggataagaagcacgaacggcaccctattttcggcaatatcgtggatgaggtcgcgtatcatg
aaaagtatcccaccatctaccacttgcgaaagaagctggtagatagtaccgacaaggcggatttgagact
catataccttgcactggcccacatgataaaattcagagggcacttcctcatcgaaggtgatcttaatcca
gacaacagtgacgtcgataagttgttcattcagctcgtgcagacttacaatcaactgtttgaagaaaatc
ccataaatgcgtcaggcgtagatgcaaaggctatactctccgcgcgattgtcaaaatcccgacggcttga
gaatctcatagcccaacttcccggcgaaaagaaaaacggattgttcgggaaccttattgccttgtcactc
ggtttgactcctaattttaagagtaatttcgatctggctgaggatgcaaaactgcagctgagtaaagata
catacgacgacgacctggacaatctcctggcccagattggagaccagtacgccgacctgttcttggctgc
caaaaacctctcagacgctattctcctgtcagacattttgcgcgtgaatactgagattacgaaggccccc
ctgtctgcctccatgattaagcgctatgatgagcaccatcaagacttgacccttcttaaagcgctggtac
ggcagcagctccctgaaaaatataaagaaatcttcttcgaccagtccaaaaatggctacgcgggctacat
cgacggaggtgcaagccaggaggagttctataagtttataaagccgatccttgagaagatggatgggacc
gaagaactcctggtgaaacttaacagggaggatctgctgcgaaagcagcgcacatttgataatgggtcca
ttccacatcaaattcatcttggagaattgcacgccattttgagaagacaggaggacttctatccgtttct
taaggacaatcgggaaaaaatagaaaagatacttacattccgaattccttactatgtcgggcccttggcg
cgagggaactctcggttcgcttggatgactcgaaaaagtgaggagactataactccttggaattttgaag
aagtcgtagacaaaggtgcttccgcgcaatcttttatagagagaatgactaatttcgacaaaaacctccc
aaacgagaaggttctgccaaagcacagccttctctacgagtattttactgtctataacgaactcactaag
gtgaaatacgtaactgaagggatgaggaagcctgcctttttgagtggcgagcagaagaaagcgatagtag
atttgctttttaaaaccaaccggaaggtcactgtgaaacaacttaaagaagactacttcaagaagataga
gtgtttcgacagcgtagaaatatctggcgtagaggaccgcttcaatgcaagcttgggcacttaccatgac
ctcctcaagataatcaaagataaagattttcttgataatgaagagaatgaggatatccttgaagacatag
tgttgactctcacgttgtttgaggatagggagatgatagaagagcgcttgaagacctatgctcatctctt
cgatgataaagtaatgaagcaactcaagcggagaaggtatactggttggggtcggctttctaggaaactc
atcaacggtattcgggataaacagtccggcaaaactatattggatttccttaagagtgatggcttcgcga
accgaaactttatgcaacttatacatgatgattcacttacatttaaggaagacattcaaaaagcgcaagt
atctggccagggcgactctctgcacgaacacatagcaaaccttgctggatcccctgcgataaagaaaggt
atactgcagacagtaaaagttgtggacgaactcgtcaaggttatgggtaggcataagcccgaaaatatag
tgattgaaatggcacgcgagaaccaaactacacaaaaaggtcaaaagaacagcagagaacggatgaaacg
aatagaggaggggatcaaggaacttggatcccaaatactgaaagagcaccccgtagaaaatacccagctt
caaaacgagaagctttatctgtactacctgcaaaacggcagagatatgtacgtagaccaggaactggaca
tcaacagattgtctgattatgatgtagatcacattgtgccgcagagcttcctcaaagatgattccataga
taacaaagtactcactcgaagtgacaaaaacagagggaaatccgataatgttcccagtgaggaagtcgtc
aagaagatgaagaattattggcggcaacttctcaacgcgaaactcatcacccaaagaaaattcgataacc
tcactaaagctgaacgcggaggactgtcagagcttgataaagcaggttttatcaaaaggcaactcgtaga
aacgagacaaataacaaaacatgtcgctcaaattttggactctcgcatgaatacaaagtatgatgaaaat
gacaagctgattcgcgaggtcaaagtaataacgctcaaaagtaaacttgtctccgatttccgaaaggact
ttcagttttacaaagtcagagagataaataattaccaccacgcccatgacgcctacctcaatgctgtggt
tggtacggctcttatcaagaaatatccgaagctcgagagcgagtttgtctatggcgactacaaggtttac
gatgtcaggaaaatgatagcgaagtctgagcaagagataggtaaggccacggctaaatactttttctatt
caaatatcatgaattttttcaaaaccgagataacgttggcgaatggcgaaatcaggaaaaggcctcttat
agagactaacggagaaacaggcgagattgtctgggataagggtagggatttcgctactgtgcgaaaggta
ctgagcatgccccaggttaacattgtcaaaaagactgaggtccaaacgggtggcttttctaaggagagta
tcctgccaaaacgcaattcagataagctcatagcgagaaaaaaggattgggacccaaagaaatatggcgg
cttcgactctccgacggtcgcatatagtgtgctggtggttgccaaagttgaaaagggcaagtctaaaaaa
ctgaaatcagtgaaggagcttctcggaataactattatggagcgcagctcatttgaaaagaatccaatcg
atttcttggaagcaaaaggatataaagaagtcaagaaggacctgatcatcaaacttccaaagtactcact
gttcgaacttgagaacggacggaagcggatgcttgcgagtgctggagaacttcaaaaaggtaacgagctc
gcccttccatcaaagtacgtaaattttttgtacttggcatcacactatgagaagctcaaaggctcccccg
aggataatgagcaaaagcagcttttcgtggaacaacataaacattaccttgatgaaatcatcgaacaaat
aagcgaattctctaaacgagttattcttgcagacgcgaatctggacaaggtgcttagcgcatacaacaag
catcgggataagccgattcgagaacaagccgaaaatataatccatcttttcactctgacgaacttgggtg
cgccggcagccttcaagtacttcgataccactattgataggaaacggtatacgagtacaaaagaagtgct
ggacgctacgcttatccatcagtccatcactgggctctacgagacgaggattgaccttagtcagttgggc
ggggacagccccaagaagaagagaaaggtggaggccagctaagaattcaataaaagatctttattttcat
tagatctgtgtgttggttttttgtgtgcggccgcaggaacccctagtgatggagttggccactccctctc
tgcgcgctcgctcgctcactgaggccgggcgaccaaaggtcgcccgacgcccgggctttgcccgggcggc
ctcagtgagcgagcgagcgcgcagctgcctgcagg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>3119</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..3119</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>cctgcaggcagctgcgcgctcgctcgctcactgaggccgcccgggcgtc
gggcgacctttggtcgcccggcctcagtgagcgagcgagcgcgcagagagggagtggccaactccatcac
taggggttcctgcggcctctagagagggcctatttcccatgattccttcatatttgcatatacgatacaa
ggctgttagagagataattagaattaatttgactgtaaacacaaagatattagtacaaaatacgtgacgt
agaaagtaataatttcttgggtagtttgcagttttaaaattatgttttaaaatggactatcatatgctta
ccgtaacttgaaagtatttcgatttcttggctttatatatcttgtggaaaggacgaaacaccgggggcca
ctagggacaggatgttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaa
agtggcaccgagtcggtgcttttttgaattccaattggacaccccgttctcctgtggattcgggtcacct
ctcactcctttcatttgggcagctcccctaccccccttacctctctagtctgtgctagctcttccagccc
cctgtcatggcatcttccaggggtccgagagctcagctagtcttcttcctccaacccgggcccctatgtc
cacttcaggacagcatgtttgctgcctccagggatcctgtgtccccgagctgggaccaccttatattccc
agggccggttaatgtggctctggttctgggtacttttatctgtcccctccaccccacagtggggccacta
gggacaggattaagcttgctaggtcttgaaaggagtgggaattggctccggtgcccgtcagtgggcagag
cgcacatcgcccacagtccccgagaagttggggggaggggtcggcaattgatccggtgcctagagaaggt
ggcgcggggtaaactgggaaagtgatgtcgtgtactggctccgcctttttcccgagggtgggggagaacc
gtatataagtgcagtagtcgccgtgaacgttctttttcgcaacgggtttgccgccagaacacaggaccgg
tgtctcgccatgctgctcctgggcctgctgctgctgctgcccctgctggctggcgcccgcctgctgtgga
actggtggaagctccggagcctccacctcccgcctcttgccccgggcttcttgcacctgctgcagcccga
cctccccatctatctgcttggcctgactcagaaattcgggcccatctacaggctccaccttgggctgcaa
gatgtggtggtgctgaactccaagaggaccattgaggaagccatggtcaaaaagtgggcagactttgctg
gcagacctgagccacttacctacaagctggtgtctaggaactacccggacctgtccttgggagactactc
cctgctctggaaagcccacaagaagctcacccgctcagccctgctgctgggcatccgtgactccatggag
ccagtggtggagcagctgacccaggagttctgtgagcgcatgagagcccagcccggcacccctgtggcca
ttgaggaggaattctctctcctcacctgcagcatcatctgttacctcaccttcggagacaagatcaagga
cgacaacttaatgcctgcctattacaaatgtatccaggaggtgttaaaaacctggagccactggtccatc
caaattgtggacgtgattccctttctcaggttcttccccaatccaggtctccggaggctgaagcaggcca
tagagaagagggatcacatcgtggagatgcagctgaggcagcacaaggagagcctcgtggcaggccagtg
gagggacatgatggactacatgctccaaggggtggcgcagccgagcatggaagagggctctggacagctc
ctggaagggcacgtgcacatggctgcagtggacctcctgatcggtggcactgagaccacagcaaacaccc
tctcctgggccgtggtttttttgcttcaccaccctgagattcagcagcgactgcaggaggagctagacca
cgaactgggccctggtgcctccagctcccgggtcccctacaaggaccgtgcacggctgcccttgctcaat
gccaccatcgccgaggtgctgcgcctgcggcccgttgtgcccttagccttgccccaccgcaccacacggc
ccagcagcatctccggctacgacatccctgagggcacagtcatcattccgaacctccaaggcgcccacct
ggatgagacggtctgggagaggccacatgagttctggcctgatcgcttcctggagccaggcaagaactcc
agagctctggccttcggctgcggtgcccgcgtgtgcctgggcgagccgctggcgcgcctggagctcttcg
tggtgctgacccgactgctgcaggccttcacgctgctgccctccggggacgccctgccctccctgcagcc
cctgccccactgcagtgtcatcctcaagatgcagcctttccaagtgcggctgcagccccgggggatgggg
gcccacagcccgggccagagccagtaaaataaaagatctttattttcattagatctgtgtgttggttttt
tgtgtgctcgagtgacagaaaagccccatccttaggcctcctccttcctagtctcctgatattgggtcta
acccccacctcctgttaggcagattccttatctggtgacacacccccatttcctggagccatctctctcc
ttgccagaacctctaaggtttgcttacgatggagccagagaggatcctgggagggagagcttggcagggg
gtgggagggaagggggggatgcgtgacctgcccggttctcagtggccaccctgcgctaccctctcccaga
acctgagctgctctgacgcggccgtctggtgcgtttcactgatcctggtgcgcggccgcaggaaccccta
gtgatggagttggccactccctctctgcgcgctcgctcgctcactgaggccgggcgaccaaaggtcgccc
gacgcccgggctttgcccgggcggcctcagtgagcgagcgagcgcgcagctgcctgcagg</INSDSeq_
sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>10338</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..10338</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q3">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Homo sapiens</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>ggagaacttacaggtcctgccacaatcctaatgcaaggatggagctgca
agttcagtttgggaatcatcagcctggattggtttggtggaagccagggagtggttgagacccccacagg
ggagctctgaggaaggaagttccgaaggagggaacgtaagaaatgaccaggtcagaaccaagggtggtcc
agaagctaacccttagcttagggacagtttcacagagaacacgtccatgatgcaagactctgctgagggc
ctggagcagtgaagactggggcaaggtcaccctctgggaagtgaagtcaccagagaccttgcggagcagc
tttgagagttctctgagtaggaaggtaacagaatgtgaaggacactggagagaaggccaataggaagcaa
acaaaaacaggccaaggaaacccagtacagggggctgcagggcccagggagtgggtccctcatctctcct
ccccacgcttggccaggtccccacctcccgggagtgcgtgggctttgaggctgtgcaggaagtgccggtg
gggctggtgcagccggccagcgcaaccctgtacgactactacaaccccggtgagcactgcaggacaccct
gaaattcaggagaactttggcataggtgccctcctatgggacaatggacaccggggtagtgagggggcag
agagccctggggctccctgggactgaggaggcagaatggaggggcctgtgccctaactcctctctgttct
ccagagcgcagatgttctgtgttttacggggcaccaagtaagagcagactcttggccaccttgtgttctg
ctgaagtctgccagtgtgctgagggtgagactgagggcctggggcggggcagtggaggcgggatggccgg
ggccccccccacactgtctgatgggttccccaacttcagggaagtgccctcgccagcgtcgcgccctgga
gcggggtctgcaggacgaggatggctacaggatgaagtttgcctgctactacccccgtgtggagtacggt
cagtcttcccaccgaggccctggcctgaccctccctcggggaccggccgttttggtctctctgggtgtag
cctgctcctcttacaggtcatgcacgcagcctgtttgctctgacaccaacttcctaccctctcagcctca
aagtaactcacctttcccccttctcctcaccccctcttaggcttccaggttaaggttctccgagaagaca
gcagagctgctttccgcctctttgagaccaagatcacccaagtcctgcacttcagtatgaagcaaaccgg
agaggcgggcagggctggggggagacagggaggctgaggtgtggccgaggacctgaccatctggaagtgt
gaaaatccccttgggctgtcagaagccttgggcttggccataaatagggaggcagtggcacctctccatg
ggggtggcgaaggtggaatgagaggatctacacagagtccccagcctgggctcaccctgcaccttctctt
cccctctgaccacttttgcgcacgtcatccccgcagccaaggatgtcaaggccgctgctaatcagatgcg
caacttcctggttcgagcctcctgccgccttcgcttggaacctgggaaagaatatttgatcatgggtctg
gatggggccacctatgacctcgagggacagtgagtcatctggtcccctcagtctcttgtcctccccatgc
ctcgccacctaggccttgcccctcagaagccagatgcctgtgctctccgtttccacctgccatcctcccg
agccctgctgactgcccctttgccccctgcagcccccagtacctgctggactcgaatagctggatcgagg
agatgccctctgaacgcctgtgccggagcacccgccagcgggcagcctgtgcccagctcaacgacttcct
ccaggagtatggcactcaggggtgccaggtgtgagggctgccctcccacctccgctgggaggaacctgaa
cctgggaaccatgaagctggaagcactgctgtgtccgctttcatgaacacagcctgggaccagggcatat
taaaggcttttggcagcaaagtgtcagtgttggcagtgaagtgtcagtgtgtgttgctagggctgagagc
agtgcccctgcccgatgcagttctgggcaggccaggttgacataaccttagactctctgagccctgatga
cccttgggctgttcagctctgctagaacctcccagatgacccgctaggagtctagtgcttcacaggacca
ccccgagcagaactgggacccaagagcctgcaccccaaggaccagagtccatgccaagaccacccttcag
cttccaaggccctccactgcccggctgtcgccagtcaccacggcctcagacagggcttgtgctcagctga
cacctgtgacacagctcttctgcctcatgagctgttgtccagctacacctccccgactctgtcctcgtgc
tgctggcggttctgaggtctgcagattttagctgagttccgggctgttgaaagcctgctgacgcttggtt
ctgttatcagtggaatgaggtgactttcccggagttgtgcaatcctcaggtccggcagtgtcttcttcca
gttactggtttcaaacaagccaaaagtctgactttggtgtgtttgtgaatcctctgaggaagccgctgtt
ctcctggggtctccccttcccaccggacctgcctaactttcccccatttagtggcacacctggggtcttc
agagatgactccgcgtctgtccaaagaagtttggtgagatcagtttccgtagaggtcatgacagttcagc
agcctgccatccagtcattcgacagaaattcgggaatctttcacttcatgccatgccctgtgccaggtgc
cagagatacagctgctcactccagggctcatcgctggggagacagataagaggacgggcagtccccaccc
tctgtgaaagatgtgatgtcagggagcagtgtggtcctgtggggcatctaaccaagtcaggggcattgcc
aggcagggacagggaaggcttcctggagcaggtggcctccaagtggggctctgaagactgagaaggagcc
aggaaaagagcaggggtagatgagggcatctggggcagaaggagaatatacaaaggcccagaggccgggg
gcaggacagggtacctttggggacattgcatgtaattgaccacattcggagtttggatttggaagtggtg
gaagagatggagatggtgagacaagtagtaagcacgtcagccttccaggtgcgctcctttccgatgagca
ctgtcttatcccacgtaactttgagaagtttgggcctttcccactgtggcagaggtttcctgaggctctt
gcatacatggccctatggttgctcatcagatctttctcccagtagctgctcagcatggtggtggcataag
cccattttccggagccagggattcagttgcagcaagacatggcccggtctgggaggtcaaccatgaagaa
ggcagtagctgtcattgcccaaccccagaaatcccaatcctgttttctccctctcagtcctgatcatgga
ttcagcagcagcgaactcgccaatgtagtgggtggcacagccagggtcttgactctggctctgcagtagc
acagtctggaaaagctctgaggggagagagacccccactggtccgagggtctggcacagagccagaaatg
ggggggaaggtatggggctgggtcgcctctgacctctcaggtaccatccaggaggccctggcctctcact
gaacccggccactcctctttggcatggcctcttcccaaatccccaaactgcctccttacccacaaaagtg
gtctctgagtgtcagtccagtgggacccccaccccttatggcttcagttccccaaatagggctggaccct
tgatcctgatccagctgtggctatccagccccttcctggggactttggactttgaggggggcatgcccag
ttgtgctgggaatccatactttccctggctggagtagaacctgtggactgtagtcctgagggcagtcatg
ttctgcctgtgcctggaaacacaagaaacttgactgcagagagaagaaagaggagagaggaacagagcga
ggaaaccgcccgtctccggggctttttctgttccctatccttgactttctaagaccagtggggtcccctc
ctctgcttctttttcctgagttctgtgaaattccccaattcttattttttatctcaaaccagctcaaggt
gggctgttttcctttcaaccaaagaaaggtgctcctggtggctaaaggtacatattcgacagctagattt
ccaggctggaatcctgccctccacaacatgcgaacaatacccgtgttgcatatagagcatggctgtgaag
agttgagtgagtgcccacaaagcacttagagcagtgtctggtacatgctattactccgcagcgggaaacc
acttcctcctttgtcttctgggcacttttgtgagtgaaaggaggcactaataacaatcacactgggatac
ctgtatatactggaatgccccaggcaaaccaggcttaaactgtattactctatctgtagcttaaactaac
aaacaacccacacaaatcacattttgttcttcaggcgattcaggaaggcctattaggcagggactgccat
tttctctctgagacaaacatcatgccagtaaactggcccacggtggggtggcagagggagagggcccagg
tgggggcggacactattgcctgcacagttgatgtggaaccagaaagctgactctggatgcaggaaaaagg
tcagggttgcatttcccttccttgcttcttgatgggtgatcaatttttttgaaatacggacgtcccaagg
ccaatgagactggtgtcattccagaaaagggccactctgtgggcgggtcggtgggagggtacctgaaggt
ggggtcaagggaggccccaaaacagtctacacagcaggagggatggctggggctcttgagctataagtgg
cacctcagggccctgacgggcgtctcgccatgctgctcctgggcctgctgctgctgctgcccctgctggc
tggcgcccgcctgctgtggaactggtggaagctccggagcctccacctcccgcctcttgccccgggcttc
ttgcacctgctgcagcccgacctccccatctatctgcttggcctgactcagaaattcgggcccatctaca
ggctccaccttgggctgcaaggtgagaggctgatctcgctctggccctcaccataggagggggcggaggt
gacggagagggtcctctctccgctgacgctgctttggctgtctcccagatgtggtggtgctgaactccaa
gaggaccattgaggaagccatggtcaaaaagtgggcagactttgctggcagacctgagccacttacctgt
aagggccgggggcattttttctttcttaaaaaaatttttttttaagagatgggttcttgctatgctgccc
aggctggtcttaaattcctagtctcaaatgatcctcccacctcagcctcaagtgtgagccacctttgggg
catccccaatccaggtccctggaagctcttgggggggcatatctggtggggagaaagcaggggttgggga
ggccgaagaaggtcaggccctcagctgccttcatcagttcccaccctccagcccccacctcctcctgcag
acaagctggtgtctaggaactacccggacctgtccttgggagactactccctgctctggaaagcccacaa
gaagctcacccgctcagccctgctgctgggcatccgtgactccatggagccagtggtggagcagctgacc
caggagttctgtgaggtaaggctgggctcctgaggccacctcgggtcagcctcgcctctcacagtagccc
ccgccctgcccgctgcacagcggcctgctgaactcacactgtttctccacagcgcatgagagcccagccc
ggcacccctgtggccattgaggaggaattctctctcctcacctgcagcatcatctgttacctcaccttcg
gagacaagatcaaggtgcctcacagcccctcaggcccacccccagcccctccctgagcctctccttgtcc
tgaactgaaagtactccctccttttctggcaggacgacaacttaatgcctgcctattacaaatgtatcca
ggaggtgttaaaaacctggagccactggtccatccaaattgtggacgtgattccctttctcagggtgagg
acctggagcctagacacccctgggttgtaggggagaggctggggtggagggagaggctccttcccacagc
tgcattctcatgcttcctgccgcagttcttccccaatccaggtctccggaggctgaagcaggccatagag
aagagggatcacatcgtggagatgcagctgaggcagcacaaggtggggactgtacgtggacggcctcccc
tcggcccacagccagtgatgctaccggcctcagcattgctatgaggcgggttcttttgcataccccagtt
atgggcctgttgccactctgtactcctctccccaggccagccgctcagcccgctcctttcaccctctgca
ggagagcctcgtggcaggccagtggagggacatgatggactacatgctccaaggggtggcgcagccgagc
atggaagagggctctggacagctcctggaagggcacgtgcacatggctgcagtggacctcctgatcggtg
gcactgagaccacagcaaacaccctctcctgggccgtggtttttttgcttcaccaccctgaggtgcgtcc
tggggacaagcaaaaggctccttcccagcaacctggccagggcggtgggcaccctcactcagctctgagc
actgtgcggctggggctgtgcttgcctcaccggcactcaggctcactgggttgctgagggagcggctgga
ggctgggcagctgtgggctgctggggcaggactccacccgatcattccccagattcagcagcgactgcag
gaggagctagaccacgaactgggccctggtgcctccagctcccgggtcccctacaaggaccgtgcacggc
tgcccttgctcaatgccaccatcgccgaggtgctgcgcctgcggcccgttgtgcccttagccttgcccca
ccgcaccacacggcccagcaggtgactcccgagggttggggatgagtgaggaaagcccgagcccagggag
gtcctggccagcctctaactccagcccccttcagcatctccggctacgacatccctgagggcacagtcat
cattccgaacctccaaggcgcccacctggatgagacggtctgggagaggccacatgagttctggcctggt
atgtggggggccgggggcctgccgtgaaaatgtggtggaggctggtccccgctgccgctgaacgcctccc
cacccacctgtccacccgcccgcagatcgcttcctggagccaggcaagaactccagagctctggccttcg
gctgcggtgcccgcgtgtgcctgggcgagccgctggcgcgcctggagctcttcgtggtgctgacccgact
gctgcaggccttcacgctgctgccctccggggacgccctgccctccctgcagcccctgccccactgcagt
gtcatcctcaagatgcagcctttccaagtgcggctgcagccccgggggatgggggcccacagcccgggcc
agagccagtgatggggcaggaccgatgccagccgggtacctcagtttctcctttattgctcccgtacgaa
cccctcccctcccccctgtaaacacagtgctgcgagatcgctggcagagaaggcttcctccagcggctgg
gtggtgaaggaccctggctcttctctcggggcgacccctcagtgctcggcagtcatactggggtgcgaga
gaggtgggcagcagctcagcctccccccgctggggagcgaaagtttcttggtctcagcttcatttccgtg
aagggcaccgagaactcgaagcccttccagtggtaccagctcactccctgggaaaggggttgtcaagaga
gagtcaaagccggatgtcccatctgctcttcccgttccccttaaggaggtagctcccagcactcaaccaa
cctccccgcagagctcccttcctgaccctccgctgcagaggattgaggcttaattctgagctggcccttt
ccagccaataaatcaactccagctccctctgcgaggctggcatgattgttccatttcacccagccactca
gtcccttgcctgttacactgtggggctgaaacctaggcaggccgagccccagccaccccagctctgagcc
gcctccccacccctcacctgatggtccactgtgctcccgtagagcccgttgaggttggcgtagtggcagt
tcctgtaccaccaggcccctcggtaggagacagcgcaggagatgagcaagctgttggggtcccgatcacg
ggcagagaagacactgccgctgtggtagctcatggagtcccctgggcagggtggaggaaggagccatgag
ggcctcccctcccagcctcaccctcccagcctcacagcctctgcttacctgcggtgccgtggtagccctc
caagtggaggcggtagtactccgcagccgagtctacgtggaaggagtcgtactgggcgaacacagcctcg
tccccagcccgcaggtccacgcgcatggagtagtcacctgcctgtgtcaggctgtgcagggcctcattgc
ctgggggtgggatacgtgccctcatcagggtcctggtgtccacagggcccccatccccatccgtagttcc
ccagtccctgtgaggcactgacccagccagaactctccagagatgttcccaaaaccatgggcatagtcct
cccagtccctccagaagtctgtctgtccatccatgcggcgctggaacacctgggaagcaagtgggggcac
catcagcctctggctcccggggcaacagaccctgccctgcacagacccctgggcttcccaatgccaccca
ccagccagccgcccccatcagtctccatgtcgcaaaacacgttcaggggccgctcgcggttgccgttgag
gaagatggtgctggtcctggaggcaccggctccgttctgcatctcctccccgcagtccctggggaagggg
atccgcagcccacctgggagaggagagcaggggccagtccttttccaagccttaggccctggctgcccac
ccagcccccggccccgggcccgtgcgtccaggtacccgtggtgaaagaggtggacacgggcggcaggagg
ctctggccccacatggcctggagccgtgcattgtaggaggtggagggaaagaggccaaggagctggtgag
atgtgatccctcctgggagcaggatctcctgtgggacagacaagggggggtcaggggagagggaggtgga
gaccctccgggagggccagaggcagcacctcctggaatcacccagggaggggagttgggtcagtggggcc
ggggcacctggttctgtccaccaggggtgtggaagctgagcaggtagcctgcgggccggactgggggctc
agtccaagtgagcagggcggtgcggggggtcacttccttggcctccaagtcccgaggggcctctagccct
aggagggaaagcaggaagaggagatggggatgaggcccaacctggctccctctacctcctctccctgtcc
cacacaccccacagaccctacctgtggtgaaggtgatgctggctggggaagtgaggttggggccccgcag
gccacgcactgtggcggtgtagttggtgtggaggacaaggtcatgcagggggtagtccaccgcgctgcct
ggggtctccgcctgcagaggcggggctgggagtgtagagaggggcatcaaggcctgccccctccatcctc
ggccagagtccagcctcccccctgcaatccccaccctgaacaagtcccctccagaggcctcaggcctgct
cacccccaggggctgtgacctggacgtcataggtgtccacaggattctgggggggcttccagtgcagcac
ggcgaatccctcggtcaagttcagtgcacgcaactgtgtgggaccgtcaggaactgggggaaggggaggg
gctcagaagggtccccgcggctctctctactccgtgcctccccagactccactggcctcccgtccgcaa<
/INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="4">
<INSDSeq>
<INSDSeq_length>1485</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1485</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q4">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atgctcttgctcggtctgttgttgttgctcccattgcttgcaggagccc
gcctgttgtggaactggtggaagctccggagcctgcatctcccccccttggcccctggctttcttcatct
tttgcagcccgacctgcctatatatctgctgggtctcactcagaagtttggacctatctaccgcctccac
ctggggctgcaggatgtggttgtgctcaattcaaaacgcacaattgaggaggcgatggttaagaaatggg
ccgactttgccggaaggcctgaaccactgacatataagctcgttagccgcaattacccagacctttccct
gggcgattactccctgctctggaaagcccataagaagctcacacgatcagcactgctgctgggaattcgc
gacagcatggagcctgtcgtagaacagctgactcaggaattctgtgagcgcatgcgggcccaacctggca
cacctgttgccatcgaggaggagttttctttgcttacatgctccattatctgctacctcacattcggcga
caagattaaagacgacaatctgatgcccgcctactacaagtgcatccaagaggtgctgaagacatggagt
cactggagcatccaaatcgtcgatgtgatcccatttctgagattcttccccaaccccgggcttaggagac
ttaagcaggctatcgaaaagagggatcacatagtcgaaatgcaacttagacagcacaaagagtctctggt
ggccggccagtggcgcgacatgatggactatatgctgcagggcgtggctcagccatccatggaagaaggc
agcggacaactccttgaggggcatgttcatatggccgccgttgacttgctgattggcggaaccgaaacaa
ctgctaatacactgtcctgggctgtggtattcctgctgcatcaccctgagatacagcaacggctccaaga
ggagctcgatcatgagctggggcccggtgcctcttcaagccgggtcccttacaaggaccgggcccgcctt
cctctgttgaatgcaaccatagctgaagtgctcagattgcgcccggtcgtaccactggccctccctcata
gaaccaccaggcccagcagtatctccggatatgatatcccagaggggactgtgattatcccaaacctgca
gggcgcccatctggacgagactgtgtgggagcggccacatgaattctggcctgacagattcctcgagcct
gggaagaactctcgggctctggcctttggttgcggggcaagggtatgcctgggggaacccttggcccggc
tggagcttttcgtagtgctgacacggctcctccaggcctttacgctgctgccaagcggcgacgctctgcc
tagcctgcaaccactgcctcattgctcagtcattctcaaaatgcagccttttcaagtgaggctgcagcca
cgaggtatgggcgcacattctcctggccagagccag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="5">
<INSDSeq>
<INSDSeq_length>4101</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..4101</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q5">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gacaaaaaatactccatcggtctggacattggtactaactctgtaggctgg
gccgttatcacggacgagtacaaagtacctagcaaaaagttcaaagtattggggaatactgacaggcatt
ccataaagaagaatctcataggagcattgctgtttgattccggagagacagcagaagctactcgactcaa
gagaaccgcacgacgccgatatacacgccgaaaaaaccgaatctgctacctgcaggagatcttctccaat
gaaatggctaaggtagacgacagcttctttcatcgacttgaagaatcttttcttgttgaggaggataaga
agcacgaacggcaccctattttcggcaatatcgtggatgaggtcgcgtatcatgaaaagtatcccaccat
ctaccacttgcgaaagaagctggtagatagtaccgacaaggcggatttgagactcatataccttgcactg
gcccacatgataaaattcagagggcacttcctcatcgaaggtgatcttaatccagacaacagtgacgtcg
ataagttgttcattcagctcgtgcagacttacaatcaactgtttgaagaaaatcccataaatgcgtcagg
cgtagatgcaaaggctatactctccgcgcgattgtcaaaatcccgacggcttgagaatctcatagcccaa
cttcccggcgaaaagaaaaacggattgttcgggaaccttattgccttgtcactcggtttgactcctaatt
ttaagagtaatttcgatctggctgaggatgcaaaactgcagctgagtaaagatacatacgacgacgacct
ggacaatctcctggcccagattggagaccagtacgccgacctgttcttggctgccaaaaacctctcagac
gctattctcctgtcagacattttgcgcgtgaatactgagattacgaaggcccccctgtctgcctccatga
ttaagcgctatgatgagcaccatcaagacttgacccttcttaaagcgctggtacggcagcagctccctga
aaaatataaagaaatcttcttcgaccagtccaaaaatggctacgcgggctacatcgacggaggtgcaagc
caggaggagttctataagtttataaagccgatccttgagaagatggatgggaccgaagaactcctggtga
aacttaacagggaggatctgctgcgaaagcagcgcacatttgataatgggtccattccacatcaaattca
tcttggagaattgcacgccattttgagaagacaggaggacttctatccgtttcttaaggacaatcgggaa
aaaatagaaaagatacttacattccgaattccttactatgtcgggcccttggcgcgagggaactctcggt
tcgcttggatgactcgaaaaagtgaggagactataactccttggaattttgaagaagtcgtagacaaagg
tgcttccgcgcaatcttttatagagagaatgactaatttcgacaaaaacctcccaaacgagaaggttctg
ccaaagcacagccttctctacgagtattttactgtctataacgaactcactaaggtgaaatacgtaactg
aagggatgaggaagcctgcctttttgagtggcgagcagaagaaagcgatagtagatttgctttttaaaac
caaccggaaggtcactgtgaaacaacttaaagaagactacttcaagaagatagagtgtttcgacagcgta
gaaatatctggcgtagaggaccgcttcaatgcaagcttgggcacttaccatgacctcctcaagataatca
aagataaagattttcttgataatgaagagaatgaggatatccttgaagacatagtgttgactctcacgtt
gtttgaggatagggagatgatagaagagcgcttgaagacctatgctcatctcttcgatgataaagtaatg
aagcaactcaagcggagaaggtatactggttggggtcggctttctaggaaactcatcaacggtattcggg
ataaacagtccggcaaaactatattggatttccttaagagtgatggcttcgcgaaccgaaactttatgca
acttatacatgatgattcacttacatttaaggaagacattcaaaaagcgcaagtatctggccagggcgac
tctctgcacgaacacatagcaaaccttgctggatcccctgcgataaagaaaggtatactgcagacagtaa
aagttgtggacgaactcgtcaaggttatgggtaggcataagcccgaaaatatagtgattgaaatggcacg
cgagaaccaaactacacaaaaaggtcaaaagaacagcagagaacggatgaaacgaatagaggaggggatc
aaggaacttggatcccaaatactgaaagagcaccccgtagaaaatacccagcttcaaaacgagaagcttt
atctgtactacctgcaaaacggcagagatatgtacgtagaccaggaactggacatcaacagattgtctga
ttatgatgtagatcacattgtgccgcagagcttcctcaaagatgattccatagataacaaagtactcact
cgaagtgacaaaaacagagggaaatccgataatgttcccagtgaggaagtcgtcaagaagatgaagaatt
attggcggcaacttctcaacgcgaaactcatcacccaaagaaaattcgataacctcactaaagctgaacg
cggaggactgtcagagcttgataaagcaggttttatcaaaaggcaactcgtagaaacgagacaaataaca
aaacatgtcgctcaaattttggactctcgcatgaatacaaagtatgatgaaaatgacaagctgattcgcg
aggtcaaagtaataacgctcaaaagtaaacttgtctccgatttccgaaaggactttcagttttacaaagt
cagagagataaataattaccaccacgcccatgacgcctacctcaatgctgtggttggtacggctcttatc
aagaaatatccgaagctcgagagcgagtttgtctatggcgactacaaggtttacgatgtcaggaaaatga
tagcgaagtctgagcaagagataggtaaggccacggctaaatactttttctattcaaatatcatgaattt
tttcaaaaccgagataacgttggcgaatggcgaaatcaggaaaaggcctcttatagagactaacggagaa
acaggcgagattgtctgggataagggtagggatttcgctactgtgcgaaaggtactgagcatgccccagg
ttaacattgtcaaaaagactgaggtccaaacgggtggcttttctaaggagagtatcctgccaaaacgcaa
ttcagataagctcatagcgagaaaaaaggattgggacccaaagaaatatggcggcttcgactctccgacg
gtcgcatatagtgtgctggtggttgccaaagttgaaaagggcaagtctaaaaaactgaaatcagtgaagg
agcttctcggaataactattatggagcgcagctcatttgaaaagaatccaatcgatttcttggaagcaaa
aggatataaagaagtcaagaaggacctgatcatcaaacttccaaagtactcactgttcgaacttgagaac
ggacggaagcggatgcttgcgagtgctggagaacttcaaaaaggtaacgagctcgcccttccatcaaagt
acgtaaattttttgtacttggcatcacactatgagaagctcaaaggctcccccgaggataatgagcaaaa
gcagcttttcgtggaacaacataaacattaccttgatgaaatcatcgaacaaataagcgaattctctaaa
cgagttattcttgcagacgcgaatctggacaaggtgcttagcgcatacaacaagcatcgggataagccga
ttcgagaacaagccgaaaatataatccatcttttcactctgacgaacttgggtgcgccggcagccttcaa
gtacttcgataccactattgataggaaacggtatacgagtacaaaagaagtgctggacgctacgcttatc
catcagtccatcactgggctctacgagacgaggattgaccttagtcagttgggcggggac</INSDSeq_
sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
Изобретение относится к области биотехнологии, а именно к набору векторов экспрессии для получения белков в клетках млекопитающих. Набор содержит вектор экспрессии, представляющий собой вирусную частицу аденоассоциированного вируса (AAV), имеющую капсидные белки AAV, в которую упакована в качестве генома одноцепочечная молекула ДНК, на концах которой располагаются ITR AAV, внутри ITR AAV последовательно расположены промотор первого фактора элонгации эукариот EF1 альфа, последовательность гистидиновой метки, сигнал внутриклеточной локализации в ядре 5’-SV40 NLS, кодон-оптимизированная последовательность гена Cas9 Streptococcus pyogenes, еще один сигнал внутриклеточной локализации в ядре 3’-SV40 NLS, в качестве терминатора транскрипции использован синтетический полиА сигнал, и вектор экспрессии, представляющий собой вирусную частицу аденоассоциированного вируса (AAV), имеющую капсидные белки AAV, в которую упакована в качестве генома одноцепочечная молекула ДНК, на концах которой располагаются ITR AAV, внутри последовательно располагается эукариотический промотор полимеразы III - U6, после которого располагается кассета экспрессии РНК гида, включающая последовательность РНК-гида в формате crRNA, представляющую последовательность в 20 нуклеотидов, комплементарную таргетируемому локусу, сшитую с последовательностью trackRNA, область гомологии с локусом человеческого генома AAVS1 - левое гомологичное плечо, кассета экспрессии траснгена: промотор EFS-NS, под которым расположена белок-кодирующая последовательность гена hCYP21A2 на 78-99% идентичная последовательности SEQ ID NO: 3, терминатор транскрипции - полиА сигнал, область гомологии с локусом человеческого генома AAVS1 - правое гомологичное плечо. Изобретение расширяет арсенал средств для экспрессии 21-гидроксилазы в клетках млекопитающих. 7 з.п. ф-лы, 3 ил., 4 табл., 4 пр.
1. Набор для получения белков в клетках млекопитающих, содержащий:
(i) вектор экспрессии, представляющий собой вирусную частицу аденоассоциированного вируса (AAV), имеющую капсидные белки AAV, в которую упакована в качестве генома одноцепочечная молекула ДНК, на концах которой расположены последовательности ITR AAV, внутри ITR AAV последовательно расположены промотор первого фактора элонгации эукариот EF1 альфа, последовательность гистидиновой метки, сигнал внутриклеточной локализации в ядре 5’-SV40 NLS, кодон-оптимизированная последовательность гена Cas9 Streptococcus pyogenes, еще один сигнал внутриклеточной локализации в ядре 3’-SV40 NLS, в качестве терминатора транскрипции использован синтетический полиА сигнал, и
(ii) вектор экспрессии, представляющий собой вирусную частицу аденоассоциированного вируса (AAV), имеющую капсидные белки AAV, в которую упакована в качестве генома одноцепочечная молекула ДНК, на концах которой расположены последовательности ITR AAV, внутри ITR AAV последовательно расположены эукариотический промотор полимеразы III - U6, кассета экспрессии РНК гида, включающая последовательность РНК-гида в формате crRNA, комплементарную таргетируемому локусу, сшитую с последовательностью trackRNA, область гомологии с локусом человеческого генома AAVS1 - левое гомологичное плечо, кассета экспрессии траснгена: промотор EFS-NS, под контролем которого расположена белок-кодирующая последовательность гена hCYP21A2 на 78-99% идентичная последовательности SEQ ID NO: 3, терминатор транскрипции - полиА сигнал, область гомологии с локусом человеческого генома AAVS1 - правое гомологичное плечо.
2. Набор по п.1, характеризующийся тем, что ITR AAV представляет собой ITR AAV серотипа 2.
3. Набор по п.1, характеризующийся тем, что кодон-оптимизированная последовательность гена Cas9 Streptococcus pyogenes представляет собой SEQ ID NO: 5.
4. Набор по п.1, характеризующийся тем, что один из указанных векторов представляет собой вектор с последовательностью SEQ ID NO: 1 или SEQ ID NO: 2.
5. Набор по п.1, характеризующийся тем, что один из указанных векторов представляет собой вектор с последовательностью SEQ ID NO: 1, а второй - с последовательностью SEQ ID NO: 2.
6. Набор по п.1, характеризующийся тем, что полиА сигнал является полиА сигналом гена β-глобина человека.
7. Набор по п.1, характеризующийся тем, что последовательность РНК-гида в формате crRNA представляет собой последовательность в 20 нуклеотидов.
8. Набор по п.1, характеризующийся тем, что дополнительно содержит буфер и/или физиологический раствор.
| WO 2019143803 A1, 25.07.2019 | |||
| WO 2022198038 A1, 22.09.2022 | |||
| НОВЫЕ ФЕРМЕНТЫ CRISPR И СИСТЕМЫ | 2016 |
|
RU2771826C2 |
| ДОСТАВКА, КОНСТРУИРОВАНИЕ И ОПТИМИЗАЦИЯ СИСТЕМ, СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЦЕЛЕНАПРАВЛЕННОГО ВОЗДЕЙСТВИЯ И МОДЕЛИРОВАНИЯ ЗАБОЛЕВАНИЙ И НАРУШЕНИЙ ПОСТМИТОТИЧЕСКИХ КЛЕТОК | 2014 |
|
RU2725502C2 |
| Способ получения повышенной стойкости против разъедающего действия основных шлаков огнеупорного материала | 1932 |
|
SU34575A1 |
| ИНДУЦИРУЕМЫЕ КАСПАЗЫ И СПОСОБЫ ИСПОЛЬЗОВАНИЯ | 2017 |
|
RU2757058C2 |
| Deborah P Merke et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2024-01-30—Публикация
2023-07-29—Подача