ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В данной заявке испрашивается приоритет предварительной заявки на патент США с серийным номером 62/629072, поданной 11 февраля 2018 г., содержание которой включено посредством ссылки во всей полноте, и на которую испрашивается приоритет.
ВВЕДЕНИЕ
Раскрытый в данном документе предмет изобретения предлагает способы и композиции для усиления иммунного ответа на рак и патогены. Он относится к новым конструкциям T-клеточных рецепторов (TCR) и содержащим их сконструированным иммунореактивным клеткам. Сконструированные иммунореактивные клетки, содержащие новые TCR, являются антиген-направленными.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Адоптивная иммунотерапия с использованием антиген-распознающих рецепторов (например, химерных антигенных рецепторов (CAR)) показала замечательные клинические результаты в лечении лейкоза и является одной из самых многообещающих новых стратегий лечения рака. Для создания терапий CAR современные клинические протоколы используют аутологичные T-клетки и случайно интегрируемые векторы, включая гамма-ретровирусные, лентивирусные и транспозоны, что приводит к полуслучайной интеграции и переменной экспрессии CAR из-за разнообразия трансгенов. В целом, сочетание аутологичных источников клеток и случайной интеграции векторов имеет предрасположенность к генерации клеточных продуктов с переменной эффективностью. Таким образом, существует потребность в новых конструкциях антиген-распознающих рецепторов, обладающих постоянной эффективностью и повышенной способностью обнаруживать низкие уровни антигена-мишени.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Раскрытый в данном документе предмет изобретения в целом предлагает HLA-независимые (или не рестриктированные по HLA) T-клеточные рецепторы (называемые "HI-TCR"), которые связываются с представляющим интерес антигеном HLA-независимым образом, и содержащие их иммунореактивные клетки. Раскрытый в данном документе предмет изобретения также предлагает способы применения таких клеток для вызывания и/или усиления иммунного ответа на антиген-мишень, и/или лечения и/или предупреждения неоплазии или других заболеваний/нарушений, при которых желательно усиление антиген-специфического иммунного ответа.
Раскрытый в данном документе предмет изобретения предлагает рекомбинантный T-клеточный рецептор (TCR), содержащий антигенсвязывающую цепь, которая содержит внеклеточный антигенсвязывающий домен и константный домен, где данный рекомбинантный TCR связывается с антигеном HLA-независимым образом.
В определенных вариантах осуществления константный домен содержит нативный или модифицированный пептид TRAC и/или нативный или модифицированный пептид TRBC. В определенных вариантах осуществления константный домен способен образовывать гомодимер или гетеродимер с другим константным доменом.
В определенных вариантах осуществления рекомбинантный TCR экспрессируется из кассеты экспрессии, помещенной в эндогенный локус TRAC и/или локус TRBC иммунореактивной клетки. В определенных вариантах осуществления помещение кассеты экспрессии рекомбинантного TCR нарушает или прекращает экспрессию эндогенного TCR, содержащего нативную α-цепь TCR и/или нативную β-цепь TCR, в иммунореактивной клетке. В определенных вариантах осуществления помещение кассеты экспрессии рекомбинантного TCR предотвращает или устраняет ошибочное спаривание между рекомбинантным TCR и нативной α-цепью TCR и/или нативной β-цепью TCR в иммунореактивной клетке. В определенных вариантах осуществления антигенсвязывающая цепь способна связываться с полипептидом CD3ζ. Антигенсвязывающая цепь после связывания с антигеном способна активировать полипептид CD3ζ, связанный с антигенсвязывающей цепью. Активация полипептида CD3ζ способна активировать иммунореактивную клетку. Полипептид CD3ζ может быть эндогенным или экзогенным. В определенных вариантах осуществления полипептид CD3ζ является эндогенным и является эндогенным и интегрирован в нативный комплекс CD3. В определенных вариантах осуществления полипептид CD3ζ является экзогенным и, необязательно, интегрирован с костимулирующей молекулой, выбранной из группы, состоящей из полипептида CD28, полипептида 4-1BB, полипептида OX40, полипептида ICOS, полипептида DAP-10 и любой их комбинации. В определенных вариантах осуществления антигенсвязывающая цепь дополнительно содержит костимулирующую область, причем рекомбинантный TCR после связывания с антигеном способен стимулировать иммунореактивную клетку. Костимулирующая область может включать в себя костимулирующую молекулу, выбранную из группы, состоящей из полипептида CD28, полипептида 4-1BB, полипептида OX40, полипептида ICOS, полипептида DAP-10 и любой их комбинации. В определенных вариантах осуществления костимулирующая область содержит полипептид CD28.
В определенных вариантах осуществления рекомбинантный TCR способен связываться с комплексом CD3. В определенных вариантах осуществления рекомбинантный TCR способен интегрироваться с комплексом CD3 и обеспечивать HLA-независимое распознавание антигена. В определенных вариантах осуществления комплекс CD3 является эндогенным. В определенных вариантах осуществления рекомбинантный TCR заменяет эндогенный TCR в комплексе CD3/TCR.
В определенных вариантах осуществления внеклеточный антигенсвязывающий домен способен к димеризации с другим внеклеточным антигенсвязывающим доменом. Внеклеточный антигенсвязывающий домен может включать в себя лиганд рецептора клеточной поверхности, рецептор лиганда клеточной поверхности, антигенсвязывающую часть антитела или его фрагмента или антигенсвязывающую часть TCR. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит вариабельную область тяжелой цепи (VH) антитела или VHH из верблюжьего антитела, содержащего только VH, и/или вариабельную область легкой цепи (VL) антитела. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен способен к димеризации с другим внеклеточным антигенсвязывающим доменом. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит VH антитела, причем человеческая, мышиная или верблюжья VH способна к димеризации с другим внеклеточным антигенсвязывающим доменом, содержащим VL антитела, и образованию вариабельного фрагмента (Fv). В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит VL антитела, причем VL способна к димеризации с другим внеклеточным антигенсвязывающим доменом, содержащим VH антитела, и образованию вариабельного фрагмента (Fv).
В определенных вариантах осуществления рекомбинантный TCR связывается с опухолевым антигеном. Опухолевый антиген может быть выбран из группы, состоящей из CD19, MUC16, MUC1, CAlX, CEA, CD8, CD7, CD10, CD20, CD22, CD30, CLL1, CD33, CD34, CD38, CD41, CD44, CD49f, CD56, CD74, CD133, CD138, EGP-2, EGP-40, EpCAM, erb-B234, FBP, фетального ацетилхолинового рецептора, фолатного рецептора-a, GD2, GD3, HER-2, hTERT, IL-13R-a2, легкой цепи K, KDR, LeY, молекулы клеточной адгезии L1, MAGE-A1, мезотелина, ERBB2, MAGEA3, p53, MART1, GP100, протеиназы 3 (PR1), тирозиназы, сурвивина, hTERT, EphA2, лигандов NKG2D, NY-ES0-1, онкофетального антигена (h5T4), PSCA, PSMA, ROR1, TAG-72, VEGF-R2, WT-1, BCMA, CD123, CD44V6, NKCS1, EGF1R, EGFR-VIII и CD99, CD70, ADGRE2, CCR1, LILRB2, LILRB4, PRAME и ERBB. В определенных вариантах осуществления опухолевый антиген представляет собой CD19.
В определенных вариантах осуществления рекомбинантный TCR проявляет большую чувствительность к антигену, чем CAR, нацеленный на тот же антиген. В определенных вариантах осуществления рекомбинантный TCR способен вызывать иммунный ответ, когда связывается с антигеном, который имеет низкую плотность на поверхности опухолевой клетки. В определенных вариантах осуществления антиген, который имеет низкую плотность на клеточной поверхности, имеет плотность ниже приблизительно 2000 молекул на клетку.
Раскрытый в данном документе предмет изобретения дополнительно предлагает иммунореактивные клетки, содержащие рекомбинантный TCR, описанный в настоящем документе. В определенных вариантах осуществления кассета экспрессии по меньшей мере одной антигенсвязывающей цепи рекомбинантного TCR помещена в локус эндогенного гена иммунореактивной клетки. В определенных вариантах осуществления кассеты экспрессии двух антигенсвязывающих цепей рекомбинантного TCR помещены в локус эндогенного гена иммунореактивной клетки, причем данные две антигенсвязывающие цепи способны к димеризации. Помещение кассеты экспрессии рекомбинантного TCR может нарушать или прекращать экспрессию эндогенного TCR, содержащего нативную α-цепь TCR и/или нативную β-цепь TCR, в иммунореактивной клетке, тем самым предотвращая или устраняя ошибочное спаривание между рекомбинантным TCR и нативной α-цепью TCR и/или нативной β-цепью TCR в иммунореактивной клетке. Локус эндогенного гена может представлять собой локус CD3δ, локус CD3ε, локус CD247, локус B2M, локус TRAC, локус TRBC или локус TRGC или локус TRDC. В определенных вариантах осуществления локус эндогенного гена представляет собой локус TRAC и/или локус TRBC. Локус эндогенного гена может включать в себя модифицированную область терминатора транскрипции. В определенных вариантах осуществления модифицированная область терминатора транскрипции содержит геномный элемент, выбранный из группы, состоящей из терминатора транскрипции TK, терминатора транскрипции GCSF, терминатора транскрипции TCRA, терминатора транскрипции HBB, терминатора транскрипции бычьего гормона роста, терминатора транскрипции SV40 и элемента P2A; элемент P2A позволяет использовать эндогенный терминатор транскрипции целевого гена. В определенных вариантах осуществления, когда один локус эндогенного Т-клеточного рецептора в клетке модифицирован для экспрессии по меньшей мере одной антигенсвязывающей цепи рекомбинантного TCR, один или более других локусов эндогенного Т-клеточного рецептора в клетке модифицированы для устранения экспрессии цепи эндогенного TCR. В определенных вариантах осуществления один или более других локусов эндогенного T-клеточного рецептора дополнительно модифицированы для экспрессии представляющего интерес гена. Представляющий интерес ген может представлять собой противоопухолевый цитокин, лиганд костимулирующей молекулы, ген отслеживания или ген самоубийства. В определенных вариантах осуществления один или более локусов эндогенного TCR дополнительно модифицированы для включения последовательности, кодирующей костимулирующий сигнальный домен(ы), для создания цепи TCR, содержащей такой сигнальный домен(ы) на карбоксильном конце.
В определенных вариантах осуществления иммунореактивную клетку выбирают из группы, состоящей из T-клетки, цитотоксического T-лимфоцита (CTL), регуляторной T-клетки, естественной киллерной T-клетки (NKT-клетки), человеческой эмбриональной стволовой клетки и плюрипотентной стволовой клетки, из которой могут дифференцироваться лимфоидные клетки. В определенных вариантах осуществления иммунореактивная клетка является аутологичной.
В определенных вариантах осуществления иммунореактивная клетка дополнительно содержит по меньшей мере один экзогенный костимулирующий лиганд. В определенных вариантах осуществления костимулирующий лиганд выбирают из группы, состоящей из CD80, CD86, 41BBL, CD275, CD40L, OX40L и любой их комбинации. В определенных вариантах осуществления клетка дополнительно содержит или включает в себя один экзогенный костимулирующий лиганд. В определенных вариантах осуществления один экзогенный костимулирующий лиганд представляет собой CD80 или 4-1BBL. В определенных вариантах осуществления клетка дополнительно содержит или включает в себя два экзогенных костимулирующих лиганда. В определенных вариантах осуществления два экзогенных костимулирующих лиганда представляют собой CD80 и 4-1BBL.
В определенных вариантах осуществления иммунореактивная клетка дополнительно содержит по меньшей мере один химерный костимулирующий рецептор (CCR). В определенных вариантах осуществления CCR содержит костимулирующую молекулу, выбранную из группы, состоящей из полипептида CD28, полипептида 4-1BB, полипептида OX40, полипептида ICOS, полипептида DAP-10 и любой их комбинации.
Раскрытый в данном документе предмет изобретения также предлагает фармацевтический композиции, содержащие иммунореактивную клетку(и), раскрытую в настоящем документе, и фармацевтически приемлемый эксципиент. Фармацевтическую композицию можно использовать для лечения неоплазии.
Кроме того, предлагаются способы снижения опухолевой нагрузки у субъекта. Кроме того, раскрытый в данном документе предмет изобретения предлагает способы увеличения продолжительности жизни субъекта, имеющего новообразование (например, рак). В определенных вариантах осуществления способ содержит введение субъекту эффективного количества иммунореактивных клеток, описанных в настоящем документе, или фармацевтической композиции, описанной в настоящем документе.
Раскрытый в данном документе предмет изобретения также предлагает способы лечения или предупреждения новообразования. В определенных вариантах осуществления способ содержит введение субъекту эффективного количества иммунореактивных клеток, описанных в настоящем документе, или фармацевтической композиции, описанной в настоящем документе. Новообразование может быть выбрано из группы, состоящей из рака крови, B-клеточного лейкоза, множественной миеломы, острого лимфобластного лейкоза (ALL), хронического лимфоцитарного лейкоза, неходжкинской лимфомы и аденокарциномы. В определенных вариантах осуществления новообразование представляет собой B-клеточный лейкоз, множественную миелому, острый лимфобластный лейкоз (ALL), хронический лимфоцитарный лейкоз или неходжкинскую лимфому, и рекомбинантный TCR связывается с CD19. В определенных вариантах осуществления новообразование представляет собой B-клеточный лейкоз, множественную миелому, острый лимфобластный лейкоз (ALL), хронический лимфоцитарный лейкоз, аденокарциному или неходжкинскую лимфому, и рекомбинантный TCR связывается с CD19, MUC16, MUC1, CAlX, CEA, CD8, CD7, CD10, CD20, CD22, CD30, CLL1, CD33, CD34, CD38, CD41, CD44, CD49f, CD56, CD74, CD133, CD138, EGP-2, EGP-40, EpCAM, erb-B234, FBP, фетальным ацетилхолиновым рецептором, фолатным рецептором-a, GD2, GD3, HER-2, hTERT, IL-13R-a2, легкой цепью K, KDR, LeY, молекулой клеточной адгезии L1, MAGE-A1, мезотелином (MSLN), ERBB2, MAGEA3, p53, MART1, GP100, протеиназой 3 (PR1), тирозиназой, сурвивином, hTERT, EphA2, лигандами NKG2D, NY-ES0-1, онкофетальным антигеном (h5T4), PSCA, PSMA, ROR1, TAG-72, VEGF-R2, WT-1, BCMA, CD123, CD44V6, NKCS1, EGF1R, EGFR-VIII, CD99, CD70, ADGRE2, CCR1, LILRB2, LILRB4, PRAME и ERBB. В определенных вариантах осуществления новообразование представляет собой CD19+ ALL.
Раскрытый в данном документе предмет изобретения дополнительно предлагает способы получения антиген-специфической иммунореактивной клетки. В определенных вариантах осуществления способ содержит введение в иммунореактивную клетку последовательности нуклеиновой кислоты, кодирующей рекомбинантный TCR, описанный в настоящем документе. Последовательность нуклеиновой кислоты может содержаться в векторе. В определенных вариантах осуществления кассета экспрессии по меньшей мере одной антигенсвязывающей цепи рекомбинантного TCR помещена в локус эндогенного гена иммунореактивной клетки. В определенных вариантах осуществления кассеты экспрессии двух антигенсвязывающих цепей рекомбинантного TCR помещены в локус эндогенного гена иммунореактивной клетки, причем данные две антигенсвязывающие цепи способны к димеризации. Локус эндогенного гена может представлять собой локус CD3δ, локус CD3ε, локус CD247, локус B2M, локус TRAC, локус TRBC, локус TRDC и/или локус TRGC. В определенных вариантах осуществления локус эндогенного гена представляет собой локус TRAC или локус TRBC. В определенных вариантах осуществления помещение кассеты экспрессии рекомбинантного TCR нарушает или прекращает экспрессию эндогенного TCR, содержащего нативную α-цепь TCR и/или нативную β-цепь TCR, в иммунореактивной клетке, тем самым предотвращая или устраняя ошибочное спаривание между рекомбинантным TCR и нативной α-цепью TCR и/или нативной β-цепью TCR в иммунореактивной клетке. В определенных вариантах осуществления локус эндогенного гена содержит модифицированную область терминатора транскрипции. в определенных вариантах осуществления модифицированная область терминатора транскрипции содержит геномный элемент, выбранный из группы, состоящей из терминатора транскрипции TK, терминатора транскрипции GCSF, терминатора транскрипции TCRA, терминатора транскрипции HBB, терминатора транскрипции бычьего гормона роста, терминатора транскрипции SV40 и элемента P2A. В определенных вариантах осуществления, когда один локус эндогенного Т-клеточного рецептора в клетке модифицирован для экспрессии по меньшей мере одной антигенсвязывающей цепи рекомбинантного TCR, один или более других локусов эндогенного Т-клеточного рецептора в клетке модифицированы для устранения экспрессии цепи эндогенного TCR. В определенных вариантах осуществления один или более других локусов эндогенного Т-клеточного рецептора дополнительно модифицированы для экспрессии представляющего интерес гена. В определенных вариантах осуществления представляющий интерес ген представляет собой противоопухолевый цитокин, лиганд костимулирующей молекулы, ген отслеживания или ген самоубийства.
Раскрытый в данном документе предмет изобретения дополнительно предлагает нуклеиновые кислоты, кодирующие рекомбинантный TCR, описанный в настоящем документе, и композиции нуклеиновой кислоты, содержащие рекомбинантный TCR, описанный в настоящем документе. В определенных вариантах осуществления последовательности нуклеиновой кислоты содержатся в векторе. Раскрытый в данном документе предмет изобретения также предлагает векторы, содержащие композицию нуклеиновой кислоты, описанную в настоящем документе. Кроме того, предлагаются наборы, содержащие рекомбинантный TCR, описанный в настоящем документе, иммунореактивную клетку, описанную в настоящем документе, фармацевтическую композицию, описанную в настоящем документе, композицию нуклеиновой кислоты, описанную в настоящем документе, или вектор, описанный в настоящем документе. В определенных вариантах осуществления набор дополнительно содержит письменные инструкции по лечению и/или предупреждению новообразования, патогенной инфекции, аутоиммунного нарушения или аллогенного трансплантата.
Типичные новообразования, для которых можно использовать раскрытый в данном документе предмет изобретения, включают, но без ограничения, лейкозы (например, острый лейкоз, острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз, острый миелобластный лейкоз, острый промиелоцитарный лейкоз, острый миеломоноцитарный лейкоз, острый моноцитарный лейкоз, острый эритролейкоз, хронический лейкоз, хронический миелоцитарный лейкоз, хронический лимфоцитарный лейкоз), истинную полицитемию, лимфому (болезнь Ходжкина, неходжкинское заболевание), макроглобулинемию Вальденстрема, болезнь тяжелых цепей и содидные опухоли, такие как саркомы и карциномы (например, фибросаркому, миксосаркому, липосаркому, хондросаркому, остеогенную саркому, хордому, ангиосаркому, эндотелиосаркому, лимфангиосаркому, лимфангиоэндотелиосаркому, синовиому, мезотелиому, опухоль Юинга, лейомиосаркому, рабдомиосаркому, карциному толстой кишки, рак поджелудочной железы, рак молочной железы, рак яичников, рак предстательной железы, плоскоклеточную карциному, базальноклеточную карциному, аденокарциному, карциному потовых желез, карциному сальных желез, папиллярную карциному, папиллярные аденокарциномы, цистаденокарциному, медуллярную карциному, бронхогенную карциному, почечно-клеточную карциному, гепатому, карциному желчного протока, хориокарциному, семиному, эмбриональную карциному, опухоль Вильмса, рак шейки матки, рак матки, рак яичек, карциному легкого, мелкоклеточную карциному легкого, карциному мочевого пузыря, эпителиальную карциному, глиому, астроцитому, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, акустическую неврому, олигоденроглиому, шванному, менингиому, меланому, нейробластому и ретинобластому).
Раскрытый в данном документе предмет изобретения дополнительно предлагает применение любого рекомбинантного TCR, любой фармацевтической композиции или любой иммунореактивной клетки, раскрытых в настоящем документе, для применения в терапии.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Нижеследующее подробное описание, приведенное в качестве примера, но не предназначенное для ограничения раскрытого в данном документе предмета изобретения конкретными описанными вариантами осуществления, может быть понято в сочетании с прилагаемыми чертежами.
Фигуры 1A-1E изображают HLA-независимый основанный на TCR химерный антигенный рецептор HIT (HIT-CAR, т.е. HI-TCR или HIT) и стратегию нацеливания на ген в локусе TRAC в человеческих T-клетках. (A) Схематическое представление T-клеточного рецептора (TCR), B-клеточного рецептора (BCR), химерного антигенного рецептора (CAR) и основанного на TCR HLA-независимого химерного антигенного рецептора (HIT-CAR, т.е. HI-TCR или HIT). (B) Направляемая CRISPR/Cas9 интеграция 3 рецепторов в локус TRAC. Сверху: локус TRAC; посередине: rAAV6, содержащий кассету другого рецептора, фланкированную плечами гомологии. (C) Типичные графики проточной цитометрии TCR/мышиного F(ab')2 через 4 дня после воздействия на TRAC. Антитело к TCR распознает в качестве эпитопа константную цепь TCR альфа и бета. (D) Цитотоксическая активность по результатам 18-часового биолюминесцентного анализа с использованием экспрессирующих люциферазу светлячков (FFL) NALM-6 в качестве клеток-мишеней (n=3). (E) Относительная MFI CAR (1=MFI в 0 ч.) CAR-T-клеток после 1, 2 или 4 (стрелки) стимуляций на CD19-положительных клетках-мишенях.
Фигуры 2A-2B изображают экспрессию и терапевтическую эффективность HI-TCR. (A) Типичные графики проточной цитометрии TCR/мышиного F(ab')2 через 4 дня после воздействия на TRAC. (B) Анализ Каплана-Мейера выживаемости мышей в условиях получения NALM-6-несущими мышами по 5×105 CAR-T-клеток.
Фигуры 3A-3E изображают стратегию нацеливания на ген и экспрессию NYESO TCR. (A) Схематическое представление генов NYESO TCR, интегрированных в альфа или бета цепь TCR. (B) Типичные графики проточной цитометрии TCR-V-бета-1 через 4 дня после воздействия на TRAC или TRBC. (C) Цитотоксическая активность по результатам 18-часового биолюминесцентного анализа с использованием экспрессирующих люциферазу светлячков (FFL) PC3 в качестве клеткок-мишеней (n=3). (D) Схематическое представление совместного нацеливания как на TCR-альфа, так и на TCR-бета. (E) Типичные графики проточной цитометрии TCR-V-бета-1/4-1BBL через 4 дня после совместного нацеливания на TRAC и TRBC.
Фигуры 4A-4C изображают стратегию интегрирования CAR в локус TRAC и модуляцию экспрессии с помощью различных сигналов терминации транскрипции/3'-нетранслируемых областей (3'-UTR). (A) Схематическое представление гена CAR 1928z, интегрированного в локус TRAC. Поли(A) (черная рамка) соответствует сегменту кассеты CAR, который был модифицирован для тестирования различных 3'-UTR вирусов и млекопитающих. (B) Типичные графики проточной цитометрии CAR через 3 дня после TRAC (левая панель) и геометрическое среднее интенсивности флуоресценции (gMFI), MFI и медианные значения для CAR-экспрессирующей популяции (правая панель). В рамке исходная последовательность 3'-UTR поли(A) бычьего гормона роста. (C) Абсолютная (сверху) и относительная (снизу) MFI CAR (1=MFI в 0 ч.) CAR-T-клеток после 1, 2 стимуляций на CD19-положительных клетках-мишенях (как показано на фиг. 1).
Фигуры 5A и 5B изображают эффективность генетически интегрированных CAR с различными последовательностями 3'-UTR. (A) FFL-NALM-6-несущие мыши получали по 1×105 CAR-T-клеток, а опухолевая нагрузка показана как биолюминесцентный сигнал в пересчете на одно животное через 14 дней после введения T-клеток. n=6 мышей на группу. (B) Опухолевая нагрузка (средняя яркость) у NALM-6-несущих мышей, получавших по 1×105 CAR-T-клеток (n=6; линия=одна мышь), количественно определена в дни 7, 14 и 21 после введения T-клеток.
Фигуры 6A-6C изображают нацеливание гена HIT в локус TRAC в человеческих T-клетках. (A) Направляемая CRISPR/Cas9 интеграция гена CAR или HIT в локус TRAC. Сверху локус TRAC; посередине rAAV6, содержащий кассету CAR, фланкированную плечами гомологии; снизу rAAV6, содержащий кассету HIT, фланкированную плечами гомологии. (B) Типичные графики проточной цитометрии CAR/HIT через 4 дня после трансфекции T-клеток мРНК Cas9 и гРНК TRAC и добавления AAV6. Поверхностные белки CAR и HIT детектировали с использованием козьего антимышиного IgG. (C) Среднее значение средней интенсивности флуоресценции (MFI) CAR/HIT по анализу FACS через 4 дня после трансдукции (n=6 независимых экспериментов).
Фигуры 7A-7B показывают, что HIT-T-клетки превосходят CAR-T-клетки в уничтожении клеток-мишеней, экспрессирующих низкие уровни антигенов. Линию клеток Nalm6 (экспрессирующих люциферазу светлячков) подвергали редактированию генома в локусе CD19 с использованием CRISPR/Cas9, и получали клоны, экспрессирующие различные уровни CD19. (A) Анализ FACS типичных клонов Nalm6 для групп с разным уровнем экспрессии CD19 (Neg=отсутствует). (B) Цитотоксическая активность по результатам 4-часового биолюминесцентного анализа с использованием NALM6 в качестве клеткок-мишеней, экспрессирующих различные уровни CD19, и T-клеток с CAR (красные квадраты) или HIT (синие кружки) при отношении эффектор (E): мишень (T) 1:1.
Фигуры 8A-8C показывают, что HIT-T-клетки превосходят CAR-T-клетки в уничтожении клеток-мишеней, экспрессирующих низкие уровни антигенов. Цитотоксическая активность по результатам 18-часового биолюминесцентного анализа с использованием NALM6 в качестве клеткок-мишеней, экспрессирующих различные уровни CD19 (показаны справа), которые инкубировали с нетрансдуцированными T-клетками (A), CAR-T-клетками (B) и HIT-T-клетками (C) при различных отношениях эффектор (E): мишень (T).
Фигуры 9A-9D показывают, что HIT-T-клетки, экспрессирующие костимулирующие лиганды, превосходят CAR-T-клетки в контроле развившейся B-ALL-опухоли с очень низкими уровнями CD19. NALM-6-несущие мыши получали по 4×105 нетрансдуцированных (NT), CAR- или HIT-T-клеток. Опухолевую нагрузку количественно определяли еженедельно в течение 54-дневного периода с использованием BLI. Количественное определение представляет собой среднее количество фотонов, регистрируемых вентрально и дорсально, в расчете на одно животное во все заданные моменты времени. Каждая линия представляет одну мышь, и n=5 мышей на группу. (A) Нетрансдуцированные T-клетки (черные) по сравнению с CAR-T-клетками (красные). (B) CAR-T-клетки (красные) по сравнению с HIT-T-клетками (зеленые). (C) T-клетки, экспрессирующие только HIT (зеленые), HIT+костимулирующий лиганд CD80 (оранжевые), HIT+костимулирующий лиганд 41BBL (розовые) или HIT+костимулирующие лиганды CD80+41BBL (синие). (D) Анализ выживаемости мышей.
Фигуры 10A-10C показывают, что базовую экспрессию TRAC-CAR можно контролировать с помощью последовательностей 3'-UTR, не воздействуя на кинетику восполнения клеточной поверхности после встречи с антигеном. (A) Направляемая CRISPR/Cas9 интеграция гена CAR в локус TRAC. Нацеливающая конструкция (AAV) содержит кодирующую CAR 1928z последовательность, за которой следует последовательность 3'-UTR, фланкированная последовательностями, гомологичными локусу TRAC (LHA и RHA, левое и правое плечи гомологии). (B) Каждая последовательность 3'-UTR обеспечивает разные уровни CAR на поверхности (измерено с помощью FACS). TK: тимидимкиназа (короткий вариант); GCSF: человеческий GCSF, полученный из плазмиды pEF-BOS; TCRa: TCR-альфа, экзон 4; HBB: человеческий B-глобин; RBG: кроличий B-глобин; SV40: поли(A) обезьяньего вируса 40; P2A: саморасщепляющаяся последовательность 2A тешовируса-1 свиньи; это позволило использовать эндогенную поли(A)-последовательность TRAC. (C) CAR-T-клетки стимулировали один раз (указано красной стрелкой) CD19-экспрессирующими клетками 3T3, и измеряли MFI CAR каждые 24 ч. в течение 3-дневного периода. Все CAR-T-клетки демонстрируют сходную регуляцию экспрессии CAR.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Раскрытый в данном документе предмет изобретения предлагает HLA-независимые (или не рестриктированные по HLA) T-клеточные рецепторы (называемые "HI-TCR"), которые связываются с представляющим интерес антигеном HLA-независимым образом. В определенных вариантах осуществления HI-TCR представляют собой молекулы TCR, в которых вариабельный домен TCR заменен вариабельным доменом из антитела (Fv), что приводит к FvTCR. В определенных неограничивающих вариантах осуществления HI-TCR может связываться с опухолевым антигеном или антигеном патогена. Раскрытый в данном документе предмет изобретения также предлагает клетки, включая генетически модифицированные иммунореактивные клетки (например, T-клетки, NKT-клетки или CTL-клетки), содержащие раскрытый в данном документе HI-TCR. В определенных неограничивающих вариантах осуществления связывание HI-TCR антигена способно активировать иммунореактивную клетку. Раскрытый в данном документе предмет изобретения также предлагает способы применения такой клетки для вызывания и/или усиления иммунного ответа на антиген-мишень и/или лечения и/или предупреждения неоплазии или других заболеваний/нарушений, при которых желательно усиление антиген-специфического иммунного ответа.
1. Определения
Если не указано иное, все используемые в настоящем документе технические и научные термины имеют значение, понятное специалисту в данной области техники. Следующие ссылки предоставляют специалисту общее определение многих терминов, используемых в раскрытом в данном документе предмете изобретения: Singleton et al., Dictionary of Microbiology and Molecular Biology (2nd ed. 1994); The Cambridge Dictionary of Science and Technology (Walker ed., 1988); The Glossary of Genetics, 5th Ed., R. Rieger et al. (eds.), Springer Verlag (1991); and Hale & Marham, The Harper Collins Dictionary of Biology (1991). В контексте настоящего документа следующие термины имеют значения, указанные ниже, если не указано иное.
В контексте настоящего документа термин "около" или "приблизительно" означает нахождение в пределах приемлемого диапазона ошибок для конкретного значения, определяемого средним специалистом в данной области техники, который будет зависеть частично от того, как измерено или определено значение, т.е. от ограничений системы измерения. Например, "приблизительно" может означать в пределах 3 или более 3 стандартных отклонений в соответствии с практикой в данной области техники. Альтернативно, "приблизительно" может означать диапазон вплоть до приблизительно 20%, например вплоть до приблизительно 10%, вплоть до приблизительно 5%, или вплоть до приблизительно 1% от заданного значения. Альтернативно, особенно в отношении биологических систем или процессов, этот термин может означать нахождение в пределах порядка величины, например, в пределах приблизительно 5-кратного или в пределах приблизительно 2-кратного значения.
Под "активирует иммунореактивную клетку" понимается индукция передачи сигнала или изменения экспрессии белка в клетке, приводящие к инициированию иммунного ответа. Например, когда цепи CD3 группируются в ответ на связывание лиганда и иммунорецепторные тирозиновые ингибирующие мотивы (ITAM), возникает каскад передачи сигнала. В определенных вариантах осуществления, когда эндогенный TCR или экзогенный CAR связывается с антигеном, происходит формирование иммунологического синапса, который включает в себя скопление множества молекул вблизи связанного рецептора (например, CD4 или CD8, CD3γ/δ/ε /ζ и т.д.). Это скопление связанных с мембраной сигнальных молекул позволяет мотивам ITAM, содержащимся в цепях CD3, фосфорилироваться. Это фосфорилирование, в свою очередь, запускает путь активации Т-клеток, в конечном итоге активируя факторы транскрипции, такие как NF-κB и AP-1. Эти факторы транскрипции индуцируют глобальную экспрессию генов T-клетки для увеличения продукции IL-2 для пролиферации и экспрессии основных регуляторных белков T-клетки, для того чтобы инициировать опосредованный Т-клетками иммунный ответ.
Под "стимулирует иммунореактивную клетку" понимается сигнал, который приводит к надежному и устойчивому иммунному ответу. В различных вариантах осуществления это происходит после активации иммунных клеток (например, T-клеток) или одновременно опосредуется через рецепторы, включая, но без ограничения, CD28, CD137 (4-lBB), OX40, CD40 и ICOS. Получение нескольких стимулирующих сигналов может быть важным для создания надежного и долговременного иммунного ответа, опосредованного Т-клетками. T-клетки могут быстро становиться ингибированными и нечувствительными к антигену. Хотя эффекты этих костимулирующих сигналов могут варьироваться, они обычно приводят к повышенной экспрессии генов для генерации долгоживущих, пролиферативных и антиапоптотических T-клеток, которые надежно реагируют на антиген для его полного и устойчивого уничтожения.
Термин "антиген-распознающий рецептор" в контексте настоящего документа относится к рецептору, который способен активировать иммунную или иммунореактивную клетку (например, T-клетку) в ответ на связывание с антигеном. Неограничивающие примеры антиген-распознающих рецепторов включают нативные или эндогенные T-клеточные рецепторы ("TCR") и химерные антигенные рецепторы ("CAR").
В контексте настоящего документа термин "антитело" означает не только интактные молекулы антител, но также фрагменты молекул антител, которые сохраняют иммуноген-связывающую способность. Такие фрагменты также хорошо известны в данной области техники и регулярно используются как in vitro, так и in vivo. Соответственно, в контексте настоящего документа, термин "антитело" означает не только интактные молекулы иммуноглобулинов, но также хорошо известные активные фрагменты F(ab')2 и Fab. Фрагменты F(ab')2 и Fab, в которых отсутствует фрагмент Fc интактного антитела, быстрее выводятся из кровотока и могут иметь меньшее неспецифическое тканевое связывание, чем интактное антитело (Wahl et al., J. Nucl. Med. 24:316-325 (1983). В контексте настоящего документа антитела включают цельные нативные антитела, биспецифические антитела; химерные антитела; Fab, Fab', одноцепочечные фрагменты V-области (scFv), слитые полипептиды и нетрадиционные антитела. В определенных вариантах осуществления антитело представляет собой гликопротеин, содержащий по меньшей мере две тяжелые (H) цепи и две легкие (L) цепи, соединенные дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно обозначаемой в настоящем документе VH) и константной (CH) области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно обозначаемой в настоящем документе VL) и константной CL области легкой цепи. Константная область легкой цепи состоит из одного домена CL. Области VH и VL могут быть дополнительно подразделены на гипервариабельные области, называемые определяющими комплементарность областями (CDR), перемежающиеся с более консервативными областями, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца до карбокси-конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (C1 q) классической системы комплемента.
В контексте настоящего документа "CDR" определяются как аминокислотные последовательности определяющих комплементарность областей антитела, которые представляют собой гипервариабельные области тяжелой и легкой цепей иммуноглобулина. Смотри, например, Kabat et al., Sequences of Proteins of Immunological Interest, 4th U. S. Department of Health and Human Services, National Institutes of Health (1987). Обычно антитела содержат в вариабельной области три CDR или области CDR в тяжелой цепи и три в легкой цепи. CDR обеспечивают большинство контактных остатков для связывания антитела с антигеном или эпитопом. В определенных вариантах осуществления области CDR оозначают с использованием системы Кабата (Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication № 91-3242).
В контексте настоящего документа термин "одноцепочечный вариабельный фрагмент" или "scFv" представляет собой слитый белок вариабельных областей тяжелой (VH) и легкой цепей (VL) иммуноглобулина, ковалентно связанных с образованием гетеродимера VH::VL. VH и VL или соединены непосредственно, соединены кодирующим пептид линкером (например, 10, 15, 20, 25 аминокислот), который соединяет N-конец VH с C-концом VL или C-конец VH с N-концом VL. Линкер обычно богат глицином для гибкости, а также серином или треонином для растворимости. Несмотря на удаление константных областей и введение линкера, белки scFv сохраняют специфичность исходного иммуноглобулина. Антитела-одноцепочечные полипептиды Fv могут экспрессироваться из нуклеиновой кислоты, включая кодирующие VH и VL последовательности, как описано Huston, et al. (Proc. Nat. Acad. Sci. USA, 85:5879-5883, 1988). Смотри также патенты США №№ 5091513, 5132405 и 4956778; и патентные публикации США №№ 20050196754 и 20050196754. Описаны антагонистические scFv, обладающие ингибирующей активностью (смотри, например, Zhao et al., Hyrbidoma (Larchmt) 2008 27(6):455-51; Peter et al., J Cachexia Sarcopenia Muscle 2012 August 12; Shieh et al., J Imunol. 2009 183(4):2277-85; Giomarelli et al., Thromb Haemost 2007 97(6):955-63; Fife eta., J Clin Invst 2006 116(8):2252-61; Brocks et al., Immunotechnology 1997 3(3):173-84; Moosmayer et al., Ther Immunol 1995 2(10:31-40). Описаны агонистические scFv, обладающие стимулирующей активностью (смотри, например, Peter et al., J Bioi Chern 2003 25278(38):36740-7; Xie et al., Nat Biotech 1997 15(8):768-71; Ledbetter et al., Crit Rev Immunol. 1997 17(5-6):427-55; Ho et al., BioChim Biophys Acta 2003 1638(3):257-66).
В контексте настоящего документа термин "аффинность" означает меру силы связывания. Аффинность может зависеть от близости стереохимического соответствия между связывающими центрами антител и антигенными детерминантами, от размера области контакта между ними и/или от распределения заряженных и гидрофобных групп. В контексте настоящего документа термин "аффинность" также включает в себя термин "авидность", который относится к силе связи антиген-антитело после образования обратимых комплексов. В данной области техники известны способы расчета аффинности антитела к антигену, включая, но без ограничения, различные эксперименты по связыванию антигена, например функциональные анализы (например, анализ с помощью проточной цитометрии).
Термин "химерный антигенный рецептор" или "CAR" в контексте настоящего документа относится к молекуле, содержащей внеклеточный антигенсвязывающий домен, слитый с внутриклеточным сигнальным доменом, который способен активировать или стимулировать иммунореактивную клетку, и трансмембранный домен. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен CAR содержит scFv. scFv может быть получен путем слияния вариабельных тяжелой и легкой областей антитела. Альтернативно или дополнительно, scFv может быть получен из Fab (а не из антитела, например, получен из библиотек Fab). В определенных вариантах осуществления scFv слит с трансмембранным доменом, а затем с внутриклеточным сигнальным доменом. В определенных вариантах осуществления CAR имеет высокую аффинность или авидность связывания с антигеном.
В контексте настоящего документа термин "молекулы нуклеиновой кислоты" включает любую молекулу нуклеиновой кислоты, которая кодирует представляющий интерес полипептид или его фрагмент. Такие молекулы нуклеиновой кислоты не обязательно должны быть на 100% гомологичны или идентичны эндогенной последовательности нуклеиновой кислоты, но могут проявлять идентичность по существу. Полинуклеотиды, обладающие "идентичностью по существу" или "гомологией по существу" с эндогенной последовательностью, обычно способны гибридизоваться по меньшей мере с одной цепью двухцепочечной молекулы нуклеиновой кислоты. Под "гибридизацией" понимается пара для образования двухцепочечной молекулы из комплементарных полинуклеотидных последовательностей (например, ген описанный в настоящем документе) или их частей при различных условиях строгости. (Смотри, например, Wahl, G. М. and S. L. Berger (1987) Methods Enzymol. 152:399; Kimmel, A. R. (1987) Methods Enzymol. 152:507).
Например, концентрация соли в жестких условиях обычно составляет менее приблизительно 750 мМ NaCl и 75 мМ цитрата тринатрия, например менее приблизительно 500 мМ NaCl и 50 мМ цитрата тринатрия или менее приблизительно 250 мМ NaCl и 25 мМ цитрата тринатрия. Гибридизация в условиях низкой жесткости может быть получена в отсутствие органического растворителя, например формамида, тогда как гибридизация в условиях высокой жесткости может быть получена в присутствии по меньшей мере приблизительно 35% формамида, например по меньшей мере приблизительно 50% формамида. Жесткие условия по температуре обычно включают температуры по меньшей мере приблизительно 30°C, по меньшей мере приблизительно 37°C или по меньшей мере приблизительно 42°C. Варьирование дополнительных параметров, таких как время гибридизации, концентрация детергента, например додецилсульфата натрия (ДСН), и включение или исключение ДНК-носителя, хорошо известны специалистам в данной области техники. Различные уровни жесткости достигаются путем комбинирования этих различных условий по мере необходимости. В определенных вариантах осуществления гибридизация происходит при 30°C в 750 мМ NaCl, 75 мМ цитрата тринатрия и 1% ДСН. В определенных вариантах осуществления гибридизация происходит при 37°C в 500 мМ NaCl, 50 мМ цитрата тринатрия, 1% ДСН, 35% формамида и 100 мкг/мл денатурированной ДНК из молок лососевых (млДНК). В определенных вариантах осуществления гибридизация происходит при 42°C в 250 мМ NaCl, 25 мМ цитрата тринатрия, 1% ДСН, 50% формамида и 200 мкг/мл млДНК. Полезные варианты этих условий будут очевидны специалистам в данной области техники.
Для большинства применений этапы промывания, следующие за гибридизацией, также будут различаться по жесткости. Условия жесткости промывания могут определяться концентрацией соли и температурой. Как указано выше, жесткость промывания может быть увеличена за счет уменьшения концентрации соли или повышения температуры. Например, концентрация соли в жестких условиях для этапов промывания может составлять менее приблизительно 30 мМ NaCl и 3 мМ цитрата тринатрия, например менее приблизительно 15 мМ NaCl и 1,5 мМ цитрата тринатрия. Жесткие условия по температуре для этапов промывания обычно включают температуру по меньшей мере приблизительно 25°C, по меньшей мере приблизительно 42°C или по меньшей мере приблизительно 68°C. В определенных вариантах осуществления этапы промывания происходят при 25°C в 30 мМ NaCl, 3 мМ цитрата тринатрия и 0,1% ДСН. В определенных вариантах осуществления этапы промывания происходят при 42°C в 15 мМ NaCl, 1,5 мМ цитрата тринатрия и 0,1% ДСН. В определенных вариантах осуществления этапы промывания происходят при 68°C в 15 мМ NaCl, 1,5 мМ цитрата тринатрия и 0,1% ДСН. Дополнительные вариации этих условий будут очевидны специалистам в данной области техники. Методы гибридизации хорошо известны специалистам в данной области техники и описаны, например, в документах Benton and Davis (Science 196:180, 1977); Grunstein and Rogness (Proc. Natl. Acad. Sci., USA 72:3961, 1975); Ausubel et al. (Current Protocols in Molecular Biology, Wiley Interscience, New York, 2001); Berger and Kimmel (Guide to Molecular Cloning Techniques, 1987, Academic Press, New York); and Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York.
Под "по существу идентичными" или "по существу гомологичными" понимаются полипептид или молекула нуклеиновой кислоты по меньшей мере приблизительно на 50% гомологичные или идентичные эталонным аминокислотной последовательности (например, любой из аминокислотных последовательностей, описанных в настоящем документе) или последовательности нуклеиновой кислоты (например, любой из последовательностей нуклеиновой кислоты, описанных в настоящем документе). В определенных вариантах осуществления такая последовательность по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 65%, по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95%, по меньшей мере приблизительно на 99% или по меньшей мере приблизительно на 100% гомологична или идентична последовательности аминокислот или нуклеиновой кислоты, используемой для сравнения.
Идентичность последовательностей можно измерять с помощью программного обеспечения для анализа последовательностей (например, пакета программного обеспечения для анализа последовательностей Genetics Computer Group, University of Wisconsin Biotechnology Center, 1710 University Avenue, Madison, Wis. 53705, программ BLAST, BESTFIT, GAP или PILEUP/PRETTYBOX). Такое программное обеспечение сопоставляет идентичные или похожие последовательности, присваивая степени гомологии различным заменам, делециям и/или другим модификациям. Консервативные замены обычно включают замены в следующих группах: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин; серин, треонин; лизин, аргинин; и фенилаланин, тирозин. В типичном подходе к определению степени идентичности можно использовать программу BLAST, причем оценка вероятности между e-3 и e-100 указывает на родственную последовательность.
Под "аналогом" понимается структурно родственные полипептид или молекула нуклеиновой кислоты, имеющие функцию эталонных полипептида или молекулы нуклеиновой кислоты.
Термин "лиганд" в контексте настоящего документа относится к молекуле, которая связывается с рецептором. В определенных вариантах осуществления лиганд связывается с рецептором на другой клетке, обеспечивая распознавание и/или взаимодействие клетка-клетка.
Термин "конститутивная экспрессия" или "конститутивно экспрессируется" в контексте настоящего документа относится к экспрессии при всех физиологических условиях.
Под "заболеванием" понимается любое состояние, заболевание или нарушение, которое повреждает или препятствует нормальному функционированию клетки, ткани или органа, например неоплазию и патогенную инфекцию клетки.
Под "эффективным количеством" понимается количество, достаточное для терапевтического эффекта. В определенных вариантах осуществления "эффективное количество" представляет собой количество, достаточное для остановки, улучшения или ингибирования продолжающейся пролиферации, роста или метастазирования (например, инвазии или миграции) неоплазии.
Под "усилением толерантности" понимается предотвращение активности аутореактивных клеток или иммунореактивных клеток, которые нацелены на трансплантированные органы или ткани.
Под "эндогенными" понимаются молекула нуклеиновой кислоты или полипептид, которые обычно экспрессируются в клетке или ткани.
Под "экзогенными" понимаются молекула нуклеиновой кислоты или полипептид, которые эндогенно не присутствуют в клетке или не присутствуют на уровне, достаточном для достижения функциональных эффектов, получаемых при сверхэкспрессии. Термин "экзогенный", следовательно, охватывает любые рекомбинантные молекулу нуклеиновой кислоты или полипептид, экспрессируемые в клетке, такие как чужеродные, гетерологичные и сверхэкспрессируемые молекулы нуклеиновой кислоты и полипептиды. Под "экзогенной" нуклеиновой кислотой понимается нуклеиновая кислота, не присутствующая в нативной клетке дикого типа; например, экзогенная нуклеиновая кислота может отличаться от эндогенного аналога по последовательности, положению/местоположению или и по тому, и по другому. Для ясности, экзогенная нуклеиновая кислота может иметь такую же или другую последовательность по сравнению со своим природным эндогенным аналогом; она может быть введена с помощью генной инженерии в саму клетку или в ее предшественник и может, необязательно, быть связана с альтернативными контрольными последовательностями, такими как ненативные промотор или секреторная последовательность.
Под "гетерологичными молекулой нуклеиновой кислоты или полипептидом" понимается молекула нуклеиновой кислоты (например, молекула кДНК, ДНК или РНК) или полипептид, которые обычно не присутствуют в клетке или образце полученном из клетки. Эта нуклеиновая кислота может происходить из другого организма или может представлять собой, например, молекулу мРНК, которая обычно не экспрессируется в клетке или образце.
Под "иммунореактивной клеткой" понимается клетка, которая функционирует в иммунном ответе, или ее предшественник или потомство.
Под "модулированием" понимается положительное или отрицательное изменение. Примеры модуляции включают изменение приблизительно на 1%, приблизительно на 2%, приблизительно на 5%, приблизительно на 10%, приблизительно на 25%, приблизительно на 50%, приблизительно на 75% или приблизительно на 100%.
Под "увеличением" понимается положительное изменение по меньшей мере приблизительно на 5%. Изменение может составлять приблизительно 5%, приблизительно 10%, приблизительно 25%, приблизительно 30%, приблизительно 50%, приблизительно 75%, приблизительно 100% или более.
Под "уменьшением" понимается отрицательное изменение по меньшей мере приблизительно на 5%. Изменение может составлять приблизительно 5%, приблизительно 10%, приблизительно 25%, приблизительно 30%, приблизительно 50%, приблизительно 75% или даже приблизительно 100%.
Под "выделенной клеткой" понимается клетка, отделенная от молекулярных и/или клеточных компонентов, которые сопровождают клетку в естественных условиях.
Термины "выделенный", "очищенный" или "биологически чистый" относятся к материалу, в различной степени свободному от компонентов, которые обычно его сопровождают в его естественном состоянии. "Выделение" означает степень отделения от исходного источника или окружающей среды. "Очистка" означает более высокую степень отделения, чем выделение. "Очищенный" или "биологически чистый" белок по существу свободен от других материалов, так что любые примеси не оказывают существенного влияния на биологические свойства белка и не вызывают других неблагоприятных последствий. То есть нуклеиновая кислота или пептид являются очищенными, если они по существу свободны от клеточного материала, вирусного материала или культуральной среды при получении с помощью методов рекомбинантной ДНК или от химических предшественников или других химикатов при химическом синтезе. Чистоту и гомогенность обычно определяют с использованием методов аналитической химии, например электрофореза в полиакриламидном геле или высокоэффективной жидкостной хроматографии. Термин "очищенный" может означать, что нуклеиновая кислота или белок дают по существу одну полосу в электрофоретическом геле. Для белка, который может быть подвергнут модификациям, например фосфорилированию или гликозилированию, различные модификации могут приводить к различным выделенным белкам, которые можно очищать отдельно.
Термин "антигенсвязывающий домен" в контексте настоящего документа относится к домену, способному специфически связывать конкретную антигенную детерминанту или набор антигенных детерминант, присутствующих на клетке.
"Линкер" в контексте настоящего документа должен означать функциональную группу (например, химическую или полипептидную), которая ковалентно соединяет два или более полипептидов или нуклеиновых кислот, так что они связаны друг с другом. В контексте настоящего документа "пептидный линкер" относится к одной или более аминокислотам, используемым для соединения двух белков вместе (например, для соединения доменов VH и VL). В определенных вариантах осуществления линкер содержит последовательность GGGGSGGGGSGGGGS [SEQ ID NO: 31].
Под "новообразованием" понимается заболевание, характеризующееся патологической пролиферацией клетки или ткани и ее последующей миграцией или инвазией в другие ткани или органы. Рост неоплазии обычно является неконтролируемым и прогрессирующим и происходит в условиях, которые не вызывают размножение нормальных клеток или могут вызвать его прекращение. Неоплазия может поражать различные типы клеток, ткани или органы, включая, но без ограничения, органы, выбранные из группы, состоящей из мочевого пузыря, кости, головного мозга, молочной железы, хряща, глии, пищевода, маточной трубы, желчного пузыря, сердца, кишечника, почки, печени, легкого, лимфатического узла, нервной ткани, яичников, поджелудочной железы, предстательной железы, скелетных мышц, кожи, спинного мозга, селезенки, желудка, яичек, тимуса, щитовидной железы, трахеи, мочеполового тракта, мочеточника, уретры, матки и влагалища, или их ткань или тип клеток. К неоплазиям относятся раки, такие как саркомы, карциномы или плазмоцитомы (злокачественная опухоль плазматических клеток). В определенных вариантах осуществления новообразование представляет собой солидную опухоль.
Типичные новообразования, для которых можно использовать раскрытый в данном документе предмет изобретения, включают, но без ограничения, лейкозы (например, острый лейкоз, острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз, острый миелобластный лейкоз, острый промиелоцитарный лейкоз, острый миеломоноцитарный лейкоз, острый моноцитарный лейкоз, острый эритролейкоз, хронический лейкоз, хронический миелоцитарный лейкоз, хронический лимфоцитарный лейкоз), истинную полицитемию, лимфому (болезнь Ходжкина, неходжкинское заболевание), макроглобулинемию Вальденстрема, болезнь тяжелых цепей и содидные опухоли, такие как саркомы и карциномы (например, фибросаркому, миксосаркому, липосаркому, хондросаркому, остеогенную саркому, хордому, ангиосаркому, эндотелиосаркому, лимфангиосаркому, лимфангиоэндотелиосаркому, синовиому, мезотелиому, опухоль Юинга, лейомиосаркому, рабдомиосаркому, карциному толстой кишки, рак поджелудочной железы, рак молочной железы, рак яичников, рак предстательной железы, плоскоклеточную карциному, базальноклеточную карциному, аденокарциному, карциному потовых желез, карциному сальных желез, папиллярную карциному, папиллярные аденокарциномы, цистаденокарциному, медуллярную карциному, бронхогенную карциному, почечно-клеточную карциному, гепатому, карциному желчного протока, хориокарциному, семиному, эмбриональную карциному, опухоль Вильмса, рак шейки матки, рак матки, рак яичек, карциному легкого, мелкоклеточную карциному легкого, карциному мочевого пузыря, эпителиальную карциному, глиому, астроцитому, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, акустическую неврому, олигоденроглиому, шванному, менингиому, меланому, нейробластому и ретинобластому).
Под "рецептором" понимается полипептид или его часть, присутствующие на клеточной мембране, которые селективно связывают один или более лигандов.
Под "распознаванием" понимается селективное связывание с мишенью. T-клетка, которая распознает опухоль, может экспрессировать рецептор (например, TCR или CAR), который связывается с опухолевым антигеном.
Под "эталоном" или "контролем" понимается стандарт сравнения. Например, уровень связывания scFv-антиген клеткой, экспрессирующей CAR и scFv, можно сравнить с уровнем связывания scFv-антиген в соответствующей клетке, экспрессирующей только CAR.
Под "секретируемым" понимается полипептид, который высвобождается из клетки через секреторный путь через эндоплазматический ретикулум, аппарат Гольджи и в виде везикулы, которая временно сливается с плазматической мембраной клетки, высвобождая белки за пределы клетки.
Под "сигнальной последовательностью" или "лидерной последовательностью" понимается пептидная последовательность (например, 5, 10, 15, 20, 25 или 30 аминокислот), присутствующая на N-конце вновь синтезированных белков, которая направляет их вход в секреторный путь. Примеры лидерных последовательностей включают, но без ограничения, сигнальную последовательность IL-2: MYRMQLLSCIALSLALVTNS [SEQ ID NO: 12] (человек), MYSMQLASCVTLTLVLLVNS [SEQ ID NO: 13] (мышь); лидерную последовательность каппа: METPAQLLFLLLLWLPDTTG [SEQ ID NO: 14] (человек), METDTLLLWVLLLWVPGSTG [SEQ ID NO: 15] (мышь); лидерную последовательность CD8: MALPVTALLLPLALLLHAARP [SEQ ID NO: 16] (человек); усеченный человеческий сигнальный пептид CD8: MALPVTALLLPLALLLHA [SEQ ID NO: 28] (человек); сигнальную последовательность альбумина: MKWVTFISLLFSSAYS [SEQ ID NO: 29] (человек); и сигнальную последовательность пролактина: MDSKGSSQKGSRLLLLLVVSNLLLCQGVVS [SEQ ID NO: 30] (человек). Под "растворимым" понимается полипептид, который легко диффундирует в водной среде (например, не связанный с мембраной).
Под "специфически связывает" понимается полипептид или его фрагмент, который распознает и связывается с представляющей интерес биологической молекулой (например, полипептидом), но который по существу не распознает и не связывает другие молекулы в образце, например биологическом образце, который в естественных условиях включает в себя раскрытый в данном документе полипептид.
Термин "опухолевый антиген" в контексте настоящего документа относится к антигену (например, полипептиду), который уникально или дифференциально экспрессируется на опухолевой клетке по сравнению с нормальной или не неопластической клеткой. В определенных вариантах осуществления опухолевый антиген включает любой полипептид, экспрессируемый опухолью, который способен активировать или вызывать иммунный ответ через антиген-распознающий рецептор (например, CD19, MUC-16) или способен подавлять иммунный ответ посредством связывания рецептор-лиганд (например, CD47, PD-Ll/L2, B7.1/2).
Предполагается, что термины "содержит", "содержащий" имеют широкое значение, приписываемое им в патентном законе США, и могут означать "включает в себя", "включая" и т.п.
В контексте настоящего документа "лечение" относится к клиническому вмешательству в попытке изменить течение заболевания индивидуума или клетки, подвергаемых лечению, и может проводиться или для профилактики, или во время курса клинической патологии. Терапевтические эффекты лечения включают, без ограничения, предотвращение возникновения или рецидива заболевания, облегчение симптомов, уменьшение любых прямых или косвенных патологических последствий заболевания, предотвращение метастазов, снижение скорости прогрессирования заболевания, улучшение или временное смягчение болезненного состояния и ремиссию или улучшенный прогноз. Предотвращая прогрессирование заболевания или нарушения, лечение может предотвращать ухудшение из-за нарушения у пораженного или диагностированного субъекта или субъекта, у которого подозревают наличие нарушения, но также лечение может предотвращать начало нарушения или симптома нарушения у субъекта, имеющего риск нарушения, или у которого подозревают наличие нарушения.
"Индивидуумом" или "субъектом" в настоящем документе является позвоночное, такое как человек или животное, не являющееся человеком, например млекопитающее. Млекопитающие включают, но без ограничения, людей, приматов, сельскохозяйственных животных, спортивных животных, грызунов и домашних животных. Неограничивающие примеры животных, не являющихся человеком, включают грызунов, таких как мыши, крысы, хомяки и морские свинки; кролики; собаки; кошки; овцы; свиньи; козы; крупный рогатый скот; лошади; и не являющиеся человеком приматы, такие как обезьяны и мартышки.
Термин "иммунокомпрометированный" в контексте настоящего документа относится к субъекту, у которого есть иммунодефицит. Такой субъект очень уязвим для оппортунистических инфекций, инфекций, вызываемых организмами, которые обычно не вызывают заболевания у человека со здоровой иммунной системой, но могут поражать людей с плохо функционирующей или подавленной иммунной системой.
Другие аспекты раскрытого в данном документе предмета изобретения описаны в нижеследующем раскрытии и находятся в пределах объема раскрытого в данном документе предмета изобретения.
2. HLA-независимый T-клеточный рецептор (HI-TCR)
Настоящее раскрытие предлагает HI-TCR, который связывается с представляющим интерес антигеном HLA-независимым образом. В определенных неограничивающих вариантах осуществления связывание антигена способно активировать иммунореактивную клетку, содержащую HI-TCR. В определенных неограничивающих вариантах осуществления HI-TCR содержит антигенсвязывающую цепь. В определенных вариантах осуществления антигенсвязывающая цепь содержит внеклеточный антигенсвязывающий домен. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен происходит из scFv, Fab или антитела мышиного, человеческого или верблюжьего (например, из ламы) происхождения. В определенных вариантах осуществления антигенсвязывающая цепь дополнительно содержит константный домен.
2.1. Антигены
В определенных вариантах осуществления HI-TCR связывается с опухолевым антигеном. В связанных с опухолью вариантах осуществления, описанных в настоящем документе, можно использовать любой опухолевый антиген (антигенный пептид). Источники антигена включают, но без ограничения, раковые белки. Антиген может экспрессироваться в форме пептида или в форме интактного белка или его части. Интактный белок или его часть могут быть нативными или мутагенизированными. Неограничивающие примеры опухолевых антигенов включают карбоангидразу IX (CAlX), карциноэмбриональный антиген (CEA), CD8, CD7, CD10, CD19, CD20, CD22, CD30, CD33, CLL1, CD34, CD38, CD41, CD44, CD49f, CD56, CD74, CD133, CD138, CD123, CD44V6, антиген инфицированной цитомегаловирусом (CMV) клетки (например, антиген клеточной поверхности), эпителиальный гликопротеин-2 (EGP-2), эпителиальный гликопротеин-40 (EGP-40), эпителиальную молекулу клеточной адгезии (EpCAM), рецепторные тирозиновые протеинкиназы erb-B234 (erb-B234), связывающий фолат белок (FBP), фетальный ацетилхолиновый рецептор (AChR), фолатный рецептор-α, ганглиозид G2 (GD2), ганглиозид G3 (GD3), человеческий рецептор-2 эпидермального фактора роста (HER-2), человеческую теломеразную обратную транскриптазу (hTERT), субъединицу альфа-2 рецептора интерлейкина-13 (IL-13Rα2), легкую цепь κ, содержащий домен с киназной вставкой рецептор (KDR), льюис Y (LeY), молекулу клеточной адгезии L1 (L1CAM), семейство A антигенов меланомы, 1 (MAGE-A1), муцин 16 (MUC16), муцин 1 (MUC1), мезотелин (MSLN), ERBB2, MAGEA3, p53, MART1, GP100, протеиназу 3 (PR1), тирозиназу, сурвивин, hTERT, EphA2, лиганды NKG2D, раково-тестикулярный антиген NY-ESO-1, онкофетальный антиген (h5T4), антиген стволовых клеток предстательной железы (PSCA), простатспецифический мембранный антиген (PSMA), ROR1, опухоль-ассоциированный гликопротеин 72 (TAG-72), фактор роста эндотелия сосудов R2 (VEGF-R2) и белок опухоли Вильмса (WT-1), BCMA, NKCS1, EGF1R, EGFR-VIII, CD99, CD70, ADGRE2, CCR1, LILRB2, LILRB4, PRAME и ERBB.
В определенных вариантах осуществления HI-TCR связывается с CD19. В определенных вариантах осуществления HI-TCR связывается с человеческим полипептидом CD19. В определенных вариантах осуществления человеческий полипептид CD19 содержит аминокислотную последовательность, приведенную в SEQ ID NO: 11.
PEEPLVVKVEEGDNAVLQCLKGTSDGPTQQLTWSRESPLKPFLKLSLGLPGLGIHMRPLAIWLFIFNVSQQMGGFYLCQPGPPSEKAWQPGWTVNVEGSGELFRWNVSDLGGLGCGLKNRSSEGPSSPSGKLMSPKLYVWAKDRPEIWEGEPPCLPPRDSLNQSLSQDLTMAPGSTLWLSCGVPPDSVSRGPLSWTHVHPKGPKSLLSLELKDDRPARDMWVMETGLLLPRATAQDAGKYYCHRGNLTMSFHLEITARPVLWHWLLRTGGWK [SEQ ID NO: 11].
В определенных вариантах осуществления HI-TCR связывается с внеклеточным доменом белка CD19.
В определенных вариантах осуществления HI-TCR связывается с антигеном патогена, например для применения в лечении и/или предупреждении патогенной инфекции или другого инфекционного заболевания, например у иммунокомпрометированного субъекта. Неограничивающие примеры патогенов включает вирусы, бактерии, грибы, паразиты и простейшие, способные вызывать заболевание.
Неограничивающие примеры вирусов включают Retroviridae (например, вирусы иммунодефицита человека, такие как HIV-1 (также называемый HDTV-III, LAVE или HTLV-III/LAV) или HIV-III; и другие изоляты, такие как HIV-LP; Picornaviridae (например, полиовирусы, вирус гепатита A; энтеровирусы, вирусы Коксаки человека, риновирусы, эховирусы); Calciviridae (например, штаммы, вызывающие гастроэнтерит); Togaviridae (например, вирусы лошадиного энцефалита, вирусы краснухи); Flaviridae (например, вирусы денге, вирусы энцефалита, вирусы желтой лихорадки); Coronoviridae (например, коронавирусы); Rhabdoviridae (например, вирусы везикулярного стоматита, вирусы бешенства); Filoviridae (например, вирусы Эбола); Paramyxoviridae (например, вирусы парагриппа, вирус паротита, вирус кори, респираторно-синцитиальный вирус); Orthomyxoviridae (например, вирусы гриппа); Bungaviridae (например, вирусы Хантаан, бунгавирусы, флебовирусы и найровирусы); Arena viridae (вирусы геморрагической лихорадки); Reoviridae (например, реовирусы, орбивирусы и ротавирусы); Birnaviridae; Hepadnaviridae (вирус гепатита B); Parvovirida (парвовирусы); Papovaviridae (вирусы папилломы, вирусы полиомы); Adenoviridae (большинство аденовирусов); Herpesviridae (вирус простого герпеса (HSV) 1 и 2, вирус ветряной оспы, цитомегаловирус (CMV), вирус герпеса); Poxviridae (вирусы натуральной оспы, вирусы осповакцины, поксвирусы); и Iridoviridae (например, вирус африканской чумы свиней); и неклассифицированные вирусы (например, возбудитель дельта-гепатита (считается дефектным спутником вируса гепатита B), возбудители ни A, ни B гепатита (класс 1=внутренне передаваемый; класс 2=парентерально передаваемый, т.е. гепатит C); вирус Норуолк и родственные вирусы и астровирусы).
Неограничивающие примеры бактерий включают Pasteurella, Staphylococci, Streptococcus, Escherichia coli, виды Pseudomonas и виды Salmonella. Конкретные примеры инфекционных бактерий включают, но без ограничения, Helicobacter pyloris, Borelia burgdorferi, Legionella pneumophilia, виды Mycobacteria (например М. tuberculosis, М. avium, М. intracellulare, М. kansaii, М. gordonae), Staphylococcus aureus, Neisseria gonorrhoeae, Neisseria meningitidis, Listeria monocytogenes, Streptococcus pyogenes (стрептококки группы A), Streptococcus agalactiae (стрептококки группы B), Streptococcus (группа вириданс), Streptococcus faecalis, Streptococcus bovis, Streptococcus (анаэробные виды), Streptococcus pneumoniae, патогенные виды Campylobacter, виды Enterococcus, Haemophilus influenzae, Bacillus antracis, corynebacterium diphtheriae, виды corynebacterium, Erysipelothrix rhusiopathiae, Clostridium perfringers, Clostridium tetani, Enterobacter aerogenes, Klebsiella pneumoniae, Pasturella multocida, виды Bacteroides, Fusobacterium nucleatum, Streptobacillus moniliformis, Treponema pallidium, Treponema pertenue, Leptospira, Rickettsia и Actinomyces israelli.
В определенных вариантах осуществления антиген патогена представляет собой вирусный антиген, присутствующий в цитомегаловирусе (CMV), вирусный антиген, присутствующий в вирусе Эпштейна-Барр (EBV), вирусный антиген, присутствующий в вирусе иммунодефицита человека (HIV) или вирусный антиген, присутствующий в вирусе гриппа.
2.2. Внеклеточный антигенсвязывающий домен
В определенных вариантах осуществления антигенсвязывающая цепь содержит внеклеточный антигенсвязывающий домен. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен специфически связывается с антигеном, например опухолевым антигеном или антигеном патогена, например с антигенами, раскрытыми в разделе 2.1. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен способен к димеризации с другим внеклеточным антигенсвязывающим доменом (например, к образованию вариабельного фрагмента (Fv)), причем димеризованные антигенсвязывающие домены (например, Fv) специфически связываются с антигеном, например опухолевым антигеном или антигеном патогена.
В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит лиганд рецептора клеточной поверхности. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит рецептор лиганда клеточной поверхности.
В определенных вариантах осуществления внеклеточный антигенсвязывающий домен специфически связывается с антигеном, например опухолевым антигеном или антигеном патогена. В определенных вариантах осуществления антигенсвязывающая цепь способна образовывать димер с другой антигенсвязывающей цепью. В определенных вариантах осуществления HI-TCR содержит гетеродимер, содержащий две различные антигенсвязывающие цепи. В определенных вариантах осуществления HI-TCR содержит гомодимер, содержащий две идентичные антигенсвязывающие цепи. В определенных вариантах осуществления антигенсвязывающие цепи димеризуются через одну или более дисульфидных связей. В определенных вариантах осуществления антигенсвязывающая цепь способна образовывать тример или олигомер с одной или более идентичными или различными антигенсвязывающими цепями. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен способен к димеризации с другим внеклеточным антигенсвязывающим доменом (например, к образованию вариабельного фрагмента (Fv)), причем димеризованные антигенсвязывающие домены (например, Fv) специфически связываются с антигеном, например опухолевым антигеном или антигеном патогена.
В определенных неограничивающих вариантах осуществления внеклеточный антигенсвязывающий домен HI-TCR (например, Fv или его аналог) связывается с антигеном с константой диссоциации (Kd) приблизительно 2×10-7 М или менее. В определенных вариантах осуществления Kd составляет приблизительно 2×10-7 М или менее, приблизительно 1×10-7 М или менее, приблизительно 9×10-8 М или менее, приблизительно 1×10-8 М или менее, приблизительно 9×10-9 М или менее, приблизительно 5×10-9 М или менее, приблизительно 4×10-9 М или менее, приблизительно 3×10-9 или менее, приблизительно 2×10-9 М или менее или приблизительно 1×10-9 М или менее. В определенных неограничивающих вариантах осуществления Kd составляет приблизительно 3×10-9 М или менее. В определенных неограничивающих вариантах осуществления Kd составляет от приблизительно 1×10-9 М до приблизительно 3×10-7 М. В определенных неограничивающих вариантах осуществления Kd составляет от приблизительно 1,5×10-9 М до приблизительно 3×10-7 М. В определенных неограничивающих вариантах осуществления Kd составляет от приблизительно 1,5×10-9 М до приблизительно 2,7×10-7 М.
Связывание внеклеточного антигенсвязывающего домена (например, Fv или его аналога) может быть подтверждено, например, с помощью твердофазного иммуноферментного анализа (ELISA), радиоиммуноанализа (RIA), анализа FACS, биотеста (например, ингибирования роста) или Вестерн-блоттинга. Каждый из этих анализов обычно выявляет присутствие комплексов белок-антитело, представляющих особый интерес, с использованием меченого реагента (например, антитела или Fv), специфичного к представляющему интерес комплексу. Например, Fv можно радиоактивно пометить и использовать в радиоиммуноанализе (RIA) (смотри, например, документ Weintraub, B., Principles of Radioimmunoassays, Seventh Training Course on Radioligand Assay Techniques, The Endocrine Society, March, 1986, который включен в настоящий документ посредством ссылки). Радиоактивный изотоп может быть обнаружен с помощью таких средств, как γ-счетчик или сцинтилляционный счетчик, или с помощью авторадиографии. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен помечают флуоресцентным маркером. Неограничивающие примеры флуоресцентных маркеров включают зеленый флуоресцентный белок (GFP), синий флуоресцентный белок (например, EBFP, EBFP2, Azurite и mKalama1), голубой флуоресцентный белок (например, ECFP, Cerulean и CyPet) и желтый флуоресцентный белок (например, YFP, Citrine, Venus и YPet).
В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит антигенсвязывающую часть TCR.
В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит антигенсвязывающую часть антитела или его фрагмента. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит вариабельную область тяжелой цепи (VH) и/или вариабельную область легкой цепи (VL) антитела. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит одноцепочечный вариабельный фрагмент (scFv). В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит антитела только с тяжелой цепью (VHH). В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит Fab, который, необязательно, сшит. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит F(ab)2. В определенных вариантах осуществления любая из вышеупомянутых молекул может содержаться в слитом белке с гетерологичной последовательностью для образования внеклеточного антигенсвязывающего домена.
В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит вариабельную область тяжелой цепи (VH) и/или вариабельную область легкой цепи (VL) антитела, причем VH или VL способны к димеризации с другим внеклеточным антигенсвязывающим доменом, содержащим VL или VH (например, с образованием вариабельного фрагмента (Fv)). В определенных вариантах осуществления Fv представляет собой человеческий Fv. В определенных вариантах осуществления Fv представляет собой гуманизированный Fv. В определенных вариантах осуществления Fv представляет собой мышиный Fv. В определенных вариантах осуществления Fv идентифицируют путем скрининга фаговой библиотеки Fv с помощью слитого белка антиген-Fc.
Дополнительные внеклеточные антигенсвязывающие домены, нацеленные на представляющий интерес антиген, могут быть получены секвенированием существующей области scFv или Fab существующего антитела, нацеленного на тот же антиген.
В определенных вариантах осуществления димеризованный внеклеточный антигенсвязывающий домен раскрытого в данном документе HI-TCR представляет собой мышиный Fv. В определенных вариантах осуществления димеризованный внеклеточный антигенсвязывающий домен представляет собой Fv, который связывается с человеческим полипептидом CD19. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен представляет собой Fv, который содержит аминокислотную последовательность SEQ ID NO: 9 и специфически связывается с человеческим полипептидом CD19 (например, человеческим полипептидом CD19, содержащим аминокислотную последовательность, приведенную в SEQ ID NO: 11). В определенных вариантах осуществления нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 9, приведена в SEQ ID NO: 10.
В определенных вариантах осуществления Fv содержит вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 7. В определенных вариантах осуществления Fv содержит вариабельную область легкой цепи (VL), содержащий аминокислотную последовательность, приведенную в SEQ ID NO: 8. В определенных вариантах осуществления Fv содержит VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 7, и VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 8. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит VH, содержащую аминокислотную последовательность, которая по меньшей мере приблизительно на 80% (например, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90% или по меньшей мере приблизительно на 95%) гомологична или идентична SEQ ID NO: 7. Например, внеклеточный антигенсвязывающий домен содержит VH, содержащую аминокислотную последовательность, которая по меньшей мере приблизительно на 80%, приблизительно на 81%, приблизительно на 82%, приблизительно на 83%, приблизительно на 84%, приблизительно на 85%, приблизительно на 86%, приблизительно на 87%, приблизительно на 88%, приблизительно на 89%, приблизительно на 90%, приблизительно на 91%, приблизительно на 92%, приблизительно на 93%, приблизительно на 94%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98% или приблизительно на 99% гомологична или идентична SEQ ID NO: 7. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 7. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит VL, содержащую аминокислотную последовательность, которая по меньшей мере приблизительно на 80% (например, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90% или по меньшей мере приблизительно на 95%) гомологична SEQ ID NO: 8. Например, внеклеточный антигенсвязывающий домен содержит VL, содержащую аминокислотную последовательность, которая по меньшей мере приблизительно на 80%, приблизительно на 81%, приблизительно на 82%, приблизительно на 83%, приблизительно на 84%, приблизительно на 85%, приблизительно на 86%, приблизительно на 87%, приблизительно на 88%, приблизительно на 89%, приблизительно на 90%, приблизительно на 91%, приблизительно на 92%, приблизительно на 93%, приблизительно на 94%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98% или приблизительно на 99% гомологична или идентична SEQ ID NO: 8. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 8. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит VH, содержащую аминокислотную последовательность, которая по меньшей мере приблизительно на 80% (например, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90% или по меньшей мере приблизительно на 95%) гомологична SEQ ID NO: 7, и VL, содержащую аминокислотную последовательность, которая по меньшей мере приблизительно на 80% (например, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90% или по меньшей мере приблизительно на 95%) гомологична или идентична SEQ ID NO: 8. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 7, и VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 8.
В определенных вариантах осуществления Fv содержит вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 44. В определенных вариантах осуществления Fv содержит вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 45. В определенных вариантах осуществления Fv содержит VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 44, и VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 45. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит VH, содержащую аминокислотную последовательность, которая по меньшей мере приблизительно на 80% (например, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90% или по меньшей мере приблизительно на 95%) гомологична или идентична SEQ ID NO: 44. Например, внеклеточный антигенсвязывающий домен содержит VH, содержащую аминокислотную последовательность, которая по меньшей мере приблизительно на 80%, приблизительно на 81%, приблизительно на 82%, приблизительно на 83%, приблизительно на 84%, приблизительно на 85%, приблизительно на 86%, приблизительно на 87%, приблизительно на 88%, приблизительно на 89%, приблизительно на 90%, приблизительно на 91%, приблизительно на 92%, приблизительно на 93%, приблизительно на 94%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98% или приблизительно на 99% гомологична или идентична SEQ ID NO: 44. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 44. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит VL, содержащую аминокислотную последовательность, которая по меньшей мере приблизительно на 80% (например, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90% или по меньшей мере приблизительно на 95%) гомологична SEQ ID NO: 45. Например, внеклеточный антигенсвязывающий домен содержит VL, содержащую аминокислотную последовательность, которая по меньшей мере приблизительно на 80%, приблизительно на 81%, приблизительно на 82%, приблизительно на 83%, приблизительно на 84%, приблизительно на 85%, приблизительно на 86%, приблизительно на 87%, приблизительно на 88%, приблизительно на 89%, приблизительно на 90%, приблизительно на 91%, приблизительно на 92%, приблизительно на 93%, приблизительно на 94%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98% или приблизительно на 99% гомологична или идентична SEQ ID NO: 45. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 45. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит VH, содержащую аминокислотную последовательность, которая по меньшей мере приблизительно на 80% (например, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90% или по меньшей мере приблизительно на 95%) гомологична SEQ ID NO: 44, и VL, содержащую аминокислотную последовательность, которая по меньшей мере приблизительно на 80% (например, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90% или по меньшей мере приблизительно на 95%) гомологична или идентична SEQ ID NO: 45. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 44, и VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 45.
В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит CDR1 VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 1, или ее консервативную модификацию, CDR2 VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 2, или ее консервативную модификацию, и CDR3 VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 3, ее консервативную модификацию. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит CDR1 VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 1, CDR2 VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 2, и CDR3 VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 3. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит CDR1 VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 4, или ее консервативную модификацию, CDR2 VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 5, или ее консервативную модификацию, и CDR3 VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 6, или ее консервативную модификацию. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит CDR1 VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 4, CDR2 VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 5, и CDR3 VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 6. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит CDR1 VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 1, или ее консервативную модификацию, CDR2 VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 2, или ее консервативную модификацию, CDR3 VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 3, ее консервативную модификацию, CDR1 VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 4, или ее консервативную модификацию, CDR2 VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 5, или ее консервативную модификацию, и CDR3 VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 6, или ее консервативную модификацию. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит CDR1 VH, содержащую аминокислоты, имеющие последовательность, приведенную в SEQ ID NO: 1, CDR2 VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 2, CDR3 VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 3, CDR1 VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 4, CDR2 VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 5, и CDR3 VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 6.
Таблица 1
EVKLQQSGAELVRPGSSVKISCKASGYAFSSYWMNWVKQRPGQGLEWIGQIYPGDGDTNYNGKFKGQATLTADKSSSTAYMQLSGLTSEDSAVYFCARKTISSVVDFYFDYWGQGTTVTV [SEQ ID NO:44]
DIELTQSPKFMSTSVGDRVSVTCKASQNVGTNVAWYQQKPGQSPKPLIYSATYRNSGVPDRFTGSGSGTDFTLTITNVQSKDLADYFCQQYNRYPYTSGGGTKLEI [SEQ ID NO:45]
В контексте настоящего документа термин "консервативная модификация последовательности" относится к модификации аминокислот, которая не оказывает значительного влияния или значительно не изменяет характеристики связывания раскрытого в данном документе HI-TCR, содержащего данную аминокислотную последовательность. Консервативные модификации могут включать аминокислотные замены, добавления и делеции. Модификации могут быть введены в Fv раскрытого в данном документе HI-TCR стандартными методами, известными в данной области техники, такими как сайт-направленный мутагенез и опосредованный ПЦР мутагенез. Аминокислоты можно разделить на группы в соответствии с их физико-химическими свойствами, такими как заряд и полярность. Консервативными аминокислотными заменами являются те, в которых аминокислотный остаток заменен аминокислотой из той же группы. Например, аминокислоты можно классифицировать по заряду: положительно заряженные аминокислоты включают лизин, аргинин, гистидин, отрицательно заряженные аминокислоты включают аспарагиновую кислоту, глутаминовую кислоту, аминокислоты с нейтральным зарядом включают аланин, аспарагин, цистеин, глутамин, глицин, изолейцин, лейцин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин и валин. Кроме того, аминокислоты можно классифицировать по полярности: полярные аминокислоты включают аргинин (основной полярный), аспарагин, аспарагиновую кислоту (кислые полярные), глутаминовую кислоту (кислая полярная), глутамин, гистидин (основные полярные), лизин (основной полярный), серин, треонин и тирозин; неполярные аминокислоты включают аланин, цистеин, глицин, изолейцин, лейцин, метионин, фенилаланин, пролин, триптофан и валин. Таким образом, один или более аминокислотных остатков в области CDR могут быть заменены другими аминокислотными остатками из той же группы, и измененное антитело может быть протестировано на сохранение функции (т.е. функций, перечисленных в пунктах (c)-(l) выше) с использованием функциональных анализов, описанных в настоящем документе. В определенных вариантах осуществления изменяют не более одного, не более двух, не более трех, не более четырех, не более пяти остатков в указанной последовательности или области CDR.
Аминокислотные последовательности VH и/или VL, имеющие гомологию по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90% или по меньшей мере приблизительно 95% (например, приблизительно 81%, приблизительно 82%, приблизительно 83%, приблизительно 84%, приблизительно 85%, приблизительно 86%, приблизительно 87%, приблизительно 88%, приблизительно 89%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98% или приблизительно 99%) с указанной последовательностью (например, SEQ ID NO: 7 и 8) могут содержать замены (например, консервативные замены), вставки или делеции по сравнению с указанной последовательностью(ими), но сохраняют способность связываться с антигеном-мишенью (например, CD19). В определенных вариантах осуществления в указанной последовательности (например, SEQ ID NO: 7 и 8) заменены, вставлены и/или удалены от 1 до 10 аминокислот. В определенных вариантах осуществления замены, вставки или делеции имеют место в областях за пределами CDR (например, в FR) внеклеточного антигенсвязывающего домена. В определенных вариантах осуществления внеклеточный антигенсвязывающий домен содержит последовательность VH и/или VL, выбранную из группы, состоящей из SEQ ID NO: 7 и 8, включая посттрансляционные модификации этой последовательности (SEQ ID NO: 7 и 8).
В контексте настоящего документа процент гомологии между двумя аминокислотными последовательностями эквивалентен проценту идентичности между этими двумя последовательностями. Процент идентичности между двумя последовательностями является функцией количества идентичных положений, общих для последовательностей (т.е. % гомологии=количество идентичных положений/общее количество положений × 100), с учетом количества гэпов и длины каждого гэпа, которые необходимо ввести для оптимального выравнивания двух последовательностей. Сравнение последовательностей и определение процента идентичности между двумя последовательностями может быть выполнено с использованием математического алгоритма.
Процент гомологии между двумя аминокислотными последовательностями можно определять с помощью алгоритма E. Meyers и W. Miller (Comput. Appl. Biosci., 4:11-17 (1988)), который был включен в программу ALIGN (версия 2.0), с использованием весовой таблицы остатков PAM120, штрафа за длину гэпа 12 и штрафа за гэп 4. Кроме того, процент гомологии между двумя аминокислотными последовательностями можно определять с использованием алгоритма Needleman и Wunsch (J. Mol. Biol. 48:444-453 (1970)), который был включен в программу GAP в программном пакете GCG (доступен на www.gcg.com), с использованием или матрицы Blossum 62, или матрицы PAM250 и веса гэпа 16, 14, 12, 10, 8, 6 или 4 и веса длины 1, 2, 3, 4, 5 или 6.
Дополнительно или альтернативно, аминокислотные последовательности раскрытого в данном документе предмета изобретения можно дополнительно использовать в качестве "последовательности запроса" для выполнения поиска в общедоступных базах данных, например для идентификации родственных последовательностей. Такой поиск может быть выполнен с помощью программы XBLAST (версия 2.0), Altschul, et al. (1990) J. Mol. Biol. 215:403-10. Поиск белков BLAST может быть выполнен с помощью программы XBLAST, счет=50, длина слова=3, для получения аминокислотных последовательностей, гомологичных указанным последовательностям (например, последовательностям вариабельных областей тяжелой и легкой цепей m903, m904, m905, m906 и m900 scFv), раскрытым в настоящем документе. Для получения выравниваний с гэпами для целей сравнения можно использовать Gapped BLAST, как описано в Altschul et al., (1997) Nucleic Acids Res. 25(17):3389-3402. При использовании программ BLAST и Gapped BLAST можно использовать параметры соответствующих программ (например, XBLAST и NBLAST) по умолчанию.
2.3. Константный домен
В определенных вариантах осуществления антигенсвязывающая цепь дополнительно содержит константный домен. В определенных вариантах осуществления константный домен содержит шарнирную/спейсерную область и трансмембранный домен. В определенных вариантах осуществления константный домен способен образовывать гомодимер или гетеродимер с другим константным доменом. В определенных вариантах осуществления константный домен димеризуется через одну или более дисульфидных связей. В определенных вариантах осуществления антигенсвязывающая цепь способна образовывать тример или олигомер с одним или более идентичными или различными константными доменами.
В определенных неограничивающих вариантах осуществления константный домен содержит константную область T-клеточного рецептора, например константную область T-клеточного рецептора-альфа (TRAC), константную область T-клеточного рецептора-бета (TRBC, например TRBC1 или TRBC2), константную область T-клеточного рецептора-гамма (TRGC, например TRGC1 или TRGC2), константную область T-клеточного рецептора-дельта (TRDC) или любые их варианты или функциональные фрагменты.
В определенных вариантах осуществления константный домен раскрытого в данном документе HI-TCR содержит нативный или модифицированный пептид TRAC. В определенных вариантах осуществления полипептид TRAC содержит аминокислотную последовательность, которая по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95%, по меньшей мере приблизительно на 96%, по меньшей мере приблизительно на 97%, по меньшей мере приблизительно на 98%, по меньшей мере приблизительно на 99% или по меньшей мере приблизительно на 100% гомологична или идентична аминокислотной последовательности, приведенной в SEQ ID NO:38 (которая приведена ниже), или ее фрагментам, и/или может, необязательно, содержать вплоть до одной, или вплоть до двух, или вплоть до трех консервативный аминокислотных замен.
IQNPDPAVYQLRDSKSSDKSVCLFTDFDSQTNVSQSKDSDVYITDKTVLDMRSMDFKSNSAVAWSNKSDFACANAFNNSIIPEDTFFPSPESSCDVKLVEKSFETDTNLNFQNLSVIGFRILLLKVAGFNLLMTLRLWSS [SEQ ID NO:38]
В определенных вариантах осуществления полипептид TRAC имеет аминокислотную последовательность, которая по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95%, по меньшей мере приблизительно на 96%, по меньшей мере приблизительно на 97%, по меньшей мере приблизительно на 98%, по меньшей мере приблизительно на 99% или по меньшей мере приблизительно на 100% гомологична или идентична аминокислотной последовательности, кодируемой транскриптом, экспрессируемым геном NCBI Genbank ID: 28755, NG_001332.3, диапазон 925603-930229 (SEQ ID NO:29, которая приведена ниже), или ее фрагментам, и/или может, необязательно, содержать вплоть до одной, или вплоть до двух, или вплоть до трех консервативный аминокислотных замен.
1 atatccagaa ccctgaccct gccgtgtacc agctgagaga ctctaaatcc agtgacaagt
61 ctgtctgcct attcaccgat tttgattctc aaacaaatgt gtcacaaagt aaggattctg
121 atgtgtatat cacagacaaa actgtgctag acatgaggtc tatggacttc aagagcaaca
181 gtgctgtggc ctggagcaac aaatctgact ttgcatgtgc aaacgccttc aacaacagca
241 ttattccaga agacaccttc ttccccagcc caggtaaggg cagctttggt gccttcgcag
301 gctgtttcct tgcttcagga atggccaggt tctgcccaga gctctggtca atgatgtcta
361 aaactcctct gattggtggt ctcggcctta tccattgcca ccaaaaccct ctttttacta
421 agaaacagtg agccttgttc tggcagtcca gagaatgaca cgggaaaaaa gcagatgaag
481 agaaggtggc aggagagggc acgtggccca gcctcagtct ctccaactga gttcctgcct
541 gcctgccttt gctcagactg tttgcccctt actgctcttc taggcctcat tctaagcccc
601 ttctccaagt tgcctctcct tatttctccc tgtctgccaa aaaatctttc ccagctcact
661 aagtcagtct cacgcagtca ctcattaacc caccaatcac tgattgtgcc ggcacatgaa
721 tgcaccaggt gttgaagtgg aggaattaaa aagtcagatg aggggtgtgc ccagaggaag
781 caccattcta gttgggggag cccatctgtc agctgggaaa agtccaaata acttcagatt
841 ggaatgtgtt ttaactcagg gttgagaaaa cagctacctt caggacaaaa gtcagggaag
901 ggctctctga agaaatgcta cttgaagata ccagccctac caagggcagg gagaggaccc
961 tatagaggcc tgggacagga gctcaatgag aaaggagaag agcagcaggc atgagttgaa
1021 tgaaggaggc agggccgggt cacagggcct tctaggccat gagagggtag acagtattct
1081 aaggacgcca gaaagctgtt gatcggcttc aagcagggga gggacaccta atttgctttt
1141 cttttttttt tttttttttt tttttttttt tgagatggag ttttgctctt gttgcccagg
1201 ctggagtgca atggtgcatc ttggctcact gcaacctccg cctcccaggt tcaagtgatt
1261 ctcctgcctc agcctcccga gtagctgaga ttacaggcac ccgccaccat gcctggctaa
1321 ttttttgtat ttttagtaga gacagggttt cactatgttg gccaggctgg tctcgaactc
1381 ctgacctcag gtgatccacc cgcttcagcc tcccaaagtg ctgggattac aggcgtgagc
1441 caccacaccc ggcctgcttt tcttaaagat caatctgagt gctgtacgga gagtgggttg
1501 taagccaaga gtagaagcag aaagggagca gttgcagcag agagatgatg gaggcctggg
1561 cagggtggtg gcagggaggt aaccaacacc attcaggttt caaaggtaga accatgcagg
1621 gatgagaaag caaagagggg atcaaggaag gcagctggat tttggcctga gcagctgagt
1681 caatgatagt gccgtttact aagaagaaac caaggaaaaa atttggggtg cagggatcaa
1741 aactttttgg aacatatgaa agtacgtgtt tatactcttt atggcccttg tcactatgta
1801 tgcctcgctg cctccattgg actctagaat gaagccaggc aagagcaggg tctatgtgtg
1861 atggcacatg tggccagggt catgcaacat gtactttgta caaacagtgt atattgagta
1921 aatagaaatg gtgtccagga gccgaggtat cggtcctgcc agggccaggg gctctcccta
1981 gcaggtgctc atatgctgta agttccctcc agatctctcc acaaggaggc atggaaaggc
2041 tgtagttgtt cacctgccca agaactagga ggtctggggt gggagagtca gcctgctctg
2101 gatgctgaaa gaatgtctgt ttttcctttt agaaagttcc tgtgatgtca agctggtcga
2161 gaaaagcttt gaaacaggta agacaggggt ctagcctggg tttgcacagg attgcggaag
2221 tgatgaaccc gcaataaccc tgcctggatg agggagtggg aagaaattag tagatgtggg
2281 aatgaatgat gaggaatgga aacagcggtt caagacctgc ccagagctgg gtggggtctc
2341 tcctgaatcc ctctcaccat ctctgacttt ccattctaag cactttgagg atgagtttct
2401 agcttcaata gaccaaggac tctctcctag gcctctgtat tcctttcaac agctccactg
2461 tcaagagagc cagagagagc ttctgggtgg cccagctgtg aaatttctga gtcccttagg
2521 gatagcccta aacgaaccag atcatcctga ggacagccaa gaggttttgc cttctttcaa
2581 gacaagcaac agtactcaca taggctgtgg gcaatggtcc tgtctctcaa gaatcccctg
2641 ccactcctca cacccaccct gggcccatat tcatttccat ttgagttgtt cttattgagt
2701 catccttcct gtggtagcgg aactcactaa ggggcccatc tggacccgag gtattgtgat
2761 gataaattct gagcacctac cccatcccca gaagggctca gaaataaaat aagagccaag
2821 tctagtcggt gtttcctgtc ttgaaacaca atactgttgg ccctggaaga atgcacagaa
2881 tctgtttgta aggggatatg cacagaagct gcaagggaca ggaggtgcag gagctgcagg
2941 cctcccccac ccagcctgct ctgccttggg gaaaaccgtg ggtgtgtcct gcaggccatg
3001 caggcctggg acatgcaagc ccataaccgc tgtggcctct tggttttaca gatacgaacc
3061 taaactttca aaacctgtca gtgattgggt tccgaatcct cctcctgaaa gtggccgggt
3121 ttaatctgct catgacgctg cggctgtggt ccagctgagg tgaggggcct tgaagctggg
3181 agtggggttt agggacgcgg gtctctgggt gcatcctaag ctctgagagc aaacctccct
3241 gcagggtctt gcttttaagt ccaaagcctg agcccaccaa actctcctac ttcttcctgt
3301 tacaaattcc tcttgtgcaa taataatggc ctgaaacgct gtaaaatatc ctcatttcag
3361 ccgcctcagt tgcacttctc ccctatgagg taggaagaac agttgtttag aaacgaagaa
3421 actgaggccc cacagctaat gagtggagga agagagacac ttgtgtacac cacatgcctt
3481 gtgttgtact tctctcaccg tgtaacctcc tcatgtcctc tctccccagt acggctctct
3541 tagctcagta gaaagaagac attacactca tattacaccc caatcctggc tagagtctcc
3601 gcaccctcct cccccagggt ccccagtcgt cttgctgaca actgcatcct gttccatcac
3661 catcaaaaaa aaactccagg ctgggtgcgg gggctcacac ctgtaatccc agcactttgg
3721 gaggcagagg caggaggagc acaggagctg gagaccagcc tgggcaacac agggagaccc
3781 cgcctctaca aaaagtgaaa aaattaacca ggtgtggtgc tgcacacctg tagtcccagc
3841 tacttaagag gctgagatgg gaggatcgct tgagccctgg aatgttgagg ctacaatgag
3901 ctgtgattgc gtcactgcac tccagcctgg aagacaaagc aagatcctgt ctcaaataat
3961 aaaaaaaata agaactccag ggtacatttg ctcctagaac tctaccacat agccccaaac
4021 agagccatca ccatcacatc cctaacagtc ctgggtcttc ctcagtgtcc agcctgactt
4081 ctgttcttcc tcattccaga tctgcaagat tgtaagacag cctgtgctcc ctcgctcctt
4141 cctctgcatt gcccctcttc tccctctcca aacagaggga actctcctac ccccaaggag
4201 gtgaaagctg ctaccacctc tgtgcccccc cggcaatgcc accaactgga tcctacccga
4261 atttatgatt aagattgctg aagagctgcc aaacactgct gccaccccct ctgttccctt
4321 attgctgctt gtcactgcct gacattcacg gcagaggcaa ggctgctgca gcctcccctg
4381 gctgtgcaca ttccctcctg ctccccagag actgcctccg ccatcccaca gatgatggat
4441 cttcagtggg ttctcttggg ctctaggtcc tgcagaatgt tgtgaggggt ttattttttt
4501 ttaatagtgt tcataaagaa atacatagta ttcttcttct caagacgtgg ggggaaatta
4561 tctcattatc gaggccctgc tatgctgtgt atctgggcgt gttgtatgtc ctgctgccga
4621 tgccttc [SEQ ID NO:29]
В соответствии с раскрытым в данном документе предметом изобретения "молекула нуклеиновой кислоты TRAC" относится к полинуклеотиду, кодирующему полипептид TRAC.
В определенных вариантах осуществления константный домен раскрытого в данном документе HI-TCR содержит нативный или модифицированный пептид TRBC. В определенных вариантах осуществления константный домен раскрытого в данном документе HI-TCR содержит нативный или модифицированный пептид TRBC2. В определенных вариантах осуществления полипептид TRBC2 содержит аминокислотную последовательность, которая по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95%, по меньшей мере приблизительно на 96%, по меньшей мере приблизительно на 97%, по меньшей мере приблизительно на 98%, по меньшей мере приблизительно на 99% или по меньшей мере приблизительно на 100% гомологична или идентична аминокислотной последовательности, приведенной в SEQ ID NO:39, которая приведена ниже, или ее фрагментам, и/или может, необязательно, содержать вплоть до одной, или вплоть до двух, или вплоть до трех консервативный аминокислотных замен.
DLKNVFPPEVAVFEPSEAEISHTQKATLVCLATGFYPDHVELSWWVNGKEVHSGVSTDPQPLKEQPALNDSRYCLSSRLRVSATFWQNPRNHFRCQVQFYGLSENDEWTQDRAKPVTQIVSAEAWGRADCGFTSESYQQGVLSATILYEILLGKATLYAVLVSALVLMAMVKRKDSRG [SEQ ID NO:39]
В определенных вариантах осуществления константный домен раскрытого в данном документе HI-TCR содержит нативный или модифицированный пептид TRBC1. В определенных вариантах осуществления полипептид TRBC1 содержит аминокислотную последовательность, которая по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95%, по меньшей мере приблизительно на 96%, по меньшей мере приблизительно на 97%, по меньшей мере приблизительно на 98%, по меньшей мере приблизительно на 99% или по меньшей мере приблизительно на 100% гомологична или идентична аминокислотной последовательности, приведенной в SEQ ID NO:40, которая приведена ниже, или ее фрагментам, и/или может, необязательно, содержать вплоть до одной, или вплоть до двух, или вплоть до трех консервативный аминокислотных замен.
DLNKVFPPEV AVFEPSEAEI SHTQKATLVC LATGFFPDHV ELSWWVNGKE
VHSGVSTDPQ PLKEQPALND SRYCLSSRLR VSATFWQNPR NHFRCQVQFY
GLSENDEWTQ DRAKPVTQIV SAEAWGRADC GFTSVSYQQG VLSATILYEI
LLGKATLYAV LVSALVLMAM VKRKDF [SEQ ID NO:40]
В определенных вариантах осуществления полипептид TRBC имеет аминокислотную последовательность, которая по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95%, по меньшей мере приблизительно на 96%, по меньшей мере приблизительно на 97%, по меньшей мере приблизительно на 98%, по меньшей мере приблизительно на 99% или по меньшей мере приблизительно на 100% гомологична или идентична аминокислотной последовательности, кодируемой транскриптом, экспрессируемым геном NCBI Genbank ID: 28639, NG_001333.2, диапазон 645749-647196 (TRBC1, SEQ ID NO: 30), NCBI Genbank ID: 28638, NG_001333.2, диапазон 655095-656583 (TRBC2, SEQ ID NO:31), или ее фрагментам, и/или может, необязательно, содержать вплоть до одной, или вплоть до двух, или вплоть до трех консервативный аминокислотных замен.
1 aggacctgaa caaggtgttc ccacccgagg tcgctgtgtt tgagccatca gaagcagaga
61 tctcccacac ccaaaaggcc acactggtgt gcctggccac aggcttcttc cccgaccacg
121 tggagctgag ctggtgggtg aatgggaagg aggtgcacag tggggtcagc acagacccgc
181 agcccctcaa ggagcagccc gccctcaatg actccagata ctgcctgagc agccgcctga
241 gggtctcggc caccttctgg cagaaccccc gcaaccactt ccgctgtcaa gtccagttct
301 acgggctctc ggagaatgac gagtggaccc aggatagggc caaacccgtc acccagatcg
361 tcagcgccga ggcctggggt agagcaggtg agtggggcct ggggagatgc ctggaggaga
421 ttaggtgaga ccagctacca gggaaaatgg aaagatccag gtagcagaca agactagatc
481 caaaaagaaa ggaaccagcg cacaccatga aggagaattg ggcacctgtg gttcattctt
541 ctcccagatt ctcagcccaa cagagccaag cagctgggtc ccctttctat gtggcctgtg
601 taactctcat ctgggtggtg ccccccatcc ccctcagtgc tgccacatgc catggattgc
661 aaggacaatg tggctgacat ctgcatggca gaagaaagga ggtgctgggc tgtcagagga
721 agctggtctg ggcctgggag tctgtgccaa ctgcaaatct gactttactt ttaattgcct
781 atgaaaataa ggtctctcat ttattttcct ctccctgctt tctttcagac tgtggcttta
841 cctcgggtaa gtaagccctt ccttttcctc tccctctctc atggttcttg acctagaacc
901 aaggcatgaa gaactcacag acactggagg gtggagggtg ggagagacca gagctacctg
961 tgcacaggta cccacctgtc cttcctccgt gccaacagtg tcctaccagc aaggggtcct
1021 gtctgccacc atcctctatg agatcctgct agggaaggcc accctgtatg ctgtgctggt
1081 cagcgccctt gtgttgatgg ccatggtaag caggagggca ggatggggcc agcaggctgg
1141 aggtgacaca ctgacaccaa gcacccagaa gtatagagtc cctgccagga ttggagctgg
1201 gcagtaggga gggaagagat ttcattcagg tgcctcagaa gataacttgc acctctgtag
1261 gatcacagtg gaagggtcat gctgggaagg agaagctgga gtcaccagaa aacccaatgg
1321 atgttgtgat gagccttact atttgtgtgg tcaatgggcc ctactacttt ctctcaatcc
1381 tcacaactcc tggctcttaa taacccccaa aactttctct tctgcaggtc aagagaaagg
1441 atttctga [SEQ ID NO:30]
1 aggacctgaa aaacgtgttc ccacccgagg tcgctgtgtt tgagccatca gaagcagaga
61 tctcccacac ccaaaaggcc acactggtat gcctggccac aggcttctac cccgaccacg
121 tggagctgag ctggtgggtg aatgggaagg aggtgcacag tggggtcagc acagacccgc
181 agcccctcaa ggagcagccc gccctcaatg actccagata ctgcctgagc agccgcctga
241 gggtctcggc caccttctgg cagaaccccc gcaaccactt ccgctgtcaa gtccagttct
301 acgggctctc ggagaatgac gagtggaccc aggatagggc caaacccgtc acccagatcg
361 tcagcgccga ggcctggggt agagcaggtg agtggggcct ggggagatgc ctggaggaga
421 ttaggtgaga ccagctacca gggaaaatgg aaagatccag gtagcggaca agactagatc
481 cagaagaaag ccagagtgga caaggtggga tgatcaaggt tcacagggtc agcaaagcac
541 ggtgtgcact tcccccacca agaagcatag aggctgaatg gagcacctca agctcattct
601 tccttcagat cctgacacct tagagctaag ctttcaagtc tccctgagga ccagccatac
661 agctcagcat ctgagtggtg tgcatcccat tctcttctgg ggtcctggtt tcctaagatc
721 atagtgacca cttcgctggc actggagcag catgagggag acagaaccag ggctatcaaa
781 ggaggctgac tttgtactat ctgatatgca tgtgtttgtg gcctgtgagt ctgtgatgta
841 aggctcaatg tccttacaaa gcagcattct ctcatccatt tttcttcccc tgttttcttt
901 cagactgtgg cttcacctcc ggtaagtgag tctctccttt ttctctctat ctttcgccgt
961 ctctgctctc gaaccagggc atggagaatc cacggacaca ggggcgtgag ggaggccaga
1021 gccacctgtg cacaggtgcc tacatgctct gttcttgtca acagagtctt accagcaagg
1081 ggtcctgtct gccaccatcc tctatgagat cttgctaggg aaggccacct tgtatgccgt
1141 gctggtcagt gccctcgtgc tgatggccat ggtaaggagg agggtgggat agggcagatg
1201 atgggggcag gggatggaac atcacacatg ggcataaagg aatctcagag ccagagcaca
1261 gcctaatata tcctatcacc tcaatgaaac cataatgaag ccagactggg gagaaaatgc
1321 agggaatatc acagaatgca tcatgggagg atggagacaa ccagcgagcc ctactcaaat
1381 taggcctcag agcccgcctc ccctgcccta ctcctgctgt gccatagccc ctgaaaccct
1441 gaaaatgttc tctcttccac aggtcaagag aaaggattcc agaggctag
[SEQ ID NO:31]
В соответствии с раскрытым в данном документе предметом изобретения "молекула нуклеиновой кислоты TRBC" относится к полинуклеотиду, кодирующему полипептид TRBC.
В определенных вариантах осуществления константный домен раскрытого в данном документе HI-TCR содержит нативный или модифицированный пептид TRGC. В определенных вариантах осуществления константный домен раскрытого в данном документе HI-TCR содержит нативный или модифицированный пептид TRGC1. В определенных вариантах осуществления полипептид TRGC1 имеет аминокислотную последовательность, которая по меньшей мере приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или на 100% гомологична или идентична аминокислотной последовательности, приведенной в SEQ ID NO: 42, которая приведена ниже.
DKQLDADVSP KPTIFLPSIA ETKLQKAGTY LCLLEKFFPD VIKIHWQEKK
SNTILGSQEG NTMKTNDTYM KFSWLTVPEK SLDKEHRCIV RHENNKNGVD
QEIIFPPIKT DVITMDPKDN CSKDANDTLL LQLTNTSAYY MYLLLLLKSV
VYFAIITCCL LRRTAFCCNG EKS [SEQ ID NO:42]
В определенных вариантах осуществления константный домен раскрытого в данном документе HI-TCR содержит нативный или модифицированный пептид TRGC2. В определенных вариантах осуществления полипептид TRGC2 имеет аминокислотную последовательность, которая по меньшей мере приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или на 100% гомологична или идентична аминокислотной последовательности, приведенной в SEQ ID NO: 43, которая приведена ниже.
DKQLDADVSP KPTIFLPSIA ETKLQKAGTY LCLLEKFFPD IIKIHWQEKK
SNTILGSQEG NTMKTNDTYM KFSWLTVPEE SLDKEHRCIV RHENNKNGID
QEIIFPPIKT DVTTVDPKYN YSKDANDVIT MDPKDNWSKD ANDTLLLQLT
NTSAYYTYLL LLLKSVVYFA IITCCLLRRT AFCCNGEKS [SEQ ID NO:43]
В определенных вариантах осуществления полипептид TRGC имеет аминокислотную последовательность, которая по меньшей мере приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или на 100% гомологична или идентична аминокислотной последовательности, кодируемой транскриптом, экспрессируемым геном NCBI Genbank ID: 6966, NG_001336.2, диапазон 108270-113860 (TRGC1, SEQ ID NO: 32), NCBI Genbank ID: 6967, NG_001336.2, диапазон 124376-133924 (TRGC2, SEQ ID NO: 33), или ее фрагментам, и/или может, необязательно, содержать вплоть до одной, или вплоть до двух, или вплоть до трех консервативный аминокислотных замен.
1 ataaacaact tgatgcagat gtttccccca agcccactat ttttcttcct tcaattgctg
61 aaacaaagct ccagaaggct ggaacatacc tttgtcttct tgagaaattt ttccctgatg
121 ttattaagat acattggcaa gaaaagaaga gcaacacgat tctgggatcc caggagggga
181 acaccatgaa gactaacgac acatacatga aatttagctg gttaacggtg ccagaaaagt
241 cactggacaa agaacacaga tgtatcgtca gacatgagaa taataaaaac ggagttgatc
301 aagaaattat ctttcctcca ataaagacag gtatgtgttt acgcatatca tctgtcagaa
361 cacttctttg aaagtgaatg ctgcattttt tcctttcagt attaatgaaa aacaaacata
421 aatctttctt aaatattgtt acatttaatg gtagcataaa tgccctgcta cttttctata
481 gaattaaaat ggtataggtt ttggagaaaa caaaattgaa aaagttactg aaggtttgtc
541 agcctcagct ccattatcca aaataagaaa gtcacgtgct ggtttttagg gttgttagat
601 ggattaaaga aacaacatac acagaagcat ctagcaacgt gacacgtggt aaacgctcaa
661 aaagtgttct cccttctttt gatgacttta cttgatcagg aaataacata tatatgtctt
721 tcaggaatgt tctgcccaag caggagagtc actcacctca atcttgctac ccacaaagtt
781 taacctaaaa acaacgggtt cattgttgac aaaatgatgt ttatctgttg ttgacagaat
841 gatgtttatc taaaaacagt tccaattttc tatttccttt gctgagacac aaaggggagg
901 caaatgtgca aagcttgagg gtagtcttac cactgtgctt aagtgttctg atttttctag
961 tgatcagggc aaaataaaaa gtatagtaag ttccaaggca gtgaatatta tacaggagag
1021 aagttacagt tttataatgt gttttccttt acactaaatt ctaaaagtaa aaagtctttt
1081 tttttttttg acagagtttc actcttgttg cccaagcagg tgtgctatgg tatgatctca
1141 gctcactgca acctccacct cccgggttca agtgattctc ttacttcagc ctcccgacag
1201 gctgggattg caggcgcctg ccaccacacc tggctaattt ttgtgttttt agtagagatg
1261 gggtttcacc atgttggcca ggctggtctc aaattcctga cctcaagtga tccatccacc
1321 tcggcctcca agtgctggga ttatgggcgt cagccactgt gcccagccta aaagtaaaat
1381 gtctttcatg agcttcccaa ggcagctacg ttaaggagga cacttctctt aatgtcattc
1441 tacagtagat ttctaatgct ctttcttgga agtttgtttt tctgagaaaa gctaaaaata
1501 taacatggaa gtgatcatat tatataatca atgaagtgct tttcaaggag ataaaactaa
1561 tctggtccac acttgcaacc aaccttgatt gagagagaga gagaactcag gatacacttg
1621 aagattttat tatggggaac agttacttta ttctttttac ctcaatcaat gcatggaaat
1681 aagtgatagt cattttcatt tatcttttaa taaatgaagt caccatgagg aaaataaaaa
1741 gacattgaaa acccattaaa gtcagccctt aaagatattt ggacatgcag acttgataac
1801 taacgtttgc attcttgaga cttacccaaa acccatacct caagtccaag tttttagaat
1861 tcatgaaata aagatctcag tgagtgcata aaattgcgca ccagaatcat atccgtatag
1921 acaagaacac atctactaga aaaataataa accaacacac caatgcaact gtgttttctt
1981 ctgttttaaa gtatgttgtc tttgtatgca tgtttgcttc ttcctttttt tttttaacat
2041 cacagataaa ttcaactctc acctcaggtt ttattgagag aactgtcaat gtgacttggc
2101 ctctgtcttt ctagtcccag aaagaattgc actgaaatct gagctcctgt aataaaaaca
2161 accatttgct gagagtaatt aacatactga aagagatttt cttagagtac acaatggtga
2221 cattatattg cctctttata aataactttc tatctatttc tgtggattat tcctacaaag
2281 tacttttcat atgtccaatt tcttttcttc ccctacaact actgtctgaa tactggctct
2341 gctatttgct gatatgattc tcggcaagtt gcctgcactt tttaaacttt atttcctcat
2401 tcagaacatg gggccataca taatacaact cacttcagtg ttattgggga attaaacaaa
2461 aaatgcatgg gaagcattta acatagtgcc tgacacaata atgagtactc agtagatgtt
2521 agcttttatt aatattgttg ttgttatgtc cagaaacact atacctccag aaaatcatgg
2581 gtacttgctg gggacattgg ggatatgcat gatttggaaa agaatgactg ctttttttgc
2641 ttagatgaga aatttttcta agccagactc cttcaaatat gtaagattct gttgtggatt
2701 caaggactga aagaattctt ggccgagtgt ggtggcttat ccctgtaatc ccagcatttt
2761 gtgaggacaa ggcaggaaga ttgcttgagt ccaggagttt gaaaccagcc tgcgcaacat
2821 ggcgaaaccc tgtctctaca aaaaatacaa acattagctc ggagtgagtg ctgacatgtg
2881 cctgtactcc cagctactca gaaggctgag atgggaggat ctcatgagcc tggggagttt
2941 gaggcttcag tgagccgtga tgacaccgta ctatactcca ctccagcctg ggtgacagtg
3001 agaccctgcc tcaaaaaaca aacaaacaaa caaacaaaac aaaattaatc tttttgctga
3061 tgtcatgtca gcagtgtgtg ttgaaggctg taaagcagcc atttgttcag tttatttttc
3121 cattgaacaa gtatttatca aaaacatact ttgtggcagt cactatgcta ggagctatga
3181 atacagaagg aaaagtaaat gctcttggat actacactcc agttgtgata aaaaagaaaa
3241 aatgtattct tcaccaactt caacatcttg atgtgcaaaa acataataca tgaattagat
3301 ctacctaatt acacagaatt agaccaattg tttctggaat tgtgggctca tatttttaat
3361 aactgtcctc ctgcctctct gtcgacaggt tttataaata ttcatttaat tacacacaca
3421 cacacgaaca attgactagt acttgctctc attcttctag atgtcatcac aatggatccc
3481 aaagacaatt gttcaaaaga tgcaaatggt aagcttttgt gtttttccct tcctcctgat
3541 cattttgttt tgaacttctc tggcttgaaa aatcagggaa tggattttgc taggttggat
3601 gctgcagaat ggacctagtg atattttaaa ttagtccctc attttctagg agttgtatta
3661 acaaacctaa ctactgcttt ggggtatgag atgactgtaa attagagagg gtacagtggt
3721 atagtgatat gcttttaatt atttcaaaaa aaagatttta ttcattcatg tgtctttttt
3781 ctttttcttt tctttttttt ttttttttgg acagagtctt gctctgtcac ccaggctgga
3841 gtgcggtggc agtatctcag ctcaccacaa cctccgcctc ccggcttcaa gtgattctcc
3901 tgcctcagct tctcgagtag ctgggactac aggcgcgtgc caccatgccc ggctaatttt
3961 tgtattttta gtagagttgg ggtttcacca tgttggccag gatggcctcg aatttgtgac
4021 ctcgtgatct gccccctcgc cctcccgaac tgttgggatt acaggcgtga gtcactgtgc
4081 ccggcctcct gtcctgtctt ttgtttaatg actgggaaaa acatgatacc atgttgcttc
4141 tcgagttgtt ttgttttagt ctttggtctt tgctagtagc taataacacg aactagtgtt
4201 tatcaagtgc tttttacaca gaagggcttg ggctgtgttc tgcattttct tgtttaaccc
4261 tcttaaaact cctataaaat ggtacatatt tttctcccaa tttacagtcc ctttaaagca
4321 aataattata aaaatcccta tacatgtcac acagctagat ctgggatttc aaatcaggcc
4381 atcaaacaaa gagtttatgt acttagtaag ttttctgttc tttttctaca atagagtcag
4441 atagcaagaa attaccaagc caggaacctg aaacaaaacg gacatcatgt ggggctgggt
4501 gggtgcatgg gctttgcaga ctggactttc actccagctc ttttaatgat taggtgtaag
4561 tgacctacat tttgtgagca acagttttct catcagccaa caaagaataa ttacaccaga
4621 ttcacagtta ttgaagagat aaaggcatga atgtgagatg tctggcatag ggcatctcat
4681 ttagcagaca cagaatgagt acttgtttct ggctttttct ctctacatat gcacaaagaa
4741 tgcgactaga agcatgggct ctagccctgc tcaactttcc tctatttcca ataccaaggg
4801 gctctgactt aggctgccac accaggcaag gagggcagta ccacctcact tgaccaaggg
4861 cagggagtca cggacacatc acttcttgag atccttttcc acaccaagga ctgatgtttc
4921 tggaattctc actttatgaa gacaaaacat ataaatggaa attttctcag gtagagactc
4981 actcttgtag ctcattgagt aggcactagt ggtccacccc cactgtcttt acttattcct
5041 tgacatcaca tatctcttgc aaaacctcaa ataatattaa atgcaatcac ccaataatag
5101 catagccata attagaggca tttaggaaag acaggtgagt gtgccacaac tacctaacac
5161 atcagcaaat ctggattaac cactttcttt gattttccac aatgcaacct tactttttaa
5221 tagttgggaa tgttctaagt gaatttagca gaggttgtta atcaacttga aagctgaatt
5281 ctgacttgtc tgactcttgg tggtgctggt agcagtagat gtttactttt aggttttggt
5341 ggtggtggaa tatcacttca acgtaaatca tcagaaataa gtatttgtga acccctctcg
5401 cattaatgta tcttattctg taaaaagaac atgtgcaatt tctcttagat acactactgc
5461 tgcagctcac aaacacctct gcatattaca tgtacctcct cctgctcctc aagagtgtgg
5521 tctattttgc catcatcacc tgctgtctgc ttagaagaac ggctttctgc tgcaatggag
5581 agaaatcata a [SEQ ID NO:32]
1 ataaacaact tgatgcagat gtttccccca agcccactat ttttcttcct tcgattgctg
61 aaacaaaact ccagaaggct ggaacatacc tttgtcttct tgagaaattt ttcccagata
121 ttattaagat acattggcaa gaaaagaaga gcaacacgat tctgggatcc caggagggga
181 acaccatgaa gactaacgac acatacatga aatttagctg gttaacggtg ccagaagagt
241 cactggacaa agaacacaga tgtatcgtca gacatgagaa taataaaaac ggaattgatc
301 aagaaattat ctttcctcca ataaagacag gtatgtgttt acacatatca tctgtcagaa
361 cacttctttg aaagtgaatg ctgcattttt tcctttcagt attaatgaaa aacataaatc
421 tttcttaaaa attgttacat ttaatggtag cgtaaatgcc ctgctacttt tctatagaat
481 taaaatggta taggttttgg agaaaacaaa attgaaaaag ttgctgaagg tttgtcagcc
541 tcagctccat tatccaaaat aagaaagtca cgtgctggtt tttagggttg ttagatggat
601 taaagaaaca acatacacag aagcatctag caacgtgaca cgtggtaaac gctcaaaaag
661 tgttctccct tcttttgatg actttacttg atcaggaaat aacatatata tgtctttcag
721 gaatgttctg cccaagcagg agagtcactc acctcaatct tgctacccac aaagtttaac
781 ctaaaaacaa cgggttcatt gttgacaaaa taatgtttat ctgaagataa ctgtagatca
841 tatttatctg tagataatgt ttatctgtgg agtgtggctc tacaaaacat agaatagtct
901 tggtcactgc agttttatag aggccttggg tttttcagag tttcatttta tatatcacca
961 taaagtaaca tttcataatt acaggttggt aaggcttaca tgtacaaaca ttcttccatt
1021 ttccataata aatgcatttc ctgccattgg tgaatgcagc tcaataaaca tttattgtac
1081 aattatgaca cgccaggctt agtggaaatg tggatgaaca gacaaggatg agttactgtc
1141 ctaaggatga tgcatgacag tgcagagaat atactctctt cctgatcact cagggtcact
1201 catgattcat gcgcgaggtc ccaaaacagt gcctttgatg cagattctgt acatctctag
1261 acgattggtc caagggctga atgtgctctg gcccagtggt ccagtctgtc actatatgtc
1321 aacatcctga atatgaacat aacagtccaa catctcaaga gtgggcatga aaaggactca
1381 ttttgtgctt tttcctgtgg ttaacaagtc ctttttagcc tgggggaaca agcattaaca
1441 aaatgtttga agatctttgc cacgtaccat tccaaatttc tagggtaagt ctttagcttt
1501 tcagatcctg agtttctgca atgatcaaat gtgatttgga cagttgcgtt gactttctcc
1561 tggggctata atggagtgca aaggaaacaa tggcagggaa aatgcttgct ttcaaaatgg
1621 tagcatggat gtgttcattc gtgtagttac tgtattaggt atagcctttc ctgaaactaa
1681 ctgaagtggg gttataaaaa cagtcccaat tttctatttc ctttgctgag acacaaagag
1741 gagacaaaag agcaaagctt gagggtagtt ttaccactgt gcttaagtgt tctgattttt
1801 ccagtgatca gggtgaaata aaaagcatag taagttccag ggcagtgaat accatacagg
1861 agacaagtta cagttttata atgtgtttta ctttacacta aattctaaaa gtaaaatgtc
1921 tttttttttt tccgagacag agtttcactc ttgtagccca ggcaggagtg ctatggtgtg
1981 atctcggctc acagcaacct ccacctccca gtttcaagcg attcttctgc ctcagcctcc
2041 cgagaagttg aaattacagg tgcctggcac catatctcgc taattattct atttttagta
2101 gagatcgggt tttaccatgt tggccaggct ggtctcgaac tcctgacttc aagtgatcca
2161 cccgcctcag cctcccaaag tgctgggatt acaggtgtga gtcactgtgc cggacctaac
2221 agtaaaatgt ctttcatgtg cttctcaagg caactacatt aaggaggaca catctcttaa
2281 tgtcattcta cagtagattt ctaatgctct ttcttggaag tttgtttttc tgagaagagc
2341 taaaaatata ataacatgga agtgatcata ttatataatc aatgaagtgc tttcaaagga
2401 gataaaacta acctggtctg catttgcaac cagccttgat tgagagagag agaactcagg
2461 atacacttag agattttatt atggggaata gttactttat tcattttacc tcaatcaatg
2521 catggaaata agtgacagtc attttcattt atcttttaat aaataaagtc accatgagga
2581 aaatgaaaac ccattaaagt cagtccttaa agatatttgg acatgcagac atgataacta
2641 acatttccat tcgtgagact tacccaaaac ctatacctca agtccatttc ttagaataca
2701 tgaaataaag atctcagtga gtgtataaaa ctgcacacca gaatcatatc cgtatagaca
2761 agaatacatc tactagaaaa atataaacca aaacaccaag gtgactctgt ttttttctgt
2821 tttaaaatat gttgtctttg tatgcatgtt tgcttcttcc tttttttttt taaacatcgc
2881 agataaattc aactctcacc tcagttgaga gagaactgtc aatgtgactt ggcctctctc
2941 tttctagtcc cagaaagaat tgcactgaaa tgctgagctc ctgtaataaa aatgaccatt
3001 tgctgagagt aattaacata ctgaaagaga ttttcttaga atagtgcaca atggcccaat
3061 ggtgacatta tattgtctct ttataaatta ttttctatct atttctgtgg attatttcta
3121 caaagcactt ttcatatgtc caattccttt tattccccta caagtactga ctgactactg
3181 gctctgctgt tcactgatat gactttcggc aagttgcctg cactttttaa acgttatttc
3241 ctcattcaga acatggggcc atacaaaata caactcactt cagtgttatt ggggaattaa
3301 acaaataaat gcatgggaag catttaacat agtgcctgac acaataatga gcactcagta
3361 gatgttagct tttattaata ttgttgttgc tatgtccaga aacactatac ctccagaaaa
3421 tcatgggtac ttgctgggga cgttggggat atgcatgatt ttgaaaggag tgactgctct
3481 ttactgctca gatgagaaat ttttctaagc cagactcctt caaacatgta agattctgtt
3541 gtggattcta ggactgaaag aattcttggc cgagtgtggt ggcttatcct ggtaatctca
3601 tcatttggga ggacaaggca ggaagattgc ttgagcccag gagttggaaa caagcctgga
3661 caacatggcg aaaccctgtc tctacaaaaa atacaaacat tagctggtca tgggagtgag
3721 tgcctgtact cccagctact caggaggcta agataggagg atcacctgag cctgggcagt
3781 ttgaggtttc agtgagccgt gatgacacca tactatactc cactccagcc tgggtgacag
3841 tgacatcctg cctcaaaaaa acccccaaaa ttattctttt tgctgatttc atgtcagcag
3901 tgtgtgctga aggctgtaaa gtagccactt gttctgttta tttttccatt gaacaagtat
3961 ttatcaaaaa cgtactttgt ggaaggcact gtgctaggaa ctatgcatac agaaggaaaa
4021 ccaaatgttc ttggatacta cactccagtt gtgataaaaa agaaaaaagt attcttcaca
4081 aacttcaaca ttttgatgtg caaaaacata atatatgaat tagatctacc taactacaca
4141 gaattagacc aattatttct gggattatgg gctcatattt ttaataactg tcctcctacc
4201 tctctgttga caggttttat aaatattcat ttaattacac acagtcacag acacactcag
4261 acacacacac atacacacac acacacacct tgacaaataa tgggcatgaa caattgactg
4321 gtacttgctc tcattcttct agatgtcacc acagtggatc ccaaatacaa ttattcaaag
4381 gatgcaaatg gtaagttttt gtgtttttta tttcctcctg atcattttaa gttttgaact
4441 tctctggctt gaaaaatcag ggaatggatt ttgctaggtt ggatgctgca gaatggacct
4501 aatcatattt taaattagtc cctctttttc taggagttgt attaacaaac ctaactactg
4561 cttcatgtaa gagatgactg taaattgaag ggtacagtga tatgctttca gttatttcaa
4621 aaaacagact ttactcatcc atgtgtcttt tttcttttct tttttttctt ttttgagacg
4681 gagtctcgct ctgttgaaca ggctggattg cagtgacgcg atctcacctc actacaacct
4741 ccgcctctgg agttcaagcg attctccagc ctcagcttct caagtagctg ggactacagg
4801 cacatgccac catgtccggg tcatctttgt atttttagca gagaccgggt ttcactatgt
4861 tggccaggct ggtctagaat tcctgacttc gtgatctgcc ccctcagccc tccgaagtgc
4921 tgggattaca gacgtgagtc actgtgcccg gcctaacagt aaaatgtctt tcatgcgctt
4981 ctcaaggcaa ctacgttaag gaggacactt ctcttaatgt cattctacag tagatttcta
5041 atgctctttc ttggaagttt gtttttctga gaaaagctaa aaatataaca tggaagtgat
5101 catattgtat aatcaatgaa gtgcttttca aggagataaa actaatctgg tccacgtttg
5161 caaccaacct tgattgagag agagagagaa ctcaggatac acttggagat tttattatgg
5221 ggaatagtta ctttattctt ttttcctcaa tcaattcatg gaaataagtg atagtcatat
5281 tcatttatct tttaataaat gaagtcacca tgaggaaaat aaaaagacat tgaaaaccca
5341 ttaaagttag cccttaaaga tatttggaca tgcagacttg ataactaacg tttgcattct
5401 tgagacttac ccaaaaccca tacctcaagt ccatgttttt agaattcatg aaataaagat
5461 ctcagtgagt gcataaaatt gcgcaccaga atcatatccg tatagacaag aacacatcta
5521 ctagaaaaat aataaaccaa cacaccaatg caactgtgtt ttcttctgtt ttaaaatatg
5581 ttgtctttgt atgcatgttt gcttcttcct tttttttttt taacatcaca gataaattca
5641 actctcacct caggttttat tgagagaact gtcaatgtga cttggcctct gtctttctag
5701 tcccagaaag aatcgcactg aaatgctgag ctcctgtaat aaaaatgacc atttgctgag
5761 agtaattaac atactgaaag agattttctt agagtacaca atggtgacat tatattgtct
5821 ctttataaat aactttctat ctatttctgt ggattattcc tacaaagtac ttttcatatg
5881 tccagtttct tttcttcccc tacaactacc gtctgaatac tggctctgct atttgctgat
5941 atgattctcg gcaagttgcc tgcacttttt aaactttatt tcctcattca gaacatgggg
6001 ccatgtaata ctcatgtacg tgagtattac gtaataatgc tcacttaagt gttactgggg
6061 aattaaacaa aaaaatgcat ggcaagcatt taacatagtg cctgacacaa taatgagcac
6121 tcagtagatg ttagatttta ttaatattgt tgttgttatg tccggaaaca ctatacctcc
6181 agaaaatcat gggtacttgc ttgggatgtt ggggatatgc atgatttgga aaggtatgac
6241 tgcttttttc tgcttagatg agaaattttt ctaagccaga ctccttcaaa tatgtaagat
6301 tctgttgtgg attctaggac ggaaagaatt cttggtcagg tgtggtttct tatccctgta
6361 atcccagaat tttgggagga caaggcagga agattgcttg agcccaggag tttgaaacca
6421 gcctgggcaa caagacgaaa ccctgtctct acaaaagtac ataaattagc ttggcttggt
6481 ggtgtgtgcc tgtattacca gctattcggg agactgagat gggaggatct cctgaacctg
6541 tgaagtttga ggcttcagtg agccgtgatg acaccatact atactcgact ccagcctgtg
6601 cgacagtgag actctgcgtc aaaaaaaaaa ccccaaaatt attgtttttg ctgatttcag
6661 gtcagcagtg tgtgctgaag ggtgtaaagt agccacttga tcagtttatt tttccactga
6721 acaagtattt atcaaaaaca tactttgtgg tctgtttttg ataaataaaa aggcactgtg
6781 ctaggagcca tgaatacaga aggaaaacca aatgttcttg gatactacac tccagttgtg
6841 ataaaaaaga aaaatgtatt cttcacgaac ttcaacattt tgatatgcaa aaacatagta
6901 tataaattag atctacctga ttacgtagaa tcagaccaat tatttctgga attgagggct
6961 catattttta ataactgtcc tcctgcctct ctgttgacag gttttataaa tattcattta
7021 attacacaca cacacacaca caccttgaca aataatggac atgaacaatt gactagtact
7081 tgctctcatt cttctagatg tcatcacaat ggatcccaaa gacaattggt caaaagatgc
7141 aaatggtaag cttttgtgtt tttcctttcc tcctgatcat tttaagtttt gaacttctct
7201 ggcttgaaaa atcagggaat gggccgggtg cggtggctca cgcctgtaat cccagcactt
7261 tgggaggccg aggcgggcgg atcacgaggt caggagatcg agaccatccc ggctaaaacg
7321 gtgaaacccc gtctctacta aaaatacaaa aaattagccg ggcttagtgg cgggcgcctg
7381 tagtcccagc tacttgggag gctgaggcag gagaatggcg tgaacccggg aggcggagct
7441 tgcagtgagc cgagattgcg ccactgcact ccactccagc ctgggcgaca gagcgagact
7501 ccgtctcaaa aaaaaaaaaa aaaaaaaaaa aagaaaaatc agggaatgga ttttgctagg
7561 ttggatgctg cagaatggac ctagtgatat tttaaattag tccctctttt tctaggagtt
7621 gtattaacaa acctaactac tgcttcgggt atgagatgac tgtaaattag agggtacagt
7681 gatatgcttt cagttatttc aaaaaacaga ctttattcat ccgtctgtct tttttttttt
7741 tttttttttt tttttttgag acggaggagt ctcactctat cacccaggct ggagtgcagt
7801 ggcgcgatct cggctcacca taacctccgc cttactggtt caagcgattc tccagcctca
7861 gcttctcaag tagctgggac tacaggtgca caccaccata cctggctaat ttttgtattt
7921 ttaatagaga tggggtttca ccacgctggc caggatggtc ttgaattctt gacctcgtga
7981 tctgccccct cgggctccca aacttctggg attataggcg tgagccactg tgcccggcct
8041 tctgtctttt gttataatga ctggggaaaa catgatacca tgttgcttct tgagttgttt
8101 tgttttagtc tttggtcttt gctagtagct aataacacga actagtgttt atcaagtgct
8161 ttttacacag aagggcttgt tctgcatttt ctagtttaat catcttaata ctcctataaa
8221 gtagtacaat atattttctc ccattttaca gtccctttaa agtaaataac tataaaaatc
8281 ccttatacat gtcacacagc taggtctggc atttcaaatc aggacatcaa acaaagaatt
8341 cgtgcagtta ctaagtcctc tattttttct acaatagaaa aaatagcaag aattacagat
8401 agcaagacat tacaaggcag gaatctgaaa cgaaagggac ataatgtggg gctgggtggg
8461 tgcatgagct ttgcagacta gactttcatt ccagctcttt taatgattag gtgtaagtga
8521 cctacatttt gtgagtaaca gttttctcat cagccaacta agaataatta caccagattc
8581 acagttattg aagagataag ggcatgaatg tgagatgtct ggcgtagggt atctcattta
8641 gcagacacag aatgaatact tgtttctggc tttttctctc tacatatgca caaagaatgt
8701 gactagaagc attggctcta gccctgctca actttcctct atttccaata ccaaggggct
8761 ctgacttagg ctgccacacc aggcaaggag gggcagtacc acctcacttg accaagggca
8821 gggagtcacg gacacatcac ttcctgagat ccttttccac accaaggact gatgtttctg
8881 gaattctcac tttatgaaga caaaacatat aaatggaaat ttctgcagga agagactcac
8941 tcttgtagct cattgagtag gcactagtgg tccaccccca ctgtctttac ttattccttg
9001 acatcacata tctcttgtaa aacctcaaat aatgttaaat gcaatcaccc aataatagca
9061 tagccataat tagaggcatt taggaaagac aggtgagtgt gccacaacta cctaacacat
9121 cagcaaatct ggattaacca ctttctttga ttttccacaa tgcaacctta ctttttaata
9181 gttgggaatg ttctaagtga atttagcaga ggttgttaat caacttgaaa gctgaattct
9241 gacttgtctg actcttggtg gtgctggtag cagtagatgt ttacttttag gttttggtgg
9301 tggtggaata tcacttcaac gtaaatcatc agaaataagt atttgtgaac ccctctcgca
9361 ttaatatatc ttattctgta aaaagaacat gtgcaatttc tcttagatac actactgctg
9421 cagctcacaa acacctctgc atattacacg tacctcctcc tgctcctcaa gagtgtggtc
9481 tattttgcca tcatcacctg ctgtctgctt agaagaacgg ctttctgctg caatggagag
9541 aaatcataa [SEQ ID NO:33]
В соответствии с раскрытым в данном документе предметом изобретения "молекула нуклеиновой кислоты TRGC" относится к полинуклеотиду, кодирующему полипептид TRGC.
В определенных вариантах осуществления константный домен раскрытого в данном документе HI-TCR содержит нативный или модифицированный пептид TRDC. В определенных вариантах осуществления полипептид TRDC имеет аминокислотную последовательность, которая по меньшей мере приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или на 100% гомологична или идентична аминокислотной последовательности, приведенной в SEQ ID NO: 41, которая приведена ниже.
SQPHTKPSVF VMKNGTNVAC LVKEFYPKDI RINLVSSKKI TEFDPAIVIS
PSGKYNAVKL GKYEDSNSVT CSVQHDNKTV HSTDFEVKTD STDHVKPKET
ENTKQPSKSC HKPKAIVHTE KVNMMSLTVL GLRMLFAKTV AVNFLLTAKL
FFL [SEQ ID NO:41]
В определенных неограничивающих вариантах осуществления константный область T-клеточного рецептора содержит шарнирную/спейсерную область, которая связывает внеклеточный антигенсвязывающий домен с константным доменом. Шарнирная/спейсерная область может быть достаточно гибкой, чтобы позволить антигенсвязывающему домену ориентироваться в разных направлениях для облегчения распознавания антигена. В определенных неограничивающих вариантах осуществления шарнирная/спейсерная область может представлять собой шарнирную область IgG1 или область CH2CH3 иммуноглобулина и части CD3, часть полипептида CD28, часть полипептида CD8, вариант любого из вышеперечисленного, который по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90% или по меньшей мере приблизительно на 95% ему гомологичен или идентичен, или синтетическую спейсерную последовательность. В определенных неограничивающих вариантах осуществления шарнирная/спейсерная область CAR может содержать нативную или модифицированную шарнирную область полипептида CD3ζ, полипептида CD40, полипептида 4-1BB, полипептида OX40, пептида CD166, пептида CD166, пептида CD8a, пептида CD8b, полипептида ICOS, пептида ICAM-1, пептида CTLA-4, синтетический пептид (не основанный на белке, связанном с иммунным ответом) или их комбинацию.
2.4. Внутриклеточный сигнальный домен
В определенных неограничивающих вариантах осуществления раскрытый в данном документе HI-TCR содержит антигенсвязывающую цепь, которая не содержит внутриклеточный домен. В определенных вариантах осуществления антигенсвязывающая цепь способна связываться с полипептидом CD3ζ. В определенных вариантах осуществления антигенсвязывающая цепь содержит константный домен, который способен связываться с полипептидом CD3ζ. В определенных вариантах осуществления полипептид CD3ζ является эндогенным. В определенных вариантах осуществления полипептид CD3ζ является экзогенным. В определенных вариантах осуществления связывание антигенсвязывающей цепи с антигеном способно активировать полипептид CD3ζ, связанный с антигенсвязывающей цепью. В определенных вариантах осуществления экзогенный полипептид CD3ζ слит или интегрирован с костимулирующей молекулой, раскрытой в настоящем документе.
В определенных неограничивающих вариантах осуществления раскрытый в данном документе HI-TCR содержит антигенсвязывающую цепь, которая содержит внутриклеточный домен. В определенных вариантах осуществления внутриклеточный домен содержит полипептид CD3ζ. В определенных вариантах осуществления связывание антигенсвязывающей цепи с антигеном способно активировать полипептид CD3ζ антигенсвязывающей цепи.
Активированный полипептид CD3ζ может активировать и/или стимулировать иммунореактивную клетку (например, клетку лимфоидной линии, например T-клетку). CD3ζ содержит три иммунорецепторных тирозиновых активирующих мотива (ITAM1, ITAM2 и ITAM3), три богатых основными участками области (BRS) (BRS1, BRS2 и BRS3) и передает сигнал активации клетке (например, клетке лимфоидной линии, например T-клетке) после связывания антигена с антигенсвязывающей цепью. Внутриклеточный сигнальный домен CD3ζ-цепи является первичным передатчиком сигналов от эндогенных TCR. В определенных вариантах осуществления полипептид CD3ζ содержит или имеет аминокислотную последовательность, которая по меньшей мере приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или приблизительно на 100% гомологична последовательности, имеющей ссылочный номер NCBI: NP_932170 (SEQ ID NO: 17), ссылочный номер NCBI: NP_000725.1 (SEQ ID NO: 18), или ее фрагментам, и/или может, необязательно, содержать вплоть до одной, или вплоть до двух, или вплоть до трех консервативный аминокислотных замен. В определенных неограничивающих вариантах осуществления полипептид CD3ζ содержит или имеет аминокислотную последовательность, которая является последовательной частью SEQ ID NO: 17, которая имеет длину по меньшей мере 20, или по меньшей мере 30, или по меньшей мере 40, или по меньшей мере 50 и вплоть до 164 аминокислот. Альтернативно или дополнительно, в различных неограничивающих вариантах осуществления полипептид CD3ζ содержит или имеет аминокислотную последовательность аминокислот 1-164, 1-50, 50-100, 100-150 или 150-164 из SEQ ID NO: 17. В определенных вариантах осуществления полипептид CD3ζ содержит или имеет аминокислотную последовательность аминокислот 52-164 из SEQ ID NO: 17.
SEQ ID NO: 17 приведена ниже:
1 MKWKALFTAA ILQAQLPITE AQSFGLLDPK LCYLLDGILF IYGVILTALF LRVKFSRSAD
61 APAYQQGQNQ LYNELNLGRR EEYDVLDKRR GRDPEMGGKP QRRKNPQEGL YNELQKDKMA
121 EAYSEIGMKG ERRRGKGHDG LYQGLSTATK DTYDALHMQA LPPR [SEQ ID NO: 17]
В определенных вариантах осуществления внутриклеточный сигнальный домен содержит человеческий полипептид CD3ζ. Человеческий полипептид CD3ζ может содержать или иметь аминокислотную последовательность, которая по меньшей мере приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или приблизительно на 100% гомологична или идентична SEQ ID NO: 18 или ее фрагментам, и/или может, необязательно, содержать вплоть до одной, или вплоть до двух, или вплоть до трех консервативный аминокислотных замен. SEQ ID NO: 18 приведена ниже:
RVKFSRSADA PAYQQGQNQL YNELNLGRRE EYDVLDKRRG RDPEMGGKPR RKNPQEGLYN
ELQKDKMAEA YSEIGMKGER RRGKGHDGLY QGLSTATKDT YDALHMQALP PR [SEQ ID NO: 18].
Типичная последовательность нуклеиновой кислоты, кодирующая аминокислотную последовательность SEQ ID NO: 18, приведена в SEQ ID NO: 19, которая приведена ниже.
AGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACCAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGC [SEQ ID NO: 19]
2.4.1. Костимулирующая область
В определенных неограничивающих вариантах осуществления раскрытый в данном документе HI-TCR содержит антигенсвязывающую цепь, которая содержит внутриклеточный домен, причем внутриклеточный домен содержит костимулирующую область. В определенных вариантах осуществления внутриклеточный домен содержит костимулирующую область и полипептид CD3ζ. В определенных вариантах осуществления внутриклеточный домен содержит костимулирующую область и не содержит полипептид CD3ζ.
В определенных вариантах осуществления костимулирующая область содержит по меньшей мере одну костимулирующую молекулу, которая может обеспечивать оптимальную активацию лимфоцитов. В контексте настоящего документа "костимулирующие молекулы" относятся к молекулам клеточной поверхности, отличным от антигенных рецепторов или их лигандов, которые необходимы для эффективного ответа лимфоцитов на антиген. По меньшей мере одна костимулирующая сигнальная область может включать в себя полипептид CD28, полипептид 4-1BB, полипептид OX40, полипептид ICOS, полипептид DAP-10 или их комбинацию. Костимулирующая молекула может связываться с костимулирующим лигандом, который представляет собой белок, экспрессируемый на клеточной поверхности, который после связывания со своим рецептором вызывает ответ костимуляции, т.е. внутриклеточный ответ, который влияет на стимуляцию, обеспечиваемую, когда антиген связывается с молекулой своего CAR. Костимулирующие лиганды, включают, но без ограничения, CD80, CD86, CD70, OX40L и 4-1BBL. В одном примере лиганд 4-1BB (т.е. 4-1BBL) может связываться с 4-1BB (также известным как "CD137") для обеспечения внутриклеточного сигнала, который в сочетании с сигналом CAR индуцирует эффекторную клеточную функцию CAR+ T-клетки. CAR, содержащие внутриклеточный сигнальный домен, который содержит костимулирующую сигнальную область, содержащую 4-1BB, ICOS или DAP-10, раскрыты в патенте США 7446190, который включен в настоящий документ посредством ссылки во всей полноте.
В определенных вариантах осуществления костимулирующая область антигенсвязывающей цепи HI-TCR содержит костимулирующую сигнальную область, которая содержит полипептид CD28. Полипептид CD28 может содержать или иметь аминокислотную последовательность, которая по меньшей мере приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или на 100% гомологична или идентична последовательности, имеющей ссылочный номер NCBI: P10747 или NP_006130 (SEQ ID NO: 20), или ее фрагментам, и/или может, необязательно, содержать вплоть до одной, или вплоть до двух, или вплоть до трех консервативный аминокислотных замен. В неограничивающих определенных вариантах осуществления полипептид CD28 содержит или имеет аминокислотную последовательность, которая является последовательной частью SEQ ID NO: 20, которая имеет длину по меньшей мере 20, или по меньшей мере 30, или по меньшей мере 40, или по меньшей мере 50 и вплоть до 220 аминокислот. Альтернативно или дополнительно, в различных неограничивающих вариантах осуществления полипептид CD28 содержит или имеет аминокислотную последовательность аминокислот 1-220, 1-50, 50-100, 100-150, 114-220, 150-200 или 200-220 из SEQ ID NO: 20. В определенных вариантах осуществления костимулирующая область содержит костимулирующую сигнальную область, которая содержит полипептид CD28, содержащий или имеющий аминокислотную последовательность аминокислот 180-220 из SEQ ID NO: 20.
1 MLRLLLALNL FPSIQVTGNK ILVKQSPMLV AYDNAVNLSC KYSYNLFSRE FRASLHKGLD
61 SAVEVCVVYG NYSQQLQVYS KTGFNCDGKL GNESVTFYLQ NLYVNQTDIY FCKIEVMYPP
121 PYLDNEKSNG TIIHVKGKHL CPSPLFPGPS KPFWVLVVVG GVLACYSLLV TVAFIIFWVR
181 SKRSRLLHSD YMNMTPRRPG PTRKHYQPYA PPRDFAAYRS [SEQ ID NO: 20]
В определенных вариантах осуществления костимулирующая область содержит человеческий внутриклеточный сигнальный домен CD28. Человеческий внутриклеточный сигнальный домен CD28 может содержать или иметь аминокислотную последовательность, которая по меньшей мере приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или приблизительно на 100% гомологична или идентична SEQ ID NO: 21 или ее фрагментам, и/или может, необязательно, содержать вплоть до одной, или вплоть до двух, или вплоть до трех консервативный аминокислотных замен. SEQ ID NO: 21 приведена ниже:
RSKRSRLLHS DYMNMTPRRP GPTRKHYQPY APPRDFAAYR S [SEQ ID NO: 21].
Типичная последовательность нуклеиновой кислоты, кодирующая аминокислотную последовательность SEQ ID NO: 21, приведена в SEQ ID NO: 22, которая приведена ниже.
AGGAGTAAGAGGAGCAGGCTCCTGCACAGTGACTACATGAACATGACTCCCCGCCGCCCCGGGCCCACCCGCAAGCATTACCAGCCCTATGCCCCACCACGCGACTTCGCAGCCTATCGCTCC [SEQ ID NO: 22]
В определенных вариантах осуществления костимулирующая область содержит костимулирующую сигнальную область, которая содержит две костимулирующие молекулы, например костимулирующие сигнальные области CD28 и 4-1BB или костимулирующие сигнальные области CD28 и OX40.
4-1BB может действовать как лиганд фактора некроза опухоли (TNF) и обладает стимулирующей активностью. Полипептид 4-1BB может содержать или иметь аминокислотную последовательность, которая по меньшей мере приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или приблизительно на 100% гомологична или идентична последовательности, имеющей ссылочный номер NCBI: P41273 или NP_001552 (SEQ ID NO: 23), или ее фрагментам, и/или может, необязательно, содержать вплоть до одной, или вплоть до двух, или вплоть до трех консервативный аминокислотных замен.
SEQ ID NO: 23 приведена ниже:
1 MGNSCYNIVA TLLLVLNFER TRSLQDPCSN CPAGTFCDNN RNQICSPCPP NSFSSAGGQR
61 TCDICRQCKG VFRTRKECSS TSNAECDCTP GFHCLGAGCS MCEQDCKQGQ ELTKKGCKDC
121 CFGTFNDQKR GICRPWTNCS LDGKSVLVNG TKERDVVCGP SPADLSPGAS SVTPPAPARE
181 PGHSPQIISF FLALTSTALL FLLFFLTLRF SVVKRGRKKL LYIFKQPFMR PVQTTQEEDG
241 CSCRFPEEEE GGCEL [SEQ ID NO: 23]
В соответствии с раскрытым в данном документе предметом изобретения "молекула нуклеиновой кислоты 4-1BB" относится к полинуклеотиду, кодирующему полипептид 4-1BB.
В определенных вариантах осуществления костимулирующая область содержит внутриклеточный сигнальный домен 4-1BB. Внутриклеточный сигнальный домен 4-1BB может содержать или иметь аминокислотную последовательность, которая по меньшей мере приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или приблизительно на 100% гомологична или идентична SEQ ID NO: 24 или ее фрагментам, и/или может, необязательно, содержать вплоть до одной, или вплоть до двух, или вплоть до трех консервативный аминокислотных замен. SEQ ID NO: 24 приведена ниже:
KRGRKKLLYI FKQPFMRPVQ TTQEEDGCSC RFPEEEEGGC EL [SEQ ID NO: 24].
Типичная последовательность нуклеиновой кислоты, кодирующая аминокислотную последовательность SEQ ID NO: 24, приведена в SEQ ID NO: 27, которая приведена ниже.
AAACGGGGCAGAAAGAAACTCCTGTATATATTCAAACAACCATTTATGAGACCAGTACAAACTACTCAAGAGGAAGATGGCTGTAGCTGCCGATTTCCAGAAGAAGAAGAAGGAGGATGTGAACTG [SEQ ID NO: 27]
Полипептид OX40 может содержать или иметь аминокислотную последовательность, которая по меньшей мере приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или приблизительно на 100% гомологична или идентична последовательности, имеющей ссылочный номер NCBI: P43489 или NP_003318 (SEQ ID NO: 25), или ее фрагментам, и/или может, необязательно, содержать вплоть до одной, или вплоть до двух, или вплоть до трех консервативный аминокислотных замен.
SEQ ID NO: 25 приведена ниже:
1 MCVGARRLGR GPCAALLLLG LGLSTVTGLH CVGDTYPSND RCCHECRPGN GMVSRCSRSQ
61 NTVCRPCGPG FYNDVVSSKP CKPCTWCNLR SGSERKQLCT ATQDTVCRCR AGTQPLDSYK
121 PGVDCAPCPP GHFSPGDNQA CKPWTNCTLA GKHTLQPASN SSDAICEDRD PPATQPQETQ
181 GPPARPITVQ PTEAWPRTSQ GPSTRPVEVP GGRAVAAILG LGLVLGLLGP LAILLALYLL
241 RRDQRLPPDA HKPPGGGSFR TPIQEEQADA HSTLAKI [SEQ ID NO: 25]
В соответствии с раскрытым в данном документе предметом изобретения "молекула нуклеиновой кислоты OX40" относится к полинуклеотиду, кодирующему полипептид OX40.
Полипептид ICOS может содержать или иметь аминокислотную последовательность, которая по меньшей мере приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или приблизительно на 100% гомологична или идентична последовательности, имеющей ссылочный номер NCBI: NP_036224 (SEQ ID NO: 26), или ее фрагментам, и/или может, необязательно, содержать вплоть до одной, или вплоть до двух, или вплоть до трех консервативный аминокислотных замен.
SEQ ID NO: 26 приведена ниже:
1 MKSGLWYFFL FCLRIKVLTG EINGSANYEM FIFHNGGVQI LCKYPDIVQQ FKMQLLKGGQ
61 ILCDLTKTKG SGNTVSIKSL KFCHSQLSNN SVSFFLYNLD HSHANYYFCN LSIFDPPPFK
121 VTLTGGYLHI YESQLCCQLK FWLPIGCAAF VVVCILGCIL ICWLTKKKYS SSVHDPNGEY
181 MFMRAVNTAK KSRLTDVTL [SEQ ID NO: 26]
В соответствии с раскрытым в данном документе предметом изобретения "молекула нуклеиновой кислоты ICOS" относится к полинуклеотиду, кодирующему полипептид ICOS.
В определенных вариантах осуществления сайты мутаций и/или соединения между доменами/мотивами/областями CAR, полученными из различных белков, деиммунизируются. Иммуногенность соединений между различными фрагментами CAR можно прогнозировать с помощью NetMHC 4.0 Server. Для каждого пептида, содержащего по крайней мере 1 а.к. из следующего фрагмента, можно прогнозировать аффинность связывания с HLA A, B и C для всех аллелей. Каждому пептиду может быть присвоена оценка иммуногенности каждого пептида. Оценка иммуногенности может быть рассчитана по формуле Оценка иммуногенности = [(50 - аффинность связывания) * частота HLA]n. n представляет собой номер прогноза для каждого пептида.
2.5. Комплекс CD3
В определенных вариантах осуществления раскрытый в данном документе HI-TCR способен связываться с комплексом CD3 (также известным как "T-клеточный корецептор"). В определенных вариантах осуществления HI-TCR и комплекс CD3 образуют антиген-распознающий рецепторный комплекс, аналогичный нативному комплексу TCR/CD3. В определенных вариантах осуществления комплекс CD3 является эндогенным. В определенных вариантах осуществления комплекс CD3 является экзогенным. В определенных вариантах осуществления раскрытый в данном документе HI-TCR заменяет нативный и/или эндогенный TCR в комплексе CD3/TCR. В определенных вариантах осуществления комплекс CD3 содержит цепь CD3γ, цепь CD3δ и две цепи CD3ε.
В определенных вариантах осуществления цепь CD3γ содержит или имеет аминокислотную последовательность, которая по меньшей мере приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или приблизительно на 100% гомологична или идентична ссылочному номеру NCBI: NP_000064.1 (SEQ ID NO: 34, которая приведена ниже) или ее фрагментам и/или может, необязательно, содержать вплоть до одной, или вплоть до двух, или вплоть до трех консервативный аминокислотных замен.
1 meqgkglavl ilaiillqgt laqsikgnhl vkvydyqedg svlltcdaea knitwfkdgk
61 migfltedkk kwnlgsnakd prgmyqckgs qnkskplqvy yrmcqnciel naatisgflf
121 aeivsifvla vgvyfiagqd gvrqsrasdk qtllpndqly qplkdreddq yshlqgnqlr
181 rn [SEQ ID NO:34]
В определенных вариантах осуществления цепь CD3δ содержит или имеет аминокислотную последовательность, которая по меньшей мере приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или приблизительно на 100% гомологична или идентична ссылочным номерам NCBI: NP_000723.1 (SEQ ID NO: 35, которая приведена ниже), NP_001035741.1 (SEQ ID NO: 36, которая приведена ниже) или их фрагментам и/или может, необязательно, содержать вплоть до одной, или вплоть до двух, или вплоть до трех консервативный аминокислотных замен.
1 mehstflsgl vlatllsqvs pfkipieele drvfvncnts itwvegtvgt llsditrldl
61 gkrildprgi yrcngtdiyk dkestvqvhy rmcqscveld patvagiivt dviatlllal
121 gvfcfaghet grlsgaadtq allrndqvyq plrdrddaqy shlggnwarn k [SEQ ID NO: 35]
1 mehstflsgl vlatllsqvs pfkipieele drvfvncnts itwvegtvgt llsditrldl
61 gkrildprgi yrcngtdiyk dkestvqvhy rtadtqallr ndqvyqplrd rddaqyshlg
121 gnwarnk [SEQ ID NO: 36]
В определенных вариантах осуществления цепь CD3ε содержит или имеет аминокислотную последовательность, которая по меньшей мере приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или приблизительно на 100% гомологична или идентична ссылочному номеру NCBI: NP_000724.1 (SEQ ID NO: 37, которая приведена ниже) или ее фрагментам и/или может, необязательно, содержать вплоть до одной, или вплоть до двух, или вплоть до трех консервативный аминокислотных замен.
1 mqsgthwrvl glcllsvgvw gqdgneemgg itqtpykvsi sgttviltcp qypgseilwq
61 hndkniggde ddknigsded hlslkefsel eqsgyyvcyp rgskpedanf ylylrarvce
121 ncmemdvmsv ativivdici tggllllvyy wsknrkakak pvtrgagagg rqrgqnkerp
181 ppvpnpdyep irkgqrdlys glnqrri [SEQ ID NO: 37]
В определенных вариантах осуществления рекомбинантный TCR проявляет большую чувствительность к антигену, чем CAR, нацеленный на тот же антиген. В определенных вариантах осуществления рекомбинантный TCR способен вызывать иммунный ответ при связывании с антигеном, который имеет низкую плотность на поверхности опухолевой клетки. В определенных вариантах осуществления иммунореактивные клетки, содержащие раскрытый в данном документе HI-TCR, можно использовать для лечения субъекта, имеющего опухолевые клетки с низким уровнем экспрессии поверхностного антигена, например при рецидиве заболевания, причем субъект получал лечение, которое ведет к остаточным опухолевым клеткам. В определенных вариантах осуществления опухолевые клетки имеют низкую плотность молекулы-мишени на поверхности опухолевых клеток. В определенных вариантах осуществления молекула-мишень, имеющая низкую плотность на клеточной поверхности, имеет плотность менее приблизительно 5000 молекул на клетку, менее приблизительно 4000 молекул на клетку, менее приблизительно 3000 молекул на клетку, менее приблизительно 2000 молекул на клетку, менее приблизительно 1500 молекул на клетку, менее приблизительно 1000 молекул на клетку, менее приблизительно 500 молекул на клетку, менее приблизительно 200 молекул на клетку или менее приблизительно 100 молекул на клетку. В определенных вариантах осуществления молекула-мишень, имеющая низкую плотность на клеточной поверхности, имеет плотность менее приблизительно 2000 молекул на клетку. В определенных вариантах осуществления молекула-мишень, имеющая низкую плотность на клеточной поверхности, имеет плотность менее приблизительно 1500 молекул на клетку. В определенных вариантах осуществления молекула-мишень, имеющая низкую плотность на клеточной поверхности, имеет плотность менее приблизительно 1000 молекул на клетку. В определенных вариантах осуществления молекула-мишень, имеющая низкую плотность на клеточной поверхности, имеет плотность между приблизительно 4000 молекул на клетку и приблизительно 2000 молекул на клетку, между приблизительно 2000 молекул на клетку и приблизительно 1000 молекул на клетку, между приблизительно 1500 молекул на клетку и приблизительно 1000 молекул на клетку, между приблизительно 2000 молекул на клетку и приблизительно 500 молекул на клетку, между приблизительно 1000 молекул на клетку и приблизительно 200 молекул на клетку или между приблизительно 1000 молекул на клетку и приблизительно 100 молекул на клетку.
2.6. HI-TCR 19
В определенных вариантах осуществления раскрытый в данном документе HI-TCR содержит две антигенсвязывающие цепи, например VL-TRAC и VH-TRBC, которые способны к димеризации, причем HI-TCR связывается с CD19 (например, с человеческим CD19).
VL-TRAC
В определенных вариантах осуществления раскрытый в данном документе HI-TCR содержит антигенсвязывающую цепь, которая содержит внеклеточный антигенсвязывающий домен домена VL антитела и константный домен TRAC. В определенных вариантах осуществления антитело связывается с CD19 (например, с человеческим CD19). В определенных вариантах осуществления антигенсвязывающую цепь обозначают "VL-TRAC".
VH-TRBC
В определенных вариантах осуществления раскрытый в данном документе HI-TCR содержит антигенсвязывающую цепь, которая содержит внеклеточный антигенсвязывающий домен домена VH антитела и константный домен TRBC. В определенных вариантах осуществления антитело связывается с CD19 (например, с человеческим CD19). В определенных вариантах осуществления антигенсвязывающую цепь обозначают "VH-TRBC".
3. Иммунореактивные клетки
Раскрытый в данном документе предмет изобретения предлагает иммунореактивные клетки, содержащие раскрытый в данном документе HI-TCR. В определенных вариантах осуществления HI-TCR способен активировать иммунореактивную клетку. При связывании с антигеном иммунореактивные клетки проявляют цитолитические эффекты по отношению к клеткам, несущим антиген. В определенных вариантах осуществления иммунореактивные клетки, содержащие HI-TCR, проявляют сравнимую или лучшую терапевтическую эффективность по сравнению с клетками, содержащими химерный антигенный рецептор (CAR), нацеленный на тот же антиген. В определенных вариантах осуществления иммунореактивные клетки, содержащие HI-TCR, проявляют сравнимые или лучшие цитолитические эффекты по сравнению с клетками, содержащими химерный антигенный рецептор (CAR), нацеленный на тот же антиген. В определенных вариантах осуществления иммунореактивные клетки, содержащие HI-TCR, секретируют противоопухолевые цитокины. Цитокины, секретируемые иммунореактивными клетками, включают, но без ограничения, TNFα, IFNγ и IL2.
Иммунореактивные клетки раскрытого в данном документе предмета изобретения могут представлять собой клетки лимфоидной линии. Лимфоидная линия, содержащая B-клетки, T-клетки и естественные киллеры (NK), обеспечивает продукцию антител, регуляцию клеточной иммунной системы, обнаружение чужеродных агентов в крови, обнаружение чужеродных для хозяина клеток и т.п. Неограничивающие примеры иммунореактивных клеток лимфоидной линии включают T-клетки, естественные киллерные T-клетки (NKT-клетки) и их предшественники, включая эмбриональные стволовые клетки и плюрипотентные стволовые клетки (например, те, из которых могут дифференцироваться лимфоидные клетки). T-клетки могут представлять собой лимфоциты, которые созревают в тимусе и в основном отвечают за клеточный иммунитет. T-клетки включены в адаптивную иммунную систему. T-клетки раскрытого в данном документе предмета изобретения могут быть Т-клетками любого типа, включая, но без ограничения, хелперные T-клетки, цитотоксические T-клетки, T-клетки памяти (включая центральные T-клетки памяти, подобные стволовым клеткам T-клетки памяти (или стволовые T-клетки памяти) и два типа эффекторных T-клеток памяти: например, TEM-клетки и TEMRA-клетки), регуляторные T-клетки (также известные как супрессорные T-клетки), T-клетки-естественные киллеры, связанные со слизистой оболочкой инвариантные T-клетки и γδ-T-клетки. Цитотоксические T-клетки (CTL или киллерные T-клетки) представляют собой субпопуляцию Т-лимфоцитов, способных вызывать гибель инфицированных соматических или опухолевых клеток. Собственные Т-клетки пациента могут быть генетически модифицированы для нацеливания на определенные антигены через введение HI-TCR. В определенных вариантах осуществления иммунореактивная клетка представляет собой T-клетку. T-клетка может представлять собой CD4+ T-клетку или CD8+ T-клетку. В определенных вариантах осуществления T-клетка представляет собой CD4+ T-клетку. В определенных вариантах осуществления T-клетка представляет собой CD8+ T-клетку.
В определенных вариантах осуществления иммунореактивная клетка содержит по меньшей мере один костимулирующий лиганд, экзогенный или рекомбинантный (например, клетка трансдуцирована им). В определенных вариантах осуществления иммунореактивная клетка коэкспрессирует HI-TCR и по меньшей мере один экзогенный костимулирующий лиганд. Взаимодействие между HI-TCR и по меньшей мере одним экзогенным костимулирующим лигандом обеспечивает не специфический к антигену сигнал, важный для полной активации иммунореактивной клетки (например, T-клетки). Костимулирующие лиганды включают, но без ограничения, членов суперсемейства факторов некроза опухоли (TNF) и лиганды суперсемейства иммуноглобулинов (Ig). TNF является цитокином, участвующим в системном воспалении и стимулирующим реакцию острой фазы. Его основная роль заключается в регуляции иммунных клеток. Члены суперсемейства TNF обладают рядом общих черт. Большинство членов суперсемейства TNF синтезируются как трансмембранные белки типа II (внеклеточный C-конец), содержащие короткий цитоплазматический сегмент и относительно длинную внеклеточную область. Члены суперсемейства TNF включают, но без ограничения, фактор роста нервов (NGF), CD40L (CD40L)/CD154, CD137L/4-1BBL, TNF-α, CD134L/OX40L/CD252, CD27L/CD70, лиганд Fas (FasL), CD30L/CD153, фактор некроза опухоли бета (TNFβ)/лимфотоксин-альфа (LTα), лимфотоксин-бета (LTβ), CD257/фактор активации B-клеток (BAFF)/Blys/THANK/Tall-1, лиганд индуцируемого глюкокортикоидами рецептора TNF (GITRL) и связанный с TNF индуцирующий апоптоз лиганд (TRAIL), LIGHT (TNFSF14). Суперсемейство иммуноглобулинов (Ig) представляет собой большую группу белков клеточной поверхности и растворимых белков, которые участвуют в процессах распознавания, связывания или адгезии клеток. Эти белки имеют общие структурные особенности с иммуноглобулинами - они имеют иммуноглобулиновый домен (укладку). Лиганды суперсемейства иммуноглобулинов включают, но без ограничения, CD80 и CD86, два лиганда CD28. В определенных вариантах осуществления по меньшей мере один костимулирующий лиганд выбирают из группы, состоящей из 4-1BBL, CD275, CD80, CD86, CD70, OX40L, CD48, TNFRSF14 и их комбинации. В определенных вариантах осуществления иммунореактивная клетка содержит или включает в себя один экзогенный или рекомбинантный костимулирующий лиганд. В определенных вариантах осуществления один экзогенный или рекомбинантный костимулирующий лиганд представляет собой 4-1BBL или CD80. В определенных вариантах осуществления один экзогенный или рекомбинантный костимулирующий лиганд представляет собой 4-1BBL. В определенных вариантах осуществления иммунореактивная клетка содержит или включает в себя два экзогенных или рекомбинантных костимулирующих лиганда. В определенных вариантах осуществления два экзогенных или рекомбинантных костимулирующих лиганда представляют собой 4-1BBL и CD80.
В определенных вариантах осуществления иммунореактивная клетка может содержать или быть трансдуцирована по меньшей мере одним химерным костимулирующим рецептором (CCR). В контексте настоящего документа термин "химерный костимулирующий рецептор" или "CCR" относится к химерному рецептору, который связывается с антигеном и после связывания с антигеном передает костимулирующий сигнал клетке (например, T-клетке), содержащей CCR, но сам по себе не передает клетке сигнал активации. CCR описан в Krause, et al., J. Exp. Med. (1998);188(4):619-626, и US20020018783, который включен посредством ссылки во всей полноте. CCR имитируют костимулирующие сигналы, но в отличие от CAR, не обеспечивают сигнал активации T-клетки, например у CCR нет полипептида CD3ζ. CCR обеспечивают костимуляцию, например CD28-подобный сигнал, в отсутствие природного костимулирующего лиганда на антигенпрезентирующей клетке. Комбинаторное распознавание антигена, т.е. использование CCR в комбинации с CAR, может увеличивать реактивность T-клеток в отношении экспрессирующих два антигена T-клеток, тем самым улучшая избирательное нацеливание на опухоль. Смотри WO2014/055668, который включен посредством ссылки во всей полноте. Kloss et al. описывают стратегию, которая объединяет комбинаторное распознавание антигена, разделение сигнализации и, что особенно важно, баланс силы активации и костимуляции T-клеток, для генерации Т-клеток, которые устраняют клетки-мишени, которые экспрессируют комбинацию антигенов, при сохранении клеток, которые экспрессируют каждый из антигенов по отдельности (Kloss et al., Nature Biotechnology (2013);31(1):71-75, содержание которой включено посредством ссылки во всей полноте). При таком подходе для активации Т-клеток требуется опосредованное CAR распознавание одного антигена, тогда как костимуляция независимо опосредуется CCR, специфичным ко второму антигену. Для достижения селективности в отношении опухоли комбинаторный подход к распознаванию антигена снижает эффективность активации Т-клеток до уровня, при котором они неэффективны без помощи, обеспечиваемой одновременным распознаванием CCR второго антигена.
В определенных вариантах осуществления CCR содержит внеклеточный антигенсвязывающий домен, который связывается со вторым антигеном, трансмембранный домен и костимулирующую сигнальную область, которая содержит по меньшей мере одну костимулирующую молекулу. В определенных вариантах осуществления CCR сам по себе не передает в клетку сигнал активации. Неограничивающие примеры костимулирующих молекул включают CD28, 4-1BB, OX40, ICOS, DAP-10 и любую их комбинацию. В определенных вариантах осуществления костимулирующая сигнальная область CCR содержит одну костимулирующую сигнальную молекулу. В определенных вариантах осуществления одна костимулирующая сигнальная молекула представляет собой CD28. В определенных вариантах осуществления одна костимулирующая сигнальная молекула представляет собой 4-1BB. В определенных вариантах осуществления костимулирующая сигнальная область содержит две костимулирующие сигнальные молекулы. В определенных вариантах осуществления две костимулирующие сигнальные молекулы представляют собой CD28 и 4-1BB. Второй антиген выбирают таким образом, чтобы экспрессия как первого антигена, так и второго антигена была ограничена клетками-мишенями (например, раковой тканью или раковыми клетками). Аналогично CAR, внеклеточный антигенсвязывающий домен может представлять собой scFv, Fab, F(ab)2 или слитый белок с гетерологичной последовательностью для образования внеклеточного антигенсвязывающего домена.
В определенных вариантах осуществления CCR коэкспрессируется с HI-TCR, связывающимся с антигеном, который отличается от антигена, с которым связывается CCR, например HI-TCR связывается с первым антигеном, а CCR связывается со вторым антигеном.
Типы человеческих лимфоцитов раскрытого в данном документе предмета изобретения включают, без ограничения, периферические донорские лимфоциты, например раскрытые в Sadelain, М., et al. 2003 Nat Rev Cancer 3:35-45 (раскрывает периферические донорские лимфоциты, генетически модифицированные для экспрессии CAR), в Morgan, R.A., et al. 2006 Science 314:126-129 (раскрывает периферические донорские лимфоциты, генетически модифицированные для экспрессии полноразмерного распознающего опухолевый антиген T-клеточного рецепторного комплекса, содержащего гетеродимер α и β), в Panelli, М.C., et al. 2000 J Immunol 164:495-504; Panelli, М.C., et al. 2000 J Immunol 164:4382-4392 (раскрывают культуры лимфоцитов, получаемых из инфильтрирующих опухоль лимфоцитов (TIL) в опухолевых биопсиях) и в Dupont, J., et al. 2005 Cancer Res 65:5417-5427; Papanicolaou, G.A., et al. 2003 Blood 102:2498-2505 (раскрывают селективно размножаемые in vitro антиген-специфические лейкоциты периферической крови с использованием искусственных антигенпрезентирующих клеток (AAPC) или обученных дендритных клеток). Иммунореактивные клетки (например, T-клетки) могут быть аутологичными, не аутологичными (например, аллогенными) или полученными in vitro из сконструированных клеток-предшественников или стволовых клеток.
Раскрытые в данном документе иммунореактивные клетки способны модулировать микроокружение опухоли. Опухоли имеют микроокружение, которое враждебно иммунному ответу хозяина и задействует ряд механизмов злокачественных клеток для их защиты от иммунного распознавания и устранения. Это "враждебное микроокружение опухоли" содержит множество иммуносупрессорных факторов, включая инфильтрирующие регуляторные CD4+ T-клетки (Treg), миелоидные супрессорные клетки (MDSC), опухолевые макрофаги (TAM), иммуносупрессивные цитокины, включая TGF-β, и экспрессию лигандов, направленных на иммуносупрессивные рецепторы, экспрессируемые активированными T-клетками (CTLA-4 и PD-1). Эти механизмы иммуносупрессии играют роль в поддержании толерантности и подавлении несоответствующих иммунных ответов, однако в микроокружении опухоли эти механизмы предотвращают эффективный противоопухолевый иммунный ответ. В совокупности эти иммуносупрессивные факторы могут вызывать или выраженную анергию, или апоптоз адоптивно перенесенных модифицированных CAR T-клеток при встрече с опухолевыми клетками-мишенями.
Неочищенный источник CTL может быть любым известным в данной области техники, таким как костный мозг, фетальный, неонатальный или взрослый, или другой источник гемопоэтических клеток, например фетальная печень, периферическая кровь или пуповинная кровь. Для сепарации клеток можно использовать различные методы. Например, можно первоначально удалять не являющиеся CTL клетки с помощью способов отрицательного отбора. Для идентификации маркеров, связанных с конкретными клеточными линиями и/или стадиями дифференцировки как для положительного, так и для отрицательного отбора, особенно полезны mAb.
Большая часть окончательно дифференцированных клеток может быть первоначально удалена с помощью относительно грубой сепарации. Например, для удаления большого количества нерелевантных клеток можно первоначально использовать сепарацию с помощью магнитных гранул. В определенных вариантах осуществления перед выделением клеток удаляют по меньшей мере приблизительно 80%, обычно по меньшей мере приблизительно 70% от общего количества гемопоэтических клеток.
Процедуры сепарации включают, но без ограничения, центрифугирование в градиенте плотности; розеткообразование; связывание с частицами, которые модифицируют плотность клеток; магнитную сепарацию с помощью покрытых антителами магнитных гранул; аффинную хроматографию; цитотоксические средства, присоединенные к mAb или используемые в сочетании с mAb, включая, но без ограничения, комплемент и цитотоксины; и пэннинг с антителом, прикрепленным к твердой подложке, например планшету, чипу, элютриацию или любые другие удобные способы.
Методы сепарации и анализа включают, но без ограничения, проточную цитометрию, которая может иметь различную степень сложности, например множество цветовых каналов, каналы обнаружения светорассеяния на малые и тупые углы, каналы импеданса.
Клетки можно отбирать против мертвых клеток с использованием красителей, связанных с мертвыми клетками, таких как йодид пропидия (PI). В определенных вариантах осуществления клетки собирают в среде, содержащей 2% фетальной телячьей сыворотки (FCS) или 0,2% бычьего сывороточного альбумина (БСА), или любой другой подходящей, например стерильной, изотонической, среде.
4. Векторы
Генетическая модификация иммунореактивной клетки (например, T-клетки или NKT-клетки) может быть осуществлена путем трансдукции по существу гомогенной композиции клеток рекомбинантной конструкцией ДНК. В определенных вариантах осуществления для введения конструкции ДНК в клетку используют ретровирусный вектор (гамма-ретровирусный или лентивирусный). Например, полинуклеотид, кодирующий HI-TCR, можно клонировать в ретровирусный вектор, и экспрессия может осуществляться с его эндогенного промотора, с длинного концевого повтора ретровируса или с промотора, специфичного для представляющего интерес типа клеток-мишеней. Также можно использовать невирусные векторы.
Для начальной генетической модификации иммунореактивной клетки для включения HI-TCR обычно для трансдукции используют ретровирусный вектор, однако можно использовать любой другой подходящий вирусный вектор или невирусную систему доставки. HI-TCR может быть сконструирован с вспомогательной молекулой (например, цитокином) в одной мультицистронной кассете экспрессии, в нескольких кассетах экспрессии одного вектора или в нескольких векторах. Примеры элементов, которые создают полицистронную кассету экспрессии, включают, но без ограничения, различные вирусные и невирусные внутренние участки посадки рибосомы (IRES, например IRES FGF-1, IRES FGF-2, IRES VEGF, IRES IGF-II, IRES NF-κB, IRES RUNX1, IRES p53, IRES гепатита A, IRES гепатита C, IRES пестивируса, IRES афтовируса, IRES пикорнавируса, IRES полиовируса и IRES вируса энцефаломиокардита) и расщепляемые линкеры (например, пептиды 2A, например пептиды P2A, T2A, E2A и F2A). Также подходят комбинации ретровирусного вектора и подходящей линии упаковки, причем капсидные белки становятся функциональными в отношении инфицирования человеческих клеток. Известны различные продуцирующие амфотропные вирусы линии клеток, включая, но без ограничения, PA12 (Miller, et al. (1985) Mol. Cell. Biol. 5:431-437); PA317 (Miller, et al. (1986) Mol. Cell. Biol. 6:2895-2902); и CRIP (Danos, et al. (1988) Proc. Natl. Acad. Sci. USA 85:6460-6464). Также подходят неамфотропные частицы, например частицы, псевдотипированные оболочкой VSVG, RD114 или GALV, и любые другие, известные в данной области техники.
Возможные способы трансдукции также включают непосредственное совместное культивирование клеток с клетками-продуцентами, например с помощью способа Bregni, et al. (1992) Blood 80:1418-1422, или культивирование только с вирусным супернатантом или концентрированными исходными растворами с вектором с соответствующими факторами роста и поликатионами или без них, например с помощью способа Xu, et al. (1994) Exp. Hemat. 22:223-230; и Hughes, et al. (1992) J. Clin. Invest. 89:1817.
Другие трансдуцирующие вирусные векторы можно использовать для модификации иммунореактивной клетки. В определенных вариантах осуществления выбранный вектор демонстрирует высокую эффективность инфицирования и стабильную интеграцию и экспрессию (смотри, например, Cayouette et al., Human Gene Therapy 8:423-430, 1997; Kido et al., Current Eye Research 15:833-844, 1996; Bloomer et al., Journal of Virology 71:6641-6649, 1997; Naldini et al., Science 272:263-267, 1996; и Miyoshi et al., Proc. Natl. Acad. Sci. U.S.A. 94:10319, 1997). Другие вирусные векторы, которые можно использовать, включают, например, аденовирусные, лентивирусные и аденоассоциированные вирусные векторы, вирус осповакцины, вирус папилломы крупного рогатого скота или вирус герпеса, такой как вирус Эпштейна-Барр (также смотри, например, векторы в Miller, Human Gene Therapy 15-14, 1990; Friedman, Science 244:1275-1281, 1989; Eglitis et al., BioTechniques 6:608-614, 1988; Tolstoshev et al., Current Opinion in Biotechnology 1:55-61, 1990; Sharp, The Lancet 337:1277-1278, 1991; Cornetta et al., Nucleic Acid Research and Molecular Biology 36:311-322, 1987; Anderson, Science 226:401-409, 1984; Moen, Blood Cells 17:407-416, 1991; Miller et al., Biotechnology 7:980-990, 1989; LeGal La Salle et al., Science 259:988-990, 1993; и Johnson, Chest 107:77S- 83S, 1995). Ретровирусные векторы особенно хорошо разработаны и использовались в клинических условиях (Rosenberg et al., N. Engl. J. Med 323:370, 1990; Anderson et al., Патент США № 5399346).
Для генетической модификации иммунореактивной клетки также можно использовать невирусные подходы. Например, молекула нуклеиновой кислоты может быть введена в иммунореактивную клетку путем введения нуклеиновой кислоты при липофекции (Feigner et al., Proc. Natl. Acad. Sci. U.S.A. 84:7413, 1987; Ono et al., Neuroscience Letters 17:259, 1990; Brigham et al., Am. J. Med. Sci. 298:278, 1989; Staubinger et al., Methods in Enzymology 101:512, 1983), конъюгацией асиалоорозомукоид-полилизин (Wu et al., Journal of Biological Chemistry 263:14621, 1988; Wu et al., Journal of Biological Chemistry 264:16985, 1989) или с помощью микроинъекции в хирургических условиях (Wolff et al., Science 247:1465, 1990). Другие невирусные способы переноса гена включают трансфекцию in vitro с использованием фосфата кальция, декстрана DEAE, электропорацию и слияние протопластов. Потенциально полезными для доставки ДНК в клетку также могут быть липосомы. Трансплантация нормальных генов в пораженные ткани субъекта может быть выполнена путем переноса нормальной нуклеиновой кислоты в клетку культивируемого типа ex vivo (например, аутологичную или гетерологичную первичную клетку или ее потомство), после чего клетку (или ее потомков) вводят в целевую ткань или вводят системно. Рекомбинантные рецепторы могут быть произведены или получены с использованием транспозаз или целевых нуклеаз (например, нуклеаз с цинковыми пальцами, мегануклеаз или нуклеаз TALE, CRISPR). Временную экспрессию можно получить с помощью электропорации РНК. В определенных вариантах осуществления рекомбинантные рецепторы могут быть введены с помощью вектора на основе транспозона. В определенных вариантах осуществления вектор на основе транспозона содержит транспозон (также известный как мобильный элемент). В определенных вариантах осуществления транспозон может распознаваться транспозазой. В определенных вариантах осуществления транспозаза представляет собой транспозазу Спящей красавицы.
Система коротких палиндромных повторов, регулярно расположенных группами (CRISPR), представляет собой инструмент редактирования генома, обнаруженный в прокариотических клетках. При использовании для редактирования генома система включает в себя Cas9 (белок, способный модифицировать ДНК, используя крРНК в качестве ориентира), CRISPR РНК (крРНК, содержит РНК, используемую Cas9 для направления к правильному участку ДНК хозяина вместе с областью, которая связывается с тракрРНК (обычно в форме шпильки), образуя активный комплекс с Cas9), трансактивирующую крРНК (тракрРНК, связывается с крРНК и образует активный комплекс с Cas9) и необязательный участок матрицы репарации ДНК (ДНК, которая направляет процесс восстановления клеток, позволяя вставлять определенную последовательность ДНК). CRISPR/Cas9 часто использует плазмиду для трансфекции клеток-мишеней. Для каждого применения должна быть разработана крРНК, поскольку это последовательность, которую Cas9 использует для идентификации и прямого связывания с целевой ДНК в клетке. Несущая матрицу репарации кассета экспрессии CAR также должна быть разработана для каждого применения, поскольку она должна перекрываться с последовательностями по обе стороны от разреза и кодировать последовательность вставки. Множество крРНК и тракрРНК могут быть упакованы вместе с образованием одиночной направляющей РНК (онРНК). Эта онРНК может быть соединена вместе с геном Cas9 и превращена в плазмиду для трансфекции в клетки.
Нуклеаза с цинковыми пальцами (ZFN) представляет собой искусственный фермент рестрикции, который генерируют путем объединения ДНК-связывающего домена с цинковыми пальцами с ДНК-расщепляющим доменом. Домен с цинковыми пальцами может быть сконструирован для нацеливания на определенные последовательности ДНК, что позволяет нуклеазе с цинковыми пальцами нацеливаться на желаемые последовательности в геномах. ДНК-связывающие домены отдельных ZFN обычно содержат множество отдельных цинк-пальцевых повторов, и каждый может распознавать множество пар оснований. Наиболее распространенный способом создания нового домена с цинковыми пальцами является комбинирование цинк-пальцевых "модулей" меньшего размера с известной специфичностью. Наиболее распространенным расщепляющим доменом в ZFN является неспецифический расщепляющий домен из рестрикционной эндонуклеазы FokI типа IIs. При использовании аппарата эндогенной гомологичной рекомбинации (HR) и несущей гомологичную ДНК-матрицу кассеты CAR экспрессии ZFN можно использовать для вставки кассеты CAR экспрессии в геном. Когда последовательность-мишень расщеплена ZFN, аппарат HR ищет гомологию между поврежденной хромосомой и гомологичной ДНК-матрицей, а затем копирует последовательность матрицы между двумя поврежденными концами хромосомы, в результате чего гомологичная ДНК-матрица интегрируется в геном.
Нуклеазы на основе эффекторов, подобных активаторам транскрипции (TALEN), представляют собой ферменты рестрикции, которые могут быть сконструированы для разрезания определенных последовательностей ДНК. Система TALEN работает практически по тому же принципу, что и ZFN. Их генерируют путем объединения ДНК-связывающего домена эффекторов, подобных активатору транскрипции, с расщепляющим ДНК доменом. Эффекторы, подобные активаторам транскрипции (TALE), состоят из повторяющихся мотивов из 33-34 аминокислот с двумя вариабельными положениями, которые обладают сильным распознаванием конкретных нуклеотидов. Путем сборки массивов этих TALE ДНК-связывающий домен TALE может быть сконструирован так, чтобы связывать желаемую последовательность ДНК и тем самым направлять нуклеазу к разрезанию в определенных местоположениях в геноме. Экспрессия кДНК для применения в способах полинуклеотидной терапии может быть направлена с любого подходящего промотора (например, промоторов человеческого цитомегаловируса (CMV), обезьяньего вируса 40 (SV40) или металлотионеинов) и регулироваться любым подходящим регуляторным элементом или интроном млекопитающих (например, структурой энхансера/промотора/интрона фактора элонгации 1a). Например, при желании, для направления экспрессии нуклеиновой кислоты можно использовать энхансеры, о которых известно, что они, предпочтительно, направляют экспрессию генов в определенных типах клеток. Используемые энхансеры могут включать в себя, без ограничения, энхансеры, характеризуемые как тканеспецифические или клеткоспецифические. Альтернативно, если геномный клон используют в качестве терапевтической конструкции, регуляция может быть опосредована когнатными регуляторными последовательностями или, если желательно, регуляторными последовательностями, происходящими из гетерологичного источника, включая любой из промоторов или регуляторных элементов, описанных выше.
Полученные клетки можно выращивать в условиях, аналогичных условиям для немодифицированных клеток, в результате чего модифицированные клетки можно размножать и использовать для различных целей.
6. Способы редактирования генома
В определенных неограничивающих вариантах осуществления HI-TCR, костимулирующий лиганд, CCR или любые другие молекула/трансген, раскрытые в настоящем документе, экспрессируется иммунореактивной клеткой через модифицированный геномный локус. В определенных вариантах осуществления кассета экспрессии трансгена интегрирована в целевой геномный локус иммунореактивной клетки с помощью способов направленного редактирования генома. В определенных вариантах осуществления целевой геномный локус может представлять собой локусы CD3δ, CD3ε, CD247, B2M, TRAC, TRBC1, TRBC2, TRGC1 и/или TRGC2.
6.1. Конструирование локуса T-клеточного рецептора
В определенных вариантах осуществления HI-TCR экспрессируется иммунореактивной клеткой через модифицированный локус эндогенного Т-клеточного рецептора. В определенных вариантах осуществления кассета экспрессии HI-TCR интегрирована в локус эндогенного Т-клеточного рецептора. В определенных вариантах осуществления кассета экспрессии HI-TCR интегрирована в пределах локуса T-клеточного рецептора альфа (TRA, GenBank ID: 6955). В определенных вариантах осуществления кассета экспрессии HI-TCR интегрирована в пределах локуса T-клеточного рецептора бета (TRB, GenBank ID: 6957). В определенных вариантах осуществления кассета экспрессии HI-TCR интегрирована в пределах локуса T-клеточного рецептора гамма (TRG, GenBank ID: 6965).
В определенных вариантах осуществления кассета экспрессии HI-TCR содержит внеклеточный антигенсвязывающий домен, который интегрирован в первый экзон локуса константного домена TCR, так что внеклеточный антигенсвязывающий домен и константный домен TCR содержатся в одной антигенсвязывающей цепи HI-TCR. В определенных вариантах осуществления локус константного домена TCR может представлять собой TRAC, TRBC1, TRBC2, TRGC1 или TRGC2. В определенных вариантах осуществления кассета экспрессии HI-TCR содержит внеклеточный антигенсвязывающий домен, который интегрирован в первый экзон локуса TRAC, так что внеклеточный антигенсвязывающий домен и пептид TRAC содержатся в первой антигенсвязывающей цепи HI-TCR. В определенных вариантах осуществления кассета экспрессии HI-TCR дополнительно содержит вторую антигенсвязывающую цепь, которая, необязательно, содержит внеклеточный антигенсвязывающий домен и пептид TRBC. В определенных вариантах осуществления кассета экспрессии HI-TCR содержит внеклеточный антигенсвязывающий домен, который интегрирован в первый экзон локуса TRBC, так что внеклеточный антигенсвязывающий домен и пептид TRBC содержатся в первой антигенсвязывающей цепи HI-TCR. В определенных вариантах осуществления кассета экспрессии HI-TCR дополнительно содержит вторую антигенсвязывающую цепь, которая, необязательно, содержит внеклеточный антигенсвязывающий домен и пептид TRAC. В определенных вариантах осуществления кассета экспрессии содержит элементы, которые создают полицистронную кассету экспрессии, например расщепляемый пептид, например пептид 2A.
В определенных вариантах осуществления рекомбинантный TCR экспрессируется из кассеты экспрессии, помещенной в эндогенный локус TRAC и/или локус TRBC иммунореактивной клетки. В определенных вариантах осуществления помещение кассеты экспрессии рекомбинантного TCR нарушает или прекращает экспрессию эндогенного TCR, содержащего нативную α-цепь TCR и/или нативную β-цепь TCR, в иммунореактивной клетке. В определенных вариантах осуществления помещение кассеты экспрессии рекомбинантного TCR предотвращает или устраняет ошибочное спаривание между рекомбинантным TCR и нативной α-цепью TCR и/или нативной β-цепью TCR в иммунореактивной клетке.
Для модификации локуса эндогенного Т-клеточного рецептора можно использовать любые подходящие способы и системы генетического редактирования. Для модификации локуса эндогенного Т-клеточного рецептора можно использовать способы редактирования генома, раскрытые в разделе 4. В определенных вариантах осуществления для модификации локуса T-клеточного рецептора используют систему CRISPR. В определенных вариантах осуществления система CRISPR нацелена на экзон 1 человеческого локуса TRAC. В определенных вариантах осуществления система CRISPR содержит направляющую РНК (гРНК), которая нацелена на экзон 1 человеческого локуса TRAC.
В определенных вариантах осуществления для модификации локуса эндогенного Т-клеточного рецептора используют нуклеазу с цинковыми пальцами. В определенных вариантах осуществления для модификации локуса эндогенного Т-клеточного рецептора используют систему TALEN.
В определенных вариантах осуществления, когда один локус эндогенного Т-клеточного рецептора в клетке модифицирован для экспрессии одной или более антигенсвязывающих цепей HI-TCR, один или более других локусов эндогенного Т-клеточного рецептора в клетке модифицированы для устранения эндогенной экспрессии цепи эндогенного TCR. В определенных вариантах осуществления один или более других локусов эндогенного Т-клеточного рецептора дополнительно модифицированы для экспрессии представляющего интерес гена, например противоопухолевого цитокина (например, IL-2, IL-12, TNFα и INFγ), лиганда костимулирующей молекулы (например, 4-1BBL), гена отслеживания (например, eGFP) или гена самоубийства.
6.2. Модификация экспрессии гена посредством редактирования генома промотора или терминатора транскрипции
В определенных неограничивающих вариантах осуществления экспрессия кассеты экспрессии HI-TCR, интегрированной в целевой геномный локус, управляется эндогенным промотором/энхансером геномного локуса. В определенных вариантах осуществления экспрессия кассеты экспрессии HI-TCR, интегрированной в целевой геномный локус, управляется модифицированным промотором/энхансером, введенным в геномный локус. Для модификации области промотора/энхансера целевого геномного локуса и тем самым усиления или модификации экспрессии HI-TCR в иммунореактивной клетке можно использовать любые способы направленного редактирования генома. В определенных вариантах осуществления модификация содержит замену эндогенного промотора на конститутивный промотор или индуцибельный промотор или вставку конститутивного промотора или индуцибельного промотора в область промотора целевого геномного локуса. В определенных вариантах осуществления конститутивный промотор расположен в целевом геномном локусе для управления экспрессией гена HI-TCR. Подходящие конститутивные промоторы включают, но без ограничения, промотор CMV, промотор EF1a, промотор SV40, промотор PGK1, промотор Ubc, промотор бета-актина и промотор CAG. Альтернативно или дополнительно, условный или индуцибельный промотор расположен в целевом геномном локусе для управления экспрессией гена HI-TCR. Неограничивающие примеры условных промоторов включают промотор тетрациклинового ответного элемента (TRE) и промотор эстрогенового ответного элемента (ERE). Кроме того, энхансерные элементы могут быть размещены в других областях, чем область промотора.
В определенных неограничивающих вариантах осуществления экспрессия кассеты экспрессии HI-TCR, интегрированной в целевой геномный локус, регулируется эндогенным терминатором транскрипции геномного локуса. В определенных вариантах осуществления экспрессия кассеты экспрессии HI-TCR, интегрированной в целевой геномный локус регулируется модифицированным терминатором транскрипции, введенным в геномный локус. Можно использовать любые способы направленного редактирования генома для модификации области терминатора транскрипции целевого геномного локуса и, таким образом, модификации экспрессии HI-TCR в иммунореактивной клетке. В определенных вариантах осуществления модификация содержит замену эндогенного терминатора транскрипции на альтернативный терминатор транскрипции или вставку альтернативного терминатора транскрипции в область терминатора транскрипции целевого геномного локуса. В определенных вариантах осуществления альтернативный терминатор транскрипции содержит область 3'-UTR или область поли(A) гена. В определенных вариантах осуществления альтернативный терминатор транскрипции является эндогенным. В определенных вариантах осуществления альтернативный терминатор транскрипции является экзогенным. В определенных вариантах осуществления альтернативные терминаторы транскрипции включают, но без ограничения, терминатор транскрипции TK, терминатор транскрипции GCSF, терминатор транскрипции TCRA, терминатор транскрипции HBB, терминатор транскрипции бычьего гормона роста, терминатор транскрипции SV40 и элемент P2A.
Для модификации области промотора/энхансера и/или области терминатора транскрипции целевого геномного локуса можно использовать любые способы направленного редактирования генома. В определенных вариантах осуществления для модификации области промотора/энхансера и/или области терминатора транскрипции целевого геномного локуса можно использовать систему CRISPR. В определенных вариантах осуществления для модификации области промотора/энхансера и/или области терминатора транскрипции целевого геномного локуса используют нуклеазы с цинковыми пальцами. В определенных вариантах осуществления для модификации области промотора/энхансера и/или области терминатора транскрипции целевого геномного локуса используют систему TALEN.
Способы доставки средств/систем редактирования генома могут варьироваться в зависимости от потребности. В определенных вариантах осуществления компоненты выбранного способа редактирования генома доставляют в виде конструкций ДНК в одной или более плазмидах. В определенных вариантах осуществления компоненты доставляют посредством вирусных векторов. Общие способы доставки включают, но без ограничения, электропорацию, микроинъекцию, генную пушку, импалефекцию, гидростатическое давление, непрерывную инфузию, обработку ультразвуком, магнитофекцию, аденоассоциированные вирусы, псевдотипирование белков оболочки вирусных векторов, репликационно-компетентные векторы, цис- и транс-действующие элементы, вирус простого герпеса и химические носители (например, олигонуклеотиды, липоплексы, полимерсомы, полиплексы, дендримеры, неорганические наночастицы и проникающие в клетки пептиды).
Модификация может быть произведена в любом месте в пределах целевого геномного локуса или в любом месте, которое может влиять на экспрессию генов целевого геномного локуса. В определенных вариантах осуществления модификация происходит перед сайтом начала транскрипции целевого геномного локуса. В определенных вариантах осуществления модификация происходит между сайтом начала транскрипции и кодирующей белок областью целевого геномного локуса. В определенных вариантах осуществления модификация происходит после кодирующей белок области целевого геномного локуса. В определенных вариантах осуществления модификация происходит перед сайтом начала транскрипции целевого геномного локуса, причем модификация приводит к новому сайту начала транскрипции.
7. Полипептиды и аналоги
В раскрытый в данном документе предмет изобретения также включены полипептиды (например, CD19, CD8, CD28, CD3ζ, CD40, 4-1BB, OX40, CD84, CD166, CD8a, CD8b, ICOS, ICAM-1, TRAC, TRBC1, TRBC2, TRGC1, TRGC2, CD3γ, CD3δ, CD3ε и CTLA-4) или их фрагменты, которые модифицированы способами, которые усиливают их противоопухолевую активность при экспрессии в иммунореактивной клетке. Раскрытый в данном документе предмет изобретения предлагает способы оптимизации аминокислотной последовательности или последовательности нуклеиновой кислоты путем внесения изменений в последовательность. Такие изменения могут включать определенные мутации, делеции, вставки или посттрансляционные модификации. Раскрытый в данном документе предмет изобретения дополнительно включает в себя аналоги любого природного полипептида, раскрытого в настоящем документе (включая, но без ограничения, CD19, CD8, CD28, CD3ζ, CD40, 4-1BB, OX40, CD84, CD166, CD8a, CD8b, ICOS, ICAM-1, TRAC, TRBC1, TRBC2, TRGC1, TRGC2, CD3γ, CD3δ, CD3ε и CTLA-4). Аналоги могут отличаться от природного полипептида, раскрытого в настоящем документе, изменениями аминокислотной последовательности, посттрансляционными модификациями или и тем, и другим. Аналоги могут демонстрировать гомологию по меньшей мере приблизительно 85%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99% или более со всей природной аминокислотной последовательности раскрытого в данном документе предмета изобретения или с ее частью. Длина сравнения последовательностей составляет по меньшей мере 5, 10, 15 или 20 аминокислотных остатков, например по меньшей мере 25, 50, или 75 аминокислотных остатков, или более 100 аминокислотных остатков. С другой стороны, в типичном подходе к определению степени идентичности можно использовать программу BLAST, причем оценка вероятности между e-3 и e-100 указывает на родственную последовательность. Модификации включают химическую дериватизацию полипептидов in vivo и in vitro, например ацетилирование, карбоксилирование, фосфорилирование или гликозилирование; такие модификации могут происходить во время синтеза или процессинга полипептида или после обработки выделенными модифицирующими ферментами. Аналоги также могут отличаться от природных полипептидов изменениями первичной последовательности. К ним относятся генетические варианты, как природные, так и индуцированные (например, возникающие в результате случайного мутагенеза из-за облучения или воздействия этанметилсульфата или в результате сайт-специфического мутагенеза, как описано в Sambrook, Fritsch and Maniatis, Molecular Cloning: A Laboratory Manual (2d ed.), CSH Press, 1989, или в Ausubel et al., выше). Также включены циклизованные пептиды, молекулы и аналоги, которые содержат остатки, отличные от L-аминокислот, например D-аминокислоты или неприродные или синтетические аминокислоты, например β или γ-аминокислоты.
В дополнение к полноразмерным полипептидам раскрытый в данном документе предмет изобретения также предлагает фрагменты любого из полипептидов или пептидных доменов, раскрытых в настоящем документе. В контексте настоящего документа термин "фрагмент" означает по меньшей мере 5, 10, 13 или 15 аминокислот. В определенных вариантах осуществления фрагмент содержит по меньшей мере 20 соседних аминокислот, по меньшей мере 30 соседних аминокислот или по меньшей мере 50 соседних аминокислот. В определенных вариантах осуществления фрагмент содержит по меньшей мере от 60 до 80, 100, 200, 300 или более соседних аминокислот. Фрагменты могут быть получены с помощью способов, известных специалистам в данной области техники, или могут быть результатом нормального процессинга белка (например, удаления из формирующегося полипептида аминокислот, которые не требуются для биологической активности, или удаления аминокислот в случае альтернативного сплайсинга мРНК или альтернативного процессинга белка).
Небелковые аналоги имеют химическую структуру, предназначенную для имитации функциональной активности белка, раскрытого в настоящем документе. Такие аналоги могут иметь более высокую физиологический активность, чем исходный полипептид. Способы конструирования аналогов хорошо известны в данной области техники, и синтез аналогов может быть осуществлен в соответствии с такими способами путем модификации химических структур таким образом, что полученные аналоги повышают противоопухолевую активность исходного полипептида при экспрессии в иммунореактивной клетке. Эти химические модификации включают, но без ограничения, замену альтернативных R-групп и изменение степени насыщения у конкретных атомов углерода исходного полипептида. В определенных вариантах осуществления белковые аналоги относительно устойчивы к разложению in vivo, что приводит к более длительному терапевтическому эффекту при введении. Анализы для измерения функциональной активности включают, но без ограничения, описанные в примерах ниже.
8. Введение
Композиции, содержащие раскрытые в данном документе иммунореактивные клетки, можно вводить системно или непосредственно субъекту для вызывания и/или усиления иммунного ответа на антиген и/или лечения и/или предупреждения неоплазии, патогенной инфекции или инфекционного заболевания. В определенных вариантах осуществления раскрытые в данном документе иммунореактивные клетки или содержащие их композиции вводят непосредственно в представляющий интерес орган (например, орган, пораженный неоплазией). Альтернативно, раскрытые в данном документе иммунореактивные клетки или содержащие их композиции вводят в представляющий интерес орган опосредованно, например путем введения в систему кровообращения (например, в сосудистую сеть опухоли). Для увеличения продукции T-клеток, NKT-клеток или CTL-клеток in vitro или in vivo до, во время или после введения клеток или композиций можно вводить средства для размножения и дифференцировки.
Раскрытые в данном документе иммунореактивные клетки можно вводить в любом физиологически приемлемом носителе, обычно внутрисосудистым путем, хотя их также можно вводить в кость или другое удобное место, где клетки смогут найти подходящее место для регенерации и дифференцировки (например, тимус). Обычно вводят по меньшей мере приблизительно 1×l05 клеток, в конечном итоге достигая приблизительно 1×l010 или более. Раскрытые в данном документе иммунореактивные клетки могут содержать очищенную популяцию клеток. Специалисты в данной области техники могут легко определить процент раскрытых в данном документе иммунореактивных клеток в популяции с использованием различных хорошо известных способов, таких как сортировка флуоресцентно-активированных клеток (FACS). Подходящие диапазоны чистоты в популяциях, содержащих раскрытые в данном документе иммунореактивные клетки, составляют от приблизительно 50% до приблизительно 55%, от приблизительно 5% до приблизительно 60% и от приблизительно 65% до приблизительно 70%. В определенных вариантах осуществления чистота составляет от приблизительно 70% до приблизительно 75%, от приблизительно 75% до приблизительно 80% или от приблизительно 80% до приблизительно 85%. В определенных вариантах осуществления чистота составляет от приблизительно 85% до приблизительно 90%, от приблизительно 90% до приблизительно 95% и от приблизительно 95% до приблизительно 100%. Дозировки могут быть легко скорректированы специалистами в данной области техники (например, снижение чистоты может потребовать увеличения дозировки). Клетки можно вводить путем инъекции, через катетер и т.п.
Раскрытые в данном документе композиции могут представлять собой фармацевтические композиции, содержащие раскрытые в данном документе иммунореактивные клетки или их предшественники и фармацевтически приемлемый носитель. Введение может быть аутологичным или гетерологичным. Например, иммунореактивные клетки или предшественники могут быть получены от одного субъекта и введены тому же субъекту или другому совместимому субъекту. Полученные из периферической крови иммунореактивные клетки или их потомство (например, полученные in vivo, ex vivo или in vitro) можно вводить с помощью локальной инъекции, включая катетерное введение, системную инъекцию, локальную инъекцию, внутривенную инъекцию или парентеральное введение. При введении терапевтической композиции раскрытого в данном документе предмета изобретения (например, фармацевтической композиции, содержащей раскрытую в данном документе иммунореактивную клетку) она может быть составлена в виде стандартной инъекционной лекарственной формы (раствор, суспензия, эмульсия).
9. Композиции
Композиции, содержащие раскрытые в данном документе иммунореактивные клетки, могут быть удобно представлены в виде стерильных жидких препаратов, например изотонических водных растворов, суспензий, эмульсий, дисперсий или вязких композиций, которые могут быть забуферены до выбранного pH. Жидкие препараты обычно легче приготовить, чем гели, другие вязкие композиции и твердые композиции. Кроме того, жидкие композиции несколько удобнее вводить, особенно путем инъекции. С другой стороны, вязкие композиции могут быть составлены в соответствующем диапазоне вязкости для обеспечения более длительных периодов контакта с конкретными тканями. Жидкие или вязкие композиции могут содержать носители, которые могут представлять собой растворитель или дисперсионную среду, содержащую, например, воду, солевой раствор, фосфатно-солевой буфер, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.п.) и подходящие их смеси.
Стерильные растворы для инъекций могут быть приготовлены путем включения генетически модифицированных иммунореактивных клеток в необходимом количестве подходящего растворителя с различными количествами других ингредиентов по желанию. Такие композиции могут быть в смеси с подходящим носителем, разбавителем или эксципиентом, таким как стерильная вода, физиологический раствор, глюкоза, декстроза и т.п. Композиции также могут быть лиофилизированы. Композиции могут содержать вспомогательные вещества, такие как смачивающие, диспергирующие или эмульгирующие средства (например, метилцеллюлозу), pH-буферные средства, гелеобразующие или повышающие вязкость добавки, консерванты, ароматизаторы, красители и т.п. в зависимости от желаемых пути введения и препарата. Можно обращаться к стандартным текстам, таким как "REMINGTON'S PHARMACEUTICAL SCIENCE", 17th edition, 1985, включенный в настоящий документ посредством ссылки, для получения подходящих препаратов без излишних экспериментов.
Можно добавлять различные добавки, которые повышают стабильность и стерильность композиций, включая противомикробные консерванты, антиоксиданты, хелатирующие средства и буферы. Предотвращение действия микроорганизмов может быть обеспечено различными антибактериальными и противогрибковыми средствами, например парабенами, хлорбутанолом, фенолом, сорбиновой кислотой и т.п. Продолжительная абсорбция инъекционной фармацевтической формы может быть достигнута за счет использования средств, замедляющих абсорбцию, например моностеарата алюминия и желатина. Однако в соответствии с раскрытым в данном документе предметом изобретения любые используемые носитель, разбавитель или добавка должны быть совместимы с генетически модифицированными иммунореактивными клетками или их предшественниками.
Композиции могут быть изотоническими, т.е. они могут иметь такое же осмотическое давление, как кровь и слезная жидкость. Желаемая изотоничность композиций может быть достигнута с использованием хлорида натрия или других фармацевтически приемлемых средств, таких как декстроза, борная кислота, тартрат натрия, пропиленгликоль или другие неорганические или органические растворенные компоненты. Хлорид натрия особенно подходит для буферов, содержащих ионы натрия.
Вязкость композиций при желании можно поддерживать на выбранном уровне с помощью фармацевтически приемлемого загущающего средства. Например, метилцеллюлоза легко и экономично доступна, и с ней легко работать. Другие подходящие загущающие средства включают, например, ксантановую камедь, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, карбомер и т.п. Концентрация загустителя может зависеть от выбранного средства. Важным моментом является использование количества, которое позволит достичь выбранной вязкости. Очевидно, что выбор подходящих носителей и других добавок будет зависеть от точного пути введения и природы конкретной лекарственной формы, например жидкой лекарственной формы (например, от того, должна ли композиция быть приготовлена в виде раствора, суспензии, геля или другой жидкой формы, такой как форма с замедленным высвобождением или заполненная жидкостью форма).
Количество вводимых клеток будет варьироваться для подлежащего лечению субъекта. В одном варианте осуществления являющемуся человеком субъекту вводят между приблизительно 104 и приблизительно 1010, между приблизительно 105 и приблизительно 109 или между приблизительно 106 и приблизительно 108 раскрытых в данном документе иммунореактивных клеток. Более эффективные клетки можно вводить в еще меньшем количестве. В определенных вариантах осуществления являющемуся человеком субъекту вводят по меньшей мере приблизительно 1×108, приблизительно 2×108, приблизительно 3×108, приблизительно 4×108 или приблизительно 5×108 раскрытых в данном документе иммунореактивных клеток. Точное определение того, какую дозу можно считать эффективной, может быть основано на факторах, индивидуальных для каждого субъекта, включая размер, возраст, пол, вес и состояние конкретного субъекта. Дозировки могут быть легко определены специалистами в данной области техники на основе этого раскрытия и знаний в данной области техники.
Специалист в данной области техники может легко определить количество клеток и необязательных добавок, наполнителей и/или носителя в композициях, подлежащее введению в способах. Обычно любые добавки (в дополнение к активной клетке(ам) и/или средству(ам)) присутствуют в количестве от 0,001 до 50% (по весу) раствора в фосфатно-солевом буфере, а активный ингредиент составляет порядка от микрограммов до миллиграммов, например от приблизительно 0,0001 до приблизительно 5 вес.%, от приблизительно 0,0001 до приблизительно 1 вес.%, от приблизительно 0,0001 до приблизительно 0,05 вес.% или от приблизительно 0,001 до приблизительно 20 вес.%, от приблизительно 0,01 до приблизительно 10 вес.% или от приблизительно 0,05 до приблизительно 5 вес.%. Для любой композиции, подлежащей введению животному или человеку, можно определить следующее: токсичность, например путем определения летальной дозы (LD) и LD50 на подходящей животной модели, например на грызуне, таком как мышь; дозировку композиции(ий), концентрацию в ней компонентов и время введения композиции(ий), которые вызывают подходящий ответ. Такие определения не требуют излишних экспериментов благодаря знаниям специалиста в данной области техники, этому раскрытию и документам, цитируемым в настоящем документе. Также и время для последовательных введений может быть установлено без излишних экспериментов.
10. Способы лечения
Раскрытый в данном документе предмет изобретения предлагает способы для вызывания и/или повышения иммунного ответа у нуждающегося в этом субъекта. Раскрытые в данном документе иммунореактивные клетки и содержащие их композиции можно использовать для лечения и/или предупреждения неоплазии у субъекта. Раскрытые в данном документе иммунореактивные клетки и содержащие их композиции можно использовать для увеличения продолжительности жизни субъекта, страдающего от неоплазии. Раскрытые в данном документе иммунореактивные клетки и содержащие их композиции можно также использовать для лечения и/или предупреждения патогенной инфекции или другого инфекционного заболевания у субъекта, такого как иммунокомпрометированный субъект, являющийся человеком. Такие способы содержат введение раскрытых в данном документе иммунореактивных клеток в эффективном количестве или содержащей их композиции (например, фармацевтической композиции) для достижения желаемого эффекта, будь то паллиативное лечение имеющегося состояния или предотвращение рецидива. Для лечения вводимое количество представляет собой количество, эффективное для достижения желаемого эффекта. Эффективное количество можно вводить за одно или более введений. Эффективное количество можно вводить болюсом или путем непрерывной перфузии.
В определенных вариантах осуществления иммунореактивные клетки, содержащие HI-TCR, раскрытый в настоящем документе, можно использовать для лечения субъекта, имеющего опухолевые клетки с низким уровнем экспрессии поверхностного антигена, например при рецидиве заболевания, причем субъект получал лечение, которое ведет к остаточным опухолевым клеткам. В определенных вариантах осуществления опухолевые клетки имеют низкую плотность молекулы-мишени на поверхности опухолевых клеток. В определенных вариантах осуществления молекула-мишень, имеющая низкую плотность на клеточной поверхности, имеет плотность менее приблизительно 5000 молекул на клетку, менее приблизительно 4000 молекул на клетку, менее приблизительно 3000 молекул на клетку, менее приблизительно 2000 молекул на клетку, менее приблизительно 1500 молекул на клетку, менее приблизительно 1000 молекул на клетку, менее приблизительно 500 молекул на клетку, менее приблизительно 200 молекул на клетку или менее приблизительно 100 молекул на клетку. В определенных вариантах осуществления молекула-мишень, имеющая низкую плотность на клеточной поверхности, имеет плотность менее приблизительно 2000 молекул на клетку. В определенных вариантах осуществления молекула-мишень, имеющая низкую плотность на клеточной поверхности, имеет плотность менее приблизительно 1500 молекул на клетку. В определенных вариантах осуществления молекула-мишень, имеющая низкую плотность на клеточной поверхности, имеет плотность менее приблизительно 1000 молекул на клетку. В определенных вариантах осуществления молекула-мишень, имеющая низкую плотность на клеточной поверхности, имеет плотность между приблизительно 4000 молекул на клетку и приблизительно 2000 молекул на клетку, между приблизительно 2000 молекул на клетку и приблизительно 1000 молекул на клетку, между приблизительно 1500 молекул на клетку и приблизительно 1000 молекул на клетку, между приблизительно 2000 молекул на клетку и приблизительно 500 молекул на клетку, между приблизительно 1000 молекул на клетку и приблизительно 200 молекул на клетку или между приблизительно 1000 молекул на клетку и приблизительно 100 молекул на клетку. В определенных вариантах осуществления иммунореактивные клетки, содержащие HI-TCR, раскрытый в настоящем документе, можно использовать для лечения субъекта, имеющего рецидив заболевания, причем субъект получал иммунореактивные клетки (например, T-клетки), содержащие CAR, содержащий внутриклеточный сигнальный домен, который содержит костимулирующий сигнальный домен, содержащий полипептид 4-1BB (например, 4-1BBz CAR). В определенных вариантах осуществления опухолевые клетки имеют низкую плотность опухолеспецифического антигена на поверхности опухолевых клеток. В определенных вариантах осуществления заболевание представляет собой CD19+ ALL. В определенных вариантах осуществления опухолевые клетки имеют низкую плотность CD19 на опухолевых клетках. Такие способы содержат введение раскрытых в данном документе иммунореактивных клеток в эффективном количестве или содержащей их композиции (например, фармацевтической композиции) для достижения желаемого эффекта, облегчения имеющегося состояния или предотвращения рецидива.
"Эффективное количество" (или "терапевтически эффективное количество") представляет собой количество, достаточное для достижения благоприятного или желаемого клинического результата при лечении. Эффективное количество можно вводить субъекту в одной или более дозах. С точки зрения лечения эффективное количество представляет собой количество, достаточное для ослабления, облегчения, стабилизации, обращения вспять или замедления прогрессирования заболевания или иного уменьшения патологических последствий заболевания. Эффективное количество обычно определяется врачом в каждом конкретном случае и находится в пределах компетенции специалиста в данной области техники. При определении подходящей дозировки для достижения эффективного количества обычно принимают во внимание несколько факторов. К этим факторам относятся возраст, пол и вес субъекта, подлежащее лечению состояние, тяжесть состояния и форму и эффективную концентрацию вводимых иммунореактивных клеток.
Для адоптивной иммунотерапии с использованием антиген-специфических T-клеток обычно вливают дозы клеток в диапазоне приблизительно 106-1010 (например, приблизительно 109). После введения раскрытых в данном документе клеток хозяину и последующей дифференцировки индуцируются Т-клетки, которые специфически направлены против специфического антигена. Модифицированные клетки можно вводить любым способом, известным в данной области техники, включая, но без ограничения, внутривенный, подкожный, интранодальный, внутриопухолевый, интратекальный, внутриплевральный, внутрибрюшинный и непосредственно в тимус.
Раскрытый в данном документе предмет изобретения предлагает способы для лечения и/или предупреждения неоплазии у субъекта. Способ может содержать введение эффективного количества раскрытых в данном документе иммунореактивных клеток или содержащей их композиции субъекту с неоплазией.
Неограничивающие примеры неоплазии включают раки крови (например, лейкозы, лимфомы и миеломы), рак яичников, рак молочной железы, рак мочевого пузыря, рак головного мозга, рак толстой кишки, рак кишечника, рак печени, рак легких, рак поджелудочной железы, рак предстательной железы, рак кожи, рак желудка, глиобластому, рак горла, меланому, нейробластому, аденокарциному, глиому, саркому мягких тканей и различные карциномы (включая рак предстательной железы и мелкоклеточный рак легкого). Подходящие карциномы также включают любые известные в области онкологии, включая, но без ограничения, астроцитому, фибросаркому, миксосаркому, липосаркому, олигодендроглиому, эпендимому, медуллобластому, примитивную нейроэктодермальную опухоль (PNET), хондросаркому, остеогенную саркому, протоковую аденокарциному поджелудочной железы, мелкоклеточные и крупноклеточные аденокарциномы легких, хордому, ангиосаркому, эндотелиосаркому, плоскоклеточную карциному, бронхоальвеолярную карциному, эпителиальную аденокарциному и ее метастазы в печень, лимфангиосаркому, лимфангиоэндотелиосаркому, гепатому, холангиокарциному, синовиому, мезотелиому, опухоль Юинга, рабдомиосаркому, карциному толстой кишки, базальноклеточную карциному, карциному потовых желез, папиллярную карциному, карциному сальных желез, папиллярную аденокарциному, цистаденокарциному, медуллярную карциному, бронхогенную карциному, почечно-клеточную карциному, карциному желчного протока, хориокарциному, семиному, эмбриональную карциному, опухоль Вильмса, опухоль яичка, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, акустическую неврому, олигодендроглиому, менингиому, нейробластому, ретинобластому, лейкоз, множественную миелому, макроглобулинемию Вальденстрема и болезнь тяжелых цепей, опухоли молочной железы, такие как протоковая и дольчатая аденокарцинома, плоскоклеточные и аденокарциномы шейки матки, эпителиальные карциномы матки и яичников, аденокарциномы предстательной железы, плоскоклеточную переходную карциному мочевого пузыря, B и T-клеточные лимфомы (узловые и диффузные), плазмоцитому, острые и хронические лейкозы, злокачественную меланому, саркомы мягких тканей и лейомиосаркомы. В определенных вариантах осуществления новообразование выбирают из группы, состоящей из раков крови (например лейкозов, лимфом и миелом), рака яичников, рака предстательной железы, рака молочной железы, рака мочевого пузыря, рака головного мозга, рака толстой кишки, рака кишечника, рака печени, рака легких, рака поджелудочной железы, рака предстательной железы, рака кожи, рака желудка, глиобластомы, рака горла. В определенных вариантах осуществления раскрытые в данном документе иммунореактивные клетки и содержащие их композиции можно использовать для лечения и/или предупреждения раков крови (например, лейкозов, лимфом и миелом) или рака яичников, которые не поддаются традиционным терапевтическим вмешательствам. В определенных вариантах осуществления новообразование представляет собой солидную опухоль.
Субъекты могут иметь запущенную форму заболевания, и в этом случае цель лечения может включать в себя смягчение или обращение вспять прогрессирования заболевания и/или уменьшение побочных эффектов. Субъекты могут иметь историю состояния, от которого они уже получали лечение, и в этом случае терапевтическая цель обычно включает в себя уменьшение или задержку рецидива при его риске.
Подходящие являющиеся людьми субъекты терапии обычно включают две группы лечения, которые можно различить по клиническим критериям. Субъектами с "запущенным заболеванием" или "высокой опухолевой нагрузкой" являются те, у которых присутствует клинически измеряемая опухоль. Клинически измеряемой является опухоль, которая может быть обнаружена по опухолевому образованию (например, путем пальпации, КТ-сканирования, сонограммы, маммографии или рентгена; положительных биохимических или гистопатологических маркеров самих по себе недостаточно для идентификации этой популяции). Этим субъектам вводят фармацевтическую композицию, чтобы вызвать противоопухолевый ответ с целью облегчения их состояния. В идеальном случае в результате происходит уменьшение опухолевого образования, но преимуществом является любое клиническое улучшение. Клиническое улучшение включает снижение риска или скорости прогрессирования или уменьшение патологических последствий опухоли.
Вторая группа подходящих субъектов известна в данной области техники как "адъювантная группа". В нее входят индивидуумы, у которых есть история неоплазии, но которые оказались чувствительны к другим методам терапии. Предыдущая терапия могла включать, но без ограничения, хирургическую резекцию, лучевую терапию и традиционную химиотерапию. В результате у этих индивидуумов нет клинически измеримой опухоли. Однако предполагается, что они подвержены риску прогрессирования заболевания или рядом с исходным местом опухоли, или из-за метастазов. Эту группу можно разделить на индивидуумов с высоким риском и низким риском. Подразделение производится на основе признаков, наблюдаемых до или после первоначального лечения. Эти признаки известны в области медицины и соответствующим образом определены для каждой отдельной неоплазии. Признаками подгрупп высокого риска являются проникновение опухоли в соседние ткани или поражение лимфатических узлов.
Другая группа имеет генетическую предрасположенность к неоплазии, но еще не обнаружила клинических признаков неоплазии. Например, женщины, имеющие положительный результат теста на генетическую мутацию, связанную с раком молочной железы, но все еще детородного возраста, могут желать получать одну или более иммунореактивных клеток, описанных в настоящем документе, при профилактическом лечении для предотвращения возникновения неоплазии до подходящего для превентивной хирургии момента.
Кроме того, раскрытый в данном документе предмет изобретения предлагает способы лечения и/или предупреждения патогенной инфекции (например, вирусной инфекции, бактериальной инфекции, грибковой инфекции, паразитарной инфекции или протозойной инфекции) у субъекта, например у иммунокомпрометированного субъекта. Способ может содержать введение эффективного количества раскрытых в данном документе иммунореактивных клеток или содержащей их композиции субъекту, имеющему патогенную инфекцию. Примеры вирусных инфекций, восприимчивых к лечению, включают, но без ограничения, инфицирование цитомегаловирусом (CMV), вирусом Эпштейна-Барр (EBV), вирусом иммунодефицита человека (HIV) и вирусом гриппа.
В раскрытые в данном документе иммунореактивные клетки (например, T-клетки) могут быть внесены дополнительные модификации для предотвращения или минимизации рисков иммунологических осложнений (известных как "злокачественная трансформация Т-клеток"), например реакции трансплантат против хозяина (GvHD), или когда здоровые ткани экспрессируют те же антигены-мишени, что и опухолевые клетки, что приводит к результатам, аналогичным GvHD. Потенциальным решением этой проблемы является введение в раскрытые в данном документе иммунореактивные клетки гена самоубийства. Подходящие гены самоубийства включают, но без ограничения, тимидинкиназу вируса простого герпеса (hsv-tk), индуцибельный ген самоубийства каспазы 9 (iCasp-9) и усеченный полипептид рецептора эпидермального фактора роста человека (EGFRt). В определенных вариантах осуществления ген самоубийства представляет собой полипептид EGFRt. Полипептид EGFRt может обеспечивать удаление T-клеток путем введения моноклонального антитела против EGFR (например, цетуксимаба). EGFRt может быть ковалентно присоединен выше антиген-распознающего рецептора раскрытого в данном документе CAR. Ген самоубийства может быть включен в вектор, содержащий нуклеиновые кислоты, кодирующие раскрытый в данном документе CAR. Таким образом, введение пролекарства, предназначенного для активации гена самоубийства (например, пролекарства (например, AP1903, которое может активировать iCasp-9) во время злокачественной трансформации T-клеток (например, GVHD), запускает апоптоз в активированных геном самоубийства CAR-экспрессирующих T-клетках. Включение гена самоубийства в раскрытый в данном документе CAR дает дополнительный уровень безопасности благодаря возможности устранения большинства CAR-T-клеток за очень короткий период времени. Раскрытая в данном документе иммунореактивная клетка (например, T-клетка), в которую включен ген самоубийства, может быть заранее устранена в определенный момент времени после инфузии CAR-T-клеток или ликвидирована при первых признаках токсичности.
11. Наборы
Раскрытый в данном документе предмет изобретения предлагает наборы для вызывания и/или усиления иммунного ответа и/или лечения и/или предупреждения неоплазии или патогенной инфекции у субъекта. В определенных вариантах осуществления набор содержит эффективное количество раскрытых в данном документе иммунореактивных клеток или содержащую их фармацевтическую композицию. В определенных вариантах осуществления набор содержит стерильный контейнер; такие контейнеры могут представлять собой коробки, ампулы, бутыли, флаконы, пробирки, пакеты, мешки, блистерные упаковки или другие подходящие формы контейнеров, известные в данной области техники. Такие контейнеры могут быть изготовлены из пластика, стекла, многослойной бумаги, металлической фольги или других материалов, подходящих для хранения лекарственных средств. В определенных неограничивающих вариантах осуществления набор включает в себя выделенную молекулу нуклеиновой кислоты, кодирующую HI-TCR, раскрытый в настоящем документе, который направлен на представляющий интерес антиген, в экспрессируемой форме, которая может, необязательно, содержаться в одном или более векторах.
Если желательно, иммунореактивные клетки и/или молекулы нуклеиновой кислоты предоставляют вместе с инструкциями по введению клеток или молекул нуклеиновой кислоты субъекту, имеющему неоплазию, или патоген, или иммунное нарушение, или риск их развития. Инструкции обычно включают информацию об использовании композиции для лечения и/или предотвращения неоплазии или патогенной инфекции. В определенных вариантах осуществления инструкции включают в себя по меньшей мере одно из следующего: описание терапевтического средства; режим дозировки и применения для лечения или предупреждения неоплазии, патогенной инфекции или иммунного нарушения или их симптомов; меры предосторожности; предупреждения; показания; противопоказания; информацию о передозировке; неблагоприятные реакции; фармакологию у животных; клинические исследования; и/или ссылки. Инструкции могут быть выполнены непосредственно на контейнере (при наличии), или в виде этикетки, прикрепленной к контейнеру, или в виде отдельного листа, брошюры, карточки или папки, поставляемых в контейнере или вместе с ним.
ПРИМЕРЫ
В практике настоящего раскрытия используются, если не указано иное, традиционные методы молекулярной биологии (включая рекомбинантные методы), микробиологии, клеточной биологии, биохимии и иммунологии, которые находятся в пределах компетенции специалиста в данной области техники. Такие методы полностью объяснены в литературе, такой как "Molecular Cloning: A Laboratory Manual", second edition (Sambrook, 1989); "Oligonucleotide Synthesis" (Gait, 1984); "Animal Cell Culture" (Freshney, 1987); "Methods in Enzymology" "Handbook of Experimental Immunology" (Weir, 1996); "Gene Transfer Vectors for Mammalian клетки" (Miller and Calos, 1987); "Current Protocols in Molecular Biology" (Ausubel, 1987); "PCR: The Polymerase Chain Reaction", (Mullis, 1994); "Current Protocols in Immunology" (Coligan, 1991). Эти методы применимы к получению полинуклеотидов и полипептидов, раскрытых в настоящем документе, и поэтому их можно рассматривать при создании и практическом применении раскрытого в данном документе предмета изобретения. В следующих разделах будут рассмотрены особенно полезные методы для конкретных вариантов осуществления.
Следующие ниже примеры представлены для того, чтобы предоставить средним специалистам в данной области техники полное раскрытие и описание того, как производить и использовать раскрытые в данном документе клетки и композиции, и не предназначены для ограничения объема того, что авторы считают своим изобретением.
Пример 1 - Введение в T-клетки комплексов эндогенного не рестриктированного по HLA T-клеточного рецептора/CD3
Введение
В локусе TCR были произведены определенные модификации, предназначенные для изменения антигенной специфичности человеческих Т-клеток без нарушения или обхода их комплекса CD3, который физиологически контролирует и регулирует активацию T-клеток. При таком подходе T-клетка потеряла свой эндогенный T-клеточный рецептор и приобрела способность распознавать антиген независимо от HLA, используя свой комплекс CD3, который в ином случае при использовании CAR не задействован. Это было достигнуто посредством целенаправленного разрушения эндогенного TCR в сочетании с введением антигенсвязывающих доменов в локус TRAC таким образом, чтобы сохранить все компоненты природного комплекса CD3 в их нативной структуре. Рекомбинантная TCR-подобная молекула (т.е. HI-TCR, FvTCR или HIT-CAR) может нести вариабельные домены, происходящие из иммуноглобулиновых генов или альтернативных лигандов, для прямого распознавания антигена. Рекомбинированный рецептор передает сигналы через комплекс CD3, который может быть или интактным (т.е. в своей физиологической композиции) или усиленным посредством нековалентного включения костимулирующих доменов.
Результаты
Была разработана новая стратегия одноэтапной генерации T-клеток с TCR и TCR-подобной молекулой путем интеграции гена TCR или TCR-подобного гена с другим вариабельным доменом для заранее определенного антигена. Это приводило к экспрессии нового TCR/TCR-подобного гена под контролем эндогенного промотора TCR (альфа, бета или обоих) с одновременным нарушением поверхностной экспрессии эндогенного TCR.
Была разработана стратегия одноэтапной генерации универсальных CAR-T-клеток путем направления интеграции кассеты с лишенным промотора геном CAR в первый экзон константной цепи TCR-альфа (TRAC). Это приводило к экспрессии CAR под контролем эндогенного промотора TCR-альфа с одновременным нарушением экспрессии гена TCR-альфа, что ведет к отсутствию экспрессии TCR на клеточной поверхности. Направление гена CAR в локус TRAC осуществляли посредством гомологичной рекомбинации (HR) с использованием сайт-специфической нуклеазы (например, CRISPR/Cas9) и донорной матрицы AAV. Благодаря использованию основанного на HR направления генов настоящая стратегия позволяла генерировать T-клети с уникальной специфичностью, которую кодировал химерный рецептор TCR, содержащий специфический антигенсвязывающий домен. Антигенсвязывающий домен происходил из иммуноглобулина (т.е. фрагмент Fv), лиганда рецептора клеточной поверхности или TCR (αβ или γδ). Гибридный химерный антигенный рецептор иммуноглобулин-TCR (т.е. HIT-CAR, FvTCR или HI-TCR) или γδTCR позволял T-клетке распознавать клетку-мишень HLA-независимым образом. Вставка нового αβTCR может быть выполнена таким же образом, но приведет к рестриктированному по HLA распознаванию антигена.
Например, фигура 1A показывает схематическое представление T-клеточного рецептора (TCR), B-клеточного рецептора (BCR), химерного антигенного рецептора (CAR) и основанного на TCR HLA-независимого химерного антигенного рецептора (т.е. HIT-CAR, FvTCR или HI-TCR). Направляемая CRISPR/Cas9 интеграция трех рецепторов в локус TRAC показана на фигуре 1B. Сконструированный HIT-CAR нацелен на CD19. Экспрессия HIT-CAR (т.е. HI-TCR) на клеточной поверхности из локуса TRAC показана на фигуре 1C. Цитотоксические эффекты и пролиферация T-клеток с HIT-CAR (т.е. HI-TCR или FvTCR) показаны на фигурах 1D и 1E соответственно.
Были созданы условия для получения вплоть до 65% T-клеток с HIT-CAR (т.е. HI-TCR или FvTCR), сочетающих разрушение целевого гена и направленную вставку HIT-CAR (т.е. HI-TCR или FvTCR) за один этап, как показано на фигуре 2A. Эти T-клетки проявляли in vitro и in vivo литическую активность в отношении опухоли, аналогично ранее охарактеризованным TRAC-CAR-T-клеткам, экспрессирующим CAR 1928z, как показано на фигуре 2B. Кроме того, взаимодействие с антигеном вызывало понижающую регуляцию T-клеток с HIT-CAR (т.е. HI-TCR или FvTCR), которая зависела от количества антиген-зависимых стимуляций. Поскольку экспрессия эндогенного TCR на клеточной поверхности была устранена, эти T-клетки с HIT-CAR (т.е. HI-TCR или FvTCR) оказались полезны для разработки пригодной к использованию иммунотерапии.
Для иммунотерапии можно использовать мишени, отличные от CD19. Схематическое представление генов NYESO TCR, интегрированных в альфа или бета-цепи TCR, показано на фигуре 3A. Экспрессия TRAC-NYESO-TCR и TRBC-NYESO-TCR (т.е. HI-TCR или FvTCR) на клеточной поверхности показана на фигуре 3B. Типичные графики проточной цитометрии TCR-V-бета-1 через 4 дня после воздействия на TRAC или TRBC показаны на фигуре 3B. Цитотоксическая активность сконструированных T-клеток показана на фигуре 3C. На фигуре 3D показано схематическое представление альтернативной схемы совместного нацеливания на TCR-альфа и TCR-бета, в которой NYESO-HI-TCR помещают в локус TRAC, а кассету экспрессии 4-1BBL помещают в локус TRBC. Экспрессия TRAC-NYESO-TCR и TRBC-4-1BBL на клеточной поверхности показана на фигуре 3E.
Также был предложен вариант подхода, в котором костимулирующий домен нековалентно вставляют в комплекс CD3, что обеспечивает супрафизиологическую реакцию на антиген и активацию. Это достигается путем слияния костимулирующего домена с одной или с обеими цепями TCR. Более того, возможны две дозировки костимуляции путем слияния костимулирующего домена с одной или с обеими модифицированными цепями TCR (т.е. антигенсвязывающими цепями).
Более того, HI-TCR показал большую чувствительность по сравнению с CAR. Человеческие T-клетки, отредактированные с заменой эндогенного TCR на HI-TCR, приобрели способность взаимодействовать с антигенами с более низкими плотностями и убивать такие клетки. Например, таблица 2 показывает цитотоксическую активность HI-TCR-клеток in vitro. HI-TCR или CD19-CAR вводили в эндогенный локус TRAC человеческих периферических Т-клеток посредством опосредованного CRISPR/Cas9 редактирования генов и донорных векторов AAV6. Через пять дней после воздействия на ген T-клетки (6, 30, или 150 тысяч) инкубировали с 250 тысячами лейкозных клеток Nalm6, которые экспрессируют разные уровни CD19 (от очень низких до высоких уровней). Клетки инкубировали в течение 22 ч. в 500 мкл среды X-Vivo, содержащей сыворотку (без IL2). Совместные культуры анализировали с помощью FACS в присутствии счетных гранул для определения общего количества клеток Nalm6. Цитотоксическая активность показана как процент убитых Nalm6. E/T: соотношение эффектор (T-клетки) к мишени (Nalm6). Данные ясно демонстрируют, что HI-TCR может обнаруживать более низкие уровни антигена CD19, чем CAR. Эта особенность может быть очень полезной для антигенов с умеренной или низкой экспрессией, таких как CD22, BCMA, CCR1, CD70 и т.д., а также может быть полезной для лечения рецидива после терапии CAR в отношении любого антигена, поскольку опухолевые клетки при рецидиве часто демонстрируют сниженные плотности антигенов на своей поверхности.
Таблица 2. Процент гибели опухолевых клеток
Кроме того, было обнаружено, что панель экзогенных и эндогенных 3'-нетранслируемых областей (3'-UTR) способна регулировать точную и предсказуемую экспрессию генов в локусе TCR. Например, фигура 4A показывает схематическое представление гена CD28z CAR, интегрированного в локус TRAC. Поли(A) (черная рамка) соответствует сегменту кассеты CAR, который был модифицирован для тестирования различных 3'-UTR вирусов и млекопитающих. При использовании TRAC-CAR-T-клеток, экспрессирующих CD28z CAR, в качестве модели, было показано, что определенные 3'-UTR снижают экспрессию CAR по сравнению поли(A)-последовательностью бычьего гормона роста (bGH) (фигуры 4B и 4C), которая давала CAR-T-клетки с нарушенной цитотоксической активностью in vivo (фигуры 5A и 5B). Было показано, что некоторые другие 3'-UTR, включая эндогенную 3'-UTR TRAC, увеличивают уровни поверхностной экспрессии CAR (фигуры 4B и 4C), что дает CAR-T-клетки с улучшенной цитотоксической активностью in vivo (фигуры 5A и 5B). Эти 3'-UTR можно также использовать для регуляции точной и предсказуемой экспрессии гена любого HI-TCR, раскрытого в настоящем документе.
Вышеописанные генетические модификации в локусе TRAC позволяют генерировать T-клетки, экспрессирующие оптимальные уровни HI-TCR, который как и физиологический TCR, но в отличие от CAR, используют преимущества аппарата активации эндогенных Т-клеток (комплекс CD3 и расположенные ниже сигнальные элементы). Этот подход может способствовать развитию как аутологичной, так и аллогенной T-клеточных терапий.
Другой важной областью, в которой находит соответствующее применение редактирование гена TCR, являются происходящие от T-iPS T-клетки. T-iPS-клетки представляют собой плюрипотентные стволовые клетки, полученные путем перепрограммирования периферических T-лимфоцитов. Эти T-iPS-клетки, таким образом, содержат перегруппированный T-клеточный рецептор, или αβ, или γδ-TCR, который может быть модифицирован с использованием технологий редактирования генов. T-клетки, происходящие от T-iPS-клеток посредством направленной дифференцировки, экспрессируют перегруппированный TCR, который может быть обнаружен и секвенирован. Используя эту последовательность, можно определить точное местоположение перегруппированного вариабельного домена в геноме T-iPS-клеток. Используя нуклеазы, которые специфически нацелены на этот перегруппированный вариабельный домен, и донорную ДНК, содержащую вариабельный домен TCR с известной специфичностью, можно заменить эндогенный вариабельный домен на новый. Этот подход требует двух этапов редактирования гена: одно воздействие на α (или γ) цепь, а другое на β (или δ) цепь. Подход может быть реализован за один этап, поскольку необходимо модифицировать только два аллеля. Кроме того, используя стратегию, аналогичную описанной для первичных человеческих T-клеток, цепи TCR могут быть модифицированы для экспрессии любого HI-TCR, раскрытого в настоящем документе.
Пример 2
На фигуре 1A показана направляемая CRISPR/Cas9 интеграция трех рецепторов в локус TRAC. Сконструированный HIT-CAR нацелен на CD19. На фигурах 6B и 6C показана экспрессия HIT-CAR (т.е. HI-TCR) на клеточной поверхности из локуса TRAC. На фигурах 7A, 7B и 8A-8C показаны цитолитические эффекты и пролиферация T-клеток с HIT-CAR (т.е. HI-TCR или FvTCR). В частности, эти данные показывают, что HIT-T-клетки превосходят CAR-T-клетки в уничтожении клеток-мишеней, экспрессирующих низкие уровни антигенов.
Кроме того, для коэкспрессии костимулирующих лигандов были сконструированы HI-TCR-T-клетки, как показано на фигурах 9A-9D. В этом конкретном эксперименте на следующий день после введения HI-TCR в локус TRAC T-клетки переносили с помощью ретровирусных векторов SFG, кодирующих CD80, 41BBL или и тот, и другой. Через 5 дней после размножения этих клеток ex vivo 4e5 положительных по TRAC-CAR или TRAC-HI-TCR T-клеток вводили мышам NSG, несущим клетки NALM6, экспрессирующие очень низкий уровень CD19. TRAC-HI-TCR-T-клетки экспрессировали CD80, 41BBL, оба или ни одного лиганда. Для оценки опухолевой нагрузки каждую неделю и отслеживания выживаемости мышей использовали биолюминесценцию.
Наблюдали, что TRAC-CAR-T-клетки не были способны контролировать опухоль с очень низкими уровнями CD19, и все мыши были неизлечимо больны к 30 дню. При такой низкой дозе HI-TCR-T-клетки первоначально контролировали опухолевую нагрузку, однако мыши снова заболевали к 10 дню и были неизлечимо больны к 40 дню. Добавление костимулирующих лигандов к HI-TCR-T-клеткам улучшало противоопухолевую активность с оптимальным ответом при коэкспрессии HI-TCR-T-клетками CD80 и 4-1BBL. Эта улучшенная активность приводила к долгосрочному контролю NALM6, экспрессирующих очень низкие уровни CD19.
Фигуры 10A-10C дополнительно демонстрируют, что базовую экспрессию TRAC-CAR можно контролировать с помощью различных 3'-UTR-последовательностей, не воздействуя на кинетику восполнения клеточной поверхности после встречи с антигеном. TRAC-CAR-T-клетки конструировали таким же образом, как описано ранее, так что все конструкции находились под транскрипционным контролем эндогенного промотора TRAC. Наблюдали, что модификация 3'-UTR (которая включает в себя поли(A)-сигнал) модулирует базовый уровень экспрессии (фигура 10B). Когда эти различные TRAC-CAR-T-клетки культивировали на опухолевых клетках, экспрессирующих CD19, с помощью проточной цитометрии наблюдали снижение экспрессии CAR на клеточной поверхности с последующим восполнением (фигура 10C). Различные 3'-UTR изменяли базовый уровень экспрессии, но они сохраняли ту же кинетику восполнения, а конечный уровень экспрессии был подобен базовому.
Кроме того, также были созданы HI-TCR, нацеленный на CD70, и HI-TCR, нацеленный на CD22. HI-TCR, нацеленный на представляющий интерес антиген, может быть создан путем секвенирования существующей области scFv или Fab существующего антитела, нацеленного на тот же антиген, для получения внеклеточного антигенсвязывающего домена.
Варианты осуществления раскрытого в данном документе предмета изобретения
Из вышеприведенного описания очевидно, что в раскрытом в данном документе предмете изобретения могут быть сделаны изменения и модификации, чтобы адаптировать его к различным применениям и условиям. Такие варианты осуществления также входят в объем нижеследующей формулы изобретения.
Перечисление списка элементов в любом определении переменной в настоящем документе включает в себя определения этой переменной как любого отдельного элемента или комбинации (или подкомбинации) перечисленных элементов. Изложение варианта осуществления в настоящем документе включает в себя этот вариант осуществления как любой отдельный вариант осуществления или в комбинации с любыми другими вариантами осуществления или их частями.
Все патенты и публикации, упомянутые в этом описании, включены в настоящий документ посредством ссылки в той же степени, как если бы каждый независимый патент и публикация были специально и индивидуально указаны как включенные посредством ссылки.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> MEMORIAL SLOAN-KETTERING CANCER CENTER
<120> НЕ РЕСТРИКТИРОВАННЫЕ ПО HLA T-КЛЕТОЧНЫЕ РЕЦЕПТОРЫ И ИХ
ПРИМЕНЕНИЕ
<130> 072734.0845
<140> PCT/US2019/017525
<141> 2019-02-11
<150> 62/629,072
<151> 2018-02-11
<160> 48
<170> PatentIn version 3.5
<210> 1
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 1
Gly Tyr Ala Phe Ser Ser
1 5
<210> 2
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 2
Tyr Pro Gly Asp Gly Asp
1 5
<210> 3
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 3
Lys Thr Ile Ser Ser Val Val Asp Phe
1 5
<210> 4
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 4
Lys Ala Ser Gln Asn Val Gly Thr Asn Val Ala
1 5 10
<210> 5
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 5
Ser Ala Thr Tyr Arg Asn
1 5
<210> 6
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 6
Gln Gln Tyr Asn Arg Tyr Pro Tyr Thr
1 5
<210> 7
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 7
Glu Val Lys Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gln Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Gln Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Gly Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Lys Thr Ile Ser Ser Val Val Asp Phe Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 8
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 8
Asp Ile Glu Leu Thr Gln Ser Pro Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Pro Leu Ile
35 40 45
Tyr Ser Ala Thr Tyr Arg Asn Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr Asn Val Gln Ser
65 70 75 80
Lys Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn Arg Tyr Pro Tyr
85 90 95
Thr Ser Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 9
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 9
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Glu Val Lys Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro
20 25 30
Gly Ser Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser
35 40 45
Ser Tyr Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu
50 55 60
Trp Ile Gly Gln Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly
65 70 75 80
Lys Phe Lys Gly Gln Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr
85 90 95
Ala Tyr Met Gln Leu Ser Gly Leu Thr Ser Glu Asp Ser Ala Val Tyr
100 105 110
Phe Cys Ala Arg Lys Thr Ile Ser Ser Val Val Asp Phe Tyr Phe Asp
115 120 125
Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Glu Leu Thr
145 150 155 160
Gln Ser Pro Lys Phe Met Ser Thr Ser Val Gly Asp Arg Val Ser Val
165 170 175
Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Asn Val Ala Trp Tyr Gln
180 185 190
Gln Lys Pro Gly Gln Ser Pro Lys Pro Leu Ile Tyr Ser Ala Thr Tyr
195 200 205
Arg Asn Ser Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr
210 215 220
Asp Phe Thr Leu Thr Ile Thr Asn Val Gln Ser Lys Asp Leu Ala Asp
225 230 235 240
Tyr Phe Cys Gln Gln Tyr Asn Arg Tyr Pro Tyr Thr Ser Gly Gly Gly
245 250 255
Thr Lys Leu Glu Ile Lys Arg
260
<210> 10
<211> 789
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полинуклеотид
<400> 10
atggctctcc cagtgactgc cctactgctt cccctagcgc ttctcctgca tgcagaggtg 60
aagctgcagc agtctggggc tgagctggtg aggcctgggt cctcagtgaa gatttcctgc 120
aaggcttctg gctatgcatt cagtagctac tggatgaact gggtgaagca gaggcctgga 180
cagggtcttg agtggattgg acagatttat cctggagatg gtgatactaa ctacaatgga 240
aagttcaagg gtcaagccac actgactgca gacaaatcct ccagcacagc ctacatgcag 300
ctcagcggcc taacatctga ggactctgcg gtctatttct gtgcaagaaa gaccattagt 360
tcggtagtag atttctactt tgactactgg ggccaaggga ccacggtcac cgtctcctca 420
ggtggaggtg gatcaggtgg aggtggatct ggtggaggtg gatctgacat tgagctcacc 480
cagtctccaa aattcatgtc cacatcagta ggagacaggg tcagcgtcac ctgcaaggcc 540
agtcagaatg tgggtactaa tgtagcctgg tatcaacaga aaccaggaca atctcctaaa 600
ccactgattt actcggcaac ctaccggaac agtggagtcc ctgatcgctt cacaggcagt 660
ggatctggga cagatttcac tctcaccatc actaacgtgc agtctaaaga cttggcagac 720
tatttctgtc aacaatataa caggtatccg tacacgtccg gaggggggac caagctggag 780
atcaaacgg 789
<210> 11
<211> 272
<212> Белок
<213> Homo sapiens
<400> 11
Pro Glu Glu Pro Leu Val Val Lys Val Glu Glu Gly Asp Asn Ala Val
1 5 10 15
Leu Gln Cys Leu Lys Gly Thr Ser Asp Gly Pro Thr Gln Gln Leu Thr
20 25 30
Trp Ser Arg Glu Ser Pro Leu Lys Pro Phe Leu Lys Leu Ser Leu Gly
35 40 45
Leu Pro Gly Leu Gly Ile His Met Arg Pro Leu Ala Ile Trp Leu Phe
50 55 60
Ile Phe Asn Val Ser Gln Gln Met Gly Gly Phe Tyr Leu Cys Gln Pro
65 70 75 80
Gly Pro Pro Ser Glu Lys Ala Trp Gln Pro Gly Trp Thr Val Asn Val
85 90 95
Glu Gly Ser Gly Glu Leu Phe Arg Trp Asn Val Ser Asp Leu Gly Gly
100 105 110
Leu Gly Cys Gly Leu Lys Asn Arg Ser Ser Glu Gly Pro Ser Ser Pro
115 120 125
Ser Gly Lys Leu Met Ser Pro Lys Leu Tyr Val Trp Ala Lys Asp Arg
130 135 140
Pro Glu Ile Trp Glu Gly Glu Pro Pro Cys Leu Pro Pro Arg Asp Ser
145 150 155 160
Leu Asn Gln Ser Leu Ser Gln Asp Leu Thr Met Ala Pro Gly Ser Thr
165 170 175
Leu Trp Leu Ser Cys Gly Val Pro Pro Asp Ser Val Ser Arg Gly Pro
180 185 190
Leu Ser Trp Thr His Val His Pro Lys Gly Pro Lys Ser Leu Leu Ser
195 200 205
Leu Glu Leu Lys Asp Asp Arg Pro Ala Arg Asp Met Trp Val Met Glu
210 215 220
Thr Gly Leu Leu Leu Pro Arg Ala Thr Ala Gln Asp Ala Gly Lys Tyr
225 230 235 240
Tyr Cys His Arg Gly Asn Leu Thr Met Ser Phe His Leu Glu Ile Thr
245 250 255
Ala Arg Pro Val Leu Trp His Trp Leu Leu Arg Thr Gly Gly Trp Lys
260 265 270
<210> 12
<211> 20
<212> Белок
<213> Homo sapiens
<400> 12
Met Tyr Arg Met Gln Leu Leu Ser Cys Ile Ala Leu Ser Leu Ala Leu
1 5 10 15
Val Thr Asn Ser
20
<210> 13
<211> 20
<212> Белок
<213> Mus sp.
<400> 13
Met Tyr Ser Met Gln Leu Ala Ser Cys Val Thr Leu Thr Leu Val Leu
1 5 10 15
Leu Val Asn Ser
20
<210> 14
<211> 20
<212> Белок
<213> Homo sapiens
<400> 14
Met Glu Thr Pro Ala Gln Leu Leu Phe Leu Leu Leu Leu Trp Leu Pro
1 5 10 15
Asp Thr Thr Gly
20
<210> 15
<211> 20
<212> Белок
<213> Mus sp.
<400> 15
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly
20
<210> 16
<211> 21
<212> Белок
<213> Homo sapiens
<400> 16
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro
20
<210> 17
<211> 164
<212> Белок
<213> Homo sapiens
<400> 17
Met Lys Trp Lys Ala Leu Phe Thr Ala Ala Ile Leu Gln Ala Gln Leu
1 5 10 15
Pro Ile Thr Glu Ala Gln Ser Phe Gly Leu Leu Asp Pro Lys Leu Cys
20 25 30
Tyr Leu Leu Asp Gly Ile Leu Phe Ile Tyr Gly Val Ile Leu Thr Ala
35 40 45
Leu Phe Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
50 55 60
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
65 70 75 80
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
85 90 95
Gly Gly Lys Pro Gln Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
100 105 110
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
115 120 125
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
130 135 140
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
145 150 155 160
Leu Pro Pro Arg
<210> 18
<211> 112
<212> Белок
<213> Homo sapiens
<400> 18
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 19
<211> 336
<212> ДНК
<213> Homo sapiens
<400> 19
agagtgaagt tcagcaggag cgcagacgcc cccgcgtacc agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat 180
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc 240
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc 300
tacgacgccc ttcacatgca ggccctgccc cctcgc 336
<210> 20
<211> 220
<212> Белок
<213> Homo sapiens
<400> 20
Met Leu Arg Leu Leu Leu Ala Leu Asn Leu Phe Pro Ser Ile Gln Val
1 5 10 15
Thr Gly Asn Lys Ile Leu Val Lys Gln Ser Pro Met Leu Val Ala Tyr
20 25 30
Asp Asn Ala Val Asn Leu Ser Cys Lys Tyr Ser Tyr Asn Leu Phe Ser
35 40 45
Arg Glu Phe Arg Ala Ser Leu His Lys Gly Leu Asp Ser Ala Val Glu
50 55 60
Val Cys Val Val Tyr Gly Asn Tyr Ser Gln Gln Leu Gln Val Tyr Ser
65 70 75 80
Lys Thr Gly Phe Asn Cys Asp Gly Lys Leu Gly Asn Glu Ser Val Thr
85 90 95
Phe Tyr Leu Gln Asn Leu Tyr Val Asn Gln Thr Asp Ile Tyr Phe Cys
100 105 110
Lys Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser
115 120 125
Asn Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro
130 135 140
Leu Phe Pro Gly Pro Ser Lys Pro Phe Trp Val Leu Val Val Val Gly
145 150 155 160
Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile
165 170 175
Phe Trp Val Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met
180 185 190
Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro
195 200 205
Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser
210 215 220
<210> 21
<211> 41
<212> Белок
<213> Homo sapiens
<400> 21
Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 22
<211> 123
<212> ДНК
<213> Homo sapiens
<400> 22
aggagtaaga ggagcaggct cctgcacagt gactacatga acatgactcc ccgccgcccc 60
gggcccaccc gcaagcatta ccagccctat gccccaccac gcgacttcgc agcctatcgc 120
tcc 123
<210> 23
<211> 255
<212> Белок
<213> Homo sapiens
<400> 23
Met Gly Asn Ser Cys Tyr Asn Ile Val Ala Thr Leu Leu Leu Val Leu
1 5 10 15
Asn Phe Glu Arg Thr Arg Ser Leu Gln Asp Pro Cys Ser Asn Cys Pro
20 25 30
Ala Gly Thr Phe Cys Asp Asn Asn Arg Asn Gln Ile Cys Ser Pro Cys
35 40 45
Pro Pro Asn Ser Phe Ser Ser Ala Gly Gly Gln Arg Thr Cys Asp Ile
50 55 60
Cys Arg Gln Cys Lys Gly Val Phe Arg Thr Arg Lys Glu Cys Ser Ser
65 70 75 80
Thr Ser Asn Ala Glu Cys Asp Cys Thr Pro Gly Phe His Cys Leu Gly
85 90 95
Ala Gly Cys Ser Met Cys Glu Gln Asp Cys Lys Gln Gly Gln Glu Leu
100 105 110
Thr Lys Lys Gly Cys Lys Asp Cys Cys Phe Gly Thr Phe Asn Asp Gln
115 120 125
Lys Arg Gly Ile Cys Arg Pro Trp Thr Asn Cys Ser Leu Asp Gly Lys
130 135 140
Ser Val Leu Val Asn Gly Thr Lys Glu Arg Asp Val Val Cys Gly Pro
145 150 155 160
Ser Pro Ala Asp Leu Ser Pro Gly Ala Ser Ser Val Thr Pro Pro Ala
165 170 175
Pro Ala Arg Glu Pro Gly His Ser Pro Gln Ile Ile Ser Phe Phe Leu
180 185 190
Ala Leu Thr Ser Thr Ala Leu Leu Phe Leu Leu Phe Phe Leu Thr Leu
195 200 205
Arg Phe Ser Val Val Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe
210 215 220
Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly
225 230 235 240
Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
245 250 255
<210> 24
<211> 42
<212> Белок
<213> Homo sapiens
<400> 24
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 25
<211> 277
<212> Белок
<213> Homo sapiens
<400> 25
Met Cys Val Gly Ala Arg Arg Leu Gly Arg Gly Pro Cys Ala Ala Leu
1 5 10 15
Leu Leu Leu Gly Leu Gly Leu Ser Thr Val Thr Gly Leu His Cys Val
20 25 30
Gly Asp Thr Tyr Pro Ser Asn Asp Arg Cys Cys His Glu Cys Arg Pro
35 40 45
Gly Asn Gly Met Val Ser Arg Cys Ser Arg Ser Gln Asn Thr Val Cys
50 55 60
Arg Pro Cys Gly Pro Gly Phe Tyr Asn Asp Val Val Ser Ser Lys Pro
65 70 75 80
Cys Lys Pro Cys Thr Trp Cys Asn Leu Arg Ser Gly Ser Glu Arg Lys
85 90 95
Gln Leu Cys Thr Ala Thr Gln Asp Thr Val Cys Arg Cys Arg Ala Gly
100 105 110
Thr Gln Pro Leu Asp Ser Tyr Lys Pro Gly Val Asp Cys Ala Pro Cys
115 120 125
Pro Pro Gly His Phe Ser Pro Gly Asp Asn Gln Ala Cys Lys Pro Trp
130 135 140
Thr Asn Cys Thr Leu Ala Gly Lys His Thr Leu Gln Pro Ala Ser Asn
145 150 155 160
Ser Ser Asp Ala Ile Cys Glu Asp Arg Asp Pro Pro Ala Thr Gln Pro
165 170 175
Gln Glu Thr Gln Gly Pro Pro Ala Arg Pro Ile Thr Val Gln Pro Thr
180 185 190
Glu Ala Trp Pro Arg Thr Ser Gln Gly Pro Ser Thr Arg Pro Val Glu
195 200 205
Val Pro Gly Gly Arg Ala Val Ala Ala Ile Leu Gly Leu Gly Leu Val
210 215 220
Leu Gly Leu Leu Gly Pro Leu Ala Ile Leu Leu Ala Leu Tyr Leu Leu
225 230 235 240
Arg Arg Asp Gln Arg Leu Pro Pro Asp Ala His Lys Pro Pro Gly Gly
245 250 255
Gly Ser Phe Arg Thr Pro Ile Gln Glu Glu Gln Ala Asp Ala His Ser
260 265 270
Thr Leu Ala Lys Ile
275
<210> 26
<211> 199
<212> Белок
<213> Homo sapiens
<400> 26
Met Lys Ser Gly Leu Trp Tyr Phe Phe Leu Phe Cys Leu Arg Ile Lys
1 5 10 15
Val Leu Thr Gly Glu Ile Asn Gly Ser Ala Asn Tyr Glu Met Phe Ile
20 25 30
Phe His Asn Gly Gly Val Gln Ile Leu Cys Lys Tyr Pro Asp Ile Val
35 40 45
Gln Gln Phe Lys Met Gln Leu Leu Lys Gly Gly Gln Ile Leu Cys Asp
50 55 60
Leu Thr Lys Thr Lys Gly Ser Gly Asn Thr Val Ser Ile Lys Ser Leu
65 70 75 80
Lys Phe Cys His Ser Gln Leu Ser Asn Asn Ser Val Ser Phe Phe Leu
85 90 95
Tyr Asn Leu Asp His Ser His Ala Asn Tyr Tyr Phe Cys Asn Leu Ser
100 105 110
Ile Phe Asp Pro Pro Pro Phe Lys Val Thr Leu Thr Gly Gly Tyr Leu
115 120 125
His Ile Tyr Glu Ser Gln Leu Cys Cys Gln Leu Lys Phe Trp Leu Pro
130 135 140
Ile Gly Cys Ala Ala Phe Val Val Val Cys Ile Leu Gly Cys Ile Leu
145 150 155 160
Ile Cys Trp Leu Thr Lys Lys Lys Tyr Ser Ser Ser Val His Asp Pro
165 170 175
Asn Gly Glu Tyr Met Phe Met Arg Ala Val Asn Thr Ala Lys Lys Ser
180 185 190
Arg Leu Thr Asp Val Thr Leu
195
<210> 27
<211> 126
<212> ДНК
<213> Homo sapiens
<400> 27
aaacggggca gaaagaaact cctgtatata ttcaaacaac catttatgag accagtacaa 60
actactcaag aggaagatgg ctgtagctgc cgatttccag aagaagaaga aggaggatgt 120
gaactg 126
<210> 28
<211> 18
<212> Белок
<213> Homo sapiens
<400> 28
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala
<210> 29
<211> 4627
<212> ДНК
<213> Homo sapiens
<400> 29
atatccagaa ccctgaccct gccgtgtacc agctgagaga ctctaaatcc agtgacaagt 60
ctgtctgcct attcaccgat tttgattctc aaacaaatgt gtcacaaagt aaggattctg 120
atgtgtatat cacagacaaa actgtgctag acatgaggtc tatggacttc aagagcaaca 180
gtgctgtggc ctggagcaac aaatctgact ttgcatgtgc aaacgccttc aacaacagca 240
ttattccaga agacaccttc ttccccagcc caggtaaggg cagctttggt gccttcgcag 300
gctgtttcct tgcttcagga atggccaggt tctgcccaga gctctggtca atgatgtcta 360
aaactcctct gattggtggt ctcggcctta tccattgcca ccaaaaccct ctttttacta 420
agaaacagtg agccttgttc tggcagtcca gagaatgaca cgggaaaaaa gcagatgaag 480
agaaggtggc aggagagggc acgtggccca gcctcagtct ctccaactga gttcctgcct 540
gcctgccttt gctcagactg tttgcccctt actgctcttc taggcctcat tctaagcccc 600
ttctccaagt tgcctctcct tatttctccc tgtctgccaa aaaatctttc ccagctcact 660
aagtcagtct cacgcagtca ctcattaacc caccaatcac tgattgtgcc ggcacatgaa 720
tgcaccaggt gttgaagtgg aggaattaaa aagtcagatg aggggtgtgc ccagaggaag 780
caccattcta gttgggggag cccatctgtc agctgggaaa agtccaaata acttcagatt 840
ggaatgtgtt ttaactcagg gttgagaaaa cagctacctt caggacaaaa gtcagggaag 900
ggctctctga agaaatgcta cttgaagata ccagccctac caagggcagg gagaggaccc 960
tatagaggcc tgggacagga gctcaatgag aaaggagaag agcagcaggc atgagttgaa 1020
tgaaggaggc agggccgggt cacagggcct tctaggccat gagagggtag acagtattct 1080
aaggacgcca gaaagctgtt gatcggcttc aagcagggga gggacaccta atttgctttt 1140
cttttttttt tttttttttt tttttttttt tgagatggag ttttgctctt gttgcccagg 1200
ctggagtgca atggtgcatc ttggctcact gcaacctccg cctcccaggt tcaagtgatt 1260
ctcctgcctc agcctcccga gtagctgaga ttacaggcac ccgccaccat gcctggctaa 1320
ttttttgtat ttttagtaga gacagggttt cactatgttg gccaggctgg tctcgaactc 1380
ctgacctcag gtgatccacc cgcttcagcc tcccaaagtg ctgggattac aggcgtgagc 1440
caccacaccc ggcctgcttt tcttaaagat caatctgagt gctgtacgga gagtgggttg 1500
taagccaaga gtagaagcag aaagggagca gttgcagcag agagatgatg gaggcctggg 1560
cagggtggtg gcagggaggt aaccaacacc attcaggttt caaaggtaga accatgcagg 1620
gatgagaaag caaagagggg atcaaggaag gcagctggat tttggcctga gcagctgagt 1680
caatgatagt gccgtttact aagaagaaac caaggaaaaa atttggggtg cagggatcaa 1740
aactttttgg aacatatgaa agtacgtgtt tatactcttt atggcccttg tcactatgta 1800
tgcctcgctg cctccattgg actctagaat gaagccaggc aagagcaggg tctatgtgtg 1860
atggcacatg tggccagggt catgcaacat gtactttgta caaacagtgt atattgagta 1920
aatagaaatg gtgtccagga gccgaggtat cggtcctgcc agggccaggg gctctcccta 1980
gcaggtgctc atatgctgta agttccctcc agatctctcc acaaggaggc atggaaaggc 2040
tgtagttgtt cacctgccca agaactagga ggtctggggt gggagagtca gcctgctctg 2100
gatgctgaaa gaatgtctgt ttttcctttt agaaagttcc tgtgatgtca agctggtcga 2160
gaaaagcttt gaaacaggta agacaggggt ctagcctggg tttgcacagg attgcggaag 2220
tgatgaaccc gcaataaccc tgcctggatg agggagtggg aagaaattag tagatgtggg 2280
aatgaatgat gaggaatgga aacagcggtt caagacctgc ccagagctgg gtggggtctc 2340
tcctgaatcc ctctcaccat ctctgacttt ccattctaag cactttgagg atgagtttct 2400
agcttcaata gaccaaggac tctctcctag gcctctgtat tcctttcaac agctccactg 2460
tcaagagagc cagagagagc ttctgggtgg cccagctgtg aaatttctga gtcccttagg 2520
gatagcccta aacgaaccag atcatcctga ggacagccaa gaggttttgc cttctttcaa 2580
gacaagcaac agtactcaca taggctgtgg gcaatggtcc tgtctctcaa gaatcccctg 2640
ccactcctca cacccaccct gggcccatat tcatttccat ttgagttgtt cttattgagt 2700
catccttcct gtggtagcgg aactcactaa ggggcccatc tggacccgag gtattgtgat 2760
gataaattct gagcacctac cccatcccca gaagggctca gaaataaaat aagagccaag 2820
tctagtcggt gtttcctgtc ttgaaacaca atactgttgg ccctggaaga atgcacagaa 2880
tctgtttgta aggggatatg cacagaagct gcaagggaca ggaggtgcag gagctgcagg 2940
cctcccccac ccagcctgct ctgccttggg gaaaaccgtg ggtgtgtcct gcaggccatg 3000
caggcctggg acatgcaagc ccataaccgc tgtggcctct tggttttaca gatacgaacc 3060
taaactttca aaacctgtca gtgattgggt tccgaatcct cctcctgaaa gtggccgggt 3120
ttaatctgct catgacgctg cggctgtggt ccagctgagg tgaggggcct tgaagctggg 3180
agtggggttt agggacgcgg gtctctgggt gcatcctaag ctctgagagc aaacctccct 3240
gcagggtctt gcttttaagt ccaaagcctg agcccaccaa actctcctac ttcttcctgt 3300
tacaaattcc tcttgtgcaa taataatggc ctgaaacgct gtaaaatatc ctcatttcag 3360
ccgcctcagt tgcacttctc ccctatgagg taggaagaac agttgtttag aaacgaagaa 3420
actgaggccc cacagctaat gagtggagga agagagacac ttgtgtacac cacatgcctt 3480
gtgttgtact tctctcaccg tgtaacctcc tcatgtcctc tctccccagt acggctctct 3540
tagctcagta gaaagaagac attacactca tattacaccc caatcctggc tagagtctcc 3600
gcaccctcct cccccagggt ccccagtcgt cttgctgaca actgcatcct gttccatcac 3660
catcaaaaaa aaactccagg ctgggtgcgg gggctcacac ctgtaatccc agcactttgg 3720
gaggcagagg caggaggagc acaggagctg gagaccagcc tgggcaacac agggagaccc 3780
cgcctctaca aaaagtgaaa aaattaacca ggtgtggtgc tgcacacctg tagtcccagc 3840
tacttaagag gctgagatgg gaggatcgct tgagccctgg aatgttgagg ctacaatgag 3900
ctgtgattgc gtcactgcac tccagcctgg aagacaaagc aagatcctgt ctcaaataat 3960
aaaaaaaata agaactccag ggtacatttg ctcctagaac tctaccacat agccccaaac 4020
agagccatca ccatcacatc cctaacagtc ctgggtcttc ctcagtgtcc agcctgactt 4080
ctgttcttcc tcattccaga tctgcaagat tgtaagacag cctgtgctcc ctcgctcctt 4140
cctctgcatt gcccctcttc tccctctcca aacagaggga actctcctac ccccaaggag 4200
gtgaaagctg ctaccacctc tgtgcccccc cggcaatgcc accaactgga tcctacccga 4260
atttatgatt aagattgctg aagagctgcc aaacactgct gccaccccct ctgttccctt 4320
attgctgctt gtcactgcct gacattcacg gcagaggcaa ggctgctgca gcctcccctg 4380
gctgtgcaca ttccctcctg ctccccagag actgcctccg ccatcccaca gatgatggat 4440
cttcagtggg ttctcttggg ctctaggtcc tgcagaatgt tgtgaggggt ttattttttt 4500
ttaatagtgt tcataaagaa atacatagta ttcttcttct caagacgtgg ggggaaatta 4560
tctcattatc gaggccctgc tatgctgtgt atctgggcgt gttgtatgtc ctgctgccga 4620
tgccttc 4627
<210> 30
<211> 1448
<212> ДНК
<213> Homo sapiens
<400> 30
aggacctgaa caaggtgttc ccacccgagg tcgctgtgtt tgagccatca gaagcagaga 60
tctcccacac ccaaaaggcc acactggtgt gcctggccac aggcttcttc cccgaccacg 120
tggagctgag ctggtgggtg aatgggaagg aggtgcacag tggggtcagc acagacccgc 180
agcccctcaa ggagcagccc gccctcaatg actccagata ctgcctgagc agccgcctga 240
gggtctcggc caccttctgg cagaaccccc gcaaccactt ccgctgtcaa gtccagttct 300
acgggctctc ggagaatgac gagtggaccc aggatagggc caaacccgtc acccagatcg 360
tcagcgccga ggcctggggt agagcaggtg agtggggcct ggggagatgc ctggaggaga 420
ttaggtgaga ccagctacca gggaaaatgg aaagatccag gtagcagaca agactagatc 480
caaaaagaaa ggaaccagcg cacaccatga aggagaattg ggcacctgtg gttcattctt 540
ctcccagatt ctcagcccaa cagagccaag cagctgggtc ccctttctat gtggcctgtg 600
taactctcat ctgggtggtg ccccccatcc ccctcagtgc tgccacatgc catggattgc 660
aaggacaatg tggctgacat ctgcatggca gaagaaagga ggtgctgggc tgtcagagga 720
agctggtctg ggcctgggag tctgtgccaa ctgcaaatct gactttactt ttaattgcct 780
atgaaaataa ggtctctcat ttattttcct ctccctgctt tctttcagac tgtggcttta 840
cctcgggtaa gtaagccctt ccttttcctc tccctctctc atggttcttg acctagaacc 900
aaggcatgaa gaactcacag acactggagg gtggagggtg ggagagacca gagctacctg 960
tgcacaggta cccacctgtc cttcctccgt gccaacagtg tcctaccagc aaggggtcct 1020
gtctgccacc atcctctatg agatcctgct agggaaggcc accctgtatg ctgtgctggt 1080
cagcgccctt gtgttgatgg ccatggtaag caggagggca ggatggggcc agcaggctgg 1140
aggtgacaca ctgacaccaa gcacccagaa gtatagagtc cctgccagga ttggagctgg 1200
gcagtaggga gggaagagat ttcattcagg tgcctcagaa gataacttgc acctctgtag 1260
gatcacagtg gaagggtcat gctgggaagg agaagctgga gtcaccagaa aacccaatgg 1320
atgttgtgat gagccttact atttgtgtgg tcaatgggcc ctactacttt ctctcaatcc 1380
tcacaactcc tggctcttaa taacccccaa aactttctct tctgcaggtc aagagaaagg 1440
atttctga 1448
<210> 31
<211> 1489
<212> ДНК
<213> Homo sapiens
<400> 31
aggacctgaa aaacgtgttc ccacccgagg tcgctgtgtt tgagccatca gaagcagaga 60
tctcccacac ccaaaaggcc acactggtat gcctggccac aggcttctac cccgaccacg 120
tggagctgag ctggtgggtg aatgggaagg aggtgcacag tggggtcagc acagacccgc 180
agcccctcaa ggagcagccc gccctcaatg actccagata ctgcctgagc agccgcctga 240
gggtctcggc caccttctgg cagaaccccc gcaaccactt ccgctgtcaa gtccagttct 300
acgggctctc ggagaatgac gagtggaccc aggatagggc caaacccgtc acccagatcg 360
tcagcgccga ggcctggggt agagcaggtg agtggggcct ggggagatgc ctggaggaga 420
ttaggtgaga ccagctacca gggaaaatgg aaagatccag gtagcggaca agactagatc 480
cagaagaaag ccagagtgga caaggtggga tgatcaaggt tcacagggtc agcaaagcac 540
ggtgtgcact tcccccacca agaagcatag aggctgaatg gagcacctca agctcattct 600
tccttcagat cctgacacct tagagctaag ctttcaagtc tccctgagga ccagccatac 660
agctcagcat ctgagtggtg tgcatcccat tctcttctgg ggtcctggtt tcctaagatc 720
atagtgacca cttcgctggc actggagcag catgagggag acagaaccag ggctatcaaa 780
ggaggctgac tttgtactat ctgatatgca tgtgtttgtg gcctgtgagt ctgtgatgta 840
aggctcaatg tccttacaaa gcagcattct ctcatccatt tttcttcccc tgttttcttt 900
cagactgtgg cttcacctcc ggtaagtgag tctctccttt ttctctctat ctttcgccgt 960
ctctgctctc gaaccagggc atggagaatc cacggacaca ggggcgtgag ggaggccaga 1020
gccacctgtg cacaggtgcc tacatgctct gttcttgtca acagagtctt accagcaagg 1080
ggtcctgtct gccaccatcc tctatgagat cttgctaggg aaggccacct tgtatgccgt 1140
gctggtcagt gccctcgtgc tgatggccat ggtaaggagg agggtgggat agggcagatg 1200
atgggggcag gggatggaac atcacacatg ggcataaagg aatctcagag ccagagcaca 1260
gcctaatata tcctatcacc tcaatgaaac cataatgaag ccagactggg gagaaaatgc 1320
agggaatatc acagaatgca tcatgggagg atggagacaa ccagcgagcc ctactcaaat 1380
taggcctcag agcccgcctc ccctgcccta ctcctgctgt gccatagccc ctgaaaccct 1440
gaaaatgttc tctcttccac aggtcaagag aaaggattcc agaggctag 1489
<210> 32
<211> 5591
<212> ДНК
<213> Homo sapiens
<400> 32
ataaacaact tgatgcagat gtttccccca agcccactat ttttcttcct tcaattgctg 60
aaacaaagct ccagaaggct ggaacatacc tttgtcttct tgagaaattt ttccctgatg 120
ttattaagat acattggcaa gaaaagaaga gcaacacgat tctgggatcc caggagggga 180
acaccatgaa gactaacgac acatacatga aatttagctg gttaacggtg ccagaaaagt 240
cactggacaa agaacacaga tgtatcgtca gacatgagaa taataaaaac ggagttgatc 300
aagaaattat ctttcctcca ataaagacag gtatgtgttt acgcatatca tctgtcagaa 360
cacttctttg aaagtgaatg ctgcattttt tcctttcagt attaatgaaa aacaaacata 420
aatctttctt aaatattgtt acatttaatg gtagcataaa tgccctgcta cttttctata 480
gaattaaaat ggtataggtt ttggagaaaa caaaattgaa aaagttactg aaggtttgtc 540
agcctcagct ccattatcca aaataagaaa gtcacgtgct ggtttttagg gttgttagat 600
ggattaaaga aacaacatac acagaagcat ctagcaacgt gacacgtggt aaacgctcaa 660
aaagtgttct cccttctttt gatgacttta cttgatcagg aaataacata tatatgtctt 720
tcaggaatgt tctgcccaag caggagagtc actcacctca atcttgctac ccacaaagtt 780
taacctaaaa acaacgggtt cattgttgac aaaatgatgt ttatctgttg ttgacagaat 840
gatgtttatc taaaaacagt tccaattttc tatttccttt gctgagacac aaaggggagg 900
caaatgtgca aagcttgagg gtagtcttac cactgtgctt aagtgttctg atttttctag 960
tgatcagggc aaaataaaaa gtatagtaag ttccaaggca gtgaatatta tacaggagag 1020
aagttacagt tttataatgt gttttccttt acactaaatt ctaaaagtaa aaagtctttt 1080
tttttttttg acagagtttc actcttgttg cccaagcagg tgtgctatgg tatgatctca 1140
gctcactgca acctccacct cccgggttca agtgattctc ttacttcagc ctcccgacag 1200
gctgggattg caggcgcctg ccaccacacc tggctaattt ttgtgttttt agtagagatg 1260
gggtttcacc atgttggcca ggctggtctc aaattcctga cctcaagtga tccatccacc 1320
tcggcctcca agtgctggga ttatgggcgt cagccactgt gcccagccta aaagtaaaat 1380
gtctttcatg agcttcccaa ggcagctacg ttaaggagga cacttctctt aatgtcattc 1440
tacagtagat ttctaatgct ctttcttgga agtttgtttt tctgagaaaa gctaaaaata 1500
taacatggaa gtgatcatat tatataatca atgaagtgct tttcaaggag ataaaactaa 1560
tctggtccac acttgcaacc aaccttgatt gagagagaga gagaactcag gatacacttg 1620
aagattttat tatggggaac agttacttta ttctttttac ctcaatcaat gcatggaaat 1680
aagtgatagt cattttcatt tatcttttaa taaatgaagt caccatgagg aaaataaaaa 1740
gacattgaaa acccattaaa gtcagccctt aaagatattt ggacatgcag acttgataac 1800
taacgtttgc attcttgaga cttacccaaa acccatacct caagtccaag tttttagaat 1860
tcatgaaata aagatctcag tgagtgcata aaattgcgca ccagaatcat atccgtatag 1920
acaagaacac atctactaga aaaataataa accaacacac caatgcaact gtgttttctt 1980
ctgttttaaa gtatgttgtc tttgtatgca tgtttgcttc ttcctttttt tttttaacat 2040
cacagataaa ttcaactctc acctcaggtt ttattgagag aactgtcaat gtgacttggc 2100
ctctgtcttt ctagtcccag aaagaattgc actgaaatct gagctcctgt aataaaaaca 2160
accatttgct gagagtaatt aacatactga aagagatttt cttagagtac acaatggtga 2220
cattatattg cctctttata aataactttc tatctatttc tgtggattat tcctacaaag 2280
tacttttcat atgtccaatt tcttttcttc ccctacaact actgtctgaa tactggctct 2340
gctatttgct gatatgattc tcggcaagtt gcctgcactt tttaaacttt atttcctcat 2400
tcagaacatg gggccataca taatacaact cacttcagtg ttattgggga attaaacaaa 2460
aaatgcatgg gaagcattta acatagtgcc tgacacaata atgagtactc agtagatgtt 2520
agcttttatt aatattgttg ttgttatgtc cagaaacact atacctccag aaaatcatgg 2580
gtacttgctg gggacattgg ggatatgcat gatttggaaa agaatgactg ctttttttgc 2640
ttagatgaga aatttttcta agccagactc cttcaaatat gtaagattct gttgtggatt 2700
caaggactga aagaattctt ggccgagtgt ggtggcttat ccctgtaatc ccagcatttt 2760
gtgaggacaa ggcaggaaga ttgcttgagt ccaggagttt gaaaccagcc tgcgcaacat 2820
ggcgaaaccc tgtctctaca aaaaatacaa acattagctc ggagtgagtg ctgacatgtg 2880
cctgtactcc cagctactca gaaggctgag atgggaggat ctcatgagcc tggggagttt 2940
gaggcttcag tgagccgtga tgacaccgta ctatactcca ctccagcctg ggtgacagtg 3000
agaccctgcc tcaaaaaaca aacaaacaaa caaacaaaac aaaattaatc tttttgctga 3060
tgtcatgtca gcagtgtgtg ttgaaggctg taaagcagcc atttgttcag tttatttttc 3120
cattgaacaa gtatttatca aaaacatact ttgtggcagt cactatgcta ggagctatga 3180
atacagaagg aaaagtaaat gctcttggat actacactcc agttgtgata aaaaagaaaa 3240
aatgtattct tcaccaactt caacatcttg atgtgcaaaa acataataca tgaattagat 3300
ctacctaatt acacagaatt agaccaattg tttctggaat tgtgggctca tatttttaat 3360
aactgtcctc ctgcctctct gtcgacaggt tttataaata ttcatttaat tacacacaca 3420
cacacgaaca attgactagt acttgctctc attcttctag atgtcatcac aatggatccc 3480
aaagacaatt gttcaaaaga tgcaaatggt aagcttttgt gtttttccct tcctcctgat 3540
cattttgttt tgaacttctc tggcttgaaa aatcagggaa tggattttgc taggttggat 3600
gctgcagaat ggacctagtg atattttaaa ttagtccctc attttctagg agttgtatta 3660
acaaacctaa ctactgcttt ggggtatgag atgactgtaa attagagagg gtacagtggt 3720
atagtgatat gcttttaatt atttcaaaaa aaagatttta ttcattcatg tgtctttttt 3780
ctttttcttt tctttttttt ttttttttgg acagagtctt gctctgtcac ccaggctgga 3840
gtgcggtggc agtatctcag ctcaccacaa cctccgcctc ccggcttcaa gtgattctcc 3900
tgcctcagct tctcgagtag ctgggactac aggcgcgtgc caccatgccc ggctaatttt 3960
tgtattttta gtagagttgg ggtttcacca tgttggccag gatggcctcg aatttgtgac 4020
ctcgtgatct gccccctcgc cctcccgaac tgttgggatt acaggcgtga gtcactgtgc 4080
ccggcctcct gtcctgtctt ttgtttaatg actgggaaaa acatgatacc atgttgcttc 4140
tcgagttgtt ttgttttagt ctttggtctt tgctagtagc taataacacg aactagtgtt 4200
tatcaagtgc tttttacaca gaagggcttg ggctgtgttc tgcattttct tgtttaaccc 4260
tcttaaaact cctataaaat ggtacatatt tttctcccaa tttacagtcc ctttaaagca 4320
aataattata aaaatcccta tacatgtcac acagctagat ctgggatttc aaatcaggcc 4380
atcaaacaaa gagtttatgt acttagtaag ttttctgttc tttttctaca atagagtcag 4440
atagcaagaa attaccaagc caggaacctg aaacaaaacg gacatcatgt ggggctgggt 4500
gggtgcatgg gctttgcaga ctggactttc actccagctc ttttaatgat taggtgtaag 4560
tgacctacat tttgtgagca acagttttct catcagccaa caaagaataa ttacaccaga 4620
ttcacagtta ttgaagagat aaaggcatga atgtgagatg tctggcatag ggcatctcat 4680
ttagcagaca cagaatgagt acttgtttct ggctttttct ctctacatat gcacaaagaa 4740
tgcgactaga agcatgggct ctagccctgc tcaactttcc tctatttcca ataccaaggg 4800
gctctgactt aggctgccac accaggcaag gagggcagta ccacctcact tgaccaaggg 4860
cagggagtca cggacacatc acttcttgag atccttttcc acaccaagga ctgatgtttc 4920
tggaattctc actttatgaa gacaaaacat ataaatggaa attttctcag gtagagactc 4980
actcttgtag ctcattgagt aggcactagt ggtccacccc cactgtcttt acttattcct 5040
tgacatcaca tatctcttgc aaaacctcaa ataatattaa atgcaatcac ccaataatag 5100
catagccata attagaggca tttaggaaag acaggtgagt gtgccacaac tacctaacac 5160
atcagcaaat ctggattaac cactttcttt gattttccac aatgcaacct tactttttaa 5220
tagttgggaa tgttctaagt gaatttagca gaggttgtta atcaacttga aagctgaatt 5280
ctgacttgtc tgactcttgg tggtgctggt agcagtagat gtttactttt aggttttggt 5340
ggtggtggaa tatcacttca acgtaaatca tcagaaataa gtatttgtga acccctctcg 5400
cattaatgta tcttattctg taaaaagaac atgtgcaatt tctcttagat acactactgc 5460
tgcagctcac aaacacctct gcatattaca tgtacctcct cctgctcctc aagagtgtgg 5520
tctattttgc catcatcacc tgctgtctgc ttagaagaac ggctttctgc tgcaatggag 5580
agaaatcata a 5591
<210> 33
<211> 9549
<212> ДНК
<213> Homo sapiens
<400> 33
ataaacaact tgatgcagat gtttccccca agcccactat ttttcttcct tcgattgctg 60
aaacaaaact ccagaaggct ggaacatacc tttgtcttct tgagaaattt ttcccagata 120
ttattaagat acattggcaa gaaaagaaga gcaacacgat tctgggatcc caggagggga 180
acaccatgaa gactaacgac acatacatga aatttagctg gttaacggtg ccagaagagt 240
cactggacaa agaacacaga tgtatcgtca gacatgagaa taataaaaac ggaattgatc 300
aagaaattat ctttcctcca ataaagacag gtatgtgttt acacatatca tctgtcagaa 360
cacttctttg aaagtgaatg ctgcattttt tcctttcagt attaatgaaa aacataaatc 420
tttcttaaaa attgttacat ttaatggtag cgtaaatgcc ctgctacttt tctatagaat 480
taaaatggta taggttttgg agaaaacaaa attgaaaaag ttgctgaagg tttgtcagcc 540
tcagctccat tatccaaaat aagaaagtca cgtgctggtt tttagggttg ttagatggat 600
taaagaaaca acatacacag aagcatctag caacgtgaca cgtggtaaac gctcaaaaag 660
tgttctccct tcttttgatg actttacttg atcaggaaat aacatatata tgtctttcag 720
gaatgttctg cccaagcagg agagtcactc acctcaatct tgctacccac aaagtttaac 780
ctaaaaacaa cgggttcatt gttgacaaaa taatgtttat ctgaagataa ctgtagatca 840
tatttatctg tagataatgt ttatctgtgg agtgtggctc tacaaaacat agaatagtct 900
tggtcactgc agttttatag aggccttggg tttttcagag tttcatttta tatatcacca 960
taaagtaaca tttcataatt acaggttggt aaggcttaca tgtacaaaca ttcttccatt 1020
ttccataata aatgcatttc ctgccattgg tgaatgcagc tcaataaaca tttattgtac 1080
aattatgaca cgccaggctt agtggaaatg tggatgaaca gacaaggatg agttactgtc 1140
ctaaggatga tgcatgacag tgcagagaat atactctctt cctgatcact cagggtcact 1200
catgattcat gcgcgaggtc ccaaaacagt gcctttgatg cagattctgt acatctctag 1260
acgattggtc caagggctga atgtgctctg gcccagtggt ccagtctgtc actatatgtc 1320
aacatcctga atatgaacat aacagtccaa catctcaaga gtgggcatga aaaggactca 1380
ttttgtgctt tttcctgtgg ttaacaagtc ctttttagcc tgggggaaca agcattaaca 1440
aaatgtttga agatctttgc cacgtaccat tccaaatttc tagggtaagt ctttagcttt 1500
tcagatcctg agtttctgca atgatcaaat gtgatttgga cagttgcgtt gactttctcc 1560
tggggctata atggagtgca aaggaaacaa tggcagggaa aatgcttgct ttcaaaatgg 1620
tagcatggat gtgttcattc gtgtagttac tgtattaggt atagcctttc ctgaaactaa 1680
ctgaagtggg gttataaaaa cagtcccaat tttctatttc ctttgctgag acacaaagag 1740
gagacaaaag agcaaagctt gagggtagtt ttaccactgt gcttaagtgt tctgattttt 1800
ccagtgatca gggtgaaata aaaagcatag taagttccag ggcagtgaat accatacagg 1860
agacaagtta cagttttata atgtgtttta ctttacacta aattctaaaa gtaaaatgtc 1920
tttttttttt tccgagacag agtttcactc ttgtagccca ggcaggagtg ctatggtgtg 1980
atctcggctc acagcaacct ccacctccca gtttcaagcg attcttctgc ctcagcctcc 2040
cgagaagttg aaattacagg tgcctggcac catatctcgc taattattct atttttagta 2100
gagatcgggt tttaccatgt tggccaggct ggtctcgaac tcctgacttc aagtgatcca 2160
cccgcctcag cctcccaaag tgctgggatt acaggtgtga gtcactgtgc cggacctaac 2220
agtaaaatgt ctttcatgtg cttctcaagg caactacatt aaggaggaca catctcttaa 2280
tgtcattcta cagtagattt ctaatgctct ttcttggaag tttgtttttc tgagaagagc 2340
taaaaatata ataacatgga agtgatcata ttatataatc aatgaagtgc tttcaaagga 2400
gataaaacta acctggtctg catttgcaac cagccttgat tgagagagag agaactcagg 2460
atacacttag agattttatt atggggaata gttactttat tcattttacc tcaatcaatg 2520
catggaaata agtgacagtc attttcattt atcttttaat aaataaagtc accatgagga 2580
aaatgaaaac ccattaaagt cagtccttaa agatatttgg acatgcagac atgataacta 2640
acatttccat tcgtgagact tacccaaaac ctatacctca agtccatttc ttagaataca 2700
tgaaataaag atctcagtga gtgtataaaa ctgcacacca gaatcatatc cgtatagaca 2760
agaatacatc tactagaaaa atataaacca aaacaccaag gtgactctgt ttttttctgt 2820
tttaaaatat gttgtctttg tatgcatgtt tgcttcttcc tttttttttt taaacatcgc 2880
agataaattc aactctcacc tcagttgaga gagaactgtc aatgtgactt ggcctctctc 2940
tttctagtcc cagaaagaat tgcactgaaa tgctgagctc ctgtaataaa aatgaccatt 3000
tgctgagagt aattaacata ctgaaagaga ttttcttaga atagtgcaca atggcccaat 3060
ggtgacatta tattgtctct ttataaatta ttttctatct atttctgtgg attatttcta 3120
caaagcactt ttcatatgtc caattccttt tattccccta caagtactga ctgactactg 3180
gctctgctgt tcactgatat gactttcggc aagttgcctg cactttttaa acgttatttc 3240
ctcattcaga acatggggcc atacaaaata caactcactt cagtgttatt ggggaattaa 3300
acaaataaat gcatgggaag catttaacat agtgcctgac acaataatga gcactcagta 3360
gatgttagct tttattaata ttgttgttgc tatgtccaga aacactatac ctccagaaaa 3420
tcatgggtac ttgctgggga cgttggggat atgcatgatt ttgaaaggag tgactgctct 3480
ttactgctca gatgagaaat ttttctaagc cagactcctt caaacatgta agattctgtt 3540
gtggattcta ggactgaaag aattcttggc cgagtgtggt ggcttatcct ggtaatctca 3600
tcatttggga ggacaaggca ggaagattgc ttgagcccag gagttggaaa caagcctgga 3660
caacatggcg aaaccctgtc tctacaaaaa atacaaacat tagctggtca tgggagtgag 3720
tgcctgtact cccagctact caggaggcta agataggagg atcacctgag cctgggcagt 3780
ttgaggtttc agtgagccgt gatgacacca tactatactc cactccagcc tgggtgacag 3840
tgacatcctg cctcaaaaaa acccccaaaa ttattctttt tgctgatttc atgtcagcag 3900
tgtgtgctga aggctgtaaa gtagccactt gttctgttta tttttccatt gaacaagtat 3960
ttatcaaaaa cgtactttgt ggaaggcact gtgctaggaa ctatgcatac agaaggaaaa 4020
ccaaatgttc ttggatacta cactccagtt gtgataaaaa agaaaaaagt attcttcaca 4080
aacttcaaca ttttgatgtg caaaaacata atatatgaat tagatctacc taactacaca 4140
gaattagacc aattatttct gggattatgg gctcatattt ttaataactg tcctcctacc 4200
tctctgttga caggttttat aaatattcat ttaattacac acagtcacag acacactcag 4260
acacacacac atacacacac acacacacct tgacaaataa tgggcatgaa caattgactg 4320
gtacttgctc tcattcttct agatgtcacc acagtggatc ccaaatacaa ttattcaaag 4380
gatgcaaatg gtaagttttt gtgtttttta tttcctcctg atcattttaa gttttgaact 4440
tctctggctt gaaaaatcag ggaatggatt ttgctaggtt ggatgctgca gaatggacct 4500
aatcatattt taaattagtc cctctttttc taggagttgt attaacaaac ctaactactg 4560
cttcatgtaa gagatgactg taaattgaag ggtacagtga tatgctttca gttatttcaa 4620
aaaacagact ttactcatcc atgtgtcttt tttcttttct tttttttctt ttttgagacg 4680
gagtctcgct ctgttgaaca ggctggattg cagtgacgcg atctcacctc actacaacct 4740
ccgcctctgg agttcaagcg attctccagc ctcagcttct caagtagctg ggactacagg 4800
cacatgccac catgtccggg tcatctttgt atttttagca gagaccgggt ttcactatgt 4860
tggccaggct ggtctagaat tcctgacttc gtgatctgcc ccctcagccc tccgaagtgc 4920
tgggattaca gacgtgagtc actgtgcccg gcctaacagt aaaatgtctt tcatgcgctt 4980
ctcaaggcaa ctacgttaag gaggacactt ctcttaatgt cattctacag tagatttcta 5040
atgctctttc ttggaagttt gtttttctga gaaaagctaa aaatataaca tggaagtgat 5100
catattgtat aatcaatgaa gtgcttttca aggagataaa actaatctgg tccacgtttg 5160
caaccaacct tgattgagag agagagagaa ctcaggatac acttggagat tttattatgg 5220
ggaatagtta ctttattctt ttttcctcaa tcaattcatg gaaataagtg atagtcatat 5280
tcatttatct tttaataaat gaagtcacca tgaggaaaat aaaaagacat tgaaaaccca 5340
ttaaagttag cccttaaaga tatttggaca tgcagacttg ataactaacg tttgcattct 5400
tgagacttac ccaaaaccca tacctcaagt ccatgttttt agaattcatg aaataaagat 5460
ctcagtgagt gcataaaatt gcgcaccaga atcatatccg tatagacaag aacacatcta 5520
ctagaaaaat aataaaccaa cacaccaatg caactgtgtt ttcttctgtt ttaaaatatg 5580
ttgtctttgt atgcatgttt gcttcttcct tttttttttt taacatcaca gataaattca 5640
actctcacct caggttttat tgagagaact gtcaatgtga cttggcctct gtctttctag 5700
tcccagaaag aatcgcactg aaatgctgag ctcctgtaat aaaaatgacc atttgctgag 5760
agtaattaac atactgaaag agattttctt agagtacaca atggtgacat tatattgtct 5820
ctttataaat aactttctat ctatttctgt ggattattcc tacaaagtac ttttcatatg 5880
tccagtttct tttcttcccc tacaactacc gtctgaatac tggctctgct atttgctgat 5940
atgattctcg gcaagttgcc tgcacttttt aaactttatt tcctcattca gaacatgggg 6000
ccatgtaata ctcatgtacg tgagtattac gtaataatgc tcacttaagt gttactgggg 6060
aattaaacaa aaaaatgcat ggcaagcatt taacatagtg cctgacacaa taatgagcac 6120
tcagtagatg ttagatttta ttaatattgt tgttgttatg tccggaaaca ctatacctcc 6180
agaaaatcat gggtacttgc ttgggatgtt ggggatatgc atgatttgga aaggtatgac 6240
tgcttttttc tgcttagatg agaaattttt ctaagccaga ctccttcaaa tatgtaagat 6300
tctgttgtgg attctaggac ggaaagaatt cttggtcagg tgtggtttct tatccctgta 6360
atcccagaat tttgggagga caaggcagga agattgcttg agcccaggag tttgaaacca 6420
gcctgggcaa caagacgaaa ccctgtctct acaaaagtac ataaattagc ttggcttggt 6480
ggtgtgtgcc tgtattacca gctattcggg agactgagat gggaggatct cctgaacctg 6540
tgaagtttga ggcttcagtg agccgtgatg acaccatact atactcgact ccagcctgtg 6600
cgacagtgag actctgcgtc aaaaaaaaaa ccccaaaatt attgtttttg ctgatttcag 6660
gtcagcagtg tgtgctgaag ggtgtaaagt agccacttga tcagtttatt tttccactga 6720
acaagtattt atcaaaaaca tactttgtgg tctgtttttg ataaataaaa aggcactgtg 6780
ctaggagcca tgaatacaga aggaaaacca aatgttcttg gatactacac tccagttgtg 6840
ataaaaaaga aaaatgtatt cttcacgaac ttcaacattt tgatatgcaa aaacatagta 6900
tataaattag atctacctga ttacgtagaa tcagaccaat tatttctgga attgagggct 6960
catattttta ataactgtcc tcctgcctct ctgttgacag gttttataaa tattcattta 7020
attacacaca cacacacaca caccttgaca aataatggac atgaacaatt gactagtact 7080
tgctctcatt cttctagatg tcatcacaat ggatcccaaa gacaattggt caaaagatgc 7140
aaatggtaag cttttgtgtt tttcctttcc tcctgatcat tttaagtttt gaacttctct 7200
ggcttgaaaa atcagggaat gggccgggtg cggtggctca cgcctgtaat cccagcactt 7260
tgggaggccg aggcgggcgg atcacgaggt caggagatcg agaccatccc ggctaaaacg 7320
gtgaaacccc gtctctacta aaaatacaaa aaattagccg ggcttagtgg cgggcgcctg 7380
tagtcccagc tacttgggag gctgaggcag gagaatggcg tgaacccggg aggcggagct 7440
tgcagtgagc cgagattgcg ccactgcact ccactccagc ctgggcgaca gagcgagact 7500
ccgtctcaaa aaaaaaaaaa aaaaaaaaaa aagaaaaatc agggaatgga ttttgctagg 7560
ttggatgctg cagaatggac ctagtgatat tttaaattag tccctctttt tctaggagtt 7620
gtattaacaa acctaactac tgcttcgggt atgagatgac tgtaaattag agggtacagt 7680
gatatgcttt cagttatttc aaaaaacaga ctttattcat ccgtctgtct tttttttttt 7740
tttttttttt tttttttgag acggaggagt ctcactctat cacccaggct ggagtgcagt 7800
ggcgcgatct cggctcacca taacctccgc cttactggtt caagcgattc tccagcctca 7860
gcttctcaag tagctgggac tacaggtgca caccaccata cctggctaat ttttgtattt 7920
ttaatagaga tggggtttca ccacgctggc caggatggtc ttgaattctt gacctcgtga 7980
tctgccccct cgggctccca aacttctggg attataggcg tgagccactg tgcccggcct 8040
tctgtctttt gttataatga ctggggaaaa catgatacca tgttgcttct tgagttgttt 8100
tgttttagtc tttggtcttt gctagtagct aataacacga actagtgttt atcaagtgct 8160
ttttacacag aagggcttgt tctgcatttt ctagtttaat catcttaata ctcctataaa 8220
gtagtacaat atattttctc ccattttaca gtccctttaa agtaaataac tataaaaatc 8280
ccttatacat gtcacacagc taggtctggc atttcaaatc aggacatcaa acaaagaatt 8340
cgtgcagtta ctaagtcctc tattttttct acaatagaaa aaatagcaag aattacagat 8400
agcaagacat tacaaggcag gaatctgaaa cgaaagggac ataatgtggg gctgggtggg 8460
tgcatgagct ttgcagacta gactttcatt ccagctcttt taatgattag gtgtaagtga 8520
cctacatttt gtgagtaaca gttttctcat cagccaacta agaataatta caccagattc 8580
acagttattg aagagataag ggcatgaatg tgagatgtct ggcgtagggt atctcattta 8640
gcagacacag aatgaatact tgtttctggc tttttctctc tacatatgca caaagaatgt 8700
gactagaagc attggctcta gccctgctca actttcctct atttccaata ccaaggggct 8760
ctgacttagg ctgccacacc aggcaaggag gggcagtacc acctcacttg accaagggca 8820
gggagtcacg gacacatcac ttcctgagat ccttttccac accaaggact gatgtttctg 8880
gaattctcac tttatgaaga caaaacatat aaatggaaat ttctgcagga agagactcac 8940
tcttgtagct cattgagtag gcactagtgg tccaccccca ctgtctttac ttattccttg 9000
acatcacata tctcttgtaa aacctcaaat aatgttaaat gcaatcaccc aataatagca 9060
tagccataat tagaggcatt taggaaagac aggtgagtgt gccacaacta cctaacacat 9120
cagcaaatct ggattaacca ctttctttga ttttccacaa tgcaacctta ctttttaata 9180
gttgggaatg ttctaagtga atttagcaga ggttgttaat caacttgaaa gctgaattct 9240
gacttgtctg actcttggtg gtgctggtag cagtagatgt ttacttttag gttttggtgg 9300
tggtggaata tcacttcaac gtaaatcatc agaaataagt atttgtgaac ccctctcgca 9360
ttaatatatc ttattctgta aaaagaacat gtgcaatttc tcttagatac actactgctg 9420
cagctcacaa acacctctgc atattacacg tacctcctcc tgctcctcaa gagtgtggtc 9480
tattttgcca tcatcacctg ctgtctgctt agaagaacgg ctttctgctg caatggagag 9540
aaatcataa 9549
<210> 34
<211> 182
<212> Белок
<213> Homo sapiens
<400> 34
Met Glu Gln Gly Lys Gly Leu Ala Val Leu Ile Leu Ala Ile Ile Leu
1 5 10 15
Leu Gln Gly Thr Leu Ala Gln Ser Ile Lys Gly Asn His Leu Val Lys
20 25 30
Val Tyr Asp Tyr Gln Glu Asp Gly Ser Val Leu Leu Thr Cys Asp Ala
35 40 45
Glu Ala Lys Asn Ile Thr Trp Phe Lys Asp Gly Lys Met Ile Gly Phe
50 55 60
Leu Thr Glu Asp Lys Lys Lys Trp Asn Leu Gly Ser Asn Ala Lys Asp
65 70 75 80
Pro Arg Gly Met Tyr Gln Cys Lys Gly Ser Gln Asn Lys Ser Lys Pro
85 90 95
Leu Gln Val Tyr Tyr Arg Met Cys Gln Asn Cys Ile Glu Leu Asn Ala
100 105 110
Ala Thr Ile Ser Gly Phe Leu Phe Ala Glu Ile Val Ser Ile Phe Val
115 120 125
Leu Ala Val Gly Val Tyr Phe Ile Ala Gly Gln Asp Gly Val Arg Gln
130 135 140
Ser Arg Ala Ser Asp Lys Gln Thr Leu Leu Pro Asn Asp Gln Leu Tyr
145 150 155 160
Gln Pro Leu Lys Asp Arg Glu Asp Asp Gln Tyr Ser His Leu Gln Gly
165 170 175
Asn Gln Leu Arg Arg Asn
180
<210> 35
<211> 171
<212> Белок
<213> Homo sapiens
<400> 35
Met Glu His Ser Thr Phe Leu Ser Gly Leu Val Leu Ala Thr Leu Leu
1 5 10 15
Ser Gln Val Ser Pro Phe Lys Ile Pro Ile Glu Glu Leu Glu Asp Arg
20 25 30
Val Phe Val Asn Cys Asn Thr Ser Ile Thr Trp Val Glu Gly Thr Val
35 40 45
Gly Thr Leu Leu Ser Asp Ile Thr Arg Leu Asp Leu Gly Lys Arg Ile
50 55 60
Leu Asp Pro Arg Gly Ile Tyr Arg Cys Asn Gly Thr Asp Ile Tyr Lys
65 70 75 80
Asp Lys Glu Ser Thr Val Gln Val His Tyr Arg Met Cys Gln Ser Cys
85 90 95
Val Glu Leu Asp Pro Ala Thr Val Ala Gly Ile Ile Val Thr Asp Val
100 105 110
Ile Ala Thr Leu Leu Leu Ala Leu Gly Val Phe Cys Phe Ala Gly His
115 120 125
Glu Thr Gly Arg Leu Ser Gly Ala Ala Asp Thr Gln Ala Leu Leu Arg
130 135 140
Asn Asp Gln Val Tyr Gln Pro Leu Arg Asp Arg Asp Asp Ala Gln Tyr
145 150 155 160
Ser His Leu Gly Gly Asn Trp Ala Arg Asn Lys
165 170
<210> 36
<211> 127
<212> Белок
<213> Homo sapiens
<400> 36
Met Glu His Ser Thr Phe Leu Ser Gly Leu Val Leu Ala Thr Leu Leu
1 5 10 15
Ser Gln Val Ser Pro Phe Lys Ile Pro Ile Glu Glu Leu Glu Asp Arg
20 25 30
Val Phe Val Asn Cys Asn Thr Ser Ile Thr Trp Val Glu Gly Thr Val
35 40 45
Gly Thr Leu Leu Ser Asp Ile Thr Arg Leu Asp Leu Gly Lys Arg Ile
50 55 60
Leu Asp Pro Arg Gly Ile Tyr Arg Cys Asn Gly Thr Asp Ile Tyr Lys
65 70 75 80
Asp Lys Glu Ser Thr Val Gln Val His Tyr Arg Thr Ala Asp Thr Gln
85 90 95
Ala Leu Leu Arg Asn Asp Gln Val Tyr Gln Pro Leu Arg Asp Arg Asp
100 105 110
Asp Ala Gln Tyr Ser His Leu Gly Gly Asn Trp Ala Arg Asn Lys
115 120 125
<210> 37
<211> 207
<212> Белок
<213> Homo sapiens
<400> 37
Met Gln Ser Gly Thr His Trp Arg Val Leu Gly Leu Cys Leu Leu Ser
1 5 10 15
Val Gly Val Trp Gly Gln Asp Gly Asn Glu Glu Met Gly Gly Ile Thr
20 25 30
Gln Thr Pro Tyr Lys Val Ser Ile Ser Gly Thr Thr Val Ile Leu Thr
35 40 45
Cys Pro Gln Tyr Pro Gly Ser Glu Ile Leu Trp Gln His Asn Asp Lys
50 55 60
Asn Ile Gly Gly Asp Glu Asp Asp Lys Asn Ile Gly Ser Asp Glu Asp
65 70 75 80
His Leu Ser Leu Lys Glu Phe Ser Glu Leu Glu Gln Ser Gly Tyr Tyr
85 90 95
Val Cys Tyr Pro Arg Gly Ser Lys Pro Glu Asp Ala Asn Phe Tyr Leu
100 105 110
Tyr Leu Arg Ala Arg Val Cys Glu Asn Cys Met Glu Met Asp Val Met
115 120 125
Ser Val Ala Thr Ile Val Ile Val Asp Ile Cys Ile Thr Gly Gly Leu
130 135 140
Leu Leu Leu Val Tyr Tyr Trp Ser Lys Asn Arg Lys Ala Lys Ala Lys
145 150 155 160
Pro Val Thr Arg Gly Ala Gly Ala Gly Gly Arg Gln Arg Gly Gln Asn
165 170 175
Lys Glu Arg Pro Pro Pro Val Pro Asn Pro Asp Tyr Glu Pro Ile Arg
180 185 190
Lys Gly Gln Arg Asp Leu Tyr Ser Gly Leu Asn Gln Arg Arg Ile
195 200 205
<210> 38
<211> 140
<212> Белок
<213> Homo sapiens
<400> 38
Ile Gln Asn Pro Asp Pro Ala Val Tyr Gln Leu Arg Asp Ser Lys Ser
1 5 10 15
Ser Asp Lys Ser Val Cys Leu Phe Thr Asp Phe Asp Ser Gln Thr Asn
20 25 30
Val Ser Gln Ser Lys Asp Ser Asp Val Tyr Ile Thr Asp Lys Thr Val
35 40 45
Leu Asp Met Arg Ser Met Asp Phe Lys Ser Asn Ser Ala Val Ala Trp
50 55 60
Ser Asn Lys Ser Asp Phe Ala Cys Ala Asn Ala Phe Asn Asn Ser Ile
65 70 75 80
Ile Pro Glu Asp Thr Phe Phe Pro Ser Pro Glu Ser Ser Cys Asp Val
85 90 95
Lys Leu Val Glu Lys Ser Phe Glu Thr Asp Thr Asn Leu Asn Phe Gln
100 105 110
Asn Leu Ser Val Ile Gly Phe Arg Ile Leu Leu Leu Lys Val Ala Gly
115 120 125
Phe Asn Leu Leu Met Thr Leu Arg Leu Trp Ser Ser
130 135 140
<210> 39
<211> 178
<212> Белок
<213> Homo sapiens
<400> 39
Asp Leu Lys Asn Val Phe Pro Pro Glu Val Ala Val Phe Glu Pro Ser
1 5 10 15
Glu Ala Glu Ile Ser His Thr Gln Lys Ala Thr Leu Val Cys Leu Ala
20 25 30
Thr Gly Phe Tyr Pro Asp His Val Glu Leu Ser Trp Trp Val Asn Gly
35 40 45
Lys Glu Val His Ser Gly Val Ser Thr Asp Pro Gln Pro Leu Lys Glu
50 55 60
Gln Pro Ala Leu Asn Asp Ser Arg Tyr Cys Leu Ser Ser Arg Leu Arg
65 70 75 80
Val Ser Ala Thr Phe Trp Gln Asn Pro Arg Asn His Phe Arg Cys Gln
85 90 95
Val Gln Phe Tyr Gly Leu Ser Glu Asn Asp Glu Trp Thr Gln Asp Arg
100 105 110
Ala Lys Pro Val Thr Gln Ile Val Ser Ala Glu Ala Trp Gly Arg Ala
115 120 125
Asp Cys Gly Phe Thr Ser Glu Ser Tyr Gln Gln Gly Val Leu Ser Ala
130 135 140
Thr Ile Leu Tyr Glu Ile Leu Leu Gly Lys Ala Thr Leu Tyr Ala Val
145 150 155 160
Leu Val Ser Ala Leu Val Leu Met Ala Met Val Lys Arg Lys Asp Ser
165 170 175
Arg Gly
<210> 40
<211> 176
<212> Белок
<213> Homo sapiens
<400> 40
Asp Leu Asn Lys Val Phe Pro Pro Glu Val Ala Val Phe Glu Pro Ser
1 5 10 15
Glu Ala Glu Ile Ser His Thr Gln Lys Ala Thr Leu Val Cys Leu Ala
20 25 30
Thr Gly Phe Phe Pro Asp His Val Glu Leu Ser Trp Trp Val Asn Gly
35 40 45
Lys Glu Val His Ser Gly Val Ser Thr Asp Pro Gln Pro Leu Lys Glu
50 55 60
Gln Pro Ala Leu Asn Asp Ser Arg Tyr Cys Leu Ser Ser Arg Leu Arg
65 70 75 80
Val Ser Ala Thr Phe Trp Gln Asn Pro Arg Asn His Phe Arg Cys Gln
85 90 95
Val Gln Phe Tyr Gly Leu Ser Glu Asn Asp Glu Trp Thr Gln Asp Arg
100 105 110
Ala Lys Pro Val Thr Gln Ile Val Ser Ala Glu Ala Trp Gly Arg Ala
115 120 125
Asp Cys Gly Phe Thr Ser Val Ser Tyr Gln Gln Gly Val Leu Ser Ala
130 135 140
Thr Ile Leu Tyr Glu Ile Leu Leu Gly Lys Ala Thr Leu Tyr Ala Val
145 150 155 160
Leu Val Ser Ala Leu Val Leu Met Ala Met Val Lys Arg Lys Asp Phe
165 170 175
<210> 41
<211> 153
<212> Белок
<213> Homo sapiens
<400> 41
Ser Gln Pro His Thr Lys Pro Ser Val Phe Val Met Lys Asn Gly Thr
1 5 10 15
Asn Val Ala Cys Leu Val Lys Glu Phe Tyr Pro Lys Asp Ile Arg Ile
20 25 30
Asn Leu Val Ser Ser Lys Lys Ile Thr Glu Phe Asp Pro Ala Ile Val
35 40 45
Ile Ser Pro Ser Gly Lys Tyr Asn Ala Val Lys Leu Gly Lys Tyr Glu
50 55 60
Asp Ser Asn Ser Val Thr Cys Ser Val Gln His Asp Asn Lys Thr Val
65 70 75 80
His Ser Thr Asp Phe Glu Val Lys Thr Asp Ser Thr Asp His Val Lys
85 90 95
Pro Lys Glu Thr Glu Asn Thr Lys Gln Pro Ser Lys Ser Cys His Lys
100 105 110
Pro Lys Ala Ile Val His Thr Glu Lys Val Asn Met Met Ser Leu Thr
115 120 125
Val Leu Gly Leu Arg Met Leu Phe Ala Lys Thr Val Ala Val Asn Phe
130 135 140
Leu Leu Thr Ala Lys Leu Phe Phe Leu
145 150
<210> 42
<211> 173
<212> Белок
<213> Homo sapiens
<400> 42
Asp Lys Gln Leu Asp Ala Asp Val Ser Pro Lys Pro Thr Ile Phe Leu
1 5 10 15
Pro Ser Ile Ala Glu Thr Lys Leu Gln Lys Ala Gly Thr Tyr Leu Cys
20 25 30
Leu Leu Glu Lys Phe Phe Pro Asp Val Ile Lys Ile His Trp Gln Glu
35 40 45
Lys Lys Ser Asn Thr Ile Leu Gly Ser Gln Glu Gly Asn Thr Met Lys
50 55 60
Thr Asn Asp Thr Tyr Met Lys Phe Ser Trp Leu Thr Val Pro Glu Lys
65 70 75 80
Ser Leu Asp Lys Glu His Arg Cys Ile Val Arg His Glu Asn Asn Lys
85 90 95
Asn Gly Val Asp Gln Glu Ile Ile Phe Pro Pro Ile Lys Thr Asp Val
100 105 110
Ile Thr Met Asp Pro Lys Asp Asn Cys Ser Lys Asp Ala Asn Asp Thr
115 120 125
Leu Leu Leu Gln Leu Thr Asn Thr Ser Ala Tyr Tyr Met Tyr Leu Leu
130 135 140
Leu Leu Leu Lys Ser Val Val Tyr Phe Ala Ile Ile Thr Cys Cys Leu
145 150 155 160
Leu Arg Arg Thr Ala Phe Cys Cys Asn Gly Glu Lys Ser
165 170
<210> 43
<211> 189
<212> Белок
<213> Homo sapiens
<400> 43
Asp Lys Gln Leu Asp Ala Asp Val Ser Pro Lys Pro Thr Ile Phe Leu
1 5 10 15
Pro Ser Ile Ala Glu Thr Lys Leu Gln Lys Ala Gly Thr Tyr Leu Cys
20 25 30
Leu Leu Glu Lys Phe Phe Pro Asp Ile Ile Lys Ile His Trp Gln Glu
35 40 45
Lys Lys Ser Asn Thr Ile Leu Gly Ser Gln Glu Gly Asn Thr Met Lys
50 55 60
Thr Asn Asp Thr Tyr Met Lys Phe Ser Trp Leu Thr Val Pro Glu Glu
65 70 75 80
Ser Leu Asp Lys Glu His Arg Cys Ile Val Arg His Glu Asn Asn Lys
85 90 95
Asn Gly Ile Asp Gln Glu Ile Ile Phe Pro Pro Ile Lys Thr Asp Val
100 105 110
Thr Thr Val Asp Pro Lys Tyr Asn Tyr Ser Lys Asp Ala Asn Asp Val
115 120 125
Ile Thr Met Asp Pro Lys Asp Asn Trp Ser Lys Asp Ala Asn Asp Thr
130 135 140
Leu Leu Leu Gln Leu Thr Asn Thr Ser Ala Tyr Tyr Thr Tyr Leu Leu
145 150 155 160
Leu Leu Leu Lys Ser Val Val Tyr Phe Ala Ile Ile Thr Cys Cys Leu
165 170 175
Leu Arg Arg Thr Ala Phe Cys Cys Asn Gly Glu Lys Ser
180 185
<210> 44
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 44
Glu Val Lys Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gln Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Gln Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Gly Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Lys Thr Ile Ser Ser Val Val Asp Phe Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val
115 120
<210> 45
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 45
Asp Ile Glu Leu Thr Gln Ser Pro Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Pro Leu Ile
35 40 45
Tyr Ser Ala Thr Tyr Arg Asn Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr Asn Val Gln Ser
65 70 75 80
Lys Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn Arg Tyr Pro Tyr
85 90 95
Thr Ser Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 46
<211> 16
<212> Белок
<213> Homo sapiens
<400> 46
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Ser Ser Ala Tyr Ser
1 5 10 15
<210> 47
<211> 30
<212> Белок
<213> Homo sapiens
<400> 47
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Cys Gln Gly Val Val Ser
20 25 30
<210> 48
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 48
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2841244C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ РЕКОМБИНАНТНЫЙ РЕЦЕПТОР, И РОДСТВЕННЫЕ КОМПОЗИЦИИ | 2019 |
|
RU2835579C2 |
| HPV-СПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2018 |
|
RU2804664C2 |
| АНТИГЕНСВЯЗЫВАЮЩИЕ ДОМЕНЫ ПРОТИВ TRBC1 | 2018 |
|
RU2791327C2 |
| МЕЗОТЕЛИНОВЫЕ CAR-РЕЦЕПТОРЫ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2822193C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) С АНТИГЕНСВЯЗЫВАЮЩИМИ ДОМЕНАМИ К КОНСТАНТНОЙ ОБЛАСТИ β Т-КЛЕТОЧНОГО РЕЦЕПТОРА | 2015 |
|
RU2830064C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР | 2016 |
|
RU2752880C2 |
| СВЯЗЫВАЮЩИЙ ДОМЕН | 2019 |
|
RU2829934C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, НАЦЕЛЕННЫЕ НА АНТИГЕН СОЗРЕВАНИЯ В-КЛЕТОК, И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2761632C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) С АНТИГЕНСВЯЗЫВАЮЩИМИ ДОМЕНАМИ К КОНСТАНТНОЙ ОБЛАСТИ β Т-КЛЕТОЧНОГО РЕЦЕПТОРА | 2015 |
|
RU2744046C2 |
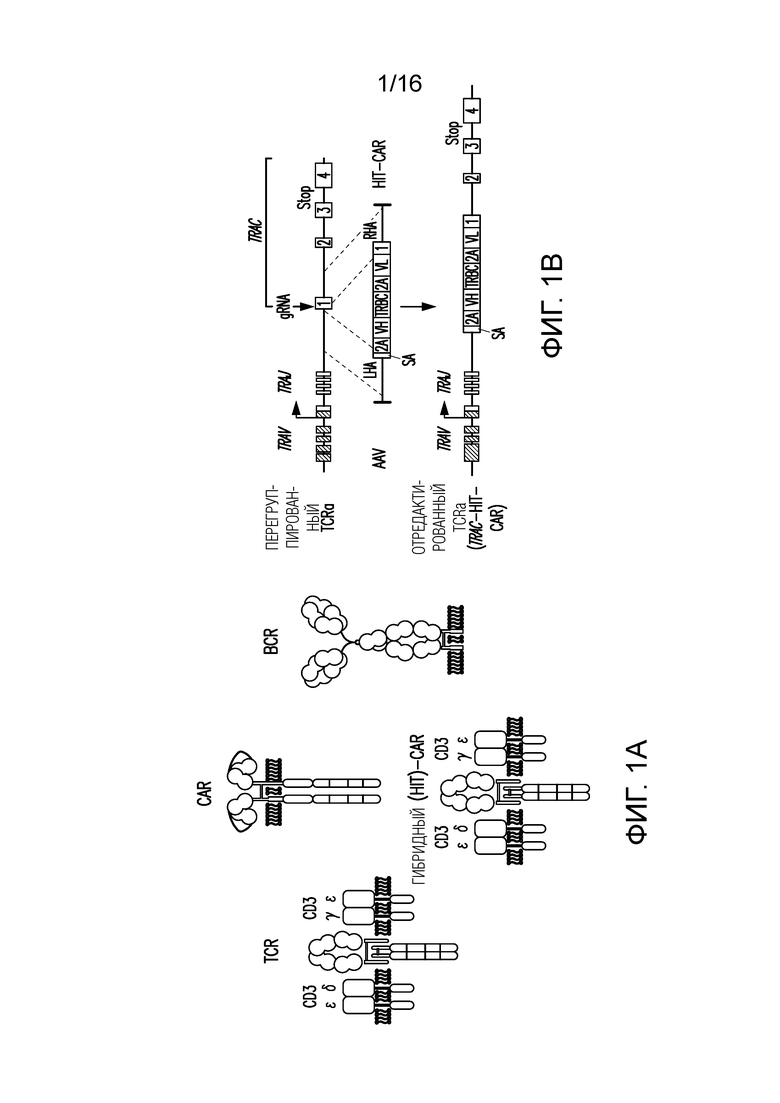
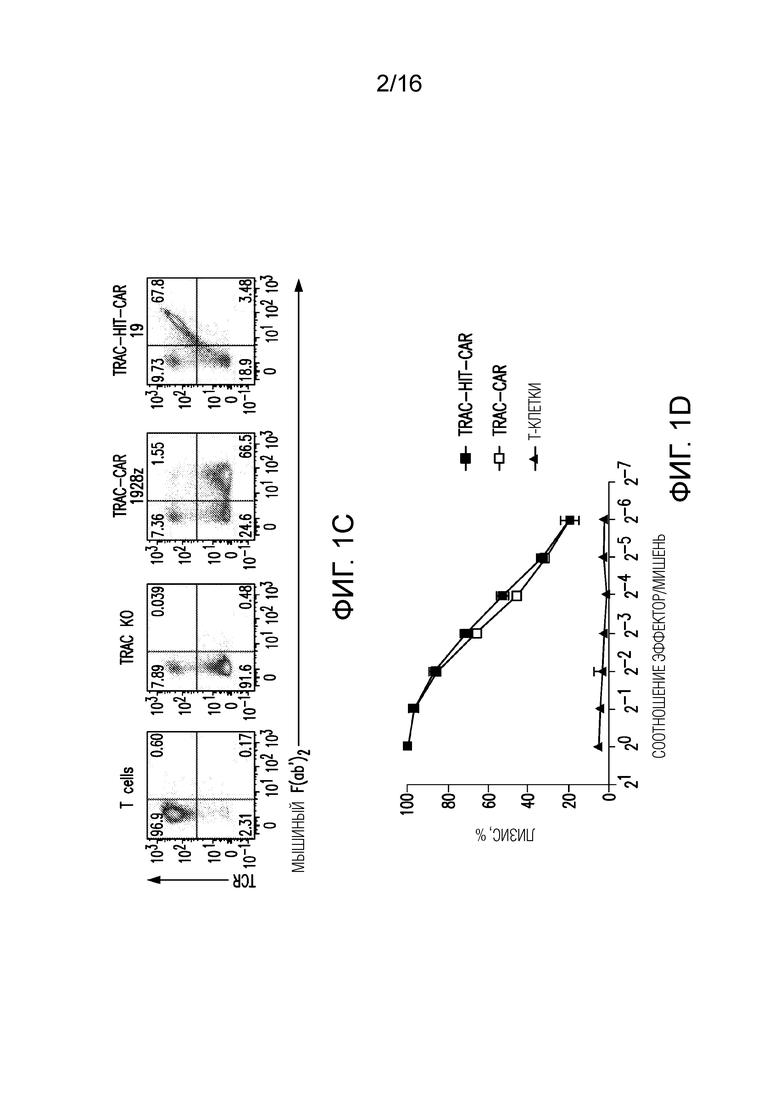
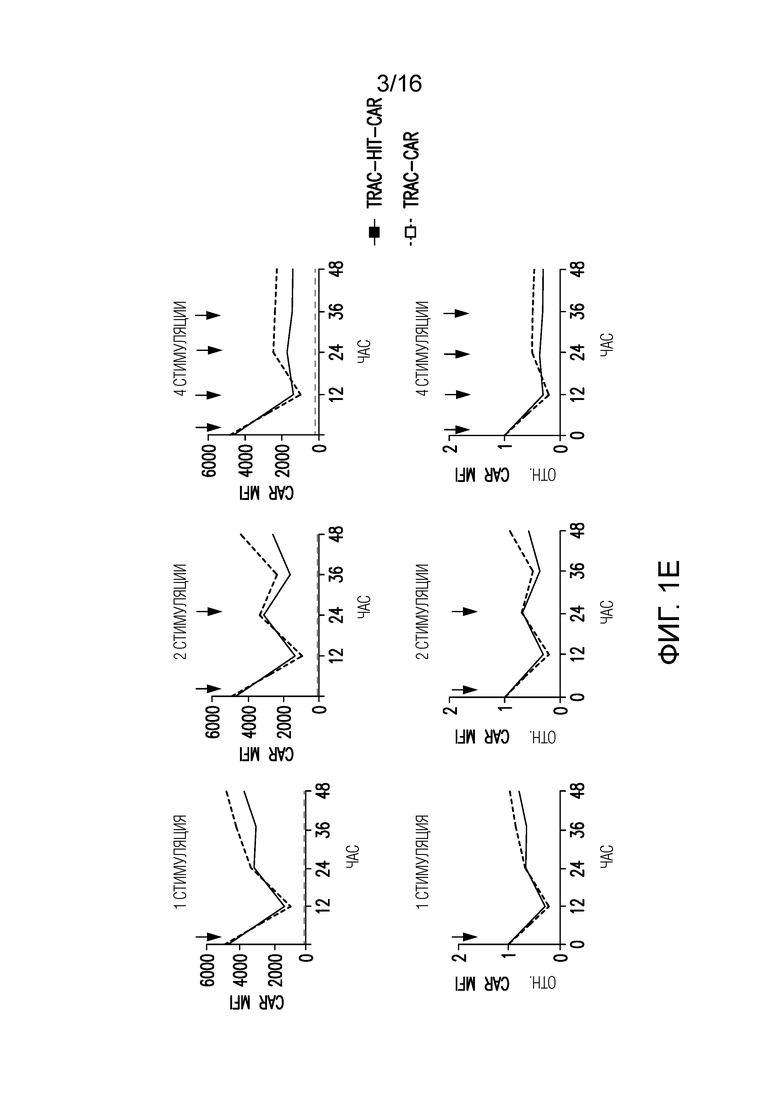
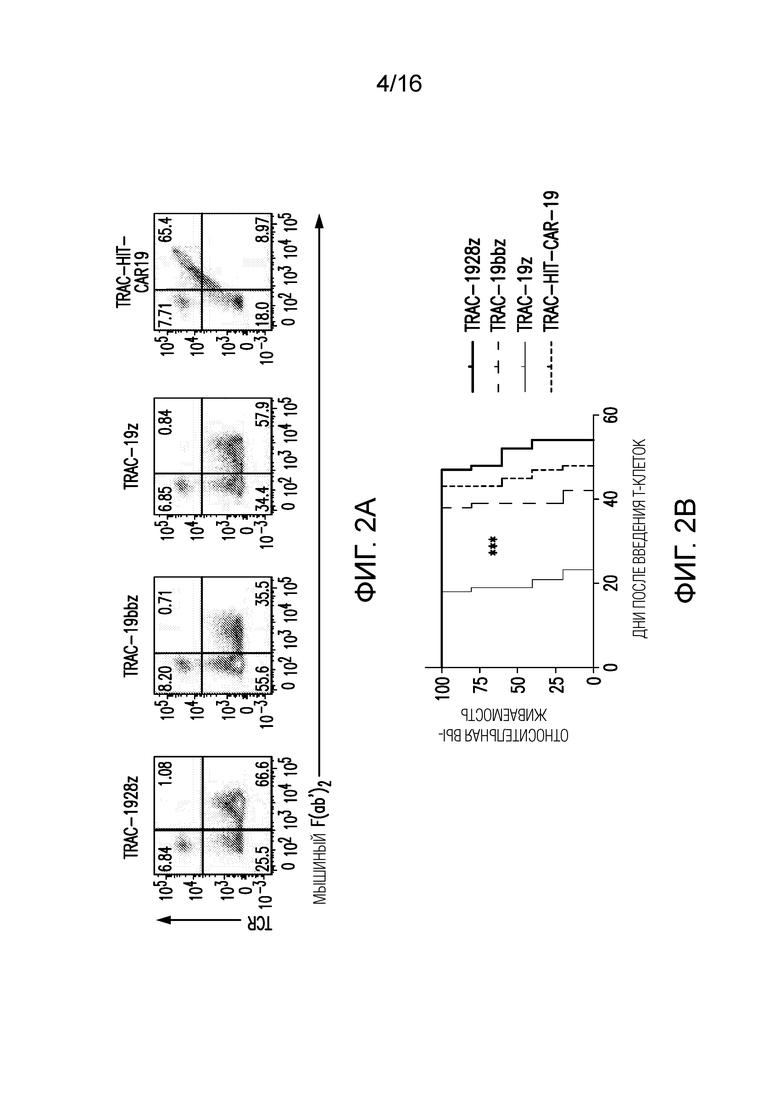
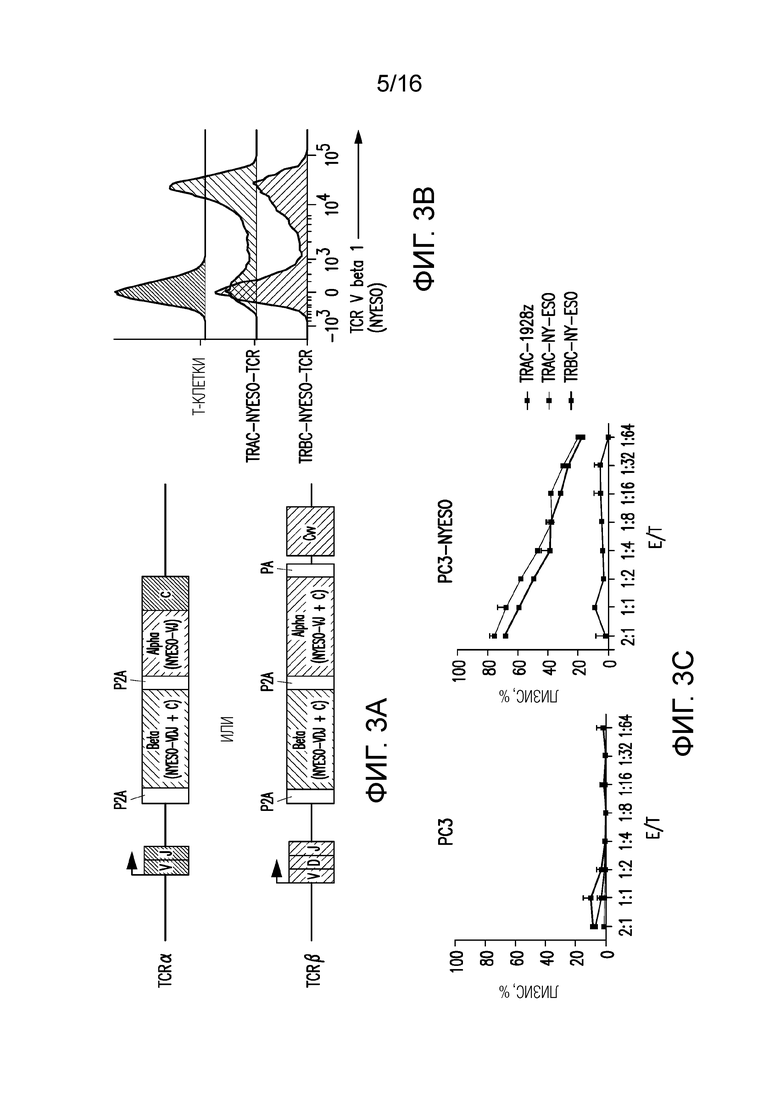
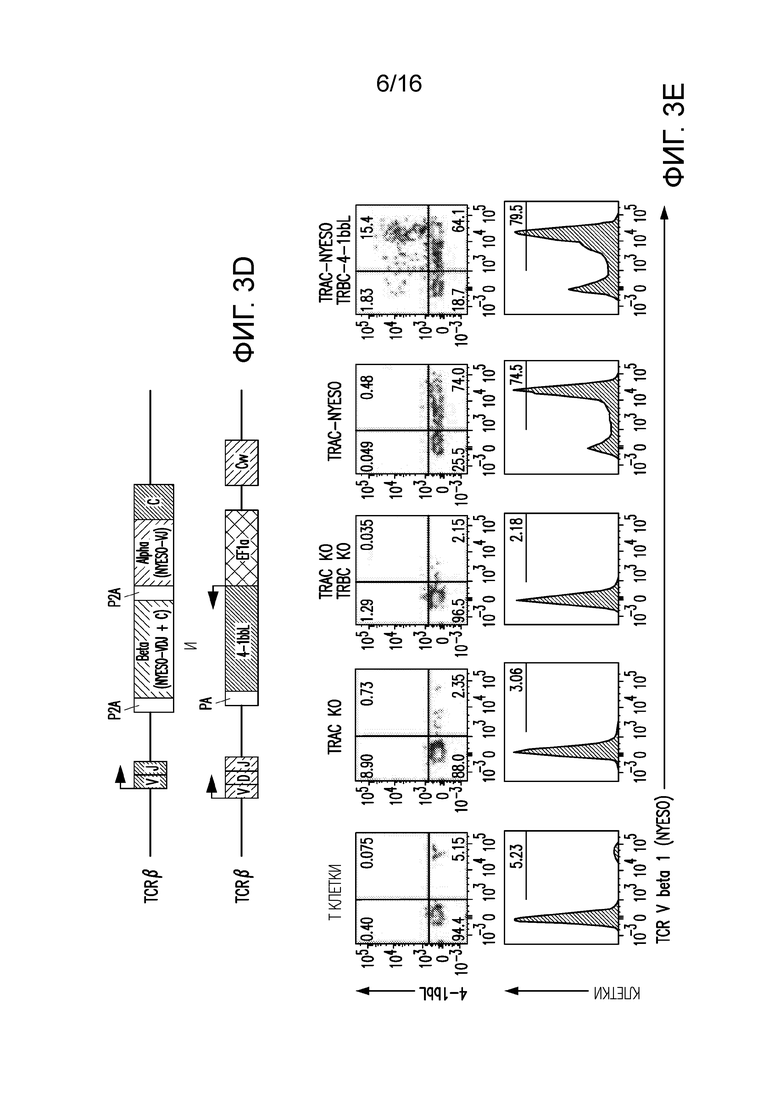
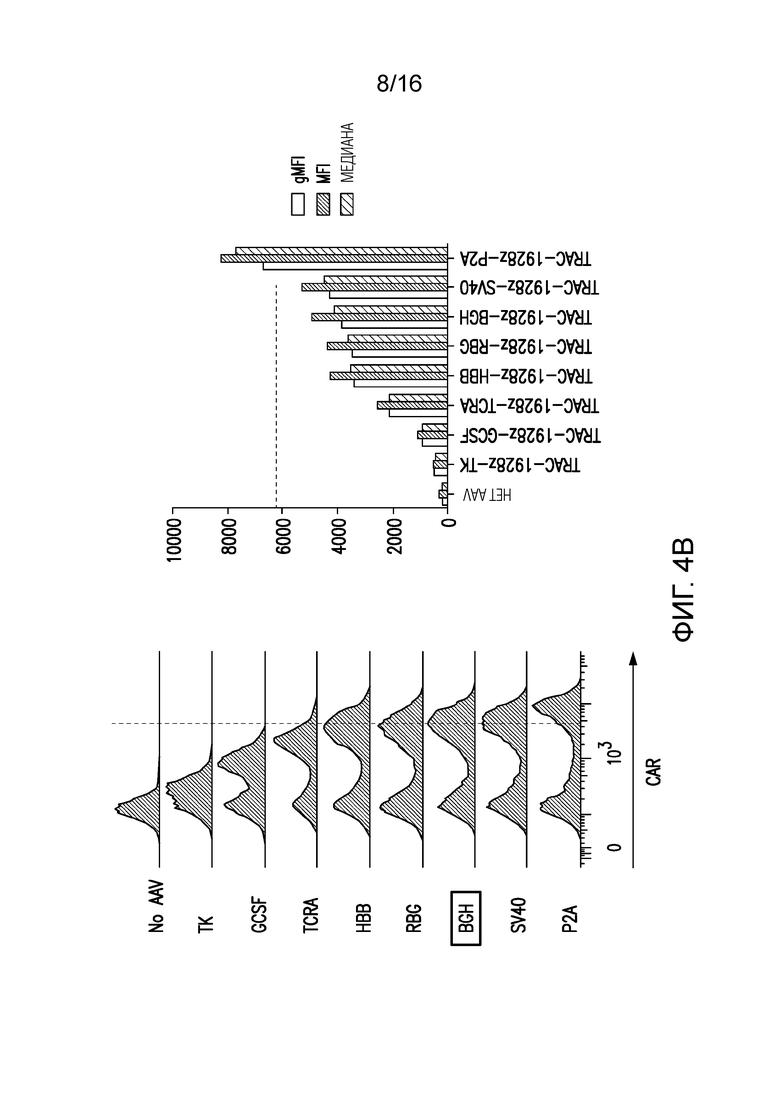
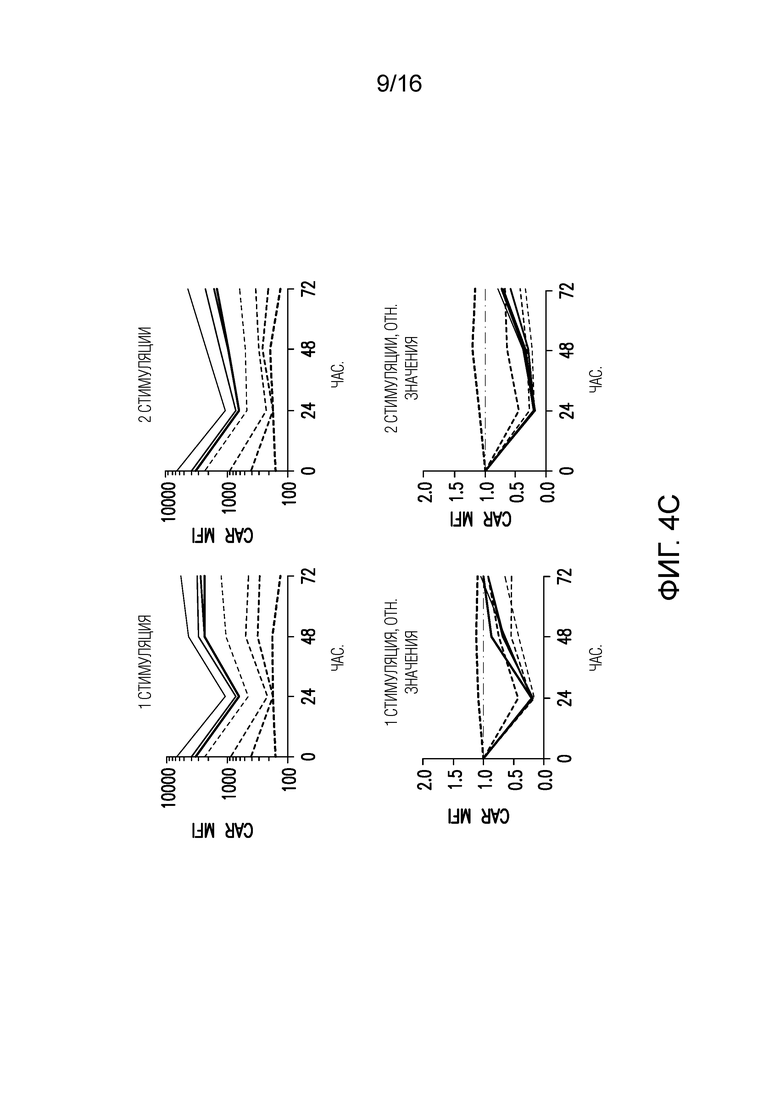
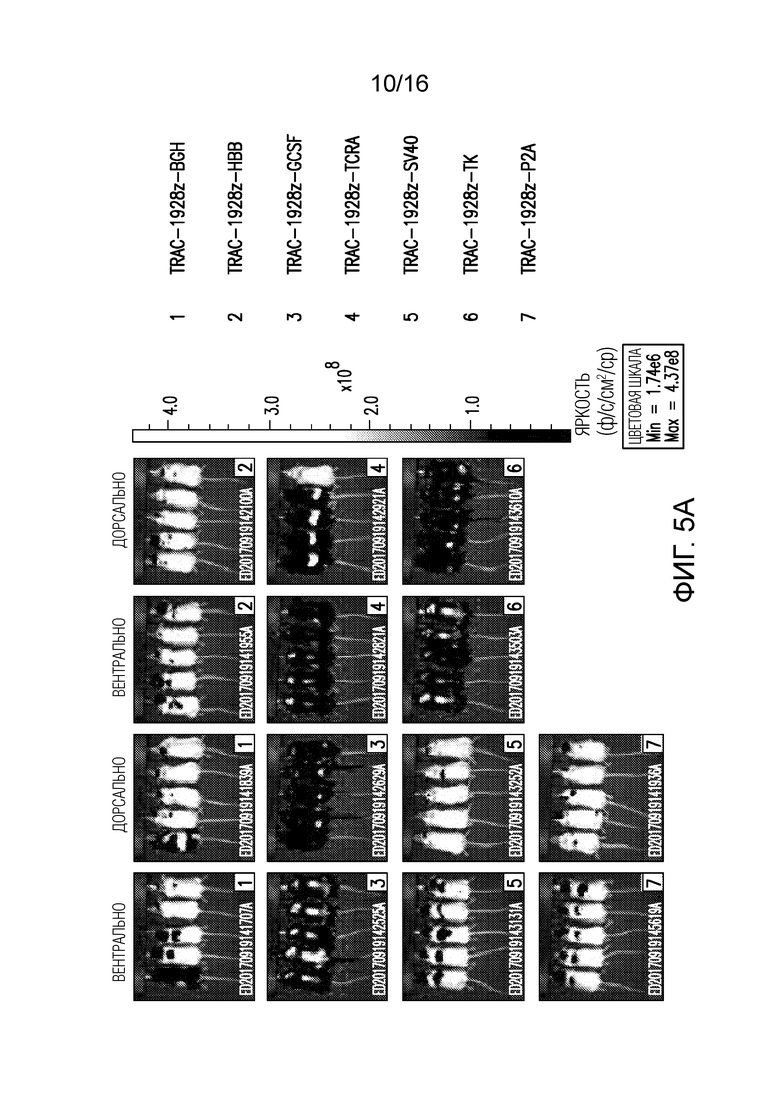
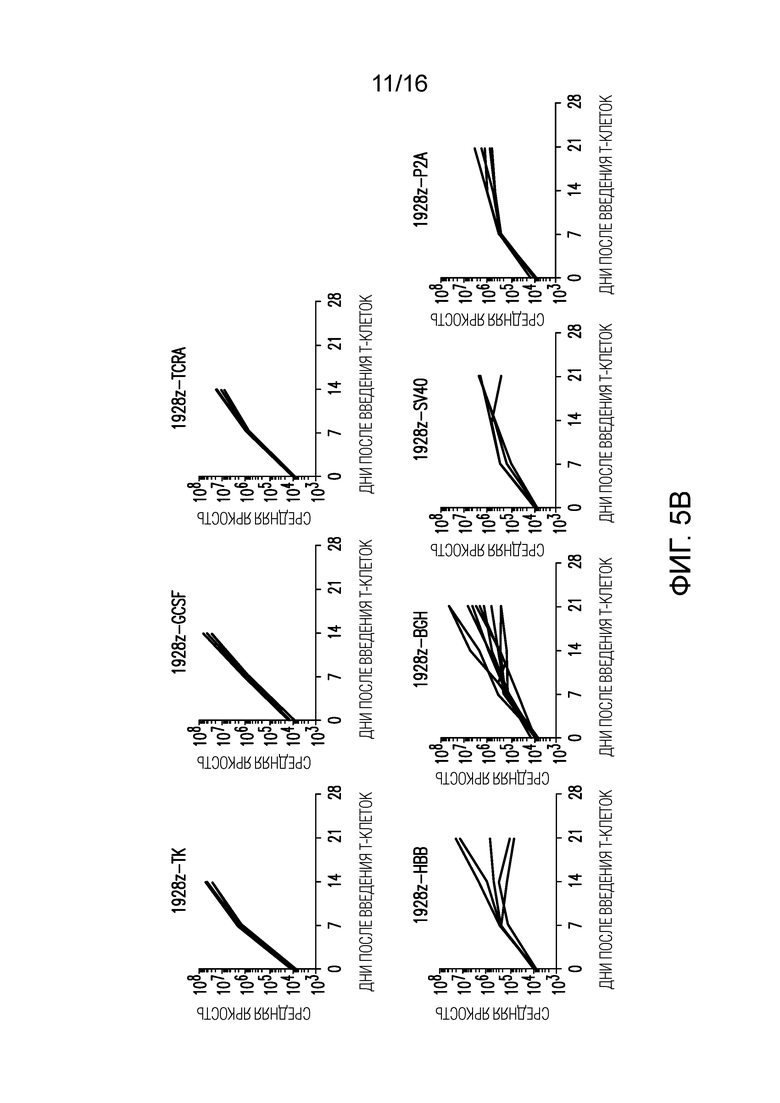
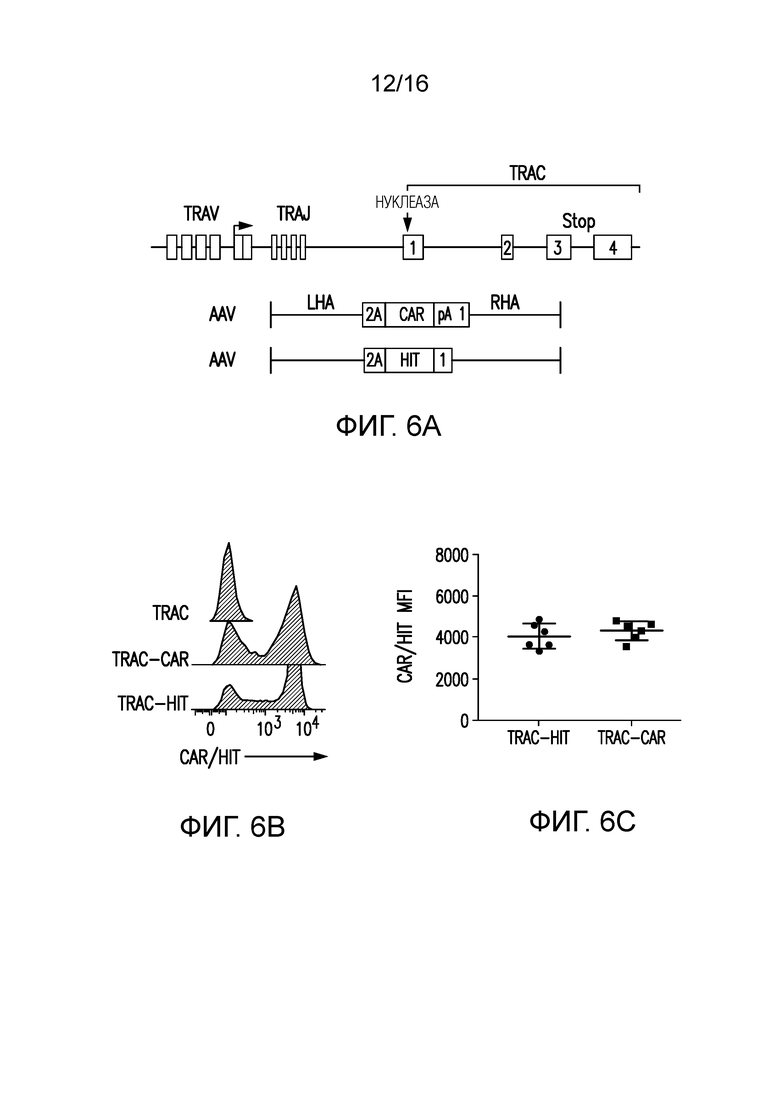
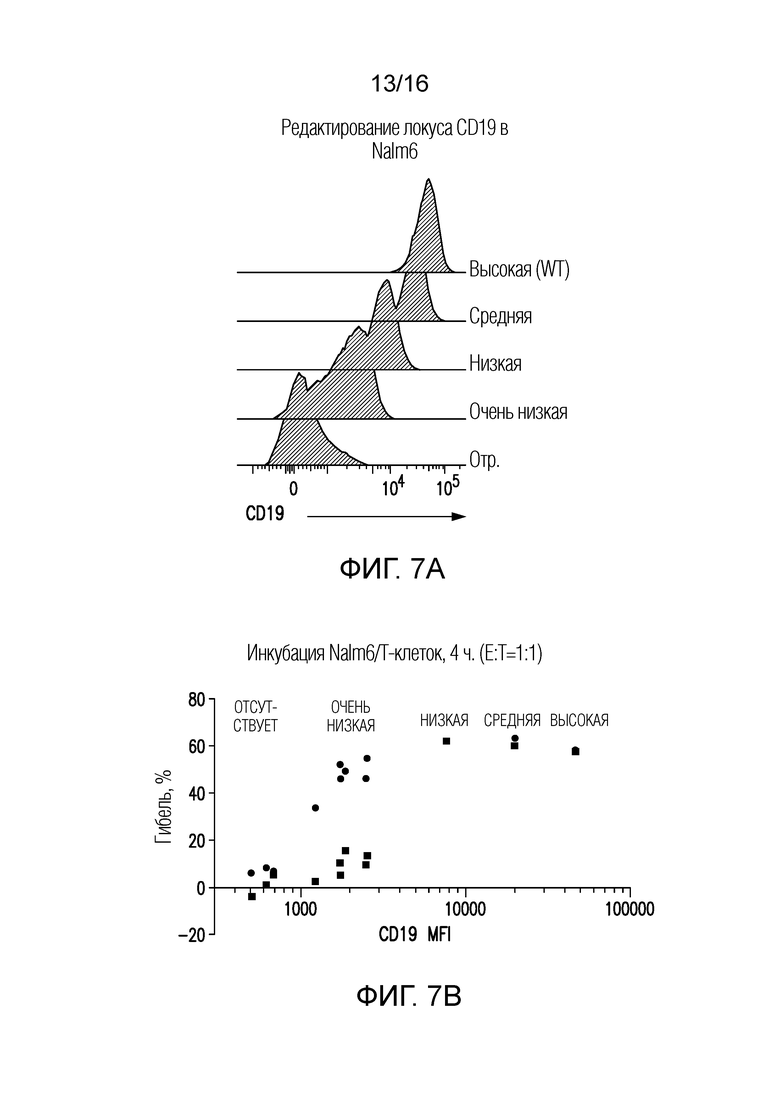
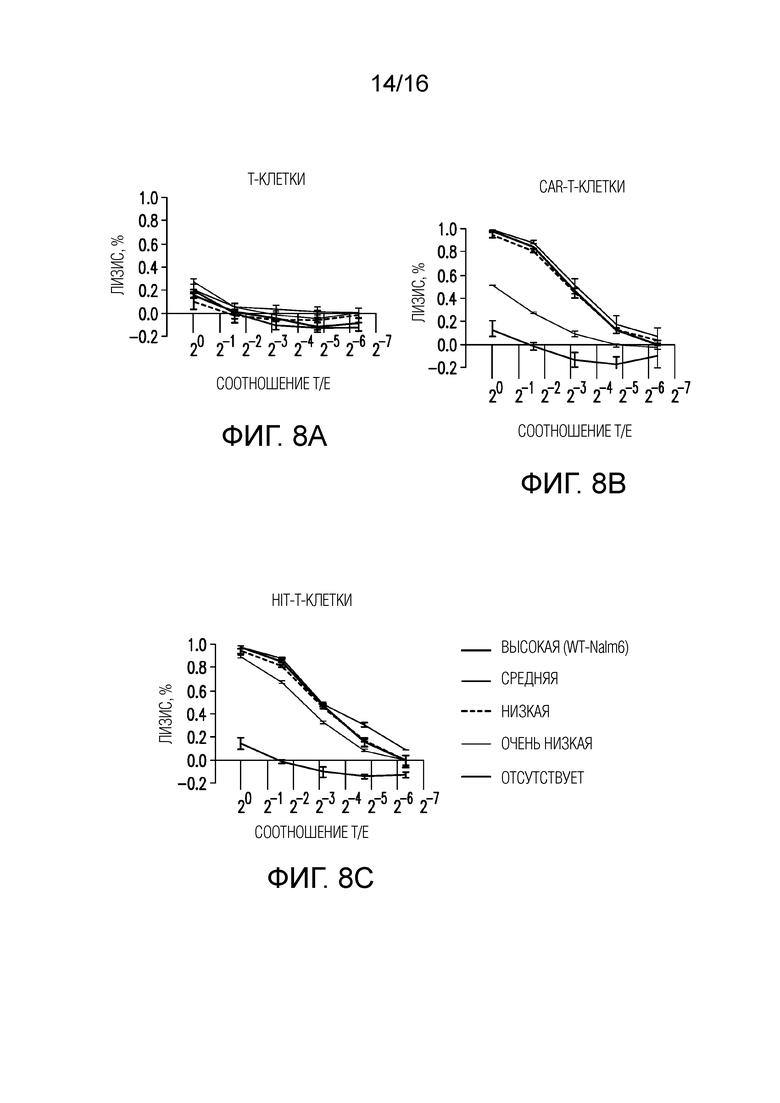
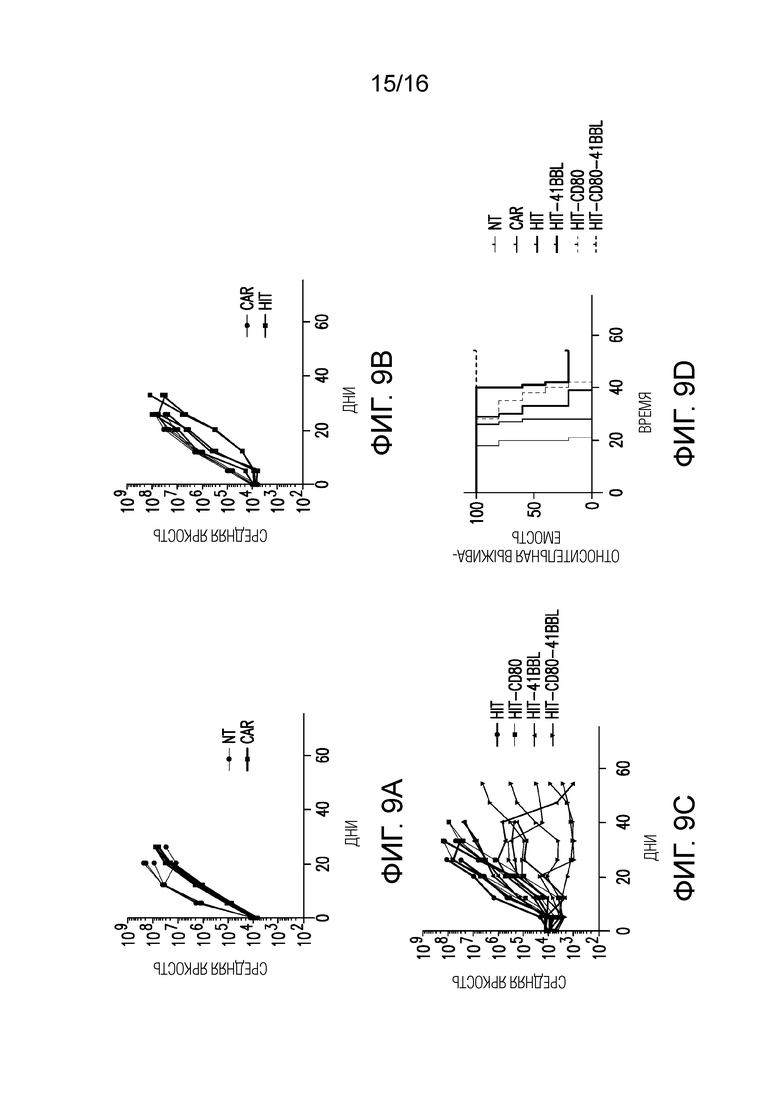
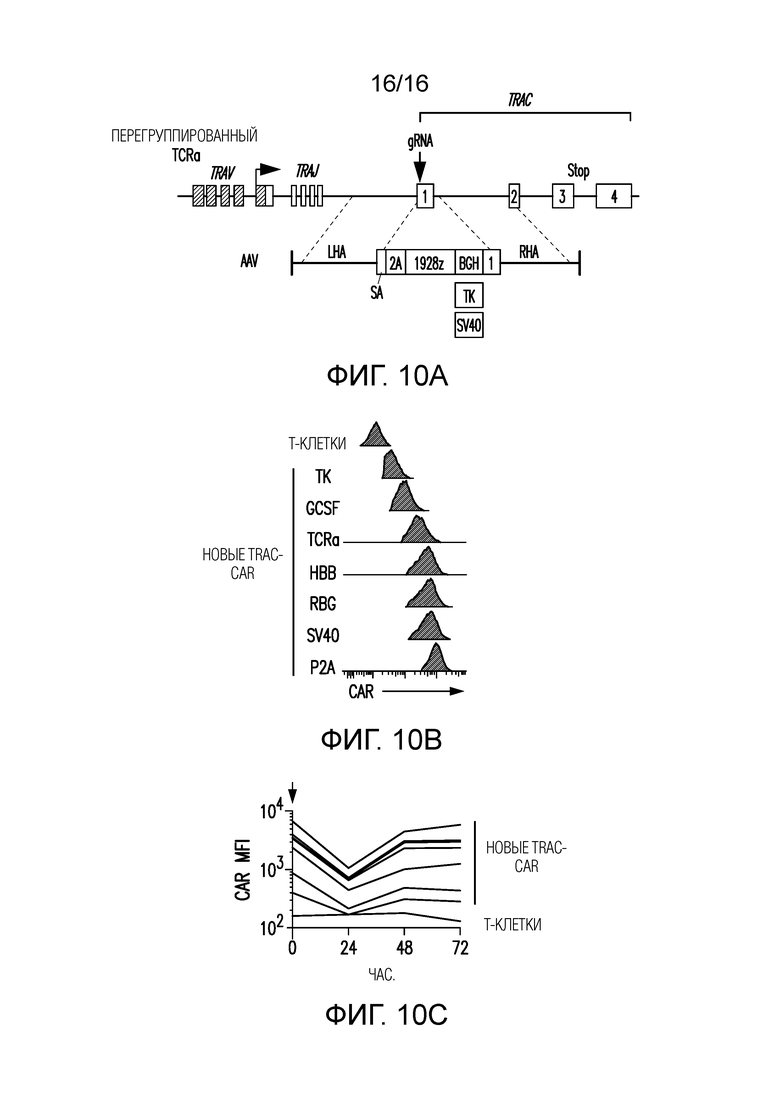
Изобретение относится к молекулярной биологии, иммунологии и медицине, в частности к новым конструкциям T-клеточных рецепторов (TCR) и содержащим их сконструированным иммунореактивным клеткам. Раскрытый в данном документе предмет изобретения предлагает способы и композиции для усиления иммунного ответа на рак и патогены. TCR по настоящему изобретению связывается с антигеном HLA-независимым образом. Изобретение обеспечивает новые конструкции антиген-распознающих рецепторов, обладающие постоянной эффективностью и повышенной способностью обнаруживать низкие уровни антигена-мишени. 11 н. и 13 з.п. ф-лы, 10 ил., 2 табл., 2 пр.
1. Рекомбинантный T-клеточный рецептор (TCR), содержащий антигенсвязывающую цепь, которая содержит:
a) антигенсвязывающий домен вариабельной области иммуноглобулина, который связывается с антигеном HLA-независимым образом; и
b) константный домен, который способен связываться с полипептидом CD3ζ, необязательно где константный домен содержит полипептид TRAC, который по меньшей мере приблизительно на 80% идентичен аминокислотной последовательности, представленной в SEQ ID NO: 38, или полипептид TRBC, который по меньшей мере приблизительно на 80% идентичен аминокислотной последовательности, представленной в SEQ ID NO: 39;
где указанный рекомбинантный TCR связывается с опухолевым антигеном.
2. Рекомбинантный T-клеточный рецептор (TCR), содержащий первую антигенсвязывающую цепь и вторую антигенсвязывающую цепь, где:
a) указанная первая антигенсвязывающая цепь содержит первый антигенсвязывающий фрагмент VH антитела и первый константный домен; и
b) указанная вторая антигенсвязывающая цепь содержит второй антигенсвязывающий фрагмент VL антитела и второй константный домен;
где
i) каждый из указанного первого константного домена и указанного второго константного домена способен связываться с полипептидом CD3ζ;
ii) каждый из указанного первого константного домена и указанного второго константного домена содержит полипептид TRAC, который по меньшей мере приблизительно на 80% идентичен аминокислотной последовательности, представленной в SEQ ID NO: 38, или полипептид TRBC, который по меньшей мере приблизительно на 80% идентичен аминокислотной последовательности, представленной в SEQ ID NO: 39;
iii) каждая из указанной первой антигенсвязывающей цепи и указанной второй антигенсвязывающей цепи связывается с антигеном HLA-независимым образом;
iv) каждая из указанной первой антигенсвязывающей цепи и указанной второй антигенсвязывающей цепи связывается с антигеном с константой диссоциации (Kd) приблизительно 1×10-8 М или менее; и
v) указанный рекомбинантный TCR связывается с опухолевым антигеном.
3. Рекомбинантный TCR по п. 1 или 2, где полипептид CD3ζ слит с внутриклеточным доменом костимулирующей молекулы или его фрагментом, необязательно где указанная костимулирующая молекула выбрана из CD28, 4-1BB, OX40, ICOS, DAP-10 и их комбинаций.
4. Рекомбинантный TCR по любому из пп. 1-3, где антигенсвязывающая цепь дополнительно содержит костимулирующую область, где данный рекомбинантный TCR после связывания с антигеном способен стимулировать иммунореактивную клетку, необязательно где указанная костимулирующая область содержит внутриклеточный домен костимулирующей молекулы или его фрагмент, необязательно где указанная костимулирующая молекула выбрана из CD28, 4-1BB, OX40, ICOS, DAP-10 и их комбинаций, необязательно где костимулирующая молекула представляет собой CD28.
5. Рекомбинантный TCR по любому из пп. 1-4, где антигенсвязывающий домен содержит антигенсвязывающий фрагмент вариабельной области тяжелой цепи (VH) антитела и/или антигенсвязывающий фрагмент вариабельной области легкой цепи (VL) антитела,
необязательно где указанный антигенсвязывающий домен содержит антигенсвязывающий фрагмент VH антитела, а рекомбинантный TCR дополнительно содержит вторую антигенсвязывающую цепь, которая содержит (a) второй антигенсвязывающий фрагмент VL антитела и (b) второй константный домен, который содержит нативный или модифицированный полипептид TRAC или нативный или модифицированный полипептид TRBC,
необязательно где указанные VH и VL образуют вариабельный фрагмент (Fv).
6. Рекомбинантный TCR по любому из пп. 1-5, где указанный опухолевый антиген
a) выбирают из группы, состоящей из CD19, MUC16, MUC1, CAlX, CEA, CD8, CD7, CD10, CD20, CD22, CD30, CLL1, CD33, CD34, CD38, CD41, CD44, CD49f, CD56, CD74, CD133, CD138, EGP-2, EGP-40, EpCAM, Erb-B2, Erb-B3, Erb-B4, FBP, фетального ацетилхолинового рецептора, фолатного рецептора-α, GD2, GD3, HER-2, hTERT, IL-13R-α2, легкой цепи κ, KDR, LeY, молекулы клеточной адгезии L1, MAGE-A1, мезотелина, ERBB2, MAGEA3, p53, MART1, GP100, протеиназы 3 (PR1), тирозиназы, сурвивина, hTERT, EphA2, лигандов NKG2D, NY-ES0-1, онкофетального антигена (h5T4), PSCA, PSMA, ROR1, TAG-72, VEGF-R2, WT-1, BCMA, CD123, CD44V6, NKCS1, EGF1R, EGFR-VIII, CD99, CD70, ADGRE2, CCR1, LILRB2, LILRB4, PRAME и ERBB,
b) выбирают из CD22, BCMA, CCR1 и CD70;
с) представляет собой CD70; или
d) представляет собой CD19.
7. Рекомбинантный TCR по любому из пп. 1-6, где антиген имеет низкую плотность на клеточной поверхности, необязательно где указанный антиген имеет плотность менее приблизительно 10000 молекул на клетку; необязательно где указанная клетка представляет собой клетку опухоли.
8. Рекомбинантный TCR по п.7, где указанная опухоль
a) представляет собой злокачественную опухоль, необязательно где злокачественная опухоль представляет собой рак крови,
b) представляет собой рецидивирующую опухоль,
c) представляет собой солидную опухоль,
d) представляет собой гематологическое злокачественное новообразование, и/или
e) выбрана из В-клеточного лейкоза, множественной миеломы, острого лимфобластного лейкоза (ALL), хронического лимфоцитарного лейкоза (CLL), лимфомы Ходжкина, неходжкинской лимфомы, острого миелоидного лейкоза (AML) и аденокарциномы.
9. Иммунореактивная клетка, содержащая рекомбинантный TCR по любому из пп. 1-8, где указанную клетку выбирают из T-клетки, естественной киллерной клетки (NK-клетки) и плюрипотентной стволовой клетки, из которой может дифференцироваться лимфоидная клетка.
10. Иммунореактивная клетка по п. 9, где рекомбинантный TCR экспрессируется трансгеном, который интегрирован в локус эндогенного гена данной иммунореактивной клетки.
11. Иммунореактивная клетка по п. 10, где локус эндогенного гена представляет собой локус CD3δ, локус CD3ε, локус CD247, локус B2M, локус TRAC, локус TRBC, локус TRDC и/или локус TRGC, необязательно где локус эндогенного гена представляет собой локус TRAC и/или локус TRBC.
12. Иммунореактивная клетка по п. 11, где экспрессия эндогенного TCR, содержащего нативную α-цепь TCR и/или нативную β-цепь TCR, нарушена или устранена в иммунореактивной клетке, посредством чего предотвращается или устраняется ошибочное спаривание между рекомбинантным TCR и нативной α-цепью TCR и/или нативной β-цепью TCR в иммунореактивной клетке.
13. Иммунореактивная клетка по любому из пп. 10-12, где локус эндогенного гена содержит модифицированную область терминатора транскрипции, необязательно где модифицированная область терминатора транскрипции содержит геномный элемент, выбранный из группы, состоящей из терминатора транскрипции TK, терминатора транскрипции GCSF, терминатора транскрипции TCRA, терминатора транскрипции HBB, терминатора транскрипции бычьего гормона роста, терминатора транскрипции SV40 и элемента P2A.
14. Иммунореактивная клетка по любому из пп. 10-13, где локус эндогенного гена представляет собой первый локус эндогенного Т-клеточного рецептора (TCR), а второй локус эндогенного TCR, который отличен от первого локуса эндогенного TCR, модифицирован для устранения экспрессии цепи эндогенного TCR, кодируемой вторым локусом эндогенного TCR, необязательно где второй локус эндогенного TCR дополнительно модифицирован для экспрессии гена, необязательно где указанный ген представляет собой противоопухолевый цитокин, лиганд костимулирующей молекулы, ген отслеживания или ген самоубийства.
15. Иммунореактивная клетка по любому из пп. 9-14, где указанная клетка представляет собой T-клетку, выбранную из цитотоксического Т-лимфоцита (CTL), регуляторной Т-клетки и естественной киллерной Т-клетки (NKT).
16. Иммунореактивная клетка по любому из пп. 9-15, дополнительно содержащая:
a) по меньшей мере один экзогенный костимулирующий лиганд, необязательно где указанный экзогенный костимулирующий лиганд выбирают из группы, состоящей из CD80, CD86, 41BBL, CD275, CD40L, OX40L и их комбинаций, необязательно где данная клетка содержит один экзогенный костимулирующий лиганд, необязательно где указанный один экзогенный костимулирующий лиганд представляет собой CD80 или 4-1BBL; или два экзогенных костимулирующих лиганда, где указанные два экзогенных костимулирующих лиганда представляют собой CD80 и 4-1BBL;
b) по меньшей мере один химерный костимулирующий рецептор (CCR), необязательно где указанный CCR содержит внутриклеточный домен костимулирующей молекулы или его фрагмент, необязательно где указанная костимулирующая молекула выбрана из CD28, 4-1BB, OX40, ICOS, DAP-10 и их комбинаций; и/или
c) по меньшей мере один химерный антигенный рецептор (CAR).
17. Фармацевтическая композиция для лечения опухоли, содержащая эффективное количество иммунореактивной клетки по любому из пп. 9-16 и фармацевтически приемлемый эксципиент.
18. Применение иммунореактивной клетки по любому из пп. 9-16 или фармацевтической композиции по п. 17 в снижении опухолевой нагрузки, необязательно где указанная опухоль
a) представляет собой злокачественную опухоль, необязательно где злокачественная опухоль представляет собой рак крови,
b) представляет собой рецидивирующую опухоль,
c) представляет собой солидную опухоль,
d) представляет собой гематологическое злокачественное новообразование,
e) выбрана из В-клеточного лейкоза, множественной миеломы, острого лимфобластного лейкоза (ALL), хронического лимфоцитарного лейкоза (CLL), лимфомы Ходжкина, неходжкинской лимфомы, острого миелоидного лейкоза (AML) и аденокарциномы;
f) выбрана из В-клеточного лейкоза, множественной миеломы, острого лимфобластного лейкоза (ALL), хронического лимфоцитарного лейкоза и неходжкинской лимфомы, и указанный рекомбинантный TCR связывается с CD19;
g) выбрана из В-клеточного лейкоза, множественной миеломы, острого лимфобластного лейкоза (ALL), острого миелоидного лейкоза (AML), хронического лимфоцитарного лейкоза или неходжкинской лимфомы, и указанный рекомбинантный TCR связывается с BCMA, ADGRE2, CCR1, CD22, CD70 или их комбинацией; или
h) представляет собой CD19+ ALL.
19. Применение иммунореактивной клетки по любому из пп. 9-16 или фармацевтической композиции по п. 17 в лечении или предупреждении опухоли, необязательно где указанная опухоль
a) представляет собой злокачественную опухоль, необязательно где злокачественная опухоль представляет собой рак крови,
b) представляет собой рецидивирующую опухоль,
c) представляет собой солидную опухоль,
d) представляет собой гематологическое злокачественное новообразование,
e) выбрана из В-клеточного лейкоза, множественной миеломы, острого лимфобластного лейкоза (ALL), хронического лимфоцитарного лейкоза (CLL), лимфомы Ходжкина, неходжкинской лимфомы, острого миелоидного лейкоза (AML) и аденокарциномы;
f) выбрана из В-клеточного лейкоза, множественной миеломы, острого лимфобластного лейкоза (ALL), хронического лимфоцитарного лейкоза и неходжкинской лимфомы, и указанный рекомбинантный TCR связывается с CD19;
g) выбрана из В-клеточного лейкоза, множественной миеломы, острого лимфобластного лейкоза (ALL), острого миелоидного лейкоза (AML), хронического лимфоцитарного лейкоза или неходжкинской лимфомы, и указанный рекомбинантный TCR связывается с BCMA, ADGRE2, CCR1, CD22, CD70 или их комбинацией; или
h) представляет собой CD19+ ALL.
20. Применение иммунореактивной клетки по любому из пп. 9-16 или фармацевтической композиции по п. 17 в продлении выживания у субъекта, имеющего опухоль, необязательно где указанная опухоль
a) представляет собой злокачественную опухоль, необязательно где злокачественная опухоль представляет собой рак крови,
b) представляет собой рецидивирующую опухоль,
c) представляет собой солидную опухоль,
d) представляет собой гематологическое злокачественное новообразование,
e) выбрана из В-клеточного лейкоза, множественной миеломы, острого лимфобластного лейкоза (ALL), хронического лимфоцитарного лейкоза (CLL), лимфомы Ходжкина, неходжкинской лимфомы, острого миелоидного лейкоза (AML) и аденокарциномы;
f) выбрана из В-клеточного лейкоза, множественной миеломы, острого лимфобластного лейкоза (ALL), хронического лимфоцитарного лейкоза и неходжкинской лимфомы, и указанный рекомбинантный TCR связывается с CD19;
g) выбрана из В-клеточного лейкоза, множественной миеломы, острого лимфобластного лейкоза (ALL), острого миелоидного лейкоза (AML), хронического лимфоцитарного лейкоза или неходжкинской лимфомы, и указанный рекомбинантный TCR связывается с BCMA, ADGRE2, CCR1, CD22, CD70 или их комбинацией; или
h) представляет собой CD19+ ALL.
21. Способ получения антиген-специфической иммунореактивной клетки, где данный способ содержит введение в иммунореактивную клетку последовательности нуклеиновой кислоты, кодирующей рекомбинантный TCR по любому из пп. 1-8.
22. Нуклеиновая кислота, кодирующая рекомбинантный TCR по любому из пп. 1-8.
23. Экспрессионный вектор, содержащий нуклеиновую кислоту по п. 22.
24. Набор для лечения неоплазии, содержащий рекомбинантный TCR по любому из пп. 1-8, иммунореактивную клетку по любому из пп. 9-16, фармацевтическую композицию по п. 17, нуклеиновую кислоту по п. 22 или вектор по п. 23 и письменные инструкции по лечению и/или предупреждению новообразования.
| WO 2019157454 A1, 19.06.2014 | |||
| EYQUEM J | |||
| et al., Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection, Nature, 2017, vol | |||
| Приспособление для открывания боковых откидных стенок вагонетки | 1922 |
|
SU543A1 |
| Способ обработки грубых шерстей на различных аппаратах для мериносовой шерсти | 1920 |
|
SU113A1 |
| TOSOLINI M | |||
| et al., Assessment of tumor-infiltrating TCRVγ9Vδ2 γδ lymphocyte abundance by deconvolution of human cancers microarrays, Oncoimmunology, 2017, vol | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2024-02-05—Публикация
2019-02-11—Подача