Заявляемое изобретение относится к медицине, в частности андрологии и может быть использовано при разработке фармакологических композиций и лекарственных форм, предназначенных для лечения и профилактики нарушений сперматогенеза после перенесенных урогенитальных инфекций и вирусных заболеваний.
В настоящее время мужское бесплодие неуклонно прогрессирует и составляет по оценке разных авторов до 50% бесплодных браков. Снижение фертильности наблюдается примерно у 7% половозрелых мужчин и в основном связано с нарушением сперматогенеза и ухудшением качества спермы. Из причин, наиболее часто вызывающих нарушения сперматогенеза, следует отнести возраст, неблагоприятные этиологические факторы, хронические урогенитальные инфекции, прием антибиотиков (например, антибиотиков фторхинолонового ряда), стресс, курение и алкоголь. В последнее время в качестве этиологических факторов нарушения сперматогенеза стали рассматривать вирусные инфекции, в частности вирус герпеса и вирусы, вызывающие острые респираторные заболевания, включая COVID-19. В настоящее время арсенал средств коррекции нарушений сперматогенеза в основном представлен фармакологическими средствами, направленными на устранение инфекционно-воспалительных факторов нарушения сперматогенеза, в частности антибиотиками, противовирусными препаратами, многочисленными композициями витаминов, антиоксидантов, включая биофлавоноиды. Однако сами антибактериальные и противовирусные препараты способны нарушать сперматогенез, а антиоксиданты и биофлавоноиды не компенсируют все проявления оксидативного стресса и гипоксии вследствие как инфекционного процесса, так и вследствие токсического воздействия антибиотиков на сперматогенез. Фактически в андрологии при тяжелых нарушениях сперматогенеза приходится находить оптимальный баланс между приемом антибиотиков и средствами компенсации их токсического действия. При этом следует учитывать, что практически все фармакологически средства коррекции сперматогенеза используются в ситуации уже возникших нарушений и практически не применяются для профилактики нарушений сперматогенеза, кроме нарушений, вызванных воздействием ионизирующего излучения или цитостатических препаратов.
Известен способ вторичной профилактики нарушений сперматогенеза при воздействии радиации, отличающийся тем, что животным в ранние сроки после радиационного облучения ежедневно в течение 21-24 дней вводят внутрижелудочно по 3,0-3,5 мл одну из следующих минеральных вод: сульфатную натриево-магниево-кальциевую воду или указанную воду с добавлением микроэлемента кремния [патенте RU 2169571 «Способ вторичной профилактикинарушений сперматогенеза при воздействии радиации», опубл. 27.06.2001, Бюл. №18]. Недостатком способа является то, что не изучена его эффективность при инфекционно-воспалительных нарушениях сперматогенеза. Кроме того, оценка эффективности ограничена показателями степени деструктивных изменений сперматогенного эпителия семенных канальцев, в том числе по наличию наиболее зрелых форм половых клеток (сперматиды и сперматозоиды), однако отсутствуют количественные характеристики, позволяющие судить об эффективности заявленного способа.
Предложено применение в качестве средства для профилактики и коррекции нарушений сперматогенеза, вызванных цитостатическим воздействием, экстракта левзеи сафлоровидной (Rhaponticum carthamoides) [патент RU 2318529 «Средство для профилактики и коррекции нарушений сперматогенеза, вызванного цитостатическим воздействием», опубл. 10.03.2008, Бюл. №7]. Экстракт левзеи сафлоровидной является малотоксичным лекарственным средством. Показано, что под действием экстракта левзеи менее выражено явление отека, сокращается количество погибших и патологически измененных сперматогенных клеток, происходит более быстрое восстановление общего количество половых клеток - показателя, характеризующего продуктивность сперматогенеза. Однако применение заявленного средства ограничено нарушениями сперматогенеза, вызванными цитостатиками, нет данных, подтверждающих его эффективность для лечения и профилактики инфекционно-воспалительных нарушений сперматогенеза.
Предложен комплексный природный препарат в виде суппозитория для лечения андрологических заболеваний, содержащий цветочную пыльцу или пергу, масло какао или другую жировую основу, гомогенизированные личинки пчелиной матки с нативным маточным молочком или лиофилизированный порошок из гомогенизированных трутневых личинок и трутневого молочка [патент RU 2376978 «Комплексный апипрепарат в виде суппосториев для лечения андрологических заболеваний и способ его получения», опубл. 27.12.2000, Бюл. №36]. Заявленное средство, в частности, способствует улучшению показателей сперматогенеза при таких нарушениях как олигозооспермия и тератозооспермия 2-3 степени. Однако при исследовании не подтверждено увеличение количества сперматозоидов в увеличенном объеме эякулята. Кроме того, заявленное средство обладает высокой аллергогенностью, которая свойственна практически всем биопродуктам пчеловодства. Также отсутствуют, какие либо данные о лечебно-профилактической эффективности предложенного средства при нарушениях сперматогенеза, индуцированных инфекционно-воспалительным процессом.
Предложен способ восстановления сперматогенеза после оперативных вмешательств на яичке, придатке яичка, семенных канатиках путем введения в яичко аутологичной плазмы, обогащенной тромбоцитами (АОТ) [патент RU 2735888 «Способ протекции и восстановления сперматогенеза при оперативных вмешательствах на семенном канатике, яичке, придатке яичка», опубл. 09.11.2020, Бюл. №19]. Однако заявленный способ не всегда приводит к нормализации сперматогенеза, у ряда пациентов наблюдается гипосперматогенез (до сперматоцитов I-го типа) и лишь единичные сперматозоиды, что ставит под сомнение его высокую эффективность. Другим недостатком заявленного способа является необходимость оперативного вмешательства путем рассечения белочной оболочки яичка. Также отсутствуют какие либо данные о лечебной эффективности предложенного средства при нарушениях сперматогенеза, индуцированных инфекционно-воспалительным процессом.
Предложен комплексный способ стимуляции сперматогенеза после операции больных по поводу варикоцеле (аномальное расширение вен гроздевидного сплетения семенного канатика и внутренних семенных вен) или другой урологической патологии с нарушением сперматогенеза [патент RU 2406549 «Способ комплексной стимуляции сперматогнеза», опубл. 20.12.2010, Бюл. №35]. Для этого на фоне проведения медикаментозной терапии воздействуют контактно на область мошонки низкоинтенсивным лазерным излучением с длиной волны 0,63 мкм выходной мощностью 30 мВт. Применение способа на группе больных варикоцеле привело к увеличению общего количества сперматозоидов и доли в них активно подвижных форм. Недостатком заявленного способа является его недостаточная эффективность, обусловленная неспецифическим характером воздействия на сперматогенез как лазерного излучения, так и применяемых медикаментозных средств (мембраностабилизаторы, антиоксиданты, комплекс поливитаминов, витамины «Аевит»), а также отсутствием исследования лечебно-профилактической эффективности предложенного способа при нарушениях сперматогенеза, индуцированных инфекционно-воспалительным процессом.
Для стимуляции сперматогенеза предложено воздействовать на область семенников низкоинтенсивным лазерным излучением с длиной волны 475 нм, выходная мощность излучения 10 мВт, расстояние от органа 1 см [патент RU 2481132 «Способ стимуляции сперматогенеза в эксперименте», опубл. 10.05.2013, Бюл. №13]. Осуществление способа демонстрировали на здоровых самцах белых нелинейных крыс.
Способ позволил увеличить количество половых клеток (без идентификации) на 15-25%, увеличить подвижность сперматозоидов на 5-15%. Недостатком заявленного способа является проблематичность переноса его эффективности со здоровых субъектов на субъекты с нарушением сперматогенеза. Другим недостатком является неспецифичность (опосредованность) теплового воздействия на сперматогенез и отсутствие каких-либо данных о лечебно-профилактической эффективности предложенного способа при нарушениях сперматогенеза, индуцированных инфекционно-воспалительным процессом.
Известен способ стимуляции сперматогенеза, включающий инъекционное введение под белочную оболочку яичка суспензии мультипотентных мезенхимных стромальных клеток (МСК) жировой ткани человека в бессывороточной среде роста, лишенной ксеногенных компонентов, в количестве 500-600 тысяч клеток, содержащихся в 400±100 мкл суспензии [патент RU 2653779 «Способ стимуляции сперматогенеза», опубл. 14.05.2018, Бюл. №14]. Осуществление способа продемонстрировано на половозрелых крысах-самцах группы Wistar на модели искусственного нарушения сперматогенеза путем двухстороннего абдоминального крипторхизма. Введение МСК человека под белочную оболочку яичка осуществляли после обратного низведение яичек в мошонку. Получены положительные эффекты на стадиях созревания сперматозоидов (сперматогонии, сперматоциты), дана количественная характеристика субпопуляций клеток сперматогенного эпителия, однако содержание сперматозоидов было значительно ниже содержания клеток-предшественников сперматогенеза, что свидетельствует о недостаточной эффективности заявленного способа. Другим недостатком является применение чужеродных для крыс МСК человека, травматичность и болезненность процедуры введения МСК, требующая глубокой анестезии, а также сложность и высокая стоимость за счет выделения и культивирования мезенхимальных клеток жировой ткани человека. Средство применяли исключительно для стимуляции искусственно нарушенного сперматогенеза, а не для лечения и профилактики инфекционно-воспалительных нарушений сперматогенеза.
Предложен способ стимуляции нарушенного сперматогенеза и усиления синтеза тестостерона при наличии андрогенной недостаточности. Способ заключается в трансплантации ткани неонатального яичка животного. Для этого используют ткань яичек плодов на поздних стадиях развития или новорожденных крысят. Способ обеспечивает стойкое приживление трансплантатов и рост пересаженной ткани, что ведет к повышению концентрации тестостерона в крови и стимуляции сперматогенеза в поврежденном яичке при существенном экономическом эффекте за счет исключения необходимости использования стволовых клеток для этих целей [патент RU 2669027 «Способ стимуляции нарушенного сперматогенеза и синтеза тестостерона с помощью трансплантации неонатальной тестикулярной ткани», опубл. 05.10.2018, Бюл. №28]. Недостатком описанного способа является необходимость применения иммунодепрессивных препаратов после пересадки яичка, сложность адаптации к медицинской практике, непригодность столь радикального способа для лечения и профилактики инфекционно-воспалительных нарушений сперматогенеза.
Для стимуляции сперматогенеза предложено использовать антиэстроген транс-кломифен в составе фармацевтической композиции. Показано, что композиция с кломифеном значительно и долговременно повышает не только уровень тестостерона и лютеинизирующего гормона, но и фолликулостимулирующего гормона, который стимулирует сперматогенез [патенте RU 2404757 «Способы и материалы с транс-кломифеном для лечения мужского бесплоджия», опубл. 27.11.2010, Бюл. №13]. Недостатком предложенного способа является большое число осложнений при использовании антиэстрогенных препаратов. Также отсутствуют, какие либо данные о лечебно-профилактической эффективности предложенного средства при нарушениях сперматогенеза, индуцированных инфекционно-воспалительным процессом.
Предложено применение пробиотиков для улучшения качества спермы у субъекта, включающих штаммы Lactobacillus rhamnosus СЕСТ 8361 и Bifidobacterium longum СЕСТ 7347 путем перорального введения [патент RU 2724534 «Применение пробиотиков для усиления мужской фертильности», опубл. 23.06.2020, Бюл. №18]. Показано, что указанные пробиотики способствуют повышению подвижности сперматозоидов и снижению фрагментации ДНК в сперматозоидах у мужчин с астенозооспермией (малой подвижностью сперматозоидов). Основным недостатком заявленного средства является его недостаточная эффективность, обусловленная неспецифичностью действия пробиотиков на сперматогенез, и отсутствие объективных данных, подтверждающих их лечебно-профилактическую активность. Другим недостатком аналога является отсутствие исследований влияния заявленных средств на нарушение сперматогенеза, индуцированного инфекционно-воспалительным процессом.
Для лечения нарушений сперматогенеза различной этиологии предложено использовать селективный ингибитор α1-адренорецепторов доксазозин. Для этого больному вводят доксазозин в течение 4-5 недель. Способ позволяет увеличить количество подвижных сперматозоидов при различных патологических состояниях, вызывающих изменение сперматогенеза [патент RU 2187306 «Способ улучшения качества спермы», опубл. 20.08.2002, Бюл. 23]. Однако нормализация подвижности сперматозоидов отмечена только у 60% пациентов, некоторое улучшение подвижности - у 30% из обследуемой группы мужчин, что свидетельствует о недостаточной терапевтической эффективности доксазозина. Другим недостатком является большое количество осложнений при приеме доксазозина и отсутствие каких либо данных о лечебно-профилактической эффективности предложенного средства при нарушениях сперматогенеза, индуцированных инфекционно-воспалительным процессом.
Преимущественно для стимуляции сперматогенеза в клинической практике используются гормональные препараты с гонадотропным действием. В частности, известен способ комплексного лечения нормогонадотропного бесплодия у мужчин, включающий стандартные схемы лечения, отличающийся тем, что дополнительно вводится фоллитропин альфа (гонал-ф) подкожно 3 раза в неделю 150 ME в течение 6 недель и ультрафиолетовое облучение крови в течение 20 мин, 2 раза в неделю, курс 12 процедур [патент RU 2480256 «Способ комплексного лечения нормогонадотропного бесплодия у мужчин», опубл. 27.04.2013, Бюл. №12]. Недостатком заявленного способа является то, что результативность заявленного способа, выражающаяся, по мнению авторов, в стимуляции роста семявыносящих канальцев, увеличении уровня тестостерона в крови, удлинении сроков продолжительности жизнеспособности сперматозоидов и активности сперматогенеза, увеличении концентрации активноподвижных сперматозоидов, не подкреплена фактическими данными. Другим недостатком заявленного способа является большое число осложнений при использовании гормональных препаратов. Кроме того, нормогонадотропное бесплодие у мужчин связано с гормональными нарушениями, и в заявленном способе отсутствуют какие либо данные о его лечебно-профилактической эффективности при нарушениях сперматогенеза, индуцированных инфекционно-воспалительным процессом.
Из негормональных препаратов для стимуляции сперматогенеза в андрологической практике используют прозводные L-карнитина в виде, фумаратов, ацетатов и тартратов. Так, предложена композиция для мужчин, направленная на улучшение функционального состояния органов мужской репродуктивной системы, содержащая карнитина тартрат, цинка сульфат, альфа-токоферола ацетат, фолиевую кислоту, селенит натрия и вспомогательные вещества при определенном соотношении компонентов в миллиграммах на одно саше массой 5000 м [патент RU 2665636 «Композиция для улучшения мужской репродуктивной функции», опубл. 03.09.2018 Бюл. №25]. Заявленная композиция апробирована на здоровых крысах линии Wistar. Установлено, что заявленная композиция незначительно (примерно на 2%) увеличивает как общее число сперматозоидов, так их подвижность и живучесть и столь же незначительно снижает долю аномальных сперматозоидов. Поскольку исследование выполнено на здоровых животных, это затрудняет возможность интерпретации эффективности заявленного средства для лечения и профилактики инфекционно-воспалительных нарушений сперматогенеза.
Известно ректальное лекарственное средство для коррекции нарушений сперматогенеза при мужской инфертильности, содержащее водорастворимые соединения цинка и L-аргинина и фармацевтически приемлемый носитель, которое может дополнительно содержать диметилсульфоксид, коэнзим Q10, селен, L-карнитин [патент RU 2686334 «Ректальное лекарственное средство коррекции нарушений сперматогенеза при мужской инфертильности», опубл. 25.04.2019, Бюл. №12]. Исследование проводили на аутбредных крысах самцах с ирритативным простатитом, полученным путем ректального введения 10% раствора ДМСО со скипидаром. Использование заявленного средства позволяет повысить концентрацию сперматозоидов, увеличить их подвижность и снизить степень фрагментации ДНК сперматозоидов, однако снижает долю нормальных форм сперматозоидов, что свидетельствует о его недостаточной эффективности. Кроме того, отсутствуют, какие либо данные об эффективности предложенного средства при нарушениях сперматогенеза, индуцированных инфекционно-воспалительным процессом.
Известно исследование эффективности применения комплекса ацетил-L-карнитина и L-карнитина (СпермАктин) при мужском бесплодии [В.В. Михайличенко, А.И. Новиков, В.Н. Фесенко, С.В. Фесенко, Э.Д. Казимзаде, Л.М. Родыгин «Результаты применения комплекса ацетил-L-карнитина и L-карнитина в лечении бесплодия у мужчин // Андрология и генитальная хирургия. 2014. №2. С. 70-73]. На пациентах с мужским бесплодием, характеризующихся отсутствием клинических и лабораторных признаков воспалительных изменений придаточных половых желез, варикоцеле и других негативно влияющих на сперматогенез заболеваний органов мошонки, подтвержденном результатами ультразвукового исследования и доплерографии, отсутствием иммунной формы бесплодия, выраженной соматической патологии, показано, что применение указанного средства способствует существенному увеличению доли подвижных сперматозоидов, концентрации сперматозоидов в эякуляте, повышению процентного содержания нормальных форм сперматозоидов. Недостатком указанного средства является то, что его эффективность не исследована на пациентах с инфекционно-воспалительными нарушениями сперматогенеза.
Наиболее близким аналогом является биологически активная добавка Андродоз в качестве средства для улучшения сперматогенеза, включающая L-аргинин 720 мг, L-карнитин 240 мг, L-карнозин 92 мг, а также вспомогательные вещества в виде витаминов и микроэлементов [Андродоз https://altravita-ivf.ru/informatsiya-dlya-patsientov/lekarstvennye-preparaty/androdoz-l.html. Дата публикации 15 мая 2015 г., обновлено 30 июня 2020 г.]. На пациентах с хроническим бактериальным простатитом, получавших биологически активную добавку Андродоз, показано, что в 92% наблюдали улучшение показателей спермограммы. Прирост среднего показателя концентрации сперматозоидов составил 154%, прирост доли подвижных форм (А+В) - 87%, прирост нормальных форм сперматозоидов - 60,4%. Не отмечено каких-либо значимых нежелательных побочных реакций. [Алчинбаев М.К., Медеубеков УШ., Хусаинов Т., Мухамеджан И.Т. Новые подходы к лечению патоспермии // Урология. 2013. №2. С. 48-51]. Однако хронический бактериальный простатит является заболеванием с длительным течением, в то время как актуальным является поиск лечебно-профилактических средств при нарушениях сперматогенеза, индуцированных инфекционно-воспалительным процессом, на ранних стадиях. Недостатком указанного средства является отсутствие исследований эффективности применения Андродоза на ранних стадиях формирования указанных нарушений сперматогенеза.
Технической проблемой, решаемой созданием изобретения, является повышение эффективности лечения и профилактики инфекционно-воспалительных нарушений сперматогенеза на ранних стадиях, расширение арсенала лечебно-профилактических средств.
Решение указанной технической проблемы достигается тем, что в качестве средства профилактики и лечения нарушений сперматогенеза, вызванных инфекционно-воспалительным процессом, применяют окисленный декстран с м.М. 40-60 кДа в виде 0,5-2% водного раствора.
Для оценки лечения и профилактики нарушений сперматогенеза на моделях in vivo заявленным средством использовали модель нарушения сперматогенеза, вызванную внутрибрюшинным введением эндотоксина (липополисахарида, ЛПС) Escherichia coli (ЛПС индуцированное нарушение сперматогенеза). Выбор модели был обусловлен тем, что парентеральное введение бактериального эндотоксина имитирует мощную иммунологическую реакцию по типу септического шока или «цитокинового шторма», характерную для нарушений сперматогенеза вследствие различных острых и хронических урогенитальных инфекций, а также после перенесенных острых респираторных вирусных инфекций, включая COVID-19.
Дизайн эксперимента
Исследование выполнено на половозрелых особях крыс-самцов линии Wistar массой 180-200 г. Животные были разделены на 3 группы исследования по 5 животных: 1 группа - крысы-самцы с однократным интраперитонеальным введением 2 мл 0,9% р-ра NaCl; 2 группа - крысы-самцы с однократным интраперитонеальным введением ЛПС Escherichia coli из расчета 50 мкг/кг массы тела; 3 группа - крысы-самцы с однократным интраперитонеальным введением ЛПС Escherichia coli из расчета 50 мкг/кг массы тела и через 30 минут интраперитонеальным введением 2 мл 2% раствора окисленного декстрана с м.М. 40 кДа; 4 группа - крысы-самцы с однократным интраперитонеальным введением ЛПС Escherichia coli из расчета 50 мкг/кг массы тела и через 30 минут интраперитонеальным введением 2 мл 2% раствора L-карнитина.
Животных выводили из эксперимента путем передозировки эфирного наркоза на 3 сутки после введения тестируемых веществ с соблюдением принципов гуманности директив Европейского сообщества (86/609/ЕЕС) и Хельсинкской декларации и в соответствии с требованиями правил проведения работ с использованием экспериментальных животных.
Материалы и методы исследования
Объектом гистологического исследования являлись фрагменты семенников крыс линии Wistar, которые фиксировали в нейтральном 10% забуференном р-ре формалина с последующей пробоподготовкой, изготовлением парафиновых блоков и гистологических стекол со срезами ткани семенников, окрашенными гематоксилином и эозином. Визуализацию структурных изменений семенников осуществляли методом прямой световой микроскопии при увеличении ×200. Морфометрическую оценку гистологических структур осуществляли в поперечных срезах извитых семенных канальцев с наиболее продвинутыми стадиями сперматогенеза в 10 произвольно взятых полях зрения при увеличении ×400 с использованием морфометрической сетки на 100 точек площадью 3,64×104 мкм2. При этом осуществляли подсчет численной плотности (Nai) сперматозоидов в просвете канальца, ранних и поздних сперматид, сперматоцитов, сперматогоний, клеток Сертоли, клеток Лейдига. Исследование гистологических образцов осуществляли с помощью цифрового лабораторного светового оптического иммерсионного флуоресцентного поляризационного фазового микроскопа Olympus СХ43 (Япония) с программным обеспечением для анализа изображений и фотоархивирования. Фотосъемку препаратов производили цифровой камерой MOTICAM S6, (Япония) с последующей обработкой изображения.
Работы выполнены с использованием оборудования ЦКП ФИЦ ФТМ «Протеомный анализ», поддержанного финансированием Минобрнауки России (соглашение №075-15-2021-691).
Статистическая обработка полученных данных осуществлялась с помощью программ Statistica и Excel. Оценку достоверности статистических различий между показателями аналогичных параметров осуществляли с использованием t-критерия Стьюдента. Достоверными считали отличия при уровне значимости р<0,05. Результаты исследования представлены в таблице 1
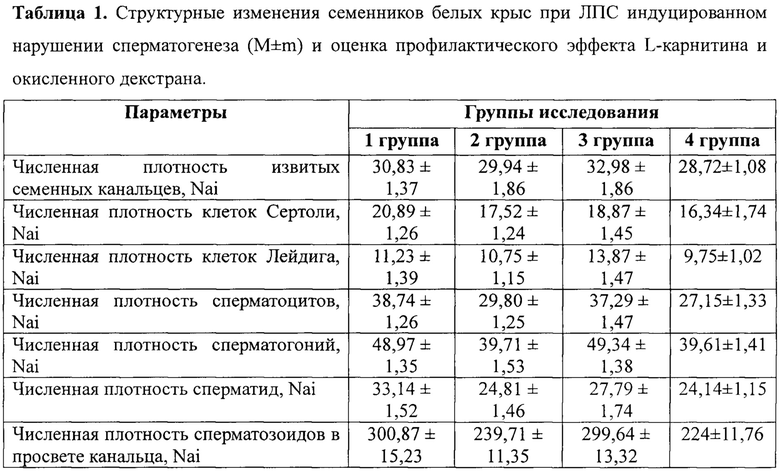
Как видно из представленных в таблице 1 данных окисленный декстран обладает выраженным лечебно-профилактическим действием при нарушении сперматогенеза, вызванном интраперитонеальным введением эндотоксина Escherichia coli. При этом лечебно-профилактический эффект L-карнитина на данной модели практически не наблюдается.
В качестве основного механизма лечебно-профилактического действия окисленного декстрана при инфекционно-воспалительных нарушениях сперматогенеза является его способность селективно стимулировать тканевые макрофаги через бета-гликановые и асиалогликопротеиновые рецепторы, приводя к активной выработке ими противовоспалительных цитокинов [Abdullah М., Kierszenbaum A.L. Identification of Rat Tesis Galactosyl Receptor Using Antibodies to Liver Asialoglycoprotein Receptor: Purification and Localization on Surfaces of Spermatogenic Cells and Sperm // The Journal of Cell Biology, Volume 108, February l989, P. 367-375]. Также известно, что тестикулярные макрофаги являются специфической популяцией тканевых макрофагов, которые отвечают за весь процесс сперматогенеза. Установлено, что активация макрофагов окисленным декстраном ведет к увеличение продукции ими оксида азота [Ткачев В.О., Колесникова О.П., Троицкий А.В., Шкурупий В.А. Влияние окисленных декстранов на NO-синтазную и аргиназную активность макрофагов мышей // Бюллетень экспериментальной биологии и медицины. - 2008. - Т. 146, №7. - С. 91-93.]. Оксид азота является эндогенным регулятором и стимулятором сперматогенеза, его продукция тестикулярными макрофагами ведет к активации клеток Лейдига и увеличению выработки ими андрогенов, которые активируют весь процесс сперматогенеза в целом. Учитывая, что тестикулярные макрофаги являются специфическим фенотипом тканевых макрофагов, их активация посредством взаимодействия с клеточными рецепторами является общим, генетически детерминированным свойством. В связи с этим данные представленные в таблице 1 можно рассматривать не только в качестве доказательства профилактического действия окисленного декстрана при ЛПС индуцированном нарушении сперматогенеза, но также в качестве подтверждения лечебного действия окисленного декстрана, так как окисленный декстран вводился через 30 минут после введения ЛПС. При таком интервале между введениями, повреждающее действие ЛПС на сперматогенез, опосредованное через иммунологические реакции (цитокиновый «шторм») в значительной степени уже реализуются, так как ЛПС вводится в системный кровоток посредством внутрибрюшинной инъекции, которая по скорости резорбции вводимых веществ, за счет высокой васкуляризации брюшины, идентична внутривенному введению. В пользу лечебного действия окисленного декстрана также свидетельствует увеличение численной плотности клеток Лейдига и численной плотности сперматозоидов в просвете канальцев. Эти параметры интегрально отражают завершенность процесса сперматогенеза и характеризуют окисленный декстран в качестве средства стимуляции сперматогенеза при его нарушении, опосредованном системными иммунологическими реакциями, индуцированными бактериальным эндотоксином.
Неочевидность заявленного технического решения определяется отсутствием в современной научной литературе каких либо сведений, относительно лечения и профилактики нарушений сперматогенеза окисленным декстраном, индуцированного введением бактериального эндотоксина, имитирующим инфекционно-воспалительный процесс.
Для определения эффективного диапазона концентраций раствора окисленного декстрана в качестве критерия профилактики нарушения сперматогенеза использовали степень восстановления численной плотности сперматозоидов в просвете семенных канальцев у крыс на модели ЛПС индуцированного нарушения сперматогенеза. При концентрации раствора окисленного декстрана с м.М. 40-60 кДа в пределах 0,5-2 мас. % степень восстановления сперматогенеза составляет 95-99% от контрольных значений интактных животных (введение физиологического раствора), при снижении концентрации раствора окисленного декстрана менее 0,5% степень восстановления снижается (менее 95%), а при повышении концентрации раствора выше 2% не увеличивается. Кроме того, при концентрации растворов окисленного декстрана с м.М. 40-60 кДа свыше 2% из-за высокой вязкости затруднена их стерилизующая фильтрация через микропористые фильтры (0,2 мкм). Диапазон молекулярных масс окисленного декстрана обусловлен тем, что в данном диапазоне молекулярных масс промышленно выпускаются декстраны, а для фармакологических целей используются лишь декстраны с м.М. 40 кДа и м.М. 60 кДа. Декстраны с другими молекулярными массами выпускаются лишь ограниченными партиями только для научно-исследовательских работ и в медицинской практике не используются. Окисленный декстран может быть получен при окислении декстрана любым известным способом, исключающим наличие токсичных примесей в готовом продукте (тяжелые металлы, галогены, надкислоты).
Заявленное техническое решение иллюстрируется следующими примерами конкретного выполнения.
Пример 1
Готовят 0,5% раствор окисленного декстрана с м.М. 40 кДа. Для этого 0,5 г окисленного декстрана с м.М. 40 кДа растворяют в 99,5 мл дистиллированной воды. Полученный раствор охлаждают до комнатной температуры и фильтруют через микропористые фильтры с диаметром пор 0,2 мкм в стерильные флаконы.
Степень восстановления численной плотности сперматозоидов в просвете семенных канальцев у крыс на модели ЛПС индуцированного нарушения сперматогенеза составила 95%.
Пример 2
Готовят 2,0% раствор окисленного декстрана с м.М. 60 кДа. Для этого 2,0 г окисленного декстрана с м.М. 60 кДа растворяют в 98 мл дистиллированной воды. Полученный раствор охлаждают до комнатной температуры и фильтруют через микропористые фильтры с диаметром пор 0,2 мкм в стерильные флаконы.
Степень восстановления численной плотности сперматозоидов в просвете семенных канальцев у крыс на модели ЛПС индуцированного нарушения сперматогенеза составила 99%.
Пример 3
Готовят 1,0% раствор окисленного декстрана с м.М. 40 кДа. Для этого 1,0 г окисленного декстрана с м.М. 40 кДа растворяют в 99 мл дистиллированной воды. Полученный раствор охлаждают до комнатной температуры и фильтруют через микропористые фильтры с диаметром пор 0,2 мкм в стерильные флаконы.
Степень восстановления численной плотности сперматозоидов в просвете семенных канальцев у крыс на модели ЛПС индуцированного нарушения сперматогенеза составила 97%.
Пример 4
Готовят 1,5% раствор окисленного декстрана с м.М. 40 кДа. Для этого 1,5 г окисленного декстрана с м.М. 40 кДа растворяют в 98,5 мл дистиллированной воды. Полученный раствор охлаждают до комнатной температуры и фильтруют через микропористые фильтры с диаметром пор 0,2 мкм в стерильные флаконы.
Степень восстановления численной плотности сперматозоидов в просвете семенных канальцев у крыс на модели ЛПС индуцированного нарушения сперматогенеза составила 98%.
Пример 5
Готовят 1,7% раствор окисленного декстрана с м.М. 60 кДа. Для этого 1,7 г окисленного декстрана с м.М. 60 кДа растворяют в 98,3 мл дистиллированной воды. Полученный раствор охлаждают до комнатной температуры и фильтруют через микропористые фильтры с диаметром пор 0,2 мкм в стерильные флаконы.
Степень восстановления численной плотности сперматозоидов в просвете семенных канальцев у крыс на модели ЛПС индуцированного нарушения сперматогенеза составила 97%.
| название | год | авторы | номер документа |
|---|---|---|---|
| Средство для профилактики интерстициальной пневмонии | 2020 |
|
RU2747550C1 |
| Средство и способ профилактики интерстициальной пневмонии инфекционной этиологии | 2021 |
|
RU2784177C1 |
| СПОСОБ СТИМУЛЯЦИИ СПЕРМАТОГЕННОЙ И АНДРОГЕНПРОДУЦИРУЮЩЕЙ ФУНКЦИИ МУЖСКИХ ПОЛОВЫХ ЖЕЛЕЗ | 1991 |
|
RU2040258C1 |
| СПОСОБ СТИМУЛЯЦИИ СПЕРМАТОГЕНЕЗА | 2016 |
|
RU2652902C1 |
| СПОСОБ СТИМУЛЯЦИИ НАРУШЕННОГО СПЕРМАТОГЕНЕЗА И СИНТЕЗА ТЕСТОСТЕРОНА С ПОМОЩЬЮ ТРАНСПЛАНТАЦИИ НЕОНАТАЛЬНОЙ ТЕСТИКУЛЯРНОЙ ТКАНИ | 2017 |
|
RU2669027C1 |
| СПОСОБ СТИМУЛЯЦИИ СПЕРМАТОГЕНЕЗА | 2016 |
|
RU2653779C1 |
| СПОСОБ ПРОТЕКЦИИ И ВОССТАНОВЛЕНИЯ СПЕРМАТОГЕНЕЗА ПРИ ОПЕРАТИВНЫХ ВМЕШАТЕЛЬСТВАХ НА СЕМЕННОМ КАНАТИКЕ, ЯИЧКЕ, ПРИДАТКЕ ЯИЧКА | 2020 |
|
RU2735888C2 |
| СПОСОБ ВТОРИЧНОЙ ПРОФИЛАКТИКИ НАРУШЕНИЙ СПЕРМАТОГЕНЕЗА ПРИ ВОЗДЕЙСТВИИ РАДИАЦИИ | 1999 |
|
RU2169571C2 |
| Фармацевтическая композиция для лечения или профилактики нарушений репродуктивной и эректильной функций у мужчин и ее применение | 2023 |
|
RU2825382C1 |
| СПОСОБ КОМПЛЕКСНОЙ СТИМУЛЯЦИИ СПЕРМАТОГЕНЕЗА | 2009 |
|
RU2406549C1 |
Изобретение относится к области медицины, в частности андрологии, и раскрывает применение средства, включающего окисленный декстран с м.М. 40-60 кДа в виде водного раствора с концентрацией 0,5-2,0 мас. %, для лечения и профилактики инфекционно-воспалительных нарушений сперматогенеза. Техническим результатом изобретения является повышение эффективности лечения и профилактики инфекционно-воспалительных нарушений сперматогенеза на ранних стадиях, а также расширение арсенала лечебно-профилактических средств. 1 табл., 5 пр.
Применение средства для лечения и профилактики инфекционно-воспалительных нарушений сперматогенеза, включающего окисленный декстран с м.М. 40-60 кДа в виде водного раствора с концентрацией 0,5-2,0 мас. %.
| Ректальное лекарственное средство коррекции нарушений сперматогенеза при мужской инфертильности | 2017 |
|
RU2686334C2 |
| СПОСОБ ЛЕЧЕНИЯ МУЖСКОГО БЕСПЛОДИЯ | 1995 |
|
RU2101017C1 |
| CN 108685874 A, 23.10.2018 | |||
| Средство для снижения патоморфологических изменений при гиперплазии предстательной железы | 2020 |
|
RU2740946C1 |
| Способ получения окисленного декстрана | 2016 |
|
RU2618341C1 |
| АЛЧИНБАЕВ М.К | |||
| и др | |||
| Новые подходы к лечению патоспермии | |||
| Урология | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| С | |||
| Приспособление для автоматической односторонней разгрузки железнодорожных платформ | 1921 |
|
SU48A1 |
Авторы
Даты
2024-03-01—Публикация
2023-07-13—Подача