ДАННЫЕ, ОТНОСЯЩИЕСЯ К ЗАЯВКЕ
Настоящая заявка испрашивает приоритет на основании австралийской патентной заявки № 2015904924, озаглавленной «CD131-связывающие белки и их применения», поданной 27 ноября 2015 года. Содержание ее полностью включено в настоящую заявку посредством ссылки.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка подана со списком последовательностей в электронном виде. Содержания перечня последовательностей полностью включены в настоящую заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к CD131-связывающим белкам и соединениям и их применениям.
УРОВЕНЬ ТЕХНИКИ
Плейотропные цитокины интерлейкин (IL)-3 (IL-3), IL-5 и гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) играют критические и частично дублирующие роли в дифференциации и функции миелоидных клеток. Они являются важными посредниками в защите хозяина и играют важную роль во врожденном иммунитете, но также могут вносить значительный вклад в развитие и прогрессирование воспалительных патологий, включая воспалительные заболевания дыхательных путей, такие как астма, хронический риносинусит с назальным полипозом и без него (CRSwNP, CRSsNP), хроническая обструктивная болезнь легких (ХОБЛ, chronic obstructive pulmonary disease (COPD)) и синдром перекрытия астмы и COPD (asthma-COPD overlap syndrome (ACOS)). GM-CSF также вовлечен в аутоиммунные состояния, такие как ревматоидный артрит, и IL-3 играет определенную роль в таких состояниях, как лейкемия. Экспрессия GM-CSF повышается в мокроте, бронхоальвеолярной лаважной жидкости (bronchoalveolar lavage fluid (BALF)) и бронхиальной биопсии при развитии астмы и COPD. IL-3 действует на ранних стадиях гемопоэза и синергизирует с другими факторами роста для развития системы кроветворения. Он также модулирует активность зрелых типов клеток, таких как моноциты, дендритные клетки, мегакариоциты, тучные клетки, и может активировать эозинофилы и простые базофилы для высвобождения гистамина. Фактор роста базофилов, повышенные уровни IL-3 в BALF, как правило, присутствуют после сенсибилизации аллергеном. IL-5 более зависит от типа клеток, регулируя производство и высвобождение зрелых эозинофилов из костного мозга в кровоток. Повышенные уровни IL-5 были обнаружены в сыворотке крови и жидкости из дыхательных путей пациентов с астмой. У пациентов с астмой ингаляция IL-5 увеличивала AHR, а также привлечение активированных эозинофилов в дыхательные пути.
Общим свойством IL-3, IL-5 и GM-CSF является то, что каждый их них посылает сигнал через мультимерный рецептор, состоящий из общей для всех β-цепи (цепь βc или CD131) и цитокин-специфической α-цепи.
Следствием свидетельств, подтверждающих ключевую роль клеток миелоидной линии и IL-3, IL-5 и GM-CSF в развитии и прогрессе воспалительного заболевания дыхательных путей, является то, что ряд терапевтических антител, нацеленных на отдельные цитокины или рецепторные α-цепи, находятся в стадии клинической разработки. Хотя данные средства могут оказаться применимыми в отдельных подгруппах пациентов, вполне вероятно, что их более широкое применение будет ограничено как избыточной, так и перекрывающейся функцией молекул, на которые они нацелены, а также различной природой воспалительного клеточного инфильтрата, который может служить основой астмы. Например, исследования антитела меполизумаба против IL-5 показали, что нацеливание только на IL-5 не влияет на обструкцию дыхательных путей или гиперреактивность дыхательных путей у пациентов с астмой.
Специалисту в данной области будет ясно, на основании вышеизложенного, что существует потребность в соединениях (например, антителах и белках, полученных из антител), которые могут лечить состояния, опосредуемые IL-3, IL-5 и/или GM-CSF.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
При подготовке настоящего изобретения авторы изобретения стремились получить реагенты (например, антитела и белки, содержащие антигенсвязывающие домены), которые связываются с CD131 и нейтрализуют передачу сигналов посредством IL-3, IL-5 и GM-CSF. Авторы изобретения получили серию антител, обладающих такой активностью, некоторые из которых эффективно нейтрализуют передачу сигналов посредством IL-3, IL-5 и GM-CSF, например, предотвращают пролиферацию TF-1-клетки в ответ на каждый из данных цитокинов, среди других многочисленных тестов. Авторы изобретения также выполнили картографирование эпитопов и обнаружили, что антитела связывались с CD131 внутри области, обозначенной «сайт 2 (Site 2)», а также обнаружили, что определенные остатки внутри сайта 2, которые важны для связывания IL-3, IL-5 и GM-CSF, также важны для связывания антител.
Авторы изобретения дополнительно показали, что полученное ими антитело способно снизить выживаемость воспалительных клеток у людей, страдающих болезнью дыхательных путей (например, астмой и/или назальным полипозом). Такое подавление выживаемости воспалительных клеток было больше, чем то, которое наблюдалось с использованием текущего стандарта лечения воспалительных заболеваний дыхательных путей, таких как астма (то есть преднизолона). Используя модель ксенотрансплантата назального полипоза, авторы изобретения показали, что полученное ими антитело уменьшило размер и массу полипов и количество В-клеток, проникающих в полипы, по сравнению с контрольным антителом.
Авторы изобретения также показали, что нейтрализация передачи сигналов посредством IL-3, IL-5 и GM-CSF является эффективным способом снижения выживаемости эозинофилов, например, для лечения эозинофилии. Это было показано с использованием антитела по настоящему изобретению, которое связывается с CD131, или с использованием комбинирования антител против каждого из IL-3Rα, IL-5R и GM-CSF-R. Хотя комбинирование антител было эффективным в снижении выживаемости эозинофилов, антитело по настоящему изобретению было более эффективным.
Исходя из вышеизложенного специалисту в данной области техники будет очевидно, что авторы изобретения продуцировали белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен способен связываться или специфически связываться с CD131 и нейтрализовать передачу сигналов посредством IL-3, IL-5 и GM-CSF. Авторы изобретения также разработали способы лечения различных состояний и/или снижения выживаемости эозинофилов путем нейтрализации передачи сигналов посредством IL-3, IL-5 и GM-CSF, например, с использованием белка по настоящему изобретению.
В одном примере настоящее изобретение относится к CD131-связывающему белку, содержащему антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF, и где CD131-связывающий белок ингибирует GM-CSF-индуцированную пролиферацию эритролейкозных клеток TF-1 с IC50, составляющей по меньшей мере 700 нМ.
В одном примере CD131-связывающий белок ингибирует GM-CSF-индуцированную пролиферацию клеток TF-1 с IC50, составляющей по меньшей мере 600 нМ или 500 нМ. Например, IC50 составляет по меньшей мере около 460 нМ. Например, IC50 составляет по меньшей мере около 300 нМ, или 200 нМ, или 100 нМ. Например, IC50 составляет по меньшей мере около 460 нМ. Например, IC50 составляет по меньшей мере около 10 нМ или 5 нМ или 1 нМ. В одном примере IC50 составляет по меньшей мере около 1 нМ. Например, IC50 составляет по меньшей мере около 0,9 нМ, или 0,8 нМ, или 0,6 нМ. В одном примере IC50 составляет по меньшей мере около 0,5 нМ. В одном примере IC50 составляет по меньшей мере около 0,4 нМ. В одном примере IC50 составляет по меньшей мере около 0,3 нМ.
В одном примере CD131-связывающий белок ингибирует индуцированную IL-3 пролиферацию клеток TF-1 с IC50, составляющей по меньшей мере 600 нМ или 500 нМ. Например, IC50 составляет по меньшей мере около 460 нМ. Например, IC50 составляет по меньшей мере около 300 нМ, или 200 нМ, или 100 нМ. Например, IC50 составляет по меньшей мере около 10 нМ, или 5 нМ, или 1 нМ. В одном примере IC50 составляет по меньшей мере около 1 нМ. Например, IC50 составляет по меньшей мере около 0,9 нМ, или 0,8 нМ, или 0,6 нМ. В одном примере IC50 составляет по меньшей мере около 0,5 нМ. В одном примере IC50 составляет по меньшей мере около 0,2 нМ или по меньшей мере около 0,1 нМ. В одном примере IC50 составляет по меньшей мере около 0,15 нМ.
В одном примере CD131-связывающий белок ингибирует IL-5-индуцированную пролиферацию клеток TF-1 с IC50, составляющей по меньшей мере 600 нМ или 500 нМ. Например, IC50 составляет по меньшей мере около 460 нМ. Например, IC50 составляет по меньшей мере около 300 нМ, или 200 нМ, или 100 нМ. Например, IC50 составляет по меньшей мере около 10 нМ, или 5 нМ, или 1 нМ. В одном примере IC50 составляет по меньшей мере около 5 нМ. Например, IC50 составляет по меньшей мере около 4 нМ. В одном примере IC50 составляет по меньшей мере около 4,5 нМ, или по меньшей мере около 4,6 нМ, или по меньшей мере около 4,7 нМ. В одном примере IC50 составляет по меньшей мере около 4,6 нМ.
Способы определения IC50 включают культивирование клеток TF-1 (например, около 1 × 104 TF-1 клеток) в присутствии CD131-связывающего белка (например, в течение по меньшей мере около 3 минут или 1 часа, например, около 30 минут) до добавления соответствующего фактора роста (GM-CSF, IL-3 и/или IL-5) и дальнейшее культивирование клеток (например, в течение по меньшей мере около 48 часов или по меньшей мере около 72 часов или по меньшей мере около 96 часов, например, около 72 часов), с последующим определением клеточной пролиферации. Пролиферацию клеток можно определить, выращивая клетки в присутствии 3[H]-тимидина в течение около 6 часов и определяя включение 3[H]-тимидина, например, с помощью жидкостного сцинтилляционного подсчета. Определяя пролиферацию при различных концентрациях CD131-связывающего белка, можно определить IC50.
В одном из примеров настоящее изобретение относится к CD131-связывающему белку, содержащему антигенсвязывающий домен антитела, в котором данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF в большей степени, чем антитело BION-1 (как описано в Sun et al., Blood, 94: 1943-1951, 1999).
Настоящее изобретение дополнительно обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с эпитопом внутри сайта 2 в CD131 и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF. В этой связи, специалист в данной области должен знать, что сайт 2 полипептида CD131 состоит из остатков из двух CD131-полипептидов, которые образуют димер, например, сайт 2 содержит остатки внутри петель A-B и E-F домена 1 одного CD131-полипептида и остатки внутри петель B-C и F-G другого CD131-полипептида.
В одном примере антигенсвязывающий домен связывается с эпитопом, образованным при димеризации двух CD131-полипептидов. Например, антигенсвязывающий домен связывается с остатками в домене 1 одного полипептида CD131 и остатками в домене 4 другого полипептида CD131.
В одном примере антигенсвязывающий домен связывается с эпитопом, содержащим одну или более аминокислот, соответствующих остаткам 39 и/или 103 в SEQ ID NO: 1.
В другом примере антигенсвязывающий домен связывается с эпитопом, содержащим одну или более аминокислот, соответствующих остаткам 338, 365, 367 и 368 в SEQ ID NO: 1.
В еще одном примере антигенсвязывающий домен связывается с эпитопом, образованным при димеризации двух полипептидов CD131, причем данный эпитоп содержит одну или более (или все) аминокислот, соответствующих остаткам 39 и 103 одного CD131-полипептида и остаткам 338, 365, 367 и 368 другого CD131-полипептида.
В другом примере настоящее изобретение обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с эпитопом внутри сайта 2 полипептида CD131 и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF, причем данный антигенсвязывающий домен связывается с эпитопом, включающим аминокислоты, участвующие в связывании IL-3, IL-5 и/или GM-CSF с CD131. Например, аминокислоты соответствуют остаткам 39, 103, 338, 365, 367 и 368 в SEQ ID NO: 1. Например, аминокислота соответствует остатку 39 в SEQ ID NO: 1. Например, остатки соответствуют остаткам 39 и 103 одного CD131-полипептида и остаткам 338, 365, 367 и 368 другого CD131-полипептида. Например, остатки соответствуют остатку 39 одного CD131-полипептида и остатку 365 и/или остатку 367 другого CD131-полипептида.
Настоящее изобретение дополнительно обеспечивает соединение, которое связывается с эпитопом внутри сайта 2 CD131-полипептида или специфически связывается с эпитопом внутри сайта 2 CD131-полипептида и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF. Например, данное соединение связывается с эпитопом, образованным при димеризации двух CD131-полипептидов. Например, данное соединение связывается с остатками в домене 1 одного полипептида CD131 и остатками в домене 4 другого полипептида CD131.
В одном примере соединение связывается с эпитопом, содержащим одну или более аминокислот, соответствующих остаткам 39 и/или 103 в SEQ ID NO: 1.
В другом примере соединение связывается с эпитопом, содержащим одну или более аминокислот, соответствующих остаткам 365 и 367 в SEQ ID NO: 1.
В другом примере соединение связывается с эпитопом, содержащим одну или более аминокислот, соответствующих остаткам 338, 365, 367 и 368 в SEQ ID NO: 1.
В еще одном примере соединение связывается с эпитопом, образованным при димеризации двух CD131-полипептидов, причем данный эпитоп содержит одну или более (или все) аминокислот, соответствующих остаткам 39 и 103 одного CD131-полипептида и остаткам 338, 365, 367 и 368 другого полипептида CD131.
Настоящее изобретение также обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и где CD131-связывающий белок связывается с одним или несколькими (или всеми) из следующих мутантных полипептидов(а):
(i) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 119;
(ii) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 123;
(iii) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 124;
(iv) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 135;
(v) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 131;
(vi) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 136;
(vii) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 137;
(viii) мутатный полипептид, содержащий последовательность, представленную в SEQ ID NO: 139;
(ix) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 145,
на уровне, который снижен по сравнению с уровнем связывания CD131-связывающего белка с полипептидом, содержащим последовательность, представленную в SEQ ID NO: 192.
Настоящее изобретение также обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и где CD131-связывающий белок связывается с мутантным полипептидом, содержащим последовательность, представленную в SEQ ID NO: 137, на уровне, который снижен по сравнению с уровнем связывания CD131-связывающего белка с полипептидом, содержащим последовательность, представленную в SEQ ID NO: 192.
Настоящее изобретение также обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и где CD131-связывающий белок связывается с мутантным полипептидом, содержащим последовательность, представленную в SEQ ID NO: 139, на уровне, который снижен по сравнению с уровнем связывания CD131-связывающего белка с полипептидом, содержащим последовательность, представленную в SEQ ID NO: 192.
В одном примере уровень связывания (например, определяемый посредством KD) CD131-связывающего белка с мутантным полипептидом уменьшается по меньшей мере в около 3 раз или 4 раз или 5 раз или 10 раз. Например, уровень связывания с мутантным полипептидом снижается по меньшей мере в около 20 или 50 раз или 100 раз.
В одном примере, аффинность (KD) CD131-связывающего белка по отношению к мутантному полипептиду составляет около 4 × 10-6 или более, например, 4,5 × 10-6 или 1 × 10-5.
В одном примере настоящее изобретение обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF, и где CD131-связывающий белок предпочтительно связывается с полипептидом, содержащим последовательность, представленную в SEQ ID NO: 192, по сравнению с одним или несколькими (или всеми) из следующего мутантного полипептида(ов):
(i) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 119;
(ii) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 124;
(iii) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 131;
(iv) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 137;
(v) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 139; или
(vi) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 140.
В одном примере CD131-связывающий белок не обнаруживает связывания или не связывается в значительной степени с мутантным полипептидом. Например, CD131-связывающий белок, который не обнаруживает связывания с одним или несколькими из следующих мутантных полипептидов, не связывается в значительной степени с одним или несколькими из следующего мутантного полипептида(ов):
(i) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 119;
(ii) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 124;
(iii) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 131; или
(iv) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 137.
В одном примере CD131-связывающий белок по настоящему изобретению связывается с полипептидом или перекрестно реагирует с полипептидом, содержащим последовательность, представленную в любой из SEQ ID NO: 117, 118, 120-123, 125-130, 132-136, 138 или 140-148.
В одном примере CD131-связывающий белок по настоящему изобретению связывается с полипептидом, содержащим последовательность, представленную в SEQ ID NO: 127, с более высокой аффинностью, чем с полипептидом, содержащим последовательность, представленную в SEQ ID NO: 192.
В одном примере CD131-связывающий белок по настоящему изобретению связывается или перекрестно реагирует с одним или несколькими из следующего мутантного полипептида(ов):
(i) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 135;
(ii) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 136; и/или
(iii) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 138.
Настоящее изобретение также обеспечивает соединение, которое связывается или специфически связывается с CD131 и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF, и где данное соединение связывается с одним или несколькими (или всеми) из следующего мутантного полипептида(ов):
(i) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 119;
(ii) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 124;
(iii) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 131;
(iv) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 137;
(v) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 139;
(vi) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 140,
на уровне, который снижен по сравнению с уровнем связывания соединения с полипептидом, содержащим последовательность, представленную в SEQ ID NO: 192.
Специалистам в данной области будут очевидны способы определения связывания CD131-связывающего белка с полипептидом. Например, полипептид иммобилизован на твердой или полутвердой поверхности, и CD131-связывающий белок контактирует с иммобилизованным полипептидом. Затем связывание определяют, например, поверхностным плазмонным резонансом.
Настоящее изобретение дополнительно обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и где CD131-связывающий белок конкурентно ингибирует связывание антитела 9А2 (содержащего VL, содержащую последовательность, представленную в SEQ ID NO: 5, и VH, содержащую последовательность, представленную в SEQ ID NO: 20) с CD131 и/или полипептидом, содержащим последовательность, представленную в SEQ ID NO: 192.
В одном примере настоящее изобретение относится к CD131-связывающему белку, содержащему антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF, и где CD131-связывающий белок конкурентно ингибирует связывание антитела 9А2 (содержащего VL, содержащий последовательность, представленную в SEQ ID NO: 5, и константную область легкой цепи каппа человека, и VH, содержащую последовательность, представленную в SEQ ID NO: 20, и константную область IgG4 человека) с CD131 и/или полипептидом, содержащим последовательность, представленную в SEQ ID NO: 192.
Настоящее изобретение дополнительно обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и где CD131-связывающий белок конкурентно ингибирует связывание антитела 9А2 (содержащего легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5, и тяжелую цепь, содержащую последовательность, представленную в SEQ ID NO: 20) с CD131 и/или полипептидом, содержащим последовательность, представленную в SEQ ID NO: 192.
Настоящее изобретение дополнительно обеспечивает соединение, которое связывается или специфически связывается с CD131 и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF и конкурентно ингибирует связывание одного или нескольких из следующих антител с CD131 и/или полипептидом, включающим последовательность, представленную в SEQ ID NO: 192:
(i) антитело, содержащее VL, содержащую последовательность, представленную в SEQ ID NO: 5, и VH, содержащую последовательность, представленную в SEQ ID NO: 20;
(ii) антитело, содержащее VL, содержащую последовательность, представленную в SEQ ID NO: 5, и константную область легкой цепи каппа человека, и VH, содержащую последовательность, представленную в SEQ ID NO: 20, и константную область IgG4 человека; и/или
(iii) антитело, содержащее легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5, и тяжелую цепь, содержащую последовательность, представленную в SEQ ID NO: 20.
Настоящее изобретение дополнительно или альтернативно обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF, и где данный антигенсвязывающий домен содержит по меньшей мере одно из:
(i) VH, содержащую определяющую комплементарность область (complementarity determining region (CDR)) 1, содержащую последовательность, по меньшей мере на около 40% идентичную последовательности, представленной между аминокислотами от 26 до 35 в SEQ ID NO: 20, CDR2, содержащую последовательность, по меньшей мере на около 65% идентичную последовательности, представленной между аминокислотами от 50 до 66 в SEQ ID NO: 20, и CDR3, содержащую последовательность, по меньшей мере на около 44% идентичную последовательности, представленной между аминокислотами от 99 до 106 в SEQ ID NO: 20;
(ii) VH, содержащую последовательность, по меньшей мере на около 89% или 90%, или 91%, или 92%, или 93%, или 94%, или 95%, или 96%, или 97%, или 98%, или 99% идентичную последовательности, представленной в любой из SEQ ID NO: 20, 25, 37, 59, 63, 64, 65, 68, 69, 72 или 101;
(iii) VL, содержащую CDR1, содержащую последовательность, по меньшей мере на около 45% идентичную последовательности, представленной между аминокислотами от 24 до 34 в SEQ ID NO: 5, CDR2, содержащую последовательность, обозначенную между аминокислотами от 44 до 51 в SEQ ID NO: 5, и CDR3, содержащую последовательность, по меньшей мере на около 44% идентичную последовательности, представленной между аминокислотами от 89 до 97 в SEQ ID NO: 5;
(iv) VL, содержащую последовательность, по меньшей мере на около 94% или 95%, или 96%, или 97%, или 98%, или 99% идентичную последовательности, представленной в SEQ ID NO: 5;
(v) VH, содержащую CDR1, содержащую последовательность, обозначенную между аминокислотами от 26 до 35 в SEQ ID NO: 180, CDR2, содержащую последовательность, представленную между аминокислотами от 50 до 66 в SEQ ID NO: 180, и CDR3, содержащую последовательность, представленную между аминокислотами от 99 до 106 в SEQ ID NO: 180;
(vi) VH, содержащую последовательность, представленную в SEQ ID NO: 180;
(vii) VL, содержащую CDR1, содержащую последовательность, представленную между аминокислотами от 24 до 34 в SEQ ID NO: 177, CDR2, содержащую последовательность, представленную между аминокислотами от 44 до 51 в SEQ ID NO: 177, и CDR3, содержащую последовательность, представленную между аминокислотами от 89 до 97 в SEQ ID NO: 177;
(viii) VL, содержащую последовательность, представленную в SEQ ID NO: 177;
(ix) VL, содержащую аминокислотную последовательность, представленную в SEQ ID NO: 5;
(x) VH, как изложено в (i), и VL, как изложено в (iii);
(xi) VH, как изложено в (i) и VL, как изложено в (iv);
(xii) VH, как изложено в (i), и VL, как изложено в (ix);
(xiii)) VH, как изложено в (ii), и VL, как изложено в (iii);
(xiv) VH, как изложено в (ii), и VL, как изложено в (iv);
(xv) VH, как изложено в (ii), и VL, как изложено в (ix);
(xvi) VH, как изложено в (v), и VL, как изложено в (vii);
(xvii) VH, как изложено в (v), и VL, как изложено в (viii);
(xviii) VH, как изложено в (v), и VL, как изложено в (ix);
(xix) VH, как изложено в (vi), и VL, как изложено в (vii);
(хх) VH, как изложено в (vi), и VL, как изложено в (viii); или
(xxi) VH, как изложено в (vi), и VL, как изложено в (ix).
В одном примере ссылка в вышеприведенном абзаце(ах) на последовательности CDR в пределах определенной последовательности (то есть SEQ ID NO) будет пониматься следующим образом:
• для VH, CDR1 находится между аминокислотами от 26 до 35; CDR2 находится между аминокислотами от 50 до 66; и CDR3 находится между аминокислотами от 99 до 106; и
• для VL, CDR1 находится между аминокислотами от 24 до 34; CDR2 находится между аминокислотами от 44 до 51; и CDR3 находится между аминокислотами от 89 до 97.
В одном примере антигенсвязывающий домен содержит VH, содержащую последовательность, представленную в SEQ ID NO: 193, и VL, содержащую последовательность, представленную в SEQ ID NO: 5.
Настоящее изобретение дополнительно или альтернативно обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF, и где данный антигенсвязывающий домен содержит VL, содержащую последовательность, представленную в SEQ ID NO: 5.
Настоящее изобретение дополнительно или альтернативно обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF, и где данный антигенсвязывающий домен содержит VL, содержащую последовательность, представленную в SEQ ID NO: 5 (или содержащий последовательности CDR из VL, содержащие последовательность, представленную в SEQ ID NO: 5), и причем данный антигенсвязывающий домен содержит VH, содержащую CDR2, как изложено в любой из SEQ ID NO: 49, 52, 53, 56, 57, 59, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 80, 81, 83, 88, 91, 92, 93, 94, 95, 99, 100, 101, 102, 103, 114 или 195. В одном примере антигенсвязывающий домен содержит VH, содержащую CDR2, как изложено в любой из SEQ ID NO: 59, 63, 64, 65, 68, 69, 72 или 100.
Настоящее изобретение дополнительно или альтернативно обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит VL, содержащую последовательность, представленную в SEQ ID NO: 5 (или содержащий последовательности CDR из VL, содержащие последовательность, представленную в SEQ ID NO: 5), и причем данный антигенсвязывающий домен содержит VH, содержащую CDR2 и CDR3, как изложено в любой из SEQ ID NO: 49, 52, 53, 56, 57, 59, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 80, 81, 83, 88, 91, 92, 93, 94, 95, 99, 100, 101, 102, 103, 114, 115, 116, 182, 186 или 195. В одном примере антигенсвязывающий домен содержит VH, содержащую CDR2 и CDR3, как изложено в любой из SEQ ID NO: 59, 63, 64, 65, 68, 69, 72 или 100.
Настоящее изобретение дополнительно или альтернативно обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит VL, содержащую последовательность, представленную в SEQ ID NO: 5 (или содержащий последовательности CDR из VL, содержащие последовательность, представленную в SEQ ID NO: 5), и причем данный антигенсвязывающий домен содержит VH, содержащую CDR1 и CDR3, как изложено в любой из SEQ ID NO: 49, 52, 53, 56, 57, 59, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 80, 81, 83, 88, 91, 92, 93, 94, 95, 99, 100, 101, 102, 103, 114, 115, 116, 182, 186 или 195. В одном примере антигенсвязывающий домен содержит VH, содержащую CDR1 и CDR3, как изложено в любой из SEQ ID NO: 59, 63, 64, 65, 68, 69, 72 или 100. В одном примере антигенсвязывающий домен содержит VH, содержащую CDR1 и CDR3, как изложено в SEQ ID NO: 25.
В одном примере ссылка в вышеприведенном абзаце(ах) на последовательности CDR в пределах определенной последовательности (то есть SEQ ID NO) будет пониматься следующим образом:
• для VH, CDR1 находится между аминокислотами от 26 до 35; CDR2 находится между аминокислотами от 50 до 66; и CDR3 находится между аминокислотами от 99 до 106; а также
• для VL, CDR1 находится между аминокислотами от 24 до 34; CDR2 находится между аминокислотами от 44 до 51; и CDR3 находится между аминокислотами от 89 до 97.
Настоящее изобретение дополнительно или альтернативно обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит:
(i) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ii) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(iii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 6;
(iv) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 6;
(v) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 7;
(vi) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 7;
(vii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 8;
(viii) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 8;
(ix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 9;
(x) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 9;
(xi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 10;
(xii) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 10;
(xiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 11;
(xiv) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 11;
(xv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 12;
(xvi) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 12;
(xvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 13;
(xviii) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 13;
(xix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 14;
(xx) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 14;
(xxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 15;
(xxii) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 15;
(xxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 16;
(xxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 16;
(xxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 17;
(xxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 17;
(xxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 18;
(xxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 18;
(xxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 19;
(xxx) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 19;
(xxxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 21, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 21, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 22, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 22, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 23, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 23, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 24, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 24, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 25, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xl) VH, содержащую последовательность, представленную в SEQ ID NO: 25, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xli) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 26, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xlii) VH, содержащую последовательность, представленную в SEQ ID NO: 26, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xliii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 27, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xliv) VH, содержащую последовательность, представленную в SEQ ID NO: 27, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xlv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 28, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xlvi) VH, содержащую последовательность, представленную в SEQ ID NO: 28, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xlvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 29, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xlviii) VH, содержащую последовательность, представленную в SEQ ID NO: 29, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xlix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 30, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(l) VH, содержащую последовательность, представленную в SEQ ID NO: 30, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(li) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 31, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lii) VH, содержащую последовательность, представленную в SEQ ID NO: 31, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(liii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 32, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(liv) VH, содержащую последовательность, представленную в SEQ ID NO: 32, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 33, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lvi) VH, содержащую последовательность, представленную в SEQ ID NO: 33, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 34, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lviii) VH, содержащую последовательность, представленную в SEQ ID NO: 34, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 35, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(1x) VH, содержащую последовательность, представленную в SEQ ID NO: 35, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 36, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxii) VH, содержащую последовательность, представленную в SEQ ID NO: 36, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 37, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 37, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxv) VH, содержащего последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 38, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 38, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 39, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5
(lxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 39, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 40, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxx) VH, содержащую последовательность, представленную в SEQ ID NO: 40, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 41, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 41, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 42, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 42, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 43, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 43, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 44, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 44, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 45, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxx) VH, содержащую последовательность, представленную в SEQ ID NO: 45, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 46, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 46, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 47, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 47, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 48, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 48, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 49, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 49, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 50, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xc) VH, содержащую последовательность, представленную в SEQ ID NO: 50, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xci) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 51, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xcii) VH, содержащую последовательность, представленную в SEQ ID NO: 51, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xciii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 52, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xciv) VH, содержащую последовательность, представленную в SEQ ID NO: 52, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xcv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 53, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xcvi) VH, содержащую последовательность, представленную в SEQ ID NO: 53, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xcvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 54, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xcviii) VH, содержащую последовательность, представленную в SEQ ID NO: 54, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xcix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 55, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(c) VH, содержащую последовательность, представленную в SEQ ID NO: 55, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ci) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 56, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cii) VH, содержащую последовательность, представленную в SEQ ID NO: 56, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ciii) VH, содержащую последовательности CDR 1, 2 и 3, изложенной в SEQ ID NO: 57, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(civ) VH, содержащую последовательность, представленную в SEQ ID NO: 57, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 58, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cvi) VH, содержащую последовательность, представленную в SEQ ID NO: 58, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(сvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 59, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(сviii) VH, содержащую последовательность, представленную в SEQ ID NO: 59, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 60, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cx) VH, содержащую последовательность, представленную в SEQ ID NO: 60, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 61, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxii) VH, содержащую последовательность, представленную в SEQ ID NO: 61, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 62, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 62, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 63, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 63, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 64, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 64, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 65, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxx) VH, содержащую последовательность, представленную в SEQ ID NO: 65, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 66, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 66, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 67, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 67, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 68, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 68, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 69, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 69, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 70, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxx) VH, содержащую последовательность, представленную в SEQ ID NO: 70, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 71, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 71, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 72, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 72, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 73, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 73, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 75, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 75, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 76, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxl) VH, содержащую последовательность, представленную в SEQ ID NO: 76, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxli) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 77, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxlii) VH, содержащую последовательность, представленную в SEQ ID NO: 77, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxliii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 78, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxliv) VH, содержащую последовательность, представленную в SEQ ID NO: 78, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxlv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 79, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxlvi) VH, содержащую последовательность, представленную в SEQ ID NO: 79, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxlvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 80, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxlviii) VH, содержащую последовательность, представленную в SEQ ID NO: 80, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxlix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 81, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cl) VH, содержащую последовательность, представленную в SEQ ID NO: 81, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cli) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 82, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clii) VH, содержащую последовательность, представленную в SEQ ID NO: 82, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cliii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 83, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cliv) VH, содержащую последовательность, представленную в SEQ ID NO: 83, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 84, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clvi) VH, содержащую последовательность, представленную в SEQ ID NO: 84, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 85, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clviii) VH, содержащую последовательность, представленную в SEQ ID NO: 85, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 86, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clx) VH, содержащую последовательность, представленную в SEQ ID NO: 86, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 87, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxii) VH, содержащую последовательность, представленную в SEQ ID NO: 87, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 88, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 88, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 89, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 89, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 90, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 90, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 91, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxx) VH, содержащую последовательность, представленную в SEQ ID NO: 91, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 92, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 92, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 93, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 93, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 94, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 94, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 95, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 95, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 96, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxx) VH, содержащую последовательность, представленную в SEQ ID NO: 96, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 97, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 97, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 98, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 98, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 99, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 99, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 100, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 100, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 101, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxc) VH, содержащую последовательность, представленную в SEQ ID NO: 101, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxci) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 102, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxcii) VH, содержащую последовательность, представленную в SEQ ID NO: 102, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxciii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 103, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxciv) VH, содержащую последовательность, представленную в SEQ ID NO: 103, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxcv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 104, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxcvi) VH, содержащую последовательность, представленную в SEQ ID NO: 104, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxcvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 105, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxcviii) VH, содержащую последовательность, представленную в SEQ ID NO: 105, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxcix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 106, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cc) VH, содержащую последовательность, представленную в SEQ ID NO: 106, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cci) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 107, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccii) VH, содержащую последовательность, представленную в SEQ ID NO: 107, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cciii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 108, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cciv) VH, содержащую последовательность, представленную в SEQ ID NO: 108, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 109, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccvi) VH, содержащую последовательность, представленную в SEQ ID NO: 109, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 110, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccviii) VH, содержащую последовательность, представленную в SEQ ID NO: 110, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 111, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccx) VH, содержащую последовательность, представленную в SEQ ID NO: 111, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 112, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccxii) VH, содержащую последовательность, представленную в SEQ ID NO: 112, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 113, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 113, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 114, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 114, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 115, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 115, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 116, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5; или
(ccxx) VH, содержащую последовательность, представленную в SEQ ID NO: 116, и VL, содержащую последовательность, представленную в SEQ ID NO: 5.
В одном примере ссылка в вышеприведенном абзаце(ах) на CDR в пределах определенной последовательности (то есть SEQ ID NO) будет пониматься следующим образом:
• Для VH, CDR1 находится между аминокислотами от 26 до 35; CDR2 находится между аминокислотами от 50 до 66; и CDR3 находится между аминокислотами от 99 до 106; а также
• Для VL, CDR1 находится между аминокислотами от 24 до 34; CDR2 находится между аминокислотами от 44 до 51; и CDR3 находится между аминокислотами от 89 до 97.
Настоящее изобретение дополнительно или альтернативно обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит:
(i) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 49, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ii) VH, содержащую последовательность, представленную в SEQ ID NO: 49, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(iii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 52, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(iv) VH, содержащую последовательность, представленную в SEQ ID NO: 52, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(v) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 53, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(vi) VH, содержащую последовательность, представленную в SEQ ID NO: 53, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(vii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 56, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(viii) VH, содержащую последовательность, представленную в SEQ ID NO: 56, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 57, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(x) VH, содержащую последовательность, представленную в SEQ ID NO: 57, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 59, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xii) VH, содержащую последовательность, представленную в SEQ ID NO: 59, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xiii)) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 61, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xiv) VH, содержащую последовательность, представленную в SEQ ID NO: 61, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 62, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xvi) VH, содержащую последовательность, представленную в SEQ ID NO: 62, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 63, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xviii) VH, содержащую последовательность, представленную в SEQ ID NO: 63, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 64, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xx) VH, содержащую последовательность, представленную в SEQ ID NO: 64, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 65, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxii) VH, содержащую последовательность, представленную в SEQ ID NO: 65, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 66, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 66, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 67, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 67, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 68, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 68, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 69, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxx) VH, содержащую последовательность, представленную в SEQ ID NO: 69, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 70, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 70, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 71, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 71, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 72, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 72, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 73, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 73, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 75, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xl) VH, содержащую последовательность, представленную в SEQ ID NO: 75, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xli) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 76, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xlii) VH, содержащую последовательность, представленную в SEQ ID NO: 76, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xliii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 77, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xliv) VH, содержащую последовательность, представленную в SEQ ID NO: 77, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xlv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 78, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xlvi) VH, содержащую последовательность, представленную в SEQ ID NO: 78, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xlvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 80, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xlviii) VH, содержащую последовательность, представленную в SEQ ID NO: 80, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xlix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 81, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(l) VH, содержащую последовательность, представленную в SEQ ID NO: 81, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(li) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 83, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lii) VH, содержащую последовательность, представленную в SEQ ID NO: 83, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(liii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 88, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(liv) VH, содержащую последовательность, представленную в SEQ ID NO: 88, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 91, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lvi) VH, содержащую последовательность, представленную в SEQ ID NO: 91, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 92, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lviii) VH, содержащую последовательность, представленную в SEQ ID NO: 92, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 93, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lx) VH, содержащую последовательность, представленную в SEQ ID NO: 93, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 94, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxii) VH, содержащую последовательность, представленную в SEQ ID NO: 94, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 95, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 95, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 99, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 99, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 100, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 100, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 101, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxx) VH, содержащую последовательность, представленную в SEQ ID NO: 101, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 102, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 102, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности VH, представленной в SEQ ID NO: 103, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 103, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 114, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 114, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 115, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 115, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 116, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5; или
(lxxx) VH, содержащую последовательность, представленную в SEQ ID NO: 116, и VL, содержащую последовательность, представленную в SEQ ID NO: 5
В одном примере ссылка в вышеприведенном абзаце(ах) на последовательности CDR в пределах определенной последовательности (то есть SEQ ID NO) будет пониматься следующим образом:
• для VH, CDR1 находится между аминокислотами от 26 до 35; CDR2 находится между аминокислотами от 50 до 66; и CDR3 находится между аминокислотами от 99 до 106; а также
• для VL, CDR1 находится между аминокислотами от 24 до 34; CDR2 находится между аминокислотами от 44 до 51; и CDR3 находится между аминокислотами от 89 до 97.
Настоящее изобретение также обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 59, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5; или
Настоящее изобретение также обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит VH, содержащую последовательность, представленную в SEQ ID NO: 59, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
Настоящее изобретение также обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 63, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
Настоящее изобретение также обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит VH, содержащую последовательность, представленную в SEQ ID NO: 63, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
Настоящее изобретение также обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 64, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
Настоящее изобретение также обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит VH, содержащую последовательность, представленную в SEQ ID NO: 64, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
Настоящее изобретение также обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 65, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
Настоящее изобретение также обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит VH, содержащую последовательность, представленную в SEQ ID NO: 65, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
Настоящее изобретение также обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 68, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
Настоящее изобретение также обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит VH, содержащую последовательность, представленную в SEQ ID NO: 68, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
Настоящее изобретение также обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 69, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
Настоящее изобретение также обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит VH, содержащую последовательность, представленную в SEQ ID NO: 69, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
Настоящее изобретение также обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 72, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
Настоящее изобретение также обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит VH, содержащую последовательность, представленную в SEQ ID NO: 72, и VL, содержащую последовательность, представленную в SEQ ID NO: 5; или
Настоящее изобретение также обеспечивает CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем данный антигенсвязывающий домен связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 100, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5.
В одном примере ссылка в вышеприведенном абзаце(ах) на последовательности CDR в пределах определенной последовательности (то есть SEQ ID NO) будет пониматься следующим образом:
• для VH, CDR1 находится между аминокислотами от 26 до 35; CDR2 находится между аминокислотами от 50 до 66; и CDR3 находится между аминокислотами от 99 до 106; а также
• для VL, CDR1 находится между аминокислотами от 24 до 34; CDR2 находится между аминокислотами от 44 до 51; и CDR3 находится между аминокислотами от 89 до 97.
В одном примере, CD131-связывающий белок, описанный в настоящем изобретении, содержит, по меньшей мере, VH и VL, причем VH и VL связываются с образованием Fv, содержащего антигенсвязывающий домен. Специалист в данной области техники поймет, что антигенсвязывающий домен содержит сайт связывания антитела.
В одном примере VH и VL находятся в одной полипептидной цепи. Например, белок представляет собой:
(i) одноцепочечный фрагмент Fv (scFv);
(ii) димерный scFV(di-scFv);
(iii) один из (i) или (ii), связанный с константной областью антитела, Fc или константным доменом тяжелой цепи (CH)2 и/или CH3; или
(iv) один из (i) или (ii), связанный с белком, который связывается с иммунной эффекторной клеткой.
В одном примере VH и VL находятся в отдельных полипептидных цепях.
Например, белок представляет собой:
(i) диатело;
(ii) триотело;
(iii) тетратело;
(iv) Fab;
(v) F(ab’)2;
(vi) Fv;
(vii) один из от (i) до (vi), связанный с константной областью антитела, Fc или константным доменом тяжелой цепи (CH)2 и/или CH3;
(viii) один из от (i) до (vi), связанный с белком, который связывается с иммунной эффекторной клеткой.
Вышеупомянутые белки (описанные в предыдущих двух списках) также можно назвать антигенсвязывающими доменами антител.
В одном примере белок представляет собой антитело, например моноклональное антитело. В одном примере антитело представляет собой «голое антитело» (naked antibody).
В одном примере белок (или антитело) является химерным, деиммунизированным, гуманизированным, человеческим или приматизированным.
В одном примере белок или антитело является человеческим. Например, настоящее изобретение обеспечивает антитело, которое связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF и где антитело содержит антигенсвязывающий домен или VH и/или VL, как описано в любом примере в настоящем изобретении.
В одном примере антитело по настоящему изобретению содержит VL, содержащую последовательность, представленную в любой из SEQ ID NO: 5-19, например, в SEQ ID NO: 5.
В одном примере антитело по настоящему изобретению содержит VL, содержащую последовательность, представленную в SEQ ID No: 179.
В одном примере антитело, описанное в описании, содержит VH, содержащую последовательность, представленную в любой из SEQ ID NO: от 20 до 116.
В одном примере антитело по настоящему изобретению содержит VH, содержащую последовательность, представленную в любой из SEQ ID NO: 182, 186 или 90.
В одном примере настоящее изобретение обеспечивает CD131-связывающее антитело, которое связывается или специфически связывается с CD131 и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит:
(i) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ii) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(iii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 6;
(iv) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 6;
(v) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 7;
(vi) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 7;
(vii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 8;
(viii) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 8;
(ix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 9;
(x) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 9;
(xi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 10;
(xii) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 10;
(xiii)) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 11;
(xiv) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 11;
(xv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 12;
(xvi) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 12;
(xvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 13;
(xviii) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 13;
(xix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 14;
(xx) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 14;
(xxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 15;
(xxii) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 15;
(xxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 16;
(xxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 16;
(xxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 17;
(xxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 17;
(xxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 18;
(xxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 18;
(xxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 19;
(xxx) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и VL, содержащую последовательность, представленную в SEQ ID NO: 19;
(xxxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 21, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 21, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 22, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 22, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 23, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 23, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 24, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 24, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 25, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xl) VH, содержащую последовательность, представленную в SEQ ID NO: 25, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xli) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 26, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xlii) VH, содержащую последовательность, представленную в SEQ ID NO: 26, и VL,содержащую последовательность, представленную в SEQ ID NO: 5;
(xliii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 27, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xliv) VH, содержащую последовательность, представленную в SEQ ID NO: 27, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xlv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 28, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xlvi) VH, содержащую последовательность, представленную в SEQ ID NO: 28, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xlvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 29, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xlviii) VH, содержащую последовательность, представленную в SEQ ID NO: 29, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xlix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 30, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(l) VH, содержащую последовательность, представленную в SEQ ID NO: 30, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(li) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 31, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lii) VH, содержащую последовательность, представленную в SEQ ID NO: 31, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(liii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 32, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(liv) VH, содержащую последовательность, представленную в SEQ ID NO: 32, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 33, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lvi) VH, содержащую последовательность, представленную в SEQ ID NO: 33, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 34, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lviii) VH, содержащую последовательность, представленную в SEQ ID NO: 34, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 35, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(1x) VH, содержащую последовательность, представленную в SEQ ID NO: 35, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 36, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxii) VH, содержащую последовательность, представленную в SEQ ID NO: 36, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 37, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 37, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 38, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 38, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 39, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 39, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 40, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxx) VH, содержащую последовательность, представленную в SEQ ID NO: 40, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 41, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 41, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 42, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 42, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 43, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 43, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxvii), VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 44, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 44, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 45, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxx) VH, содержащую последовательность, представленную в SEQ ID NO: 45, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 46, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 46, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 47, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 47, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 48, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 48, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 49, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 49, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 50, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xc) VH, содержащую последовательность, представленную в SEQ ID NO: 50, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xci) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 51, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xcii) VH, содержащую последовательность, представленную в SEQ ID NO: 51, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xciii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 52, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xciv) VH, содержащую последовательность, представленную в SEQ ID NO: 52, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xcv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 53, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xcvi) VH, содержащую последовательность, представленную в SEQ ID NO: 53, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xcvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 54, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xcviii) VH, содержащую последовательность, представленную в SEQ ID NO: 54, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xcix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 55, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(c) VH, содержащую последовательность, представленную в SEQ ID NO: 55, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ci) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 56, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cii) VH, содержащую последовательность, представленную в SEQ ID NO: 56, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ciii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 57, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(civ) VH, содержащую последовательность, представленную в SEQ ID NO: 57, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 58, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cvi) VH, содержащую последовательность, представленную в SEQ ID NO: 58, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 59, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cviii) VH, содержащую последовательность, представленную в SEQ ID NO: 59, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 60, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cx) VH, содержащую последовательность, представленную в SEQ ID NO: 60, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 61, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxii) VH, содержащую последовательность, представленную в SEQ ID NO: 61, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 62, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 62, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 63, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 63, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 64, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 64, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 65, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxx) VH, содержащую последовательность, представленную в SEQ ID NO: 65, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 66, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 66, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 67, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 67, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 68, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 68, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 69, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 69, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 70, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxx) VH, содержащую последовательность, представленную в SEQ ID NO: 70, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 71, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 71, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 72, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 72, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 73, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 73, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 75, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 75, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 76, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxl) VH, содержащую последовательность, представленную в SEQ ID NO: 76, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxli) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 77, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxlii) VH, содержащую последовательность, представленную в SEQ ID NO: 77, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxliii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 78, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxliv) VH, содержащую последовательность, представленную в SEQ ID NO: 78, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxlv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 79, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxlvi) VH, содержащую последовательность, представленную в SEQ ID NO: 79, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxlvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 80, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxlviii) VH, содержащую последовательность, представленную в SEQ ID NO: 80, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxlix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 81, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cl) VH, содержащую последовательность, представленную в SEQ ID NO: 81, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cli) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 82, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clii) VH, содержащую последовательность, представленную в SEQ ID NO: 82, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cliii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 83, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cliv) VH, содержащую последовательность, представленную в SEQ ID NO: 83, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 84, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clvi) VH, содержащую последовательность, представленную в SEQ ID NO: 84, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 85, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clviii) VH, содержащую последовательность, представленную в SEQ ID NO: 85, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 86, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clx) VH, содержащую последовательность, представленную в SEQ ID NO: 86, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 87, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxii) VH, содержащую последовательность, представленную в SEQ ID NO: 87, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 88, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 88, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 89, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 89, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 90, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 90, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 91, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxx) VH, содержащую последовательность, представленную в SEQ ID NO: 91, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 92, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 92, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 93, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 93, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 94, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 94, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 95, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 95, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 96, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxx) VH, содержащую последовательность, представленную в SEQ ID NO: 96, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 97, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 97, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 98, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 98, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 99, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 99, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 100, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 100, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 101, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxc) VH, содержащую последовательность, представленную в SEQ ID NO: 101, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxci) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 102, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxcii) VH, содержащую последовательность, представленную в SEQ ID NO: 102, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxciii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 103, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxciv) VH, содержащую последовательность, представленную в SEQ ID NO: 103, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxcv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 104, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxcvi) VH, содержащую последовательность, представленную в SEQ ID NO: 104, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxcvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 105, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxcviii) VH, содержащую последовательность, представленную в SEQ ID NO: 105, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxcix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 106, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cc) VH, содержащую последовательность, представленную в SEQ ID NO: 106, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cci) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 107, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccii) VH, содержащую последовательность, представленную в SEQ ID NO: 107, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(cciii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 108, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cciv) VH, содержащую последовательность, представленную в SEQ ID NO: 108, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 109, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccvi) VH, содержащую последовательность, представленную в SEQ ID NO: 109, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 110, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccviii) VH, содержащую последовательность, представленную в SEQ ID NO: 110, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 111, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccx) VH, содержащую последовательность, представленную в SEQ ID NO: 111, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccxi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 112, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccxii) VH, содержащую последовательность, представленную в SEQ ID NO: 112, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccxiii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 113, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 113, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccxv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 114, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 114, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 115, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 115, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccxix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 116, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5; или
(ccxx) VH, содержащую последовательность, представленную в SEQ ID NO: 116, и VL, содержащую последовательность, представленную в SEQ ID NO: 5.
В одном примере ссылка в вышеприведенном абзаце(ах) на последовательности CDR в пределах определенной последовательности (то есть SEQ ID NO) будет пониматься следующим образом:
• для VH, CDR1 находится между аминокислотами от 26 до 35; CDR2 находится между аминокислотами от 50 до 66; и CDR3 находится между аминокислотами от 99 до 106; а также
• для VL, CDR1 находится между аминокислотами от 24 до 34; CDR2 находится между аминокислотами от 44 до 51; и CDR3 находится между аминокислотами от 89 до 97.
Настоящее изобретение также обеспечивает CD131-связывающее антитело, которое связывается или специфически связывается с CD131 и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF, и причем данный антигенсвязывающий домен содержит:
(i) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 59, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ii) VH, содержащую последовательность, представленную в SEQ ID NO: 59, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(iii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 63, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(iv) VH, содержащую последовательность, представленную в SEQ ID NO: 63, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(v) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 64, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(vi) VH, содержащую последовательность, представленную в SEQ ID NO: 64, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(vii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 65, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(viii) VH, содержащую последовательность, представленную в SEQ ID NO: 65, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(ix) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 68, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(x) VH, содержащую последовательность, представленную в SEQ ID NO: 68, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xi) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 69, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xii) VH, содержащую последовательность, представленную в SEQ ID NO: 69, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xiii)) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 72, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xiv) VH, содержащую последовательность, представленную в SEQ ID NO: 72, и VL, содержащую последовательность, представленную в SEQ ID NO: 5;
(xv) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 100, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5; или
(xvi) VH, содержащую последовательность, представленную в SEQ ID NO: 100, и VL, содержащую последовательность, представленную в SEQ ID NO: 5.
В одном примере ссылка в вышеприведенном абзаце(ах) на последовательности CDR в пределах определенной последовательности (то есть SEQ ID NO) будет пониматься следующим образом:
• для VH, CDR1 находится между аминокислотами от 26 до 35; CDR2 находится между аминокислотами от 50 до 66; и CDR3 находится между аминокислотами от 99 до 106; а также
• для VL, CDR1 находится между аминокислотами от 24 до 34; CDR2 находится между аминокислотами от 44 до 51; и CDR3 находится между аминокислотами от 89 до 97.
В одном примере CD131-связывающий белок или антитело по настоящему изобретению включает VH, содержащую CDR2 и CDR3 CD131-связывающего белка или антитела, как описано в настоящем изобретении, и VL, содержащую CDR1, CDR2 и CDR3 CD131-связывающего белка или антитела, как описано в настоящем изобретении.
В одном примере CD131-связывающий белок или антитело по настоящему изобретению включает VH, содержащую CDR1 и CDR3 CD131-связывающего белка или антитела, как описано в настоящем изобретении, и VL, содержащую CDR1, CDR2 и CDR3 CD131-связывающего белка или антитела, как описано в настоящем изобретении.
В одном примере CD131-связывающий белок или антитело по настоящему изобретению включает VH, содержащую CDR1, CDR2 и CDR3 CD131-связывающего белка или антитела, как описано в настоящем изобретении, и VL, содержащую CDR1 и CDR3 CD131-связывающего белка или антитела, как описано в настоящем изобретении.
В одном примере CD131-связывающий белок или антитело по данному описанию содержит VH, содержащую CDR1, CDR2 и CDR3 CD131-связывающего белка или антитела, как описано в настоящем изобретении, и VL, содержащую CDR2 и CDR3 CD131-связывающего белка или антитела, как описано в настоящем изобретении.
В одном примере CD131-связывающий белок или антитело по данному изобретению связывается с полипептидом, содержащим последовательность, представленную в SEQ ID NO: 194 с KD, составляющей около 100 нМ или менее, например, когда полипептид иммобилизован на твердой поверхности и KD определяется поверхностным плазмонным резонансом. В одном примере KD составляет 10 нМ или менее, например, 5 нМ или менее или 4 нМ или менее, или 3 нМ или менее, или 2 нМ или менее. В одном примере KD составляет 1 нМ или менее. В одном примере KD составляет 0,9 нМ или менее, или 0,7 нМ или менее, или 0,8 нМ или менее, или 0,7 нМ или менее или 0,6 нМ или менее. В одном примере KD составляет 0,5 нМ или менее. В одном примере KD составляет 0,4 нм или менее. В одном примере KD составляет 0,3 нМ или менее.
В одном примере CD131-связывающий белок или антитело по настоящему изобретению связывается с клеткой, экспрессирующей CD131 (например, нейтрофилом или эозинофилом или клеткой TF-1) с KD, составляющей около 10 нМ или менее, например, с использованием конкурентного анализа с использованием меченого и немеченого белка или антитела. В одном примере KD составляет 5 нМ или менее, или 4 нМ или менее, или 3 нМ или менее, или 2 нМ или менее. В одном примере KD составляет 1 нМ или менее. В одном примере KD составляет 0,9 нМ или менее, или 0,7 нМ или менее, или 0,8 нМ или менее, или 0,7 нМ или менее, или 0,6 нМ или менее.
В одном примере KD составляет около 300 нМ или менее для нейтрофила.
В одном примере KD составляет около 700 нМ или менее для эозинофила.
В одном примере KD составляет около 400 нМ или менее для клетки TF-1.
В одном примере CD131-связывающий белок или антитело по настоящему изобретению уменьшает или предотвращает IL-3- и/или GM-CSF-индуцированную передачу сигнала посредством STAT-5.
В одном примере CD131-связывающий белок или антитело по настоящему изобретению уменьшает или предотвращает IL-3-индуцированную передачу сигнала посредством STAT-5 с IC50, составляющей около 20 нМ или менее. В одном примере pStat-5 IC50 IL-3 составляет около 10 нМ или менее, или около 9 нм или менее, или около 8 нм или менее. В одном примере pStat-5 IC50 IL-3 составляет около 7,5 нМ или менее, например, 7,3 нМ.
В одном примере CD131-связывающий белок или антитело по настоящему изобретению уменьшает или предотвращает GM-CSF-индуцированную передачу сигнала посредством STAT-5 с IC50, составляющей около 60 нМ или менее. В одном примере -5 IC50 GM-CSF pStat составляет около 50 нМ или менее, или около 45 нм или менее, или около 40 нМ или менее. В одном примере CD131-связывающий белок или антитело по настоящему изобретению уменьшает или предотвращает GM-CSF-индуцированную передачу сигнала посредством STAT-5 с IC50, составляющей около 40 нМ.
Например, белок или антитело контактирует с клеткой (например, клеткой TF-1), содержащей репортерный ген бета-лактамазы под контролем элемента ответа интерферон-регуляторного фактора 1 (irf1) в присутствии IL-3 и/или GM-CSF. Клетки также контактируют с подходящим субстратом (например, отрицательно заряженным флюоресцентным бета-лактамазным субстратом, таким как CCF2 или CCF4), и определяется изменение сигнала (например, флуоресценции). Снижение изменения сигнала в положительном контроле (т.е. клетки, контактирующие с IL-3 и/или GM-CSF в отсутствие белка или антитела) указывает на то, что белок или антитело уменьшает или предотвращает IL-3- и/или GM-CSF-индуцированную передачу сигнала посредством STAT-5.
В одном примере CD131-связывающий белок или антитело по настоящему изобретению конкурирует с IL-3 и/или GM-CSF и/или IL-5 за связывание с клеткой, экспрессирующей CD131 (например, клетками TF-1).
В одном примере CD131-связывающий белок или антитело по настоящему изобретению конкурирует с IL-3 за связывание с клеткой, экспрессирующей CD131 (например, клетками TF-1), с IC50, составляющей около 10 нМ или менее. В одном примере IC50 составляет около 9 нм или менее, или около 8 нм или менее, или около 7 нм или менее. В одном примере IC50 составляет около 6 нм или менее, например, около 5,96 нМ или менее.
В одном примере CD131-связывающий белок или антитело по настоящему изобретению конкурирует с GM-CSF за связывание с клеткой, экспрессирующей CD131 (например, клетками TF-1), с IC50, составляющей около 600 нМ или менее. В одном примере IC50 составляет около 550 нМ или менее, или около 500 нМ или менее. В одном примере IC50 составляет около 480 нМ или менее или около 460 нМ или менее, например, около 456 нМ или менее.
В одном примере CD131-связывающий белок или антитело по настоящему изобретению конкурирует с IL-5 за связывание с клеткой, экспрессирующей CD131 (например, клетками TF-1), с IC50, составляющей около 1600 нМ или менее. В одном примере IC50 составляет около 1550 нМ или менее, или около 1500 нМ или менее. В одном примере IC50 составляет около 1480 нМ или менее, или около 1460 нМ или менее, или около 1450 нМ или менее, например, около 1448 нМ или менее.
В одном примере IL-3 и/или GM-CSF и/или IL-5 конкурируют с CD131-связывающим белком или антителом по настоящему изобретению за связывание с клеткой, экспрессирующей CD131 (например, клетками TF-1).
Например, клетки (например, около 1-2 × 106 TF-1-клеток) контактируют с CD131-связывающим белком или антителом по настоящему изобретению в течение около 45 минут. Затем меченый IL-3 и/или GM-CSF и/или IL-5 контактирует с клетками (например, в течение от 1 до 2 часов) и, после промывки, оценивается уровень метки, связанной с клетками. Снижение уровня связанной метки по сравнению с положительным контролем (т.е. клетки, контактирующие с меченым цитокином в отсутствие белка или антитела) указывает на то, что белок или антитело конкурируют с IL-3 и/или GM-CSF и/или IL-5 за связывание с клеткой. Реципрокный анализ используют для определения способности IL-3 и/или GM-CSF и/или IL-5 конкурировать с белком или антителом к клетке.
В одном примере CD131-связывающий белок или антитело по настоящему изобретению обладает одним или более из следующих свойств:
(i) уменьшает или ингибирует активацию изолированных человеческих нейтрофилов посредством GM-CSF, как определяется уменьшением или ингибированием GM-CSF-индуцированного увеличения размера нейтрофильных клеток;
(ii) уменьшает или ингибирует IL-3-индуцированную секрецию IL-8 человеческими базофилами;
(iii) уменьшает или предотвращает IL-3-опосредованную выживаемость или плазмоцитоидные дендритные клетки (plasmacytoid dendritic cells (pDC));
(iv) уменьшает или предотвращает активацию эозинофилов периферической крови человека посредством IL-5, как определяется оценкой изменения прямого рассеяния, оцененного с помощью проточной цитометрии;
(v) уменьшает или предотвращает выживание эозинофилов периферической крови человека в присутствии IL-5 и/или GM-CSF и/или IL-3;
(vi) уменьшает или предотвращает IL-3-индуцированное высвобождение фактора некроза опухоли (tumor necrosis factor (TNF)) α из человеческих тучных клеток;
(vii) уменьшает или предотвращает IL-3-индуцированное высвобождение IL-13 из человеческих тучных клеток;
(viii) уменьшает или предотвращает потенцирование IgE-опосредованного высвобождения IL-8 из человеческих тучных клеток посредством IL-3 и/или IL-5 и/или GM-CSF;
(ix) уменьшает или предотвращает образование колониеобразующих единиц-гранулоцитов-макрофагов (CFU-GM) CD34+ клетками костного мозга человека, культивированными в присутствии фактора стволовых клеток (stem cell factor (SCF)), GM-CSF, IL-3 и IL-5;
(x) уменьшает размер или массу полипов в мышиной модели ксенотрансплантата назального полипоза человека; и/или
(xi) уменьшает количество B-клеток в полипе в мышиной модели ксенотрансплантата назального полипоза человека.
В одном примере CD131-связывающий белок по настоящему изобретению не оказывает существенного или значительного ингибирования пролиферации клеток TF-1 в ответ на один или более из эритропоэтина, IL-6, IL-4 или фактора стволовых клеток. Способы определения способности CD131-связывающего белка ингибировать пролиферацию клеток TF-1 в отношении цитокина или фактора роста описаны в настоящем изобретении и легко адаптируются к настоящему примеру данного раскрытия.
В одном примере CD131-связывающий белок или антитело по настоящему изобретению уменьшает выживаемость или индуцирует гибель иммунных клеток (например, эозинофилов) из мокроты или ткани носового полипа у субъекта, страдающего воспалительным заболеванием дыхательных путей или назальным полипозом. Например, иммунные клетки культивируют в присутствии IL-3 и/или IL-5 и/или GM-CSF и белка или антитела. Затем оценивают гибель клеток, например, путем определения экспрессии аннексина-V, например, с использованием сортировки клеток с активированной флуоресценцией). Увеличение количества клеток, экспрессирующих аннексин-V (т.е. подвергающихся апоптозу) в присутствии белка или антитела по сравнению с аналогичным увеличением количества клеток в отсутствие белка или антитела, указывает на то, что белок или антитело снижает выживаемость или индуцирует гибель иммунных клеток (например, эозинофилов).
Ссылка в настоящем изобретении на белок или антитело, которое «связывается с» CD131, обеспечивает литеральную поддержку белка или антитела, которое «связывается специфически с» или «специфически связывается с» CD131.
Настоящее изобретение также обеспечивает антигенсвязывающие домены или антигенсвязывающие фрагменты вышеупомянутых антител.
В одном примере белок или антитело, как описано в настоящем изобретении, содержит человеческую константную область, например, константную область IgG, такую как константная область IgG1, IgG2, IgG3 или IgG4, или их смеси. В случае антитела или белка, содержащего VH и VL, VH может быть связана с константной областью тяжелой цепи, и VL может быть связана с константной областью легкой цепи.
С-концевой лизин константной области тяжелой цепи целого антитела (или CD131-связывающего белка, содержащего константную область или CH3) по настоящему изобретению может быть удален, например, во время продуцирования или очистки антитела или белка или путем рекомбинантной инженерии нуклеиновой кислоты, кодирующей тяжелую цепь антитела. Соответственно, целые антитела (или CD131-связывающие белки) могут содержать популяции со всеми удаленными остатками С-концевого лизина, популяции без остатков С-концевых лизинов и/или популяции, имеющие смесь белка с С-концевым остатком лизина и без него. В некоторых примерах популяции могут дополнительно содержать белок, в котором С-концевой остаток лизина удален в одной из константных областей тяжелой цепи. Аналогично, композиция целых антител может содержать такую же или подобную смесь популяций антител с остатком С-концевого лизина или без него.
В одном примере белок или антитело, как описано в настоящем изобретении, включает константную область антитела IgG4 или стабилизированную константную область антитела IgG4. В одном примере белок или антитело содержит константную область IgG4 с остатком пролина в положении 241 (в соответствии с системой нумерации Kabat (Kabat et al., Sequences of Proteins of Immunological Interest Washington DC United States Department of Health and Human Services, 1987 и/или 1991)).
В одном примере константная область тяжелой цепи включает последовательность, представленную в SEQ ID NO: 197. В одном примере белок или антитело, как описано в настоящем изобретении, или композиция белка или антитела, как описано в настоящем изобретении, содержит константную область тяжелой цепи, включая стабилизированную константную область тяжелой цепи, содержащую смесь последовательностей, полностью или частично, с С-концевым остатком лизина и без него.
В одном примере антитело по настоящему изобретению содержит VH, описанную в настоящем изобретении, связанную или слитую с константной областью IgG4 или стабилизированной константной областью IgG4 (например, как обсуждалось выше), и VL, связанную или слитую с константной областью легкой цепи каппа.
Функциональные характеристики CD131-связывающего белка по настоящему изобретению будут взяты для применения с соответствующими изменениями к антителу по настоящему изобретению.
В одном примере CD131-связывающий белок или антитело, как описано в настоящем изобретении, является выделенным и/или рекомбинантным.
В одном примере CD131-связывающий белок или антитело по настоящему изобретению конъюгирован с другим соединением, например детектируемой меткой или соединением, которое продлевает период полувыведения белка или антитела, таким как полиэтиленгликоль или альбумин-связывающий белок. Другие подходящие соединения описаны в настоящем изобретении.
Настоящее изобретение также обеспечивает нуклеиновую кислоту, кодирующую CD131-связывающий белок или антитело по настоящему изобретению или его полипептид.
В одном примере такая нуклеиновая кислота включена в экспрессионную конструкцию, в которой нуклеиновая кислота функционально связана с промотором. Такая экспрессионная конструкция может находиться в векторе, например, в виде плазмиды.
В примерах настоящего изобретения, относящихся к CD131-связывающим белкам с одной полипептидной цепью, экспрессионная конструкция может содержать промотор, связанный с нуклеиновой кислотой, кодирующей данную полипептидную цепь.
В примерах, направленных на множественные полипептидные цепи, которые образуют CD131-связывающий белок, экспрессионная конструкция содержит нуклеиновую кислоту, кодирующую полипептид, содержащий, например, VH, функционально связанную с промотором, и нуклеиновую кислоту, кодирующую полипептид, содержащий, например, VL, функционально связанную с промотором.
В другом примере экспрессионная конструкция представляет собой бицистронную экспрессионную конструкцию, например, содержащую следующие функционально связанные компоненты в направлении от 5' к 3':
(i) промотор
(ii) нуклеиновая кислота, кодирующая первый полипептид;
(iii) участок внутренней посадки рибосомы; а также
(iv) нуклеиновая кислота, кодирующая второй полипептид,
где первый полипептид содержит VH, и второй полипептид содержит VL, или наоборот.
Настоящее изобретение также обеспечивает отдельные экспрессионные конструкции, одна из которых кодирует первый полипептид, содержащий VH, и другая из которых кодирует второй полипептид, содержащий VL. Например, настоящее изобретение также обеспечивает композицию, содержащую:
(i) первую экспрессионную конструкцию, содержащую нуклеиновую кислоту, кодирующую полипептид, содержащий VH, функционально связанную с промотором; а также
(ii) вторую экспрессионную конструкцию, содержащую нуклеиновую кислоту, кодирующую полипептид, содержащий VL, функционально связанную с промотором.
Настоящее изобретение также обеспечивает выделенную или рекомбинантную клетку, экспрессирующую CD131-связывающий белок по настоящему изобретению.
В одном примере клетка содержит экспрессионную конструкцию по настоящему изобретению или:
(i) первую экспрессионную конструкцию, содержащую нуклеиновую кислоту, кодирующую полипептид, содержащий VH, функционально связанную с промотором; а также
(ii) вторую экспрессионную конструкцию, содержащую нуклеиновую кислоту, кодирующую полипептид, содержащий VL, функционально связанную с промотором,
причем первый и второй полипептиды ассоциируют с образованием CD131-связывающего белка по настоящему изобретению.
Примеры клеток по настоящему изобретению включают бактериальные клетки, дрожжевые клетки, клетки насекомых или клетки млекопитающих.
Настоящее изобретение дополнительно обеспечивает способы получения CD131-связывающего белка или антитела по настоящему изобретению. Например, такой способ включает в себя поддержание экспрессионной конструкции(й) по настоящему изобретению в условиях, достаточных для продуцирования CD131-связывающего белка или антитела.
В одном примере способ получения CD131-связывающего белка или антитела по настоящему изобретению включает в себя культивирование клетки по настоящему изобретению в условиях, достаточных для продуцирования и, необязательно, секретирования CD131-связывающего белка или антитела.
В одном примере способ получения CD131-связывающего белка или антитела по настоящему изобретению дополнительно включает выделение белка или антитела и, необязательно, составления CD131-связывающего белка или антитела в фармацевтическую композицию.
Настоящее изобретение дополнительно обеспечивает композицию, содержащую CD131-связывающий белок или антитело по настоящему изобретению и фармацевтически приемлемый носитель.
В некоторых примерах данная композиция содержит:
(i) антитело по настоящему изобретению, содержащее С-концевой остаток лизина из тяжелой цепи;
(ii) антитело по настоящему изобретению, не содержащее С-концевой остаток лизина из тяжелой цепи; и/или
(iii) антитело по настоящему изобретению, содержащее С-концевой остаток лизина на одной тяжелой цепи и не имеющее С-концевого остатка лизина на другой (или иной) тяжелой цепи,
и, необязательно, фармацевтически приемлемый носитель.
Настоящее изобретение также обеспечивает способ лечения или профилактики CD131-опосредованного состояния у субъекта, причем данный способ включает введение CD131-связывающего белка или антитела или композиции по настоящему изобретению.
Настоящее изобретение также обеспечивает способ ингибирования или нейтрализации CD131 у субъекта, причем данный способ включает введение CD131-связывающего белка, антитела или композиции по настоящему изобретению. В одном примере субъект страдает от CD131-опосредованного состояния.
В одном примере описанный в настоящем изобретении способ включает введение от около 0,05 мг/кг до 30 мг/кг CD131-связывающего белка или антитела. Например, данный способ включает введение от 0,1 мг/кг до 10 мг/кг или от 0,2 мг/кг до 5 мг/кг CD131-связывающего белка или антитела. В одном примере способ включает введение от около 0,5 до около 2,0 мг/кг CD131-связывающего белка или антитела.
Настоящее изобретение также обеспечивает применение CD131-связывающего белка или антитела или композиции по настоящему изобретению в медицине.
Настоящее изобретение дополнительно обеспечивает применение CD131-связывающего белка или антитела по настоящему изобретению при изготовлении лекарственного средства для лечения CD131-опосредованного состояния.
Настоящее изобретение также обеспечивает CD131-связывающий белок или антитело или композицию по настоящему изобретению для применения при лечении CD131-опосредованного состояния.
Настоящее изобретение дополнительно обеспечивает способ для локализации и/или обнаружения и/или диагностики и/или прогнозирования CD131-опосредованного состояния, связанного с клеткой, экспрессирующей CD131, причем данный способ включает in vivo обнаружение CD131-связывающего белка или антитела по настоящему изобретению, связанного с CD131-экспрессирующей клеткой, если присутствует, где CD131-связывающий белок или антитело конъюгирован с детектируемой меткой. В одном примере данный способ дополнительно включает введение CD131-связывающего белка или антитела субъекту.
Настоящее изобретение также относится к способу обнаружения CD131 или CD131-экспрессирующей клетки в образце, причем данный способ включает контактирование образца со CD131-связывающим белком или антителом по настоящему изобретению таким образом, что образуется комплекс, и обнаружение комплекса, причем обнаружение комплекса указывает на наличие CD131 или клетки, экспрессирующей CD131 в образце. В одном примере способ осуществляют ex vivo или in vitro. Такой способ позволяет диагностировать или прогнозировать состояния, причем обнаружение CD131 или CD131-экспрессирующей клетки является диагностическим или прогностическим для данного состояния.
В одном из примеров CD131-опосредованное состояние является аутоиммунным состоянием, воспалительным состоянием, аллергическим заболеванием или раком. Например, состояние представляет собой астму, назальный полипоз, хронический риносинусит с полипами носа или без них (CRSwNP или CRSsNP) или рак мочевого пузыря. В одном примере данное состояние, представляет собой астму, устойчивую к кортикостероидам. В другом примере состояние, представляет собой хронический риносинусит с полипами носа (CRSwNP). В другом примере состояние представляет собой хронический риносинусит без носовых полипов (CRSsNP). В следующем примере состояние представляет собой рак мочевого пузыря. В одном примере состояние представляет собой острый миелоидный лейкоз. В следующем примере состояние представляет собой хронический миелоидный лейкоз.
В другом примере способ включает введение ингибитора IL-3 и IL-5 и GM-CSF, например триспецифического антитела или CD131-связывающего белка или антитела (например, CD131-связывающего белка или антитела по настоящему изобретению).
Настоящее изобретение также обеспечивает набор (например, упаковку или изделие), содержащее CD131-связывающий белок или антитело, как описано в настоящем изобретении, в соответствии с любым примером, необязательно, с упакованными инструкциями для применения в способе, как описано в настоящем изобретении.
Настоящее изобретение дополнительно обеспечивает способ выбора соединения (например, антитела или белка, содержащего его антигенсвязывающий домен), которое связывается или специфически связывается с CD131 и нейтрализует передачу сигналов посредством IL-3, IL-5 и GM-CSF, причем данный способ включает выбор соединения, которое конкурентно ингибирует связывание одного или более из следующих антител с CD131 и/или полипептидом, содержащим последовательность, представленную в SEQ ID NO: 192:
(i) антитело, содержащее VL, содержащую последовательность, представленную в SEQ ID NO: 5, и VH, содержащую последовательность, представленную в SEQ ID NO: 20;
(ii) антитело, содержащее VL, содержащую последовательность, представленную в SEQ ID NO: 5, и константную область легкой цепи каппа человека, и VH, содержащую последовательность, представленную в SEQ ID NO: 20, и константную область IgG4 человека; и/или
(iii) антитело, содержащее легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5, и тяжелую цепь, содержащую последовательность, представленную в SEQ ID NO: 20.
Настоящее изобретение также обеспечивает соединение, которое связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, причем данный способ включает в себя выбор соединения, которое связывается с одним или несколькими (или всеми) из следующего мутантного полипептида(ов):
(i) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 119;
(ii) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 124;
(iii) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 131;
(iv) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 137;
(v) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 139;
(vi) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 140,
на уровне, который понижен по сравнению с уровнем связывания соединения с полипептидом, содержащим последовательность, представленную в SEQ ID NO: 192.
КЛЮЧ К ПЕРЕЧНЮ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO 1: аминокислотная последовательность CD131 Homo sapiens
SEQ ID NO 2: аминокислотная последовательность IL2-рецептора α Homo sapiens
SEQ ID NO 3: аминокислотная последовательность рецептора GCS-F Homo sapiens
SEQ ID NO 4: аминокислотная последовательность рецептора IL-5 Homo sapiens
SEQ ID NO 5: аминокислотная последовательность VL-цепи антитела 9А2
SEQ ID NO 6: аминокислотная последовательность VL-цепи антитела 9А2-VR1
SEQ ID NO 7: аминокислотная последовательность VL-цепи антитела 9А2-VR2
SEQ ID NO 8: аминокислотная последовательность VL-цепи антитела 9А2-VR3
SEQ ID NO 9: аминокислотная последовательность VL-цепи антитела 9А2-VR4
SEQ ID NO 10: аминокислотная последовательность VL-цепи антитела 9А2-VR5
SEQ ID NO 11: аминокислотная последовательность VL-цепи антитела 9А2-VR6
SEQ ID NO 12: аминокислотная последовательность VL-цепи антитела 9А2-VR8
SEQ ID NO 13: аминокислотная последовательность VL-цепи антитела 9А2-VR9
SEQ ID NO 14: аминокислотная последовательность VL-цепи антитела 9А2-VR11
SEQ ID NO 15: аминокислотная последовательность VL-цепи антитела 9А2-VR12
SEQ ID NO 16: аминокислотная последовательность VL-цепи антитела 9А2-VR13
SEQ ID NO 17: аминокислотная последовательность VL-цепи антитела 9А2-VR14
SEQ ID NO 18: аминокислотная последовательность VL-цепи антитела 9А2-VR16
SEQ ID NO 19: аминокислотная последовательность VL-цепи антитела 9А2-VR19
SEQ ID NO 20: аминокислотная последовательность VH-цепи антитела 9А2
SEQ ID NO 21: аминокислотная последовательность VH-цепи антитела 9А2-VR20
SEQ ID NO 22: аминокислотная последовательность VH-цепи антитела 9А2-VR21
SEQ ID NO 23: аминокислотная последовательность VH-цепи антитела 9А2-VR22
SEQ ID NO 24: аминокислотная последовательность VH-цепи антитела 9А2-VR23
SEQ ID NO 25: аминокислотная последовательность VH-цепи антитела 9А2-VR24
SEQ ID NO 26: аминокислотная последовательность VH-цепи антитела 9А2-VR26
SEQ ID NO: 27: аминокислотная последовательность VH-цепи антитела 9А2-VR27
SEQ ID NO: 28 аминокислотная последовательность VH-цепи антитела 9А2-VR28
SEQ ID NO: 29: аминокислотная последовательность VH-цепи антитела 9А2-VR31
SEQ ID NO 30: аминокислотная последовательность VH-цепи антитела 9А2-VR32
SEQ ID NO 31: аминокислотная последовательность VH-цепи антитела 9А2-VR33
SEQ ID NO 32: аминокислотная последовательность VH-цепи антитела 9А2-VR34
SEQ ID NO 33: аминокислотная последовательность VH-цепи антитела 9А2-VR35
SEQ ID NO 34: аминокислотная последовательность VH-цепи антитела 9А2-VR36
SEQ ID NO 35: аминокислотная последовательность VH-цепи антитела 9А2-VR37
SEQ ID NO 36: аминокислотная последовательность VH-цепи антитела 9А2-VR38
SEQ ID NO 37: аминокислотная последовательность VH-цепи антитела 9А2-VR39
SEQ ID NO 38: аминокислотная последовательность VH-цепи антитела 9А2-VR40
SEQ ID NO 39: аминокислотная последовательность VH-цепи антитела 9А2-VR41
SEQ ID NO 40: аминокислотная последовательность VH-цепи антитела 9А2-VR42
SEQ ID NO 41: аминокислотная последовательность VH-цепи антитела 9А2-VR43
SEQ ID NO 42: аминокислотная последовательность VH-цепи антитела 9А2-VR44
SEQ ID NO 43: аминокислотная последовательность VH-цепи антитела 9А2-VR45
SEQ ID NO 44: аминокислотная последовательность VH-цепи антитела 9А2-VR46
SEQ ID NO: 45: аминокислотная последовательность VH-цепи антитела 9А2-VR47
SEQ ID NO 46: аминокислотная последовательность VH-цепи антитела 9А2-VR48
SEQ ID NO 47: аминокислотная последовательность VH-цепи антитела 9А2-VR49
SEQ ID NO 48: аминокислотная последовательность VH-цепи антитела 9А2-VR50
SEQ ID NO 49: аминокислотная последовательность VH-цепи антитела 9А2-VR24.04
SEQ ID NO: 50 аминокислотная последовательность VH-цепи антитела 9А2-VR24.07
SEQ ID NO 51: аминокислотная последовательность VH-цепи антитела 9А2-VR24.10
SEQ ID NO 52: аминокислотная последовательность VH-цепи антитела 9А2-VR24.12
SEQ ID NO 53: аминокислотная последовательность VH-цепи антитела 9А2-VR24.19
SEQ ID NO 54: аминокислотная последовательность VH-цепи антитела 9А2-VR24.24
SEQ ID NO 55: аминокислотная последовательность VH-цепи антитела 9А2-VR24.76
SEQ ID NO 56: аминокислотная последовательность VH-цепи антитела 9А2-VR24.78
SEQ ID NO 57: аминокислотная последовательность VH-цепи антитела 9А2-VR24.81
SEQ ID NO: 58: аминокислотная последовательность VH-цепи антитела 9А2-VR24.82
SEQ ID NO 59: аминокислотная последовательность VH-цепи антитела 9А2-VR24.84
SEQ ID NO 60: аминокислотная последовательность VH-цепи антитела 9А2-VR24.87
SEQ ID NO 61: аминокислотная последовательность VH-цепи антитела 9А2-VR24.91
SEQ ID NO 62: аминокислотная последовательность VH-цепи антитела 9А2-VR24.93
SEQ ID NO 63: аминокислотная последовательность VH-цепи антитела 9А2-VR24.27
SEQ ID NO 64: аминокислотная последовательность VH-цепи антитела 9А2-VR24.29
SEQ ID NO 65: аминокислотная последовательность VH-цепи антитела 9А2-VR24.30
SEQ ID NO 66: аминокислотная последовательность VH-цепи антитела 9А2-VR24.33
SEQ ID NO 67: аминокислотная последовательность VH-цепи антитела 9А2-VR24.44
SEQ ID NO 68: аминокислотная последовательность VH-цепи антитела 9А2-VR24.97
SEQ ID NO 69: аминокислотная последовательность VH-цепи антитела 9А2-VR24.98
SEQ ID NO 70: аминокислотная последовательность VH-цепи антитела 9А2-VR24.102
SEQ ID NO 71: аминокислотная последовательность VH-цепи антитела 9А2-VR24.107
SEQ ID NO 72: аминокислотная последовательность VH-цепи антитела 9А2-VR24.110
SEQ ID NO 73: аминокислотная последовательность VH-цепи антитела 9А2-VR24.111
SEQ ID NO 74: аминокислотная последовательность VH-цепи антитела 9А2-VR24.55
SEQ ID NO: 75: аминокислотная последовательность VH-цепи антитела 9А2-VR24.56
SEQ ID NO 76: аминокислотная последовательность VH-цепи антитела 9А2-VR24.57
SEQ ID NO 77: аминокислотная последовательность VH-цепи антитела 9А2-VR24.122
SEQ ID NO 78: аминокислотная последовательность VH-цепи антитела 9А2-VR24.124
SEQ ID NO 79: аминокислотная последовательность VH-цепи антитела 9А2-VR24.131
SEQ ID NO 80: аминокислотная последовательность VH-цепи антитела 9А2-VR39.01
SEQ ID NO 81: аминокислотная последовательность VH-цепи антитела 9А2-VR39.02
SEQ ID NO 82: аминокислотная последовательность VH-цепи антитела 9А2-VR39.04
SEQ ID NO 83: аминокислотная последовательность VH-цепи антитела 9А2-VR39.05
SEQ ID NO 84: аминокислотная последовательность VH-цепи антитела 9А2-VR39.06
SEQ ID NO 85: аминокислотная последовательность VH-цепи антитела 9А2-VR39.11
SEQ ID NO 86: аминокислотная последовательность VH-цепи антитела 9А2-VR39.12
SEQ ID NO 87: аминокислотная последовательность VH-цепи антитела 9А2-VR39.16
SEQ ID NO 88: аминокислотная последовательность VH-цепи антитела 9А2-VR39.17
SEQ ID NO 89: аминокислотная последовательность VH-цепи антитела 9А2-VR39.18
SEQ ID NO 90: аминокислотная последовательность VH-цепи антитела 9А2-VR39.19
SEQ ID NO 91: аминокислотная последовательность VH-цепи антитела 9А2-VR39.21
SEQ ID NO 92: аминокислотная последовательность VH-цепи антитела 9А2-VR39.22
SEQ ID NO 93: аминокислотная последовательность VH-цепи антитела 9А2-VR39.23
SEQ ID NO 94: аминокислотная последовательность VH-цепи антитела 9А2-VR39.24
SEQ ID NO 95: аминокислотная последовательность VH-цепи антитела 9А2-VR39.97
SEQ ID NO 96: аминокислотная последовательность VH-цепи антитела 9А2-VR39.98
SEQ ID NO 97: аминокислотная последовательность VH-цепи антитела 9А2-VR39.102
SEQ ID NO 98: аминокислотная последовательность VH-цепи антитела 9А2-VR39.103
SEQ ID NO: 99: аминокислотная последовательность VH-цепи антитела 9А2-VR39.105
SEQ ID NO 100: аминокислотная последовательность VH-цепи антитела 9А2-VR39.109
SEQ ID NO 101: аминокислотная последовательность VH-цепи антитела 9А2-VR39.110
SEQ ID NO 102: аминокислотная последовательность VH-цепи антитела 9А2-VR39.111
SEQ ID NO 103: аминокислотная последовательность VH-цепи антитела 9А2-VR39.112
SEQ ID NO 104: аминокислотная последовательность VH-цепи антитела 9А2-VR39.116
SEQ ID NO 105: аминокислотная последовательность VH-цепи антитела 9А2-VR39.27
SEQ ID NO 106: аминокислотная последовательность VH-цепи антитела 9А2-VR39.28
SEQ ID NO 107: аминокислотная последовательность VH-цепи антитела 9А2-VR39.46
SEQ ID NO 108: аминокислотная последовательность VH-цепи антитела 9А2-VR39.122
SEQ ID NO 109: аминокислотная последовательность VH-цепи антитела 9А2-VR39.139
SEQ ID NO 110: аминокислотная последовательность VH-цепи антитела 9А2-VR39.140
SEQ ID NO 111: аминокислотная последовательность VH-цепи антитела 9А2-VR39.148
SEQ ID NO 112: аминокислотная последовательность VH-цепи антитела 9А2-VR39.162
SEQ ID NO 113: аминокислотная последовательность VH-цепи антитела 9А2-VR39.77
SEQ ID NO 114: аминокислотная последовательность VH-цепи антитела 9А2-VR39.93
SEQ ID NO 115: аминокислотная последовательность VH-цепи антитела 9А2-VR39.174
SEQ ID NO 116: аминокислотная последовательность VH-цепи антитела 9А2-VR39.177
SEQ ID NO 117: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C- концевую метку 6xHis и содержащая замену N37A
SEQ ID NO 118: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену D38A
SEQ ID NO 119: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену Y39A
SEQ ID NO 120: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену T40A
SEQ ID NO 121: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену S41A
SEQ ID NO 122: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену H42A
SEQ ID NO 123: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену S102A
SEQ ID NO 124: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену F103A
SEQ ID NO 125: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену V104A
SEQ ID NO 126: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену V105A
SEQ ID NO 127: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену T106A
SEQ ID NO 128: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену D107A
SEQ ID NO 129: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену V108A
SEQ ID NO 130: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену N337A
SEQ ID NO 131: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену I338A
SEQ ID NO 132: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену Q339A
SEQ ID NO 133: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену M340A
SEQ ID NO 134: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену K362A
SEQ ID NO 135: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену M363A
SEQ ID NO 136: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену R364A
SEQ ID NO 137: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену Y365A
SEQ ID NO 138: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену E366A
SEQ ID NO 139: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену H367A
SEQ ID NO 140: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену I368A
SEQ ID NO 141: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену D369A
SEQ ID NO 142: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену R418A
SEQ ID NO 143: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену T419A
SEQ ID NO 144: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену n G420A
SEQ ID NO 145: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену Y421A
SEQ ID NO 146: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену N422A
SEQ ID NO 147: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену G423A
SEQ ID NO 148: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis и содержащая замену I424A
SEQ ID NO: 149: последовательность нуклеиновой кислоты, кодирующая тримерный олигонуклеотид 9А2 L1.1
SEQ ID NO: 150: последовательность нуклеиновой кислоты, кодирующая тримерный олигонуклеотид 9А2 L3.1
SEQ ID NO 151: последовательность нуклеиновой кислоты, кодирующая тримерный олигонуклеотид 9А2 L3.2
SEQ ID NO 152: последовательность нуклеиновой кислоты, кодирующая тримерный олигонуклеотид 9А2 H1.1
SEQ ID NO 153: последовательность нуклеиновой кислоты, кодирующая тримерный олигонуклеотид 9А2 H2.1
SEQ ID NO 154: последовательность нуклеиновой кислоты, кодирующая тримерный олигонуклеотид 9А2 H3.1
SEQ ID NO 155: последовательность нуклеиновой кислоты, кодирующая тримерный олигонуклеотид 9А2 H3.2
SEQ ID NO 156: последовательность нуклеиновой кислоты, кодирующая тримерный олигонуклеотид 9А2-VR24-H2.1
SEQ ID NO: 157: последовательность нуклеиновой кислоты, кодирующая тримерный олигонуклеотид 9А2-VR24-H2.2
SEQ ID NO 158: последовательность нуклеиновой кислоты, кодирующая тримерный олигонуклеотид 9А2-VR24-H2.3
SEQ ID NO 159: последовательность нуклеиновой кислоты, кодирующая тримерный олигонуклеотид 9А2-VR39-H1.1
SEQ ID NO: 160: последовательность нуклеиновой кислоты, кодирующая тримерный олигонуклеотид 9А2-VR39-H1.2
SEQ ID NO 161: последовательность нуклеиновой кислоты, кодирующая тримерный олигонуклеотид 9А2-VR39-H2.2
SEQ ID NO 162: последовательность нуклеиновой кислоты, кодирующая тримерный олигонуклеотид 9А2-VR39-H2.3
SEQ ID NO 163: аминокислотная последовательность VH-цепи стоп-матрицы 9А2 H1.1
SEQ ID NO 164: аминокислотная последовательность VH-цепи стоп-матрицы 9А2 H2.1
SEQ ID NO 165: аминокислотная последовательность VH-цепи стоп-матрицы 9А2 H3.1
SEQ ID NO 166: аминокислотная последовательность VH-цепи стоп-матрицы 9А2 H3.2
SEQ ID NO 167: аминокислотная последовательность VL-цепи стоп-матрицы 9А2 L1.1
SEQ ID NO 168: аминокислотная последовательность VL-цепи стоп-матрицы 9А2 L3.1
SEQ ID NO 169: аминокислотная последовательность VL-цепи стоп-матрицы 9А2 L3.2
SEQ ID NO 170: аминокислотная последовательность VH-цепи стоп-матрицы 9А2 VR24-H2.1
SEQ ID NO 171: аминокислотная последовательность VH-цепи стоп-матрицы 9А2 VR24-H2.2
SEQ ID NO 172: аминокислотная последовательность VH-цепи стоп-матрицы 9А2 VR24-H2.3
SEQ ID NO 173: аминокислотная последовательность VH-цепи стоп-матрицы 9А2 VR39-H1.1
SEQ ID NO 174: аминокислотная последовательность VH-цепи стоп-матрицы 9А2 VR39-H1.2
SEQ ID NO 175: аминокислотная последовательность VH-цепи стоп-матрицы 9А2 VR39-H2.2
SEQ ID NO 176: аминокислотная последовательность VH-цепи стоп-матрицы 9А2 VR39-H2.3
SEQ ID NO 177: аминокислотная последовательность консенсуса VL-цепи антитела 9А2 и производных
SEQ ID NO 178: аминокислотная последовательность консенсуса CDR1 VL-цепи антитела 9А2 и производных
SEQ ID NO 179: аминокислотная последовательность консенсуса CDR3 VL-цепи антитела 9А2 и производных
SEQ ID NO 180: аминокислотная последовательность консенсуса VH-цепи антитела 9А2 и производных
SEQ ID NO: 181: аминокислотная последовательность консенсуса CDR1 VH-цепи антитела 9А2 и производных
SEQ ID NO: 182: аминокислотная последовательность консенсуса CDR2 VH-цепи антитела 9А2 и производных
SEQ ID NO: 183: аминокислотная последовательность консенсуса CDR3 VH-цепи антитела 9А2 и производных
SEQ ID NO: 184: аминокислотная последовательность консенсуса VH-цепи антитела 9А2-VR24 и производных
SEQ ID NO 185: аминокислотная последовательность консенсуса CDR1 VH-цепи антитела 9А2-VR24 и производных
SEQ ID NO: 186: аминокислотная последовательность консенсуса CDR2 VH-цепи 9А2-VR24 и производных
SEQ ID NO 187: аминокислотная последовательность консенсуса CDR3 VH-цепи антитела 9А2-VR24 и производных
SEQ ID NO 188: аминокислотная последовательность консенсуса VH-цепи антитела 9А2-VR39 и производных
SEQ ID NO: 189: аминокислотная последовательность консенсуса CDR1 VH-цепи антитела 9А2-VR39 и производных
SEQ ID NO: 190: аминокислотная последовательность консенсуса CDR2 VH-цепи антитела 9А2-VR39 и производных
SEQ ID NO: 191: аминокислотная последовательность консенсуса CDR3 VH-цепи антитела 9А2-VR39 и производных
SEQ ID NO: 192: аминокислотная последовательность растворимого CD131 Homo sapiens, содержащая C-концевую метку 6xHis
SEQ ID NO: 193: аминокислотная последовательность VH-цепи мутантов 9А2-VR24 HCDR2
SEQ ID NO: 194: аминокислотная последовательность тяжелой цепи антитела 9А2
SEQ ID NO: 195: аминокислотная последовательность легкой цепи антитела 9А2
SEQ ID NO: 196: аминокислотная последовательность стабилизированной константной области тяжелой цепи IgG4
SEQ ID NO: 197: аминокислотная последовательность константной области легкой цепи каппа
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 представлено схематическое изображение, показывающее последовательности вариабельных областей в VL антитела 9А2 и производных. Области, выделенные в четырехугольниках, содержат последовательности CDR (как обозначено), как определено системой нумерации Кабата.
На фигурах 2А и 2В представлены схематические изображения, показывающие последовательности вариабельных областей в VH антитела 9А2 и производных. Области, выделенные в четырехугольниках, содержат последовательности CDR (как обозначено), как определено системой нумерации Кабата.
На фигурах 3А и 3В представлены схематические изображения, показывающие последовательности вариабельных областей в VH антитела 9А2-VR24 и производных. Области, выделенные в четырехугольниках, содержат последовательности CDR (как обозначено), как определено системой нумерации Кабата.
На фигурах 4А и 4В представлены схематические изображения, показывающие последовательности вариабельных областей в VH антитела 9А2-VR39 и производных. Области, выделенные в четырехугольниках, содержат последовательности CDR (как обозначено), как определено системой нумерации Кабата.
Фигура 5 представляет собой схематическое изображение, показывающее аминокислотные последовательности вариабельных областей антитела 9А2, используемые для созревания аффинности. На панели A показана последовательность вариабельных областей легкой цепи, и на панели B показана последовательность вариабельных областей тяжелой цепи антитела 9А2, с подчеркнутыми последовательностями CDR и областями, выбранными для рандомизации, изображенными в четырехугольнике и пронумерованными в соответствии с нумерацией Кабата.
Фигуры 6A-F представляют собой графические изображения, показывающие эффект антитела 9А2 и выбранных производных на передачу сигнала посредством IL-3, GM-CSF и IL-5. Клетки TF-1 обрабатывали тестируемыми антителами (BION-1  9А2
9А2  9А2-VR24
9А2-VR24  и 9А2-VR24.29
и 9А2-VR24.29  ) в течение 30 минут до добавления цитокинов: (A) IL-3. (B) GM-CSF. (C) IL-5. Последовательно, оценивали пролиферацию по включению 3[H]-тимидина, и значения IC50 отложены в D для BION-1
) в течение 30 минут до добавления цитокинов: (A) IL-3. (B) GM-CSF. (C) IL-5. Последовательно, оценивали пролиферацию по включению 3[H]-тимидина, и значения IC50 отложены в D для BION-1  и 9А2
и 9А2  Гистограммы показывают среднюю и стандартную ошибку технических повторов. Эксперименты повторяли по меньшей мере 3 раза. Показаны типичные эксперименты. Панель (E) показывает эффективность воздействия аффинно-созревших библиотек антитела 9А2 (как описано на фигуре 5) на передачу сигналов посредством GM-CSF. Отложены отдельные значения IC50. Панель (F) показывает эффективность воздействия созревших аффинности библиотек 9А2-VR24- и 9А2-VR39-производных антитела 9А2 на передачу сигналов посредством GM-CSF. Отложены отдельные значения IC50. Выделены варианты 9А2-VR24
Гистограммы показывают среднюю и стандартную ошибку технических повторов. Эксперименты повторяли по меньшей мере 3 раза. Показаны типичные эксперименты. Панель (E) показывает эффективность воздействия аффинно-созревших библиотек антитела 9А2 (как описано на фигуре 5) на передачу сигналов посредством GM-CSF. Отложены отдельные значения IC50. Панель (F) показывает эффективность воздействия созревших аффинности библиотек 9А2-VR24- и 9А2-VR39-производных антитела 9А2 на передачу сигналов посредством GM-CSF. Отложены отдельные значения IC50. Выделены варианты 9А2-VR24  9А2-VR39
9А2-VR39  и 9А2-VR- 24.29
и 9А2-VR- 24.29 
На фигурах 7А и 7В представлены графические изображения, показывающие результаты анализа с использованием TF-1-bla для оценки передачи сигналов посредством IL-3 (A) или GM-CSF (B) в присутствии антитела 9А2. Гистограммы показывают среднюю и стандартную ошибку технических повторов. Показаны типичные эксперименты.
На фигурах 8A-D представлены графические изображения, показывающие, что антитело 9А2 не нейтрализует пролиферацию эритролейкозных клеток TF-1, стимулируемую IL-6 (A), IL-4 (B), SCF (C) или эритропоэтином (D). Пролиферацию оценивали по включению 3[H]-тимидина. Гистограммы показывают среднюю и стандартную ошибку технических повторов. Все эксперименты повторяли по меньшей мере 4 раза, за исключением Еро-стимуляции клеток TF-1, что повторяли дважды.
Фигура 9 представляет собой ряд графических изображений, показывающих, что антитело 9А2 связывается с клетками, транзиентно трансфицированными человеческим CD131, а не с клетками, экспрессирующими только человеческие α-цепь GM-CSFR, α-цепь IL-3R или α-цепь IL-5R, как определено проточной цитометрией. Контрольные антитела к α-цепи GM-CSFR, α-цепи IL-3R или α-цепи IL-5R человека подтвердили экспрессию данных белков в трансфицированных клетках.
Фигуры 10 A-C представляют собой ряд графических изображений, показывающих анализ кинетики связывания рекомбинантных Fab антител 9А2 (A), 9А2-VR24 (B) и 9А2-VR24.29 (C) с CD131 с использованием поверхностного плазмонного резонанса.
Фигуры 11А и В представляют собой схематические изображения, показывающие аминокислотные последовательности вариабельных областей тяжелой цепи антител, используемых для созревания аффинности. Последовательности (A) вариабельной области тяжелой цепи из 9А2-VR24 и (В) вариабельной области тяжелой цепи из 9А2-VR39 показаны с подчеркнутыми последовательностями CDR и выбранными для рандомизации областями, изображенными в четырехугольниках и пронумерованными в соответствии с нумерацией Кабата.
На фигурах 12A-D представлены графические изображения, показывающие, что 9А2-VR24.29 связывается с высокой аффинностью с клетками, экспрессирующими человеческий CD131. Исследования по связыванию с насыщением проводились на (А и В) нейтрофилах или (C и D) эозинофилах, инкубированных с меченым радиоактивным иодом 9А2-VR24.29 IgG или меченым радиоактивным иодом 9А2-VR24.29 Fab. (A и C) Кривые связывания показаны для суммарного  специфически
специфически  и неспецифически (□, пунктирная линия) связанного 9А2-VR24.29 IgG. Трансформация Скэтчарда данных по связыванию 9А2-VR24.29 IgG
и неспецифически (□, пунктирная линия) связанного 9А2-VR24.29 IgG. Трансформация Скэтчарда данных по связыванию 9А2-VR24.29 IgG  и 9А2-VR24.29 Fab
и 9А2-VR24.29 Fab  показана с линиями, указывающими на наилучшее соответствие для связывания каждого меченого радиоактивным иодом антитела (B и D). Каждая точка представляет собой среднее значение двойных определений связанного с клеткой меченного радиоактивным иодом антитела после вычитания неспецифического связывания. Показаны данные из одного эксперимента по связыванию нейтрофилов и типичного эксперимента по связыванию эозинофилов, n = 2.
показана с линиями, указывающими на наилучшее соответствие для связывания каждого меченого радиоактивным иодом антитела (B и D). Каждая точка представляет собой среднее значение двойных определений связанного с клеткой меченного радиоактивным иодом антитела после вычитания неспецифического связывания. Показаны данные из одного эксперимента по связыванию нейтрофилов и типичного эксперимента по связыванию эозинофилов, n = 2.
Фигура 13 представляет собой табличное изображение, показывающее аффинность 9А2-VR24.29 IgG или 9А2-VR24.29 Fab в отношении нейтрофилов, эозинофилов или TF1-клеток.
На фигурах 14A-J представлены графические изображения, показывающие, что 9А2-VR24.29 ингибирует выживание клеток, выделенных из ткани человека при воспалении дыхательных путей. На панели (A) показан анализ образцов мокроты у пациентов с легкой атопической астмой на исходном уровне (закрашенные символы) и через 24 часа после сенсибилизации ингалируемым аллергеном (незакрашенные символы), которые были собраны, и были сделаны цитоспины для дифференциальных подсчетов клеток, и была определена процентная доля для присутствующих типов клеток. На панели (B) показаны результаты анализа образцов мокроты, инкубированных с 9А2-VR24.29 (100 мкг/мл) или с изотипным контролем (100 мкг/мл) при 37 °C в течение 24 ч, и клетки проанализированы на жизнеспособность с использованием проточной цитометрии. Данные выражены как жизнеспособность клеток в процентах по сравнению с изотипным контролем для каждого донора. На панели (C) показаны результаты анализа образцов мокроты, инкубированных с 9А2-VR24.29 (100 мкг/мл) или с изотипным контролем (100 мкг/мл) при 37 °C в течение 24 часов в присутствии 1 нг/мл каждого из IL-3, GM-CSF и IL-5, и клетки проанализированы на жизнеспособность с использованием проточной цитометрии. Неадгезионные мононуклеарные клетки (NAMC) из образцов (D-E) костного мозга и (F-G) крови, собранные в начале исследования и через 24 часа после сенсибилизации ингалируемым аллергеном у аллергических астматических субъектов, инкубировали с 9А2-VR24.29 (100 мкг/мл, закрашенные столбики) или mAb изотипного контроля (100 мкг/мл, незакрашенные столбики) при 37 °C в течение 24 ч в присутствии разбавителя (отриц.), или 1 нг/мл каждого из IL-3, GM-CSF и IL-5, или объединенных цитокинов (все), и были подсчитаны (D, F) GM CFU и (E, G) Eo/Baso CFU. Панель (H) показывает, что эозинофилы были преобладающим типом клеток в нестимулированных клетках носового полипа, культивируемых ex vivo. Панель (I) показывает, что 9А2-VR24.29 ингибирует выживание нестимулированных эозинофилов, выделенных из NP-ткани через 72 часа выращивания в культуре. Панель (J) показывает влияние 9А2-VR24.29 на выживаемость культивируемых клеточных инфильтратов по сравнению с преднизолоном и индивидуальными антителами к β-цепям. Данные представляются в виде разброса вокруг среднего значения и 95%-ных доверительных интервалов. ns, не достоверно p> 0,05; * p <0,05; ** p <0,01; *** p <0,005.
Фигура 15 представляет собой графическое изображение, показывающее результаты анализа Luminex супернатантов клеточных инфильтратов тканей носового полипа от 12 различных доноров, культивируемых в течение 5 дней. Суспензии одиночных клеток анализировали на различные концентрации хемокинов и цитокинов с помощью анализов Luminex human 42-plex bead assays. Показаны концентрации для каждого аналита для каждого отдельного донора, n = 12 доноров.
На фигурах 16A-O представлены графические изображения, показывающие, что 9А2-VR24.29 ингибирует активацию первичных миелоидных клеток после стимуляции цитокинами семейства CD131. (А) Первичные человеческие нейтрофилы предварительно обрабатывали с 9А2-VR24.29, стимулировали с GM-CSF в течение 18 ч, и их активацию определяли путем изменения прямого рассеяния с помощью проточной цитометрии. (B) Первичные человеческие базофилы предварительно обрабатывали с 9А2-VR24.29, стимулировали с IL-3 в течение 18 ч, и высвобождение IL-8 определяли с помощью ELISA. (C) pDC предварительно обрабатывали с 9А2-VR24.29, стимулировали с IL-3 в течение 24 ч, и выживаемость клеток определяли с помощью ViaLight® Plus Cell Proliferation and Cytotoxicity BioAssay. (D-E) Первичные человеческие эозинофилы выделяли от нормальных здоровых доноров, затем предварительно обрабатывали с (D) 9А2-VR24.29 перед стимуляцией с IL-5, и определяли изменение бокового рассеяния с помощью проточной цитометрии, или с (E) 9А2-VR24.29  , анти-IL-5Rα
, анти-IL-5Rα  анти-IL-3Rα
анти-IL-3Rα  анти-GM-CSFRα
анти-GM-CSFRα  или сочетанием анти-IL-5Rα, анти- IL-3Rα и анти- GM-CSFRα
или сочетанием анти-IL-5Rα, анти- IL-3Rα и анти- GM-CSFRα  перед обработкой коктейлем из IL-3, IL-5, GM-CSF в течение 72 ч, и определяли выживаемость клеток. Показаны данные из типичных экспериментов, n = 5. Эозинофилы обрабатывали с (F) IL-3, (G) GM-CSF и (H) IL-5 при концентрациях EC80 и определяли выживаемость клеток. Пунктирная линия указывает количество клеток в отсутствие стимуляции. Эозинофилы предварительно обрабатывали тестируемыми антителами (I) анти-IL-3Rα
перед обработкой коктейлем из IL-3, IL-5, GM-CSF в течение 72 ч, и определяли выживаемость клеток. Показаны данные из типичных экспериментов, n = 5. Эозинофилы обрабатывали с (F) IL-3, (G) GM-CSF и (H) IL-5 при концентрациях EC80 и определяли выживаемость клеток. Пунктирная линия указывает количество клеток в отсутствие стимуляции. Эозинофилы предварительно обрабатывали тестируемыми антителами (I) анти-IL-3Rα  (J) анти-GMRα
(J) анти-GMRα  и (K) анти-IL-5Rα
и (K) анти-IL-5Rα  перед обработкой с (F) IL-3, (G) GM-CSF (H) IL-5, в течение 72 ч и определяли выживаемость клеток. (L-N) HCMC предварительно обрабатывали 9А2-VR24.29 в течение 1 часа перед добавлением IL-3 (1 нг/мл), IL-5 (10 нг/мл) или GM-CSF (1 нг/мл) для дополнительной инкубации в течение 48 ч. Человеческий миеломный IgE (0,5 мкг/мл) добавляли за 20 ч перед анти-IgE-стимуляцией. После инкубации обновляли среду и затем HCMC стимулировали с помощью анти-IgE (1 мкг/мл) в присутствии IL-3 (1 нг/мл) для (L) высвобождения TNF (18 часов) и (M) высвобождения IL-13 (8 часов), и (N) IL-3 (1 нг/мл), IL-5 (10 нг/мл) или GM-CSF (1 нг/мл) для высвобождения IL-8 (8 часов). анти-IgE
перед обработкой с (F) IL-3, (G) GM-CSF (H) IL-5, в течение 72 ч и определяли выживаемость клеток. (L-N) HCMC предварительно обрабатывали 9А2-VR24.29 в течение 1 часа перед добавлением IL-3 (1 нг/мл), IL-5 (10 нг/мл) или GM-CSF (1 нг/мл) для дополнительной инкубации в течение 48 ч. Человеческий миеломный IgE (0,5 мкг/мл) добавляли за 20 ч перед анти-IgE-стимуляцией. После инкубации обновляли среду и затем HCMC стимулировали с помощью анти-IgE (1 мкг/мл) в присутствии IL-3 (1 нг/мл) для (L) высвобождения TNF (18 часов) и (M) высвобождения IL-13 (8 часов), и (N) IL-3 (1 нг/мл), IL-5 (10 нг/мл) или GM-CSF (1 нг/мл) для высвобождения IL-8 (8 часов). анти-IgE  анти-IgE+IL-3
анти-IgE+IL-3  анти-IgE+GM-CSF (), анти-IgE+IL-5
анти-IgE+GM-CSF (), анти-IgE+IL-5  анти-IgE+IL-3+9А2-VR24.29
анти-IgE+IL-3+9А2-VR24.29  анти-IgE+GM-CSF+9А2-VR24.29
анти-IgE+GM-CSF+9А2-VR24.29  анти-IgE+IL-5+9А2-VR24.29
анти-IgE+IL-5+9А2-VR24.29  Уровни цитокинов в супернатантах измеряли с помощью ELISA. Значительные различия в высвобождении цитокинов в отсутствие или в присутствии 9А2-VR24.29 анализировали однонаправленным ANOVA с посттестом Даннета, * p < 0,05, ** p < 0,01, *** p < 0,001. Все значения выражены как среднее + SEM для 4 независимых экспериментов. (O) Клетки CD34 + BM предварительно обрабатывали 9А2-VR24.29
Уровни цитокинов в супернатантах измеряли с помощью ELISA. Значительные различия в высвобождении цитокинов в отсутствие или в присутствии 9А2-VR24.29 анализировали однонаправленным ANOVA с посттестом Даннета, * p < 0,05, ** p < 0,01, *** p < 0,001. Все значения выражены как среднее + SEM для 4 независимых экспериментов. (O) Клетки CD34 + BM предварительно обрабатывали 9А2-VR24.29  , анти-IL-5R
, анти-IL-5R  анти-IL-3R 〈
анти-IL-3R 〈  анти-GM-CSFR 〈
анти-GM-CSFR 〈  или анти-IL-5R 〈, анти-IL-3R 〈, анти-GM-CSFR 〈 в комбинации
или анти-IL-5R 〈, анти-IL-3R 〈, анти-GM-CSFR 〈 в комбинации  и выращивали в полутвердых средах, содержащих SCF (50 нг/мл), IL-3 (10 нг/мл), IL-5 (10 нг/мл) и GM-CSF (10 нг/мл). Клетки инкубировали при 37 °C в течение от 14 до 16 дней и подсчитывали колонии. Все значения выражены как среднее + S.E.M. Все эксперименты повторяли по меньшей мере 4 раза с показанными типичными экспериментами.
и выращивали в полутвердых средах, содержащих SCF (50 нг/мл), IL-3 (10 нг/мл), IL-5 (10 нг/мл) и GM-CSF (10 нг/мл). Клетки инкубировали при 37 °C в течение от 14 до 16 дней и подсчитывали колонии. Все значения выражены как среднее + S.E.M. Все эксперименты повторяли по меньшей мере 4 раза с показанными типичными экспериментами.
На фигуре 17A-С представлены графические изображения, показывающие эффект 9А2-VR24.29 на носовые полипы в модели ксенотрансплантата человека. (A) показывает внешний размер полипов, выделенных из модели ксенотрансплантата после обработки с 9А2-VR24.29  или антителом контрольного изотипа
или антителом контрольного изотипа  Мышей обрабатывали антителами в моменты времени, указанные стрелками. Данные представлены как среднее + S.E.M. Было также оценено количество эозинофилов (В) и нейтрофилов (С), инфильтрирующих полипы. р > 0,05; * p < 0,05; ** p < 0,01; *** p < 0,005.
Мышей обрабатывали антителами в моменты времени, указанные стрелками. Данные представлены как среднее + S.E.M. Было также оценено количество эозинофилов (В) и нейтрофилов (С), инфильтрирующих полипы. р > 0,05; * p < 0,05; ** p < 0,01; *** p < 0,005.
Фигуры 18A-G представляют собой ряд графических изображений, показывающих, что 9А2-VR24.29 ингибирует выживание воспалительных клеток ксенотрансплантата носового полипа человека in vivo. Ксенотрансплантаты носовых полипов обрабатывались еженедельно, в общей сложности, 4 подкожными внутриполиповыми инъекциями изотипически контрольного mAb или 9А2-VR24.29 (5 мг/кг/инъекция), и полипы вырезали через 5 недель после трансплантации. (A) Окрашенные толуидином синим тучные клетки/мм2 (n = 11 мышей на лечение, образцы от 9 разных пациентов); (B-G), количество полученных клеток человека из ксенотрансплантатов носовых полипов, определенное проточным цитометрическим анализом (В) эозинофилов (CD16- CD15+ CD49d+ Siglec8+); (C) нейтрофилов (CD14- CD49d- CD15+ CD16+); (D) макрофагов (CD16- CD49d- CD14+ CD15+); (E) В-клеток (CD45+ CD19+ CD20+); (F) плазматических В-клеток (CD45+ CD19+ CD138+); и (G) Т-клеток (CD3+CD4+, CD3+CD8+, CD3+CD4+CD8+). Данные: среднее ± диапазон; (B-D) n = 14 мышей/лечение, образцы носового полипа от 6 разных пациентов; (E-G) n = 6 или 7 мышей для mAb контрольного изотипа и 9А2-VR24.29, соответственно, 3 разных пациента с носовым полипом; (A, D-G) * p <0,05 Mann-Whitney U или (B) *p <0,05 тест Уилкоксона (Wilcoxon Signed Rank test) для указанных сравнений; ns = незначительно.
На фигурах 19A-D представлены графические изображения, показывающие, что 9А2-VR24.29 конкурирует с IL-3, GM-CSF и IL-5 за связывание с первичными человеческими миелоидными клетками и человеческими TF-1-клетками. Очищенные человеческие эозинофилы предварительно инкубировали с 9А2-VR24.29  или с контрольным антителом IgG4 человека
или с контрольным антителом IgG4 человека  (A) Затем клетки уравновешивали с 340 пкМ меченого радиоактивным иодом IL-3, (B) 40 пкМ меченного радиоактивным иодом GM-CSF (С) 200 пкМ меченного радиоактивным иодом IL-5. Каждая точка представляет собой среднее значение повторяющихся определений связанного с клеткой меченного радиоактивным иодом цитокина, и столбики, обозначающие ошибки, представляют собой стандартное отклонение. Показаны данные из типичных экспериментов, n = 2. (D) TF-1 клетки предварительно инкубировали с IL-3
(A) Затем клетки уравновешивали с 340 пкМ меченого радиоактивным иодом IL-3, (B) 40 пкМ меченного радиоактивным иодом GM-CSF (С) 200 пкМ меченного радиоактивным иодом IL-5. Каждая точка представляет собой среднее значение повторяющихся определений связанного с клеткой меченного радиоактивным иодом цитокина, и столбики, обозначающие ошибки, представляют собой стандартное отклонение. Показаны данные из типичных экспериментов, n = 2. (D) TF-1 клетки предварительно инкубировали с IL-3  , GM-CSF
, GM-CSF  или IL-5
или IL-5  , затем клетки уравновешивали с 85 пкМ меченного радиоактивным иодом 9А2-VR24.29. Каждая точка представляет собой среднее значение двойных определений связанных с клеткой меченного радиоактивным иодом 9А2-VR24.29, и столбики, обозначающие ошибки, представляют собой стандартное отклонение. Показаны данные из типичного эксперимента, n = 3.
, затем клетки уравновешивали с 85 пкМ меченного радиоактивным иодом 9А2-VR24.29. Каждая точка представляет собой среднее значение двойных определений связанных с клеткой меченного радиоактивным иодом 9А2-VR24.29, и столбики, обозначающие ошибки, представляют собой стандартное отклонение. Показаны данные из типичного эксперимента, n = 3.
На фигурах 20A-D представлено графическое изображение интерфейса взаимодействия между 9А2-VR24.29 и CD131 в сайте 2. (A) Наложение комплекса CD131/9А2-VR24.29 Fab на третичную структуру рецептора GM-CSF, показывающее перекрытие интерфейса взаимодействия между 9А2-VR24.29 Fab (тяжелая цепь показана оранжевым цветом и легкая цепь показана желтым цветом) и GM-CSF (серый). Димер CD131 из третичной структуры GM-CSF окрашен в зеленый и фиолетовый цвета. (B) С помощью визуализации поверхности показаны важнейшие остатки на поверхности димера CD131, которые взаимодействуют с 9А2-VR24.29. Отдельные остатки окрашены, чтобы обозначить эффект специфических мутаций с замещением аланина на аффинность связывания 9А2-VR24.29: мутации, которые приводят к отсутствию связывания или незначительному связыванию, окрашены красным цветом, мутации, которые уменьшают связывание в диапазоне от 10-5 до 10-7 М, показаны желтым цветом, и мутации, улучшающие связывание, показаны синим цветом. Подробные взаимодействия с участием последовательностей CDR H1-H3 и CDR L1 и L3 показаны в соседних панелях с масштабированием. Полярные взаимодействия показаны как черные ломаные линии, и важнейшие ван-дер-ваальсовые взаимодействия показаны желтым цветом. Все фигуры были сделаны с использованием программы PyMOL. (C) Показаны важнейшие остатки CD131 (Y365 и H367), участвующие в образовании сети взаимодействия р-р с D101 и Y100 из CDR H3. Водородные связи показаны как черные ломаные линии, и ван-дер-ваальсовы контакты обозначены желтыми ломаными линиями. (D) Показано участие F103 и I338 в стабилизации боковой цепи Y39 на CD131, показана водородная связь между Y39 и D101 из CDR H3. Водородные связи показаны как черные ломаные линии и ван-дер-ваальсовы контакты обозначены желтыми ломаными линиями.
На фигурах 21A-J представлены графические изображения, показывающие воздействие 9А2-VR24.29 и преднизолона на носовые полипы в модели ксенотрансплантата человека. (A) показывает внешний размер полипов, выделенных из модели ксенотрансплантата, после обработки 9А2-VR24.29, преднизолоном, физиологическим раствором или антителом контрольного изотипа. Мышей обрабатывали антителами в моменты времени, указанные стрелками. Данные представлены как среднее + S.E.M. # p <0,05;** p <0,01. (B) показывает массу полипов, выделенных из модели ксенотрансплантата, после обработки 9А2-VR24.29, преднизолоном, физиологическим раствором или антителом контрольного изотипа. (C-J) число полученных восстановившихся человеческих клеток из ксенотрансплантатов носовых полипов, определенных способом проточного цитометрического анализа, (C) эозинофилов (CD16- CD15+ CD49d+ Siglec8+); (D) нейтрофилов (CD14- CD49d- CD15+ CD16+); (E) макрофагов (CD16- CD49d- CD14+ CD15+); (F-H) Т-клеток (CD3+CD4+, CD3+CD8+, CD3+CD4+CD8+, соответственно); (I) В-клеток (CD45+ CD19+ CD20+; CD45+ CD19+ CD138+). (J) Плазматические клетки. Данные: среднее ± диапазон; (A) #p <0,05, ## p <0,01, * * p <0,01, *** p <0,005 Двухсторонний дисперсионный анализ ANOVA с поправкой Бонферрони; или (B-J) критерий Крускала-Уоллиса * p <0,05.
На фигурах 22A-B представлены графические изображения, показывающие воздействие 9А2-VR24.29 и преднизолона на число носовых полипов и образование слизи в модели ксенотрансплантата человека. (А) показывает число окрашенных толуидином синим тучных клеток/мм2; и (B) площадь слизи (мм2) из полипов, выделенных из модели ксенотрансплантата после обработки 9А2-VR24.29, преднизолоном, физиологическим раствором или антителом контрольного изотипа. Данные: среднее ± диапазон; тест Крускала-Уоллиса * p <0,05.
На фигурах 23A-B представлено графическое изображение, показывающее воздействие 9А2-VR24.29, вводимого внутрь полипа и системно, на носовые полипы в модели ксенотрансплантата человека. (А) показывает внешний размер полипов и (В) массу полипов, выделенных из модели ксенотрансплантата, после внутриполипной или системной обработки с 9А2-VR24.29 или антителом контрольного изотипа.
ПОДРОБНОЕ ОПИСАНИЕ
Общее
По всему тексту данной спецификации, если специально не указано иное или контекст не требует иного, ссылка на одну стадию, композицию вещества, группу стадий или группу композиций вещества должна приниматься для охвата одного и нескольких (то есть одного или более) из данных стадий, композиций вещества, групп стадий или групп композиций вещества.
Специалисты в данной области техники поймут, что настоящее раскрытие восприимчиво к изменениям и модификациям, отличным от тех, которые конкретно описаны. Следует понимать, что данное раскрытие включает все такие варианты и модификации. Раскрытие изобретения также включает все стадии, признаки, композиции и соединения, упомянутые или указанные в данном описании, индивидуально или коллективно, и любые и все комбинации или любые две или более упомянутых стадий или признаков.
Настоящее раскрытие не должно ограничиваться рамками конкретных примеров, описанных в настоящем изобретении, которые предназначены только для примера. Функционально эквивалентные продукты, композиции и способы, несомненно, входят в объем настоящего изобретения.
Любой пример настоящего изобретения в настоящем изобретении должен быть применен mutatis mutandis (с соответствующими изменениями) к любому другому примеру настоящего изобретения, если конкретно не указано иное.
Любой пример настоящего изобретения, относящийся к CD131-связывающему белку, будет взят для применения с соответствующими изменениями к CD131-связывающему антителу.
Любой пример настоящего изобретения, относящегося к CD131-связывающему белку, будет взят для применения с соответствующими изменениями к CD131-связывающему соединению
Если специально не определено иначе, все технические и научные термины, используемые в настоящем изобретении, должны приниматься с тем же значением, которое обычно понимается специалистом в данной области техники (например, в культуре клеток, молекулярной генетике, иммунологии, иммуногистохимии, химии белка и биохимии).
Если не указано иное, рекомбинантный белок, клеточная культура и иммунологические способы, используемые в настоящем описании, являются стандартными процедурами, хорошо известными специалистам в данной области техники. Такие способы описаны и объяснены во всей литературе в таких источниках, как J. Perbal, A Practical Guide to Molecular Cloning, John Wiley and Sons (1984), J. Sambrook et al. Molecular Cloning: A Laboratory Manual, Cold Spring Harbour Laboratory Press (1989), T.A. Brown (издатель), Essential Molecular Biology: A Practical Approach, Volumes 1 and 2, IRL Press (1991), D.M. Glover and B.D. Hames (издатели), DNA Cloning: A Practical Approach, Volumes 1-4, IRL Press (1995 and 1996), и F.M. Ausubel et al. (издатели), Current Protocols in Molecular Biology, Greene Pub. Associates and Wiley-Interscience (1988, включая все обновления до настоящего времени), Ed Harlow and David Lane (издатели) Antibodies: A Laboratory Manual, Cold Spring Harbour Laboratory, (1988), и J.E. Coligan et al. (издатели) Current Protocols in Immunology, John Wiley & Sons (включая все обновления до настоящего времени).
Описание и определения вариабельных областей и их частей, иммуноглобулинов, антител и их фрагментов в настоящем документе могут быть дополнительно уточнены в обсуждении в Kabat Sequences of Proteins of Immunological Interest, National Institutes of Health, Bethesda, Md., 1987 and 1991, Bork et al., J Mol. Biol. 242, 309-320, 1994, Chothia and Lesk J. Mol Biol. 196:901-917, 1987, Chothia et al. Nature 342, 877-883, 1989 и/или или Al-Lazikani et al., J Mol Biol 273, 927-948, 1997.
Термин «и/или», например «X и/или Y» следует понимать как «X и Y» или «X или Y», и их следует принимать для обеспечения явной поддержки как для всех значений, так и для каждого значения.
Всюду по тексту данной спецификации слово «содержать» или такие вариации, как «содержит» или «содержащий», будут подразумевать включение заявленного элемента, целого числа или стадии или группы элементов, целых чисел или стадий, но не исключение любого другого элемента, целого числа или стадии или группы элементов, целых чисел или стадий.
Используемый в настоящем изобретении термин «производный от» должен быть принят, чтобы указать, что указанное целое число может быть получено из определенного источника, хотя и не обязательно непосредственно из данного источника.
Ссылка на диапазон, например, остатков, будет пониматься как включающая. Например, ссылка на «область, содержащую аминокислоты от 56 до 65», будет понята инклюзивным образом, то есть данная область содержит последовательность аминокислот, пронумерованных 56, 57, 58, 59, 60, 61, 62, 63, 64 и 65 в упомянутой последовательности.
Выбранные определения
Только для номенклатуры и без ограничения служащая примером последовательность CD131 человека (pre-CD131) изложена в справочной последовательности NCBI (NCBI Reference Sequence): NP_000386.1 и номер доступа в Genbank NCBI P32927 (и представлена в SEQ ID NO: 1). Последовательность зрелого человеческого CD131 не содержит аминокислот от 1 до 16 из SEQ ID NO: 1. Позиции аминокислот часто упоминаются в настоящем изобретении со ссылкой на pre-CD131. Позиции в зрелом CD131 легко определяются путем учета сигнальной последовательности (аминокислоты от 1 до 16 в случае SEQ ID NO: 1). Последовательность CD131 от других видов может быть определена с использованием последовательностей, представленных в настоящем изобретении и/или в общедоступных базах данных и/или определяемых с использованием стандартных способов (например, как описано в Ausubel et al., (редакторы), Current Protocols in Molecular Biology, Greene Pub Associates и Wiley-Interscience (1988, включая все обновления до настоящего времени) или Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press (1989)). Ссылка на человеческий CD131 может быть сокращена до hCD131. Ссылка на растворимый CD131 относится к полипептидам, содержащим внеклеточный участок CD131, например аминокислоты от 17 до 438 в SEQ ID NO: 1.
Ссылка в настоящем изобретении на CD131 включает нативные формы CD131 и их мутантные формы, сохраняющие способность связываться с CD131 (например, hCD131) и индуцировать передачу сигнала.
Термин «выделенный белок» или «выделенный полипептид» обозначает белок или полипептид, который, в силу своего происхождения или источника происхождения, не связан с естественно связанными компонентами, которые сопровождают его в его нативном состоянии; практически не содержит других белков из того же источника. Белок может быть практически свободен от естественно связанных компонентов или по существу очищен путем выделения с использованием способов очистки белка, известных в данной области техники. Под «существенно очищенным» подразумевается, что белок по существу не содержит загрязняющих веществ, например по меньшей мере на около 70% или 75%, или 80%, или 85%, или 90%, или 95%, или 96%, или 97%, или 98%, или 99% свободен от загрязнений.
Термин «рекомбинантный» следует понимать как продукт искусственной генетической рекомбинации. Соответственно, в контексте рекомбинантного белка, содержащего антигенсвязывающий домен антитела, данный термин не охватывает антитело, встречающееся естественным образом в организме субъекта, которое является продуктом естественной рекомбинации, которая возникает во время созревания В-клеток. Однако, если такое антитело выделено, его следует рассматривать как выделенный белок, содержащий антигенсвязывающий домен антитела. Аналогично, если нуклеиновая кислота, кодирующая белок, выделяется и экспрессируется с использованием рекомбинантного средства, то полученный белок представляет собой рекомбинантный белок, содержащий антигенсвязывающий домен антитела. Рекомбинантный белок также охватывает белок, экспрессируемый искусственным рекомбинантным средством, когда он находится внутри клетки, ткани или субъекта, например, в которой он экспрессируется.
Термин «белок» следует понимать, как включающий одну полипептидную цепь, то есть ряд смежных аминокислот, связанных пептидными связями, или ряд полипептидных цепей, ковалентно или нековалентно связанных друг с другом (то есть полипептидный комплекс). Например, ряд полипептидных цепей может быть ковалентно связан с использованием подходящей химической или дисульфидной связи. Примеры нековалентных связей включают водородные связи, ионные связи, силы Ван-дер-Ваальса и гидрофобные взаимодействия.
Термин «полипептид» или «полипептидная цепь», как будет понятно из вышеприведенного абзаца, обозначает ряд смежных аминокислот, связанных пептидными связями.
Используемый в настоящем изобретении термин «антигенсвязывающий домен» следует понимать как область антитела, которая способна специфически связываться с антигеном, то есть VH или VL, или Fv, содержащий как VH, так и VL. Антигенсвязывающий домен не обязательно должен быть в контексте целого антитела, например, он может быть выделен (например, доменное антитело) или быть в другом виде, например, как описано в настоящем изобретении, например, как scFv.
Для целей настоящего изобретения термин «антитело» включает в себя белок, способный специфически связываться с одним или несколькими близкородственными антигенами (например, CD131) в силу антигенсвязывающего домена, содержащегося в Fv. Данный термин включает четырехцепочечные антитела (например, две легкие цепи и две тяжелые цепи), рекомбинантные или модифицированные антитела (например, химерные антитела, гуманизированные антитела, человеческие антитела, CDR-привитые антитела, приматированные антитела, деиммунизированные антитела, сингуманизированные антитела, полу-антитела, биспецифические антитела). Антитело обычно содержит константные домены, которые могут быть расположены в константной области или в константном фрагменте или во фрагменте, поддающемся кристаллизации (Fc). Примеры форм антител содержат четырехцепочечную структуру в качестве основной единицы. Полноразмерные антитела состоят из двух ковалентно связанных тяжелых цепей (от 50 до 70 кД) и двух легких цепей (~ 23 кДа каждая). Легкая цепь обычно содержит вариабельную область (если присутствует) и константный домен, и у млекопитающих является либо легкой цепью κ, либо легкой цепью λ. Тяжелая цепь обычно содержит вариабельную область и один или два константных домена, связанных шарнирной областью с дополнительным константным доменом(ами). Тяжелые цепи млекопитающих относятся к одному из следующих типов: α, δ, ε, γ или μ. Каждая легкая цепь также ковалентно связана с одной из тяжелых цепей. Например, две тяжелые цепи и тяжелая и легкая цепи удерживаются вместе межцепочечными дисульфидными связями и нековалентными взаимодействиями. Количество межцепочечных дисульфидных связей может варьироваться у разных типов антител. Каждая цепь имеет N-концевую вариабельную область (VH или VL, каждая из которых имеет длину ~ 110 аминокислот) и один или более константных доменов на С-конце. Константный домен легкой цепи (CL, длина которого составляет ~ 110 аминокислот) выровнен с первым константным доменом тяжелой цепи (CH1, длина которого составляет от 330 до 440 аминокислот) и связан с ним дисульфидными связями. Вариабельная область легкой цепи выровнена с вариабельной областью тяжелой цепи. Тяжелая цепь антитела может содержать 2 или более дополнительных домена CH (таких как CH2, CH3 и тому подобное) и может содержать шарнирную область между константными доменами CH1 и CH2. Антитела могут быть любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса. В одном примере антитело представляет собой мышиное (мышиное или крысиное) антитело или антитело примата (например, человеческое). В одном примере отсутствует С-концевой остаток лизина в тяжелой цепи антитела. В одном примере антитело является гуманизированным, сингуманизированным, химерным, CDR-привитым или деиммунизированным.
Термины «полноразмерное антитело», «интактное антитело» или «цельное антитело» используются взаимозаменяемо, чтобы относиться к антителу в его практически неповрежденной форме, в отличие от антигенсвязывающего фрагмента антитела. В частности, целые антитела включают те антитела, у которых имеются тяжелые и легкие цепи, включая область Fc. Константными доменами могут быть константные домены с последовательностью дикого типа (например, константные домены с последовательностью дикого типа человека) или их варианты аминокислотной последовательности.
Используемый в настоящем изобретении термин «вариабельная область» относится к участкам легкой и/или тяжелой цепей антитела, как определено в настоящем изобретении, которая способна специфически связываться с антигеном и включает аминокислотные последовательности областей, определяющих комплементарность (CDR); т.е. CDR1, CDR2 и CDR3, и каркасных областей (FR). Например, вариабельная область содержит три или четыре последовательности FR (например, FR1, FR2, FR3 и необязательно FR4) вместе с тремя CDR. VH относится к вариабельной области тяжелой цепи. VL относится к вариабельной области легкой цепи.
Используемый в настоящем изобретении термин «области, определяющие комплементарность» (синоним CDR, то есть CDR1, CDR2 и CDR3) относится к аминокислотным остаткам вариабельной области антитела, присутствие которых является основным фактором специфического связывания антигена. Каждый домен вариабельной области (VH или VL) обычно имеет три CDR, идентифицированные как CDR1, CDR2 и CDR3. В одном примере положения аминокислот, присвоенные последовательностям CDR и FR, определены в соответствии с Kabat Sequences of Proteins of Immunological Interest, National Institutes of Health, Bethesda, Md., 1987 и 1991 (также упоминается в настоящем изобретении как «система нумерации Кабата»). В другом примере положения аминокислот, присвоенные последовательностям CDR и FR, определены в соответствии с усовершенствованной схемой нумерации Enhanced Chothia Numbering Scheme (http://www.bioinfo.org.uk/mdex.html). В соответствии с системой нумерации Кабата, последовательности FR и CDR в VH расположены следующим образом: остатки от 1 до 30 (FRl), от 31 до 35 (CDR1), от 36 до 49 (FR2), от 50 до 65 (CDR2), от 66 до 94 (FR3), от 95 до 102 (CDR3) и от 103 до 113 (FR4). В соответствии с системой нумерации Кабата, последовательности FR и CDR в VL расположены следующим образом: остатки от 1 до 23 (FR1), от 24 до 34 (CDR1), от 35 до 49 (FR2), от 50 до 56 (CDR2), от 57 до 88 (FR3), от 89 до 97 (CDR3) и от 98 до 107 (FR4). Настоящее раскрытие не ограничивается последовательностями FR и CDR, как определено системой нумерации Кабата, но включает в себя все системы нумерации, включая систему канонической нумерации или систему нумерации Chothia и Lesk J. Mol. Biol. 196: 901- 917, 1987; Chothia et al., Nature 342: 877- 883, 1989; и/или Al- Lazikani et al., J. Mol. Biol. 273: 927- 948, 1997; систему нумерации Honnegher and Plükthun J. Mol. Biol. 309: 657- 670, 2001; или систему IMGT, обсуждаемую в Giudicelli et al., Nucleic Acids Res. 25: 206-211 1997. В одном примере последовательности CDR определяются в соответствии с системой нумерации Кабата. Необязательно, CDR2 тяжелой цепи в соответствии с системой нумерации Кабата не содержит пять С-концевых аминокислот, перечисленных в настоящем изобретении, или любая одна или более из данных аминокислот замещены другой природной аминокислотой. В данной связи, Padlan et al., FASEB J., 9: 133-139, 1995 установили, что пять С-концевых аминокислот CDR2 тяжелой цепи обычно не участвуют в связывании антигена.
«Каркасные области» (FR) представляют собой те остатки вариабельной области, которые отличаются от остатков CDR.
Используемый в настоящем изобретении термин «Fv» следует понимать как любой белок, состоящий из нескольких полипептидов или одного полипептида, в котором VL и VH ассоциируют и образуют комплекс, имеющий антигенсвязывающий домен, то есть способный к специфически связыванию с антигеном. VH и VL, которые образуют антигенсвязывающий домен, могут находиться в одной полипептидной цепи или в разных полипептидных цепях. Кроме того, Fv по настоящему изобретению (а также любой белок по настоящему изобретению) может иметь множество антигенсвязывающих доменов, которые могут или не могут связывать один и тот же антиген. Данный термин следует понимать как охватывающий фрагменты, непосредственно полученные из антитела, а также белки, соответствующие такому фрагменту, продуцируемому с использованием рекомбинантного средства. В некоторых примерах VH не связан с константным доменом тяжелой цепи (CH) 1 и/или VL не связан с константным доменом легкой цепи (CL). Типичные Fv-содержащие полипептиды или белки включают Fab-фрагмент, Fab-фрагмент, F(ab’)-фрагмент, scFv, диатело, триотело, тетратело или комплекс более высокого порядка или любой из вышеперечисленных, связанный с его константной областью или доменом, например, доменом CH2 или CH3, например, миниантитело. «Fab-фрагмент» состоит из моновалентного антигенсвязывающего фрагмента иммуноглобулина и может быть получен путем переваривания целого антитела ферментом папаином с получением фрагмента, состоящего из цельной легкой цепи и части тяжелой цепи, или может быть получен с использованием рекомбинантного средства. «Fab'-фрагмент» антитела может быть получен путем обработки цельного антитела пепсином с последующим восстановлением, с получением молекулы, состоящей из цельной легкой цепи и части тяжелой цепи, содержащей VH и один константный домен. Два фрагмента Fab' получают из одной молекулы антитела, обработанной таким образом. Фрагмент Fab' также может быть получен рекомбинантным путем. Фрагмент «F(ab')2» антитела состоит из димера двух Fab’-фрагментов, удерживаемых вместе двумя дисульфидными связями, и получается обработкой цельной молекулы антитела ферментом пепсином без последующего восстановления. Фрагмент «Fab2» представляет собой рекомбинантный фрагмент, содержащий два Fab-фрагмента, соединенных с использованием, например, лейциновой молнии или домена CH3. «Одноцепочечный Fv» или «scFv» представляет собой рекомбинантную молекулу, содержащую фрагмент вариабельной области (Fv) антитела, в которой вариабельная область легкой цепи и вариабельная область тяжелой цепи ковалентно связаны подходящим гибким полипептидным линкером.
Используемый в настоящем изобретении термин «связывается» со ссылкой на взаимодействие CD131-связывающего белка или его антигенсвязывающего домена с антигеном означает, что данное взаимодействие зависит от наличия конкретной структуры (например, антигенной детерминанты или эпитопа) на антигене. Например, антитело распознает и связывается со специфической структурой белка, а не с белками в целом. Если антитело связывается с эпитопом «А», присутствие молекулы, содержащей эпитоп «А» (или свободный, немеченый «А»), в реакции, содержащей меченый «А» и белок, уменьшит количество меченого «А», связанного с антителом.
Используемый в настоящем изобретении термин «специфически связывается» или «связывается специфически» означает, что CD131-связывающий белок по настоящему изобретению вступает во взаимодействие или ассоциирует более часто, быстрее, с большей продолжительностью и/или с большей аффинностью с конкретным антигеном или клеткой, экспрессирующей конкретный антиген, чем при использовании альтернативных антигенов или клеток. Например, CD131-связывающий белок связывается с CD131 (например, hCD131 или полипептидом, содержащим область из него, например, полипептидом, содержащим последовательность, представленную в SEQ ID NO: 191) с существенно большей аффинностью (например, от 1,5 раз или 2 раз, или 5 раз, или 10 раз, или 20 раз, или 40 раз, или 60 раз, или 80 раз до 100 раз или 150 раз или 200 раз), чем он делает с другими интерлейкиновыми рецепторами или с антигенами, обычно распознаваемыми полиреактивными встречающимися в природе антителами (т.е. встречающимися в природе антителами, которые, как известно, связывают различные антигены, естественным образом обнаруженные у людей). В примере настоящего изобретения CD131-связывающий белок, который «специфически связывается» с одной формой hCD131 или полипептидом, содержащим его область (например, внеклеточную область hCD131), или полипептидом, содержащим последовательность, представленную в SEQ ID NO: 191, с аффинностью, превышающей по меньшей мере в 1,5 раза или в 2 раза или более (например, в 5 или 10 раз, или в 20 раз, или в 50 раз, или в 100 раз, или в 200 раз) аффинность мутантной формы SEQ ID NO: 191, содержащей последовательность, представленную в SEQ ID NO: 119, 124, 131 или 137. Ссылка на «связывание» обеспечивает явную поддержку термина «специфическое связывание», и наоборот.
Как использовано в данном описании, под термином «не обнаруживаемое связывание» следует понимать в виду, что CD131-связывающий белок, например, антитело, связывается с антигеном-кандидатом на уровне, менее чем на 10%, или 8%, или 6%, или 5% превышающим фон. Фон может быть уровнем сигнала связывания, обнаруживаемым в отсутствие белка и/или в присутствии белка, служащего отрицательным контролем (например, антитела контрольного изотипа), и/или уровня связывания, обнаруживаемого в присутствии антигена отрицательного контроля. Уровень связывания детектируют с использованием биосенсорного анализа (например, Biacore), в котором антиген (например, полипептид) иммобилизован и контактирует с CD131-связывающим белком.
Как использовано в данном описании, термин «не связывается существенно» следует понимать как означающий, что уровень связывания CD131-связывающего белка по настоящему изобретению с полипептидом не превышает статистически значимо фон, например, уровень сигнала связывания, обнаруживаемого в отсутствие CD131-связывающего белка и/или в присутствии белка, служащего отрицательным контролем (например, антитела контрольного изотипа), и/или уровень связывания, детектируемый в присутствии отрицательного контрольного полипептида. Уровень связывания детектируют с использованием биосенсорного анализа (например, Biacore), в котором антиген (например, полипептид) иммобилизован и контактирует с CD131-связывающим белком.
Как используется в настоящем изобретении, фразы, относящиеся к «уменьшенному связыванию» или «связыванию на более низком уровне» по отношению к антигену, будут пониматься как означающие, что CD131-связывающий белок, например, антитело, связывается с антигеном (например, мутантом последовательности SEQ ID NO: 191, как описано в настоящем изобретении, например, мутантом, содержащим последовательность, представленную в SEQ ID NO: 119, 124, 131 или 137) с аффинностью, по меньшей мере около 1,5 раз или 2 раз, или 5 раз, или 10 раз, или 20 раз, или 50 раз, или 100 раз меньше, чем контрольный эпитоп или антиген (например, SEQ ID NO: 191).
Можно считать, что CD131-связывающий белок или антитело «преимущественно связывается» с полипептидом, если он связывается с таким полипептидом с константой диссоциации (KD), которая меньше, чем КD белка или антитела для другого полипептида. В одном примере считается, что CD131-связывающий белок или антитело преимущественно связывается с полипептидом, если он связывает полипептид с аффинностью (т.е. KD), которая превышает по меньшей мере в около 1,5 раза или 2 раза, или 5 раз, или 10 раз, или 20 раз, или 50 раз, или 100 раз, или 200 раз KD белка или антитела для другого полипептида.
Для целей разъяснения и, как будет очевидно специалисту в данной области техники, на основе приведенного в настоящем изобретении примера, ссылка на «аффинность» в данном описании является ссылкой на KD белка или антитела.
В целях пояснения и, как будет очевидно специалисту в данной области на основе описания в настоящем документе, следует понимать, что ссылка на «аффинность, составляющую по меньшей мере около» означает, что аффинность (или KD) равна упомянутому значению или выше (т.е. значение, указанное как аффинность, ниже), т.е. аффинность, равная 2 нM, больше, чем аффинность, равная 3 нM. Иными словами, данный термин может быть «аффинностью, равной X или менее», где X представляет собой значение, указанное в настоящем изобретении.
«IC50, составляющая по меньшей мере около», будет означать, что IC50 равна упомянутому значению или ниже (то есть значение, указанное как IC50, ниже), то есть IC50, равная 2 мкг/мл, больше, чем IC50, равная 1 мкг/мл. С другой стороны, данный термин может быть «IC50, равная X или менее», где X представляет собой значение, указанное в настоящем изобретении.
Используемый в настоящем изобретении термин «эпитоп» (синоним «антигенная детерминанта») следует понимать как область CD131, с которой связывается CD131-связывающий белок, содержащий антигенсвязывающий домен антитела. Данный термин не обязательно ограничивается конкретными остатками или структурой, с которыми связывается CD131-связывающий белок. Так, например, данный термин включает в себя область, охватывающую аминокислоты, контактирующие с CD131-связывающим белком и с от 5 до 10 (или более) или от 2 до 5 или от 1 до 3 аминокислот за пределами данной области. В некоторых примерах эпитоп содержит ряд расположенных прерывисто аминокислот, которые расположены близко друг к другу, когда CD131-полипептид свернут и, например, ассоциирован с другим C131-полипептидом, то есть с «конформационным эпитопом».
Термин «конкурентно ингибирует» следует понимать как означающий, что CD131-связывающий белок по настоящему изобретению (или его антигенсвязывающий домен) уменьшает или предотвращает связывание указанного антитела или C131-связывающего белка с CD131, например, с CD131. Это может быть связано со связыванием CD131-связывающего белка (или антигенсвязывающего домена) и антитела с тем же или перекрывающимся эпитопом. Из вышеизложенного будет очевидно, что CD131-связывающий белок не обязательно полностью ингибирует связывание антитела, а требует только уменьшения связывания статистически значимым количеством, например, по меньшей мере, на 10% или 20%, или 30%, или 40%, или 50%, или 60%, или 70%, или 80%, или 90%, или 95%. Например, CD131-связывающий белок снижает связывание антитела по меньшей мере на 30%, например, по меньшей мере на около 50%, например, по меньшей мере на 70%, например, по меньшей мере на 75%, даже больше предпочтительно, по меньшей мере на около 80% или 85%, например, по меньшей мере на 90%. Способы определения конкурентного ингибирования связывания известны в данной области техники и/или описаны в настоящем изобретении. Например, антитело подвергается воздействию CD131 либо в присутствии, либо в отсутствие CD131-связывающего белка. Если меньшее количество антител связывается в присутствии CD131-связывающего белка, чем в отсутствие CD131-связывающего белка, считается, что белок препятствует связыванию антитела. В одном примере конкурентное торможение происходит не из-за стерических препятствий.
«Перекрывание» в контексте двух эпитопов должно означать, что два эпитопа имеют достаточное количество общих аминокислотных остатков, чтобы позволить CD131-связывающему белку (или его антигенсвязывающему домену), который связывается с одним эпитопом, конкурентно ингибировать связывание CD131-связывающего белка (или его антигенсвязывающего домена), который связывается с другим эпитопом. Например, «перекрывающиеся» эпитопы содержат по меньшей мере 1 или 2, или 3, или 4, или 5, или 6, или 7, или 8, или 9, или 20 аминокислот.
Используемый в настоящем изобретении термин «нейтрализовать» следует понимать как означающий, что белок способен блокировать, уменьшать или предупреждать CD131-опосредованную передачу сигнала в клетке с помощью IL-3, IL-5 и/или GM-CSF. Способы определения нейтрализации известны в данной области техники и/или описаны в настоящем изобретении.
Используемый в настоящем изобретении термин «состояние» относится к нарушению или вмешательству в нормальную функцию и не должен ограничиваться каким-либо конкретным состоянием и будет включать в себя заболевания или расстройства.
Как используется в настоящем изобретении, «состояние, связанное с CD131», относится к любому состоянию, которое вызвано или связано с избытком CD131 или клеток, экспрессирующих CD131. Специалист в данной области техники может легко определить такие условия. Типичные условия описаны в настоящем изобретении.
Используемые в настоящем изобретении термины «предотвращающий», «предотвращать» или «предотвращение» включают в себя введение CD131-связывающего белка по настоящему изобретению, чтобы тем самым остановить или затруднить развитие по меньшей мере одного симптома состояния. Данный термин также охватывает лечение субъекта в состоянии ремиссии, чтобы предотвратить или затруднить рецидив.
Используемые в настоящем изобретении термины «лечение», «лечить» или «проводить лечение» включают введение CD131-связывающего белка, описанного в настоящем изобретении, чтобы таким образом уменьшить или устранить по меньшей мере один признак определенного заболевания или состояния.
Используемый в настоящем изобретении термин «субъект» следует понимать как любое животное, включая людей, например млекопитающее. Примеры субъектов включают, но не ограничиваются ими, людей и приматов, не являющихся людьми. Например, субъект представляет собой человека.
Антитела
В одном примере CD131-связывающий белок, как описано в настоящем изобретении, в соответствии с любым примером, представляет собой антитело.
Способы получения антител известны в данной области и/или описаны в Harlow and Lane (редакторы). A Laboratory Manual, Cold Spring Harbor Laboratory, (1988). Как правило, в таких способах CD131 (например, hCD131) или его область (например, внеклеточная область, например, содержащая последовательность, представленную в SEQ ID NO: 191), или иммуногенный фрагмент или его эпитоп или клетку, экспрессирующую и отображающую то же самое (т.е. иммуноген), необязательно с любым подходящим или желательным носителем, адъювантом или фармацевтически приемлемым эксципиентом, вводят животному, не являющемуся человеком, например мыши, курице, крысе, кролику, морской свинке, собаке, лошади, корове, козе или свинье. Иммуноген можно вводить интраназально, внутримышечно, подкожно, внутривенно, внутрикожно, внутрибрюшинно или другим известным путем.
Производство поликлональных антител можно контролировать, отбирая кровь иммунизованного животного в различные моменты после иммунизации. Можно сделать одну или более дополнительных иммунизаций, если требуется для достижения желаемого титра антител. Процесс стимулирования и титрования повторяется до тех пор, пока не будет достигнут подходящий титр. Когда достигается желаемый уровень иммуногенности, у иммунизированного животного отбирают кровь и выделяют и хранят сыворотку, и/или животное используют для получения моноклональных антител (mAb).
Моноклональные антитела представляют собой один пример формы антитела, предусмотренной настоящим изобретением. Термин «моноклональное антитело» или «mAb» относится к гомогенной популяции антител, способной связываться с одним и тем же антигеном(ами), к примеру, с тем же эпитопом в пределах антигена. Данный термин не предназначен для ограничения в отношении источника антитела или способа его изготовления.
Для получения mAb может использоваться любой из ряда известных способов, таких как, например, процедура, проиллюстрированная в US4196265 или у Harlow and Lane (1988), см. выше.
Например, подходящее животное иммунизируют иммуногеном в условиях, достаточных для стимуляции клеток, продуцирующих антитела. Грызуны, такие как кролики, мыши и крысы, являются типичными животными. Мыши, генетически сконструированные для экспрессии человеческих антител и, например, не экспрессирующие мышиные антитела, также могут быть использованы для получения антитела по настоящему изобретению (например, как описано в WO2002/066630).
После иммунизации соматические клетки, способные продуцировать антитела, в частности, B-лимфоциты (В-клетки), выбирают для использования в протоколе получения mAb. Данные клетки могут быть получены из биопсий селезенки, миндалин или лимфатических узлов или из образца периферической крови. В-клетки иммунизованного животного затем сливают с клетками «бессмертной линии» клеток миеломы, обычно получаемой из тех же видов, что и животное, которое было иммунизировано иммуногеном.
Гибриды амплифицируют культурой в селективной среде, содержащей агент, который блокирует синтез нуклеотидов de novo в среде для культивирования тканей. Типичными агентами являются аминоптерин, метотрексат и азасерин.
Амплифицированные гибридомы подвергают функциональному отбору в отношении специфичности антител и/или по титру, такому как, например, проточная цитометрия и/или иммуногистохимический и/или иммунологический анализы (например, радиоиммунологический анализ, иммуноферментный анализ на фермент, анализ цитотоксичности, анализ налета, точечный иммуноанализ и тому подобное).
Альтернативно, технология ABL-MYC (NeoClone, Madison WI 53713, США) используется для получения линий клеток, секретирующих MAb (например, как описано в Largaespada et al., J. Immunol. Methods 197: 85- 95, 1996).
Антитела также могут быть получены или выделены путем скрининга библиотеки дисплея, например библиотеки фагового дисплея, например, как описано в US6300064 и/или US5885793. Например, авторы настоящего изобретения выделили полностью человеческие антитела из библиотеки фагового дисплея.
Как описано в настоящем изобретении, некоторые CD131-связывающие белки по настоящему изобретению, которые связывают CD131, перекрестно реагируют с некоторыми мутантными формами CD131 или полипептидами, включающими области CD131, которые были мутированы и/или не являются другими. Данные характеристики могут быть использованы для получения антитела или CD131-связывающего белка.
Например, библиотеку фагового дисплея подвергают скринингу полипептидом, содержащим SEQ ID NO: 1 или 191, для идентификации белков, которые связываются с ним. Мутантные формы полипептида (например, содержащие последовательность, представленную в SEQ ID NO: 119, 124, 131 или 137), связывание CD131-связывающего белка с которыми не обнаруживается или происходит на пониженном уровне, затем используют для удаления перекрестно-реактивных белков и/или мутантных форм полипептида (например, содержащие последовательность, представленную в SEQ ID NO: 135, 136, 138 или 142, с которой связывается CD131-связывающий белок, используются для выделения белков, которые являются правильно перекрестно-реактивными. Процесс скрининга для иммунизации не относящегося к человеку млекопитающего также может быть разработан на основе вышеизложенного.
В следующем примере CD131 или его внеклеточная область (необязательно мутантная форма, с которой связывается антитело 9А2) или клетка, экспрессирующая CD131, контактирует с 9А2. Библиотеку фагового дисплея затем вводят в контакт с CD131 или его областью, или клеткой, и отбирают экспрессируемые фагом белки, которые могут конкурировать с антителом за связывание.
Антитело по настоящему изобретению может быть синтетическим антителом. Например, антитело представляет собой химерное антитело, гуманизированное антитело, человеческое антитело, сингуманизированное антитело, приматизированное антитело или деиммунизированное антитело.
Деиммунизированные, химерные, CDR-привитые, гуманизированные, сингуманизированные, приматизированные, человеческие и составные CD131- связывающие белки
CD131-связывающие белки по настоящему изобретению могут представлять собой CDR-привитые белки, которые включают в себя последовательности CDR из антитела из не относящегося к человеку вида (например, мыши или крысы, или не являющегося человеком примата), привитые на FR или вставленные в FR из человеческого антитела, или которые включают последовательности CDR из антитела из одного типа антитела (например, одного типа человеческого антитела), привитые на FR или вставленные в FR из другого типа антитела (например, другого типа человеческого антитела). Данный термин также охватывает составной CD131-связывающий белок, включающий, например, одну или более вариабельных областей с привитыми CDR и одну или более, например, человеческих вариабельных областей, химерных вариабельных областей, сингуманизированных вариабельных областей или приматизированных вариабельных областей.
CD131-связывающие белки по настоящему изобретению могут представлять собой гуманизированные белки.
Термин «гуманизированный белок» следует понимать как относящийся к белку, содержащему человекоподобную вариабельную область, которая включает в себя последовательности CDR из антитела из не относящегося к человеку вида (например, мыши или крысы, или не являющегося человеком примата), привитые на FR или вставленные в FR из человеческого антитела (данный тип антитела попадает в класс «CDR-привитого антитела»). Гуманизированные CD131-связывающие белки также включают белки, в которых один или несколько остатков человеческого белка модифицированы одной или несколькими аминокислотными заменами и/или один или несколько FR-остатков белка человека заменены соответствующими остатками, отличными от таковых у человека. Гуманизированные белки могут также содержать остатки, которые не обнаружены ни в человеческом антителе, ни в нечеловеческом антителе. Любые дополнительные области белка (например, область Fc) обычно являются человеческими. Гуманизация может быть выполнена с использованием способа, известного в данной области техники, например US5225539, US6054297, US7566771 или US5585089. Термин «гуманизированный белок» также охватывает супер-гуманизированный белок, например, как описано в патенте США 7732578. Данный термин также охватывает составной белок, включающий, например, одну или более гуманизированных вариабельных областей и одну или более, например, человеческих вариабельных областей, химерных вариабельных областей, сингуманизированных вариабельных областей или приматизированных вариабельных областей.
CD131-связывающие белки по настоящему изобретению могут представлять собой человеческие CD131-связывающие белки. Используемый в настоящем изобретении термин «человеческий белок» относится к белкам, имеющим вариабельные и, необязательно, константные области антител, обнаруженные у людей, например, в зародышевой линии человека или в соматических клетках или из библиотек, полученных с использованием таких областей. «Человеческие» белки могут включать аминокислотные остатки, не кодируемые человеческими последовательностями, например мутации, вводимые случайными мутациями или сайт-направленными мутациями in vitro (в частности, мутации, которые включают консервативные замены, или мутации в небольшом количестве остатков белка, например, в 1, 2, 3, 4 или 5 остатках белка). Данные «человеческие белки» не обязательно должны появляться в результате иммунного ответа человека, скорее, они могут быть получены с использованием рекомбинантного средства (например, скрининга библиотеки фагового дисплея) и/или трансгенного животного (например, мыши), включая нуклеиновую кислоту, кодирующую константные и/или вариабельные области антител человека, и/или с использованием управляемого отбора (например, как описано в US5565332). Данный термин также охватывает созревшие аффинности формы таких антител. Для целей настоящего описания также будет считаться, что человеческий белок включает белок, содержащий последовательности FR из человеческого антитела или последовательности FR, содержащие последовательности из консенсусной последовательности человеческих FR, и в которых одна или более CDR являются случайными или полуслучайными, например, как описано в US6300064 и/или US6248516.
Иллюстративными CD131-связывающими белками человека являются антитела, содержащие следующие пары вариабельных областей:
(i) VH, содержащая последовательность, представленную в SEQ ID NO: 20, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(ii) VH, содержащая последовательность, представленную в SEQ ID NO: 20, и VL, содержащая последовательность, представленную в SEQ ID NO: 6;
(iii) VH, содержащая последовательность, представленную в SEQ ID NO: 20, и VL, содержащая последовательность, представленную в SEQ ID NO: 7;
(iv) VH, содержащая последовательность, представленную в SEQ ID NO: 20, и VL, содержащая последовательность, представленную в SEQ ID NO: 8;
(v) VH, содержащая последовательность, представленную в SEQ ID NO: 20, и VL, содержащая последовательность, представленную в SEQ ID NO: 9;
(vi) VH, содержащая последовательность, представленную в SEQ ID NO: 20, и VL, содержащая последовательность, представленную в SEQ ID NO: 10;
(vii) VH, содержащая последовательность, представленную в SEQ ID NO: 20, и VL, содержащая последовательность, представленную в SEQ ID NO: 11;
(viii) VН, содержащая последовательность, представленную в SEQ ID NO: 20, и VL, содержащая последовательность, представленную в SEQ ID NO: 12;
(ix) VH, содержащая последовательность, представленную в SEQ ID NO: 20, и VL, содержащая последовательность, представленную в SEQ ID NO: 13;
(x) VH, содержащая последовательность, представленную в SEQ ID NO: 20, и VL, содержащая последовательность, представленную в SEQ ID NO: 14;
(xi) VH, содержащая последовательность, представленную в SEQ ID NO: 20, и VL, содержащая последовательность, представленную в SEQ ID NO: 15;
(xii) VH, содержащая последовательность, представленную в SEQ ID NO: 20, и VL, содержащая последовательность, представленную в SEQ ID NO: 16;
(xiii)) VH, содержащая последовательность, представленную в SEQ ID NO: 20, и VL, содержащая последовательность, представленную в SEQ ID NO: 17;
(xiv) VH, содержащая последовательность, представленную в SEQ ID NO: 20, и VL, содержащая последовательность, представленную в SEQ ID NO: 18;
(xv) VH, содержащая последовательность, представленную в SEQ ID NO: 20, и VL, содержащая последовательность, представленную в SEQ ID NO: 19;
(xvi) VH, содержащая последовательность, представленную в SEQ ID NO: 21, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xvii) VH, содержащая последовательность, представленную в SEQ ID NO: 22, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xviii) VH, содержащая последовательность, представленную в SEQ ID NO: 23, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xix) VH, содержащая последовательность, представленную в SEQ ID NO: 24, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xx) VH, содержащая последовательность, представленную в SEQ ID NO: 25, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxi) VH, содержащая последовательность, представленную в SEQ ID NO: 26, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxii) VH, содержащая последовательность, представленную в SEQ ID NO: 27, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxiii) VH, содержащая последовательность, представленную в SEQ ID NO: 28, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxiv) VH, содержащая последовательность, представленную в SEQ ID NO: 29, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxv) VH, содержащая последовательность, представленную в SEQ ID NO: 30, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxvi) VH, содержащая последовательность, представленную в SEQ ID NO: 31, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxvii) VH, содержащая последовательность, представленную в SEQ ID NO: 32, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxviii) VH, содержащая последовательность, представленную в SEQ ID NO: 33, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxix) VH, содержащая последовательность, представленную в SEQ ID NO: 34, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxx) VH, содержащая последовательность, представленную в SEQ ID NO: 35, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxxi) VH, содержащая последовательность, представленную в SEQ ID NO: 36, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxxii) VH, содержащая последовательность, представленную в SEQ ID NO: 37, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxxiii) VH, содержащая последовательность, представленную в SEQ ID NO: 38, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxxiv) VH, содержащая последовательность, представленную в SEQ ID NO: 39, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxxv) VH, содержащая последовательность, представленную в SEQ ID NO: 40, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxxvi) VH, содержащая последовательность, представленную в SEQ ID NO: 41, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxxvii) VH, содержащая последовательность, представленную в SEQ ID NO: 42, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxxviii) VH, содержащая последовательность, представленную в SEQ ID NO: 43, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xxxix) VH, содержащая последовательность, представленную в SEQ ID NO: 44, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xl) VH, содержащая последовательность, представленную в SEQ ID NO: 45, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xli) VH, содержащая последовательность, представленную в SEQ ID NO: 46, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xlii) VH, содержащая последовательность, представленную в SEQ ID NO: 47, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xliii) VH, содержащая последовательность, представленную в SEQ ID NO: 48, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xliv) VH, содержащая последовательность, представленную в SEQ ID NO: 49, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xlv) VH, содержащая последовательность, представленную в SEQ ID NO: 50, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xlvi) VH, содержащая последовательность, представленную в SEQ ID NO: 51, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xlvii) VH, содержащая последовательность, представленную в SEQ ID NO: 52, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xlviii) VH, содержащая последовательность, представленную в SEQ ID NO: 53, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xlix) VH, содержащая последовательность, представленную в SEQ ID NO: 54, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(l) VH, содержащая последовательность, представленную в SEQ ID NO: 55, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(li) VH, содержащая последовательность, представленную в SEQ ID NO: 56, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lii) VH, содержащая последовательность, представленную в SEQ ID NO: 57, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(liii) VH, содержащая последовательность, представленную в SEQ ID NO: 58, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(liv) VH, содержащая последовательность, представленную в SEQ ID NO: 59, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lv) VH, содержащая последовательность, представленную в SEQ ID NO: 60, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lvi) VH, содержащая последовательность, представленную в SEQ ID NO: 61, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lvii) VH, содержащая последовательность, представленную в SEQ ID NO: 62, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lviii) VH, содержащая последовательность, представленную в SEQ ID NO: 63, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lix) VH, содержащая последовательность, представленную в SEQ ID NO: 64, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lx) VH, содержащая последовательность, представленную в SEQ ID NO: 65, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxi) VH, содержащая последовательность, представленную в SEQ ID NO: 66, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxii) VH, содержащая последовательность, представленную в SEQ ID NO: 67, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxiii) VH, содержащая последовательность, представленную в SEQ ID NO: 68, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxiv) VH, содержащая последовательность, представленную в SEQ ID NO: 69, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxv) VH, содержащая последовательность, представленную в SEQ ID NO: 70, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxvi) VH, содержащая последовательность, представленную в SEQ ID NO: 71, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxvii) VH, содержащая последовательность, представленную в SEQ ID NO: 72, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxviii) VH, содержащая последовательность, представленную в SEQ ID NO: 73, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxix) VH, содержащая последовательность, представленную в SEQ ID NO: 75, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxx) VH, содержащая последовательность, представленную в SEQ ID NO: 76, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxi) VH, содержащая последовательность, представленную в SEQ ID NO: 77, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxii) VH, содержащая последовательность, представленную в SEQ ID NO: 78, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxiii) VH, содержащая последовательность, представленную в SEQ ID NO: 79, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxiv) VH, содержащая последовательность, представленную в SEQ ID NO: 80, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxv) VH, содержащая последовательность, представленную в SEQ ID NO: 81, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxvi) VH, содержащая последовательность, представленную в SEQ ID NO: 82, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxvii) VH, содержащая последовательность, представленную в SEQ ID NO: 83, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxviii) VH, содержащая последовательность, представленную в SEQ ID NO: 84, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxix) VH, содержащая последовательность, представленную в SEQ ID NO: 85, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxx) VH, содержащая последовательность, представленную в SEQ ID NO: 86, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxxi) VH, содержащая последовательность, представленную в SEQ ID NO: 87, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxxii) VH, содержащая последовательность, представленную в SEQ ID NO: 88, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxxiii) VH, содержащая последовательность, представленную в SEQ ID NO: 89, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxxiv) VH, содержащая последовательность, представленную в SEQ ID NO: 90, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxxv) VH, содержащая последовательность, представленную в SEQ ID NO: 91, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxxvi) VH, содержащая последовательность, представленную в SEQ ID NO: 92, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxxvii) VH, содержащая последовательность, представленную в SEQ ID NO: 93, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxxviii) VH, содержащая последовательность, представленную в SEQ ID NO: 94, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(lxxxix) VH, содержащая последовательность, представленную в SEQ ID NO: 95, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xc) VH, содержащая последовательность, представленную в SEQ ID NO: 96, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xci) VH, содержащая последовательность, представленную в SEQ ID NO: 97, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xcii) VH, содержащая последовательность, представленную в SEQ ID NO: 98, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xciii) VH, содержащая последовательность, представленную в SEQ ID NO: 99, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xciv) VH, содержащая последовательность, представленную в SEQ ID NO: 100, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xcv) VH, содержащая последовательность, представленную в SEQ ID NO: 101, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xcvi) VH, содержащая последовательность, представленную в SEQ ID NO: 102, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xcvii) VH, содержащая последовательность, представленную в SEQ ID NO: 103, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xcviii) VH, содержащая последовательность, представленную в SEQ ID NO: 104, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(xcix) VH, содержащая последовательность, представленную в SEQ ID NO: 105, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(c) VH, содержащая последовательность, представленную в SEQ ID NO: 106, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(ci) VH, содержащая последовательность, представленную в SEQ ID NO: 107, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(cii) VH, содержащая последовательность, представленную в SEQ ID NO: 108, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(ciii) VН, содержащая последовательность, представленную в SEQ ID NO: 109, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(civ) VH, содержащая последовательность, представленную в SEQ ID NO: 110, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(cv) VH, содержащая последовательность, представленную в SEQ ID NO: 111, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(cvi) VH, содержащая последовательность, представленную в SEQ ID NO: 112, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(cvii) VН, содержащая последовательность, представленную в SEQ ID NO: 113, и VL, содержащая последовательность, представленную в SEQ ID NO: 5;
(cviii) VH, содержащая последовательность, представленную в SEQ ID NO: 114, и VL, содержащая последовательность, представленную в SEQ ID NO: 5; или
(cix) VH, содержащая последовательность, представленную в SEQ ID NO: 115, и VL, содержащая последовательность, представленную в SEQ ID NO: 5.
Необязательно, VH связана с константной областью тяжелой цепи, например константной областью тяжелой цепи IgG4 или константной областью стабилизированного IgG4, например, как обсуждалось в настоящем изобретении, например, содержащей последовательность, представленную в SEQ ID NO: 197. В одном примере в константной области тяжелой цепи отсутствует С-концевой остаток лизина.
Необязательно, VL связана с константной областью легкой цепи.
CD131-связывающие белки по настоящему изобретению могут представлять собой сингуманизированные белки. Термин «сингуманизированный белок» относится к белку, полученному способом, описанным в WO2007/019620. Сингуманизированный CD131-связывающий белок включает в себя вариабельную область антитела, где данная вариабельная область содержит последовательности FR из вариабельной области антител от примата Нового Света и последовательности CDR из вариабельной области антитела не от примата Нового Света. Например, сингуманизированный CD131-связывающий белок включает в себя вариабельную область антитела, где вариабельная область содержит последовательности FR из вариабельной области антитела от примата Нового Света и последовательности CDR от мышиного или крысиного антитела. В одном примере сингуманизированный CD131-связывающий белок представляет собой CD131-связывающее антитело, в котором одна или обе вариабельные области являются сингуманизированными. Данный термин также охватывает составной белок, включающий, например, одну или более сингуманизированных вариабельных областей и одну или более, например, вариабельных областей человека или гуманизированных вариабельных областей или химерных вариабельных областей.
CD131-связывающие белки по настоящему изобретению могут представлять собой приматизированные белки. «Приматизированный белок» включает в себя вариабельную область (области) из антитела, продуцируемого после иммунизации приматов, отличных от человека (например, яванского макака). Необязательно, вариабельные области антитела примата, отличного от человека, связаны с константными областями человека для получения приматизированного антитела. Примеры способов получения приматизированных антител описаны в US6113898. Данный термин также охватывает составной белок, включающий, например, одну или более приматизированных вариабельных областей и одну или более, например, вариабельных областей человека или гуманизированных вариабельных областей или химерных вариабельных областей.
В одном примере CD131-связывающий белок по настоящему изобретению представляет собой химерный белок. Термин «химерные белки» относится к белкам, в которых антигенсвязывающий домен относится к конкретному виду (например, мышиному, например, мыши или крысе) или принадлежит к определенному классу или подклассу антител, в то время как остальная часть белка представляет собой белок, полученный от другого вида (например, человеческий или отличный от человека примат) или принадлежащий другому классу или подклассу антител. В одном примере химерный белок представляет собой химерное антитело, содержащее VH и/или VL из антитела, отличного от человека (например, мышиного антитела), а остальные области антитела берутся из антитела человека. Получение таких химерных белков известно в данной области техники и может быть достигнуто стандартными средствами (как описано, например, в US6331415, US5807715, US4816567 и US4816397). Данный термин также охватывает составной белок, включающий, например, одну или более химерных вариабельных областей и одну или более, например, вариабельных областей человека или гуманизированных вариабельных областей или химерных вариабельных областей.
Настоящее раскрытие также рассматривает деиммунизированный CD131-связывающий белок, например, как описано в WO 2000/34317 и WO2004/108158. Деиммунизированные антитела и белки имеют один или более эпитопов, например эпитопы В-клеток или эпитопы Т-клеток, которые удалены (т.е. мутированные), тем самым снижая вероятность того, что у субъекта будет повышаться иммунный ответ против антитела или белка. Например, CD131-связывающий белок по настоящему изобретению анализируют для идентификации одного или нескольких эпитопов B или Т-клеток, и один или несколько аминокислотных остатков в эпитопе мутируют, чтобы, тем самым, уменьшить иммуногенность CD131-связывающего белка.
Специалисту в данной области техники будет очевидно, что «составной» белок содержит одну форму VH (например, человека) и другую форму VL (например, гуманизированную). Настоящее раскрытие в явном виде охватывает все комбинации форм VH и VL.
Белки, содержащие антитело-связывающий домен
Однодоменные антитела
В некоторых примерах CD131-связывающий белок по настоящему изобретению представляет собой или содержит однодоменное антитело (которое используется взаимозаменяемо с термином «доменное антитело» или «dAb»). Однодоменное антитело представляет собой одну полипептидную цепь, содержащую всю или часть вариабельной области тяжелой цепи антитела. В некоторых примерах однодоменное антитело представляет собой однодоменное антитело человека (Domantis, Inc., Waltham, MA, см., например, US6248516).
Диатела, триотела, тетратела
В некоторых примерах CD131-связывающий белок по настоящему изобретению представляет собой или содержит антитело, триотело, тетратело или белковый комплекс более высокого порядка, такой как описанный в WO 98/04001 и/или WO94/007921.
Например, диатело представляет собой белок, содержащий две ассоциированные полипептидные цепи, причем каждая полипептидная цепь содержит структуру VL–X-VH или VH-X-VL, где VL представляет собой вариабельную область легкой цепи антитела, VH представляет собой вариабельную область тяжелой цепи антитела, Х представляет собой линкер, содержащий недостаточные остатки, чтобы обеспечить связывание VH и VL в одной полипептидной цепи (или образовать Fv), или отсутствует, и где VH одной полипептидной цепи связывается с VL из другой полипептидной цепи с образованием антигенсвязывающего домена, т.е. с образованием молекулы Fv, способной специфически связываться с одним или несколькими антигенами. VH и VL могут быть одинаковыми в каждой полипептидной цепи, или VH и VL могут быть различными в каждой полипептидной цепи, с тем чтобы образовать биспецифическое антитело (то есть состоящее из двух Fv, имеющих различную специфичность).
Одноцепочечный Fv (scFv)
CD131-связывающий белок по настоящему изобретению может представлять собой scFv. Специалист в данной области техники должен знать, что scFv содержат области VH и VL в одной полипептидной цепи и полипептидный линкер между VH и VL, который позволяет, чтобы scFv образовал желаемую структуру для связывания антигена (то есть для связывания VH и VL из одной полипептидной цепи друг с другом с образованием Fv). Например, данный линкер содержит более 12 аминокислотных остатков с (Gly4Ser)3 и является одним из наиболее предпочтительных линкеров для scFv.
Настоящее изобретение также предусматривает стабилизированный дисульфидной связью Fv (или diFv или dsFv), в котором один цистеиновый остаток введен в FR VH-области и FR VL-области, и цистеиновые остатки связаны дисульфидной связью, с получением стабильного Fv.
Альтернативно или в дополнение, настоящее изобретение включает в себя димерный scFv, то есть белок, содержащий две молекулы scFv, связанные нековалентной или ковалентной связью, например, с лейцин-молнией (например, производным от Fos или Jun). Альтернативно, два scFv связаны пептидным линкером достаточной длины, чтобы позволить как образование scFv, так и связывание с антигеном, например, как описано в US20060263367.
Другие антитела и белки, содержащие антигенсвязывающие домены
Настоящее изобретение также предусматривает другие антитела и белки, содержащие их антигенсвязывающие домены, такие как:
(i) биспецифические белки «ключ и отверстие (key and hole)», как описано в US 57731168;
(ii) гетероконъюгатные белки, например, как описано в US4676980;
(iii) гетероконъюгатные белки, полученные с использованием химического сшивающего агента, например, как описано в US4676980; а также
(iv) Fab3 (например, как описано в EP19930302894).
Мутации в белках
Настоящее изобретение также обеспечивает CD131-связывающий белок или нуклеиновую кислоту, кодирующую CD131-связывающий белок, имеющую по меньшей мере 80% идентичности с описанной в настоящем изобретении последовательностью. В одном примере CD131-связывающий белок или нуклеиновая кислота по настоящему изобретению содержит последовательность, по меньшей мере на около 85% или 90%, или 95%, или 97%, или 98%, или 99% идентичную описанной в настоящем изобретении последовательности, где белок специфически связывается с CD131, как описано в настоящем изобретении, в соответствии с любым примером.
Альтернативно, или дополнительно, CD131-связывающий белок содержит последовательность CDR (например, три последовательности CDR), по меньшей мере на около 80% или 85%, или 90%, или 95%, или 97%, или 98%, или 99% идентичную последовательности(ям) CDR из VH или VL, как описано в настоящем изобретении, в соответствии с любым примером, где белок способен специфически связываться с CD131, как описано в настоящем изобретении, в соответствии с любым примером. В этой связи, авторы изобретения продуцировали многочисленные антитела, имеющие различные последовательности внутри их CDR. Способы определения связывания белка с CD131 описаны в настоящем изобретении.
Например, авторы изобретения идентифицировали группу CD131-связывающих белков, разделяющих по меньшей мере 40% идентичности в их HCDR1.
Авторы изобретения также идентифицировали класс CD131-связывающего белка, который имеет по меньшей мере 65% идентичности в его HCDR2 в соответствии с системой нумерации Кабата, и подкласс CD131-связывающих белков, имеющих по меньшей мере около 77% идентичности в их HCDR2, в соответствии с системой нумерации Кабата (например, производные антитела 9А2-VR24, содержащие мутации в HCDR2 и имеющие IC50 для ингибирования передачи сигнала посредством GM-CSF, равную 0,5 нМ или менее).
Как обсуждалось в настоящем изобретении, в данной области техники также известно, что пять С-концевых остатков CDR2 тяжелой цепи могут быть мутированы с консервативными или неконсервативными аминокислотными заменами (31% остатков) (Padlan et al., FASEB J. 9: 133-139, 1995). Таким образом, белок может содержать CDR2, имеющую по меньшей мере около 35% идентичности с CDR2-последовательностью тяжелой цепи, описанной в настоящем изобретении.
Например, авторы изобретения идентифицировали группу CD131-связывающих белков, разделяющих по меньшей мере около 44% идентичности их последовательностей HCDR3 в соответствии с системой нумерации Кабата.
Например, авторы изобретения идентифицировали несколько остатков в VH, содержащей последовательность, представленную в SEQ ID NO: 20, которые могут быть заменены без потери функции или приводя к улучшению функции. В одном примере CD131-связывающий белок содержит от 1 до 12 аминокислотных замен, по сравнению с SEQ ID NO: 20. Например, C131-связывающий белок содержит 1 или 2, или 3, или 4, или 5 или 6, или 7, или 8, или 9, или 10 аминокислотных замен, по сравнению с SEQ ID NO: 20. Например, CD131-связывающий белок содержит 9 аминокислотных замен по сравнению с SEQ ID NO: 37. Например, CD131-связывающий белок содержит 10 аминокислотных замен, по сравнению с SEQ ID NO: 20. В одном примере замены находятся внутри CDR1 и/или CDR2.
В одном примере, CD131-связывающий белок содержит от 1 до 5 аминокислотных замен в CDR2, по сравнению с SEQ ID NO: 20. Например, CD131-связывающий белок содержит 1 или 2, или 3, или 4, или 5 аминокислотных замен в CDR2, по сравнению с SEQ ID NO: 20.
В одном примере, CD131-связывающий белок содержит от 1 до 6 аминокислотных замен в CDR1, по сравнению с SEQ ID NO: 20. Например, CD131-связывающий белок содержит 1 или 2, или 3, или 4, или 5, или 6 аминокислотных замен в CDR3, по сравнению с SEQ ID NO: 20.
В одном примере CD131-связывающий белок по настоящему изобретению содержит мутант последовательности, представленной в SEQ ID NO: 20, где данная мутантная последовательность, по меньшей мере, содержит пролин в положении 58 в SEQ ID NO: 20.
В одном примере CD131-связывающий белок по настоящему изобретению содержит мутант последовательности, представленной в SEQ ID NO: 20, где данная мутантная последовательность, по меньшей мере, содержит гистидин или аспарагин или серин в положении 61 в SEQ ID NO: 20.
В одном примере, CD131-связывающий белок по настоящему изобретению включает в себя мутант последовательности, представленной в SEQ ID NO: 20, причем данный мутант последовательности, по меньшей мере, содержит пролин в положении 30, триптофан в положении 31, аргинин в положении 33, валин в положении 34 и гистидин в положении 35, каждый из которых относится к SEQ ID NO: 20.
Например, авторы изобретения идентифицировали группу CD131-связывающих белков, разделяющих по меньшей мере 45% идентичности в их LCDR1 в соответствии с системой нумерации Кабата.
Настоящее изобретение также охватывает мутантные формы CD131-связывающего белка, включающие одну или более консервативных аминокислотных замен по сравнению с последовательностью, представленной в настоящем изобретении. В некоторых примерах CD131-связывающий белок содержит 10 или менее, например, 9 или 8, или 7 или 6, или 5, или 4, или 3, или 2, или 1 консервативные аминокислотные замены. «Консервативная аминокислотная замена» представляет собой «консервативную аминокислотную замену», в которой аминокислотный остаток заменен аминокислотным остатком, имеющим сходную боковую цепь и/или гидропатию и/или гидрофильность.
В данной области техники были определены семьи аминокислотных остатков, имеющих сходные боковые цепи, включая основные боковые цепи (например, лизин, аргинин, гистидин), кислотные боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), в-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин). Гидропатические индексы описаны, например, в Kyte and Doolittle J. Mol. Biol., 157: 105-132, 1982, и гидрофильные индексы описаны, например, в US4554101.
Настоящее изобретение также рассматривает неконсервативные аминокислотные изменения. Например, особый интерес представляют замены заряженных аминокислот другой заряженной аминокислотой и нейтральными или положительно заряженными аминокислотами. В некоторых примерах белок, связывающийся с CD131, содержит 10 или менее, например, 9 или 8, или 7, или 6, или 5, или 4, или 3, или 2, или 1 неконсервативных аминокислотных замен.
В одном примере мутация(и) происходит внутри последовательности FR из антигенсвязывающего домена CD131-связывающего белка по настоящему изобретению. В другом примере мутация(и) происходит внутри последовательности CDR из CD131-связывающего белка по настоящему изобретению.
Типичные способы получения мутантных форм CD131-связывающего белка включают:
• мутагенез ДНК (Thie et al., Methods Mol. Biol. 525: 309-322, 2009) или РНК (Kopsidas et al., Immunol. Lett. 107:163-168, 2006; Kopsidas et al. BMC Biotechnology, 7: 18, 2007 и WO1999/058661);
• введение нуклеиновой кислоты, кодирующей полипептид, в мутатор-клетку, например, бактериальные клетки XL-1Red, XL-mutS и XL-mutS-Kanr (Stratagene);
• перестановку (shuffling) в ДНК, например, как описано в Stemmer, Nature 370: 389-91, 1994; а также
• сайт-направленный мутагенез, например, как описано в Dieffenbach (ed) and Dveksler (ed) (In: PCR Primer: A Laboratory Manual, Cold Spring Harbor Laboratories, NY, 1995).
Типичные способы определения биологической активности мутантных CD131-связывающих белков по настоящему изобретению будут очевидны специалисту в данной области техники и/или описаны в настоящем изобретении, например, связывание антигена. Например, в настоящем изобретении описаны способы определения связывания антигена, конкурентного ингибирования связывания, аффинности, ассоциации, диссоциации и терапевтической эффективности.
В другом примере нуклеиновая кислота по настоящему изобретению включает последовательность, по меньшей мере на около 80% или 85%, или 90%, или 95%, или 97%, или 98%, или 99% идентичную последовательности, изложенной в настоящем изобретении, и кодирующую CD131-связывающий белок, имеющий функцию, описанную в настоящем изобретении, в соответствии с любым примером. Настоящее раскрытие также охватывает нуклеиновые кислоты, кодирующие CD131-связывающий белок по настоящему изобретению, который отличается от последовательности, приведенной в настоящем изобретении в качестве примера в результате вырождения генетического кода.
% идентичности нуклеиновой кислоты или полипептида определяют с помощью GAP (Needleman and Wunsch. Mol. Biol., 48, 443-453, 1970) анализа (программа GCG) со штрафом на создание пробела = 5, и штрафом за расширение пробела = 0,3. Последовательность запросов составляет по меньшей мере 50 остатков в длину, и анализ GAP выравнивает две последовательности в области, содержащей по меньшей мере 50 остатков. Например, последовательность запросов составляет по меньшей мере 100 остатков в длину, и анализ GAP выравнивает две последовательности в области, содержащей по меньшей мере 100 остатков. Например, две последовательности выровнены по всей их длине.
В настоящем изобретении также рассматривается нуклеиновая кислота, которая гибридизуется в условиях жесткой гибридизации с нуклеиновой кислотой, кодирующей описанный в настоящем изобретении CD131-связывающий белок. «Умеренная жесткость» определяется в настоящем изобретении как гибридизация и/или промывка, осуществляемая в 2 × SSC-буфере, 0,1% (мас./об.) SDS при температуре в диапазоне от 45°C до 65°C, или в эквивалентных условиях. «Высокая жесткость» определяется в настоящем изобретении как гибридизация и/или промывка, осуществляемая в 0,1 × SSC-буфере, 0,1% (мас./об.) SDS или с низкой концентрацией соли и при температуре, составляющей по меньшей мере 65 °C, или в эквивалентных условиях. Ссылка на конкретный уровень жесткости охватывает эквивалентные условия с использованием растворов для промывки/гибридизации, отличных от SSC, известных специалистам в данной области техники. Например, известны способы расчета температуры, при которой нити двухцепочечной нуклеиновой кислоты будут диссоциировать (также известной как температура плавления или Tm). Температура, которая аналогична (например, в пределах 5°C или в пределах 10°C) или равна Tm нуклеиновой кислоты, считается высокой жесткостью. Средняя жесткость должна считаться равной от 10°C до 20°C или от 10°C до 15°C от рассчитанной Tm нуклеиновой кислоты.
Константные области
Настоящее изобретение включает в себя CD131-связывающие белки и/или антитела, описанные в настоящем изобретении, содержащие константную область антитела. Это включает антигенсвязывающие фрагменты антитела, слитого с Fc.
Последовательности константных областей, применимых для получения белков по настоящему изобретению, могут быть получены из ряда различных источников. В некоторых примерах константную область белка или ее часть из белка получают из человеческого антитела. Константная область или ее часть может быть получена из любого класса антител, включая IgM, IgG, IgD, IgA и IgE, и любого изотипа антитела, включая IgG1, IgG2, IgG3 и IgG4. В одном примере константная область представляет собой человеческий изотип IgG4 или стабилизированную константную область IgG4.
В одном примере Fc-область константной области имеет уменьшенную способность индуцировать эффекторную функцию, например, по сравнению с Fc-областью природного или относящегося к дикому типу человеческого IgG1 или IgG3. В контексте настоящего изобретения «эффекторные функции» относятся к тем биологическим активностям, опосредуемым клетками или белками, которые связываются с Fc-областью (Fc-область нативной последовательности или Fc-область с вариантом последовательности аминокислот) антитела, приводя к гибели клетки. Примеры эффекторных функций, индуцированных антителами, включают: комплемент-зависимую цитотоксичность (complement dependent cytotoxicity (CDC)); антитело-зависимую опосредуемую клетками цитотоксичность (antibody-dependent-cell-mediated cytotoxicity (ADCC)); антитело-зависимый клеточный фагоцитоз (antibody-dependent-cell-phagocytosis (ADCP)); и активацию В-клеток. В одном примере эффекторной функцией является ADCC и/или ADCP и/или CDC. Способы оценки уровня эффекторной функции белка, содержащего Fc-область, известны в данной области техники и/или описаны в настоящем изобретении.
В одном примере Fc-область представляет собой Fc-область IgG4 (то есть из константной области IgG4), например, Fc-область человеческого IgG4. Последовательности подходящих Fc-областей IgG4 будут очевидны для квалифицированного специалиста и/или доступны в общедоступных базах данных (например, из Национального центра информации по биотехнологии).
В одном примере константная область представляет собой стабилизированную константную область IgG4. Под термином «стабилизированная константная область IgG4» понимается константная область IgG4, которая была модифицирована для снижения обмена Fab-плеча или склонности к обмену Fab-плечом или образованию полуантитела или склонности к получению полуантитела. «Обмен Fab-плеча» относится к типу белковой модификации для человеческого IgG4, в котором тяжелая цепь IgG4 и присоединенная легкая цепь (половина молекулы) обменена на пару тяжелая цепь-легкая цепь из другой молекулы IgG4. Таким образом, молекулы IgG4 могут приобретать два отдельных плеча Fab, распознающих два разных антигена (приводя к биспецифическим молекулам). Обмен Fab-плечами происходит естественным образом in vivo и может быть индуцирован in vitro очищенными клетками крови или восстанавливающими агентами, такими как восстановленный глутатион. «Полу-антитело» образуется, когда антитело IgG4 диссоциирует с образованием двух молекул, каждая из которых содержит одну тяжелую цепь и одну легкую цепь.
В одном примере стабилизированная константная область IgG4 содержит пролин в положении 241 шарнирной области, в соответствии с системой Кабата (Kabat et al., Sequences of Proteins of Immunological Interest Washington DC United States Department of Health and Human Services, 1987 и/или 1991). Данное положение соответствует положению 228 шарнирной области в соответствии с системой нумерации EU (Kabat et al., Sequences of Proteins of Immunological Interest Washington DC United States Department of Health and Human Services, 2001 и Edelman et al., Proc. Natl. Acad. USA, 63, 78-85, 1969). В человеческом IgG4 данный остаток обычно представляет собой серин. После замещения серина пролином, шарнирная область IgG4 содержит последовательность CPPC. В данной связи, специалист в данной области техники должен знать, что «шарнирная область» представляет собой богатый пролином участок константной области тяжелой цепи антитела, который связывает Fc-области и Fab, что обеспечивает подвижность на двух Fab-плечах антитела. Шарнирная область включает цистеиновые остатки, которые участвуют в образовании дисульфидных связей между тяжелыми цепями. Она обычно определяется как участок от Glu226 до Pro243 человеческого IgG1 в соответствии с системой нумерации Кабата. Шарнирные области других изотипов IgG могут быть выровнены с последовательностью IgG1, при помещении первого и последнего цистеиновых остатков, образующих дисульфидные (SS) связи между тяжелыми цепями в тех же положениях (см., например, WO 02010/080538).
Дополнительные примеры стабилизированных антител IgG4 представляют собой антитела, в которых аргинин в положении 409 в константной области тяжелой цепи человеческого IgG4 (в соответствии с системой нумерации ЕС) замещен лизином, треонином, метионином или лейцином (например, как описано в WO2006/033386). Fc-область константной области может дополнительно или альтернативно содержать остаток, выбранный из группы, состоящей из: аланина, валина, глицина, изолейцина и лейцина, в позиции, соответствующей 405 (в соответствии с системой нумерации ЕС). Необязательно, шарнирная область содержит пролин в положении 241 (т.е. последовательность CPPC) (как описано выше).
В другом примере Fc-область представляет собой область, модифицированную, чтобы иметь уменьшенную эффекторную функцию, то есть «неиммуномостимулирующую Fc-область». Например, Fc-область представляет собой Fc-область IgG1, содержащую замену в одном или нескольких положениях, выбранных из группы, состоящей из 268, 309, 330 и 331. В другом примере Fc-область представляет собой Fc-область IgG1, содержащую одно или несколько из следующих изменений E233P, L234V, L235A и делецию G236 и/или одно или несколько из следующих изменений A327G, A330S и P331S (Armour et al., Eur J Immunol. 29:2613-2624, 1999; Shields et al., J Biol Chem. 276(9):6591-604, 2001). Дополнительные примеры неиммуностимулирующих областей Fc описаны, например, в Dall'Acqua et al., J Immunol. 177: 1129-1138 2006; и/или Hezareh J Virol ;75: 12161-12168, 2001).
В другом примере Fc-область представляет собой химерную Fc-область, например, содержащую по меньшей мере один домен CH2 из антитела IgG4 и по меньшей мере один домен CH3 из антитела IgG1, где Fc-область включает замену в одном или нескольких аминокислотных положениях, выбранных из группы, состоящей из 240, 262, 264, 266, 297, 299, 307, 309, 323, 399, 409 и 427 (система нумерации EU) (например, как описано в заявке WO 2010/085682). Типичные замены включают 240F, 262L, 264T, 266F, 297Q, 299A, 299K, 307P, 309K, 309M, 309P, 323F, 399S и 427F.
Дополнительные модификации
Настоящее изобретение также обеспечивает дополнительные модификации антитела или CD131-связывающего белка, содержащего Fc-область или константную область.
Например, антитело содержит одну или более аминокислотных замен, которые увеличивают период полувыведения белка. Например, антитело содержит Fc-область, содержащую одну или более аминокислотных замен, которые увеличивают аффинность Fc-области в отношении неонатальной Fc-области (FcRn). Например, аффинность Fc-области по отношению к FcRn увеличилась при более низком значении рН, например, около рН 6,0, для облегчения связывания Fc/FcRn в эндосоме. В одном примере аффинность Fc-области по отношению к FcRn увеличивалась при значении рН около 6, по сравнению с ее аффинностью при значении рН около 7,4, что облегчает повторное высвобождение Fc в кровь после рециркуляции в клетках. Такие аминокислотные замены применимы для продления периода полувыведения белка путем уменьшения клиренса из крови.
Иллюстративные аминокислотные замены включают T250Q и/или M428L или T252A, T254S и T266F или M252Y, S254T и T256E или H433K и N434F, в соответствии с системой нумерации ЕС. Дополнительные или альтернативные аминокислотные замены описаны, например, в US200735620 или US7083784.
Иллюстративные CD131-связывающие белки
Иллюстративная вариабельная область, содержащая CD131-связывающие белки, полученные авторами изобретения, описана в таблице 1.
Таблица 1. Последовательности иллюстративных CD131-связывающих белков
Получение белков
В одном примере CD131-связывающий белок, описанный в настоящем изобретении в соответствии с любым примером, получают при культивировании гибридомы в условиях, достаточных для получения белка, например, как описано в настоящем изобретении и/или как известно в данной области.
Рекомбинантная экспрессия
В другом примере CD131-связывающий белок, описанный в настоящем изобретении в соответствии с любым примером, является рекомбинантным.
В случае рекомбинантного белка, кодирующая нуклеиновая кислота может быть клонирована в экспрессионные конструкции или векторы, которые затем трансфицируются в клетки-хозяева, такие как клетки E. coli, дрожжевые клетки, клетки насекомых или клетки млекопитающих, такие как клетки simian COS, клетки яичника китайского хомячка (Chinese Hamster Ovary (CHO)), клетки эмбриональной почки человека (human embryonic kidney (HEK)) или клетки миеломы, которые не продуцируют белок. Типичными клетками, используемыми для экспрессии белка, являются клетки СНО, клетки миеломы или клетки НЕК. Способы молекулярного клонирования для достижения данных целей известны в данной области техники и описаны, например, в Ausubel et al. (редакторы), Current Protocols in Molecular Biology, Greene Pub. Associates и Wiley-Interscience (1988, включая все обновления до настоящего времени) или Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press (1989). Множество способов клонирования и in vitro-амплификации подходит для построения рекомбинантных нуклеиновых кислот. Способы получения рекомбинантных антител также известны в данной области техники, см., например, US4816567 или US5530101.
После выделения нуклеиновая кислота вставляется функционально связанной с промотором в экспрессионную конструкцию или экспрессирующий вектор для дальнейшего клонирования (амплификация ДНК) или для экспрессии в бесклеточной системе или в клетках.
Используемый в настоящем изобретении термин «промотор» следует принимать в самом широком контексте и он включает в себя транскрипционные регуляторные последовательности геномного гена, включая блок TATA или инициатор, который необходим для точного инициирования транскрипции, с дополнительными регуляторными элементами или без них (например, расположенные в направлении, противоположном направлению транскрипции (upstream), активирующие последовательности, сайты связывания фактора транскрипции, энхансеры и глушители), которые изменяют экспрессию нуклеиновой кислоты, например, в ответ на развитие и/или внешний раздражитель, или специфично для ткани. В настоящем контексте термин «промотор» также используется для описания рекомбинантной, синтетической или гибридной нуклеиновой кислоты или производного, который дает, активирует или усиливает экспрессию нуклеиновой кислоты, с которой она функционально связана. Иллюстративные промоторы могут содержать дополнительные копии одного или более определенных регуляторных элементов для дальнейшего усиления экспрессии и/или изменения пространственной экспрессии и/или временной экспрессии указанной нуклеиновой кислоты.
Используемый в настоящем изобретении термин «функционально связанный с» означает позиционирование промотора относительно нуклеиновой кислоты, так что экспрессия нуклеиновой кислоты контролируется промотором.
Многие векторы для экспрессии в клетках доступны. Компоненты вектора обычно включают (но не ограничиваются ими) одно или несколько из следующего: сигнальную последовательность, последовательность, кодирующую белок (например, производную из информации, представленной в настоящем изобретении), энхансерный элемент, промотор и последовательность терминации транскрипции. Специалисту в данной области техники будут известны подходящие последовательности для экспрессии белка. Примеры сигнальных последовательностей включают сигналы прокариотической секреции (например, pelB, щелочная фосфатаза, пенициллиназа, Ipp или термостабильный энтеротоксин II), сигналы секреции дрожжей (например, лидерная последовательность инвертазы, лидерная последовательность фактора α или лидерная последовательность кислотной фосфатазы) или сигналы секреции млекопитающих, а также вирусные секреторные лидеры (например, сигнал gD вируса простого герпеса).
Типичные промоторы, активные в клетках млекопитающих, включают предранний промотор цитомегаловируса (cytomegalovirus immediate early promoter (CMV-IE)), промотор человеческого фактора элонгации 1-α (EF1), промоторы малых ядерных РНК (U1a и U1b), промотор тяжелой цепи α-миозина, промотор обезьянего вируса 40 (Simian virus 40 (SV40)), промотор вируса саркомы Rous ((Rous sarcoma virus) RSV), основной поздний промотор аденовируса, промотор β-актина; гибридный регуляторный элемент, содержащий усилитель CMV/промотор β-актина или промотор иммуноглобулина или его активный фрагмент. Примерами применимых клеточных линий клеток млекопитающих являются линия CV1 почки обезьяны, трансформированная вирусом SV40 (COS-7, ATCC CRL 1651); человеческая эмбриональная линия почек (293 или 293 клетки, субклонированные для роста в суспензионной культуре, клетки почек эмбриона хомяка (BHK, ATCC CCL 10) или клетки яичника китайского хомячка (CHO).
Типичные промоторы, подходящие для экспрессии в клетках дрожжей, таких как, например, дрожжевая клетка, выбранная из группы, включающей Pichia pastoris, Saccharomyces cerevisiae и S. pombe, включают в себя, но не ограничиваются ими, промотор ADH1, промотор GAL1, промотор GAL4, промотор CUP1, промотор PHO5, промотор nmt, промотор RPR1 или промотор TEF1.
Специалистам в данной области техники известны средства для введения изолированной нуклеиновой кислоты или экспрессионной конструкции, содержащей изолированную нуклеиновую кислоту, в клетку для экспрессии. Техника, используемая для данной клетки, зависит от известных успешных способов. Средства для введения рекомбинантной ДНК в клетки, среди прочих, включают микроинъекцию, трансфекцию, опосредованную DEAE-декстраном, трансфекцию, опосредованную липосомами, например, с использованием липофектамина (Gibco, MD, USA) и/или целцефина (Gibco, MD, USA), PEG-опосредованное поглощение ДНК, электропорацию и бомбардировку микрочастицами, например, с использованием покрытых ДНК частиц вольфрама или золота (Agracetus Inc., WI, USA).
Клетки-хозяева, используемые для получения белка, могут быть культивированы в различных средах, в зависимости от используемого типа клеток. Для культивирования клеток млекопитающих подходят коммерчески доступные среды, такие как Ham's Fl0 (Sigma), Minimal Essential Medium ((MEM), (Sigma), RPMl-1640 (Sigma) и Dulbecco's Modified Eagle's Medium ((DMEM), Sigma). Среды для культивирования других типов клеток, обсуждаемых в настоящем изобретении, известны в данной области техники.
Выделение белков
Способы выделения белков известны в данной области техники и/или описаны в настоящем изобретении.
Когда CD131-связывающий белок секретируется в культуральную среду, надосадочные жидкости из таких экспрессионных систем могут быть сначала сконцентрированы с использованием коммерчески доступного фильтра для концентрации белка, например, ультрафильтрационной установки Amicon или Millipore Pellicon. Ингибитор протеазы, такой как PMSF, может быть включен в любую из вышеперечисленных стадий для ингибирования протеолиза, и антибиотики могут быть включены для предотвращения роста случайных загрязняющих веществ. Альтернативно или дополнительно, надосадочные жидкости могут быть отфильтрованы и/или отделены от клеток, экспрессирующих белок, например, с использованием непрерывного центрифугирования.
CD131-связывающий белок, полученный из клеток, могут быть очищен с использованием, например, ионного обмена, гидроксиапатитной хроматографии, гидрофобной хроматографии, гель-электрофореза, диализа, аффинной хроматографии (например, аффинной хроматографии на основе белка А или хроматографии на основе белка G), или любой комбинации из вышеупомянутого. Данные способы известны в данной области техники и описаны, например, в WO99/57134 или в Ed Harlow and David Lane (редакторы). Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, (1988).
Специалист в данной области техники также будет знать, что белок может быть модифицирован с включением метки для облегчения очистки или обнаружения, например полигистидиновой метки, например гексагистидиновой метки или метки гемагглютинина вируса гриппа (HA), или метки Simian Virus 5 (V5) или метки FLAG или метки глутатион-S-трансферазы (GST). Полученный белок затем очищают с использованием способов, известных в данной области техники, таких как аффинная очистка. Например, белок, содержащий гексагистидиновую метку, очищают путем контактирования образца, содержащего белок, с никель-нитрилотриуксусной кислотой (Ni-NTA), которая специфически связывает гексагистидиновую метку, иммобилизованную на твердой или полутвердой подложке, промывания образца для удаления несвязанного белка и последующего элюирования связанного белка. Альтернативно, или дополнительно, лиганд или антитело, которое связывается с меткой, используют в способе аффинной очистки.
Cоединения, не являющиеся производными антител
Иммуноглобулины и фрагменты иммуноглобулина
Примером соединения по настоящему изобретению является белок, включающий вариабельный участок иммуноглобулина, такой как рецептор Т-клеток или тяжелоцепочечный иммуноглобулин (например, IgNAR, антитело верблюда).
Тяжелоцепочечные иммуноглобулины
Тяжелоцепочечные иммуноглобулины структурно отличаются от многих других форм иммуноглобулина (например, антител), поскольку они содержат тяжелую цепь, но не содержат легкую цепь. Соответственно, данные иммуноглобулины также называются «антителами только с тяжелой цепью». Тяжелоцепочечные иммуноглобулины встречаются, например, у верблюдов и хрящевой рыбы (также называемые IgNAR).
Вариабельные области, присутствующие во встречающихся в природе тяжелоцепочечных иммуноглобулинах, обычно упоминаются как «домены VHH» в верблюжьих Ig и V-NAR в IgNAR, чтобы отличить их от вариабельных областей тяжелой цепи, которые присутствуют в обычных 4-цепочечных антителах (которые называются «доменами VH») и из вариабельных областей легкой цепи, которые присутствуют в обычных 4-цепочечных антителах (которые называются «доменами VL»).
Тяжелоцепочечные иммуноглобулины не требуют наличия легких цепей для связывания с высокой аффинностью и высокой специфичностью с соответствующим антигеном. Это означает, что однодоменные связывающие фрагменты могут быть получены из тяжелоцепочечных иммуноглобулинов, которые легко экспрессируются и обычно стабильны и растворимы.
Общее описание тяжелоцепочечных иммуноглобулинов из верблюдов и их вариабельных областей и способы их получения и/или выделения и/или применения находится, среди прочего, в следующих ссылках WO94/04678, WO 97/49805 и WO 97/49805.
Общее описание тяжелоцепочечных иммуноглобулинов из хрящевой рыбы и их вариабельных областей и способы их получения и/или выделения и/или применения находится, среди прочего, в WO 2005/5118629.
V-подобные белки
Примером соединения по настоящему изобретению является Т-клеточный рецептор. Т-клеточные рецепторы имеют два V-домена, которые объединяются в структуру, аналогичную Fv-модулю антитела. Novotny et al., Proc Natl Acad Sci USA 88: 8646-8650, 1991 описывает, как два V-домена Т-клеточного рецептора (называемые альфа и бета) могут быть слиты и экспрессированы как одноцепочечный полипептид, как дополнительно изменить поверхностные остатки, чтобы уменьшить гидрофобность, непосредственно аналогичную scFv антитела. Другие публикации, описывающие продукцию одноцепочечных Т-клеточных рецепторов или мультимерных Т-клеточных рецепторов, содержащих два домена V-альфа и V-бета, включают в себя WO1999/045110 или WO2011/107595.
Другие, не относящиеся к антителам белки, содержащие антигенсвязывающие домены, включают белки с V-подобными доменами, которые обычно являются мономерными. Примеры белков, содержащих такие V-подобные домены, включают CTLA-4, CD28 и ICOS. Дальнейшее раскрытие белков, содержащих такие V-подобные домены, включено в WO 99/455110.
Аднектины
В одном примере соединение по настоящему изобретению представляет собой аднектин (adnectin). Аднектины основаны на десятом домене фибронектина типа III (10Fn3) человеческого фибронектина, в котором области петель изменены для обеспечения связывания антигена. Например, три петли на одном конце β-сэндвича домена 10Fn3 могут быть сконструированы так, чтобы аднектин мог специфически распознавать антиген. Для получения дополнительной информации см. US20080139791 или WO2005/056764.
Антикалины
В следующем примере соединение по настоящему изобретению представляет собой антикалин (anticalin). Антикалины являются производными от липокалинов, которые представляют собой семейство внеклеточных белков, осуществляющих транспорт небольших гидрофобных молекул, таких как стероиды, билины, ретиноиды и липиды. Липокалины имеют жесткую β-складчатую вторичную структуру с несколькими петлями на открытом конце конической структуры, которые могут быть сконструированы для связывания с антигеном. Такие искусственные липокалины известны как антикалины. Для дальнейшего описания антикалинов см. US7250297B1 или US20070224633.
Аффитела
В следующем примере соединение по настоящему изобретению представляет собой аффитело (affibody). Аффитело представляет собой каркас, имеющий происхождение из домена Z (антигенсвязывающего домена) белка A из Staphylococcus aureus, который может быть сконструирован с целью связывания антигена. Домен Z состоит из трехспирального пучка, включающего приблизительно 58 аминокислот. Библиотеки были созданы рандомизацией поверхностных остатков. Для получения дополнительной информации см. EP1641818.
Авимеры
В следующем примере соединение по настоящему изобретению представляет собой авимер (Avimer). Авимеры являются мультидоменными белками, полученными из семейства каркасов A-домена. Нативные домены из приблизительно 35 аминокислот принимают определенную структуру, связанную дисульфидными связями. Появление разнообразия обусловлено перетасовкой природного разнообразия, демонстрируемого семейством A-доменов. Для получения дополнительной информации см. WO2002088171.
Белки DARPin
В следующем примере соединение по настоящему изобретению представляет собой сконструированный белок с анкириновыми повторами (Designed Ankyrin Repeat Protein (DARPin)). Белки DARPin имеют происхождение из анкирина (Ankyrin), который представляет собой семейство белков, которые опосредуют присоединение интегральных мембранных белков к цитоскелету. анкириновый повтор представляет собой мотив из 33 остатков, состоящий из двух α-спиралей и β-поворота. Они могут быть сконструированы для связывания различных антигенов-мишеней рандомизацией остатков в первой α-спирали и β-повороте каждого повтора. Их связывающая поверхность может быть расширена увеличением числа модулей (способ созревания аффинности). Для получения дополнительной информации см. US20040132028.
Другие неспецифические полипептиды
Другие, не относящиеся к антителам белки, содержащие антигенсвязывающие домены, включают такие домены, которые базируются на человеческом γ-кристаллине и человеческом убиквитине (аффилинах), доменах человеческих ингибиторов протеаз типа Кунитца, PDZ-доменах Ras-связывающего белка AF-6, токсинах скорпиона (харибдотоксин), лектиновом домене C-типа (тетранектины).
Пептиды
В одном примере связывающая молекула представляет собой пептид, например, выделенный из библиотеки случайных пептидов. Чтобы идентифицировать подходящий пептид, создают и скринируют библиотеку случайных пептидов, как описано в US5, 773, 731, US5, 591, 446 и US5, 834, 318. Как правило, такие библиотеки создаются из коротких случайных олигонуклеотидов, которые экспрессируются либо in vitro, либо in vivo и отображаются таким образом, чтобы облегчить скрининг библиотеки для идентификации пептида, который. способен специфически связываться с описанным в настоящем изобретении антигеном. Способы отображения включают в себя фаговое отображение, ретровирусное отображение, отображение поверхности бактерий, бактериальный флагеллярный дисплей, дисплей бактериальной споры, отображение поверхности дрожжей, отображение поверхности млекопитающих и способы отображения in vitro, включая отображение мРНК, отображение рибосом и ковалентное отображение.
Пептид, способный связывать антиген, описанный в настоящем изобретении, идентифицируется любым из ряда способов, известных в данной области техники, таких как, например, стандартные способы очистки аффинности, как описано, например, в Scopes, 1994, с использованием анализа FACS, как описано в US645563.
Небольшие молекулы
В другом примере связывающая молекула представляет собой небольшую молекулу. Такая небольшая молекула может быть выделена из библиотеки. Биологические библиотеки с небольшими молекулами доступны коммерчески или, альтернативно, могут быть созданы с использованием способов, известных в данной области техники, таких как, например, описанные в патенте США 5463664.
Способы синтеза небольших органических соединений будут значительно варьироваться в зависимости от соединения, однако, такие способы будут известны специалистам в данной области техники.
В одном примере информатика используется для выбора подходящих химических строительных блоков из известных соединений для получения комбинаторной библиотеки. Например, подход моделирования QSAR (Quantitative Structure Activity Relationship) использует линейные регрессии или деревья регрессии структур соединений для определения соответствия. Программное обеспечение от Chemical Computing Group, Inc. (Монреаль, Канада) использует высокопроизводительные скрининговые экспериментальные данные об активных и неактивных соединениях для создания вероятностной модели QSAR, которая затем используется для выбора главных соединений. Бинарный способ QSAR основан на трех характерных свойствах соединений, которые образуют «дескриптор» вероятности того, что конкретное соединение будет или не будет выполнять требуемую функцию: частичный заряд, молярная рефрактерность (связывание) и logP (липофильность молекулы). Каждый атом имеет площадь поверхности в молекуле и связан с данными тремя свойствами. Определяются все атомы соединения с частичным зарядом в определенном диапазоне и поверхности суммируются (дескриптор поверхности Ван-дер-Уоллса). Затем двоичные модели QSAR используются для создания моделей активности или моделей ADMET, которые используются для создания комбинаторной библиотеки. Соответственно, главные соединения, идентифицированные на начальных экранах, могут быть использованы для расширения списка подлежащих скринингу соединений, чтобы таким образом идентифицировать высокоактивные соединения.
Аптамеры нуклеиновой кислоты
В другом примере соединение представляет собой аптамер нуклеиновой кислоты (адаптируемый олигомер). Аптамеры представляют собой одноцепочечные олигонуклеотиды или аналоги олигонуклеотидов, которые способны образовывать вторичную и/или третичную структуру, которая обеспечивает способность связываться с определенной молекулой-мишенью, такой как белок или небольшая молекула, например CD131. Таким образом, аптамеры представляют собой олигонуклеотидную аналогию с антителами. Как правило, аптамеры содержат от около 15 до около 100 нуклеотидов, например от около 15 до около 40 нуклеотидов, например от около 20 до около 40 нуклеотидов, так как олигонуклеотиды, имеющие длину, которая попадает в данные диапазоны, могут быть получены обычными способами.
Аптамер может быть изолирован или идентифицирован из библиотеки аптамеров. Библиотеку аптамера получают, например, клонированием случайных олигонуклеотидов в вектор (или вектор экспрессии в случае аптамера РНК), где случайная последовательность фланкирована известными последовательностями, которые обеспечивают сайт связывания для праймеров ПЦР. Отбирается аптамер, который обеспечивает желаемую биологическую активность (например, связывается специфически с N-эпитопом CD131). Аптамер с повышенной активностью выбирают, например, с использованием SELEX (Sytematic Evolution of Ligands by EXponential enrichment). Подходящие способы получения и/или скрининга библиотеки аптамеров описаны, например, в Elloington and Szostak, Nature 346: 818- 22, 1990; US 5270163; и/или US 5475096.
Конъюгаты
В одном примере CD131-связывающий белок по настоящему изобретению конъюгирован с соединением. Например, данное соединение выбрано из группы, состоящей из радиоизотопа, детектируемой метки, терапевтического соединения, коллоида, токсина, нуклеиновой кислоты, пептида, белка, соединения, которое увеличивает период полувыведения CD131-связывающего белка у субъекта, и их смесей.
Другое соединение может быть прямо или непрямо связано с CD131-связывающим белком (например, может содержать линкер в случае непрямого связывания). Примеры соединений включают в себя радиоизотоп (например, йод-131, иттрий-90 или индий-111), детектируемую метку (например, флуорофор или флуоресцентный нанокристалл или квантовую точку), терапевтическое соединение (например, химиотерапевтическое или противоопухолевое), коллоид (например, золото), токсин (например, рицин или столбнячный токсоид), нуклеиновую кислоту, пептид (например, пептид, связывающий сывороточный альбумин), белок (например, белок, содержащий антиген связывающего домена антитела или сывороточного альбумина), соединение, которое увеличивает период полувыведения CD131-связывающего белка у субъекта (например, полиэтиленгликоль или другой водорастворимый полимер, обладающий такой активностью), и их смеси. Служащие примерами соединения, которые могут быть конъюгированы с CD131-связывающим белком по настоящему изобретению, и способы такой конъюгации, известны в данной области техники и описаны, например, в WO 02010/059821.
CD131-связывающий белок может быть конъюгирован с наночастицами (например, как описано в Kogan et al., Nanomedicine (Lond). 2: 287-306, 2007). Наночастицами могут быть металлические наночастицы.
CD131-связывающий белок могут содержаться в нацеленных на антитело бактериальных мини-клетках (например, как описано в PCT/IB2005/000204).
Некоторые примеры соединений, которые могут быть конъюгированы с CD131-связывающим белком по настоящему изобретению, перечислены в таблице 2
Таблица 2. Соединения, применимые при конъюгации
• Глицерин
• Глюкоза
• Aллофикоцианин (APC)
• Alexa Fluor 488
• Cy5.5
• иммуномодуляторы или белки, такие как цитокины, например интерферон
• токсины
• иммуноглобулин или антитело или вариабельная область антитела
• средства, удлиняющие период полувыведения, такие как альбумин или вариабельные области антитела или пептиды, которые связываются с альбумином
• 5-FU
• Доксорубицин
• Идаруцибин
Оценка активности CD131-связывающего белка
Связывание с CD131 и их мутантами
Специалисту в данной области техники будет очевидно, что некоторые CD131-связывающие белки по настоящему изобретению связываются с внеклеточной областью (например, областью, описанной в настоящем изобретении) hCD131 и со специфическими мутантными формами внеклеточной области hCD131 (например, SEQID NO: 3 или SEQID NO: 192 без определенных точечных мутаций или с определенными точечными мутациями). Способы оценки связывания с белком известны в данной области техники, например, как описано в Scopes (In: Protein purification: principles and practice, Third Edition, Springer Verlag, 1994). Такой способ обычно включает иммобилизацию CD131-связывающего белка и контактирование с меченым антигеном. После промывки для удаления неспецифического связанного белка количество метки и, как следствие, связанный антиген детектируется. Конечно, CD131-связывающий белок может быть помечен и антиген иммобилизован. Также можно использовать анализы на основе отбора на поверхности планшета (Panning). Альтернативно, или дополнительно, можно использовать анализы поверхностного плазмонного резонанса.
Описанные выше анализы также могут быть использованы для определения уровня связывания белка с CD131 или его внеклеточной областью (например, как изложено в SEQID NO: 192).
В одном примере CD131-связывающий белок по настоящему изобретению связывается с полипептидом, содержащим последовательность, представленную в SEQ ID NO: 119, на уровне, по меньшей мере приблизительно в 1, 5 раза или в 2 раза, или в 5 раз, или в 10 раз, или в 50 раз, или в 100 раз, или в 150 раз, или в 160 раз, или в 200 раз ниже, чем он связывается с полипептидом SEQ ID NO: 192. В одном примере CD131-связывающий белок настоящего описания не обнаруживает связывания с полипептидом, содержащим последовательность, представленную в SEQ ID NO: 119.
В одном примере CD131-связывающий белок по настоящему изобретению связывается с полипептидом SEQ ID NO: 124 на уровне, по меньшей мере приблизительно в 1,5 раза или в 2 раза, или в 5 раз, или в 10 раз, или в 50 раз, или в 100 раз, или в 150 раз, или в 160 раз, или в 200 раз ниже, чем он связывается с полипептидом SEQ ID NO: 192. В одном примере CD131-связывающий белок по настоящему изобретению не обнаруживает связывания с полипептидом, содержащим последовательность, представленную в SEQ ID NO: 124.
В одном примере CD131-связывающий белок по настоящему изобретению связывается с полипептидом SEQ ID NO: 131 на уровне, по меньшей мере приблизительно в 1,5 раза или в 2 раза, или в 5 раз, или в 10 раз, или в 50 раз, или в 100 раз, или в 150 раз, или в 160 раз, или в 200 раз ниже, чем он связывается с полипептидом SEQ ID NO: 192. В одном примере CD131-связывающий белок по настоящему изобретению не обнаруживает связывания с полипептидом, содержащим последовательность, представленную в SEQ ID NO: 131.
В одном примере CD131-связывающий белок по настоящему изобретению связывается с полипептидом SEQ ID NO: 137 на уровне, по меньшей мере приблизительно в 1,5 раза или в 2 раза, или в 5 раз, или в 10 раз, или в 50 раз, или в 100 раз, или в 150 раз, или в 160 раз, или в 200 раз ниже, чем он связывается с полипептидом SEQ ID NO: 192. В одном примере CD131-связывающий белок по настоящему изобретению не обнаруживает связывания с полипептидом, содержащим последовательность, представленную в SEQ ID NO: 137.
В одном примере CD131-связывающий белок по настоящему изобретению связывается с полипептидом SEQ ID NO: 139 на уровне, по меньшей мере приблизительно в 1,5 раза или в 2 раза, или в 5 раз, или в 10 раз, или в 50 раз, или в 100 раз, или в 150 раз, или в 160 раз, или в 200 раз, или в 1000 раз, или в 2000 раз ниже, чем он связывается с полипептидом SEQ ID NO: 192.
В одном примере CD131-связывающий белок по настоящему изобретению связывается с полипептидом SEQ ID NO: 138 на уровне, по меньшей мере приблизительно в 1,5 раза или в 2 раза, или в 5 раз, или в 10 раз, или в 50 раз, или в 100 раз ниже, чем он связывается с полипептидом SEQ ID NO: 192.
Уровень связывания удобно определить с помощью биосенсора, например, с помощью поверхностного плазмонного резонанса.
Настоящее изобретение рассматривает любую комбинацию вышеперечисленных характеристик. В одном примере описанный в настоящем изобретении CD131-связывающий белок обладает всеми характеристиками связывания, изложенными в предыдущих семи абзацах.
Картирование эпитопов
В другом примере картирован эпитоп, связываемый белком, описанным в настоящем изобретении. Специалистам в данной области техники будут очевидны способы картирования эпитопа. Например, получают ряд перекрывающихся пептидов, охватывающих последовательность CD132 или ее область, содержащую представляющий интерес эпитоп, например пептиды, содержащие от 10 до 15 аминокислот. CD131-связывающий белок затем вводят в контакт с каждым пептидом и определяют пептид(ы), с которым он связывается. Это позволяет определять пептид(ы), содержащий эпитоп, с которым связывается белок. Если с белком связывается несколько несмежных пептидов, то белок может связывать конформационный эпитоп.
Альтернативно или в дополнение, аминокислотные остатки в CD131 подвергают мутагенезу, например, путем аланинового сканирующего мутагенеза или замены эволюционно консервативных аминокислот, и определяют мутации, которые уменьшают или предотвращают связывание CD131-связывающего белка. Любая мутация, которая уменьшает или предотвращает связывание CD131-связывающего белка, вероятно, находится внутри эпитопа, связываемого CD131-связывающим белком.
Дополнительный способ определения области, содержащей эпитоп, включает связывание CD131 или его области с иммобилизованным CD131-связывающим белком по настоящему изобретению и переваривание полученного комплекса с помощью протеаз. Пептид(ы), который остается связанным с иммобилизованным CD131-связывающим белком, затем выделяют и анализируют, например, используя масс-спектрометрию для определения их последовательности.
Еще один способ включает превращение атомов водородов в CD131 или его области в дейтроны и связывание полученного белка с иммобилизованным CD131-связывающим белком по настоящему изобретению. Дейтроны затем превращаются обратно в водород, CD131 или его область выделяют, расщепляют ферментами и анализируют, например, с использованием масс-спектрометрии для идентификации тех областей, которые содержат дейтроны, которые были бы защищены от превращения в водород связыванием CD131-связывающего белка, описанного в настоящем изобретении.
Необязательно, определяют константу диссоциации (Kd), константу ассоциации (Ka) и/или константу аффинности (KD) иммобилизованного CD131-связывающего белка для CD131 или его эпитопа. «Kd» или «Ka» или «KD» для CD131-связывающего белка в одном примере измеряется анализом связывания меченного радиоактивным изотопом или флуоресцентно-меченного CD131. В случае «Kd», в данном анализе CD131-связывающий белок уравновешивается минимальной концентрацией меченого CD131 в присутствии полученных титрованием разведений немеченого CD131. После промывки для удаления несвязанного CD131 определяют количество метки, что указывает на Kd белка.
Согласно другому примеру, Kd, Ka или KD измеряют с использованием анализа поверхностного плазмонного резонанса, например, с использованием поверхностного плазмонного резонанса BIAcore (BIAcore, Inc., Piscataway, NJ) с иммобилизованным CD131 или его областью или иммобилизованным IL-CD131-связывающим белком.
В некоторых примерах CD131-связывающий белок имеет аналогичную KD или улучшенную KD (то есть значение KD ниже, чем), по сравнению с антителом 9А2 или 9А2-VR24 или 9А2-VR39, поскольку они могут конкурировать за связывание с CD131.
Определение конкурентного связывания
Анализы для определения белка, который конкурентно ингибирует связывание антитела 9А2 или антитела, содержащего V-области его другого антитела, описанного в настоящем изобретении, будет очевидным для специалиста в данной области. Один из таких способов приведен в качестве примера в настоящем изобретении.
Например, антитело конъюгируют с детектируемой меткой, например флуоресцентной меткой или радиоактивной меткой. Меченое антитело и тестируемый CD131-связывающий белок затем смешивают и вводят в контакт с CD131 или его областью (например, которая содержится в полипептиде, содержащем SEQ ID NO: 192) или с клеткой, экспрессирующей CD131 или его область. Уровень меченого антитела затем определяют и сравнивают с уровнем, определяемым, когда меченое антитело вводят в контакт с CD131, областью или клетками в отсутствие CD131-связывающего белка. Если уровень меченого антитела снижается в присутствии тестируемого CD131-связывающего белка по сравнению с таковым в отсутствие CD131-связывающего белка, то CD131-связывающий белок считается конкурентно ингибирующим связывание антитела с CD131.
Необязательно, тестируемый CD131-связывающий белок конъюгируют с другой меткой к антителу. Данные альтернативные маркировки позволяют обнаружить уровень связывания тестируемого CD131-связывающего белка с CD131 или его областью или клеткой.
В другом примере CD131-связывающему белку дают связаться с CD131 или его областью (например, которая содержится в полипептиде, содержащем последовательность SEQ ID NO: 192) или клеткой, экспрессирующей экспрессирующей CD131 или его область, до контактирования CD131, области или клетки с антителом. Снижение количества связанного антитела в присутствии CD131-связывающего белка по сравнению с таковым в отсутствие CD131-связывающего белка указывает на то, что белок конкурентно ингибирует связывание антитела с CD131. Реципрокный анализ также может быть осуществлен с использованием меченого CD131-связывающего белка и сначала позволяет антителу связаться с CD131. В данном случае уменьшенное количество меченого CD131-связывающего белка, связанного с CD131 в присутствии антитела, по сравнению с таковым в отсутствие антитела, указывает на то, что CD131-связывающий белок конкурентно ингибирует связывание антитела с CD131.
Любой из вышеприведенных анализов может быть выполнен с мутантной формой CD131 и/или SEQ ID NO: 192 и/или с внеклеточной областью CD131, с которой связывается антитело 9А2, например, как описано в настоящем изобретении.
Определение нейтрализации
В одном примере CD131-связывающий белок уменьшает или предотвращает связывание IL-3, IL-5 и/или GM-CSF с рецептором, содержащим CD131 (например, IL-3R, IL-5R и/или GM-CSF-R, соответственно). Данные анализы могут быть проведены как анализ конкурентного связывания с использованием меченого IL-3/IL-5/GM-CSF и/или меченого CD131-связывающего белка. Например, клетки, экспрессирующие соответствующий рецептор, контактируют с IL-3/IL-5/GM-CSF в присутствии или в отсутствие CD131-связывающего белка, и определяется количество связанной метки. Уменьшение количества связанной метки в присутствии CD131-связывающего белка по сравнению с таковым в отсутствие соединения указывает на то, что соединение уменьшает или предотвращает связывание IL-3/IL-5/GM-CSF с рецептором, содержащим CD131. Путем тестирования нескольких концентраций соединения определяют IC50, то есть концентрацию белка, которая уменьшает количество IL-3/IL-5/GM-CSF, которое связывается с рецептором, содержащим CD131, или может быть определена величина EC50, то есть, концентрация белка, при которой достигается 50% максимального ингибирования связывания IL-3/IL-5/GM-CSF с CD131, достигаемого соединением.
В следующем примере CD131-связывающий белок уменьшает или предотвращает опосредуемую IL-3/IL-5/GM-CSF пролиферацию клеток лейкемической линии TF-1. Например, клетки TF-1 культивируются без IL-3/IL-5/GM-CSF в течение периода времени, достаточного для прекращения их пролиферации (например, от 24 до 48 часов). Затем клетки культивируют в присутствии IL-3/IL-5/GM-CSF и различных концентраций CD131-связывающего белка. Контрольные клетки не контактируют с соединением (положительный контроль) или с IL-3/IL-5/GM-CSF (отрицательный контроль). Затем пролиферацию клеток оценивают, используя стандартную методику, например, включение 3H-тимидина. CD131-связывающий белок, который уменьшает или предотвращает пролиферацию клеток в присутствии IL-3 до уровня, меньшего, чем положительный, считается нейтрализующим сигнал, передаваемый IL-3. Путем тестирования нескольких концентраций CD131-связывающего белка определяют IC50.
В другом примере CD131-связывающий белок ингибирует или предотвращает активацию STAT-5. Например, клетки (например, клетки TF-1), содержащие ген-репортер бета-лактамазы под контролем интерферон-регуляторного фактора 1 (irf1) в присутствии IL-3 и/или GM-CSF. Подходящие клетки доступны от Life Technologies Corporation. Клетки также подвергают контакту с подходящим субстратом (например, отрицательно заряженным флюоресцентным бета-лактамазным субстратом, таким как CCF2 или CCF4) и определяют изменение сигнала (например, флуоресценции). Уменьшение изменения сигнала в положительном контроле (то есть в клетках, контактирующих с IL-3 и/или GM-CSF в отсутствие белка или антитела) указывает на то, что белок или антитело уменьшает или предотвращает IL-3 и/или GM-CSF-индуцированную передачу сигнала посредством STAT-5.
В следующем примере CD131-связывающий белок по настоящему изобретению воздействует на иммунную клетку.
Например, CD131-связывающий белок уменьшает или ингибирует активацию изолированных человеческих нейтрофилов посредством GM-CSF, как определено уменьшением или ингибированием увеличения количества клеток нейтрофилов, индуцированного GM-CSF. Например, нейтрофилы (например, около 1 × 105 клеток) культивируют в присутствии CD-131-связывающего белка и GM-CSF в течение подходящего времени (например, около 24 часов). Затем клетки фиксируют (например, формальдегидом) и анализируют на прямое рассеяние с использованием проточной цитометрии.
В одном примере CD131-связывающий белок уменьшает или ингибирует IL-3-индуцированную секрецию IL-8 человеческими базофилами. Например, базофилы (например, около 1 × 105 клеток) культивируют в присутствии CD131-связывающего белка и IL-3 в течение подходящего времени (например, 24 часа). Секрецию IL-8 затем оценивают, например, используя ELISA, например, как доступно из R&D Systems.
В следующем примере CD131-связывающий белок уменьшает или предотвращает IL-3-опосредуемое выживание клеток pDC. Например, клетки pDC культивируют в присутствии CD131-связывающего белка и IL-3 в течение подходящего времени (например, 24 часа). Выживаемость клеток затем оценивают, например, с использованием стандартного способа, такого как набор ViaLight Plus Kit от Lonza.
В следующем примере CD131-связывающий белок уменьшает или предотвращает активацию эозинофилов периферической крови человека посредством IL-5, как определено путем оценки изменения прямого рассеяния, оцененного с помощью проточной цитометрии. Например, эозинофилы (например, около 1 × 105 клеток) культивируют в присутствии CD131-связывающего белка и IL-5 в течение подходящего времени (например, около 24 часов). Затем клетки фиксируются (например, в формальдегиде), и производят оценку изменения прямого рассеяния, например, с использованием проточной цитометрии.
В следующем примере CD131-связывающий белок по настоящему изобретению уменьшает или предотвращает выживаемость эозинофилов периферической крови человека в присутствии IL-5 и/или GM-CSF и/или IL-3. Например, эозинофилы (например, около 1 × 104 клеток) культивируют в присутствии CD131-связывающего белка и IL-5 и/или GM-CSF и/или IL-3 в течение подходящего времени (например, около 5 дней), и число клеток оценивают с использованием стандартного способа (например, комплект ViaLight Plus Kit от Lonza).
В еще одном дополнительном примере CD131-связывающий белок по настоящему изобретению уменьшает или предотвращает IL-3-индуцированного высвобождение TNFα из человеческих тучных клеток. Например, культивируемые человеческие тучные клетки (например, десятинедельные клетки, полученные из периферической крови) культивируют в присутствии CD131-связывающего белка и IL-3. Уровни секреции TNFα затем оценивают, например, с помощью ELISA.
В следующем примере CD131-связывающий белок по настоящему изобретению уменьшает или предотвращает IL-3-индуцированное высвобождение IL-13 из человеческих тучных клеток. Например, культивируемые человеческие тучные клетки (например, десятинедельные клетки, полученные из периферической крови) культивируют в присутствии CD131-связывающего белка и IL-3. Уровни секреции IL-13 затем оценивают, например, с помощью ELISA.
В следующем примере CD131-связывающий белок по настоящему изобретению уменьшает или предотвращает усиление IgE-опосредованного высвобождения IL-8 из человеческих тучных клеток посредством IL-3 и/или IL-5 и/или GM-CSF. Например, культивируемые человеческие тучные клетки (например, десятинедельные клетки, полученные из периферической крови) культивируют в присутствии CD131-связывающего белка и IL-3/IL-5/GM-CSF (например, в течение около 48 часов). Затем клетки культивируют с IgE (например, IgE человеческой миеломы) в течение подходящего времени (например, около 24 часов) и оценивают секрецию IL-8, например, с помощью ELISA.
В следующем примере CD131-связывающий белок уменьшает или предотвращает образование CFU-GM клетками костного мозга CD34+ (или клетками пуповинной крови), культивированными в присутствии SCF, GM-CSF, IL-3 и IL-5. Например, клетки CD34+ (например, около 1 × 103 клеток) культивируют (например, на метилцеллюлозе (такой как 1% метилцеллюлоза), дополненной эмбриональной телячьей сывороткой, бычьим сывороточным альбумином, SCF, GM-CSF, IL-3 и IL-5), и в присутствии CD131-связывающего белка. Клетки культивируют в течение подходящего времени (например, около 16 дней), и подсчитывают число колоний, образующихся впоследствии.
В следующем примере CD131-связывающий белок или антитело по настоящему изобретению снижает выживаемость или индуцирует гибель иммунных клеток (например, эозинофилов) из мокроты или ткани носового полипа у субъекта, страдающего воспалительной болезнью дыхательных путей или назальным полипозом. Например, иммунные клетки культивируют в присутствии IL-3 и/или IL-5 и/или GM-CSF и белка или антитела. Затем гибель клеток оценивают с использованием стандартных способов, например, определением экспрессии аннексина-V, например, с использованием сортировки клеток с активированной флуоресценцией).
В другом примере CD131-связывающий белок уменьшает или предотвращает IL-3-опосредованное высвобождение гистамина из базофилов. Например, лейкоциты низкой плотности, содержащие базофилы, инкубируют с IgE, IL-3 и различными концентрациями антитела или антигенсвязывающего фрагмента. Контрольные клетки не содержат иммуноглобулина (положительный контроль) или IL-3 (отрицательный контроль). Затем уровень высвобожденного гистамина оценивают с использованием стандартного способа, например, RIA. Считается, что CD131-связывающий белок, который снижает уровень высвобождения гистамина до уровня меньше, чем положительный контроль, нейтрализует передачу сигнала посредством IL-3. В одном примере уровень восстановления коррелирует с концентрацией белка. Пример способа оценки IL-3-опосредованного высвобождения гистамина описан, например, у Lopez et al., J. Cell. Physiol., 145: 69, 1990.
Другой анализ для оценки нейтрализации передачи сигнала посредством IL-3 включает в себя определение того, уменьшает или не уменьшает, или предотвращает или не предотвращает CD131-связывающий белок IL-3-опосредованное действие на эндотелиальные клетки. Например, эндотелиальные клетки пуповины человека (human umbilical vein endothelial cells (HUVEC)) культивируют в присутствии IL-3 (необязательно с IFN-γ) и различных концентраций CD131-связывающего белка. Затем оценивают количество секретируемого IL-6, например, используя твердофазный иммуноферментный анализ (ELISA). Контрольные культуры не содержат CD131-связывающий белок (положительный контроль) или IL-3 (отрицательный контроль). Считается, что CD131-связывающий белок, который уменьшает или предотвращает выработку IL-6 в присутствии IL-3 до уровня меньше, чем положительный контроль, нейтрализует передачу сигнала посредством IL-3.
Другие способы оценки сигнализации нейтрализации рассматриваются в настоящем раскрытии.
Определение эффекторной функции
Как обсуждалось в настоящем изобретении, некоторые CD131-связывающие белки по настоящему изобретению имеют пониженную эффекторную функцию или имеют эффекторную функцию (или повышенную эффекторную функцию). Способы оценки ADCC-активности известны в данной области техники.
В одном примере уровень ADCC-активности оценивают с использованием анализа высвобождения 51Cr, анализа высвобождения европия или анализа высвобождения 35S. В каждом из данных анализов клетки, экспрессирующие CD131, культивируют с одним или несколькими перечисленными соединениями в течение определенного периода времени и в условиях, достаточных для того, чтобы соединение принималось клеткой. В случае анализа высвобождения 35S, клетки, экспрессирующие CD131, можно культивировать с 35S-меченным метионином и/или цистеином в течение периода времени, достаточного для включения меченых аминокислот во вновь синтезированные белки. Затем клетки культивируют в присутствии или в отсутствие CD131-связывающего белка и в присутствии иммунных эффекторных клеток, например, мононуклеарных клеток периферической крови (РВМС) и/или NK-клеток. Затем определяют количество 51Cr, европия и/или 35S в клеточной культуральной среде, и небольшие изменения или отсутствие изменений в количестве в присутствии CD131-связывающего белка по сравнению с таковыми в отсутствие CD131-связывающего белка указывает на то, что белок обладает пониженной эффекторной функцией, и увеличенное количество по сравнению с таковым в отсутствие CD131-связывающего белка (или увеличенное количество по сравнению с таковым в присутствии CD131-связывающего белка, содержащего Fc-область IgG1), указывает на наличие эффекторной функции или повышенную эффекторную функцию. Типичные публикации, раскрывающие анализы для оценки уровня ADCC, индуцированного белком, включают Hellstrom, et al., Proc. Natl Acad. Sci. USA 83:7059-7063, 1986 и Bruggemann, et al., J. Exp. Med. 166:1351-1361, 1987.
Другие анализы для оценки уровня ADCC, индуцированной белком, включают нерадиоактивный анализ цитотоксичности ACTI™ для проточной цитометрии (ACTI™ nonradioactive cytotoxicity assay for flow cytometry) (CellTechnology, Inc. CA, USA) или нерадиоактивный анализ цитотоксичности CytoTox 96® (CytoTox 96® non-radioactive cytotoxicity assay) (Promega, WI, USA).
Анализы связывания C1q также могут быть проведены для подтверждения того, что CD131-связывающий белок способен связывать C1q и может индуцировать CDC. Для оценки активации комплемента может быть проведен анализ CDC (см., например, Gazzano-Santoro et al., J.Immunol. Methods 202: 163, 1996).
Определение периода полувыведения
Некоторые CD131-связывающие белки, охватываемые настоящим изобретением, имеют улучшенный период полувыведения, например, модифицированы для продления их периода полувыведения по сравнению с CD131-связывающими белками, которые не модифицированы. Специалисту в данной области техники будет понятно, какие способы определения CD131-связывающего белка с улучшенным периодом период полувыведения могут быть использованы. Например, оценивают способность CD131-связывающего белка связываться с неонатальным Fc-рецептором (FcRn). В связи с этим, повышенная аффинность связывания с FcRn увеличивает период полувыведения в сыворотке CD131-связывающего белка (см., например, Kim et al., Eur J of Immunol 24:542, 1994).
Период полувыведения CD131-связывающего белка по настоящему изобретению может также быть измерен с помощью фармакокинетических исследований, например, в соответствии со способом, описанным Kim et al., Eur J of Immunol 24:542, 1994. Согласно данному способу, меченый CD131-связывающий белок вводится внутривенно мышеам, и его концентрация в плазме периодически измеряется как функция времени, например, от 3 минут до 72 часов после инъекции. Полученная таким образом кривая клиренса должна быть двухфазной, то есть с альфа-фазой и бета-фазой. Для определения in vivo периода полувыведения белка, рассчитывается скорость клиренса в бета-фазе и сравнивается с фазой белка дикого типа или немодифицированного белка.
Оценка терапевтической эффективности
Анализы для оценки терапевтической эффективности описаны выше в отношении определения нейтрализации CD131-связывающим белком.
В другом примере эффективность белка для лечения состояния оценивают с использованием анализа in vivo.
Так, например, CD131-связывающий белок может быть протестирован при Тh2-воспалительном состоянии, таком как астма или гиперреактивность дыхательных путей. Иллюстративной моделью аллергической астмы является мышиная OVA-модель, например, как описано в Wang et al, J. Immunol. 165: 2222, 2000. После индукции воспаления CD131-связывающий белок вводят мышам и оценивают симптомы астмы, такие как количество эозинофилов в бронхоальвеолярной лаважной жидкости (bronchoalveolar lavage fluid (BAL)), секрецию слизи и/или гиперплазию бокаловидных клеток. Другие модели астмы известны в данной области техники и включают в себя модель воспалительной астмы у овцы, описанную в WO2002/098216, мышиную модель аллергической астмы, например, индуцированную клещевым аллергеном домашней пыли (Fattouh et al., Am J Respir Crit Care Med 172: 314–321, 2005), мышиную модель тяжелой бронхиальной астмы, в которой сверхэкспрессированы IL-5 и эотаксин, или мыши, получающие эндотрахеальную инстилляцию поли-L-лизина, которые являются гиперчувствительными к метахолину при доставке в виде аэрозоля (Homma et al., Am J Physiol Lung Cell Mol Physiol 289: L413–L418, 2005).
В другом примере CD131-связывающий белок тестируют на животной модели артрита. Служащие примером модели включают штамм SKG мыши (Sakaguchi et al., Nature, 426: 454-460), крысиную модель индуцированного коллагеном II типа артрита, мышиную модель индуцированного коллагеном II типа артрита или модели артрита, индуцированного антигеном, у нескольких видов (Bendele J Musculoskel Neuron Interact; 1(4):377-385, 2001). В данных анализах индуцируется артрит и оценивается способность CD131-связывающего белка уменьшать один или более симптомов артрита, например, воспаление суставов и/или маркеры воспаления в синовиальной жидкости. CD131-связывающий белок, который уменьшает симптом артрита, считается применимым для лечения данного состояния или CD131-опосредованного состояния (например, CD131-опосредованного воспалительного состояния).
CD131-связывающий белок также или альтернативно может быть протестирован в модели COPD, например, когда отличное от человека млекопитающее (например, грызун, например, мышь) подвергают воздействию сигаретного дыма. После воздействия млекопитающему вводят CD131-связывающий белок, и уровень воспаления легких и/или количество нейтрофилов в легких оценивают или рассчитывают с использованием стандартных способов. CD131-связывающий белок, который уменьшает воспаление легких и/или число нейтрофилов, считается применимым для лечения воспаления легких или COPD или CD131-опосредованного состояния (например, CD131-опосредованного воспалительного состояния, такого как CD131-опосредованное воспалительное состояние легких).
В следующем примере CD131-связывающий белок тестируют в модели колита, например, у обработанных оксазолоном мышей, у которых развивается эозинофилия толстой кишки, или модели, как описано в Albert et al., Am. J. Pathol., 178: 150-160, 2011).
В другом примере CD131-связывающий белок вводят животному, не относящемуся к человеку (например, примату, отличному от человека), и оценивают количество/уровень иммунных клеток, например эозинофилов, в кровяном русле или в ткани или в другом образце (например, жидкости BAL). CD131-связывающий белок, который уменьшает количество/уровень иммунных клеток по сравнению с таковым перед введением и/или у контрольного млекопитающего, которому белок не вводили, считается подходящим для лечения заболевания или состояния.
В другом примере CD131-связывающий белок тестируют в модели пассивной кожной анафилаксии, например, в которой отличному от человека млекопитающему (например, грызун, такой как мышь), сенсибилизированному антидинитрофенилом (DNP)-IgE и впоследствии стимулированному DNP-человеческим сывороточным альбумином (HSA), вводят CD131-связывающий белок, и изменение толщины уха от исходного уровня (т.е. до введения) и/или уровня цитокина, такого как TNF или IL-13, оценивается или рассчитывается с использованием стандартных способов. CD131-связывающий белок, который уменьшает изменение толщины ушей и/или уменьшает уровень цитокинов по сравнению с контрольным млекопитающим, к которому данное соединение не применяли, считается подходящим для лечения заболевания или состояния.
В другом примере уровень цитокина, такого как IFNα или TNFα, определяется в кровяном русле млекопитающего, например, с использованием ELISA. CD131-связывающий белок, который снижает уровень цитокина по сравнению с уровнем до введения и/или у контрольного млекопитающего, которому соединение не вводили, считается подходящим для лечения заболевания или состояния.
Состояния, подлежащие лечению
Настоящее изобретение рассматривает лечение или предотвращение любого состояния, которое вызвано или усугубляется при передаче сигнала через CD131 (например, посредством IL-3 и/или IL-5 и/или GM-CSF) у субъекта.
В одном примере данное состояние является аутоиммунным или воспалительным заболеванием или аллергическим состоянием.
В одном примере данное состояние представляет собой аутоиммунное опосредованное воспалительным заболевание. Например, аутоиммунное опосредованное воспалительным заболевание представляет собой ревматоидный артрит, рассеянный склероз, интерстициальная болезнь легких, колит или системная красная волчанка. В одном примере аутоиммунное состояние представляет собой рассеянный склероз. В одном примере аутоиммунное состояние представляет собой интерстициальное заболевание легких. В следующем примере аутоиммунное состояние представляет собой системную красную волчанку.
В одном примере воспалительное заболевание представляет собой хроническое воспалительное заболевание. Например, хроническое воспалительное заболевание представляет собой буллезный пемфигоид или синдром Чурга-Стросса. В одном примере состояние представляет собой буллезный пемфигоид. В другом примере данное состояние представляет собой синдром Чурга-Стросса.
В одном примере состояние представляет собой аллергическое состояние. Например, состояние представляет собой крапивницу, астму, гиперреактивность дыхательных путей, аллергический ринит, аллергический бронхолегочный аспергиллез, целиакию, полипоз носа, хронический риносинусит с носовыми полипами (chronic rhinosinusitis with nasal polyps (CRSwNP)), хронический риносинусит без носовых полипов (chronic rhinosinusitis without nasal polyps (CRSsNP)) или атопический дерматит. В одном примере состояние представляет собой хронический риносинусит с носовыми полипами (CRSwNP). В одном примере состояние представляет собой хронический риносинусит без носовых полипов (CRSsNP). В другом примере состояние представляет собой атопический дерматит. В другом примере состояние представляет собой хроническую крапивницу.
В одном примере аллергическое заболевание является аллергическим заболеванием легких. Например, состояние состояние представляет собой гиперреактивность астмы или дыхательных путей. Например, состояние представляет собой астму.
В соответствующем примере состояние представляет собой респираторное состояние. Например, состояние представляет собой астму или COPD или кистозный фиброз, фиброз легких или бронхиолит, альвеолит или васкулит или саркоидоз. В одном примере состояние представляет собой COPD. В другом примере состояние представляет собой легочный фиброз.
Используемый в настоящем изобретении термин «астма» будет пониматься как заболевание, характеризующееся пароксизмальными или стойкими симптомами одышки, сдавленности в грудной клетке, хрипения, образования мокроты и кашля, связанными с переменным ограничением воздушного потока и гиперреактивностью дыхательных путей по отношению к эндогенным или экзогенным стимулам (Canadian Asthma Consensus Guidelines), и/или состояние, характеризующееся гиперреактивностью дыхательных путей, которое приводит к повторяющимся эпизодам хрипения, одышки, сдавленности в грудной клетке и кашля, особенно ночью или ранним утром, а также обструкцией воздушного потока, которая часто обратима либо спонтанно, либо с помощью лечения (The Global Initiative for Asthma).
В одном примере состояние представляет собой тяжелую астму. Используемый в настоящем изобретении термин «тяжелая астма» будет пониматься как хорошо контролируемые симптомы астмы при высоких и очень высоких дозах ингаляционных кортикостероидов с использованием или без применения пероральных кортикостероидов; и «очень тяжелая астма» будет пониматься как хорошо или недостаточно хорошо контролируемые симптомы астмы, несмотря на очень высокую дозу ингаляционных и проглоченных кортикостероидов и с необходимостью или без необходимости дополнительных способов лечения. Для данных определений ежедневные высокие и очень высокие дозы ингаляционного кортикостероида (приблизительные эквивалентные дозы) определяются следующим образом: высокая доза представляет собой беклометазона дипропионат, от 1000 до 2000 мкг; флутиказон, от 500 до 1000 мкг; и будесонид, от 800 до 1600 мкг, и очень высокая доза представляет собой флутиказон, от 1000 до 2000 мкг, и будесонид, от 1600 до 3200 мкг.
В одном примере состояние представляет собой рефрактерную астму. Используемый в настоящем изобретении термин «рефрактерная астма» включает пациентов с «фатальной» или «почти фатальной» астмой, а также подгруппы астмы, которые ранее были описаны как «тяжелая астма» и «стероидзависимая и/или резистентная астма», трудно контролируемая астма», «плохо контролируемая астма», «лабильная астма» или «необратимая астма». Рефрактерная астма может быть определена в соответствии с рекомендациями Американского торакального общества, когда выполняются один или оба основных критерия и два второстепенных критерия, описанные ниже. Основными критериями являются: для достижения контроля до уровня персистирующей астмы мягко-умеренной степени: (1) Лечение непрерывным или почти непрерывным (≥50% года) приемом пероральных кортикостероидов 2) Требование лечения высокодозированными ингаляционными кортикостероидами. Второстепенными критериями являются: (1) Требование ежедневного лечения препаратом-регулятором, в дополнение к ингаляционным кортикостероидам, например, LABA, теофиллином или антагонистом лейкотриена (2) Симптомы астмы, требующие применения β-агонистов короткого действия ежедневно или почти ежедневно (3) Персистирующая обструкция дыхательных путей (FEV1 <80% предсказанного, суточная вариабельность пиковой скорости выдоха (peak expiratory flow (PEF)) > 20%) (4) Одно или более посещений срочной помощи при астме в год (5) Три или более оральных стероидных «всплеска» в год (6) Быстрое ухудшение с ≤25% уменьшением пероральной или ингаляционной кортикостероидной дозы (7) Почти смертельный исход из-за астмы в прошлом. Для определения рефрактерной астмы препарат (мкг/сут) и доза (puffs/d) представляют собой следующее: (а) Беклометазон дипропионат > 1260 > 40 вдыхаемых ингаляционных доз (42 мкг/ингаляция) > 20 вдыхаемых ингаляционных доз (84 мкг/ингаляция); (b) Будезонид > 1200 > 6 вдыхаемых ингаляционных доз; (c) Флунизолид > 2000 > 8 вдыхаемых ингаляционных доз; (d) Пропионат флутиказона > 880 > 8 вдыхаемых ингаляционных доз (110 мкг), > 4 вдыхаемых ингаляционных дозы (220 мкг); (е) Триамцинолон ацетонид > 2000 > 20 вдыхаемых ингаляционных доз.
В одном примере состояние представляет собой острую астму или неаллергическую астму. Используемый в настоящем изобретении термин «мягкая астма» или «аллергическая астма» относится к астме, вызванной аллергенами (например, фекалиями пылевых клещей или пыльцой), активирующими тучные клетки, расположенные под слизистой оболочкой нижних дыхательных путей респираторного тракта. Активация тучных клеток вызывает выброс гранул, которые стимулируют эпителий носа к продуцированию слизи и последующему сокращению гладкой мускулатуры в дыхательных путях. Данное сокращение гладких мышц сжимает дыхательные пути, вызывая характерное астматическое свистящее дыхание.
В одном примере состояние представляет собой хроническую астму. «Хроническая астма» вызвана не аллергенами, а, скорее, является результатом воспаления, получаемого при острой астме. Общие эффекты острой астмы вызывают хроническое воспаление, которое приводит к тому, что эпителий слизистой оболочки становится сверхчувствительным к реакциям на окружающую среду. Таким образом, простые экологические агенты, такие как дым, могут стимулировать гиперчувствительный эпителий к производству больших количеств слизи и сужению дыхательныех путей.
В одном примере состояние представляет собой назальный полипоз.
В одном примере состояние представляет собой эозинофилию или характеризуется эозинофилией. Типичные условия включают состояния легких (такие как астма и синдром Лоффлера), васкулит (например, синдром Чурга-Стросса), хроническую эозинофильную пневмонию, воспалительное заболевание кишечника (например, колит (например, язвенный колит) или болезнь Крона), вызванную лекарственными средствами эозинофилию, паразитарные инфекции кишечника, коллагеновые сосудистые заболевания (например, ревматоидный артрит), цирроз печени, рефлюксный эзофагит, заболевания кожи (например, отшелушивающий дерматит или атопический дерматит), эозинофильные желудочно-кишечные расстройства (например, гастроэнтерит, эзофагит, гастрит), носовые полипы, гиперэозинофильный бронхит или аллергический конъюнктивит.
В одном примере данное состояние является эозинофильным желудочно-кишечным расстройством. В одном примере состояние представляет собой эзофагит. В другом примере состояние представляет собой гастрит. В другом примере состояние представляет собой гастроэнтерит.
В одном примере аутоиммунное состояние представляет собой аутоиммунное состояние сустава, такое как воспалительный артрит, ревматоидный артрит или идиопатический артрит, например, ювенильный идиопатический артрит. В одном примере состояние представляет собой ревматоидный артрит.
В одном примере аутоиммунное состояние представляет собой состояние аутоиммунного кишечника, такое как воспалительное заболевание кишечника, такое как язвенный колит или болезнь Крона.
В одном примере аутоиммунное состояние представляет собой аутоиммунное состояние кожи, такое как псориаз.
В одном примере представляет собой буллезный пемфигоид.
В одном примере состояние представляет собой мастоцитоз.
В одном примере состояние представляет собой синдром активации тучных клеток.
В одном примере представляет собой рак. Примеры рака включают рак мочевого пузыря и гематологические раковые заболевания, такие как лимфома или лейкемия. В одном примере рак представляет собой рак мочевого пузыря.
В одном примере гематологический рак представляет собой острый миелоидный лейкоз. В другом примере гематологический рак является хроническим миелоидным лейкозом.
В одном примере субъект устойчив к лечению, не отвечает адекватно или не подходит для лечения другим соединением, используемым для лечения данного состояния. Например, субъект, страдающий аутоиммунным или воспалительным или аллергическим заболеванием, устойчив к лечению, не отвечает адекватно или не подходит для лечения кортикостероидом, и/или иммунодепрессантом, и/или циклофосфамидом, и/или метотрексатом, и/или анти-TNF-антителом или растворимым рецептором TNF, и/или анти-CD20-антителом, и/или анти-IL6-антителом, и/или анти-CD22-антителом.
Настоящее изобретение также обеспечивает способ ингибирования пролиферации клеток, чувствительных к IL-3/IL-5/GM-CSF, in vivo, причем данный способ включает введение субъекту CD131-связывающего белка или антитела по настоящему изобретению.
Настоящее изобретение также обеспечивает способ ингибирования накопления эозинофилов in vivo, причем данный способ включает введение субъекту CD131-связывающего белка или антитела по настоящему изобретению.
Композиции
В некоторых примерах CD131-связывающий белок, как описано в настоящем изобретении, можно вводить перорально, парентерально, посредством ингаляционного спрея, адсорбции, абсорбции, местно, ректально, назально, буккально, вагинально, внутрижелудочно, через имплантированный резервуар в лекарственных формах, содержащих обычные нетоксичные фармацевтически приемлемые носители, или любой другой удобной лекарственной формой. Используемый в настоящем изобретении термин «парентеральный» включает подкожные, внутривенные, внутримышечные, внутрибрюшинные, интратекальные, внутрижелудочковые, интрастернальные, внутриполостные и внутричерепные инъекции или способы вливания.
Способы получения CD131-связывающего белка в подходящей форме для введения субъекту (например, фармацевтическая композиция) известны в данной области техники и включают, например, способы, описанные в Remington's Pharmaceutical Sciences (18th ed., Mack Publishing Co., Easton, Pa., 1990) и U.S. Pharmacopeia: National Formulary (Mack Publishing Company, Easton, Pa., 1984).
Фармацевтические композиции по настоящему изобретению особенно применимы для парентерального введения, такого как внутривенное введение или введение в полость тела или просвет органа или сустава. Композиции для введения обычно включают раствор CD131-связывающего белка, растворенного в фармацевтически приемлемом носителе, например, в водном носителе. Могут быть использованы различные водные носители, например, буферный солевой раствор и тому подобное. Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, необходимые для аппроксимации физиологических условий, таких как регулирующие рН и буферные агенты, агенты для регулирования токсичности и тому подобное, например ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и тому подобное. Концентрация CD131-связывающего белка по настоящему изобретению в данных составах может широко варьироваться и будет выбираться, в основном, исходя из объемов жидкости, вязкости, массы тела и т.п., в соответствии с выбранным конкретным способом введения и потребностями пациента. Примеры носителей включают воду, физиологический раствор, раствор Рингера, раствор декстрозы и 5% человеческий сывороточный альбумин. Также могут использоваться неводные носители, такие как смешанные масла и этилолеат. Липосомы могут также использоваться в качестве носителей. Носители могут содержать незначительные количества добавок, которые повышают изотоничность и химическую стабильность, например, буферы и консерванты.
После приготовления CD131-связывающий белок по настоящему изобретению будет вводиться способом, совместимым с лекарственной формой, и в таком количестве, которое является терапевтически/профилактически эффективным. Составы легко вводятся в различных лекарственных формах, таких как тип растворов для инъекций, описанных выше, но также рассматриваются другие фармацевтически приемлемые формы, например таблетки, пилюли, капсулы или другие твердые вещества для перорального введения, суппозитории, пессарии, назальные растворы или аэрозоли, аэрозоли, ингалянты, липосомальные формы и тому подобное. Также могут быть использованы фармацевтические капсулы или композиции замедленного высвобождения. Композиции замедленного высвобождения обычно предназначены для обеспечения константного уровня лекарственного средства в течение длительного периода времени и могут быть использованы для доставки CD131-связывающего белка по настоящему изобретению.
В WO2002/080967 описаны композиции и способы введения аэрозольных композиций, содержащих антитела для лечения, например, астмы, которые также подходят для введения CD131-связывающего белка по настоящему изобретению.
Комбинированные терапии
В одном примере CD131-связывающий белок по настоящему изобретению вводят в сочетании с другим соединением, подходящим для лечения описанного в настоящем изобретении состояния, либо в виде объединенных, либо дополнительных стадий лечения или в качестве дополнительных компонентов терапевтического препарата.
Например, другое соединение является противовоспалительным соединением. Альтернативно, или дополнительно, другое соединение является иммунодепрессантом. Альтернативно, или дополнительно, другое соединение представляет собой кортикостероид, такой как преднизон и/или преднизолон. Альтернативно, или дополнительно, другое соединение представляет собой метотрексат. Альтернативно, или дополнительно, другое соединение представляет собой циклофосфамид. Альтернативно или дополнительно, другое соединение представляет собой мофетил микофенолята. Альтернативно или дополнительно, другое соединение представляет собой анти-CD20-антитело (например, ритуксимаб или отатумумаб). Альтернативно или дополнительно, другое соединение представляет собой анти-CD22-антитело (например, эпратузумаб). Альтернативно или дополнительно, другое соединение представляет собой антитело против TNF (например, инфликсимаб или адалимумаб или голимумаб) или растворимый рецептор TNF (например, этанерцепт). Альтернативно или дополнительно, другое соединение представляет собой антагонист CTLA-4 (например, abatacept, CTLA4-Ig). Альтернативно или дополнительно, другое соединение представляет собой антитело против IL-6. Альтернативно или дополнительно, другое соединение представляет собой антагонист BLYS, такой как антитело против BLYS (например, belimumab).
В другом примере другое соединение представляет собой препарат химиотерапии или другой препарат, используемый для лечения рака.
В другом примере описанный в настоящем изобретении белок вводят до или после лучевой терапии для лечения рака.
Настоящее изобретение также относится к способу снижения дозы кортикостероида, требуемой для лечения пациента, страдающего аллергическим заболеванием (например, астмой или назальным полипозом), причем данный способ включает совместное введение CD131-связывающего белка по настоящему изобретению и кортикостероида, где кортикостероид вводят при более низкой дозе, чем если его вводят отдельно или в отсутствие CD131-связывающего белка. CD131-связывающий белок и кортикостероид не нужно вводить в одно и то же время, только таким образом, чтобы они оказывали перекрывающееся действие на субъекта (например, оба одновременно активны внутри субъекта).
Дозировки и сроки введения
Подходящие дозировки CD131-связывающего белка по настоящему изобретению будут варьироваться в зависимости от специфического CD131-связывающего белка, состояния, подлежащего лечению и/или подлежащего лечению субъекта. В пределах способности квалифицированного врача определять подходящую дозу, например, начиная с субоптимальной дозы и постепенно модифицируя дозу для определения оптимальной или применимой дозы. Альтернативно, чтобы определить подходящую дозу для лечения/профилактики, используют данные из анализов клеточной культуры или исследования на животных, где подходящая доза находится в пределах диапазона циркулирующих концентраций, которые включают ED50 активного соединения с незначительной токсичностью или без нее. Доза может варьироваться в пределах данного диапазона в зависимости от используемой лекарственной формы и используемого способа введения. Терапевтически/профилактически эффективную дозу можно оценить первоначально из анализа клеточной культуры. Доза может быть составлена на животных моделях для достижения диапазона концентрации циркулирующей плазмы, который включает IC50 (то есть концентрацию или количество соединения, при котором достигается полумаксимальное ингибирование симптомов), как определено в культуре клеток. Такая информация может использоваться для более точного определения применимых доз у людей. Уровни в плазме могут измеряться, например, с помощью высокоэффективной жидкостной хроматографии.
В некоторых примерах способ по настоящему изобретению включает введение профилактически или терапевтически эффективного количества белка, описанного в настоящем изобретении.
Термин «терапевтически эффективное количество» представляет собой количество, которое, при введении субъекту, нуждающемуся в лечении, улучшает прогноз и/или состояние субъекта и/или уменьшает или ингибирует один или более симптомов клинического состояния, описанных в настоящем изобретении, до уровня, который ниже данного наблюдаемого и принимается как клинически диагностический или клинически характерный для данного состояния. Количество, которое вводится субъекту, будет зависеть от конкретных характеристик состояния, подлежащего лечению, типа и стадии лечения, способа введения и характеристик субъекта, таких как общее состояние здоровья, другие заболевания, возраст, пол, генотип и масса тела. Специалист в данной области техники сможет определить соответствующие дозы в зависимости от данных и других факторов. Соответственно, данный термин не следует истолковывать таким образом, чтобы ограничить настоящее изобретение конкретным количеством, например массой или количеством белка(ов), скорее, настоящее изобретение охватывает любое количество CD131-связывающего белка(ов), достаточное для достижения заявленного результата у субъекта.
Используемый в настоящем изобретении термин «профилактически эффективное количество» следует понимать как количество белка, достаточное для предотвращения или ингибирования или задержки начала одного или нескольких обнаруживаемых симптомов клинического состояния. Специалисту в данной области техники должно быть известно, что такое количество будет варьировать в зависимости, например, от вводимого специфического C131-связывающего белка(ов), и/или конкретного субъекта, и/или типа или тяжести или уровня состояния, и/или предрасположенности (генетической или иным образом) к состоянию. Соответственно, данный термин не следует истолковывать таким образом, чтобы ограничить настоящее изобретение конкретным количеством, например массой или количеством CD131-связывающего белка(ов), скорее, настоящее описание охватывает любое количество C131-связывающего белка(ов), достаточное для достижения заявленного результата у субъекта.
Для in vivo введения CD131-связывающего белка, описанного в настоящем изобретении, нормальные дозировки могут варьироваться от около 10 нг/кг до около 100 мг/кг массы тела человека или более в день. При повторных введениях в течение нескольких дней или дольше, в зависимости от тяжести заболевания или расстройства, подлежащего лечению, лечение может поддерживаться до тех пор, пока не будет достигнуто желаемое подавление симптомов.
В некоторых примерах CD131-связывающий белок вводят в начальной (или загружаемой) дозе от около 1 мг/кг до около 30 мг/кг, например, от около 1 мг/кг до около 10 мг/кг, или около 1 мг/кг, или около 2 мг/кг, или 5 мг/кг. Затем CD131-связывающий белок можно вводить при более низкой поддерживающей дозе от около 0,01 мг/кг до около 2 мг/кг, например, от около 0,05 мг/кг до около 1 мг/кг, например, от около 0,1 мг/кг до около 1 мг/кг, например, около 0,1 мг/кг или 0,5 мг/кг или 1 мг/кг. Поддерживающие дозы можно вводить каждые от 7 до 30 дней, например, каждые от 10 до 15 дней, например, каждые 10 или 11, или 12, или 13, или 14, или 15 дней.
В некоторых примерах C131-связывающий белок вводят в дозе от около 0,01 мг/кг до около 50 мг/кг, например, от около 0,05 мг/кг до около 3 мг/кг, например, от около 0,1 мг/кг до около 20 мг/кг, например, от около 0,1 мг/кг до около 10 мг/кг, например от около 0,1 мг/кг до около 2 мг/кг. Например, CD131-связывающий белок вводят в дозе от около 0,01 мг/кг до около 5 мг/кг, например от около 0,1 мг/кг до около 2 мг/кг, например около 0,2 мг/кг, или 0,3 мг/кг, или 0,5 мг/кг, или 1 мг/кг, или 1,5 мг/кг (например, без более высокой нагрузочной дозы или более низкой поддерживающей дозы). В некоторых примерах вводят многочисленные дозы, например, каждые от 7 до 30 дней, например, каждые от 10 до 22 дней, например, каждые от 10 до 15 дней, например, каждые 10, или 11, или 12, или 13, или 14, или 15, или 16, или 17, или 18, или 19, или 20, или 21, или 22 дня. Например, CD131-связывающий белок вводят каждые 7 дней или каждые 14 дней или каждые 21 день.
В некоторых примерах, во время начала терапии, млекопитающему вводят CD131-связывающий белок не более 7 последовательных дней, или 6 последовательных дней, или 5 последовательных дней, или 4 последовательных дня.
В случае млекопитающего, который неадекватно реагирует на лечение, можно вводить несколько доз в неделю. Альтернативно, или, в дополнение, можно вводить увеличивающиеся дозы.
В другом примере для млекопитающих, испытывающих побочное действие, исходную (или нагрузочную) дозу можно разделить на несколько дней в течение одной недели или в течение нескольких дней подряд.
Введение CD131-связывающего белка в соответствии со способами по настоящему изобретению может быть непрерывным или прерывистым, в зависимости, например, от физиологического состояния реципиента, является ли назначение введения терапевтическим или профилактическим, и других факторов, известных специалистам-практикам. Введение CD131-связывающего белка может быть по существу непрерывным в течение заранее выбранного периода времени или может быть в серии разнесенных доз, например, во время или после развития состояния.
Способы обнаружения CD131
Следующие способы обнаружения могут быть выполнены с CD131-связывающим белком по настоящему изобретению, например, с CD131-связывающим белком, конъюгированным с детектируемой меткой, как обсуждалось в настоящем изобретении. Обнаружение CD131 или клеток, экспрессирующих CD131, с помощью описанного в настоящем изобретении способа, применимо для диагностики или прогнозирования состояния.
Иммуноанализ представляет собой пример формата анализа для диагностики состояния у субъекта или обнаружения CD131 и клеток, экспрессирующих CD131, в образце. Настоящее изобретение рассматривает любую форму иммуноанализа, включая вестерн-блоттинг, иммуноферментный твердофазный анализ (enzyme-linked immunosorbent assay (ELISA)), иммуносорбентный анализ с флуоресценцией (fluorescence-linked immunosorbent assay (FLISA)), конкурентный анализ, радиоиммунологический анализ, латеральный иммуноанализ, проточный иммуноанализ, электрохемилюминесцентный анализ, нефелометрический анализ, анализ на основе турбидометрии и анализ на основе сортировки клеток с активируемой флуоресценцией (fluorescence activated cell sorting (FACS)).
Одной из форм подходящего иммуноанализа является, например, ELISA или FLISA.
В одной форме такой анализ включает в себя иммобилизацию CD131-связывающего белка по настоящему изобретению на твердой матрице, такой как, например, полистироловая или поликарбонатная микролунка или индикаторная полоска, мембрана или стеклянная подложка (например, предметное стекло). Затем испытываемый образец вводят в непосредственный контакт с CD131-связывающим белком, и CD131 или клетки, экспрессирующие CD131, в образце связываются или захватываются. После промывки для удаления любого несвязанного белка в образце, CD131-связывающий белок, который связывается с CD131 в определенном эпитопе или связывается с другим антигеном в клетке, приводится в непосредственный контакт с захваченным CD131 или клеткой. Данный детекторный белок обычно помечен детектируемой репортерной молекулой, такой как, например, фермент (например, пероксидаза хрена (HRP), щелочная фосфатаза (AP) или β-галактозидаза) в случае ELISA или флуорофор в случае FLISA. Альтернативно, может быть использован второй меченый белок, который связывается с детекторным белком. После промывки для удаления любого несвязанного белка детектируемую репортерную молекулу обнаруживают путем добавления субстрата в случае ELISA, такого как, например, перекись водорода, ТМБ или толуидин, или 5-бром-4-хлор-3-индол-бета-D-галатотопиранозид (x-gal). Конечно, иммобилизованный (захватный) белок и белок-детектор могут использоваться противоположным образом.
Затем определяют уровень антигена в образце, используя стандартную кривую, которая была получена с использованием известных количеств маркера, или в сравнении с контрольным образцом.
Описанные выше анализы легко модифицируются для использования хемилюминесценции или электрохемилюминесценции в качестве основы для обнаружения.
Как будет очевидно специалисту в данной области техники, другие способы обнаружения, основанные на иммуносорбентном анализе, применимы при выполнении по настоящему изобретению. Например, иммуносорбентный способ, основанный на описании, приведенном выше, с использованием радиоактивной метки для обнаружения, или золотой метки (например, коллоидное золото) для обнаружения, или липосомы, например, инкапсулирующей NAD+, для обнаружения, или иммуносорбентный способ со связанным акридином.
В некоторых примерах по настоящему изобретению уровень CD131 или экспрессирующих его клеток определяют с использованием поверхностного плазмонного резонансного детектора (например, BIAcore™, GE Healthcare, Piscataway, NJ), проточного устройства, например, как описано в US7205159; микро- или нано-иммуноаналитического устройства (например, как описано в US20001016199); устройства для иммунохроматографического анализа (например, как описано в US20040228761 или US20040265926); флуоресцентного поляризационного иммуноанализа (fluorescence polarization immunoassay (FPIA), например, как описано в US 4593089 или US4751190); или иммунотурбидиметрического анализа (например, как описано в US5571728 или US6248597).
Образцы и контрольные образцы
Как будет очевидно специалисту в данной области техники, некоторые из примеров, описанных в настоящем изобретении, требуют определенной степени количественного определения для определения уровня CD131 или экспрессирующих его клеток. Такая количественная оценка может быть выполнена путем включения подходящего контрольного образца в анализ по настоящему изобретению.
В одном примере подходящим контрольным образцом является образец, который получен от здорового субъекта или нормального субъекта.
В настоящем контексте термин «здоровый субъект» следует понимать как индивидуум, который, как известно, не страдает от состояния, связанного с CD131, например, воспалительного состояния.
Термин «нормальный субъект» следует понимать как индивидуум, имеющий нормальный уровень CD131 или клетки, экспрессирующей CD131, в образце по сравнению с популяцией индивидуумов.
Настоящее изобретение также рассматривает контрольный образец как набор данных, полученный от нормального и/или здорового субъекта или популяции нормальных и/или здоровых субъектов.
В одном примере способ по настоящему изобретению дополнительно содержит определение уровня CD131 в контрольном образце, например, с использованием способа, описанного в настоящем изобретении.
В одном примере образец от субъекта и контрольный образец анализируют приблизительно или практически в одно и то же время.
В одном примере образец от субъекта и контрольного образца анализируют, используя тот же способ по настоящему изобретению, как описано в настоящем изобретении, в любом одном или более примерах, чтобы обеспечить сравнение результатов.
Наборы
Настоящее изобретение дополнительно содержит набор, содержащий одно или несколько из следующего:
(i) CD131-связывающий белок по настоящему изобретению или экспрессионная конструкция(и), кодирующая то же самое;
(ii) клетка по настоящему изобретению; или
(iii) фармацевтическая композиция по настоящему изобретению.
В другом примере настоящее изобретение обеспечивает набор, содержащий множество соединений, где взятые вместе соединения нейтрализуют передачу сигнала посредством IL-3, IL-5 и GM-CSF.
В случае набора для обнаружения CD131, такой набор может дополнительно содержать средство обнаружения, например, связанное с CD131-связывающим белком по настоящему изобретению.
В случае набора для терапевтического/профилактического использования, такой набор может дополнительно содержать фармацевтически приемлемый носитель.
Необязательно набор по настоящему изобретению упаковывается с инструкциями для применения в способе, описанном в настоящем изобретении, в соответствии с любым примером.
Настоящее изобретение включает в себя следующие неограничивающие примеры.
Неограничивающие примеры
Пример 1: Способы
Культура клеток
Клетки FreeStyle™ 293-F (FS293F) и экспрессирующий вектор млекопитающих pcDNA3.1 получали от Invitrogen. Клетки культивировали в среде GIBCO®FreeStyle™ 293 Expression Medium (Life Technologies). Все среды для культивирования тканей дополняли реагентом пенициллин/стрептомицин/фунгизон (GIBCO®, Life Technologies), и клетки поддерживали при 37°C в инкубаторах с атмосферой, содержащей 8% CO2.
Цитокины и антитела
Рекомбинантный человеческий GM-CSF, кодирующий замену P6YY для облегчения мечения радиоактивным иодом, получали из E.coli, как описано ранее (Hercus et al., Proc Natl Acad Sci USA 91: 5838-5842, 1994). Рекомбинантный человеческий IL-3, содержащий остатки 13-121 и замену W13Y для облегчения мечения радиоактивным иодом (Murphy et al., Growth Factors 28:104-110, 2010) экспрессировали и очищали из E.coli. Рекомбинантный человеческий IL-5, не содержащий носителя, был приобретен у R&D Systems (Minneapolis, MN). Цитокины (IL-3, GM-CSF) для клеточных анализов были приобретены у R&D Systems (Minneapolis, MN). Анти-человеческое IgE-антитело (специфичное к ε-цепи) было приобретено у Sigma (St. Louis, MO, USA), и IgE человеческой миеломы был приобретен у Calbiochem Darmstadt, Germany.
Получение гибридом
Пятьдесят мкг меченого гексагистидином (последовательностью из шести остатков гистидина) белка shCD131 вводили внутрибрюшинно мышам BALB/с, дефицитным по обоим βс и βIL-3 (Scott et al. Blood 96: 1588-1590, 2000). Мыши получили дополнительные 2 x4 еженедельные инъекции в той же дозе в том же месте. Гибридомы были получены, как описано ранее (Nicola et al., Blood 82:1724-1731, 1993), за исключением того, что клетки селезенки сливались с клетками миеломы Sp2/0. Отдельные гибридомы (3H3, которая была направлена против С-концевой метки HexA-His, и анти-hβc mAb 7H12 и 3F1) повторно клонировали предельным разведением. Гибридомы культивировали в среде Hybridoma SFM, дополненной 0,5-1,0% низкой IgG FCS (GIBCO®, Life Technologies) во вращающихся флаконах при 37°С.
Получение плазмид экспрессии кДНК
кДНК человеческого бета общего рецептора (CD131; GenBank, номер доступа P32927) и аминокислотные мутанты CD131 были кодон-оптимизированы для человеческой экспрессии и синтезированы Geneart® (Life Technologies), каждая с консенсусной последовательностью Козака (106) (GCCACC) непосредственно перед (по направлению транскрипции) инициирующим метионином (+1). С помощью стандартных способов мутагенеза на основе ПЦР генерировали полноразмерные трансмембранные CD131-мутанты и растворимые варианты CD131 (sCD131) (усеченные после Ser438 с C-концевыми гексагистидиновыми метками, слитыми в рамке считывания). После того, как синтез каждой кДНК был завершен, она переваривалась с NHeI и XhoI и лигировалась в pcDNA3.1 (Invitrogen, Life Technologies).
кДНК альфа-цепи рецептора человеческого интерлейкина-3 (Hu-IL3 Rα цепь; GenBank, номер доступа NP_002174), кДНК альфа-цепи гранулоцитарно-макрофагального колониестимулирующего фактора человека (GM-CSFR α цепь, GenBank, номер доступа NP_006131) и изоформа 1 альфа-цепи рецептора человеческого интерлейкина-5 (Hu-IL5R α цепь, GenBank, номер доступа NP_000555) были получены либо от Dr H. Ramshaw (Centre for Cancer Biology, Adelaide, Australia), либо от Geneart® (Life Technologies) и клонированы, как описано выше. кДНК антитела против Hu-IL5R α цепи (US6018032) была синтезирована (Geneart®, Life Technologies) на основе IgG4pK.
Рекомбинантные Fab-фрагменты антитела 9А2 и аффинно-зрелые варианты были получены клонированием полноразмерной легкой цепи и усеченной тяжелой цепи, где стоп-кодон вводили после аминокислоты 241, отдельно в pcDNA3.1, как описано выше.
Крупномасштабные препараты плазмидной ДНК получали с использованием наборов QIAGEN Plasmid Maxi или Giga Kits в соответствии с инструкциями производителя. Нуклеотидные последовательности всех плазмидных конструкций подтверждали секвенированием обеих нитей с использованием BigDye™ Terminator Version 3.1 Ready Reaction Cycle Sequencing и Applied Biosystems 3130xl Genetic Analyzer.
Временные трансфекции для получения рекомбинантных белков
Временные трансфекции экспрессионных плазмид с использованием клеток FS293F проводили с использованием трансфекционного реагента 293fectin (Invitrogen, Life Technologies) в соответствии с инструкциями производителя либо в Cellbag 2L (GE Healthcare Life Sciences) в 2/10 волновой биореакторной системе 2/10 (2/10 Wave Bioreactor system 2/10, GE Healthcare), либо в 50 мл биореакторных трубах (Bioreactor tubes, Sartorius) в течение 6 дней при 37°C в инкубаторах с атмосферой 8% CO2. Культуры дополняли через 4 часа после трансфекции добавлением Pluron ICF68 (Gibco, Life Technologies) до конечной концентрации 0,1% об./об. и через 24 часа после трансфекции добавлением LucraTone Lupine (Millipore) до конечной концентрации 0,5% об./об. Супернатанты клеточной культуры собирали центрифугированием при 2500 об/мин и пропускали через фильтр с диаметром пор 0,45 мкм (Nalgene) перед очисткой.
Очистка антител
Все моноклональные антитела и рекомбинантные Fab-фрагменты очищали аффинности с использованием хроматографических смол HiTrap MabSelect Sure или KappaSelect (1 мл, GE Healthcare Life Sciences), соответственно, а затем обессоливали на колонке HiPrep™ 26/10 Desalting column (GE Healthcare Life Sciences) на высокопроизводительной хроматографической системе ÄKTAxpress (GE Healthcare Life Sciences). Fab-фрагменты получали перевариванием очищенных антител с использованием иммобилизованной папаин-агарозы (Sigma, St. Louis, Missouri) и очищали с использованием хроматографии на основе белка А и эксклюзионной хроматографии. Отфильтрованную среду для культивирования клеток (500 мл) наносили на колонку, которая была уравновешена буфером 1 X MTPBS, со скоростью 1 мл/мин и последовательно промывали 1 х MTPBS, pH 7,3 (10 мл) и 10 мМ Трис, 150 мМ NaCl pH 7,2 (80 мл) в присутствии 0,5 М аргинина для облегчения удаления эндотоксина. Связанное антитело затем элюировали 8 мл 0,1 М NaAcetate pH 3,0 (или 0,1 М глицина pH 2,5) и сразу же наносили на колонку для обессоливания. Белковые фракции объединяли и концентрировали, используя центрифужное устройство Amicon UltraCel 50K (Millipore) перед стерильной фильтрацией с использованием фильтров с диаметром пор 0,22 мкм. Чистоту антител оценивали с помощью SDS-PAGE и белка, визуализированного с использованием краски PlustOne™ Coomassie™ Blue PhastGel™ R-350 Stain, согласно инструкциям производителя, и концентрации антител определяли хроматографически в сравнении с контрольными стандартами антител.
Очистка белков с гистидиновой меткой
Растворимые мутанты CD131 (sCD131) и sCD131 очищали с помощью тандема никель-хроматографии и эксклюзионной хроматографии на системе очистки AKTATM express (GE Healthcare Life Sciences). Колоночную хроматографию проводили в соответствии с инструкциями производителя. Образцы после элюции наносили непосредственно на колонку Superdex 200 pg 26/60 (GE Healthcare Life Sciences) со скоростью 4 мл/мин в PBS и собирали фракции. Пиковые фракции, содержащие фракции sCD131, объединяли после дополнительного анализа исключения по размеру и стерильно фильтровали для последующего тестирования.
Получение антител
Фагмидную FAB-библиотеку скринировали на фагмиды, которые связывали рекомбинантный внеклеточный домен человеческого рецептора βc (CD131), слитого с Fc-областью человеческого IgG1 (CD131-Fc, Apollo Cytokine Research), иммобилизованной на Dynabeads® М-280 Streptavidin (Invitrogen Life Технологии), с помощью меченного биотином «антитела захвата» против Fc-области человека (Jackson ImmunoResearch Laboratories). Отбор проводили, следуя описанным ранее способам (Hoet et al., Nat Biotechnol 23: 344-348, 2005). Перед отбором находили и исключали фаговые клоны, способные к неспецифическому связыванию либо со стрептавидином, либо с Fc, посредством 5 последовательных инкубаций со смесью стрептавидиновых гранул в соотношении 1:1 per se (самих по себе) или покрытых неревалентным человеческим IgG-антителом, с помощью меченного биотином «антитела захвата» против Fc-области человека. Три раунда отбора выполняли, инкубируя обедненные фаговые клоны с уменьшающимися концентрациями иммобилизованного CD131-Fc (15 мкг, 10 мкг и 5 мкг) в 2% молоке/PBST (MTPBS, 0,1% Твин-20) в течение 20 минут при комнатной температуре и затем промывали 12 раз. Отобранные фаговые клоны амплифицировали в логарифмической фазе клеток E. coli TG1 и «спасали» Fab-фагмиду путем суперинфекции с помощью вспомогательного фага M13K07 перед очисткой с использованием стандартных протоколов (Barbas et al., Proc Natl Acad Sci USA 88:7978-7982, 1991). Отдельные клоны собирали после второго и третьего раундов отбора, и кассеты Fab и легкие цепи амплифицировали с помощью ПЦР и последовательно секвенировали, как описано (Hoet et al., выше). Фаговый конкурентный анализ ELISA использовали для скрининга на высокоаффинные клоны. Селекцию уникальных клонов антител переформатировали для экспрессии полноразмерных IgG4-антител с мутацией в шарнирной области серин 241-пролин (Angal et al., Mol Immunol 30:105-108, 1993) и с легкой цепью каппа (называемой IgG4pK) путем клонирования всей легкой цепи (вариабельных и константных доменов) и вариабельного домена тяжелой цепи из выбранных Fab-конструкций, полученных из фага, в вектор pRhG4 (Jostock et al., Immunol Methods 289:65-80, 2004).
Созревание аффинности клона 9А2
Созревание аффинности клона 9А2 было достигнуто рандомизацией последовательностей CDR с праймерами, которая включала комбинацию из 19 аминокислот (без цистеина) (SEQ ID NO: 149-162). Семь различных библиотек было построено с использованием способов, описанных ранее (Sidhu et al., Methods Enzymol 328:333-363, 2000)) с использованием вариантов «стоп-матрицы (stop template)» pTac-geneIII-9A2 Fab, где для каждой фагмиды была создана стоп-матрица зародышевой линии (GeneArt®, Life Technologies) замещением 18 кодонов (6 аминокислотных остатков) во всех CDR стоп-кодонами TAA (SEQ ID NO: 163-176). Аминокислоты в последовательностях CDR были пронумерованы согласно Кабат (1991, как обсуждалось в настоящем изобретении). Каждая стоп-матрица использовалась в качестве матрицы для мутагенеза по Кункелю (Kunkel et al., Methods Enzymol 154: 367-382, 1997) с мутагенными олигонуклеотидами, описанными в дополнительной таблице 5. Продукты реакции мутагенеза были электропорированы в E.coli SS320, затем продуцирование фагов инициировали с добавлением вспомогательного фага M13-KO7 перед инкубацией при 30°C в течение 18 часов. Фаги очищали с использованием стандартных протоколов (Barbas et al., выше). Эффективность мутагенеза варьировалась от 27% до 100%, как оценивалось секвенированием 12 клонов, выбранных случайным образом из каждой библиотеки. Праймер 3254 (5' GGTTCTGGCAAATATTCTG 3', SEQ ID NO: 199) использовали для последовательности клонов из библиотек L1, L3.1 и L3.2, и праймер SeqCL (5' ATGCGTGCGAAGTGACCCATCAGG 3', SEQ ID NO: 200) использовали для последовательности клонов из библиотек H1.1, H2.1, H3.1 и Н3.2. Каждая библиотека содержала от 4 × 109 до 1,05 × 1010 отдельных клонов.
Библиотеки подвергали пяти раундам отбора в растворе с иммобилизованным CD131-Fc, где концентрацию уменьшали в 10 раз с каждым раундом, от 100 нМ до 10 пкМ в пятом раунде для всех библиотек, за исключением H3.1, где концентрацию уменьшали в 10 раз от 100 нМ до 10 нМ во 2-м раунде и поддерживали константной при 10 нМ во всех последовательных отборочных раундах. Аффинно-зрелый фаг выделяли из библиотек по существу, как описано выше для генерации антител. Уникальные фаговые клоны идентифицировали путем секвенирования 20 случайно выбранных клонов из каждой библиотеки с использованием праймеров 3254 (для клонов легкой цепи) и SeqCL (для клонов тяжелых цепей) и консенсусной последовательности. Уникальные варианты были переформатированы в полноразмерные человеческие антитела IgG4/Kappa, как описано выше.
Варианты 9А2-VR24 и 9А2-VR39 были выбраны для дополнительного созревания аффинности. Библиотеки были основаны на аминокислотных последовательностях 9А2-VR24 и 9А2-VR39. Стоп-матрицы, полученные GeneArt®(Life Technologies), перечислены выше и библиотеки построены с использованием способов, описанных выше, с вышеприведенными мутагенными олигонуклеотидами. Эффективность мутагенеза составляла от 50% до 90%, как было определено путем секвенирования 12 клонов, выбранных случайным образом из каждой библиотеки. Каждая библиотека содержала от 0,25 × 109 до 2,5 × 109 отдельных клонов. Библиотеки подвергали четырем раундам отбора в растворе с уменьшением концентрации иммобилизованного CD131-Fc, используя способы, как описано выше. Концентрацию мишени уменьшали в 10 раз с каждым раундом, от 100 пкМ до 1 пкМ в 4 раунде.
После 4-го раунда селекции шарики с 1 пкМ результирующего фага и соответствующий чистый образец промывали, как описано выше, и ресуспендировали в PBS. Затем его элюировали 50 мМ DTT (Dithiothreitol), затем нейтрализовали или инкубировали при комнатной температуре в течение 1 часа в присутствии избытка иммобилизованного CD131-Fc (1 нМ) для выбора вариантов с улучшенными off-rates, с последующим промыванием, элюированием и нейтрализацией, как описано выше. Уникальные варианты из каждой библиотеки идентифицировали путем секвенирования с использованием праймера SeqCL и переформатировали в полностью человеческие IgG4/каппа-антитела, как описано выше.
ELISA
Клоны фагмида-Fab тестировали на связывание мишени с помощью ELISA. Очищенный белок CD131-Fc или нерелевантное человеческое IgG-антитело наносили при 2 мкг/мл в MTPBS; рН 7,3 на 96-луночные планшеты Maxisorp ELISA и оставляли в течение ночи при 4°C. Планшеты блокировали в течение 2 часов при 37°C с 200 мкл/лунку 5% обезжиренного молока/PBST, дважды промывали PBST перед инкубацией с супернатантом фага (100 мкл/лунка) в течение 90 минут при комнатной температуре. Планшеты промывали x 5 PBST перед инкубацией с антителом против M13-HRP (GE Healthcare), разведенным 1: 10 000 в PBST. Плиты промывали х 6 с PBST и получали сигнал с использованием 100 мкл субстрата TMB/E (Chemicon International, Inc). Реакцию останавливали 2 М фосфорной кислотой (50 мкл/лунка) и измеряли при 450 нМ. Для определения приблизительных аффинностей связывания фагмидных клонов с белком CD131-Fc проводили конкурентные анализы ELISA. Супернатант фага разбавляли 2% обезжиренным молоком/PBST, чтобы получить значение оптической плотности при 450 нМ, равное 1,5, от экстраполяции результатов ELISA по титрованию фагов. Перед добавлением 50 мкл/лунку соответствующего разбавленного супернатанта фага, в каждую лунку добавляли равный объем конкурирующего белка CD131-Fc при начальной концентрации 2,5 мкМ и затем разбавляли 4 раза в 2% обезжиренном молоке/PBST.
Определение аффинности связывания
Кинетики связывания измеряли с помощью SPR с BIAcore™ A-100 (GE Healthcare Life Sciences). Анти-C-концевое антитело HexA-His (3H3) иммобилизовали на пятнах 1, 2, 4 и 5 каждой проточной ячейки сенсорного чипа CM-5 (GE Healthcare Life Sciences) с использованием химической реакции сочетания с аминами (116). Антитело 3H3 инъецировали в течение 7 минут при концентрации 30 мкг/мл в 10 мМ CH3COONa, pH 5,0, что обычно приводило к уровню иммобилизации от 13000 до 15000 единиц ответа (RU). Поскольку shβc является димером, кинетические анализы выполнялись с shβc, зафиксированным на поверхности датчика, и очищенный Fab вводили в качестве аналита. Эффектов авидности избегали при использовании Fab, а не цельного IgG.
shCD131 фиксировали на пятнах 1 и 5 каждой проточной ячейки в течение 2 минут при концентрации 0, 4 мкг/мл. Для анализа 9А2 очищенный Fab инъецировали через каждую проточную ячейку в течение 2 минут, и диссоциацию контролировали дополнительно 5 минут. Для некоторых анализов очищенный Fab инъецировали через каждую проточную ячейку в течение 3 минут, и диссоциацию контролировали дополнительно 10 минут. Регенерацию поверхности проводили после каждого цикла с 40-секундной инъекцией 25 мМ глицина, рН 2,0. Анализ проводили с Fab в нескольких концентрациях от 100 до 0,31 нМ, причем каждая концентрацию анализировали дважды и в случайном порядке. Анализ проводили при скорости потока 30 мкл/мин в буфере HBS-EP (10 мМ Hepes, 150 мМ NaCl, 3 мМ EDTA, 0,005% Твин 20, pH 7,4) при 37°C. Ответы от пятен 2 и 4 каждой проточной ячейки (в которой shβc не был захвачен, но в остальном обрабатывался одинаково), были вычтены из значений пятен 1 и 5, соответственно, для получения референсных, полученных вычитанием данных. Полученные для сравнения вычитаемые ответы от контрольной инъекции, содержащей только один буфер, вычитались из полученных сенсорграмм для получения дважды референсных данных, подходящих для кинетического анализа. Сенсограммы с дважды референсными данными аппроксимировали с использованием нелинейной регрессии к модели, описывающей кинетику 1:1, включая член, позволяющий учитывать ограничения по массопереносу. Значение Rmax аппроксимировали локально, чтобы учитывать небольшие отклонения в уровне захваченного sCD131, со скоростью ассоциации (ka), скоростью диссоциации (kd) и константой равновесной диссоциации (KD), аппроксимированной глобально.
Картирование эпитопов
Картирование эпитопа shCD131 осуществляли измерением аффинности Fab для различных аланиновых точечных мутантов shCD131, по существу, как описано выше, со следующими исключениями. Каждый мутант shCD131 захватывали в течение 120 секунд при концентрациях от 1 до 5 мкг/мл. Для кинетического анализа очищенные рекомбинантные Fab вводили в течение 2 минут, а диссоциацию контролировали в течение дополнительных 2 минут. Для стационарного анализа аффинности Fab вводили в течение 2 или 3 минут, и диссоциацию контролировали в течение 60 секунд. Концентрации Fab составляли от 16 мкМ до 3,9 нМ в двухкратных разведениях. Анализы проводили при 25°C. Из всех сенсорграмм вычитали контрольные значения, как описано выше. Для определения стационарной аффинности (только KD), ответ в конце фазы связывания был использован для подгонки данных к модели с моносайтовым связыванием. Кинетические параметры определяли, как описано выше. Кинетики двух контрольных Fab (7H12 и 3F1) с эпитопами, отличными от 9А2, также определялись для каждого точечного мутанта, чтобы установить, вызвала ли мутация структурные возмущения у shCD131. 7H12 и 3F1 связывают эпитопы в доменах 4 и 3 hβc, соответственно (данные не показаны).
Кристаллизация комплекса Fab
Fab-комплекс очищали из смеси мономерных компонентов с помощью эксклюзионной хроматографии. Все опыты по кристаллизации комплекса проводили при 18°С с использованием коммерчески доступных автоматизированных систем для кристаллизации белка с белком в концентрации 6 мг/мл. Опыты по кристаллизации осуществляли с использованием устройства для манипуляции с жидкостями Art Robbins liquid handler (Gryphon) в 96-луночном формате сидячей капли. Прямоугольные пластинчатые кристаллы появлялись в период времени от 2 до 3 дней в 40% PEG 200 и 100 мМ Tris pH 8,5 из набора PEGs Suite (Qiagen 130904). Кристаллы оптимизировали способом паровой диффузии (висячей капли).
Для оптимизации дифракции кристаллов использовались несколько способов предварительной кристаллизации и посткристаллизации. Обработка кристаллов с от 0,3% до 1% глютаральдегида (Sigma-Aldrich 111-30-8) в течение от 15 мин до 1 ч улучшила дифракцию от 8 Å до 4 Å. После скрининга нескольких кристаллов три частичных набора данных были объединены для получения полного набора данных с разрешением 3,9 Å.
Определение структуры комплекса Fab
Сбор данных проводился с 20% аттенюированным лучом. Кристаллы принадлежали к пространственной группе С2 с размерами элементарной ячейки а = 99,95, b = 71,28, c = 221,23. Данные были масштабированы и обработаны с использованием XDS (Kabsch W. Xds. Acta crystallographica Section D, Biological crystallography 2010; 66:125-32) и Aimless (Evans PR, Murshudov GN. How good are my data and what is the resolution? Acta crystallographica Section D, Biological crystallography 2013; 69:1204-14), и замена молекул была проведена с использованием Phaser (CCP4 suite) (McCoy AJ, Grosse-Kunstleve RW, Adams PD, Winn MD, Storoni LC, Read RJ. Phaser crystallographic software. Journal of applied crystallography 2007; 40:658-74). Структура внеклеточной части CD131 (PDB 2GYS) была модифицирована до частичного димера CD131, состоящего только из доменов D4 и D1 и использовалась в качестве поисковой модели для обнаружения молекулы CD131. Молекулу Fab располагали с использованием PDB 3HI5 в качестве модели поиска (сходство последовательностей ~ 84% для тяжелой цепи 9А2-VR24.29) после удаления петель CDR. Один раствор, содержащий частичный CD131-димер (включающий домены D1 и D2 из мономера А и домены D3 и D4 от мономера В), и одна молекула Fab, содержащая тяжелую (H) и легкую (L) цепи, был получен с Rwork/Rfree 0,38/0,45 после первого раунда очистки твердого тела. Первоначальная электронная плотность была наиболее ясной для молекулы Fab и доменов D4 и D1 из CD131, тогда как плотность для CD131-доменов D2 и D3 была самой слабой. Начальная модель Fab была улучшена за счет итерационных циклов построения модели в программе Coot и уточнения модели с использованием программы Phenix.
Хотя карты электронной плотности для доменов D4 и D1 из CD131 и вариабельных доменов цепей H и L из Fab были непрерывными, электронная плотность не наблюдалась для частей D2 и D3 в CD131 и частей константных доменов цепей H и L из Fab даже в конце уточнения. Структура была усовершенствована до конечной Rwork/Rfree 0,30/0,34. Структура была подтверждена с использованием Molprobity.
Тестирование связывания рецептора клеточной поверхности
Цитокины и антитела были помечены радиоактивным иодом с использованием Pierce Pre-Coated Iodination tubes (Thermo Scientific) в соответствии с инструкциями производителя. Связывание MAb с клетками, экспрессирующими hβc, определяли инкубацией от 1 до 2 × 106 клеток с помеченным радиоактивным иодом mAb в определенном диапазоне концентраций при 23°C в течение от 1 до 2 часов при осторожном перемешивании. Затем суспензии клеток центрифугировали через сыворотку плода теленка (FCS) и радиоактивность, связанную с клеточными осадками, оценивали подсчетом в счетчике Wizard2 2470 Automatic Gamma Counter (Perkin Elmer, Rowville, VIC, Australia). Неспецифическое связывание оценивали для каждого меченого радиоактивным иодом mAb в присутствии по меньшей мере 500-кратного избытка немеченого mAb. Константы диссоциации и число рецепторов были рассчитаны с использованием программ EBDA и LIGAND (117) (KELL Radlig, Biosoft, Cambridge, UK). Анализы конкурентного связывания выполнялись, как описано ранее (41). Вкратце, от 1 до 2 × 106 клеток инкубировали с mAb или цитокином-конкурентом в определенном диапазоне концентраций при 4 °C в течение 45 минут при осторожном перемешивании. Затем добавляли меченый радиоактивным иодом цитокин или mAb, и смесь инкубировали при 23°C в течение дополнительных от 1 до 2 часов с осторожным перемешиванием. Затем суспензии клеток центрифугировали через FCS, и радиоактивность, связанную с клеточными осадками, оценивали подсчетом.
Анализы TF-1-пролиферации
Клетки TF-1 поддерживали в средах RPMI с 10% FCS, 1 x глутамином, 1 x пенициллином/стрептомицином и 2 нг/мл hGM-CSF (R&D Systems) при 37°C и 5% CO2. Клетки истощали в отношении фактора роста в течение 18 часов, помещали в 96-луночные плоскодонные планшеты с плотностью 1 × 104 клеток/лунку, затем обрабатывали испытываемыми антителами в течение 30 минут до добавления IL-3 (R&D Systems), IL-5 (R&D Systems) или GM-CSF. Клетки инкубировали при 37°C и 5% CO2 в течение 72 часов и пульсировали с 3[H]-тимидином в течение последних 6 часов перед сбором на стеклянные фильтры. Включение 3[H]-тимидина определяли жидкостно-сцинтилляционным счетом с помощью β-счетчика Beckman.
Анализы клеточной сигнализации
Анализ GeneBLAzer® TF-1 bla pStat5
Клетки TF-1 bla (Invitrogen) культивировали в RPMI с 10% FCS, 0,1 мМ несущественных аминокислот (Non-Essential Amino Acids (NEAA)), 1 мМ пирувата натрия, пен/стрепт, бластицидином (Invitrogen, Life Technologies) (5 мкг/мл) и hGM-CSF (2 нг/мл). Перед анализом клетки промывали 3 раза PBS 0,1% FCS для удаления фактора роста, затем ресуспендировали в аналитической среде (Opti-MEM с 0,5% FCS, 0,1 мМ NEAA, 1 мМ пирувата натрия, пен/стрепт) и инкубировали при 37°C и 5% CO2 в течение 18 часов. Клетки высевали в аналитической среде с плотностью 1,2 × 105 клеток на лунку в 96-луночных планшетах с плоским, прозрачным дном и черными стенками, затем обрабатывали испытываемыми антителами в течение 30 минут до добавления IL-3 (R&D Systems) или GM-CSF (R&D Systems). Клетки инкубировали при 37°C и 5% CO2 в течение 5 часов, после чего добавляли за 2,5 часа до считывания (Invision, Perkin Elmer) субстрат FRET B/G (Invitrogen, Life Technologies).
Внутриклеточное окрашивание pSTAT5
Трансфицированные или нетрансфицированные клетки FS293F высевали в 96-луночные круглодонные планшеты с плотностью 5 × 105 клеток/лунку, затем обрабатывали IL-3 (R&D Systems), IL-5 (R&D Systems) или GM-CSF (R&D Systems). Клетки инкубировали при 37°C и 5% CO2 в течение 20 минут, затем удаляли супернатант и клетки фиксировали в 2% формальдегиде при 37°C и 5% CO2 в течение 10 минут. Клетки промывали x 2 холодным PBS, 0,1% BSA, затем пропитывали 90% ледяным метанолом в течение 20 мин. Клетки промывали, как изложено выше, инкубировали с анти-фосфо-STAT5-PE-антителами (BD Biosciences) в течение 1 часа при комнатной температуре. Клетки снова промывали, снова суспендировали в 200 мкл PBS, 0,1% BSA и анализировали с помощью проточной цитометрии.
Анализы по активации первичных человеческих клеток
Выделение нейтрофилов, эозинофилов, базофилов, pDC и тучных клеток.
Нейтрофилы, эозинофилы, базофилы были выделены из светлых слоев лейкоцитов от здоровых доноров (Australian Red Cross Blood Service (ARCBS), Melbourne, Victoria and Adelaide, South Australia). Мононуклеарные клетки периферической крови (РВМС) отделяли от гранулоцитов и красных кровяных клеток центрифугированием в градиентах плотности Ficoll-Paque™ PLUS (GE Healthcare Life Sciences). Нейтрофилы отделяли от осадков красных кровяных клеток седиментацией в декстране. Нейтрофилы промывали холодным PBS, и красные кровяные клетки лизировали гипотоническим шоком. Осадки красных кровяных клеток, содержащие гранулоциты, лизировали раствором хлорида аммония (Stem Cell Technologies), и эозинофилы выделяли с использованием MACS® Eosinophil Isolation Kit (Miltenyi Biotec). Базофилы и pDC были выделены из фракции PBMC с использованием комплектов для выделения MACS® Basophil или pDC Isolation Kits (Miltenyi Biotec). HCMC были получены из фракции CD34+ клеток-предшественников, выделенной из фракции PBMC, с использованием MACS® CD34 Microbeads (Miltenyi Biotec). Выделенные CD34+ клетки переносили в 6-луночные планшеты с плотностью 5 × 106 клеток/мл в IMDM, дополненной 1% инсулин-трансферрин-селеном, 5 × 10-5 М 2-меркаптоэтанолом, 1% пенициллином-стрептомицином, 0,1% BSA, 100 нг/мл rhSCF, 50 нг/мл rhIL-6 и 5 нг/мл rhIL-3, и помещали в инкубатор CO2 при 37°С. Среду, дополненную цитокинами, заменяли еженедельно в течение 10 недель, после чего достигали > 95% чистоты тучных клеток. rhIL-3 был исключен из культуральной среды после первых 2 недель культивирования, и, начиная с 6-й недели, в культуральную среду добавляли 10% FCS.
Анализы на базофилах
Для обнаружения высвобождения IL-8 из базофилов выделенные базофилы высевали с плотностью 1 × 105/лунку в 96-луночные круглодонные планшеты, затем добавляли испытываемые антитела за 30 минут до добавления IL-3 (R&D Systems). Клетки инкубировали при 37°C и 5% CO2 в течение 18 часов, и бесклеточные супернатанты собирали и анализировали на IL-8 с помощью ELISA (системы R&D).
Анализы на эозинофилах.
Очищенные эозинофилы высевали с плотностью 1 × 105 клеток/лунку в 96-луночные круглодонные планшеты, затем добавляли испытываемые антитела за 30 минут до добавления IL-5 (R&D Systems). Клетки инкубировали при 37°C и 5% CO2 в течение 2 часов, фиксировали 2% формальдегидом в течение 20 минут и анализировали на изменение прямого рассеяния с помощью проточной цитометрии.
Очищенные эозинофилы высевали в количестве 1 × 104/лунку в 96-луночные плоскодонные планшеты, затем добавляли испытываемые антитела за 30 минут до добавления IL-5 (R&D Systems), IL-3 (R&D Systems) и GM-CSF (R&D Systems). Клетки инкубировали при 37°C и 5% CO2 в течение 5 дней, и количество клеток определяли с помощью набора ViaLight®Plus Cell Proliferation and Cytotoxicity BioAssay Kit (Lonza).
Анализы на нейтрофилах
Очищенные нейтрофилы высевали с плотностью 1 × 105 клеток/лунку в 96-луночные круглодонные планшеты, затем добавляли испытываемые антитела за 30 минут до добавления GM-CSF (R&D Systems). Клетки инкубировали при 37°C и 5% CO2 в течение 24 часов, фиксировали 2% формальдегидом в течение 20 минут и анализировали на изменение прямого рассеяния проточной цитометрией.
Анализы на тучных клетках
Десятинедельные культивированные HCMC, полученные из периферической крови, предварительно инкубировали с испытываемыми антителами в течение 1 ч перед добавлением IL-3 (1 нг/мл), IL-5 (10 нг/мл) или GM-CSF (1 нг/мл) для дополнительной инкубации в течение 48 ч. Человеческий миеломный IgE (0,5 мкг/мл) добавляли за 24 ч перед анти-IgE Ab-стимуляцией с помощью анти-IgE (1 мкг/мл) в присутствии IL-3 (1 нг/мл), IL-5 (10 нг/мл) или GM-CSF (1 нг/мл) в течение 18 ч, в случае TNF, или в течение 8 ч для высвобождения IL8 и IL-13. Уровни цитокинов в супернатанте измеряли с помощью ELISA. Уровни человеческого TNF-α в супернатантах клеточной культуры определяли с использованием человеческого TNF-α ELISA Ready-SET-Go! Kit (eBioscience, San Diego, CA, USA).
Анализы на образование клеточных колоний костного мозга человека
Для анализов колониеобразующих единиц (colony forming unit (CFU)), CD34+ ВМ клетки (Stem Cell Technologies) высевали в количестве 1 × 103 клеток на 35 мм блюдо в IMDM, содержащей 1% метилцеллюлозы с добавлением 30% фетальной сыворотки теленка, 1% BSA, 50 нг/мл hSCF, 10 нг/мл hGM-CSF, 10 нг/мл hIL-3 (MethoCult H4534 Classic; Stem Cell Technologies) и 10 нг/мл hIL-5 (Peprotech). Культуры инкубировали при 37°C в увлажненной атмосфере с 5% CO2 в течение от 14 до 16 дней, после чего колонии были перечислены.
Анализы на клетках носовых полипов (NP)
Свежие образцы NP были получены из хирургического центра Victoria Parade Surgical Centre (VPSC) с утверждением институциональной этики и с письменного согласия. Образцы NP разрезали на мелкие кусочки и помещали в 3 мл среды (RPMI с 10% FCS, 1 x глутамин, 1 x пенициллин/стрептомицин) на лунку в 6-луночных планшетах. Ткань инкубировали в течение 18 часов при 37°C и 5% CO2, затем суспензию единичных клеток собирали, пропуская среду, содержащую ткань и клеточный экссудат, через нейлоновый фильтр с величиной пор 70 мкм (BD Biosciences). Красные кровяные клетки лизировали, затем клетки высевали в количестве 1 × 106 клеток/лунку в 3 мл среды в 6-луночных планшетах. Клетки инкубировали в течение 6 часов при 37°C и 5% CO2 для удаления адгезивных клеток, затем неадгезивные клетки высевали в количестве от 1 до 5 × 104 клеток/лунку в 96-луночные плоскодонные планшеты в присутствии испытываемых антител или преднизолона (50 мкМ, Sigma). Культуры клеток инкубировали в течение 5 дней при 37°C и 5% CO2, затем супернатанты собирали для анализа цитокинов и хемокинов. Уровни цитокинов определяли с использованием наборов человеческих цитокинов/хемокинов Luminex (Millipore) в соответствии с инструкциями производителя. Сбор и анализ данных проводили на приборе Luminex-100 (Luminex, Texas USA) с программным обеспечением MasterPlex. Количество выживших живых клеток определяли с использованием набора ViaLight® Plus Cell Proliferation and Cytotoxicity BioAssay Kit (Lonza).
Анализы на сенсибилизацию ингаляционными аллергенами
Субъекты со стабильной, легкой атопической астмой, которые также были некурящими, без других заболеваний легких и не беременны, с исходным FEV1 ≥70% от прогнозируемого значения, были выбраны для сенсибилизации аллергенами. Исследование было одобрено факультетом наук о здоровье Макмистера/Гамильтонским научным советом по этике научных исследований в области здравоохранения (McMaster Faculty of Health Sciences/Hamilton Health Sciences Research Ethics Board), и от субъектов было получено подписанное информированное согласие. Сенсибилизацию аллергенами выполняли, как описано ранее (O’Byrne et al., Am Rev Respir Dis 136:740-751, 2987). Образцы мокроты смешивали в PBS (без DTT) для диспергирования клеток и смесь фильтровали для удаления слизи перед центрифугированием. Осадок клеток ресуспендировали в концентрации 1 × 106 клеток/мл в RPMI с 100 ед/мл пенициллина/стрептомицина и 10% FCS. Проводили центрифугирование на цитологической центрифуге Сytospin для дифференциального подсчета клеток, включая процент эозинофилов, нейтрофилов, макрофагов, лимфоцитов и бронхиальных эпителиальных клеток. Смешанную популяцию клеток инкубировали в течение 24 часов с 9А2-VR24.29 при конечной концентрации 100 мкг/мл. Результаты сравнивали с инкубацией с нерелевантным антителом контрольного изотипа при конечной концентрации 100 мкг/мл. Никаких факторов роста не было добавлено. Клетки инкубировали при 37°C в течение 24 часов в инкубаторе с увлажнением с 5% диоксидом углерода. Через 24 часа клетки удаляли из лунок, промывали и повторно суспендировали в Binding Buffer (BD Pharmingen, Cat № 556454). Клетки окрашивали вместе со специфическими маркерами клеточной линии с использованием следующих антител и изотипных контролей: анти-CD16 FITC анти-IgG1 FITC, анти-CD3 PeCy7, анти-IgG1 PeCy7, анти-CD68 APC, анти-IgG2b APC, Siglec 8-PE и анти-IgG1 PE, и жизнеспособность конкретных популяций оценивали на исходном уровне и через 24 часа после сенсибилизации аллергенами.
Анализы на ксенотрансплантате носового полипа
Модель ксенотрансплантата носового полипа человека была создана по существу, как описано у Bernstein et al., Ann Otol Rhinol Laryngol 115:65-73, 2006; Bernstein et al., Ann Otol Rhinol Laryngol 118:866-875, 2009; and Bernstein et al., Ann Otol Rhinol Laryngol 121:307-316, 2012, с использованием Rag2−/− Il2rg−/−hIL-3/GM-CSF нокаутных мышей. Использовали профилактический подход, при котором Rag2−/− Il2rg−/−hIL-3/GM-CSF нокаутным мышам имплантировали, в подкожные карманы, кусочки размером 4 мм3 неразрушенных человеческих носовых полипов (полученные от 9 разных пациентов, перенесших операцию из-за назального полипоза), которые предварительно обрабатывались в течение 1 часа с 100 мкг/мл либо 9А2-VR24.29, либо антителом контрольного изотипа. Через 1 неделю мышам вводили (интраполип.) 9А2-VR24.29 (5 мг/кг) или антитело контрольного изотипа (5 мг/кг), еженедельно в течение 4 недель, и размер полипов контролировали извне.
Получение костного мозга и клеток периферической крови для количественного определения Eo/Baso-CFU и GM-CFU из популяций клеток CD34+.
Образцы крови (80 мл) и аспираты костного мозга (5 мл) собирали от субъектов c легкой атопической астмой до и через 24 часа после сенсибилизации аллергенами. Моноядерные клетки низкой плотности (Low-density mononuclear cells (MNC)) выделяли осаждением в градиентах плотности Accuprep™ (Cedarlane, AN551). Неадгезивные мононуклеарные клетки (Non-adherent mononuclear cells (NAMNC)) ресуспендировали в среде Iscovе 2+ (модифицированная по способу Исков (Iscove) среда Дульбекко (Dulbecco) с 1% пенициллином/стрептомицином (Gibco, 15140-122) и 1% 2-меркаптоэтанолом (Sigma, M3148) и помещали в Methocult® cultures (Stemcell Technologies, 04236) в присутствии 16% фетальной бычьей сыворотки (Sigma, 13G210) и IL-5 (10 нг/мл) (R&D Systems, 205-IL-005), IL-3 (25 нг/мл) (R&D Systems, 203-IL-010), GM-CSF (10 нг/мл) (R&D Systems, 215-GM-010) или сочетании всех 3 факторов роста. Клетки NAMNC культивировали в концентрации 0,5 × 106 клеток/мл в течение 2 недель при 5% СО2, с высокой влажностью при 37°С. Количество Eо/B CFU количественно определяли на двойных планшетах с использованием микроскопа с инвертированным освещением с увеличением 40 раз и рассчитывали среднее число колониеобразующих единиц на планшет. Колонию определяли как группу эозинофилов/базофилов с минимальной плотностью в 40 клеток.
Пример 2: Результаты
Получение нейтрализующего, полностью человеческого mAb со специфичностью в отношении человеческого рецептора CD131.
Наивная (необработанная) Fab-библиотека из человеческого материала была подвергнута скринингу с использованием всей рекомбинантной внеклеточной области CD131 для облегчения идентификации фрагментов Fab, показывающих одновременный антагонизм в отношении факторов IL-3, GM-CSF и IL-5 с высокой эффективностью. Конкурентный фаговый анализ ELISA затем использовали для скрининга на клоны с наибольшей аффинностью, и уникальные клоны были выбраны и отформатированы как целые IgG4pK-антитела.
Эффективность оценивали, проводя скрининговые тесты GM-CSF-зависимой пролиферации TF-1. Было идентифицировано антитело 9А2, которое может дозозависимо ингибировать IL-3-, GM-CSF- и IL-5-индуцированную пролиферацию эритролейкозных клеток TF-1 (фигура 6, A-D). Аминокислотная последовательность вариабельных областей тяжелой и легкой цепей антитела 9А2 показана на фигуре 5. 9А2 также блокировало активность IL-3 и GM-CSF при использовании репортерного анализа STAT-5 в клетках TF-1 (фигура 7A и B). Клетки TF-1 также размножаются в ответ на IL-6, IL-4, Epo и SCF. 9А2 не ингибирует пролиферацию эритролейкозных клеток TF-1, стимулированных Epo, IL-6, IL-4 и SCF (фигура 8), демонстрируя специфичность данного антитела. 9А2 связывалось конкретно с клетками, экспрессирующими человеческий CD131, но не с клетками, экспрессирующими только альфа-цепь человеческого IL-3R, альфа-цепь человеческого GM-CSFR или альфа-цепь человеческого IL-5R (фигура 9).
Созревание аффинности антитела 9А2 приводит к 1500-кратному повышению эффективности.
9А2 представляет собой антагонист активности GM-CSF и IL-5 с IC50, равной 456 нМ (GM-CSF) в анализе пролиферации клеток TF-1 (фигура 6B).
Созревание аффинности данного антитела проводилось для идентификации вариантов с более высокими аффинностями в отношении CD131, чем у родительского 9А2, и которые способны существенно ингибировать активацию IL-3-, GM-CSF- и IL-5-опосредованных рецепторов в клинически значимых терапевтических дозах.
Семь фаговых библиотек, каждая из которых покрывает 6 аминокислотных остатков и рандомизирована для всех 19 возможных аминокислот (исключая цистеин), было создано для систематического анализа вклада каждой из 9A2 CDR (исключая CDR2 легкой цепи) в связывание антитела с CD131. Расположение каждой библиотеки показано на фигурах 5A и 5B. После нескольких раундов отбора уникальные варианты из каждой библиотеки были преобразованы в молекулы человеческого IgG4pK, экспрессированы, очищены и скринированы в анализах пролиферации TF-1. Репрезентативные варианты из всех библиотек были либо похожи, либо показали улучшение эффективности по сравнению с родительским 9А2 (таблица 3), за исключением тех, которые нацелены на CDR3 из легкой цепи родительского 9А2.
Таблица 3. Список вариантов из 1-го раунда созревания аффинности 9А2
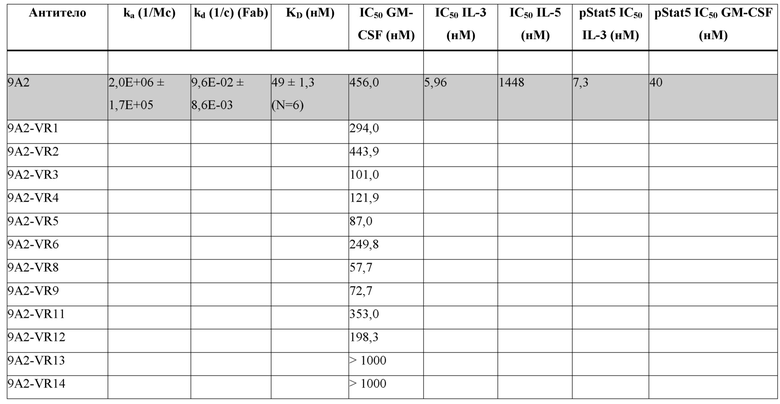
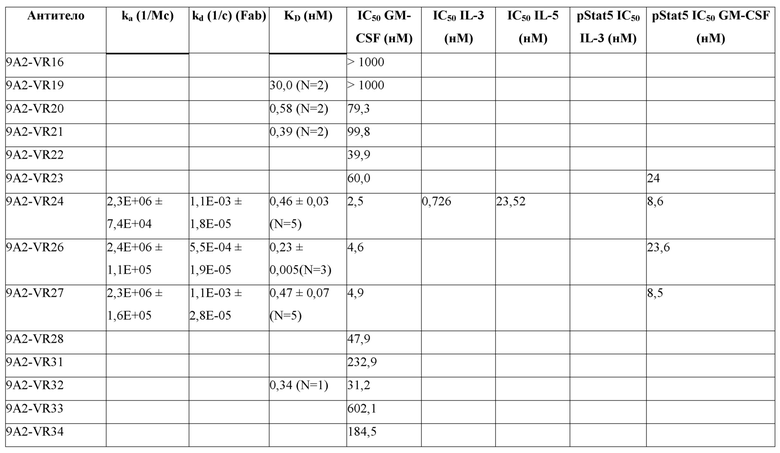
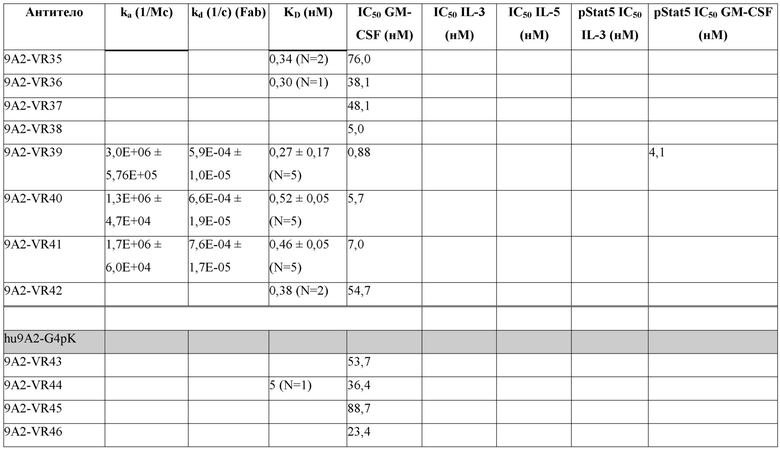
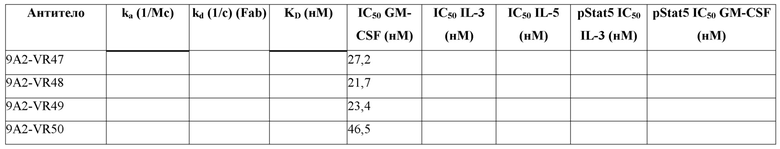
Улучшенные показатели диссоциации наблюдались для всех вариантов, которые показали повышенную аффинность (таблица 3). Увеличение специфической активности было наибольшим для клонов, полученных из библиотек CDR1 (H1.1) и CDR2 (H2.1) тяжелой цепи (фигура 6E). Вариант 9А2-VR24 происходил из библиотеки CDR1 тяжелой цепи (H1.1) и характеризовался 182-кратным увеличением специфической активности по сравнению с родительским 9А2 (таблица 3). Вариант 9А2-VR24 связывался с shCD131 с 106-кратным увеличением аффинности (KD = 0,46 нМ) по сравнению с родительским 9А2 (KD = 49 нМ) из-за 87-кратного снижения скорости диссоциации (kd) (таблица 3). SPR-анализ рекомбинантных Fab антитела 9А2 (фигура 10A) и 9А2-VR24 (фигура 10B), связывающихся с shCD131, показал, что в то время как диссоциация 9А2 происходила в течение 2 минут, 9А2-VR24 все еще оставался связанным через 5 минут. Наиболее эффективный вариант CDR2 (H2.1) (9А2-VR39) показал приблизительно 180-кратное улучшение аффинности связывания (KD = 0,27 нМ) и 518-кратное увеличение Увеличение специфической активности в случае GM-CSF по сравнению с родительским 9А2 (см. Таблицу 3 для всех протестированных вариантов).
Варианты 9А2-VR24 и 9А2-VR39 были выбраны для дополнительной оптимизации аффинности. С использованием комбинаторного подхода, была зафиксирована последовательность для 9А2-VR24 или 9А2-VR39 (фигуры 11A и 11B), и были созданы библиотеки, предназначенные для нацеливания на все остатки в CDRH2 с аминокислотной последовательностью 9А2-VR24 (VR24-H2.1 – 2.3) и на все остатки в CDRH1 и остатки 57-65 в CDRH2 с аминокислотной последовательностью 9А2-VR39 (VR39-H1.1, H2.1, H2.1, H2.3). Был добавлен дополнительный шаг отбора по десорбции («off rate»), поскольку все предыдущие улучшения эффективности коррелировали с улучшениями параметра off-rate. Уникальные варианты полученные при всех стратегиях отбора были преобразованы в молекулы IgG4pK для дополнительного анализа в анализах пролиферации TF-1. Фигура 6F показывает, что варианты с улучшенной эффективностью против GM-CSF были получены из каждой из 7 библиотек. Комбинация последовательности CDR1 из VR24 и последовательности CDR2 из VR39 не идентифицировалась как высокоэффективный ингибитор из данного второго цикла созревания аффинности. Измерения аффинности и эффективности (IC50 GM-CSF) для всех протестированных вариантов приведены в таблице 4.
Таблица 4. Список вариантов из 2-го раунда созревания аффинности (последовательности, как описано в таблице 1). Рекомбинантные Fab были получены для выбранных вариантов, и выполнялись кинетические измерения.
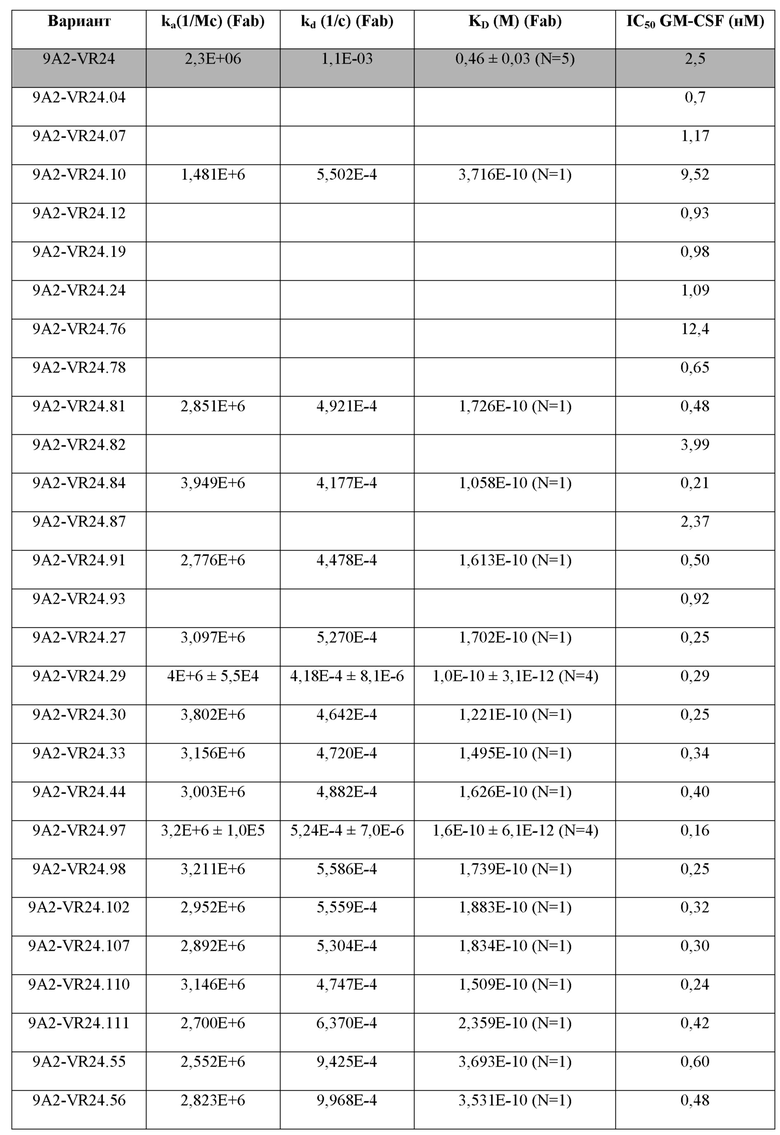
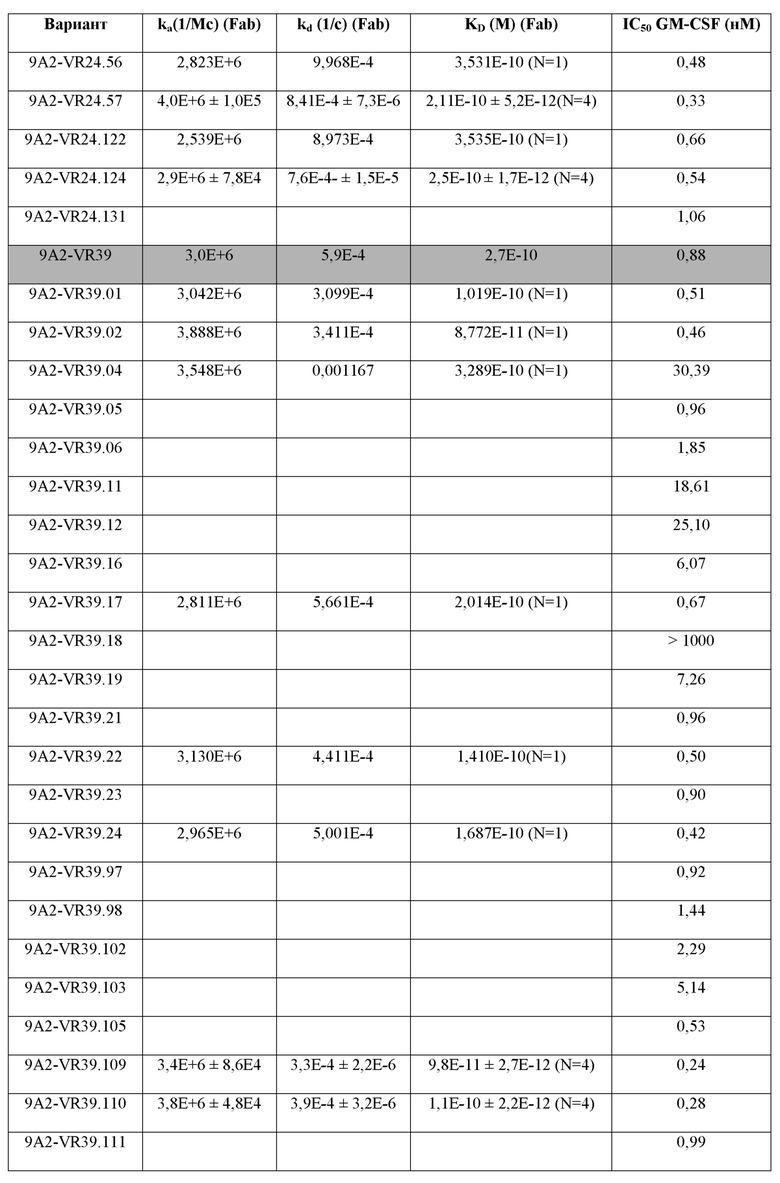
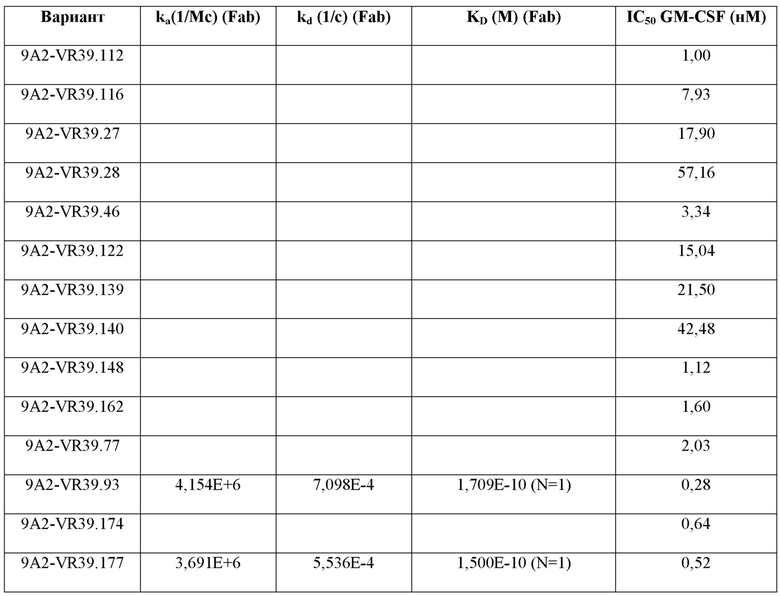
Вариант 9А2-VR24.29 был выбран для дополнительного анализа. Способность 9А2-VR24.29 ингибировать пролиферацию TF-1 клеток в ответ на IL-3, GM-CSF и IL-5 сравнивали с родительскими антителами 9А2 и 9А2-VR24 и BION-1 (Sun et al., Blood 94:1943-1951, 1999). 9А2-VR24.29 было значительно сильнее, чем оба исходных антитела и BION-1 при ингибировании пролиферации клеток TF-1 в ответ на все три относящихся к CD131-семейству цитокина, с IC50, равной 0,29 нМ, против GM-CSF (фигуры 6A-C). Данная величина означает 8, 6-кратное улучшение по сравнению с 9А2-VR24 (2,5 нМ) и 1572-кратное улучшение по сравнению с исходным антителом 9А2. Улучшения эффективности 9А2-VR24.29 по сравнению с родительским 9А2 наблюдали также для IL-3 (41-кратное, IC50 = 0,144 нМ) и IL-5 (310-кратное, IC50 = 4, 67 нМ). 9А2-VR24.29 связывался с shCD131 (K = 100 пМ) с аффинностью, которая была в 4,6 раз больше, чем у 9А2-VR24, из-за допонительного 2,6-кратного улучшения скорости диссоциации (kd) (таблица 3).
Радиоизотопное антитело 125I-9А2-VR24.29 связывалось с рецептором CD131 на нейтрофилах с KD = 246 пМ, и рекомбинантный Fab-фрагмент 9А2-VR24.29 связывался с аналогичной аффинностью, KD = 384 пM (фигура 12 A-B, фигура 13). 9А2-VR24.29IgG, связывался с человеческими эозинофилами со средним значением KD = 629 пM (фигура 12 C, фигура 13).
9А2-VR24.29 снижает выживаемость культивируемых ex vivo первичных клеток, выделенных и из дыхательной ткани людей, страдающих от заболевания дыхательных путей.
Воздействие 9А2-VR24.29, оказываемое на выживаемость миелоидных и лимфоидных клеток, выделенных из индуцированной мокроты на исходном уровне и через 24 часа после сенсибилизации ингаляционным аллергеном, было исследовано способом проточной цитометрии. Индуцированную мокроту собирали от доноров до и через 24 часа после сенсибилизации ингаляционным аллергеном. Дифференциальный подсчет клеток смешанной клеточной популяции показал, что преобладающими типами клеток были нейтрофилы и макрофаги с меньшей долей эозинофилов, лимфоцитов и бронхиальных эпителиальных клеток (фигура 14А). Клетки, полученные из мокроты, инкубировали ex vivo, в отсутствие экзогенных факторов роста, в течение 24 часов, и воздействие 9А2-VR24.29 на данные культуры сравнивали с повторными культурами, обработанными антителом контрольного изотипа. Клетки, у которых исходная жизнеспособность составляла менее 10%, были исключены из анализа. 9А2-VR24.29 вызвало значительное снижение клеточной выживаемости у эозинофилов из мокроты (значение Р = 0,0391), как было обнаружено окрашиванием аннексином V (фигура 14B). Не наблюдалось значительного влияния 9А2-VR24.29, по сравнению с антителом контрольного изотипа, на выживаемость популяций нейтрофилов, лимфоцитов или макрофагов.
В аналогичном исследовании клетки мокроты выделяли и инкубировали, как описано ранее, но в присутствии 1 нг/мл каждого из IL-3, IL-5 и GM-CSF. В данной ситуации 9А2-VR24.29 вызвало значительное снижение выживаемости как эозинофилов мокроты (6 из 8 пациентов, значение Р = 0,0078), так и нейтрофилов (6 из 8 субъектов, значение Р = 0,0391), собранных в начале исследования и через 24 часа после сенсибилизации аллергеном, как было обнаружено при окрашивании аннексином V (фигура 14С), по сравнению с антителом контрольного изотипа. Также наблюдалось незначительное снижение выживаемости базофилов (5 из 8 пациентов, значение Р = 0,3828).
Образцы периферической крови и костного мозга были получены от пациентов с бессимптомной аллергической астмой перед и после сенсибилизации аллергеном и культивировались в присутствии либо IL-3, GM-CSF или IL-5, либо сочетания всех трех цитокинов. Определяли воздействие обработки антителом 9А2-VR24.29 или антителом с контролируемым изотипом на GM- или Eo/B-CFU, возникающие из CD34+ предшественников из образцов костного мозга и крови. Обработка 9А2-VR24.29, по сравнению с антителом контрольного изотипа, значительно уменьшала количество GM-CFU в периферической крови и костном мозге, культивируемых в любых условиях (фигура 14D-G). Обработка антителом 9А2-VR24.29, по сравнению с антителом контрольного изотипа, также значительно уменьшала количество Eo/B-CFU в периферической крови и костном мозге, культивируемых в любых условиях.
Для определения уровней экспрессии воспалительных цитокинов и хемокинов использовали культуру NP воспалительных клеточных инфильтратов. Уровни воспалительных цитокинов и хемокинов, продуцируемых нестимулированными NP-клетками, оценивали по анализу Luminex (фигура 15). Наблюдали от высокого до очень высоких уровней (100 пг/мл - > 1000 пг/мл) хемокинов рекрутинга нейтрофилов, моноцитов и Т-клеток, включая GRO, IL-8, MCP-1, Fractalkine, IP-10, MCP-3 и MDC, а также факторов роста, которые опосредуют активацию данных клеток, таких как G-CSF, GM-CSF и IL-6. Кроме того, хемокины MIP-1б и MIP-1в, которые активируют нейтрофилы, эозинофилы и базофилы, присутствовали в диапазоне от 10 до 100 пг/мл, и как провоспалительные (TNFα, IFNγ, IL-1α, IFNβ), так и противовоспалительные (IL-10, IL-1RA) факторы были обнаружены при аналогичных концентрациях. Цитокины, присутствующие при низких, но обнаруживаемых концентрациях, включали цитокины Th2, такие как IL-5, цитокины Th-1/Th17 и другие, которые участвуют в выживании T-клеток и B-клеток и выживании и активации NK-клеток. Полученные данные подтверждают, что NK-клетки обеспечивают соответствующую патогенную воспалительную среду, из которой можно исследовать иммунные клетки, которые способствуют заболеванию дыхательных путей.
Для того, чтобы определить, может ли 9А2-VR24.29 непосредственно ингибировать выживаемость нестимулированных клеток из ткани больного человека, клетки культивировали в течение 5 дней ex vivo из свежевыделенной NP-ткани человека, полученной от 16 пациентов, которые прошли факультативную полиэктомию и затем контактировали с 9А2-VR24.29. В соответствии с предыдущими исследованиями, эозинофилы были преобладающим типом клеток у большинства доноров (фигура 14H). Кроме того, как определено проточной цитометрией, 9А2-VR24.29 ингибировало выживаемость нестимулированных эозинофилов, выделенных из NP-ткани через 72 часа роста в культуре (фигура 14I). 9А2-VR24.29 не оказало существенного влияния на выживаемость нейтрофилов, лимфоцитов или макрофагов.
Воздействие 9А2-VR24.29 на выживаемость культивируемых NP-воспалительных суммарных клеточных инфильтратов сравнивали с эффектом преднизолона, текущего стандарта ухода, а также отдельных антител против β-цепи (фигура 14J). Каждое испытываемое состояние выражали как процент выживаемости по сравнению с необработанным контролем для каждого донора, где необработанный контроль соответствует максимальной выживаемости (100%). Лечение преднизолоном снижало общую выживаемость клеток, со средней и медианной величинами, которые составляли 83,9% и 83,02%, соответственно. Каждое мАт против отдельной β-цепи снижало выживаемость в пределах от 82, 3% (против β-цепи GM-CSFR) до 92,3% (против β-цепи IL), сравнительно с необработанным контролем. Комбинирование mAb против всех трех β-цепей снижало выживаемость до уровня, аналогичного тому, который наблюдалось при лечении преднизолоном. В данных анализах антителу 9А2-VR24.29 удалось ингибировать выживаемость суммарного клеточного инфильтрата в аналогичной степени по сравнению с тем, что наблюдалось после лечения преднизолоном, со средней выживаемостью 79,4% и медианной величиной 74,8%, но также и у более широкого диапазона пациентов.
9А2-VR24.29 ингибирует активацию и выживаемость первичных человеческих миелоидных клеток, стимулированных IL-3, GM-CSF и IL-5.
Были выделены миелоидные клетки человека, включая нейтрофилы, базофилы, плазмоцитоидные дендритные клетки (plasmacytoid dendritic cells (pDC)), тучные клетки и человеческие CD34+ BM-клетки от нормальных доноров для проверки ингибирующей активности 9А2-VR24.29 в других первичных человеческих миелоидных клетках, которые способствуют заболеванию дыхательных путей. 9А2-VR24.29 ингибировало GM-CSF-индуцированную активацию человеческих нейтрофилов, определяемую увеличением размера клеток, измеренным проточной цитометрией дозозависимым образом (фигура 16A). IL-8, хемотаксический фактор, который привлекает преимущественно нейтрофилы, базофилы, эозинофилы и Т-клетки, секретируется человеческими базофилами в ответ на стимуляцию с IL-3. 9А2-VR24.29 было способно блокировать IL-3-индуцированную секрецию IL-8 из очищенных человеческих базофилов в зависимости от дозы (фигура 16В). DC играют решающую роль в развитии астмы и аллергии, и их уровни повышались у пациентов с астмой. Выживаемость CD11c- pDC зависит от IL-3. 9А2-VR24.29 ингибирует IL-3-опосредованную выживаемость CD11c- pDC в зависимости от дозы, как измерено с помощью анализа VialightPlus (фигура 16С).
Эозинофилы являлися доминирующими иммунными эффекторными клетками при астме и, благодаря их активации и дегрануляции, способствуют воспалению дыхательных путей. Важность эозинофилов в патогенезе астмы подтверждается снижением симптомов у пациентов, получавших антитела к IL-5 или рецептору IL-5. IL-5 является ключевым фактором дифференциации и выживаемости эозинофилов из гемопоэтических предшественников и способствует активации зрелых эозинофилов. 9А2-VR24.29 способно ингибировать IL-5-индуцированную активацию очищенных эозинофилов человеческой периферической крови, определяемую увеличением прямого рассеяния, дозозависимым образом (фигура 16D). В дополнение к IL-5, человеческие эозинофилы также реагируют на стимуляцию с GM-CSF и IL-3 (фигура 16F-H). В частности, введение рекомбинантного IL-3 или GM-CSF у людей вызывает повышение уровня циркулирующих эозинофилов. Поэтому при заболеваниях, где эозинофилия является патогенной особенностью, все три цитокина, взятые вместе, могут способствовать увеличению числа эозинофилов, опосредуя их рекрутинг из ВМ и их повышенную выживаемость в месте патологии. Анализ выживаемости эозинофилов использовали для оценки способности 9А2-VR24.29 блокировать выживаемость эозинофилов в ответ на коктейль из всех трех цитокинов (в дозах EC80). Индивидуальные антагонисты к α-цепи IL-3R, α-цепи GM-CSFR или α-цепи IL-5R также оценивались в том же анализе. Определяли эффективность каждого индивидуального антагониста рецептора в ответ на стимуляцию их соответствующим цитокином, и полное торможение наблюдалось при ~ 10 нМ для каждого антагониста (фигура 16IK). Однако, напротив, обработка эозинофилов с 9А2-VR24.29 при концентрациях до 200 нМ или 30 мкг/мл позволила полностью блокировать их выживаемость в присутствии IL-5, GM-CSF и IL-3. Подобное снижение выживаемости клеток могло быть достигнуто только отдельными антагонистами α-цепи, когда они были объединены (при EC80 для каждого цитокина) (фигура 16E). Представленные данные свидетельствуют о том, что 9А2-VR24.29 может быть более эффективным, чем антитела, нацеленные на одну мишень, для борьбы с опосредованными эозинофилами заболеваниями, такими как астма.
Тучные клетки человека обильно присутствуют в тканях слизистой оболочки, которые взаимодействуют с окружающей средой, где они могут усугублять, частично, посредством выделения TNF-α, аллергические воспалительные реакции. Ранее было показано, что IL-3 регулирует генерацию тучных клеток и некоторые функции тучных клеток in vitro и является сильным активатором высвобождения TNF-α в тучных клетках, стимулированных с IgE + анти-IgE. 9А2-VR24.29 ингибировало данный эффект IL-3 в культивируемых тучных клетках человека (HCMC) дозозависимым образом (фигура 16L). Тучные клетки также играют определенную роль в поздней фазе аллергической реакции через их IgE-зависимое высвобождение многофункциональных цитокинов, таких как IL-13, и поэтому влияют на развитие, прочность и/или устойчивость иммунных ответов, связанных с Th2-клетками. IL-3 (но не GM-CSF и IL-5) также мог потенцировать высвобождение IL-13 из IgE-стимулированных тучных клеток. 9А2-VR24.29 удалось блокировать IL-3-потенцированное высвобождение IL-13 дозозависимым образом (фигура 16M). IL-3, IL-5 и GM-CSF способны потенцировать IgE-опосредованное высвобождение IL-8 из HCMC, и данные ответы также блокировались посредством 9А2-VR24.29 (фигура 16N).
9А2-VR24.29 удалось уменьшить образование колоний человеческих CD34+ BM CFU-GM в ответ на цитокиновый коктейль, включающий SCF, GM-CSF, IL-3 и IL-5. 9А2-VR24.29 было способно дозозависимым образом ингибировать образование колоний CFU-GM до уровня, наблюдаемого при культивировании клеток в присутствии только SCF. Отдельные антагонисты, направленные против α-цепи IL-3R, α-цепи GM-CSFR или α-цепи IL-5R, также была проверены на их способность уменьшать образование колоний. Снижение образования колоний CFU-GM путем обработки с 9А2-VR24.29 было аналогичным тому, которое наблюдалось, когда человеческие CD34+ BM-клетки обрабатывались сочетанием ингибиторов всех трех альфа-цепей (фигура 16O). Полученные данные согласуются с данными, полученными в исследованиях по выживаемости эозинофилов, демонстрируя, что 9А2-VR24.29 может одновременно ингибировать действия IL-3, IL-5 и GM-CSF, когда данные цитокины добавляли вместе.
Профилактическое введение 9А2-VR24.29 уменьшает рост ксенотрансплантата носового полипа у Rag2−/− Il2rg−/−hIL-3/GM-CSF KI мышей
Поскольку 9А2-VR24.29 не является активным в отношении мышиного CD131/βIL-3 рецептора, и мышиные IL-3 или GM-CSF не являются перекрестно-реактивными в отношении человеческой IL-3Rα или GMRα, способность 9А2-VR24.29 работать в условиях in vivo была определена с использованием описанной выше модели ксенотрансплантата человеческого носового полипа (см. способы). Был использован профилактический подход, в котором Rag2−/− Il2rg−/−hIL-3/GM-CSF KI мышам имплантировали, в подкожные карманы, кусочки размером 4 мм3 неразрушенных человеческих носовых полипов (полученные от 9 разных пациентов, перенесших операцию из-за назального полипоза), которые предварительно обрабатывались в течение 1 часа с 100 мкг/мл либо 9А2-VR24.29, либо антителом контрольного изотипа. Через 1 неделю мышам вводили (интраполип.) 9А2-VR24.29 (5 мг/кг) или антитело контрольного изотипа (5 мг/кг), еженедельно в течение 4-х недель, и размер полипов контролировали извне. Через 5 недель мышей умерщвляли, и полипы взвешивали и анализировали гистологически и проточной цитометрией. Наблюдалось статистически значимое уменьшение размера для 9А2-VR24.29-обработанных полипов (фигура 17А). 9А2-VR24.29 также вызвало статистически значимое снижение веса носовых полипов в конце периода лечения, тогда как это не наблюдалось для полипов, обработанных антителом контрольного изотипа. 9А2-VR24.29 также уменьшало размер слизистой железы, накопление слизи и клеточный инфильтрат в полипы (фигуры 17В и С). Через 5 недель полипы исследовали проточной цитометрией на Т- и В-лимфоциты человека, эозинофилы, нейтрофилы и макрофаги. Статистически значимое снижение числа окрашенных тулуидиновым синим тучных клеток, эозинофилов (CD16-CD15+CD49d+Siglec8+), нейтрофилов (CD14-CD49d-CD15+CD16+), популяции B-клеток (CD45+CD19+), но не макрофагов (CD16-CD49d-CD14+CD15+) и популяции Т-клеток (т.е. CD3+CD4+ и CD3+CD8+) наблюдали в 9А2-VR24.29-обработанных носовых полипах, по сравнению с носовыми полипами, обработанными антителом контрольного изотипа (фигура 18).
9А2-VR24.29 ингибирует функцию IL-3, GM-CSF и IL-5 при связывании с остатками в сайте 2 в CD131.
Эксперименты с взаимным ингибированием проводили для оценки способности 9А2-VR24.29 конкурировать за связывание цитокинов IL-3, GM-CSF и IL-5 с клетками, экспрессирующими рецепторы для данных цитокинов. Предварительная инкубация эозинофилов человека с 9А2-VR24.29, но не с несущественным изотипным контролем IgG предотвращала связывание 125I-меченного IL-3 и уменьшала связывание 125I-меченного IL-5 на 85% (фигура 19, A, С). Предварительная инкубация человеческих нейтрофилов с 9А2-VR24.29, но не с несущественным изотипным контролем IgG полностью предотвращала связывание 125I-меченного GM-CSF (фигура 19B).
Предварительная инкубация клеток TF-1 с IL-3 и GM-CSF приводила к связыванию 125I-меченного 9А2-VR24.29 на 90% при самой высокой концентрации (фигура 19D). Предварительная инкубация с IL-5 также приводила к связыванию 9А2-VR24.29, но только на 40% (фигура 19D), что, скорее всего, является следствием относительно низкой аффинности комплекса IL-5/IL-5R по отношению к цепи CD131. Данные исследования показывают, что сайт 2 на CD131 (который является сайтом связывания цитокинов), вероятно, перекрывается с эпитопом 9А2.
Структурный анализ 9А2-VR24.29-связывающего эпитопа на CD131
Аминокислотные остатки человеческого CD131, которые связывают 9А2 и его аффинно-зрелое производное 9А2-VR24.29, определяли с использованием сайт-специфического аланинового мутагенеза. Исследования по мутагенезу и кристаллизации человеческого CD131 определили сайт 2 как интерфейс, состоящий из петель A-B и E-F домена 1 из одной цепи CD131 и петель B-C и F-G домена 4 из другой цепи CD131. Наложение третичной структуры рецептора GM-CSF (PDB 4NKQ) на комплекс CD131/9А2-VR24.29 показывает, что 9А2-VR24.29 оказывает свою ингибирующее действие на CD131 путем прямой блокады сайта связывания цитокинов (фигура 20A). Площадь поверхности, равная 933 Е2, оказывается недоступной извне, и поверхностная комплементарность интерфейса (Sc = 0,59) согласуется с высокой аффинностью связывания комплекса с KD, равной 100 пМ, как измерено с помощью SPR. Структура показывает, что большинство контактов 9А2-VR24.29 опосредуется через CDR-петли тяжелой цепи (CDR от H1 до H3) (фигура 20B), что согласуется с изменениями в данных CDR, обеспечивающими наибольшие улучшения в аффинности.
Гидрофобные и полярные контакты способствуют связыванию 9А2-VR24.29 с CD131. Карбонильные группы полипептидной цепи CDR H1 в P30 и W31 образуют полярные контакты с боковой цепью гуанидина R364 и карбонильной группой остова Q101 у CD131, соответственно. Боковая цепь Y32 в CDR H1 может связываться водородной связью с карбонильной группой остова R364 и может потенциально участвовать в р-р взаимодействии с Y365 из CD131. S53 из CDR H2 создает полярные контакты с S102 из D1 в CD131. Боковая цепь R52 образует солевой мостик с D107, и он также находится на расстоянии водородной связи от аминогруппы остова V104 на CD131, Боковая цепь Y100 из CDR Н3 в 9А2-VR24.29 образует водородные связи с остатками E366 и H367 в CD131 и образует р-р взаимодействия с Y365 на CD131. Боковая цепь D101 из CDR H3 создает полярные контакты с боковыми цепями Y39, Y421 и аминогруппой основной цепи V105 на CD131. Для сравнения, легкая цепь 9А2-VR24.29, по-видимому, играет более ограниченную роль во взаимодействии с CD131. Боковая цепь остатка W32 на CDR L1 обеспечивает полярный контакт с карбонильной группой главной цепи остатка G420 и ван-дер-ваальсов контакт с боковой цепью остатка Y421. Никакие остатки из CDR L2 не контактируют с CD131. F94 на CDR L3 находится в ван-дер-ваальсовом контакте с боковой цепью остатка T106 из D1 в CD131. В дополнение к данным контактам, ароматические боковые цепи остатков Y32 из CDR H1 и Y100 из CDR H3 смотрят внутрь сайта 2 в образуемого с CD131 интефейса и участвуют в р-р взаимодействии с боковыми цепями остатков Y365 и H367 из CD131, дополнительно стабилизируя комплекс CD131/9А2-VR24.29 (фигура 20C).
Несколько аланиновых точечных мутантов было получено для известных сайтах связывания лигандов на hCD131 и вокруг них. Несколько аланиновых точечных мутантов shCD131 было создано для известных сайтах связывания лигандов на CD131 и вокруг них. Используя SPR, измеряли аффинность очищенного рекомбинантного Fab-фрагмента антитела 9А2 в отношении связывания с данными мутантами относительно shCD131 дикого типа (WT) (таблица 5). Наиболее заметные эффекты были отмечены для мутантов F103A, Q339A и I424A, которые приводили к незначительному связыванию, и для мутации I388A, которая приводила к отсутствию связывания 9А2/9А2-VR24.29. Структурно, F103 и I338 участвуют в стабилизации боковой цепи остатка Y39, который образует важную водородную связь с боковой цепью D101 на CDR H3 (фигура 20D). Мутация данных остатков может влиять на ориентацию Y39, что, в свою очередь, влияет на связывание 9А2-VR24.29. Q399 и I424 не взаимодействуют с 9А2-VR24.29, напротив, они глубоко погружены в D1-D4-интерфейс димера, поэтому потеря связывания 9А2-VR24.29 может быть вызвана структурным воздействием на димер.
Мутация остатка Y39A из D1 в CD131 приводила к слабому связыванию 9А2 и 9А2-VR24.29, дополнительно подчеркивая важность остатка Y39 для высокоаффинного связывания. Мутация остатков Tyr365, His367 и I368 из D4 приводила к слабому связыванию. Из них, Y365 и H367 участвуют в создании важных водородных связей с D101 и Y100 на CDR H3, соответственно. Данные остатки также составляли часть сети р-р взаимодействий, содержащей Y32 и Y100 из последовательностей CDR H1 и H3, что дополнительно подчеркивает их роль во взаимодействии 9А2-VR24.29. Хотя I368 не взаимодействует непосредственно с 9А2-VR24.29, он является частью гидрофобной канавки на интерфейсе сайта 2 и может быть структурно важным для поддержания правильной ориентации окружающих ароматических боковых цепей остатков Y39, Y421, Y365 и H367. Интересно, что мутация Thr106 увеличивает аффинность приблизительно в 10 раз. Вместе это говорит о том, что эпитоп антитела 9А2 центрирован вокруг данных остатков. Расположенные на поверхности остатки Ser102, Val104 и Arg364 также образуют часть эпитопа антитела 9А2, поскольку мутации данных аминокислот уменьшали связывание 9А2 с WT shCD131 от 3 до 7 раз. Данные эксперименты повторяли, используя 9А2-VR24.29, с практически идентичными результатами (таблица 5), что указывает на то, что первоначальная характеристика эпитопа сохранялась после двух раундов созревания аффинности.
Данный сайт, с которым связываются 9А2 и 9А2-VR24.29, также удален от места связывания антитела BION-1, для связывания которого важны остатки 363, 364 и 366 (Sun et al., выше).
Таблица 5. Влияние одиночных аминокислотных замен в человеческом CD131 на связывание с Fab антитела 9А2
Терапевтическое введение 9А2-VR24.29 уменьшает рост ксенотрансплантата носового полипа в Rag2−/− Il2rg−/−hIL-3/GM-CSF KI мышах
Rag2−/− Il2rg−/−hIL-3/GM-CSF KI мышам имплантировали, в подкожные карманы, кусочки размером 4 мм3 неразрушенных человеческих носовых полипов, как описано выше. Через 1 неделю мышам вводили (внутриполип.) 9А2-VR24.29 (5 мг/кг), антитело контрольного изотипа (5 мг/кг), преднизолон (1 мг/кг) или физиологический раствор (0,9%) еженедельно в течение 4 недель и размер полипов контролировали извне. Через 5 недель мышей умерщвляли, и полипы взвешивали и анализировали гистологически и проточной цитометрией. Наблюдалось значительное уменьшение размера полипов, обработанных 9А2-VR24.29, по сравнению с полипами, обработанными антителом контрольного изотипа. Имелось значительное снижение массы полипов после обработки с 9А2-VR24.29, тогда как не было существенной разницы в массе после обработки антителом контрольного изотипа. Наблюдалось значительное уменьшение размера полипов, обработанных преднизолоном, по сравнению с полипами, обработанными носителем (0,9% солевой раствор) (фигура 21А). Наблюдалось значительное снижение массы полипов после обработки преднизолоном, в то время как не было никакой существенной разницы в массе после обработки носителем (фигура 21B).
Через 5 недель полипы исследовали проточной цитометрией на человеческие Т-лимфоциты, эозинофилы, нейтрофилы и макрофаги. Статистически значимое снижение числа популяций эозинофилов (CD16-CD15+CD49d+Siglec8+), нейтрофилов (CD14-CD49d-CD15+CD16+), макрофагов (CD16-CD49d-CD14+CD15+) и CD3+ CD4+ (но не CD3+ CD8+ и CD3+ CD4+ CD8+) Т-клеток наблюдали в полипах, обработанных 9А2-VR24.29, по сравнению с полипами, обработанными антителом контрольного изотипа. Не наблюдалось уменьшение в какой-либо из данных популяций для полипов, обработанных преднизолоном, по сравнению с полипами, обработанными носителем (фигура 21C-H). Оба 9А2-VR24.29 и преднизолон не приводили к изменениям в плазматических В-клетках (CD45+CD19+CD20+ и CD45+CD19+CD138+) (фигура 21I-J).
Оба 9А2-VR24.29 и преднизолон уменьшали число окрашенных тулуидиновым синим тучных клеток и продуцирование слизи в носовых полипах человека, хотя данный эффект был более выраженным для 9А2-VR24.29 (фигура 22А и В).
Системное введение 9А2-VR24.29 столь же эффективно, как и внутриполипное введение 9А2-VR24.29 в снижении размера и массы носовых полипов
Rag2−/− Il2rg−/−hIL-3/GM-CSF KI мышам имплантировали, в подкожные карманы, кусочки размером 4 мм3 неразрушенных человеческих носовых полипов, как описано выше. Через 1 неделю мышам вводили инъекцией (внутриполипно) 9А2-VR24.29 (5 мг/кг) или антитело контрольного изотипа (5 мг/кг), или мышам вводили инъекцией системно (внутривенно) 9А2-VR24.29 (10 мг/кг) или антитело контрольного изотипа (10 мг/кг) еженедельно в течение 4 недель, и размер полипов контролировали извне.
Через 5 недель мышей умерщвляли и полипы взвешивали. Как внутриполипные, так и системные инъекции 9А2-VR24.29 уменьшали размер (фигура 23А) и массу (фигура 23B) носовых полипов.
9А2-VR24.29 не связывает или не нейтрализует функцию IL-3, GM-CSF и IL-5 от других видов приматов
Способность 9А2-VR24.29 связывать или нейтрализовать функцию IL-3, GM-CSF и IL-5 была исследована у обезьян-резусов, бабуинов, обезьян-белок и яванских макак. Несмотря на сходство в аминокислотных последовательностях между видами 9А2-VR24.29, было невозможно связать или нейтрализовать IL-3, GM-CSF и IL-5.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> СиЭсЭл ЛИМИТЕД
<120> CD131-СВЯЗЫВАЮЩИЕ БЕЛКИ И ИХ ПРИМЕНЕНИЯ
<130> 524225
<160> 197
<170> PatentIn version 3.5
<210> 1
<211> 897
<212> PRT
<213> Homo sapiens
<400> 1
Met Val Leu Ala Gln Gly Leu Leu Ser Met Ala Leu Leu Ala Leu Cys
1 5 10 15
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
20 25 30
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
35 40 45
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
50 55 60
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
65 70 75 80
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
85 90 95
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
100 105 110
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
115 120 125
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
130 135 140
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
145 150 155 160
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
165 170 175
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
180 185 190
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
195 200 205
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
210 215 220
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
225 230 235 240
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
245 250 255
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
260 265 270
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
275 280 285
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
290 295 300
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
305 310 315 320
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
325 330 335
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
340 345 350
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
355 360 365
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
370 375 380
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
385 390 395 400
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
405 410 415
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
420 425 430
Ser Trp Asp Thr Glu Ser Val Leu Pro Met Trp Val Leu Ala Leu Ile
435 440 445
Val Ile Phe Leu Thr Ile Ala Val Leu Leu Ala Leu Arg Phe Cys Gly
450 455 460
Ile Tyr Gly Tyr Arg Leu Arg Arg Lys Trp Glu Glu Lys Ile Pro Asn
465 470 475 480
Pro Ser Lys Ser His Leu Phe Gln Asn Gly Ser Ala Glu Leu Trp Pro
485 490 495
Pro Gly Ser Met Ser Ala Phe Thr Ser Gly Ser Pro Pro His Gln Gly
500 505 510
Pro Trp Gly Ser Arg Phe Pro Glu Leu Glu Gly Val Phe Pro Val Gly
515 520 525
Phe Gly Asp Ser Glu Val Ser Pro Leu Thr Ile Glu Asp Pro Lys His
530 535 540
Val Cys Asp Pro Pro Ser Gly Pro Asp Thr Thr Pro Ala Ala Ser Asp
545 550 555 560
Leu Pro Thr Glu Gln Pro Pro Ser Pro Gln Pro Gly Pro Pro Ala Ala
565 570 575
Ser His Thr Pro Glu Lys Gln Ala Ser Ser Phe Asp Phe Asn Gly Pro
580 585 590
Tyr Leu Gly Pro Pro His Ser Arg Ser Leu Pro Asp Ile Leu Gly Gln
595 600 605
Pro Glu Pro Pro Gln Glu Gly Gly Ser Gln Lys Ser Pro Pro Pro Gly
610 615 620
Ser Leu Glu Tyr Leu Cys Leu Pro Ala Gly Gly Gln Val Gln Leu Val
625 630 635 640
Pro Leu Ala Gln Ala Met Gly Pro Gly Gln Ala Val Glu Val Glu Arg
645 650 655
Arg Pro Ser Gln Gly Ala Ala Gly Ser Pro Ser Leu Glu Ser Gly Gly
660 665 670
Gly Pro Ala Pro Pro Ala Leu Gly Pro Arg Val Gly Gly Gln Asp Gln
675 680 685
Lys Asp Ser Pro Val Ala Ile Pro Met Ser Ser Gly Asp Thr Glu Asp
690 695 700
Pro Gly Val Ala Ser Gly Tyr Val Ser Ser Ala Asp Leu Val Phe Thr
705 710 715 720
Pro Asn Ser Gly Ala Ser Ser Val Ser Leu Val Pro Ser Leu Gly Leu
725 730 735
Pro Ser Asp Gln Thr Pro Ser Leu Cys Pro Gly Leu Ala Ser Gly Pro
740 745 750
Pro Gly Ala Pro Gly Pro Val Lys Ser Gly Phe Glu Gly Tyr Val Glu
755 760 765
Leu Pro Pro Ile Glu Gly Arg Ser Pro Arg Ser Pro Arg Asn Asn Pro
770 775 780
Val Pro Pro Glu Ala Lys Ser Pro Val Leu Asn Pro Gly Glu Arg Pro
785 790 795 800
Ala Asp Val Ser Pro Thr Ser Pro Gln Pro Glu Gly Leu Leu Val Leu
805 810 815
Gln Gln Val Gly Asp Tyr Cys Phe Leu Pro Gly Leu Gly Pro Gly Pro
820 825 830
Leu Ser Leu Arg Ser Lys Pro Ser Ser Pro Gly Pro Gly Pro Glu Ile
835 840 845
Lys Asn Leu Asp Gln Ala Phe Gln Val Lys Lys Pro Pro Gly Gln Ala
850 855 860
Val Pro Gln Val Pro Val Ile Gln Leu Phe Lys Ala Leu Lys Gln Gln
865 870 875 880
Asp Tyr Leu Ser Leu Pro Pro Trp Glu Val Asn Lys Pro Gly Glu Val
885 890 895
Cys
<210> 2
<211> 378
<212> PRT
<213> Homo sapiens
<400> 2
Met Val Leu Leu Trp Leu Thr Leu Leu Leu Ile Ala Leu Pro Cys Leu
1 5 10 15
Leu Gln Thr Lys Glu Asp Pro Asn Pro Pro Ile Thr Asn Leu Arg Met
20 25 30
Lys Ala Lys Ala Gln Gln Leu Thr Trp Asp Leu Asn Arg Asn Val Thr
35 40 45
Asp Ile Glu Cys Val Lys Asp Ala Asp Tyr Ser Met Pro Ala Val Asn
50 55 60
Asn Ser Tyr Cys Gln Phe Gly Ala Ile Ser Leu Cys Glu Val Thr Asn
65 70 75 80
Tyr Thr Val Arg Val Ala Asn Pro Pro Phe Ser Thr Trp Ile Leu Phe
85 90 95
Pro Glu Asn Ser Gly Lys Pro Trp Ala Gly Ala Glu Asn Leu Thr Cys
100 105 110
Trp Ile His Asp Val Asp Phe Leu Ser Cys Ser Trp Ala Val Gly Pro
115 120 125
Gly Ala Pro Ala Asp Val Gln Tyr Asp Leu Tyr Leu Asn Val Ala Asn
130 135 140
Arg Arg Gln Gln Tyr Glu Cys Leu His Tyr Lys Thr Asp Ala Gln Gly
145 150 155 160
Thr Arg Ile Gly Cys Arg Phe Asp Asp Ile Ser Arg Leu Ser Ser Gly
165 170 175
Ser Gln Ser Ser His Ile Leu Val Arg Gly Arg Ser Ala Ala Phe Gly
180 185 190
Ile Pro Cys Thr Asp Lys Phe Val Val Phe Ser Gln Ile Glu Ile Leu
195 200 205
Thr Pro Pro Asn Met Thr Ala Lys Cys Asn Lys Thr His Ser Phe Met
210 215 220
His Trp Lys Met Arg Ser His Phe Asn Arg Lys Phe Arg Tyr Glu Leu
225 230 235 240
Gln Ile Gln Lys Arg Met Gln Pro Val Ile Thr Glu Gln Val Arg Asp
245 250 255
Arg Thr Ser Phe Gln Leu Leu Asn Pro Gly Thr Tyr Thr Val Gln Ile
260 265 270
Arg Ala Arg Glu Arg Val Tyr Glu Phe Leu Ser Ala Trp Ser Thr Pro
275 280 285
Gln Arg Phe Glu Cys Asp Gln Glu Glu Gly Ala Asn Thr Arg Ala Trp
290 295 300
Arg Thr Ser Leu Leu Ile Ala Leu Gly Thr Leu Leu Ala Leu Val Cys
305 310 315 320
Val Phe Val Ile Cys Arg Arg Tyr Leu Val Met Gln Arg Leu Phe Pro
325 330 335
Arg Ile Pro His Met Lys Asp Pro Ile Gly Asp Ser Phe Gln Asn Asp
340 345 350
Lys Leu Val Val Trp Glu Ala Gly Lys Ala Gly Leu Glu Glu Cys Leu
355 360 365
Val Thr Glu Val Gln Val Val Gln Lys Thr
370 375
<210> 3
<211> 836
<212> PRT
<213> Homo sapiens
<400> 3
Met Ala Arg Leu Gly Asn Cys Ser Leu Thr Trp Ala Ala Leu Ile Ile
1 5 10 15
Leu Leu Leu Pro Gly Ser Leu Glu Glu Cys Gly His Ile Ser Val Ser
20 25 30
Ala Pro Ile Val His Leu Gly Asp Pro Ile Thr Ala Ser Cys Ile Ile
35 40 45
Lys Gln Asn Cys Ser His Leu Asp Pro Glu Pro Gln Ile Leu Trp Arg
50 55 60
Leu Gly Ala Glu Leu Gln Pro Gly Gly Arg Gln Gln Arg Leu Ser Asp
65 70 75 80
Gly Thr Gln Glu Ser Ile Ile Thr Leu Pro His Leu Asn His Thr Gln
85 90 95
Ala Phe Leu Ser Cys Cys Leu Asn Trp Gly Asn Ser Leu Gln Ile Leu
100 105 110
Asp Gln Val Glu Leu Arg Ala Gly Tyr Pro Pro Ala Ile Pro His Asn
115 120 125
Leu Ser Cys Leu Met Asn Leu Thr Thr Ser Ser Leu Ile Cys Gln Trp
130 135 140
Glu Pro Gly Pro Glu Thr His Leu Pro Thr Ser Phe Thr Leu Lys Ser
145 150 155 160
Phe Lys Ser Arg Gly Asn Cys Gln Thr Gln Gly Asp Ser Ile Leu Asp
165 170 175
Cys Val Pro Lys Asp Gly Gln Ser His Cys Cys Ile Pro Arg Lys His
180 185 190
Leu Leu Leu Tyr Gln Asn Met Gly Ile Trp Val Gln Ala Glu Asn Ala
195 200 205
Leu Gly Thr Ser Met Ser Pro Gln Leu Cys Leu Asp Pro Met Asp Val
210 215 220
Val Lys Leu Glu Pro Pro Met Leu Arg Thr Met Asp Pro Ser Pro Glu
225 230 235 240
Ala Ala Pro Pro Gln Ala Gly Cys Leu Gln Leu Cys Trp Glu Pro Trp
245 250 255
Gln Pro Gly Leu His Ile Asn Gln Lys Cys Glu Leu Arg His Lys Pro
260 265 270
Gln Arg Gly Glu Ala Ser Trp Ala Leu Val Gly Pro Leu Pro Leu Glu
275 280 285
Ala Leu Gln Tyr Glu Leu Cys Gly Leu Leu Pro Ala Thr Ala Tyr Thr
290 295 300
Leu Gln Ile Arg Cys Ile Arg Trp Pro Leu Pro Gly His Trp Ser Asp
305 310 315 320
Trp Ser Pro Ser Leu Glu Leu Arg Thr Thr Glu Arg Ala Pro Thr Val
325 330 335
Arg Leu Asp Thr Trp Trp Arg Gln Arg Gln Leu Asp Pro Arg Thr Val
340 345 350
Gln Leu Phe Trp Lys Pro Val Pro Leu Glu Glu Asp Ser Gly Arg Ile
355 360 365
Gln Gly Tyr Val Val Ser Trp Arg Pro Ser Gly Gln Ala Gly Ala Ile
370 375 380
Leu Pro Leu Cys Asn Thr Thr Glu Leu Ser Cys Thr Phe His Leu Pro
385 390 395 400
Ser Glu Ala Gln Glu Val Ala Leu Val Ala Tyr Asn Ser Ala Gly Thr
405 410 415
Ser Arg Pro Thr Pro Val Val Phe Ser Glu Ser Arg Gly Pro Ala Leu
420 425 430
Thr Arg Leu His Ala Met Ala Arg Asp Pro His Ser Leu Trp Val Gly
435 440 445
Trp Glu Pro Pro Asn Pro Trp Pro Gln Gly Tyr Val Ile Glu Trp Gly
450 455 460
Leu Gly Pro Pro Ser Ala Ser Asn Ser Asn Lys Thr Trp Arg Met Glu
465 470 475 480
Gln Asn Gly Arg Ala Thr Gly Phe Leu Leu Lys Glu Asn Ile Arg Pro
485 490 495
Phe Gln Leu Tyr Glu Ile Ile Val Thr Pro Leu Tyr Gln Asp Thr Met
500 505 510
Gly Pro Ser Gln His Val Tyr Ala Tyr Ser Gln Glu Met Ala Pro Ser
515 520 525
His Ala Pro Glu Leu His Leu Lys His Ile Gly Lys Thr Trp Ala Gln
530 535 540
Leu Glu Trp Val Pro Glu Pro Pro Glu Leu Gly Lys Ser Pro Leu Thr
545 550 555 560
His Tyr Thr Ile Phe Trp Thr Asn Ala Gln Asn Gln Ser Phe Ser Ala
565 570 575
Ile Leu Asn Ala Ser Ser Arg Gly Phe Val Leu His Gly Leu Glu Pro
580 585 590
Ala Ser Leu Tyr His Ile His Leu Met Ala Ala Ser Gln Ala Gly Ala
595 600 605
Thr Asn Ser Thr Val Leu Thr Leu Met Thr Leu Thr Pro Glu Gly Ser
610 615 620
Glu Leu His Ile Ile Leu Gly Leu Phe Gly Leu Leu Leu Leu Leu Thr
625 630 635 640
Cys Leu Cys Gly Thr Ala Trp Leu Cys Cys Ser Pro Asn Arg Lys Asn
645 650 655
Pro Leu Trp Pro Ser Val Pro Asp Pro Ala His Ser Ser Leu Gly Ser
660 665 670
Trp Val Pro Thr Ile Met Glu Glu Asp Ala Phe Gln Leu Pro Gly Leu
675 680 685
Gly Thr Pro Pro Ile Thr Lys Leu Thr Val Leu Glu Glu Asp Glu Lys
690 695 700
Lys Pro Val Pro Trp Glu Ser His Asn Ser Ser Glu Thr Cys Gly Leu
705 710 715 720
Pro Thr Leu Val Gln Thr Tyr Val Leu Gln Gly Asp Pro Arg Ala Val
725 730 735
Ser Thr Gln Pro Gln Ser Gln Ser Gly Thr Ser Asp Gln Val Leu Tyr
740 745 750
Gly Gln Leu Leu Gly Ser Pro Thr Ser Pro Gly Pro Gly His Tyr Leu
755 760 765
Arg Cys Asp Ser Thr Gln Pro Leu Leu Ala Gly Leu Thr Pro Ser Pro
770 775 780
Lys Ser Tyr Glu Asn Leu Trp Phe Gln Ala Ser Pro Leu Gly Thr Leu
785 790 795 800
Val Thr Pro Ala Pro Ser Gln Glu Asp Asp Cys Val Phe Gly Pro Leu
805 810 815
Leu Asn Phe Pro Leu Leu Gln Gly Ile Arg Val His Gly Met Glu Ala
820 825 830
Leu Gly Ser Phe
835
<210> 4
<211> 420
<212> PRT
<213> Homo sapiens
<400> 4
Met Ile Ile Val Ala His Val Leu Leu Ile Leu Leu Gly Ala Thr Glu
1 5 10 15
Ile Leu Gln Ala Asp Leu Leu Pro Asp Glu Lys Ile Ser Leu Leu Pro
20 25 30
Pro Val Asn Phe Thr Ile Lys Val Thr Gly Leu Ala Gln Val Leu Leu
35 40 45
Gln Trp Lys Pro Asn Pro Asp Gln Glu Gln Arg Asn Val Asn Leu Glu
50 55 60
Tyr Gln Val Lys Ile Asn Ala Pro Lys Glu Asp Asp Tyr Glu Thr Arg
65 70 75 80
Ile Thr Glu Ser Lys Cys Val Thr Ile Leu His Lys Gly Phe Ser Ala
85 90 95
Ser Val Arg Thr Ile Leu Gln Asn Asp His Ser Leu Leu Ala Ser Ser
100 105 110
Trp Ala Ser Ala Glu Leu His Ala Pro Pro Gly Ser Pro Gly Thr Ser
115 120 125
Ile Val Asn Leu Thr Cys Thr Thr Asn Thr Thr Glu Asp Asn Tyr Ser
130 135 140
Arg Leu Arg Ser Tyr Gln Val Ser Leu His Cys Thr Trp Leu Val Gly
145 150 155 160
Thr Asp Ala Pro Glu Asp Thr Gln Tyr Phe Leu Tyr Tyr Arg Tyr Gly
165 170 175
Ser Trp Thr Glu Glu Cys Gln Glu Tyr Ser Lys Asp Thr Leu Gly Arg
180 185 190
Asn Ile Ala Cys Trp Phe Pro Arg Thr Phe Ile Leu Ser Lys Gly Arg
195 200 205
Asp Trp Leu Ala Val Leu Val Asn Gly Ser Ser Lys His Ser Ala Ile
210 215 220
Arg Pro Phe Asp Gln Leu Phe Ala Leu His Ala Ile Asp Gln Ile Asn
225 230 235 240
Pro Pro Leu Asn Val Thr Ala Glu Ile Glu Gly Thr Arg Leu Ser Ile
245 250 255
Gln Trp Glu Lys Pro Val Ser Ala Phe Pro Ile His Cys Phe Asp Tyr
260 265 270
Glu Val Lys Ile His Asn Thr Arg Asn Gly Tyr Leu Gln Ile Glu Lys
275 280 285
Leu Met Thr Asn Ala Phe Ile Ser Ile Ile Asp Asp Leu Ser Lys Tyr
290 295 300
Asp Val Gln Val Arg Ala Ala Val Ser Ser Met Cys Arg Glu Ala Gly
305 310 315 320
Leu Trp Ser Glu Trp Ser Gln Pro Ile Tyr Val Gly Asn Asp Glu His
325 330 335
Lys Pro Leu Arg Glu Trp Phe Val Ile Val Ile Met Ala Thr Ile Cys
340 345 350
Phe Ile Leu Leu Ile Leu Ser Leu Ile Cys Lys Ile Cys His Leu Trp
355 360 365
Ile Lys Leu Phe Pro Pro Ile Pro Ala Pro Lys Ser Asn Ile Lys Asp
370 375 380
Leu Phe Val Thr Thr Asn Tyr Glu Lys Ala Gly Ser Ser Glu Thr Glu
385 390 395 400
Ile Glu Val Ile Cys Tyr Ile Glu Lys Pro Gly Val Glu Thr Leu Glu
405 410 415
Asp Ser Val Phe
420
<210> 5
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> VL последовательность антитела 9A2
<400> 5
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 6
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> VL последовательность антитела 9A2-VR1
<400> 6
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Pro Phe
20 25 30
Met Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 7
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> VL последовательность антитела 9A2-VR2
<400> 7
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Gln Arg Pro Phe
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 8
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> VL последовательность антитела 9A2-VR3
<400> 8
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Leu Arg Pro Phe
20 25 30
Val Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 9
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> VL последовательность антитела 9A2-VR4
<400> 9
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Pro Phe
20 25 30
Val Asp Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 10
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> VL последовательность антитела 9A2-VR5
<400> 10
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Pro Phe
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 11
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> VL последовательность антитела 9A2-VR6
<400> 11
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Val Arg Pro Phe
20 25 30
Val Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 12
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> VL последовательность антитела 9A2-VR8
<400> 12
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Val Arg Pro Phe
20 25 30
Ile Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 13
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> VL последовательность антитела 9A2-VR9
<400> 13
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Pro Phe
20 25 30
Ile Asp Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 14
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> VL последовательность антитела 9A2-VR11
<400> 14
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Val Arg Pro Phe
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 15
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> VL последовательность антитела 9A2-VR12
<400> 15
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Pro Phe
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 16
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> VL последовательность антитела 9A2-VR13
<400> 16
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gly Lys Pro Val Leu Asp Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 17
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> VL последовательность антитела 9A2-VR14
<400> 17
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gly Lys Pro Val Phe Asp Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 18
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> VL последовательность антитела 9A2-VR16
<400> 18
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gly Ile Pro Val Leu Gly Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 19
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> VL последовательность антитела 9A2-VR19
<400> 19
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gly Ile Pro Ile Leu Gly Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 20
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2
<400> 20
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 21
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR20
<400> 21
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn His Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 22
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR21
<400> 22
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Met His Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 23
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR22
<400> 23
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gln Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 24
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR23
<400> 24
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Glu Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 25
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24
<400> 25
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 26
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR26
<400> 26
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ile His Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 27
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR27
<400> 27
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr His Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 28
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR28
<400> 28
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Val His Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 29
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR31
<400> 29
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ala Gln Trp Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 30
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR32
<400> 30
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Val Arg Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 31
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR33
<400> 31
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Ser Gly Trp Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 32
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR34
<400> 32
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser His Phe Pro Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 33
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR35
<400> 33
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Phe Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 34
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR36
<400> 34
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Gly Gly Asp Lys Arg Gln Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 35
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR37
<400> 35
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Met Trp Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 36
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR38
<400> 36
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Met Gly Ala Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 37
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39
<400> 37
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 38
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR40
<400> 38
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Tyr Gly Ile Gln Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 39
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR41
<400> 39
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Lys Gly Trp Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 40
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR42
<400> 40
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Gly Gly Asp Ile Arg Gln Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 41
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR43
<400> 41
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Ser Asp His Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 42
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR44
<400> 42
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser His Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 43
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR45
<400> 43
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Ser Asp Asn Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 44
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR46
<400> 44
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Ser Asp His Phe Arg Glu Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 45
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR47
<400> 45
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Ser Asp His Phe Ser Pro Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 46
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR48
<400> 46
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Ser Asp His Phe Lys Pro Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 47
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR49
<400> 47
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Ser Asp His Phe Asn Pro Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 48
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR50
<400> 48
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Ser Asp His Phe Ala Pro Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 49
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.04
<400> 49
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile His Thr His Arg His Ile Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 50
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.07
<400> 50
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile His Thr His Arg Asn Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 51
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.10
<400> 51
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile His Thr Gly Ser Gln Trp Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 52
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.12
<400> 52
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile His Thr His Tyr Gln Tyr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 53
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.19
<400> 53
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile His Thr Gln Ser Lys Trp Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 54
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.24
<400> 54
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Thr Asp Gly Thr Trp Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 55
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.76
<400> 55
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Gln Thr His Gly Val Trp Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 56
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.78
<400> 56
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile His Thr His Arg Asn Tyr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 57
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.81
<400> 57
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile His Thr His Arg Asn Tyr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 58
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.82
<400> 58
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Lys His Gly Gly Arg Tyr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 59
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.84
<400> 59
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile His Thr His Arg Pro Trp Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 60
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.87
<400> 60
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile His Thr His Ser Asp Trp Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 61
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.91
<400> 61
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile His Thr His Arg Gln Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 62
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.93
<400> 62
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Asn Glu Asn Gly Trp Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 63
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.27
<400> 63
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Pro Tyr Tyr His Gln Lys Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 64
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.29
<400> 64
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Pro Tyr Tyr Asn Tyr Lys Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 65
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.30
<400> 65
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Pro Tyr Tyr Asn Arg Arg Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 66
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.33
<400> 66
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Pro Tyr Tyr Asn His Lys Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 67
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.44
<400> 67
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Pro Tyr Tyr His Pro Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 68
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.97
<400> 68
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Pro Tyr Tyr Ser Leu Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 69
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.98
<400> 69
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Pro His Tyr Asn Ser Val Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 70
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.102
<400> 70
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Pro Phe Tyr Asn Ser Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 71
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.107
<400> 71
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Pro Tyr Tyr Asn Pro Phe Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 72
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.110
<400> 72
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Pro Tyr Tyr Asn Asn His Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 73
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.111
<400> 73
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Pro Met Tyr Asn Pro His Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 74
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.55
<400> 74
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Asn Pro Ser Val
50 55 60
Lys Asn Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 75
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.56
<400> 75
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Asn Pro Ala Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 76
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.57
<400> 76
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Asn Pro Lys Val
50 55 60
Lys His Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 77
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.122
<400> 77
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Asn Ser Glu Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 78
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.124
<400> 78
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Thr Pro Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 79
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR24.131
<400> 79
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Asn Pro Ser Val
50 55 60
Met Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 80
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.01
<400> 80
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Phe Trp Phe
20 25 30
His His Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 81
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.02
<400> 81
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Tyr Trp Tyr
20 25 30
His Met Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 82
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.04
<400> 82
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Trp Phe
20 25 30
Gln His Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 83
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.05
<400> 83
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Phe
20 25 30
His Thr Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 84
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.06
<400> 84
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gln Trp Tyr
20 25 30
His Tyr Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 85
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.11
<400> 85
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gln Glu Phe
20 25 30
His Thr Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 86
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.12
<400> 86
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Phe Trp Phe
20 25 30
Asn Thr Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 87
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.16
<400> 87
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gln Trp Phe
20 25 30
Asn Ile Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 88
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.17
<400> 88
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Phe Tyr
20 25 30
His Lys Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 89
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.18
<400> 89
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Gly Tyr
20 25 30
Val Trp Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 90
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.19
<400> 90
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gln Tyr Phe
20 25 30
Asn Val Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 91
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.21
<400> 91
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gln His Tyr
20 25 30
His Thr Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 92
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.22
<400> 92
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gln Trp Tyr
20 25 30
His Val Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 93
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.23
<400> 93
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe His His Tyr
20 25 30
His Thr Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 94
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.24
<400> 94
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe His His Phe
20 25 30
His Val Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 95
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.97
<400> 95
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Phe
20 25 30
His Phe Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 96
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.98
<400> 96
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Glu His Tyr
20 25 30
His Thr Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 97
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.102
<400> 97
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gln Trp Phe
20 25 30
His Tyr Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 98
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.103
<400> 98
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gln His Phe
20 25 30
His Trp Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 99
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.105
<400> 99
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Tyr Tyr
20 25 30
His Met Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 100
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.109
<400> 100
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Met Trp Tyr
20 25 30
His His Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 101
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.110
<400> 101
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Val Trp Tyr
20 25 30
His His Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 102
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.111
<400> 102
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Phe
20 25 30
His Phe Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 103
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.112
<400> 103
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Tyr Tyr
20 25 30
His Gln Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 104
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.116
<400> 104
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Phe
20 25 30
Val Met Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 105
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.27
<400> 105
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Arg Thr Ser Phe Met Trp Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 106
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.28
<400> 106
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Arg Gly Ala Pro Met Trp Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 107
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.46
<400> 107
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Asp Val Asp Phe Gly Trp Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 108
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.122
<400> 108
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Ala Gly Phe Phe Glu Tyr Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 109
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.139
<400> 109
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Pro Arg Trp Glu Trp Asn Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 110
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.140
<400> 110
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Ala Tyr Ser Glu Met Trp Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 111
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.148
<400> 111
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr His Val Ala Gln Glu Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 112
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.162
<400> 112
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Pro Gln Met Ala Gln Glu Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 113
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.77
<400> 113
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Gln Trp Pro Met
50 55 60
Asn Lys Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 114
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.93
<400> 114
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Asn Pro Ala Trp
50 55 60
Lys Lys Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 115
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.174
<400> 115
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Arg Asp His
50 55 60
Lys Lys Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 116
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH последовательность антитела 9A2-VR39.177
<400> 116
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Leu Glu Tyr
50 55 60
Lys Lys Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 117
<211> 428
<212> PRT
<213> Homo sapiens
<400> 117
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Ala Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 118
<211> 428
<212> PRT
<213> Homo sapiens
<400> 118
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Ala Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 119
<211> 428
<212> PRT
<213> Homo sapiens
<400> 119
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Ala Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 120
<211> 428
<212> PRT
<213> Homo sapiens
<400> 120
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Ala Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 121
<211> 428
<212> PRT
<213> Homo sapiens
<400> 121
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ala His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 122
<211> 428
<212> PRT
<213> Homo sapiens
<400> 122
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser Ala Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 123
<211> 428
<212> PRT
<213> Homo sapiens
<400> 123
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ala Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 124
<211> 428
<212> PRT
<213> Homo sapiens
<400> 124
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Ala Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 125
<211> 428
<212> PRT
<213> Homo sapiens
<400> 125
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Ala Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 126
<211> 428
<212> PRT
<213> Homo sapiens
<400> 126
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Ala Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 127
<211> 428
<212> PRT
<213> Homo sapiens
<400> 127
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Ala Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 128
<211> 428
<212> PRT
<213> Homo sapiens
<400> 128
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Ala Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 129
<211> 428
<212> PRT
<213> Homo sapiens
<400> 129
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Ala Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 130
<211> 428
<212> PRT
<213> Homo sapiens
<400> 130
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Ala Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 131
<211> 444
<212> PRT
<213> Homo sapiens
<400> 131
Met Val Leu Ala Gln Gly Leu Leu Ser Met Ala Leu Leu Ala Leu Cys
1 5 10 15
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
20 25 30
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
35 40 45
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
50 55 60
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
65 70 75 80
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
85 90 95
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
100 105 110
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
115 120 125
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
130 135 140
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
145 150 155 160
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
165 170 175
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
180 185 190
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
195 200 205
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
210 215 220
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
225 230 235 240
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
245 250 255
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
260 265 270
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
275 280 285
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
290 295 300
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
305 310 315 320
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
325 330 335
Asn Ala Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
340 345 350
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
355 360 365
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
370 375 380
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
385 390 395 400
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
405 410 415
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
420 425 430
Ser Trp Asp Thr Glu Ser His His His His His His
435 440
<210> 132
<211> 428
<212> PRT
<213> Homo sapiens
<400> 132
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Ala Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 133
<211> 428
<212> PRT
<213> Homo sapiens
<400> 133
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Ala Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 134
<211> 428
<212> PRT
<213> Homo sapiens
<400> 134
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Ala Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 135
<211> 428
<212> PRT
<213> Homo sapiens
<400> 135
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Ala Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 136
<211> 428
<212> PRT
<213> Homo sapiens
<400> 136
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Ala Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 137
<211> 428
<212> PRT
<213> Homo sapiens
<400> 137
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Ala Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 138
<211> 428
<212> PRT
<213> Homo sapiens
<400> 138
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Ala His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 139
<211> 428
<212> PRT
<213> Homo sapiens
<400> 139
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu Ala Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 140
<211> 428
<212> PRT
<213> Homo sapiens
<400> 140
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ala
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 141
<211> 428
<212> PRT
<213> Homo sapiens
<400> 141
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 142
<211> 428
<212> PRT
<213> Homo sapiens
<400> 142
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Ala Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 143
<211> 428
<212> PRT
<213> Homo sapiens
<400> 143
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Ala Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 144
<211> 444
<212> PRT
<213> Homo sapiens
<400> 144
Met Val Leu Ala Gln Gly Leu Leu Ser Met Ala Leu Leu Ala Leu Cys
1 5 10 15
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
20 25 30
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
35 40 45
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
50 55 60
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
65 70 75 80
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
85 90 95
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
100 105 110
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
115 120 125
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
130 135 140
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
145 150 155 160
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
165 170 175
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
180 185 190
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
195 200 205
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
210 215 220
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
225 230 235 240
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
245 250 255
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
260 265 270
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
275 280 285
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
290 295 300
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
305 310 315 320
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
325 330 335
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
340 345 350
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
355 360 365
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
370 375 380
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
385 390 395 400
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
405 410 415
Ser Arg Thr Ala Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
420 425 430
Ser Trp Asp Thr Glu Ser His His His His His His
435 440
<210> 145
<211> 428
<212> PRT
<213> Homo sapiens
<400> 145
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Ala Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 146
<211> 428
<212> PRT
<213> Homo sapiens
<400> 146
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Ala Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 147
<211> 428
<212> PRT
<213> Homo sapiens
<400> 147
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Ala Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 148
<211> 428
<212> PRT
<213> Homo sapiens
<400> 148
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ala Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 149
<211> 41
<212> DNA
<213> Искусственная последовательность
<220>
<223> nucleotide acid sequence encoding trimer oligonucleotide 9A2 L1.1
<220>
<221> n
<222> (18)..(23)
<223> n is any nucleotide provided that a codon comprising the n
encoding an amino acid other than cysteine
<220>
<221> misc_feature
<222> (18)..(23)
<223> n is a, c, g, or t
<400> 149
gtcgtgcaag ccagggtnnn nnntggtatc agcagaaacc g 41
<210> 150
<211> 45
<212> DNA
<213> Искусственная последовательность
<220>
<223> nucleotide acid sequence encoding trimer oligonucleotide 9A2 L3.1
<220>
<221> n
<222> (22)..(27)
<223> "N" is any nucleotide provided that a codon comprising the n
encoding an amino acid other than cysteine
<220>
<221> misc_feature
<222> (22)..(27)
<223> n is a, c, g, or t
<220>
<221> n
<222> (32)..(37)
<223> "N" is any nucleotide provided that a codon comprising the n
encoding an amino acid other than cysteine
<400> 150
gattttgcaa cctattattg cnnnnnnccg attacctttg gtcag 45
<210> 151
<211> 42
<212> DNA
<213> Искусственная последовательность
<220>
<223> nucleotide acid sequence encoding trimer oligonucleotide 9A2 L3.2
<220>
<221> n
<222> (20)..(25)
<223> "N" is any nucleotide provided that a codon comprising the n
encoding an amino acid other than cysteine
<220>
<221> misc_feature
<222> (20)..(25)
<223> n is a, c, g, or t
<220>
<221> n
<222> (21)..(26)
<223> "N" is any nucleotide provided that a codon comprising the n
encoding an amino acid other than cysteine
<400> 151
ctattattgc cagcaggcan nnnnntttgg tcagggcacc cg 42
<210> 152
<211> 42
<212> DNA
<213> Искусственная последовательность
<220>
<223> nucleotide acid sequence encoding trimer oligonucleotide 9A2 H1.1
<220>
<221> n
<222> (20)..(25)
<223> "N" is any nucleotide provided that a codon comprising the n
encoding an amino acid other than cysteine
<220>
<221> misc_feature
<222> (20)..(25)
<223> n is a, c, g, or t
<400> 152
agcaagcggt tttacctttn nnnnntgggt tcgtcaggca cc 42
<210> 153
<211> 44
<212> DNA
<213> Искусственная последовательность
<220>
<223> nucleotide acid sequence encoding trimer oligonucleotide 9A2 H2.1
<220>
<221> n
<222> (20)..(25)
<223> "N" is any nucleotide provided that a codon comprising the n
encoding an amino acid other than cysteine
<220>
<221> misc_feature
<222> (20)..(25)
<223> n is a, c, g, or t
<400> 153
ggaatgggtt agcagcattn nnnnnaccta ttatgccgat agcg 44
<210> 154
<211> 43
<212> DNA
<213> Искусственная последовательность
<220>
<223> nucleotide acid sequence encoding trimer oligonucleotide 9A2 H3.1
<220>
<221> n
<222> (20)..(25)
<223> "N" is any nucleotide provided that a codon comprising the n
encoding an amino acid other than cysteine
<220>
<221> misc_feature
<222> (20)..(25)
<223> n is a, c, g, or t
<400> 154
agtttattat tgcgcacgcn nnnnngatat ttggggtcag ggt 43
<210> 155
<211> 44
<212> DNA
<213> Искусственная последовательность
<220>
<223> nucleotide acid sequence encoding trimer oligonucleotide 9A2 H3.2
<220>
<221> n
<222> (21)..(26)
<223> "N" is any nucleotide provided that a codon comprising the n
encoding an amino acid other than cysteine
<220>
<221> misc_feature
<222> (21)..(26)
<223> n is a, c, g, or t
<400> 155
attattgcgc acgcttttat nnnnnntggg gtcagggtac aatg 44
<210> 156
<211> 44
<212> DNA
<213> Искусственная последовательность
<220>
<223> nucleotide acid sequence encoding trimer oligonucleotide
9A2-VR24-H2.1
<220>
<221> n
<222> (20)..(25)
<223> "N" is any nucleotide provided that a codon comprising the n
encoding an amino acid other than cysteine
<220>
<221> misc_feature
<222> (20)..(25)
<223> n is a, c, g, or t
<400> 156
ggaatgggtt agcagcattn nnnnnaccta ttatgccgat agcg 44
<210> 157
<211> 44
<212> DNA
<213> Искусственная последовательность
<220>
<223> nucleotide acid sequence encoding trimer oligonucleotide
9A2-VR24-H2.2
<220>
<221> n
<222> (19)..(24)
<223> "N" is any nucleotide provided that a codon comprising the n
encoding an amino acid other than cysteine
<220>
<221> misc_feature
<222> (19)..(24)
<223> n is a, c, g, or t
<400> 157
cgtagcagcg gtggttttnn nnnngtgaaa ggtcgtttta ccat 44
<210> 158
<211> 45
<212> DNA
<213> Искусственная последовательность
<220>
<223> nucleotide acid sequence encoding trimer oligonucleotide
9A2-VR24-H2.3
<220>
<221> n
<222> (21)..(26)
<223> "N" is any nucleotide provided that a codon comprising the n
encoding an amino acid other than cysteine
<220>
<221> misc_feature
<222> (21)..(26)
<223> n is a, c, g, or t
<400> 158
gcggtggttt tacctattat nnnnnncgtt ttaccattag ccgtg 45
<210> 159
<211> 42
<212> DNA
<213> Искусственная последовательность
<220>
<223> nucleotide acid sequence encoding trimer oligonucleotide
9A2-VR39-H1.1
<220>
<221> n
<222> (20)..(25)
<223> "N" is any nucleotide provided that a codon comprising the n
encoding an amino acid other than cysteine
<220>
<221> misc_feature
<222> (20)..(25)
<223> n is a, c, g, or t
<400> 159
agcaagcggt tttacctttn nnnnntgggt tcgtcaggca cc 42
<210> 160
<211> 42
<212> DNA
<213> Искусственная последовательность
<220>
<223> nucleotide acid sequence encoding trimer oligonucleotide
9A2-VR39-H1.2
<220>
<221> n
<222> (18)..(23)
<223> "N" is any nucleotide provided that a codon comprising the n
encoding an amino acid other than cysteine
<220>
<221> misc_feature
<222> (18)..(23)
<223> n is a, c, g, or t
<400> 160
tgagctgtgc agcaagcnnn nnntatcata tgctgtgggt tc 42
<210> 161
<211> 43
<212> DNA
<213> Искусственная последовательность
<220>
<223> nucleotide acid sequence encoding trimer oligonucleotide
9A2-VR39-H2.2
<220>
<221> n
<222> (19)..(24)
<223> "N" is any nucleotide provided that a codon comprising the n
encoding an amino acid other than cysteine
<220>
<221> misc_feature
<222> (19)..(24)
<223> n is a, c, g, or t
<400> 161
aatggtcgtg gtcgtgttnn nnnngtgaaa ggtcgtttta cca 43
<210> 162
<211> 45
<212> DNA
<213> Искусственная последовательность
<220>
<223> nucleotide acid sequence encoding trimer oligonucleotide
9A2-VR39-H2.3
<220>
<221> n
<222> (21)..(26)
<223> "N" is any nucleotide provided that a codon comprising the n
encoding an amino acid other than cysteine
<220>
<221> misc_feature
<222> (21)..(26)
<223> n is a, c, g, or t
<400> 162
gtggtcgtgt tacctattat nnnnnncgtt ttaccattag ccgtg 45
<210> 163
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of VH chain of stop template of 9A2 H1.1
<220>
<221> misc_feature
<222> (30)..(35)
<223> Xaa can be any naturally occurring amino acid
<400> 163
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Xaa Xaa Xaa
20 25 30
Xaa Xaa Xaa Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 164
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of VH chain of stop template of 9A2 H2.1
<220>
<221> misc_feature
<222> (52)..(57)
<223> Xaa can be any naturally occurring amino acid
<400> 164
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Xaa Xaa Xaa Xaa Xaa Xaa Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 165
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of VH chain of stop template of 9A2 H3.1
<220>
<221> misc_feature
<222> (99)..(104)
<223> Xaa can be any naturally occurring amino acid
<400> 165
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Xaa Xaa Xaa Xaa Xaa Xaa Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 166
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of VH chain of stop template of 9A2 H3.2
<220>
<221> misc_feature
<222> (101)..(106)
<223> Xaa can be any naturally occurring amino acid
<400> 166
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Xaa Xaa Xaa Xaa Xaa Xaa Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 167
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of VL chain of stop template of 9A2 L1.1
<220>
<221> misc_feature
<222> (29)..(34)
<223> Xaa can be any naturally occurring amino acid
<400> 167
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Xaa Xaa Xaa Xaa
20 25 30
Xaa Xaa Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 168
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of VL chain of stop template of 9A2 L3.1
<220>
<221> misc_feature
<222> (89)..(94)
<223> Xaa can be any naturally occurring amino acid
<400> 168
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Xaa Xaa Xaa Xaa Xaa Xaa Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 169
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of VL chain of stop template of 9A2 L3.2
<220>
<221> misc_feature
<222> (92)..(97)
<223> Xaa can be any naturally occurring amino acid
<400> 169
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Xaa Xaa Xaa Xaa Xaa
85 90 95
Xaa Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 170
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of VH chain of stop template of 9A2 VR24-H2.1
<220>
<221> misc_feature
<222> (52)..(57)
<223> Xaa can be any naturally occurring amino acid
<400> 170
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Xaa Xaa Xaa Xaa Xaa Xaa Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 171
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of VH chain of stop template of 9A2 VR24-H2.2
<220>
<221> misc_feature
<222> (58)..(63)
<223> Xaa can be any naturally occurring amino acid
<400> 171
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Xaa Xaa Xaa Xaa Xaa Xaa Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 172
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of VH chain of stop template of 9A2 VR24-H2.3
<220>
<221> misc_feature
<222> (61)..(66)
<223> Xaa can be any naturally occurring amino acid
<400> 172
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Thr Tyr Tyr Xaa Xaa Xaa Xaa
50 55 60
Xaa Xaa Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 173
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of VH chain of stop template of 9A2 VR39-H1.1
<220>
<221> misc_feature
<222> (30)..(35)
<223> Xaa can be any naturally occurring amino acid
<400> 173
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Xaa Xaa Xaa
20 25 30
Xaa Xaa Xaa Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 174
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of VH chain of stop template of 9A2 VR39-H1.2
<220>
<221> misc_feature
<222> (26)..(31)
<223> Xaa can be any naturally occurring amino acid
<400> 174
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Xaa Xaa Xaa Xaa Xaa Xaa Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 175
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of VH chain of stop template of 9A2 VR39-H2.2
<220>
<221> misc_feature
<222> (58)..(63)
<223> Xaa can be any naturally occurring amino acid
<400> 175
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Xaa Xaa Xaa Xaa Xaa Xaa Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 176
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of VH chain of stop template of 9A2 VR39-H2.3
<220>
<221> misc_feature
<222> (61)..(66)
<223> Xaa can be any naturally occurring amino acid
<400> 176
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser His Tyr
20 25 30
His Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Tyr Tyr Xaa Xaa Xaa Xaa
50 55 60
Xaa Xaa Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 177
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of consensus of VL chain of 9A2 and
derivatives
<220>
<221> X
<222> (29)..(29)
<223> I, Q, L or V
<220>
<221> X
<222> (30)..(30)
<223> S or R
<220>
<221> X
<222> (31)..(31)
<223> S or P
<220>
<221> X
<222> (32)..(32)
<223> W or F
<220>
<221> X
<222> (33)..(33)
<223> L, M, V or I
<220>
<221> X
<222> (34)..(34)
<223> A, S, N or D
<220>
<221> X
<222> (89)..(89)
<223> Q or G
<220>
<221> X
<222> (90)..(90)
<223> Q, K or I
<220>
<221> X
<222> (91)..(91)
<223> A or P
<220>
<221> X
<222> (92)..(92)
<223> N, V or I
<220>
<221> X
<222> (93)..(93)
<223> S, L or F
<220>
<221> X
<222> (94)..(94)
<223> F, D or G
<400> 177
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Xaa Xaa Xaa Xaa
20 25 30
Xaa Xaa Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Xaa Xaa Xaa Xaa Xaa Xaa Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
<210> 178
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of consensus of CDR1 of VL chain of 9A2 and
derivatives
<220>
<221> X
<222> (6)..(6)
<223> I, Q, L or V
<220>
<221> X
<222> (7)..(7)
<223> S or R
<220>
<221> X
<222> (8)..(8)
<223> S or P
<220>
<221> X
<222> (9)..(9)
<223> W or F
<220>
<221> X
<222> (10)..(10)
<223> L, M, V or I
<220>
<221> X
<222> (11)..(11)
<223> A, S, N or D
<400> 178
Arg Ala Ser Gln Gly Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10
<210> 179
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of consensus of CDR3 of VL chain of 9A2 and
derivatives
<220>
<221> X
<222> (1)..(1)
<223> Q or G
<220>
<221> X
<222> (2)..(2)
<223> Q, K or I
<220>
<221> X
<222> (3)..(3)
<223> A or P
<220>
<221> X
<222> (4)..(4)
<223> N, V or I
<220>
<221> X
<222> (5)..(5)
<223> S, L or F
<220>
<221> X
<222> (6)..(6)
<223> F, D or G
<400> 179
Xaa Xaa Xaa Xaa Xaa Xaa Pro Ile Thr
1 5
<210> 180
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of consensus of VH chain of 9A2 and
derivatives
<220>
<221> X
<222> (30)..(30)
<223> S, N, M, Q, E, P, I, T or V
<220>
<221> X
<222> (31)..(31)
<223> H or W
<220>
<221> X
<222> (33)..(33)
<223> H or R
<220>
<221> X
<222> (34)..(34)
<223> M or V
<220>
<221> X
<222> (35)..(35)
<223> L or H
<220>
<221> X
<222> (52)..(52)
<223> R, S, N or G
<220>
<221> X
<222> (53)..(53)
<223> S or G
<220>
<221> X
<222> (54)..(54)
<223> S, A, F, D, M, R, Y or K
<220>
<221> X
<222> (55)..(55)
<223> G, Q, V, H, K, M or I
<220>
<221> X
<222> (56)..(56)
<223> G, W, R, F, W, A or I
<220>
<221> X
<222> (57)..(57)
<223> F, S, T, P, N, Q or V
<220>
<221> X
<222> (101)..(101)
<223> D or S
<220>
<221> X
<222> (102)..(102)
<223> S or D
<220>
<221> X
<222> (103)..(103)
<223> F, H or N
<220>
<221> X
<222> (105)..(105)
<223> D, R, S, K, N or A
<220>
<221> X
<222> (106)..(106)
<223> I, E or P
<400> 180
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Xaa Xaa Tyr
20 25 30
Xaa Xaa Xaa Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Xaa Xaa Xaa Xaa Xaa Xaa Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Xaa Xaa Xaa Phe Xaa Xaa Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 181
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of consensus of CDR1 of VH chain of 9A2 and
derivatives
<220>
<221> X
<222> (5)..(5)
<223> S, N, M, Q, E, P, I, T or V
<220>
<221> X
<222> (6)..(6)
<223> H or W
<220>
<221> X
<222> (8)..(8)
<223> H or R
<220>
<221> X
<222> (9)..(9)
<223> M or V
<220>
<221> X
<222> (10)..(10)
<223> L or H
<400> 181
Gly Phe Thr Phe Xaa Xaa Tyr Xaa Xaa Xaa
1 5 10
<210> 182
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of consensus of CDR2 of VH chain of 9A2 and
derivatives
<220>
<221> X
<222> (3)..(3)
<223> R, S, N or G
<220>
<221> X
<222> (4)..(4)
<223> S or G
<220>
<221> X
<222> (5)..(5)
<223> S, A, F, D, M, R, Y or K
<220>
<221> X
<222> (6)..(6)
<223> G, Q, V, H, K, M or I
<220>
<221> X
<222> (7)..(7)
<223> G, W, R, F, W, A or I
<220>
<221> X
<222> (8)..(8)
<223> F, S, T, P, N, Q or V
<400> 182
Ser Ile Xaa Xaa Xaa Xaa Xaa Xaa Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 183
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of consensus of CDR3 of VH chain of 9A2 and
derivatives
<220>
<221> X
<222> (3)..(3)
<223> D or S
<220>
<221> X
<222> (4)..(4)
<223> S or D
<220>
<221> X
<222> (5)..(5)
<223> F, H or N
<220>
<221> X
<222> (7)..(7)
<223> D, R, S, K, N or A
<220>
<221> X
<222> (8)..(8)
<223> I, E or P
<400> 183
Phe Tyr Xaa Xaa Xaa Phe Xaa Xaa
1 5
<210> 184
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of consensus of VH chain of 9A2-VR24 and
derivatives
<220>
<221> X
<222> (52)..(52)
<223> R, H, Q or K
<220>
<221> X
<222> (53)..(53)
<223> S, T, H or N
<220>
<221> X
<222> (54)..(54)
<223> S, H, G, Q, D or E
<220>
<221> X
<222> (55)..(55)
<223> G, R, S, Y or N
<220>
<221> X
<222> (56)..(56)
<223> G, H, N, Q, K, T, V, R, P or D
<220>
<221> X
<222> (57)..(57)
<223> F, I, S, W, V or Y
<220>
<221> X
<222> (58)..(58)
<223> T or P
<220>
<221> X
<222> (59)..(59)
<223> Y, H, F or M
<220>
<221> X
<222> (61)..(61)
<223> A, H, N, S or T
<220>
<221> X
<222> (62)..(62)
<223> D, Q, Y, R, H, P, L, S or N
<220>
<221> X
<222> (63)..(63)
<223> S, K, R, V, F, H, A or E
<220>
<221> X
<222> (65)..(65)
<223> K, R or M
<220>
<221> X
<222> (66)..(66)
<223> G, N or H
<400> 184
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Tyr Xaa Xaa Xaa Val
50 55 60
Xaa Xaa Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 185
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of consensus of CDR1 of VH chain of 9A2-VR24
and derivatives
<400> 185
Gly Phe Thr Phe Pro Trp Tyr Arg Val His
1 5 10
<210> 186
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of consensus of CDR2 of VH chain of 9A2-VR24
and derivatives
<220>
<221> X
<222> (3)..(3)
<223> R, H, Q or K
<220>
<221> X
<222> (4)..(4)
<223> S, T, H or N
<220>
<221> X
<222> (5)..(5)
<223> S, H, G, Q, D or E
<220>
<221> X
<222> (6)..(6)
<223> G, R, S, Y or N
<220>
<221> X
<222> (7)..(7)
<223> G, H, N, Q, K, T, V, R, P or D
<220>
<221> X
<222> (8)..(8)
<223> F, I, S, W, V or Y
<220>
<221> X
<222> (9)..(9)
<223> T or P
<220>
<221> X
<222> (10)..(10)
<223> Y, H , F or M
<220>
<221> X
<222> (12)..(12)
<223> A, H, N, S or T
<220>
<221> X
<222> (13)..(13)
<223> D, Q, Y, R, H, P, L, S or N
<220>
<221> X
<222> (14)..(14)
<223> S, K, R, V, F, H, A or E
<220>
<221> X
<222> (16)..(16)
<223> K, R or M
<220>
<221> X
<222> (17)..(17)
<223> G, N or H
<400> 186
Ser Ile Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Tyr Xaa Xaa Xaa Val Xaa
1 5 10 15
Xaa
<210> 187
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of consensus of CDR3 of VH chain of 9A2-VR24
and derivatives
<400> 187
Phe Tyr Asp Ser Phe Phe Asp Ile
1 5
<210> 188
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of consensus of VH chain of 9A2-VR39 and
derivatives
<220>
<221> X
<222> (26)..(26)
<223> G, R, D, A or P
<220>
<221> X
<222> (27)..(27)
<223> F, G, V, R or Y
<220>
<221> X
<222> (28)..(28)
<223> T, S, A, P, F or W
<220>
<221> X
<222> (29)..(29)
<223> F, P or E
<220>
<221> X
<222> (30)..(30)
<223> S, F, Y, N, P, Q, H, E, M, V, G, W or M
<220>
<221> X
<222> (31)..(31)
<223> H, W, E, F, G, Y or N
<220>
<221> X
<222> (32)..(32)
<223> Y or F
<220>
<221> X
<222> (33)..(33)
<223> H, M, Q, N or V
<220>
<221> X
<222> (34)..(34)
<223> M, H, T, Y, I, K, W, V, F or Q
<220>
<221> X
<222> (35)..(35)
<223> L, V or I
<220>
<221> X
<222> (59)..(59)
<223> Y, H or Q
<220>
<221> X
<222> (60)..(60)
<223> Y, V or M
<220>
<221> X
<222> (61)..(61)
<223> A, Q or N
<220>
<221> X
<222> (62)..(62)
<223> D, Q, W, P, R or L
<220>
<221> X
<222> (63)..(63)
<223> S, E, P, A or D
<220>
<221> X
<222> (64)..(64)
<223> V, M, W, H or Y
<220>
<221> X
<222> (65)..(65)
<223> K or N
<220>
<221> X
<222> (66)..(66)
<223> G or K
<400> 188
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Xaa Xaa Xaa Xaa Xaa Xaa Xaa
20 25 30
Xaa Xaa Xaa Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Arg Val Thr Xaa Xaa Xaa Xaa Xaa Xaa
50 55 60
Xaa Xaa Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 189
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of consensus of CDR1 of VH chain of 9A2-VR39
and derivatives
<220>
<221> X
<222> (1)..(1)
<223> G, R, D, A or P
<220>
<221> X
<222> (2)..(2)
<223> F, G, V, R or Y
<220>
<221> X
<222> (3)..(3)
<223> T, S, A, P, F or W
<220>
<221> X
<222> (4)..(4)
<223> F, P or E
<220>
<221> X
<222> (5)..(5)
<223> S, F, Y, N, P, Q, H, E, M, V, G, W or M
<220>
<221> X
<222> (6)..(6)
<223> H, W, E, F, G, Y or N
<220>
<221> X
<222> (7)..(7)
<223> Y or F
<220>
<221> X
<222> (8)..(8)
<223> H, M, Q, N or V
<220>
<221> X
<222> (9)..(9)
<223> M, H, T, Y, I, K, W, V, F or Q
<220>
<221> X
<222> (10)..(10)
<223> L, V or I
<400> 189
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10
<210> 190
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of consensus of CDR2 of VH chain of 9A2-VR39
and derivatives
<220>
<221> X
<222> (10)..(10)
<223> Y, H or Q
<220>
<221> X
<222> (11)..(11)
<223> Y, V or M
<220>
<221> X
<222> (12)..(12)
<223> A, Q or N
<220>
<221> X
<222> (13)..(13)
<223> D, Q, W, P, R or L
<220>
<221> X
<222> (14)..(14)
<223> S, E, P, A or D
<220>
<221> X
<222> (15)..(15)
<223> V, M, W, H or Y
<220>
<221> X
<222> (16)..(16)
<223> K or N
<220>
<221> X
<222> (17)..(17)
<223> G or K
<400> 190
Ser Ile Asn Gly Arg Gly Arg Val Thr Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10 15
Xaa
<210> 191
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of consensus of CDR3 of VH chain of 9A2-VR39
and derivatives
<400> 191
Phe Tyr Asp Ser Phe Phe Asp Ile
1 5
<210> 192
<211> 428
<212> PRT
<213> Homo sapiens
<400> 192
Trp Glu Arg Ser Leu Ala Gly Ala Glu Glu Thr Ile Pro Leu Gln Thr
1 5 10 15
Leu Arg Cys Tyr Asn Asp Tyr Thr Ser His Ile Thr Cys Arg Trp Ala
20 25 30
Asp Thr Gln Asp Ala Gln Arg Leu Val Asn Val Thr Leu Ile Arg Arg
35 40 45
Val Asn Glu Asp Leu Leu Glu Pro Val Ser Cys Asp Leu Ser Asp Asp
50 55 60
Met Pro Trp Ser Ala Cys Pro His Pro Arg Cys Val Pro Arg Arg Cys
65 70 75 80
Val Ile Pro Cys Gln Ser Phe Val Val Thr Asp Val Asp Tyr Phe Ser
85 90 95
Phe Gln Pro Asp Arg Pro Leu Gly Thr Arg Leu Thr Val Thr Leu Thr
100 105 110
Gln His Val Gln Pro Pro Glu Pro Arg Asp Leu Gln Ile Ser Thr Asp
115 120 125
Gln Asp His Phe Leu Leu Thr Trp Ser Val Ala Leu Gly Ser Pro Gln
130 135 140
Ser His Trp Leu Ser Pro Gly Asp Leu Glu Phe Glu Val Val Tyr Lys
145 150 155 160
Arg Leu Gln Asp Ser Trp Glu Asp Ala Ala Ile Leu Leu Ser Asn Thr
165 170 175
Ser Gln Ala Thr Leu Gly Pro Glu His Leu Met Pro Ser Ser Thr Tyr
180 185 190
Val Ala Arg Val Arg Thr Arg Leu Ala Pro Gly Ser Arg Leu Ser Gly
195 200 205
Arg Pro Ser Lys Trp Ser Pro Glu Val Cys Trp Asp Ser Gln Pro Gly
210 215 220
Asp Glu Ala Gln Pro Gln Asn Leu Glu Cys Phe Phe Asp Gly Ala Ala
225 230 235 240
Val Leu Ser Cys Ser Trp Glu Val Arg Lys Glu Val Ala Ser Ser Val
245 250 255
Ser Phe Gly Leu Phe Tyr Lys Pro Ser Pro Asp Ala Gly Glu Glu Glu
260 265 270
Cys Ser Pro Val Leu Arg Glu Gly Leu Gly Ser Leu His Thr Arg His
275 280 285
His Cys Gln Ile Pro Val Pro Asp Pro Ala Thr His Gly Gln Tyr Ile
290 295 300
Val Ser Val Gln Pro Arg Arg Ala Glu Lys His Ile Lys Ser Ser Val
305 310 315 320
Asn Ile Gln Met Ala Pro Pro Ser Leu Asn Val Thr Lys Asp Gly Asp
325 330 335
Ser Tyr Ser Leu Arg Trp Glu Thr Met Lys Met Arg Tyr Glu His Ile
340 345 350
Asp His Thr Phe Glu Ile Gln Tyr Arg Lys Asp Thr Ala Thr Trp Lys
355 360 365
Asp Ser Lys Thr Glu Thr Leu Gln Asn Ala His Ser Met Ala Leu Pro
370 375 380
Ala Leu Glu Pro Ser Thr Arg Tyr Trp Ala Arg Val Arg Val Arg Thr
385 390 395 400
Ser Arg Thr Gly Tyr Asn Gly Ile Trp Ser Glu Trp Ser Glu Ala Arg
405 410 415
Ser Trp Asp Thr Glu Ser His His His His His His
420 425
<210> 193
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of VH chain of 9A2-VR24 HCDR2 mutants
<220>
<221> misc_feature
<222> (52)..(59)
<223> Xaa can be any naturally occurring amino acid
<220>
<221> misc_feature
<222> (61)..(63)
<223> Xaa can be any naturally occurring amino acid
<220>
<221> misc_feature
<222> (65)..(66)
<223> Xaa can be any naturally occurring amino acid
<400> 193
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Tyr Xaa Xaa Xaa Val
50 55 60
Xaa Xaa Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 194
<211> 444
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of antibody 9A2 heavy chain
<400> 194
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Pro Trp Tyr
20 25 30
Arg Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Gly Gly Phe Pro Tyr Tyr Asn Tyr Lys Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Tyr Asp Ser Phe Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 195
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of antibody 9A2 light chain
<400> 195
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Leu Arg Pro Phe
20 25 30
Val Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 196
<211> 327
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of stabilized IgG4 heavy chain constant
region
<400> 196
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 197
<211> 104
<212> PRT
<213> Искусственная последовательность
<220>
<223> amino acid sequence of kappa light chain constant region
<400> 197
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
1 5 10 15
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
20 25 30
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
35 40 45
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
50 55 60
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
65 70 75 80
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
85 90 95
Lys Ser Phe Asn Arg Gly Glu Cys
100
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ HLA-G, КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АНТИТЕЛА ПРОТИВ HLA-G, И СПОСОБЫ ПРИМЕНЕНИЯ АНТИТЕЛ ПРОТИВ HLA-G | 2019 |
|
RU2810326C2 |
| АНТИТЕЛО К TIGIT И ЕГО ИСПОЛЬЗОВАНИЕ | 2019 |
|
RU2786434C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С TFR | 2019 |
|
RU2810756C2 |
| ВЫСОКОАФФИННЫЕ АНТИ-PD-1 И АНТИ-LAG-3 АНТИТЕЛА И ПОЛУЧЕННЫЕ ИЗ НИХ БИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ | 2019 |
|
RU2782381C2 |
| АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТСЯ С РАКОВЫМИ КЛЕТКАМИ И ОБЕСПЕЧИВАЮТ НАПРАВЛЕННЫЙ ПЕРЕНОС РАДИОНУКЛИДОВ К УКАЗАННЫМ КЛЕТКАМ | 2020 |
|
RU2833191C2 |
| Антитело против FXI/FXIA, его антигенсвязывающий фрагмент и фармацевтическое применение | 2021 |
|
RU2838408C1 |
| C3-СВЯЗЫВАЮЩИЕ АГЕНТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2802307C2 |
| ТРИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ, ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2822200C2 |
| АНТИТЕЛО, СПОСОБНОЕ СВЯЗЫВАТЬСЯ С ТИМИЧЕСКИМ СТРОМАЛЬНЫМ ЛИМФОПОЭТИНОМ, И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2825304C2 |
| АНТИГЕНСВЯЗЫВАЮЩИЕ БЕЛКИ ПРОТИВ TIGIT И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2776714C2 |
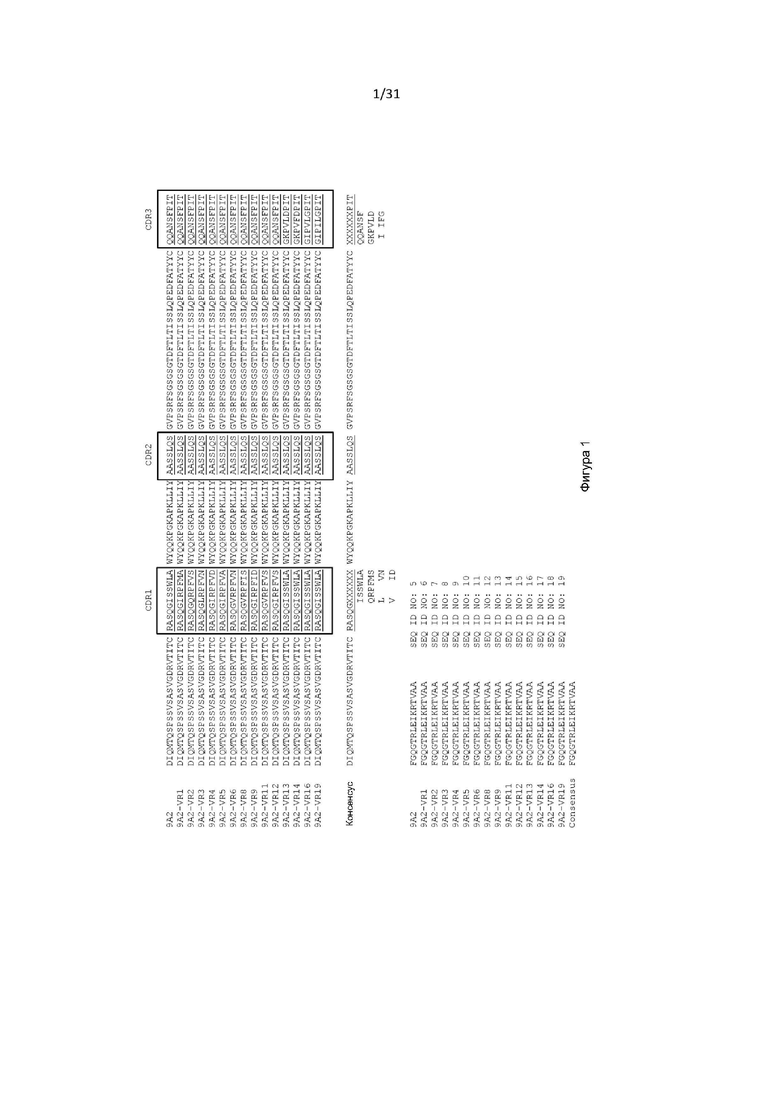
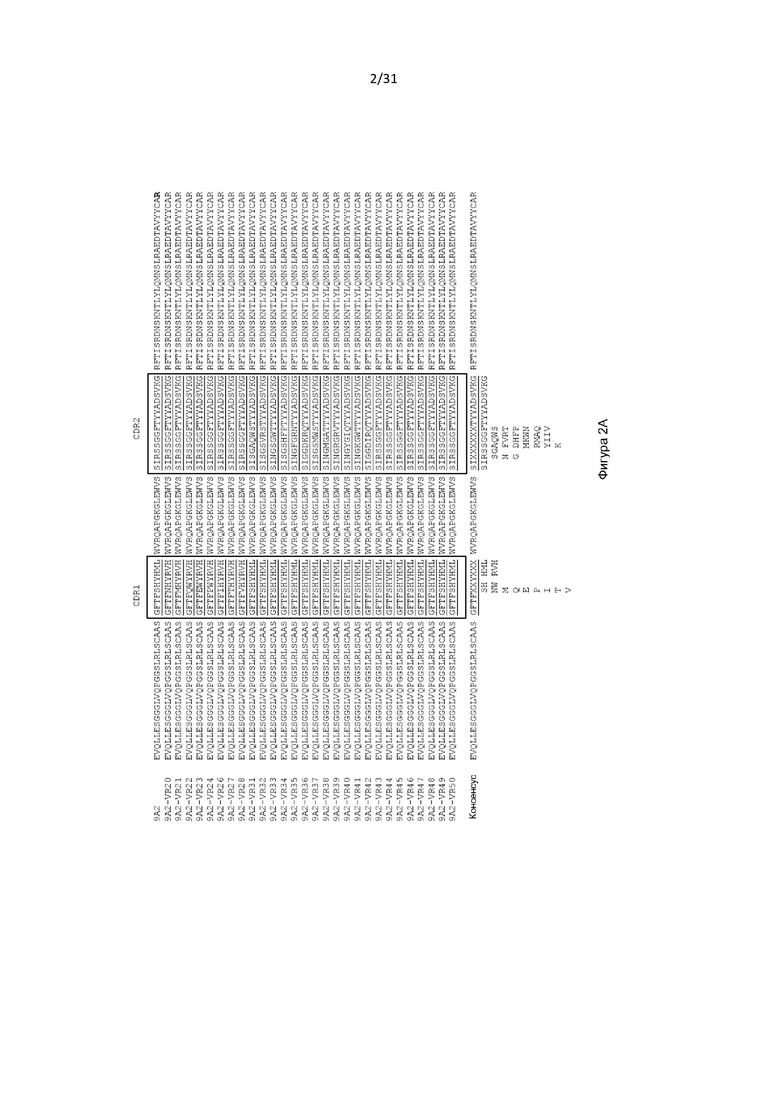

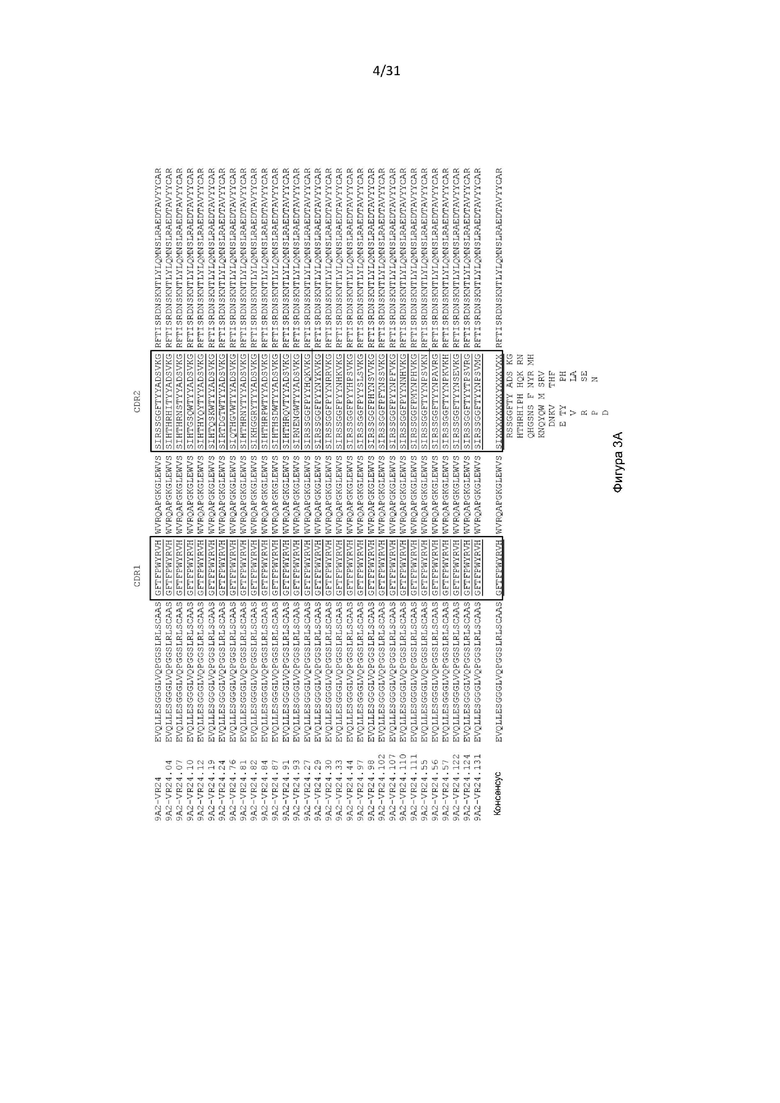

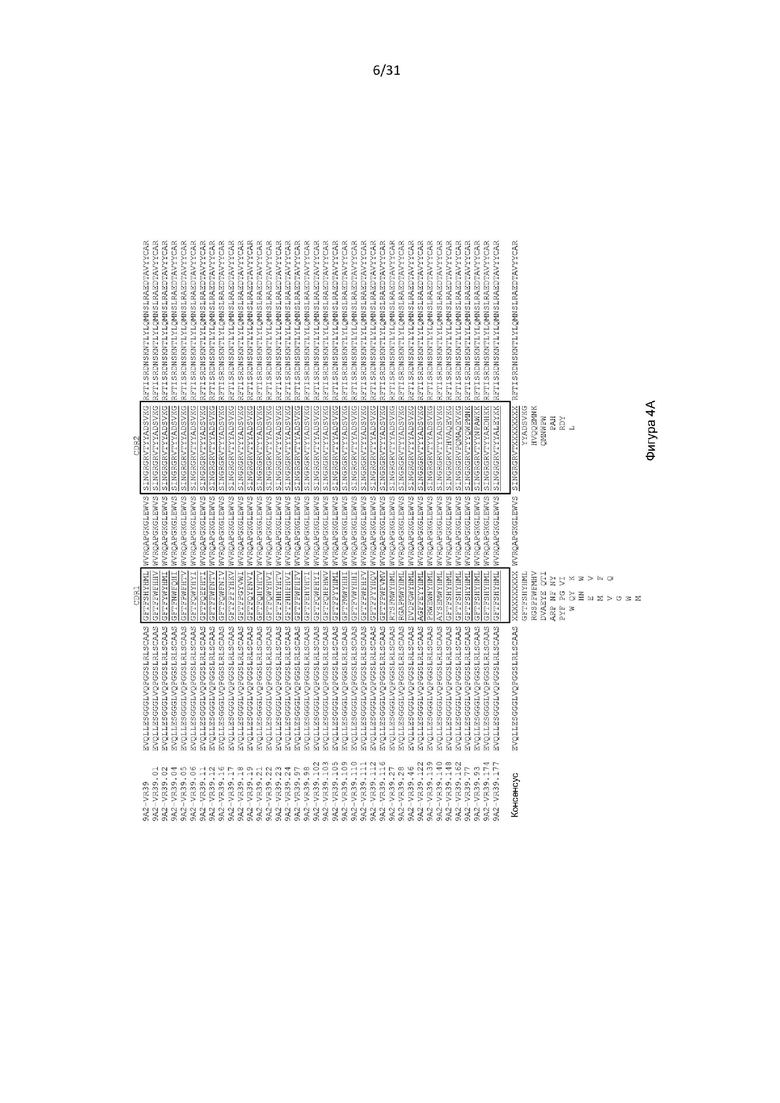


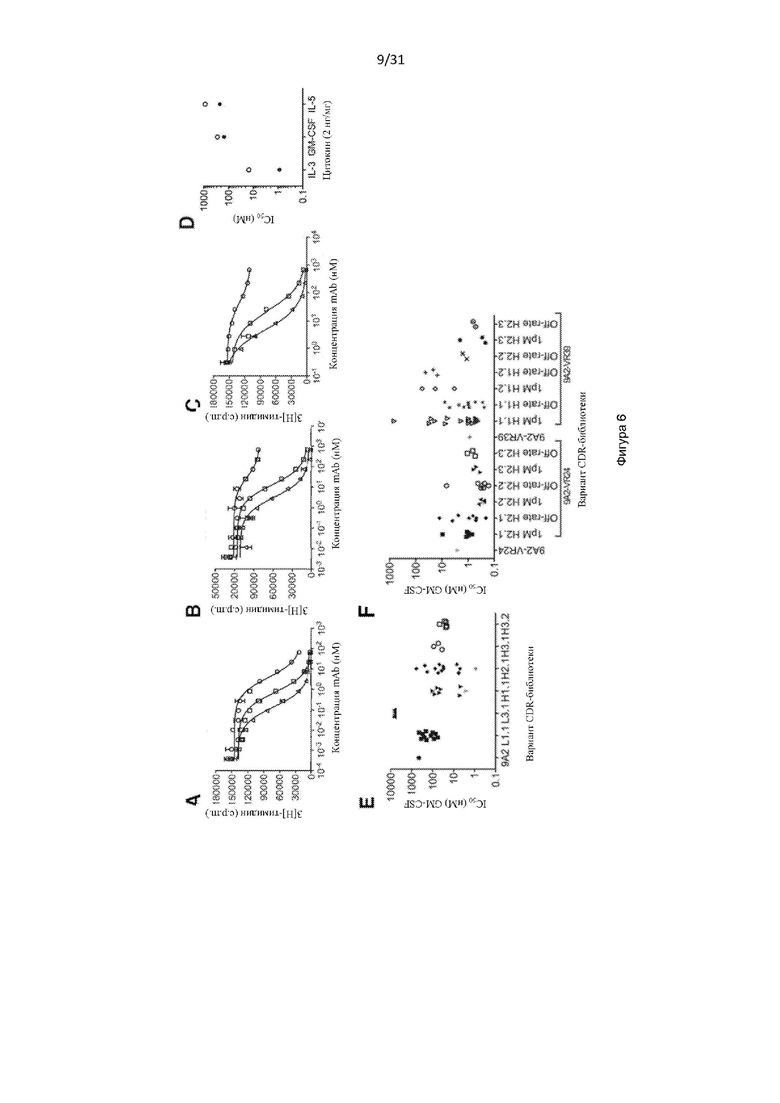
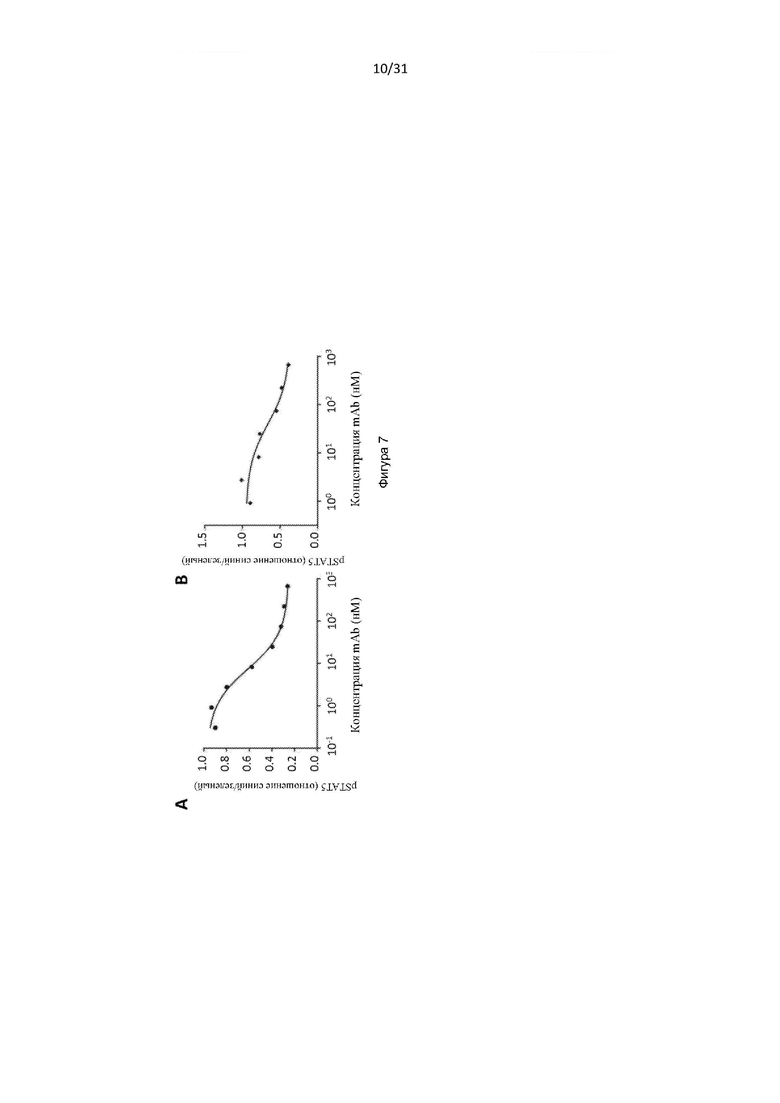
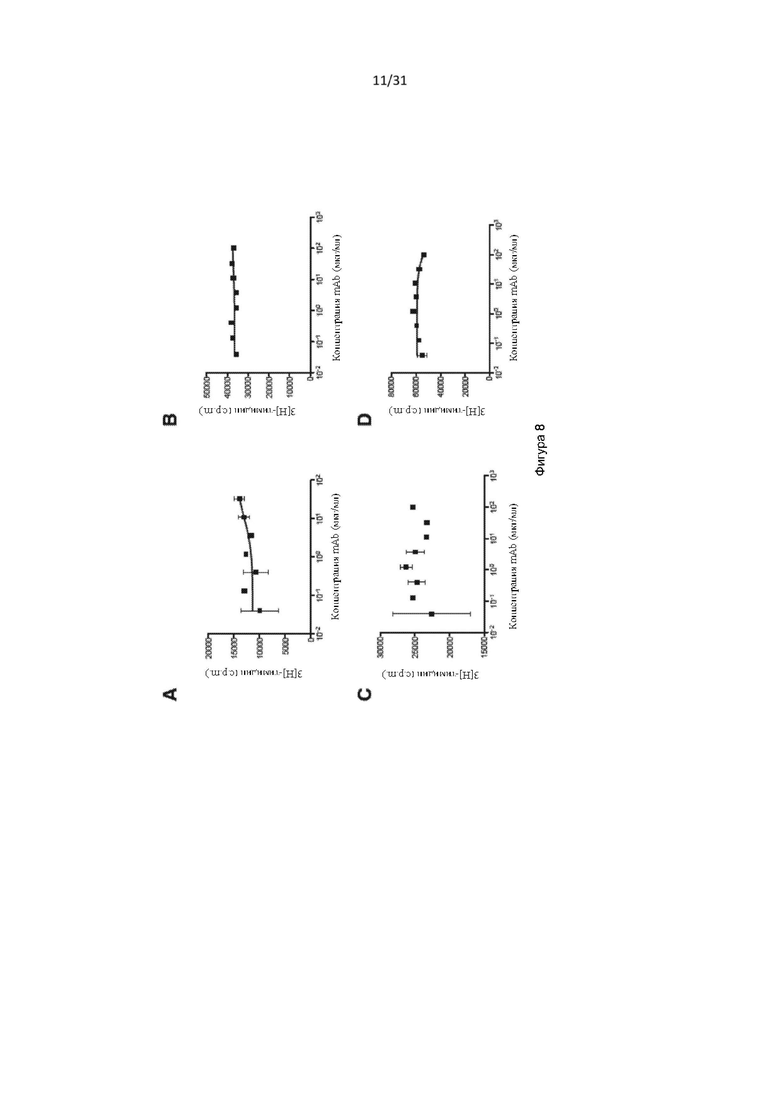
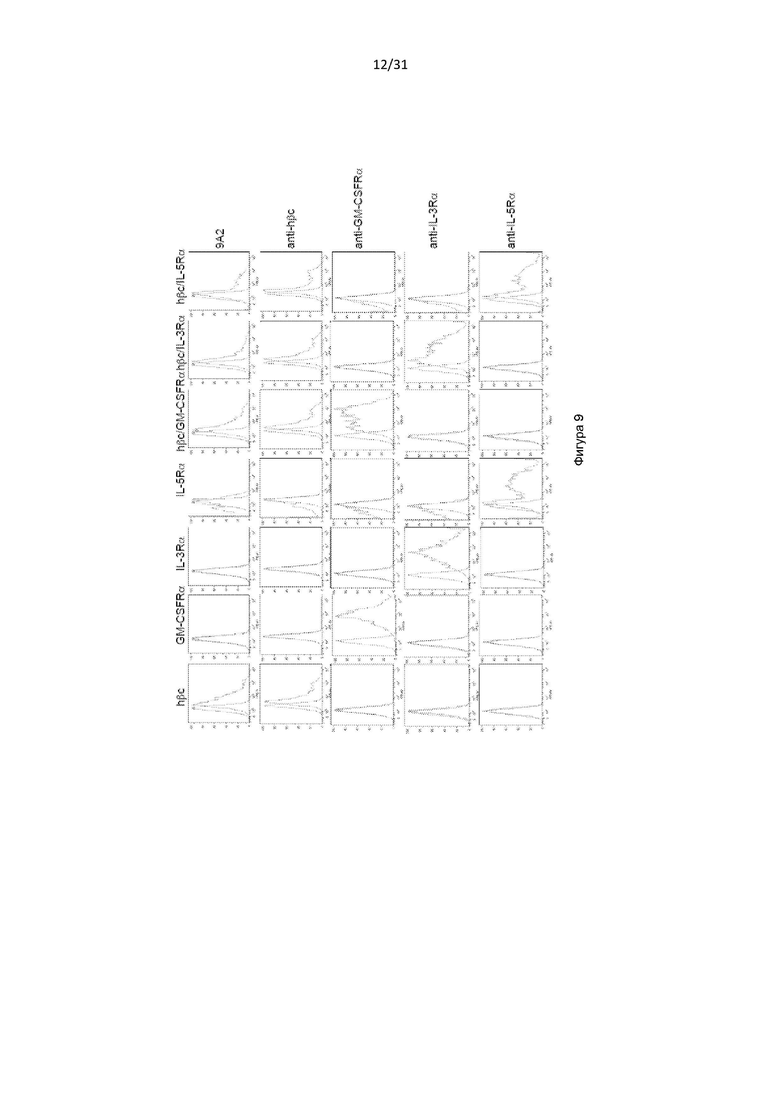
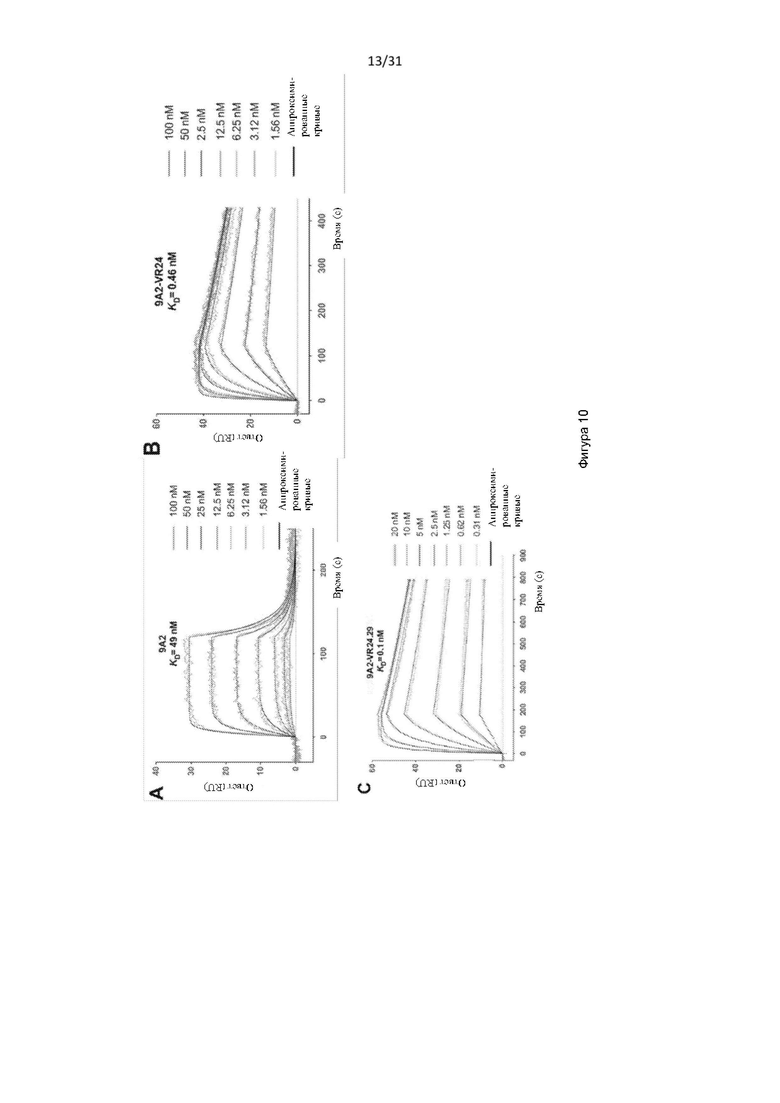

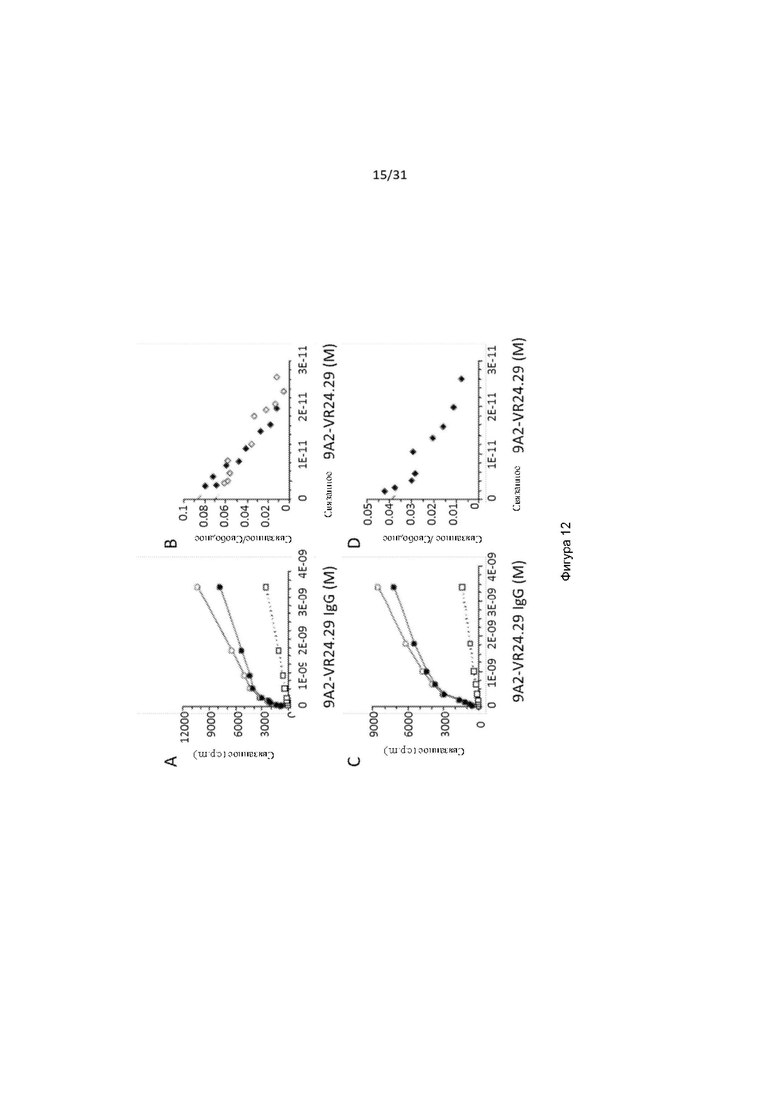
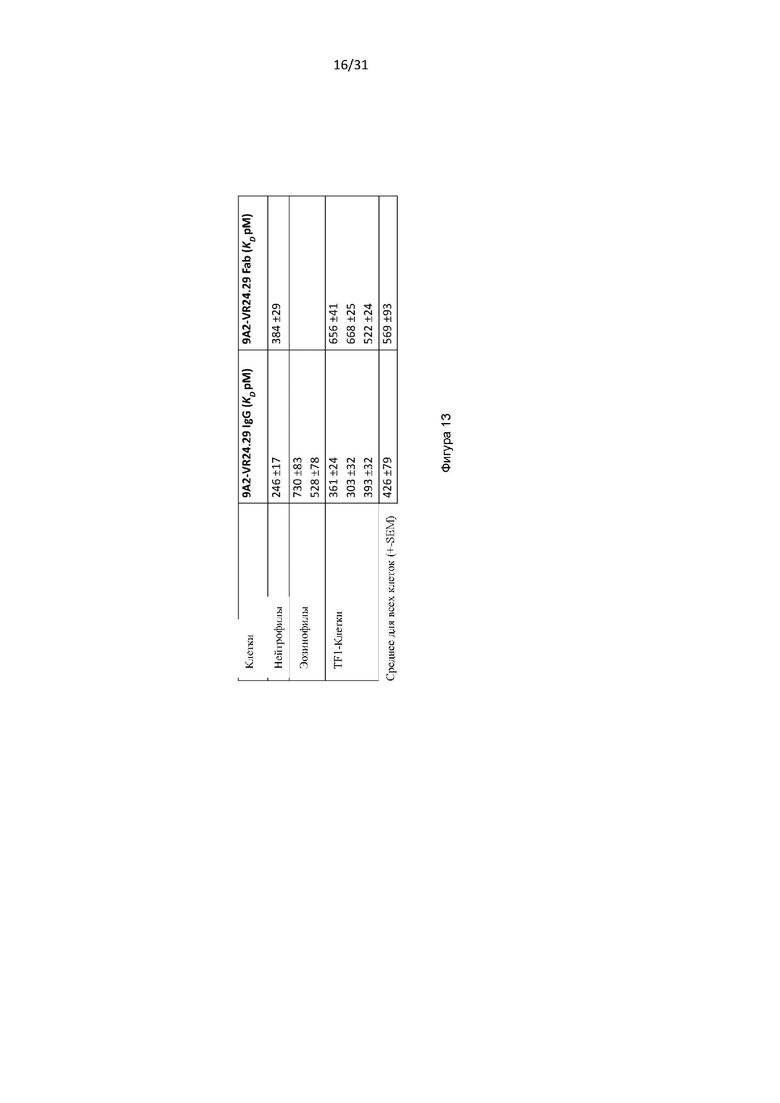
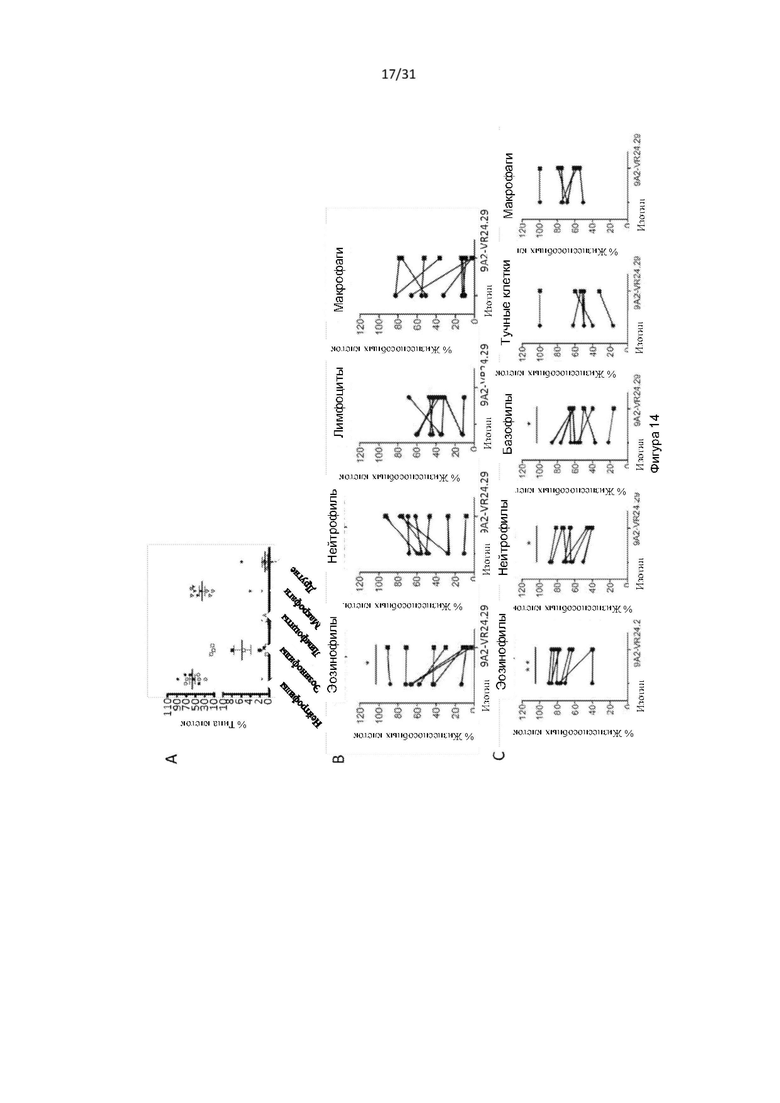
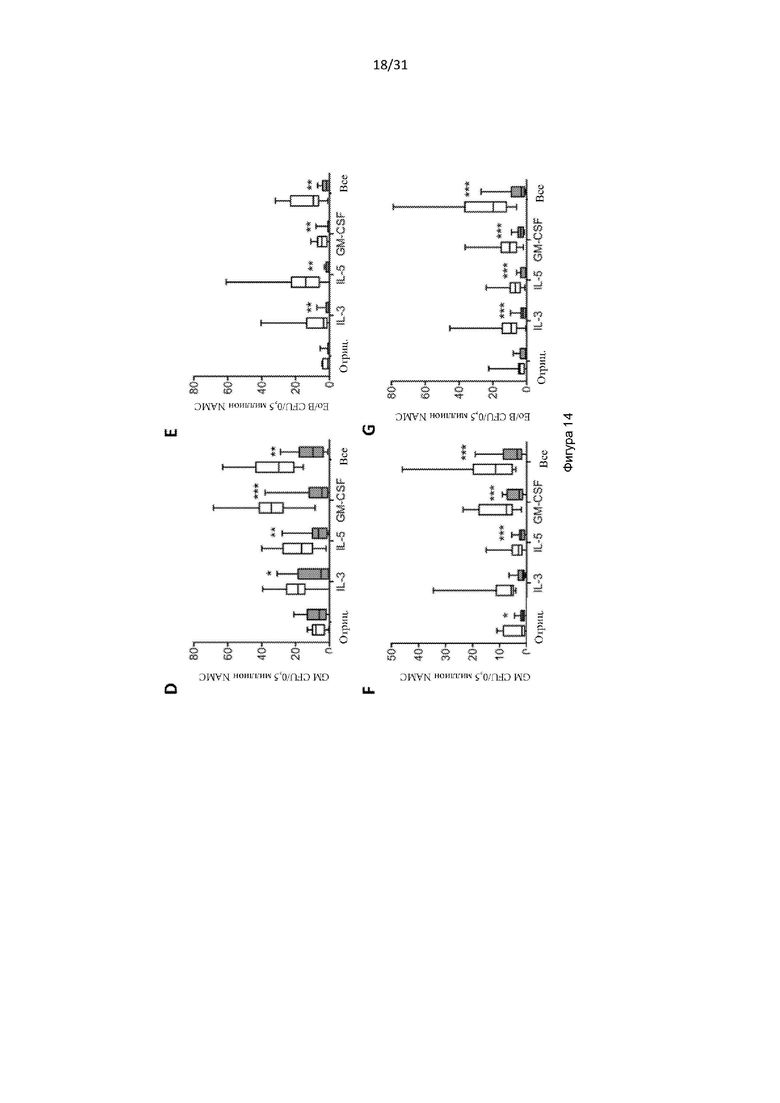
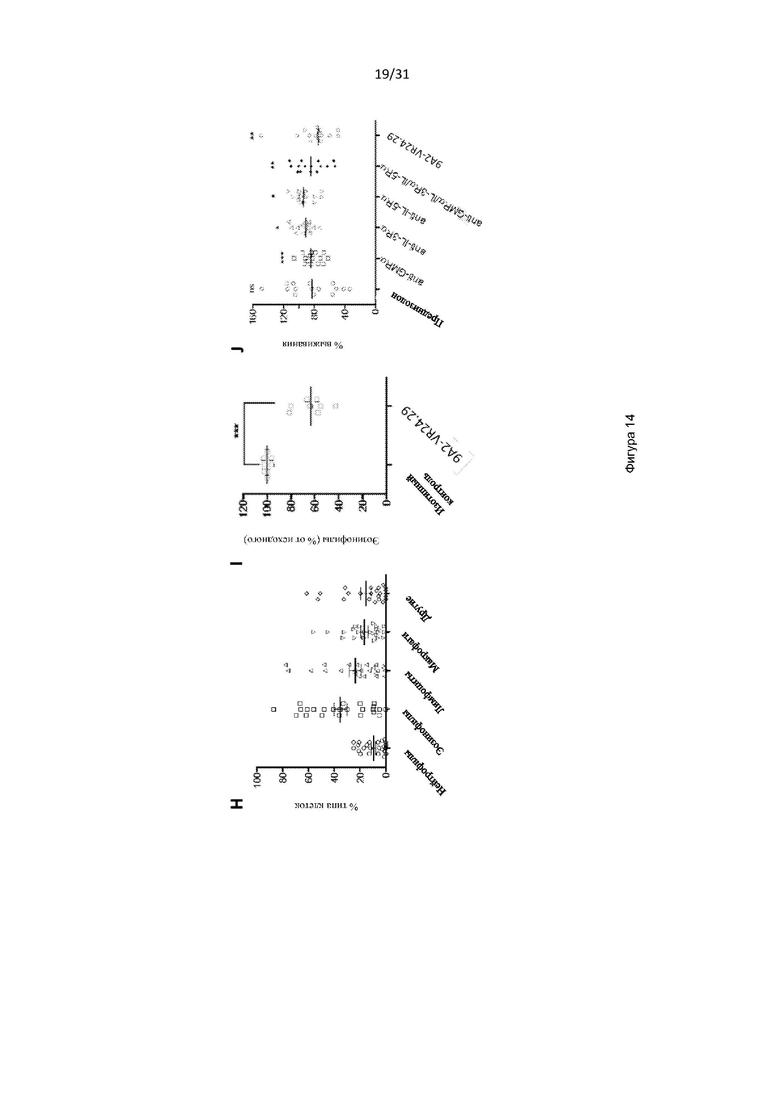
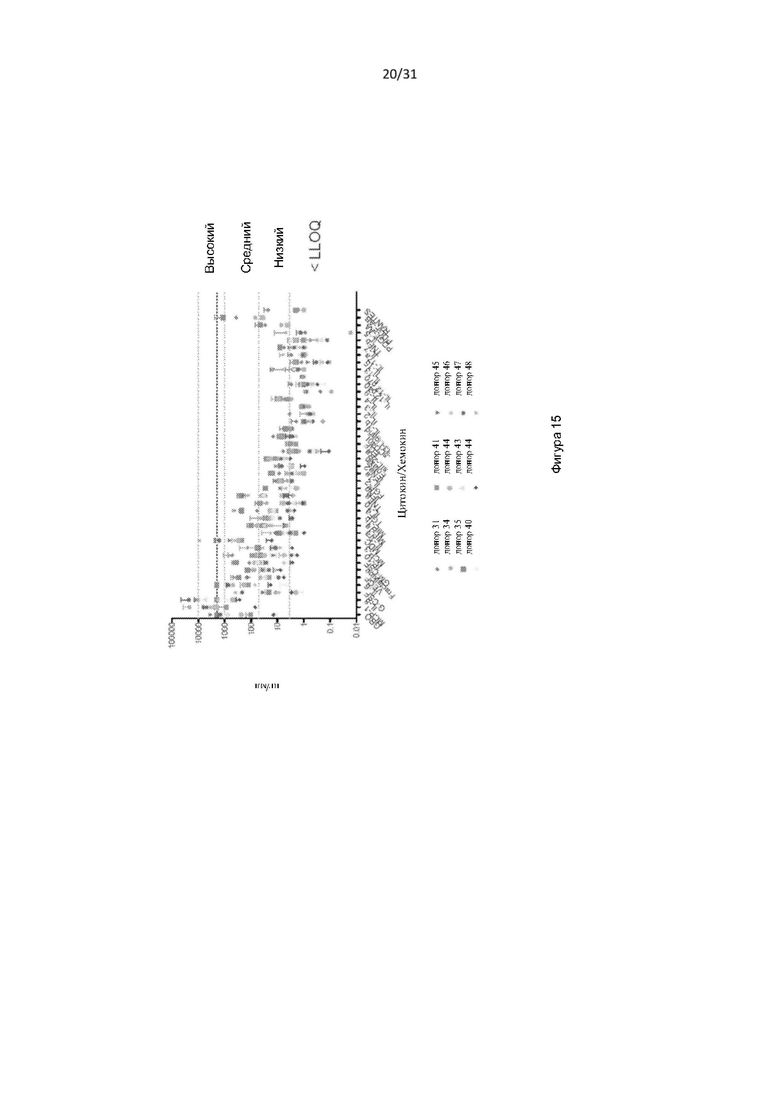
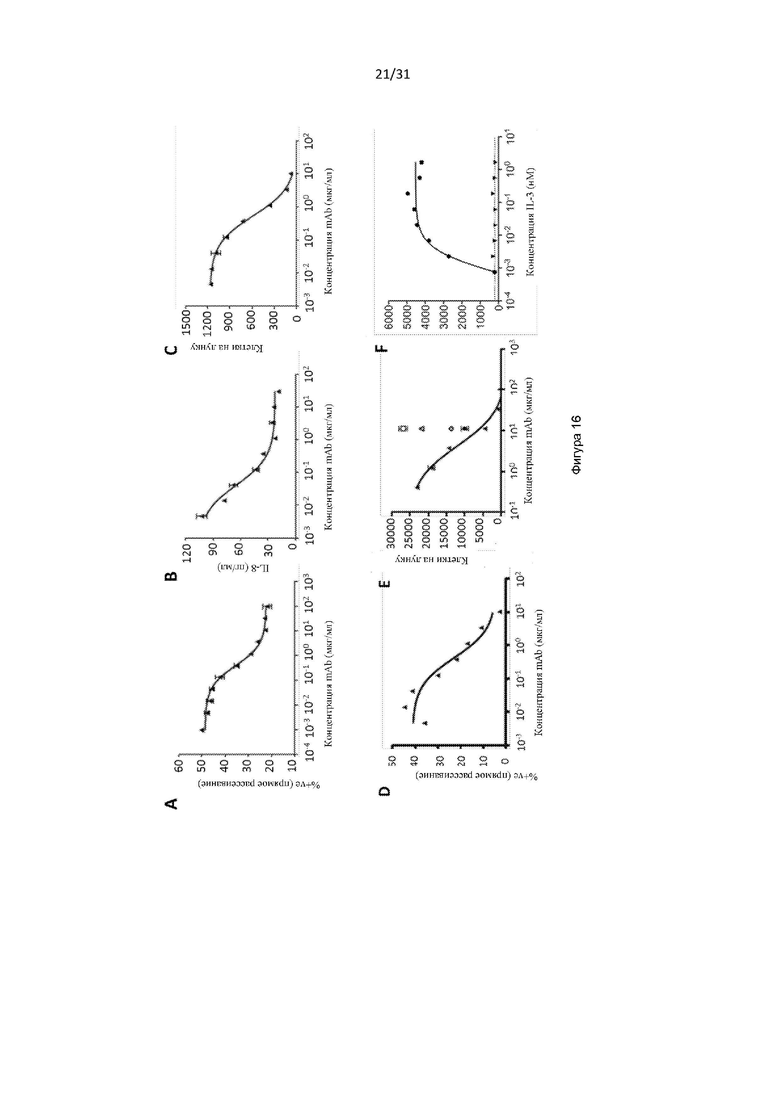
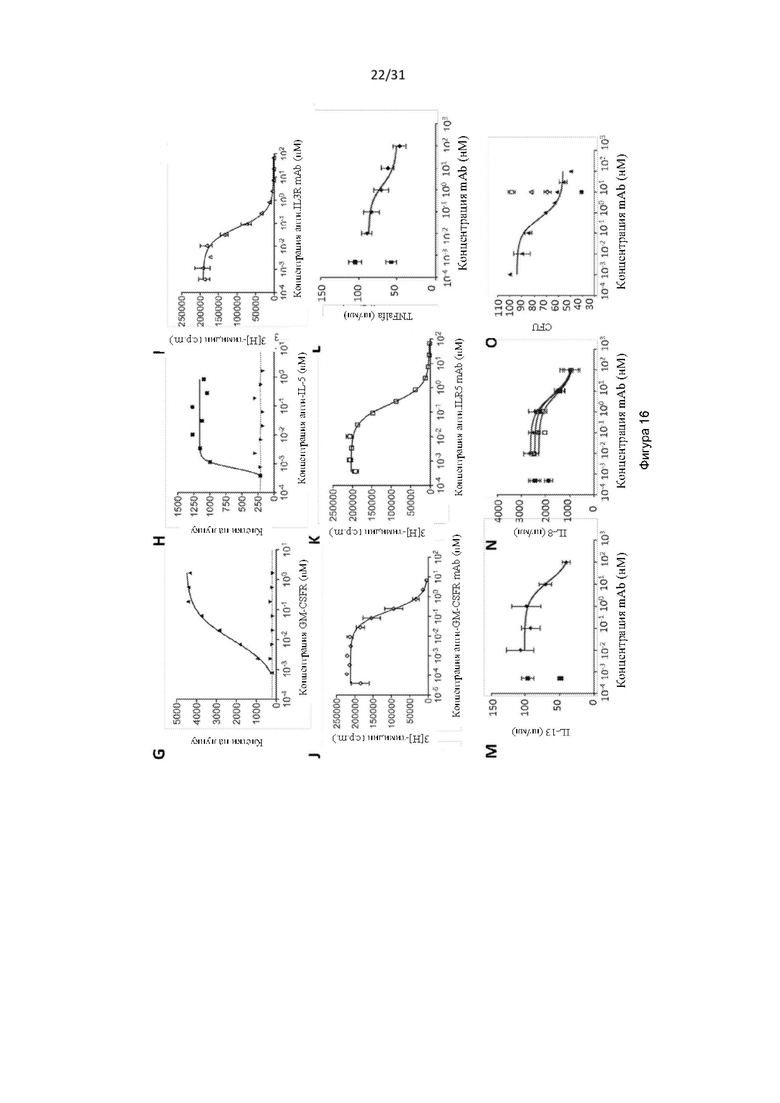
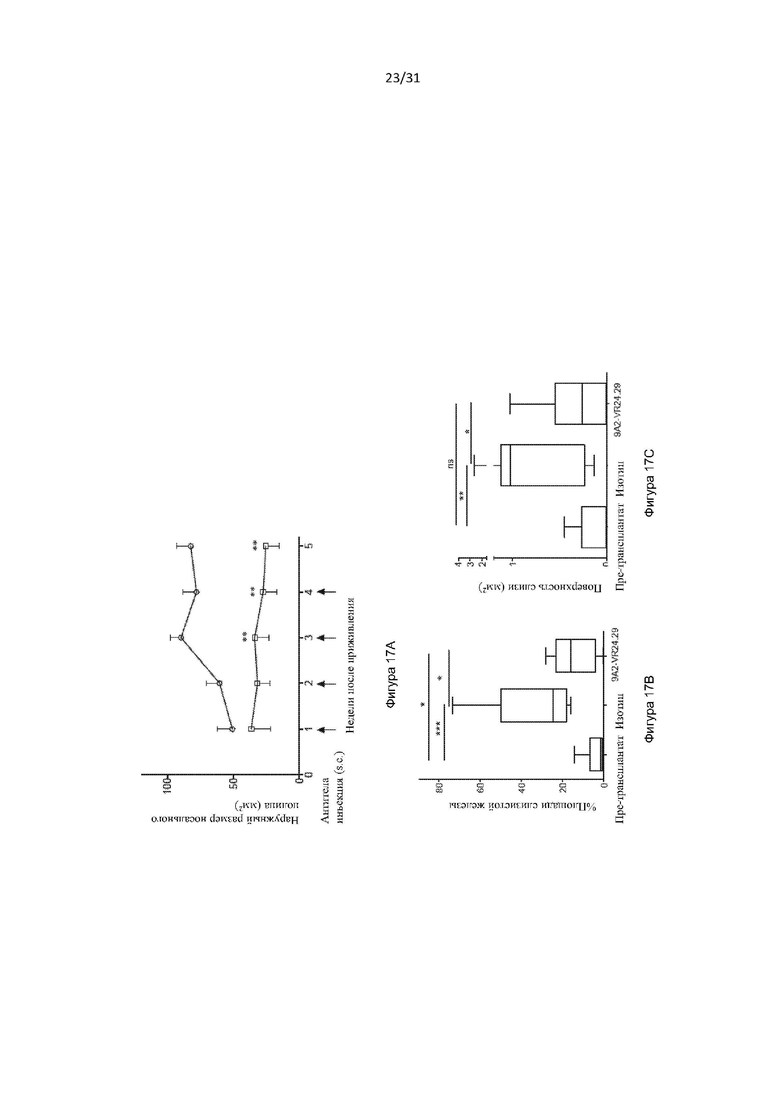
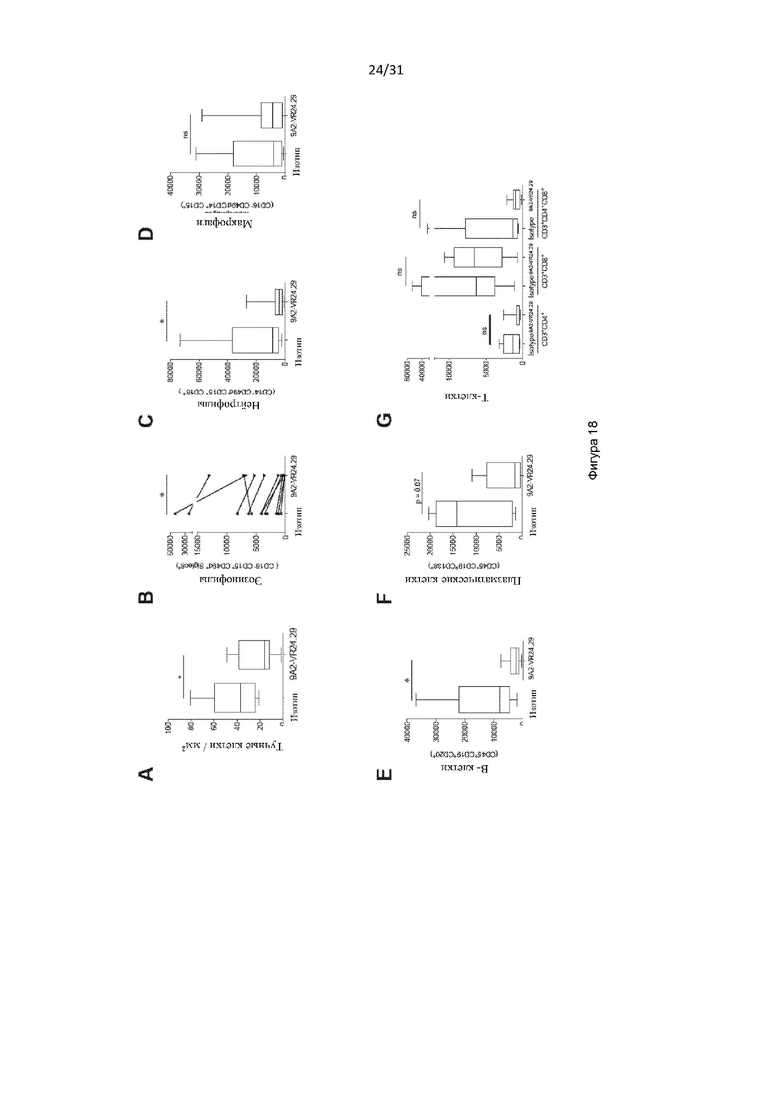
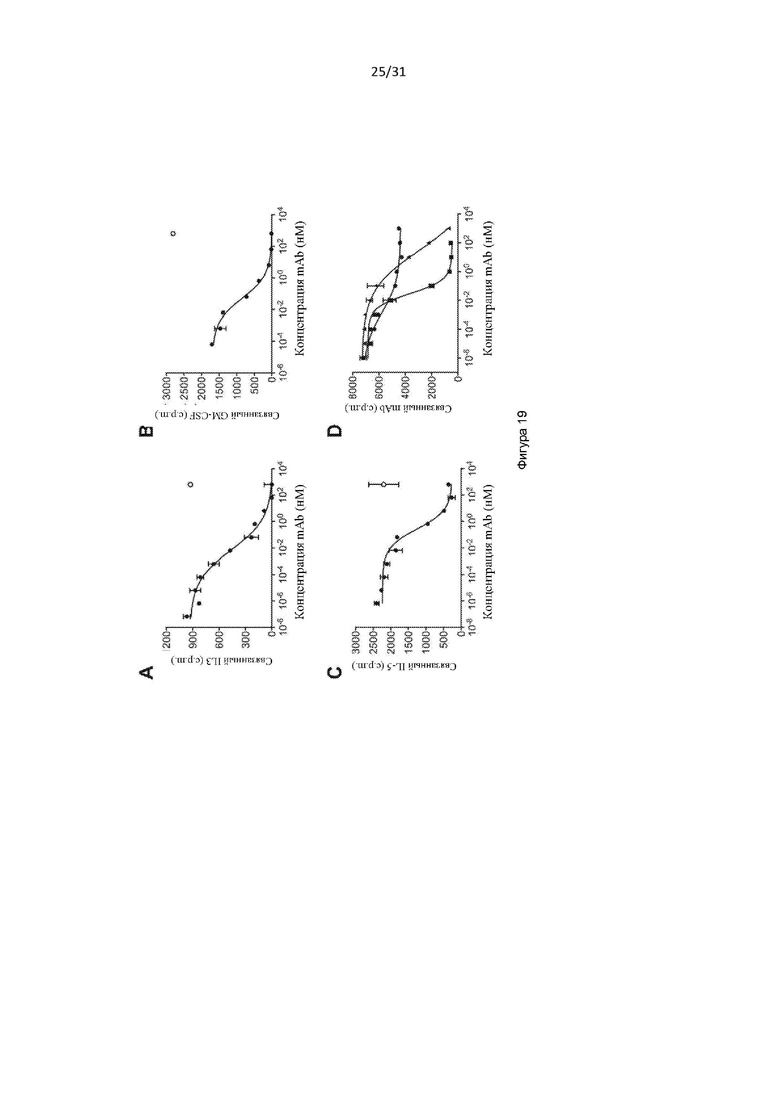
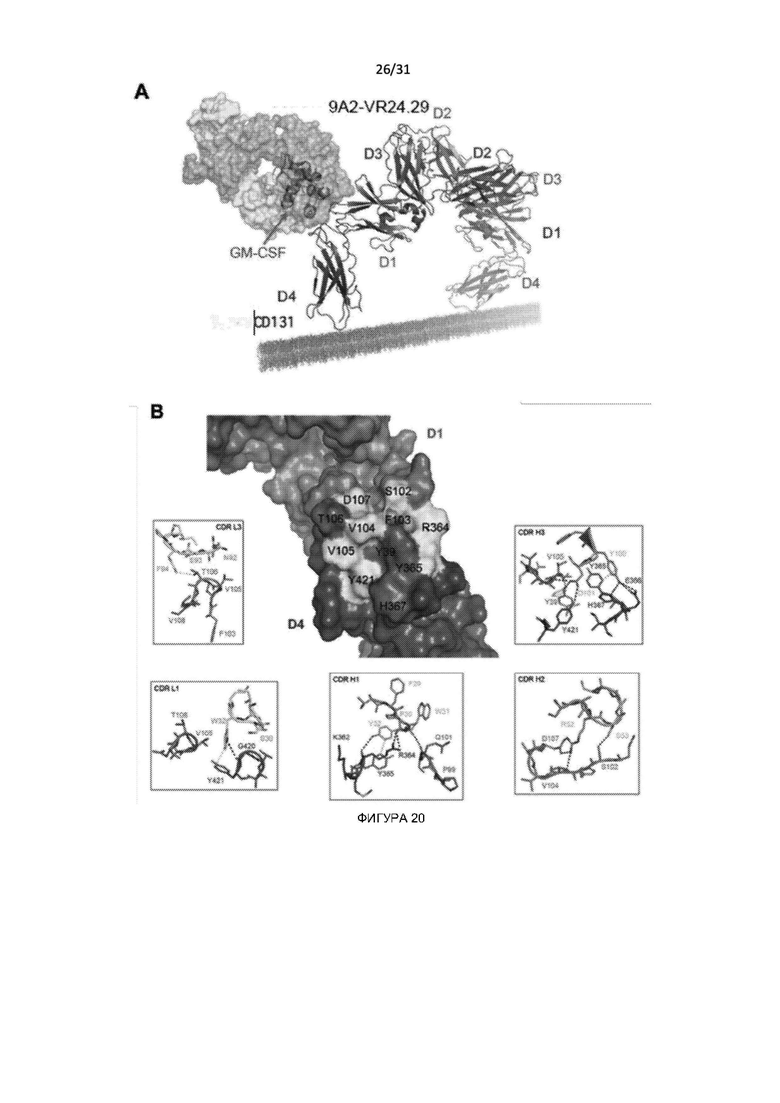

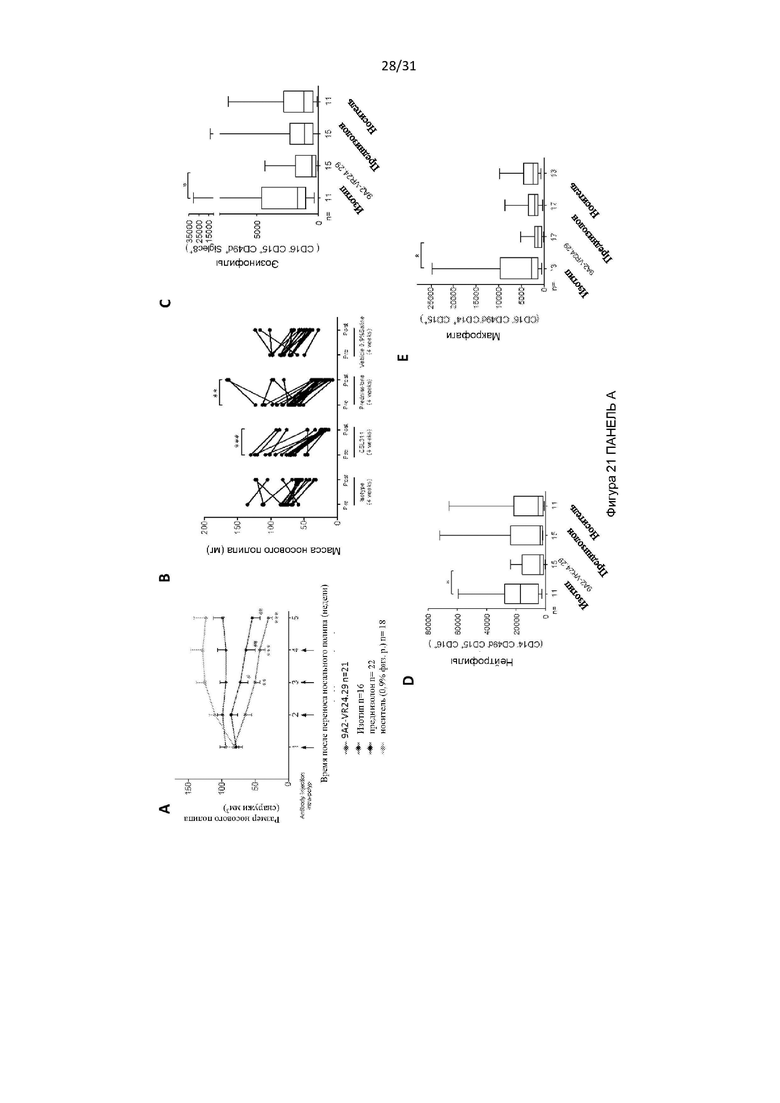
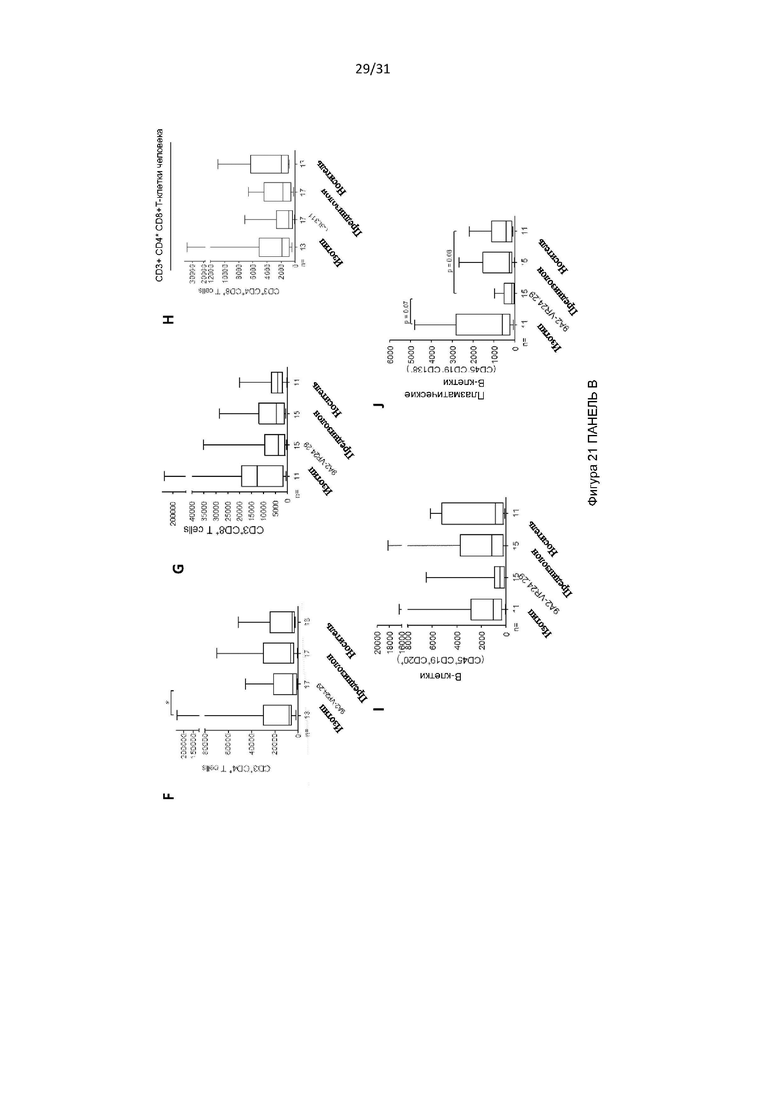

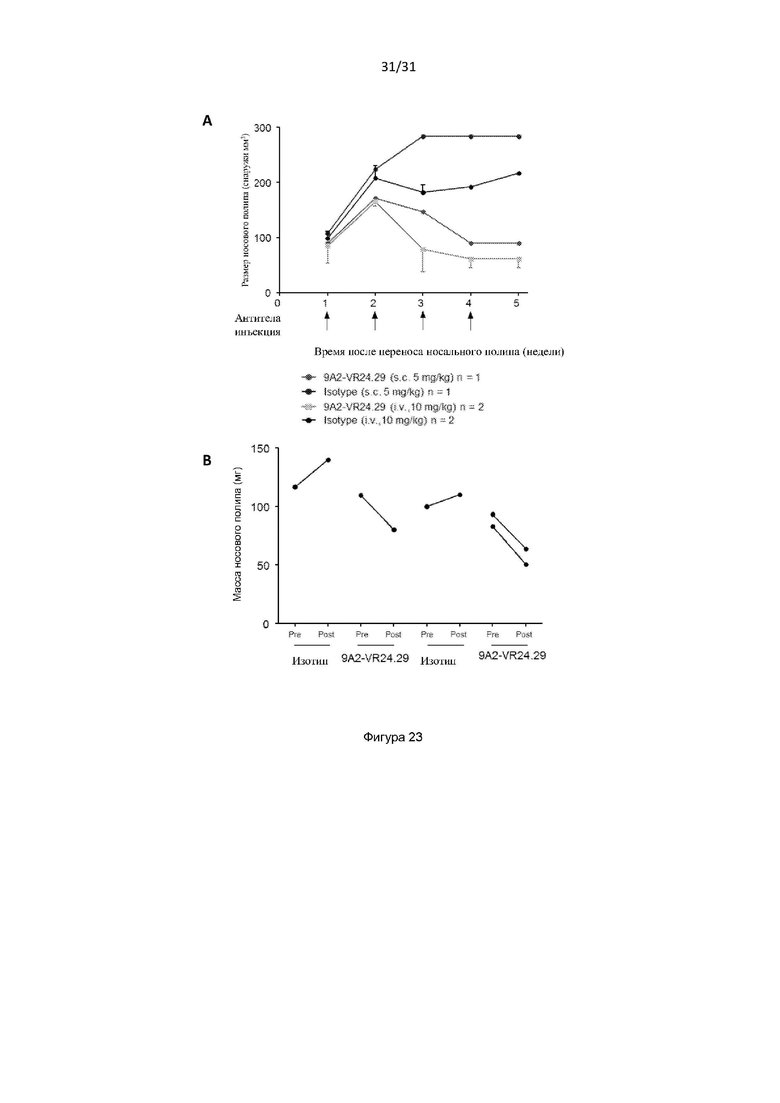
Изобретение относится к области биотехнологии, конкретно - к получению CD131-связывающего белка. Полученный CD131-связывающий белок представляет собой антитело и нейтрализует передачу сигналов интерлейкином 3 (IL-3), IL-5 и гранулоцитарно-макрофагальным колониестимулирующим фактором (GM-CSF). 4 н. и 5 з.п. ф-лы, 23 ил., 5 табл., 2 пр.
1. CD131-связывающий белок, содержащий антигенсвязывающий домен антитела, причем CD131-связывающий белок представляет собой антитело, которое специфически связывается с CD131, где указанный антигенсвязывающий домен:
(a) связывается или специфически связывается с эпитопом внутри сайта 2 CD131 и нейтрализует передачу сигнала посредством интерлейкина-3 (IL-3), интерлейкина-5 (IL-5) и гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF);
(b) связывается с эпитопом, образованным при димеризации двух полипептидов CD131; и
(c) связывается с остатками внутри домена 1 полипептида CD131 и с остатками внутри домена 4 другого полипептида CD131; и причем данный антигенсвязывающий домен содержит:
(i) вариабельную область тяжелой цепи (VH), содержащую области, определяющие комплементарность (CDR) 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и вариабельную область легкой цепи (VL), содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ii) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(iii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 6;
(iv) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 6;
(v) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 7;
(vi) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 7;
(vii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 8;
(viii) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 8;
(ix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 9;
(x) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 9;
(xi) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 10;
(xii) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 10;
(xiii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 11;
(xiv) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 11;
(xv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 12;
(xvi) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 12;
(xvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 13;
(xviii) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 13;
(xix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 14;
(xx) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 14;
(xxi) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 20, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 15;
(xxii) VH, содержащую последовательность, представленную в SEQ ID NO: 20, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 15;
(xxiii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 21, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 21, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 22, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 22, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 23, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 23, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 24, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxx) VH, содержащую последовательность, представленную в SEQ ID NO: 24, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxxi) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 25, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 25, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxxiii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 26, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 26, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxxv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 27, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 27, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxxvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 28, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 28, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(xxxix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 29, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xl) VH, содержащую последовательность, представленную в SEQ ID NO: 29, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(xli) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 30, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xlii) VH, содержащую последовательность, представленную в SEQ ID NO: 30, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(xliii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 31, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xliv) VH, содержащую последовательность, представленную в SEQ ID NO: 31, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(xlv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 32, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xlvi) VH, содержащую последовательность, представленную в SEQ ID NO: 32, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(xlvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 33, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xlviii) VH, содержащую последовательность, представленную в SEQ ID NO: 33, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(xlix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 34, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(l) VH, содержащую последовательность, представленную в SEQ ID NO: 34, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(li) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 35, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lii) VH, содержащую последовательность, представленную в SEQ ID NO: 35, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(liii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 36, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(liv) VH, содержащую последовательность, представленную в SEQ ID NO: 36, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(lv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 37, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lvi) VH, содержащую последовательность, представленную в SEQ ID NO: 37, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(lvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 38, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lviii) VH, содержащую последовательность, представленную в SEQ ID NO: 38, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(lix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 39, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(1x) VH, содержащую последовательность, представленную в SEQ ID NO: 39, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxi) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 40, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxii) VH, содержащую последовательность, представленную в SEQ ID NO: 40, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxiii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 41, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 41, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 42, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 42, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 43, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 43, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 44, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxx) VH, содержащую последовательность, представленную в SEQ ID NO: 44, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxi) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 45, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 45, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxiii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 46, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 46, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 47, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 47, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 48, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 48, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 49, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxx) VH, содержащую последовательность, представленную в SEQ ID NO: 49, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxxi) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 50, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 50, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxxiii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 51, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 51, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxxv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 52, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 52, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxxvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 53, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(lxxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 53, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(lxxxix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 54, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xc) VH, содержащую последовательность, представленную в SEQ ID NO: 54, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(xci) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 55, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xcii) VH, содержащую последовательность, представленную в SEQ ID NO: 55, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(xciii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 56, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xciv) VH, содержащую последовательность, представленную в SEQ ID NO: 56, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(xcv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 57, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xcvi) VH, содержащую последовательность, представленную в SEQ ID NO: 57, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(xcvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 58, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(xcviii) VH, содержащую последовательность, представленную в SEQ ID NO: 58, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(xcix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 59, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(c) VH, содержащую последовательность, представленную в SEQ ID NO: 59, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(ci) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 60, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cii) VH, содержащую последовательность, представленную в SEQ ID NO: 60, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(ciii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 61, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(civ) VH, содержащую последовательность, представленную в SEQ ID NO: 61, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 62, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cvi) VH, содержащую последовательность, представленную в SEQ ID NO: 62, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(сvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 63, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(сviii) VH, содержащую последовательность, представленную в SEQ ID NO: 63, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 64, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cx) VH, содержащую последовательность, представленную в SEQ ID NO: 64, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxi) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 65, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxii) VH, содержащую последовательность, представленную в SEQ ID NO: 65, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxiii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 66, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 66, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 67, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 67, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 68, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 68, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 69, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxx) VH, содержащую последовательность, представленную в SEQ ID NO: 69, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxi) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 70, и VL, содержащую последовательности CDR 1, 2 и 3 из, представленной в SEQ ID NO: 5;
(cxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 70, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxiii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 71, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 71, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 72, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 72, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 73, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 73, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 75, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxx) VH, содержащую последовательность, представленную в SEQ ID NO: 75, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxxi) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 76, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 76, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxxiii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 77, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 77, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxxv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 78, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 78, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxxvii) VH, содержащую последовательности CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 79, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 79, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxxxix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 80, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxl) VH, содержащую последовательность, представленную в SEQ ID NO: 80, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxli) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 81, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxlii) VH, содержащую последовательность, представленную в SEQ ID NO: 81, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxliii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 82, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxliv) VH, содержащую последовательность, представленную в SEQ ID NO: 82, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxlv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 83, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxlvi) VH, содержащую последовательность, представленную в SEQ ID NO: 83, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxlvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 84, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxlviii) VH, содержащую последовательность, представленную в SEQ ID NO: 84, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxlix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 85, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cl) VH, содержащую последовательность, представленную в SEQ ID NO: 85, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cli) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 86, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clii) VH, содержащую последовательность, представленную в SEQ ID NO: 86, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cliii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 87, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cliv) VH, содержащую последовательность, представленную в SEQ ID NO: 87, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(clv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 88, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clvi) VH, содержащую последовательность, представленную в SEQ ID NO: 88, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(clvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 89, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clviii) VH, содержащую последовательность, представленную в SEQ ID NO: 89, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(clix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 90, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clx) VH, содержащую последовательность, представленную в SEQ ID NO: 90, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxi) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 91, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxii) VH, содержащую последовательность, представленную в SEQ ID NO: 91, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxiii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 92, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 92, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 93, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 93, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 94, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 94, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 95, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxx) VH, содержащую последовательность, представленную в SEQ ID NO: 95, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxi) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 96, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 96, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxiii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 97, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 97, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 98, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 98, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 99, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 99, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 100, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxx) VH, содержащую последовательность, представленную в SEQ ID NO: 100, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxxi) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 101, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxxii) VH, содержащую последовательность, представленную в SEQ ID NO: 101, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxxiii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 102, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxxiv) VH, содержащую последовательность, представленную в SEQ ID NO: 102, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxxv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 103, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxxvi) VH, содержащую последовательность, представленную в SEQ ID NO: 103, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxxvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 104, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(clxxxviii) VH, содержащую последовательность, представленную в SEQ ID NO: 104, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(clxxxix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 105, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxc) VH, содержащую последовательность, представленную в SEQ ID NO: 105, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxci) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 106, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxcii) VH, содержащую последовательность, представленную в SEQ ID NO: 106, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxciii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 107, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxciv) VH, содержащую последовательность, представленную в SEQ ID NO: 107, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxcv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 108, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxcvi) VH, содержащую последовательность, представленную в SEQ ID NO: 108, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxcvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 109, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cxcviii) VH, содержащую последовательность, представленную в SEQ ID NO: 109, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cxcix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 110, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cc) VH, содержащую последовательность, представленную в SEQ ID NO: 110, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cci) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 111, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccii) VH, содержащую последовательность, представленную в SEQ ID NO: 111, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(cciii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 112, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(cciv) VH, содержащую последовательность, представленную в SEQ ID NO: 112, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccv) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 113, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccvi) VH, содержащую последовательность, представленную в SEQ ID NO: 113, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccvii) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 114, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccviii) VH, содержащую последовательность, представленную в SEQ ID NO: 114, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccix) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 115, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
(ccx) VH, содержащую последовательность, представленную в SEQ ID NO: 115, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5;
(ccxi) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 116, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5; или
(ccxii) VH, содержащую последовательность, представленную в SEQ ID NO: 116, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5.
2. CD131-связывающий белок по п. 1, причем указанный антигенсвязывающий домен:
(a) связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и причем CD131-связывающий белок ингибирует GM-CSF-индуцированную пролиферацию эритролейкозных клеток TF-1 с IC50, равной по меньшей мере 700 нМ; или
(b) связывается или специфически связывается с CD131 и нейтрализует передачу сигнала посредством IL-3, IL-5 и GM-CSF, и где CD131-связывающий белок связывается со всеми из следующих мутантных полипептидов:
(i) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 119;
(ii) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 123;
(iii) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 124;
(iv) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 135;
(v) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 131;
(vi) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 136;
(vii) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 137;
(viii) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 139;
(ix) мутантный полипептид, содержащий последовательность, представленную в SEQ ID NO: 145,
на уровне, который снижен по сравнению с уровнем связывания CD131-связывающего белка с полипептидом, содержащим последовательность, представленную в SEQ ID NO: 192.
3. CD131-связывающий белок по п. 1 или 2, причем указанный антигенсвязывающий домен связывается с полипептидом, содержащим последовательность, представленную в SEQ ID NO: 127, с большей аффинностью, чем он связывается с полипептидом, содержащим последовательность, представленную в SEQ ID NO: 192.
4. CD131-связывающий белок по п. 1 или 2, причем данный белок представляет собой антитело, содержащее:
(i) VH, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 64, и VL, содержащую CDR 1, 2 и 3 из последовательности, представленной в SEQ ID NO: 5;
или
(ii) VH, содержащую последовательность, представленную в SEQ ID NO: 64, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 5.
5. CD131-связывающий белок по п. 1 или 2, который обладает одним или более из следующих свойств:
(i) уменьшает или ингибирует активацию изолированных человеческих нейтрофилов посредством GM-CSF, как определяется уменьшением или ингибированием GM-CSF-индуцированного увеличения размера клеток нейтрофилов;
(ii) уменьшает или ингибирует IL-3-индуцированную секрецию IL-8 человеческими базофилами;
(iii) уменьшает или предотвращает IL-3-опосредованную выживаемость или плазмоцитоидные дендритные клетки (plasmacytoid dendritic cells (pDCs));
(iv) уменьшает или предотвращает активацию эозинофилов периферической крови человека посредством IL-5, как определяется оценкой изменения прямого рассеяния, оцененного проточной цитометрией;
(v) уменьшает или предотвращает выживаемость эозинофилов периферической крови человека в присутствии IL-5, и/или GM-CSF, и/или IL-3;
(vi) уменьшает или предотвращает IL-3-индуцированное высвобождение фактора некроза опухоли (tumor necrosis factor (TNF)) α из человеческих тучных клеток;
(vii) уменьшает или предотвращает IL-3-индуцированное высвобождение IL-13 из человеческих тучных клеток;
(viii) уменьшает или предотвращает потенцирование IgE-опосредованного высвобождения IL-8 из человеческих тучных клеток посредством IL-3, и/или IL-5, и/или GM-CSF;
(ix) уменьшает или предотвращает образование колониеобразующих единиц-гранулоцитов-макрофагов (CFU-GM) CD34+ клетками костного мозга человека, культивированными в присутствии фактора стволовых клеток (SCF), GM-CSF, IL-3 и IL-5.
6. CD131-связывающий белок по п. 1 или 2, в котором, если VH и VL находятся в одной полипептидной цепи, белок представляет собой:
(i) одноцепочечный фрагмент Fv (scFv);
(ii) димерный scFV(di-scFv);
(iii) один из (i) или (ii), связанный с константной областью антитела, Fc или константным доменом тяжелой цепи (CH)2 и/или CH3; или
(iv) один из (i) или (ii), связанный с белком, который связывается с иммунной эффекторной клеткой, или,
если VH и VL находятся в отдельных полипептидных цепях, белок представляет собой:
(i) диатело;
(ii) триотело;
(iii) тетратело;
(iv) Fab;
(v) F(ab’)2;
(vi) Fv;
(vii) один из от (i) до (vi), связанный с константной областью антитела, Fc или константным доменом тяжелой цепи (CH)2 и/или CH3;
(viii) один из от (i) до (vi), связанный с белком, который связывается с иммунной эффекторной клеткой; или
(ix) антитело.
7. Нуклеиновая кислота, кодирующая CD131-связывающий белок по любому из пп. 1-6.
8. Вектор экспрессии, содержащий нуклеиновую кислоту по п. 7.
9. Выделенная или рекомбинантная клетка для продуцирования CD131-связывающего белка, содержащая вектор экспрессии по п. 8.
| WO 2000009561 A1, 24.02.2000 | |||
| WO 2000047620 A1, 17.08.2000 | |||
| МИХЕЕВА К.О | |||
| и др., Роль полиморфизма генов интерлейкина-5 (-703) и рецептора к интерлейкину-5 (-80) в формировании эозинофилии крови при туберкулезе легких, Бюллетень сибирской медицины, 2012, V | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| SELLERI S | |||
| et al., GM-CSF/IL-3/IL-5 receptor common β chain (CD131) | |||
Авторы
Даты
2022-06-14—Публикация
2016-11-25—Подача