Изобретение относится к области аналитической химии, а именно к методу модификации сорбента на основе силикагеля, позволяющему разделять гидрофильные и гидрофобные низкомолекулярные соединения в биологических жидкостях. Изобретение может быть применено в области лабораторной диагностики, фармацевтического производства на этапах клинических и предклинических испытаний, а также в области судмедэкспертизы.
Основным способом хроматографического определения низкомолекулярных соединений в биологических жидкостях является использование метода высокоэффективной жидкостной хроматографии с хромато-масс-спектрометрическим детектором, работающим в режиме ионизации распылением в электрическом поле (патент РФ 2642593, G01N 33/48, опубл. 25.01.2018 г., патент РФ RU 2650968, G01N 33/49, опубл. 18.04.2018 г.)
Также для исходно летучих соединений и соединений, подвергнутых дериватизации, может быть использован метод газовой хроматографии с хромато-масс-спектрометрическим детектором (патент РФ 2622996, G01N 33/48, опубл. 21.06.2017 г., . Способ количественного определения салицилатов в плазме крови). Также возможно определение малых молекул в плазме крови методом высокоэффективной жидкостной хроматографии с использованием ультрафиолетового или диодноматричного детектора при условии предварительного осаждениея белков (патент РФ 2687493 C1, G01N 30/02, G01N 30/10, G01N 30/26, G01N 30/50, G01N 30/74, C07D 501/06, C07D 501/24, C07D 417/12, опубл. 14.05.2019 г., Способ определения цефотаксима методом обращенно-фазной высокоэффективной жидкостной хроматографии; патент РФ 2302632, G01N33/50, опубл. 10.07.2007, C2. Способ определения гистамина в плазме крови) или экстракции (патент РФ 2677341 C1, G01N33/50, G01N30/02, опубл. 16.01.2019 г., Способ определения содержания фумаровой и малеиновой кислот в плазме крови методом высокоэффективной жидкостной хроматографии). Недостатком способов, включающих использование масс-спектрометрического детектора, является высокая стоимость анализа, включающая затраты на оборудование и реактивы масс-спектрометрической чистоты, малый диапазон линейности детектора, а также необходимость использования внутреннего стандарта. Способы, включающие осаждение и очистку от белков увеличивают время пробоподготовки и расход реактивов.
Альтернативным способом хроматографического определения малых молекул в присутствии белковых молекул является использование колонок, наполненных сорбентом, не вступающим во взаимодействие с белковой матрицей пробы.
Известны сорбенты для хроматографии типа RAM (restricted access medium - среда с ограниченным доступом), позволяющие определять низкомолекулярные соединения в присутствии белков за счет того, что на внешней поверхности сорбента находятся полярные заряженные или нейтральные молекулы, отталкивающие белки (эксклюзия по заряду), в то время как на поверхности пор находятся функциональные группы, взаимодействующие с низкомолекулярными веществами, способными в них проникнуть (Faria H.D., Abrão L.C.C., Santos M.G., Barbosa A.F., Figueiredo E.C. New advances in restricted access materials for sample preparation: A review. Analytica Chimica Acta. 989/2017; US 4,855,054 A, B01D15/08, published 08.08.1989, Using liquid chromatography dual zone packing materials; US 7,208,093 B2, BO1D15/08, published 24.04.2007, Chromatographic two-layer particles). Недостатком данного вида сорбентов является многостадийный синтез, и ограничение по размеру модификатора внутренней поверхности пор.
Также известны сорбенты типа SPS (Semi-permeable surface - полупроницаемая поверхность), позволяющие определять низкомолекулярные соединения в присутствии белков за счет того, что молекулы, модифицирующие поверхность сорбента, создают внешний слой, не позволяющий белкам проникнуть в образующиеся квази-поры за счет стерических затруднений или эксклюзии по заряду.
К данному типу относится сорбент для разделения биологических жидкостей (CCCР 1788463A1, G01N 30/48 B01J 20/10, опубл. 15.01.1993 г., Способ получения сорбента для разделения биологических жидкостей). Данный сорбент получают последовательной обработкой кремнезема с диаметром пор 6-10 нм кремнийорганическим модификатором и биологическими молекулами, в качестве биологических молекул применяют молекулы белков с молекулярной массой 40-90 тыс. дальтон, обработку проводят в буферном растворе вблизи изоэлектрической точки используемых белков, образующиеся глобулы которых имеют диаметр 9-15 нм, а для закрепления биологических молекул на поверхности используют глутаровый альдегид. Недостатком данного сорбента является невозможность определения гидрофильных соединений в биологических жидкостях, разделение низкомолекулярных соединений, отличающихся только гидрофильными функциональными группами, а также ограничения по количеству органического растворителя в буфере и рабочего диапазона pH с целью избежать преципитацию белков неподвижной фазы. Аналогичными недостатками обладают сорбенты, приведенные в статьях (Takeda N, Niwa T, Maeda K, Shibata M, Tatematsu A. Rapid assay for indoxyl sulphate in uremic serum by internal-surface reversed-phase high-performance liquid chromatography. Journal of chromatography, 431(2)/1988, Perry J.A., Invergo B., Wagner H., Szczerba T.J., Rateike J.D., An Improved Internal Surface Reversed Phase, Journal of Liquid Chromatography, 15/1992).
Коммерческим аналогом сорбента наполнена колонка Regis, SPS-5PM-S5-100 ODS (Regis Technologies, site: www.registech.com/ram-semi-permeable-surface-sps). К поверхности силикагеля привит октадецилсилил и полиэтиленгликоль. Полиэтиленгликоль образует внешний слой, затрудняющий проникновение биологических молекул, низкомолекулярные соединения удерживаются по обращенно-фазовому механизму. Основным недостатком данного изобретения является невозможность анализа гидрофильных соединений. Помимо этого, октадецилсилил и полиэтиленгликоль привиты независимо друг от друга, что уменьшает плотность прививки, что приводит к снижению емкости и гидролитической устойчивости.
Прототипом является сорбент, описанный в работе (Haginaka, J., Wakai, J., Yasuda, H., Synthesis of mixed-functional-phase silica supports for liquid chromatography and their applications to assays of drugs in serum. Journal of chromatography, 535/1990). К силанольным группам сорбента на основе силикагеля прививают 3-глицидоксипропил, после чего к непрореагировавшим группам прививают фенил-, бутил-, или октилсилан и проводят гидролиз оксиранового цикла с образованием диольных групп. Таким образом, фенил-, бутил- и октилсиланы на поверхности препятствуют связыванию белков с гидрофильными диольными группами, низкомолекулярные гидрофильные и гидрофобные соединения, в свою очередь, беспрепятственно взаимодействуют по гидрофильному и гидрофобному механизмам с неподвижной фазой колонки. Недостатком прототипа также является сниженная в сравнении с существующими фазами плотность прививки и плохая воспроизводимость соотношения дезоксиглицирил:алкил на поверхности.
Техническим результатом заявленного изобретения является создание сорбента для разделения низкомолекулярных соединений, обладающих гидрофильными группами, а также гидрофобных низкомолекулярных соединений в присутствии белков и крупных гидрофильных молекул, содержащихся в биологических жидкостях (плазма крови, моча, тканевая жидкость) без предварительной пробоподготовки, что уменьшает время анализа.
Поставленная задача решается тем, что хроматографический сорбент для анализа низкомолекулярных соединений в биологических жидкостях для жидкостной хроматографии, получен взаимодействием силанольных групп на поверхности силикагеля с модификаторами с последующим образованием полупроницаемой мембраны, отличающийся тем, что в качестве модификатора используют аминоалкилдиэтоксисилан или аминоалкилтрихлорсилан с последующим присоединением глицидилового эфира карбоновой кислоты, содержащей не менее 5 атомов углерода, сопровождающимся гидролизом оксиранового цикла.
Предложенная структура поверхности сорбента на основе силикагеля отличается тем, что хроматографическая колонка, заполненная данным сорбентом, позволяет анализировать гидрофильные, гидрофобные, нейтральные и заряженные низкомолекулярные соединения в присутствии белков плазмы. Также структура модификатора устойчива к изменениям pH и содержанию модификатора в подвижной фазе. Колонка совместима с такими органическими растворителями, как ацетонитрил, метанол, этанол, изопропиловый спирт и тетрагидрофуран. В отличие от прототипа, к поверхности сорбента прививается молекула, обладающая гидрофобной и гидрофильной частью, в результате чего не снижается плотность прививки. Заявленный способ синтеза состоит из 4 этапов:
1. Подготовка сорбента на основе силикагеля.
Обжиг силикагеля проводится муфельной печи в течение 10-12 часов при температуре в диапазоне 500-700°С. После проводится гидратация силикагеля в среде 0,1 M соляной кислоты с последующей сушкой в сушильном шкафу при 100-140°С в течение 2-4 часов, в результате чего на поверхности силикагеля увеличивается количество силанольных групп.
2. Прививка к силикагелю линкера, содержащего аминогруппу.
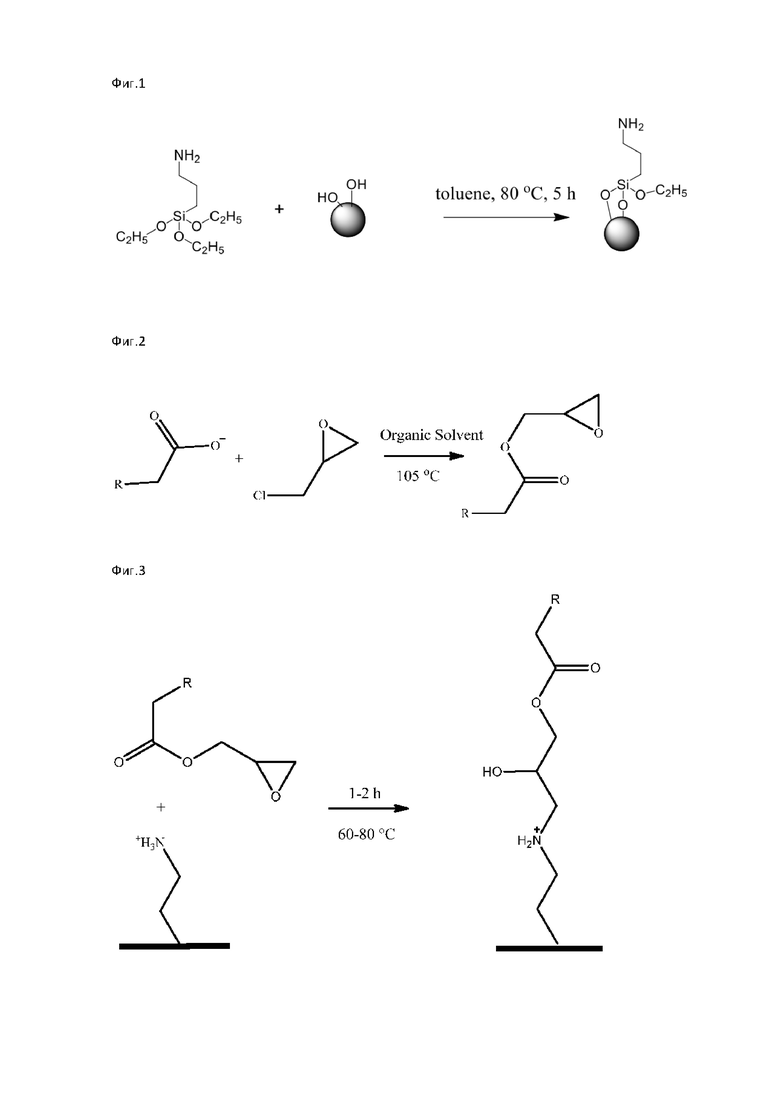
Аминоалкилтриэтоксисилан или аминоалкилтрихлорсилан взаимодействует с силанольными группами на поверхности силикагеля с образованием ковалентных связей Si-C (фиг. 1). Реакцию проводят в среде толуола при 80°С в течение 5 часов. После чего производят наполнение сорбентом корпуса хроматографической колонки. Набивка сорбента проводится мокрым методом.
3. Синтез глицидилового эфира карбоновой кислоты с количеством атомов углерода не менее 5 (далее кислота).
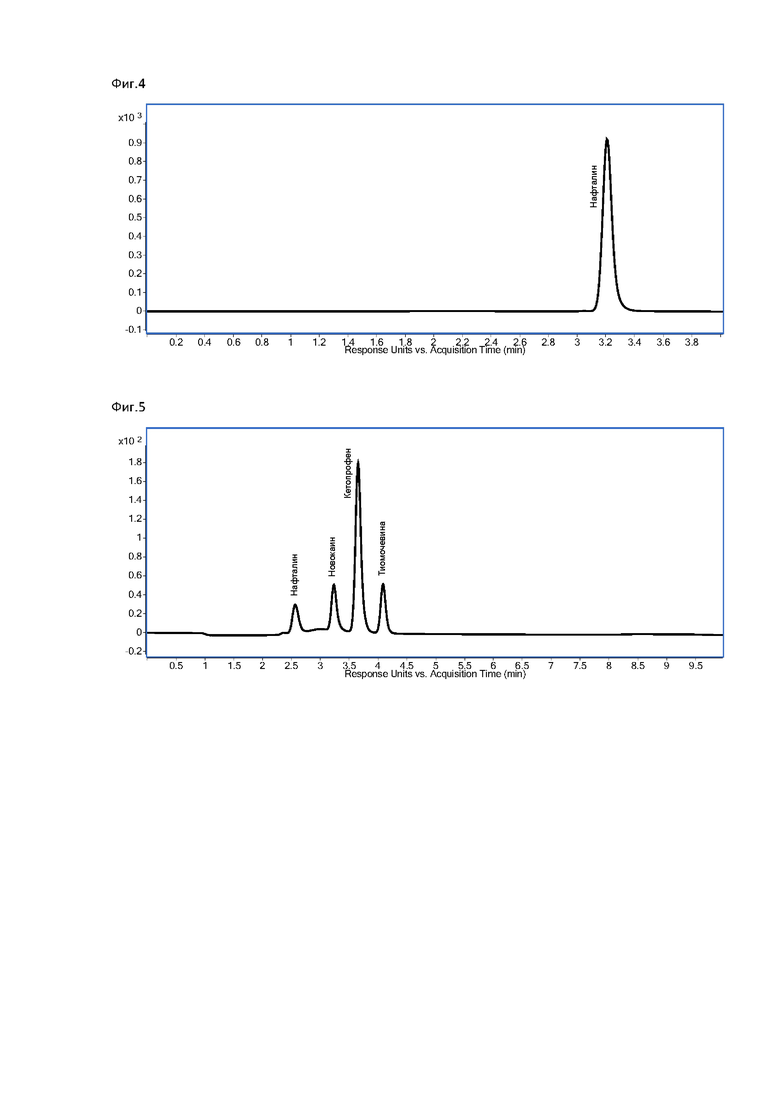
Синтез глицидилового эфира проводится в среде органического растворителя при температуре от 50 до 110°С. Для синтеза используются 99% эпихлоргидрин и соль карбоновой кислоты А или 99% эпихлоргидрин и карбоновая кислота А с добавлением гидроксидов или карбонатов щелочных металлов, гидроксидов щелочноземельных металлов, алкоголятов щелочных или щелочноземельных металлов; солей аммония и солей фосфония в качестве катализатора. После завершения синтеза смесь продуктов реакции фильтруют и промывают горячей дистиллированной водой. Схема реакции представлена на фиг. 2.
4. N-алкилирование.
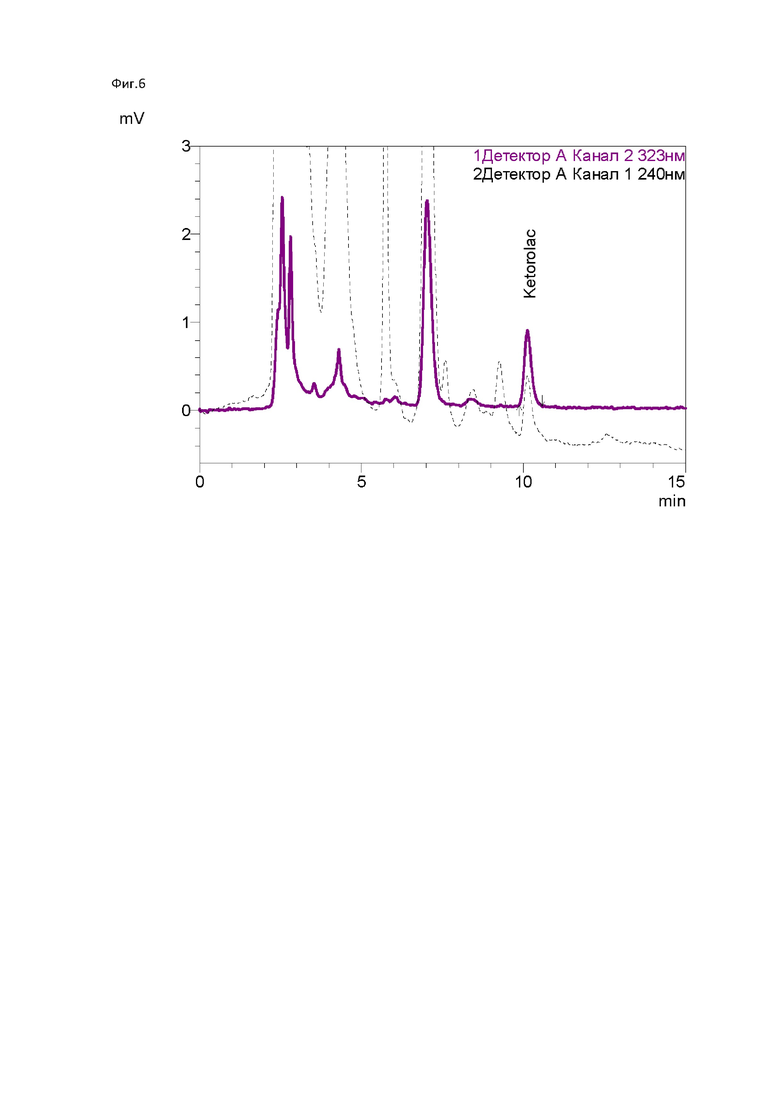
Высушенный продукт перерастворяют в подходящем органическом растворителе (например, смеси толуол-тетрагидрофуран) и пропускают раствор через сорбент в течение 1-2 часов при температуре 60-80°С. После чего промывают колонку изопропиловым спиртом с целью смыть непрореагировавший модификатор. Конечная структура поверхности сорбента представлена на фиг. 3.
Пример осуществления изобретения.
Провели обжиг 5 г силикагеля с диаметром зерна сорбента 5 мкм при температуре 550°С в течение 12 часов в фарфоровом тигле. После остывания тигля к силикагелю прилили 6 мл 0,1 M соляной кислоты, сушили при 105°С в сушильном шкафу в течение 2,5 часов до полного осушения. После чего силикагель хроматографической чистоты поместили в стакан объемом 400 мл, добавили 2,652 г аминпропилтриэтоксисилана в пересчете на чистое вещество, 200 мл толуола и перемешивали при температуре 80°С в течение 5 часов. После произвели наполнение корпуса колонки 250×4,6 мм мокрым способом.
Для синтеза глицидилового эфира в трехгорлую колбу на 50 мл перенесли 6,96 г пальмитата натрия, внесли 50 мл диметилформамида, покапельно добавляли 2,2 мл эпихлоргидрина 99% при постоянном перемешивании и температуре 95-105°С в течение 5 часов. После смесь продуктов реакции отфильтровали и промыли 100 мл дистиллированной воды при 60°С, высушили под вакуумом до постоянной массы. Масса продукта синтеза составила 1,51 г.
Продукт перерастворили в смеси толуол-тетрагидрофуран (1:1), пропускали раствор через наполненную сорбентом колонку в течение 1 часа при температуре 80°С.
Демонстрация селективности
Колонка, наполненная разработанным сорбентом, может работать в обращенном, гидрофильном, ионообменном и эксклюзионном режимах. Удерживание по механизму гидрофобных взаимодействий продемонстрировано на фиг. 4. Время удерживания нафталина составило 3,21 мин при изократическом элюировании смеси ацетонитрил - вода в объемном соотношении 85:15 при потоке 1 мл/мин.
Удерживание по смешанному механизму гидрофобных взаимодействий и ионного обмена продемонстрировано на фиг. 5. В качестве элюента использована смесь ацетонитрил - 20мМ фосфатный буфер (2,5 pH) в соотношении 75:25. Поток 1 мл/мин. В данных условиях гидрофобные взаимодействия подавлены, следовательно, нафталин выходит в мертвое время, новокаин и тиомочевина удерживаются за счет гидрофильных взаимодействий, а кетопрофен - за счет анионного обмена.
Также продемонстрирована возможность разделения гидрофильных молекул в присутствии белков плазмы крови. Модельный раствор содержал плазму крови и кеторолак в субтерапевтической концентрации 0,1 мкг/мл. Анализ произведен в режиме изократического элюирования смесью ацетонитрил-10 мМ раствор NH4H2PO4 в соотношении 85:25 при объеме потока 1 мл/мин. Объем инжекции составил 100 мкл, селективная длина волны - 323 нм. Разделение продемонстрировано на фиг. 6. Белки удерживаются по механизму эксклюзии по размеру, кеторолак - по механизму ионного обмена. Таким образом, разработанный сорбент может быть использован для анализа гидрофильных, гидрофобных, нейтральных или заряженных низкомолекулярных соединений в плазме крови.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения сорбента для разделения биологических жидкостей | 1991 |
|
SU1788463A1 |
| СОРБЕНТ ДЛЯ ОПРЕДЕЛЕНИЯ СОЕДИНЕНИЙ ИОННОЙ И ГИДРОФИЛЬНОЙ ПРИРОДЫ | 2016 |
|
RU2638660C1 |
| Способ получения сорбента для разделения биологических жидкостей жидкостной хроматографией | 1987 |
|
SU1478112A1 |
| Способ количественного определения амиодарона в плазме крови человека | 2024 |
|
RU2835337C1 |
| СОРБЕНТ ДЛЯ ОПРЕДЕЛЕНИЯ СОЕДИНЕНИЙ ГИДРОФИЛЬНОЙ ПРИРОДЫ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2019 |
|
RU2730316C1 |
| СОРБЕНТ ДЛЯ РАЗДЕЛЕНИЯ ОПТИЧЕСКИХ ИЗОМЕРОВ ВЕЩЕСТВ И ИХ АНАЛИЗА В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ МЕТОДОМ ВЭЖХ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2014 |
|
RU2592893C2 |
| Способ определения противосудорожных препаратов в биологических жидкостях | 1987 |
|
SU1476377A1 |
| СПОСОБ ОЧИСТКИ РЕКОМБИНАНТНОГО БЕЛКА | 2020 |
|
RU2832283C1 |
| Способ количественного определения биоцидного азотсодержащего органического соединения гидразида изоникотиновой кислоты (изониазида) в водном растворе этого соединения | 2016 |
|
RU2633080C2 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ВЫСОКОЭФФЕКТИВНЫХ КОЛОНОК ДЛЯ ИОННОЙ ХРОМАТОГРАФИИ | 2012 |
|
RU2499628C2 |
Изобретение относится к методам модификации сорбента на основе силикагеля, позволяющего разделять гидрофильные и гидрофобные низкомолекулярные соединения в биологических жидкостях. Предложен хроматографический сорбент для анализа низкомолекулярных соединений в биологических жидкостях для жидкостной хроматографии, получаемый взаимодействием силанольных групп на поверхности силикагеля с модификаторами с последующим образованием полупроницаемой мембраны. В качестве модификатора используют аминоалкилдиэтоксисилан или аминоалкилтрихлорсилан с последующим присоединением глицидилового эфира карбоновой кислоты, содержащей не менее 5 атомов углерода, сопровождающимся гидролизом оксиранового цикла. Технический результат - создание сорбента для разделения низкомолекулярных соединений, обладающего гидрофильными группами, а также гидрофобных низкомолекулярных соединений в присутствии белков и крупных гидрофильных молекул, содержащихся в биологических жидкостях (плазма крови, моча, тканевая жидкость) без предварительной пробоподготовки, что уменьшает время анализа. 6 ил., 1 пр.
Хроматографический сорбент для анализа низкомолекулярных соединений в биологических жидкостях для жидкостной хроматографии, получаемый взаимодействием силанольных групп на поверхности силикагеля с модификаторами с последующим образованием полупроницаемой мембраны, отличающийся тем, что в качестве модификатора используют аминоалкилдиэтоксисилан или аминоалкилтрихлорсилан с последующим присоединением глицидилового эфира карбоновой кислоты, содержащей не менее 5 атомов углерода, сопровождающимся гидролизом оксиранового цикла.
| Haginaka J., Wakai J., Yasuda H | |||
| Synthesis of mixed-functional-phase silica supports for liquid chromatography and their applications to assays of drugs in serum | |||
| Journal of Chromatography A, 1990, vol.535, pp.163-172 | |||
| СОРБЕНТ ДЛЯ ОПРЕДЕЛЕНИЯ СОЕДИНЕНИЙ ГИДРОФИЛЬНОЙ ПРИРОДЫ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2019 |
|
RU2730316C1 |
| Способ получения сорбента для разделения биологических жидкостей | 1991 |
|
SU1788463A1 |
| Perry J.A | |||
| et al | |||
| An Improved Internal Surface Reversed Phase | |||
| Journal of | |||
Авторы
Даты
2024-04-23—Публикация
2023-05-29—Подача