Техническая область изобретения
Настоящее изобретение относится к микроорганизму, продуцирующему L-аминокислоту с разветвленной цепью, обладающему усиленной активностью регулятора ацетатного метаболизма А, и способу получения L-аминокислоты с разветвленной цепью с его использованием.
Предшествующий уровень техники
L-Аминокислоты в качестве основных структурных единиц белков используются в качестве основных ингредиентов фармацевтических препаратов, пищевых добавок, кормов для животных, питательных добавок, пестицидов, дезинфицирующих веществ и т.п. В частности, для аминокислот с разветвленной цепью (ВСАА) в качестве обобщающего термина для незаменимых аминокислот L-валина, L-лейцина и L-изолейцина известны антиоксиданые действия и действия, непосредственно способствующие синтезу белка в мышечных клетках.
Тем не менее, получение аминокислот с разветвленной цепью с использованием микроорганизмов в основном осуществляется с использованием микроорганизмов рода Escherichia или микроорганизмов рода Corynebacterium, и известно, что аминокислоты с разветвленной цепью получают при помощи биосинтеза с использованием 2-кетоизокапроата в качестве предшественника из пировиноградной кислоты посредством различных стадий (US 10316297 В2, US 10526586 В2, и US 10072278 В2). Тем не менее, получение L-аминокислот с разветвленной цепью с использованием микроорганизмов имеет проблему, заключающуюся в том, что массовое получение в промышленном масштабе затруднительно.
Описание изобретения
Техническая проблема
При указанном предшествующем уровне техники, в качестве результата интенсивных попыток усилить способность продуцировать L-аминокислоты с разветвленной цепью с использованием микроорганизмов, авторы настоящего изобретения обнаружили, что способность продуцировать L-аминокислоты с разветвленной цепью значительно увеличивается за счет увеличения у микроорганизмов экспрессии регулятора ацетатного метаболизма А (далее называемого как RamA), таким образом, завершив настоящее изобретение.
Техническое решение
Задача настоящего изобретения заключается в том, чтобы предложить микроорганизм, продуцирующий L-аминокислоту с разветвленной цепью, обладающий усиленной активностью регулятора ацетатного метаболизма А.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить микроорганизм, продуцирующий L-аминокислоту с разветвленной цепью, включающей полинуклеотид, обладающий промоторной активностью и содержащий замену нуклеотида на другой нуклеотид в одном или более чем одном из соответствующих положений, выбранных из положений 34-го, 36-го, 37-го, 41-го и 43-го нуклеотидов нуклеотидной последовательности, представленной в SEQ ID NO: 1.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить способ получения L-аминокислоты с разветвленной цепью, где способ включает выращивание микроорганизма в культуральной среде.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить полинуклеотид, обладающий промоторной активностью и содержащий замену нуклеотида на другой нуклеотид в одном или более чем одном из соответствующих положений, выбранных из положений 34, 36, 37, 41 и 43 нуклеотидной последовательности, представленной в SEQ ID NO: 1.
Благоприятные эффекты
L-аминокислоты с разветвленной цепью могут быть получены с высокими выходами путем выращивания микроорганизма, продуцирующего L-аминокислоту с разветвленной цепью, содержащего полинуклеотид в соответствии с настоящим изобретением.
Кроме того, аминокислоты, полученные при помощи настоящего изобретения, могут применяться в различных продуктах, таких как продукты питания, пищевые добавки или фармацевтические лекарственные средства, а также корма для животных или добавки в корма для животных.
Наилучший способ осуществления изобретения
Настоящее изобретение будет описано более подробно. Тем не менее, каждое описание и воплощения, раскрытые в настоящем изобретении, могут применяться здесь в различных описаниях и воплощениях. Кроме того, все комбинации различных компонентов, раскрытых в описании настоящего изобретения, включены в объем описания настоящего изобретения. Кроме того, объем настоящего изобретения не должен ограничиваться приведенными здесь описаниями.
Специалисту в данной области техники понятно или он способен определить с использованием не более чем экспериментального пути множество эквивалентов конкретных воплощений описания настоящего изобретения. Предполагается, что такие эквиваленты включены в объем формулы изобретения.
В одном аспекте настоящего изобретения предложен микроорганизм, продуцирующий L-аминокислоту с разветвленной цепью, обладающий усиленной активностью регулятора ацетатного метаболизма А.
Использованный здесь термин "регулятор ацетатного метаболизма А" относится к регуляторному белку, связанному с метаболизмом уксусной кислоты в качестве белка-мишени в соответствии с описанием настоящего изобретения, и может кодироваться геном ramA.
В настоящем изобретении экспрессия регулятора ацетатного метаболизма А может быть усилена, и усиление экспрессии может приводить в результате к увеличению способности продуцировать L-аминокислоту с разветвленной цепью.
Использованный здесь термин "усиление" активности регулятора ацетатного метаболизма А означает то, что активность регулятора ацетатного метаболизма А увеличена по сравнению с исходной активностью. Усиление может быть использовано взаимозаменяемо с активацией, повышающей регуляцией, сверхэкспрессией, увеличением и т.д. В этой связи активация, усиление, повышающая регуляция, сверхэкспрессия и увеличение могут включать все действия, которые демонстрируют активность, которая исходно не обнаруживалась, или демонстрируют улучшенную активность по сравнению с исходной активностью или активностью перед модификацией. "Исходная активность" относится к активности конкретного полипептида, исходно присутствующей в родительском штамме или не модифицированном микроорганизме перед трансформацией, когда микроорганизм трансформируют путем генетической модификации, вызванной природным или искусственным фактором. Этот термин может быть использован взаимозаменяемо с термином "активность перед модификацией". "Усиление", "повышающая регуляция", "сверхэкспрессия" или "увеличение" активности полипептида по сравнению с исходной активностью означает то, что активность и/или концентрация (уровень экспрессии) конкретного полипептида улучшена по сравнению с активностью и/или концентрацией (уровнем экспрессии), исходно присутствующей в родительском штамме или немодифицированном микроорганизме перед трансформацией.
Усиление может быть достигнуто путем введения чужеродного полипептида или путем усиления активности и/или увеличения концентрации (уровня экспрессии) эндогенного полипептида. Усилена ли активность регулятора ацетатного метаболизма А или не усилена можно идентифицировать на основе улучшения/увеличения активности или уровня экспрессии полипептида или количества продукта, высвободившегося из полипептида.
Усиление активности регулятора ацетатного метаболизма А может быть достигнуто путем использования различных способов, хорошо известных в области техники, и эти способы не ограничены до тех пор, пока активность полипептида-мишени усиливается по сравнению с активностью микроорганизма перед модификацией. В частности, могут быть использованы любые способы генетической инженерии и/или белковой инженерии, хорошо известные в области техники (например, Sitnicka et al. Functional Analysis of Genes. Advances in Cell Biology. 2010, Vol.2. 1-16, Sambrook et al. Molecular Cloning 2012).
В частности, усиление активности регулятора ацетатного метаболизма А может быть осуществлено путем:
1) увеличения числа копий полинуклеотида, кодирующего полипептид в клетках;
2) замены регуляторной последовательности экспрессии генов на хромосоме, кодирующей полипептид, на последовательность, улучшающую экспрессию полипептида, или введения в нее модификации;
3) модификации нуклеотидной последовательности, кодирующей стартовый кодон или область 5'-UTR генного транскрипта, кодирующего полипептид;
4) модификации аминокислотной последовательности полипептида для усиления активности полипептида;
5) модификации последовательности полинуклеотида, кодирующего полипептид, для усиления активности полипептида (например, путем модификации нуклеотидной последовательности гена полипептида, для кодирования полипептида, модифицированного таким образом, что он обладает усиленной активностью);
6) введения чужеродного полипептида, обладающего активностью полипептида, который кодирует чужеродный полинуклеотид;
7) оптимизации кодона полинуклеотида, кодирующего полипептид;
8) модификации или химической модификации экспонированной области, выбранной путем анализа трехмерной структуры полипептида; или
9) любой комбинации двух или более чем двух, выбранных из 1)-8) выше, но не ограничиваясь ими.
Конкретно, увеличение числа копий полинуклеотида, кодирующего полипептид, как описано в 1) выше, может быть достигнуто путем введения вектора, который реплицируется и функционирует независимо от клетки-хозяина и функционально связан с полинуклеотидом, кодирующим полипептид, в клетке-хозяине. В качестве альтернативы, увеличение числа копий может быть достигнуто путем введения одной копии или двух или более чем двух копий полинуклеотида, кодирующего полипептид, в хромосому клетки-хозяина. Введение в хромосому может быть осуществлено путем введения вектора, способного встраивать полинуклеотид в хромосому клетки-хозяина, в клетку-хозяина, но не ограничиваясь этим. Вектор является таким, как описано ниже.
Замена регуляторной последовательности экспрессии генов (или области, регулирующей экспрессию) на хромосоме, кодирующей полипептид, последовательностью, улучшающей экспрессию полипептида, или введение в нее модификации, как описано в 2) выше, может быть достигнуто, например, путем индукции мутации в последовательности путем делеции, вставки, неконсервативной или консервативной замены, или любой их комбинации, или путем замены регуляторной последовательности экспрессии генов на последовательность, способную улучшать экспрессию полипептида, для того, чтобы дополнительно усиливать активность области, регулирующей экспрессию. Область, регулирующая экспрессию, может включать, без ограничения, промотор, операторную последовательность, последовательность, кодирующую сайт связывания с рибосомой, последовательность, регулирующую терминацию транскрипции или трансляции, энхансер, и т.д. Замена может быть осуществлена, в частности, при помощи способа замены эндогенного промотора на сильный гетерологичный промотор, но не ограничиваться этим.
Примеры сильного промотора, известного в области техники, могут включать промоторы CJ1-CJ7 (патент США №US 7662943 В2), промотор lac, промотор trp, промотор trc, промотор tac, промотор PR фага лямбда, промотор PL, промотор tet, промотор gapA, промотор SPL7, промотор SPL13(sm3) (патент США №US 10584338 В2), промотор 02 (патент США №US 10273491 В2), промотор tkt и промотор усе А, но не ограничиваться этим.
Модификация нуклеотидной последовательности, кодирующей стартовый кодон или область 5'-UTR генного транскрипта, кодирующего полипептид, описанный в 3) выше, может быть осуществлена, например, путем замены нуклеотидной последовательности на нуклеотидную последовательность, кодирующую другой стартовый кодон, обладающий более высоким уровнем экспрессии полипептида, чем эндогенный стартовый кодон, но не ограничиваться этим.
Модификация аминокислотной последовательности или нуклеотидной последовательности, описанной в 4) и 5) выше, может быть достигнута путем индукции мутации в аминокислотной последовательности полипептида нуклеотидной последовательности, кодирующей полипептид, путем делеции, вставки, не консервативной или консервативной замены, или любой их комбинации, или путем замены аминокислотной последовательности или нуклеотидной последовательности на аминокислотную последовательность или нуклеотидную последовательность, модифицированную таким образом, что она обладает более сильной активностью, или аминокислотную последовательность или нуклеотидную последовательность, модифицированную для увеличения активности, для того, чтобы дополнительно усиливать активность полипептида, но не ограничиваться этим. Замена может быть осуществлена, в частности, путем встраивания полинуклеотида в хромосому путем гомологичной рекомбинации, но не ограничиваться этим. В этой связи, используемый для этого вектор может дополнительно включать маркер для отбора для подтверждения его встраивания в хромосому. Маркер для отбора будет описан ниже.
Введение чужеродного полипептида, обладающего активностью полипептида, описанного в 6) выше, может быть достигнуто путем введения в клетку чужеродного полинуклеотида, кодирующего полипептид, демонстрирующий активность, идентичную/похожую на активность полипептида. Происхождение или последовательность чужеродного полинуклеотида не ограничена конкретным образом до тех пор, пока чужеродный полинуклеотид демонстрирует активность, идентичную/похожую на активность полипептида. Способ, используемый для введения, может быть подходящим образом выбран специалистом в данной области техники.
Поскольку введенный полинуклеотид экспрессируется в клетке-хозяине, получают полипептид, и его активность может быть увеличена.
Оптимизация кодона полинуклеотида, кодирующего полипептид, описанный в 7) выше, может быть достигнута путем оптимизации кодона для увеличения транскрипции или трансляции эндогенного полинуклеотида в клетке-хозяине, или путем оптимизации кодона для того, чтобы дать возможность для оптимизированной транскрипции или трансляции чужеродного полинуклеотида в клетке-хозяине.
Модификация или химическая модификация экспонированной области, выбранной путем анализа трехмерной структуры полипептида, описанного в 8) выше, может быть достигнута, например, путем определения матрицы белка кандидата в соответствии со сходством между последовательностями на основе сравнения информации о последовательности анализируемого полипептида и базой данных, в которой хранится информация о последовательностях существующих белков, на основе идентификации их структуры, выбора экспонируемой области, которую предполагается модифицировать или химически модифицировать, и модификации или химической модификации экспонируемой области.
Усиление активности регулятора ацетатного метаболизма А, как описано выше, может представлять собой увеличение активности или концентрации (уровня экспрессии) полипептида по сравнению с активностью или концентрацией регулятора ацетатного метаболизма А, экспрессируемого в штаммах дикого типа или не модифицированных штаммах микроорганизмов, или увеличение количества продукта, полученного из полипептида, но не ограничиваться этим.
Конкретней, используемый здесь термин "регуляторная последовательность экспрессии генов", взаимозаменяемо используемый с "областью, регулирующей экспрессию гена", относится к последовательности, функционально связанной с геном-мишенью, таким образом, чтобы экспрессировать ген-мишень, и может включать модифицированный полинуклеотид в соответствии с описанием настоящего изобретения. В соответствии с описанным выше регуляторная последовательность экспрессии генов, в соответствии с описанием настоящего изобретения, может относиться к промотору, энхансеру и т.д. для осуществления транскрипции гена, и может представлять собой концепцию, дополнительно включающую операторную последовательность для контроля транскрипции, последовательность, кодирующую подходящий сайт связывания мРНК с рибосомой, и ДНК, регулирующую терминацию транскрипции и трансляции.
В одном воплощении описания настоящего изобретения регуляторная последовательность экспрессии генов может представлять собой промотор, но она не ограничивается этим.
В одном воплощении описания настоящего изобретения экспрессия регулятора ацетатного метаболизма А может быть усилена путем введения модификации в промотор или замены промотора на промотор, обладающий более сильной активностью, но не ограничивается этим.
Используемый здесь термин "промотор" относится к нетранслируемой нуклеотидной последовательности, включающей сайт связывания с полимеразой, расположенной выше кодирующей области, и обладающей активностью, инициирующей транскрипцию гена-мишени в мРНК, т.е. область ДНК, которая приводит к инициации транкрипции гена, когда с ней связывается полимераза. Промотор может располагаться в 5'-области сайта инициации транскрипции мРНК.
Использованный здесь термин "функционально связанный" относится к функциональной связи с последовательностью гена-мишени, таким образом, что полинуклеотид, обладающий промоторной активностью в соответствии с настоящим изобретением, инициирует и опосредует транскрипцию гена-мишени. Функциональное связывание может быть осуществлено с использованием способа генетической рекомбинации, известного в области техники, и сайт-специфическое расщепление ДНК и лигирование могут быть осуществлены с использованием фермента рестрикции, лигирования и т.д., но не ограничиваться этим.
В настоящем изобретении ген-мишень относится к гену, кодирующему белок-мишень, экспрессию которого необходимо контролировать в микроорганизме, в частности, ген может представлять собой ген, кодирующий регулятор ацетатного метаболизма А, но не ограничивается этим. Конкретней, ген может представлять собой ген ramA, но не ограничивается этим.
Кроме того, ген ramA может представлять собой эндогенный ген или чужеродный ген, и может включать мутацию для корректирования активности. Последовательность гена ramA может быть легко получена из известной базы данных, такой как GenBank Национальных Институтов Здравоохранения (National Institutes of Health) (U.S.A.) специалистами в данной области техники.
В еще одном аспекте настоящего изобретения предложен микроорганизм, продуцирующий L-аминокислоту с разветвленной цепью, включающий полинуклеотид, обладающий промоторной активностью, и включающий замену нуклеотида на отличающийся нуклеотид в одном или более чем одном из соответствующих положений, выбранных из положений 34, 36, 37, 41 и 43 нуклеотидной последовательности, представленной в SEQ ID NO: 1.
Использованный здесь термин "полинуклеотид" относится к цепи ДНК, имеющей определенную минимальную длину в виде полимера из нуклеотидов, в котором мономеры нуклеотидов связаны друг с другом в форме длинной цепи посредством ковалентных связей.
При рассмотрений описания "промотора" термин "полинуклеотид, обладающий промоторной активностью", может быть использован в описании настоящего изобретения взаимозаменяемо с "модифицированный полинуклеотид", "модифицированный промотор" или "модифицированный промотор ramA", и все из вышеописанных терминов могут быть использованы здесь.
В этой связи, термин "модификация" относится к генетическому или негенетическому стабильному изменению фенотипа, и может быть использован взаимозаменяемо здесь с термином "мутация".
В частности, модифицированный полинуклеотид в соответствии с описанием настоящего изобретения может обладать модифицированной (увеличенной) промоторной активностью по сравнению с полинуклеотидом, не имеющим модификацию. Таким образом, экспрессия гена ramA, который представляет собой ген-мишень, функционально связанный с модифицированным полинуклеотидом в соответствии с описанием настоящего изобретения, и активность белка, кодируемого геном ramA, может быть скорректирована (увеличена), и также может быть скорректирована экспрессия других генов, а также гена-мишени.
В свете задач в соответствии с настоящим изобретением полинуклеотид, обладающий промоторной активностью, относится к полинуклеотиду, способному экспрессировать белок, вовлеченный в увеличение продукции аминокислот, в частности, аминокислот с разветвленной цепью, конкретней, аминокислот, включающих лейцин, валин и изолейцин, но не ограничивающихся этим.
Использованный здесь термин "полинуклеотидная последовательность, раскрытая в SEQ ID NO: 1" может относиться к промоторной последовательности гена, кодирующего регулятор ацетатного метаболизма A (RamA).
Полинуклеотид, обладающий промоторной активностью, в соответствии с описанием настоящего изобретения представляет собой модифицированный полинуклеотид, не обладающий природной последовательностью, а обладающий промоторной активностью, и экспрессия белка-мишени, функционально связанного с ним, может быть увеличена по сравнению с полинуклеотидной последовательностью, представленной в SEQ ID NO: 1.
В частности, модифицированный полинуклеотид в соответствии с описанием настоящего изобретения, может представлять собой полинуклеотид, в котором нуклеотидная последовательность, представленная в SEQ ID NO: 1, т.е. промоторная последовательность гена ramA является модифицированной, и по меньшей мере один нуклеотид, выбранный из 34-го, 36-го, 37-го, 41-го и 43-го нуклеотидов последовательности, могут быть заменены на отличающийся нуклеотид.
Конкретней, модифицированный полинуклеотид в соответствии с описанием настоящего изобретения может включать замену 34-го нуклеотида на Т; замену 36-го нуклеотида на Т; замену 37-го нуклеотида на G; замену 41-го нуклеотида на Т; замену 43-го нуклеотида на А; или любую их комбинацию в нуклеотидной последовательности, представленной в SEQ ID NO: 1, но не ограничиваться этим. При модификации полинуклеотид в соответствии с описанием настоящего изобретения может состоять из одной нуклеотидной последовательности, выбранной из SEQ ID NO: 3-5.
В одном воплощении модифицированный полинуклеотид в соответствии с описанием настоящего изобретения может включать замену 34-го нуклеотида на Т; замену 36-го нуклеотида на Т; замену 37-го нуклеотида на G в нуклеотидной последовательности, представленной в SEQ ID NO: 1. В этом случае модифицированный полинуклеотид в соответствии с описанием настоящего изобретения может состоять из SEQ ID NO: 5.
В еще одном воплощении модифицированный полинуклеотид в соответствии с описанием настоящего изобретения может включать замену 41-го нуклеотида на Т; и замену 43-го нуклеотида на А в нуклеотидной последовательности, представленной в SEQ ID NO: 1. В этом случае модифицированный полинуклеотид в соответствии с описанием настоящего изобретения может состоять из SEQ ID NO: 4.
В еще одном воплощении модифицированный полинуклеотид в соответствии с описанием настоящего изобретения может включать замену 34-го нуклеотида на Т; замену 36-го нуклеотида на Т; замену 37-го нуклеотида на G; замену 41-го нуклеотида на Т; и замену 43-го нуклеотида на А в нуклеотидной последовательности, представленной в SEQ ID NO: 1. В этом случае модифицированный полинуклеотид в соответствии с описанием настоящего изобретения может состоять из SEQ ID NO: 3.
Микроорганизм, продуцирующий L-аминокислоту с разветвленной цепью в соответствии с настоящим изобретением, может представлять собой микроорганизм, включающий полинуклеотид, который обладает промоторной активностью и включает замену 34-го нуклеотида на Т; замену 36-го нуклеотида на Т; замену 37-го нуклеотида на G; замену 41-го нуклеотида на Т; замену 43-го нуклеотида на А; или любую их комбинацию в нуклеотидной последовательности, представленной в SEQ ID NO: 1.
В частности, микроорганизм, продуцирующий L-аминокислоту с разветвленной цепью в соответствии с настоящим изобретением, может представлять собой микроорганизм, включающий полинуклеотид, обладающий промоторной активностью и состоящий из одной нуклеотидной последовательности, выбранной из SEQ ID NO: 3-5, или нуклеотидной последовательности, имеющей с ней по меньшей мере 80% или более и менее чем 100% гомологию последовательности. Модифицированный полинуклеотид в соответствии с описанием настоящего изобретения более подробно будет описан ниже.
Использованный здесь термин "аминокислота с разветвленной цепью" относится к аминокислоте, имеющей разветвленную алкильную группу по боковой цепи, и включающей валин, лейцин и изолейцин. В частности, в описании настоящего изобретения аминокислота с разветвленной цепью может представлять собой L-аминокислоту с разветвленной цепью, и L-аминокислота с разветвленной цепью может представлять собой L-валин, L-лейцин и L-изолейцин, но не ограничиваться этим.
Использованный здесь термин "микроорганизм, продуцирующий аминокислоту с разветвленной цепью", включает все микроорганизмы дикого типа и микроорганизмы, в которых осуществлена природная или искусственная генетическая модификация, и может представлять собой микроорганизм, включающий генетическую модификацию для продукции аминокислоты-мишени с разветвленной цепью или обладающей улучшенной активностью, в котором конкретный механизм ослаблен или усилен путем введения чужеродного гена или усиления или инактивации активности эндогенного гена. В описании настоящего изобретения "микроорганизм, способный продуцировать L-аминокислоту с разветвленной цепью", могут быть использован взаимозаменяемо с "микроорганизмом, продуцирующим аминокислоту с разветвленной цепью", и "микроорганизмом, обладающим способностью продуцировать аминокислоту с разветвленной цепью".
В свете задач в соответствии с описанием настоящего изобретения микроорганизм может представлять собой любой микроорганизм, способный продуцировать аминокислоту с разветвленной цепью, и включающий модифицированный полинуклеотид в соответствии с описанием настоящего изобретения. В частности, микроорганизм, продуцирующий аминокислоту с разветвленной цепью, может представлять собой микроорганизм, отличающийся тем, что способность продуцировать аминокислоту-мишень с разветвленной цепью увеличена путем включения модифицированного полинуклеотида. В частности, в описании настоящего изобретения микроорганизм, продуцирующий аминокислоту с разветвленной цепью, или микроорганизм, обладающий способностью продуцировать аминокислоту с разветвленной цепью, может представлять собой микроорганизм, в котором некоторые из генов в пути биосинтеза аминокислоты с разветвленной цепью усилены или ослаблены, или микроорганизм, в котором некоторые из генов в пути разрушения аминокислоты с разветвленной цепью усилены или ослаблены, но не ограничиваться этим.
В воплощении в описании настоящего изобретения микроорганизм рода Corynebacterium, обладающий способностью продуцировать аминокислоту с разветвленной цепью, может относиться к микроорганизму рода Corynebacterium, включающему модифицированный полинуклеотид в соответствии с описанием настоящего изобретения, или трансформированному вектором, включающим ген, кодирующим полинуклеотид в соответствии с описанием настоящего изобретения, обладающему улучшенной способностью продуцировать аминокислоту с разветвленной цепью. "Микроорганизм рода Corynebacterium, обладающий усиленной способностью продуцировать аминокислоту с разветвленной цепью" относится к микроорганизму, обладающему усиленной способностью продуцировать аминокислоту с разветвленной цепью, по сравнению со способностью продуцировать аминокислоту родительским штаммом перед трансформацией или не модифицированным микроорганизмом. "Не модифицированный микроорганизм" не исключает штаммы, имеющие мутацию, которая может встречаться у микроорганизмов в природе, и относится к микроорганизму, не включающему полинуклеотид в соответствии с описанием настоящего изобретения, или микроорганизму, не трансфицированному вектором, включающим полинуклеотид в соответствии с описанием настоящего изобретения.
Микроорганизм рода Corynebacterium конкретным образом может включать Corynebacterium glutamicum, Corynebacterium ammoniagenes, Brevibacterium lactofermentum, Brevibacterium flavum, Corynebacterium thermoaminogenes, Corynebacterium efficiens, Corynebacterium stationis и т.д., но не ограничиваться этим.
Использованный здесь термин "вектор" относится к искусственной молекуле ДНК, включающей генетический материал, экспрессирующий полипептид-мишень в надлежащей клетке-хозяине, в частности, конструкции ДНК, включающей нуклеотидную последовательность полинуклеотида, кодирующего полипептид-мишень, и функционально связанного с подходящей областью, регулирующей экспрессию, способного экспрессировать ген-мишень. После трансформации подходящей клетки-хозяина вектором последний может реплицироваться или функционировать независимо от генома хозяина или может быть встроен в геном.
Используемый в настоящем изобретении вектор не ограничен конкретным образом, и может быть использован любой вектор, известный в области техники. Примеры обычных векторов могут включать природную или рекомбинантную плазмиду, космиду, вирус и бактериофаг. Например, в качестве фагового вектора или космидного вектора можно использовать pWE15, М13, MBL3, MBL4, IXII, ASHII, APII, t10, t11, Charon4A, Charon21A и т.д. В качестве плазмидного вектора можно использовать векторы на основе pDZ, pBR, pUC, pBluescriptII, pGEM, pTZ, pCL, pET и т.д. В частности, можно использовать векторы pDZ, pDC, pDCM2, pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118 и pCC1BAC.
Например, целевой полинуклеотид может быть встроен в хромосому с использованием вектора для встраивания в хромосому. Встраивание полинуклеотида в хромосому может быть осуществлено при помощи любого из способов, известных в области техники, например, при помощи гомологичной рекомбинации, но не ограничиваться ими. Полинуклеотид может дополнительно включать маркер селекции для подтверждения встраивания в хромосому. Маркер селекции используется для отбора клеток, трансформированных вектором, т.е. для идентификации того, встроена ли молекула нуклеиновой кислоты-мишени или нет, и могут быть использованы маркеры, обеспечивающие селективные фенотипы, такие как устойчивость к лекарственным средствам, потребность в питательных веществах, устойчивость к цитотоксическим агентам или экспрессия поверхностного полипептида белков. В среде, обработанной селективным агентом, могут быть отобраны трансформированные клетки, поскольку только клетки, экспрессирующие маркер селекции, способны выживать или демонстрировать различные фенотипы.
Использованный здесь термин "трансформация" относится к введению вектора, включающего полинуклеотид-мишень, в клетку-хозяина или микроорганизм таким образом, чтобы полинуклеотид экспрессировался в клетке-хозяине. Трансформированный полинуклеотид могут быть представлен в форме, встроенной в хромосому клетки-хозяина, или в форме, расположенной за пределами хромосомы, при условии, что полипептид экспрессируется в клетке-хозяине. Кроме того, полинуклеотид может включать ДНК и РНК, кодирующие полипептид-мишень. Полинуклеотид может быть введен в клетку-хозяина в любой форме при условии, что полинуклеотид может быть введен в клетку-хозяина и экспрессироваться в ней. Например, полинуклеотид может быть введен в клетку-хозяина в форме экспрессирующейся кассеты, которая представляет собой генетическую конструкцию, включающую все элементы, необходимые для саморепликации. Как правило, экспрессирующаяся кассета может включать промотор, функционально связанный с полинуклеотидом, сигнал терминации транскрипции, сайт связывания с рибосомой и сигнал терминации трансляции. Экспрессирующаяся кассета может находиться в форме самореплицирующегося экспрессирующегося вектора. Кроме того, полинуклеотид может быть введен в клетку-хозяина в своей исходной форме и функционально связан с последовательностью, необходимой для экспрессии в клетке-хозяине, но не ограничиваться этим.
В еще одном аспекте описания настоящего изобретения предложен способ получения L-аминокислоты с разветвленной цепью, включающий культивирование микроорганизма в культуральной среде.
Кроме того, этот способ получения L-аминокислоты с разветвленной цепью может дополнительно включать выделение или отделение вещества-мишени из культуральной среды или микроорганизма.
"Полинуклеотид", "микроорганизм рода Corynebacterium", "вектор" и " L-аминокислота с разветвленной цепью" описаны выше.
Использованный здесь термин "культивирование" относится к выращиванию микроорганизма в соответствии с описанием настоящего изобретения в надлежащим образом подобранной среде. Процесс культивирования в соответствии с описанием настоящего изобретения может быть осуществлен с использованием подходящих культуральных сред и условий культивирования, хорошо известных в области техники.
Процесс культивирования может быть надлежащим образом скорректирован специалистом в данной области техники в соответствии с выбранным штаммом. В частности, культивирование может быть осуществлено при помощи метода периодического культивирования, метода непрерывного выращивания и метода выращивания подпитываемой культуры, но не ограничиваться этим.
Использованный здесь термин "культуральная среда" относится к веществу, в котором в качестве основных элементов смешаны питательные вещества, требующиеся для выращивания микроорганизма в соответствии с описанием настоящего изобретения, и объем питательных веществ и факторов роста, а также вода, которые необходимы для жизнедеятельности и роста. В частности, хотя культуральные среды и другие условия выращивания микроорганизма рода Corynebacterium в соответствии с описанием настоящего изобретения не ограничены конкретным образом при условии, что эти среды обычно используются при выращивании микроорганизмов, микроорганизм в соответствии с настоящим изобретением может быть выращен в обычной среде, содержащей подходящие источники углерода, источники азота, источники фосфора, неорганические соединения, аминокислоты и/или витамины, в аэробных условиях при корректировании температуры, рН и т.д.
В частности, культуральная среда для микроорганизма рода Corynebacterium раскрыта в документе ("Manual of Methods for General Bacteriology" by the American Society for Bacteriology (Washington D.C., U.S.A., 1981)).
В настоящем изобретении в качестве источников углерода могут быть использованы углеводы, такие как глюкоза, сахароза, лактоза, фруктоза и мальтоза; сахарные спирты, такие как маннит и сорбит; органические кислоты, такие как пировиноградная кислота, молочная кислота и лимонная кислота и аминокислоты такие как глутаминовая кислота, метионин и лизин. Кроме того, могут быть использованы природные органические питательных вещества, такие как гидролизаты крахмала, меласса, сырая меласса, рисовые отруби, маниок, выжимки сахарного тростника и жидкий кукурузный экстракт, и в частности могут быть использованы углеводы, такие как глюкоза и стерильные предварительно обработанные мелассы (т.е. мелассы, преобразованные в редуцированные сахара), и подходящие количества любых других источников углерода, могут также использоваться без ограничения. Эти источники углерода могут быть использованы сами по себе или в комбинации, по меньшей мере, двух из них, но не ограничиваются этим.
В качестве источников азота могут быть использованы источники неорганического азота, такие как аммиак, сульфат аммония, хлорид аммония, ацетат аммония, фосфат аммония, карбонат аммония и нитрат аммония; и источники органического азота, такие как аминокислоты, например, глутаминовая кислота, метионин и глютамин, пептон, NZ-амин, мясной экстракт, дрожжевой экстракт, солодовый экстракт, жидкий кукурузный экстракт, гидролизат казеина, рыба или продукты ее деградации, и обезжиренный соевый жмых или продукты его деградации. Эти источники азота могут быть использованы сами по себе или в комбинации по меньшей мере двух из них, но не ограничиваться этим.
В качестве источников фосфора могут быть использованы первичный кислый фосфат калия, гидрофосфат калия или соответствующие содержащие натрий соли. В качестве неорганических соединений могут быть использованы хлорид натрия, хлорид кальция, хлорид железа, сульфат магния, сульфат железа, сульфат марганца, карбонат кальция и т.д. Кроме того, могут быть дополнительно включены аминокислоты, витамины и/или соответствующие предшественники. Эти компоненты или предшественники могут быть добавлены к культуральной среде партиями или путем непрерывного процесса, но не ограничиваться этим.
Кроме того, во время процесса культивирования микроорганизма в соответствии с настоящим изобретением значение рН культуральной среды может быть скорректировано путем добавления подходящим образом соединения, такого как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота и серная кислота. Кроме того, во время процесса культивирования образование пены может быть предотвращено путем использования пеногасителя, такого как сложный эфир полигликоля и жирной кислоты. Кроме того, кислород или содержащий кислород газ могут быть введены в культуральную среду для поддержания культуральной среды в аэробных условиях, или азот, водород или углекислый газ могут быть введены в культуральную среду для поддержания культуральной среды в анаэробных и микроаэробных условиях, не нагнетая в нее никаких других газов, но не ограничиваться этим.
В настоящем изобретении температура культивирования может поддерживаться на уровне от 20°С до 45°С, в частности, от 25°С до 40°С, и культивирование может осуществляться в течение приблизительно от 10 до 160 часов, но не ограничиваться этим.
L-Аминокислота с разветвленной цепью, получаемая путем культивирования в соответствии с настоящим изобретением, может высвобождаться в культуральную среду или оставаться в клетках.
Способ получения L-аминокислоты с разветвленной цепью в соответствии с настоящим изобретением дополнительно может включать получение микроорганизма в соответствии с настоящим изобретением, получение культуральной среды для выращивания штамма или любую их комбинацию (независимо от последовательности, в любой последовательности), например, до культивирования.
Способ получения L-аминокислоты с разветвленной цепью в соответствии с настоящим изобретением дополнительно может включать выделение L-аминокислоты с разветвленной цепью из культуральной среды (в которой осуществлялось выращивание) или микроорганизма в соответствии с описанием настоящего изобретения. Стадия выделения может быть дополнительно осуществлена после процесса культивирования.
Стадия выделения может быть осуществлена путем сбора целевой L-аминокислоты с разветвленной цепью с использованием подходящего способа, известного в области техники, в соответствии со способами культивирования микроорганизма в соответствии с настоящим изобретением, такими как периодический способ выращивания, непрерывный способ выращивания или выращивание с подпиткой. Например, могут быть использованы центрифугирование, фильтрование, обработка агентом, осаждающим белок (высаливание), экстракция, ультразвуковое разрушение, ультрафильтрация, диализ, различные хроматографические способы, такие как хроматография на молекулярных ситах (гель-фильтрация), адсорбционная хроматография, ионообменная хроматография и аффинная хроматография, HPLC (высокоэффективная жидкостная хроматография), SMB (хроматография на псевдоподвижном слое) и любая их комбинация. Целевая L-аминокислота-мишень с разветвленной цепью может быть выделена из культуральной среды или микроорганизма с использованием любого подходящего способа, известного в области техники.
Кроме того, способ получения L-аминокислоты с разветвленной цепью в соответствии с настоящим изобретением дополнительно может включать стадию очистки. Очистка может быть осуществлена с использованием подходящего способа, известного в области техники. В качестве примера, когда способ получения L-аминокислоты с разветвленной цепью в соответствии с настоящим изобретением включает стадию выделения и стадию очистки, тогда стадия выделения и стадия очистки могут быть осуществлены непрерывно или с перерывами независимо от последовательности, или могут быть осуществлены одновременно или в виде одной объединенной стадии, но не ограничиваться этим.
В еще одном аспекте настоящего изобретения предложен полинуклеотид, обладающий промоторной активностью и включающий замену по меньшей мере одного нуклеотида, выбранного из 34-го, 36-го, 37-го, 41-го и 43-го нуклеотидов нуклеотидной последовательности, представленной в SEQ ID NO: 1, на другой нуклеотид.
"Полинуклеотид" и "промотор" являются такими, как описано выше.
Кроме того, последовательность модифицированного полинуклеотида в соответствии с описанием настоящего изобретения может быть модифицирована путем мутагенеза, хорошо известного в области техники, например, направленной эволюции и сайт-направленного мутагенеза.
Таким образом, модифицированный полинуклеотид в соответствии с настоящим изобретением может включать полинуклеотид, имеющий нуклеотидную последовательность, в которой 34-е основание зафиксировано как Т; 36-е основание зафиксировано как Т; 37-е основание зафиксировано как G; 41-е основание зафиксировано как Т; и 43-е основание зафиксировано как А, а другая часть нуклеотидной последовательности обладает по меньшей мере 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% гомологией или идентичностью с нуклеотидной последовательностью SEQ ID NO: 3.
Кроме того, модифицированный полинуклеотид в соответствии с настоящим изобретением может включать полинуклеотид, имеющий нуклеотидную последовательность, в которой 41-е основание зафиксировано как Т; и 43-е основание зафиксировано как А, а другая часть нуклеотидной последовательности обладает по меньшей мере 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% гомологией или идентичностью с нуклеотидной последовательностью SEQ ID NO: 4.
Кроме того, модифицированный полинуклеотид в соответствии с описанием настоящего изобретения может включать полинуклеотид, имеющий нуклеотидную последовательность, в которой 34-е основание зафиксировано как Т; 36-е основание зафиксировано как Т; и 37-е основание зафиксировано как G, а другая часть последовательности обладает по меньшей мере 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% гомологией или идентичностью с нуклеотидной последовательностью SEQ ID NO: 5.
В этом случае нуклеотидная последовательность, обладающая гомологией или идентичностью, может исключать последовательность, обладающую 100% идентичностью, или может представлять собой последовательность, обладающую идентичностью меньшей чем 100%.
Очевидно то, что любой полинуклеотид, имеющий нуклеотидную последовательность, включающую делецию, модификацию, замену или вставку одного или нескольких нуклеотидов, отличающихся от 34-го, 36-го, 37-го, 41-го или 43-го положений, входят в объем настоящего изобретения при условии, что нуклеотидная последовательность сохраняет гомологию и биологическую активность, идентичную или эквивалентную гомологии и биологической активности по меньшей мере одной нуклеотидной последовательности, выбранной из SEQ ID NO: 3-5.
Использованный здесь термин "гомология" или "идентичность" относится к степени сходства между двумя данными аминокислотными последовательностями или нуклеотидными последовательностями, и она может быть выражена в процентах. Часто термины "гомология" и "идентичность" можно использовать взаимозаменяемо.
Гомологию или идентичность последовательности консервативных полинуклеотидов или полипептидов можно определить путем стандартного алгоритма выравнивания, и вместе с ним можно использовать штраф за пропуск в последовательности, установленный по умолчанию в используемой программе. По существу, гомологичные или идентичные последовательности как правило могут гибридизироваться друг с другом полностью или частично в умеренно строгих или очень строгих условиях. Очевидно то, что гибридизация включает гибридизацию полинуклеотида с полинуклеотидом, включающих общий кодон или вырожденный кодон.
Гомология, сходство или идентичность между двумя последовательностями полинуклеотидов или полипептидов могут быть определены с использованием любого компьютерного алгоритма, известного в области техники, например, программы "FASTA", с использованием параметров по умолчанию, введенных Pearson et al. (1988) Proc. Natl. Acad. Sci. USA 85:2444. Альтернативно, гомология, сходство или идентичность могут быть определены с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48:443-453), встроенного в программу Needleman пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16:276-277) (версия 5.0.0 или более поздняя) (включающую программный пакет GCG (Devereux, J. et al., Nucleic Acids Research 12:387 (1984)), BLASTP, BLASTN, FASTA (Atschul, S. F. et al., J MOLEC BIOL 215:403 (1990); Guide to Huge Computers, Martin J. Bishop, ed., Academic Press, San Diego, 1994, и CARILLO et al. (1988) SIAM J Applied Math 48:1073). Например, гомология, сходство или идентичность могут быть определены с использованием базы данных BLAST Национального Центра Биотехнологической Информации или ClustalW.
Гомологию, сходство или идентичность между полинуклеотидами или полипептидами можно определить путем сравнения информации о последовательностях с помощью компьютерной программы GAP, как введено Needleman et al., (1970), J Mol Biol. 48:443, как раскрыто Smith and Waterman, Adv. Appl. Math (1981) 2:482. Кратко, программа GAP определяет сходство по количеству выровненных одинаковых символов (т.е. нуклеотидов или аминокислот), деленому на общее количество символов в более короткой из двух последовательностей. Параметры по умолчанию для программы GAP могут включать: (1) матрицу двоичного сравнения (содержащую величину 1 в случае идентичности и 0 в случае не идентичности) и взвешенную матрицу сравнения в соответствии с Gribskov, et al. (1986), Nucl. Acids Res. 14:6745, как описано в Schwartz and Dayhoff, eds., Atlas Of Protein Sequence and Structure, National Biomedical Research Foundation, pp.353-358 (1979) (или EDNAFULL (версия EMBOSS NCBI NUC4.4); (2) штраф 3,0 за каждый пропуск и дополнительно штраф 0,10 за каждый символ в каждом пропуске (или альтернативно, штраф за внесение пропуска 10, штраф за удлинение пропуска 0,5) и (3) отсутствие штрафа за окончание пропуска.
Кроме того, модифицированный полинуклеотид в соответствии с описанием настоящего изобретения может включать различные модификации в кодирующей области, предложенные не для изменения нуклеотидной последовательности вследствие вырожденности кодонов или с учетом кодонов, предпочтительных для живого организма, в котором экспрессируется полинуклеотид. Кроме того, полинуклеотид может включать любую нуклеотидную последовательность, обладающую промоторной активностью, и гибридизированную с зондом, сконструированным с использованием известной генетической последовательности, например, нуклеотидной последовательности, полностью или частично комплементарной нуклеотидной последовательности в строгих условиях, включающей без ограничения замену по меньшей мере одного нуклеотида в нуклеотидной последовательности SEQ ID NO: 1.
Термин "строгие условия" относится к условиям, обеспечивающим возможность специфичной гибридизации между полинуклеотидами. Такие условия подробно раскрыты в известных документах (например, J. Sambrook et al.). Например, условия могут включать осуществление гибридизации между генами, обладающими высокой гомологией, например, гомологией 40% или больше, в частности, 70% или больше, 80% или больше, 85% или больше, 90% или больше, конкретней, 95% или больше, еще конкретней, 97% или больше, и наиболее конкретно, 99% или больше, без гибридизации между генами, обладающими гомологией или идентичностью меньше чем описанная выше, или осуществления гибридизации однократно, в частности, два или три раза, в обычных условиях промывания для гибридизации по Саузерну при концентрации соли и температуре 60°С, 1×SSC, и 0,1% SDS (додецилсульфат натрия), в частности, 60°С, 0,1×SSC, 0,1% SDS, конкретней 68°С, 0,1×SSC, и 0,1% SDS.
Для гибридизации необходимо, чтобы две нуклеиновые кислоты имели комплементарные последовательности, даже несмотря на несовпадение между основаниями в соответствии со степенью строгости гибридизации. Термин "комплементарный" используется для описания взаимодействия между основаниями нуклеотидов, которые способны гибридизироваться друг с другом. Например, в отношении ДНК аденозин комплементарен тимину, а цитозин комплементарен гуанину. Таким образом, описание настоящего изобретения может включать не только по существу похожие последовательности нуклеиновой кислоты, а также выделенный фрагмент нуклеиновой кислоты, но комплементарный полноразмерной последовательности.
В частности, полинуклеотиды, обладающие гомологией или идентичностью, могут быть обнаружены с использованием вышеописанных условий гибридизации, включающих процесс гибридизации при величине Tm 55°С. Кроме того, величина Tm может составлять 60°С, 63°С или 65°С, но не ограничиваясь этим, и может быть соответствующим образом скорректирована специалистом в данной области техники в соответствии с предполагаемыми задачами. Подходящая степень строгости гибридизации полинуклеотидов может зависеть от длины полинуклеотидов и степени комплементарности и параметров, хорошо известных в данной области техники (Sambrook et al., выше, 9.50-9.51, 11.7-11.8).
В частности, выражение "модифицированный полинуклеотид состоит из одной нуклеотидной последовательности, выбранной из SEQ ID NO: 3-5, или нуклеотидной последовательности, обладающей по меньшей мере 80% или большей и меньше чем 100% гомологией последовательности" не исключает вставку и/или делецию, и/или мутацию нуклеотида, которые могут возникать в процессе лигирования с геном-мишенью, например, с использованием фермента рестрикции, в случае, когда полинуклеотид используют в состоянии, лигированном с геном-мишенью, в качестве промотора.
Например, полинуклеотид, состоящий из одной нуклеотидной последовательности, выбранной из SEQ ID NO: 3-5, и обладающий промоторной активностью, также может включать полинуклеотид, гибридизировавшийся полностью или частично комплементарно с одной нуклеотидной последовательностью, выбранной из SEQ ID NO: 3-5 в строгих условиях, обладающий промоторной активностью в соответствии с описанием настоящего изобретения.
Микроорганизм, включающий модифицированный полинуклеотид в соответствии с описанием настоящего изобретения, отличается тем, что увеличивается продукция аминокислоты с разветвленной цепью, включающей валин, лейцин или изолейцин. Хотя штаммы дикого типа, относящиеся к роду Corynebacterium, не могут продуцировать аминокислоты с разветвленной цепью или продуцируют их в следовых количествах, полинуклеотид, обладающий промоторной активностью в соответствии с описанием настоящего изобретения, является значимым вследствие того, что при его использовании увеличивается продукция аминокислот с разветвленной цепью.
Способ в соответствии с изобретением
Далее описание настоящего изобретения будет описано более подробно со ссылкой на следующие примеры. Тем не менее, следующие примеры приведены всего лишь для представления примеров описания настоящего изобретения, и объем описания настоящего изобретения не ограничен ими.
Пример 1. Отбор мутантных штаммов, обладающих усиленной способностью продуцировать валин, путем искусственного мутагенеза
Пример 1-1. Индукция искусственной мутации при помощи УФ-излучения
Для того, чтобы отобрать мутантный штамм, обладающий усиленной способностью продуцировать валин, который представляет собой типичную аминокислоту с разветвленной цепью, Corynebacterium glutamicum KCCM11201P (Корейский патент №10-1117022) в качестве валин-продуцирующего штамма наносили на содержащую агар питательную среду и выращивали при 30°С в течение 36 часов. С нее отбирали несколько сотен колоний и подвергали воздействию УФ-излучения при комнатной температуре для того, чтобы вызвать случайную мутацию в геномах штаммов.
Пример 1-2. Оценка ферментационного титра и отбор штамма с индуцированной мутацией
Для того, чтобы отобрать мутантный штамм, обладающий усиленной способностью продуцировать L-валин по сравнению с Corynebacterium glutamicum KCCM11201P, используемым в качестве родительского штамма, проводили тестирование ферментационного титра на штаммах, в которых индуцировали случайную мутацию. После субкультивирования каждой из колоний в питательной среде каждый из штаммов инокулировали в колбу с угловыми перегородками объемом 250 мл, содержащей 25 мл продуцирующей среды и выращивали при перемешивании при 30°С в течение 72 часов при 200 об./мин. Затем концентрации L-валина анализировали с использованием HPLC, и проанализированные концентрации L-валина представлены в таблице 1 ниже.
Питательная среда (рН 7,2)
10 г глюкозы, 5 г мясного бульона, 10 г полипептона, 2,5 г хлорида натрия, 5 г дрожжевого экстракта, 20 г агара, 2 г мочевины (на основе 1 л дистиллированной воды).
Продуцирующая среда (рН 7,0)
100 г глюкозы, 40 г сульфата аммония, 2,5 г соевого белка, 5 г кукурузного экстракта, 3 г мочевины, 1 г двухосновного фосфата калия, 0,5 г гептагидрата сульфата магния, 100 мкг биотина, 1 мг тиамина-HCl, 2 мг пантотената кальция, 3 мг никотинамида и 30 г карбоната кальция (на основе 1 л дистиллированной воды).
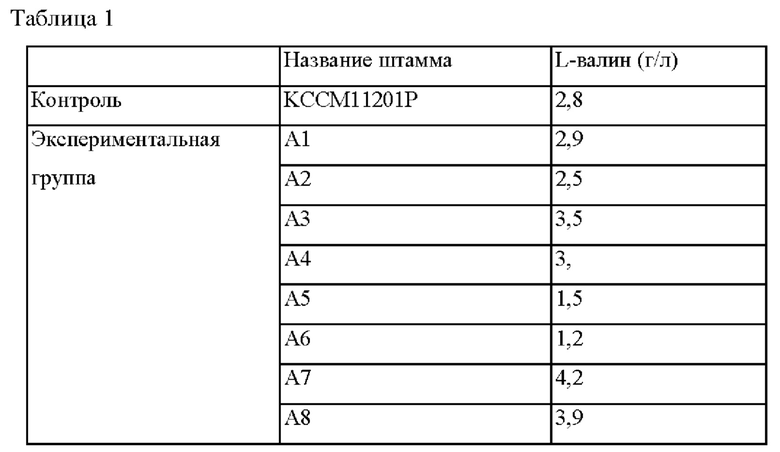

На основе сравнения с штаммом KCCM11201P, используемым в качестве контроля, был отобран штамм А7, у которого продукция валина увеличивалась в самой большой степени (смотри таблицу 1).
Пример 2. Подтверждение мутации путем секвенирования гена
Основные гены штамма А7, обладающего усиленной способностью продуцировать валин, секвенировали и сравнивали с генами штамма KCCM11201P и штамма Corynebacterium glutamicum АТСС14067. В результате подтвердили то, что штамм А7 содержит мутацию в промоторном положении регулятора ацетатного метаболизма А.
В частности, подтвердили то, что штамм А7 имеет нуклеотидную последовательность SEQ ID NO: 2, включающую мутацию в промоторной области (SEQ ID NO: 1) гена ram А.
В следующих примерах, исследовали эффекты модификации, введенной в конкретное положение промоторной области гена ramA и эффекты усиления экспрессии RamA путем улучшения или замены промотора гена ramA на продукцию валина, изолейцина и лейцина, которые представляют собой аминокислоты с разветвленной цепью, у микроорганизма рода Corynebacterium.
Пример 3. Конструирование штамма, в который введена модификация, и подтверждение способности продуцировать валин
Пример 3-1. Введение модифицированного промотора в штамм Corynebacterium glutamicum KCCM11201P и оценка способности продуцировать L-валин
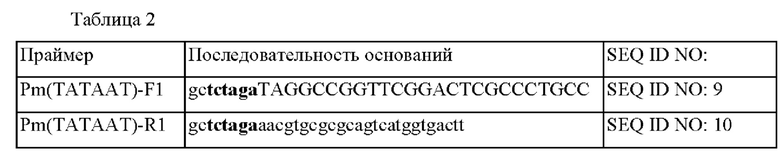
Для того, чтобы ввести в ген ramA модифицированный полинуклеотид промотора, представленный в SEQ ID NO: 2, в Corynebacterium glutamicum KCCM11201P, получали вектор, включающий желаемую модификацию. В частности, геномную ДНК штамма А7 экстрагировали с использованием набора G-spin Total DNA Extraction Mini Kit (Intron, № по каталогу 17045) в соответствии с протоколами к набору, и PCR (полимеразную цепную реакцию) проводили с использованием геномной ДНК в качестве матрицы. В следующих условиях: денатурация при 94°С в течение 5 минут; 25 циклов денатурации при 94°С в течение 30 секунд, отжиг при 55°С в течение 30 секунд, и полимеризация при 72°С в течение 150 секунд; и затем полимеризация при 72°С в течение 7 минут, и продукт PCR (далее называемый как "фрагмент 1 с введенной модификацией") длиной 1114 п.о. получали с использованием SEQ ID NO: 9 и 10.
После обработки ферментом рестрикции XbaI (New England Biolabs, Beverly, MA) полученного фрагмента 1 с введенной модификацией, фрагмент 1 с введенной модификацией лигировали с вектором pDZ (Корейский патент №10-0924065 и Публикация международной заявки на патент №2008-033001), обработанным тем же самым ферментом рестрикции с использованием Т4 лигазы (New England Biolabs, Beverly, MA). После трансформации E.coli DH5a конструированным геном трансформированные штаммы отбирали в среде LB (Лурия-Бертани), содержащей канамицин, и из них ДНК получали с использованием набора DNA-spin plasmid DNA purification kit (iNtRON) для получения вектора pDZ-Pm-ramA, включающего фрагмент 1 с введенной модификацией.
Corynebacterium glutamicum KCCM11201P трансформировали вектором pDZ-Pm-ramA путем хромосомной гомологичной рекомбинации (van der Rest et al., Appl Microbiol Biotechnol 52:541-545, 1999). Штаммы, в хромосому которых был введен вектор путем гомологичной рекомбинации последовательности, отбирали в культуральной среде, содержащей канамицин (25 мг/л). Затем PCR проводили с трансформантами Corynebacterium glutamicum, в которых вторичная рекомбинация была завершена, с использованием SEQ ID NO: 9 и 10, и подтверждали штаммы, в которые модификация была введена в промотор в области против хода транскрипции относительно ramA (SEQ ID NO: 1) на хромосоме. Рекомбинантный штамм был назван Corynebacterium glutamicum KCCM11201P-Pm-ramA.
Для сравнения способности продуцировать валин между продуцирующими валин Corynebacterium glutamicum KCCM11201P и KCCM11201P-Pm-ramA проводили оценку в колбе. После субкультивирования каждого из штаммов в питательной среде, каждый из штаммов инокулировали в колбу с угловыми перегородками объемом 250 мл, содержащей 25 мл продуцирующей среды, и выращивали при перемешивании при 30°С в течение 72 часов при 200 об./мин. Затем концентрации L-валина анализировали с использованием HPLC, и проанализированные концентрации L-валина представлены в таблице 3 ниже.
Питательная среда (рН 7,2)
10 г глюкозы, 5 г мясного бульона, 10 г полипептона, 2,5 г хлорида натрия, 5 г дрожжевого экстракта, 20 г агара, 2 г мочевины (на основе 1 л дистиллированной воды).
Продуцирующая среда (рН 7,0)
100 г глюкозы, 40 г сульфата аммония, 2,5 г соевого белка, 5 г кукурузного экстракта, 3 г мочевины, 1 г двухосновного фосфата калия, 0,5 г гептагидрата сульфата магния, 100 мкг биотина, 1 мг тиамина-HCl, 2 мг пантотената кальция, 3 мг никотинамида, 30 г карбоната кальция (на основе 1 л дистиллированной воды).
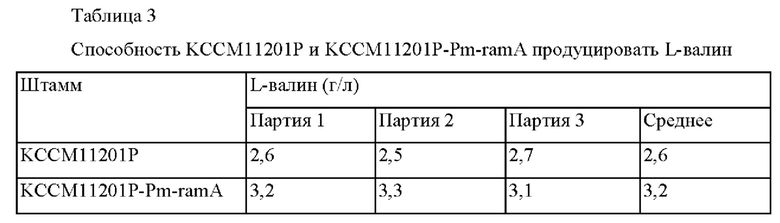
В результате, подтвердили, что способность продуцировать L-валин штамма KCCM11201P-Pm-ramA была усилена приблизительно на 23% по сравнению с KCCM11201P.
Пример 3-2. Конструирование мутантного штамма Corynebacterium Glutamicum KCCM11201P, в котором промотор улучшен и заменен, и оценка способности сконструированного штамма продуцировать L-валин
В соответствии с представленным в результатах примера 3-1 выше подтвердили, что способность продуцировать валин была усилена путем модификации промотора гена ramA, и, таким образом, конструировали векторы для улучшения или замены промотора ramA на основе модифицированного промотора в соответствии с SEQ ID NO: 2 для дополнительного увеличения экспрессии ramA.
Для того, чтобы сконструировать векторы, включающие модификацию, синтезировали праймер 3 (SEQ ID NO: 11) - праймер 10 (SEQ ID NO: 18) в таблице 4 таким образом, что они содержат область для фермента рестрикции xbaI по 5'-концу и 3'-концу.
Улучшенные промоторы ramA были названы Pm1, Pm2 и Pm3-ramA, и пару праймеров в соответствии с SEQ ID NO: 11 и 13 и пару праймеров в соответствии с SEQ ID NO: 12 и 14 использовали для конструирования Pm1-ramA, и пару праймеров в соответствии с SEQ ID NO: 11 и 15 и пару праймеров в соответствии с SEQ ID NO: 12 и 14 использовали для конструирования Pm2-ramA. Кроме того, пару праймеров в соответствии с SEQ ID NO: 11 и 17; и пару праймеров в соответствии с SEQ ID NO: 12 и 18 использовали для конструирования Pm3-ramA.
PCR проводили с использованием каждого из праймеров и хромосомной ДНК дикого типа Corynebacterium glutamicum в качестве матрицы [Sambrook et al., Molecular Cloning, a Laboratory Manual (1989), Cold Spring Harbor Laboratories].
В этом случае PCR осуществляли в следующих условиях: денатурация при 95°С в течение 5 минут; 30 циклов денатурации при 94°С в течение 30 секунд, отжиг при 56°С в течение 30 секунд, и полимеризация при 72°С в течение 1 минуты; и затем полимеризация при 72°С в течение 7 минут.
Затем продукт PCR, полученный при помощи вышеописанного процесса, и ранее полученный вектор pDZ-Pm-ramA обрабатывали ферментом рестрикции xbaI, а затем подвергали бесшовному клонированию. Бесшовное клонирование проводили с использованием набора In-Fusion® HD Cloning Kit (Clontech). E. coli DH5a трансформировали им и наносили на твердую среду LB, содержащую канамицин (25 мг/л). Колонии, трансформированные плазмидами, в которые был введен ген-мишень, отбирали при помощи PCR, и плазмиды получали путем экстракции и назвали, соответственно, pDZ-Pm1-ramA, pDZ-Pm2-ramA и pDZ-Pm3-ramA.


Кроме того, отдельно, для того, чтобы заменить промотор ramA на Pcj7, представляющий собой более сильный промотор, синтезировали праймер 11 (SEQ ID NO: 19) - праймер 16 (SEQ ID NO: 24) в таблице 4, имеющие область для фермента рестрикции xbaI по 5'-концу и 3'-концу.
Вектор pDZ-Pcj7-ramA конструировали тем же самым образом, как способ конструирования векторов в примере 3-1, описанном выше, с использованием пары праймеров в соответствии с SEQ ID NO: 19 и 20; пары праймеров в соответствии с SEQ ID NO: 21 и 22; и пары праймеров в соответствии с SEQ ID NO: 23 и 24.
Corynebacterium glutamicum KCCM11201P трансформировали векторами pDZ-Pm1-ramA, pDZ-Pm2-ramA, pDZ-Pm3-ramA и pDZ-Pcj7-ramA путем хромосомной гомологичной рекомбинации (van der Rest et al., Appl Microbiol Biotechnol 52:541-545, 1999). Штаммы, в хромосому которых был введен вектор путем гомологичной рекомбинации последовательности, отбирали в культуральной среде, содержащей канамицин (25 мг/л). Затем PCR проводили с использованием трансформантов Corynebacterium glutamicum, в которых вторичная рекомбинация была завершена с использованием SEQ ID NO: 9 и 10, и подтверждали штаммы, в которых промотор ramA был улучшен и заменен на промотор Pcj7.
Среди рекомбинантных штаммов Corynebacterium glutamicum KCCM11201P-Pm1-ramA, KCCM11201P-Pm2-ramA и KCCM11201P-Pm3-ramA были названы, соответственно, CA08-1518, CA08-1519 и СА08-1520, и депонированы в Корейский Центр Культур Микроорганизмов (KCCM), признанный в качестве международного депозитария в соответствии с Будапештским договором о международном признании депонирования микроорганизмов для целей патентной процедуры 27 апреля 2020 года под номерами, соответственно, KCCM12704P, KCCM12705P и KCCM12706P.
Кроме того, штамм с заменой на промотор Pcj7, был назван KCCM11201P-Pcj7-ramA. Затем способность продуцировать валин оценивали тем же самым образом, как в примере 3-1 выше, и результаты представлены в таблице 5 ниже.
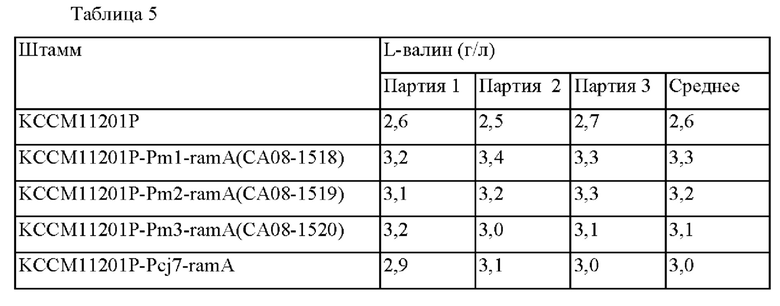
На основании результатов в таблице 5 подтвердили, что штаммы KCCM11201P-Pm1-ramA (СА08-1518), KCCM11201P-Pm2-ramA (СА08-1519) и KCCM11201P-Pm3-ramA (СА08-1520), включающие улучшенный промотор по сравнению с штаммом KCCM11201P, демонстрировали увеличение продукции L-валина приблизительно на 27%, 23% и 19%, соответственно, что было близким или больше чем способность штамма KCCM11201P-Pcj7-ramA продуцировать L-валин, у которого промотор был заменен на более сильный.
Пример 3-3: Конструирование мутантного штамма Corynebacterium glutamicum CJ7V, в котором промотор гена ramA был улучшен и заменен, и оценка способности сконструированного штамма продуцировать L-валин
Для того, чтобы идентифицировать, достигается ли эффект усиления способности продуцировать L-валин в других штаммах, продуцирующих L-валин, относящихся к Corynebacterium glutamicum, в дикий тип Corynebacterium glutamicum АТСС14067 вводили один тип модификации [ilvN(A42V); Biotechnology and Bioprocess Engineering, June 2014, Volume 19, Issue 3, pp 456-467] для получения штамма, обладающего усиленной способностью продуцировать L-валин.
В частности, геномную ДНК штамма дикого типа Corynebacterium glutamicum АТСС 14067 экстрагировали с использованием набора G-spin Total DNA Extraction Mini Kit (Intron, номер по каталогу №17045) в соответствии с протоколами в наборе. PCR проводили с использованием геномной ДНК в качестве матрицы. Для того, чтобы сконструировать вектор для введения модификации A42V в ген ilvN, фрагменты А и В гена получали с использованием, соответственно, пары праймеров в соответствии с SEQ ID NO: 25 и 26; и пары праймеров в соответствии с SEQ ID NO: 27 и 28. PCR осуществляли в следующих условиях: денатурация при 94°С в течение 5 минут; 25 циклов денатурации при 94°С в течение 30 секунд, отжиг при 55°С в течение 30 секунд и полимеризация при 72°С в течение 60 секунд, и затем полимеризация при 72°С в течение 7 минут.
В результате получали фрагменты А и В полинуклеотида, оба из которых включали 537 п.о. Продукт PCR длиной 1044 п.о. (далее называемый как "фрагмент 2 с введенной модификацией") получали путем осуществления PCR с перекрывающимися праймерами с использованием двух фрагментов в качестве матриц в соответствии с SEQ ID NO: 25 и 26.
После обработки полученного фрагмента 2 с введенной модификацией ферментом рестрикции XbaI (New England Biolabs, Beverly, MA) фрагмент 2 с введенной модификацией лигировали с вектором pDZ, обработанным тем же самым ферментом рестрикции, с использованием Т4 лигазы (New England Biolabs, Beverly, MA). После трансформации E.coli DH5a сконструированным геном трансформированные штаммы отбирали в среде LB, содержащей канамицин, и из нее получали ДНК с использованием набора DNA-spin plasmid DNA purification kit (iNtRON). Вектор, используемый для введения модификации A42V в ген ilvN, назвали pDZ-ilvN(A42V).

Затем Corynebacterium glutamicum АТСС 14067 дикого типа трансформировали вектором pDZ-ilvN(A42V) путем хромосомной гомологичной рекомбинации (van der Rest et al., Appl Microbiol Biotechnol 52:541-545, 1999). Штаммы, в хромосому которых был введен вектор путем гомологичной рекомбинации, последовательности отбирали в культуральной среде, содержащей канамицин (25 мг/л). Затем фрагменты гена амплифицировали при помощи PCR, проводимой с трансформантами Corynebacterium glutamicum, в которых вторичная рекомбинация была завершена, с использованием SEQ ID NO: 25 и 26, и штаммы, в которые была введена модификация, подтверждали путем секвенирования гена. Рекомбинантный штамм назвали Corynebacterium glutamicum CJ7V.
Наконец, Corynebacterium glutamicum CJ7V трансформировали векторами тем же самым образом, как в примерах 3-1 и 3-2, и штаммы назвали, соответственно, Corynebacterium glutamicum CJ7V-Pm1-ramA, CJ7V-Pm2-ramA, CJ7V-Pm3-ramA и CJ7V-Pcj7-ramA. Для сравнения способности продуцировать L-валин сконструированными штаммами, их выращивали тем же самым образом, как в примере 3-1 выше, концентрации L-валина анализировали, и проанализированные концентрации L-валина представлены в таблице 7 ниже.
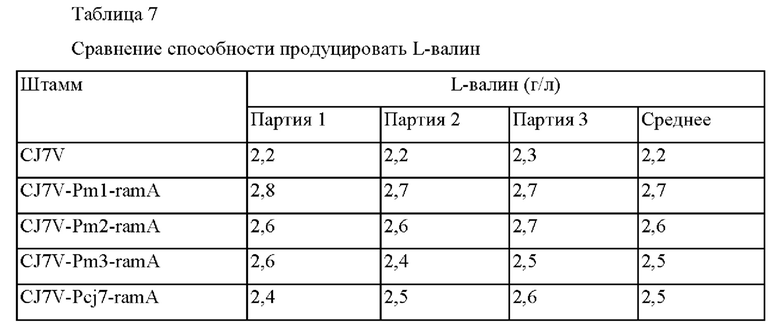
В соответствии с представленными в таблице 7 данными, подтвердили, что штаммы CJ7V-Pm1-ramA, CJ7V-Pm2-ramA и CJ7V-Pm3-ramA, включающие улучшенный промотор демонстрировали увеличение продукции L-валина, соответственно, приблизительно на 23%, 18% и 14%, что было близким или больше чем способность штамма CJ7V-Pcj7-ramA продуцировать L-валин, у которого промотор был заменен на более сильный.
Пример 3-4: Конструирование мутантного штамма Corynebacterium glutamicum CJ8V, в котором промотор гена ramA улучшен и заменен, и оценка сконструированного штамма продуцировать L-валин
Для того, чтобы идентифицировать, достигается ли эффект улучшения способности продуцировать L-валин для других штаммов, продуцирующих L-валин, относящихся к Corynebacterium glutamicum, в Corynebacterium glutamicum АТСС 13869 дикого типа вводили один тип модификации [ilvN(A42V)] тем же самым образом, как в способе в соответствии с примером 3-3 получения штамма, обладающего способностью продуцировать L-валин, и рекомбинантный штамм назвали Corynebacterium glutamicum CJ8V.
Наконец, Corynebacterium glutamicum CJ8V трансформировали векторами тем же самым образом, как в способе в примерах 3-1 и 3-2, и штаммы назвали, соответственно, Corynebacterium glutamicum CJ8V-Pm1-ramA, CJ8V-Pm2-ramA, CJ8V-Pm3-ramA и CJ8V-Pcj7-ramA. Для сравнения способности продуцировать L-валин между сконструированными штаммами их выращивали тем же самым образом как в примере 3-1 выше, анализировали концентрации L-валина, и проанализированные концентрации L-валина представлены в таблице 8 ниже.
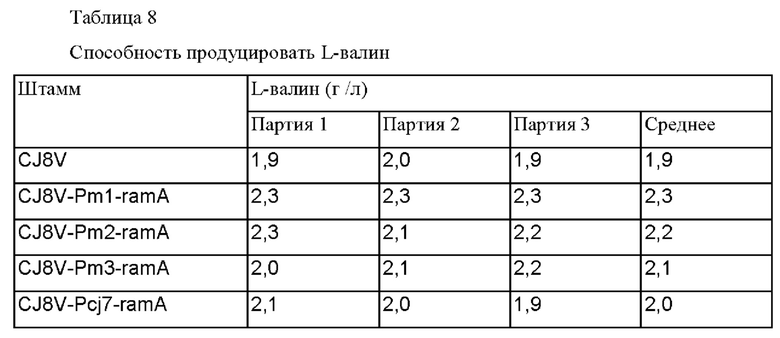
В соответствии с представленными в таблице 8 данными, подтвердили, что штаммы CJ8V-Pm1-ramA, CJ8V-Pm2-ramA и CJ8V-Pm3-ramA, включающие улучшенный промотор по сравнению с штаммом CJ8V, демонстрировали увеличение продукции L-валина, соответственно, приблизительно на 21%, 16% и 10%, что было близким или больше чем способность штамма CJ8V-Pcj7-ramA продуцировать L-валин, у которого промотор был заменен на более сильный.
Пример 4. Конструирование мутантного штамма Corynebacterium glutamicum KCCM11661P и KCCM11662P, продуцирующего L-лейцин, в который введена модификация промотора, и оценка способности продуцировать L-лейцин
Corynebacterium glutamicum KCCM11661P и KCCM11662P трансформировали векторами pDZ-Pm1-ramA, pDZ-Pm2-ramA, pDZ-Pm3-ramA и pDZ-Pcj7-ramA путем хромосомной гомологичной рекомбинации (van der Rest et al., Appl Microbiol Biotechnol 52:541-545, 1999). Штаммы, в хромосому которых был введен вектор путем гомологичной рекомбинации последовательности, отбирали в культуральной среде, содержащей канамицин (25 мг/л). Затем PCR проводили с трансформантами Corynebacterium glutamicum, в которых вторичная рекомбинация была завершена, с использованием SEQ ID NO: 9 и 10, и подтверждали штаммы, в которых промотор ramA был улучшен и заменен на Pcj7. Рекомбинантные штаммы назвали, соответственно, Corynebacterium glutamicum KCCM1166lP-Pm1-ramA, KCCM11661P Pm2-ramA, К KCCM11661P-Pm3-ramA, KCCM11661P-Pcj7-ramA и KCCM11662P-Pm1-ramA, KCCM11662P Pm2-ramA, К KCCM11662P-Pm3-ramA и KCCM11662P-Pcj7-ramA.
Сконструированные штаммы выращивали в соответствии со следующим способом и сравнивали способность продуцировать лейцин.
После субкультивирования каждого из штаммов в питательной среде каждый из штаммов инокулировали в колбу с угловыми перегородками объемом 250 мл, содержащую 25 мл продуцирующей среды, и выращивали при перемешивании при 30°С в течение 72 часов при 200 об./мин. Затем, концентрации L-лейцина анализировали с использованием HPLC, и проанализированные концентрации L-лейцина представлены в таблице 9 ниже.
<Питательная среда (рН 7,2)>
10 г глюкозы, 5 г мясного бульона, 10 г полипептона, 2,5 г хлорида натрия, 5 г дрожжевого экстракта, 20 г агара, 2 г мочевины (на основе 1 л дистиллированной воды)
<Продуцирующая среда (рН 7,0)>
50 г глюкозы, 20 г сульфата аммония, 20 г кукурузного экстракта, 1 г двухосновного фосфата калия, 0,5 г гептагидрата сульфата магния, 100 мкг биотина, 1 мг тиамина-HCl и 15 г карбоната кальция (на основе 1 л дистиллированной воды)
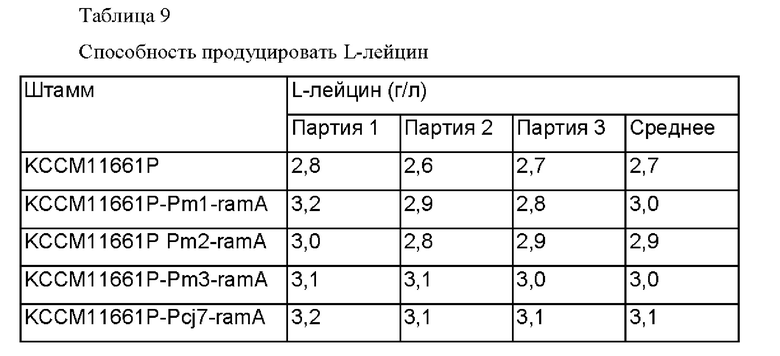
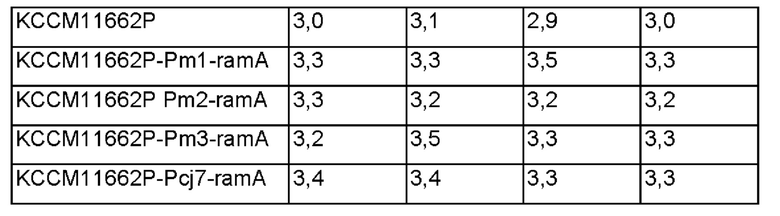
В результате подтвердили, что штаммы KCCM11661P-Pm1-ramA, KCCM11661P Pm2-ramA и KCCM11661P-Pm3-ramA, включающие улучшенный промотор, демонстрировали увеличение продукции L-лейцина, соответственно, на 11%, 7% и 11% по сравнению с штаммом KCCM11661P, что было близким или больше чем способность штамма KCCM11661P-Pcj7-ramA продуцировать L-лейцин, у которого промотор был заменен на более сильный.
Кроме того, подтвердили, что штаммы KCCM11662P-Pm1-ramA, KCCM11662P Pm2-ramA и KCCM11662P-Pm3-ramA, включающие улучшенный штамм, демонстрировали увеличение продукции L-лейцина, соответственно, на 10%, 6% и 10% по сравнению с штаммом KCCM11662P, что было близким или больше чем способность штамма KCCM11662P-Pcj7-ramA продуцировать L-лейцин, у которого промотор был заменен на более сильный.
Пример 5. Конструирование мутантного штамма Corynebacterium glutamicum KCCM11248P, продуцирующего L-изолейщш, в котором промотор гена ramA улучшен и заменен, и оценка способности продуцировать L-изолейцин
Для того, чтобы идентифицировать, достигается ли эффект, улучшающий способность продуцировать L-изолейцин, в других штаммах, продуцирующих L-изолейцин, относящихся к Corynebacterium glutamicum, штамм Corynebacterium glutamicum KCCM11248P, продуцирующий L-изолейцин, трансформировали векторами тем же самым образом, как в примерах 3-1 и 3-2 выше, и трансформированные штаммы назвали, соответственно, Corynebacterium glutamicum KCCM11248P-Pm-ramA, KCCM11248P-Pm1-ramA, KCCM11248P-Pm2-ramA, KCCM11248P-Pm3-ramA и KCCM11248P-Pcj7-ramA. Штаммы KCCM11248P-Pm-ramA, KCCM11248P-Pm1-ramA, KCCM11248P-Pm2-ramA, KCCM11248P-Pm3-ramA и KCCM11248P-Pcj7-ramA выращивали в соответствии со следующим способом, и оценивали способность продуцировать изолейцин.
Каждый из штаммов инокулировали в колбу с угловыми перегородками объемом 250 мл, содержащую 25 мл среды для посева, и выращивали при перемешивании при 30°С в течение 20 часов при 200 об./мин. Затем 1 мл среды для посева инокулировали в колбу с угловыми перегородками объемом 250 мл, содержащую 24 мл продуцирующей среды и выращивали при перемешивании при 30°С в течение 48 часов при 200 об./мин. Композиции среды для посева и продуцирующей среды являются следующими.
<Среда для посева (рН 7,0)>
20 г глюкозы, 10 г пептона, 5 г дрожжевого экстракта, 1,5 г мочевины, 4 г KH2PO4, 8 г K2HPO4, 0,5 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамина НС1, 2000 мкг пантотената кальция и 2000 мкг никотинамида (на основе 1 л дистиллированной воды)
<Продуцирующая среда (рН 7,0)>
50 г глюкозы, 12,5 г (NH4)2SO4, 2,5 г соевого белка, 5 г кукурузного экстракта, 3 г мочевины, 1 г KH2PO4, 0,5 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамина HCl, 2000 мкг пантотената кальция, 3000 мкг никотинамида, 30 г СаСО3 (на основе 1 л дистиллированной воды)
После завершения выращивания концентрации L-изолейцина измеряли при помощи HPLC, измеренные концентрации L-изолейцина представлены в таблице 10 ниже.
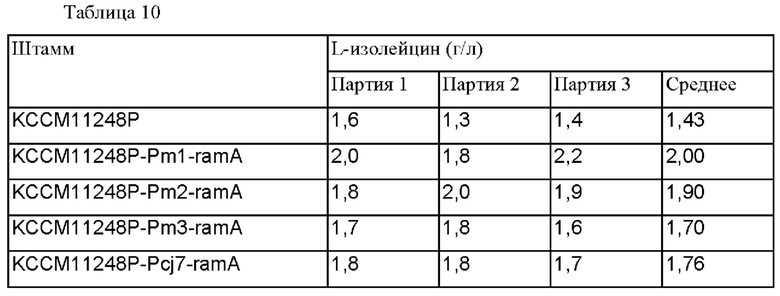
В результате подтвердили, что штаммы KCCM11248P-Pm1-ramA, KCCM11248P-Pm2-ramA и KCCM11248P-Pm3-ramA, включающие улучшенный промотор, демонстрировали увеличение продукции L-изолейцина, соответственно, на 39%, 32% и 18%, по сравнению с штаммом KCCM11248P, что было близким или больше чем способность штамма KCCM11248P-Pcj7-ramA продуцировать L-изолейцин, у которого промотор был заменен на более сильный.
Вышеприведенное описание настоящего изобретения предложено для иллюстрации, и специалистам в данной области техники должно быть понятно, что различные изменения и модификации могут быть реализованы без изменения технической концепции и основных признаков в соответствии с описанием настоящего изобретения. Таким образом, ясно, что вышеописанные воплощения являются иллюстративными во всех аспектах, а не ограничивают описание настоящего изобретения. Таким образом, объем описания определен не подробным описанием, а формулой изобретения и ее эквивалентами, и все изменения в объеме формулы изобретения и ее эквивалентах следует рассматривать как включенные в данное описание.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CJ CheilJedang Corporation
<120> МИКРООРГАНИЗМ, ОБЛАДАЮЩИЙ УСИЛЕННОЙ СПОСОБНОСТЬЮ ПРОДУЦИРОВАТЬ L-
АМИНОКИСЛОТУ С РАЗВЕТВЛЕННОЙ ЦЕПЬЮ, И СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ С
РАЗВЕТВЛЕННОЙ ЦЕПЬЮ С ЕГО ИСПОЛЬЗОВАНИЕМ
<130> OPA21067-PCT
<150> KR 10-2020-0061175
<151> 2020-05-21
<160> 28
<170> KoPatentIn 3.0
<210> 1
<211> 55
<212> ДНК
<213> Искусственная последовательность
<220>
<223> промотор гена RamA
<400> 1
gcgatccgcc tcgactatgt tcacccccaa aggggaagta cactgtaccc ttgtc 55
<210> 2
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариант промотора гена RamA
<400> 2
gcgatccgcc tcgactatgt tcacccccaa aggggaagta taatgtaccc ttgtcgaatg 60
attgttactc gtgacgcgcc ctatgggtgt accagcacgg gtgtaaagca ggaggaaatc 120
tgaag 125
<210> 3
<211> 55
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариант промотора гена RamA Pm1
<400> 3
gcgatccgcc tcgactatgt tcacccccaa aggtgtggta taatggaccc ttgtc 55
<210> 4
<211> 55
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариант промотора гена RamA Pm2
<400> 4
gcgatccgcc tcgactatgt tcacccccaa aggggaagta taatggaccc ttgtc 55
<210> 5
<211> 55
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариант промотора гена RamA Pm3
<400> 5
gcgatccgcc tcgactatgt tcacccccaa aggtgtggta cactggaccc ttgtc 55
<210> 6
<211> 512
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариант промотора гена RamA Pcj7
<400> 6
gcgatccgcc tcgactatgt tcacccccaa aggggaagta cactgtaccc ttgtcgaatg 60
attgttactc gtgacgcgcc ctatgggtgt accagcacgg gtgtaaagca ggaggaaatc 120
tgaaggtacc gccggcatag cctaccgatg tagattccac cccatctgtc tcccagtaca 180
ttttttcatg accccagaaa catcccagcg ctactaatag ggagcgttga ccttccttcc 240
acggaccggt aatcggagtg cctaaaaccg catgcggctt aggctccaag ataggttctg 300
cgcggccggg taatgcatct tctttagcaa caagttgagg ggtaggtgca aataagaacg 360
acatagaaat cgtctccttt ctgtttttaa tcaacataca ccaccaccta aaaattcccc 420
gaccagcaag ttcacagtat tcgggcacaa tatcgttgcc aaaatattgt ttcggaatat 480
catgggatac gtacccaacg aaaggaaaca ct 512
<210> 7
<211> 846
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ген RamA ATCC14067
<400> 7
gtggataccc agcggattaa agatgacgaa gatgctattc gttcggcgct gacatcgctg 60
aaaaccgcaa caggcatccc agtcaccatg ttcgccactg tgttgcagga caatcgcctg 120
caaattactc agtgggttgg gttgcgtacc ccggctctgc agaatctggt cattgaacca 180
ggtgtgggcg ttggtggacg cgtcgtcgca acccgtcgtc cggttggtgt gagtgattac 240
accagggcaa atgtcatttc acatgagaag gattccgcga ttcaggatga gggccttcat 300
tccattgtcg cagttcccgt gatcgtgcac cgcgaaatcc gtggcgtttt gtatgttggc 360
gttcactctg cggtgcgtct cggcgacact gttattgaag aagtcaccat gactgcgcgc 420
acgttggaac aaaacctggc gatcaactcc gcgcttcgcc gcaatggcgt tcctgatggt 480
cgcggttccc tcaaagctag ccgcgtgatg aatggggcgg agtgggagca ggttcgttcc 540
actcattcca agctgcgcat gctggcaaat cgtgtgaccg atgaggatct gcgccgcgat 600
ttggaagagc tttgcgatca gatggtcacc ccagtccgca tcaagcagac caccaagctg 660
tccgcgcgtg agttggacgt gctggcttgt gtcgcgctcg gtcacaccaa cgtcgaagct 720
gctgaagaga tgggcatcgg cgcggaaacc gtcaagagct acctgcgctc ggtcatgcgc 780
aagctcggcg cccacacgcg ctacgaggca gtcaacgcag cacgccggat cggcgcactg 840
ccttaa 846
<210> 8
<211> 281
<212> PRT
<213> Искусственная последовательность
<220>
<223> ген RamA ATCC14067 a.a.
<400> 8
Met Asp Thr Gln Arg Ile Lys Asp Asp Glu Asp Ala Ile Arg Ser Ala
1 5 10 15
Leu Thr Ser Leu Lys Thr Ala Thr Gly Ile Pro Val Thr Met Phe Ala
20 25 30
Thr Val Leu Gln Asp Asn Arg Leu Gln Ile Thr Gln Trp Val Gly Leu
35 40 45
Arg Thr Pro Ala Leu Gln Asn Leu Val Ile Glu Pro Gly Val Gly Val
50 55 60
Gly Gly Arg Val Val Ala Thr Arg Arg Pro Val Gly Val Ser Asp Tyr
65 70 75 80
Thr Arg Ala Asn Val Ile Ser His Glu Lys Asp Ser Ala Ile Gln Asp
85 90 95
Glu Gly Leu His Ser Ile Val Ala Val Pro Val Ile Val His Arg Glu
100 105 110
Ile Arg Gly Val Leu Tyr Val Gly Val His Ser Ala Val Arg Leu Gly
115 120 125
Asp Thr Val Ile Glu Glu Val Thr Met Thr Ala Arg Thr Leu Glu Gln
130 135 140
Asn Leu Ala Ile Asn Ser Ala Leu Arg Arg Asn Gly Val Pro Asp Gly
145 150 155 160
Arg Gly Ser Leu Lys Ala Ser Arg Val Met Asn Gly Ala Glu Trp Glu
165 170 175
Gln Val Arg Ser Thr His Ser Lys Leu Arg Met Leu Ala Asn Arg Val
180 185 190
Thr Asp Glu Asp Leu Arg Arg Asp Leu Glu Glu Leu Cys Asp Gln Met
195 200 205
Val Thr Pro Val Arg Ile Lys Gln Thr Thr Lys Leu Ser Ala Arg Glu
210 215 220
Leu Asp Val Leu Ala Cys Val Ala Leu Gly His Thr Asn Val Glu Ala
225 230 235 240
Ala Glu Glu Met Gly Ile Gly Ala Glu Thr Val Lys Ser Tyr Leu Arg
245 250 255
Ser Val Met Arg Lys Leu Gly Ala His Thr Arg Tyr Glu Ala Val Asn
260 265 270
Ala Ala Arg Arg Ile Gly Ala Leu Pro
275 280
<210> 9
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 9
gctctagata ggccggttcg gactcgccct gcc 33
<210> 10
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 10
gctctagaaa cgtgcgcgca gtcatggtga ctt 33
<210> 11
<211> 50
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 11
gctcggtacc cggggatcct ctagataggc cggttcggac tcgccctgcc 50
<210> 12
<211> 50
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 12
ttacgccaag cttgcatgct ctagaaacgt gcgcgcagtc atggtgactt 50
<210> 13
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 13
cgacaagggt ccattatacc acacctttgg gggt 34
<210> 14
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 14
acccccaaag gtgtggtata atggaccctt gtcg 34
<210> 15
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 15
tcgacaaggg tacattatac ttccccttt 29
<210> 16
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 16
aaaggggaag tataatgtac ccttgtcga 29
<210> 17
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 17
aagggtacag tgtaccacac ctttgggggt 30
<210> 18
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 18
acccccaaag gtgtggtaca ctgtaccctt 30
<210> 19
<211> 50
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 19
attcgagctc ggtacccggt ctagatcaag aaactgcagg tgtgtaccga 50
<210> 20
<211> 50
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 20
catcggtagg ctatgccggc ggtaccttca gatttcctcc tgctttacac 50
<210> 21
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 21
gtaccgccgg catagcctac cgatg 25
<210> 22
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 22
agtgtttcct ttcgttgggt acgta 25
<210> 23
<211> 50
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 23
tacgtaccca acgaaaggaa acactgtgga tacccagcgg attaaagatg 50
<210> 24
<211> 50
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 24
tgcatgcctg caggtcgact ctagaatcgc ggcgcagatc ctcatcggtc 50
<210> 25
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 25
aatttctaga ggcagaccct attctatgaa gg 32
<210> 26
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 26
agtgtttcgg tctttacaga cacgagggac 30
<210> 27
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 27
gtccctcgtg tctgtaaaga ccgaaacact 30
<210> 28
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 28
aatttctaga cgtgggagtg tcactcgctt gg 32
1
<---
Изобретение относится к биотехнологии. Предложены микроорганизм, продуцирующий L-аминокислоту с разветвленной цепью, обладающий усиленной активностью регулятора ацетатного метаболизма A по сравнению с эндогенной активностью регулятора ацетатного метаболизма A, и способ получения L-аминокислот с разветвленной цепью с его использованием, где L-аминокислота с разветвленной цепью представляет собой лейцин или изолейцин. Изобретение обеспечивает получение увеличенных выходов лейцина или изолейцина. 2 н. и 4 з.п. ф-лы, 10 табл., 5 пр.
1. Микроорганизм, продуцирующий L-аминокислоту с разветвленной цепью, обладающий усиленной активностью регулятора ацетатного метаболизма A по сравнению с эндогенной активностью регулятора ацетатного метаболизма A,
где усиленная активность получена путем: введения модификации в промотор регулятора ацетатного метаболизма A; замены эндогенного промотора на сильный гетерологичный промотор или их комбинации,
где L-аминокислота с разветвленной цепью представляет собой лейцин или изолейцин,
где модификация включает замену нуклеотида на другой нуклеотид в одном или более соответствующих положениях, выбранных из положений 34, 36, 37, 41 и 43 нуклеотидной последовательности, представленной в SEQ ID NO: 1,
где полинуклеотид содержит замену 34-го нуклеотида на T; замену 36-го нуклеотида на T; замену 37-го нуклеотида на G; замену 41-го нуклеотида на T; замену 43-го нуклеотида на A; или их комбинацию, в нуклеотидной последовательности, представленной в SEQ ID NO: 1.
2. Микроорганизм по п. 1, где полинуклеотид содержит одну нуклеотидную последовательность, выбранную из SEQ ID NO: 3-5.
3. Микроорганизм по п. 1, который представляет собой микроорганизм рода Corynebacterium.
4. Микроорганизм по п. 3, где микроорганизм рода Corynebacterium включает Corynebacterium glutamicum.
5. Способ получения L-аминокислоты с разветвленной цепью, включающий культивирование микроорганизма по любому из пп. 1-4 в культуральной среде,
где L-аминокислота с разветвленной цепью представляет собой лейцин или изолейцин.
6. Способ по п. 5, дополнительно включающий выделение или отделение лейцина или изолейцина из культуральной среды или микроорганизма.
| ZHANG H | |||
| ET AL | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| WO 2019147059 A1, 01.08.2019 | |||
| US 2002197605 A1, | |||
Авторы
Даты
2024-05-21—Публикация
2021-05-20—Подача