Ссылка на родственные заявки
Согласно настоящей заявке испрашивается приоритет в соответствии с заявкой на выдачу патента США № 62/747877, поданной 19 октября 2018 года, и в соответствии с заявкой на выдачу патента США № 62/790788, поданной 10 января 2019 года, каждая из которых включена в данный документ посредством ссылки.
Область техники, к которой относится изобретение
Изобретение относится к области биотехнологии, связанной с получением D-тагатозы. Более конкретно, в изобретении представлены усовершенствованные способы получения D-тагатозы, способные ферментативно превращать сахариды (например, полисахариды, олигосахариды, дисахариды, сахарозу, D-глюкозу и D-фруктозу) в D-тагатозу.
Предшествующий уровень техники
D-тагатоза (далее тагатоза) представляет собой низкокалорийный, натуральный подсластитель, который обладает 92% сладости сахарозы, но только 38% калорий. Из-за своих высоких отпускных цен его использование в качестве подсластителя ограничено. Тагатоза отличается множеством преимуществ для здоровья: она не вызывает кариеса; она является низкокалорийной; у нее очень низкий гликемический индекс, равный 3; она снижает гликемический индекс глюкозы на 20%; она может снизить средние уровни глюкозы в крови; она помогает предотвращать сердечно-сосудистые заболевания, инсульты и другие сосудистые заболевания, способствуя холестерину липопротеинов высокой плотности (HDL); и он представляет собой проверенный пребиотик и антиоксидант. Lu et al., Tagatose, a New Antidiabetic and Obesity Control Drug, Diabetes Obes. Metab. 10(2): 109-34 (2008). Таким образом, тагатоза явно имеет множество вариантов применения в потребляемых продуктах и в различных отраслях промышленности, таких как фармацевтическая, биотехнологическая, академическая, пищевая, производство напитков, пищевых добавок и бакалейная промышленность.
Тагатозу преимущественно получают посредством гидролиза лактозы с помощью лактазы с образованием D-глюкозы и D-галактозы (см. WO 2011/150556, CN 103025894, US 5,002,612, US 6057135 и US 8802843). Затем D-галактозу изомеризуют в D-тагатозу либо химически с помощью гидроксида кальция в щелочных условиях, либо ферментативно с помощью L-арабинозаизомеразы в условиях нейтрального pH. Конечный продукт выделяют с помощью комбинации фильтрации и ионообменной хроматографии. Этот способ страдает из-за дорогостоящего разделения D-глюкозы и D-галактозы и низкого выхода продукта. Разрабатывается несколько методов ферментация микробных клеток, но ни один из них не является практической альтернативой из-за их зависимости от дорогостоящего сырья (например, галактита и D-псикозы), низкого выхода продукта и дорогостоящего разделения. Также сообщалось о других методах получения тагатозы. См., например, Lee et al. Scientific Reports | 7: 1934 | DOI:10.1038/s41598-017-02211-3, pp. 1-8; публикацию патента США № 2018/0023073; публикации международных заявок на патент №№ WO 2014/196811, WO 2018/004310, WO 2018/021894, WO 2018/182344, WO 2018/182345, WO 2018/182354, WO 2018/182355 и WO 2016/064146.
В публикации международной заявки на патент № WO 2017/059278 недавно описан ферментативный синтез тагатозы в способе, который включает этапы преобразования фруктозо-6-фосфата (F6P) в тагатозо-6-фосфат (T6P), катализируемого эпимеразой, фруктозо-6-фосфатэпимеразой, и этап преобразования T6P в тагатозу, катализируемого фосфатазой, тагатозо-6-фосфат фосфатазой. Однако несмотря на усовершенствования в ферментативном получении тагатозы все-таки существует необходимость и нужда в предоставлении дополнительно усовершенствованных способов получения тагатозы, которые могут, например, обеспечивать более высокий выход с пониженными количествами ферментов. Имеется большой промышленный и коммерческий интерес к снижению стоимости получения тагатозы, и это снижение включает использование уменьшенного количества ферментов и использование комбинаций ферментов, более эффективных, чем ранее использованные ферменты.
Сущность изобретения
В изобретении представлены усовершенствованные способы получения тагатозы, позволяющие ферментативно превращать сахариды (например, полисахариды, олигосахариды, дисахариды, сахарозу, D-глюкозу и D-фруктозу) в тагатозу. В одном аспекте усовершенствованный способ согласно изобретению получения тагатозы из сахарида включает этап преобразования фруктозо-6-фосфата (F6P) в тагатозо-6-фосфат (T6P) с использованием фруктозо-6-фосфатэпимеразы (F6PE), причем F6PE содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичность последовательности с SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 7. В другом аспекте усовершенствованный способ согласно изобретению получения тагатозы из сахарида включает этап преобразования T6P в тагатозу с использованием тагатозо-6-фосфатфосфатазы (T6PP), причем T6PP содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичность последовательности с SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6. В некоторых вариантах осуществления изобретения усовершенствованный способ включает этап преобразования фруктозо-6-фосфата (F6P) в тагатозо-6-фосфат (T6P) с использованием фруктозо-6-фосфатэпимеразы (F6PE), причем F6PE содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичность последовательности с SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 7, и этап преобразования T6P в тагатозу с использованием тагатозо-6-фосфатфосфатазы (T6PP), причем T6PP содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичность последовательности с SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6.
В некоторых усовершенствованных способах согласно изобретению способ получения тагатозы также включает этап преобразования глюкозо-6-фосфата (G6P) в F6P, где этап катализируют фосфоглюкозоизомеразой (PGI). Некоторые способы согласно изобретению дополнительно включают этап преобразования глюкозо-1-фосфата (G1P) в G6P, катализируемого фосфоглюкомутазой (PGM). Некоторые способы согласно изобретению дополнительно включают этапы преобразования сахарида в G1P, катализируемого по меньшей мере одним ферментом.
Сахариды, используемые в любом из способов, можно выбрать из группы, состоящей из крахмала или его производного, целлюлозы или ее производного и сахарозы. Крахмалом или его производным может быть амилоза, амилопектин, растворимый крахмал, амилодекстрин, мальтодекстрин, мальтоза, мальтотриоза или глюкоза. В некоторых усовершенствованных способах согласно изобретению способ получения тагатозы включает преобразование крахмала в производное крахмала с помощью ферментативного гидролиза или с помощью кислотного гидролиза крахмала. В других способах производное крахмала получают с помощью ферментативного гидролиза крахмала, катализируемого изоамилазой, пуллуланазой, альфа-амилазой или комбинацией двух или более из этих ферментов. Некоторые способы согласно изобретению могут дополнительно включать добавление 4-глюкантрансферазы (4GT).
Другие способы согласно изобретению получения тагатозы дополнительно включают этап преобразования фруктозы в F6P, катализируемого по меньшей мере одним ферментом. Другие способы согласно изобретению дополнительно включают этап преобразования сахарозы во фруктозу, катализируемого по меньшей мере одним ферментом. G6P, подлежащий использованию в некоторых способах получения тагатозы, также может быть получен путем преобразования глюкозы в G6P, катализируемого по меньшей мере одним ферментом. В свою очередь, глюкоза может быть получена путем преобразования сахарозы в глюкозу, катализируемого по меньшей мере одним ферментом.
Способ согласно изобретению проводят в условиях реакции в том числе при температуре в диапазоне от приблизительно 37°C до приблизительно 85°C, с pH в диапазоне от приблизительно 5,0 до приблизительно 9,0 и/или в течение от приблизительно 1 часа до приблизительно 48 часов, или в виде непрерывных реакций. В некоторых вариантах осуществления этапы способа получения тагатозы проводят в этих условиях реакции в одном биореакторе. В других вариантах осуществления этапы проводят в этих условиях реакции во многих биореакторах, расположенных последовательно.
В некоторых способах согласно изобретению этапы получения тагатозы проводят без ATP, без NAD(H), с концентрацией фосфата от приблизительно 0,1 мМ до приблизительно 150 мМ, фосфат используют повторно, и/или этап преобразования T6P в тагатозу включает энергетически выгодную химическую реакцию.
Краткое описание чертежей
На фиг. 1 представлено схематичное изображение, показывающее ферментативный путь преобразования крахмала или его производных продуктов в тагатозу. Использованы следующие сокращения: αGP, альфа-глюканфосфорилаза или фосфорилаза крахмала; PGM, фосфоглюкомутаза; PGI, фосфоглюкоизомераза; F6PE, фруктозо-6-фосфатэпимераза; T6PP, тагатозо-6-фосфатфосфатаза; IA, изоамилаза; PA, пуллуланаза; MP, мальтозофосфорилаза; PPGK, полифосфатглюкокиназа.
На фиг. 2 представлен ферментативный путь преобразования целлюлозы или ее производных продуктов в тагатозу. CDP, целлодекстринфосфорилаза; CBP, целлобиозофосфорилаза; PPGK, полифосфатглюкокиназа; PGM, фосфоглюкомутаза; PGI, фосфоглюкоизомераза; F6PE, фруктозо-6-фосфатэпимераза; T6PP, тагатозо-6-фосфатфосфатаза.
На фиг. 3 представлено схематичное изображение, показывающее ферментативный путь преобразования фруктозы в тагатозу. PPFK, полифосфатфруктокиназа; F6PE, фруктозо-6-фосфатэпимераза; T6PP, тагатозо-6-фосфатфосфатаза.
На фиг. 4 представлено схематичное изображение, показывающее ферментативный путь преобразования глюкозы в тагатозу. PPGK, полифосфатглюкокиназа; PGI, фосфоглюкоизомераза; F6PE, фруктозо-6-фосфатэпимераза; T6PP, тагатозо-6-фосфатфосфатаза.
На фиг. 5 представлен ферментативный путь преобразования сахарозы или ее производных продуктов в тагатозу. SP, сахароза фосфорилаза; PPFK, полифосфатфруктокиназа; PGM, фосфоглюкомутаза; PGI, фосфоглюкоизомераза; F6PE, фруктозо-6-фосфатэпимераза; T6PP, тагатозо-6-фосфатфосфатаза.
На фиг. 6 представлена энергия Гиббса реакции между промежуточными продуктами на основании образования энергии Гиббса для преобразования глюкозы 1-фосфат в тагатозу.
На фиг. 7 представлено преобразование F6P в тагатозу, как описано в примере 3 на хроматограмме HPLC. (Сплошная линия) хроматограмма 0 часов; (пунктирная линия) 2 часа с F6PE (Uniprot ID B5YBD7) и T6PP (Uniprot ID O29805); и (линия точками) 2 часа в улучшенном способе с F6PE (Uniprot ID A0A0P6XN50) и T6PP (Uniprot ID D6YBK5); показаны пики (1) неопределенный компонент, (2) F6P и T6P, (3) свободный фосфат, (4) тагатоза и (5) фруктоза.
Подробное описание изобретения
Изобретение в общем относится к усовершенствованным ферментативным способам преобразования сахаридов в тагатозу. Например, изобретение относится к усовершенствованным способам преобразования сахаридов, таких как крахмал, целлюлоза, сахароза, глюкоза и фруктоза и их производных продуктов в тагатозу с использованием бесклеточных смесей ферментов. В отличие от способов получения на основе клеток изобретение включает бесклеточное получение тагатозы, имеет относительно высокие скорости реакции из-за устранения клеточной мембраны, которая часто замедляет транспорт субстрата/продукта в клетку и из нее. Способы согласно изобретению также приводят к конечному продукту, не содержащему богатых питательными веществами ферментационных сред/клеточных метаболитов.
В одном аспекте изобретение относится к усовершенствованным способам получения тагатозы, включающим этапы преобразования F6P в T6P, катализируемого F6PE; и преобразования T6P в тагатозу, катализируемого T6PP, с использованием ферментов с улучшенной активностью по сравнению с F6PE и/или T6PP, ранее использованным в способе получения тагатозы. См., например, публикацию международной заявки на патент WO2017/059278, раскрывающую F6PE и T6PP: F6PE из Anaerolinea thermophila UNI-1 (Uniprot ID E8N0N6); F6PE из Caldicellulosiruptor kronotskyensis (Uniprot ID E4SEH3); F6PE из Caldilinea aerophila (Uniprot ID I0I507); F6PE из Caldithrix abyssi (Uniprot ID H1XRG1); и F6PE из Dictyoglomus thermophilum (Uniprot ID B5YBD7); T6PP из Archaeoglobus fulgidus (Uniprot ID O29805); T6PP из Archaeoglobus profundus (Uniprot ID D2RHV2_ARCPA); и T6PP из Archaeoglobus veneficus (Uniprot ID F2KMK2_ARCVS). Использование ферментов с более высокой активностью обеспечивает использование пониженных количеств ферментов, снижая за счет этого стоимость всего способа.
В усовершенствованных способах согласно изобретению F6PE обладают более высокой активностью по сравнению с активностью ранее раскрытой термофильной F6PE из Dictyoglomus thermophilum (Uniprot ID B5YBD7). См. публикацию международной заявки на патент WO2017/059278. Предпочтительно, F6PE, используемые в способах согласно изобретению, обладают ферментативной активностью, улучшенной по меньшей мере на 10%, по меньшей мере на 30%, по меньшей мере на 80%, по меньшей мере на 100%, по меньшей мере на 150%, по меньшей мере на 180% или по меньшей мере на 200% относительно активности термофильной F6PE из Dictyoglomus thermophilum (Uniprot ID B5YBD7). Например, как показано в примере 1, термофильная F6PE из Thermanaerothrix daxensis (Uniprot A0A0P6XN50) обладает ферментативной активностью, улучшенной приблизительно на 150% относительно термофильной F6PE из Dictyoglomus thermophilum (Uniprot ID: B5YBD7), термофильная F6PE из Candidatus Thermofonsia клада 3 (Uniprot ID A0A2M8QBR9) обладает ферментативной активностью, улучшенной приблизительно на 120% относительно термофильной F6PE из Dictyoglomus thermophilum (Uniprot ID: B5YBD7), а термофильная F6PE из Thermoanaerobacterium thermosaccharolyticum (Uniprot A0A223HVJ3) обладает ферментативной активностью, улучшенной приблизительно на 178% относительно термофильной F6PE из Dictyoglomus thermophilum (Uniprot ID B5YBD7). В примерах ниже представлены протоколы для специалистов в данной области для определения активности F6PE, которые включают инкубацию фермента с его субстратом, а затем измерение количеств реагентов и продуктов с помощью HPLC. Измерения относительной активности любых двух ферментов проводят в идентичных условиях реакции, таких как буфер, pH, температура и так далее.
F6PE, используемые в способах согласно изобретению, являются специфическими к F6P и T6P; эпимеризация, катализируемая F6PE, представляет собой обратимую реакцию. В реакции присутствуют конкретные средства, обладающие более высокой активностью к F6P/T6P по сравнению с другими фосфорилированными моносахаридами. Например, F6PE обладает более высокой активностью эпимеризации по отношению к F6P/T6P чем, например, по отношению к G6P.
Примеры F6PE для использования в усовершенствованном способе согласно изобретению включают, но без ограничения, следующие белки: термофильную F6PE из Thermanaerothrix daxensis (Uniprot ID A0A0P6XN50) с аминокислотной последовательностью, приведенной в SEQ ID NO: 1; термофильную F6PE из Thermoanaerobacterium thermosaccharolyticum (Uniprot ID A0A223HVJ3) с аминокислотной последовательностью, приведенной в SEQ ID NO: 2; термофильную F6PE из Candidatus Thermofonsia клада 3 (Uniprot ID A0A2M8QBR9) с аминокислотной последовательностью, приведенной в SEQ ID NO: 7; и F6PE, имеющую по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 99% или 100% идентичность аминокислотной последовательности с SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 7. Усовершенствованный способ получения тагатозы из сахарида согласно изобретению включает этап преобразования фруктозо-6-фосфата (F6P) в тагатозо-6-фосфат (T6P) с использованием F6PE, где F6PE содержит аминокислотную последовательность, имеющую по меньшей мере 90%, идентичность аминокислотной последовательности с SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 7.
F6PE, используемые в способах согласно изобретению, представляют собой эпимеразы, которые могут преобразовывать F6P в T6P. F6PE используют кофактор в виде двухвалентного металла, такого как магний, марганец, кобальт или цинк, предпочтительно магний. F6PE для использования в способах согласно изобретению содержат аминокислотную последовательность, имеющую по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 99% или 100% идентичность аминокислотной последовательности с SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 7, а предпочтительно содержат цилиндр TIM альдолазного типа. См. Wichelecki et al. (2015) J. Biol. Chem. v290, pp. 28963-76.
В усовершенствованных способах согласно изобретению T6PP обладают более высокой активностью по сравнению с активностью ранее раскрытой T6PP из Archaeoglobus fulgidus (Uniprot ID O29805). См. публикацию международной заявки на патент WO2017/059278. Предпочтительно, T6PP, используемые в способах согласно изобретению, обладают ферментативной активностью, улучшенной по меньшей мере на 10%, по меньшей мере на 30%, по меньшей мере на 80%, по меньшей мере на 100%, по меньшей мере на 150%, по меньшей мере на 300%, по меньшей мере на 500%, по меньшей мере на 600%, по меньшей мере на 900%, по меньшей мере на 1200%, по меньшей мере на 1500%, по меньшей мере на 1800% или по меньшей мере на 2100% относительно активности T6PP из Archaeoglobus fulgidus (Uniprot ID O29805). Например, как показано в примере 2, T6PP из Methanosarcina thermophila CHTI-55 (Uniprot ID A0A0E3NCH4) обладает ферментативной активностью, улучшенной приблизительно на 614% относительно T6PP из Archaeoglobus fulgidus (Uniprot ID O29805), T6PP из Thermobispora bispora strain ATCC 19993 (Uniprot D6YBK5) обладает ферментативной активностью, улучшенной приблизительно на 1328% относительно T6PP из Archaeoglobus fulgidus (Uniprot ID O29805), T6PP из Spirochaeta thermophila ATCC 49972 (Uniprot ID E0RT70) обладает ферментативной активностью, улучшенной приблизительно на 2075% относительно T6PP из Archaeoglobus fulgidus (Uniprot ID O29805), а T6PP из Sphaerobacter thermophilus DSM 20745 (Uniprot ID D1C7G9) обладает ферментативной активностью, улучшенной приблизительно на 814% относительно T6PP из Archaeoglobus fulgidus (Uniprot ID O29805). В примерах ниже представлены протоколы для специалистов в данной области для определения активности T6PP, которые включают инкубацию фермента с его субстратом, а затем измерение количеств реагентов и продуктов с помощью HPLC. Измерения относительной активности любых двух ферментов проводят в идентичных условиях реакции, таких как буфер, pH, температура и так далее.
T6PP, используемые в способах согласно изобретению, являются специфическими к T6P. Для T6PP специфический означает обладающий более высокой активностью дефосфорилирования по отношению к T6P по сравнению с другими фосфорилированными моносахаридами в способе. Например, T6PP обладает более высокой активностью дефосфорилирования по отношению к T6P, чем, например, по отношению к G1P, G6P и F6P.
Примеры T6PP для использования в способах согласно изобретению включают, но без ограничения, следующие белки: T6PP из Methanosarcina thermophila CHTI-55 (Uniprot ID A0A0E3NCH4) с аминокислотной последовательностью, приведенной в SEQ ID NO: 3; T6PP из Thermobispora bispora strain ATCC 19993 (Uniprot ID D6YBK5) с аминокислотной последовательностью, приведенной в SEQ ID NO: 4; T6PP из Spirochaeta thermophila strain ATCC 49972 (Uniprot ID E0RT70) с аминокислотной последовательностью, приведенной в SEQ ID NO: 5; T6PP из Sphaerobacter thermophilus strain DSM 20745 (Uniprot ID D1C7G9) с аминокислотной последовательностью, приведенной в SEQ ID NO: 6; и T6PP, имеющие по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 99% или 100% идентичность аминокислотной последовательности с SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6. Способ согласно изобретению получения тагатозы из сахарида включает преобразование фруктозо-6-фосфата (F6P) в тагатозо-6-фосфат (T6P) с использованием фруктозо-6-фосфатэпимеразы (F6PE) и преобразование полученного T6P в тагатозу с использованием тагатозо-6-фосфатфосфатазы (T6PP), где T6PP содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичность последовательности с SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6.
В способах согласно изобретению T6PP представляют собой фосфатазы, которые преобразуют T6P в тагатозу. T6PP используют кофактор в виде двухвалентного металла, такого как цинк, марганец, кобальт или магний, предпочтительно магний. В способах согласно изобретению T6PP имеют по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 99% или 100% идентичность аминокислотной последовательности с SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6; и предпочтительно содержат домен с укладкой Россмана для катализа и дополнительно кэпирующий домен C1 для субстратной специфичности; сигнатуру DxD в 1-ой β-цепи укладки Россмана для координации магния, где второй Asp представляет собой общий кислотно/основной катализатор; Thr или Ser на конце 2-ой β-цепи укладки Россмана, который способствует стабильности промежуточных продуктов реакции; Lys на N-конце α-спирали, C-концевой к 3-ей β-цепи укладки Россмана, который способствует стабильности промежуточных продуктов реакции; и сигнатуру E(D/N) на конце 4-ой β-цепи укладки Россмана для координации катионов двухвалентных металлов, таких как магний. См., например, Burroughs et al., Evolutionary Genomics of the HAD Superfamily: Understanding the Structural Adaptations and Catalytic Diversity in a Superfamily of Phosphoesterases and Allied Enzymes. J. Mol. Biol. 2006; 361; 1003-1034.
Предпочтительный ферментативный способ согласно изобретению включает этап преобразования фруктозо-6-фосфата (F6P) в тагатозо-6-фосфат (T6P) с использованием фруктозо-6-фосфатэпимеразы (F6PE), где F6PE содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичность последовательности с SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 7, и этап преобразования T6P в тагатозу с использованием тагатозо-6-фосфатфосфатазы (T6PP), где T6PP содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичность последовательности с SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6. Более предпочтительно, F6PE содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичность последовательности с SEQ ID NO: 2, а T6PP содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичность последовательности с SEQ ID NO: 5. Наиболее предпочтительно, F6PE имеет аминокислотную последовательность, приведенную в SEQ ID NO:2, а T6PP имеет аминокислотную последовательность, приведенную в SEQ ID NO: 5.
Способ получения тагатозы из сахарида согласно изобретению также включает этап ферментативного преобразования глюкозо-6-фосфата (G6P) в F6P, где этап катализируют фосфоглюкозоизомеразой (PGI). Иллюстративные PGI, которые можно использовать, включают PGI, раскрытые в публикации международной заявки на патент WO2017/059278: PGI из Clostridium thermocellum (Uniprot ID A3DBX9) и PGI из Thermus thermophilus (Uniprot ID Q5SLL6).
Способ получения тагатозы согласно изобретению дополнительно включает этап преобразования глюкозо-1-фосфата (G1P) в G6P, где этап катализируют фосфоглюкомутазой (PGM). Примером PGM является PGM из Thermococcus kodakaraensis (Uniprot ID Q68BJ6), раскрытая в публикации международной заявки на патент WO2017/059278.
Кроме того, способы согласно изобретению могут дополнительно содержать этап преобразования сахарида в G1P, где этап катализируют по меньшей мере одним ферментом, а сахарид выбирают из группы, состоящей из крахмала или его производного (фиг. 1), целлюлозы или ее производного (фиг. 2), фруктозы (фиг. 3), глюкозы (фиг. 4) и сахарозы (фиг. 5). Ферментом или ферментами, используемыми на этапе преобразования сахарида в G1P в способах согласно изобретению, может быть альфа-глюканфосфорилаза (αGP), мальтозофосфорилаза, сахарозофосфорилаза, целлодекстринфосфорилаза, целлобиозофосфорилаза и/или целлюлозофосфорилаза, и их смеси. Выбор фермента или комбинации ферментов для получения F6P зависит от сахарида, используемого в способе.
Целлюлоза является наиболее распространенным биоресурсом и основным компонентом стенок клеток растений. Непищевая лигноцеллюлозная биомасса содержит целлюлозу, гемицеллюлозу и лигнин, а также другие второстепенные компоненты. Чистую целлюлозу, включая Авицел (микрокристаллическую целлюлозу), регенерированную аморфную целлюлозу, бактериальную целлюлозу, фильтровальную бумагу и так далее, можно получить с помощью серии обработок. Частично гидролизованные целлюлозные субстраты включают водонерастворимые целлодекстрины, степень полимеризации которых составляет более 7, водорастворимые целлодекстрины со степенью полимеризации 3-6, целлобиозу, глюкозу и фруктозу.
В некоторых способах согласно изобретению целлюлозу и ее производные продукты можно преобразовать в тагатозу с помощью серии этапов. См. фиг. 2. Например, в способе согласно изобретению представлен путь, который включает следующие этапы: получение G1P из целлодекстрина и целлобиозы и свободного фосфата, катализируемое целлодекстринфосфорилазой (CDP) и целлобиозофосфорилазой (CBP), соответственно; преобразование G1P в G6P, катализируемое PGM; преобразование G6P в F6P, катализируемое PGI; преобразование F6P в тагатозу, как описано выше, а ионы фосфата можно повторно использовать на этапе преобразования целлодекстрина и целлобиозы в G1P.
Для гидролиза твердой целлюлозы в водорастворимые целлодекстрины и целлобиозу можно использовать несколько ферментов. Такие ферменты включают эндоглюканазу и целлобиогидролазу, но не включают бета-глюкозидазу (целлобиазу). Перед гидролизом целлюлозы и получением G1P целлюлозу и биомассу можно предварительно обработать для увеличения их реакционноспособности и уменьшения степени полимеризации цепей целлюлозы. Способы предварительной обработки целлюлозы и биомассы включают предварительную обработку разбавленной кислотой, фракционирование лигноцеллюлозы на основе растворителя целлюлозы, расширение волокон аммиаком, пропитывание водным аммиаком, обработку ионной жидкостью и частичный гидролиз с использованием концентрированных кислот, включая соляную кислоту, серную кислоту, фосфорную кислоту и их комбинации.
Когда сахариды включают целлобиозу, а ферменты включают целлобиозофосфорилазу, G1P получают из целлобиозы с помощью целлобиозофосфорилазы. Когда сахариды включают целлодекстрины, а ферменты включают целлодекстринфосфорилазу, G1P получают из целлодекстринов с помощью целлодекстринфосфорилазы. Когда сахариды включают целлюлозу, а ферменты включают целлюлозофосфорилазу, G1P получают из целлюлозы с помощью целлюлозофосфорилазы.
Когда сахариды включают мальтозу, а ферменты включают мальтозофосфорилазу, G1P получают из мальтозы с помощью мальтозофосфорилазы. если сахариды включают сахарозу, а ферменты включают сахарозофосфорилазу, G1P получают из сахарозы с помощью сахарозофосфорилазы.
Когда сахаридом является крахмал или производное крахмала, производное можно выбрать из группы, состоящей из амилозы, амилопектина, растворимого крахмала, амилодекстрина, мальтодекстрина, мальтозы, мальтотриозы и глюкозы и их смесей. В некоторых способах согласно изобретению ферменты, используемые для преобразования сахарида в G1P, включают αGP. На этом этапе, когда сахариды включают крахмал, G1P получают из крахмала с помощью αGP; когда сахариды включают растворимый крахмал, амилодекстрин или мальтодекстрин, G1P получают из растворимого крахмала, амилодекстрина или мальтодекстрина с помощью αGP. Примером αGP является αGP из Thermotoga maritima (Uniprot ID G4FEH8), раскрытая в публикации международной заявки на патент WO2017/059278.
Некоторые способы согласно изобретению могут дополнительно включать этап преобразования крахмала в производное крахмала, где производное крахмала получают с помощью ферментативного гидролиза крахмала или с помощью кислотного гидролиза крахмала. В некоторых способах согласно изобретению мальтозофосфорилазу (MP) можно использовать для увеличения выхода тагатозы путем фосфоролитического расщепления мальтозы продукта распада на G1P и глюкозу. Альтернативно, 4-глюкантрансферазу (4GT) можно использовать для увеличения выхода тагатозы за счет рециклинга глюкозы, мальтозы и мальтотриозы продуктов распада в более длинные мальтоолигосахариды; которые могут фосфоролитически расщепляться αGP с получением G1P. Примером 4GT является 4GT из Thermococcus litoralis (Uniprot ID O32462), раскрытая в публикации международной заявки на патент WO2017/059278. В некоторых способах согласно изобретению в способ можно добавить полифосфат и полифосфатглюкокиназу (PPGK), увеличивая таким образом выход тагатозы за счет фосфорилирования глюкозы продукта распада в G6P.
Крахмал является наиболее широко используемым в природе соединением для запасания энергии и в основном хранится в семенах растений. Натуральный крахмал содержит линейную амилозу и разветвленный амилопектин. Примеры производных крахмала включают амилозу, амилопектин, растворимый крахмал, амилодекстрин, мальтодекстрин, мальтозу, фруктозу и глюкозу. Примеры производных целлюлозы включают предварительно обработанную биомассу, регенерированную аморфную целлюлозу, целлодекстрин, целлобиозу, фруктозу и глюкозу. Производные сахарозы включают фруктозу и глюкозу.
Если в способах используют производное крахмала, производное крахмала можно получить с помощью ферментативного гидролиза крахмала, катализируемого изоамилазой, пуллуланазой, α-амилазой или их комбинацией. Кукурузный крахмал содержит множество ответвлений, которые затрудняют действие αGP. Изоамилазу можно использовать для устранения разветвлений крахмала с получением линейного амилодекстрина. Предварительно обработанный изоамилазой крахмал может приводить к более высокой концентрации F6P в конечном продукте. Изоамилаза и пуллуланаза расщепляют альфа-1,6-гликозидные связи, которые обеспечивают более полный распад крахмала альфа-глюканфосфорилазой. Альфа-амилаза расщепляет альфа-1,4-гликозидные связи, поэтому альфа-амилазу используют для разложения крахмала на фрагменты для более быстрого преобразования в тагатозу.
Тагатозу также можно получить из фруктозы. См. фиг. 3. Способы согласно изобретению также могут включать этап преобразования фруктозы в F6P, причем этап катализируют по меньшей мере одним ферментом и, необязательно, этап преобразования сахарозы во фруктозу, причем этап катализируют по меньшей мере одним ферментом. Например, способ включает получение F6P из фруктозы и полифосфата, катализируемое полифосфатфруктокиназой (PPFK). Преобразование F6P в тагатозу описано выше. Фруктозу можно получить, например, путем ферментативного преобразования сахарозы. Ионы фосфата, получаемые при преобразовании T6P в тагатозу, затем можно повторно использовать на этапах преобразования сахарозы в G1P.
Тагатозу также можно получить из глюкозы. См. фиг. 4. Способы согласно изобретению также могут включать этап преобразования глюкозы в G6P, катализируемого по меньшей мере одним ферментом, и, необязательно, этап преобразования сахарозы во фруктозу, причем этап катализируют по меньшей мере одним ферментом. Например, способ включает получение G6P из глюкозы и полифосфата, катализируемое полифосфатглюкокиназой (PPGK). Глюкоза может быть получена, например, путем ферментативного преобразования сахарозы. См. фиг. 5.
В некоторых способах согласно изобретению ионы фосфата, получаемые при преобразовании T6P в тагатозу, повторно используют на этапе преобразования производных крахмала в G1P (См., например, фиг. 1), производных целлюлозы в G1P (См., например, фиг. 2) или сахарозы в G1P (См. фиг. 5), особенно, если способ проводят в одном реакционном сосуде. Кроме того, PPFK и полифосфат можно использовать для увеличения выхода тагатозы путем получения F6P из фруктозы, получаемой путем фосфоролитического расщепления сахарозы с помощью SP.
Способы получения тагатозы из сахарида, например, включают следующие этапы: (i) преобразование сахарида в глюкозо-1-фосфат (G1P) с использованием одного или нескольких ферментов; (ii) преобразование G1P в G6P с использованием фосфоглюкомутазы (PGM, EC 5.4.2.2); (iii) преобразование G6P в F6P с использованием фосфоглюкоизомеразы (PGI, EC 5.3.1.9); (iv) преобразование F6P в T6P с помощью фруктозо-6-фосфатэпимеразы (F6PE) и (v) преобразование T6P в тагатозу с помощью тагатозо-6-фосфатфосфатазы (T6PP). В усовершенствованных способах согласно изобретению F6PE содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичность последовательности с SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 7, и/или T6PP содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичность последовательности с SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6. В таких способах, например, ферментом на этапе (i) является αGP. Обычно, соотношения ферментных единиц, используемых в способе, составляют 1:1:1:1:1 (αGP:PGM:PGI:F6PE:T6PP). Ферментной единицей является количество фермента, необходимого для преобразования 1 мкмоль субстрата в продукт за 1 минуту. Соответственно, фермент с более высокой активностью будет иметь более низкое количество фермента в показателях мг фермента на одну ферментную единицу по сравнению с ферментом с более низкой активностью, который катализирует такую же реакцию. Для оптимизации выхода продукта эти соотношения можно регулировать с любым числом комбинаций. Например, отдельный фермент может присутствовать в количестве приблизительно 2x, 3x, 4x, 5x и так далее относительно количества других ферментов.
Способ получения тагатозы согласно изобретению может включать следующие дополнительные этапы: получение глюкозы из полисахаридов и олигосахаридов с помощью ферментативного гидролиза или кислотного гидролиза, преобразование глюкозы в G6P, катализируемое по меньшей мере одним ферментом, получение фруктозы из полисахаридов и олигосахаридов с помощью ферментативного гидролиза или кислотного гидролиза и преобразование фруктозы в G6P, катализируемое по меньшей мере одним ферментом. Примеры полисахаридов и олигосахаридов перечислены выше.
Способы получения тагатозы согласно изобретению можно осуществлять в одном биореакторе или реакционном сосуде. Альтернативно, этапы также можно проводить во многих биореакторах или реакционных сосудах, которые расположены последовательно. В предпочтительном способе ферментативное получение тагатозы проводят в одном реакционном сосуде.
Ферменты, используемые в изобретении, могут принимать форму растворимых, иммобилизованных, собранных или агрегированных белков. Эти ферменты можно адсорбировать на нерастворимых органических или неорганических подложках, обычно используемых для улучшения функциональности, как известно в данной области. Они включают полимерные подложки, например, из агарозы, метакрилата, полистирола или декстрана, а также неорганические подложки, например, из стекла, металла или материалов на основе углерода. Эти материалы часто получают с большими отношениями поверхности к объему и специальными поверхностями, которые способствуют прикреплению и активности иммобилизованных ферментов. Ферменты могут быть прикреплены к этим твердым подложкам за счет ковалентных, ионных или гидрофобных взаимодействий. Ферменты также могут быть прикреплены с помощью взаимодействий методами генной инженерии, таких как ковалентное слияние с другим белком или пептидной последовательностью с аффинностью с твердой подложкой, наиболее часто полигистидиновой последовательностью. Ферменты могут быть прикреплены либо прямо к поверхности, либо к покрытию поверхности, или они могут быть прикреплены к другим белкам, уже присутствующим на поверхности или покрытии поверхности. Все ферменты могут быть иммобилизованы на одном носителе, на отдельных носителях или комбинации того и другого (например, два фермента на носитель, затем эти носители смешивают). Эти варианты можно смешивать равномерно или в определенных слоях для оптимизации оборота в реакторе непрерывного действия. Например, в начале реактор может иметь слой aGP, чтобы обеспечить высокое начальное увеличение G1P. Все ферменты могут быть иммобилизованы на одном носителе, на отдельных носителях или группами. Для оптимизации оборота эти ферменты могут быть смешаны равномерно или в определенных слоях или зонах.
В способе изобретения можно использовать любой подходящий биологический буфер, известный в данной области, такой как HEPES, PBS, BIS-TRIS, MOPS, DIPSO, Trizma и так далее. Реакционный буфер для всех вариантов осуществления может иметь pH в диапазоне 5,0-9,0. Более предпочтительно, реакционный буфер pH может находиться в диапазоне от приблизительно 6,0 до приблизительно 7,3. Например, pH реакционного буфера может составлять 6,0, 6,2, 6,4, 6,6, 6,8, 7,0, 7,2 или 7,3.
В некоторых усовершенствованных способах согласно изобретению реакционный буфер содержит катионы двухвалентных металлов. Примеры включают Mn2+, Co2+, Mg2+ и Zn2+ и тому подобное, предпочтительно Mg2+. Концентрация катионов двухвалентных металлов может находиться в диапазоне от приблизительно 0 мМ до приблизительно 150 мМ, от приблизительно 0 мМ до приблизительно 100 мМ, от приблизительно 1 мМ до приблизительно 50 мМ, предпочтительно от приблизительно 5 мМ до приблизительно 50 мМ, или более предпочтительно от приблизительно 10 мМ до приблизительно 50 мМ. Например, концентрация катионов двухвалентных металлов может составлять приблизительно 0,1 мМ, приблизительно 0,5 мМ, приблизительно 1 мМ, приблизительно 1,5 мМ, приблизительно 2 мМ, приблизительно 2,5 мМ, приблизительно 5 мМ, приблизительно 6 мМ, приблизительно 7 мМ, приблизительно 8 мМ, приблизительно 9 мМ, приблизительно 10 мМ, приблизительно 15 мМ, приблизительно 20 мМ, приблизительно 25 мМ, приблизительно 30 мМ, приблизительно 35 мМ, приблизительно 40 мМ, приблизительно 45 мМ, приблизительно 50 мМ или приблизительно 55 мМ.
Температура реакции, при которой проводят этапы способа, может находиться в диапазоне 37-85°C. Более предпочтительно, этапы можно осуществлять при температуре в диапазоне от приблизительно 37°C до приблизительно 85°C. Температура может составлять, например, приблизительно 40°C, приблизительно 45°C, приблизительно 50°C, приблизительно 55°C или приблизительно 60°C. Предпочтительно, температура реакции составляет приблизительно 50°C. В некоторых способах согласно изобретению температура реакции является постоянной и во время способа не меняется.
Время реакции согласно раскрытым способам можно регулировать по необходимости, и оно может находиться в диапазоне от приблизительно 1 часа до приблизительно 48 часов. Например, время реакции может составлять приблизительно 16 часов, приблизительно 18 часов, приблизительно 20 часов, приблизительно 22 часа, приблизительно 24 часа, приблизительно 26 часов, приблизительно 28 часов, приблизительно 30 часов, приблизительно 32 часа, приблизительно 34 часа, приблизительно 36 часов, приблизительно 38 часов, приблизительно 40 часов, приблизительно 42 часа, приблизительно 44 часа, приблизительно 46 часов или приблизительно 48 часов. Более предпочтительно, время реакции составляет приблизительно 24 часа.
Реакцию можно проводить партиями или непрерывным способом с использованием реактора с уплотненным слоем или аналогичного устройства. В непрерывном способе раствор мальтодекстрина нужно нагнетать через слой иммобилизованного фермента с такой скоростью, чтобы преобразование в тагатозу завершилось бы, когда раствор выходит из колонки для последующей обработки. Например, 200 г/л мальтодекстрина можно нагнетать через колонку, заполненную иммобилизованными ферментами (с поддержанием, например, 50°C), таким образом, что, когда мальтодекстрин выходит из колонки, достигается максимальный выход тагатозы. Этот метод обеспечивает большую объемную производительность по сравнению с циклическими методами. Это ограничивает время контакта продукта согласно изобретению с колонкой и условия реакции, что снижает вероятность распада продукта (например, возможное образование гидроксиметилфурфурола). Будь то циклический или непрерывный режим различные этапы способов согласно изобретению можно осуществлять с использованием таких же условий реакции, что и другие этапы. Например, в отдельном способе согласно изобретению с использованием одного биореактора или реакционного сосуда условия реакции, такие как pH и температура, и реакционный буфер остаются постоянными для всех этапов способа.
Затем ионы фосфата, полученные путем дефосфорилирования T6P с помощью T6PP, можно повторно использовать на этапе способа преобразования сахарида в G1P, особенно, когда все этапы способа проводят в одном биореакторе или реакционном сосуде. Возможность повторного использования фосфата в раскрытых способах обеспечивает использование нестехиометрических количеств фосфата, что сохраняет низкой концентрацию фосфатов в реакции. Это влияет на общий путь и общую скорость способов, но не ограничивает активность отдельных ферментов и обеспечивает общую эффективность способов получения тагатозы.
Например, концентрации фосфата в реакции могут находиться в диапазоне от приблизительно 0 мМ до приблизительно 300 мМ, от приблизительно 0 мМ до приблизительно 150 мМ, от приблизительно 1 мМ до приблизительно 50 мМ, предпочтительно от приблизительно 5 мМ до приблизительно 50 мМ или более предпочтительно от приблизительно 10 мМ до приблизительно 50 мМ. Например, концентрация фосфата в реакции может составлять приблизительно 0,1 мМ, приблизительно 0,5 мМ, приблизительно 1 мМ, приблизительно 1,5 мМ, приблизительно 2 мМ, приблизительно 2,5 мМ, приблизительно 5 мМ, приблизительно 6 мМ, приблизительно 7 мМ, приблизительно 8 мМ, приблизительно 9 мМ, приблизительно 10 мМ, приблизительно 15 мМ, приблизительно 20 мМ, приблизительно 25 мМ, приблизительно 30 мМ, приблизительно 35 мМ, приблизительно 40 мМ, приблизительно 45 мМ, приблизительно 50 мМ или приблизительно 55 мМ.
Поэтому, низкие концентрации фосфата приводят к уменьшенным производственным затратам из-за низкого общего содержания фосфата и, таким образом, к более низкой стоимости удаления фосфата. Это также предотвращает ингибирование T6PP за счет высоких концентраций свободного фосфата и снижает вероятность загрязнения фосфатом.
Кроме того, раскрытые в данном документе способы можно осуществлять без дополнительного ATP в качестве источника фосфата, то есть без ATP. Способы также можно осуществлять без необходимости добавления NAD(H), то есть без NAD(H). Другие преимущества также состоят в том, что по меньшей мере один этап раскрытых способов получения тагатозы включает энергетически выгодную химическую реакцию. Фиг. 6. Хотя использование ферментов с более высокой активностью не будет влиять на общий энергетический баланс, возможность использования пониженных количеств ферментов в усовершенствованных способах является преимуществом. Преимущество состоит в снижении общей стоимости фермента в общей стоимости получения продукта.
Способы согласно изобретению могут обеспечивать высокие выходы из-за очень выгодной константы равновесия всей реакции. Теоретически, до 99% выхода можно обеспечивать, если исходный материал полностью преобразуется в промежуточный продукт. Также, этап преобразования T6P в тагатозу согласно изобретению является необратимой фосфатазной реакцией независимо от сырья. Поэтому, тагатозу получают с очень высоким выходом.
В способах согласно изобретению используют недорогие исходные материалы и снижают производственные затраты за счет снижения затрат, связанных с разделением сырья и продукта. Крахмал, целлюлоза, сахароза и их производные представляют собой менее дорогое сырье, чем, например, лактоза. Когда тагатозу получают из лактозы, глюкозы и галактозы, тагатозу отделяют с помощью хроматографии, что приводит к более высоким производственным затратам.
Способы согласно изобретению обеспечивают легкое извлечение тагатозы, а затраты на разделение минимизированы. Предпочтительно, в способах согласно изобретению извлечение тагатозы происходит не с помощью хроматографического разделения. После получения тагатозы в непрерывной реакции продукт вместо этого пропускают через микрофильтрацию, ионообмен (катионный, затем анионный, не смешанный слой), концентрирование, кристаллизацию, выделение кристаллов и сушку. Из-за высоких выходов тагатозы этап кристаллизации - это все, что требуется для очистки тагатозы. Для дополнительной очистки тагатозы перед кристаллизацией можно использовать нанофильтрацию для устранения риска присутствия фермента в процессе кристаллизации и для удаления любых непреобразованных декстринов, которые могут совместно кристаллизоваться с тагатозой или ограничить возможность повторного использования маточного раствора (мальтодекстрин, мальтотетраоза, мальтотриоза, мальтоза и так далее.).
Усовершенствованный способ получения тагатозы согласно изобретению включает следующие этапы: (i) преобразование сахарида в глюкозо-1-фосфат (G1P) с использованием одного или нескольких ферментов; (ii) преобразование G1P в G6P с использованием фосфоглюкомутазы (PGM, EC 5.4.2.2); (iii) преобразование G6P в F6P с использованием фосфоглюкоизомеразы (PGI, EC 5.3.1.9); (iv) преобразование F6P в T6P с помощью фруктозо-6-фосфатэпимеразы (F6PE) и (v) преобразование T6P в тагатозу с помощью тагатозо-6-фосфатфосфатазы (T6PP), где F6PE содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичность последовательности с SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 7, и/или где T6PP содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичность последовательности с SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6. Этот способ предпочтительно осуществляют в одном биореакторе или реакционном сосуде.
Предпочтительно, усовершенствованный способ получения тагатозы согласно изобретению включает следующие этапы: (i) преобразование сахарида в глюкозо-1-фосфат (G1P) с использованием αGP, где сахарид выбирают из группы, состоящей из крахмала, одного или нескольких производные крахмала или их комбинации; (ii) преобразование G1P в G6P с использованием фосфоглюкомутазы (PGM, EC 5.4.2.2); (iii) преобразование G6P в F6P с использованием фосфоглюкоизомеразы (PGI, EC 5.3.1.9); (iv) преобразование F6P в T6P с помощью фруктозо-6-фосфатэпимеразы (F6PE) и (v) преобразование T6P в тагатозу с помощью тагатозо-6-фосфатфосфатазы (T6PP), где F6PE содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичность последовательности с SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 7, и/или где T6PP содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичность последовательности с SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6. Способ предпочтительно осуществляют в одном реакционном сосуде, и он может предусматривать одно или несколько разных условий способа, обсуждавшихся выше.
Примеры
Материалы и Способы
Все химические вещества, включая глюкозо-1-фосфат, хлорид магния, фосфат натрия (одно- и двухосновный), относятся к категории реактивов или более высокой и приобретены у Sigma-Aldrich (St. Louis, MO, USA) или Fisher Scientific (Pittsburgh, PA, USA), если не указано иное. E. coli BL21 (DE3) (Sigma-Aldrich, St. Louis, MO, USA) использовали в качестве клетки-хозяина для экспрессии рекомбинантного белка. Среду ZYM-5052, содержащую 50 мг л-1 канамицина, использовали для роста клеток E. coli и экспрессии рекомбинантного белка.
Получение и очистка рекомбинантных ферментов
Штамм E. coli BL21 (DE3), несущий экспрессирующую белок плазмиду (pET28a), инкубировали в колбе Эрленмейера объемом 1 л с 100 мл среды ZYM-5052, содержащей 50 мг л-1 канамицина. Клетки выращивали при 37°C при встряхивании с вращением при 220 об/мин в течение 16-24 часов. Клетки собирали путем центрифугирования при 12°C и один раз промывали либо 20 мМ HEPES (pH 7,5), содержащим 50 мМ NaCl и 5 мМ MgCl2 (тепловое осаждение) или 20 мМ HEPES (pH 7,5), содержащим 300 мМ NaCl и 5 мМ имидазола (очистка Ni). Осадок клеток ресуспендировали в том же буфере и лизировали ультразвуком. После центрифугирования белки-мишени в супернатантах очищали. Меченные His белки очищали с помощью Profinity IMAC Ni-Charged Resin (Bio-Rad, Hercules, CA, USA). Тепловое осаждение при 50-80°C в течение 5-30 минут использовали для очистки термостабильных ферментов. Чистоту рекомбинантных белков проверяли с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE).
Пример 1: F6PE с более высокой активностью
Относительную активность разных F6PE измеряли в 50 мМ буфера HEPES (pH 7,2), содержащего 5 мМ MgCl2, 0,5 мМ MnCl2, 38,5 мМ G1P, 0,05 г/л PGM, 0,05 г/л PGI, 0,05 г/л F6PE и 0,075 г/л T6PP из Methanosarcina thermophila CHTI-55 (Uniprot ID A0A0E3NCH4) при 50°C в течение 1 часа. Реакцию останавливали фильтрацией фермента с помощью концентратора Vivaspin 2 (10000 MWCO). Продукт, тагатозу, оценивали с использованием колонки Agilent Hi-Plex H и детектора показателя преломления. Образец обрабатывали в 5 мМ H2SO4 со скоростью 0,6 мл/мин в течение 15 мин при 65°C. В таблице 1 показано, что F6PE, используемые в усовершенствованных способах согласно изобретению, обладают более высокой активностью относительно ранее раскрытого F6PE из Dictyoglomus thermophilum (Uniprot ID B5YBD7). См. публикацию международной заявки на патент WO2017/059278.
Таблица 1: Относительная активность F6PE
Пример 2: T6PP с более высокой активностью
Относительную активность T6PP измеряли в 50 мМ буфера HEPES (pH 7,2), содержащего 5 мМ MgCl2, 0,5 мМ MnCl2, 38,5 мМ G1P, 0,05 г/л PGM, 0,05 г/л PGI, 0,25 г/л F6PE из Thermanaerothrix daxensis (Uniprot ID A0A0P6XN50) и 0,05 г/л T6PP при 50°C в течение 1 часа. Реакцию останавливали фильтрацией фермента с помощью концентратора Vivaspin 2 (10000 MWCO). Продукт, тагатозу, оценивали с использованием колонки Agilent Hi-Plex H и детектора показателя преломления. Образец обрабатывали в 5 мМ H2SO4 со скоростью 0,6 мл/мин в течение 15 мин при 65°C. В таблице 2 показано, что T6PP, используемые в усовершенствованных способах согласно изобретению, обладают более высокой активностью относительно ранее раскрытого T6PP из Archaeoglobus fulgidus (Uniprot ID O29805). См. публикацию международной заявки на патент WO 2017/059278.
Таблица 2: Относительная активность T6PP
Пример 3: Усовершенствованное получение тагатозы из F6P
Преобразование F6P в тагатозу с использованием ранее раскрытых ферментов F6PE (Uniprot ID B5YBD7) и T6PP (Uniprot ID O29805) сравнивали с преобразованием F6P в тагатозу с помощью ферментов, используемых в усовершенствованных способах согласно изобретению F6PE (Uniprot ID A0A0P6XN50) и T6PP (Uniprot ID D6YBK5). 0,20 мл реакционной смеси, содержащей 38,5 мМ F6P, 50 мМ HEPES pH 7,2, 5 мМ MgCl2, 0,5 мМ MnCl2, 0,1 г/л F6PE и 0,033 г/л T6PP, инкубировали при 50°C в течение 2 часов.
Реакцию останавливали фильтрацией фермента с помощью концентратора Vivaspin 2 (10000 MWCO) и анализировали с помощью HPLC (серия Agilent 1100) с использованием колонки Agilent Hi-Plex H и детектора показателя преломления. Образец обрабатывали в 5 мМ H2SO4 со скоростью 0,6 мл/мин в течение 15,5 минут при 65°C. Результаты показывают 4,4-кратное улучшение выработки тагатозы с помощью ферментов согласно усовершенствованному способу по сравнению с ранее раскрытыми ферментами (фиг. 7). Небольшое количество фруктозы (см. Фиг. 7, плечо 5 на пике 4) имеется в реакции с ферментами усовершенствованного способа. Это может быть свидетельством того, что T6PP изначально сталкивается с большим количеством F6P по сравнению с T6P для данной реакции, и не является проблемой всего пути.
Список Последовательностей
Альфа-глюканфосфорилаза
Thermotoga maritima (Uniprot ID G4FEH8) - SEQ ID NO: 8
MLEKLPENLKELESLAYNLWWSWSRPAQRLWRMIDSEKWEEHRNPVKILREVSKERLEELSKDEDFIALYELTLERFTDYMEREDTWFNVNYPEWDEKIVYMCMEYGLTKALPIYSGGLGILAGDHLKSASDLGLPLIAVGLLYKHGYFTQQIDSDGRQIEIFPEYDIEELPMKPLRDEDGNQVIVEVPIDNDTVKARVFEVQVGRVKLYLLDTDFEENEDRFRKICDYLYNPEPDVRVSQEILLGIGGMKLLKTLKIKPGVIHLNEGHPAFSSLERIKSYMEEGYSFTEALEIVRQTTVFTTHTPVPAGHDRFPFDFVEKKLTKFFEGFESKELLMNLGKDEDGNFNMTYLALRTSSFINGVSKLHADVSRRMFKNVWKGVPVEEIPIEGITNGVHMGTWINREMRKLFDRYLGRVWREHTDLEGIWYGVDRIPDEELWEAHLNAKKRFIDYIRESIKRRNERLGINEPLPEISENVLIIGFARRFATYKRAVLLFSDLERLKRIVNNSERPVYIVYAGKAHPRDEGGKEFLRRIYEVSQMPDFKNKIIVLENYDIGMARLMVSGVDVWLNNPRRPMEASGTSGMKAAANGVLNASVYDGWWVEGYNGRNGWVIGDESVLPETEADDPKDAEALYELLENEIIPTYYENREKWIFMMKESIKSVAPKFSTTRMLKEYTEKFYIKGLVNREWLERRENVEKIGAWKERILKNWENVSIERIVLEDSKSVEVTVKLGDLTPNDVIVELVAGRGEGMEDLEVWKVIHIRRYRKENDLFVYTYTNGVLGHLGSPGWFYAVRVIPYHPRLPIKFLPEVPVVWKKVL
Фосфоглюкомутаза
Thermococcus kodakaraensis (Uniprot ID Q68BJ6) - SEQ ID NO: 9
MGKLFGTFGVRGIANEEITPEFALKIGMAFGTLLKREGRERPLVVVGRDTRVSGEMLKDALISGLLSTGCDVIDVGIAPTPAIQWATNHFNADGGAVITASHNPPEYNGIKLLEPNGMGLKKEREAIVEELFFSEDFHRAKWNEIGELRKEDIIKPYIEAIKNRVDVEAIKKRRPFVVVDTSNGAGSLTLPYLLRELGCKVVSVNAHPDGHFPARNPEPNEENLKGFMEIVKALGADFGVAQDGDADRAVFIDENGRFIQGDKTFALVADAVLRENGGGLLVTTIATSNLLDDIAKRNGAKVMRTKVGDLIVARALLENNGTIGGEENGGVIFPDFVLGRDGAMTTAKIVEIFAKSGKKFSELIDELPKYYQFKTKRHVEGDRKAIVAKVAELAEKKGYKIDTTDGTKIIFDDGWVLVRASGTEPIIRIFSEAKСМ.KAREYLELGIKLLEEALKG
Фруктозо-6-фосфат 4-эпимеразы
(Сравнительный) Dictyoglomus thermophilum (Uniprot ID B5YBD7) - SEQ ID NO: 10
MWLSKDYLRKKGVYSICSSNPYVIEASVEFAKEKNDYILIEATPHQINQFGGYSGMTPEDFKNFVMGIIKEKGIEEDRVILGGDHLGPLPWQDEPSSSAMKKAKDLIRAFVESGYKKIHLDCSMSLSDDPVVLSPEKIAERERELLEVAEETARKYNFQPVYVVGTDVPVAGGGEEEGITSVEDFRVAISSLKKYFEDVPRIWDRIIGFVIMLGIGFNYEKVFEYDRIKVRKILEEVKKENLFVEGHSTDYQTKRALRDMVEDGVRILKVGPALTASFRRGVFLLSSIEDELISEDKRSNIKKVVLETMLKDDKYWRKYYKDSERLELDIWYNLLDRIRYYWEYKEIKIALNRLFENFSEGVDIRYIYQYFYDSYFKVREGKIRNDPRELIKNEIKKVLEDYHYAVNL
Thermanaerothrix daxensis (Uniprot ID A0A0P6XN50) - SEQ ID NO: 1
MVTYLDFVVLSHRFRRPLGЕГОVCSAHPYVIEAALRNGMMTHTPVLIEATCNQVNQYGGYTGMTPADFVRYVENIAARVGSPRENLLLGGDHLGPLVWAHEPAESAMEKARALVKAYVEAGFRKIHLDCSMPCADDRDFSPKVIAERAAELAQVAESTCDVMGLPLPNYVIGTEVPPAGGAKAEAETLRVTRPEDAAETIALTRAAFFKRGLESAWERVVALVVQPGVEFGDHQIHVYRREEAQALSRFIESQPGLVYEAHSTDYQPRDALRALVEDHFAILKVGPALTFAFREAVFALASIEDWVCDSPSRILEVLETTMLANPVYWQKYYLGDERARRIARGYSFSDRIRYYWSAPAVEQAFERLRANLNRVSIPLVLLSQYLPDQYRKVRDGRLPNQFDALILDKIQAVLEDYNVACGVRIGE
Thermoanaerobacterium thermosaccharolyticum (Uniprot ID A0A223HVJ3) - SEQ ID NO: 2
MAKEHPLKELVNKQKSGISEGIVSICSSNEFVIEASMERALTNGDYVLIESTANQVNQYGGYIGMTPIEFKKFVFSIAKKVDFPLDKLILGGDHLGPLIWKNESSNLALAKASEОДИНАКОВЫЕYVLAGYTKIHIDTSMRLKDDTDFNTEIIAQRSAVLLKAAENAYMELNKNNKNVLHPVYVIGSEVPIPGGSQGSDESLQITDAKDFENTVEIFKDVFSKYGLINEWENIVAFVVQPGVEFGNDFVHEYKRDEAKELTDALKNYKTFVFEGHSTDYQTRESLKQMVEDGIAILKVGPALTFALREALIALNNIENELLNNVDSIKLSNFTNVLVSEMINNPEHWKNHYFGDDARKKFLCKYSYSDRCRYYLPTRNVKNSLNLLIRNLENVKIPMTLISQFMPLQYDNIRRGLIKNEPISLIKNAIMNRLNDYYYAIKP
Бактерия Candidatus Thermofonsia клада 3 (Uniprot ID A0A2M8QBR9) - SEQ ID NO: 7
MTYLDYLTASHHSGKPIGLSSICSAHPWVLRTALQGERPVLIESTCNQVNQFGGYSGMKPADFVRFVHSLAAENGFPTEKILLGGDHLGPSPWQNEPAEQAMAKAIEMVRAYVQAGYTKIHLDCSMPLGGERQLPVEVIAQRTVQLAEAAEQAAHESRLTSHTLRYVIGSEVPPPGGAIGPHEGLRVTPVEEARQTLEVMQAAFHQAGLEAAWERVRALVVQPGVEFGDDFVHDYDPAAAAGLARFIETVPNLVYEAHSTDYQTPESLAALVRDHFAILKVGPALTFALREAVFALAMIENELFPAEERSHLVERLEAAMLRQPGHWQRHYHGEERQQALARKYSFSDRIRYYWGDPDVQAAFRQLLANLERVAPLPLTLLSQYLPEMFGEIRRGLLLNHPAAFLERKIQAVLDTYRAACGEED
Тагатозо-6-фосфатфосфатазы
(Сравнительный) Archaeoglobus fugidis (Uniprot ID O29805) - SEQ ID NO: 11
MFKPKAIAVDIDGTLTDRKRALNCRAVEALRKVKIPVILATGNISCFARAAAKLIGVSDVVICENGGVVRFEYDGEDIVLGDKEKCVEAVRVLEKHYEVELLDFEYRKSEVCMRRSFDINEARLIEGMGVKLVDSGFAYHIMDADVSKGKALKFVAERLGISSAEFAVIGDSENDIDMFRVAGFGIAVANADERLKEYADLVTPSPDGEGVVEALQFLGLLR
Methanosarcina thermophila CHTI-55 (Uniprot ID A0A0E3NCH4) - SEQ ID NO: 3
MLKALIFDMDGVLVDSMPFHAAAWKKAFFEMGMEIQDSDIFAIEGSNPRNGLPLLIRKARKEPEAFDFEAITSIYRQEFKRVFEPKAFEGMKECLEVLKKRFLLSVVSGSDHVIVHSIINRLFPGIFDIVVTGDDIINSKPHPDPFLKAVELLNVRREECVVIENAILGVEAAKNARIYCIGVPTYVEPSHLDKADLVVEDHRQLMQHLLSLEPANGFRQ
Thermobispora bispora штамм ATCC 19993 (Uniprot ID D6YBK5) - SEQ ID NO: 4
MDVVLFDMDGLLVDTERLWFAVETEVVERLGGSWGPEHQRQLVGGSLKRAVAYMLEHTGADVDPDVVAGWLIEGMERRLTESVDPMPGAMELLTALRDEGIPTGLVTSSRRPLADAVLKHIGREHFDVVVTADDVSHAKPHPEPYLTALAMLSADPARSVALEDSPNGVASAVAAGCRVVAVPSLLPIPEQPGVTVLPALTHADVGLLRSLVG
Spirochaeta thermophila ATCC 49972 (Uniprot ID E0RT70) - SEQ ID NO: 5
MRKRRECAPPGIRAAIFDMDGTLVNSEDVYWDADCAFLDRYGIPHDDALREYMIGRGTKGFIEWMRTQKEIPRSDEELAREKMEVFLAHARGRVQVFPEMRRLLGLLEEAGMPCALASGSPRGIIEVLLEETGLAGFFRVVVSADEVARPKPAPDVFLEAAGRLGVEPGGCVVFEDSEPGVRAGLDAGMVCVAIPTLVKDRYPEVFYQADVLFEGGMGEFSAERVWEWLGCGVGVGR
Sphaerobacter thermophilus DSM 20745 (Uniprot ID D1C7G9) - SEQ ID NO: 6
MSQGVRGVVFDLDGLLVEСМ.YWEQARREFVSRYGGTWGDDAQQAVMGANTRQWSRYIREAFDIPLTEEEIAAAVIARMQELYHDHLPLLPGAIPAVRALADRYPLAVASSSPPVLIRFVLAEMGVAECFQSVTSSDEVAHGKPAPDVYHLACERLGVAPEQAVAFEDSTAGIAAALAAGLRVIAVPNRSYPPDPDVLRRADLTLPSLEEFDPAVLEQW
4-глюкантрансфераза
Thermococcus litoralis (Uniprot ID O32462) - SEQ ID NO: 12
MERINFIFGIHNHQPLGNFGWVFEEAYNRSYRPFMEILEEFPEMKVNVHFSGPLLEWIEENKPDYLDLLRSLIKRGQLEIVVAGFYEPVLAAIPKEDRLVQIEMLKDYARKLGYDAKGVWLTERVWQPELVKSLREAGIEYVVVDDYHFMSAGLSKEELFWPYYTEDGGEVITVFPIDEKLRYLIPFRPVKKTIEYLESLTSDDPSKVAVFHDDGEKFGVWPGTYEWVYEKGWLREFFDAЕГОNEKINLMTYSEYLSKFTPRGLVYLPIASYFEMSEWSLPAKQAKLFVEFVEQLKEEGKFEKYRVFVRGGIWKNFFFKYPESNFMHKRMLMVSKAVRDNPEARKYILKAQCNDAYWHGVFGGIYLPHLRRTVWENIIKAQRYLKPENKILDVDFDGRAEIMVENDGFIATIKPHYGGSIFELSSKRKAVNYNDVLPRRWEHYHEVPEATKPEKEСМ.GIASIHELGKQIPEEIRRELAYDWQLRAILQDHFIKPEETLDNYRLVKYHELGDFVNQPYEYEMIENGVKLWREGGVYAEEKIPARVEKKIELTEDGFIAKYRVLLEKPYKALFGVEINLAVHSVMEKPEEFEAKEFEVNDPYGIGKVRIELDKAAKVWKFPIKTLSQSEAGWDFIQQGVSYTMLFPIEKELEFTVRFREL
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Bonumose, LLC
<120> Ферментативное получение тагатозы
<130> 146.0009-WO00
<150> US 62/747877
<151> 2018-10-19
<150> US 62/790,788
<151> 2019-01-10
<160> 12
<170> PatentIn version 3.5
<210> 1
<211> 426
<212> БЕЛОК
<213> Thermanaerothrix daxensis
<400> 1
Met Val Thr Tyr Leu Asp Phe Val Val Leu Ser His Arg Phe Arg Arg
1 5 10 15
Pro Leu Gly Ile Thr Ser Val Cys Ser Ala His Pro Tyr Val Ile Glu
20 25 30
Ala Ala Leu Arg Asn Gly Met Met Thr His Thr Pro Val Leu Ile Glu
35 40 45
Ala Thr Cys Asn Gln Val Asn Gln Tyr Gly Gly Tyr Thr Gly Met Thr
50 55 60
Pro Ala Asp Phe Val Arg Tyr Val Glu Asn Ile Ala Ala Arg Val Gly
65 70 75 80
Ser Pro Arg Glu Asn Leu Leu Leu Gly Gly Asp His Leu Gly Pro Leu
85 90 95
Val Trp Ala His Glu Pro Ala Glu Ser Ala Met Glu Lys Ala Arg Ala
100 105 110
Leu Val Lys Ala Tyr Val Glu Ala Gly Phe Arg Lys Ile His Leu Asp
115 120 125
Cys Ser Met Pro Cys Ala Asp Asp Arg Asp Phe Ser Pro Lys Val Ile
130 135 140
Ala Glu Arg Ala Ala Glu Leu Ala Gln Val Ala Glu Ser Thr Cys Asp
145 150 155 160
Val Met Gly Leu Pro Leu Pro Asn Tyr Val Ile Gly Thr Glu Val Pro
165 170 175
Pro Ala Gly Gly Ala Lys Ala Glu Ala Glu Thr Leu Arg Val Thr Arg
180 185 190
Pro Glu Asp Ala Ala Glu Thr Ile Ala Leu Thr Arg Ala Ala Phe Phe
195 200 205
Lys Arg Gly Leu Glu Ser Ala Trp Glu Arg Val Val Ala Leu Val Val
210 215 220
Gln Pro Gly Val Glu Phe Gly Asp His Gln Ile His Val Tyr Arg Arg
225 230 235 240
Glu Glu Ala Gln Ala Leu Ser Arg Phe Ile Glu Ser Gln Pro Gly Leu
245 250 255
Val Tyr Glu Ala His Ser Thr Asp Tyr Gln Pro Arg Asp Ala Leu Arg
260 265 270
Ala Leu Val Glu Asp His Phe Ala Ile Leu Lys Val Gly Pro Ala Leu
275 280 285
Thr Phe Ala Phe Arg Glu Ala Val Phe Ala Leu Ala Ser Ile Glu Asp
290 295 300
Trp Val Cys Asp Ser Pro Ser Arg Ile Leu Glu Val Leu Glu Thr Thr
305 310 315 320
Met Leu Ala Asn Pro Val Tyr Trp Gln Lys Tyr Tyr Leu Gly Asp Glu
325 330 335
Arg Ala Arg Arg Ile Ala Arg Gly Tyr Ser Phe Ser Asp Arg Ile Arg
340 345 350
Tyr Tyr Trp Ser Ala Pro Ala Val Glu Gln Ala Phe Glu Arg Leu Arg
355 360 365
Ala Asn Leu Asn Arg Val Ser Ile Pro Leu Val Leu Leu Ser Gln Tyr
370 375 380
Leu Pro Asp Gln Tyr Arg Lys Val Arg Asp Gly Arg Leu Pro Asn Gln
385 390 395 400
Phe Asp Ala Leu Ile Leu Asp Lys Ile Gln Ala Val Leu Glu Asp Tyr
405 410 415
Asn Val Ala Cys Gly Val Arg Ile Gly Glu
420 425
<210> 2
<211> 434
<212> БЕЛОК
<213> Thermoanaerobacterium thermosaccharolyticum
<400> 2
Met Ala Lys Glu His Pro Leu Lys Glu Leu Val Asn Lys Gln Lys Ser
1 5 10 15
Gly Ile Ser Glu Gly Ile Val Ser Ile Cys Ser Ser Asn Glu Phe Val
20 25 30
Ile Glu Ala Ser Met Glu Arg Ala Leu Thr Asn Gly Asp Tyr Val Leu
35 40 45
Ile Glu Ser Thr Ala Asn Gln Val Asn Gln Tyr Gly Gly Tyr Ile Gly
50 55 60
Met Thr Pro Ile Glu Phe Lys Lys Phe Val Phe Ser Ile Ala Lys Lys
65 70 75 80
Val Asp Phe Pro Leu Asp Lys Leu Ile Leu Gly Gly Asp His Leu Gly
85 90 95
Pro Leu Ile Trp Lys Asn Glu Ser Ser Asn Leu Ala Leu Ala Lys Ala
100 105 110
Ser Glu Leu Ile Lys Glu Tyr Val Leu Ala Gly Tyr Thr Lys Ile His
115 120 125
Ile Asp Thr Ser Met Arg Leu Lys Asp Asp Thr Asp Phe Asn Thr Glu
130 135 140
Ile Ile Ala Gln Arg Ser Ala Val Leu Leu Lys Ala Ala Glu Asn Ala
145 150 155 160
Tyr Met Glu Leu Asn Lys Asn Asn Lys Asn Val Leu His Pro Val Tyr
165 170 175
Val Ile Gly Ser Glu Val Pro Ile Pro Gly Gly Ser Gln Gly Ser Asp
180 185 190
Glu Ser Leu Gln Ile Thr Asp Ala Lys Asp Phe Glu Asn Thr Val Glu
195 200 205
Ile Phe Lys Asp Val Phe Ser Lys Tyr Gly Leu Ile Asn Glu Trp Glu
210 215 220
Asn Ile Val Ala Phe Val Val Gln Pro Gly Val Glu Phe Gly Asn Asp
225 230 235 240
Phe Val His Glu Tyr Lys Arg Asp Glu Ala Lys Glu Leu Thr Asp Ala
245 250 255
Leu Lys Asn Tyr Lys Thr Phe Val Phe Glu Gly His Ser Thr Asp Tyr
260 265 270
Gln Thr Arg Glu Ser Leu Lys Gln Met Val Glu Asp Gly Ile Ala Ile
275 280 285
Leu Lys Val Gly Pro Ala Leu Thr Phe Ala Leu Arg Glu Ala Leu Ile
290 295 300
Ala Leu Asn Asn Ile Glu Asn Glu Leu Leu Asn Asn Val Asp Ser Ile
305 310 315 320
Lys Leu Ser Asn Phe Thr Asn Val Leu Val Ser Glu Met Ile Asn Asn
325 330 335
Pro Glu His Trp Lys Asn His Tyr Phe Gly Asp Asp Ala Arg Lys Lys
340 345 350
Phe Leu Cys Lys Tyr Ser Tyr Ser Asp Arg Cys Arg Tyr Tyr Leu Pro
355 360 365
Thr Arg Asn Val Lys Asn Ser Leu Asn Leu Leu Ile Arg Asn Leu Glu
370 375 380
Asn Val Lys Ile Pro Met Thr Leu Ile Ser Gln Phe Met Pro Leu Gln
385 390 395 400
Tyr Asp Asn Ile Arg Arg Gly Leu Ile Lys Asn Glu Pro Ile Ser Leu
405 410 415
Ile Lys Asn Ala Ile Met Asn Arg Leu Asn Asp Tyr Tyr Tyr Ala Ile
420 425 430
Lys Pro
<210> 3
<211> 220
<212> БЕЛОК
<213> Methanosarcina thermophila CHTI-55
<400> 3
Met Leu Lys Ala Leu Ile Phe Asp Met Asp Gly Val Leu Val Asp Ser
1 5 10 15
Met Pro Phe His Ala Ala Ala Trp Lys Lys Ala Phe Phe Glu Met Gly
20 25 30
Met Glu Ile Gln Asp Ser Asp Ile Phe Ala Ile Glu Gly Ser Asn Pro
35 40 45
Arg Asn Gly Leu Pro Leu Leu Ile Arg Lys Ala Arg Lys Glu Pro Glu
50 55 60
Ala Phe Asp Phe Glu Ala Ile Thr Ser Ile Tyr Arg Gln Glu Phe Lys
65 70 75 80
Arg Val Phe Glu Pro Lys Ala Phe Glu Gly Met Lys Glu Cys Leu Glu
85 90 95
Val Leu Lys Lys Arg Phe Leu Leu Ser Val Val Ser Gly Ser Asp His
100 105 110
Val Ile Val His Ser Ile Ile Asn Arg Leu Phe Pro Gly Ile Phe Asp
115 120 125
Ile Val Val Thr Gly Asp Asp Ile Ile Asn Ser Lys Pro His Pro Asp
130 135 140
Pro Phe Leu Lys Ala Val Glu Leu Leu Asn Val Arg Arg Glu Glu Cys
145 150 155 160
Val Val Ile Glu Asn Ala Ile Leu Gly Val Glu Ala Ala Lys Asn Ala
165 170 175
Arg Ile Tyr Cys Ile Gly Val Pro Thr Tyr Val Glu Pro Ser His Leu
180 185 190
Asp Lys Ala Asp Leu Val Val Glu Asp His Arg Gln Leu Met Gln His
195 200 205
Leu Leu Ser Leu Glu Pro Ala Asn Gly Phe Arg Gln
210 215 220
<210> 4
<211> 213
<212> БЕЛОК
<213> Thermobispora bispora штамм ATCC 19993
<400> 4
Met Asp Val Val Leu Phe Asp Met Asp Gly Leu Leu Val Asp Thr Glu
1 5 10 15
Arg Leu Trp Phe Ala Val Glu Thr Glu Val Val Glu Arg Leu Gly Gly
20 25 30
Ser Trp Gly Pro Glu His Gln Arg Gln Leu Val Gly Gly Ser Leu Lys
35 40 45
Arg Ala Val Ala Tyr Met Leu Glu His Thr Gly Ala Asp Val Asp Pro
50 55 60
Asp Val Val Ala Gly Trp Leu Ile Glu Gly Met Glu Arg Arg Leu Thr
65 70 75 80
Glu Ser Val Asp Pro Met Pro Gly Ala Met Glu Leu Leu Thr Ala Leu
85 90 95
Arg Asp Glu Gly Ile Pro Thr Gly Leu Val Thr Ser Ser Arg Arg Pro
100 105 110
Leu Ala Asp Ala Val Leu Lys His Ile Gly Arg Glu His Phe Asp Val
115 120 125
Val Val Thr Ala Asp Asp Val Ser His Ala Lys Pro His Pro Glu Pro
130 135 140
Tyr Leu Thr Ala Leu Ala Met Leu Ser Ala Asp Pro Ala Arg Ser Val
145 150 155 160
Ala Leu Glu Asp Ser Pro Asn Gly Val Ala Ser Ala Val Ala Ala Gly
165 170 175
Cys Arg Val Val Ala Val Pro Ser Leu Leu Pro Ile Pro Glu Gln Pro
180 185 190
Gly Val Thr Val Leu Pro Ala Leu Thr His Ala Asp Val Gly Leu Leu
195 200 205
Arg Ser Leu Val Gly
210
<210> 5
<211> 237
<212> БЕЛОК
<213> Spirochaeta thermophila ATCC 49972
<400> 5
Met Arg Lys Arg Arg Glu Cys Ala Pro Pro Gly Ile Arg Ala Ala Ile
1 5 10 15
Phe Asp Met Asp Gly Thr Leu Val Asn Ser Glu Asp Val Tyr Trp Asp
20 25 30
Ala Asp Cys Ala Phe Leu Asp Arg Tyr Gly Ile Pro His Asp Asp Ala
35 40 45
Leu Arg Glu Tyr Met Ile Gly Arg Gly Thr Lys Gly Phe Ile Glu Trp
50 55 60
Met Arg Thr Gln Lys Glu Ile Pro Arg Ser Asp Glu Glu Leu Ala Arg
65 70 75 80
Glu Lys Met Glu Val Phe Leu Ala His Ala Arg Gly Arg Val Gln Val
85 90 95
Phe Pro Glu Met Arg Arg Leu Leu Gly Leu Leu Glu Glu Ala Gly Met
100 105 110
Pro Cys Ala Leu Ala Ser Gly Ser Pro Arg Gly Ile Ile Glu Val Leu
115 120 125
Leu Glu Glu Thr Gly Leu Ala Gly Phe Phe Arg Val Val Val Ser Ala
130 135 140
Asp Glu Val Ala Arg Pro Lys Pro Ala Pro Asp Val Phe Leu Glu Ala
145 150 155 160
Ala Gly Arg Leu Gly Val Glu Pro Gly Gly Cys Val Val Phe Glu Asp
165 170 175
Ser Glu Pro Gly Val Arg Ala Gly Leu Asp Ala Gly Met Val Cys Val
180 185 190
Ala Ile Pro Thr Leu Val Lys Asp Arg Tyr Pro Glu Val Phe Tyr Gln
195 200 205
Ala Asp Val Leu Phe Glu Gly Gly Met Gly Glu Phe Ser Ala Glu Arg
210 215 220
Val Trp Glu Trp Leu Gly Cys Gly Val Gly Val Gly Arg
225 230 235
<210> 6
<211> 219
<212> БЕЛОК
<213> Sphaerobacter thermophilus 20745
<400> 6
Met Ser Gln Gly Val Arg Gly Val Val Phe Asp Leu Asp Gly Leu Leu
1 5 10 15
Val Glu Ser Glu Glu Tyr Trp Glu Gln Ala Arg Arg Glu Phe Val Ser
20 25 30
Arg Tyr Gly Gly Thr Trp Gly Asp Asp Ala Gln Gln Ala Val Met Gly
35 40 45
Ala Asn Thr Arg Gln Trp Ser Arg Tyr Ile Arg Glu Ala Phe Asp Ile
50 55 60
Pro Leu Thr Glu Glu Glu Ile Ala Ala Ala Val Ile Ala Arg Met Gln
65 70 75 80
Glu Leu Tyr His Asp His Leu Pro Leu Leu Pro Gly Ala Ile Pro Ala
85 90 95
Val Arg Ala Leu Ala Asp Arg Tyr Pro Leu Ala Val Ala Ser Ser Ser
100 105 110
Pro Pro Val Leu Ile Arg Phe Val Leu Ala Glu Met Gly Val Ala Glu
115 120 125
Cys Phe Gln Ser Val Thr Ser Ser Asp Glu Val Ala His Gly Lys Pro
130 135 140
Ala Pro Asp Val Tyr His Leu Ala Cys Glu Arg Leu Gly Val Ala Pro
145 150 155 160
Glu Gln Ala Val Ala Phe Glu Asp Ser Thr Ala Gly Ile Ala Ala Ala
165 170 175
Leu Ala Ala Gly Leu Arg Val Ile Ala Val Pro Asn Arg Ser Tyr Pro
180 185 190
Pro Asp Pro Asp Val Leu Arg Arg Ala Asp Leu Thr Leu Pro Ser Leu
195 200 205
Glu Glu Phe Asp Pro Ala Val Leu Glu Gln Trp
210 215
<210> 7
<211> 424
<212> БЕЛОК
<213> Бактерия Candidatus Thermofonsia клада 3
<400> 7
Met Thr Tyr Leu Asp Tyr Leu Thr Ala Ser His His Ser Gly Lys Pro
1 5 10 15
Ile Gly Leu Ser Ser Ile Cys Ser Ala His Pro Trp Val Leu Arg Thr
20 25 30
Ala Leu Gln Gly Glu Arg Pro Val Leu Ile Glu Ser Thr Cys Asn Gln
35 40 45
Val Asn Gln Phe Gly Gly Tyr Ser Gly Met Lys Pro Ala Asp Phe Val
50 55 60
Arg Phe Val His Ser Leu Ala Ala Glu Asn Gly Phe Pro Thr Glu Lys
65 70 75 80
Ile Leu Leu Gly Gly Asp His Leu Gly Pro Ser Pro Trp Gln Asn Glu
85 90 95
Pro Ala Glu Gln Ala Met Ala Lys Ala Ile Glu Met Val Arg Ala Tyr
100 105 110
Val Gln Ala Gly Tyr Thr Lys Ile His Leu Asp Cys Ser Met Pro Leu
115 120 125
Gly Gly Glu Arg Gln Leu Pro Val Glu Val Ile Ala Gln Arg Thr Val
130 135 140
Gln Leu Ala Glu Ala Ala Glu Gln Ala Ala His Glu Ser Arg Leu Thr
145 150 155 160
Ser His Thr Leu Arg Tyr Val Ile Gly Ser Glu Val Pro Pro Pro Gly
165 170 175
Gly Ala Ile Gly Pro His Glu Gly Leu Arg Val Thr Pro Val Glu Glu
180 185 190
Ala Arg Gln Thr Leu Glu Val Met Gln Ala Ala Phe His Gln Ala Gly
195 200 205
Leu Glu Ala Ala Trp Glu Arg Val Arg Ala Leu Val Val Gln Pro Gly
210 215 220
Val Glu Phe Gly Asp Asp Phe Val His Asp Tyr Asp Pro Ala Ala Ala
225 230 235 240
Ala Gly Leu Ala Arg Phe Ile Glu Thr Val Pro Asn Leu Val Tyr Glu
245 250 255
Ala His Ser Thr Asp Tyr Gln Thr Pro Glu Ser Leu Ala Ala Leu Val
260 265 270
Arg Asp His Phe Ala Ile Leu Lys Val Gly Pro Ala Leu Thr Phe Ala
275 280 285
Leu Arg Glu Ala Val Phe Ala Leu Ala Met Ile Glu Asn Glu Leu Phe
290 295 300
Pro Ala Glu Glu Arg Ser His Leu Val Glu Arg Leu Glu Ala Ala Met
305 310 315 320
Leu Arg Gln Pro Gly His Trp Gln Arg His Tyr His Gly Glu Glu Arg
325 330 335
Gln Gln Ala Leu Ala Arg Lys Tyr Ser Phe Ser Asp Arg Ile Arg Tyr
340 345 350
Tyr Trp Gly Asp Pro Asp Val Gln Ala Ala Phe Arg Gln Leu Leu Ala
355 360 365
Asn Leu Glu Arg Val Ala Pro Leu Pro Leu Thr Leu Leu Ser Gln Tyr
370 375 380
Leu Pro Glu Met Phe Gly Glu Ile Arg Arg Gly Leu Leu Leu Asn His
385 390 395 400
Pro Ala Ala Phe Leu Glu Arg Lys Ile Gln Ala Val Leu Asp Thr Tyr
405 410 415
Arg Ala Ala Cys Gly Glu Glu Asp
420
<210> 8
<211> 822
<212> БЕЛОК
<213> Thermotoga maritima
<400> 8
Met Leu Glu Lys Leu Pro Glu Asn Leu Lys Glu Leu Glu Ser Leu Ala
1 5 10 15
Tyr Asn Leu Trp Trp Ser Trp Ser Arg Pro Ala Gln Arg Leu Trp Arg
20 25 30
Met Ile Asp Ser Glu Lys Trp Glu Glu His Arg Asn Pro Val Lys Ile
35 40 45
Leu Arg Glu Val Ser Lys Glu Arg Leu Glu Glu Leu Ser Lys Asp Glu
50 55 60
Asp Phe Ile Ala Leu Tyr Glu Leu Thr Leu Glu Arg Phe Thr Asp Tyr
65 70 75 80
Met Glu Arg Glu Asp Thr Trp Phe Asn Val Asn Tyr Pro Glu Trp Asp
85 90 95
Glu Lys Ile Val Tyr Met Cys Met Glu Tyr Gly Leu Thr Lys Ala Leu
100 105 110
Pro Ile Tyr Ser Gly Gly Leu Gly Ile Leu Ala Gly Asp His Leu Lys
115 120 125
Ser Ala Ser Asp Leu Gly Leu Pro Leu Ile Ala Val Gly Leu Leu Tyr
130 135 140
Lys His Gly Tyr Phe Thr Gln Gln Ile Asp Ser Asp Gly Arg Gln Ile
145 150 155 160
Glu Ile Phe Pro Glu Tyr Asp Ile Glu Glu Leu Pro Met Lys Pro Leu
165 170 175
Arg Asp Glu Asp Gly Asn Gln Val Ile Val Glu Val Pro Ile Asp Asn
180 185 190
Asp Thr Val Lys Ala Arg Val Phe Glu Val Gln Val Gly Arg Val Lys
195 200 205
Leu Tyr Leu Leu Asp Thr Asp Phe Glu Glu Asn Glu Asp Arg Phe Arg
210 215 220
Lys Ile Cys Asp Tyr Leu Tyr Asn Pro Glu Pro Asp Val Arg Val Ser
225 230 235 240
Gln Glu Ile Leu Leu Gly Ile Gly Gly Met Lys Leu Leu Lys Thr Leu
245 250 255
Lys Ile Lys Pro Gly Val Ile His Leu Asn Glu Gly His Pro Ala Phe
260 265 270
Ser Ser Leu Glu Arg Ile Lys Ser Tyr Met Glu Glu Gly Tyr Ser Phe
275 280 285
Thr Glu Ala Leu Glu Ile Val Arg Gln Thr Thr Val Phe Thr Thr His
290 295 300
Thr Pro Val Pro Ala Gly His Asp Arg Phe Pro Phe Asp Phe Val Glu
305 310 315 320
Lys Lys Leu Thr Lys Phe Phe Glu Gly Phe Glu Ser Lys Glu Leu Leu
325 330 335
Met Asn Leu Gly Lys Asp Glu Asp Gly Asn Phe Asn Met Thr Tyr Leu
340 345 350
Ala Leu Arg Thr Ser Ser Phe Ile Asn Gly Val Ser Lys Leu His Ala
355 360 365
Asp Val Ser Arg Arg Met Phe Lys Asn Val Trp Lys Gly Val Pro Val
370 375 380
Glu Glu Ile Pro Ile Glu Gly Ile Thr Asn Gly Val His Met Gly Thr
385 390 395 400
Trp Ile Asn Arg Glu Met Arg Lys Leu Phe Asp Arg Tyr Leu Gly Arg
405 410 415
Val Trp Arg Glu His Thr Asp Leu Glu Gly Ile Trp Tyr Gly Val Asp
420 425 430
Arg Ile Pro Asp Glu Glu Leu Trp Glu Ala His Leu Asn Ala Lys Lys
435 440 445
Arg Phe Ile Asp Tyr Ile Arg Glu Ser Ile Lys Arg Arg Asn Glu Arg
450 455 460
Leu Gly Ile Asn Glu Pro Leu Pro Glu Ile Ser Glu Asn Val Leu Ile
465 470 475 480
Ile Gly Phe Ala Arg Arg Phe Ala Thr Tyr Lys Arg Ala Val Leu Leu
485 490 495
Phe Ser Asp Leu Glu Arg Leu Lys Arg Ile Val Asn Asn Ser Glu Arg
500 505 510
Pro Val Tyr Ile Val Tyr Ala Gly Lys Ala His Pro Arg Asp Glu Gly
515 520 525
Gly Lys Glu Phe Leu Arg Arg Ile Tyr Glu Val Ser Gln Met Pro Asp
530 535 540
Phe Lys Asn Lys Ile Ile Val Leu Glu Asn Tyr Asp Ile Gly Met Ala
545 550 555 560
Arg Leu Met Val Ser Gly Val Asp Val Trp Leu Asn Asn Pro Arg Arg
565 570 575
Pro Met Glu Ala Ser Gly Thr Ser Gly Met Lys Ala Ala Ala Asn Gly
580 585 590
Val Leu Asn Ala Ser Val Tyr Asp Gly Trp Trp Val Glu Gly Tyr Asn
595 600 605
Gly Arg Asn Gly Trp Val Ile Gly Asp Glu Ser Val Leu Pro Glu Thr
610 615 620
Glu Ala Asp Asp Pro Lys Asp Ala Glu Ala Leu Tyr Glu Leu Leu Glu
625 630 635 640
Asn Glu Ile Ile Pro Thr Tyr Tyr Glu Asn Arg Glu Lys Trp Ile Phe
645 650 655
Met Met Lys Glu Ser Ile Lys Ser Val Ala Pro Lys Phe Ser Thr Thr
660 665 670
Arg Met Leu Lys Glu Tyr Thr Glu Lys Phe Tyr Ile Lys Gly Leu Val
675 680 685
Asn Arg Glu Trp Leu Glu Arg Arg Glu Asn Val Glu Lys Ile Gly Ala
690 695 700
Trp Lys Glu Arg Ile Leu Lys Asn Trp Glu Asn Val Ser Ile Glu Arg
705 710 715 720
Ile Val Leu Glu Asp Ser Lys Ser Val Glu Val Thr Val Lys Leu Gly
725 730 735
Asp Leu Thr Pro Asn Asp Val Ile Val Glu Leu Val Ala Gly Arg Gly
740 745 750
Glu Gly Met Glu Asp Leu Glu Val Trp Lys Val Ile His Ile Arg Arg
755 760 765
Tyr Arg Lys Glu Asn Asp Leu Phe Val Tyr Thr Tyr Thr Asn Gly Val
770 775 780
Leu Gly His Leu Gly Ser Pro Gly Trp Phe Tyr Ala Val Arg Val Ile
785 790 795 800
Pro Tyr His Pro Arg Leu Pro Ile Lys Phe Leu Pro Glu Val Pro Val
805 810 815
Val Trp Lys Lys Val Leu
820
<210> 9
<211> 456
<212> БЕЛОК
<213> Thermococcus kodakaraensis
<400> 9
Met Gly Lys Leu Phe Gly Thr Phe Gly Val Arg Gly Ile Ala Asn Glu
1 5 10 15
Glu Ile Thr Pro Glu Phe Ala Leu Lys Ile Gly Met Ala Phe Gly Thr
20 25 30
Leu Leu Lys Arg Glu Gly Arg Glu Arg Pro Leu Val Val Val Gly Arg
35 40 45
Asp Thr Arg Val Ser Gly Glu Met Leu Lys Asp Ala Leu Ile Ser Gly
50 55 60
Leu Leu Ser Thr Gly Cys Asp Val Ile Asp Val Gly Ile Ala Pro Thr
65 70 75 80
Pro Ala Ile Gln Trp Ala Thr Asn His Phe Asn Ala Asp Gly Gly Ala
85 90 95
Val Ile Thr Ala Ser His Asn Pro Pro Glu Tyr Asn Gly Ile Lys Leu
100 105 110
Leu Glu Pro Asn Gly Met Gly Leu Lys Lys Glu Arg Glu Ala Ile Val
115 120 125
Glu Glu Leu Phe Phe Ser Glu Asp Phe His Arg Ala Lys Trp Asn Glu
130 135 140
Ile Gly Glu Leu Arg Lys Glu Asp Ile Ile Lys Pro Tyr Ile Glu Ala
145 150 155 160
Ile Lys Asn Arg Val Asp Val Glu Ala Ile Lys Lys Arg Arg Pro Phe
165 170 175
Val Val Val Asp Thr Ser Asn Gly Ala Gly Ser Leu Thr Leu Pro Tyr
180 185 190
Leu Leu Arg Glu Leu Gly Cys Lys Val Val Ser Val Asn Ala His Pro
195 200 205
Asp Gly His Phe Pro Ala Arg Asn Pro Glu Pro Asn Glu Glu Asn Leu
210 215 220
Lys Gly Phe Met Glu Ile Val Lys Ala Leu Gly Ala Asp Phe Gly Val
225 230 235 240
Ala Gln Asp Gly Asp Ala Asp Arg Ala Val Phe Ile Asp Glu Asn Gly
245 250 255
Arg Phe Ile Gln Gly Asp Lys Thr Phe Ala Leu Val Ala Asp Ala Val
260 265 270
Leu Arg Glu Asn Gly Gly Gly Leu Leu Val Thr Thr Ile Ala Thr Ser
275 280 285
Asn Leu Leu Asp Asp Ile Ala Lys Arg Asn Gly Ala Lys Val Met Arg
290 295 300
Thr Lys Val Gly Asp Leu Ile Val Ala Arg Ala Leu Leu Glu Asn Asn
305 310 315 320
Gly Thr Ile Gly Gly Glu Glu Asn Gly Gly Val Ile Phe Pro Asp Phe
325 330 335
Val Leu Gly Arg Asp Gly Ala Met Thr Thr Ala Lys Ile Val Glu Ile
340 345 350
Phe Ala Lys Ser Gly Lys Lys Phe Ser Glu Leu Ile Asp Glu Leu Pro
355 360 365
Lys Tyr Tyr Gln Phe Lys Thr Lys Arg His Val Glu Gly Asp Arg Lys
370 375 380
Ala Ile Val Ala Lys Val Ala Glu Leu Ala Glu Lys Lys Gly Tyr Lys
385 390 395 400
Ile Asp Thr Thr Asp Gly Thr Lys Ile Ile Phe Asp Asp Gly Trp Val
405 410 415
Leu Val Arg Ala Ser Gly Thr Glu Pro Ile Ile Arg Ile Phe Ser Glu
420 425 430
Ala Lys Ser Glu Glu Lys Ala Arg Glu Tyr Leu Glu Leu Gly Ile Lys
435 440 445
Leu Leu Glu Glu Ala Leu Lys Gly
450 455
<210> 10
<211> 408
<212> БЕЛОК
<213> Dictyoglomus thermophilum
<400> 10
Met Trp Leu Ser Lys Asp Tyr Leu Arg Lys Lys Gly Val Tyr Ser Ile
1 5 10 15
Cys Ser Ser Asn Pro Tyr Val Ile Glu Ala Ser Val Glu Phe Ala Lys
20 25 30
Glu Lys Asn Asp Tyr Ile Leu Ile Glu Ala Thr Pro His Gln Ile Asn
35 40 45
Gln Phe Gly Gly Tyr Ser Gly Met Thr Pro Glu Asp Phe Lys Asn Phe
50 55 60
Val Met Gly Ile Ile Lys Glu Lys Gly Ile Glu Glu Asp Arg Val Ile
65 70 75 80
Leu Gly Gly Asp His Leu Gly Pro Leu Pro Trp Gln Asp Glu Pro Ser
85 90 95
Ser Ser Ala Met Lys Lys Ala Lys Asp Leu Ile Arg Ala Phe Val Glu
100 105 110
Ser Gly Tyr Lys Lys Ile His Leu Asp Cys Ser Met Ser Leu Ser Asp
115 120 125
Asp Pro Val Val Leu Ser Pro Glu Lys Ile Ala Glu Arg Glu Arg Glu
130 135 140
Leu Leu Glu Val Ala Glu Glu Thr Ala Arg Lys Tyr Asn Phe Gln Pro
145 150 155 160
Val Tyr Val Val Gly Thr Asp Val Pro Val Ala Gly Gly Gly Glu Glu
165 170 175
Glu Gly Ile Thr Ser Val Glu Asp Phe Arg Val Ala Ile Ser Ser Leu
180 185 190
Lys Lys Tyr Phe Glu Asp Val Pro Arg Ile Trp Asp Arg Ile Ile Gly
195 200 205
Phe Val Ile Met Leu Gly Ile Gly Phe Asn Tyr Glu Lys Val Phe Glu
210 215 220
Tyr Asp Arg Ile Lys Val Arg Lys Ile Leu Glu Glu Val Lys Lys Glu
225 230 235 240
Asn Leu Phe Val Glu Gly His Ser Thr Asp Tyr Gln Thr Lys Arg Ala
245 250 255
Leu Arg Asp Met Val Glu Asp Gly Val Arg Ile Leu Lys Val Gly Pro
260 265 270
Ala Leu Thr Ala Ser Phe Arg Arg Gly Val Phe Leu Leu Ser Ser Ile
275 280 285
Glu Asp Glu Leu Ile Ser Glu Asp Lys Arg Ser Asn Ile Lys Lys Val
290 295 300
Val Leu Glu Thr Met Leu Lys Asp Asp Lys Tyr Trp Arg Lys Tyr Tyr
305 310 315 320
Lys Asp Ser Glu Arg Leu Glu Leu Asp Ile Trp Tyr Asn Leu Leu Asp
325 330 335
Arg Ile Arg Tyr Tyr Trp Glu Tyr Lys Glu Ile Lys Ile Ala Leu Asn
340 345 350
Arg Leu Phe Glu Asn Phe Ser Glu Gly Val Asp Ile Arg Tyr Ile Tyr
355 360 365
Gln Tyr Phe Tyr Asp Ser Tyr Phe Lys Val Arg Glu Gly Lys Ile Arg
370 375 380
Asn Asp Pro Arg Glu Leu Ile Lys Asn Glu Ile Lys Lys Val Leu Glu
385 390 395 400
Asp Tyr His Tyr Ala Val Asn Leu
405
<210> 11
<211> 223
<212> БЕЛОК
<213> Archaeoglobus fugidis
<400> 11
Met Phe Lys Pro Lys Ala Ile Ala Val Asp Ile Asp Gly Thr Leu Thr
1 5 10 15
Asp Arg Lys Arg Ala Leu Asn Cys Arg Ala Val Glu Ala Leu Arg Lys
20 25 30
Val Lys Ile Pro Val Ile Leu Ala Thr Gly Asn Ile Ser Cys Phe Ala
35 40 45
Arg Ala Ala Ala Lys Leu Ile Gly Val Ser Asp Val Val Ile Cys Glu
50 55 60
Asn Gly Gly Val Val Arg Phe Glu Tyr Asp Gly Glu Asp Ile Val Leu
65 70 75 80
Gly Asp Lys Glu Lys Cys Val Glu Ala Val Arg Val Leu Glu Lys His
85 90 95
Tyr Glu Val Glu Leu Leu Asp Phe Glu Tyr Arg Lys Ser Glu Val Cys
100 105 110
Met Arg Arg Ser Phe Asp Ile Asn Glu Ala Arg Lys Leu Ile Glu Gly
115 120 125
Met Gly Val Lys Leu Val Asp Ser Gly Phe Ala Tyr His Ile Met Asp
130 135 140
Ala Asp Val Ser Lys Gly Lys Ala Leu Lys Phe Val Ala Glu Arg Leu
145 150 155 160
Gly Ile Ser Ser Ala Glu Phe Ala Val Ile Gly Asp Ser Glu Asn Asp
165 170 175
Ile Asp Met Phe Arg Val Ala Gly Phe Gly Ile Ala Val Ala Asn Ala
180 185 190
Asp Glu Arg Leu Lys Glu Tyr Ala Asp Leu Val Thr Pro Ser Pro Asp
195 200 205
Gly Glu Gly Val Val Glu Ala Leu Gln Phe Leu Gly Leu Leu Arg
210 215 220
<210> 12
<211> 659
<212> БЕЛОК
<213> Thermococcus litoralis
<400> 12
Met Glu Arg Ile Asn Phe Ile Phe Gly Ile His Asn His Gln Pro Leu
1 5 10 15
Gly Asn Phe Gly Trp Val Phe Glu Glu Ala Tyr Asn Arg Ser Tyr Arg
20 25 30
Pro Phe Met Glu Ile Leu Glu Glu Phe Pro Glu Met Lys Val Asn Val
35 40 45
His Phe Ser Gly Pro Leu Leu Glu Trp Ile Glu Glu Asn Lys Pro Asp
50 55 60
Tyr Leu Asp Leu Leu Arg Ser Leu Ile Lys Arg Gly Gln Leu Glu Ile
65 70 75 80
Val Val Ala Gly Phe Tyr Glu Pro Val Leu Ala Ala Ile Pro Lys Glu
85 90 95
Asp Arg Leu Val Gln Ile Glu Met Leu Lys Asp Tyr Ala Arg Lys Leu
100 105 110
Gly Tyr Asp Ala Lys Gly Val Trp Leu Thr Glu Arg Val Trp Gln Pro
115 120 125
Glu Leu Val Lys Ser Leu Arg Glu Ala Gly Ile Glu Tyr Val Val Val
130 135 140
Asp Asp Tyr His Phe Met Ser Ala Gly Leu Ser Lys Glu Glu Leu Phe
145 150 155 160
Trp Pro Tyr Tyr Thr Glu Asp Gly Gly Glu Val Ile Thr Val Phe Pro
165 170 175
Ile Asp Glu Lys Leu Arg Tyr Leu Ile Pro Phe Arg Pro Val Lys Lys
180 185 190
Thr Ile Glu Tyr Leu Glu Ser Leu Thr Ser Asp Asp Pro Ser Lys Val
195 200 205
Ala Val Phe His Asp Asp Gly Glu Lys Phe Gly Val Trp Pro Gly Thr
210 215 220
Tyr Glu Trp Val Tyr Glu Lys Gly Trp Leu Arg Glu Phe Phe Asp Ala
225 230 235 240
Ile Thr Ser Asn Glu Lys Ile Asn Leu Met Thr Tyr Ser Glu Tyr Leu
245 250 255
Ser Lys Phe Thr Pro Arg Gly Leu Val Tyr Leu Pro Ile Ala Ser Tyr
260 265 270
Phe Glu Met Ser Glu Trp Ser Leu Pro Ala Lys Gln Ala Lys Leu Phe
275 280 285
Val Glu Phe Val Glu Gln Leu Lys Glu Glu Gly Lys Phe Glu Lys Tyr
290 295 300
Arg Val Phe Val Arg Gly Gly Ile Trp Lys Asn Phe Phe Phe Lys Tyr
305 310 315 320
Pro Glu Ser Asn Phe Met His Lys Arg Met Leu Met Val Ser Lys Ala
325 330 335
Val Arg Asp Asn Pro Glu Ala Arg Lys Tyr Ile Leu Lys Ala Gln Cys
340 345 350
Asn Asp Ala Tyr Trp His Gly Val Phe Gly Gly Ile Tyr Leu Pro His
355 360 365
Leu Arg Arg Thr Val Trp Glu Asn Ile Ile Lys Ala Gln Arg Tyr Leu
370 375 380
Lys Pro Glu Asn Lys Ile Leu Asp Val Asp Phe Asp Gly Arg Ala Glu
385 390 395 400
Ile Met Val Glu Asn Asp Gly Phe Ile Ala Thr Ile Lys Pro His Tyr
405 410 415
Gly Gly Ser Ile Phe Glu Leu Ser Ser Lys Arg Lys Ala Val Asn Tyr
420 425 430
Asn Asp Val Leu Pro Arg Arg Trp Glu His Tyr His Glu Val Pro Glu
435 440 445
Ala Thr Lys Pro Glu Lys Glu Ser Glu Glu Gly Ile Ala Ser Ile His
450 455 460
Glu Leu Gly Lys Gln Ile Pro Glu Glu Ile Arg Arg Glu Leu Ala Tyr
465 470 475 480
Asp Trp Gln Leu Arg Ala Ile Leu Gln Asp His Phe Ile Lys Pro Glu
485 490 495
Glu Thr Leu Asp Asn Tyr Arg Leu Val Lys Tyr His Glu Leu Gly Asp
500 505 510
Phe Val Asn Gln Pro Tyr Glu Tyr Glu Met Ile Glu Asn Gly Val Lys
515 520 525
Leu Trp Arg Glu Gly Gly Val Tyr Ala Glu Glu Lys Ile Pro Ala Arg
530 535 540
Val Glu Lys Lys Ile Glu Leu Thr Glu Asp Gly Phe Ile Ala Lys Tyr
545 550 555 560
Arg Val Leu Leu Glu Lys Pro Tyr Lys Ala Leu Phe Gly Val Glu Ile
565 570 575
Asn Leu Ala Val His Ser Val Met Glu Lys Pro Glu Glu Phe Glu Ala
580 585 590
Lys Glu Phe Glu Val Asn Asp Pro Tyr Gly Ile Gly Lys Val Arg Ile
595 600 605
Glu Leu Asp Lys Ala Ala Lys Val Trp Lys Phe Pro Ile Lys Thr Leu
610 615 620
Ser Gln Ser Glu Ala Gly Trp Asp Phe Ile Gln Gln Gly Val Ser Tyr
625 630 635 640
Thr Met Leu Phe Pro Ile Glu Lys Glu Leu Glu Phe Thr Val Arg Phe
645 650 655
Arg Glu Leu
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ФЕРМЕНТАТИВНОЕ ПОЛУЧЕНИЕ ГЕКСОЗ | 2018 |
|
RU2766710C2 |
| МУЛЬТИМЕРИЗУЮЩИЕСЯ ПОЛИПЕПТИДЫ, ПРОИСХОДЯЩИЕ ОТ ДОМЕНА С УКЛАДКОЙ ТИПА РУЛЕТ ОСНОВАНИЯ ПЕНТОНА АДЕНОВИРУСА | 2019 |
|
RU2820522C2 |
| ФЕРМЕНТАТИВНОЕ ПОЛУЧЕНИЕ D-АЛЛЮЛОЗЫ | 2017 |
|
RU2819709C2 |
| КОМПОЗИЦИИ И СПОСОБЫ РЕДАКТИРОВАНИЯ ГЕНОВ | 2019 |
|
RU2804665C2 |
| МУЛЬТИФУНКЦИОНАЛЬНЫЙ МУЛЬТИСПЕЦИФИЧЕСКИЙ МУЛЬТИМЕРНЫЙ БИОМОЛЕКУЛЯРНЫЙ ПОЛИМЕР, ИМЕЮЩИЙ ПРОЛОНГИРОВАННУЮ ЭФФЕКТИВНОСТЬ IN VIVO | 2020 |
|
RU2805307C1 |
| ХИМЕРНЫЙ БЕЛОК L1 ПАПИЛЛОМАВИРУСА | 2020 |
|
RU2808002C2 |
| НЕ ТОКСИЧЕСКИЕ ПОЛИПЕПТИДЫ КЛОСТРИДИАЛЬНОГО НЕЙРОТОКСИНА ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ НЕВРОЛОГИЧЕСКИХ НАРУШЕНИЙ | 2020 |
|
RU2839368C1 |
| ПОЛИВАЛЕНТНАЯ ИММУНОГЕННАЯ КОМПОЗИЦИЯ ПРОТИВ ПАПИЛЛОМАВИРУСА ЧЕЛОВЕКА | 2020 |
|
RU2806424C2 |
| ГИБРИДНЫЕ НЕЙРОТОКСИНЫ | 2017 |
|
RU2782382C2 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2837821C1 |
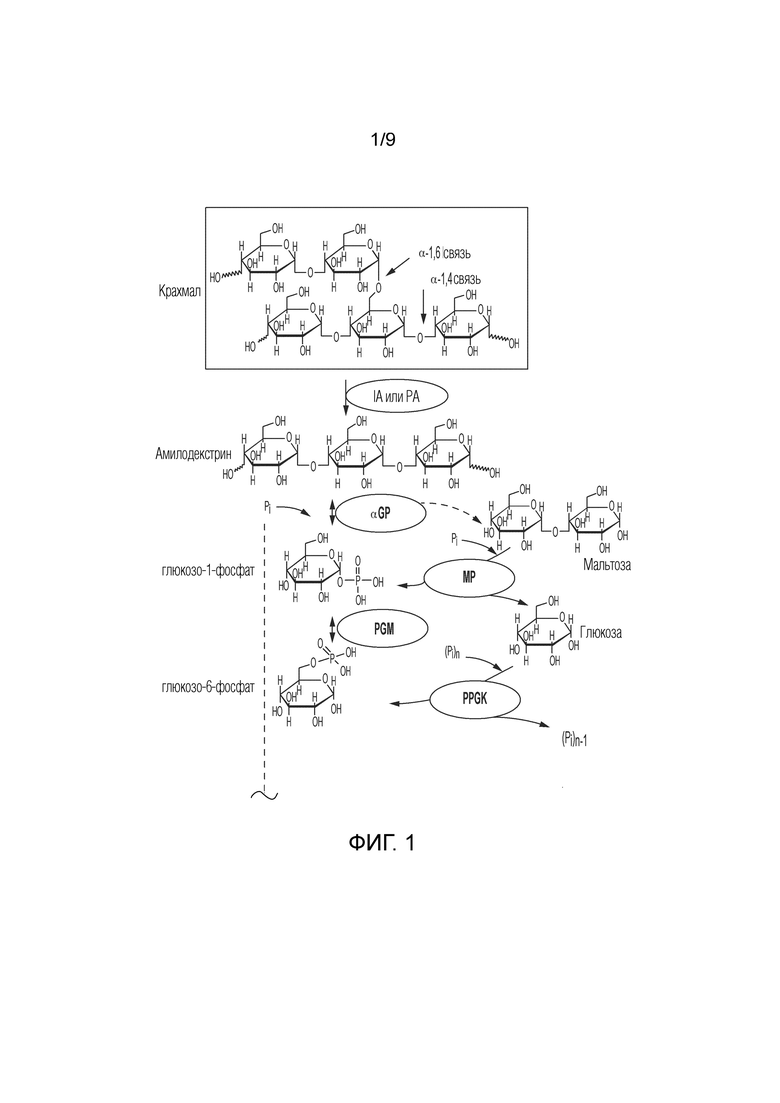
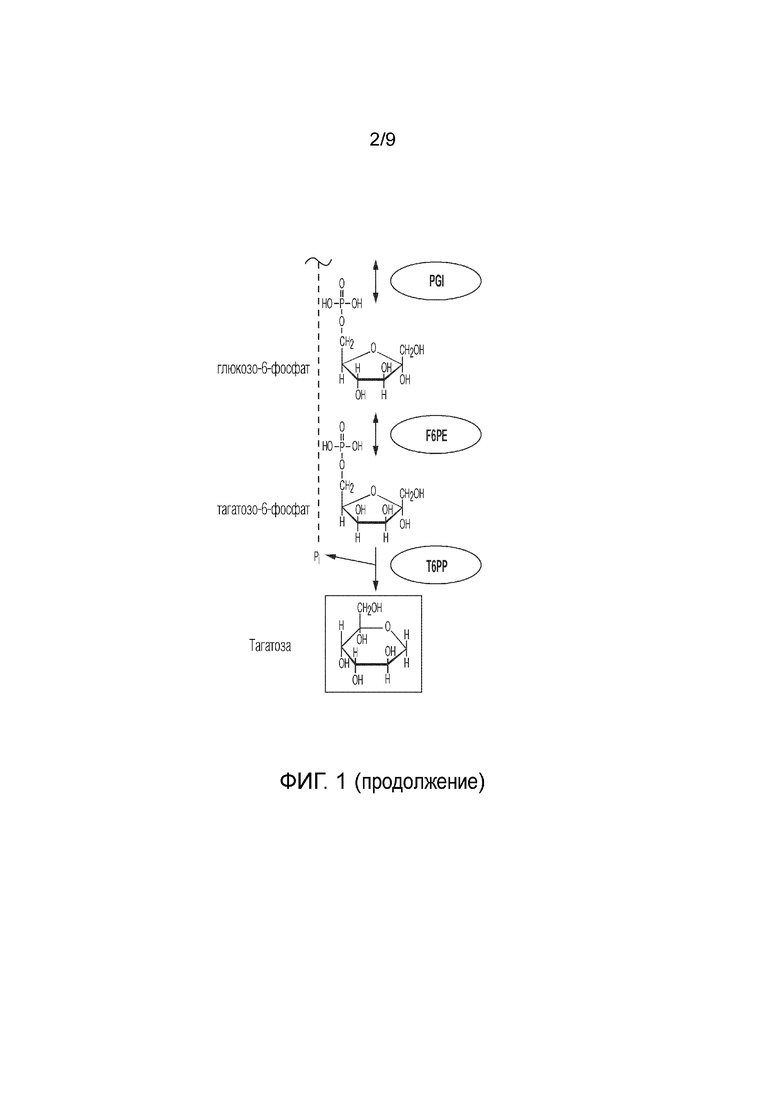
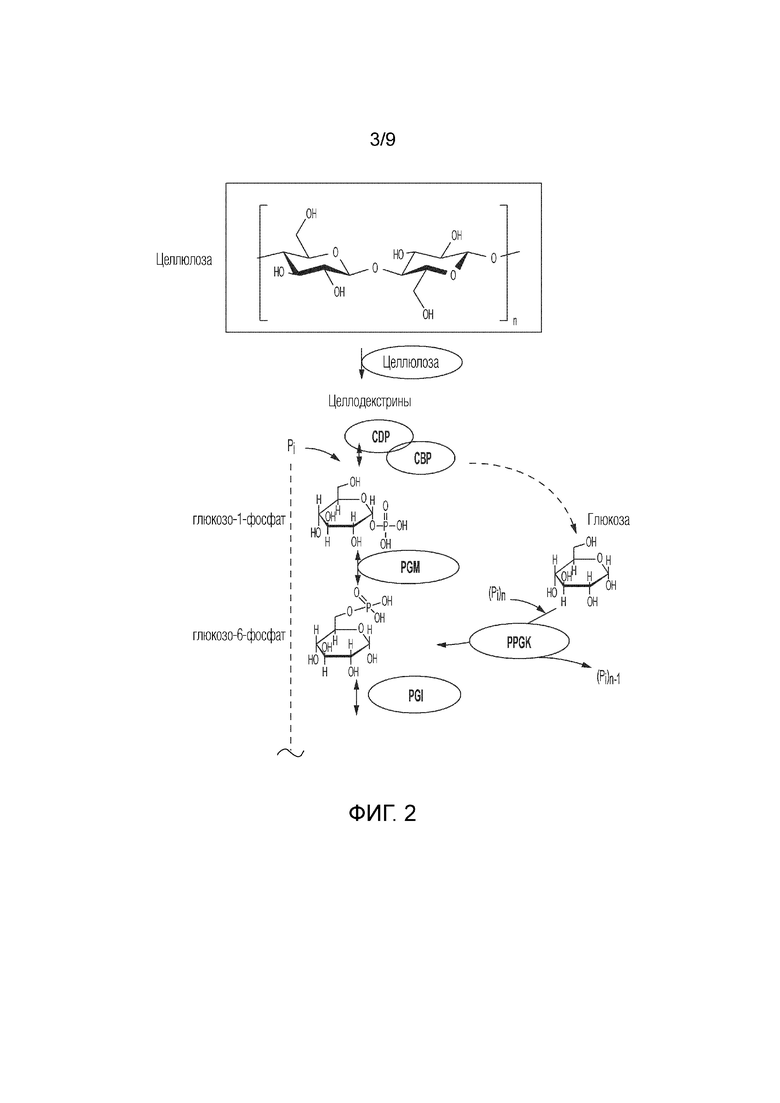
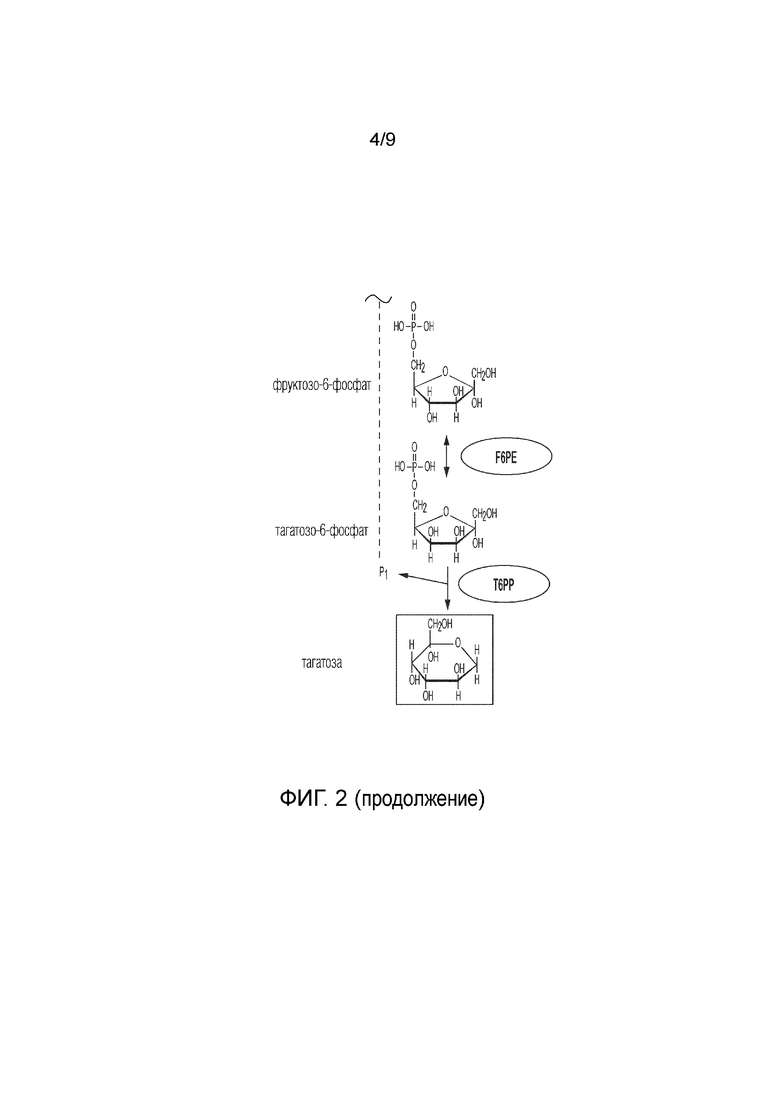
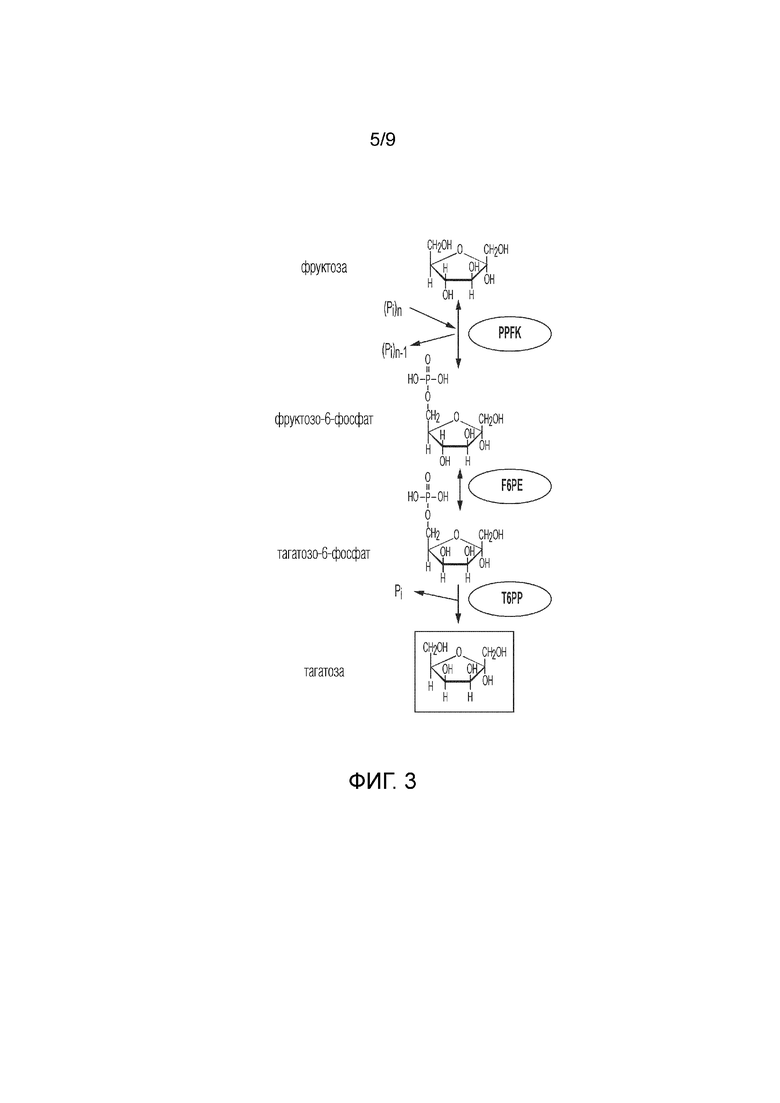
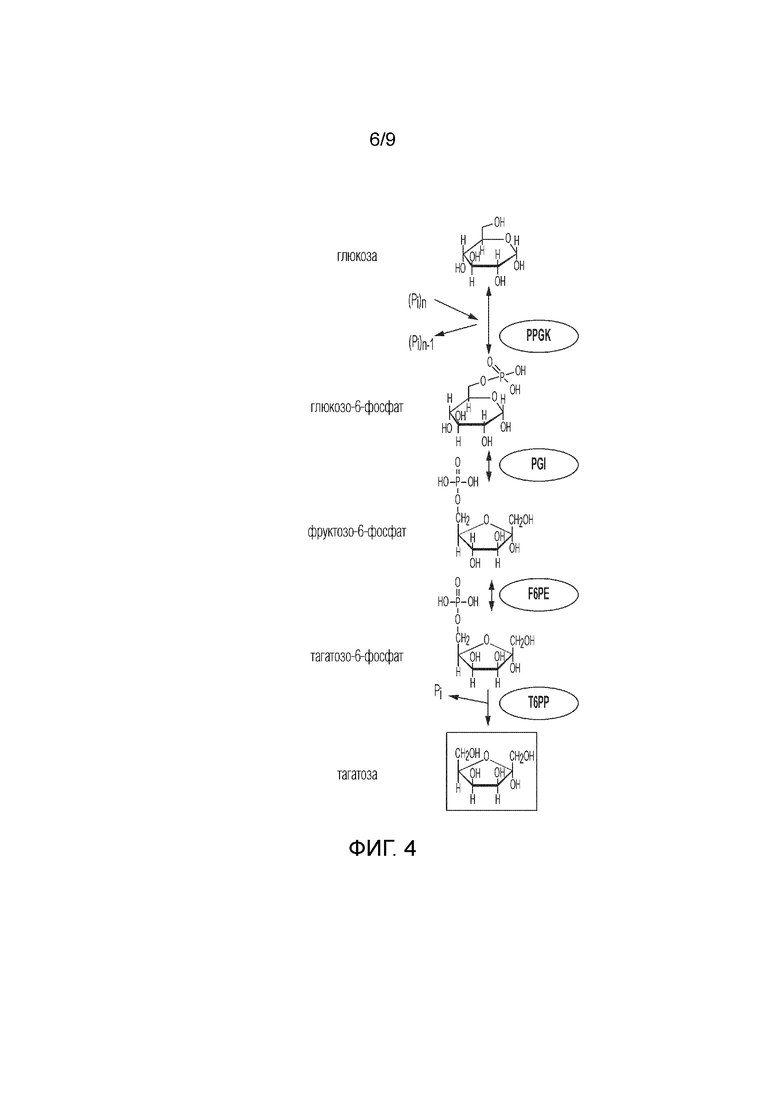
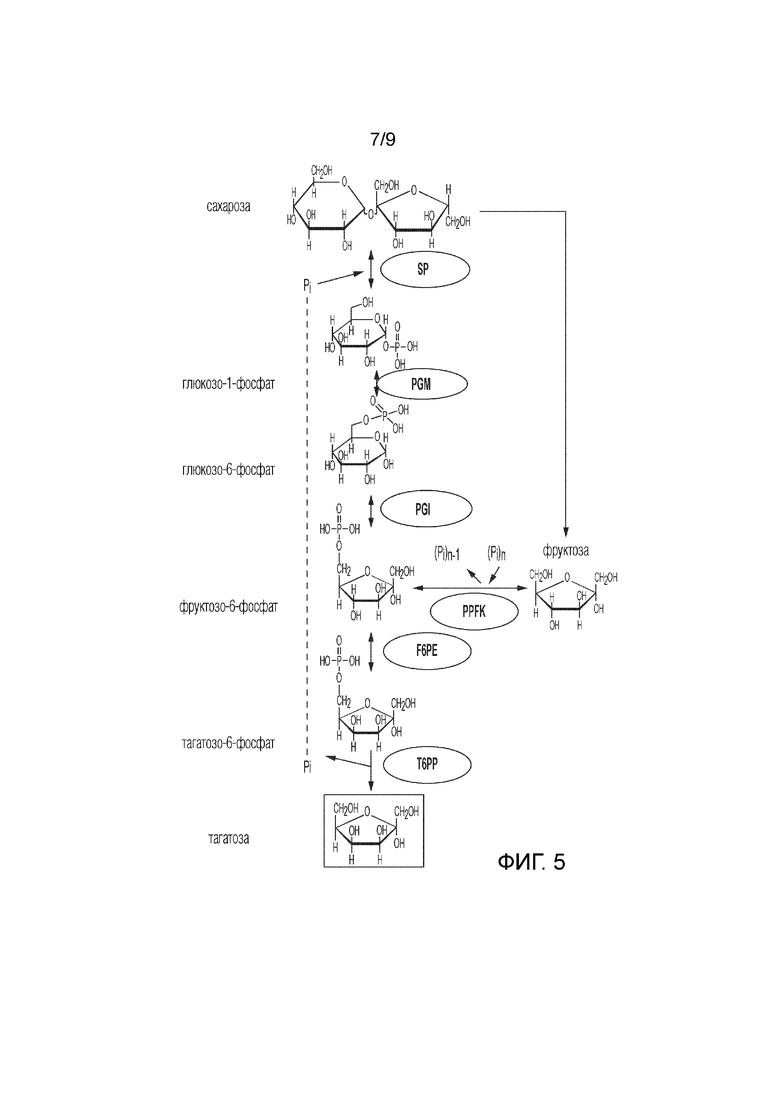
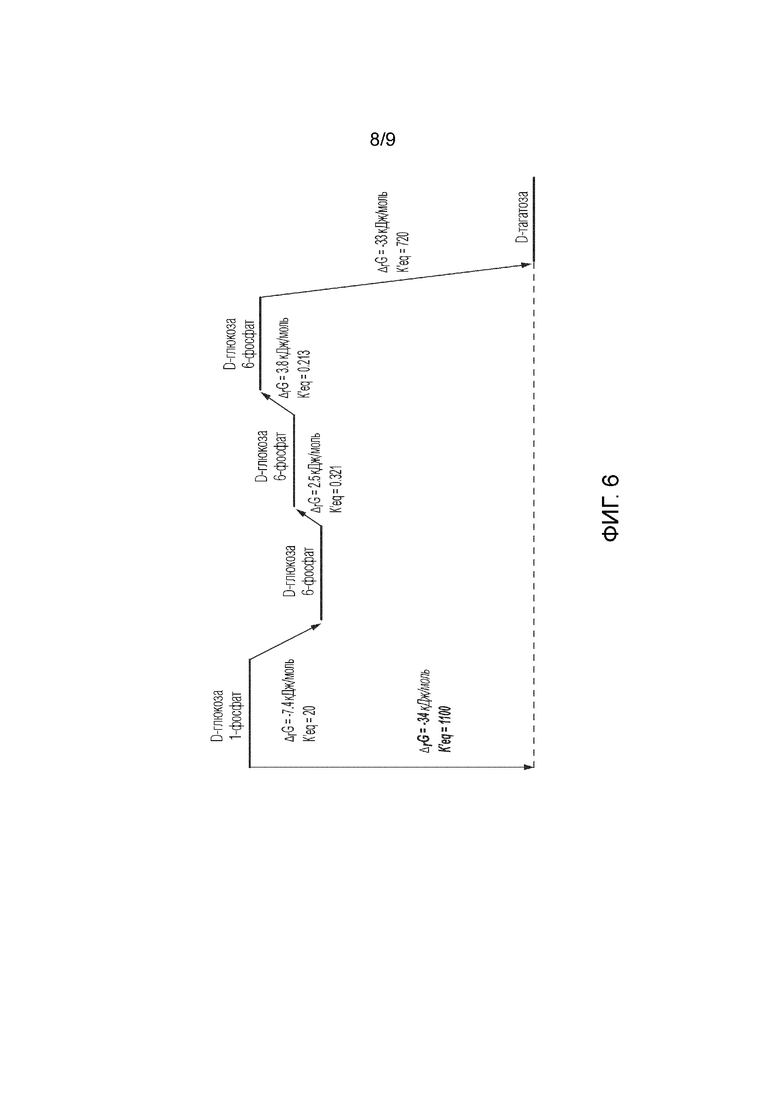
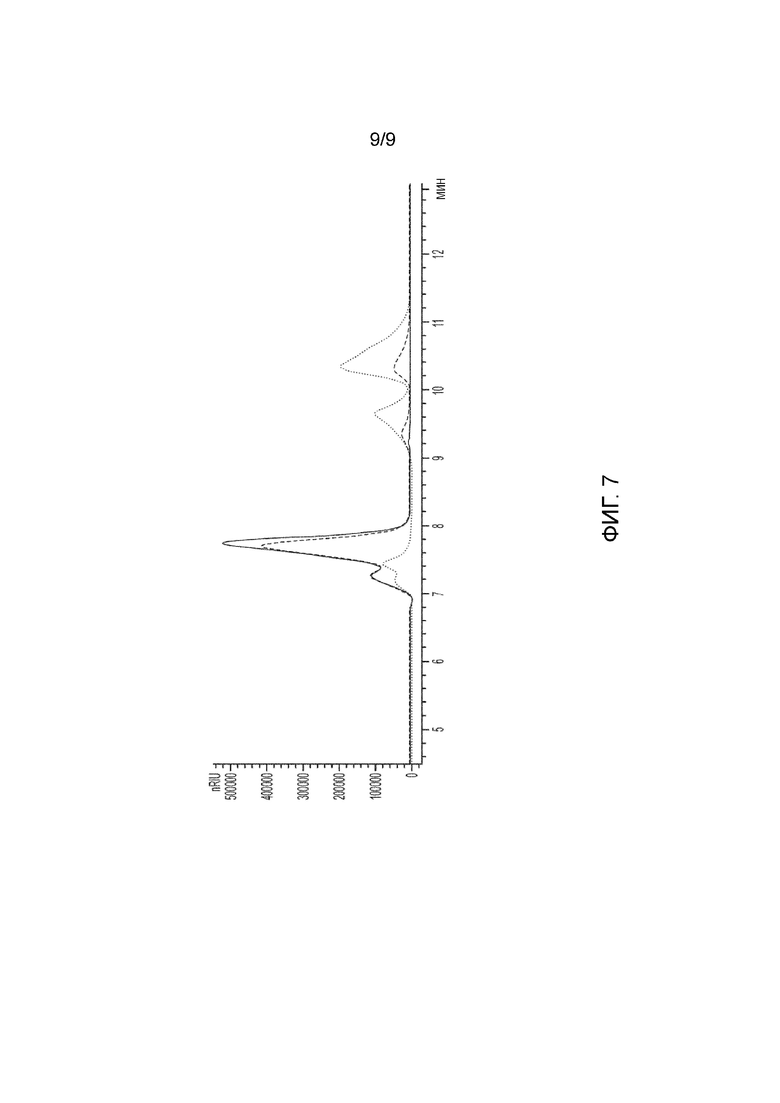
Изобретение относится к биотехнологии и представляет собой усовершенствованный способ получения тагатозы из сахарида, причем способ включает преобразование фруктозо-6-фосфата (F6P) в тагатозо-6-фосфат (T6P) с использованием фруктозо-6-фосфатэпимеразы (F6PE), причем F6PE содержит аминокислотную последовательность SEQ ID NO: 2 или SEQ ID NO: 7; и преобразование T6P в тагатозу с использованием тагатозо-6-фосфатфосфатазы (T6PP), где F6PE обладает более высокой активностью в усовершенствованном способе по сравнению со способом, в котором используется F6PE из Dictyoglomus thermophilum с номером доступа UniProt B5YBD7. Изобретение позволяет получить тагатозу с высокой степенью эффективности. 2 н. и 14 з.п. ф-лы, 7 ил., 2 табл., 3 пр.
1. Усовершенствованный способ получения тагатозы из сахарида, причем усовершенствованный способ включает:
преобразование фруктозо-6-фосфата (F6P) в тагатозо-6-фосфат (T6P) с использованием фруктозо-6-фосфатэпимеразы (F6PE), причем F6PE содержит аминокислотную последовательность SEQ ID NO: 2 или SEQ ID NO: 7; и
преобразование T6P в тагатозу с использованием тагатозо-6-фосфатфосфатазы (T6PP),
где F6PE обладает более высокой активностью в усовершенствованном способе по сравнению со способом, в котором используется F6PE из Dictyoglomus thermophilum с номером доступа UniProt B5YBD7.
2. Усовершенствованный способ получения тагатозы из сахарида, причем усовершенствованный способ включает:
преобразование фруктозо-6-фосфата (F6P) в тагатозо-6-фосфат (T6P) с использованием фруктозо-6-фосфатэпимеразы (F6PE); и
преобразование T6P в тагатозу с использованием тагатозо-6-фосфатфосфатазы (T6PP), причем T6PP содержит аминокислотную последовательность SEQ ID NO: 5, SEQ ID NO: 4, SEQ ID NO: 6 или SEQ ID NO: 3,
где T6PP обладает более высокой активностью в усовершенствованном способе по сравнению со способом, в котором используется T6PP из Archaeoglobus fulgidus с номером доступа UniProt O29805.
3. Способ по п. 2, дополнительно включающий этап преобразования фруктозо-6-фосфата (F6P) в тагатозо-6-фосфат (T6P) с использованием фруктозо-6-фосфатэпимеразы (F6PE), причем F6PE содержит аминокислотную последовательность SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 7,
где F6PE обладает более высокой активностью в усовершенствованном способе по сравнению со способом, в котором используется F6PE из Dictyoglomus thermophilum с номером доступа UniProt B5YBD7.
4. Способ по любому из пп. 1-3, дополнительно включающий этап преобразования глюкозо-6-фосфата (G6P) в F6P, причем этап катализируют фосфоглюкозоизомеразой (PGI).
5. Способ по п. 4, дополнительно включающий этап преобразования глюкозо-1-фосфата (G1P) в G6P, причем этап катализируют фосфоглюкомутазой (PGM).
6. Способ по п. 5, дополнительно включающий этап преобразования сахарида в G1P, причем этап катализируют по меньшей мере одним ферментом, причем сахарид выбирают из группы, состоящей из крахмала или его производного, целлюлозы или ее производного и сахарозы.
7. Способ по п. 6, в котором по меньшей мере один фермент выбирают из группы, состоящей из альфа-глюканфосфорилаза (αGP), мальтозофосфорилазы, сахарозофосфорилазы, целлодекстринфосфорилазы, целлобиозофосфорилазы и целлюлозофосфорилазы.
8. Способ по п. 6, в котором сахаридом является крахмал или его производное, выбранное из группы, состоящей из амилозы, амилопектина, растворимого крахмала, амилодекстрина, мальтодекстрина, мальтозы, мальтотриозы и глюкозы.
9. Способ по п. 8, дополнительно включающий этап преобразования крахмала в производное крахмала, причем производное крахмала получают с помощью ферментативного гидролиза или кислотного гидролиза крахмала.
10. Способ по п. 9, причем в способ добавляют 4-глюкантрансферазу (4GT).
11. Способ по п. 9, в котором производное крахмала получают с помощью ферментативного гидролиза крахмала, с использованием изоамилазы, пуллуланазы, альфа-амилазы или их комбинации.
12. Способ по любому из пп. 1-3, дополнительно включающий:
этап преобразования фруктозы в F6P, катализируемого по меньшей мере одним ферментом; и
необязательно, этап преобразования сахарозы во фруктозу, катализируемого по меньшей мере одним ферментом.
13. Способ по п. 4, дополнительно включающий:
этап преобразования глюкозы в G6P, катализируемого по меньшей мере одним ферментом, и
необязательно, этап преобразования сахарозы в глюкозу, катализируемого по меньшей мере одним ферментом.
14. Способ по п. 3, в котором этапы способа проводят по меньшей мере в одном из следующих условий способа:
в одном реакционном сосуде;
при температуре в диапазоне от приблизительно 37 до приблизительно 85°C;
с pH в диапазоне от приблизительно 5,0 до приблизительно 9,0;
в течение от приблизительно 1 до приблизительно 48 ч; или
в любой комбинации вышеперечисленного.
15. Способ по п. 3, в котором этапы способа проводят по меньшей мере в одном из следующих условий способа:
без аденозинтрифосфата (ATP) в качестве источника фосфата;
без никотинамидаденозиндинуклеотида;
с концентрацией фосфата от приблизительно 0,1 до приблизительно 150 мМ;
с концентрацией Mg2+ от приблизительно 0,1 до 50 мМ;
причем ионы фосфата, полученные дефосфорилированием T6P с помощью T6PP, использованы на этапе способа преобразования сахарида в G1P;
при этом по меньшей мере один этап способа включает энергетически выгодную химическую реакцию; или
в любой комбинации вышеперечисленного.
16. Способ по любому из пп. 2, 14 или 15, дополнительно включающий этап извлечения с отделением полученной тагатозы, причем извлечение с отделением происходит не с помощью хроматографического отделения.
| WO 2018182344 A1, 04.10.2018 | |||
| EP 3322803 A1, 23.05.2018 | |||
| Прибор для измерения и автоматической регистрации плотности воды на различных глубинах | 1948 |
|
SU84211A1 |
| Прибор для измерения и автоматической регистрации плотности воды на различных глубинах | 1948 |
|
SU84211A1 |
| СПОСОБ ПОЛУЧЕНИЯ ТАГАТОЗЫ С ИСПОЛЬЗОВАНИЕМ ОЛИГОСАХАРИДА СОИ | 2009 |
|
RU2451688C2 |
Авторы
Даты
2024-06-06—Публикация
2019-10-18—Подача