Изобретение относится к области микробиологии и может быть использовано в практической и научно-исследовательской работе для диагностики и изучения условно-патогенных микроорганизмов рода Desulfovibrio, а именно к питательным средам для обогащения и ускоренного культивирования сульфатредуцирующих бактерий.
Бактерии рода Desulfovibrio - это анаэробные грамотрицательные спиральные или изогнутые подвижные палочки, продуцирующие в процессе своей жизнедеятельности сероводород (H2S) и десульфовиридин, который при УФ-излучении флуоресцирует красным при щелочном рН и зеленым при кислотном рН [Machaca М, Bodean ML, Montana S, Garcia SD, Stecher D, Vay CA, Almuzara MN. Descripcion de un caso de sepsis abdominal рог Desulfovibrio desulfuricans [Description of a case of abdominal sepsis due to Desulfovibrio desulfuricans]. Rev Argent Microbiol. 2022 Jun 7:S0325-7541(22)00028-1. Spanish, doi: 10.1016/j.ram.2022.05.002. Epub ahead of print. PMID: 35688718; HagiyaH, KimuraK, Nishi I, Yamamoto N, Yoshida H, Akeda Y, Tomono K. Desulfovibrio desulfuricans bacteremia: A case report and literature review. Anaerobe. 2018 Feb;49:112-115. doi: 10.1016/j.anaerobe.2017.12.013. Epub 2018 Jan 4. PMID: 29305996; Goldstein EJ, Citron DM, Peraino VA, Cross SA. Desulfovibrio desulfuricans bacteremia and review of human Desulfovibrio infections. J Clin Microbiol. 2003 Jun;41(6):2752-4. doi: 10.1128/JCM.41.6.2752-2754.2003. PMID: 12791922; PMCID: РМС156571].
Согласно опубликованным данным, сульфатредуцирующие бактерии (СРВ) колонизируют придонные отложения солоноватых озер, а также желудочно-кишечный тракт (ЖКТ) млекопитающих, в том числе человека [Marquis TJ, Williams VJ, Banach DB. Septic arthritis caused by Desulfovibrio desulfuricans: A case report and review of the literature. Anaerobe. 2021 Aug;70:102407. doi: 10.1016/j.anaerobe.2021.102407. Epub 2021 Jun 18. PMID: 34153468; Hagiya H, Kimura K, Nishi I, Yamamoto N, Yoshida H, Akeda Y, Tomono K. Desulfovibrio desulfuricans bacteremia: A case report and literature review. Anaerobe. 2018 Feb;49:112-115. doi: 10.1016/j.anaerobe.2017.12.013. Epub 2018 Jan 4. PMID: 29305996; Carli T, Diker KS, Eyigor A. Sulphate-reducing bacteria in bovine faeces. Lett Appl Microbiol. 1995 Oct;21(4):228-9. doi: 10.1111/j.l472-765x.l995.tb01047.x. PMID: 7576512; Nasreddine R, Argudin MA, Herpol M, Miendje Deyi VY, Dauby N. First case of Desulfovibrio desulfuricans bacteraemia successfully identified using MALDI-TOF MS. New Microbes New Infect. 2019 Oct 23;32:100614. doi: 10.1016/j.nmni.2019.100614. PMID: 31763046; PMCID: РМС6859274].
СРБ присутствуют в организме бессимптомно и могут быть условно-патогенными микроорганизмами, приводящими к интраабдоминальным инфекциям, бактериемии, а также вызывать обострение воспалительных болезней ЖКТ (болезнь Крона, язвенный колит, сидром разраженного кишечника), психических и когнитивных заболеваний (болезнь Паркинсона, расстройство аутистического спектра (РАС) и т.д.). Согласно модельному эксперименту на грызунах бактерии рода Desulfovibrio могут выступать одним из этиологических факторов развития железодефицитной анемии (ЖДА).
Патогенетические эффекты бактерий рода Desulfovibrio на данный момент мало изучены. Причинами этого, в том числе, являются сложности в культивировании и идентификации культур, а также медленная скорость роста, которая осложняет рутинное исследование клинического биоматериала в лабораторной диагностике.
Согласно известным данным для жизнедеятельности бактерий рода Desulfovibrio необходимы 3 группы компонентов: доноры и акцепторы электронов, факторы роста. В группу доноров электронов относятся крахмал, сукцинат натрия, мальтоза, маннитол и ацетат натрия. В группу акцепторов электронов - сульфат марганца, сульфат железа и тиогликонат натрия. Факторами роста считаются кровь (5%), гемин, Tween 80 и витамины В6, В12 и С [Chen YR, Zhou LZ, Fang ST, Long HY, Chen JY, Zhang GX. Isolation of Desulfovibrio spp.from human gut microbiota using a next-generation sequencing directed culture method. Lett Appl Microbiol. 2019 Jun; 68(6):553-561. doi: 10.1111/lam.l3149. Epub 2019 Apr 3. PMID: 30835854; Liu F, Li J, Wu F, Zheng H, Peng Q, Zhou H. Altered composition and function of intestinal microbiota in autism spectrum disorders: a systematic review. Transl Psychiatry. 2019 Jan 29;9(1):43. doi: 10.1038/s41398-019-0389-6. PMID: 30696816; PMCID: РМС6351640].
Известны среды общего назначения, используемые для выращивания СРБ:
Среда Sulphate API Agar w/o Sodium Lactate (API) [https://exodocientifica.com.br/_technical-data/M309.pdf], следующего состава:
где необходимо растворить 25,41 смеси в 1000 мл дистиллированной воды, добавить 4 мл лактата натрия, далее нагреть до полного растворения ингредиентов, не доводя до кипения, среду разлить в пробирки и простерилизовать.
Известна питательная среда для Desulfovibrio с 1% NaCl [Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина Российской академии наук -Обособленное подразделение Федерального государственного бюджетного учреждения науки «Федеральный исследовательский центр «Пущинский научный центр биологических исследований Российской академии наук»; Всероссийская коллекция микроорганизмов -ВКМ; Дополнительная информация; Питательные среды; №54; https://www.vkm.ru/rus/Catalogue.htm; Файл описания Питательных сред], содержащая:
К2НРО4 - 0,01 г;
NaCl - 10,0 г;
MgSO4 - 0,2 г;
лактат Na(40%) - 4,0 мл;
раствор соли Мора - 1,0 мл;
дрожжевой экстракт - 1,0 г;
аскорбиновая кислота - 0,1 г;
агар - 6,0 г;
дистиллированная вода - 1000,0 мл,
где раствор соли Мора содержит:
Fe(NH4)2(SO4)2×6 H2O - 1,0 г
дистиллированная вода - 5,0 мл.
Стерилизуют растворы отдельно автоклавированием при 121°С 15 мин.
Также известна питательная среда для Desulfovibrio с лактатом [Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина Российской академии наук -Обособленное подразделение Федерального государственного бюджетного учреждения науки «Федеральный исследовательский центр «Пущинский научный центр биологических исследований Российской академии наук»; Всероссийская коллекция микроорганизмов ВКМ; Дополнительная информация; Питательные среды; №92; https://www.vkm.ru/rus/Catalogue.htm; Файл описания Питательных сред], содержащая:
Раствор 1:
К2НРО4 - 0,5 г;
NH4C1 - 1,0 г;
СаС12×6Н2О - 0,1 г;
MgSO4×7 Н20 - 2,0 г;
Na2SO4 - 1,0 г;
лактат Na - 5,0 г;
дрожжевой экстракт - 1,0 г;
резазурин - 0,0 1 г;
цистеин - 0.5 г;
дистиллированная вода - 950,0 мл.
Раствор 2:
NaHCO3 - 4,0 г;
дистиллированная вода - 40,0 мл.
Раствор 3:
Na2S×9H2O - 300,0 мг;
дистиллированная вода - 6,0 мл.
Раствор 4:
FeSO4×7H2O 0,4 г;
дистиллированная вода - 10,0 мл.
рН - 6,8
Для приготовления среды все растворы стерилизуют отдельно автоклавированием при 121°С 15 мин. Раствор 1 перед стерилизацией доводят до кипения, продувая газовой смесью из 97% N2 и 3% Н2 и стерилизуют в атмосфере этой газовой смеси. Раствор 3 стерилизуют в атмосфере N2.
Для получения накопительной культуры сульфатредуцирующих бактерий применяют среды Таусона или Постгейта [https://www.bibliotekar.ru/2-7-78-biologiya-pochv/65.htm], имеющие следующий состав:
Среда Таусона (г/л): (NH4)2SO4 - 4,0, К2НРO4 - 0,5, MgSO4X Х7Н2O - 1,0, соль Мора - 0,5, лактат кальция - 5,0. Иногда к среде добавляют дрожжевую воду (1 мл/100 мл среды).
Среда Постгейта (г/л): КН2РO4 - 0,5, NH4C1 - 1,0, CaSO4-2H2O - 1,0, MgSO4-7H2O - 2,0, лактат натрия - 3,5, дрожжевой экстракт - 1,0, FeS04-7H20 - 0,5, тиогликолят натрия-1,0, или аскорбиновая кислота - 1,0.
Приготовление питательных сред ВКМ и среды Постгейта подразумевает отдельное приготовление нескольких растворов среды и последующее их смешивание. Также вышеупомянутые среды отличает общий недостаток, который выражается медленная скорость роста целевой бактерии, что усложняет их применение в рутинной работе.
В виду того, что культивирование микроорганизмов на питательных средах является одним из основных методов изучения бактерий в микробиологии, а существующие длякультивирования бактерий рода Desulfovibrio среды сложны в приготовлении, отмечается острая необходимость в получении питательной среды наименее трудозатратной в приготовлении, содержащей все необходимые компоненты для жизнедеятельности целевых культур и способствующей быстрой детекции целевого микроорганизма в изучаемом биоматериале.
Целью заявляемого решения является получение питательной среды для культивирования сульфатредуцирующих бактерий рода Desulfovibrio spp., обеспечивающей достаточный рост бактерий, имеющихся в биоматериале, способной к их накоплению для последующего высева и возможностью дальнейшего изучения, а также в разработке наименее трудодо- и ресурснозатратного способа приготовления такой среды.
Поставленная задача достигается за счет качественного состава и соотношения компонентов питательной среды, указанных в Таблице 1.
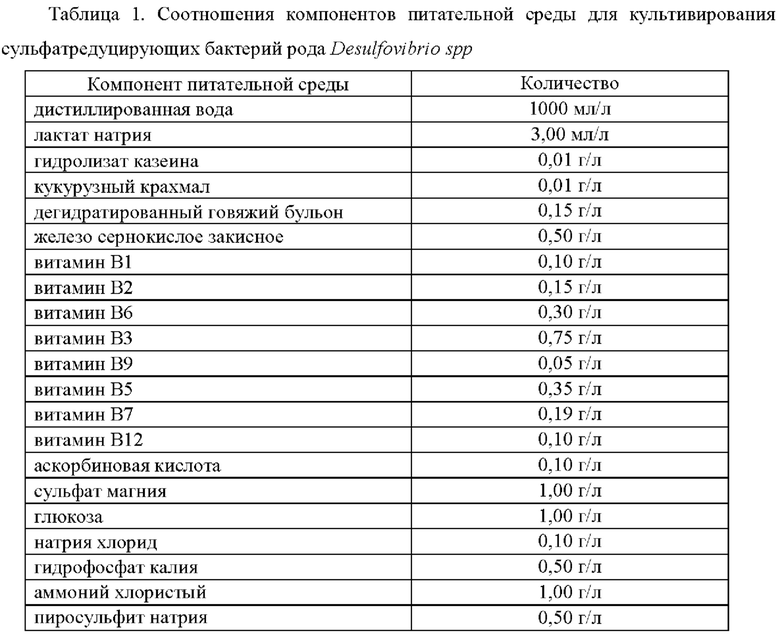
Кроме того, для получения питательной среды для культивирования сульфатредуцирующих бактерий рода Desulfovibrio spp.в твердой фазе (агаровойпитательной среды) к компонентам, указанным в Таблице 1 дополнительно добавляют агар в количестве 9,0 г/л.
Заявляемую питательную среду получают следующим способом. Для приготовления питательной среды делают навеску всех компонентов на аналитических весах согласно Таблице 1. Смешивают следующие компоненты: лактат натрия, гидролизат казеина, кукурузный крахмал, дегидратированный говяжий бульон, витамин В1, витамин В2, витамин В6, витамин В3, витамин В9, витамин В5, витамин В7, витамин В12, сульфат магния, глюкоза, натрия хлорид, гидрофосфат калия, аммоний хлористый, пиросульфит натрия. Для получения агаровой питательной среды к упомянутым компонентам также добавляют агар в количестве 9,0 г/л.
Затем добавляют дистиллированную воду 1000 мл, устанавливают рН 7,3±0,2 посредством добавления 0,1н раствора соляной кислоты или 0,1н раствора гидроксида натрия, и растворяют все компоненты, доводя полученную смесь до кипения. Аскорбиновую кислоту и железо сернокислое закисное добавляют в остывшую смесь и перемешивают. Затем получившийся раствор разливают в стерильные стеклянные бутылки для автоклавирования. Стерилизацию проводят автоклавированием при помощи высокой температуры под давлением 1,0 атм. при температуре 120,6°С в течение 15-30 мин.
Готовая питательная среда имеет желтоватый цвет, прозрачная или слегка опалесцирует.
Готовую питательную среду можно хранить в холодильнике при температуре +4-8°С до 30 дней и использовать по мере необходимости.
Заявляемое решение было получено в ФБУН ЦНИИ Эпидемиологии Роспотребнадзора в рамках выполнения темы НИР «Клинико-патогенетическое обоснование и совершенствование терапевтических программ сохранения и восстановления микробиома человека при широко распространенных инфекционных заболеваний».
Сущность заявляемого решения поясняется следующими примерами:
Пример №1. Подбор состава питательной среды для культивирования сульфатредуцирующих бактерий рода Desulfovibrio spp.
Первоначально в качестве питательных компонентов были использованы гидролизат казеина, крахмал и говяжий бульон, входящие в состав среды для определения чувствительности бактерий к антибиотикам бульона Мюллер-Хинтона.
Учитывая необходимость для роста бактерий рода Desulfovibrio spp.витаминов группы В и ионов железа (II) был подобран состав среды, представленный в Таблице 2. Таблица 2. Состав питательной среды, вариант 1.
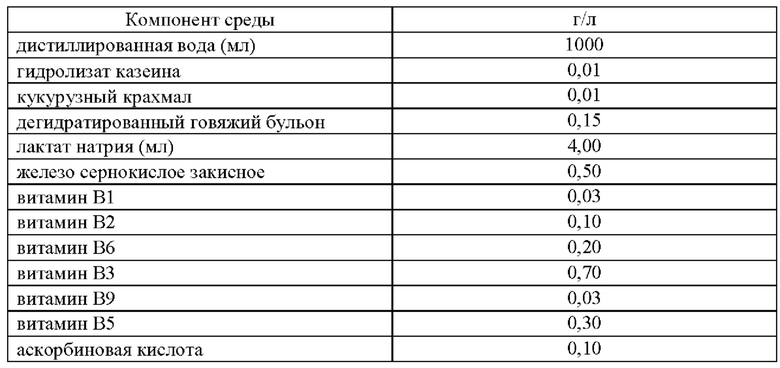
Приготовление питательной среды по варианту 1 включало следующие этапы:
1. Навеску сухих компонентов среды на аналитических весах, смешивание всех компонентов кроме железа сернокислого закисного и аскорбиновой кислоты;
2. Растворение получившейся навески в 500 мл дистиллированной воды комнатной температуры 25°С;
3. После растворения компонентов среды добавляют лактата натрия (4 мл).
4. Соединение полученного раствора с 500 мл дистиллированной воды, предварительно нагретой до 70°С;
5. Приведение рН среды до 7,3±0,2 путем добавления 0,1 н. раствора соляной кислоты или 0,1 н. раствора гидроксида натрия;
6. Доведение до кипения получившейся среды (101°С) и кипячение в течение 1 минуты;
7. Добавление в остывшую до 55°С среду железа сернокислого закисного (0,5 г) и аскорбиновой кислоты (0,1 г);
8. Стерилизацию среды путем автоклавирования под давлением 1,0 атм. (120,6°С) в течение 15-30 мин.
Для определения ростовых свойств среды использовали приготовленную среду комнатной температуры (25°С), разлитую в пробирки по 4 мл. Ростовые свойства среды проверяли при помощи посева 100 мкл коллекционной культуры Desulfovibrio desulfuricans VKM В-1799 т плотностью 1 стандарт мутности по МакФарланду.
Культуру выращивали в анаэробных условиях при 37°С. После 14 дней роста помутнения или почернения среды не наблюдалось.
В связи с неэффективностью питательной среды по варианту 1 был предложен состав среды с добавлением глюкозы в качестве донора электронов и компонентов среды прототипа - хлорида натрия, сульфата магния и гидрофосфата калия (Таблица 3).
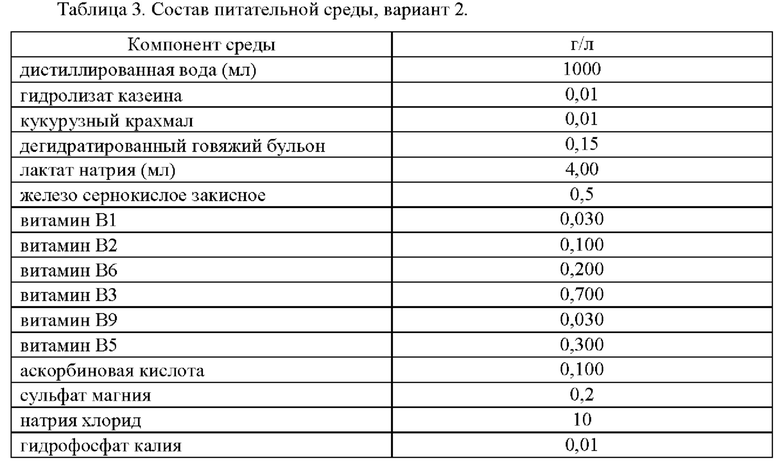
Приготовление питательной среды было аналогичным приготовлению среды варианта 1. Определение ростовых свойств питательной среды проверяли при помощи посева 100 мкл коллекционной культуры Desulfovibrio desulfuricans VKM В-1799т плотностью 1 стандарт мутности по МакФарланду.
Культуру выращивали в анаэробных условиях при 37°С. После 14 дней роста помутнения или почернения среды не наблюдалось.
В связи с неэффективностью питательной среды по варианту 2 был предложен состав по варианту 3, включающий увеличенное количество витаминов группы В и добавлением витаминов В7 и В12 (таблица 4).
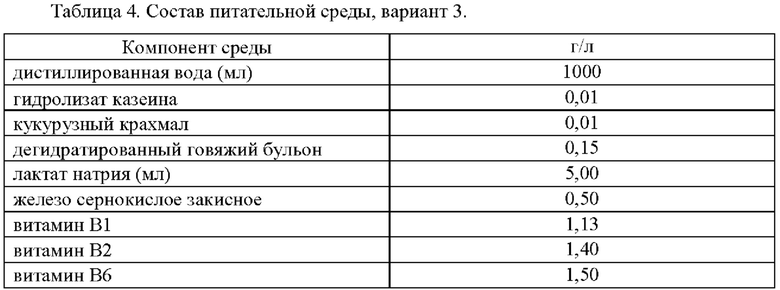
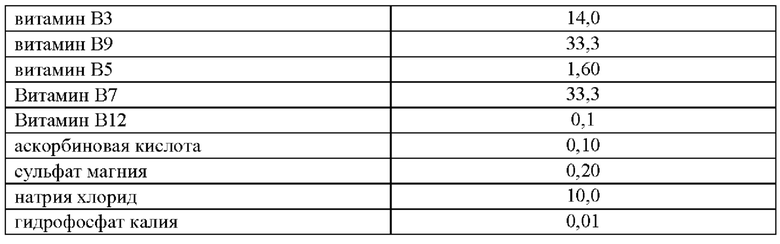
Приготовление питательной среды было аналогичным приготовлению среды варианта 1. Определение ростовых свойств среды проверяли при помощи посева 100 мкл коллекционной культуры Desulfovibrio desulfuricans VKM В-1799 т плотностью 1 стандарт мутности по МакФарланду.
Культуру выращивали в анаэробных условиях при 37°С. После 14 дней роста помутнения или почернения среды не наблюдалось.
Для культивирования прихотливых микроорганизмов в качестве органического фактора роста в состав среды варианта 4 был добавлен витамин К (таблица 5).
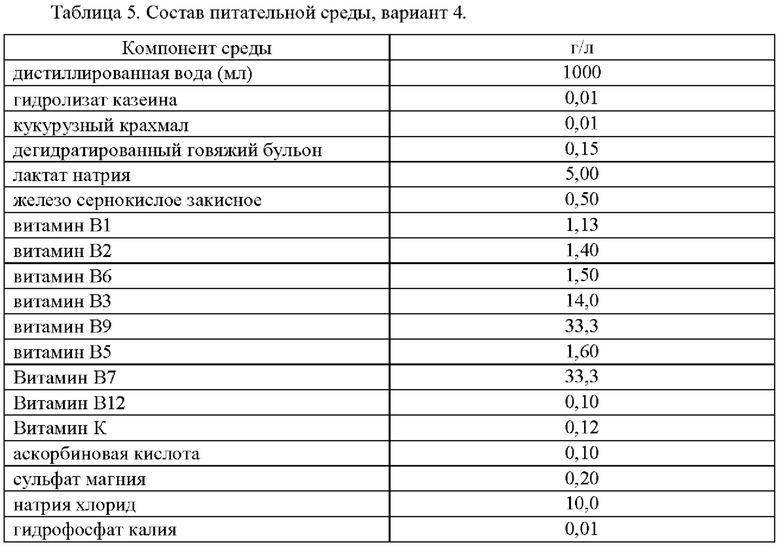
Приготовление питательной среды было аналогичным приготовлению среды по варианту 1. Определение ростовых свойств среды проверяли при помощи посева 100 мклколлекционной культуры Desulfovibrio desulfuricans VKM В-1799 т плотностью 1 стандарт мутности по МакФарланду.
Культуру выращивали в анаэробных условиях при 37°С. После 14 дней роста помутнения или почернения среды не наблюдалось.
В связи с тем, что разрабатываемые среды вариантов 1-4 включали все компоненты необходимые для роста культур Desulfovibrio spp.и учитывая задержку роста бактерий при избытке витаминов был предложен состав среды, содержащий меньшее количество витаминов группы В и лактата. Кроме того, предложенная среда в качестве неорганических факторов роста содержала ионы железа (II) и магния; в качестве органических факторов роста витамины группы В. В качестве доноров электронов выступали лактат и глюкоза; в качестве восстановителей - аскорбиновая кислота, сульфит натрия и ионы железа (II). Состав и количественные показатели компонентов полученной питательной среды представлены в Таблице 1. Питательную среду приготовили согласно заявляемому способу.
В полученной питательной среде культуру выращивали в анаэробных условиях при 37°С. После 3 дней роста наблюдалось почернение среды. Идентификация выросшей культуры показала наличие изогнутых и спиральных грамотрицательных бактерий в мазке, а также красную флуоресценцию при изменении рН среды на щелочную. Полученные результаты позволили идентифицировать культуру как Desulfovibrio spp.
Пример 2. Получение питательной среды для культивирования сульфатредуцирующих бактерий рода Desulfovibrio spp.в жидкой фазе.
Для приготовления заявляемой питательной среды на аналитических весах произвели навеску сухих компонентов в количестве, указанном в Таблице 1.
После чего смешали лактат натрия, гидролизат казеина, кукурузный крахмал, дегидратированный говяжий бульон, витамин В1, витамин В2, витамин В6, витамин В3, витамин В9, витамин В5, витамин В7, витамин В12, сульфат магния, глюкозу, натрия хлорид, гидрофосфат калия, аммоний хлористый, пиросульфит натрия. Затем добавили дистиллированную воду 1000 мл, установили рН 7,3 посредством добавления 0,1н раствора соляной кислоты.
Компоненты полученной смеси растворили, доведя ее до кипения, после чего в остывшую смесь добавили аскорбиновую кислоту, железо сернокислое закисное и перемешали.
Затем получившийся раствор разлили в стерильные стеклянные бутылки для стерилизации и провели автоклавирование под давлением 1,0 атм. при температуре 120,6°С в течение 15 мин. Полученная указанным способом питательная среда прозрачная, имелажелтоватый цвет. Готовая питательная среда хранилась в холодильнике при температуре +4-8°С 30 дней и использовалась по мере необходимости.
Пример 3. Получение питательной среды для культивирования сульфатредуцирующих бактерий рода Desulfovibrio spp.в твердой фазе (агаровой питательной среды).
Для приготовления заявляемой питательной среды на аналитических весах произвели навеску сухих компонентов в количестве, указанном в Таблице 1.
После чего смешали лактат натрия, гидролизат казеина, кукурузный крахмал, дегидратированный говяжий бульон, витамин В1, витамин В2, витамин В6, витамин В3, витамин В9, витамин В5, витамин В7, витамин В12, сульфат магния, глюкозу, натрия хлорид, гидрофосфат калия, аммоний хлористый, пиросульфит натрия. К полученной смеси добавили агар - 9,0 г/л. Затем добавили дистиллированную воду 1000 мл, установили рН 7,4 посредством добавления 0,1 н. раствора гидроксида натрия.
Компоненты полученной смеси растворили, доведя ее до кипения, после чего в остывшую среду добавили аскорбиновую кислоту и железо сернокислое закисное и перемешали.
Затем получившийся раствор разлили в стерильные стеклянные бутылки для стерилизации и провели автоклавирование под давлением 1,0 атм. при температуре 120,6°С в течение 30 мин. Полученная указанным способом питательная среда имела желтоватый цвет, слегка опалесцировала, Готовая питательная среда хранилась в холодильнике при температуре +4-8°С в течение 30 дней и использовалась по мере необходимости.
Пример 4. Оценка роста целевой бактерии питательной среде для культивирования сульфатредуцирующих бактерий рода Desulfovibrio spp.
Ростовые свойства питательной среды для культивирования сульфатредуцирующих бактерий рода Desulfovibrio spp, приготовленной согласно заявляемому способу, выявляли на коллекционном штамме, в качестве которого был использован типовой штамм рода Desulfovibrio sp.из Всероссийской коллекции микроорганизмов (Пущино): Desulfovibrio desulfuricans sp.desulfuricans VKM В-1799 т.
Заявляемую питательную среду, полученную способами, описанными в примерах 2 и 3 засевали коллекционным штаммом Desulfovibrio desulfuricans VKM В-1799 т, создавали анаэробные условия при помощи анаэростата, пакетов типа Газпак производства фирмы «Oxoid» (Thermo Fisher Scientific, США) и ставили в термостат при 37°С (СО2 6%). Рост бактерий рода Desulfovibrio sp., находящихся в исследуемом материале, получили уже через 48-72 часа роста.
Рост культуры оценивали по почернению среды - черному осадку или росту колоний в толще агара. Идентификацию бактерий проводили следующими способами:
- просвечивали образцы при УФ, доводя рН среды до щелочной или кислотной;
- готовили мазки и окрашивали по Граму с последующим использованием метода световой микроскопии.
Полученные результаты позволили идентифицировать культуру как Desulfovibrio spp.
Таким образом заявленная питательная среда, полученная согласно предлагаемому способу, обеспечивает быстрый и достаточный для культивирования рост сульфатредуцирующих бактерий рода Desulfovibrio spp., а также обладает способностью их накопления для последующего изучения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ диагностики Desulfovibrio spp. при нарушениях микробиоценоза желудочно-кишечного тракта | 2023 |
|
RU2821995C1 |
| Способ определения показателя антибиотикорезистентности бактерий рода Desulfovibrio spp. | 2023 |
|
RU2821994C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИДКИХ УГЛЕВОДОРОДОВ | 1991 |
|
RU2027760C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОВЕЛЛИТА С ИСПОЛЬЗОВАНИЕМ СУЛЬФАТРЕДУЦИРУЮЩИХ БАКТЕРИЙ, УСТОЙЧИВЫХ К МЕДИ | 2010 |
|
RU2426783C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФИДОВ КОБАЛЬТА С ИСПОЛЬЗОВАНИЕМ ШТАММА БАКТЕРИИ DESULFOVIBRIO SP. | 2016 |
|
RU2637389C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХАЛЬКОПИРИТА С ИСПОЛЬЗОВАНИЕМ АЦИДОТОЛЕРАНТНЫХ СУЛЬФАТРЕДУЦИРУЮЩИХ БАКТЕРИЙ, УСТОЙЧИВЫХ К МЕДИ | 2012 |
|
RU2482062C1 |
| ШТАММ БАКТЕРИЙ DESULFOVIBRIO SP. VK-9 ДЛЯ ОЧИСТКИ КИСЛЫХ СТОЧНЫХ ВОД ОТ ИОНОВ ТЯЖЕЛЫХ МЕТАЛЛОВ | 2015 |
|
RU2603249C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИЛЛЕРИТА С ИСПОЛЬЗОВАНИЕМ СУЛЬФАТРЕДУЦИРУЮЩИХ БАКТЕРИЙ | 2012 |
|
RU2528777C2 |
| АЦИДОФИЛЬНЫЙ ШТАММ DESULFOSPOROSINUS SP. ДЛЯ ОЧИСТКИ ЗАГРЯЗНЕННЫХ ЭКОСИСТЕМ С ЭКСТРЕМАЛЬНО КИСЛЫМИ ЗНАЧЕНИЯМИ ОТ ИОНОВ ТЯЖЕЛЫХ МЕТАЛЛОВ | 2015 |
|
RU2603277C1 |
| ШТАММ БАКТЕРИЙ DESULFOVIBRIO DESULFURICANS, ИСПОЛЬЗУЕМЫЙ ДЛЯ ОЧИСТКИ ПРОМЫШЛЕННЫХ СТОЧНЫХ ВОД ОТ ИОНОВ ТЯЖЕЛЫХ МЕТАЛЛОВ | 1991 |
|
RU2017814C1 |
Изобретение относится к области микробиологии и может быть использовано в целях питательных сред для обогащения и ускоренного культивирования сульфатредуцирующих бактерий рода Desulfovibrio spp. Раскрывается качественный и количественный состав питательной среды для культивирования сульфатредуцирующих бактерий рода Desulfovibrio spp., а также способ ее получения. Технический результат обеспечивает достаточный рост бактерий, имеющихся в биоматериале, их накопление для последующего высева с возможностью дальнейшего изучения. 2 н. и 3 з.п. ф-лы, 5 табл., 4 пр.
1. Питательная среда для культивирования сульфатредуцирующих бактерий рода Desulfovibrio spp., содержащая дистиллированную воду, лактат натрия, гидролизат казеина, кукурузный крахмал, дегидратированный говяжий бульон, железо сернокислое закисное, витамин В1, витамин В2, витамин В6, витамин В3, витамин В9, витамин В5, витамин В7, витамин В12, аскорбиновую кислоту, сульфат магния, глюкозу, натрия хлорид, гидрофосфат калия, аммоний хлористый, пиросульфит натрия, при следующем содержании компонентов:
2. Питательная среда для культивирования сульфатредуцирующих бактерий рода Desulfovibrio spp. по п.1, отличающаяся тем, что дополнительно содержит агар - 9,0 г/л.
3. Питательная среда для культивирования сульфатредуцирующих бактерий рода Desulfovibrio spp. по пп.1 и 2, отличающаяся тем, что дополнительно содержит 0,1 н. раствора соляной кислоты либо 0,1 н. раствора гидроксида натрия до установления рН 7,3±0,2.
4. Способ получения питательной среды для культивирования сульфатредуцирующих бактерий рода Desulfovibrio spp. по п.1, включающий последовательное проведение следующих стадий:
(i) смешивание лактата натрия - 3,00 мл/л; гидролизата казеина - 0,01 г/л; кукурузного крахмала - 0,01 г/л; дегидратированного говяжьего бульона - 0,15 г/л; витамина В1 - 0,10 г/л; витамина В2 - 0,15 г/л; витамина В6 - 0,30 г/л; витамина В3 - 0,75 г/л; витамина В9 - 0,05 г/л; витамина В5 - 0,35 г/л; витамина В7 - 0,19 г/л; витамина В12 - 0,10 г/л; сульфата магния - 1,00 г/л; глюкозы - 1,00 г/л; натрия хлорида - 0,10 г/л; гидрофосфата калия - 0,50 г/л; аммония хлористого - 1,00 г/л; пиросульфита натрия - 0,50 г/л;
(ii) доведение общего объема полученной на стадии (i) смеси до 1000 мл путем добавления дистиллированной воды;
(iii) установление рН 7,3±0,2 посредством добавления в смесь, полученную на стадии (ii), 0,1 н. раствора соляной кислоты либо 0,1 н. раствора гидроксида натрия;
(iv) растворение компонентов полученной на стадии (iii) смеси посредством доведения ее до кипения;
(v) смешивание остывшей смеси, полученной на стадии (iv), с аскорбиновой кислотой - 0,10 г/л и железом сернокислым закисным - 0,50 г/л;
(vi) стерилизация полученной на стадии (v) смеси в стеклянных стерилизованных бутылках путем автоклавирования под давлением 1,0 атм. при температуре 120,6°С в течение 15-30 мин.
5. Способ получения питательной среды для культивирования сульфатредуцирующих бактерий рода Desulfovibrio spp. по п.4, отличающийся тем, что на стадии (i) добавляют агар - 9,0 г/л.
| СОРОКИНА О.Н | |||
| и др | |||
| Оптимизация состава питательных сред для культивирования сульфатредуцирующих бактерий, Современные научные исследования и разработки, 2018, N1 (18), с | |||
| Способ отковки в штампах заготовок для спиральных сверл | 1921 |
|
SU367A1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ СУЛЬФАТРЕДУЦИРУЮЩИХ БАКТЕРИЙ | 1991 |
|
RU2022010C1 |
| CHEN YR, et al., Isolation of Desulfovibrio spp.from human gut microbiota using a next-generation sequencing directed culture method | |||
| Lett | |||
Авторы
Даты
2024-06-07—Публикация
2023-12-25—Подача