Область техники
Настоящее изобретение относится к области медицины, в частности к культуральной среде и способу культивирования, для культивирования или размножения первичных эпителиальных клеток молочной железы in vitro, и также к применению культивированных клеток при оценке эффективности лекарственного средства и скрининге лекарственного средства.
Уровень техники
Рак молочной железы представляет собой одну из основных злокачественных опухолей, затрагивающих здоровье женщин. Новейшие статистические результаты показывают, что рак молочной железы занимает первое и второе места в мире по показателям частоты встречаемости и смертности от злокачественных новообразований у женщин, соответственно. Несмотря на значительный прогресс в исследованиях молекулярного типирования и патогенеза рака молочной железы, за последние годы, в текущем стандарте медикаментозного лечения рака молочной железы по-прежнему преобладают гормоны и цитотоксические лекарственные средства, не предусматривающие индивидуализированной точного ведения медикаментозного лечения. Из-за разнообразия и сложности классификации рака молочной железы и его высокой гетерогенности трудно по существу предсказать эффективность клинических лекарственных средств на основе только молекулярной или генетической диагностики без функционального тестирования. (Adam A. Friedman et al., Nat Rev Cancer, 15(12): 747-56, 2015).
Функциональное тестирование относится к способу определения чувствительности противоопухолевых лекарственных средств in vitro на клетках пациентов с раком. Ключевым моментом для применения этого подхода является разработка клеточных моделей опухолей, которые имеют короткий цикл роста и могут представлять биологические характеристики пациентов с раком молочной железы. Кроме того, клеточные модели должны быть простыми в обращении, чтобы быстро и эффективно предсказывать эффективность клинических лекарств, и, таким образом, своевременно обеспечивать точное ведение медикаментозного лечения для пациентов с раком. Однако обычно низкая успешность при разработке клеточных моделей in vitro из первичных опухолевых клеток пациентов с раком, длительные циклы роста и такие проблемы, как избыточная пролиферация мезенхимальных клеток (таких как фибробласты и т.п.), ограничивают развитие в этой области. В настоящее время существует две методики культивирования первичных эпителиальных/стволовых клеток, относительно отработанных в отношении функционального тестирования опухолевых клеток. Одной из них является применение облученных фидерных клеток и ингибитора киназы ROCK Y27632 для стимуляции роста первичных эпителиальных клеток для исследования чувствительности к лекарственным средствам у индивидуальных пациентов, то есть технология кондиционируемого перепрограммирования клеток. (Liu et al., Am J Pathol, 180: 599-607, 2012). Другая методика представляет собой культивирование взрослых стволовых клеток в трехмерном пространстве in vitro с получением органоидов, аналогичных тканям и органам. (Hans Clevers et al., Cell, 11; 172(1-2): 373-386, 2018).
Однако обе методики имеют определенные ограничения. Перепрограммирование клеток представляет собой методику, в которой аутологичные первичные эпителиальные клетки пациента культивируют совместно с фидерными клетками, происходящими из мышей; однако присутствие указанных происходящих из мышей клеток может влиять на результаты теста на чувствительность к лекарственным средствам аутологичных первичных клеток пациента во время тестирования на чувствительность к лекарственным средствам первичных клеток пациента; с другой стороны, если устранить фидерные клетки, происходящие из мышей, аутологичные первичные клетки пациента могут быть извлечены из перепрограммирующего окружения, и скорость пролиферации клеток и внутриклеточный сигнальный путь могут быть значительно изменены (Liu et al., Am J Pathol, 183(6): 1862-1870, 2013; Liu et al., Cell Death Dis., 9(7): 750, 2018), что ведет к значительному влиянию на ответ аутологичных первичных клеток пациента на лекарственное средство. Технология органоидов представляет собой технологию внедрения аутологичных первичных эпителиальных клеток пациента во внеклеточный матрикс для трехмерного культивирования in vitro, которая не требует фидерных клеток, и, следовательно, отсутствует проблема помех от фидерных клеток, происходящих из мышей. Однако среда для технологии органоидов требует добавления ряда специфических факторов роста, что затратно и не подходит для широкого клинического применения. Кроме того, органоид должен быть внедрен в гель внеклеточного матрикса в течение всего процесса культивирования, и этапы посева, включающие инокуляцию клеток и пересев (пассирование), и тестирование на чувствительность к лекарственным средствам громоздки и времязатратны по сравнению с операциями двухмерного культивирования. Кроме того, размер органоида, формируемого по этой технологии, трудно контролировать, и некоторые органоиды могут достигать слишком больших размеров и вызывать внутренний некроз. Соответственно, технология органоидов имеет меньшую функциональность и применимость, чем технология двухмерного культивирования. Для работы с этой технологией требуется квалифицированный технический персонал, поэтому она не подходит для масштабного и широкого клинического применения для тестирования чувствительности к лекарственным средствам in vitro (Nick Barker, Nat Cell Biol, 18(3): 246-54, 2016).
Учитывая ограничения вышеперечисленных технологий, необходимо разработать технологию культивирования первичных эпителиальных клеток молочной железы в клинических условиях, которая может обеспечить короткий период культивирования, контролируемую стоимость, удобство работы без помех от экзогенных клеток. При применении этой технологии для создания клеточной модели первичной опухоли молочной железы культивированные клетки опухоли молочной железы могут представлять биологические характеристики пациентов с раком молочной железы. Путем in vitro оценки чувствительности к противоопухолевым лекарственным средствам на клеточных моделях, происходящих из индивидуальных пациентов с раком, можно улучшить показатель ответа на противоопухолевое лекарственное средство при клиническом применении, а также сократить отрицательные последствия, вызванные применением неподходящих для пациентов лекарственных средств, и потерю медицинских ресурсов.
Краткое описание изобретения
Принимая во внимание недостатки предшествующего уровня техники, настоящее изобретение направлено на обеспечение среды для первичных эпителиальных клеток молочной железы для культивирования первичных эпителиальных клеток молочной железы, и способа культивирования первичных эпителиальных клеток молочной железы с применением указанной среды для культивирования. Среда для культивирования первичных эпителиальных клеток молочной железы и способ культивирования по настоящему изобретению могут обеспечить достижение цели, заключающейся в коротком периоде культивирования in vitro, контролируемой стоимости, удобстве работы без помех от экзогенных клеток. Применение этой технологии для создания клеточной модели первичной опухоли молочной железы позволяет получать первичные клетки опухоли молочной железы с биологическими характеристиками пациентов с раком молочной железы, которые можно применять при скрининге новых лекарственных средств и в тесте на чувствительность к лекарственным средствам in vitro.
В одном аспекте настоящее изобретение обеспечивает культуральную среду для первичных клеток для культивирования первичных эпителиальных клеток молочной железы, содержащую амфирегулин, причем содержание амфирегулина составляет 10 нг/мл или более, и, с точки зрения стоимости, предпочтительно от 10 нг/мл до 100 нг/мл.
Культуральная среда для первичных клеток согласно настоящему изобретению предпочтительно дополнительно содержит один или более, или все из следующего: эпидермальный фактор роста (EGF), инсулин, В27, ингибитор киназы ROCK Y27632, нейрегулин 1, фактор роста фибробластов 7 (FGF7), ингибитор рецептора TGFβ типа I А8301 и ингибитор Р38/МАРК SB202190. Предпочтительно содержание EGF составляет 2,5 нг/мл - 20 нг/мл; содержание инсулина составляет 1 мкг/мл - 10 мкг/мл; В27 размеден до конечной концентрации 1:25 - 1:100; содержание Y27632 составляет 5 мкМ - 15 мкМ; содержание нейрегулина 1 составляет 5 нМ - 20 нМ; содержание FGF7 составляет 2,5 нг/мл - 20 нг/мл; содержание А8301 составляет 100 нМ - 500 нМ; содержание SB202190 составляет 100 нМ - 500 нМ.
По сравнению со средой для кондиционируемого перепрограммирования клеток и средой для органоидов из эпителиальных клеток молочной железы, в состав указанной среды добавлен амфирегулин, но она не содержит неопределенных компонентов, таких как сыворотка, экстракт бычьего гипофиза или т.п., нишевых факторов, необходимых для культивирования органоидов, таких как агонисты Wnt, белки семейства R-спондинов, ингибиторы BMP или т.п., а также не содержит фактора роста фибробластов 10 (FGF10), никотинамида и N-ацетилцистеина, что значительно снижает стоимость среды, упрощает рабочий процесс приготовления среды и обеспечивает осуществление in vitro культивирования первичных эпителиальных клеток молочной железы при контролируемой стоимости и удобстве работы.
Согласно настоящему изобретению первичные эпителиальные клетки молочной железы могут быть выбраны из опухолевых клеток молочной железы, нормальных эпителиальных клеток молочной железы и стволовых эпителиальных клеток молочной железы.
В одном аспекте настоящее изобретение обеспечивает способ культивирования первичных эпителиальных клеток молочной железы, включающий следующие этапы:
(1) Приготовление культуральной среды для первичных клеток согласно настоящему изобретению в соответствии с вышеописанной композицией.
(2) Нанесение на культуральный сосуд разбавителя геля внеклеточного матрикса.
при этом в качестве геля внеклеточного матрикса может применяться гель внеклеточного матрикса, относящийся к типу с низкими концентрациями фактора роста, например, могут применяться коммерческий матригель (Matrigel, Corning: 354230) или ВМЕ (Trevigen: 3533-010-02). Более конкретно, гель внеклеточного матрикса разводят не содержащей сыворотки средой, которая может представлять собой среду для первичных клеток согласно настоящему изобретению или DMEM/F12 (Corning: R10-092-CV). Степень разведения геля внеклеточного матрикса составляет 1:50-400, предпочтительно 1:100-200. Способ нанесения покрытия включает добавление разведенного геля внеклеточного матрикса в культуральный сосуд таким образом, чтобы полностью покрыть дно культурального сосуда, и выстаивание в течение 30 минут или более, предпочтительно выстаивание и покрытие при 37°С в течение 30-60 минут. После завершения нанесения покрытия избыток разбавителя геля внеклеточного матрикса убирают, и культуральный сосуд готов для дальнейшего использования.
(3) Выделение первичных эпителиальных клеток молочной железы из ткани молочной железы. Первичные эпителиальные клетки молочной железы могут быть получены, например, из образцов раковой ткани молочной железы и образцов парараковой ткани молочной железы. Например, образцы раковой ткани молочной железы получают из раковой ткани информированного и давшего свое согласие пациента с опухолью молочной железы путем хирургической резекции, и образцы парараковой ткани собирают из ткани молочной железы, расположенной на расстоянии по меньшей мере 5 см от раковой ткани молочной железы. Сбор вышеупомянутых образцов ткани осуществляют в течение получаса после хирургического удаления или биопсии. Более конкретно, в стерильном окружении вырезают образец ткани из не затронутых некрозом участков, в объеме более 0,5 см3, после чего образец ткани помещают в объем 10-50 мл предварительно охлажденной среды DMEM/F12, который заключен в пластиковую стерильную центрифужную пробирку с крышкой, и транспортируют в лабораторию на льду. При этом среда DMEM/F12 содержит 50-200 Ед/мл (например 100 Ед/мл) пенициллина и 50-200 Ед/мл (например 100 Ед/мл) стрептомицина (здесь и далее в настоящем документе называется жидкостью для транспортировки).
В боксе биологической безопасности образец ткани переносят в чашку для культивирования клеток, которую затем промывают жидкостью для транспортировки, клетки крови на поверхности образца ткани смывают, и ненужные ткани, такие как кожа и соединительнотканные оболочки на поверхности образца ткани, удаляют.
Промытый образец ткани переносят в другую новую чашку для культивирования, добавляя 5-25 мл жидкости для транспортировки, и образец ткани разделяют на фрагменты ткани диаметром менее 1 мм3 с помощью стерильного лезвия скальпеля и щипцов.
Фрагменты образца ткани переносят в центрифужную пробирку, которую центрифугируют при 1000 об/мин или более в течение 3-10 минут на настольной центрифуге; после аккуратного извлечения пипеткой супернатанта из центрифужной пробирки содержимое ресуспендируют, используя 5-25 мл не содержащей сыворотки среды DMEM/F12, содержащей коллагеназу II (0,5-5 мг/мл, например, 1 мг/мл) и коллагеназу IV (0,5-5 мг/мл, например, 1 мг/мл), и разделяют встряхиванием на качалке при постоянной температуре 37°С в течение по меньшей мере 1 часа (продолжительность разделения зависит от размера образца; если масса образца больше 1 г, продолжительность разделения увеличивают до 1,5-2 часов), затем его центрифугируют при 300 g/мин или более в течение 3-10 минут на настольной центрифуге; после удаления супернатанта разделенные клетки ткани ресуспендируют в 5-25 мл среды DMEM/F12, содержащей, например, 10% фетальной бычьей сыворотки, и затем измельчают и просеивают через клеточное сито с размером отверстий, например, 100 мкм, и просеянную суспензию клеток собирают в центрифужные пробирки; клетки подсчитывают с помощью гемоцитометра.
Затем суспензию клеток центрифугируют при 300 g/мин или более в течение 3-10 минут в центрифуге; после утилизации супернатанта клетки ресуспендируют в культуральной среде для первичных клеток согласно настоящему изобретению.
(4) Инокуляция первичных эпителиальных клеток молочной железы, выделенных на этапе (3), в культуральном сосуде с покрытием.
Более конкретно, первичные опухолевые клетки молочной железы инокулируют при плотности, составляющей от 1 × 103 до 1 × 105 клеток/мл (например, 1 × 104 клеток/мл) в культуральных флаконах Т12.5; добавляют 1-10 мл культуральной среды для первичных эпителиальных клеток, и затем культивируют в инкубаторе для клеток в течение 8-10 дней, например, в условиях 37°С, 5% CO2, либо при нормальной концентрации кислорода (концентрация кислорода 15-20%), либо в условиях гипоксии (концентрация кислорода 0,5-4%); во время культивирования культуральную среду для первичных клеток заменяют на свежую каждые 4 дня; разделение и пересев осуществляют, когда плотность первичных эпителиальных клеток молочной железы достигает уровня, соответствующего покрытию приблизительно 80% - 90% площади дна культурального флакона.
Указанный этап инокуляции не требует применения фидерных клеток, и, в отличие от технологии кондиционируемого перепрограммирования клеток, не включает этапов осуществления культивирования и облучения фидерных клеток. В отличие от технологии органоидов, на указанном этапе не требуется смешивать первичные клетки с гелем матрикса до однородности на льду для получения капель геля и ждать затвердевания капель геля перед добавлением среды. Культуральный сосуд с предварительно нанесенным покрытием может быть непосредственно использован для инокуляции первичных клеток. Кроме того, для нанесения покрытия на культуральные сосуды необходимо лишь незначительное количество разведенного геля внеклеточного матрикса, что обеспечивает экономию дорогостоящего геля внеклеточного матрикса и упрощение этапов осуществления по сравнению с технологией органоидов.
(5) Необязательно после культивирования инокулированных первичных эпителиальных клеток молочной железы в течение 4-10 дней, когда максимальный диаметр сформировавшихся клонов клеток в культуральном флаконе достигает 500 мкм, супернатант утилизируют, и добавляют 1-2 мл 0,05% трипсина (Thermo Fisher: 25300062) для разделения клеток, которые затем инкубируют при комнатной температуре в течение 5-20 мин. Разделенные клетки ресуспендируют в 1-10 мл среды, содержащей, например, 10% (по объему) фетальной бычьей сыворотки, 100 Ед/мл пенициллина и 100 Ед/мл стрептомицина, и центрифугируют при 300 g/мин или более в течение 3-10 минут. Разделенные одиночные клетки ресуспендируют в культуральной среде для первичных клеток согласно настоящему изобретению, и полученную суспензию клеток помещают во флакон для культивирования клеток Т25, покрытый гелем внеклеточного матрикса, для непрерывного культивирования. Покрытие наносят на флакон для культивирования клеток Т25 таким же способом, что и на этапе (2).
Размноженные эпителиальные клетки молочной железы выращивают в двухмерной конфигурации, что позволяет избежать неоднородности размеров органоидов и внутреннего некроза в чрезмерно выросших органоидах, которые могут возникать при размножении по технологии органоидов.
Кроме того, эпителиальные клетки молочной железы, в частности, опухолевые клетки молочной железы, культивированные с применением способа культивирования первичных эпителиальных клеток молочной железы согласно настоящему изобретению, могут применяться для оценки эффективности лекарственных средств и скрининга лекарственных средств, которые включают следующие этапы:
(1) Получение первичных эпителиальных клеток молочной железы, более предпочтительно, получение образцов раковой ткани или биопсия образцов раковой ткани, происходящих из пациентов с раком молочной железы; выделение первичных эпителиальных клеток молочной железы, и культивирование и размножение первичных эпителиальных клеток молочной железы (в частности, первичных опухолевых клеток молочной железы) в соответствии со способом, описанным выше, до получения количества клеток порядка по меньшей мере 105, предпочтительно порядка по меньшей мере 106.
(2) Выбор лекарственного средства для тестирования.
(3) На основании максимальной концентрации в плазме Cmax лекарственного средства в качестве референсной, использование 2-5-кратной Cmax в качестве начальной концентрации и разведение указанного лекарственного средства с получением градиентов различных концентраций лекарственного средства, например, градиентов 5-10 концентраций лекарственного средства, предпочтительно градиентов 6-8 концентраций лекарственного средства.
(4) Разделение эпителия молочной железы, культивированного на этапе (1), с получением суспензии одиночных клеток, подсчет числа клеток с помощью гемоцитометра, разведение суспензии одиночных клеток культуральной средой для первичных клеток согласно настоящему изобретению, содержащей гель внеклеточного матрикса, равномерное распределение разведенной суспензии клеток в многолуночный планшет при плотности, составляющей 1000-10000 клеток на лунку, например, по 50 мкл разведения клеток на лунку, и выдерживание для прикрепления в течение ночи.
Этот этап позволяет избежать проблемы, свойственной методике перепрограммирования клеток, заключающейся в том, что присутствие фидерных клеток может влиять на результат подсчета первичных клеток и последующий анализ жизнеспособности первичных клеток, и устраняет необходимость в трудоемком этапе смешивания, внедрения и последующего высевания суспензии клеток с гелем матрикса на льду, как в методике органоидов, что значительно упрощает рабочий процесс и улучшает функциональность и реализуемость технологии. Поскольку инокулированные клетки представляют собой суспензии отдельных клеток, а не трехмерные структуры, как органоид, указанная методика может обеспечивать более равномерные количества высеваемых клеток и меньшую вариативность количества клеток в лунках по сравнению с методикой органоидов, что делает ее более подходящей для последующих операций высокопроизводительного скрининга лекарственных средств.
(5) Добавление выбранных кандидатных лекарственных средств, таких как традиционные химиотерапевтические лекарственные средства, таргетных лекарственных средств, лекарственных антител или их комбинации в градиентных разведениях к адгезивным клеткам, полученным на этапе (4), с применением высокопроизводительной автоматизированной установки.
(6) Через несколько часов после добавления лекарственного средства, например, 72 часа, детектирование уровня выживаемости эпителиальных клеток молочной железы с применением люминесцентного набора для детекции жизнеспособности клеток Cell-Titer Glo (Promega: G7573) для скрининга активности лекарственного средства.
В частности, в каждую лунку добавляют, например, 50 мкл реагента Cell Titer-Glo (Promega: G7573) и после перемешивания до однородности измеряют интенсивность хемилюминесценции каждой лунки с помощью микропланшетного фоюоресцентного ридера. Отмечая концентрацию лекарственного средства по оси абсцисс, а интенсивность флуоресценции - по оси ординат, применяют программное обеспечение GraphPad Prism 7.0 для построения кривой зависимости эффекта от дозы лекарственного средства на основании измеренных значений, и рассчитывают интенсивность ингибирования лекарственными средствами пролиферации тестируемых клеток.
При применении первичных опухолевых клеток молочной железы согласно настоящему изобретению в скрининге лекарственных средств и тестировании in vitro на чувствительность к лекарственным средствам, поскольку не используется система совместного культивирования клеток, отсутствует явление влияния фидерных клеток на результаты тестирования, как в технологии перепрограммирования клеток. Благодаря двухмерному росту клеток взаимодействие с лекарственным средством также происходит быстрее по сравнению с продолжительностью тестирования лекарственных средств по технологии органоидов (среднее время введения согласно технологии органоидов составляет 6 дней).
Благоприятные эффекты настоящего изобретения также включают:
(1) показатель успешности культивирования первичных эпителиальных клеток молочной железы может быть улучшен, с достижением показателя успешности более 90%;
(2) может быть обеспечено воспроизведение первичными эпителиальными клетками молочной железы, культивированными in vitro, патологического фенотипа и гетерогенности пациента, от которого получены первичные клетки;
(3) культивированные первичные эпителиальные клетки молочной железы представляют собой чистые эпителиальные клетки молочной железы, на которые не влияют мезенхимальные клетки, такие как фибробласты и адипоциты;
(4) в состав среды не входит сыворотка, и соответственно, на нее не оказывает влияния качество и количество сыворотки из разных партий;
(5) эпителиальные клетки молочной железы могут быть размножены с высокой эффективностью, с успешным размножением эпителиальных клеток молочной железы до порядка величины 106 при начальном количестве клеток на уровне 104 в пределах приблизительно двух недель, и размноженные эпителиальные клетки молочной железы обладают способностью к непрерывному пересеву;
(6) нет необходимости в проведении манипуляций на льду и диссоциации геля матрикса на этапе пересева, и разделение и пересев клеток могут быть завершены в течение 10-15 минут;
(7) стоимость культивирования является контролируемой, поскольку среда для первичного рака молочной железы не требует добавления дорогостоящих агонистов Wnt, белков семейства R-спондинов, ингибиторов BMP, FGF10 и т.п. факторов, и, соответственно, имеет место упрощение и улучшение для первичных эпителиальных клеток молочной железы существующей культуральной среды для органоидов; и для инокуляции клеток не требуется применение более высокой концентрации внеклеточного матрикса для смешивания с первичными клетками с получением капель геля, напротив, необходимо только небольшое количество разведенного геля внеклеточного матрикса, что позволяет экономить дорогостоящий внеклеточный матрикс;
(8) удобство операций: по сравнению с технологией кондиционируемого перепрограммирования, указанная технология не требует культивирования или облучения фидерных клеток, что позволяет избежать проблемы, заключающейся в том, что качество и количество фидерных клеток из разных партий может влиять на эффективность культивирования первичных клеток, и объектами высевания и тестирования при скрининге лекарственных средств являются исключительно первичные эпителиальные клетки молочной железы, без помех от фидерных клеток, как в системе совместного культивирования, описанной в технологии кондиционируемого перепрограммирования клеток; по сравнению с технологией органоидов, в способе покрытия гелем внеклеточного матрикса, применяемом в настоящем изобретении, культуральный сосуд может быть подготовлен заранее, не требуется внедрять клетки в гель матрикса согласно технологии органоидов, и этапы осуществления просты и легки в исполнении;
(9) эта технология позволяет культивировать и обеспечивать эпителиальные клетки молочной железы в больших количествах и с высокой однородностью, что подходит для высокопроизводительного скрининга новых кандидатных соединений и высокопроизводительных функциональных тестов на чувствительность к лекарственным средствам in vitro у пациентов.
Применение среды для культивирования клеток согласно этому варианту реализации позволяет культивировать эпителиальные клетки молочной железы, происходящие из организма человека или других млекопитающих, включая опухолевые клетки молочной железы, нормальные эпителиальные клетки молочной железы, эпителиальные стволовые клетки молочной железы или ткани, содержащие по меньшей мере любые из этих клеток..
Кроме того, по меньшей мере из чего-либо одного из указанных клеток и тканей могут быть сформированы органоиды.
Кроме того, клетки, полученные способом культивирования согласно этому варианту реализации, могут применяться в регенеративной медицине, фундаментальных медицинских исследованиях эпителиальных клеток молочной железы, скрининге ответов на лекарственные средства и разработках новых лекарственных средств для заболеваний молочной железы, и т.п.
Краткое описание чертежей
На фиг. 1 представлены фотографии под инвертированным фазово-контрастным микроскопом первичных эпителиальных клеток молочной железы, полученных путем культивирования клеток, выделенных из клинических образцов ткани молочной железы, с применением способа культивирования первичных клеток согласно настоящему изобретению.
На фиг. 2 представлены фотографии под микроскопом клеток, которые получали путем инокуляции и культивирования первичных опухолевых клеток молочной железы, выделенных из двух разных клинических образцов ткани рака молочной железы (HMFL-XN30, HMFL-XN22), в культуральном планшете, либо покрытом гелем внеклеточного матрикса, либо без какого-либо покрытия.
На фиг. 3 представлены графики, иллюстрирующие влияние амфирегулина на пролиферацию первичных опухолевых клеток молочной железы.
На фиг. 4 приведено сравнение кривых клеточного роста, полученных при культивировании клеток, выделенных из двух клинических образцов ткани рака молочной железы (HMFL-XN12, HMFL-XN21) с применением технологии кондиционируемого перепрограммирования клеток, технологии согласно настоящему изобретению и технологии органоидов, соответственно, и представлены фотографии под микроскопом HMFL-XN21, культивированных до дня 27.
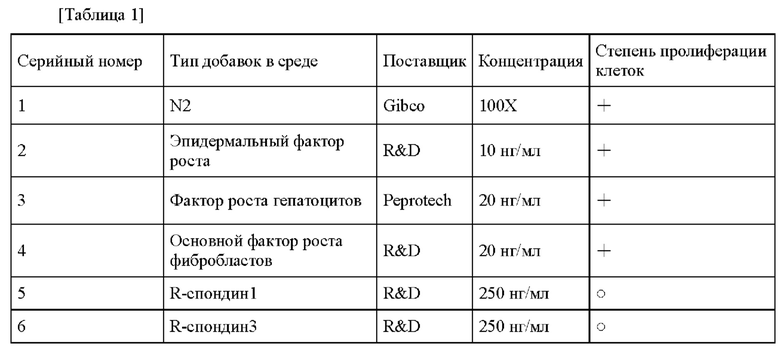
На фиг. 5 представлены фотографии под инвертированным микроскопом опухолевых клеток молочной железы, выделенных из клинического образца ткани рака молочной железы (HMFL-XN12) и культивированных до дня 9 и дня 22 с применением технологии согласно настоящему изобретению.
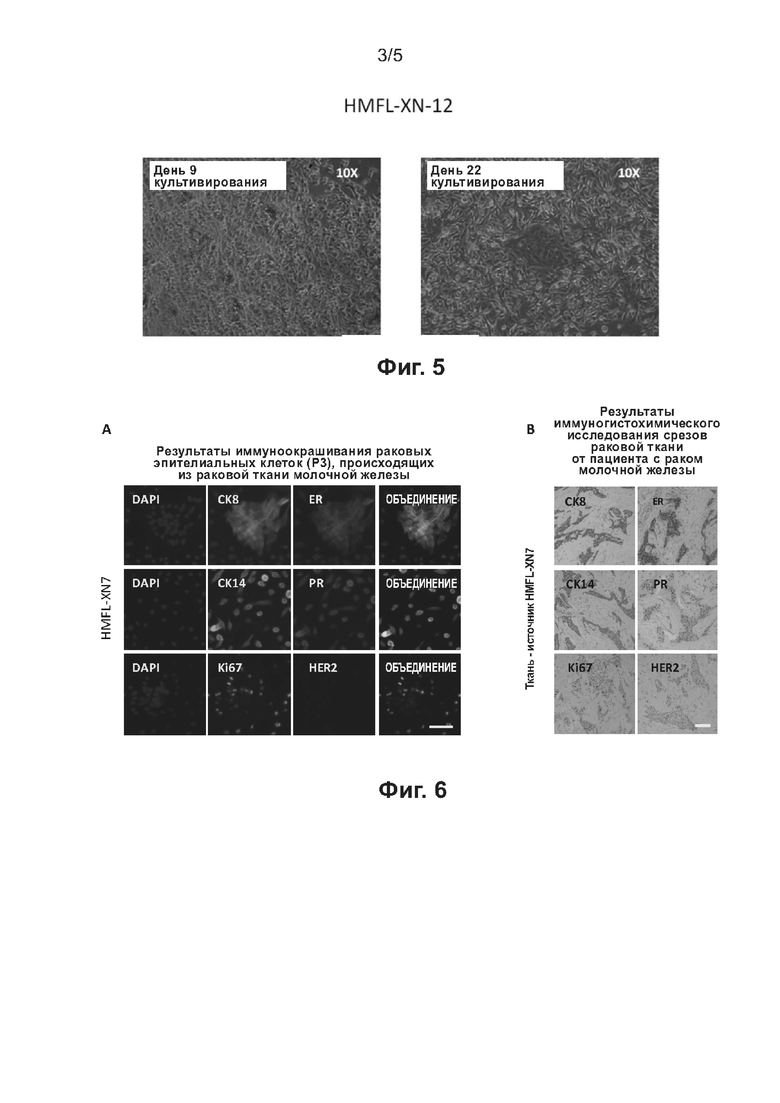
На фиг. 6 приведено сравнение результатов иммунофлуоресцентного окрашивания опухолевых клеток молочной железы, которые были выделены из извлеченного хирургическим путем образца рака молочной железы (HMFL-XN7) и культивированы с применением технологии согласно настоящему изобретению, с результатами иммуногистохимического исследования среза исходной ткани из образца ткани.
На фиг. 7 показан анализ согласованности генных мутаций опухолевых клеток молочной железы из разных пересевов, которые получали путем культивирования клеток, выделенных из извлеченных хирургическим путем образцов двух случаев рака молочной железы с применением технологии согласно настоящему изобретению, и результат кариотипического хромосомного анализа для одного случая.
На фиг. 8 показана туморогенность опухолевых клеток молочной железы у мышей, полученных путем культивирования первичных опухолевых клеток молочной железы, происходящих из раковых тканей, для двух случаев диагностированной патологии у пациентов с тройным негативным раком молочной железы, с применением технологии согласно настоящему изобретению.
На фиг. 9 представлены графики, отражающие кривые зависимости ответа первичных опухолевых клеток молочной железы, культивированных с применением технологии согласно настоящему изобретению, от дозы разных химиотерапевтических лекарственных средств и нацеливаемых лекарственных средств, и рассчитанный показатель полумаксимального ингибирования.
Подробное описание изобретения
[Пример 1]
Выделение первичных эпителиальных клеток молочной железы человека и оптимизация культуральной среды для первичных эпителиальных клеток молочной железы
(1) Выделение первичных эпителиальных клеток молочной железы человека
Образцы раковой ткани молочной железы получали из раковых тканей пяти информированных и давших согласие пациентов с опухолью молочной железы путем хирургической резекции, а именно, HMFL-XN1, HMFL-XN3, HMFL-XN4, HMFL-XN6 и HMFL-XN8. Один из образцов (HMFL-XN1) описан ниже. Вышеупомянутые образцы ткани собирали в течение получаса после хирургического удаления или биопсии. Более конкретно, из не затронутых некрозом участков в стерильном окружении вырезали образцы ткани объемом более 0,5 см3 и помещали в 20 мл предварительно охлажденной среды DMEM/F12 (произведена Corning Inc.). Среду помещали в пластиковую стерильную центрифужную пробирку объемом 50 мл с крышкой и транспортировали в лабораторию на льду; при этом среда DMEM/F12 содержала 100 Ед/мл пенициллина и 100 Ед/мл стрептомицина (здесь и далее в настоящем документе называется жидкостью для транспортировки).
В боксе биологической безопасности переносили образец ткани (HMFL-XN1) в чашку для культивирования клеток размером 100 мм. Образец ткани промывали жидкостью для транспортировки. Клетки крови на поверхности образца ткани смывали. Ненужные ткани, такие как кожа и соединительнотканные оболочки на поверхности образца ткани, удаляли.
Промытый образец ткани переносили в другую новую чашку для культивирования размером 100 мм; добавляли 10 мл жидкости для транспортировки, и использовали стерильное лезвие скальпеля и щипцы для разделения образца ткани на фрагменты ткани диаметром менее 1 мм3.
Фрагменты образца ткани переносили в центрифужную пробирку 50 мл, и центрифугировали при 1200 об/мин в течение 5 минут с применением настольной центрифуги; после аккуратного извлечения пипеткой супернатанта из центрифужной пробирки остаток ресуспендировали в 10 мл не содержащей сыворотки среды DMEM/F12, содержащей коллагеназу II (1 мг/мл) и коллагеназу IV (1 мг/мл). Его помещали на качалку при постоянной температуре 37°С для разделения путем встряхивания в течение 1 часа и затем центрифугировали при 350 g/мин на настольной центрифуге в течение 5 минут. После удаления супернатанта разделенные клетки ткани ресуспендировали в 10 мл среды DMEM/F12, содержащей 10% фетальной бычьей сыворотки, и затем измельчали и просеивали через клеточное сито с размером отверстий 100 мкм, и просеянную суспензию клеток собирали в центрифужную пробирку объемом 50 мл; клетки подсчитывали с помощью гемоцитометра.
Затем суспензию клеток центрифугировали при 350 g/мин в течение 5 минут в центрифуге; после удаления супернатанта, ее ресуспендировали в культуральной среде для первичных клеток согласно настоящему изобретению.
Остальные четыре образца опухолевой ткани молочной железы были выделены таким же образом, как описано выше.
(2) Оптимизация культуральной среды для первичных эпителиальных клеток молочной железы Матритель (Matrigel, зарегистрированный товарный знак) (производства BD Biosciences) разбавляли 1:100 не содержащей сыворотки средой DMEM/F12 с получением разведенного внеклеточного матрикса, который добавляли в 48-луночный культуральный планшет по 200 мкл/лунку, чтобы полностью покрыть дно лунок культурального планшета. Полученный планшет оставляли на 1 час в инкубаторе при 37°С. Через 1 час разведенный внеклеточный матрикс удаляли, получая покрытый матригелем планшет.
Сначала готовили основную среду. В коммерческую среду DMEM/F-12 добавляли GlutaMAX-I (производства Thermo Fisher SCIENTIFIC) в указанной концентрации (разведение 1:100), добавляли инсулин человека (производства Sigma) в конечной концентрации 10 мкг/мл, добавляли ингибитор киназы ROCK Y27632 (производства Sigma) в конечной концентрации 10 мкМ, и добавляли пенициллин-стрептомицин (производства Thermo Fisher SCIENTIFIC) до степени разведения 1:100, с получением основной среды.
Далее, в основную среду добавляли разные типы добавок (как показано в таблице 1) для получения культуральных сред для эпителиальных клеток молочной железы, содержащих разные дополнительные компоненты, и среды с разными компонентами добавляли в объеме 500 мкл/лунку в 48-луночные планшеты, который покрывали гелем внеклеточного матрикса (Matrigel). Опухолевыми клетками молочной железы (HMFL-XN1), выделенными из раковой ткани молочной железы на этапе (1) согласно указанному примеру, инокулировали покрытый матригелем 48-луночный культуральный планшет при плотности клеток 1 × 104 клеток/лунку, и равные количества свежевыделенных опухолевых клеток молочной железы (HMFL-XN1) культивировали в среде с разными составами при 37°С, при 5% концентрации СО2 и 20% концентрации кислорода. Среду обновляли каждые 4 дня после начала культивирования. Через 10 дней культивирования осуществляли подсчет клеток. В качестве экспериментального контроля использовали основную среду без каких-либо добавок. Опухолевые клетки молочной железы, выделенные из оставшихся четырех образцов раковой ткани молочной железы, культивировали и подсчитывали таким же образом, как описано выше. Экспериментальные результаты приведены в таблице 1.

При этом «+» показывает, что, в отличие от основной среды, среда с добавкой (добавками) может стимулировать пролиферацию первичных эпителиальных клеток опухоли молочной железы, выделенных из ткани по меньшей мере трех случаев рака молочной железы; «-» показывает, что среда с добавкой (добавками) оказывает эффект ингибирования пролиферации первичных эпителиальных клеток опухоли молочной железы, выделенных из ткани по меньшей мере двух случаев рака молочной железы; «о» показывает, что среда с указанной добавкой (добавками) не оказывает значимого эффекта на пролиферацию первичных эпителиальных клеток опухоли молочной железы, выделенных из ткани по меньшей мере трех случаев рака молочной железы.
[Пример 2]
Культивирование первичных эпителиальных клеток молочной железы человека
(1) Получение культуральной среды для первичных эпителиальных клеток молочной железы
Сначала получали основную среду таким же образом, как и на этапе (2) в примере 1. В основную среду добавляли амфирегулин человека (производства R&D Systems) в конечной концентрации 20 нг/мл, EGF (производства Peprotech) в конечной концентрации 10 нг/мл, В27 (производства Thermo Fisher SCIENTIFIC) до степени разведения 1:50, нейрегулин 1 человека (производства Peprotech) в конечной концентрации 10 нМ, FGF7 (производства R&D Systems) в конечной концентрации 10 нг/мл, ингибитор TGFβ1 А8301 (производства МСЕ) в конечной концентрации 500 нМ, и ингибитор Р38/МАРК SB202190 (производства МСЕ) в конечной концентрации 500 нМ, с получением культуральной среды для первичных эпителиальных клеток молочной железы.
(2) Культивирование первичных опухолевых клеток молочной железы, происходящих из раковой ткани молочной железы и нормальных эпителиальных клеток молочной железы, происходящих из парараковой ткани.
Эпителиальные клетки молочной железы, происходящие из раковой ткани, и эпителиальные клетки молочной железы, происходящие из парараковой ткани, выделяли, соответственно, из раковой ткани и парараковой ткани молочной железы одного и того же пациента с раком молочной железы, с применением того же способа, что и на этапе (1) в примере 1. Образцы парараковой ткани молочной железы собирали из ткани молочной железы на расстоянии по меньшей мере 5 см от раковой ткани молочной железы. Затем опухолевые клетки молочной железы, происходящие из раковой ткани, подсчитывали с помощью гемоцитометра, и затем инокулировали при плотности, составляющей 4×104 клеток/лунку, 12-луночный планшет, покрытый матригелем (Matrigel, зарегистрированный товарный знак) (производства BD Biosciences). 2 мл подготовленной культуральной среды для первичных эпителиальных клеток молочной железы добавляли в 12-луночный планшет, который культивировали при 37°С в условиях 5% концентрации CO2 и 20% концентрации кислорода.
На фиг. 1(A) приведено микроскопическое изображение (под инвертированным фазово-контрастным микроскопом при увеличении 50х) опухолевых клеток молочной железы (HMFL-XN11), которые были выделены из извлеченного хирургическим путем образца опухоли молочной железы и культивированы до дня 7 после инокуляции. Микроскопическое исследование показывает, что культивированные первичные опухолевые клетки молочной железы, происходящие из раковой ткани, были высокочистыми и не содержали интерстициальных клеток, таких как фибробласты и т.п. На фиг. 1(B) приведено микроскопическое изображение (под инвертированным фазово-контрастным микроскопом при увеличении 50х) первичных нормальных эпителиальных клеток молочной железы (HMFL-XN11-N), которые были выделены из образцов парараковой ткани того же пациента, что и HMFL-XN11, инокулированных в покрытый матригелем 12-луночный планшет при плотности, составляющей 4 × 104 клеток/лунку и культивированных до дня 7 после инокуляции. Фиг. 1(A) и 1(B) показывают, что применение культуральной среды для первичных эпителиальных клеток молочной железы и способ культивирования согласно настоящему изобретению могут обеспечивать эффективное культивирование in vitro как опухолевых клеток молочной железы, происходящих из раковой ткани молочной железы, так и нормальных эпителиальных клеток молочной железы, происходящих из парараковой ткани. Культивированные первичные клетки не содержат интерстициальных клеток, таких как фибробласты и т.п.
На фиг. 1(C) и 1(D) представлено сравнение микроскопических изображений (под инвертированным фазово-контрастным микроскопом при увеличении 100х) первичных опухолевых клеток молочной железы (HMFL-XN15), культивированных до дня 4 после инокуляции и культивированных до 10 дня после инокуляции, соответственно, причем указанные первичные опухолевые клетки молочной железы (HMFL-XN15) были выделены из других извлеченных хирургическим путем образцов раковой ткани молочной железы и инокулированы в покрытый матригелем 12-луночный планшет при плотности, составляющей 4 × 104 клеток/лунку. Фиг. 1(D) показывает, что две разных субпопуляции клеток, которые составляют молочную железу, т.е. люминальные клетки и миоэпителиальные клетки, могут быть культивированы с применением культуральной среды для первичных клеток и способа культивирования согласно настоящему изобретению, и соответственно, обеспечивать культивирование in vitro, которое позволяет сохранять гетерогенность образца опухоли. Путем сравнения фиг. 1(C) и 1(D) можно убедиться, что образцы раковой ткани молочной железы выделяют, инокулируют и культивируют с применением среды и способа культивирования согласно настоящему изобретению, что приводит к получению явных клонов эпителиальных клеток молочной железы на 4 день после инокуляции и культивирования, и экспоненциальному увеличению числа клеток на день 10 культивирования, что указывает на то, что технология настоящего изобретения представляет собой эффективную технологию для размножения эпителиальных клеток молочной железы in vitro.
(3) Культивирование первичных эпителиальных клеток молочной железы при нормальном содержании кислорода и в условиях гипоксии
Первичные опухолевые клетки молочной железы (HMFL-XN30), происходящие из раковой ткани молочной железы, выделяли из раковой ткани пациента с раком молочной железы с применением того же способа, что и на этапе (1) в примере 1. Затем равными количествами первичных опухолевых клеток молочной железы HMFL-XN30 (4×104 клеток/лунку) инокулировали покрытый матригелем (Matrigel, зарегистрированный товарный знак) (производства BD Biosciences) 12-луночный планшет. 2 мл приготовленной культуральной среды для первичных эпителиальных клеток молочной железы добавляли в 12-луночный планшет, и равные количества опухолевых клеток молочной железы культивировали в условиях 20% концентрации кислорода (условиях нормального содержания кислорода) и 2% концентрации кислорода (в условиях гипоксии), соответственно. Микроскопические фотографии (под инвертированным фазово-контрастным микроскопом при увеличении 100х) делали после культивирования до 7 дня. На фиг. 1(E) и 1(F) приведено сравнение клеток, полученных путем культивирования эпителиальных клеток молочной железы, происходящих из раковой ткани, в условиях нормального содержания кислорода и условиях гипоксии, соответственно. Фиг. 1(E) и 1(F) подтверждают, что высокоэффективное культивирование первичных эпителиальных клеток молочной железы, происходящих из раковой ткани, может быть достигнуто как в условиях с нормальным содержанием кислорода (20% концентрации кислорода), так и в условиях гипоксии (2% концентрации кислорода) при применении культуральной среды и способа культивирования согласно настоящему изобретению.
(4) Сравнение результатов культивирования первичных опухолевых клеток молочной железы, происходящих из раковой ткани молочной железы, в условиях с покрытием и без покрытия гелем внеклеточного матрикса
Первичные опухолевые клетки молочной железы (HMFL-XN30, HMFL-XN22), происходящие из раковой ткани, выделяли из раковых тканей двух пациентов с раком молочной железы с применением того же способа, что и на этапе (1) в примере 1. Затем равные количества (4×104 клеток/лунку) первичных опухолевых клеток молочной железы HMFL-XN30 инокулировали в покрытый матригелем (Matrigel, зарегистрированный товарный знак) (производства BD Biosciences) 12-луночный планшет, а также 12-луночный планшет без какой-либо обработки, соответственно. 2 мл подготовленной культуральной среды для первичных эпителиальных клеток молочной железы добавляли в 12-луночные планшеты, и равные количества первичных опухолевых клеток молочной железы культивировали в условиях 20% концентрации кислорода. После культивирования до 10 дня делали фотографии. HMFL-XN22 (Р3) представляли собой опухолевые клетки молочной железы HMFL-XN22, непрерывно культивированные до третьего пересева в условиях с покрытием матригелем и без покрытия матригелем, соответственно, после выделения. Остальные этапы аналогичны этапам для HMFL-XN30.
На фиг. 2 представлены микроскопические изображения происходящих из раковой ткани молочной железы первичных опухолевых клеток молочной железы HMFL-XN30 и HMFL-XN22 (Р3), которые культивировали до 10 дня в условиях с покрытием матригелем и без покрытия матригелем, соответственно. В соответствии с фиг. 2, можно подтвердить, что культуральный планшет, покрытый матригелем, благоприятнее для пролиферации опухолевых клеток молочной железы, чем культуральный планшет без какой-либо обработки.
[Пример 3]
Пролиферативное влияние амфирегулина на первичные опухолевые клетки молочной железы, происходящие из раковой ткани молочной железы
(1) Культуральную среду для первичных эпителиальных клеток молочной железы получали таким же образом, как и на этапе (1) в примере 2. Кроме того, получали другую первичную среду без амфирегулина, удаляя амфирегулин из состава культуральной среды для первичных эпителиальных клеток молочной железы.
(2) Применяя тот же способ, что и на этапе (1) в примере 1, получали первичные опухолевые клетки молочной железы (HMFL-XN2, HMFL-XN12), происходящие из извлеченных хирургическим путем образцов раковой ткани от двух разных пациентов с раком молочной железы, и первичные опухолевые клетки молочной железы (HMFL-XN13), происходящие из образца пункции от пациента с раком молочной железы.
Первичными опухолевыми клетками молочной железы (HMFL-XN2), происходящими из извлеченной хирургическим путем раковой ткани, инокулировали при одинаковой плотности (5×104 клеток/лунку) покрытый матригелем (Matrigel, зарегистрированный товарный знак) (производства BD Biosciences) 12-луночный планшет. Клетки культивировали при 37°С и 20% концентрации кислорода в среде для первичных эпителиальных клеток молочной железы согласно настоящему изобретению, содержащей амфирегулин, и первичной среде без амфирегулина, используя по две лунки-репликата на группу. На фиг. 3(A) представлены микроскопические изображения (под инвертированным фазово-контрастным микроскопом при увеличении 100х) клонов опухолевых клеток, полученных после культивирования до 6 дня в первичной культуральной среде без амфирегулина и с амфирегулином, причем культивированные клетки (HMFL-XN2) были выделены от одного и того же пациента с раком молочной железы пациент и инокулированы в одних и тех же количествах (5×104 клеток/лунку).
На фиг. 3(B) приведены результаты подсчета клеток для трех случаев происходящих из раковой ткани молочной железы опухолевых клеток молочной железы (HMFL-XN2, HMFL-XN-12 и HMFL-XN13) после культивирования до 10 дня в первичной культуральной среде без амфирегулина и с амфирегулином, соответственно, используя по две лунки-репликата на каждую группу. На фиг. 3(B) можно увидеть, что при использовании группы клеток, культивированных в культуральной среде без амфирегулина, в качестве контроля, добавление амфирегулина может способствовать пролиферации первичных эпителиальных клеток молочной железы, при этом он может способствовать пролиферации первичных эпителиальных клеток молочной железы с увеличением по меньшей мере на 50% и до 250%.
[Пример 4]
Непрерывное культивирование первичных опухолевых клеток молочной железы, происходящих из раковой ткани молочной железы, и построение кривой роста для них
(1) Культуральную среду для первичных эпителиальных клеток молочной железы получали таким же образом, что и на этапе (1) в примере 2. В качестве контроля получали другую культуральную среду для технологии кондиционируемого перепрограммирования клеток (здесь и далее в настоящем документе также называемую «среду для кондиционируемого перепрограммирования клеток»). Описание этапов получения можно найти в источнике: Liu et al., Nat Protoc., 12(2): 439-451, 2017. Состав указанной культуральной среды приведен в таблице 2. Кроме того, в качестве другого контроля получали культуральную среду для органоидов молочной железы (здесь и далее в настоящем документе также называемую «средой для органоидов»). Описание этапов получения можно найти в источнике: Hans Clevers et al., Cell, 11; 172(1-2): 373-386, 2018, и состав указанной культуральной среды приведен в таблице 3.



(2) с применением того же способа, что и на этапе (1) в примере 1, получали первичные опухолевые клетки молочной железы (HMFL-XN12 и HMFL-XN21), происходящие из двух случаев раковых тканей молочной железы. Затем HMFL-XN12 и HMFL-XN21 культивировали с одной и той же плотностью (4×104 клеток/лунку) в следующих трех вариантах условий культивирования:
A. Технология согласно настоящему изобретению: первичными опухолевыми клетками молочной железы инокулировали 12-луночный планшет, покрытый матригелем (Matrigel, зарегистрированный товарный знак) (производства BD Biosciences), при плотности, составляющей 4×104 клеток/лунку, и культивировали с применением 2 мл культуральной среды для первичных эпителиальных клеток молочной железы согласно настоящему изобретению;
B. Технология кондиционируемого перепрограммирования клеток: первичными опухолевыми клетками молочной железы инокулировали облученные γ-лучами клетки линии клеток фибробластов мыши J2 (приобретены у Kerafast) при плотности, составляющей 4×104 клеток/лунку, культивировали в 12-луночном планшете с применением среды для кондиционируемого перепрограммирования клеток (подробное описание этапов см. в источнике: Liu et al., Am J Pathol, 183(6): 1862-1870, 2013);
C. Первичными опухолевыми клетками молочной железы инокулировали покрытый матригелем (Matrigel, зарегистрированный товарный знак) (производства BD Biosciences) 12-луночный планшет при плотности, составляющей 4×104 клеток/лунку, и культивировали в 12-луночном планшете с применением 2 мл среды для органоидов.
В описанных выше трех культурах клетки культивировали в трех вариантах условий культивирования, при этом среды обновляли каждые 4 дня.
(3) В случае первичных опухолевых клеток молочной железы (HMFL-XN12 и HMFL-XN21), культивированных по технологии согласно настоящему изобретению, когда клетки в культуральном планшете покрывали приблизительно 80% площади дна планшета, супернатант культуральной среды в 12-луночном планшете удаляли, и добавляли 1 мл 0,05% трипсина (Thermo Fisher: 25300062) для разделения клеток; после инкубации при 37°С в течение 15 минут разделенные клетки ресуспендировали в 5 мл среды DMEM/F12, содержащей 10% (по объему) фетальной бычьей сыворотки, 100 Ед/мл пенициллина и 100 Ед/мл стрептомицина, и полученные клетки собирали в центрифужную пробирку для центрифугирования при 350 g/мин в течение 5 минут; центрифугированный клеточный осадок ресуспендировали в культуральной среде согласно настоящему изобретению, и клетки подсчитывали с помощью гемоцитометра; клетки инокулировали при плотности, составляющей 4×104 клеток/лунку в другой 12-луночный культуральный планшет, покрытый гелем внеклеточного матрикса, для дальнейшего культивирования.
Клетки, культивированные в двух других вариантах условий культивирования, разделяли, пересевали и подсчитывали таким же образом, как описано выше, и клетки инокулировали, соответственно, согласно этапу В или этапу С, описанным на этапе (2) в примере 4.
Когда клетки после пересева повторно покрывают приблизительно 80% площади дна культурального планшета, культивированные клетки разделяют, собирают и подсчитывают в соответствии с вышеописанным способом осуществления. Клетки повторно инокулировали при плотности, составляющей 4×104 клеток/лунку, и осуществляли непрерывное культивирование.
Ниже приведена формула для расчета показателя удвоения популяции первичных эпителиальных клеток молочной железы в разных условиях культивирования:
Показатель удвоения популяции клеток=[log(N/X0)]/log2
где N представляет собой число клеток для пересева, а Х0 представляет собой число клеток при начальной инокуляции (см. Greenwood et al., Environ Mol Mutagen 2004, 43(1): 36-44).
На фиг. 4(A) и 4(B) приведены кривые роста клеток для двух случаев в трех разных вариантах условий культивирования, построенные с помощью программного обеспечения Graphpad Prism 7.0, где дни культивирования отмечены по оси абсцисс, а показатели удвоения популяции клеток отмечены по оси ординат. На основании фиг. 4(A) и 4(B) можно убедиться, что скорость пролиферации эпителиальных клеток молочной железы, культивированных по технологии согласно настоящему изобретению, выше, чем при применении технологии кондиционируемого перепрограммирования клеток, и сравнима со скоростью при применении технологии культивирования органоидов.
Фотографии клеток на фиг. 4(C) представляют собой микроскопические изображения (под инвертированным фазово-контрастным микроскопом при увеличении 50х) HMFL-XN21, культивированных до третьего пересева (27 день) при трех разных вариантах условий культивирования.
На фиг. 5 представлено сравнение микроскопических изображений (под инвертированным фазово-контрастным микроскопом при увеличении 100х) HMFL-XN12, культивированных до 9 дня и 22 дня в культуральной среде согласно настоящему изобретению. В соответствии с фиг. 5 можно убедиться, что технология согласно настоящему изобретению позволяет обеспечить непрерывное культивирование первичных эпителиальных клеток молочной железы, и морфология клеток после нескольких пересевов и в непрерывной культуре значимо не изменяется по сравнению с морфологией до пересева.
[Пример 5]
Идентификация иммунных маркеров происходящих из опухолевой ткани первичных клеток молочной железы
(1) Культуральную среду для первичных опухолевых клеток молочной железы получали таким же образом, как на этапе (1) в примере 2.
(2) Фрагмент раковой ткани размером приблизительно с соевый боб получали из извлеченного хирургическим путем образца от пациента с раком молочной железы, и погружали в 10 мл 4% параформальдегида. Эпителиальные клетки молочной железы (HMFL-XN7) получали из остальной раковой ткани таким же образом, как и на этапе (1) в примере 1. HMFL-XN7 непрерывно культивировали до третьего пересева с применением того же способа согласно описанию на этапе (3) в примере 4.
(3) Иммунофлуоресцентный анализ использовали для детекции экспрессии важных связанных с раком биомаркеров на опухолевые клетки молочной железы человека. Использовали следующие первичные антитела: СК8 (изготовлено Abcam), СК14 (изготовлено Abcam), ER (изготовлено Cell Signaling Technology), PR (изготовлено Cell Signaling Technology), HER2 (изготовлено Cell Signaling Technology) и Ki67 (изготовлено Cell Signaling Technology). Использовали следующие вторичные антитела: антитело против IgG кролика (H+L), F(ab')2-фрагмент (конъюгат с Alexa Fluor® 488) (изготовлено Cell Signaling Technology), антитело против IgG мыши (H+L), F(ab')2-фрагмент (конъюгат с Alexa Fluor® 594) (изготовлено Cell Signaling Technology). ER и PR - важные индикаторы для предсказания того, смогут ли пациенты воспринять эндокринную терапию; HER2 представляет собой важный индикатор для предсказания того, смогут ли пациенты воспринять нацеленную против HER2 терапию; Ki67 представляет собой индикатор, позволяющий судить о злокачественности и прогнозе при раке молочной железы; СК8 и СК14 представляют собой биомаркеры эпителиальных клеток, которые также используют для идентификации и диагностики рака молочной железы.
Опухолевыми клетками молочной железы (HMFL-XN7), культивированными до третьего пересева по технологии согласно настоящему изобретению, инокулировали предметное стекло, покрытое матригелем, используя такой же способ нанесения покрытия, что и на этапе (2) в примере 1. Клетки культивировали с применением культуральной среды для первичных эпителиальных клеток молочной железы согласно настоящему изобретению, и клетки культивировали на предметном стекле. После двукратного промывания буфером PBS клетки фиксировали 4% параформальдегидом в течение 15 минут, и затем инкубировали с 1% БСА, 1% Triton Х-100 в TBST (TBS+0,1% Tween 20) при комнатной температуре в течение 1 часа. Клетки промывали буфером PBS троекратно, каждый раз в течение 3 минут. Раствор PBS удаляли; на предметное стекло наносили каплю 50 мкл разбавителя для первичных антител (приготовленного в соответствии с инструкциями к антителу); клетки инкубировали при комнатной температуре в течение 60 минут, и затем троекратно промывали PBS, каждый раз в течение 3 минут; добавляли по каплям разбавитель для вторичных антител (приготовленный в соответствии с инструкциями к антителу); клетки инкубировали при комнатной температуре в течение 60 минут, и затем троекратно промывали PBS, каждый раз в течение 3 минут. Клетки инкубировали с 1 мкг/мл красителя DAPI (производства Sigma) в течение 10 минут, и затем однократно промывали PBS. После запечатывания покровного стекла каплей заливочной среды (изготовлена Thermo Fisher Scientific) получали фотографии связанных с экспрессией рака молочной железы биомаркеров ER, PR, HER2, СК8, СК14 и Ki67 на клетки (под флуоресцентным микроскопом на увеличении 400х). Результаты представлены на фиг. 6(A). Результаты иммунофлуоресцентного окрашивания показывают, что количество ER(+), PR(+), HER2(-) и Ki67-положительных клеток среди эпителиальных клеток молочной железы, культивированных до третьего пересева с применением технологии согласно настоящему изобретению, составляло 20%.
(4) Экспрессию важных биомаркеров, связанных с раком молочной железы, в исходной ткани, из которой были получены клетки HMFL-XN7, детектировали путем иммуногистохимического исследования. Ткань фиксировали 4% параформальдегидом, заливали в парафин и разрезали, получая с помощью микротома тканевые срезы толщиной 4 мкм. Затем проводили рутинную иммуногистохимическую детекцию (подробное описание этапов см. в источнике: Yu et al., Science, 345(6193): 216-220, 2014). Использовали те же первичные антитела, как и для иммунофлуоресцентного анализа. Получали фотографии экспрессии связанных с раком биомаркеров ER, PR, HER2, СK8, СK14 и Ki67 на клетках (под биологическим микроскопом на увеличении 200х), и результаты показаны на фиг. 6(B). Результаты иммуногистохимического исследования для пациента показывают, что количество ER(+), PR(+), HER2(-) и Ki67-положительных клеток составляло приблизительно 20%.
Фиг. 6(A) и 6(B) подтверждают, что экспрессия связанных с раком биомаркеров на клетках, которые культивировали из опухолевых клеток молочной железы (HMFL-XN7) по технологии согласно настоящему изобретению до третьего пересева, соответствовала экспрессии маркеров на исходном срезе ткани, из которой были получены клетки. Это предполагает, что клетки, культивированные с применением технологии согласно настоящему изобретению, сохраняют исходные патологические характеристики раковых тканей пациентов с раком молочной железы.
[Пример 6]
Анализ генных мутаций и кариотипический анализ первичных опухолевых клеток молочной железы, происходящих из раковой ткани
(1) Анализ генных мутаций: опухолевые клетки молочной железы (HMFL-XN10, HMFL-XN12), непрерывно культивированные способом согласно настоящему изобретению в соответствии с этапом (3) в примере 4; опухолевые клетки молочной железы (Р3), культивированные in vitro до третьего пересева и раковые опухолевые клетки (Р0), которые не пересевали, полученные непосредственно от пациента с раком молочной железы, собирали путем центрифугирования, и экстрагировали геномную ДНК клеток с применением набора для выделения ДНК из образцов крови и тканей DNeasy Blood & Tissue Kit (производства QIAGEN). У пациента-донора клеток брали 2 мл периферической крови и экстрагировали геномную ДНК тем же способом в качестве фонового контроля. Затем выполняли полноэкзомное секвенирование геномной ДНК клеток и образцов крови (подробное описание процедур см. в источнике: Hans Clevers et al., Cell, 11; 172(1-2): 373-386, 2018), и результаты секвенирования анализировали на наличие мутирующего с высокой частотой опухолевого гена. Использовали программное обеспечение MuSiC для анализа высокочастотных мутаций в опухоли. В MuSiC мутация гена в периферической крови пациента-донора образца опухоли была принята в качестве фоновой, были проведены статистические тесты для каждого типа мутации указанного гена, и детектирован ген со значимо более высоким показателем мутаций, чем фоновый. Результаты анализа показаны на фиг. 7(A). Диаграммы Венна на фиг. 7(A) отражают выравнивание некоторых мутирующих с высокой частотой генов, которые несут полученные после разных пересевов опухолевые клетки молочной железы, культивированные по технологии согласно настоящему изобретению. HMFL-XN10 (Р3) представляет анализ высокочастотных мутаций для опухолевых клеток молочной железы от пациента с раком молочной железы, которые были культивированы до третьего пересева с применением способа культивирования согласно настоящему изобретению; HMFL-XN10 (Р0) представляет анализ первоначально выделенных опухолевых клеток молочной железы, которые не пересевали, полученных от того же пациента с раком молочной железы. Приведенные выше результаты анализа были получены с использованием программного обеспечения, доступного по ссылке: https://bioinfogp.cnb.csic.es/tools/venny/index.html. Результаты анализа высокочастотных мутаций в опухоли показывают, что в указанных двух группах мутирующие с высокой частотой гены по существу были одними и теми же. Манипуляции с клетками HMFL-XN12 и HMFL-XN10 осуществляли параллельно с применением того же способа. Фиг. 7(A) подтверждает, что происходящие из раковой ткани опухолевые клетки молочной железы, культивированные с применением технологии согласно настоящему изобретению, могут сохранять исходные характеристики генных мутаций раковой ткани пациента.
(2) Хромосомный кариотипический анализ: опухолевые клетки молочной железы (HMFL-XN10), непрерывно культивированные до третьего пересева (Р3) с применением того же способа согласно настоящему изобретению в соответствии с этапом (3) в примере 4. За сутки до сбора клеток в культуральную среду добавляли 0,1 мкг/мл колхамина (производства Gibco); через 16 часов клетки разделяли, собирали и обрабатывали 75 мМ KCl с низкой проницаемостью, а затем фиксировали раствором 3:1 метанола: безводной уксусной кислоты в течение 30 минут. Фиксированные клетки равномерно раскапывали на предметное стекло и оставляли для высыхания, и ядра клеток окрашивали 5 мг/мл DAPI (производства Sigma) в течение 15 минут; фотографии клеток в метафазе получали с помощью конфокального лазерного микроскопа (приобретен у Leica), и хромосомы попарно выравнивали.
Фиг. 7(B) показывает, что морфология и количество хромосом в опухолевых клетках молочной железы, культивированных до третьего пересева с применением технологии согласно настоящему изобретению для HMFL-XN10, были нормальными, без видимых полиплоидии или гипоплоидии; однако хромосомы в ядре дублировались дважды, и несколько хромосом были расположены близко друг от друга, что согласуется с кариотипом опухолевых клеток, предполагая, что указанные клетки имеют аномальные хромосомы и характеристики опухолевых клеток. Фиг. 7(B) подтверждает, что происходящие из раковой ткани опухолевые клетки молочной железы, культивированные с применением способа культивирования согласно настоящему изобретению, может сохранять характеристики хромосомного кариотипа пациента с раком молочной железы.
[Пример 7]
Эксперименты по туморогенезу с ксенотрансплантатами первичных опухолевых клеток молочной железы, полученных из раковой ткани, у мышей
Опухолевые клетки молочной железы (HMFL-XN5, HMFL-XN29) выделяли и получали из раковой ткани двух случаев диагностированной патологии у пациентов с тройным негативным раком молочной железы с применением того же способа, что и на этапе (1) в примере 1. HMFL-XN5 и HMFL-XN29 культивировали, соответственно, согласно способу, применяемому на этапе (2) в примере 2, и когда количество опухолевых клеток молочной железы достигало 1×107, опухолевые клетки молочной железы разделяли и собирали с применением того же способа согласно настоящему изобретению согласно описанию этапа (3) в примере 4. Культуральную среду для опухолевых клеток молочной железы согласно настоящему изобретению и матригель (Matrigel, зарегистрированный товарный знак) (производства BD Biosciences) смешивали в соотношении 1:1, и 100 мкл культуральной среды, смешанной с матригелем, использовали для ресуспендирования 5×106 опухолевых клеток молочной железы, и полученный продукт вводили в жировую прослойку груди и подмышечную область правой передней конечности 6-недельных самок мышей с высоким иммунодефицитом (NCG) (приобретены у Nanjing Model Animal Research Center), соответственно. Объемы и скорость роста образующихся из опухолевых клеток молочной железы опухолей у мышей наблюдали и делали фотографии каждые три дня.
Фиг. 8 подтверждает, что образование опухолей у мышей можно наблюдать в двух участках инокуляции опухолевых клеток на 13 день после инокуляции опухолевых клеток. С 13 по 22 дни пролиферация опухоли у мышей была очевидной. Это показывает, что происходящие из раковой ткани опухолевые клетки молочной железы, культивированные с применением способа культивирования согласно настоящему изобретению, обладают туморогенностью у мышей.
[Пример 8]
Функциональный тест на чувствительность к лекарственным средствам происходящих из раковой ткани опухолевых клеток молочной железы
С использованием извлеченного хирургическим путем образца от пациента с раком молочной железы в качестве примера подтверждено, что опухолевые клетки молочной железы, культивированные из происходящих из пациента образцах опухоли молочной железы, могут применяться для тестирования чувствительности опухолевых клеток пациента к разным лекарственным средствам.
1. Высевание первичных опухолевых клеток молочной железы: суспензией одиночных клеток опухолевых клеток молочной железы (HMFL-XN5, HMFL-XN7, HMFL-XN10, HMFL-XN12, и HMFL-XN29), полученной с помощью того же способа согласно настоящему изобретению, что и на этапе (3) в примере 4, инокулировали при плотности, составляющей 3000-5000 клеток/лунку, 384-луночный планшет, и клетки оставляли для прикрепления на ночь.
2. Эксперименты с градиентами лекарственных средств:
(1) Получали планшеты для хранения лекарственных средств с применением метода градиентных разведений: брали по 10 мкл стоковых растворов лекарственных средств для тестирования (концентрацию стокового раствора лекарственного средства определяли на основе 2-кратной максимальной концентрации в крови Cmax лекарственного средства в организме человека), соответственно, и добавляли в ЕР-пробирки объемом 0,5 мл, содержащие 20 мкл ДМСО; 10 мкл растворов из вышеописанных ЕР-пробирок пипетировали во вторые ЕР-пробирки объемом 0,5 мл, содержащие 20 мкл ДМСО, то есть разводили указанные лекарственные средства в отношении 1:3. Вышеописанный способ повторяли для поэтапного разведения и получали 7 концентраций, необходимых для дозирования. Разные концентрации лекарственных средств добавляли в 384-луночные планшеты для хранения лекарственных средств. В каждую лунку контрольной группы с растворителем добавляли равный объем ДМСО в качестве контроля. В указанном примере лекарственные средства для тестирования были представлены эпирубицином (производства МСЕ), лапатинибом (производства МСЕ), доцетакселом (производства МСЕ) и тамоксифеном (производства МСЕ).
(2) С применением высокопроизводительной автоматизированной установки (приобретенной у Perkin Elmer) разные концентрации лекарственных средств и контроля-растворителя в 384-луночных планшетах для хранения лекарственных средств добавляли в 384-луночные клеточные культуральные планшеты с высеянными опухолевыми клетками молочной железы. Все группы лекарственных средств и контрольные группы с растворителем включали лунки-трипликаты. Объем добавляемого в каждую лунку лекарственного средства составлял 100 нл.
(3) Тест на жизнеспособность клеток: через 72 часа после введения использовали набор для анализа Cell Titer-Glo (производства Promega) для детекции показателя хемилюминесценции культивированных клеток после введения лекарственного средства. Величина показателя хемилюминесценции отражает жизнеспособность клеток и эффект лекарственного средства на жизнеспособность клеток. В каждую лунку добавляли приготовленный раствор для детекции Cell Titer-Glo, и использовали микропланшетный ридер для детекции показателя хемилюминесценции после смешивания.
Строили графики с помощью программного обеспечения Graphpad Prism 7.0 и рассчитывали показатель полумаксимального ингибирования IC50.
(4) Результаты тестирования на чувствительность к лекарственным средствам представлены на фиг. 9.
На фиг. 9(A) - 9(D), соответственно, представлена чувствительность опухолевых клеток молочной железы, культивированных из извлеченных хирургическим путем образцов раковой ткани от пяти разных пациентов с раком молочной железы, к двум химиотерапевтическим лекарственным средствам эпирубицину и доцетакселу, к эндокринной терапии лекарственным средством тамоксифеном, и к нацеленному лекарственному средству лапатинибу. Результаты показывают, что клетки от одного и того же пациента имеют разную чувствительность к разным лекарственным средствам, а также клетки от разных пациентов имеют разную чувствительность к одному и тому же лекарственному средству.
В частности, опухолевые клетки молочной железы (HMFL-XN7), происходящие из пациента с положительным по гормональным рецепторам, отрицательным по рецептору HER2 раком молочной железы, были более чувствительны к эндокринной терапии лекарственным средством тамоксифеном по сравнению с другими пациентами, с показателем полумаксимального ингибирования 0,98 мкМ; однако чувствительность к нацеленному против HER2 лекарственному средству лапатинибу была ниже, с показателем полумаксимального ингибирования 2,5 мкМ. Результаты тестирования опухолевых клеток молочной железы (HMFL-XN12), происходящих из пациента с HER2-положительным раком молочной железы, показывают, что клетки были более чувствительны к нацеленному против HER2 лекарственному средству лапатинибу, чем у других пациентов, с показателем полумаксимального ингибирования 0,92 мкМ. Кроме того, опухолевые клетки молочной железы (HMFL-XN29), происходящие из пациента с тройным негативным раком молочной железы, были менее чувствительны к эндокринной терапии лекарственным средством тамоксифеном и нацеленному против HER2 лекарственному средству лапатинибу, чем опухолевые клетки молочной железы от других пациентов. С другой стороны, опухолевые клетки молочной железы (HMFL-XN5) от другого пациента с тройным негативным раком молочной железы не были чувствительны к ни к одному из четырех использованных для тестирования лекарственных средств.
Фиг. 9 подтверждает, что результаты теста на чувствительность опухолевых клеток молочной железы, которые культивировали согласно настоящему изобретению из раковых тканей пациентов с раком молочной железы, к химиотерапевтическим лекарственным средствам и нацеливаемым лекарственным средствам, соответствовали клинико-патологическому молекулярному типированию пациентов, что предполагает, что опухолевые клетки молочной железы, культивируемые с применением технологии согласно настоящему изобретению, потенциально могут применяться для предсказания клинической эффективности у пациентов с раком молочной железы.
Хотя настоящее изобретение было подробно описано выше в общем и с отсылкой на конкретные варианты реализации, на основе настоящего изобретения могут быть произведены некоторые модификации или усовершенствования, которые будут очевидны для специалистов в данной области техники. Таким образом, указанные модификации или усовершенствования, произведенные без отступления от существа изобретения, должны входить в объем охраны настоящего изобретения.
Промышленная применимость
Согласно настоящему изобретению предложены культуральная среда и способ культивирования, для культивирования или размножения первичных эпителиальных клеток молочной железы in vitro. Клеточные модели, полученные с применением указанной культуральной среды, и способ культивирования первичных эпителиальных клеток молочной железы согласно настоящему изобретению могут применяться для оценки или скрининга лекарственных средств для лечения заболеваний молочной железы.




Группа изобретений относится к биотехнологии. Предложены культуральная среда, содержащая от 10 нг/мл до 100 нг/мл амфирегулина, эпидермальный фактор роста, инсулин, B27, ингибитор киназы ROCK Y27632, нейрегулин 1, фактор роста фибробластов 7, ингибитор рецептора TGFβ типа I A8301 и ингибитор P38/MAPK SB202190, но не содержащая агонисты Wnt, для культивирования первичных эпителиальных клеток молочной железы; способ культивирования первичных эпителиальных клеток молочной железы, включающий применение указанной среды; и способ оценки эффективности лекарственного средства для лечения заболеваний молочной железы, включающий культивирование эпителиальных клеток молочной железы с применением заявленного способа и детектирования их жизнеспособности в присутствии лекарственного средства. Изобретения обеспечивают сокращение длительности культивирования, повышение пролиферации и однородности первичных эпителиальных клеток молочной железы, которые могут применяться для оценки лекарственных средств в лечении заболеваний молочной железы. 3 н. и 5 з.п. ф-лы, 9 ил., 3 табл., 8 пр.
1. Культуральная среда для культивирования первичных эпителиальных клеток молочной железы, характеризующаяся тем, что: указанная культуральная среда содержит амфирегулин, эпидермальный фактор роста, инсулин, B27, ингибитор киназы ROCK Y27632, нейрегулин 1, фактор роста фибробластов 7, ингибитор рецептора TGFβ типа I A8301 и ингибитор P38/MAPK SB202190, но не содержит агонисты Wnt, причем
содержание амфирегулина составляет от 10 нг/мл до 100 нг/мл.
2. Культуральная среда по п. 1, характеризующаяся тем, что:
содержание эпидермального фактора роста составляет 2,5 нг/мл или более, предпочтительно от 2,5 нг/мл до 20 нг/мл;
содержание инсулина составляет от 1 мкг/мл до 10 мкг/мл;
B27 разводят до конечной концентрации от 1:25 до 1:100;
содержание Y27632 составляет от 5 мкМ до 15 мкМ;
содержание нейрегулина 1 составляет от 5 нМ до 20 нМ;
содержание фактора роста фибробластов 7 составляет от 2,5 нг/мл до 20 нг/мл;
содержание A8301 составляет от 100 нМ до 500 нМ;
содержание SB202190 составляет от100 нМ до 500 нМ.
3. Культуральная среда по п. 1, характеризующаяся тем, что:
указанная культуральная среда не содержит сыворотки, экстракта бычьего гипофиза, агонистов Wnt, белков семейства R-спондинов, ингибиторов BMP, фактора роста фибробластов 10, никотинамида и N-ацетилцистеина.
4. Культуральная среда по любому из пп. 1-3, характеризующаяся тем, что:
первичные эпителиальные клетки молочной железы представляют собой опухолевые клетки молочной железы, нормальные эпителиальные клетки молочной железы или стволовые эпителиальные клетки молочной железы.
5. Способ культивирования первичных эпителиальных клеток молочной железы, характеризующийся тем, что он включает следующие этапы:
(1) приготовление культуральной среды по любому из пп. 1-4;
(2) покрытие культурального сосуда разведенным гелем внеклеточного матрикса;
(3) инокуляция первичных эпителиальных клеток молочной железы в культуральном сосуде с нанесенным покрытием в соответствии с этапом 2, культивирование указанных клеток при концентрации кислорода 15-20% или концентрации кислорода 0,5-4% с применением указанной культуральной среды, и разделение указанных клеток для пересева, когда первичные эпителиальные клетки молочной железы достигают плотности, соответствующей 80-90% площади дна культурального сосуда.
6. Способ культивирования по п. 5, характеризующийся тем, что:
гель внеклеточного матрикса относится к типу с низкими концентрациями факторов роста;
гель внеклеточного матрикса разводят не содержащей сыворотки средой, и степень разведения геля внеклеточного матрикса составляет от 1:50 до 1:400;
этап нанесения покрытия включает добавление разведенного геля внеклеточного матрикса в культуральный сосуд так, чтобы он полностью покрывал дно культурального сосуда, и выстаивание в течение 30 мин или более.
7. Способ оценки эффективности лекарственного средства для лечения заболеваний молочной железы, характеризующийся тем, что он включает следующие этапы:
(1) культивирование эпителиальных клеток молочной железы с применением способа культивирования по п. 5 или 6;
(2) выбор лекарственных средств для тестирования;
(3) на основании максимальной концентрации в плазме лекарственного средства Cmax в качестве референсной, использование 2–5-кратной Cmax в качестве начальной концентрации и разведение указанного лекарственного средства с получением градиентов различных концентраций лекарственного средства;
(4) разделение эпителиальных клеток молочной железы, культивированных на этапе (1), с получением суспензии одиночных клеток, разведение указанной суспензии одиночных клеток культуральной средой по любому из пп. 1-4, содержащей гель внеклеточного матрикса, добавление разведенной суспензии клеток в многолуночный планшет при плотности 1000-10000 клеток на лунку и выдерживание для прикрепления в течение ночи;
(5) добавление градиентных разведений лекарственного средства к адгезивным клеткам, полученным на этапе (4);
(6) детектирование жизнеспособности клеток для оценки эффективности лекарственного средства по его эффекту на жизнеспособность клеток.
8. Способ по п. 7, характеризующийся тем, что:
при детекции жизнеспособности клеток в каждую лунку добавляют реагент для детекции жизнеспособности клеток; и после перемешивания до однородности измеряют интенсивность хемилюминесценции каждой лунки с помощью микропланшетного ридера для измерения флуоресценции; строят кривую зависимости эффекта от дозы лекарственного средства на основании измеренных значений; и вычисляют интенсивность ингибирования каждым лекарственным средством пролиферации клеток.
| Токарный резец | 1924 |
|
SU2016A1 |
| Токарный резец | 1924 |
|
SU2016A1 |
| ОНКОИНГИБИН, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ОНКОИНГИБИН | 1993 |
|
RU2139087C1 |
Авторы
Даты
2024-05-17—Публикация
2019-11-18—Подача