Область техники
Изобретение относится к области медицинской технологии, в частности к культуральной среде и способу культивирования для культивирования или размножения первичных эпителиальных клеток плоскоклеточной карциномы пищевода in vitro, а также к способу и применению культивируемых клеток в оценке эффективности и скрининге лекарственных средств.
Уровень техники
Рак пищевода является одним из самых распространенных злокачественных новообразований желудочно-кишечного тракта в мире. Согласно последним статистическим данным Национального онкологического центра, среди десяти наиболее часто встречающихся злокачественных опухолей рак пищевода занимает шестое место у мужчин и второе место у женщин. Во многих регионах мира местный уровень заболеваемости увеличился, при этом Китай является регионом с высокой заболеваемостью раком пищевода, с годовой заболеваемостью 246000 и среднегодовым числом смертей около 150000, что составляет 21,8% смертности от рака в стране, занимая четвертое место среди типов рака, вызывающих наибольшее количество смертей (данные Национального онкологического центра, 2019 г.). В последние годы, хотя люди добились некоторого прогресса в исследованиях молекулярного типирования и патогенеза рака пищевода, из-за различий в молекулярном типировании рака пищевода между Китаем и зарубежными странами, терапевтические инструменты для плоскоклеточной карциномы пищевода (ПКРП), в частности, для пациентов на поздних стадиях, по-прежнему ограничены, а персональные рекомендации по персонализированной медицине недоступны. В отличие от аденокарциномы, ПКРП не имеет относительно ясной молекулярной мишени, и поэтому на практике трудно предсказать эффективность клинических лекарственных средств только на основании молекулярного или генетического диагноза.
Функциональное тестирование относится к способу определения чувствительности к противоопухолевым лекарственных препаратов на клетках больных раком in vitro. Ключевым для применения этого метода является разработка моделей опухолевых клеток, которые имеют короткий цикл роста и могут отражать биологические характеристики пациентов с ПКРП. Кроме того, клеточная модель должна быть простой в обращении, чтобы быстро и эффективно предсказывать эффективность клинических медикаментов, в целях предоставления своевременных точных рекомендаций по лечению пациентов с онкологическими заболеваниями. Однако обычно низкие показатели успешности создания клеточных моделей in vitro из первичных опухолевых клеток больных раком, длительные циклы роста и такие проблемы, как чрезмерная пролиферация мезенхимальных клеток (таких как фибробласты и т.п.), ограничивают развитие в этой области. В настоящее время существуют две технологии культивирования первичных эпителиальных / стволовых клеток, которые являются относительно зрелыми разработками в области функционального тестирования с использованием опухолевых клеток. Одной из них является технология, в которой используются облученные фидерные клетки и Y27632, ингибитор киназы ROCK, для стимуляции роста первичных эпителиальных клеток с целью исследования чувствительности к лекарственным средствам отдельных пациентов, то есть технология индуцированного условиями перепрограммирования клеток (Liu et al., Am J Pathol, 180: 599-607, 2012). Другая методика представляет собой 3D-культуру стволовых клеток взрослых in vitro для получения органоидов, подобных тканям и органам (Hans Clevers et al., Cell, 11; 172(1-2): 373-386, 2018).
Однако обе методики имеют определенные ограничения. Перепрограммирование клеток - это методика, в которой первичные аутологичные эпителиальные клетки пациента культивируют совместно с фидерными клетками мышиного происхождения. Присутствие этих клеток мышиного происхождения может влиять на результаты теста на чувствительность первичных аутологичных клеток пациента к лекарственным средствам, во время тестирования на чувствительность к лекарственным средствам на первичных клетках пациента; с другой стороны, в случае нокаута фидерных клеток мышиного происхождения первичные аутологичные клетки пациента могут быть удалены из среды перепрограммирования, а скорость пролиферации клеток и внутриклеточный сигнальный путь могут значительно измениться (Liu et al., Am J. Pathol, 183(6): 1862-1870, 2013; Liu et al., Cell Death Dis., 9(7): 750, 2018), что в результате значительно повлияет на реакцию первичных аутологичных клеток пациента на лекарственное средство. Органоидная технология - это технология, в которой первичные аутологичные эпителиальные клетки пациента внедряют во внеклеточный матрикс для 3D-культивирования in vitro, которая не требует фидерных клеток, и, таким образом, отсутствует проблема интерференции со стороны фидерных клеток мышиного происхождения. Однако культуральная среда органоидной технологии должна быть дополнена различными специфическими факторами роста (такими как белки Wnt и белки семейства R-спондинов), что дорого и не подходит для широкого клинического применения. Кроме того, органоид должен быть заключен в гелеобразный внеклеточный матрикс в течение всего процесса культивирования, а этапы инокуляции клеток, пересева и тестирования на чувствительность к лекарственным средствам являются трудоемкими и времязатратными по сравнению с операциями 2D-культивирования. Кроме того, размер органоида, сформированного с помощью этой технологии, трудно контролировать, и некоторые органоиды могут стать слишком большими и вызвать внутренний некроз. Таким образом, органоидная технология имеет худшую реализуемость и применимость, чем технология 2D-культуры. Для ее реализации необходим профессиональный технический, и поэтому он не подходит для всеобщего и широкого клинического применения для тестирования чувствительности к лекарственным средствам in vitro (Nick Barker, Nat Cell Biol, 18(3): 246-54, 2016).
Ввиду ограничений вышеуказанных технологий необходимо разработать технологию культивирования первичных эпителиальных клеток ПКРП в клинике, которая может обеспечить короткий период культивирования, контролируемую стоимость и удобство работы без влияния (интерференции) экзогенных клеток. Когда технология применяется для создания модели первичной опухолевой клетки ПКРП, культивируемые опухолевые клетки ПКРП могут представлять биологические характеристики пациентов с ПКРП. Путем оценки чувствительности противоопухолевых препаратов in vitro, на клеточных моделях, полученных от отдельных пациентов с раком, можно улучшить степень ответа на терапию противоопухолевыми лекарственными средствами в клинике, а проблемы, вызванные неподходящими препаратами для пациентов, и расход медицинских ресурсов могут быть сокращены.
Краткое описание изобретения
С учетом недостатков предшествующего уровня техники, изобретение направлено на создание культуральной среды для культивирования первичных эпителиальных клеток ПКРП и способа культивирования первичных эпителиальных клеток ПКРП с использованием указанной культуральной среды. Культуральная среды для первичных эпителиальных клеток ПКРП и способ культивирования согласно настоящему изобретению могут обеспечить короткий период культивирования in vitro, контролируемую стоимость, удобство работы и отсутствие влияния экзогенных клеток. При применении этой технологии для создания модели клеток первичной опухоли ПКРП, можно получить первичные опухолевые клетки ПКРП с биологическими характеристиками пациентов с ПКРП, которые можно применять при скрининге новых лекарственных средств и в тесте на чувствительность к лекарственным средствам in vitro.
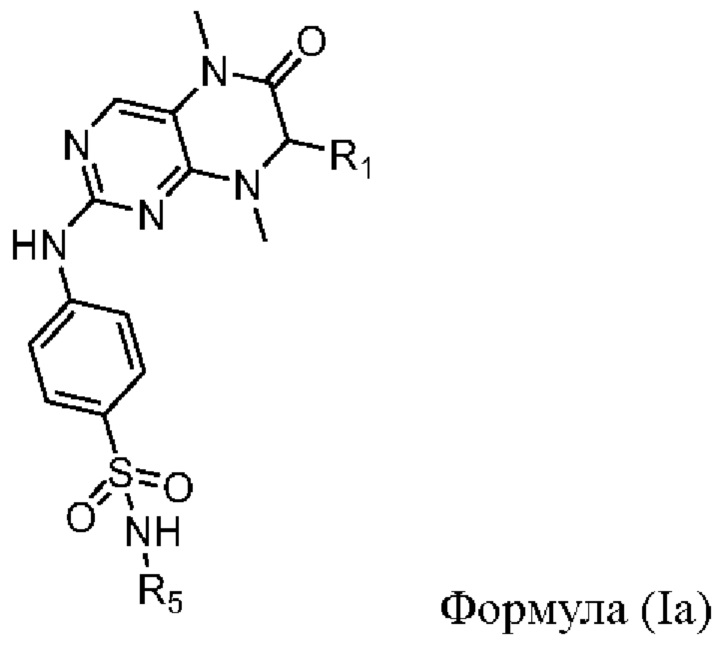
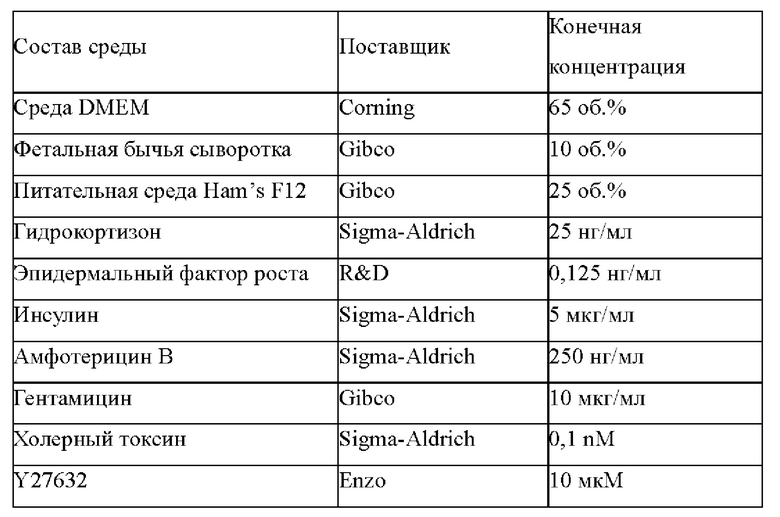
Одним из аспектов изобретения является обеспечение культуральной среды для культивирования первичных эпителиальных клеток ПКРП, содержащей ингибитор киназы MST1/2 и ингибитор киназы ROCK, где ингибитор киназы MST1/2 содержит соединение Формулы (I) или его фармацевтически приемлемую соль или сольват, а ингибитор киназы ROCK представляет собой, по меньшей мере, одно выбранное из группы, состоящей из Y27632, Фасудилаи Н-1152.

где
R1 выбран из С1-С6 алкила, С3-С6 циклоалкила, С4-С8 циклоалкилалкила, С2-С6 спироциклоалкила и арила (например, фенила и нафтила и т.д.), необязательно независимо содержащего в качестве заместителей 1-2 R6, арил-С1-С6 алкила (например, фенилметил и т.д.), необязательно независимо содержащего в качестве заместителей 1-2 R6, и гетероарила (например, тиенила и т.д.), необязательно независимо содержащего в качестве заместителей 1-2 R6;
каждый из R2 и R3 независимо выбран из С1-С6 алкила, предпочтительно С1-С3 алкила, более предпочтительно метила;
каждый из R4 и R5 независимо, выбраны из водорода, С1-С6 алкила, С3-С6 циклоалкила, С4-С8 циклоалкилалкила, гидроксила, С1-С6 алкила, С1-С6 галогеналкила, С1-С6 алкиламино С1-С6 алкила, С1-С6 алкокси С1-С6-алкила и С3-С6-гетероциклил-С1-С6 алкила (гетероциклил выбран, например, из пиперидила, тетрагидропиранила и т.д.);
R6 выбран из галогена (предпочтительно фтора и хлора, более предпочтительно фтора), С1-С6 алкила (предпочтительно метила), С1-С6 алкокси (предпочтительно метокси) и С1-С6 галогеналкила (предпочтительно трифторметила).
В предпочтительном варианте осуществления изобретения, ингибитор киназы MST1/2 содержит соединение Формулы (Ia) или его фармацевтически приемлемую соль, или сольват,
в которой
R1 выбран из С1-С6 алкила, фенила, необязательно независимо содержащего в качестве заместителей 1-2 R6, тиенила, необязательно независимо содержащего в качестве заместителей 1-2 R6, и фенилметила, необязательно независимо содержащего в качестве заместителей 1-2 R6; более предпочтительно, R1 представляет собой фенил, необязательно независимо содержащий в качестве заместителей 1-2 R6;
R5 выбран из водорода, С1-С6 алкила и С3-С6 циклоалкила; более предпочтительно, R5 представляет собой водород;
R6 независимо выбран из галогена, С1-С6 алкила и С1-С6 галогеналкила; более предпочтительно, R6 представляет собой фтор, метил или трифторметил.
Предпочтительно ингибитор киназы MST1/2 представляет собой по меньшей мере, одно соединение, выбранное из следующих соединений или его фармацевтически приемлемую соль или сольват.




Наиболее предпочтительно, ингибитор киназы MST1/2 согласно изобретению представляет собой Соединение 1, и ингибитор киназы ROCK согласно изобретению предпочтительно представляет собой Y27632.
В варианте осуществления изобретения количество ингибитора киназы MST1/2 в культуральной среде обычно составляет 0,3 мкМ-10 мкМ, предпочтительно 0,75 мкМ-6 мкМ, более предпочтительно 2 мкМ-6 мкМ. Кроме того, количество ингибитора киназы ROCK в культуральной среде обычно составляет 0,3-20 мкМ, предпочтительно 2,5-15 мкМ, более предпочтительно 7,5-12,5 мкМ.
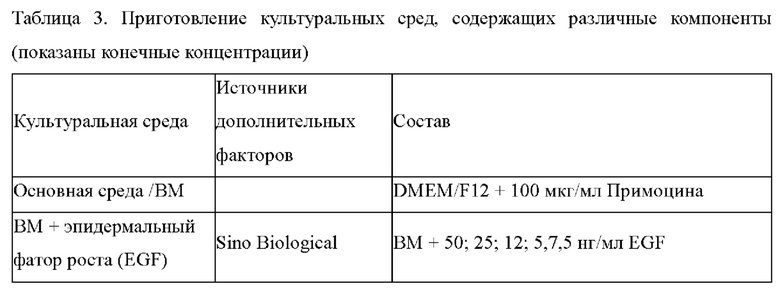
Предпочтительно, культуральная среда для первичных клеток согласно изобретению дополнительно содержит один или более из следующих факторов: эпидермальный фактор роста (EGF); комплекс инсулин-трансферрин-селен; добавка В27 или добавка N2; фактор роста гепатоцитов (HGF); ингибитор рецептора TGFp I типа, выбранный из по меньшей мере одного из А83-01, SB431542, Repsox, SB505124, SB525334, SD208, LY36494 и SJN2511; а также ингибитор Р38/МАРК, выбранный из по меньшей мере одного из SB202190, SB203580, VX-702, VX-745, PD169316, RO4402247 и BIRB796.
В предпочтительном варианте осуществления количество EGF составляет от 12,5 нг/мл до 100 нг/мл, более предпочтительно от 50 нг/мл до 100 нг/мл; соответствующие количества инсулина/трансферрина/селенита натрия в комплексе инсулин-трансферрин-селен составляет 2,5-20 мкг/мл, 1,25-10 мкг/мл, 1,25-10 нг/мл, соответственно, и более предпочтительно, 5-20 мкг/мл, 2,5-10 мкг/мл, 2,5-10 нг/мл, соответственно; объемная концентрация добавки В27 или добавки N2 в культуральной среде составляет 1:25-1:200, более предпочтительно 1:25-1:50; количество HGF составляет 2,5 нг/мл-20 нг/мл, более предпочтительно 10 нг/мл-20 нг/мл; ингибитор рецептора TGFβ I типа предпочтительно представляет собой А83-01 и количество ингибитора рецептора TGFβ I типа составляет 125 нМ-500 нМ, предпочтительно 250 нМ-500 нМ; ингибитор Р38/MAPK предпочтительно представляет собой SB202190, а количество ингибитора Р38/MAPK составляет от 125 нМ до 500 нМ, предпочтительно от 250 нМ до 500 нМ.
По сравнению со средой для индуцированного условиями перепрограммирования клеток и средой для органоидов эпителиальных клеток ПКРП, состав этой среды содержит комбинацию ингибитора киназы MST1/2 и ингибитора киназы ROCK (особенно предпочтительными являются Соединение 1 и Y27632), но не содержит неопределенных по составу компонентов, таких как: сыворотка, экстракт бычьего гипофиза или подобных; нишевые факторы, которые необходимы для культивирования органоидов, такие как агонисты Wnt, белки семейства R-спондинов, ингибиторы BMP или тому подобные; а также не содержит никотинамид и N-ацетилцистеин, что значительно снижает стоимость среды, упрощает рабочий процесс приготовления среды и получение культуры первичных эпителиальных клеток ПКРП in vitro за счет контролируемых затрат и удобства обращения.
В настоящем изобретении первичные эпителиальные клетки ПКРП могут быть выбраны из опухолевых клеток ПКРП, нормальных эпителиальных клеток ПКРП и эпителиальных стволовых клеток ПКРП.
Одним из аспектов изобретения является способ культивирования первичных эпителиальных клеток ПКРП, включающий следующие этапы:
(1) Приготовление культуральной среды для первичных клеток согласно изобретению в соответствии с описанным выше составом.
(2) Покрытие культурального сосуда разбавленным гелеобразным внеклеточным матриксом.
В частности, в качестве гелеобразного внеклеточного матрикса можно использовать гелеобразный внеклеточный матрикс с низким содержанием фактора роста, например, можно использовать коммерческий Matrigel (приобретенный в Corning) или ВМЕ (приобретенный в Trevigen). Более конкретно, гелеобразный внеклеточный матрикс разбавляют бессывороточной средой, которая может представлять собой среду DMEM/F12 (приобретенную в Corning). Степень разбавления гелеобразного внеклеточного матрикса составляет 1:50-1:400, предпочтительно 1:100-1:200. Способ покрытия включает добавление разбавленного гелеобразного внеклеточного матрикса в культуральный сосуд, чтобы полностью покрыть дно культурального сосуда, и выдерживание в течение 30 минут или более, предпочтительно выдерживание и покрытие при 37°С в течение 30-60 минут. После завершения покрытия излишки разбавленного геля внеклеточного матрикса выбрасывают, и сосуд для культивирования готов к дальнейшему использованию.
(3) Выделение первичных эпителиальных клеток ПКРП из ткани ПКРП. Первичные эпителиальные клетки ПКРП могут быть получены, например, из образцов ткани ПКРП и образцов околоопухолевой ткани. Например, образцы ткани ПКРП получают из опухолевой ткани информированного и давшего согласие пациента с ПКРП путем хирургической резекции, а образцы околоопухолевой ткани отбирают из ткани ПКРП на расстоянии не менее 5 см от ткани пищевода. Сбор вышеупомянутых образцов ткани осуществляют в течение получаса после хирургического иссечения или биопсии. Более конкретно, в стерильных условиях вырезают образец ткани из ненекротических участков объемом более 0,5 мм3, а затем образец ткани помещают в 10-15 мл предварительно охлажденной среды DMEM/F12, помещенной в пластиковую стерильную центрифужную пробирку с крышкой, и транспортируют в лабораторию на льду. При этом среда DMEM/F12 содержит 1-2 об.% пенициллина, стрептомицина и/или 0,2-0,4 об.% Примоцина (далее в данном документе именуется тканевой транспортировочной жидкостью). В случае использования стрептомицина/пенициллина диапазон концентраций стрептомицина составляет 25-400 мкг/мл, предпочтительно 50-200 мкг/мл, более предпочтительно 200 мкг/мл, диапазон концентраций пенициллина составляет 25-400 ЕД/мл, предпочтительно 50-200 ЕД/мл, более предпочтительно 200 ЕД/мл; и в случае использования Примоцина диапазон концентраций составляет 25-400 мкг/мл, предпочтительно 50-200 мкг/мл, более предпочтительно 100 мкг/мл.
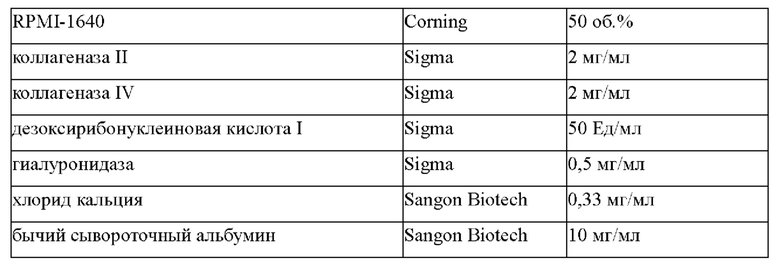
В боксе биологической безопасности образец ткани переносят в чашку для культуры клеток, которую затем промывают транспортировочной жидкостью, и смывают клетки крови с поверхности образца ткани. Промытый образец ткани переносят в другую новую культуральную чашку с добавлением 1-3 мл транспортировочной жидкости и с помощью стерильного лезвия скальпеля и пинцета разделяют образец ткани на фрагменты ткани объемом менее 3 мм3.
Фрагменты образца ткани переносят в центрифужную пробирку, которую центрифугируют при 1500 об/мин в течение 3-5 минут в настольной центрифуге (Sigma, 3-18K); после удаления супернатанта добавляют тканевую транспортную жидкость и раствор для ферментативной дезагрегации тканей в соотношении 1:1 (дозировка составляет около 5 мл раствора для ферментативной обработки тканей на 10 мг ткани; способ приготовления раствора для ферментативной дезагрегации тканей включает: растворение 1-2 мг/мл коллагеназы II, 1-2 мг/мл коллагеназы IV, 50-100 ЕД/мл дезоксирибонуклеиновой кислоты I, 0,5-1 мг/мл гиалуронидазы, 0,1-0,5 мг/мл кальция хлорида, 5-10 мг /мл бычьего сывороточного альбумина в HBSS и RPMI-1640 в объемном соотношении 1:1); затем образец нумеруется и запечатывается герметизирующей пленкой, а затем подвергается ферментативной дезагрегации в шейкере с постоянной температурой (Zhichu Instrument ZQLY-180N) при 37°С, с вращением 200-300 оборотов; завершенность расщепления определяют наблюдением через каждый 1 час; если явного тканевого фрагмента не обнаружено - процесс ферментативной дезагрегации можно прекратить; в противном случае образец продолжают подвергать ферментативной дезагрегации до тех пор, пока расщепление ткани не станет достаточным, при этом время ферментативной дезагрегации варьирует от 4 до 8 часов. После ферментативной дезагрегации нерасщепленные фрагменты ткани фильтруют через клеточный сетчатый фильтр (размер ячеек клеточного сетчатого фильтра составляет, например, 70 мкм); тканевые фрагменты на сетке фильтра промывают тканевой транспортной жидкостью; оставшиеся клетки смывают в центрифужную пробирку и центрифугируют в настольной центрифуге при 1500 об/мин в течение 3-5 минут. После удаления супернатанта наблюдают за оставшимися скоплениями клеток, чтобы определить, остались ли клетки крови; при наличии клеток крови добавляют 3 мл лизата клеток крови (приобретенного у Sigma), который затем хорошо перемешивают, лизируют при 4°С в течение 10-20 минут, при встряхивании и тщательном перемешивании каждые 5 минут; после лизиса полученный продукт вынимают и центрифугируют при 1500 об/мин в течение 3-5 минут. После удаления супернатанта добавляют основную культуральную среду согласно изобретению для ресуспендирования. Общее количество клеток получают путем подсчета с помощью счетчика для визуализации клеток в потоке (JIMBIO FIL, Jiangsu Jimbio Technology Co., Ltd.).
(4) Инокуляция эпителиальных клеток ПКРП первичной культуры, выделенных на этапе (3), в культуральный сосуд с покрытием и культивирование с использованием среды для культивирования клеток первичной культуры, полученной на этапе (1).
А именно, опухолевые клетки первичной культуры ПКРП инокулируют при плотности от 2×104 до 8×104 клеток/см2 (например, 4×104 клеток/см2) в одну лунку 6-луночного планшета; добавляют 2-3 мл основной среды для культивирования эпителиальных клеток, затем культивируют в клеточном инкубаторе в течение 8-16 дней, например, в условиях 37°С, 5% СО2; каждые 4 дня в течение культивирования среда для клеток первичной культуры меняется на свежую; ферментативная дезагрегация и пассирование выполняются, когда первичные эпителиальные клетки ПКРП вырастают до плотности клеток, которая составляет от 80% до 90% площади дна 6-луночного планшета.
Этот этап инокуляции не требует использования фидерных клеток, и, по сравнению с технологией индуцированного условиями перепрограммирования клеток, этапы культивирования и облучения фидерных клеток опущены. По сравнению с органоидной технологией, на этом этапе не требуется равномерно смешивать клетки первичной культуры с гелеобразным матриксом на льду для образования капель геля и ждать затвердевания капель геля перед добавлением среды. Предварительно покрытый культуральный сосуд можно использовать непосредственно для инокуляции клеток первичной культуры. Кроме того, для покрытия культуральных сосудов требуется лишь небольшое количество разбавленного геля внеклеточного матрикса, что приводит к экономии дорогостоящего геля внеклеточного матрикса и упрощению операций, по сравнению с органоидной технологией.
Необязательно, после культивирования инокулированных первичных эпителиальных клеток ПКРП в течение 8-16 дней, когда образовавшиеся в контейнере для культивирования клеточные клоны сходятся и покрывают 80% площади дна, супернатант удаляют и добавляют 1-2 мл 0,05% трипсина (приобретен у Thermo Fisher) для ферментативной дезагрегации клеток, которые затем инкубируют при комнатной температуре в течение 5-20 мин. Обработанные ферментом клетки ре суспендируют в 2-4 мл культуральной жидкости, содержащей, например, 5% (об./об.) эмбриональной бычьей сыворотки, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина, и центрифугируют при 1500 об/мин в течение 3 -5 минут. Дезагрегированные отдельные клетки ресуспендируют с использованием первичной клеточной культуральной среды согласно изобретению, и полученную клеточную суспензию помещают в культуральный флакон Т25, покрытый гелем внеклеточного матрикса, для непрерывного культивирования. Операция покрытия культурального флакона Т25 такая же, как и на этапе (2).
Размноженные эпителиальные клетки ПКРП растут в 2D-формате, без формирования органоидов неоднородного размера и внутреннего некроза в разросшихся органоидах, которые могут возникнуть при размножении с использованием органоидной технологии.
В другом аспекте эпителиальные клетки ПКРП, особенно опухолевые клетки ПКРП, выращиваемые методом культивирования для первичных эпителиальных клеток ПКРП согласно изобретению, можно применять для оценки эффективности лекарственного средства и скрининга лекарственного средства, который включает следующие этапы:
(1) получение первичных эпителиальных клеток ПКРП, более предпочтительно, получение образцов опухолевой ткани или образцов биопсии опухолевой ткани, взятых у пациентов с ПКРП; выделение первичных эпителиальных клеток ПКРП и культивирование и размножение первичных эпителиальных клеток ПКРП (в частности, первичных опухолевых клеток ПКРП) в соответствии со способом культивирования первичных эпителиальных клеток ПКРП, описанным выше, пока число клеток не достигнет значения, 105, предпочтительно 106.
(2) Выбор лекарственного препарата для испытания.
(3) На основании максимальной концентрации лекарственного вещества в плазме Cmax в качестве эталона, использование 2-5-кратное значение Cmax в качестве начальной концентрации, и разбавление лекарственное вещество с использованием различных градиентов концентрации, таких как градиенты концентрации лекарственного вещества 5-10, предпочтительно, 6-8.
(4) Расщепление (дезагрегация) эпителиальных клеток ПКРП, культивированных на этапе (1), в суспензию отдельных клеток; подсчет количества клеток с помощью поточного визуализирующего счетчика; разбавление суспензии отдельных клеток средой для культивирования клеток первичной культуры согласно изобретению, добавление разведенной суспензии клеток равномерно в многолуночный планшет с плотностью 2000-4000 клеток на лунку, например, 50 мкл разведенной клеточной суспензии на лунку; и прикрепление клеток в течение ночи.
Этот этап позволяет избежать проблемы метода перепрограммирования клеток, заключающейся в том, что присутствие фидерных клеток может мешать подсчету клеток первичной культуры и последующему анализу жизнеспособности клеток первичной культуры; а также устраняет необходимость в утомительном этапе смешивания, заключения и последующего посева клеточной суспензии в гелеобразный матрикс на льду, как в органоидной технологии, что значительно упрощает процесс работы и повышает работоспособность и практичность технологии. Поскольку инокулированные клетки представляют собой суспензии одиночных клеток, а не трехмерные структуры, такие как органоиды, этот метод может позволить получить более равномерное количество клеток в чашках и меньшие различия в количестве клеток между лунками по сравнению с органоидной технологией, что делает этот способ более подходящим для последующих высокопроизводительных операций по скринингу лекарственных веществ.
(5) Добавление выбранных лекарственных веществ-кандидатов, таких как традиционные химиотерапевтические лекарственные вещества, препараты направленного действия, препараты антител или их комбинации с градиентными разведениями, к прикрепленным клеткам, полученным на этапе (4), с использованием высокопроизводительной автоматизированной рабочей станции.
(6) Через несколько часов после добавления лекарственного вещества, например, 72 часа, определение показателя выживаемости эпителиальных клеток ПКРП с использованием набора для определения жизнеспособности клеток по люминесценции Cell-Titer Glo (приобретен у Promega) для скрининга активности лекарственного вещества.
В частности, в каждую лунку добавляют, например, 10 мкл реагента Cell Titer-Glo (приобретенного у Promega), и после равномерного встряхивания измеряют интенсивность хемилюминесценции каждой лунки с помощью флуоресцентного микропланшетного ридера. Принимая концентрацию лекарственного вещества за абсциссу, а интенсивность флуоресценции за ординату, используют программное обеспечение GraphPad Prism для построения кривой доза-эффект лекарственного вещества на основе измеренных значений, и рассчитывают ингибирующая активность лекарственного вещества в отношении пролиферации тестируемых клеток.
При применении первичных опухолевых клеток ПКРП согласно изобретению для скрининга лекарственных средств и в тесте на чувствительность к лекарственным средствам in vitro, явление, когда фидерные клетки в технологии перепрограммирования клеток мешают результатам испытаний, не возникает, поскольку в данной системе нет совместного культивирования клеток. Благодаря росту клеток в 2D-плоскости, взаимодействие с препаратом также происходит быстрее, чем время испытания препарата в органоидной технологии (среднее время воздействия в органоидной технологии составляет 6 дней).
Полезные эффекты изобретения также включают:
(1) вероятность успеха выращивания первичных эпителиальных клеток ПКРП может быть улучшена, с вероятностью успеха более 80%;
(2) могут быть получены эпителиальные клетки ПКРП, первично культивированные in vitro, для воспроизведения патологического фенотипа и гетерогенности пациента-хозяина клеток первичной культуры;
(3) первичные эпителиальные клетки ПКРП представляют собой чистые эпителиальные клетки ПКРП, которым не мешают фибробласты;
(4) состав среды не содержит сыворотки, а значит, на него не влияет качество и количество сыворотки из разных партий;
(5) эпителиальные клетки ПКРП могут быть размножены с высокой эффективностью, до значения 106 эпителиальных клеток ПКРП, в данном случае клетки успешно наращивались в течение примерно двух недель после начала подсчета клеток на уровне 104, а выращенные эпителиальные клетки ПКРП обладают способностью к непрерывному пассированию;
(6) нет необходимости работать на льду и диссоциировать гелеобразный матрикс на этапе пересева, а расщепление и пересев клеток можно завершить в течение 10-15 минут;
(7) стоимость культивирования является контролируемой, поскольку культуральная среда для первичных ПКРП не требует дорогостоящих агонистов Wnt, белков семейства R-спондинов, ингибиторов BMP и подобных факторов, и, таким образом, это упрощение и улучшение существующей культуральной среды для органоидов для первичных эпителиальных клеток ПКРП; и при инокуляции клеток не требуется использовать более высокую концентрацию внеклеточного матрикса для смешивания с первичными клетками с образованием капель геля, вместо этого требуется лишь небольшое количество разбавленного гелеобразного внеклеточного матрикса, что экономит количество дорогостоящего внеклеточного матрикса;
(8) операции удобны: по сравнению с технологией индуцированного условиями репрограммирования клеток, эта технология не требует культивирования или облучения фидерных клеток, что позволяет избежать проблемы, связанной с тем, что качество и количество фидерных клеток из разных партий могут повлиять на эффективность первичной клеточной культуры; а также объекты посева и тестирования при скрининге лекарственных средств представляют собой только первичные эпителиальные клетки ПКРП, без мешающих фидерных клеток в системе совместного культивирования, которые присутствуют в технологии индуцированного условиями репрограммирования клеток; по сравнению с технологией органоподобной культуры, в способе покрытия гелеобразного внеклеточного матрикса, принятом в изобретении, сосуд для культивирования можно подготовить заранее, и нет необходимости заключать клетки в гелеобразный матрикс, как в органоидной технологии; также, этапы операции просты и легки;
(9) эта технология позволяет культивировать и обеспечивать эпителиальные клетки ПКРП в большом количестве и при высокой однородности, что подходит для высокопроизводительного скрининга новых веществ-кандидатов и высокопроизводительных функциональных тестов на чувствительность к лекарственным веществам in vitro для пациентов.
Используя среду для культивирования клеток согласно этому варианту реализации настоящего изобретения, можно культивировать эпителиальные клетки ПКРП, полученные от человека или других млекопитающих, включая опухолевые клетки ПКРП, нормальные эпителиальные клетки пищевода, стволовые эпителиальные клетки ПКРП или ткани, содержащие, по меньшей мере, любые из этих клеток. В то же время культуральную среду согласно изобретению также можно использовать для разработки набора для размножения и культивирования клеток первичной культуры ПКРП in vitro.
Кроме того, клетки, полученные методом культивирования согласно этому варианту реализации настоящего изобретения, можно использовать в регенеративной медицине, в фундаментальных медицинских исследованиях эпителиальных клеток ПКРП, при скрининге реакций на лекарственные вещества и разработке новых лекарств для заболеваний ПКРП и т.п.
Описание чертежей
Фиг. 1А-1Е показано влияние различных факторов культуральной среды на пролиферацию клеток первичной культуры ПКРП; на Фиг. 1F показано влияние культуральной среды, содержащей комбинацию соединения 1 и Y27632 в различных концентрациях, на пролиферацию клеток первичной культуры ПКРП.
На Фиг. 2 показано влияние возрастающих количеств факторов в культуральной среде на пролиферацию клеток первичной культуры ПКРП.
Фиг. 3А-3Н показано влияние концентрации каждого фактора на пролиферацию клеток первичной культуры ПКРП.
Фиг. 4А и 4В представляют собой фотографии опухолевых клеток ПРКП, сделанные под инвертированным микроскопом, которые были выращены из клеток, выделенных из одного клинического образца ткани ПКРП (№0F0062), с использованием культуральной среды FEM согласно изобретению до дня 4 и дня 12, соответственно.
Фиг. 5А и 5В представляют собой микроскопические фотографии клеток, которые были выращены из первичных опухолевых клеток ПКРП, происходящих из одной ткани ПКРП (№0F0065) до дня 11, в условиях покрытия гелеобразный внеклеточным матриксом Matrigel и без покрытия Matrigel, соответственно.
Фиг.6А-6Е представляют собой фотографии клеток, сделанные под инвертированным микроскопом, которые были выращены из клеток, выделенных из одного удаленного хирургическим путем образца ПКРП (№0F0060), в течение 14 дней в пяти различных культуральных средах.
Фиг. 7 представляет собой сравнительную диаграмму эффектов клеточной пролиферации, полученных при культивировании клеток, выделенных из шести удаленных хирургическим путем образцов ПКРП (№0F0056, 0F0060, 0F0061, 0F0062, 0F0071, 0F0075), в течение 16 дней, в условиях пяти различных культуральных сред.
Фиг. 8 представляет собой сравнительную диаграмму кривых роста клеток, полученных при культивировании клеток, выделенных из одного клинического образца ткани ПКРП (№0F0075) в условиях пяти различных культуральных сред.
Фиг. 9A-9D представляют собой микроскопические фотографии клеток, выращенных из клеток, выделенных из одного клинического образца ткани ПКРП (№0Е0075) до 1-го и 9-го пересевов, в условиях культивирования FEM и EPI, соответственно.
Фиг. 10А и 10В представляют собой сравнение результатов иммуногистохимии одного удаленного хирургическим путем образца ПКРП (№0F0053) и опухолевых клеток ПКРП, полученных путем культивирования клеток, выделенных из образца (№0F0053), с культуральной средой FEM согласно изобретению, соответственно.
Фиг. 11A-11D представляют собой сравнение результатов анализа изменения числа копий опухолевых клеток ПКРПм в одном удаленном хирургическим путем образце ПКРП (№0F0025) и после разных пересевов, полученных путем культивирования клеток, выделенных из образца (№0F0025), с культуральной средой FEM изобретения соответственно.
Фиг. 12 представляет собой сравнительную диаграмму кривых роста клеток, полученных при культивировании клеток, выделенных из одного клинического образца ткани ПКРП (№0F0061), в условиях культуральной среды FEM согласно изобретению и культуральных сред, полученных путем вычитания различных компонентов, соответственно.
Фиг. 13А-13Н представляют собой микроскопические фотографии клеток, полученных путем культивирования клеток, выделенных из одного клинического образца ткани ПКРП (№0F0061), до третьего пересева, в условиях культуральной среды FEM согласно изобретению и культуральных сред, полученных путем вычитания различных компонентов, соответственно.
На Фиг. 14А и 14В показаны кривые доза-реакция опухолевых клеток из первичной культуры ПКРП на различные химиотерапевтические лекарственные вещества и лекарственные вещества направленного действия, где опухолевые клетки первичной культуры ПКРП были получены путем выращивания из удаленных хирургическим путем образцов опухолевой ткани двух разных пациентов с ПКРП (№0F0060 и №0F0062) с культуральной средой FEM согласно изобретению, соответственно.
Подробное описание изобретения
В описании характеристик, эпителиальные клетки включают дифференцированные эпителиальные клетки и эпителиальные стволовые клетки, полученные из эпителиальных тканей. Термин «Эпителиальные стволовые клетки» относится к клеткам с долговременной способностью к самообновлению, которые могут дифференцироваться в эпителиальные клетки, и к стволовым клеткам, происходящим из эпителиальных тканей. Примеры эпителиальных тканей включают: роговицу, слизистую оболочку полости рта, кожу, конъюнктиву, мочевой пузырь, почечные канальцы, почки, органы пищеварения (пищевод, желудок, двенадцатиперстную кишку, тонкую кишку (включая тощую и подвздошную кишку), толстую кишку (включая толстую кишку)), печень, поджелудочную железу, молочную железу, слюнную железу, слезную железу, предстательную железу, корень волоса, трахею, легкое и др. Среди прочего, среда для культивирования клеток (культуральная клеточная среда), согласно этому варианту реализации настоящего изобретения, предпочтительно представляет собой среду для культивирования эпителиальных клеток, полученных из пищевода.
Кроме того, в данном описании термин «эпителиальные опухолевые клетки» относится к клеткам, полученным в результате опухолегенеза клеток, происходящих из вышеупомянутых эпителиальных тканей.
В описании характеристик, термин «органоид» относится к трехмерной органоподобной клеточной ткани, образованной путем спонтанной организации и агрегации клеток в контролируемом пространстве с высокой плотностью.
[Примеры получения ингибиторов киназы MST1/2]
В описании характеристик, ингибитор киназы MST1/2 относится к любому ингибитору, который прямо или косвенно отрицательно регулирует передачу сигналов MST1/2. Как правило, ингибиторы киназы MST1/2 снижают активность киназы MST1/2, например, связываясь с ней. Поскольку MST1 и MST2 имеют сходную структуру, ингибиторами киназы MST1/2 могут быть, например, соединения, которые связываются с MST1 или MST2 и снижают их активность.
1. Получение ингибитора киназы MST1/2, соединения 1.
4-((7-(2,6-дифторфенил)-5,8-диметил-6-оксо-5,6,7,8-тетрагидроптеридин-2-ил)амино)бензсульфамид 1

Метил 2-амино-2-(2,6-дифторфенил)ацетат (А2): 2-амино-2-(2,6-дифторфенил)уксусную кислоту (2,0 г) и затем метанол (30 мл) добавляли в круглодонную лабораторную колбу с последующим добавлением по каплям тионилхлорида (1,2 мл) на бане со льдом. Реакция реакционной системы осуществлялась в течение ночи при 85°С. После завершения реакции систему выпаривали при пониженном давлении, чтобы высушить растворитель, и полученное белое твердое вещество непосредственно использовали на следующей стадии.
Метил 2-((2-хлор-5-нитропимидин-4-ил)амино)-2-(2,6-дифторфенил)ацетат (A3): метил 2-амино-2-(2,6-дифторфенил)ацетат (2 г), а затем ацетон (30 мл) и карбонат калия (2,2 г) добавляли в круглодонную лабораторную колбу, после чего систему охлаждали до -10°С на ледяной солевой бане, а затем медленно добавляли раствор 2,4-дихлор-5-нитропимидина (3,1 г) в ацетоне. Реакционную систему перемешивали в течение ночи при комнатной температуре. После завершения реакции реакционную смесь фильтровали, растворитель удаляли из фильтрата при пониженном давлении и остаток очищали с помощью колоночной хроматографии на силикагеле под давлением с получением соединения A3. Жидкостная хромато-масс-спектрометрия, LC/MS: М+Н 359.0.
2-хлор-7-(2,6-дифторфенил)-7,8-дигидроптеридин-6(5Н)-он (А4): в круглодонную лабораторную колбу добавляли метил 2-((2-хлор-5-нитропимидин-4-ил)амино)-2-(2,6-дифторфенил)ацетат (2,5 г), затем уксусную кислоту (50 мл) и порошок железа (3,9 г). Реакционную систему перемешивали при 60°С в течение двух часов. После завершения реакции реакционную систему выпаривали при пониженном давлении, чтобы высушить растворитель, и полученную смесь нейтрализовали до щелочной реакции насыщенным раствором бикарбоната натрия и экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли и сушили безводным сульфатом натрия. Органическую фазу фильтровали и упаривали досуха при пониженном давлении, для получения неочищенного продукта. Неочищенный продукт промывали диэтиловым эфиром с получением соединения А4. Жидкостная хромато-масс-спектрометрия, LC/MS: М+Н 297.0.
2-хлор-7-(2,6-дифторфенил)-5,8-диметил-7,8-дигидроптеридин-6(5Н)-он (А5): 2-хлор-7-(2,6-дифторфенил)-7,8-дигидроптеридин-6(5Н)-он (2 г) и N,N-диметилацетамид (10 мл) добавляли в круглодонную лабораторную колбу и охлаждали до -35°С с последующим добавлением йодметана (0,9 мл), а затем гидрида натрия (615 мг), и реакционную систему перемешивали в течение двух часов. После завершения реакции реакционную смесь гасили водой и экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли, соответственно, и сушили безводным сульфатом натрия. Органическую фазу фильтровали и упаривали досуха при пониженном давлении, для получения неочищенного продукта. Неочищенный продукт промывали диэтиловым эфиром с получением соединения А5. Жидкостная хромато-масс-спектрометрия, LC/MS: М+Н 325.0.
4-((7-(2,6-дифторфенил)-5,8-диметил-6-оксо-5,6,7,8-тетрагидроптеридин-2-ил)амино)бензсульфамид (1): 2-хлор-7-(2,6-дифторфенил)-5,8-диметил-7,8-дигидроптеридин-6(5Н)-он (100 мг), сульфаниламид (53 мг), п-толуолсульфокислота(53 мг) и вторичный бутанол (5 мл) добавляли в круглодонную лабораторную колбу. Реакционную систему перемешивали при 120°С в течение ночи. После завершения реакции реакционную смесь фильтровали и промывали метанолом и диэтиловым эфиром с получением соединения 1. Жидкостная хромато-масс-спектрометрия, LC/MS: М+Н 461,1.
2. Получение других соединений-ингибиторов MST1/2 согласно изобретению.
Другие соединения-ингибиторы MST1/2 согласно изобретению были синтезированы способом, аналогичным способу синтеза соединения 1, и их структуры и данные масс-спектра показаны в следующей таблице.


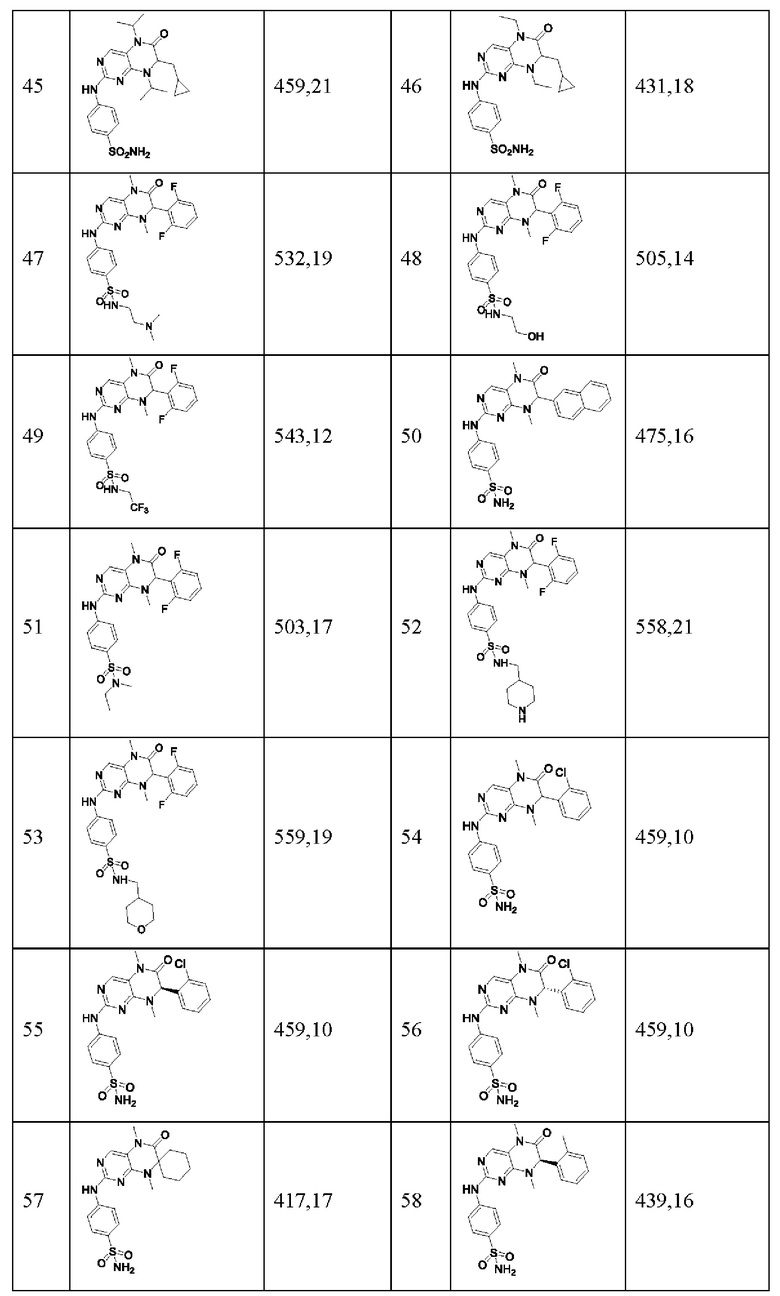

[Пример 1]
Выделение первичных эпителиальных клеток ПКРП человека
Образцы ткани ПКРП были получены из опухолевых тканей трех информированных и давших согласие пациентов с ПКРП, при удалении хирургическим путем, а именно, образцы №0F0060, 0F0061 и 0F0062. Один из образцов (№0F0060) будет описан ниже.
Вышеупомянутые образцы тканей были собраны в течение получаса после хирургического иссечения или биопсии. В частности, в стерильных условиях образцы ткани вырезали из ненекротических участков объемом более 0,5 см3 и помещали в 4 мл предварительно охлажденной транспортной жидкости для тканей (конкретный состав показан в Таблице 1). Транспортную жидкость помещали в пластиковую стерильную пробирку для криоконсервации с крышкой (приобретенной у Guangzhou Jet Bio-Filtration Co., Ltd.) и транспортировали в лабораторию с использованием системы холодовой цепи (0-10°С).

В ламинарном боксе биологической защиты образец ткани (№0F0060) переносили в чашку для культивирования клеток диаметром 100 мм (приобретенную у NEST). Образец ткани промывали тканевой транспортной жидкостью. Остатки крови на поверхности образца ткани смывали. Излишки тканей, такие как жир на поверхности образца ткани, удаляли. Промытый образец ткани переносили в другую новую культуральную посуду диаметром 100 мм; добавляли 2 мл транспортной жидкости и стерильным лезвием скальпеля и пинцетом разделяли образец ткани на фрагменты ткани объемом менее 3 мм3.
Фрагменты образца ткани переносили в центрифужную пробирку объемом 15 мл и центрифугировали при 1500 об/мин в течение 4 минут в настольной центрифуге (Sigma, 3-18K); после удаления супернатанта добавляли тканевую транспортную жидкость и раствор для ферментативной дезагрегации тканей в соотношении 1:1 (дозировка составляет около 5 мл раствора для ферментативной дезагрегации тканей на 10 мг ткани; точный состав показан в Таблице 2); затем образец был пронумерован и запечатан герметизирующей пленкой, а затем выдержан в шейкере с постоянной температурой (Zhichu Instrument ZQLY-180N) при 37°С, 300 оборотов; завершенность ферментативной дезагрегации, определяли путем наблюдения через каждый 1 час.
После ферментативной дезагрегации непереваренные фрагменты ткани фильтровали через клеточный сетчатый фильтр с размером ячеек 70 мкм; тканевые фрагменты на сетке фильтра промывали тканевой транспортной жидкостью; оставшиеся клетки смывали в центрифужную пробирку и центрифугировали при 1500 об/мин в течение 4 минут.
После удаления супернатанта наблюдали за оставшимися скоплениями клеток, чтобы определить, остались ли клетки крови; при наличии клеток крови добавляли 3 мл лизата клеток крови (приобретенного у Sigma), который затем хорошо перемешивали, лизировали при 4°С в течение 15 минут, при встряхивании и тщательном перемешивании каждые 5 минут; после лизиса полученный продукт извлекали и центрифугировали при 1500 об/мин в течение 4 минут. Супернатант отбрасывали, чтобы получить дезагрегированные и выделенные клетки первичной культуры ПКРП, к которым добавляли основную среду (ВМ) для ресуспендирования. Основную среду готовили путем добавления 0,2 об.% Примоцина (приобретенного у Invivogen, концентрация 50 мг/мл) к коммерческой среде DMEM/F-12 до получения конечной концентрации 100 мкг/мл. Общее количество клеток составило 2 280 000, что было получено путем подсчета с помощью счетчика для визуализации клеток в потоке (JIMBIO FIL, Jiangsu Jimbio Technology Co., Ltd.).
Два других образца опухолевой ткани ПКРП были выделены в соответствии с тем же способом, описанным выше, и общее количество клеток составило 1 470 000 (0F0061) и 2 680 000 (0F0062), соответственно.
[Пример 2]
Оптимизация культуральной среды для первичных эпителиальных клеток ПКРП (1) Влияние различных факторов
Гелеобразный внеклеточный матрикс (Matrigel®) (производства BD Biosciences) разбавляли в соотношении 1:100 в среде DMEM/F12, не содержащей сыворотки, для приготовления раствора внеклеточного матрикса, который добавляли в 48-луночный культуральный планшет по 500 мкл/лунку до полного покрытия дна лунок культурального планшета. Полученную смесь оставляли на 1 час в инкубаторе при 37°С. Через 1 час раствор внеклеточного матрикса удаляли, с получением планшета, покрытого матриксом Matrigel.
Приготовление основной среды (сокращенно ВМ): ВМ готовили путем добавления 0,2 об.% Примоцина (приобретенного у Invivogen, концентрация 50 мг/мл) к коммерческой среде DMEM/F-12 для получения конечной концентрации 100 мкг/мл.
Затем к основной среде (ВМ) добавляли различные виды и концентрации дополнительных факторов (Таблица 3) для приготовления культуральных сред для эпителиальных клеток ПКРП, содержащих различные дополнительные компоненты.
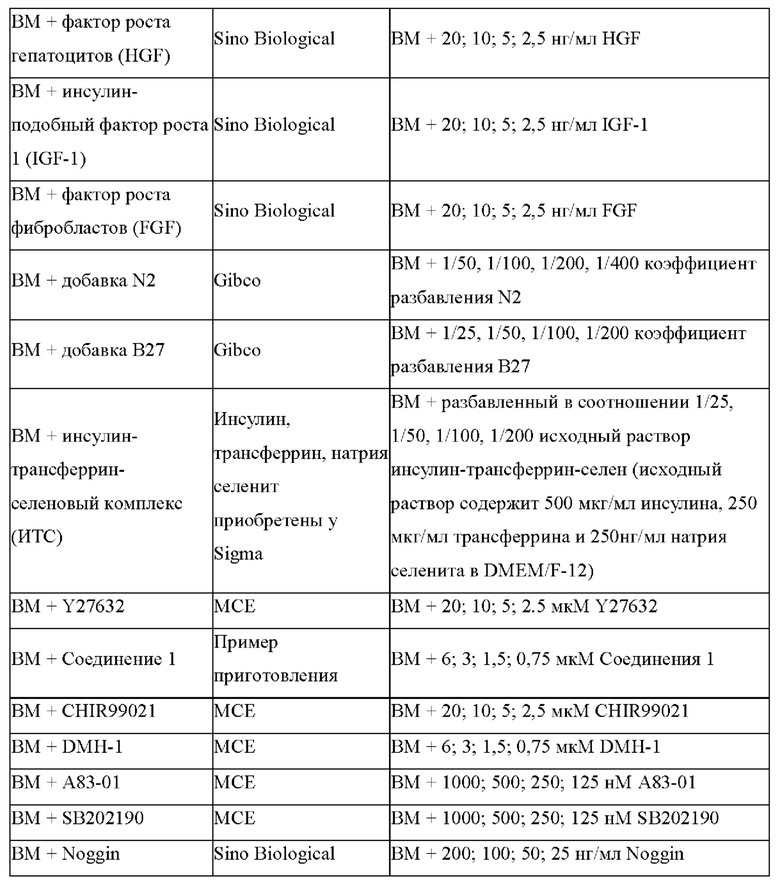
Культуральные среды с различными компонентами добавляли в объеме 500 мкл/лунку в 48-луночные планшеты, покрытые гелеобразный внеклеточным матриксом (Matrigel). Опухолевые клетки ПКРП (№0F0064), выделенные из ткани ПКРП в соответствии с тем же методом, описанным в Примере 1, были инокулированы в 48-луночный культуральный планшет, покрытый матриксом Matrigel, при плотности клеток 2×104 клеток/см2. После дезинфекции поверхности планшет был помещен в инкубатор с температурой 37°С, 5% СО2 (приобретенный у Thermo Fisher), с таким расчетом, чтобы равное количество свежевыделенных опухолевых клеток ПКРП (№0F0064) культивировалось в различных по составу средах. Культуральные среды обновляли каждые 4 дня после начала культивирования. Через 12 дней культивирования проводили подсчет клеток. В качестве контроля опыта использовали основную среду (ВМ) без каких-либо добавок. Результаты представлены на Фиг. 1А-1Е. Ордината на каждом рисунке представляет собой отношение количества клеток, полученных после культивирования в различных средах, к количеству клеток, полученных после культивирования в основной среде ВМ. Как показано на рисунках, добавление различных концентраций различных факторов, как показано в Таблице 3, к среде ВМ оказывает различное влияние на пролиферацию клеток. Среди прочего, добавка В27, добавка N2, комплекс инсулин-трансферрин-селен, эпидермальный фактор роста, фактор роста гепатоцитов, инсулиноподобный фактор роста 1, Соединение 1 и Y27632 оказывают стимулирующее действие на пролиферацию клеток в определенных диапазонах концентраций.
(2) Эффекты комбинации Y27632 и Соединения 1.
Гелеобразный внеклеточный матрикс (Matrigel®) (приобретенный у BD Biosciences) разбавляли в соотношении 1:100 в бессывороточной среде DMEM/F12 для приготовления раствора внеклеточного матрикса, который добавляли в 48-луночный культуральный планшет по 500 мкл/лунку до полного покрытия дна лунок культурального планшета. Полученную смесь оставляли на 1 час в инкубаторе при 37°С. Через 1 час раствор внеклеточного матрикса удаляли, с получением планшета, покрытого матриксом Matrigel.
Различные концентрации Y27632 и Соединения 1 (Таблица 4) добавляли к основной среде ВМ, и таким образом получали культуральные среды для эпителиальных клеток ПКРП, содержащие различные дополнительные компоненты.
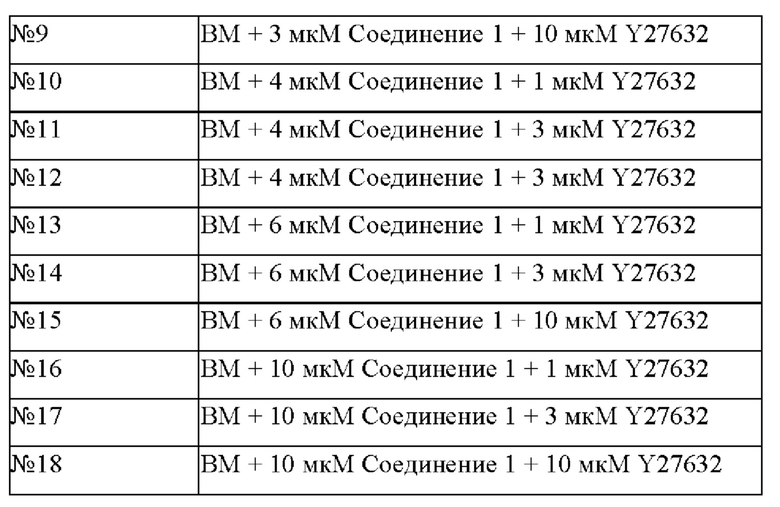
Культуральные среды с различными компонентами добавляли в объеме 500 мкл/лунку в 48-луночные планшеты, покрытые гелеобразный внеклеточным матриксом (Matrigel). Опухолевые клетки ПКРП (№0F0063), выделенные из ткани ПКРП в соответствии с тем же методом, который описан в Примере 1, были инокулированы в 48-луночный культуральный планшет, покрытый матриксом Matrigel, при плотности клеток 2×104 клеток/см2. После дезинфекции поверхности планшет помещали в инкубатор с температурой 37°С, 5% СО2 (приобретенный у Thermo Fisher), с таким расчетом, чтобы равное количество свежевыделенных опухолевых клеток ПКРП (№0F0063) культивировалось в различных по составу средах. Культуральные среды обновляли каждые 4 дня после начала культивирования. Через 12 дней культивирования проводили подсчет клеток. В качестве контроля опыта использовали основную среду ВМ. Результаты представлены на Фиг. 1F. Как показано на рисунке, комбинации различных концентраций Y27632 и Соединения 1 оказывают определенный синергетический эффект на пролиферацию клеток, при этом комбинация концентраций 10 мкМ Y27632 и 3 мкМ Соединения 1 оказывает наиболее предпочтительное действие.
(3) Влияние возрастающих количеств факторов в культуральных средах на пролиферацию первичных клеток ПКРП, полученных способом согласно изобретению
Гелеобразный внеклеточный матрикс (Matrigel®) (приобретенный у BD Biosciences) разбавляли в соотношении 1:100 в бессывороточной среде DMEM/F12 для приготовления раствора внеклеточного матрикса, который добавляли в 48-луночный культуральный планшет по 500 мкл/лунку до полного покрытия дна лунок культурального планшета. Полученную смесь оставляли на 1 час в инкубаторе при 37°С. Через 1 час раствор внеклеточного матрикса удаляли, с получением планшета, покрытого матриксом Matrigel.
Различные малые молекулы, добавки и факторы роста (Таблица 5) последовательно добавляли к основной среде ВМ, соответственно, с получением культуральных сред для эпителиальных клеток ПКРП, содержащие различные дополнительные компоненты.

Культуральные среды с различными компонентами добавляли в объеме 500 мкл/лунку в 48-луночные планшеты, покрытые гелеобразным внеклеточным матриксом (Matrigel), при этом в качестве контроля опыта использовали среду ВМ. Опухолевые клетки ПКРП (№0F0065), выделенные из ткани ПКРП в соответствии с тем же методом, описанным в Примере 1, были инокулированы в 48-луночный культуральный планшет, покрытый матриксом Matrigel, при плотности клеток 2×104 клеток/см2. После дезинфекции поверхности планшет помещали в инкубатор с температурой 37°С, 5% СО2 (приобретенный у Thermo Fisher), с таким расчетом, чтобы равное количество свежевыделенных опухолевых клеток ПКРП (№0F0065) культивировалось в различных по составу средах. Через 10 дней культивирования проводили подсчет клеток. Результаты представлены на Фиг. 2. Как показано на рисунке, было определено, что среда №8 является наиболее предпочтительной культуральной средой в этом патенте для культивирования и размножения первичных клеток ПКРП (далее сокращенно FEM). На основании этого, дальнейшее добавление некоторых факторов или низкомолекулярных ингибиторов не оказывало существенного влияния на стимуляцию пролиферации клеток.
(4) Эффекты различных концентраций дополнительных факторов на пролиферацию клеток первичной культуры ПКРП, полученных в изобретении
Гелеобразный внеклеточный матрикс (Matrigel®) (производства BD Biosciences) разбавляли в соотношении 1:100 в среде DMEM/F12, не содержащей сыворотки, с получением раствора внеклеточного матрикса, который добавляли в 48-луночный культуральный планшет по 200 мкл/лунку до полного покрытия дна лунок культурального планшета. Полученную смесь оставляли на 1 час в инкубаторе при 37°С. Через 1 час раствор внеклеточного матрикса удаляли, с получением планшета, покрытого матриксом Matrigel.
Приготовление культуральной среды для первичных эпителиальных клеток ПКРП согласно изобретению (сокращенно FEM): к основной среде (ВМ) добавляли: эпидермальный фактор роста EGF до конечной концентрации 50 нг/мл, фактор роста гепатоцитов HGF до конечной концентрации 10 нг/мл, исходный раствор с комплексом инсулин-трансферрин-селен (ITS) до конечного разведения в соотношении 1:50 (инсулин до конечной концентрации 10 мкг/мл, трансферрин до конечной концентрации 5 мкг/мл и селенит натрия до конечной концентрации 5 нг/мл в среде FEM), добавку В27 до конечного разведения в соотношении 1:50, соединение 1 до конечной концентрации 3 мкМ, Y27632 до конечной концентрации 10 мкМ, ингибитор TGFβ1 А83- 01 до конечной концентрации 500 нМ и ингибитор Р38/МАРК SB202190 до конечной концентрации 500 нМ для приготовления культуральной среды для первичных эпителиальных клеток ПКРП.
Эпителиальные клетки ПКРП, источником которых являлась опухолевая ткань, выделяли и получали из опухолевой ткани пациента с ПКРП (образец №0F0065) с использованием того же метода, что и в Примере 1. Затем, опухолевые клетки ПКРП, источником которых являлась опухолевая ткань, были подсчитаны с помощью счетчика для визуализации клеток в потоке (JIMBIO FIL, Jiangsu Jimbio Technology Co., Ltd.) для получения общего числа клеток. Затем клетки были инокулированы в покрытый матриксом Matrigel® (приобретенный у BD Biosciences) 12-луночный планшет в плотности 4×104 клеток/см2. 2 мл приготовленной культуральной среды FEM для первичных эпителиальных клеток ПКРП добавили в 12-луночный планшет, который затем был помещен в условия для культивирования при 37°С, 5% СО2, в инкубатор (приобретенный у Thermo Fisher). Когда клетки в культуральном планшете вырастали и покрывали около 80% площади поверхности дна, надосадочную жидкость среды удаляли и в 12-луночный планшет добавляли 500 мкл 0,05% трипсина (приобретенного у Gibco) для дезагрегации клеток; клетки инкубировали при 37°С в течение 10 минут до полной дезагрегации клеток, которая наблюдалась под микроскопом (EVOS М500, Invitrogen); затем ферментативную дезагрегацию останавливали, используя 1 мл культурального раствора DMEM/F12, содержащего 5% (об./об.) эмбриональной бычьей сыворотки, 100 Ед/мл пенициллина и 100 мкг/мл пенициллина; полученную смесь собирали в центрифужную пробирку объемом 15 мл и центрифугировали при 1500 об/мин в течение 4 минут, а затем удаляли надосадочную жидкость. Центрифугированные клеточные осадки ресуспендировали в основной среде ВМ и подсчитывали с помощью счетчика для визуализации клеток в потоке (JIMBIO FIL, Jiangsu Jimbio Technology Co., Ltd.) для получения общего числа клеток. Полученные клетки использовали в следующих экспериментах по культивированию.
Далее для экспериментов готовили следующие 8 культуральных сред с разным составом:
Состав 1: композиция среды FEM без добавки В27;
Состав 2: композиция среды FEM без комплекса инсулин-трансферрин-селен;
Состав 3: композиция среды FEM без эпидермального фактора роста;
Состав 4: композиция среды FEM без фактора роста гепатоцитов;
Состав 5: композиция среды FEM без Y27632;
Состав 6: композиция среды FEM без Соединения 1;
Состав 7: композиция среды FEM без А83-01;
Состав 8: композиция среды FEM без SB202190.
Суспензию дезагрегированных клеток разбавляли вышеуказанными составами 1-8, соответственно, и высевали в 48-луночный планшет в количестве 10000 клеток и в объеме 250 мкл на лунку.
При использовании среды Состава 1, в 48-луночный планшет с инокулированными клетками первичной культуры добавляли приготовленную добавку В27 по 250 мкл на лунку таким образом, чтобы конечные концентрации добавки В27 составляли 1:200, 1:100, 1:50 и 1:25, соответственно; среду Состава 1 использовали в качестве контрольной лунки (ВС).
При использовании среды Состава 2 в 48-луночный планшет с инокулированными клетками первичной культуры добавляли приготовленный комплекс инсулин-трансферрин-селен по 250 мкл на лунку таким образом, чтобы конечные концентрации исходного раствора комплекса инсулин-трансферрин-селен были 1:200, 1:100, 1:50 и 1:25, соответственно (соответствует конечным концентрациям инсулина/трансферрина/селенита натрия: 2,5 мкг/мл, 1,25 мкг/мл, 1,25 нг/мл; 5 мкг/мл, 2,5 мкг/мл, 2,5 нг/мл; 10 мкг/мл, 5 мкг/мл, 5 нг/мл; и 20 мкг/мл, 10 мкг/мл, 10 нг/мл, соответственно); среду Состава 2 использовали в качестве контрольной лунки (ВС).
При использовании среды Состава 3 в 48-луночный планшет с инокулиро ванными клетками первичной культуры добавляли приготовленный эпидермальный фактор роста по 250 мкл на лунку таким образом, чтобы конечные концентрации эпидермального фактора роста составляли 100 нг/мл, 50 нг/мл/мл, 25 нг/мл и 12,5 нг/мл, соответственно; среду Состава 3 использовали в качестве контрольной лунки (ВС).
При использовании среды Состава 4 в 48-луночный планшет с инокулированными клетками первичной культуры добавляли приготовленный фактор роста гепатоцитов по 250 мкл на лунку таким образом, чтобы конечные концентрации фактора роста гепатоцитов составляли 20 нг/мл, 10 нг/мл, 5 нг/мл и 2,5 нг/мл, соответственно; среду Состава 4 использовали в качестве контрольной лунки (ВС).
При использовании среды Состава 5 в 48-луночный планшет с инокулированными клетками первичной культуры добавляли приготовленный Y27632 по 250 мкл на лунку таким образом, чтобы конечные концентрации Y27632 составляли 20 мкМ, 15 мкМ, 12,5 мкМ, 10 мкМ, 7,5 мкМ, 5 мкМ и 2,5 мкМ, соответственно; среду Состава 5 использовали в качестве контрольной лунки (ВС).
При использовании среды Состава 6 в 48-луночный планшет с инокулированными клетками первичной культуры добавляли приготовленное Соединение 1 по 250 мкл на лунку таким образом, чтобы конечные концентрации Соединения 1 составляли 6 мкМ, 5 мкМ, 4 мкМ, 3 мкМ, 2 мкМ, 1,5 мкМ и 0,75 мкМ, соответственно; среду Состава 6 использовали в качестве контрольной лунки (ВС).
При использовании среды Состава 7 в 48-луночный планшет с инокулированными клетками первичной культуры добавляли приготовленный А83-01 по 250 мкл на лунку таким образом, чтобы конечные концентрации А83-01 составляли 1000 нМ, 500 нМ, 250 нМ и 125 нМ, соответственно; среду Состава 7 использовали в качестве контрольной лунки (ВС).
При использовании среды Состава 8 в 48-луночный планшет с инокулированными первичными клетками добавляли приготовленный SB202190 по 250 мкл на лунку таким образом, чтобы конечные концентрации SB202190 составляли 1000 нМ, 500 нМ, 250 нМ и 125 нМ, соответственно; среду Состава 8 использовали в качестве контрольной лунки (ВС).
После того, как клетки разрастались примерно до 85% площади 48 лунок, клетки подвергали ферментативной дезагрегации и подсчитывали, относительно количества клеток в контрольной лунке (ВС), и результаты были показаны на Фиг. 3А-3Н. На каждом из Фиг. 3А-3Н, соотношение представляет собой отношение числа клеток первого пересева, культивированных с использованием каждой культуральной среды, к числу клеток первого пересева, культивированных в соответствующей контрольной лунке. Если значение отношения больше 1 - это указывает на то, что стимулирующее пролиферацию действие приготовленной среды, содержащей различные концентрации факторов или низкомолекулярных соединений, предпочтительнее, чем действие среды контрольной лунки; если значение отношения меньше 1 - это указывает на то, что стимулирующее пролиферацию действие приготовленной среды, содержащей разные концентрации факторов или низкомолекулярных соединений, меньше, чем у среды контрольной лунки.
Согласно результатам, показанным на Фиг. 3А-3Н, объемная концентрация добавки В27 в культуральной среде предпочтительно составляет 1:25-1:200, более предпочтительно 1:25-1:50; объемная концентрация комплекса инсулин-трансферрин-селен предпочтительно составляет 1:25-1:200, более предпочтительно 1:25-1:100 (соответствует конечным концентрациям инсулин/трансферрин/селенит натрия 2,5-20 мкг/мл, 1,25-10 мкг/мл, 1,25-10 нг/мл, соответственно, и более предпочтительно 5-20 мкг/мл, 2,5-10 мкг/мл, 2,5-10 нг/мл, соответственно); количество эпидермального фактора роста предпочтительно составляет 12,5 нг/мл-100 нг/мл, более предпочтительно 50 нг/мл-100 нг/мл; количество фактора роста гепатоцитов предпочтительно составляет 2,5 нг/мл-20 нг/мл, более предпочтительно 10 нг/мл-20 нг/мл; количество Y27632 предпочтительно составляет 2,5 мкМ-15 мкМ и более предпочтительно 7,5 мкМ-12,5 мкМ; количество Соединения 1 предпочтительно составляет 0,75 мкМ-6 мкМ и более предпочтительно 2 мкМ-6 мкМ; количество А83-01 предпочтительно составляет 125-500 нМ и более предпочтительно 250-500 нМ; количество SB202190 предпочтительно составляет от 125 нМ до 500 нМ и более предпочтительно от 250 нМ до 500 нМ.
[Пример 3]
Культивирование первичных эпителиальных клеток ПКРП человека (1) Культивирование первичных опухолевых клеток ПКРП, полученных из ткани ПКРП. Эпителиальные клетки ПКРП, источником которых являлась опухолевая ткань, выделяли и получали из опухолевой ткани пациента с ПКРП (образец №0F0062) с использованием того же метода, что и в Примере 1. Затем опухолевые клетки ПКРП, источником которых являлась опухолевая ткань, были подсчитаны с помощью счетчика для визуализации клеток в потоке (JIMBIO FIL, Jiangsu Jimbio Technology Co., Ltd.) для получения общего числа клеток. Затем клетки были инокулированы в покрытый матриксом Matrigel® (приобретенный у BD Biosciences) 12-луночный планшет при плотности 4×104 клеток/см2. 2 мл приготовленной культуральной среды FEM для первичных эпителиальных клеток ПКРП добавили в 12-луночный планшет, который затем был помещен в условия для культивирования при 37°С, 5% СО2, в инкубатор (приобретенный у Thermo Fisher).
Фиг. 4А представляет собой микроскопическое изображение (сфотографированное с помощью 40-кратного инвертированного фазово-контрастного микроскопа) клеток, которые культивировали до 4-го дня после инокуляции при плотности 4×104 клеток/см2 в 12-луночном планшете, покрытом матриксом Matrigel, в соответствии с настоящим Примером. Наблюдение под микроскопом показывает, что культивированные опухолевые клетки первичной культуры ПКРП, полученные из опухолевой ткани, были высокой чистоты и не содержали фибробластов. Фиг. 4В представляет собой микроскопическое изображение (сфотографированное с помощью 40-кратного инвертированного фазово-контрастного микроскопа) клеток, которые культивировали до 12-го дня после инокуляции, в соответствии с настоящим Примером. Из Фиг. 4А и 4В видно, что образование явного клона можно наблюдать под микроскопом, когда выделенные клетки первичной культуры ПКРП культивировали in vitro в течение 4 дней, и число клеток значительно увеличивалось после 12 дней выращивания, что позволяет предположить, что технология данного изобретения является эффективной технологией для выращивания эпителиальных клеток ПКРП in vitro.
(2) Сравнение результатов культивирования первичных опухолевых клеток ПКРП, полученных из ткани ПКРП, в условиях покрытия гелеобразным внеклеточным матриксом и без него.
Опухолевые клетки первичной культуры ПКРП (№0F0065), полученные из опухолевых тканей, выделяли из опухолевых тканей одного пациента с ПКРП, используя тот же метод, что и в Примере 1. Затем равные количества (4×104 клеток/см2) первичных опухолевых клеток ПКРП 0F0065 инокулировали в 12-луночный планшет, покрытый матриксом Matrigel® (приобретен у BD Biosciences), а также в 12-луночный планшет, без какой-либо обработки, соответственно. 2 мл приготовленной культуральной среды FEM для первичных эпителиальных клеток ПКРП добавляли в 12-луночные планшеты, которые затем помещали в инкубатор с 37°С, 5% СО2 (приобретен у Thermo Fisher) для культивирования после дезинфекции. Фиг. 5А и 5B представляют собой микроскопические изображения (сфотографированные с помощью 100-кратного инвертированного фазово-контрастного микроскопа) первичных опухолевых клеток ПКРП 0F0065, полученных из ткани ПКРП, которые культивировали до 11-го дня в условиях покрытия матриксом Matrigel и без покрытия Matrigel, соответственно. Из рисунков видно, что плотность клеток и число клеток на Фиг. 5А (с покрытием матриксом Matrigel) выше, чем на Фиг. 5В (без покрытия матриксом Matrigel). В то же время на Фиг. 5В наблюдается небольшое число стареющих клеток (клеток с более крупными клеточными телами), тогда как на Фиг. 5А старения клеток нет. Следовательно, можно подтвердить, что культуральный планшет, покрытый матриксом Matrigel, более благоприятен для пролиферации опухолевых клеток ПКРП, чем культуральный планшет без какой-либо обработки.
[Пример 4]
Влияние различных культуральных сред на стимулирование пролиферации первичных опухолевых клеток ПКРП, полученной из опухолевой ткани ПКРП
(1) Сравнение влияния различных культуральных сред на образование клеточных клонов первичной культуры и эффекты пролиферации клеток первичной культуры.
Культуральную среду FEM для первичных эпителиальных клеток ПКРП готовили тем же способом, что и в Примере 2, а основную среду ВМ готовили в качестве контроля. В качестве другого контроля дополнительно готовили культуральную среду FM для технологии индуцированного условиями перепрограммирования клеток. Об этапах подготовки см. у Liu et al., Nat Protoc, 12(2): 439-451, 2017. Состав культуральной среды показан в Таблице 6. Параллельно, в качестве дополнительного контроля готовили культуральную среду КМ для клеток первичной карциномы пищевода. Об этапах подготовки см. у Karin J. Purdie et al., Cancer Cell Culture: Methods and Protocols, Second Edition, Methods in Molecular Biology, vol. 731, 151-159, 2011. Состав культуральной среды показан в Таблице 7. Кроме того, в качестве дополнительного контроля у Stemcell была приобретена коммерческая среда EpiCult™ Plus Medium (далее именуемая как «среда EPI»), и состав культуральной среды показан в Таблице 8.


С использованием того же метода, что и в Примере 1, были получены опухолевые клетки первичной культуры ПКРП (№0F0060), источником которых являлись опухолевые ткани ПКРП. Затем клетки культивировали при одинаковой плотности (4×104 клеток/см2) при следующих пяти условиях культивирования:
A. Технология изобретения: опухолевые клетки первичной культуры из ПКРП инокулировали в 24-луночный планшет, покрытый Matrigel® (производства BD Biosciences) при плотности 4×104 клеток/см2, культивировали с использованием 2 мл культуральной среды FEM настоящего изобретения для первичных эпителиальных клеток ПКРП;
B. Технология индуцированного условиями перепрограммирования клеток: опухолевые клетки первичной культуры из ПКРП инокулировали на слой мышиных фибробластов клеточной линии J2, обработанный гамма-лучами (приобретено у Kerafast) в плотности 4×104 клеток/см2, культивировали в 24-луночном планшете с использованием среды FM для индуцированного условиями перепрограммирования клеток (подробное описание этапов см. Liu et al., Am J Pathol, 183(6): 1862-1870, 2013);
C. Опухолевые клетки первичной культуры из ПКРП инокулировали в покрытый Matrigel 24-луночный планшет® (производства BD Biosciences) при плотности 4×104 клеток/см2, и культивировали в 24-луночном планшете с использованием 2 мл культуральной среды KM;
D. Опухолевые клетки первичной культуры из ПКРП инокулировали в покрытый Matrigel 24-луночный планшет® (производства BD Biosciences) при плотности 4×104 клеток/см2, и культивировали в 24-луночном планшете с использованием 2 мл коммерческой среды EPI;
E. Опухолевые клетки первичной культуры из ПКРП инокулировали в покрытый Matrigel 24-луночный планшет® (производства BD Biosciences) при плотности 4×104 cells/cm2, и культивировали в 24-луночном планшете с использованием 2 мл основной среды ВМ.
Для указанных выше пяти культур клетки выращивали в пяти условиях культивирования, в которых среды обновляли каждые 4 дня. В то же время наблюдали образование клеточного клона и статус пролиферации клеток при культивировании в каждой среде в 24-луночном планшете, а состояние роста клеток регистрировали путем фотографирования с помощью микроскопа (EVOS М500, Invitrogen).
Что касается первичных опухолевых клеток ПКРП (№0F0060), культивируемых по технологии изобретения, когда клетки в культуральном планшете вырастали и покрывали около 80% площади дна, надосадочную жидкость среды удаляли и в 24-луночный планшет добавляли 500 мкл 0,05% трипсина (приобретенного у Gibco) для дезагрегации клеток; клетки инкубировали при 37°С в течение 10 минут до полной дезагрегации клеток, которая наблюдалась под микроскопом (EVOS М500, Invitrogen); затем ферментативную дезагрегацию останавливали, используя 1 мл культурального раствора DMEM/F12, содержащего 5% (об./об.) эмбриональной бычьей сыворотки, 100 Ед/мл пенициллина и 100 мкг/мл пенициллина; полученную смесь собирали в центрифужную пробирку объемом 15 мл и центрифугировали при 1500 об/мин в течение 4 минут, а затем удаляли надосадочную жидкость. Центрифугированные клеточные осадки ресуспендировали в культуральной среде согласно изобретению и подсчитывали с помощью счетчика для визуализации клеток в потоке (JIMBIO FIL, Jiangsu Jimbio Technology Co., Ltd.) для получения общего числа клеток, которое составило 364000. Клетки, выращенные при других четырех условиях культивирования, подвергали ферментативной дезагрегации и подсчитывали с помощью того же операционного процесса, который описан выше. Общее количество клеток, культивируемых с использованием сред FM, KM, EPI и ВМ, составило 315000, 91000, 98000 и 84000, соответственно.
Фотографии клеток на Фиг. 6А-6Е представляют собой микроскопические фотографии (под 40× инвертированным фазово-контрастным микроскопом) образца №0F0060, который культивировали до 14-го дня в пяти различных условиях культивирования: где Фиг. 6А представляет собой микроскопическую фотографию 0F0060, культивируемого до 14-го дня с использованием базовой среды ВМ; Фиг. 6В представляет собой микроскопическую фотографию 0F0060, культивируемого до 14-го дня с использованием культуральной среды FEM согласно изобретению; Фиг. 6С представляет собой микроскопическую фотографию 0F0060, культивируемого до 14-го дня с использованием культуральной среды KM; Фиг. 6D представляет собой микроскопическую фотографию 0F0060, культивируемого до 14-го дня с использованием коммерческой среды EPI; и Фиг. 6Е представляет собой микроскопическую фотографию 0F0060, культивируемого до 14-го дня с использованием среды FM для индуцированного условиями перепрограммирования клеток. Из рисунков видно, что образец 0F0060 не мог образовывать клеточные клоны после 14 дней культивирования на основной среде ВМ (6А); при культивировании на культуральных средах KM (6С) и EPI (6D) в течение 14 дней образовалось лишь несколько клонов клеток с плохим клеточным статусом; клетки, культивированные в среде FM для индуцированного условиями перепрограммирования клеток (6Е) в течение 14 дней, размножались до определенной степени, но плотность клеток и количество клеток не были сопоставимы с таковыми, полученными в среде культивирования FEM согласно изобретению.
Фиг. 7 представляет собой сравнительную диаграмму эффектов клеточной пролиферации, полученных при культивировании клеток первичной культуры ПКРП, выделенных из образцов тканей шести пациентов с ПКРП (№0F0056, 0F0060, 0F0061, 0F0062, 0F0071, 0F0075), согласно Примеру 1, на протяжении 16 дней выращивания в условиях пяти различных культуральных сред, где√ означает умеренную способность к образованию клонов и эффект стимулирования пролиферации, √√ означает значительную способность к образованию клонов и эффект стимулирования пролиферации, × означает отсутствие образования клонов, а НТ означает "не тестировалось". Из изображения следует, что культуральная среда согласно изобретению имеет значительное превосходство над другими четырьмя условиями культивирования с точки зрения способности к образованию клонов и стимулирующего действия на пролиферацию клеток при культивировании первичных культур, источником которых являются ткани ПКРП.
(2) Непрерывное культивирование и кривая роста опухолевых клеток первичных культур ПКРП в различных культуральных средах
Культуральную среду FEM для эпителиальных клеток первичных культур ПКРП и культуральные среды ВМ, KM, FM и EPI, используемые в качестве контролей, получали с использованием того же способа, что и в (1) данного Примера.
Опухолевые клетки первичной культуры ПКРП, происходящие из ткани ПКРП (№0F0075), культивировали в следующих пяти культуральных средах, а затем подвергали ферментативной дезагрегации, пересевали и подсчитывали с использованием того же метода, что и в (1) данного Примера.
Когда после пересева клетки вырастали в культуральном планшете и снова покрывали около 80% площади дна планшета, культивируемые клетки подвергали ферментативной дезагрегации, собирали и подсчитывали с использованием описанного выше рабочего метода. Клетки снова были инокулированы при плотности 4×104 клеток/лунку и непрерывно культивировались.
Ниже приводится формула для расчета удвоения количества клеточной популяции первичных эпителиальных клеток ПКРП в различных условиях культивирования:
Удвоение популяции (PD)=3,32 * log10 (общее число дезагрегированных клеток / число клеток при начальной инокуляции), см. Chapman et al., Stem Cell Research & Therapy 2014, 5: 60.
На Фиг. 8 показаны кривые роста клеток 0F0075 при пяти различных условиях культивирования, построенные с помощью программного обеспечения Graphpad Prism. По оси абсцисс представлены дни культивирования клеток, а по оси ординат - кратная кумулятивная пролиферация клеток, т.е. кратная экспансия (размножение) клеток за период культивирования. Чем больше значение, тем больше кратность экспансии клетки за определенный период, то есть тем больше клеток размножается. Значение наклона представляет скорость размножения клеток. Из рисунка можно подтвердить, что скорость пролиферации эпителиальных клеток ПКРП, культивируемых в культуральной среде FEM согласно изобретению, была выше, чем в других четырех условиях культивирования, и также можно подтвердить, что технология согласно изобретению позволяет непрерывно культивировать первичные эпителиальные клетки ПКРП, и скорость экспансии остается неизменной после 30 дней размножения.
Фотографии клеток на Фиг. 9А и 9С представляют собой микроскопические фотографии (под 40-кратным инвертированным фазово-контрастным микроскопом) первичной культуры 0F0075, выращиваемой до первого пересева в условиях культивирования в средах FEM и EPI, соответственно. Фотографии клеток на Фиг. 9В и 9D представляют собой микроскопические фотографии (под 40-кратным инвертированным фазово-контрастным микроскопом) первичной культуры 0F0075, выращиваемой до девятого пересева в условиях культивирования в средах FEM и EPI, соответственно. Из рисунков можно подтвердить, что технология изобретения позволяет непрерывно культивировать первичные эпителиальные клетки ПКРП, и морфология клеток после многократных пересевов и непрерывного культивирования существенно не изменилась, по сравнению с морфологией до пересева. Однако морфология клеток значительно изменилась при культивировании клеток на коммерческой среде EPI до 9-го пересева, что не могло удовлетворить требование непрерывного культивирования первичных эпителиальных клеток ПКРП.
[Пример 5]
Идентификация первичных опухолевых клеток ПКРП, полученных из опухолевых тканей
(1) Иммуногистохимическая идентификация первичных тканей ПКРП и клеток первичной культуры ПКРП после пересева
Опухолевая ткань (Образец №0F0053) размером с фасолину была взята из образца хирургической резекции у пациента с ПКРП и погружена в 1 мл 4% параформальдегида. Эпителиальные клетки ПКРП (Образец №0F0053) получали из оставшейся опухолевой ткани тем же способом, что и в Примере 1. Образец 0F0053 непрерывно культивировали до шестого пересева с использованием культуральной среды FEM согласно изобретению, в соответствии со способом Примера 3.
Иммуногистохимический анализ использовали для обнаружения (детектирования) экспрессии важных биомаркеров, связанных с ПКРП, в исходной ткани образца 0F0053 и клетках первичной культуры, полученной путем непрерывного культивирования до шестого пересева. Ткань фиксировали 4% параформальдегидом, заливали в парафин и разрезали на срезы толщиной 4 мкм с помощью микротома. Затем проводили обычную иммуногистохимическую детекцию (подробно об этапах см. у Li et al., Nature Communication, (2018) 9: 2983). В качестве первичных антител использовали антитела к цитокератину (CK) (приобретены у CST), антитела к р63 (приобретены у CST), антитела к р53 (приобретены у CST) и антитела к Ki67 (приобретены у R&D).
Фиг. 10А и 10В подтверждают, что экспрессия связанных с ПКРП биомаркеров на клетках, культивированных из опухолевых клеток ПКРП (Образец №0F0053) по технологии изобретения до 6-го пересева, соответствовала экспрессии маркеров на исходном участке ткани, из которого были получены клетки. Это свидетельствует о том, что клетки, культивируемые по технологии изобретения, сохраняют исходные патологические характеристики опухолевых тканей пациентов с ПКРП.
(2) Анализ изменения числа копий тканей ПКРП и клеток ПКРП, дезагрегированных и культивируемых из опухолевых тканей.
Опухолевые клетки ПКРП (№0F0025) непрерывно культивировали с использованием культуральной среды FEM согласно изобретению, в соответствии со способом Примера 3. Для опухолевых клеток ПКРП, которые культивировали и пересевали in vitro в первый, второй и третий раз (P1, Р2 и Р3, соответственно), и опухолевых тканей, полученных непосредственно от пациентов с ПКРП хирургическим путем, геномную ДНК клеток выделяли с использованием набора DNeasy для крови и тканей (DNeasy blood & tissue Kit, производства QIAGEN). Были собраны нормальные ткани пищевода у того же пациента, геномная ДНК была выделена тем же методом и использовалась в качестве фонового контроля. Затем было выполнено полноэкзомное секвенирование геномной ДНК клеток и образцов тканей (конкретные этапы операции см. у Hans Clevers et al., Cell, 11; 172 (1-2): 373-386, 2018), и результаты секвенирования сравнивали с референсным геномом. Программное обеспечение CNVkit использовалось для анализа результатов сравнения. CBS сегментация (алгоритм круговой двоичной сегментации) использовалась для анализа числа копий гена всего генома, особенности регионов со сходным положением и изменениями числа копий были извлечены с помощью программного обеспечения rolling median, и результаты были построены в соответствии с порядком хромосом. Фиг. 11A-11D подтверждают, что изменение числа копий в опухолевых клетках ПКРП, происходящих из опухолевой ткани, которые культивировали по технологии изобретения, по существу соответствовали таковым в исходной опухолевой ткани пациента.
[Пример 6]
Влияние удаления одного фактора или комбинации факторов из культуральной среды на непрерывную экспансию клеток первичной культуры ПКРП Культуральную среду FEM для первичных эпителиальных клеток ПКРП готовили тем же способом, что и в Примере 2. В качестве контроля была приготовлена основная среда (далее также именуемая «ВМ») с использованием того же метода, что и в Примере 2. Кроме того, шесть других культуральных сред были приготовлены в соответствии с Таблицей 9.
Опухолевые клетки первичной культуры ПКРП тканевого происхождения (№0F0061) получали с использованием того же метода, что и в Примере 1. Затем клетки первичной культуры ПКРП были инокулированы в покрытый матриксом Matrigel® (произведенный BD Biosciences) 24-луночный планшет в плотности 4×104 клеток/см2. 1 мл приготовленной культуральной среды FEM согласно изобретению был использован, который затем был помещен в условия для культивирования при 37°С, 5% СО2 в инкубатор (приобретенный у Thermo Fisher).
Когда клетки в культуральном планшете вырастали и покрывали около 80% площади поверхности дна, надосадочную жидкость среды удаляли и в 24-луночный планшет добавляли 400 мкл 0,05% трипсина (приобретенного у Gibco) для дезагрегации клеток; клетки инкубировали при 37°С в течение 10 минут до полной дезагрегации клеток, которая наблюдалась под микроскопом (EVOS М500, Invitrogen); затем ферментативную дезагрегацию останавливали, используя 800 мкл культурального раствора DMEM/F12, содержащего 5% (об./об.) эмбриональной бычьей сыворотки, 100 Ед/мл пенициллина и 100 мкг/мл пенициллина; полученную смесь собирали в центрифужную пробирку объемом 15 мл и центрифугировали при 1500 об/мин в течение 4 минут, а затем удаляли надосадочную жидкость. Центрифугированные клеточные осадки ресуспендировали в культуральной среде согласно изобретению и подсчитывали с помощью счетчика для визуализации клеток в потоке (JIMBIO FIL, Jiangsu Jimbio Technology Co., Ltd.) для получения общего числа клеток. Клетки инкубировали в другом 24-луночном культуральном планшете, покрытом гелеобразным внеклеточным матриксом, в плотности 2×104 клеток/см2для дальнейшего культивирования. Клетки были инокулированы в 24-луночный культуральный планшет, покрытый гелеобразным внеклеточным матриксом в той же плотности, используя другие семь различных сред для культивирования.
Когда после пересева клетки вырастали в культуральном планшете и снова покрывали около 80% площади дна планшета, культивируемые клетки подвергали ферментативной дезагрегации, собирали и подсчитывали с использованием описанного выше рабочего метода. Клетки снова были инокулированы в плотности 2×104клеток/см2 и непрерывно культивировали с использованием соответствующих культуральных сред различного состава.
Ниже приводится формула для расчета удвоения количества клеточной популяции первичных эпителиальных клеток ПКРП в различных условиях культивирования:
Удвоение популяции (PD)=3,32 * log10 (общее число дезагрегированных клеток / число клеток при начальной инокуляции), см. Chapman et al., Stem Cell Research & Therapy 2014, 5:60.
На Фиг. 12 показаны кривые роста клеток в восьми различных условиях культивирования, построенные с помощью программного обеспечения Graphpad Prism. По оси абсцисс представлены дни культивирования клеток, а по оси ординат - кратная кумулятивная пролиферация клеток, т.е. кратная экспансия клеток за период культивирования. Чем больше значение, тем больше кратность экспансии клетки за определенный период, то есть тем больше клеток размножается. Значение наклона представляет скорость размножения клеток.
Фотографии клеток на Фиг. 13А-13Н представляют собой микроскопические фотографии (под 100-кратным инвертированным фазово-контрастным микроскопом) 0F0061, культивируемого до третьего пересева в указанных выше восьми различных условиях культивирования.
Как видно из показанных на Фиг. 12 и Фиг. 13 результатов, эффект пролиферации клеток был значительно ослаблен после удаления Соединения 1, Y27632, А83-01 или SB202190 отдельно, или комбинации Соединения 1 и Y27632, или комбинации А83-01 и SB202190, из культуральной среды согласно изобретению. Помимо прочего, после удаления комбинированных компонентов Соединения 1 и Y27632 скорость пролиферации клеток значительно снижалась, что позволяет предположить, что комбинированные компоненты Соединения 1 и Y27632 в культуральной среде согласно изобретению необходимы для пролиферации клеток и непрерывного культивирования.
[Пример 7]
Эксперименты ксенотрансплантатной модели опухолегенеза на мышах с использованием клеток первичной культуры ПКРП, полученных из опухолевой ткани
Опухолевые клетки ПКРП (№0F0056) выделяли и получали из опухолевых тканей одного пациента с патологическим диагнозом ПКРП с использованием того же метода, что и в Примере 1. Клетки 0F0065 культивировали с использованием культуральной среды FEM изобретения по методу Примера 3, и когда количество опухолевых клеток ПКРП достигало 1×107, опухолевые клетки ПКРП дезагрегировали и собирали с использованием того же метода, что и в Примере 4. Культуральную среду FEM для опухолевых клеток ПКРП согласно изобретению и матрикс Matrigel® (приобретенный у BD Biosciences) смешивали в соотношении 1:1, и 100 мкл культуральной среды, смешанной с Matrigel, использовали для ресуспендирования 5×106 опухолевых клеток ПКРП, и полученный в результате раствор инъецировали в жировую подушку ПКРП и подмышечную впадину правой передней конечности 6-недельных самок мышей с высокой степенью иммунодефицита (NCG-мыши) (приобретенных в Нанкинском центре исследования модельных животных), соответственно. Объем и скорость роста опухолей у мышей, полученных из опухолевых клеток ПКРП, наблюдали и фотографировали каждые три дня.
Образование опухоли можно наблюдать в обоих из двух мест инокуляции опухолевых клеток у мышей на 15-й день после инокуляции опухолевых клеток. С 15-го по 30-й день пролиферация опухоли у мышей была очевидной. Это указывает на то, что опухолевые клетки ПКРП, происходящие из опухолевой ткани, культивированные способом культивирования согласно изобретению, обладают онкогенностью у мышей.
[Пример 8]
Функциональный тест на чувствительность к лекарственным средствам опухолевых клеток ПКРП, происходящих из опухолевой ткани
Взяв в качестве примера образец хирургической резекции пациента с ПКРП, можно убедиться, что опухолевые клетки ПКРП, культивированные из полученных от пациента образцов опухоли ПКРП, могут быть использованы для тестирования чувствительности опухолевых клеток пациента к различным лекарственным препаратам.
1. Посев первичных опухолевых клеток ПКРП: клеточные суспензии выделенных опухолевых клеток ПКРП (№. 0F0060 и №. 0F0062), полученные в соответствии со способом Примера 1, были инокулированы в покрытый матриксом Matrigel 12-луночный® планшет (приобретенный у BD Biosciences) в плотности 4×104 клеток/см2. 2 мл приготовленной культуральной среды FEM для первичных эпителиальных клеток было добавлено в 12-луночный планшет, который затем был помещен в условия для культивирования при 37°С, 5% СО2 (приобретенный у Thermo Fisher). Когда клетки в культуральном планшете вырастали и покрывали около 80% площади поверхности дна, надосадочную жидкость среды удаляли и в 12-луночный планшет добавляли 500 мкл 0,05% трипсина (приобретенного у Gibco) для дезагрегации клеток; клетки инкубировали при 37°С в течение 10 минут до полной дезагрегации клеток, которая наблюдалась под микроскопом (EVOS М500, Invitrogen); затем ферментативную дезагрегацию останавливали, используя 1 мл культурального раствора DMEM/F12, содержащего 5% (об./об.) эмбриональной бычьей сыворотки, 100 Ед/мл пенициллина и 100 мкг/мл пенициллина; полученную смесь собирали в центрифужную пробирку объемом 15 мл и центрифугировали при 1500 об/мин в течение 4 минут, а затем удаляли надосадочную жидкость. Отцентрифугированные клеточные осадки ресуспендировали в культуральной среде FEM и подсчитывали с помощью счетчика для визуализации клеток в потоке (JIMBIO FIL, Jiangsu Jimbio Technology Co., Ltd.) для получения общего количества клеток, которое составило 830 000 и 768 000, соответственно. Клетки инкубировали в 384-луночном планшете при плотности 2000-4000 клеток/лунку, и клетки прикреплялись к поверхности в течение ночи.
2. Эксперименты с градиентом лекарств:
(1) Планшеты для хранения лекарств были приготовлены методом градиентного разведения: 10 мкл исходных растворов лекарственного средства для тестирования (концентрация исходного раствора лекарственного средства определялась на основе 2-кратной максимальной концентрации Cmax в крови в организме человека), соответственно, отбирали и добавляли в ЕР пробирки объемом 0,5 мл, содержащие 20 мкл ДМСО; 10 мкл растворов из указанных выше пробирок ЕР пипеткой переносили во вторые пробирки ЕР объемом 0,5 мл, с предварительно внесенными 20 мкл ДМСО, то есть разбавляли препараты в соотношении 1:3. Описанный выше метод повторяли для постепенного разбавления и получали 7 концентраций, необходимых для дозирования. Различные концентрации лекарств добавляли в 384-луночные планшеты для хранения лекарств. В каждую лунку контрольной группы растворителя добавляли равный объем ДМСО в качестве контроля. В этом примере тестируемыми препаратами были бортезомиб (приобретенный у МСЕ), митомицин (приобретенный у МСЕ), гидроксикамптотецин (приобретенный у МСЕ) и эрлотиниб (приобретенный у МСЕ).
(2) Используя высокопроизводительную автоматизированную рабочую станцию (JANUS, Perkin Elmer), различные концентрации лекарств и контролей растворителя в 384-луночных планшетах для хранения лекарств добавляли в 384-луночные планшеты для культивирования клеток с опухолевыми клетками ПКРП. Группы лекарственных веществ и контрольные группы с растворителем имели по 3 дублирующие лунки. Объем препаратов, добавляемых в каждую лунку, составлял 100 нл.
(3) Тест на жизнеспособность клеток: через 72 часа после введения препарата использовали набор Cell Titer-Glo (приобретенный у Promega) для определения величины хемилюминесценции культивируемых клеток после введения лекарственного средства. Величина значения хемилюминесценции отражает жизнеспособность клеток и влияние лекарственного средства на жизнеспособность клеток. В каждую лунку добавляли 10 мкл приготовленного раствора для обнаружения с помощью Cell Titer-Glo и после смешивания использовали устройство для считывания микропланшетов (Envision, Perkin Elmer) для определения значения хемилюминесценции.
(4) Тест на жизнеспособность клеток: в соответствии с формулой: Выживаемость клеток (%)=значение хемилюминесценции в лунке с лекарственным средством / значение хемилюминесценции в контрольной лунке * 100%, рассчитывали показатели выживаемости клеток, обработанных различными лекарственными средствами. Графики были сделаны с использованием программного обеспечения Graphpad Prism, и значения показателя концентрации полуингибирования IC50 были рассчитаны.
(5) Результаты тестирования на чувствительность к лекарственным средствам представлены на Фиг. 14.
Фиг. 14А и 14В, соответственно, представляют результаты чувствительности опухолевых клеток ПКРП, культивированных из полученных хирургической резекцией образцов опухолевой ткани у двух разных пациентов с ПКРП (образец №0F0060 и образец №0F0062), к двум химиотерапевтическим препаратам митомицину и гидроксикамптотецину, а также к препаратам направленного действия бортезомибу и эрлотинибу. В частности, на Фиг. 14А показаны результаты чувствительности клеток ПКРП, культивированных из образца №0F0060, к четырем лекарственным средствам; на Фиг. 14В показаны результаты чувствительности клеток ПКРП, культивированных из образца №0F0062, к четырем лекарственным средствам. Результаты показывают, что клетки одного и того же пациента имеют разную чувствительность к разным препаратам, а клетки разных пациентов также имеют разную чувствительность к одному и тому же препарату.
Промышленная применимость
Согласно изобретению предложены культуральная среда и способ культивирования для выращивания или размножения первичных эпителиальных клеток ПКРП in vitro. Культивированные клетки можно использовать для оценки эффективности и скрининга лекарств. Следовательно, изобретение применимо в промышленности.
Хотя настоящее изобретение подробно описано в настоящем документе, настоящее изобретение не ограничивается этим, и специалисты в данной области могут внести изменения в соответствии с принципом изобретения. Поэтому все модификации, выполненные в соответствии с принципом изобретения, должны рассматриваться как входящие в объем охраны изобретения.
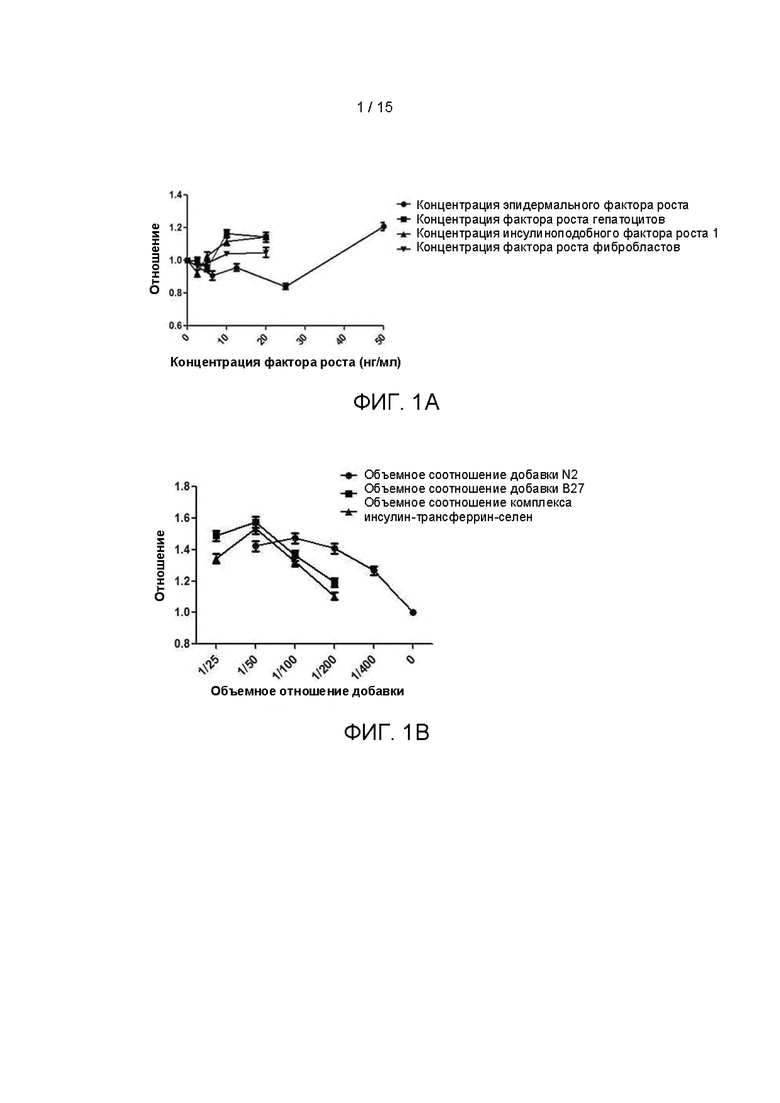
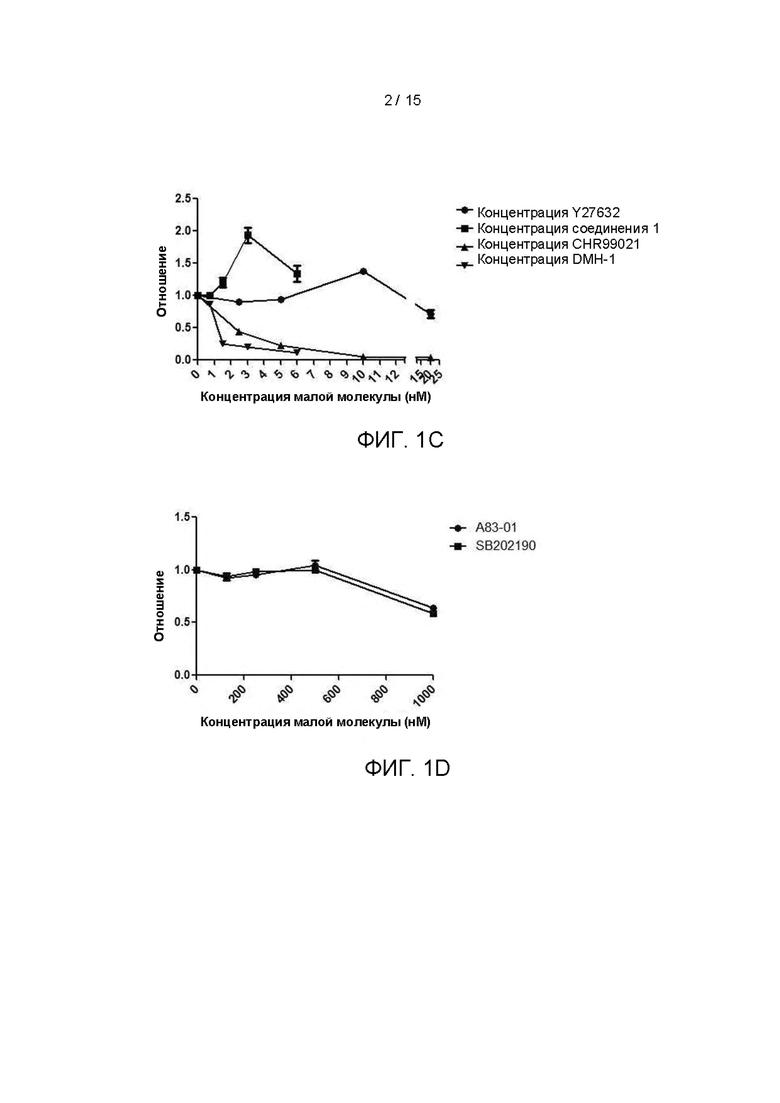

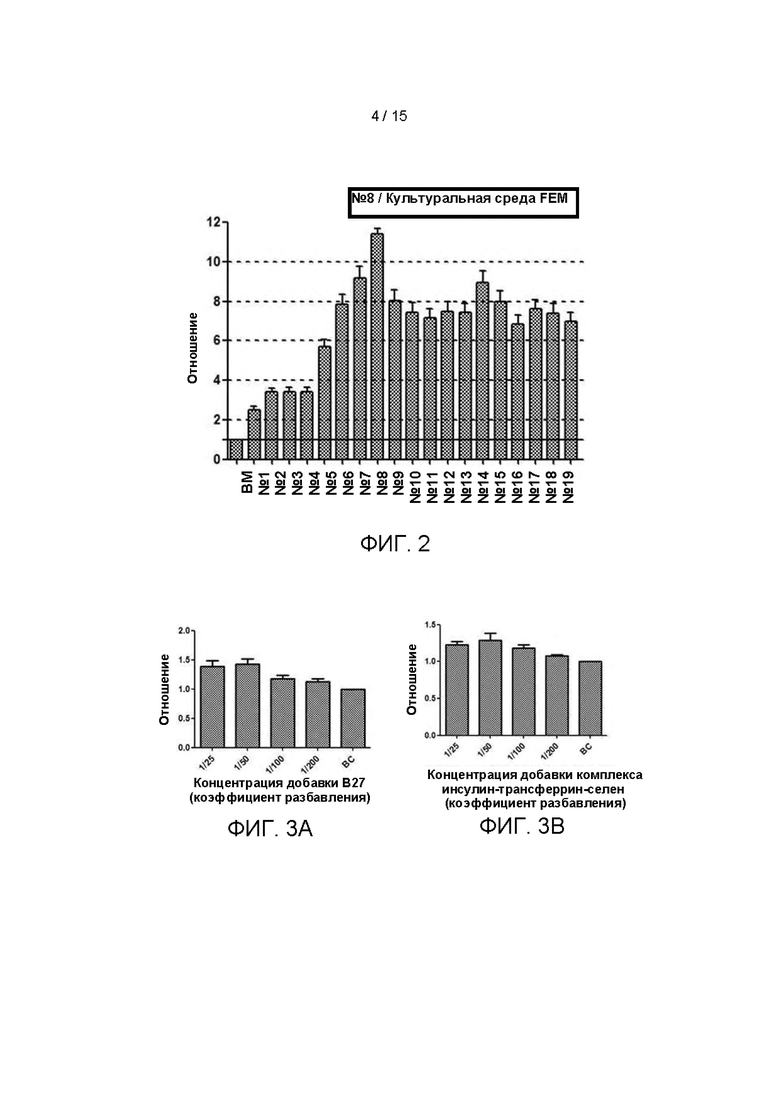
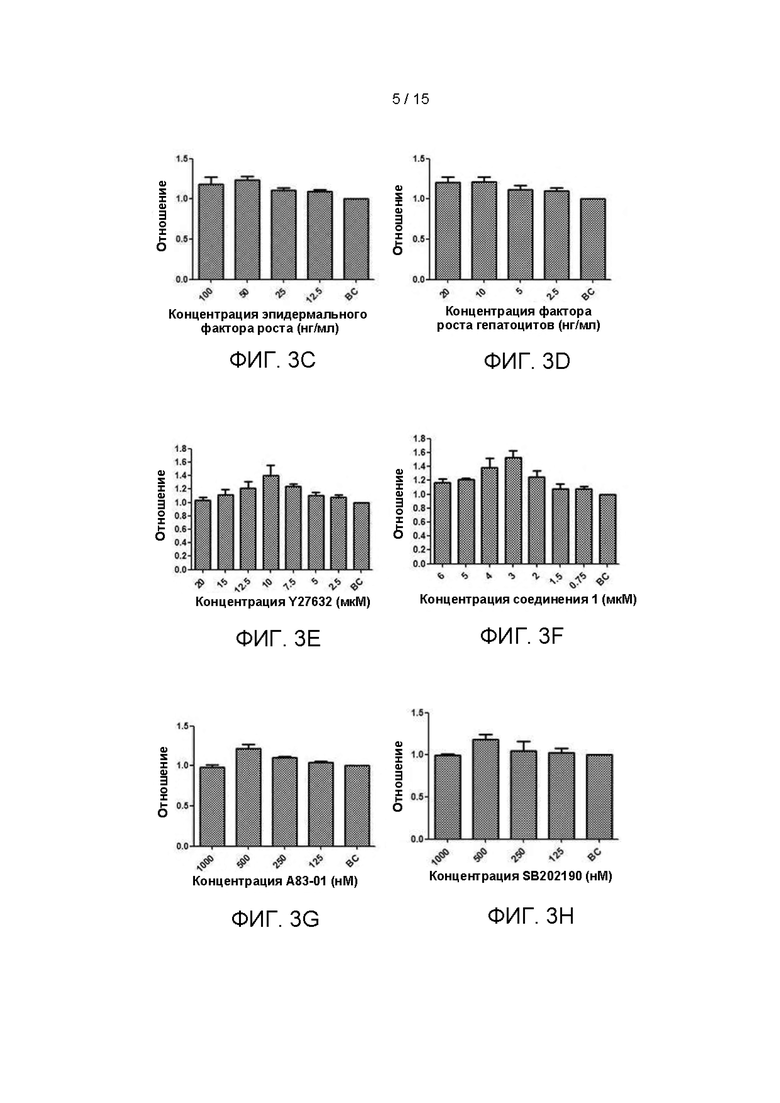
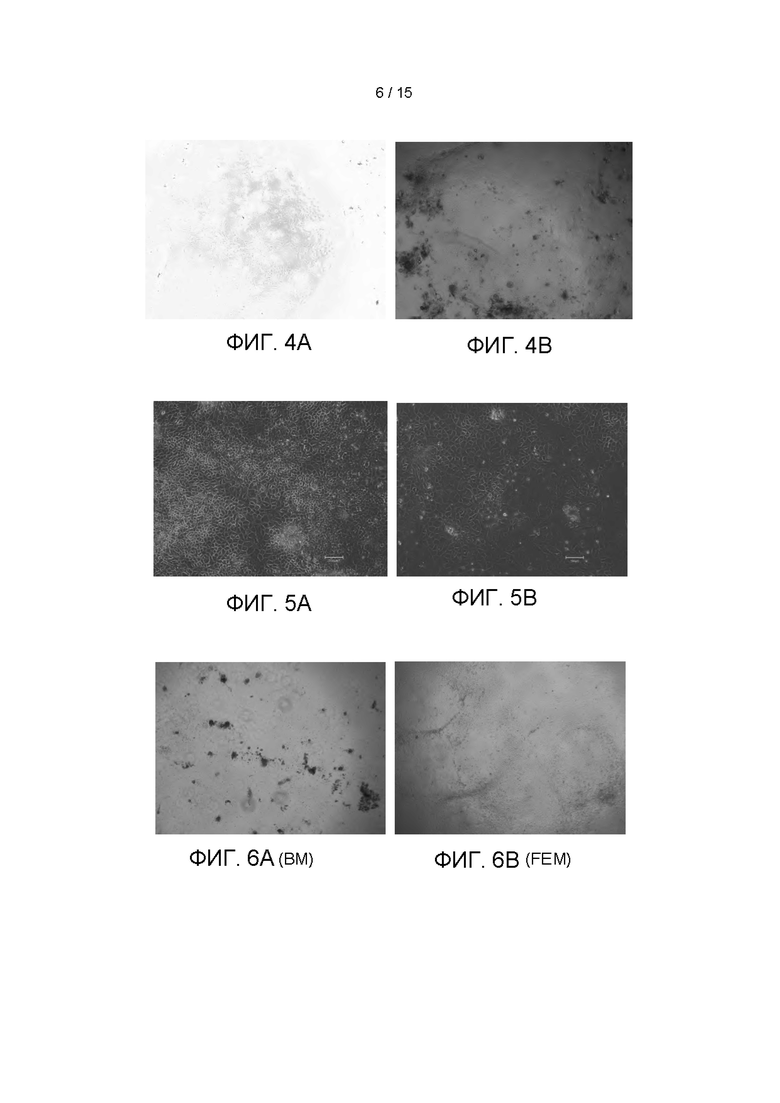

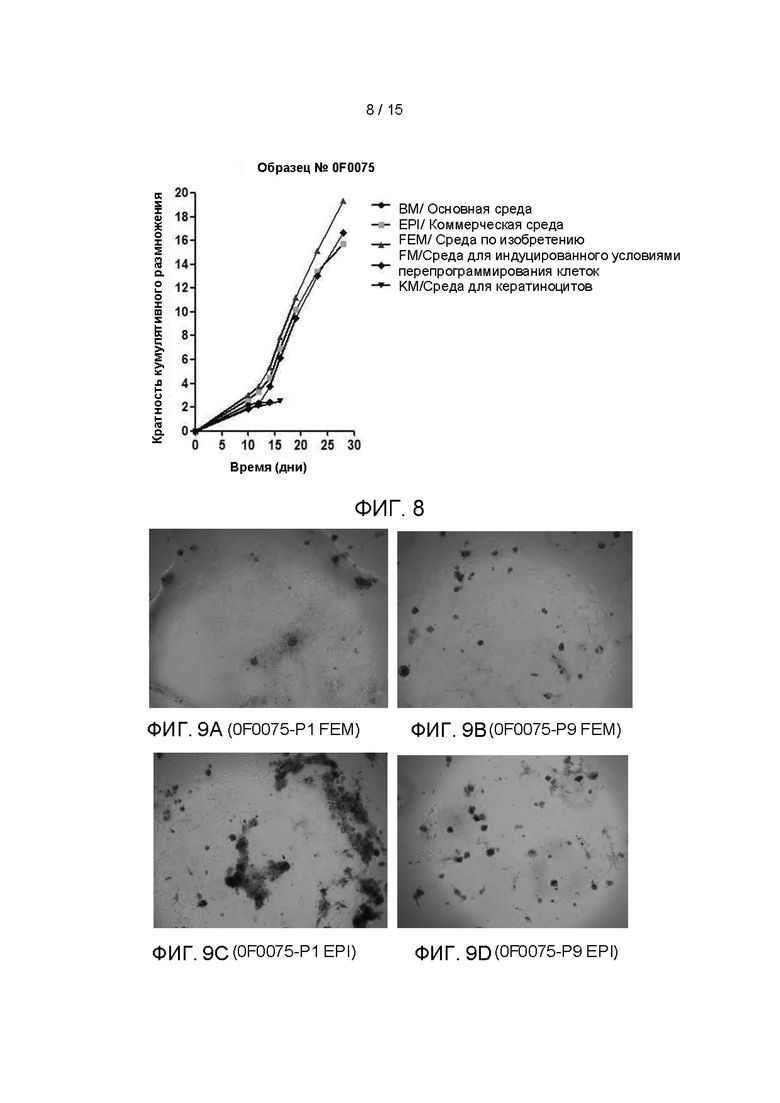

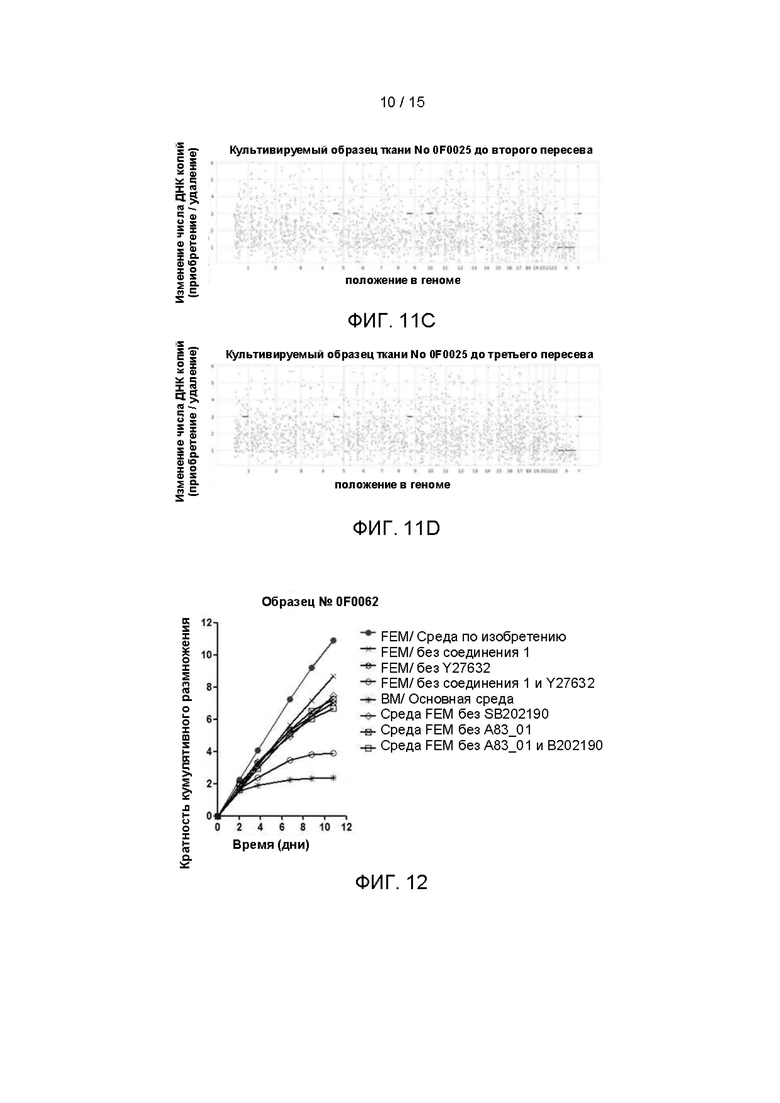





Настоящее изобретение относится к области биотехнологии. Изобретение раскрывает новую культуральную среду, содержащую ингибиторы киназы MST1/2 и киназы ROCK и обеспечивающую более короткий период культивирования клеток в сравнении с известными аналогами. Изобретение может быть применимо для культивирования или размножения in vitro эпителиальных клеток первичной плоскоклеточной карциномы пищевода. Клеточная модель, полученная с применением культуральной среды для первичных клеток, согласно настоящему изобретению может быть использована для оценки эффективности и скрининга лекарственных средств, подходящих для лечения рака пищевода. 4 н. и 10 з.п. ф-лы, 14 ил., 9 табл., 8 пр.
1. Первичная клеточная культуральная среда для культивирования первичных эпителиальных клеток плоскоклеточной карциномы пищевода (ПКРП), характеризующаяся тем, что:
включает ингибитор киназы MST1/2 и ингибитор киназы ROCK, где ингибитор киназы MST1/2 содержит соединение Формулы (I) или его фармацевтически приемлемую соль, или сольват, а ингибитор киназы ROCK представляет собой по меньшей мере один, выбранный из группы, состоящей из Y27632, Фасудила и Н-1152,
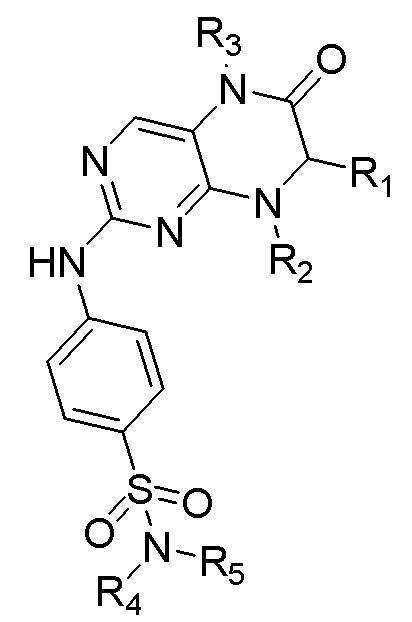 Формула (I)
Формула (I)
где
R1 выбран из C1-C6 алкила, C3-C6 циклоалкила, C4-C8 циклоалкилалкила, C2-C6 спироциклоалкила и арила, необязательно независимо содержащего в качестве заместителей 1-2 R6, арил-C1-C6 алкила, необязательно независимо содержащего в качестве заместителей 1-2 R6, и гетероарила, необязательно независимо содержащего в качестве заместителей 1-2 R6;
R2 и R3, каждый независимо, выбран из C1-C6 алкила;
R4 и R5, каждый независимо, выбран из водорода, C1-C6 алкила, C3-C6 циклоалкила, C4-C8 циклоалкилалкила, гидроксил-C1-C6 алкила, C1-C6 галогеналкила, C1-C6 алкиламино-C1-C6 алкила, C1-C6 алкокси-C1-C6 алкила и C3-C6 гетероциклил-C1-C6 алкила;
R6 выбран из галогена, C1-C6 алкила, C1-C6 алкокси и C1-C6 галогеналкила.
2. Первичная среда для культивирования клеток по п. 1, характеризующаяся тем, что
R1 выбран из C1-C6 алкила, C3-C6 циклоалкила, C4-C8 циклоалкилалкила, C2-C6 спироциклоалкила и фенила, необязательно независимо содержащего в качестве заместителей 1-2 R6, нафтила, необязательно независимо содержащего в качестве заместителей 1-2 R6, фенилметила, необязательно независимо содержащего в качестве заместителей 1-2 R6, и тиенила, необязательно независимо содержащего в качестве заместителей 1-2 R6;
R2 и R3, каждый независимо, выбраны из C1-C3 алкила;
R4 и R5, каждый независимо, выбраны из водорода, C1-C6 алкила, C3-C6 циклоалкила, C4-C8 циклоалкилалкила, гидроксил C1-C6 алкила, C1-C6 галогеналкила, C1-C6 алкиламино, C1-C6 алкила, C1-C6 алкокси C1 -C6 алкила, пиперидил C1-C6 алкила и тетрагидропиранил C1-C6 алкила;
R6 выбран из галогена, C1-C6 алкила, C1-C6 алкокси и C1-C6 галогеналкила.
3. Первичная клеточная культуральная среда по п. 1, характеризующаяся тем, что ингибитор киназы MST1/2 содержит соединение формулы (Ia) или его фармацевтически приемлемую соль, или сольват,
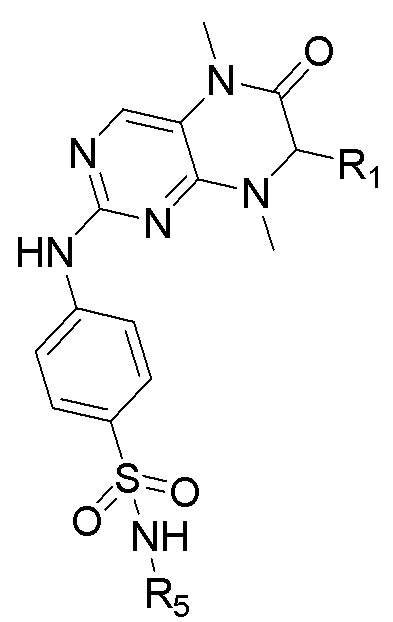 Формула (Ia)
Формула (Ia)
где
R1 выбран из C1-C6 алкила, фенила, необязательно независимо содержащего в качестве заместителей 1-2 R6, тиенила, необязательно независимо содержащего в качестве заместителей 1-2 R6, и фенилметила, необязательно независимо содержащего в качестве заместителей 1-2 R6;
R5 выбран из водорода, C1-C6 алкила и C3-C6 циклоалкила;
R6 независимо выбран из галогена, C1-C6 алкила и C1-C6 галогеналкила.
4. Первичная клеточная культуральная среда по п. 3, характеризующаяся тем, что
R1 представляет собой фенил, необязательно независимо замещенный 1-2 R6;
R5 представляет собой водород;
R6 предпочтительно представляет собой фтор, метил или трифторметил.
5. Первичная клеточная культуральная среда по п. 1, характеризующаяся тем, что ингибитор киназы MST1/2 представляет собой по меньшей мере одно соединение, выбранное из следующих соединений, или его фармацевтически приемлемую соль:



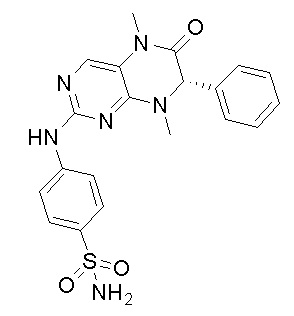


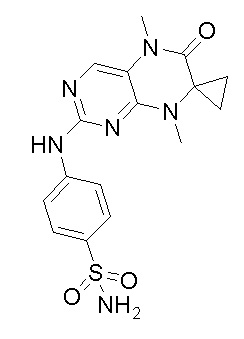
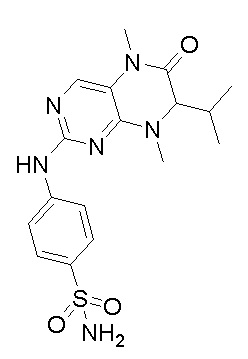
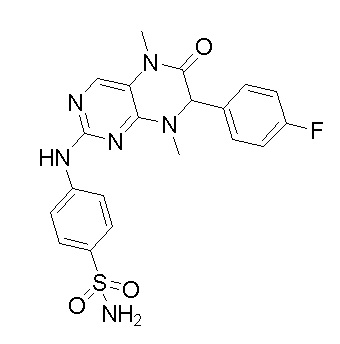

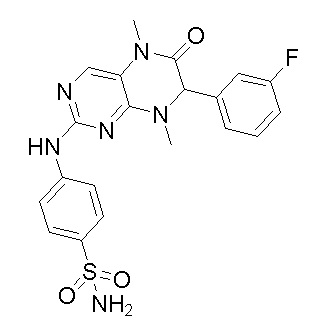

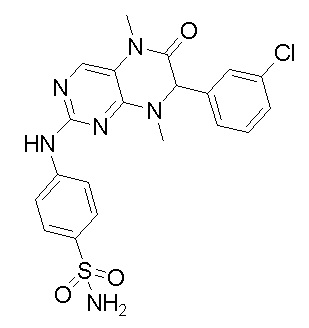
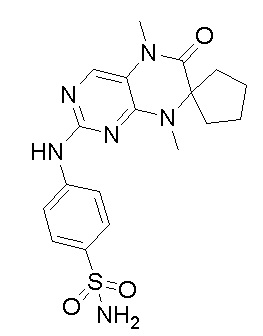

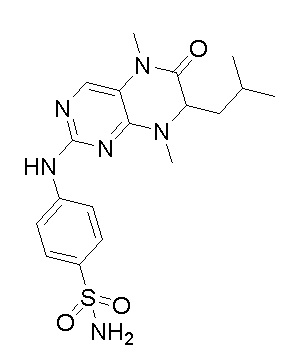

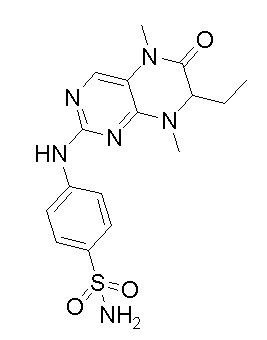

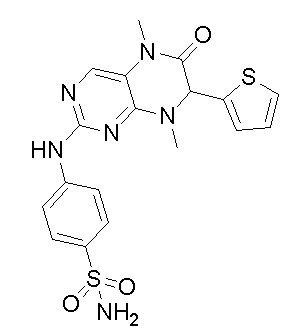
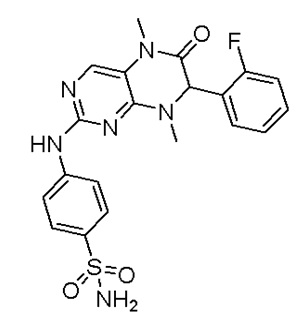
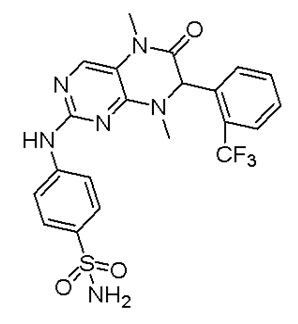
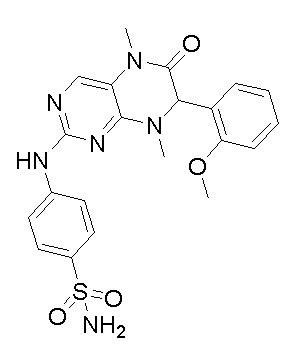
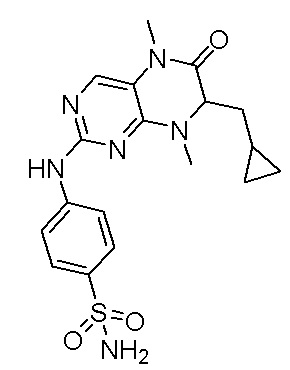
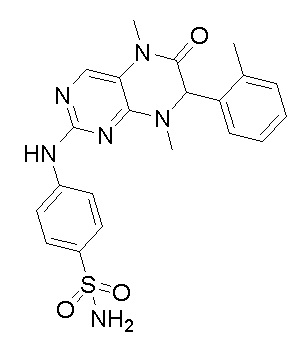
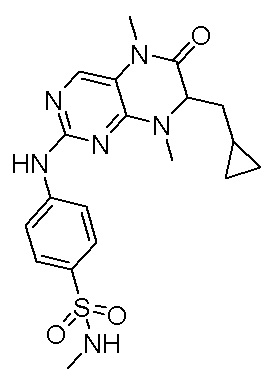
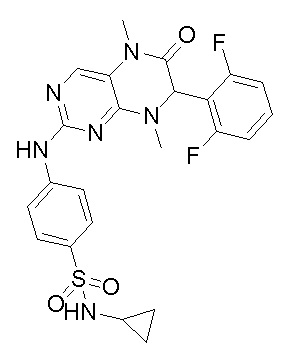




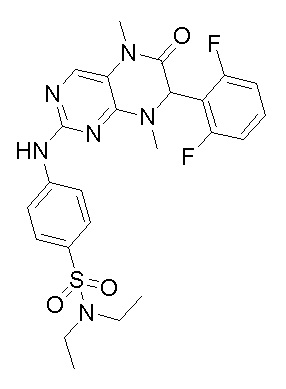

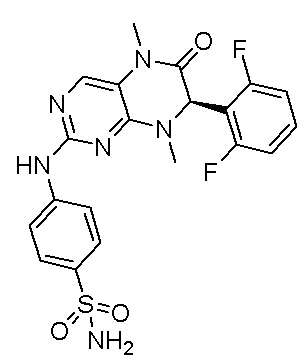
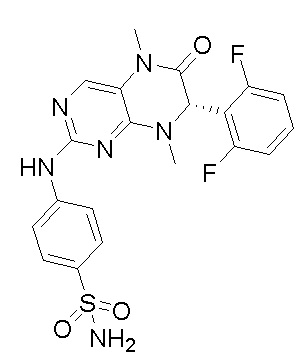






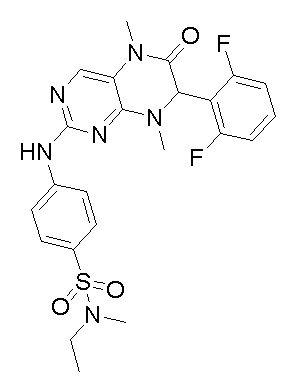
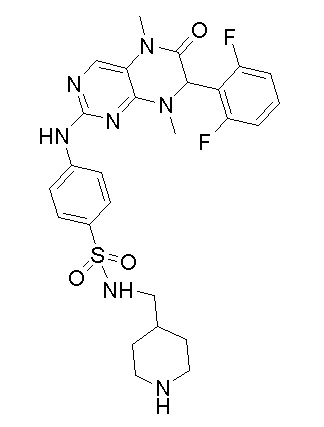
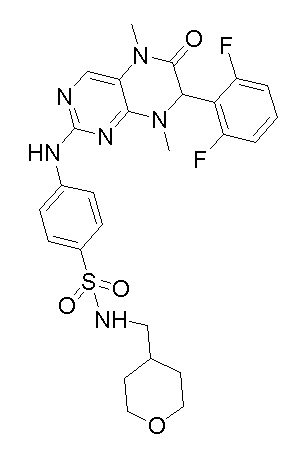

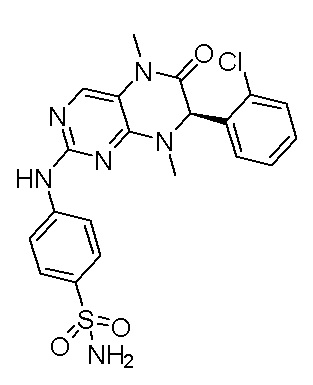


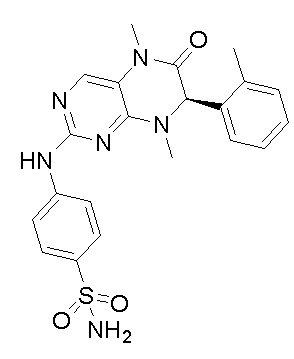
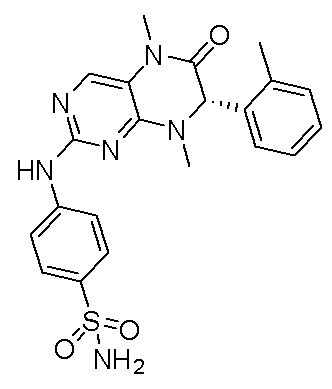 .
.
6. Первичная клеточная культуральная среда по любому из пп. 1-5, характеризующаяся тем, что:
количество ингибитора киназы MST1/2 составляет 0,3 мкМ-10 мкМ, предпочтительно 0,75 мкМ-6 мкМ, более предпочтительно 2 мкМ-6 мкМ.
7. Первичная клеточная культуральная среда по любому из пп. 1-5, характеризующаяся тем, что:
количество ингибитора киназы ROCK в культуральной среде составляет от 0,3 мкМ до 20 мкМ, предпочтительно от 2,5 мкМ до 15 мкМ, более предпочтительно от 7,5 мкМ до 12,5 мкМ.
8. Первичная клеточная культуральная среда по любому из пп. 1-5, характеризующаяся тем, что:
она дополнительно содержит один или более из следующих факторов: эпидермальный фактор роста; комплекс инсулин-трансферрин-селен; добавка B27 или добавка N2; фактор роста гепатоцитов; ингибитор рецептора TGFβ I типа, выбранный из по меньшей мере одного из A83-01, SB431542, Repsox, SB505124, SB525334, SD208, LY36494 и SJN2511; и ингибитор P38/MAPK, выбранный из по меньшей мере одного из SB202190, SB203580, VX-702, VX-745, PD169316, RO4402247 и BIRB796.
9. Первичная клеточная культуральная среда по п. 8, характеризующаяся тем, что:
количество эпидермального фактора роста составляет 12,5 нг/мл-100 нг/мл, более предпочтительно 50 нг/мл-100 нг/мл;
соответствующие количества инсулина/трансферрина/селенита натрия в комплексе инсулин-трансферрин-селен составляют 2,5-20 мкг/мл, 1,25-10 мкг/мл, 1,25-10 нг/мл, соответственно, и более предпочтительно 5-20 мкг/мл, 2,5-10 мкг/мл, 2,5-10 нг/мл, соответственно;
объемная концентрация добавки B27 или добавки N2 составляет 1:25-1:200, более предпочтительно 1:25-1:50;
количество фактора роста гепатоцитов составляет 2,5 нг/мл-20 нг/мл, более предпочтительно 10 нг/мл-20 нг/мл;
количество ингибитора рецептора TGFβ I типа составляет 125-500 нМ, предпочтительно 250-500 нМ;
и количество ингибитора P38/MAPK составляет 125-500 нМ, предпочтительно 250-500 нМ.
10. Первичная клеточная культуральная среда по любому из пп. 1-5, характеризующаяся тем, что:
не содержит сыворотки, экстракта бычьего гипофиза, агонистов Wnt, белков семейства R-спондинов, ингибиторов BMP, никотинамида или N-ацетилцистеина.
11. Первичная клеточная культуральная среда по любому из пп. 1-5, характеризующаяся тем, что:
эпителиальные клетки первичных культур ПКРП выбирают из опухолевых клеток ПКРП, нормальных эпителиальных клеток ПКРП и эпителиальных стволовых клеток ПКРП.
12. Способ культивирования эпителиальных клеток первичных культур ПКРП, отличающийся тем, что включает следующие этапы:
(1) приготовление первичной клеточной культуральной среды по любому из пп. 1-11;
(2) покрытие культурального сосуда разбавленным гелеобразным внеклеточным матриксом;
(3) инокуляция первичных эпителиальных клеток ПКРП, выделенных из тканей ПКРП, в сосуд для культивирования с покрытием и культивирование с использованием среды первичной клеточной культуральной среды с этапа (1).
13. Способ оценки эффективности лекарственного средства - кандидата для лечения заболеваний ПКРП, характеризующийся тем, что включает следующие этапы:
(1) культивирование эпителиальных клеток ПКРП способом культивирования по п. 12;
(2) выбор испытываемого лекарственного средства - кандидата и разведение в различных градиентах концентрации лекарственного средства;
(3) добавление указанного лекарственного средства - кандидата, разведенного до градиентов, к эпителиальным клеткам ПКРП, полученным на этапе (1), и определение жизнеспособности клеток.
14. Способ скрининга лекарственного средства - кандидата для лечения заболеваний ПКРП, характеризующийся тем, что включает следующие этапы:
(1) культивирование эпителиальных клеток ПКРП способом культивирования по п. 12;
(2) выбор испытываемого лекарственного вещества-кандидата и разведение в различных градиентах концентрации лекарственного средства;
(3) добавление лекарственного средства-кандидата, разведенного до градиентов, к эпителиальным клеткам ПКРП, полученным на этапе (1), и определение жизнеспособности клеток.
| CN 102787094 A, 21.11.2012 | |||
| CN 105801582 A, 27.06.2016 | |||
| US 2014315911 A1, 23.10.2014 | |||
| WO 2019126696 A1, 27.06.2019 | |||
| TURUNEN S.P | |||
| et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| RU 2018124591 A1, 06.04.2020. | |||
Авторы
Даты
2024-04-01—Публикация
2020-04-23—Подача