ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области биологии, в частности предложены культуральная среда и способ культивирования быстро размножающихся первичных клеток плоскоклеточной карциномы пищевода in vitro.
УРОВЕНЬ ТЕХНИКИ
На сегодняшний день опухоль является основной причиной смерти в Китае, как в городах, так и в сельских областях. Рак пищевода представляет собой одно из наиболее распространенных злокачественных новообразований желудочно-кишечного тракта в мире. Согласно последней статистике Национального онкологического центра, рак пищевода находится на четвертом месте среди первой десятки самых злокачественных опухолей у мужчин и на третьем - у женщин. Во многих областях мира локальная заболеваемость возросла, при этом Китай является областью с высокой заболеваемостью раком пищевода, при этом средняя ежегодная смертность составляет приблизительно 150000, что составляет 21,8% от всей национальной смертности от рака, находясь на четвертом месте среди типов рака, которые вызывают наибольшее количество смертей (непатентный документ 1). В патологической классификации рака пищевода существуют явные различия между зарубежными странами и Китаем: более чем 90% раков пищевода в зарубежных странах составляют аденокарциномы, тогда как в Китае более 90% - это плоско клеточные карциномы. Так как руководства Национальной онкологической сети (NCCN) составлены на основании изучения зарубежных случаев, существуют некоторые различия в использовании NCCN в качестве руководства для лечения страдающих раком пищевода пациентов в Китае. Следовательно, необходимо создать банк образцов первичных клеток китайской популяции, чтобы использовать его для исследования патогенеза рака пищевода in vitro и разработать новые лекарственные средства для лечения рака пищевода. В этом процессе особенно важно культивировать первичные клетки рака пищевода.
В настоящее время для культивирования первичных клеток рака пищевода существует известный способ выделения опухолевых клеток, а затем непосредственного их культивирования в среде, содержащей фетальную бычью сыворотку (непатентный документ 2); в последние годы также сообщали о способе применения процесса условного перепрограммирования для культивирования клеток эпителиального происхождения, причем в этих источниках упоминали, что указанный способ можно применять для культивирования и размножения первичных клеток рака пищевода (непатентный документ 3); затем в литературе сообщали, что полученные в ходе операции образцы рака пищевода гидролизовали трипсином и культивировали с помощью способа условного перепрограммирования (непатентный документ 4). Недавно в литературе сообщали о способе культивирования с применением коммерчески доступной культуральной среды KSFM с дополнительными факторами (непатентный документ 5), и о способе культивирования с применением технологии органоподобной культуры (непатентный документ 6).
Тем не менее, указанный выше способ согласно непатентному документу 2 не может использоваться для стабильного культивирования в течение длительного времени; периоды культивирования согласно непатентному документу 3 и непатентному документу 4 относительно длительные; способ согласно непатентному документу 5 требует более высоких затрат; реагенты, применяемые для органоподобной культуры в соответствии с непатентным документом 6, слишком дорогостоящие, и осуществление процесса культивирования сложное, что нежелательно для широкого применения.
Кроме того, так как патологический тип рака пищевода в зарубежных странах преимущественно представляет собой аденокарциному пищевода, и способы, о которых сообщают в зарубежной литературе, главным образом, предназначены для аденокарциномы пищевода, они не подходят для культивирования плоскоклеточной карциномы пищевода. Следовательно, необходимо разработать культуральную среду и способ культивирования, подходящие для культивирования первичных клеток плоскоклеточной карциномы пищевода.
Документы предшествующего уровня техники.
Непатентные документы.
Непатентный документ 1: Freddie Bray, BSc, MSc, PhD; Jacques Ferlay, ME, et al. Global Cancer Statistics 2018. CA CANCER J CLIN 2018; 68:394-424;
Непатентный документ 2: Karin J. Purdie, Celine Pourreyron, and Andrew P. South. Isolation and Culture of Squamous Cell Carcinoma lines. Cancer Cell Culture: Methods and Protocols, Second Edition, Methods in Molecular Biology, vol. 731, 2011, 151-159;
Непатентный документ 3: Xuefeng Liu, Ewa Krawczyk, et al. Conditional reprogramming and long-term expansion of normal and tumor cells from human biospecimens. Nature Protocols, VOl. 12 NO. 2, 2017, 439-451;
Непатентный документ 4: Todd J. Jensen, Christopher Foster, et al. Conditional Reprogramming of Pediatric Human Esophageal Epithelial Cells for Use in Tissue Engineering and Disease Investigation. Journal of Visualized Experiments, March 2017, 121, e55243;
Непатентный документ 5: Yuta Kasagi, et al. The Esophageal Organoid System Reveals Functional Interplay Between Notch and Cytokines in Reactive Epithelial Changes. Cellular and Molecular Gastroenterology and Hepatology, Vol. 5, No. 3, 2018, 333-352;
Непатентный документ 6: Xiaodun Li, Hayley E. Francies, et al. Organoid cultures recapitulate esophageal adenocarcinoma heterogeneity providing a model for clonality studies and precision therapeutics. NATURE COMMUNICATIONS (2018) 9:2983-2995.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для того чтобы решить обозначенные выше проблемы предшествующего уровня техники, в соответствии с настоящим изобретением предложены культуральная среда и способ культивирования для быстро размножающихся первичных клеток плоскоклеточной карциномы пищевода in vitro.
В одном аспекте настоящего изобретения предложена культуральная среда для первичных клеток плоскоклеточной карциномы пищевода, которая содержит исходную культуральную среду, следующие компоненты (1)-(6) и необязательно следующие компоненты (7)-(9), причем исходная культуральная среда может представлять собой, например, DMEM/F12, DMEM, F12 или RPMI-1640, предпочтительно представляет собой DMEM/F12.
(1) Ингибитор протеазы Rho, который выбран из одного или более из Y27632, гидроксифасудила и GSK429286A; в случае Y27632, имеющий концентрацию в диапазоне 2,5-40 мкМ, предпочтительно 5-20 мкМ, более предпочтительно 10 мкМ; в случае гидроксифасудила, имеющий концентрацию в диапазоне 2-32 мкМ, предпочтительно 4-16 мкМ, более предпочтительно 8 мкМ; и в случае GSK429286A, имеющий концентрацию в диапазоне 2-32 мкМ, предпочтительно 4-16 мкМ, более предпочтительно 8 мкМ;
(2) антибиотики, которые выбраны из одного или более из стрептомицина/пенициллина, амфотерицина В и примоцина; в случае стрептомицина/пенициллина, стрептомицин, имеющий концентрацию в диапазоне 25-400 мкг/мл, предпочтительно 50-200 мкг/мл, более предпочтительно 200 мкг/мл, пенициллин, имеющий концентрацию в диапазоне 25-400 Ед/мл, предпочтительно 50-200 Ед/мл, более предпочтительно 200 Ед/мл; в случае амфотерицина В, имеющий концентрацию в диапазоне 0,25-4 мкг/мл, предпочтительно 0,5-2 мкг/мл, более предпочтительно 1 мкг/мл; и в случае примоцина, имеющий концентрацию в диапазоне 25-400 мг/мл, предпочтительно 50-200 мг/мл, более предпочтительно 100 мг/мл; указанный антибиотик предпочтительно представляет собой примоцин;
(3) инсулин, имеющий концентрацию в диапазоне 2,5-40 мкг/мл, предпочтительно 10-40 мкг/мл, более предпочтительно 20 мкг/мл;
(4) вспомогательное вещество N2, в объемном отношении к культуральной среде, составляющем 1:400-1:25, предпочтительно 1:100-1:25, более предпочтительно 1:50;
(5) инсулиноподобный фактор роста 1 (IGF-1), имеющий концентрацию в диапазоне 2,5-40 нг/мл, предпочтительно 2,5-10 нг/мл, более предпочтительно 5 нг/мл;
(6) заменимая аминокислота, которая выбрана из одной или более из следующих аминокислот: глицин, аланин, аспарагин, аспарагиновая кислота, глутаминовая кислота, пролин и серин, с общей концентрацией в диапазоне 50-400 мкМ, предпочтительно 100-400 мкМ, более предпочтительно 400 мкМ;
(7) гидрокортизон, имеющий концентрацию в диапазоне 0-1,6 мкг/мл, предпочтительно 0,2-0,8 мкг/мл, более предпочтительно 0,4 мкг/мл;
(8) глутамин, имеющий концентрацию в диапазоне 0-8 мМ, предпочтительно 1-4 мМ, более предпочтительно 2 мМ;
(9) экстракт гипофиза крупного рогатого скота, имеющий концентрацию в диапазоне 0-56 мкг/мл, предпочтительно 3,5-14 мкг/мл, более предпочтительно 7 мкг/мл.
В другом аспекте настоящего изобретения предложен способ культивирования первичных клеток плоскоклеточной карциномы пищевода, в котором для культивирования используют культуральную среду для первичных клеток плоскоклеточной карциномы пищевода.
Указанный выше способ культивирования включает следующие этапы.
1. Выделение первичных клеток плоскоклеточной карциномы пищевода.
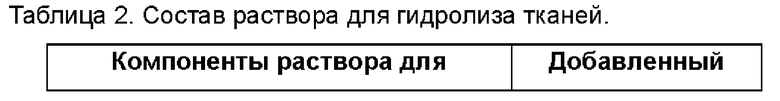
1.1 после промывки раствором для очистки тканей, в образцы ткани, такие как эндоскопические образцы, добавляют раствор для гидролиза тканей и помещают в шейкер с постоянной температурой (устройство ZQLY-180N, Zhichu) для гидролиза. Например, для гидролиза применяют 8-14 мл, предпочтительно 12 мл ферментов для гидролиза тканей; температура гидролиза варьируется от 4°С до 37°С, предпочтительно составляет 37°С; скорость встряхивания для гидролиза находится в диапазоне от 200 об/мин до 350 об/мин, предпочтительно составляет 300 об/мин.
1.2 после гидролиза полученный продукт вынимают для визуального исследования. Если не находят явных кусков ткани, то гидролиз можно завершить; в противном случае, его гидролиз продолжают до тех пор, пока гидролиз не будет достаточным. Время гидролиза находится в диапазоне от 4 до 8 часов, предпочтительно составляет 6 часов.
1.3 после гидролиза полученный продукт вынимают для центрифугирования и супернатант отбрасывают, а затем добавляют исходную культуральную среду, содержащую сыворотку для ресуспендирования, чтобы завершить гидролиз. Скорость вращения при центрифугировании находится в диапазоне от 1200 g до 1600 g, предпочтительно составляет 1500 об/мин; время центрифугирования находится в диапазоне от 2 до 5 минут, предпочтительно составляет 3 минуты; культуральная среда, содержащая сыворотку, может представлять собой, например, DMEM/F12, содержащую 5% фетальную бычью сыворотку.
2. Культивирование с применением культуральной среды для первичных клеток плоскоклеточной карциномы пищевода в соответствии с настоящим изобретением.
Первичные клетки плоскоклеточной карциномы пищевода, полученные на этапе 1 выше, ресуспендируют в культуральной среде для первичных клеток плоскоклеточной карциномы пищевода в соответствии с настоящим изобретением и подсчитывают, высевают в культуральный планшет при плотности клеток 5-10×104/см2; в то же время, в культуральный планшет добавляют трофобластные клетки при плотности клеток 2-3×104/см2; после культивирования в течение 5-7 дней, трофобластные клетки дополнительно добавляют при плотности клеток 0,5-1×104/см2; клетки гидролизуют для пересевания после того, как клетки разрастутся до 85% культурального планшета.
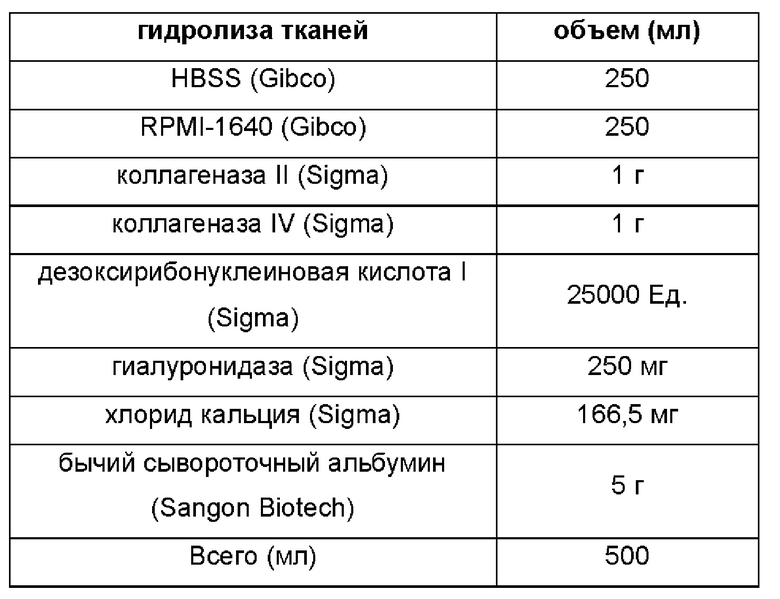
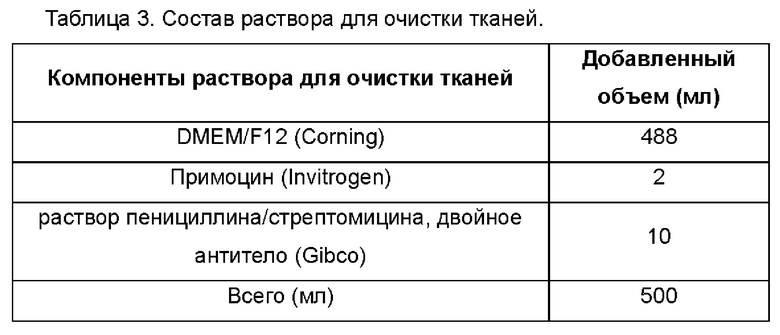
В частности, состав раствора для очистки тканей, описанного на этапе 1, следующий: основная культуральная среда DMEM/F12, содержащая 100-200 мг/мл примоцина и 2% раствор пенициллина/стрептомицина, двойное антитело. Способ получения раствора для гидролиза тканей, описанного на этапе 1, включает: растворение 1-2 мг/мл коллагеназы II, 1-2 мг/мл коллагеназы IV, 50-100 Ед/мл дезоксирибонуклеиновой кислоты I, 0,5-1 мг/мл гиалуронидазы, 1-3 мМ хлорида кальция, 1-2% бычьего сывороточного альбумина в HBSS и RPMI-1640 в объемном отношении 1:1. Трофобластные клетки, описанные на этапе 2, например, представляют собой облученные клетки NIH-3T3, и источник облучения представляет собой рентгеновские лучи или γ-лучи, предпочтительно γ-лучи, при дозе облучения 30-50 Гр, предпочтительно 35 Гр.
Эффекты изобретения
В соответствии с настоящим изобретением, путем применения улучшенной культуральной среды для первичных клеток плоскоклеточной карциномы пищевода, образцы ткани плоскоклеточной карциномы пищевода можно быстро размножить за короткое время, и можно амплифицировать и получить достаточные количества клеток за эффективное время, которые можно применять для высокопроизводительных тестов чувствительности к лекарственным средствам in vitro и для определения точного клинического лечения.
По сравнению с органоподобной культуральной средой, в культуральную среду для первичных клеток плоскоклеточной карциномы пищевода в соответствии с настоящим изобретением не требуется добавлять дорогостоящие факторы, такие как wnt3a, RSPO1 и Noggin, что значительно снижает стоимость культивирования. Кроме того, в органоподобной культуре, процесс гидролиза органоида сложен; напротив, способ культивирования в соответствии с настоящим изобретением включает простой процесс обработки, и позволяет быстро получить большое количество монослойных клеток, что может удовлетворить требованиям экспериментов. По сравнению с культуральной средой, используемой в обычной технологии условного перепрограммирования, период амплификации для получения такого же количества клеток в соответствии с настоящим изобретением короче, и настоящее изобретение также оказывает значительное стимулирующий пролиферацию эффект на малое количество образца. Культуральная среда и способ культивирования для первичных клеток плоскоклеточной карциномы пищевода в соответствии с настоящим изобретением могут значительно улучшить показатель эффективности продолжительного размножения in vitro образцов ткани плоскоклеточной карциномы пищевода, в среднем более чем на 85%.
Краткое описание чертежей
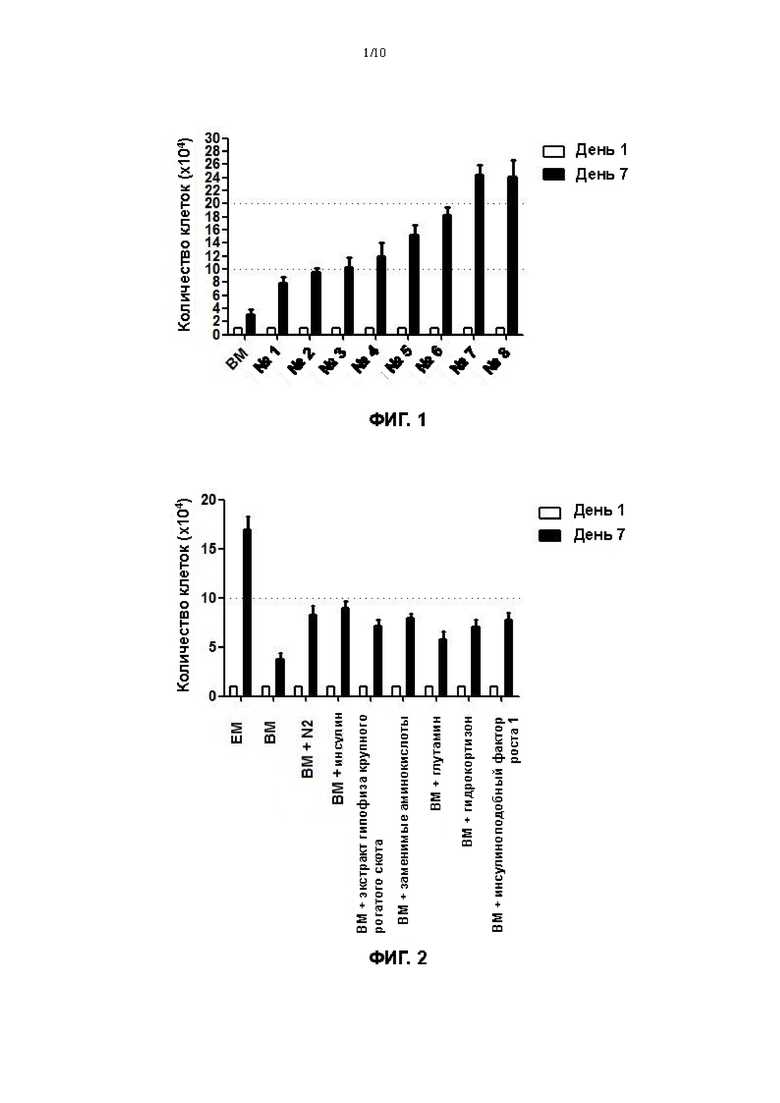
На Фигуре 1 показан эффект возрастающего количества факторов в культуральной среде для первичных клеток плоскоклеточной карциномы пищевода на пролиферацию первичных клеток плоскоклеточной карциномы пищевода.
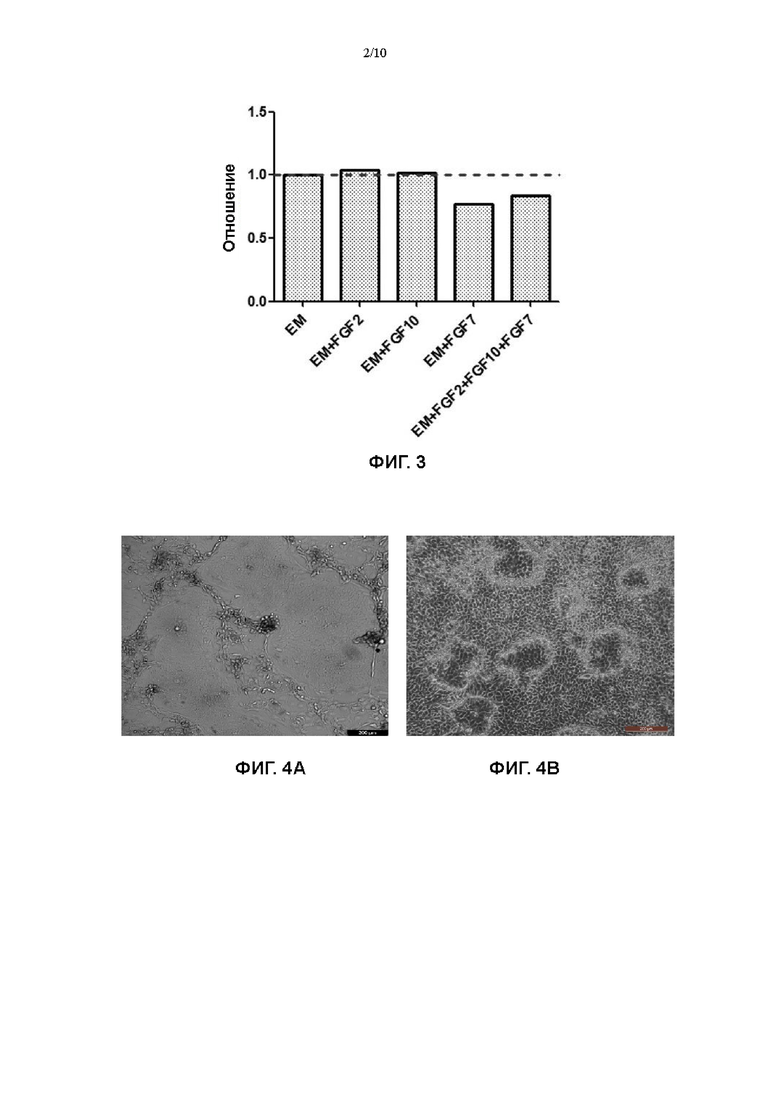
На Фигуре 2 показан эффект комбинации множества факторов в культуральной среде для первичных клеток плоскоклеточной карциномы пищевода на пролиферацию первичных клеток плоскоклеточной карциномы пищевода.
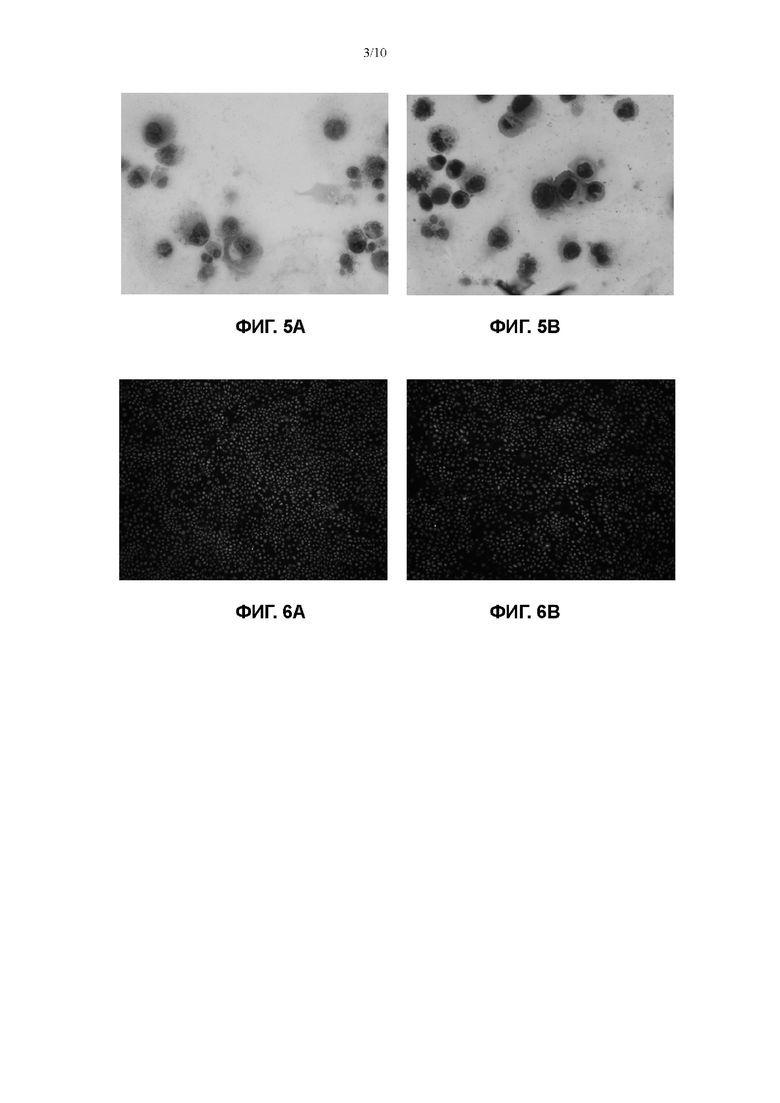
На Фигуре 3 показан эффект добавления других факторов в культуральную среду для первичных клеток плоскоклеточной карциномы пищевода в соответствии с настоящим изобретением на пролиферацию первичных клеток плоскоклеточной карциномы пищевода.
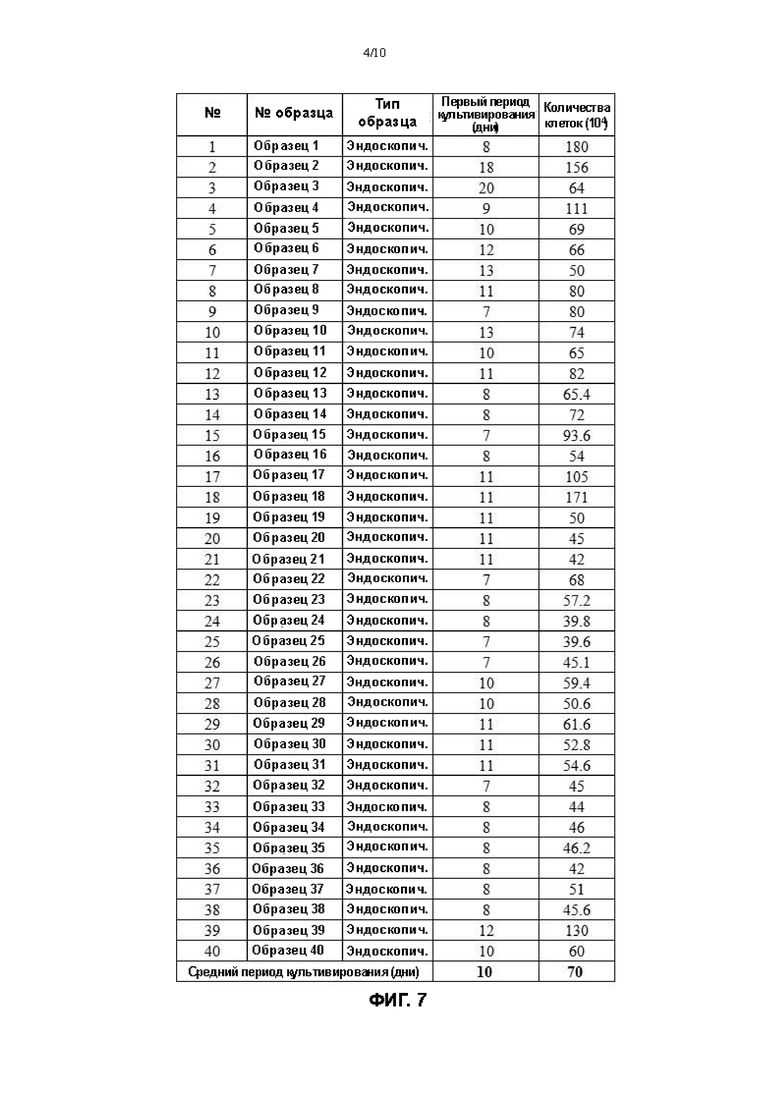
На Фигуре 4А и Фигуре 4В представлены фотографии (светлопольное освещение), полученные при наблюдении первичных клеток плоскоклеточной карциномы пищевода, культивированных in vitro, под микроскопом.
На Фигуре 5А и Фигуре 5В представлены результаты идентификации клеток плоско клеточной карциномы пищевода, культивированных in vitro, путем окрашивания по методу Райт-Гимза.
На Фигуре 6А и Фигуре 6В представлены результаты идентификации клеток плоско клеточной карциномы пищевода, культивированных in vitro, путем иммунофлуоресцентного окрашивания.
На Фигуре 7 показаны результаты первого периода размножения и статистика количества первичных клеток плоскоклеточной карциномы пищевода при применении культуральной среды для первичных клеток плоскоклеточной карциномы пищевода в соответствии с настоящим изобретением.
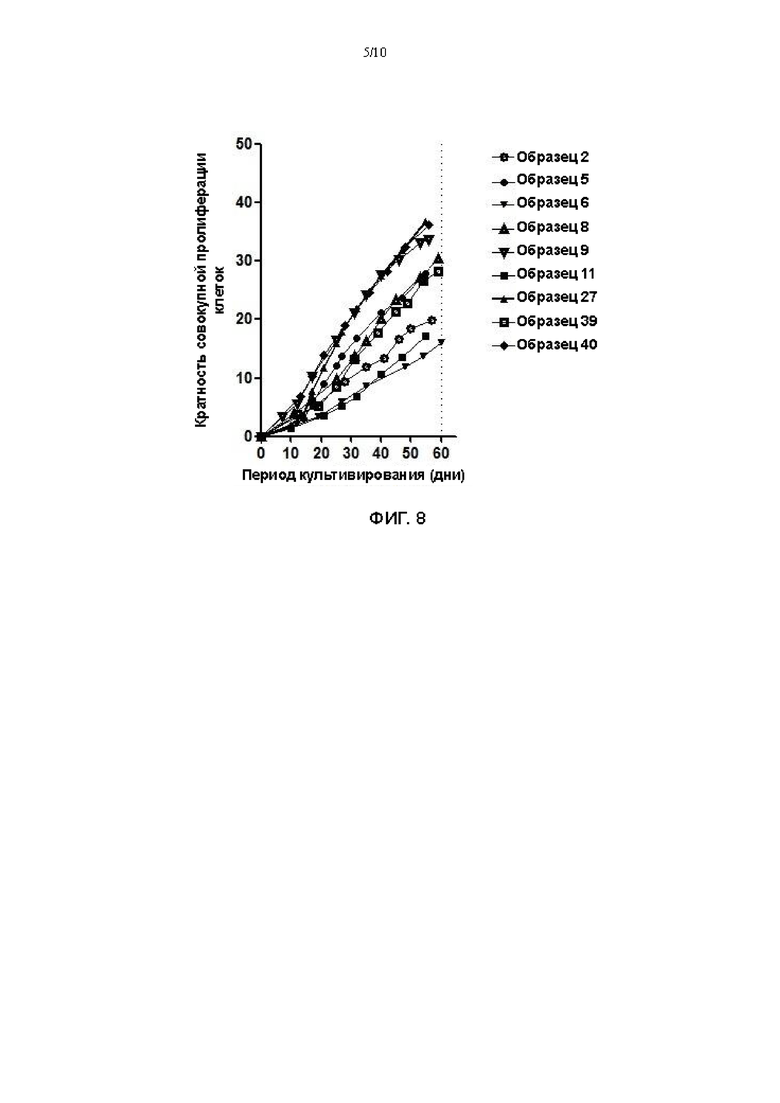
На Фигуре 8 представлена кривая размножения in vitro первичных клеток плоско клеточной карциномы пищевода с применением культуральной среды для первичных клеток плоскоклеточной карциномы пищевода в соответствии с настоящим изобретением.
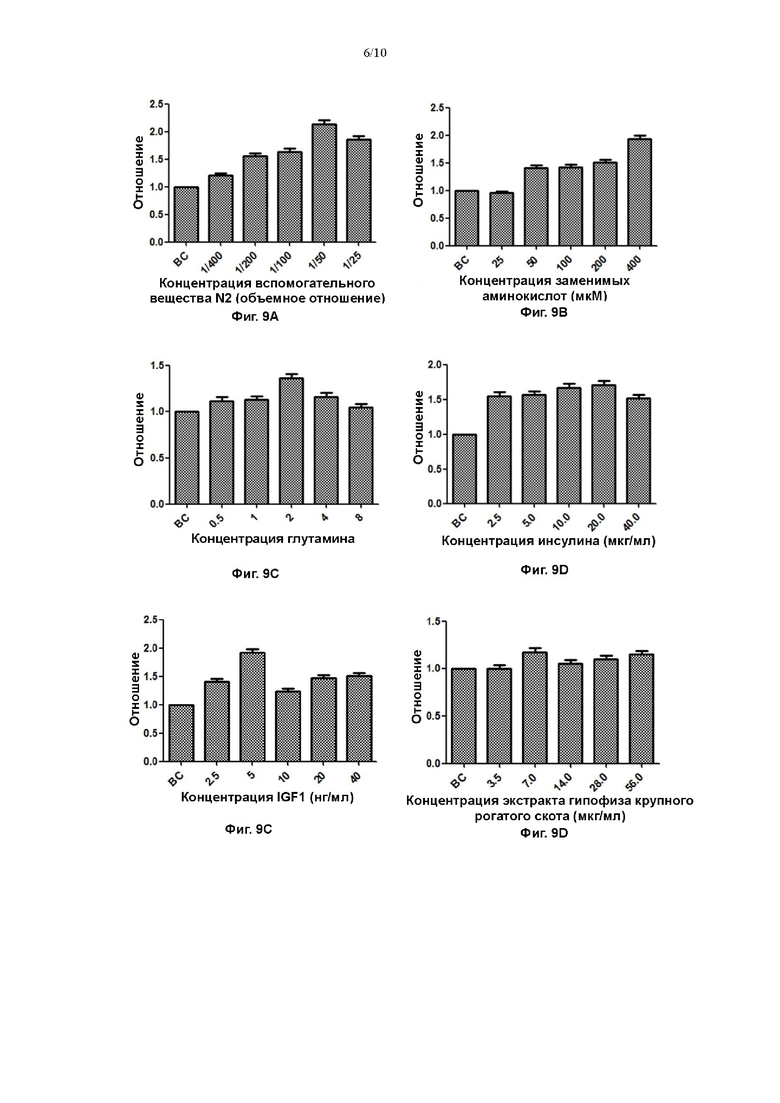
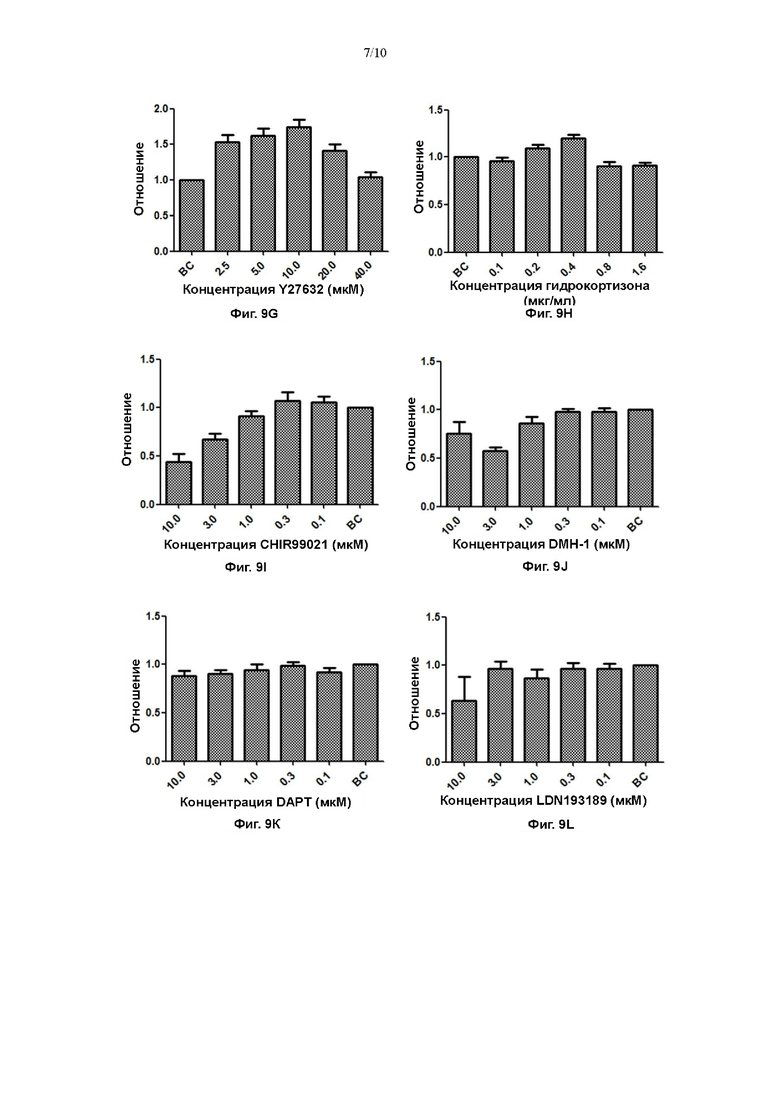
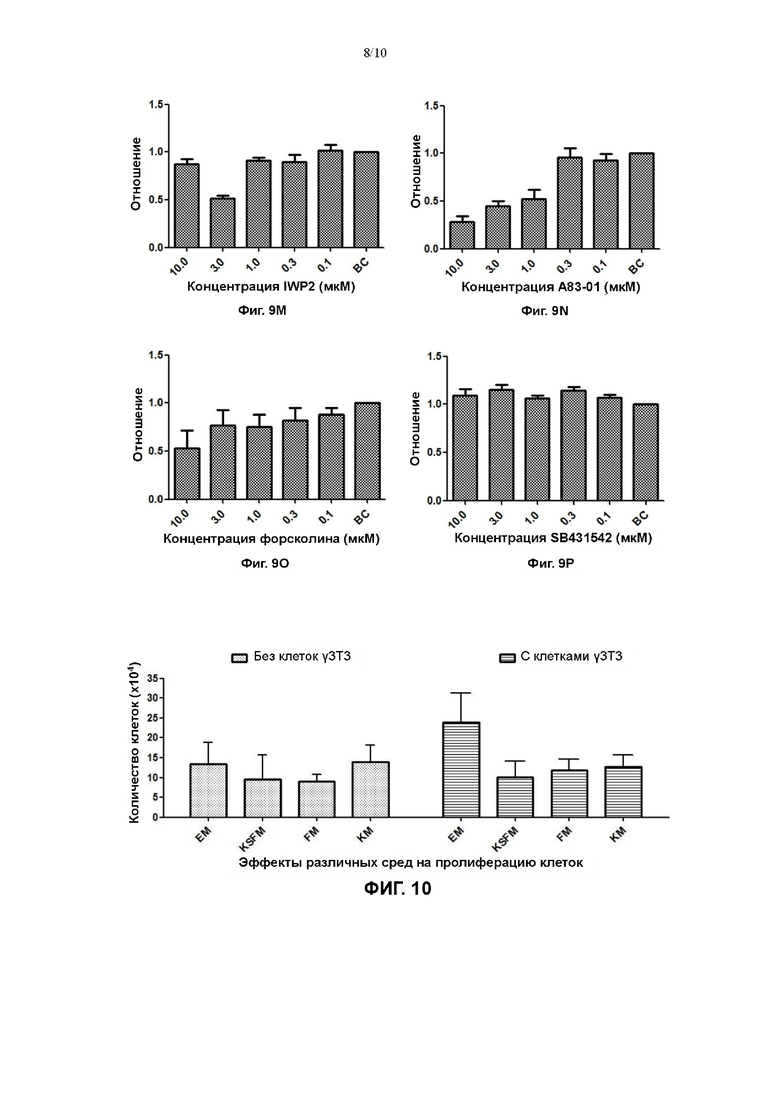
На Фигурах 9А-9Р показаны эффекты различных факторов в различных концентрациях в культуральной среде для первичных клеток плоскоклеточной карциномы пищевода на пролиферацию первичных клеток плоскоклеточной карциномы пищевода.
На Фигуре 10 показаны результаты сравнения эффекта на пролиферацию клеток культуральной среды в соответствии с настоящим изобретением с таковым для сред, описанных в литературе, и коммерчески доступной среды KSFM.
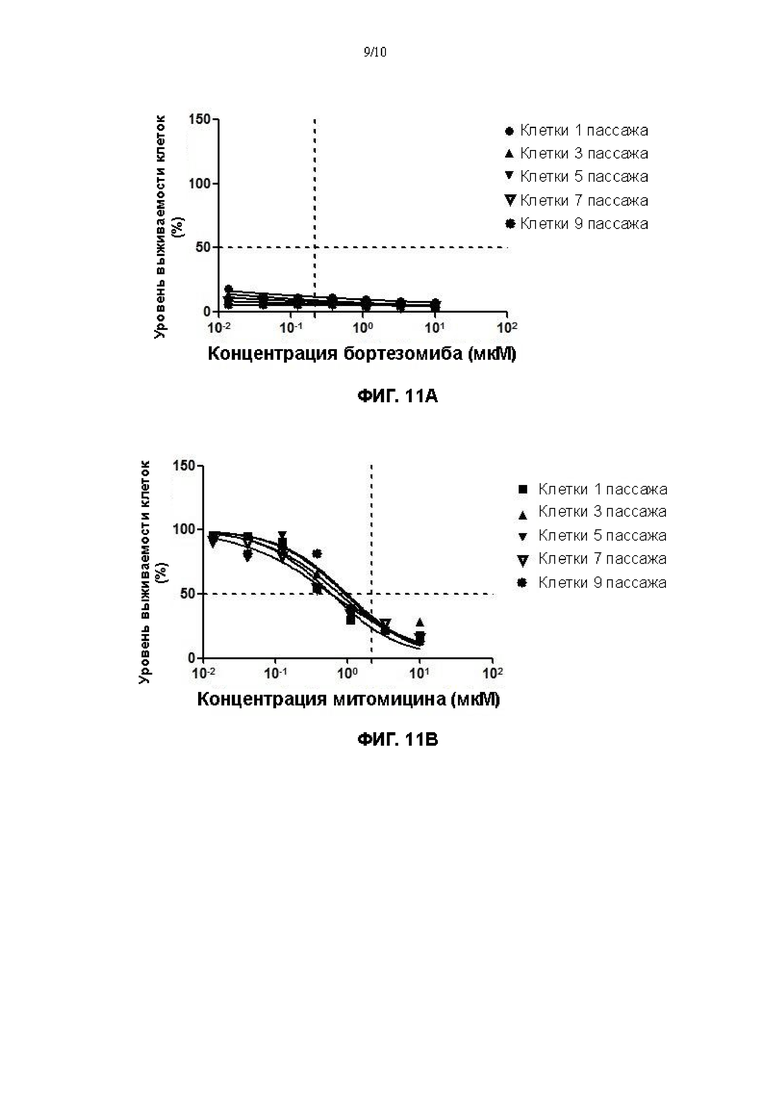
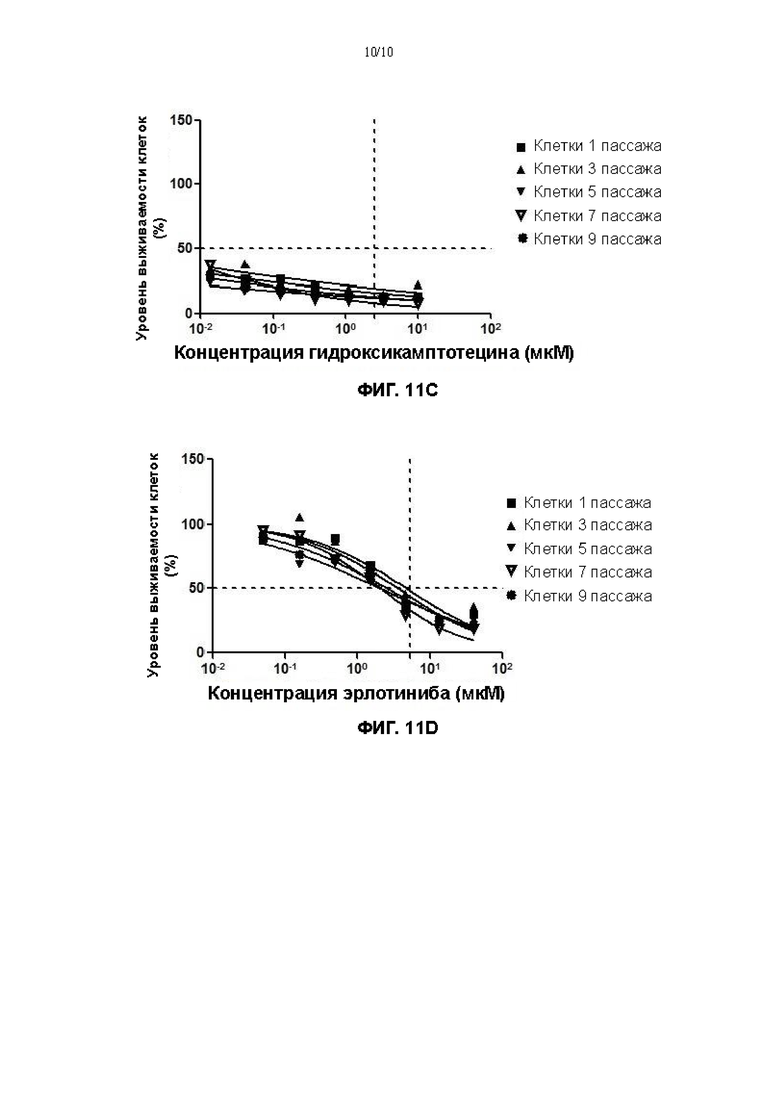
На Фигурах 11А-11D показаны результаты скрининга лекарственных средств с применением различных поколений клеток плоскоклеточной карциномы пищевода, культивированных с помощью культуральной среды в соответствии с настоящим изобретением.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение дополнительно описано ниже посредством описания конкретных вариантов реализации в комбинации с чертежами. Указанные варианты реализации используют исключительно для иллюстрирования настоящего изобретения, и объем настоящего изобретения не ограничен указанными вариантами реализации.
Пример 1. Стимулирующий пролиферацию клеток эффект культуральной среды для первичных клеток плоскоклеточной карциномы пищевода, содержащей различные компоненты.
(1) Получение культуральной среды, содержащей различные компоненты.
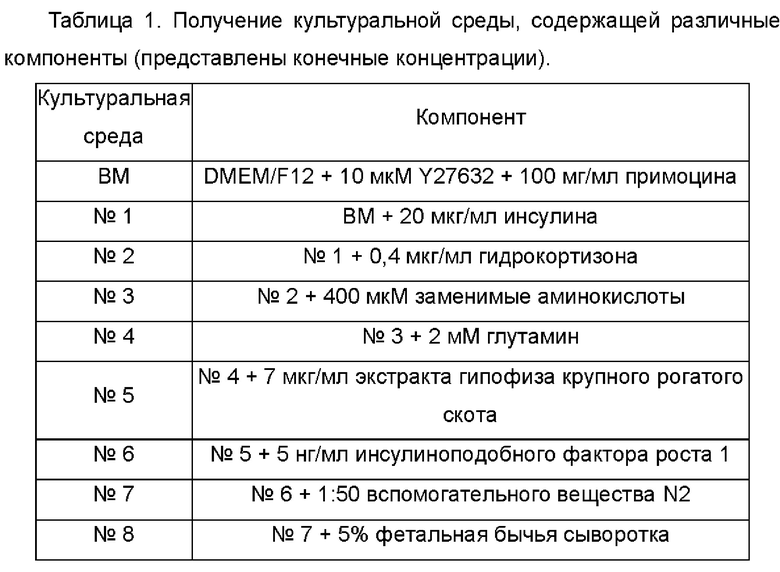
В соответствии с компонентами, представленными в таблице 1, готовили культуральные среды, содержащие различные компоненты, для исследования стимулирующего пролиферацию эффекта на клетки плоскоклеточной карциномы пищевода.
В среду DMEM/F12 (Corning) добавляли 10 мкМ Y27632 (МСЕ) и 100 мг/мл примоцина, в качестве основной культуральной среды (далее иногда обозначают ВМ), и добавляли различные факторы в эту основную культуральную среду. Среду №1 получали путем добавления инсулина (Gibco) в ВМ, среду №2 получали путем добавления гидрокортизона (Sigma) в среду №1, среду №3 получали путем добавления заменимых аминокислот (NEAA, Gibco) в среду №2, среду №4 получали путем добавления глутамина (Gibco) в среду №3, среду №5 получали путем добавления экстракта гипофиза крупного рогатого скота (BPE, М&С Gene Technology) в среду №4, среду №6 получали путем добавления инсулиноподобного фактора роста 1 (IGF-1, Sino Biological) в среду №5, среду №7 (далее иногда обозначают ЕМ) получали путем добавления вспомогательного вещества N2 (Gibco) в среду №6 и среду №8 получали путем добавления фетальной бычьей сыворотки (FBS, Gibco) в среду №7.
(2) Получение и культивирование первичных клеток плоскоклеточной карциномы пищевода.
1. Процесс получения.
Поверхности стерильной пробирки для центрифуги емкостью 15 мл, пипетки, пипетки для переноса емкостью 10 мл, стерильной всасывающей головки и т.д. стерилизовали и помещали на сверхчистое рабочее место для облучения ультрафиолетом в течение 30 минут. Культуральные среды, полученные в соответствии с таблицей 1, раствор для гидролиза тканей, полученный в соответствии с таблицей 2, и раствор для очистки тканей, полученный в соответствии с таблицей 3, вынимали из холодильной камеры с температурой 4°С заранее за 30 минут и уравновешивали до комнатной температуры.
2. Выделение первичных клеток плоскоклеточной карциномы пищевода.
2.1. Эндоскопические образцы ткани рака пищевода получали из образцов ткани пяти давших информированное согласие страдающих раком пищевода пациентов во время эндоскопического исследования, а именно, образец 50, образец 51, образец 52, образец 53 и образец 54, соответственно. Эндоскопическую ткань выделяли на сверхчистом рабочем месте и помещали в пробирку для центрифуги емкостью 15 мл, в которую затем добавляли 5 мл раствора для очистки тканей, а затем перемешивали и однократно промывали. Полученный продукт центрифугировали при 1500 об/мин в течение 4 минут.
2.2. Супернатант отбрасывали, и в полученный продукт добавляли смесь 1:1 основной культуральной среды и раствора для гидролиза тканей (дозировка составляла приблизительно 5 мл раствора для гидролиза тканей на 10 мг ткани). Образец маркировали именем и номером, запечатывали герметизирующей пленкой, а затем гидролизовали на шейкере при 37°С и 300 об/мин. Завершился ли гидролиз, определяли путем наблюдения раз в 1 час.
2.3. После гидролиза, негидролизованные куски ткани фильтровали через сетчатый фильтр с диаметром пор 40 мкм. Куски ткани на сетчатом фильтре промывали раствором для очистки тканей. Остальные клетки смывали в пробирку для центрифуги и центрифугировали при 1500 об/мин в течение 4 минут.
2.4. Супернатант отбрасывали и оставшиеся кластеры клеток исследовали визуально, чтобы определить, содержат ли они клетки крови. Если там содержались клетки крови, то добавляли 3 мл раствора, лизирующего клетки крови (Sigma), затем хорошо перемешивали, лизировали при 4°С в течение 15 минут, при встряхивании и тщательном перемешивании раз в каждые 5 минут. После лизиса, полученный продукт вынимали и центрифугировали при 1500 об/мин в течение 4 минут.
2.5. Супернатант отбрасывали и добавляли в полученный продукт 2 мл основной культуральной среды, чтобы ресуспендировать клетки, в качестве резерва.
3. Культивирование первичных клеток плоскоклеточной карциномы пищевода.
3.1. Наблюдение под микроскопом: 10 мкл ресуспендированных клеток отбирали и высевали на предметное стекло, и раковые клетки наблюдали под микроскопом через линзу объектива 10Х (EVOS М500, Invitrogen).
3.2. Количество живых клеток: 10 мкл ресуспендированной суспензии клеток тщательно смешивали с 10 мкл красителя трипанового синего (Invitrogen), а затем 10 мкл смеси добавляли в счетчик с визуализацией потока (JIMBIO FIL, Jiangsu Jimbio Technology Co., Ltd.) для получения концентрации клеток, размера частиц клеток и жизнеспособности клеток. Для подсчета выбирали клетки с размером частиц более 10 мкм.
3.3. Культивирование клеток: суспензию клеток каждого образца, которые подсчитывали выше в 3.2, разделяли на 9 равных частей, соответственно, и центрифугировали при 1500 об/мин в течение 4 минут, а затем ресуспендировали в 200 мкл ВМ и среды №1-8, соответственно. Полученные продукты высевали в 48-луночный планшет при плотности живых клеток, составляющей 1×104/см2 (10000 клеток на лунку), а затем в планшет добавляли клетки NIH-3T3, которые были облучены γ-лучами (доза облучения 35 Гр), при плотности клеток 2×104/см2. Наконец, содержимое каждой лунки 48-луночного планшета доводили до объема 500 мкл соответствующими культуральными средами, и полученный продукт тщательно перемешивали. После дезинфекции поверхности, планшет помещали в термостат на 37°С, 5% СО2 (Thermo Fisher) для культивирования. После разрастания клеток до покрытия более 85% 48-луночного планшета, клетки пересевали. (3) Результаты культивирования.
На 7 день культивирования, 48-луночный планшет вынимали, промывали 200 мкл 0,25% трипсина (Gibco) в течение 1 минуты. Жидкость удаляли путем отсасывания, и 500 мкл 0,05% трипсина (Gibco) снова добавляли в каждую лунку. Полученный продукт помещали в термостат на 37°С, 5% СО2 на 10 минут, чтобы прошла реакция, и гидролиз можно было остановить, если было видно под микроскопом (EVOS М500, Invitrogen), что клетки полностью гидролизованы. После центрифугирования при 1500 об/мин в течение 4 минут, супернатант отбрасывали, и добавляли 1 мл основной культуральной среды для ресуспендирования. Общее количество клеток определяли путем подсчета с помощью счетчика с визуализацией потока (JIMBIO FIL, Jiangsu Jimbio Technology Co., Ltd.). Результаты, полученные для первичных клеток плоскоклеточной карциномы пищевода, выделенных из эндоскопического образца ткани 50, показаны на фигуре 1.
По результатам, показанным на фигуре 1, можно определить, что по сравнению с основной культуральной средой, все указанные выше среды №1-7 могут вызывать пролиферацию первичных клеток плоскоклеточной карциномы пищевода на различных уровнях. При применении для культивирования первичных клеток плоскоклеточной карциномы пищевода среды, содержащей Y27632 и примоцин, инсулин, гидрокортизон, заменимые аминокислоты, глутамин, экстракт гипофиза крупного рогатого скота, IGF1, вспомогательное вещество N2 (среда №7), стимулирующий пролиферацию эффект было значительно лучше. Кроме того, когда для культивирования первичных клеток плоскоклеточной карциномы пищевода использовали среду №8, полученную путем добавления 5% фетальной бычьей сыворотки в среду №7, не наблюдали значительного улучшения стимулирующего пролиферацию эффекта по сравнению со средой №7 без добавления 5% фетальной бычьей сыворотки. Следовательно, можно прийти к выводу, что культуральную среду для первичных клеток плоскоклеточной карциномы пищевода в соответствии с настоящим изобретением можно применять без добавления фетальной бычьей сыворотки.
Пример 2. Эффект комбинации множества факторов в культуральной среде для первичных клеток плоско клеточной карциномы пищевода на пролиферацию первичных клеток плоскоклеточной карциномы пищевода.
В основные культуральные среды из Примера 1 (среда DMEM/F12 + 10 мкМ Y27632 + 100 мг/мл примоцина) отдельно добавляли вспомогательное вещество N2 при соотношении 1:50, 20 мкг/мл инсулина, 7 мкг/мл экстракта гипофиза крупного рогатого скота, 2 мМ глутамин, 400 мкМ заменимые аминокислоты, 0,4 мкг/мл гидрокортизона, 5 нг/мл инсулиноподобного фактора роста 1, соответственно, с получением культуральных сред из этого Примера.
В соответствии с тем же процессом, что и в Примере 1, выделяли образец 57, образец 58, образец 59, образец 60 и образец 61 эндоскопической ткани для получения первичных клеток плоскоклеточной карциномы пищевода, и полученные первичные клетки плоскоклеточной карциномы пищевода культивировали, применяя соответствующие культуральные среды, полученные в этом примере, а также среду ВМ и среду №7 (ЕМ) из Примера 1. Полученные продукты высевали в 48-луночный планшет при плотности живых клеток, составляющей 1×104/см2 (10000 клеток на лунку), а затем в планшет добавляли клетки NIH-3T3, которые были облучены γ-лучами (доза облучения 35 Гр), при плотности клеток 2×104/см2, а затем тщательно перемешивали. После дезинфекции поверхности, планшет помещали в термостат на 37°С, 5% CO2 (Thermo Fisher) для культивирования. На 7 день культивирования, 48-луночный планшет вынимали, промывали 200 мкл 0,25% трипсина (Gibco) в течение 1 минуты. Жидкость удаляли путем отсасывания, и 500 мкл 0,05% трипсина (Gibco) снова добавляли в каждую лунку. Полученный продукт помещали в термостат на 37°С, 5% СО2 на 10 минут, чтобы прошла реакция, и гидролиз можно было остановить, если было видно под микроскопом (EVOS М500, Invitrogen), что клетки полностью гидролизованы. После центрифугирования при 1500 об/мин в течение 4 минут, супернатант отбрасывали, и добавляли 1 мл основной культуральной среды для ресуспендирования. Общее количество клеток определяли путем подсчета с помощью счетчика с визуализацией потока (JIMBIO FIL, Jiangsu Jimbio Technology Co., Ltd.). Оценивали эффект комбинации двух факторов в культуральной среде для первичных клеток плоскоклеточной карциномы пищевода на пролиферацию первичных клеток плоскоклеточной карциномы пищевода. Результаты, полученные для первичных клеток плоскоклеточной карциномы пищевода, выделенных из эндоскопического образца ткани 57, показаны на фигуре 2.
На фигуре 2 показано, что когда фактор, выбранный из вспомогательного вещества N2, инсулина, экстракта гипофиза крупного рогатого скота, глутамина, заменимых аминокислот, гидрокортизона, инсулиноподобного фактора роста 1 дополнительно добавляли в основную культуральную среду (среду DMEM/F12 + 10 мкМ Y27632 + 100 мг/мл примоцина), эффективность пролиферации клеток была лучше, чем таковая в основной культуральной среде, но была не настолько хороша, как таковая в среде №7 (ЕМ) в Примере 1.
Пример 3. Эффект добавления других факторов в культуральную среду для первичных клеток плоскоклеточной карциномы пищевода в соответствии с настоящим изобретением на пролиферацию первичных клеток плоскоклеточной карциномы пищевода.
В среды №7 (ЕМ) из Примера 1 отдельно добавляли 10 нг/мл фактора роста фибробластов 2 (FGF2), 10 нг/мл фактора роста фибробластов 10 (FGF10), 10 нг/мл фактора роста фибробластов 7 (FGF7) или комбинацию 10 нг/мл FGF2, 10 нг/мл FGF10 и 10 нг/мл FGF7, соответственно, с получением сред этого Примера.
В соответствии с тем же процессом, что и в Примере 1, выделяли образец 62 и образец 63 эндоскопической ткани для получения первичных клеток плоскоклеточной карциномы пищевода, и полученные первичные клетки плоскоклеточной карциномы пищевода культивировали, применяя соответствующие культуральные среды, полученные в этом примере, а также среду №7 (ЕМ) из Примера 1. Полученные продукты высевали в 48-луночный планшет при плотности клеток 1×104/см2 (10000 клеток на лунку), а затем в планшет добавляли клетки NIH-3T3, которые были облучены γ-лучами (доза облучения 35 Гр), при плотности клеток 2×104/см2, а затем тщательно перемешивали. После дезинфекции поверхности, планшет помещали в термостат на 37°С, 5% СО2 (Thermo Fisher) для культивирования. На 7 день культивирования, 48-луночный планшет вынимали, промывали 200 мкл 0,25% трипсина (Gibco) в течение 1 минуты. Жидкость удаляли путем отсасывания, и 500 мкл 0,05% трипсина (Gibco) снова добавляли в каждую лунку. Полученный продукт помещали в термостат на 37°С, 5% СО2 на 10 минут, чтобы прошла реакция, и гидролиз можно было остановить, если было видно под микроскопом (EVOS М500, Invitrogen), что клетки полностью гидролизованы. После центрифугирования при 1500 об/мин в течение 4 минут, супернатант отбрасывали и добавляли 1 мл среды №7 (ЕМ) для ресуспендирования. Общее количество клеток определяли путем подсчета с помощью счетчика с визуализацией потока (JIMBIO FIL, Jiangsu Jimbio Technology Co., Ltd.). Оценивали эффект добавления других факторов в культуральную среду для первичных клеток плоскоклеточной карциномы пищевода в соответствии с настоящим изобретением на пролиферацию первичных клеток плоскоклеточной карциномы пищевода. Результаты, полученные для первичных клеток плоскоклеточной карциномы пищевода, выделенных из эндоскопического образца ткани 62, показаны на фигуре 3.
На Фигуре 3, отношение на оси ординат представляет собой отношение количества клеток, полученных путем культивирования в течение 7 дней, указанная культура содержала среду ЕМ и дополнительный фактор (различные дополнительные факторы), к количеству клеток, полученных путем культивирования в течение 7 дней в среде ЕМ. Если указанное отношение больше 1, то это свидетельствует о том, что добавление фактора (различных факторов) в среду ЕМ оказывает лучший эффект стимуляции пролиферации. Если отношение меньше 1, это свидетельствует о том, что добавление фактора (различных факторов) не оказывает предпочтительного эффекта по сравнению со средой ЕМ.
На Фиг. 3 показано, что когда для культивирования применяли среды, полученные путем дополнительного добавления FGF2 или FGF7 в среду №7 (ЕМ) из Примера 1, не наблюдали значимого эффекта на стимуляцию пролиферации по сравнению со средой ЕМ. Когда для культивирования применяли среды, полученные путем дополнительного добавления FGF7 в среду №7 (ЕМ) из Примера 1, пролиферация первичных клеток плоскоклеточной карциномы пищевода даже ингибировалась по сравнению со средой ЕМ.
Пример 4. Культивирование и идентификация первичных клеток плоскоклеточной карциномы пищевода.
В соответствии с тем же процессом, что и в Примере 1, выделяли образец 64 эндоскопической ткани для получения первичных клеток плоскоклеточной карциномы пищевода, и полученные первичные клетки плоскоклеточной карциномы пищевода культивировали, применяя среду №7 (ЕМ) из Примера 1. Полученные продукты высевали в 12-луночный планшет при плотности живых клеток, составляющей 1×104/см2 (45000 клеток на лунку), а затем в планшет добавляли клетки NIH-3T3, которые были облучены γ-лучами (доза облучения 35 Гр), при плотности клеток 2×104/см2, а затем тщательно перемешивали. После дезинфекции поверхности, планшет помещали в термостат на 37°С, 5% СО2 (Thermo Fisher) для культивирования.
На 12ый день культивированные клетки плоскоклеточной карциномы пищевода рассматривали под микроскопом (EVOS М500, Invitrogen). На Фигуре 4А и Фигуре 4В представлены фотографии, снятые под линзой объектива 4Х и 10Х, соответственно. Под микроскопом видно, что клетки близко расположены, и их морфология немного неровная.
Затем культивированные клетки промывали 200 мкл 0,25% трипсина (Gibco) в течение 1 минуты. Жидкость удаляли путем отсасывания, и 500 мкл 0,05% трипсина (Gibco) снова добавляли в каждую лунку. Полученный продукт помещали в термостат на 37°С, 5% СО2 на 10 минут, чтобы прошла реакция, и гидролиз можно было остановить, если было видно под микроскопом (EVOS М500, Invitrogen), что клетки полностью гидролизованы. После центрифугирования при 1500 об/мин в течение 4 минут, супернатант отбрасывали, и добавляли 500 мкл среды №7 (ЕМ) для ресуспендирования. Идентифицировали культивированные клетки плоскоклеточной карциномы пищевода.
100 мкл указанной выше суспензии клеток плоскоклеточной карциномы пищевода наносили на предметное стекло и идентифицировали путем окрашивания по методу Райт-Гимза. Процесс окрашивания описан ниже.
(1) Мазки суспензии клеток сушили на воздухе, а затем добавляли к ним по каплям 1 каплю раствора Райт-Гимза A (Baso), а затем 3 капли раствора Райт-Гимза В (Baso), тщательно смешивали и окрашивали в течение 3 минут.
(2) Мазки промывали проточной водой, помня, что раствор красителя следует удалять путем ополаскивания водой, а не выливания, чтобы предотвратить оседание взвешенных частиц на образце.
(3) Мазки сушили, а затем рассматривали и фотографировали под микроскопом (Olympus СХ41).
На Фигуре 5А и Фигуре 5В показаны результаты идентификации клеток плоскоклеточной карциномы пищевода, культивированных in vitro, путем окрашивания по методу Райт-Гимза, эти изображения получены в различных полях зрения под линзой объектива 10Х, соответственно. Ядра большие и интенсивно окрашенные, что согласуется со свойствами клеток плоскоклеточной карциномы.
Проводили иммунофлуоресцентное окрашивание клеток плоскоклеточной карциномы пищевода, культивированных из образца. Процесс окрашивания описан ниже.
(1) Прикрепление
Культивированные клетки плоскоклеточной карциномы пищевода высевали на предметные стекла (Thermo Fisher) и культивировали в термостате при 37°С, 5% СО2 до тех пор, пока клетки не прикрепились к стенке.
(2) Фиксация
 ФБР (Shanghai Sangon Biotech) использовали для получения 4% формальдегида (Sigma), который затем хранили в холодильной камере при 4°С до применения.
ФБР (Shanghai Sangon Biotech) использовали для получения 4% формальдегида (Sigma), который затем хранили в холодильной камере при 4°С до применения.
 После прикрепления клеток к стенке, культуральный раствор отбрасывали и клетки фиксировали на льду с помощью 4% формальдегида в течение 30 минут. Полученный продукт трижды промывали ФБР (Shanghai Sangon Biotech) в течение 5 минут.
После прикрепления клеток к стенке, культуральный раствор отбрасывали и клетки фиксировали на льду с помощью 4% формальдегида в течение 30 минут. Полученный продукт трижды промывали ФБР (Shanghai Sangon Biotech) в течение 5 минут.
(3) Пермеабилизация (избегая попадания света)
 Получение раствора для пермеабилизации: ФБР + 0,3% Н2О2 (Shanghai Sangon Biotech) + 0,3% тритон Х-100 (Shanghai Sangon Biotech).
Получение раствора для пермеабилизации: ФБР + 0,3% Н2О2 (Shanghai Sangon Biotech) + 0,3% тритон Х-100 (Shanghai Sangon Biotech).
 Пермеабилизация: ФБР отбрасывали, а затем добавляли раствор для пермеабилизации. Полученный продукт встряхивали (приблизительно при 100 об/мин) без доступа света, чтобы пермеабилизовать, в течение 30 минут, и трижды промывали ФБР в течение 5 минут.
Пермеабилизация: ФБР отбрасывали, а затем добавляли раствор для пермеабилизации. Полученный продукт встряхивали (приблизительно при 100 об/мин) без доступа света, чтобы пермеабилизовать, в течение 30 минут, и трижды промывали ФБР в течение 5 минут.
(4) Блокирование
ФБР + 0,3% тритон Х-100 использовали для приготовления 5% БСА (Shanghai Sangon Biotech), который применяли для блокирования, и блокирование проводили при 37°С в течение 30 минут.
(5) Инкубация с первичным антителом
 ФБР + 0,3% тритон Х-100 получали, чтобы разбавить антитело, причем специфическое к плоскоклеточной карциноме антитело р63 (CST) разбавляли в отношении 1:50. Блокирующий раствор отбрасывали и добавляли приготовленный разбавитель для первичных антител. Полученный продукт инкубировали в холодильной камере при 4°С в течение ночи.
ФБР + 0,3% тритон Х-100 получали, чтобы разбавить антитело, причем специфическое к плоскоклеточной карциноме антитело р63 (CST) разбавляли в отношении 1:50. Блокирующий раствор отбрасывали и добавляли приготовленный разбавитель для первичных антител. Полученный продукт инкубировали в холодильной камере при 4°С в течение ночи.
 Полученный продукт вынимали с 4°С, уравновешивали до комнатной температуры, продолжали инкубацию при 37°С в течение 1 часа, а затем трижды промывали ФБР в течение 5 минут.
Полученный продукт вынимали с 4°С, уравновешивали до комнатной температуры, продолжали инкубацию при 37°С в течение 1 часа, а затем трижды промывали ФБР в течение 5 минут.
(6) Вторичное антитело (избегая попадания света)
ФБР + 0,3% тритон Х-100 получали для разведения вторичного антитела, в нем флуоресцентное вторичное антитело кролика (Thermo Fisher) с длиной волны возбуждения 488 нм разбавляли в отношении 1:1000. Полученный продукт инкубировали при комнатной температуре в темноте в течение 1 ч, а затем трижды промывали ФБР в течение 5 минут.
(7) Окрашивание DAPI (избегая попадания света)
Разведение 1:1000 DAPI (Sigma) в ФБР применяли для окрашивания при комнатной температуре в темноте в течение 5 минут. Полученный продукт трижды промывали ФБР в течение 5 минут. Для регистрации снимали фотографии под микроскопом (EVOS М500, Invitrogen).
На Фигуре 6А и Фигуре 6В представлены результаты идентификации клеток плоско клеточной карциномы пищевода, культивированных in vitro, путем иммунофлуоресцентного окрашивания, которые представляют собой флуоресцентные изображения, снятые в различных полях зрения под линзой объектива 10Х, соответственно. На Фигурах показано, что все клетки в поле зрения окрашены зеленым при длине волны возбуждения 488 нм, указывая на то, что культивированные клетки представляют собой клетки плоскоклеточной карциномы, что согласуется с клиническим патологическим диагнозом.
Пример 6. Статистика первого периода культивирования и количество клеток плоскоклеточной карциномы пищевода, и расчет числа удвоения популяций (PD).
В соответствии с тем же процессом, что и в Примере 1, эндоскопические образцы ткани карциномы пищевода (образцы 1-40) гидролизовали для получения первичных клеток плоскоклеточной карциномы пищевода. Полученные первичные клетки плоскоклеточной карциномы пищевода культивировали, применяя среду №7 из Примера 1. Клетки высевали в 12-луночный планшет при плотности живых клеток, составляющей 1×104/см2, для культивирования. После размножения до покрытия 85% планшета, клетки гидролизовали и подсчитывали. В то же время регистрировали дни культивирования до момента гидролиза, которые принимали за один период культивирования. На фигуре 7 показано, что средний период культивирования 40 образцов составлял 10 дней, и среднее количество размноженных клеток составляло 700000.
При таком условии эксперимента непрерывно культивировали всего 9 образцов, т.е., образец 2, образец 5, образец 6, образец 8, образец 9, образец 11, образец 27, образец 39 и образец 40. Размноженные клетки амплифицировали в различных пассажах. Клетки каждого пассажа подсчитывали после гидролиза и регистрировали соответствующий период культивирования. Значение PD рассчитывали по формуле: удвоение популяции (PD)=3,32*log10 (общее количество клеток после гидролиза/исходное количество высеянных клеток). На фигуре 8 на оси абсцисс представлены дни культивирования клеток, а на оси ординат представлена кратность совокупной пролиферации клеток, т.е., кратность размножения клеток за период культивирования. Чем больше указанное значение, тем больше кратность размножения клеток за некоторый период, то есть, тем больше клеток размножилось. Уклон представляет скорость размножения клеток.
На Фигуре 8 можно наблюдать, что когда указанные выше 9 образцов культивировали с применением культуральной среды для первичных клеток плоскоклеточной карциномы пищевода в соответствии с настоящим изобретением, скорость размножения клеток оставалась по существу неизменной после 56 дней увеличения численности клеток, и все еще достигалась способность к длительному размножению.
Пример 7. Эффект концентраций добавленных факторов на пролиферацию клеток плоскоклеточной карциномы пищевода.
В соответствии с тем же процессом, что и в Примере 1, образец 65, образец 66, образец 67, образец 68 и образец 69 эндоскопической ткани выделяли для получения первичных клеток плоскоклеточной карциномы пищевода, и полученные первичные клетки плоскоклеточной карциномы пищевода культивировали, применяя среду №7 из Примера 1. Полученные продукты высевали в 12-луночный планшет при плотности живых клеток, составляющей 1×104/см2 (45000 клеток на лунку), а затем в планшет добавляли клетки NIH-3T3, которые были облучены γ-лучами (доза облучения 35 Гр), при плотности клеток 2×104/см2, а затем тщательно перемешивали. После дезинфекции поверхности, планшет помещали в термостат на 37°С, 5% СО2 (Thermo Fisher) для культивирования. После размножения клеток до покрытия более 85% планшета, 12-луночный планшет вынимали, промывали 200 мкл 0,25% трипсина (Gibco) в течение 1 минуты. Жидкость удаляли путем отсасывания, и 500 мкл 0,05% трипсина (Gibco) снова добавляли в каждую лунку. Полученный продукт помещали в термостат на 37°С, 5% СО2 на 10 минут, чтобы прошла реакция, и гидролиз можно было остановить, если было видно под микроскопом (EVOS М500, Invitrogen), что клетки полностью гидролизованы. После центрифугирования при 1500 об/мин в течение 4 минут, супернатант отбрасывали, и добавляли 1 мл основной культуральной среды для ресуспендирования. Общее количество клеток определяли путем подсчета с помощью счетчика с визуализацией потока (JIMBIO FIL, Jiangsu Jimbio Technology Co., Ltd.). Полученные клетки использовали для следующих экспериментов по культивированию.
Затем получали следующие 8 сред с различными составами для экспериментов:
Состав 1: среда №7 из Примера 1 без вспомогательного вещества N2;
Состав 2: среда №7 из Примера 1 без заменимых аминокислот;
Состав 3: среда №7 из Примера 1 без глутамина;
Состав 4: среда №7 из Примера 1 без инсулина;
Состав 5: среда №7 из Примера 1 без IGF1;
Состав 6: среда №7 из Примера 1 без экстракта гипофиза крупного рогатого скота;
Состав 7: среда №7 из Примера 1 без Y27632;
Состав 8: среда №7 из Примера 1 без гидрокортизона.
Гидролизованную суспензию клеток разбавляли указанными выше составами 1-8 и средой №7 из Примера 1, соответственно, и высевали в 24-луночный планшет по 20000 клеток и в объеме 500 мкл на лунку.
При применении среды с составом 1, получали градиент пяти концентраций вспомогательного вещества N2 в конечной концентрации 1:400, 1:200, 1:100, 1:50 и 1:25, соответственно, и полученные вспомогательные вещества N2 добавляли, соответственно, в 24-луночный планшет с высеянными первичными клетками, по 500 мкл на лунку; лунку со средой состава 1 использовали в качестве контроля (ВС).
При применении среды с составом 2, получали градиент пяти концентраций заменимых аминокислот в конечной концентрации 400 мкМ, 200 мкМ, 100 мкМ, 50 мкМ, 25 мкМ, соответственно, и полученные заменимые аминокислоты добавляли, соответственно, в 24-луночный планшет с высеянными первичными клетками, по 500 мкл на лунку; лунку со средой состава 2 использовали в качестве контроля (ВС).
При применении среды с составом 3, получали градиент пяти концентраций глутамина в конечной концентрации 8 мМ, 4 мМ, 2 мМ, 1 мМ, 0,5 мМ, соответственно, и полученный глутамин добавляли, соответственно, в 24-луночный планшет с высеянными первичными клетками, по 500 мкл на лунку; лунку со средой состава 3 использовали в качестве контроля (ВС).
При применении среды с составом 4, получали градиент пяти концентраций инсулина в конечной концентрации 40 мкг/мл, 20 мкг/мл, 10 мкг/мл, 5 мкг/мл, 2,5 мкг/мл, соответственно, и полученный инсулин добавляли, соответственно, в 24-луночный планшет с высеянными первичными клетками, по 500 мкл на лунку; лунку со средой состава 4 использовали в качестве контроля (ВС).
При применении среды с составом 5, получали градиент пяти концентраций инсулиноподобного фактора роста 1 (IGF1) в конечной концентрации 40 нг/мл, 20 нг/мл, 10 нг/мл, 5 нг/мл, 2,5 нг/мл, соответственно, и полученный инсулиноподобный фактор роста 1 (IGF1) добавляли, соответственно, в 24-луночный планшет с высеянными первичными клетками, по 500 мкл на лунку; лунку со средой состава 5 использовали в качестве контроля (ВС).
При применении среды с составом 6, получали градиент пяти концентраций экстракта гипофиза крупного рогатого скота в конечной концентрации 56 мкг/мл, 28 мкг/мл, 14 мкг/мл, 7 мкг/мл, 3,5 мкг/мл, соответственно, и полученный экстракт гипофиза крупного рогатого скота добавляли, соответственно, в 24-луночный планшет с высеянными первичными клетками, по 500 мкл на лунку; лунку со средой состава 6 использовали в качестве контроля (ВС).
При применении среды с составом 7, получали градиент пяти концентраций Y27632 в конечной концентрации 40 мкМ, 20 мкМ, 10 мкМ, 5 мкМ, 2,5 мкМ, соответственно, и полученный Y27632 добавляли, соответственно, в 24-луночный планшет с высеянными первичными клетками, по 500 мкл на лунку; лунку со средой состава 7 использовали в качестве контроля (ВС).
При применении среды с составом 8, получали градиент пяти концентраций гидрокортизона в конечной концентрации 1,6 мкг/мл, 0,8 мкг/мл, 0,4 мкг/мл, 0,2 мкг/мл, 0,1 мкг/мл, соответственно, и полученный гидрокортизон добавляли, соответственно, в 24-луночный планшет с высеянными первичными клетками, по 500 мкл на лунку; лунку со средой состава 8 использовали в качестве контроля (ВС).
Кроме того, получали градиенты 5 концентраций 8 низкомолекулярных соединений (LDN193189, IWP2, А83-01, форсколин, SB431542, CHIR99021, DMH-1, DAPT; все приобретали в МСЕ) в среде №7 согласно Примерам с получением конечной концентрации 10 мкМ, 3 мкМ, 1 мкМ, 0,3 мкМ, 0,1 мкМ, соответственно, и полученные 8 низкомолекулярных соединений (LDN193189, IWP2, А83-01, форсколин, SB431542, CHIR99021, DMH-1, DAPT) добавляли, соответственно, в 24-луночные планшеты с высеянными первичными клетками, по 500 мкл на лунку; лунку со средой №7 использовали в качестве контроля (ВС).
В то же время, 10000 облученных клеток NIH-3T3 добавляли в каждую из упомянутых выше лунок в качестве трофобластных клеток.
После того как клетки размножились до приблизительно 85% площади лунок 24-луночного планшета, клетки гидролизовали и подсчитывали, рассчитывали отношения к количеству клеток в контрольной лунке (ВС), и результаты представили на фигурах 9А-9Р. На каждой из Фигур 9А-9Р, отношение представляет собой отношение количества клеток первого пассажа, культивированных с применением каждой культуральной среды, к количеству клеток первого пассажа, культивированных в соответствующей контрольной лунке. Если указанное отношение более 1, то это свидетельствует о том, что эффект стимуляции пролиферации у полученной среды, содержащей различные концентрации факторов или низкомолекулярных соединений, превосходит таковой у среды в контрольной лунке; если отношение менее 1, то это свидетельствует о том, что эффект стимуляции пролиферации у полученной среды, содержащей различные концентрации факторов или низкомолекулярных соединений, слабее, чем таковой у среды в контрольной лунке.
На фигуре 9 показано, что диапазон концентраций вспомогательного вещества N2 составлял 1:400-1:25, и эффект пролиферации клеток был наиболее значительным при добавлении при отношении 1:50; диапазон концентраций заменимых аминокислот составлял 25-400 мкМ, и эффект пролиферации клеток был наиболее значительным при добавлении в концентрации 400 мкМ; диапазон концентраций глутамина составлял 0,5-8 мМ, и эффект пролиферации клеток был наиболее значительным при добавлении в концентрации 2 мМ; диапазон концентраций инсулиноподобного фактора роста 1 составлял 2,5-40 нг/мл, и эффект пролиферации клеток был наиболее значительным, когда концентрация составляла 5 нг/мл; диапазон концентраций экстракта гипофиза крупного рогатого скота составлял 3,5-56 мкг/мл, и эффект пролиферации клеток был наиболее значительным, когда концентрация составляла 7 мкг/мл; диапазон концентраций Y27632 составлял 2,5-40 мкМ, и эффект пролиферации клеток был наиболее значительным, когда концентрация составляла 10 мкМ; диапазон концентраций инсулина составлял 2,5-40 нг/мл, и эффект пролиферации клеток был наиболее значительным, когда концентрация составляла 20 нг/мл; диапазон концентраций гидрокортизона составлял 0,1-1,6 мкг/мл, и эффект пролиферации клеток был наиболее значительным, когда концентрация составляла 0,4 мкг/мл. У других 8 низкомолекулярных соединений (LDN193189, IWP2, А83-01, форсколин, SB431542, CHIR99021, DMH-1, DAPT) не выявили значительного эффекта на стимуляцию пролиферации при градиентах концентраций 10 мкМ, 3 мкМ, 1 мкМ, 0,3 мкМ, 0,1 мкМ.
Пример 8. Сравнение эффекта культуральной среды в соответствии с настоящим изобретением и среды известного уровня техники на пролиферацию клеток.
Среду КМ (среда для кератиноцитов) согласно непатентному документу 2 получали, как указано в Таблице 4.

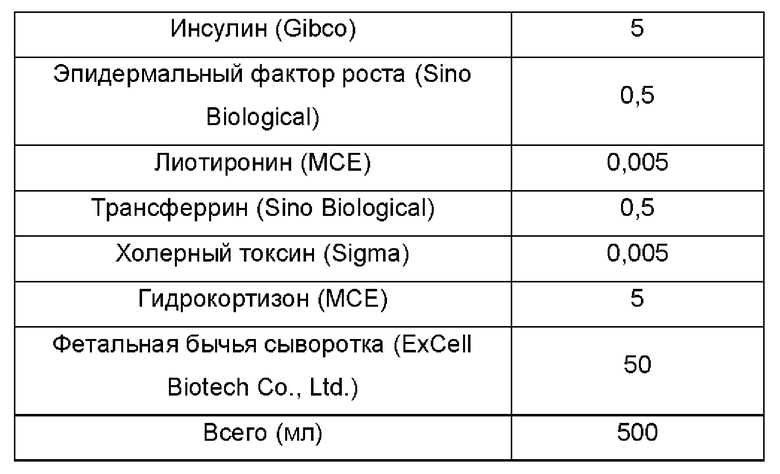
Среду FM согласно непатентному документу 3 получали, как указано в Таблице 5.
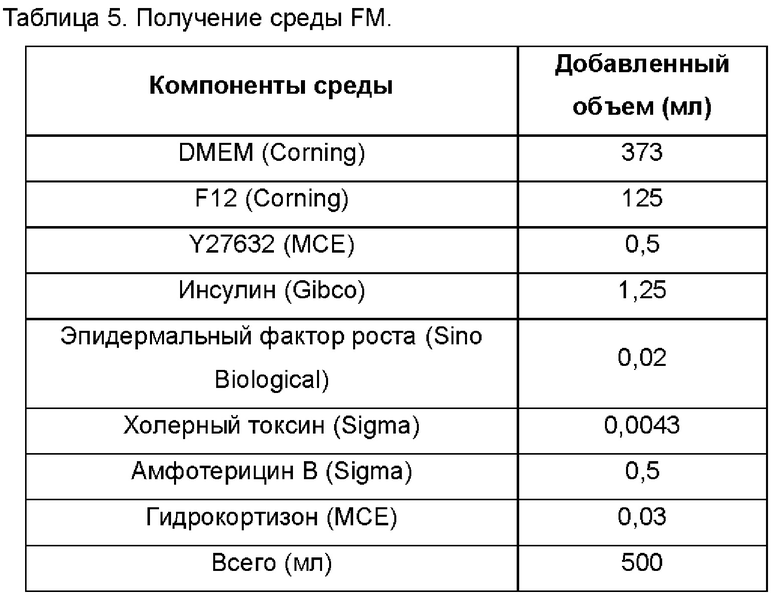
Среду KSFM приобретали в StemCell.
В соответствии с тем же процессом, что и в Примере 1, образец 70, образец 71 и образец 72 эндоскопической ткани выделяли для получения первичных клеток плоскоклеточной карциномы пищевода, которые культивировали, применяя среду ЕМ, среду KSFM, среду FM и среду КМ, соответственно.
Один из образцов (образец 70) описан ниже. Полученные первичные клетки плоскоклеточной карциномы пищевода ресуспендировали в 1 мл среды ЕМ, среды KSFM, среды FM и среды КМ, соответственно, и подсчитывали с помощью счетчика с визуализацией потока (JIMBIO FIL, Jiangsu Jimbio Technology Co., Ltd.)
Полученные продукты высевали в два 24-луночных планшета при плотности живых клеток, составляющей 1×104/см2 (20000 клеток на лунку), соответственно, причем один 24-луночный планшет культивировали без добавления клеток NIH-3T3, которые были облучены γ-лучами, а в другой 24-луночный планшет добавляли клетки NIH-3T3, которые были облучены γ-лучами (доза облучения 35 Гр), при плотности клеток 2×104/см2, а затем тщательно перемешивали. После дезинфекции поверхности, планшеты помещали в термостат при 37°С, 5% СО2 (Thermo Fisher) для культивирования. На 5ый день культивирования, 24-луночные планшеты вынимали, промывали 200 мкл 0,25% трипсина (Gibco) в течение 1 минуты. Жидкость удаляли путем отсасывания, и 500 мкл 0,05% трипсина (Gibco) снова добавляли в каждую лунку. Полученные продукты помещали на 37°С, 5% СО2 на 10 минут, чтобы прошла реакция, и гидролиз можно было остановить, если было видно под микроскопом (EVOS М500, Invitrogen), что клетки полностью гидролизованы. После центрифугирования при 1500 об/мин в течение 4 минут, отбрасывали супернатант и добавляли 1 мл основной культуральной среды для ресуспендирования. Общие количества клеток, культивированных в различных средах, определяли путем подсчета с помощью счетчика с визуализацией потока (JIMBIO FIL, Jiangsu Jimbio Technology Co., Ltd.). Результаты показаны на фигуре 11.
На Фигуре 10 можно наблюдать, что по сравнению со средой КМ, средой FM и средой KSFM, среда ЕМ позволяет получить наибольшее количество размноженных клеток при условии посева одинакового количества клеток (20000/лунку) и культивирования в течение одинакового времени, и, следовательно, оказывает значительный эффект стимуляции пролиферации клеток плоскоклеточной карциномы пищевода. Кроме того, на Фигуре 10 можно также наблюдать, что эффект среды ЕМ в культуре с применением трофобластных клеток лучше, чем таковой в отсутствие трофобластных клеток. Таким образом, культуральная среда для первичных клеток плоскоклеточной карциномы пищевода в соответствии с настоящим изобретением оказывает значительный эффект стимуляции пролиферации клеток плоскоклеточной карциномы пищевода при культивировании с трофобластными клетками, что может сократить время культивирования.
Пример 9. Применение первичных клеток плоскоклеточной карциномы пищевода, полученных путем размножения в культуральной среде в соответствии с настоящим изобретением, для скрининга лекарственных средств.
1. Культивирование и посев клеток.
В соответствии с тем же процессом, что и в Примере 1, первичные клетки плоскоклеточной карциномы пищевода выделяли из эндоскопических образцов плоскоклеточной карциномы пищевода и культивировали в среде №7 из Примера 1. После того, как клетки размножились до покрытия 85% планшета, их гидролизовали в качестве одного пассажа. Первый, третий, пятый, седьмой и девятый пассажи культивированных клеток выбирали для скрининга лекарственных средств.
Клетки гидролизовали и подсчитывали в соответствии с этапами в Примере 1, и тщательно смешивали со средой №7 из Примера 1 в загрузочном слоте (Corning) при плотности живых клеток, составляющей 4×104 клеток/см2, а затем культивировали в 384-луночном непрозрачном белом планшете для культивирования клеток (Corning). Объем в каждой лунке составлял 50 мкл и количество клеток составляло 200/лунку. Планшет запечатывали после добавления среды №7 из Примера 1 от края планшета, и подписывали на планшете названия образцов и время тестирования CellTiter-Glo (Promega). Поверхность дезинфицировали с помощью 75% спирта (LIRCON), и полученный продукт культивировали в термостате при 37°С, 5% СО2. Лекарственные средства добавляли через 24 часа.
2. Получение кандидатных лекарственных средств.
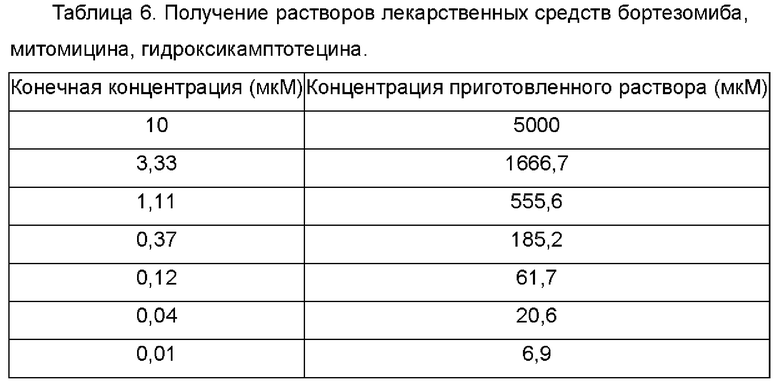
Получали градиенты 7 концентраций трех лекарственных средств (бортезомиба, митомицина и гидроксикамптотецина; все приобретали в МСЕ) в соответствии со следующей таблицей, каждую из которых добавляли в каждую лунку 384-луночного планшета (Thermo Fisher) в объеме 50 мкл и хранили при -20°С до момента применения.
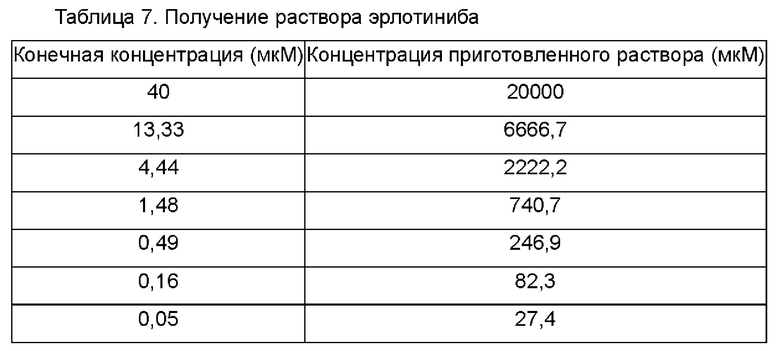
Эрлотиниб (МСЕ) получали в градиенте 7 концентраций в соответствии со следующей таблицей, каждую из которых затем добавляли в каждую лунку 384-луночного планшета (Thermo Fisher) в объеме 50 мкл, и хранили при -20°С до момента применения.
3. Высокопроизводительное добавление лекарственных средств.
Подготовленный планшет с лекарственными средствами вынимали и оставляли при комнатной температуре. После полного размораживания планшет помещали в центрифугу (Sigma 3-18K) и центрифугировали при комнатной температуре в течение 1 минуты при 1000 об/мин. Высокопроизводительную рабочую станцию (JANUS, Perkin Elmer) использовали для высокопроизводительного дозирования. В каждую лунку 384-луночного планшета с культивированными клетками плоскоклеточной карциномы пищевода добавляли 0,1 мкл кандидатных лекарственных средств в соответствующих концентрациях. После дозирования, поверхность 384-луночного планшета дезинфицировали и перемещали в термостат для дальнейшего культивирования. Жизнеспособность клеток измеряли через 72 часа.
4. Измерение жизнеспособности клеток.
Люминесцентный реагент CellTiter-Glo (Promega) вынимали из холодильной камеры с температурой 4°С, и 10 мл реагента добавляли в загрузочный слот; 384-луночный планшет для тестирования вынимали из термостата, и добавляли 10 мкл люминесцентного реагента CellTiter-Glo в каждую лунку. После отстаивания в течение 10 мин, проводили анализ, применяя многофункциональный спектрофотометр для прочтения микропланшетов (Envision, Perkin Elmer).
5. Обработка результатов.
Согласно формуле: уровень выживаемости клеток (%) = значение хемилюминесценции в лунке с лекарственным средством/значение хемилюминесценции в контрольной лунке * 100%, - рассчитывали уровень выживаемости клеток, обработанных различными лекарственными средствами, и рассчитывали концентрацию полумаксимального ингибирования (IC50) клеток лекарственными средствами, применяя программное обеспечение GraphPad Prism. Результаты представлены на фигурах 11А-11D, соответственно.
На основании Фигур 11А-11D можно утверждать, что когда клетки плоскоклеточной карциномы пищевода, культивированные в культуральной среде для первичных клеток плоскоклеточной карциномы пищевода в соответствии с настоящим изобретением, использовали для скрининга лекарственного средства, ингибиторные эффекты того же лекарственного средства на культивированные клетки из различных пассажей оставались по существу одинаковыми (кривые ингибирования по существу сопоставимы).
Промышленная применимость.
В соответствии с настоящим изобретением предложены культуральная среда и способ культивирования для быстро размножающихся первичных клеток плоскоклеточной карциномы пищевода in vitro, которые позволяют осуществить быстрое размножение образцов ткани плоскоклеточной карциномы пищевода за короткое время и амплифицировать достаточные количества клеток за эффективное время, которые можно применять для высокопроизводительных тестов чувствительности к лекарственным средствам in vitro и для определения точного клинического лечения.
Группа изобретений относится к биотехнологии. Предложены: культуральная среда и способ культивирования быстро размножающихся первичных клеток плоскоклеточной карциномы пищевода in vitro, и их применение для скрининга лекарственных средств. Культуральная среда содержит исходную культуральную среду, выбранную из DMEM/F12, DMEM, F12 или RPMI-1640, ингибитор протеазы Rho, антибиотик, инсулин, вспомогательное вещество N2, инсулиноподобный фактор роста 1, заменимую аминокислоту, гидрокортизон, глутамин и экстракт гипофиза крупного рогатого скота. 3 н. и 3 з.п. ф-лы, 11 ил., 7 табл., 9 пр.
1. Культуральная среда для первичных клеток плоскоклеточной карциномы пищевода, характеризующаяся тем, что она содержит:
исходную культуральную среду, ингибитор протеазы Rho, антибиотик, инсулин, вспомогательное вещество N2, инсулиноподобный фактор роста 1, заменимую аминокислоту, гидрокортизон, глутамин и экстракт гипофиза крупного рогатого скота,
указанная исходная культуральная среда выбрана из DMEM/F12, DMEM, F12 или RPMI-1640.
2. Культуральная среда для первичных клеток плоскоклеточной карциномы пищевода по п. 1, отличающаяся тем, что:
ингибитор протеазы Rho выбран из одного или более из Y27632, гидроксифасудила и GSK429286A; в случае Y27632, имеющего концентрацию в диапазоне 2,5-40 мкМ, предпочтительно 5-20 мкМ; в случае гидроксифасудила, имеющего концентрацию в диапазоне 2-32 мкМ, предпочтительно 4-16 мкМ; и в случае GSK429286A, имеющего концентрацию в диапазоне 2-32 мкМ, предпочтительно 4-16 мкМ;
антибиотики выбраны из одного или более из стрептомицина/пенициллина, амфотерицина B и примоцина; в случае стрептомицина/пенициллина, стрептомицина, имеющего концентрацию в диапазоне 25-400 мкг/мл, предпочтительно 50-200 мкг/мл, пенициллина, имеющего концентрацию в диапазоне 25-400 Ед/мл, предпочтительно 50-200 Ед/мл, более предпочтительно 200 Ед/мл; в случае амфотерицина B, имеющего концентрацию в диапазоне 0,25-4 мкг/мл, предпочтительно 0,5-2 мкг/мл; и в случае примоцина, имеющего концентрацию в диапазоне 25-400 мг/мл, предпочтительно 50-200 мг/мл;
инсулин имеет концентрацию в диапазоне 2,5-40 мкг/мл, предпочтительно 10-40 мкг/мл;
объемное отношение вспомогательного вещества N2 к культуральной среде составляет 1:400-1:25, предпочтительно 1:100-1:25;
инсулиноподобный фактор роста 1 имеет концентрацию в диапазоне 2,5-40 нг/мл, предпочтительно 2,5-10 нг/мл;
заменимая аминокислота выбрана из одной или более из следующих аминокислот: глицин, аланин, аспарагин, аспарагиновая кислота, глутаминовая кислота, пролин и серин, с общей концентрацией в диапазоне 50-400 мкМ, предпочтительно 100-400 мкМ;
гидрокортизон имеет концентрацию в диапазоне 0,2-1,6 мкг/мл, предпочтительно 0,2-0,8 мкг/мл;
глутамин имеет концентрацию в диапазоне 1-8 мМ, предпочтительно 1-4 мМ;
экстракт гипофиза крупного рогатого скота имеет концентрацию в диапазоне 3,5-56 мкг/мл, предпочтительно 3,5-14 мкг/мл.
3. Способ культивирования первичных клеток плоскоклеточной карциномы пищевода, в котором:
первичные клетки плоскоклеточной карциномы пищевода культивируют с применением культуральной среды для первичных клеток плоскоклеточной карциномы пищевода по п. 1 или 2.
4. Способ культивирования по п. 3, отличающийся тем, что:
в процессе культивирования добавляют трофобластные клетки при плотности клеток 2-3 × 104/см2.
5. Способ культивирования по п. 4, отличающийся тем, что:
указанные трофобластные клетки представляют собой облученные клетки NIH-3T3, и источником облучения являются рентгеновские лучи или γ-лучи, при дозе облучения 30-50 Гр.
6. Способ скрининга лекарственных средств для плоскоклеточной карциномы пищевода, характеризующийся тем, что он включает следующие этапы:
(1) культивирование первичных клеток плоскоклеточной карциномы пищевода для скрининга лекарственных средств путем применения способа культивирования первичных клеток плоскоклеточной карциномы пищевода по любому из пп. 3-5;
(2) выбор лекарственного средства для исследования и разбавление указанного лекарственного средства на основании необходимых градиентов концентрации;
(3) добавление разбавленного лекарственного средства к клеткам, культивированным и полученным на этапе (1);
(4) измерение жизнеспособности клеток;
(5) расчет уровня выживаемости клеток на основе результатов, полученных на этапе (4), и расчет концентрации полумаксимального ингибирования (IC50) клеток лекарственными средствами, а также скрининг лекарственных средств для плоскоклеточной карциномы пищевода на основе результатов IC50.
| CN 106190980 A, 07.12.2016 | |||
| JP 2014233281 A, 15.12.2015 | |||
| KATAYAMA M et al | |||
| Primary culture of human esophageal epithelial cells | |||
| The Tohoku journal of experimental medicine, Vol | |||
| Крутильная машина для веревок и проч. | 1922 |
|
SU143A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| СРЕДА ДЛЯ КУЛЬТУРЫ КЛЕТОК, НЕ СОДЕРЖАЩАЯ ОЛИГОПЕПТИДОВ | 2013 |
|
RU2642269C9 |
Авторы
Даты
2024-06-28—Публикация
2020-02-26—Подача