Область техники
Настоящее изобретение относится к области медицины, в частности, к среде для культивирования и способу культивирования для культивирования или размножения клеток стромальной опухоли желудочно-кишечного тракта in vitro, и также к способу и применению указанных культивированных клеток при оценке эффективности и скрининге лекарственных средств.
Уровень техники
Стромальная опухоль желудочно-кишечного тракта (GIST) представляет собой разновидность опухоли, происходящей из мезенхимальной ткани желудочно-кишечного тракта, на которую приходится большинство мезенхимальных опухолей желудочно-кишечного тракта, в большинстве случаев встречающуюся в желудке (50-70%). Из-за нечувствительности к традиционной лучевой терапии хирургическая резекция является эффективным методом лечения GIST. В то же время для пациентов, у которых возможность хирургического вмешательства утрачена из-за прогрессирования, метастазирования или послеоперационного рецидива опухоли, медианное время выживания с GIST составляет всего 6-18 месяцев, а 5-летняя выживаемость составляет менее 10%. За последнее десятилетие с широким применением технологии молекулярной биологии в клинической диагностике и лечении GIST, особенно с появлением и популяризацией молекулярных таргетных лекарственных средств, например, иматиниба, прогноз пациентов с GIST значительно улучшился. В настоящее время общепризнан значимый лечебный эффект иматиниба при лечении GIST на поздней стадии и послеоперационной адъювантной терапии GIST, однако в то же время исследователи проявляют все большую обеспокоенность по поводу первичной и вторичной лекарственной устойчивости к иматинибу. Исследования показали, что у 40%-50% пациентов развивается лекарственная устойчивость в течение 2 лет после получения иматиниба, у пациентов с устойчивостью к иматинибу, получавших сунитиниб в качестве лекарственного средства второй линии, медианная выживаемость без прогрессирования составляет всего 6,8 месяца, в то время как у пациентов, получавших регорафениб в качестве лекарственного средства третьей линии, медианная выживаемость без прогрессирования составляет всего 4,8 месяца. Поэтому крайне необходимо провести дальнейшие исследования патогенеза стромальных опухолей желудочно-кишечного тракта в клинической практике и разработать новые лекарственные средства для лечения стромальных опухолей желудочно-кишечного тракта.
Однако в настоящее время отсутствуют подходящие модели для исследования стромальных опухолей желудочно-кишечного тракта. Это в основном связано с различием между стромальными опухолями желудочно-кишечного тракта и другими распространенными опухолями. Распространенные опухоли, например, рак легких и рак молочной железы, имеют эпителиальное происхождение. В настоящее время способы культивирования опухолевых клеток из эпителия in vitro развиваются относительно быстро, в то время как о способах культивирования опухолевых клеток из неэпителиальных тканей in vitro сообщается редко (Xu et al., Journal of Hematology & Oncology, 11: 116, 2018). Кроме того, количество установленных моделей линий клеток стромальной опухоли желудочно-кишечного тракта также очень ограничено, и лишь несколько линий клеток стромальной опухоли желудочно-кишечного тракта доступны для приобретения у международных коммерческих компаний, производящих клетки, что создает много препятствий для фундаментальных исследований и разработки новых лекарственных средств для лечения стромальных опухолей желудочно-кишечного тракта.
Технология с использованием свежих образцов опухоли от пациентов со стромальными опухолями желудочно-кишечного тракта для разработки первичной культуры клеток стромальной опухоли желудочно-кишечного тракта in vitro является хорошим средством разработки моделей для исследования стромальных опухолей желудочно-кишечного тракта. Однако в настоящее время не существует признанного эффективного способа культивирования полученных от пациента первичных клеток стромальной опухоли желудочно-кишечного тракта in vitro. В большинстве описанных способов (Liu et al., Am J Pathol, 183(6): 1862-1870, 2013; Liu et al., Ther Adv Med Oncol, 11: 1-15, 2019; Fukuda, Oncology Reports, 30: 71-78, 2013; Zhu et al., Journal of Central South University, 35(11): 1138-1144, 2010), которые, как правило, характеризуются проблемами, связанными с низкими показателями успешности культивирования и мешающим влиянием со стороны стромальных опухолевых клеток, не имеющих отношения к желудочно-кишечному тракту, например, фибробластов, к среде для культивирования добавляют сыворотку.
Таким образом, необходимо срочно разработать эффективный способ культивирования полученных от пациента первичных клеток стромальной опухоли желудочно-кишечного тракта in vitro в целях удовлетворения потребности в сфере фундаментальных исследований и разработки новых лекарственных средств в области стромальных опухолей желудочно-кишечного тракта.
Краткое описание изобретения
Настоящее изобретение направлено на среды для культивирования клеток для культивирования первичных клеток стромальной опухоли желудочно-кишечного тракта и способа культивирования для культивирования первичных клеток стромальной опухоли желудочно-кишечного тракта с применением указанной среды. Среда для культивирования клеток и способ культивирования согласно настоящему изобретению могут обеспечить достижение результата, заключающегося в высокой частоте успеха, удобстве работы и отсутствии влияния стромальных опухолевых клеток, не имеющих отношения к желудочно-кишечному тракту, например, фибробластов. При применении среды для культивирования клеток и способа культивирования согласно настоящему изобретению для конструирования моделей на основе первичных клеток стромальной опухоли желудочно-кишечного тракта можно получить клетки стромальной опухоли желудочно-кишечного тракта с собственными биологическими характеристиками пациентов со стромальной опухолью желудочно-кишечного тракта, которые можно использовать для оценки эффективности или скрининга лекарственных средств.
В одном аспекте настоящего изобретения предложена среда для культивирования клеток для культивирования первичных клеток стромальной опухоли желудочно-кишечного тракта, содержащая гастрин, N2, инсулин, лиганд рецепторной тирозинкиназы и ингибитор Rock-киназы. Содержание гастрина предпочтительно составляет 0,3 нМ - 10 нМ, более предпочтительно 0,3 нМ - 3 нМ и более предпочтительно 0,3 нМ - 1 нМ.
Объемная концентрация N2 в среде для культивирования клеток составляет от 1:25 до 1:200; предпочтительно, объемная концентрация N2 составляет от 1:50 до 1:100.
Содержание инсулина составляет от 2 мкг/мл до 20 мкг/мл, предпочтительно от 5 мкг/мл до 10 мкг/мл. Например, в среду для культивирования добавляют коммерческий раствор инсулина (10 мг/мл, производства Sigma) в соотношении разбавления 1:500-1:5000, предпочтительно в соотношении разбавления 1:1000-1:2000; в качестве альтернативы, в среду для культивирования добавляют коммерчески доступную инсулинсодержащую добавку для культивирования, инсулин-трансферрин-селен-этаноламин (содержащую 1 мг/мл инсулина, производства Gibco), в соотношении разбавления 1:50-1:500, предпочтительно в соотношении разбавления 1:100-1:200.
Лиганд рецепторной тирозинкиназы представляет собой по меньшей мере одно соединение, выбранное из группы, состоящей из тромбоцитарного фактора роста АА, тромбоцитарного фактора роста ВВ, тромбоцитарного фактора роста СС, фактора стволовых клеток, инсулинового фактора роста 1, основного фактора роста фибробластов и фактора роста фибробластов 10; лиганд рецепторной тирозинкиназы предпочтительно представляет собой одно или более соединений, выбранных из группы, состоящей из тромбоцитарного фактора роста АА, фактора стволовых клеток и основного фактора роста фибробластов. При наличии одного или более лигандов рецепторной тирозинкиназы содержание каждого лиганда рецепторной тирозинкиназы составляет от 5 нг/мл до 500 нг/мл, предпочтительно от 20 нг/мл до 100 нг/мл.
Ингибитор Rock-киназы представляет собой по меньшей мере одно соединение, выбранное из группы, состоящей из Y27632, фасудила и Н-1152. Предпочтительным ингибитором Rock-киназы является Y27632. Содержание ингибитора Rock-киназы составляет 2-50 мкМ, предпочтительно 5-10 мкМ.
Дополнительно, среда для культивирования клеток согласно настоящему изобретению не содержит компонентов сыворотки, необходимых для описанных сред для культивирования первичных клеток стромальной опухоли желудочно-кишечного тракта (Fukuda et al., Oncology Reports, 2013, 30: 71-78; Liu et al., Nat Protoc. 2017, 12(2): 439-451), что позволяет избегать мешающего влияния чрезмерной пролиферации фибробластов.
Во втором аспекте настоящего изобретения предложен способ культивирования для культивирования первичных клеток стромальной опухоли желудочно-кишечного тракта, причем указанный способ культивирования включает следующие этапы:
(1) приготовление среды для культивирования клеток согласно настоящему изобретению;
(2) нанесение покрытия из коллагена на сосуд для культивирования;
(3) инокулирование первичных клеток стромальной опухоли желудочно-кишечного тракта в сосуд для культивирования с покрытием, культивирование указанных клеток при концентрации кислорода 0,1% - 25% с использованием среды для культивирования клеток согласно настоящему изобретению, и отделение указанных клеток для субкультивирования, когда первичные клетки стромальной опухоли желудочно-кишечного тракта достигают плотности, соответствующей приблизительно 80% - 90% площади дна сосуда для культивирования.
При этом коллаген, используемый в указанном способе культивирования, представляет собой коллаген I типа из хвоста крысы, например, можно использовать коммерческий коллаген I (производства Corning). Более конкретно, коллаген разводят сверхчистой водой в соотношении разбавления 1:5-1:100, предпочтительно в соотношении разбавления 1:10-1:50.
Способ нанесения покрытия включает добавление разбавленного коллагена в сосуд для культивирования так, чтобы он полностью покрывал дно сосуда, и выдерживание в течение 30 минут или более.
Первичные клетки стромальной опухоли желудочно-кишечного тракта можно получить из тканей стромальной опухоли желудочно-кишечного тракта, полученных от пациента.
Например, сбор вышеуказанных образцов ткани выполняют в течение получаса после хирургической резекции или биопсии у пациента. Более конкретно, из не затронутых некрозом участков стерильно вырезают образец ткани объемом 0,5 см3 или более, а затем помещают в предварительно охлажденную среду DMEM/F12 объемом 10-50 мл, содержащуюся в пластмассовой стерильной центрифужной пробирке с крышкой, и переносят в лабораторию на льду; причем среда DMEM/F12 содержит 50-200 ед/мл (например 100 ед/мл) пенициллина и 50-200 мкг/мл (например 100 мкг/мл) стрептомицина (здесь и далее в настоящей заявки такую среду называют «транспортной жидкостью»).
В биобезопасном боксе образец ткани переносят в чашку для культивирования клеток, которую затем промывают транспортной жидкостью, с поверхности образца ткани смывают клетки крови и удаляют ненужные ткани, например, кожу и фасцию на поверхности образца ткани.
Промытый образец ткани переносят в новую чашку для культивирования, добавляя 5-25 мл транспортной жидкости, и разделяют на фрагменты ткани диаметром менее 1 мм3 с помощью скальпеля со стерильным лезвием и пинцета.
Фрагменты образца ткани переносят в центрифужную пробирку, которую центрифугируют при 1000 об/мин или более в течение 3-10 минут в настольной центрифуге; после аккуратного извлечения супернатанта пипеткой из центрифужной пробирки полученный осадок ресуспендируют в 5-25 мл среды DMEM/F12, не содержащей сыворотки и содержащей коллагеназу II (0,5-5 мг/мл, например, 1 мг/мл) и коллагеназу IV (0,5-5 мг/мл, например, 1 мг/мл), и встряхивают, расщепляя на шейкере при постоянной температуре 37°С в течение по меньшей мере 30 минут (время расщепления зависит от размера образца; если образец больше 1 г, время расщепления увеличивают до 1,5-2 часов); затем центрифугируют при 300 g/мин или более в течение 3-10 минут в настольной центрифуге; после утилизации супернатанта отделенные клетки ткани ресуспендируют в 5-25 мл среды DMEM/F12, содержащей, например, 10% эмбриональной телячьей сыворотки, а затем диспергируют и протирают через клеточное сито с размером отверстий, например, 100 мкм; протертую через сито суспензию клеток собирают в центрифужную пробирку; клетки подсчитывают с помощью гемоцитометра.
Затем суспензию клеток центрифугируют при 300 g/мин или более в течение 3-10 минут в центрифуге; после утилизации супернатанта полученный осадок ресуспендируют в среде для культивирования согласно настоящему изобретению, а затем инокулируют в сосуд для культивирования с покрытием при плотности 1×103 - 1×105 клеток/мл для культивирования.
В указанном способе культивирования на этапе культивирования первичные клетки стромальной опухоли желудочно-кишечного тракта предпочтительно культивировать при концентрации кислорода от 0,1% до 4%.
В третьем аспекте настоящего изобретения предложен способ оценки эффективности лекарственных средств для лечения стромальной опухоли желудочно-кишечного тракта или скрининга лекарственных средств для лечения стромальной опухоли желудочно-кишечного тракта, включающий применение среды для культивирования и способа культивирования согласно настоящему изобретению для получения размноженных клеток-потомков стромальной опухоли желудочно-кишечного тракта, и их применение в способе и варианте применения для оценки эффективности и скрининга лекарственных средств, в частности, в способе и варианте применения для оценки эффективности и скрининга противоопухолевых лекарственных средств in vitro.
Способ оценки эффективности лекарственных средств для лечения стромальной опухоли желудочно-кишечного тракта или скрининга лекарственных средств для лечения стромальной опухоли желудочно-кишечного тракта предпочтительно включает следующие этапы:
(1) получение первичных клеток стромальной опухоли желудочно-кишечного тракта и их культивирование с применением среды для культивирования и способа культивирования согласно настоящему изобретению для получения клеток стромальной опухоли желудочно-кишечного тракта;
(2) обеспечение лекарственных средств для тестирования с требуемыми градиентами концентрации;
(3) добавление различных концентраций лекарственного средства, полученного на этапе (2), к клеткам стромальной опухоли желудочно-кишечного тракта, культивированным на этапе (1); и
(4) определение жизнеспособности клеток.
Благоприятные эффекты настоящего изобретения включают:
(1) клетки стромальной опухоли желудочно-кишечного тракта, культивированные in vitro с использованием среды для культивирования и способа культивирования согласно настоящему изобретению, могут поддерживать патологический фенотип и гетерогенность, как в организме пациента-хозяина клеток, и могут применяться в области регенеративной медицины;
(2) на культивированные клетки стромальной опухоли желудочно-кишечного тракта не влияют такие клетки, как фибробласты, и можно получить очищенные клетки стромальной опухоли желудочно-кишечного тракта и их потомки;
(3) в состав среды для культивирования не входят компоненты неопределенного состава, например, сыворотка, и, соответственно, на указанную среду не оказывают влияния качество и количество сыворотки из разных партий;
(4) эта технология позволяет получить клетки стромальной опухоли желудочно-кишечного тракта с высокой однородностью и контролируемой стоимостью, которые подходят для оценки эффективности и скрининга лекарственных средств, а также для тестирования токсичности, включая высокопроизводительный скрининг новых соединений-кандидатов и высокопроизводительные функциональные тесты для пациентов на чувствительность к лекарственным средствам in vitro.
Применение среды для культивирования клеток согласно этому варианту реализации позволяет культивировать клетки стромальной опухоли желудочно-кишечного тракта, происходящие из организма человека или других млекопитающих, или ткани, содержащие по меньшей мере любые из этих клеток, с получением размноженных соответствующих потомков клеток стромальной опухоли желудочно-кишечного тракта.
Кроме того, клетки, полученные способом культивирования согласно этому варианту реализации, можно применять в регенеративной медицине, при тестировании токсичности, в фундаментальных медицинских исследованиях клеток стромальной опухоли желудочно-кишечного тракта, при скрининге реакций на лекарственные средства, определении метаболической стабильности in vitro и метаболического спектра лекарственных средств и разработке новых лекарственных средств, мишенью которых являются стромальные опухоли желудочно-кишечного тракта, и т.п.
Краткое описание чертежей
На Фигурах 1А и 1В представлены графики, на которых показано влияние различных концентраций гастрина I и N2 в среде для культивирования на пролиферацию первичных клеток стромальной опухоли желудочно-кишечного тракта in vitro.
На Фигурах 2А-2С представлены графики, на которых показано влияние различных концентраций различных лигандов рецепторной тирозинкиназы в среде для культивирования на пролиферацию первичных клеток стромальной опухоли желудочно-кишечного тракта in vitro.
На Фигурах 3A-3F представлены графики, на которых показано влияние различных комбинаций факторов в среде для культивирования на пролиферацию первичных клеток стромальной опухоли желудочно-кишечного тракта in vitro.
На Фигуре 4 показаны фотографии под инвертированным фазово-контрастным микроскопом (100-кратное увеличение) первичных клеток стромальной опухоли желудочно-кишечного тракта, полученных путем культивирования в течение 14 дней с применением способа культивирования для культивирования клеток стромальной опухоли желудочно-кишечного тракта согласно настоящему изобретению, причем указанные первичные клетки стромальной опухоли желудочно-кишечного тракта выделили из трех образцов ткани клинических пациентов со стромальной опухолью желудочно-кишечного тракта, соответственно.
На Фигуре 5 показаны фотографии под инвертированным фазово-контрастным микроскопом (100-кратное увеличение) клеток стромальной опухоли желудочно-кишечного тракта, полученных путем культивирования первичных клеток стромальной опухоли желудочно-кишечного тракта, выделенных из одного и того же образца ткани клинического пациента со стромальной опухолью желудочно-кишечного тракта; культивирование выполняли параллельно в течение 8 дней с покрытием из коллагена I и без покрытия, соответственно, с применением способа культивирования для культивирования клеток стромальной опухоли желудочно-кишечного тракта согласно настоящему изобретению и двух описанных способов культивирования первичных клеток стромальной опухоли желудочно-кишечного тракта.
На Фигуре 6А показан результат (при микроскопии под 100-кратным увеличением) иммунофлуоресцентного окрашивания специфичных биомаркеров клеток стромальной опухоли желудочно-кишечного тракта и фибробластов, выполненного на клетках стромальной опухоли желудочно-кишечного тракта, полученных путем культивирования первичных клеток стромальной опухоли желудочно-кишечного тракта, выделенных из клинического образца ткани стромальной опухоли желудочно-кишечного тракта; культивирование выполняли параллельно в течение 14 дней с применением способа культивирования для культивирования клеток стромальной опухоли желудочно-кишечного тракта согласно настоящему изобретению и двух описанных способов культивирования для культивирования клеток стромальной опухоли желудочно-кишечного тракта, соответственно, причем клетки GIST-T1 использовали в качестве положительного контроля. На Фигуре 6В показан результат статистического анализа количества CKIT-положительных и CKIT-отрицательных меченых клеток после окрашивания клеток, полученных тремя различными вышеуказанными способами культивирования.
На Фигуре 7 представлена кривая роста клеток, полученная путем непрерывного культивирования в течение 30 дней, с применением способа культивирования для культивирования клеток стромальной опухоли желудочно-кишечного тракта согласно настоящему изобретению, причем указанные первичные клетки стромальной опухоли желудочно-кишечного тракта выделяли из клинического образца ткани стромальной опухоли желудочно-кишечного тракта.
На Фигуре 8 показан результат анализа согласованности генных мутаций между тремя образцами, полученными путем хирургической резекции стромальной опухоли желудочно-кишечного тракта, и клетками стромальной опухоли желудочно-кишечного тракта, полученными путем культивирования первичных клеток стромальной опухоли желудочно-кишечного тракта, полученных из соответствующих образцов, с применением способа культивирования для культивирования клеток стромальной опухоли желудочно-кишечного тракта согласно настоящему изобретению.
На Фигурах 9А и 9В представлены кривые зависимости реакции клеток стромальной опухоли желудочно-кишечного тракта, культивированных с использованием среды для культивирования для клеток стромальной опухоли желудочно-кишечного тракта согласно настоящему изобретению, от дозы различных целевых лекарственных средств.
Подробное описание изобретения
[Пример 1]
Выделение первичных клеток стромальной опухоли желудочно-кишечного тракта человека и оптимизация среды для культивирования для клеток стромальной опухоли желудочно-кишечного тракта
(1) Выделение первичных клеток стромальной опухоли желудочно-кишечного тракта человека
Коммерческий раствор пенициллина-стрептомицина и двух антител (производства Corning Inc., содержащий 10000 Ед/мл пенициллина и 10 мг/мл стрептомицина) добавляли к среде DMEM/F12 (производства Corning) в объемном соотношении 2% для транспортировки и промывки образцов; такую среду здесь и далее в настоящей заявке называют «транспортной жидкостью».
Образцы тканей стромальных опухолей желудочно-кишечного тракта получали из удаленных хирургическим путем образцов раковых тканей у четырех пациентов со стромальными опухолями желудочно-кишечного тракта, которые дали информированное согласие, а именно GIST-1, GIST-2, GIST-3 и GIST-4. Один из образцов (GIST-1) показан ниже. Вышеуказанные образцы ткани собирали в течение получаса после хирургического удаления у пациентов. Более конкретно, из не затронутых некрозом участков стерильно отбирали образцы ткани объемом 0,5 см3 или более и помещали в предварительно охлажденную транспортную жидкость, которую затем переносили в лабораторию на льду.
В биобезопасном боксе образец ткани (GIST-1) переносили в чашку для культивирования клеток размером 100 мм и промывали транспортной жидкостью. С поверхности образца ткани смывали клетки крови и удаляли ненужные ткани, например, кожу и фасцию.
Промытый образец ткани переносили в новую чашку для культивирования размером 100 мм, в которую добавляли 10 мл транспортной жидкости, и образец ткани разделяли на фрагменты ткани диаметром менее 1 мм3 с помощью скальпелей со стерильными лезвиями и пинцета.
Фрагменты образца ткани переносили в центрифужную пробирку объемом 50 мл и центрифугировали при 1200 об/мин в течение 5 минут на настольной центрифуге; после аккуратного извлечения супернатанта из центрифужной пробирки пипеткой полученный осадок ресуспендировали в 10 мл среды DMEM/F12, не содержащей сыворотки и содержащей коллагеназу II (1 мг/мл) (производства Sigma) и коллагеназу IV (1 мг/мл) (производства Sigma); образец помещали на качалку при постоянной температуре 37°С для гидролиза при встряхивании в течение 30-90 минут, а затем центрифугировали при 350 g/мин на настольной центрифуге в течение 5 минут; после утилизации супернатанта отделенные клетки ткани ресуспендировали в 10 мл среды DMEM/F12, содержащей 10% эмбриональной телячьей сыворотки (производства Gibco), а затем полученный осадок измельчали и протирали через клеточное сито с размером отверстий 100 мкм; протертую через сито суспензию клеток собирали в центрифужную пробирку объемом 50 мл; клетки подсчитывали с помощью гемоцитометра.
Затем суспензию клеток центрифугировали при 350 g/мин в течение 5 минут в центрифуге; после утилизации супернатанта полученный раствор ресуспендировали в следующей описанной среде для культивирования для первичных клеток стромальной опухоли желудочно-кишечного тракта.
Три других образца ткани стромальной опухоли желудочно-кишечного тракта выделяли с использованием того же способа, что и выше.
(2) Нанесение покрытия на планшеты для культивирования клеток Коллаген I типа из хвоста крысы (коллаген I типа, производства
Corning Inc.) разбавляли сверхчистой водой в соотношении 1:50 для получения разбавленного коллагена. Разбавленный коллаген добавляли в количестве 500 мкл/лунку в 24-луночный культуральный планшет, полностью покрывая дно лунок культурального планшета. После выдерживания в инкубаторе при 37°С в течение 1 часа разбавленный коллаген удаляли, получая культуральный планшет, покрытый коллагеном.
(3) Скрининг факторов, добавленных в среду для культивирования для первичных клеток стромальной опухоли желудочно-кишечного тракта
Сначала получали основную среду. В коммерческую среду DMEM/F-12 добавляли GlutaMAX-I (производства Thermo Fisher SCIENTIFIC) в соотношении разбавления 1:100, добавляли инсулинсодержащую культуральную добавку инсулин-трансферрин-селен-этаноламин (ITS-X производства Gibco) в соотношении разбавления 1:100, добавляли ингибитор ROCK-киназы Y27632 (производства Sigma) в конечной концентрации 10 мкМ, и добавляли коммерческий раствор Primocin (производства InvivoGen) (коммерческий продукт в концентрации 50 мг/мл) в соотношении разбавления 1:500 с получением основной среды.
Далее в основную среду вносили добавки различного типа (Таблица 1) с целью получения сред для культивирования для клеток стромальной опухоли желудочно-кишечного тракта, содержащих разные компоненты. Среды для культивирования с различными компонентами добавляли в объеме 500 мкл/лунку в 24-луночные планшеты, покрытые коллагеном I, причем для каждого состава среды использовали по 3 лунки. Клетки GIST (GIST-1), выделенные из тканей GIST в Разделе (1) данного примера, инокулировали в 24-луночный культуральный планшет, покрытый коллагеном I, при плотности клеток 3×104/лунку, и культивировали в средах с различными составами при 37°С, 5% концентрации СО2 и 2% концентрации кислорода. Среды обновляли каждые 3 дня после начала культивирования. Через 14 дней культивирования выполняли подсчет клеток. В качестве экспериментального контроля использовали основную среду без каких-либо дополнительных факторов, приведенных в Таблице 1.
Опухолевые клетки, выделенные из трех других образцов ткани стромальной опухоли желудочно-кишечного тракта, также культивировали и подсчитывали таким же образом, как описано выше.
Результаты статистического анализа приведены в Таблице 1.

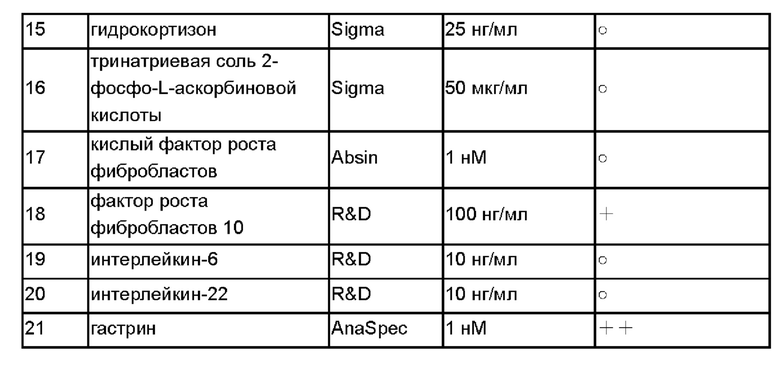
При этом «+» показывает, что, по сравнению с основной средой, среда с добавкой(ами) оказывает эффект стимуляции пролиферации первичных клеток стромальной опухоли желудочно-кишечного тракта, выделенных из ткани стромальной опухоли желудочно-кишечного тракта, по меньшей мере в трех случаях, а количество «+» показывает степень стимулирующего эффекта; «-» показывает, что среда с добавкой(ами) оказывает эффект ингибирования пролиферации первичных клеток стромальной опухоли желудочно-кишечного тракта, выделенных из ткани стромальной опухоли желудочно-кишечного тракта, по меньшей мере в двух случаях; «о» показывает, что среда с добавкой(ами) не оказывает значимого эффекта на пролиферацию первичных клеток стромальной опухоли желудочно-кишечного тракта, выделенных из ткани стромальной опухоли желудочно-кишечного тракта, по меньшей мере в трех случаях. Результаты показали, что N2, тромбоцитарный фактор роста АА - СС, фактор стволовых клеток, инсулиновый фактор роста 1, основной фактор роста фибробластов, фактор роста фибробластов 10 и гастрин могут стимулировать пролиферацию первичных клеток стромальной опухоли желудочно-кишечного тракта, выделенных из ткани стромальной опухоли желудочно-кишечного тракта, по меньшей мере в трех случаях, при этом N2, тромбоцитарный фактор роста АА, фактор роста стволовых клеток, основной фактор роста фибробластов и гастрин оказывают более сильный эффект.
(4) Оптимизация концентрации факторов, добавляемых в среду для культивирования для первичных клеток стромальной опухоли желудочно-кишечного тракта
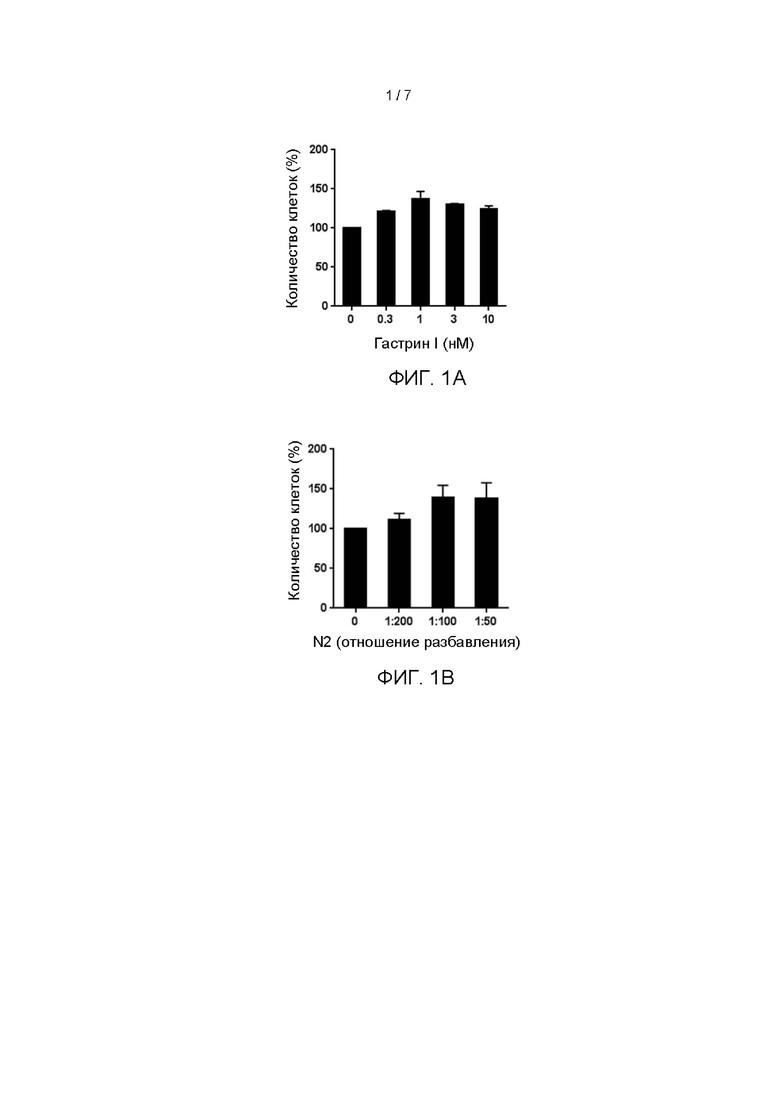
Гастрин I (производства Anaspec) добавляли в основную среду с целью получения сред для культивирования для клеток стромальной опухоли желудочно-кишечного тракта, содержащих гастрин I в конечных концентрациях 0,3 нМ, 1 нМ, 3 нМ, 10 нМ, которые добавляли в объеме 500 мкл/лунку в 24-луночный планшет, покрытый коллагеном I, используя по 3 лунки для каждой концентрации. Первичные клетки стромальной опухоли желудочно-кишечного тракта (GIST-1), выделенные из ткани стромальной опухоли желудочно-кишечного тракта в Разделе (1) данного примера, инокулировали в 24-луночный культуральный планшет, покрытый коллагеном I, при плотности клеток 3×104/лунку, и культивировали в средах с различными концентрациями гастрина I при 37°С, 5% концентрации СО2 и 2% концентрации кислорода. Среды обновляли каждые 3 дня после начала культивирования. Через 14 дней культивирования выполняли подсчет клеток. В качестве экспериментального контроля использовали основную среду с концентрацией гастрина I, равной 0 нМ. Результаты показаны на Фигуре 1А.
Добавку N2 (производства Thermo Fisher) добавляли к основной среде в соотношении разбавлений 1:200, 1:100, 1:50 с целью получения сред для культивирования для клеток стромальной опухоли желудочно-кишечного тракта с различными концентрациями N2. Различные составы сред добавляли в объеме 500 мкл/лунку в 24-луночный планшет, покрытый коллагеном I, используя 3 лунки для каждой концентрации. Культивирование и подсчет первичных клеток выполняли, как указано выше. В качестве экспериментального контроля использовали основную среду с концентрацией N2, равной 0. Результаты показаны на Фигуре 1 В.
Затем в основную среду добавляли N2, разбавленный в соотношении 1:100, и 1 нМ гастрин с целью получения Основной среды 2. В Основную среду 2 добавляли фактор стволовых клеток (SCF производства R&D) с целью получения сред для культивирования для клеток стромальной опухоли желудочно-кишечного тракта, содержащих SCF в конечных концентрациях 20 нг/мл, 50 нг/мл и 100 нг/мл, соответственно. Среды для культивирования, содержащие различные концентрации SCF, добавляли в объеме 500 мкл/лунку в 24-луночный планшет, покрытый коллагеном I, используя по 3 лунки для каждой концентрации. Первичные клетки стромальной опухоли желудочно-кишечного тракта (GIST-1), выделенные из ткани стромальной опухоли желудочно-кишечного тракта в Разделе (1) данного примера, инокулировали в 24-луночный культуральный планшет, покрытый коллагеном I, при плотности клеток 4×104/лунку, и культивировали в среде с различными концентрациями SCF при 37°С, 5% концентрации СО2 и 2% концентрации кислорода. Подсчет клеток выполняли на первичных клетках GIST, культивируемых с различными составами среды на 3, 7 и 12 сутки. Результаты показаны на Фигуре 2А.
Аналогичным образом, среды для культивирования для клеток стромальной опухоли желудочно-кишечного тракта, содержащие различные концентрации тромбоцитарного фактора роста АА (PDGFAA производства R&D) и основного фактора роста фибробластов (bFGF производства R&D), получали с использованием Основной среды 2 с конечными концентрациями 20 нг/мл, 50 нг/мл и 100 нг/мл, соответственно. Культивирование и подсчет первичных клеток выполняли, как указано выше. Результаты показаны на Фигурах 2В и 2С.
Результаты показали, что добавление различных концентраций лигандов рецепторной тирозинкиназы SCF, bFGF и PDGFAA к Основной среде 2 оказывало пролиферативное действие на пролиферацию in vitro первичных клеток GIST в зависимости от времени и дозы.
(5) Исследование пролиферативного действия каждого фактора в различных концентрациях, добавляемых в среды для культивирования для первичных клеток стромальной опухоли желудочно-кишечного тракта
Далее получали следующие 6 различных составов сред:
1. Основная среда (здесь и далее называемая ВМ): основная среда, полученная в Разделе (3) Примера 1;
2. Состав 2: основная среда с добавлением N2, разбавленного в соотношении 1:100, 1 нМ гастрина, 100 нг/мл PDGFAA и 20 нг/мл bFGF, соответственно;
3. Состав 3: основная среда с добавлением N2, разбавленного в соотношении 1:100, 1 нМ гастрина, 100 нг/мл PDGFAA и 50 нг/мл SCF, соответственно;
4. Состав 4: основная среда с добавлением N2, разбавленного в соотношении 1:100, 1 нМ гастрина, 50 нг/мл SCF и 20 нг/мл bFGF, соответственно;
5. Состав 5: основная среда с добавлением N2, разбавленного в соотношении 1:100, 100 нг/мл PDGFAA, 50 нг/мл SCF и 20 нг/мл bFGF, соответственно;
6. Состав 6: основная среда с добавлением 1 нМ гастрина, 100 нг/мл PDGFAA, 50 нг/мл SCF и 20 нг/мл bFGF, соответственно;
7. Полная среда (здесь и далее называемая СМ): основная среда с добавлением N2, разбавленного в соотношении 1:100, 1 нМ гастрина, 100 нг/мл PDGFAA, 50 нг/мл SCF и 20 нг/мл bFGF, соответственно.
Вначале выполнили сравнение пролиферативного действия основной среды и полной среды на первичные клетки GIST in vitro. Основную среду и полную среду добавляли в 24-луночный планшет, покрытый коллагеном I, в объеме 500 мкл/лунку, используя по 2 лунки для каждой группы.
В соответствии со способом, описанным в Разделе (1) Примера 1, клетки GIST (GIST-2), выделенные из ткани стромальной опухоли желудочно-кишечного тракта, инокулировали в 24-луночный культуральный планшет, покрытый коллагеном I, при плотности клеток 4×104 клеток/лунку, и культивировали с двумя различными составами среды при 37°С, 5% концентрации СО2 и 2% концентрации кислорода. На 10 сутки культивирования выполняли подсчет клеток GIST в средах различного состава. Количество клеток GIST, культивируемых с использованием основной среды, составляло 100%. Результаты показаны на Фигуре 3А. Результаты показали, что использование полной среды увеличивало количество клеток приблизительно на 70% всего за 10 дней по сравнению со случаем, когда использовали основную среду.
Затем в среду на основе Состава 2 добавляли 20 нг/мл, 50 нг/мл и 100 нг/мл SCF, соответственно, для исследования эффектов, способствующих пролиферации, при различных концентрациях SCF. Среды Состава 2, содержащие разные концентрации SCF, добавляли в 24-луночный планшет, покрытый коллагеном I, в объеме 500 мкл/лунку, используя по 2 лунки в качестве повторностей для каждой концентрации. В соответствии с тем же способом, что и в Разделе (1) этого примера, GIST-2 инокулировали в 24-луночный культуральный планшет, покрытый коллагеном I, при плотности клеток 4×104 клеток/лунку, и культивировали с составами, содержащими различные концентрации SCF, при 37°С, 5% концентрации СО2 и 2% концентрации кислорода. После культивирования до 10 суток выполняли подсчет клеток стромальной опухоли желудочно-кишечного тракта в средах различного состава. Количество клеток стромальной опухоли желудочно-кишечного тракта, культивированных с использованием среды Состава 2, составляло 100%. Результаты показаны на Фигуре 3В.
Результаты показали, что по сравнению со случаем использования среды Состава 2, добавление SCF эффективно способствовало пролиферации клеток, причем при концентрации SCF 50 нг/мл количество клеток могло увеличиваться приблизительно на 25% после 10 дней культивирования по сравнению со случаем использования среды Состава 2.
Аналогичным образом, при использовании тех же стадий, что описаны выше для Состава 2, в среду на основе Состава 3 добавляли 20 нг/мл, 50 нг/мл и 100 нг/мл bFGF, соответственно, для исследования эффектов, способствующих пролиферации, при различных концентрациях bFGF. Результаты показаны на Фигуре 3С. Результаты показали, что по сравнению со случаем использования среды Состава 3 добавление bFGF эффективно способствовало пролиферации клеток, причем при концентрации bFGF 20 нг/мл количество клеток могло увеличиваться приблизительно на 17% через 10 дней культивирования по сравнению со случаем использования среды Состава 3.
Аналогичным образом, при использовании тех же стадий, что описаны выше для Состава 2, в среду на основе Состава 4 добавляли 20 нг/мл, 50 нг/мл и 100 нг/мл PDGFAA, соответственно, для исследования эффектов, способствующих пролиферации, при различных концентрациях PDGFAA. Результаты показаны на Фигуре 3D. Результаты показали, что по сравнению со случаем с использованием среды Состава 4 добавление PDGFAA эффективно способствовало пролиферации клеток, причем при концентрации 100 нг/мл PDGFAA количество клеток могло увеличиваться приблизительно на 13% после 10 дней культивирования по сравнению со случаем использования среды Состава 4.
Аналогичным образом, при использовании тех же стадий, что описаны выше для Состава 2, в среду на основе Состава 5 добавляли 0,3 нМ, 1 нМ и 3 нМ гастрина I, соответственно, для исследования эффектов, способствующих пролиферации, при различных концентрациях гастрина I. Результаты показаны на Фигуре ЗЕ. Результаты показали, что по сравнению со случаем использования среды Состава 5 добавление гастрина I могло эффективно способствовать пролиферации клеток, причем при концентрации 1 нМ гастрина I количество клеток могло увеличиваться приблизительно на 8% через 10 дней культивирования по сравнению со случаем использования среды Состава 5.
Аналогичным образом, при использовании тех же стадий, что описаны выше для Состава 2, в среду на основе Состава 6 добавляли N2, разбавленный в соотношениях 1:200, 1:100 и 1:50, соответственно, для исследования эффектов, способствующих пролиферации, при различных концентрациях N2. Результаты показаны на Фигуре 3F. Результаты показали, что по сравнению со случаем использования среды Состава 6 добавление N2 эффективно способствовало пролиферации клеток, причем при добавлении N2 в соотношении разбавления 1:100 количество клеток могло увеличиваться приблизительно на 8% после 10 дней культивирования по сравнению со случаем использования среды Состава 6.
[Пример 2]
Культивирование первичных клеток GIST человека и сравнение с существующими способами культивирования
(1) Культивирование первичных клеток GIST, происходящих из ткани стромальной опухоли желудочно-кишечного тракта человека
Используя тот же способ, что и в Разделе (1) Примера 1, первичные клетки GIST (GIST-1, GIST-2, GIST-3) выделяли из тканей раковых опухолей трех пациентов со стромальными опухолями желудочно-кишечного тракта, соответственно. Затем выделенные клетки GIST подсчитывали с помощью гемоцитометра, а затем инокулировали в 12-луночный планшет, покрытый коллагеном I (производства Corning), при плотности клеток 5×104 клеток/лунку. При этом способ нанесения покрытия заключался в следующем: Коллаген I готовили в виде разбавленного коллагена, разбавляя его сверхчистой водой в соотношении 1:50; в 12-луночный культуральный планшет добавляли 1 мл/лунку разбавленного коллагена, полностью покрывая дно лунок планшета; после выдерживания в течение 1 часа в инкубаторе при 37°С разбавленный коллаген удаляли, получая культуральный планшет, покрытый коллагеном.
Полную среду (СМ), полученную в соответствии с Разделом (5) Примера 1, добавляли в 12-луночный планшет в количестве 2 мл/лунку и культивировали при 37°С, 5% концентрации СО2 и 2% концентрации кислорода. Среду обновляли каждые 3 суток после начала культивирования.
На Фиг. 4 представлены фотографии клеток, культивированных до 14 суток, под 100-кратным увеличением фазово-контрастного микроскопа.
(2) Получение существующих сред для культивирования для первичных клеток стромальной опухоли желудочно-кишечного тракта
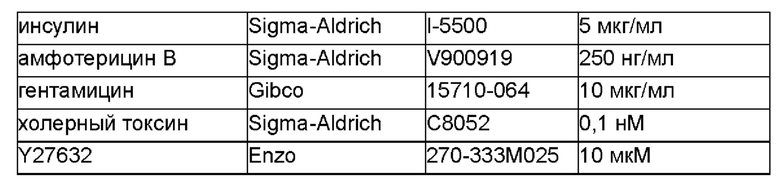
В качестве контроля получали среду для культивирования для технологии обусловленного перепрограммирования клеток (также называемую ниже «F-средой»). Процедуру получения см. в источнике (Liu et al., Am J Pathol, 183(6): 1862-1870, 2013) и состав среды представлен в Таблице 2.

В качестве еще одного контроля получали среду для культивирования для первичных клеток стромальной опухоли желудочно-кишечного тракта, описанную в литературе. Конкретные этапы получения и культивирования см. в статье Fukuda et al., Oncology Reports, 2013, 30: 71-78. Указанную среду для культивирования получали следующим образом: в RPMI 1640 (производства Corning) добавляли 20% телячью сыворотку с последующим добавлением коммерческого раствора пенициллина-стрептомицина (производства Corning) в объемном соотношении 1%, и, наконец, добавляли SCF в конечной концентрации 10 нг/мл; эту среду здесь и далее называли "Известным составом 1".
(3) Сравнение различных методик культивирования клеток стромальной опухоли желудочно-кишечного тракта
Для исследования влияния среды для культивирования и способа культивирования согласно настоящему изобретению, а также двух существующих сред для культивирования и способов культивирования, первичные клетки GIST (GIST-2) выделяли из ткани раковой опухоли пациента со стромальной опухолью желудочно-кишечного тракта, применяя тот же способ, что и во втором Разделе (1) Примера 1, и культивировали GIST-2 in vitro, параллельно используя три следующие варианта условий культивирования:
A. Технология согласно настоящему изобретению: первичные клетки GIST (GIST-2) инокулировали в 12-луночные планшеты с покрытием или без покрытия коллагеном I (производства Corning), соответственно, при плотности инокуляции 5×104 клеток/лунку, и культивировали in vitro с 2 мл/лунку полной среды СМ, полученной в Разделе (5) Примера 1, при 37°С, 5% концентрации СО2 и 2% концентрации кислорода;
B. Технология обусловленного перепрограммирования клеток: первичные клетки GIST(GIST-2) инокулировали в 12-луночные планшеты с покрытием или без покрытия коллагеном I (производства Corning), соответственно, при плотности инокуляции 5x104 клеток/лунку, и культивировали in vitro с 2 мл/лунку F-среды при 37°С, 5% концентрации СО2 и 2% концентрации кислорода;
C. Еще одна описанная технология: первичные клетки GIST (GIST-2) инокулировали в 12-луночные планшеты с покрытием или без покрытия коллагеном I (производства Corning), соответственно, при плотности инокуляции 5x104 клеток/лунку, и культивировали in vitro с 2 мл/лунку "Известного состава 1" при 37°С, 5% концентрации СО2 и 20% концентрации кислорода.
Фигура 5 представляет собой фотографии клеток GIST-2, культивированных в различных условиях культивирования до 8 суток, полученные под 100-кратным увеличением фазово-контрастного микроскопа.
Согласно Фигуре 5, можно видеть, что первичные клетки GIST, происходящие из ткани стромальной опухоли желудочно-кишечного тракта, можно эффективно культивировать in vitro с применением среды для культивирования для клеток стромальной опухоли желудочно-кишечного тракта и способа культивирования согласно настоящему изобретению. Кроме того, культуральный планшет, покрытый коллагеном I, может обеспечивать лучшую эффективность пролиферации по сравнению с культуральным планшетом, не покрытым коллагеном I, при использовании среды для культивирования для GIST согласно настоящему изобретению.
Кроме того, как показано на Фигуре 5, при сравнении со средой для культивирования и способом культивирования согласно настоящему изобретению клетки GIST, культивированные с использованием "Известного состава 1", характеризовались меньшей численностью, повышенным количеством фрагментов клеток, и влияние на культуру без покрытия коллагеном I было менее выраженным, чем в случае с нанесением покрытия. Клетки GIST, культивированные с использованием F-среды, также характеризовались меньшей численностью при сравнении с культивированием с использованием способа культивирования согласно настоящему изобретению; под микроскопом можно было видеть большое количество толстых фибробластов с нечетким контуром, что указывало на большую долю фибробластов в культивируемых клетках; очевидные различия во влиянии F-среды на культуры отсутствовали, безотносительно к наличию или отсутствию покрытия коллагеном I.
[Пример 3]
Выявление иммунных маркеров для клеток стромальных опухолей желудочно-кишечного тракта
(1) Использовали полную среду СМ, описанную в Разделе (5) Примера 1, и среды для культивирования для клеток стромальной опухоли желудочно-кишечного тракта - F-среду и "Известный состав 1", описанные в Разделе (2) Примера 2.
(2) Из клинического образца, полученного при хирургической резекции у пациента со стромальной опухолью желудочно-кишечного тракта, получали ткань раковой опухоли размером приблизительно с семя сои. Первичные клетки стромальной опухоли желудочно-кишечного тракта (GIST-1) выделяли с применением того же способа, что и в Разделе (1) Примера 1, и первичные клетки стромальной опухоли желудочно-кишечного тракта (GIST-1) культивировали с применением способов культивирования А, В и С, описанных в Разделе (3) Примера 2, соответственно.
(3) Для обнаружения экспрессии важных биомаркеров, имеющих отношение к злокачественным новообразованиям, в клетках стромальной опухоли желудочно-кишечного тракта человека использовали иммунофлуоресценцию.
Первичными антителами, используемыми в данном эксперименте, являлись антитела против CKIT (CD117) (производства Cell Signaling Technology) и α-SMA (производства Cell Signaling Technology). Для специфичного обнаружения CKIT (CD117) использовали вторичное антитело против IgG мыши (H+L), Р(ab')2-фрагмент (конъюгат с Alexa Fluor® 488) (производства Cell Signaling Technology); для специфичного обнаружения α-SMA использовали вторичное антитело против IgG кролика (H+L), Р(ab')2-фрагмент (конъюгат с Alexa Fluor® 594) (производства Cell Signaling Technology). При этом CKIT является важным биомаркером стромальных опухолей желудочно-кишечного тракта, а фибробласты не экспрессируют белок CKIT. В клинической практике CKIT обычно используют для дифференциальной диагностики стромальных опухолей желудочно-кишечного тракта. α-SMA признан важным биомаркером фибробластов.
В частности, когда клетки GIST занимали приблизительно 80% площади дна культурального планшета, среду-супернатант в исходном 12-луночном планшете утилизировали и добавляли 1 мл 0,05% трипсина (производства Thermo Fisher) для отделения клеток посредством гидролиза; после инкубирования при 37°С в течение 15 минут отделенные клетки ресуспендировали в 5 мл среды DMEM/F12, содержащей 10% (об./об.) телячьей сыворотки, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина, а затем собирали в центрифужную пробирку и центрифугировали при 300 мкг/мин в течение 5 минут. Осадок клеток в каждой группе после центрифугирования ресуспендировали с использованием полной среды СМ согласно настоящему изобретению, F-сред и "Известного состава 1", соответственно, и выполняли подсчет клеток в клеточных суспензиях с использованием гемоцитометра. Клетки инокулировали на покровные стекла, покрытые коллагеном I, при плотности 4×104 клеток/покровное стекло, используя тот же способ нанесения покрытия, что в Разделе (2) Примера 1, и клетки каждой группы культивировали с использованием полной среды СМ согласно настоящему изобретению, F-среды и "Известного состава 1", соответственно, обеспечивая рост клеток на покровных стеклах.
Через 14 дней культивирования клетки дважды промывали буфером PBS, фиксировали 4% параформальдегидом в течение 15 минут, и затем инкубировали при комнатной температуре с TBST (TBS + 0,1% Tween 20), содержащим 1% БСА (производства Shanghai Sangon Biotech) и 1% Triton Х-100, в течение часа. Клетки промывали буфером TBST 3 раза, каждый раз в течение 3 минут. После удаления буфера TBST на предметное стекло наносили 50 мкл разбавленного первичного антитела (антитела против CKIT, разбавленного в соотношении 1:2000), и инкубировали полученный раствор при 4°С в течение 12-16 часов, а затем промывали PBS 3 раза, каждый раз в течение 3 минут; на предметное стекло наносили вторичное антитело против IgG кролика (H+L), Р(ab')2-фрагмент (конъюгат с Alexa Fluor® 594) (8 мкг/мл), и инкубировали полученный раствор при комнатной температуре в течение 60 минут, а затем промывали PBS 3 раза, каждый раз в течение 3 минут. Затем на предметное стекло наносили вторичное антитело против IgG кролика (H+L), Р(ab')2-фрагмент (конъюгат с Alexa Fluor® 594) (8 мкг/мл), и полученный продукт инкубировали при комнатной температуре в течение 60 минут, а затем промывали PBS 3 раза, каждый раз в течение 3 минут. Для инкубирования клеток в течение 10 минут использовали 1 мкг/мл красителя DAPI (производства Sigma). Клетки однократно промывали PBS. После герметизации покровного стекла каплей среды для заключения тканей (производства Thermo Fisher Scientific) полученный результат фотографировали под 100-кратным увеличением флуоресцентного микроскопа.
Кроме того, в качестве положительного контроля использовали распространенную линию клеток стромальной опухоли желудочно-кишечного тракта GIST-T1 (приобретенную в АТСС). После культивирования первичных клеток до 13 суток 8×104 клеток GIST-T1 помещали на покровное стекло и культивировали на покровном стекле в течение 24 часов. Клетки подвергали иммунофлуоресцентному окрашиванию таким же образом, как и вышеуказанные клетки GIST-1, культивированные различными способами, и фотографировали.
Результаты показаны на Фигуре 6А.
Согласно Фигуре 6А, линия клеток стромальной опухоли желудочно-кишечного тракта GIST-T1 интенсивно экспрессировала белок CKIT, являющийся специфичным биомаркером клеток GIST, но не экспрессировала белок α-SMA; клетки, культивированные с помощью среды для культивирования и способа культивирования согласно настоящему изобретению, также интенсивно экспрессировали белок CKIT - специфичный биомаркер клеток GIST и не экспрессировали белок α-SMA; в то же время первичные клетки GIST, полученные из того же образца и культивированные с использованием F-среды или "Известного состава 1", редко экспрессировали белок CKIT, и большинство из них экспрессировали только специфичный биомаркер фибробластов - белок α-SMA; эти клетки характеризовались листоподобной и аналогичной мышечным волокнам морфологией, что указывает на неспособность этих двух методик культивирования эффективно культивировать клетки GIST, причем большинство культивируемых клеток представляют собой фибробласты; это не позволяет достигать уровня влияния на культуру, показанного для среды для культивирования согласно настоящему изобретению.
На Фигуре 6В показан результат анализа данных путем подсчета CKIT-положительных меченых клеток и CKIT-отрицательных меченых клеток под микроскопом после окрашивания клеток, полученных тремя различными способами культивирования, указанными выше. Результат представляет собой статистические данные подсчета в трех случайных полях зрения на микрофотографиях.
Исходя из Фигур 6А и 6В, можно подтвердить, что по сравнению с двумя описанными методиками культивирования технология согласно настоящему изобретению обеспечивает эффективное размножение полученных от пациента первичных клеток GIST in vitro, и мешающее влияние фибробластов на культивируемые клетки отсутствует.
[Пример 4]
Непрерывное культивирование первичных клеток GIST in vitro
В соответствии с тем же способом, что и в Разделе (1) Примера 2, клетки GIST-3 непрерывно культивировали с использованием полной среды СМ, описанной в Разделе (5) Примера 1.
Среду для культивирования обновляли каждые 3 суток для клеток, культивируемых в условиях согласно настоящему изобретению.
Когда клетки GIST покрывали приблизительно 80% площади дна культурального планшета, среду-супернатант в исходном 12-луночном планшете утилизировали. Добавляли 1 мл 0,05% трипсина (Thermo Fisher: 25300062) для отделения клеток путем гидролиза, и инкубировали клетки при 37°С в течение 15 минут. После полного отделения клеток отделенные клетки ресуспендировали в 5 мл среды DMEM/F12, содержащей 10% (об./об.) телячьей сыворотки, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина, а затем собирали в центрифужную пробирку и центрифугировали при 350 мкг/мин в течение 5 минут. Осадок клеток после центрифугирования ресуспендировали с использованием полной среды СМ и выполняли подсчет клеток в клеточной суспензии с использованием гемоцитометра. Клетки инокулировали в еще один 12-луночный культуральный планшет, покрытый коллагеном I, при плотности клеток 5×104 клеток/лунку для дальнейшего культивирования.
Когда рост субкультивированных клеток снова достигал приблизительно 80% площади дна культурального планшета, культивированные клетки отделяли, собирали и повторно подсчитывали в соответствии с вышеуказанным способом. Клетки повторно инокулировали при плотности 5×104 клеток/лунку для дальнейшего культивирования.
Ниже приведена формула расчета показателя удвоения популяции первичных клеток стромальной опухоли желудочно-кишечного тракта в различных условиях культивирования:
Показатель удвоения популяции клеток = [log(N/X0)]/log2
где N представляет собой количество клеток для пересева, а Х0 представляет собой количество клеток при начальной инокуляции (см. Greenwood et al., Environ Mol Mutagen 2004, 43(1): 36-44).
Фигура 7 представляет собой кривую роста для одного случая культивирования клеток стромальной опухоли желудочно-кишечного тракта в условиях согласно настоящему изобретению, построенную с помощью программного обеспечения Graphpad Prism 7.0, причем сутки культивирования отмечены по оси абсцисс, а показатели удвоения популяции клеток - по оси ординат. Исходя из Фигуры 7, можно подтвердить, что клетки GIST, культивированные с помощью среды для культивирования для желудочно-кишечных стромальных опухолевых клеток согласно настоящему изобретению, могли непрерывно пролиферировать в течение по меньшей мере 30 суток. Кроме того, при использовании существующих F-среды и "Известного состава 1" для культивирования первичных клеток GIST в соответствии с результатами Примера 3 невозможно получить очищенные клетки GIST, и культивированию указанных клеток мешает большое количество фибробластов. Таким образом, исследовать устойчивый эффект размножения первичных клеток GIST in vitro с использованием существующих F-среды и "Известного состава 1" невозможно.
[Пример 5]
Анализ согласованности генных мутаций в первичных клетках GIST В соответствии с тем же способом, что и в Разделе (1) Примера 2, первичные клетки GIST, GIST-1, GIST-2 и GIST-3 культивировали с использованием полной среды СМ, описанной в Разделе (5) Примера 1, соответственно.
На 20 сутки культивирования собирали клетки стромальной опухоли желудочно-кишечного тракта и выделяли геномную ДНК клеток с использованием набора DNeasy Blood & Tissue Kit (производства QIAGEN). Кроме того, собирали ткань стромальной опухоли желудочно-кишечного тракта пациента, соответствующую источнику клеток, и выделяли геномную ДНК клеток с использованием набора DNeasy blood & tissue kit (QIAGEN). У пациента-донора клеток брали 2 мл периферической крови и выделяли геномную ДНК из крови с использованием набора DNeasy blood & tissue kit (QIAGEN) в качестве фонового контроля.
Затем выполняли полноэкзомное секвенирование геномной ДНК клеток и образцов ткани (подробное описание процедур см. в источнике: Hans Clevers et al., Cell, 11; 172(1-2): 373-386, 2018), и анализировали результаты секвенирования на предмет мутаций, обнаруживаемых в опухоли с высокой частотой, с использованием программного обеспечения MuSiC. Программное обеспечение MuSiC принимало мутацию гена в периферической крови соответствующего пациента в качестве фона, выполняло статистический анализ для каждого типа мутации указанного гена и обнаруживало ген со значимо более высоким показателем мутации по сравнению с фоном. Результаты анализа получили с использованием программного обеспечения, доступного по ссылке https://bioinfogp.cnb.csic.es/tools/venny/index.html. Результаты анализа показаны на Фигуре 8.
Результаты анализа мутаций, обнаруживаемых в опухоли с высокой частотой, приведенные на Фигуре 8, показывают, что гены мутаций, обнаруживаемых с высокой частотой между клетками GIST, культивируемыми с использованием среды для культивирования для клеток стромальной опухоли желудочно-кишечного тракта согласно настоящему изобретению, и исходной тканью стромальной опухоли желудочно-кишечного тракта в основном сопоставимы. Другими словами, клетки GIST, культивированные с применением среды для культивирования для клеток стромальной опухоли желудочно-кишечного тракта согласно настоящему изобретению, могут сохранять исходные характерные генные мутации ткани раковой опухоли пациента.
[Пример 6]
Проверка чувствительности клеток GIST к лекарственным средствам
При использовании образцов от пациентов со стромальными опухолями желудочно-кишечного тракта, полученных путем хирургической резекции, в качестве примера продемонстрировано, что клетки GIST, культивированные из образцов ткани стромальной опухоли желудочно-кишечного тракта, полученных от пациента, можно применять для проверки чувствительности опухолевых клеток пациента к различным лекарственным средствам.
1. Посев первичных клеток GIST: клетки GIST (GIST-1 и GIST-2), культивированные способом, описанным в Разделе (1) Примера 2, с использованием полной среды СМ, описанной в Разделе (5) Примера 1, инокулировали в 384-луночный планшет при плотности 3000-5000 клеток/лунку, и обеспечивали адгезию клеток в течение ночи.
2. Эксперименты с градиентами лекарственных средств:
(1) Планшеты для хранения лекарственных средств получали с использованием способа градиентных разведений: брали по 10 мкл базовых растворов лекарственных средств, подлежащих проверке (концентрацию базового раствора лекарственного средства определяли, исходя из 2-кратной максимальной концентрации (Смаке) лекарственного средства в крови человека), соответственно, и добавляли в ЕР-пробирки объемом 0,5 мл, содержащие 20 мкл ДМСО; 10 мкл растворов из вышеописанных ЕР-пробирок переносили пипеткой во вторые ЕР-пробирки объемом 0,5 мл, содержащие 20 мкл ДМСО, т.е. разбавляли указанные лекарственные средства в соотношении 1:3. Вышеописанный способ повторяли для поэтапного разбавления и получали 6 концентраций, необходимых для введения. Различные концентрации лекарственных средств добавляли в 384-луночные планшеты для хранения лекарственных средств. В каждую лунку группы контрольного растворителя добавляли равный объем ДМСО в качестве контроля. В указанном примере лекарственные средства, подлежащие проверке, представляли собой иматиниб (производства МСЕ), сунитиниб (производства МСЕ), регорафениб (производства МСЕ), клинически утвержденные в качестве агентов для лечения стромальной опухоли желудочно-кишечного тракта.
(2) С помощью высокопроизводительной автоматизированной рабочей станции (приобретенной в Perkin Elmer) различные концентрации лекарственных средств и контрольного растворителя в 384-луночных планшетах для хранения лекарственных средств добавляли в 384-луночные клеточные культуральные планшеты с посеянными клетками стромальной опухоли желудочно-кишечного тракта. Для всех групп лекарственных средств и групп контрольного растворителя использовали по 3 лунки в качестве повторностей. Объем добавляемого в каждую лунку лекарственного средства составлял 100 нл.
(3) Проверка жизнеспособности клеток: через 72 часа после введения использовали набор для анализа Cell Titer-Glo (производства Promega) для определения показателя хемилюминесценции культивированных клеток после введения лекарственного средства. Величина показателя хемилюминесценции отражала жизнеспособность клеток и влияние лекарственного средства на жизнеспособность клеток. В каждую лунку добавляли приготовленный раствор для определения Cell Titer-Glo и после перемешивания использовали микропланшетный ридер для обнаружения показателя хемилюминесценции.
С помощью программного обеспечения Graphpad Prism 7.0 строили графики и рассчитывали концентрацию полумаксимального ингибирования IC50.
(4) Результаты проверки чувствительности к лекарственным средствам представлены на Фигуре 9А и Фигуре 9В.
На Фигурах 9А и 9В, соответственно, показана чувствительность клеток GIST, культивированных из образцов ткани раковой опухоли, полученных путем хирургической резекции у двух различных пациентов с GIST, к трем таргетным лекарственным средствам - иматинибу, сунитинибу, регорафенибу. Результаты показали, что клетки от одного и того же пациента характеризовались различной чувствительностью к различным лекарственным средствам; кроме того, клетки различных пациентов характеризовались различной чувствительностью к одному и тому же лекарственному средству.
В частности, клетки GIST (GIST-1), полученные от пациента с GIST дикого типа по CKIT, характеризовались пониженной чувствительностью к таргетному лекарственному средству иматинибу, мишенью которого является GIST с мутантным CKIT, причем концентрация полумаксимального ингибирования составила 8,42 мкМ; в то же время чувствительность к мультитаргетному ингибитору сунитинибу была относительно высокой, и концентрация полумаксимального ингибирования для него составляла 2,65 мкМ. Результаты проверки клеток GIST (GIST-2), полученных от пациента с GIST, несущей мутации CKIT, показали хорошую чувствительность к таргетному лекарственному средству иматинибу, причем концентрация полумаксимального ингибирования составляла 2,59 мкМ, и улучшенную чувствительность к регорафенибу, концентрация полумаксимального ингибирования для которого составляла 0,63 мкМ.
В соответствии с результатами, показанными в данном примере, можно подтвердить, что результаты проверки чувствительности клеток GIST, культивированных с использованием среды для культивирования для клеток стромальной опухоли желудочно-кишечного тракта согласно настоящему изобретению, к таргетным лекарственным средствам согласуются с клинико-патологическим типированием пациентов. Следовательно, среду для культивирования для клеток стромальной опухоли желудочно-кишечного тракта согласно настоящему изобретению потенциально можно применять для прогнозирования клинической эффективности лекарственного средства у пациентов с GIST.
Хотя настоящее изобретение подробно описано выше в целом и с отсылкой на конкретные варианты реализации, на основе настоящего изобретения можно реализовать некоторые модификации или усовершенствования, понятные для специалистов в данной области техники. Таким образом, указанные модификации или усовершенствования, не приводящие к изменению сущности настоящего изобретения, должны входить в рамки настоящего изобретения.
Промышленная применимость
В настоящем изобретении предложены среда для культивирования для культивирования первичных клеток GIST и способ культивирования для культивирования первичных клеток GIST с применением указанной среды для культивирования. Среду для культивирования клеток и способ культивирования согласно настоящему изобретению можно применять для культивирования клеток GIST с высоким показателем успешности; они обеспечивают удобство работы, не допускают мешающего влияния на клетки, не относящиеся к GIST, например, со стороны фибробластов, и их можно применять для разработки модели первичных клеток GIST, получения клеток GIST с биологическими особенностями, характерными для пациентов с GIST, и, таким образом, их можно применять для оценки эффективности или скрининга лекарственных средств.






Группа изобретений относится к области биотехнологии. Предложена культуральная среда для получения первичных клеток стромальной опухоли желудочно-кишечного тракта, содержащая гастрин, N2, инсулин, тромбоцитарный фактор роста AA, фактор стволовых клеток, основной фактор роста фибробластов и ингибитор Rock-киназы. Кроме того, в настоящем изобретении предложен способ культивирования клеток стромальной опухоли желудочно-кишечного тракта с использованием указанной культуральной среды. Опухолевые клетки, полученные с применением способа согласно настоящему изобретению, могут быть использованы для оценки эффективности или скрининга лекарственных средств для лечения стромальной опухоли желудочно-кишечного тракта. 4 н. и 6 з.п. ф-лы, 9 ил., 2 табл., 6 пр.
1. Культуральная среда для культивирования первичных клеток стромальной опухоли желудочно-кишечного тракта, причем:
указанная культуральная среда содержит гастрин, N2, инсулин, тромбоцитарный фактор роста AA, фактор стволовых клеток, основной фактор роста фибробластов и ингибитор Rock-киназы.
2. Культуральная среда по п. 1, отличающаяся тем, что содержание гастрина составляет 0,3-10 нМ, предпочтительно 0,3-3 нМ.
3. Культуральная среда по п. 1, отличающаяся тем, что указанный ингибитор Rock-киназы представляет собой по меньшей мере одно соединение, выбранное из группы, состоящей из Y27632, фасудила и H-1152.
4. Культуральная среда по п. 1, отличающаяся тем, что объемная концентрация N2 в указанной среде составляет от 1:25 до 1:200, предпочтительно от 1:50 до 1:100;
содержание инсулина составляет от 2 до 20 мкг/мл, предпочтительно от 5 до 10 мкг/мл;
содержание каждого из тромбоцитарного фактора роста AA, фактора стволовых клеток и основного фактора роста фибробластов составляет от 5 до 500 нг/мл, предпочтительно от 20 до 100 нг/мл;
содержание ингибитора Rock-киназы составляет от 2 до 50 мкМ, предпочтительно от 5 до 10 мкМ.
5. Культуральная среда по п. 1, отличающаяся тем, что указанная среда не содержит сыворотки.
6. Способ культивирования для культивирования первичных клеток стромальной опухоли желудочно-кишечного тракта, причем указанный способ включает следующие этапы:
(1) приготовление культуральной среды по любому из пп. 1-5;
(2) покрытие коллагеном сосуда для культивирования;
(3) инокуляция первичных клеток стромальной опухоли желудочно-кишечного тракта в указанный сосуд для культивирования с покрытием, культивирование указанных клеток при концентрации кислорода 0,1-25% с использованием указанной культуральной среды.
7. Способ культивирования по п. 6, отличающийся тем, что
указанный коллаген представляет собой коллаген I типа из хвоста крысы,
указанный коллаген разбавляют сверхчистой водой в соотношении разбавления 1:5-1:100, предпочтительно в соотношении разбавления 1:10-1:50;
способ нанесения покрытия включает добавление разбавленного коллагена в сосуд для культивирования так, чтобы он полностью покрывал дно сосуда, и выдерживание в течение 30 минут или более.
8. Способ культивирования по п. 6, отличающийся тем, что на этапе (3) культивирование выполняют при концентрации кислорода от 0,1 до 4%.
9. Способ оценки эффективности лекарственного средства для лечения стромальной опухоли желудочно-кишечного тракта, причем указанный способ включает следующие этапы:
(1) культивирование клеток стромальной опухоли желудочно-кишечного тракта с применением способа культивирования по любому из пп. 6-8;
(2) приготовление соединения-кандидата для тестирования с требуемыми градиентами концентрации;
(3) добавление различных концентраций соединения-кандидата, приготовленных на этапе (2), к клеткам стромальной опухоли желудочно-кишечного тракта, культивированным на этапе (1); и
(4) определение жизнеспособности указанных клеток.
10. Способ скрининга лекарственных средств для лечения стромальной опухоли желудочно-кишечного тракта, причем указанный способ включает следующие этапы:
(1) культивирование клеток стромальной опухоли желудочно-кишечного тракта с применением способа культивирования по любому из пп. 6-8;
(2) приготовление соединений-кандидатов для тестирования с требуемыми градиентами концентрации;
(3) добавление различных концентраций соединений-кандидатов, приготовленных на этапе (2), к клеткам стромальной опухоли желудочно-кишечного тракта, культивированным на этапе (1); и
(4) определение жизнеспособности указанных клеток.
| US 2017191030 A1, 06.07.2017 | |||
| CN 106834212 A, 13.06.2017 | |||
| CN 106967672 A, 21.07.2017 | |||
| RU 2018124591 A1, 06.04.2020. |
Авторы
Даты
2024-09-17—Публикация
2021-01-22—Подача