Изобретение относится к области медицины, химико-фармацевтической промышленности и представляет собой противогрибковое средство в отношении ряда грибов-патогенов человека и животных.
В настоящее время остро стоит проблема профилактики заболеваний растений, животных и человека, вызванных патогенными грибами. Грибковые инфекции сегодня являются одними из самых трудноизлечимых заболеваний у человека. Грибковые заболевания поражают более миллиарда человек во всем мире, а системные грибковые инфекции, по некоторым оценкам, ежегодно являются причиной смерти 1.6 млн человек [Bongomin F., Gago S., Oladele R.O., Denning D.W. Global and multi-national prevalence of fungal diseases-estimate precision. J. Fungi (Basel). 2017; 3(4):57. doi: 10.3390/jof3040057]. За последние десятилетия распространенность грибковых инфекций возросла в связи с увеличением использования иммунодепрессантов в онкологии или трансплантации, а также у пациентов с различными иммунодефицитами.
Из грибковых инфекций, наблюдаемых у пациентов с иммуносупрессией, наиболее распространенными являются инвазивный аспергиллез, фузариоз, мукормикоз и инвазивная кандидозная инфекция, характеризующиеся высокой смертностью и зачастую неэффективностью терапии.
Грибковые патогены вызывают широкий спектр инфекций, а воздействие грибковых компонентов, включая споры, в помещениях является фактором развития респираторной аллергии (аллергического ринита и бронхиальной астмы), а также атопического дерматита [Celakovská J., Josef B., Ettler K., Vaneckova J., Ettlerova K., Jan K. Sensitization to fungi in atopic dermatitis patients 14 year and older - association with other atopic diseases and parameters. Indian J. Dermatol. 2018; 63(5): 91-398. doi: 10.4103/ ijd.IJD_493_17]. Высокой сенсибилизирующей способностью обладают грибки рода Candida albicans, Aspergillus fumigatus, Alternaria alternata, Cladosporium herbarum, Penicillium notatum [Limon J.J., Skalski J.H., Underhill D.M. Commensal fungi in health and disease. Cell Host Microbe. 2018; 22(2): 156-165. doi: 10.1016/j.chom.2017.07.0]. К примеру, Aspergillus fumigatus за последнее десятилетие стал одним из наиболее клинически значимых грибковых патогенов. Попадая в организм человека, данный возбудитель может стать причиной развития серьезных заболеваний, таких как хроническая пневмония, абсцесс головного мозга у пациентов с нейтропенией и у пациентов с дефектами фагоцитов, такими как хроническая гранулематозная болезнь. Повышенная чувствительность к A. alternata является частой причиной развития аллергической астмы и атопического дерматита [Abel-Fernández E., Martínez M.J., Galán T., Pineda F. Going over Fungal Allergy: Alternaria alternata and Its Allergens. J Fungi (Basel). 2023; 9(5):582. doi: 10.3390/jof9050582]. Виды рода Fusarium признаны возбудителями атопических заболеваний у человека, вызывающими широкий спектр поверхностных (кератит, онихомикоз), или дессиминированных инфекций, причем последние встречаются исключительно у пациентов с тяжелым иммунодефицитом [Nucci M., Anaissie Е. Cutaneous infection by Fusarium species in healthy and immunocompromised hosts: implications for diagnosis and management. Clin. Infect. Dis. 2002; 35(8): 909-920. doi: 10.1086/342328].
На фармацевтическом рынке доминируют четыре основных класса противогрибковых средств: азолы, ингибирующие синтез эргостерина; полиены, взаимодействующие со стеролами мембран грибов; эхинокандины, ингибирующие синтез глюканов; и фторированные пиримидины, нарушающие метаболизм пиримидинов, что приводит к ингибированию биосинтеза ДНК и РНК [Roemer T., Krysan D.J. Antifungal drug development: challenges, unmet clinical needs, and new approaches. Cold Spring Harb. Perspect. Med. 2014; 4(5):a019703. doi: 10.1101/cshperspect.a019703]. Появление значительной резистентности к доступным в настоящее время противогрибковым препаратам, их высокая токсичность и узкий спектр активности, низкая растворимость в воде, подчеркивает необходимость в новых подходах к лечению инвазивных грибковых инфекций.
В настоящее время существует ряд запатентованных лекарственных композиций противогрибкового действия, содержащих в качестве активных компонентов антимикотические препараты имидазольной группы (кетоконазол или флуконазол), и препараты интерферона.
Известно лечебное средство в виде ректального и вагинального суппозитория противовирусного, антибактериального и антимикотического действия, содержащее антимикотик кетоконазол или флуконазол и рекомбинантный интерферон альфа, а также фармацевтически приемлемые целевые добавки [Евразийский патент на изобретение № 009840 «Лечебное средство», дата публикации 28.04.2008]. Показана его эффективность против C. Albicans, Kltbsiella sp. Недостатком лечебного средства является узкий спектр противогрибкового действия и побочные эффекты кетоназола и флуконазола в составе указанного средства.
Известна противогрибковая фармацевтическая композиция, включающая рекомбинантный человеческий интерферон 2α и флуконазол, в который дополнительно введены лизоцим, ликопид и димефосфон (патент на изобретение РФ № 2535068 «Противогрибковый лекарственный препарат в суппозитории для детей», дата публикации 10.12.2014, Бюл. № 34). Недостатком фармацевтической композиции является ограничение демонстрации её эффекта оценкой таких признаков, как уменьшение сроков лечения и удлинение межрецидивных промежутков, при этом отсутствуют данные о том, какими грибками вызвано заболевание и против каких грибков заявленное средство является эффективным.
Известно лекарственное средство для вагинального применения, обладающее множественным действием, включая противогрибковое, содержащее в качестве активных веществ флуконазол, метронидазол, альфа- или бета-, или гамма-рекомбинантный интерферон, а также вспомогательные вещества и консистентно-образующую основу, причем компоненты в лекарственном средстве находятся в определенном соотношении в г на 1 г средства [патент на изобретение РФ № 2633056 «Лекарственное средство для вагинального применения, обладающее противовирусным, противомикробным, противогрибковым, противопротозойным, противоинфекционным, иммуномодулирующим и противовоспалительным действием, в виде мази, геля, суппозитория», опубл. 11.10.2017, Бюл. № 29]. Недостатком лекарственного средства является ограничение демонстрации его противогрибкового действия оценкой таких признаков, как заживление, восстановление защитных свойств кожи и слизистых, исчезновение раздражения, отеков, при этом отсутствуют данные о том, какими грибками вызвано заболевание и против каких грибков заявленное средство является эффективным.
Известно комбинированное лекарственное средство для лечения микозов различной локализации, содержащее в качестве активного вещества смесь альфа- или бета-, или гамма-рекомбинантного интерферона в количестве 100-5000000 МЕ/г, тербинафина гидрохлорид и метронидазол, взятые в соотношении 1:1-5 [патент на изобретение РФ № 2431497 «Комбинированное лекарственное средство, обладающее противогрибковым, противовирусным, противогрибковым, противовоспалительным, иммуномодулирующим и бактерицидным действием, для наружного или локального применения», опубл. 20.10.2011, Бюл. № 29]. Недостатком известного средства является то, что его эффективность определяли по восстановлению пораженных тканей без образования коллоидных рубцов и сокращению сроков лечения, при этом отсутствуют данные о том, какими грибками вызвано заболевание и против каких грибков заявленное средство является эффективным.
Иммунотерапия в сочетании с существующей противогрибковой терапией является все более признанной стратегией в лечении грибковых инфекций, за счет доступности широкого спектра рекомбинантных цитокинов, которые оказывают свое действие не напрямую на возбудителей грибковой инфекции, а опосредованно через активацию лейкоцитов. Существующие методы иммунотерапии, включающие применение рекомбинантного интерферона-γ, гранулоцитарного колониестимулирующего фактора G-CSF, гранулоцитарного макрофагального колониестимулирующего фактора GM-CSF, широко используются в борьбе с грибковыми заболеваниями у пациентов с ослабленным иммунитетом. При этом ни G-CSF, ни GM-CSF не связывают напрямую с уменьшением заболеваемости и смертности от инвазивных грибковых инфекций, но предполагают, что они способствуют более быстрому выздоровлению пациента. В рандомизированном клиническом исследовании фазы IV было показано, что смертность, связанная с инвазивными грибковыми заболеваниями через 600 дней после аллогенной трансплантация гемопоэтических стволовых клеток, была ниже в группах, получающих GM-CSF или G-CSF + GM-CSF по сравнению с группой, принимавшей только G-CSF. [Wan L., Zhang Y., Lai Y., Jiang M., Song Y., Zhou J., et al. (2015). Effect of granulocyte-macrophage colony-stimulating factor on prevention and treatment of invasive fungal disease in recipients of allogeneic stem-cell transplantation: a prospective multicenter randomized phase IV trial. J. Clin. Oncol. 33(34), P. 3999-4006]. Недостатком указанных средств является то, что их эффективность ограничена грибами рода Aspergillus (Аsp. niger, Asp. flavus, Asp. species) и Candida (С.albicans, С.glabrata, С.tropicalis, С.krusei) Chen и др. использовали GM-CSF в качестве дополнительной терапии для лечения пациента с аспергиллезным вентрикулитом наряду с вориконазолом, амфотерицином В и каспофунгином. Через 2 года терапии больной полностью выздоровел и перешел в стойкую ремиссию, в то время как традиционная терапия в 67% случаев вызывает смертность от указанной патологии [Chen T. K., Groncy P. K., Javahery R., Chai R. Y., Nagpala P., Finkelman M., et al. (2017). Successful treatment of Aspergillus ventriculitis through voriconazole adaptive pharmacotherapy, immunomodulation, and therapeutic monitoring of cerebrospinal fluid (1rightarrow3)-β-D-glucan. Med. Mycol. 55 109-117]. Недостатком указанного средства является то, что его эффективность ограничена грибами рода Aspergillus, неизвестно его использование против грибов Alternaria alternata, Fusarium oxysporum, Penicillum spp.
Gaviria и др. было проведено in vitro сравнение активности трех распространенных в практике цитокинов - интерферона-γ, G-CSF и GМ-CSF в отношении способности модулировать фунгицидную активность лейкоцитов в отношении гифальных и псевдогифальных условно-патогенных грибов - A. fumigatus, Fusarium solani, и C. albicans [Gaviria JM, van Burik JA, Dale DC, Root RK, Liles WC. Comparison of interferon-gamma, granulocyte colony-stimulating factor, and granulocyte-macrophage colony-stimulating factor for priming leukocyte-mediated hyphal damage of opportunistic fungal pathogens. J Infect Dis. 1999. 179(4):1038-1041]. Исследование показало дифференциальные эффекты цитокинов in vitro: интерферон-γ (1000 Ед/мл) проявлял противогрибковую активность и усиливал повреждение гиф Aspergillus fumigatus, Fusarium solani и Candida albicans, в то время как G-CSF (100 нг/мл) увеличивал опосредованное полиморфноядерными нейтрофилами повреждение только гиф Fusarium solani, а GM-CSF (100 нг/мл) - Fusarium solani и Candida albicans. Исследования на животных моделях также демонстрируют эффективность указанных цитокинов против грибковых инфекций. Недостатком указанных противогрибковых средств является неизвестность их эффективности против грибов Alternaria alternata, Penicillum spp., отсутствие прямого воздействия на грибы, что снижает его эффективность при отсутствии условий для взаимодействия с иммунокомпетентными клетками, например, при нанесении на зараженную грибами поверхность.
Известно применение рекомбинантного интерферона-γ (rIFNγ) в качестве дополнительной иммунотерапии к противогрибковому и хирургическому лечению инвазивного аспергиллеза у педиатрического пациента, вызванного инфекцией Aspergillus terreus [Assendorp E.L., Gresnigt M.S., Sprenkeler EG.G., Meis J.F., Dors N., van der Linden J.W.M, Henriet S.S.V. Adjunctive interferon-γ immunotherapy in a pediatric case of Aspergillus terreus infection. Eur. J. Clin. Microbiol. Infect Dis. 2018; 7(10):1915-1922. doi: 10.1007/s10096-018-3325-4]. Исследования in vitro на моноцитах здоровых добровольцев и пациентов с Aspergillus terreus продемонстрировали, что добавление rIFNγ (5-50 нг/мл) в культуральную среду к моноцитам здоровых добровольцев приводило к росту секреции TNFα и IL-1β. Внесение rIFNγ к моноцитам пациентов с Aspergillus terreus и Aspergillus fumigatus вызывало повышенный ответ TNFα. Кроме того, rIFNγ повышал способность моноцитов как больных, так и здоровых добровольцев уничтожать споры Aspergillus terreus. Ограничением данного исследования может быть активность лишь в отношении одного патогена Aspergillus terreus и опосредованность эффекта цитокиновым профилем клеток, что снижает эффективность его применения при отсутствии контакта с иммунокомпетентными клетками.
Известно использование колониестимулирующего фактора-1 (CSF-1) для индукции устойчивости к грибковой инфекции [EP0955056A1·1999-11-10 Recombinant colony stimulating factor-1 for treatment of fungal infection], однако эффект CSF-1 связывают со стимуляцией иммунной системы через стимуляцию секреции и активности макрофагов, а противогрибковый эффект преимущественно обусловлен применением CSF-1 в сочетании с противогрибковыми агентами (амфотерицин B, флуконазол (дифлюкан), 5-фторцитозин (флюцитозин, 5-FC), кетоконазол, миконазол, интраконазол и т.д.).
В последнее время появляется все больше доказательств важной роли интерферонов I типа (ИФН-I) в защите от инфекций, вызванных грибковыми патогенами. Показано, что полиморфизмы генов, связанных с ИФН-I, ассоциированы с повышенной предрасположенностью к кандидозам [Smeekens S.P., Ng A., Kumar V., Johnson M.D., Plantinga T.S., van Diemen C., et al. Functional genomics identifies type I interferon pathway as central for host defense against Candida albicans. Nat Commun. 2013; 4:1342. https://doi.org/10.1038/ncomms2343] и аспергиллезу [Wang X., Cunha C., Grau M.S., Robertson S.J., Lacerda J.F., Campos A. Jr., et al. MAVS Expression in Alveolar Macrophages Is Essential for Host Resistance against Aspergillus fumigatus. J Immunol. 2022. 209(2):346-353. doi:10.4049/jimmunol.2100759].
Введение комбинации интерферонов I и III типов (IFN-α2 и pegylated-IFN-λ3) (1 μg) мышам с дектин-1−/− способствовало нормализации функции нейтрофилов, однако связанный с этим противогрибковый эффект продемонстрирован только на мышах, пораженных грибком Aspergillus fumigatus [Dutta O., Espinosa V., Wang K., Avina S., Rivera A. Dectin-1 Promotes Type I and III Interferon Expression to Support Optimal Antifungal Immunity in the Lung. Front Cell Infect Microbiol. 2020; 10:321. doi: 10.3389/fcimb.2020.00321]. Поскольку фунгицидный эффект интерферонов проявлялся опосредованно, через повышение функционального состояния нейтрофилов, это ограничивает сферу их применения при отсутствии контакта с иммунокомпетентными клетками.
Наиболее близким аналогом к заявляемому средству является использование рекомбинантного интерферона альфа-2б (рИФН-α2b) в качестве средства подавления противогрибковой активности Candida albicans. Показано, что обработка эпителиальных клеток влагалища rhIFN-α2b в дозе 1,25 мг/мл приводила к активации клеточного иммунитета, а также ингибировала адгезию, образование гифт и пролиферацию Candida albicans [Li T, Niu X, Zhang X, Wang S, Liu Z. Recombinant Human IFNα-2b Response Promotes Vaginal Epithelial Cells Defense against Candida albicans. Front Microbiol. 2017 Apr 20;8:697.]. Недостатками данного средства является узкий спектр грибковых патогенов, а именно, активность в отношении только Candida albicans, а также необходимость применения высоких доз рИФН-α2b (1,25 мг/мл) для достижения противогрибкового эффекта, которые оказывают побочное цитотоксическое действие. Кроме того, фунгицидный эффект рИФН-α2b проявлял опосредованно, через активацию иммунной системы организма или клеток, что ограничивает сферу его применения при отсутствии контакта с иммунокомпетентными клетками, например, при нанесении на зараженную грибами поверхность.
Аналогичный эффект рИФН-α2b (1.25 мг/мл) эти же авторы получили на крысиной модели вульвовагинального кандидоза. Рекомбинантный рИФН-α2b вызывал устранение данного патогена в 50% случаев, в то время как эффективность типичного противогрибкового препарата нистатина составила 100% [15 Li T, Liu Z, Zhang X, Chen X, Wang S. Therapeutic effectiveness of type I interferon in vulvovaginal candidiasis. Microb Pathog. 2019; 134:103562. doi: 10.1016/j.micpath.2019.103562].
Технологической проблемой является повышение эффективности противогрибкового действия в отношении патогенных грибов - возбудителей заболеваний человека и животных.
Решение технологической проблемы достигается путем применении химерного рекомбинантного интерферона рИФН-α2b-АпоА-I в качестве противогрибкового средства.
Техническим результатом является расширение спектра противогрибкового действия рИФН-α2b-АпоА-I в отношении патогенных грибов Alternaria alternate, Fusarium oxysporum, Aspergillus spp., Penicillum spp.; снижение токсичности противогрибкового средства путем применения его терапевтически значимой дозы 15-150 нг/мл; обеспечение прямого фунгицидного действия при контакте с возбудителем грибковой инфекции.
Раскрытие сущности изобретения
Предложено применение рекомбинантного интерферона альфа-2б. человека, слитого через линкер с С-конца с аминокислотной последовательностью зрелого аполипопротеина A-I человека, в качестве противогрибкового средства (далее - химерный рекомбинантный интерферон рИФН-α2b-АпоА-I или кратко рИФН-α2b-АпоА-I.
Структура заявленного химерного рекомбинантного интерферона рИФН-α2b-АпоА-I и способ его получения представлены ранее в патенте на изобретение РФ № 2764787 «Рекомбинантная плазмидная ДНК, кодирующая химерный интерферон alpha2b, рекомбинантный штамм дрожжей P. pastoris X33 - продуцент химерного интерферона alpha2b и способ получения указанного белка», опубл. 21.01.2022, Бюл. № 3.
рИФН-α2b-АпоА-I, 434 а.о., молекулярная масса 49,360 кДа (SEQ ID NO 1), включает с N-конца аминокислотную последовательность зрелого интерферона α2b человека (рИФН-α2b), 165 а.о., молекулярная масса 19,268 кДа, слитую с С-конца с аминокислотной последовательностью линкера, 20 а.о., молекулярная масса 1,469 кДа, который, в свою очередь, слит с С-конца с аминокислотной последовательностью зрелого аполипопротеина A-I человека (АпоА-I), 243 а.о., молекулярная масса 28,076 кДа. Известно, что данный интерферон обладает противовирусным действием.
Перечень фигур
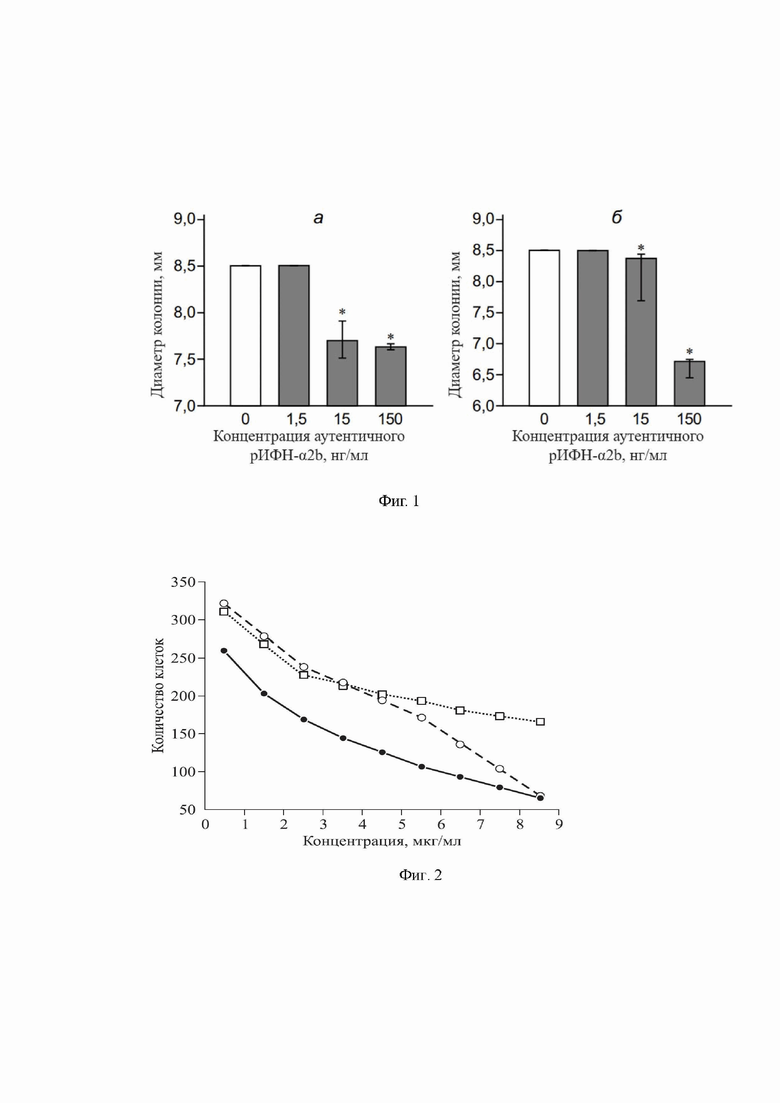
Фиг.1. Дозозависимый эффект аутентичного рИФН-α2b на диаметр колоний грибов A. alternate (а) и F. oxysporum (б) на 5-е сутки роста.
Примечание: концентрация 0 соответствует группе контроля без добавления аутентичного рИФН-α2b; * - отличие от величины показателя группы контроля статистически значимо при р < 0,05.
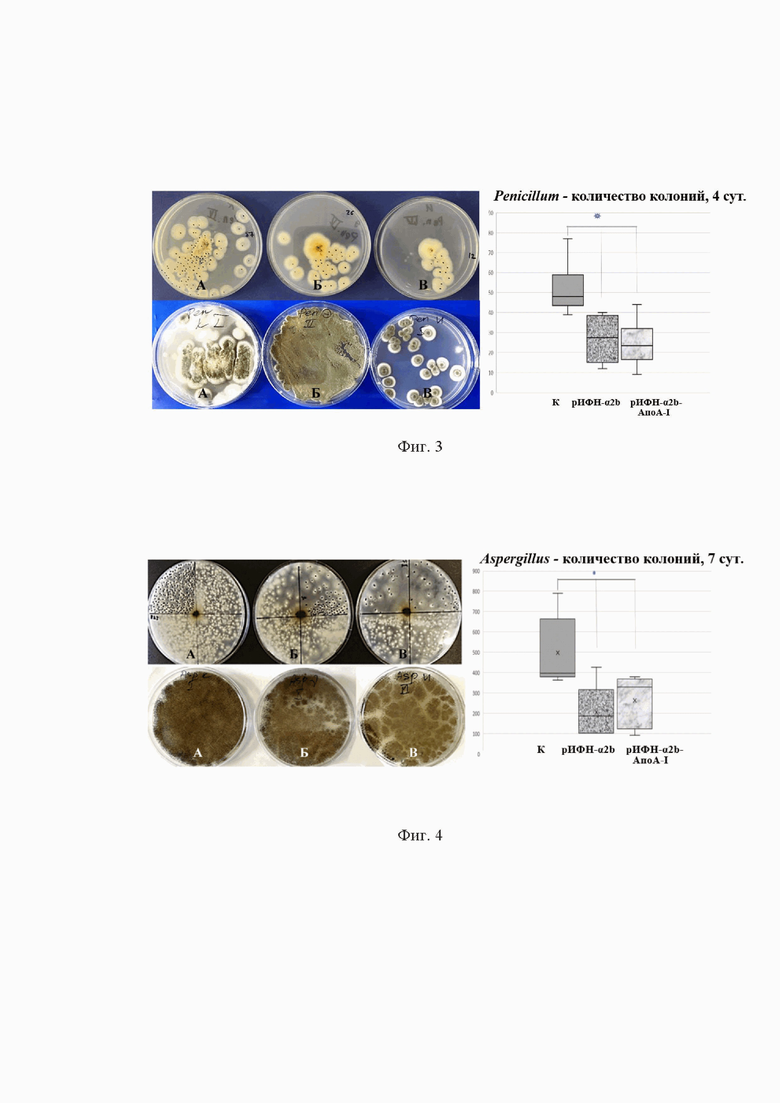
Фиг. 2. Дозозависимый цитотоксический эффект аутентичного рИФН-α2b, коммерческого рИФН-α2b «Альтевир» и заявленного химерного рИФН-α2b-АпоА-I на клетки Vero, определяемый по количеству оставшихся жизнеспособных клеток в зависимости от концентрации вводимых в культуру клеток интерферонов.
Примечание: рИФН-α2b - аутентичный рИФН-α2b; пунктир с квадратом- аутентичный рИФН-α2b, пунктир с кругом- рИФН-α2b-АпоА-I, сплошная линия с точкой- рИФН-α2b «Альтевир».
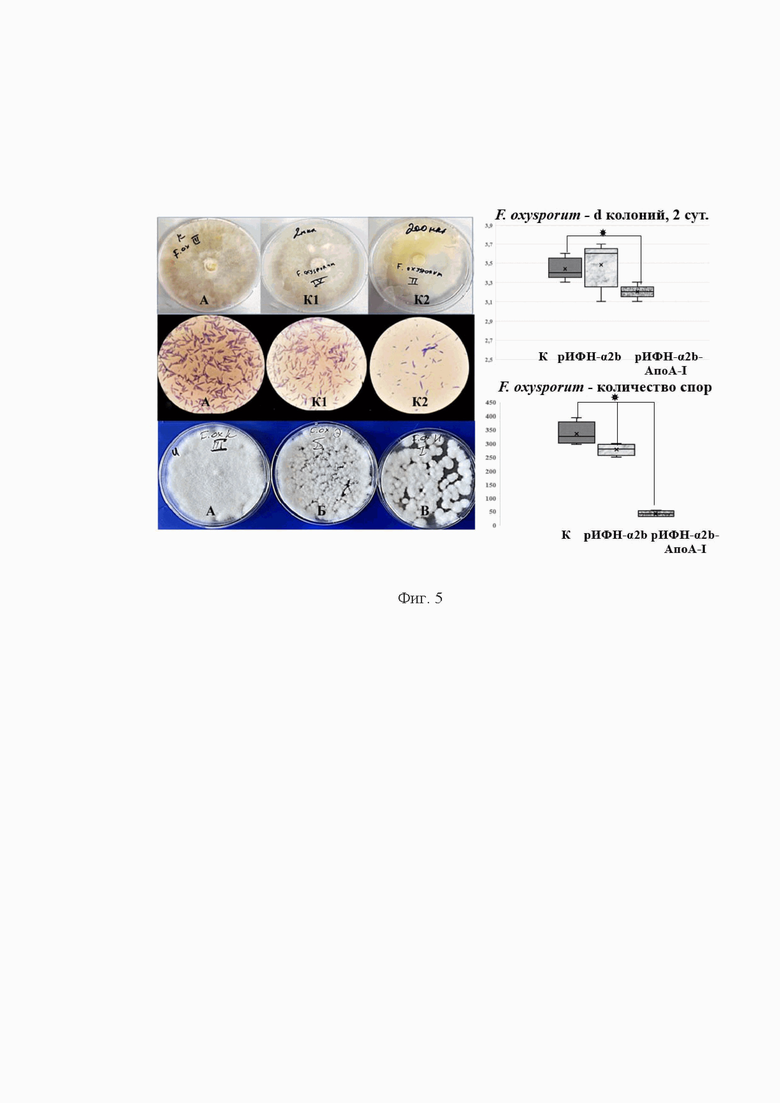
Фиг. 3. Влияние рИФН-α2b-АпоА-I на рост и количество колоний Penicillum spp в сравнении с аутентичным рИФН-α2b и контролем.
Примечание: А - контроль, Б - аутентичный рИФН-α2b, В - рИФН-α2b-АпоА-I. Верхний ряд - рост колоний гриба в течение четырех суток; нижний ряд - пересев 10-суточного гриба на среду, не содержащую добавок. Справа - количество колоний при пересеве на 4-е сутки роста гриба, *p<0,05 по сравнению с контролем.
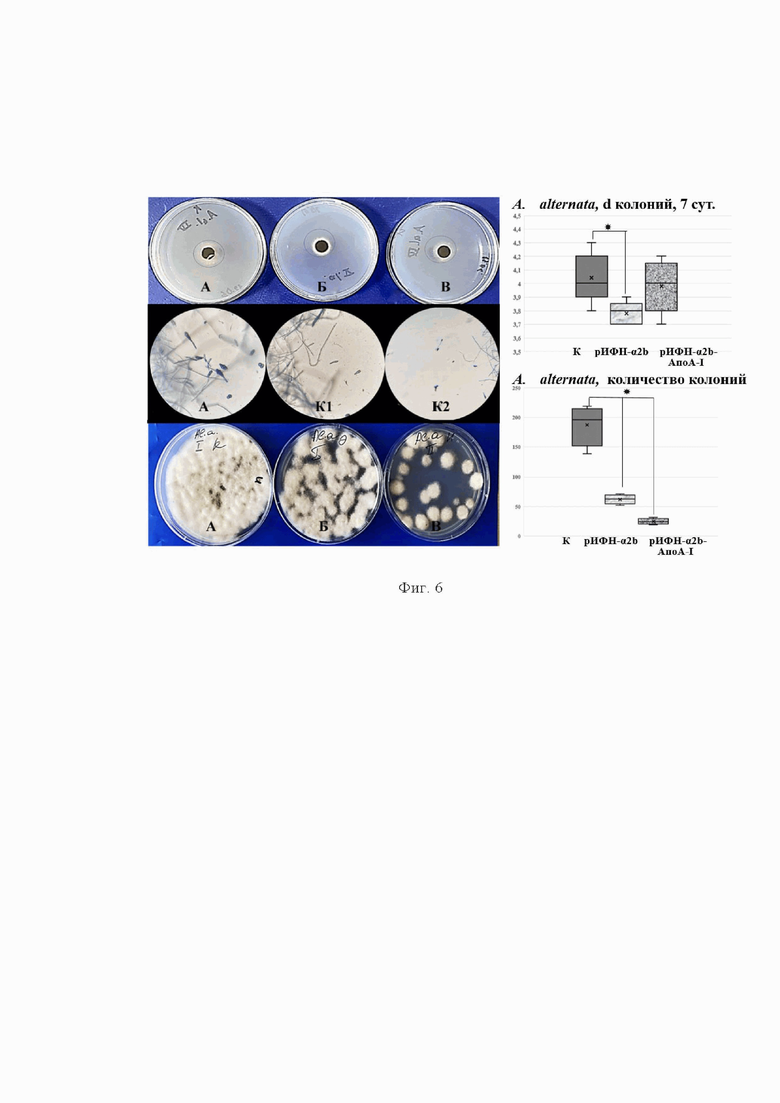
Фиг. 4. Влияние рИФН-α2b-АпоА-I на рост и количество колоний Aspergillus spp в сравнении с аутентичным рИФН-α2b и контролем
Примечание: А - контроль, Б - аутентичным рИФН-α2b, В - рИФН-α2b-АпоА-I. Верхний ряд - рост колоний в течение семи суток; нижний ряд - пересев 10-суточного гриба на среду, не содержащую добавок. Справа - количество колоний при пересеве на 7-е сутки роста гриба, *p<0,05 по сравнению с контролем.
Фиг. 5. Влияние рИФН-α2b-АпоА-I на рост, диаметр колоний и количество спор Fusarium spp в сравнении с аутентичным рИФН-α2b и контролем
Примечание: А - контроль, Б - аутентичный рИФН-α2b, В - рИФН-α2b-АпоА-I; К1 - 15 нг/мл рИФН-α2b-АпоА-I, К2 - 150 нг/мл рИФН-α2b-АпоА-I. Верхний ряд - рост колоний в течение 7 суток; средний ряд - споры, (640х); нижний ряд - пересев 10-суточного гриба на среду, не содержащую добавок. Справа - диаметр колоний на 2-е сутки роста (мм) и количество спор на 10 сутки, *p<0,05 по сравнению с контролем.
Фиг. 6. Влияние рИФН-α2b-АпоА-I на рост колоний, мицелий и споры грибов, диаметр и количество колоний Alternaria alternate в сравнении с коммерческим рИФН-α2b «Альтевир» и контролем.
Примечание: А - контроль, Б - рИФН-α2b «Альтевир, В - рИФН-α2b-АпоА-I; верхний ряд - рост в течение 2 суток; средний ряд - мицелий и споры гриба в контроле и в присутствии рИФН-α2b-АпоА-I - К1 (15 нг/мл) и К2 (150 нг/мл); нижний ряд - пересев 10-суточного гриба на среду, не содержащую добавок. Справа - Диаметр колоний Alternaria alternate на 7-е сутки роста (мм) и количество колоний при пересеве, *p<0,05 по сравнению с контролем.
Осуществление изобретения (примеры)
Фунгицидное действие заявленного средства рИФН-α2b-АпоА-I исследовали в отношении патогенных грибов Alternaria alternata, Fusarium oxysporum, Aspergillus spp., Penicillum spp.
Грибы Alternaria alternata и Fusarium oxysporum, которые были выделены из пораженных клубней картофеля сорта Розара (г. Новосибирск, Дзержинский район) в 2022 г. стандартным методом [Масленникова В.С., Цветкова В.П., Бедарева Е.В. Ростостимулирующие, антиоксидантные и фунгицидные свойства эндофитных бактерий Bacillus thuringiensis на картофеле при заражении ризоктониозом. Достижения науки и техники АПК. 2022; 36(7): 49-55], Aspergillus spp. и Penicillum spp. - из почвенных образцов Новосибирской области стандартным посевом на чашки Петри на среду Чапека и выращиванием при 25°С.
Фунгицидное действие заявленного средства рИФН-α2b-АпоА-I оценивали в сравнении с аутентичным интерфероном альфа-2б (рИФН-α2b), полученным биосинтезом в Pichia pastoris, а также коммерческим препаратом интерферона альфа-2б «Альтевир» («Фармстандарт», РФ, далее - рИФН-α2b «Альтевир. Фунгицидное действие заявленного средства рИФН-α2b-АпоА-I и указанных интерферонов для сравнения (далее - интерферонов сравнения) против выделенных патогенов оценивали с использованием методики агаровых блоков. Первоначально определили диапазон рабочих концентраций заявленного средства и интерферонов сравнения. В питательную среду Чапека раздельно вносили заявленное средство и интерфероны сравнения в концентрациях 1,5, 15 и 150 нг/мл и разливали в чашки Петри. Предварительно готовили чашки с Alternaria alternate и Fusarium oxysporum, доращивая до состояния полного покрытия мицелием гриба поверхности агара. На одинаковом расстоянии от центра колонии по окружности вырезали кусочки мицелия размером 1×1 см2 и помещали в центр каждой чашки (опытных и контрольных образцов). Все патогены оценивали в пяти повторах. Фунгицидное действие заявленного средства рИФН-α2b-АпоА-I и интерферонов сравнения оценивали по величине диаметра колонии гриба в сравнении с контролем (среда Чапека без цитокина). Выбранную рабочую концентрацию заявленного средства рИФН-α2b-АпоА-I использовали далее для оценки фунгицидной активности в отношении Alternaria alternate, Fusarium oxysporum, Aspergillus spp., Penicillum spp. В качестве положительного контроля использовали коммерческий препарат рИФН-α2b «Альтевир». Учет проводили на 2-е, 4-е, 7-е и 10-е сутки. Фунгицидное действие препаратов оценивали по величине диаметра колонии и количеству колоний. На 10-е сутки выполняли микроскопирование стандартно окрашенных метиленовым синим фитопатогенных грибов (Axio Lab.A1, Zeiss AG, Германия), оценивая состояние мицелия и спор. На 10-е сутки пересеивали спорообразующие грибы из контрольных и опытных чашек на среды без добавок цитокинов. Подсчитывали количество новых колоний. При выполнении статистической обработки полученных результатов определяли значения медианы, первого и третьего квартилей (Me [Q1; Q3]). Достоверность различий с контролем вычисляли с помощью непараметрического критерия Манна-Уитни и считали статистически значимыми при p < 0,05.
Для определения нетоксичной для клеток эукариот концентрации заявленного средства рИФН-α2b-АпоА-I был проведен анализ на цитотоксичность в сравнении с коммерческим препаратом рИФН-α2b «Альтевир». Клетки Vero культивировали в 48-луночных планшетах до монослойной культуры, вносили цитокины в концентрациях 1, 3, 6, 9 и 27 мкг/мл и культивировали в течение 24 ч. Клетки с планшета снимали TrypLE (Sigma-Aldrich), ресуспендировали в 100 мкл фосфатно-солевого буфера и подсчитывали общее количество в каждой лунке с использованием проточного цитометра CytoFlex S100 (Beckman Coulter, США). Анализ проводили в трех повторах. Данные выражали в виде среднего арифметического и ошибки среднего (M ± m).
Рабочий диапазон концентраций рИФН-α2b-АпоА-I определяли на аутентичном рИФН-α2b в отношении грибов Alternaria alternate, Fusarium oxysporum. Использовали концентрации аутентичного рИФН-α2b от 15 нг/мл до 150 нг/мл. Ингибиторное действие аутентичного рИФН-α2b оценивали на 5 сутки по уменьшению диаметра колонии грибов. Ингибирующее влияние аутентичного рИФН-α2b на Alternaria alternate было выявлено уже при концентрации 15 нг/мл, выраженное в сокращении диаметра колонии в 1,1 раза. Для Fusarium oxysporum ингибиторной оказалась концентрация аутентичного рИФН-α2b 150 нг/мл (Фиг.1).
В дальнейшем для анализа влияния фунгицидной активности рИФН-α2b-АпоА-I использовали дозу 15 нг/мл - меньшую из концентраций, оказывающих значимый эффект.
Пример 1. Анализ на цитотоксичность рИФН-α2b-АпоА-I
Анализ на цитотоксичность рИФН-α2b-АпоА-I на клетках млекопитающих Vero выявил, что его токсическое действие проявлялось уже начиная с 1 мкг/мл; 50%-я ингибирующая концентрация для рИФН-α2b-АпоА-I составила 5,8±0,45 мкг/мл, что значительно выше дозы 15-150 нг/мл, достаточной для проявления фунгицидного действия. В то же время для коммерческого препарата рИФН-α2b «Альтевир» она составила 2,6±0,4 мкг/мл (Фиг. 2).
Пример 2. Влияние рИФН-α2b-АпоА-I на количество колоний Aspergillus spp., Penicillum spp
Влияние рИФН-α2b-АпоА-I на количество колоний исследовали в отношении грибов Aspergillus spp., Penicillum spp. На 4-е сутки предынкубации Penicillum spp. с рИФН-α2b-АпоА-I количество колоний по сравнению с контролем сократилось в 1,75 раза (Фиг. 3); при предынкубации рИФН-α2b-АпоА-I с Aspergillus spp. количество колоний на 7 сутки сократилось в 1,87 раза в сравнении с контролем (Фиг. 4).
Пример 3. Влияние рИФН-α2b-АпоА-I на интенсивность роста мицелия гриба Fusarium oxysporum
На 7 сутки прединкубации в контроле (среда Чапека без цитокина) мицелий заполнял весь объем чашки, в то время как в предобработанных рИФН-α2b-АпоА-I чашках мицелий был частично редуцирован - произошло сокращение площади мицелия в 1,4 раза (Фиг. 5). Кроме того, в прединкубированных с рИФН-α2b-АпоА-I чашках уменьшилась интенсивность окраски мицелия, что свидетельствует о снижении метаболизма гриба.
Пример 4. Влияние рИФН-α2b-АпоА-I на рост колоний грибов Alternaria alternate, Fusarium oxysporum, Penicillum spp
Пересев культуры грибов Alternaria alternate, Fusarium oxysporum, Penicillum spp после 10 суток роста на среде, содержащей 15 нг/мл рИФН-α2b-АпоА-I на аналогичную среду, не содержащую данного препарата, выявил уменьшение количества колоний грибов по сравнению с контролем. (Фиг. 3, 5 - нижний ряд). Это значит, что изначально, когда грибы были прединкубировали с рИФН-α2b-АпоА-I, их рост угнетался, явно затрагивая репродуктивную систему гриба, поэтому жизнеспособных спор было меньше, что влияло на уменьшение количества вновь выросших колоний. Для учета этого явления был произведен пересев этой угнетенной грибной культуры на среду без добавки рИФН-α2b-АпоА-I для оценки его фунгистатического действия
Пример 5. Влияние рИФН-α2b-АпоА-I на спорообразование грибов Alternaria alternate, Fusarium oxysporum
На фиг. 5, 6 показано, что при концентрации 15 и 150 нг/мл рИФН-α2b-АпоА-I достигалось 87%-ное статистически значимое ингибирование спорообразования грибов Alternaria alternate, Fusarium oxysporum по сравнению с контролем.
Таким образом, показано, что заявленный рИФН-α2b-АпоА-I при прямом контакте с грибами приводит к замедлению роста колонии грибов Alternaria alternate, Aspergillus spp., Penicillum spp; разрушает гифы мицелия грибов Alternaria alternate, Penicillum spp.; редуцирует спорообразование у грибов Alternaria alternate, Fusarium oxysporum, Penicillum spp. в концентрациях 15-150 нг/мл, не токсичных для клеток млекопитающих.
Как следует из уровня техники, противогрибковые препараты обладают прямыми фунгицидными или фунгистатическими свойствами, а эффект всех видов интерферонов рассматривают через взаимодействие с клетками иммунной системы хозяина. В данном изобретении показано значительное прямое противогрибковое действие заявленного рИФН-α2b-АпоА-I на примере четырех патогенных грибов: Alternaria alternate, Fusarium oxysporum, Aspergillus spp., Penicillum spp,
Сравнение аутентичного рИФН-α2b и заявленного рИФН-α2b-АпоА-I показало лучшую фунгицидную активность химерной формы. Прямое действие рИФН-α2b-АпоА-I расширяет спектр его возможного применения для обработки различных поверхностей кожи, ногтей, то есть там, где отсутствуют клетки, способные продуцировать цитокины, хемокины и радикалы. Низкие дозы рИФН-α2b-АпоА-I, оказывающие прямое влияние на спорообразование грибов, предполагают возможность его использования в адъювантной терапии пациентов с нарушениями иммунитета.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КОНТРОЛЯ ГРИБОВ | 2021 |
|
RU2837648C1 |
| ПРИМЕНЕНИЕ КЛЕТОЧНОГО ЭКСТРАКТА ОДНОЙ ИЛИ БОЛЕЕ МИКРОСКОПИЧЕСКИХ ВОДОРОСЛЕЙ РОДА AMPHIDINIUM ДЛЯ ЕГО ФУНГИЦИДНОЙ И/ИЛИ БАКТЕРИЦИДНОЙ АКТИВНОСТИ В ОТНОШЕНИИ ГРИБОВ, ООМИЦЕТОВ И/ИЛИ ПАТОГЕННЫХ БАКТЕРИЙ РАСТЕНИЙ И СЕМЯН КУЛЬТУР | 2017 |
|
RU2762235C2 |
| Композиция с противогрибковой активностью | 2023 |
|
RU2827161C1 |
| ПРИМЕНЕНИЕ АМФИДИНОЛА С ФУНГИЦИДНОЙ И(ИЛИ) БАКТЕРИЦИДНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ГРИБОВ, ООМИЦЕТОВ И(ИЛИ) ПАТОГЕННЫХ БАКТЕРИЙ РАСТЕНИЙ И СЕМЯН | 2018 |
|
RU2790051C2 |
| Способ лечения грибковой язвы роговицы | 2021 |
|
RU2802388C2 |
| СПОСОБ БОРЬБЫ С ГРИБКОВЫМИ И БАКТЕРИАЛЬНЫМИ ЗАБОЛЕВАНИЯМИ СЕЛЬСКОХОЗЯЙСТВЕННЫХ РАСТЕНИЙ | 2008 |
|
RU2371919C1 |
| Штамм микромицета Penicillium crustosum ИНА 01369 ВКПМ F-1843 - продуцент антибиотиков, обладающий антимикробной активностью к фитопатогенным грибам рода Fusarium | 2023 |
|
RU2820703C1 |
| ИСПОЛЬЗОВАНИЕ СОЕДИНЕНИЙ ПРИ ЛЕЧЕНИИ ГРИБКОВЫХ ИНФЕКЦИЙ | 2021 |
|
RU2805930C1 |
| Штамм Trichoderma asperellum F-1395 - продуцент гидролитического комплекса | 2020 |
|
RU2740318C1 |
| Штамм спорообразующих бактерий Bacillus amyloliquefaciens, обладающий фунгицидным действием против фитопатогенных грибов, вызывающих заболевания овощных растений, биологический препарат на его основе | 2018 |
|
RU2701500C1 |
Изобретение относится к области биотехнологии и медицины и представляет собой противогрибковое средство в отношении ряда грибов-патогенов человека и животных. Предложено применение интерферона alpha-2b человека, слитого через линкер с С-конца с аминокислотной последовательностью зрелого аполипопротеина A-I человека, в качестве противогрибкового средства для расширения спектра противогрибкового действия рИФН-α2b-АпоА-I в отношении патогенных грибов Alternaria alternate, Fusarium oxysporum, Aspergillus spp., Penicillum spp.; снижения токсичности противогрибкового средства путем применения его терапевтически значимой дозы 15-150 нг/мл; обеспечения прямого фунгицидного действия при контакте с возбудителем грибковой инфекции. 6 ил., 5 пр.
Применение интерферона alpha-2b человека, слитого через линкер с С-конца с аминокислотной последовательностью зрелого аполипопротеина A-I человека (SEQ ID NO 1), в качестве противогрибкового средства.
| КОМБИНИРОВАННОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВОГРИБКОВЫМ, ПРОТИВОВИРУСНЫМ, ПРОТИВОМИКРОБНЫМ, ПРОТИВОВОСПАЛИТЕЛЬНЫМ, ИММУНОМОДУЛИРУЮЩИМ И БАКТЕРИЦИДНЫМ ДЕЙСТВИЕМ ДЛЯ НАРУЖНОГО ИЛИ ЛОКАЛЬНОГО ПРИМЕНЕНИЯ | 2010 |
|
RU2431497C1 |
| Рекомбинантная плазмидная ДНК, кодирующая химерный интерферон alpha2b, рекомбинантный штамм дрожжей P. pastoris X33 - продуцент химерного интерферона alpha2b и способ получения указанного белка | 2020 |
|
RU2764787C1 |
| ПРОТИВОГРИБКОВЫЙ ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ В СУППОЗИТОРИЯХ ДЛЯ ДЕТЕЙ | 2013 |
|
RU2535068C1 |
| Assendorp E.L., Gresnigt M.S., Sprenkeler EG.G., Meis J.F., Dors N., van der Linden J.W.M, Henriet S.S.V | |||
| Adjunctive interferon-γ immunotherapy in a pediatric case of Aspergillus terreus infection | |||
| Eur | |||
| J | |||
| Clin | |||
| Microbiol | |||
| Infect Dis | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| doi: | |||
Авторы
Даты
2024-07-25—Публикация
2024-04-09—Подача