Притязание на приоритет
Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США № 62/563877, поданной 27 сентября 2017 года, заявки на патент США № 62/652881, поданной 4 апреля 2018 года, а также заявки на патент США № 62/652882, поданной 4 апреля 2018 года. Раскрытие каждой из вышеупомянутых заявок включено в данный документ посредством ссылки во всей своей полноте.
Перечень последовательностей
Настоящая заявка содержит перечень последовательностей, который был подан в электронном виде в формате с кодировкой ASCII и настоящим включен посредством ссылки во всей своей полноте. Указанная копия в формате ASCII, созданная 26 сентября 2018 года, имеет название S2225-7015WO_SL.txt, и ее размер составляет 205145 байт.
Предпосылки изобретения
Функция имплантированных клеток, тканей и устройств зависит от множества факторов, в том числе способности обеспечивать продукт и пути биологического иммунного ответа у реципиента (Anderson et al., Semin Immunol (2008) 20:86-100; Langer, Adv Mater (2009) 21:3235-3236). Отбор клеток и модуляция иммунного ответа могут оказывать благотворный эффект на качество и функцию имплантированных клеток, тканей и устройств.
Краткое описание изобретения
В данном документе описаны композиции на основе клеток, содержащие активную клетку, например, сконструированную активную клетку, например, сконструированную клетку пигментного эпителия сетчатки (RPE) или производные этой клетки, и композиции, фармацевтические продукты и имплантируемые элементы, содержащие активную клетку, а также способы их получения и применения. В некоторых вариантах осуществления активные клетки, композиции и имплантируемые элементы, описанные в данном документе, продуцируют терапевтическое средство (например, заместительное средство), применимого, например, для лечения заболевания, нарушения или состояния у субъекта, например, нарушения свертываемости крови или лизосомной болезни накопления. В некоторых вариантах осуществления композиции и имплантируемые элементы, содержащие активную клетку, например, сконструированную клетку RPE, способны модулировать иммунный ответ или эффект иммунного ответа у субъекта.
В одном аспекте настоящее изобретение относится к имплантируемому элементу, содержащему сконструированную активную клетку (например, сконструированную клетку RPE), которая продуцирует (например, или способна продуцировать) терапевтическое средство. Терапевтическое средство может представлять собой биологическое вещество, такое как нуклеиновая кислота (например, нуклеотид, ДНК или РНК), полипептид, липид, сахар (например, моносахарид, дисахарид, олигосахарид или полисахарид) или малая молекула. В некоторых вариантах осуществления терапевтическое средство представляет собой полипептид, и сконструированная активная клетка содержит промотор, функционально связанный с нуклеотидной последовательностью, которая кодирует полипептид, где промотор фактически состоит из нуклеотидной последовательности, которая идентична или фактически идентична SEQ ID NO:23. В некоторых вариантах осуществления терапевтическое средство представляет собой средство заместительной терапии или заместительный белок, например, применимые для лечения нарушения свертываемости крови или лизосомной болезни накопления у субъекта.
В некоторых вариантах осуществления имплантируемый элемент содержит одиночную сконструированную активную клетку (например, сконструированную клетку RPE). В некоторых вариантах осуществления имплантируемый элемент содержит совокупность сконструированных активных клеток (например, сконструированных клеток RPE), например, обеспечиваемых в виде кластера или размещенных на микроносителе. В некоторых вариантах осуществления сконструированная активная клетка или активные клетки (например, сконструированная клетка RPE или клетки RPE) продуцирует(-ют) или высвобождает(-ют) терапевтическое средство (например, полипептид) в течение по меньшей мере 5 дней, например, при имплантировании в субъекта или при оценке посредством любого эталонного способа, известного в данной области техники, например, полимеразной цепной реакции или in situ гибридизации для нуклеиновых кислот; масс-спектроскопии для липидов, сахаров и малых молекул; микроскопии и других методик визуализации для средств, модифицированных с помощью флуоресцентной или люминесцентной метки, и ELISA или вестерн-блоттинга для полипептидов. В некоторых вариантах осуществления имплантируемый элемент содержит инкапсулирующий компонент (например, образованный in situ на сконструированной активной клетке или вокруг нее или предварительно сформованный перед объединением со сконструированной активной клеткой). В некоторых вариантах осуществления имплантируемый элемент является химически модифицированным, например, с помощью соединения формулы (I), описанного в данном документе.
В другом аспекте настоящее изобретение относится к способу лечения субъекта, предусматривающему введение субъекту имплантируемого элемента, содержащего сконструированную активную клетку (например, сконструированную клетку RPE). В некоторых вариантах осуществления имплантируемый элемент содержит совокупность сконструированных активных клеток (например, сконструированных клеток RPE). В некоторых вариантах осуществления субъект представляет собой человека. В некоторых вариантах осуществления сконструированная активная клетка (например, сконструированная активная клетка) представляет собой клетку человека (например, клетку RPE человека). В некоторых вариантах осуществления имплантируемый элемент содержит сконструированную активную клетку (например, сконструированную клетку RPE), которая продуцирует (или, например, способна продуцировать) терапевтическое средство, такое как нуклеиновая кислота (например, нуклеотид, ДНК или РНК), полипептид, липид, сахар (например, моносахарид, дисахарид, олигосахарид или полисахарид) или малая молекула. В некоторых вариантах осуществления терапевтическое средство представляет собой средство заместительной терапии или заместительный белок, например, применимые для лечения нарушения свертываемости крови или лизосомной болезни накопления у субъекта. В некоторых вариантах осуществления имплантируемый элемент составлен для имплантации или инъекции в субъекта. В некоторых вариантах осуществления имплантируемый элемент вводят, имплантируют или обеспечивают в месте, отличном от центральной нервной системы, головного мозга, позвоночника, глаза или сетчатки. В некоторых вариантах осуществления имплантируемый элемент вводят или имплантируют или инъецируют в брюшную полость (например, сальниковую сумку), сальник или подкожный жир субъекта.
В другом аспекте настоящее изобретение относится к способу получения или изготовления имплантируемого элемента, содержащего сконструированную активную клетку (например, сконструированную клетку RPE). В некоторых вариантах осуществления способ предусматривает обеспечение сконструированной активной клетки (например, сконструированной клетки RPE) и размещение сконструированной активной клетки (например, сконструированной клетки RPE) в заключающем компоненте, например, описанном в данном документе. В некоторых вариантах осуществления имплантируемый элемент содержит совокупность сконструированных активных клеток (например, сконструированных клеток RPE). В некоторых вариантах осуществления имплантируемый элемент содержит совокупность сконструированных активных клеток (например, сконструированных клеток RPE), например, обеспечиваемых в виде кластера или размещенных на микроносителе. В некоторых вариантах осуществления заключающий компонент формуется in situ на сконструированной активной клетке (например, сконструированной клетке RPE), совокупности сконструированных активных клеток (например, сконструированных клеток RPE) или микроносителе (например, грануле или матрице), содержащем активную клетку или активные клетки, или вокруг них. В некоторых вариантах осуществления заключающий компонент предварительно сформован перед объединением с заключаемой сконструированной активной клеткой (например, сконструированной клеткой RPE), совокупностью сконструированных активных клеток (например, сконструированных клеток RPE) или микроносителем (например, гранулой или матрицей), содержащим активную клетку или активные клетки. В некоторых вариантах осуществления заключающий компонент предусматривает гибкий полимер (например, PLA, PLG, PEG, CMC или полисахарид, например, альгинат). В некоторых вариантах осуществления заключающий компонент предусматривает негибкий полимерный или металлический корпус. В некоторых вариантах осуществления заключающий компонент является химически модифицированным, например, с помощью соединения формулы (I), описанного в данном документе.
В другом аспекте настоящее изобретение относится к способу оценки имплантируемого элемента, содержащего сконструированную активную клетку (например, сконструированную клетку RPE). В некоторых вариантах осуществления способ предусматривает обеспечение сконструированной активной клетки (например, сконструированной клетки RPE) и оценку структурного или функционального параметра инкапсулированной клетки RPE. В некоторых вариантах осуществления способ предусматривает оценку сконструированной активной клетки или совокупности сконструированных активных клеток в отношении одного или более из: а) жизнеспособности; b) продукции терапевтического средства (например, сконструированной РНК или полипептида); c) поглощения питательного вещества или кислорода или d) продуцирования продукта жизнедеятельности. В некоторых вариантах осуществления оценку выполняют через по меньшей мере 1, 5, 10, 20, 30 или 60 дней после формования имплантируемого элемента или введения имплантируемого элемента субъекту.
В другом аспекте настоящее изобретение относится к способу мониторинга имплантируемого элемента, содержащего сконструированную активную клетку (например, сконструированную клетку RPE). В некоторых вариантах осуществления способ предусматривает получение уровня параметра, например, посредством тестирования субъекта или образца из него, и сравнение полученного значения, например, посредством тестирования субъекта или образца из него, с соответствующим эталонным значением. В некоторых вариантах осуществления параметр предусматривает: а) жизнеспособность клетки; b) уровень продукции терапевтического средства (например, сконструированной РНК или полипептида); c) поглощение питательного вещества или кислорода или d) продукцию продукта жизнедеятельности. В некоторых вариантах осуществления оценку выполняют через по меньшей мере 1, 5, 10, 20, 30 или 60 дней после формования имплантируемого элемента или введения имплантируемого элемента субъекту.
В другом аспекте настоящее изобретение относится к совокупности сконструированных активных клеток (например, сконструированных клеток RPE). В некоторых вариантах осуществления совокупность характеризует предварительно заданный форм-фактор или форм-фактор, описанный в данном документе, например, кластер сконструированных активных клеток (например, сконструированных клеток RPE). В некоторых вариантах осуществления кластер сконструированных активных клеток (например, сконструированных клеток RPE) содержит по меньшей мере приблизительно 5, 10, 25, 50, 75, 100, 200, 250, 300, 400, 500 или более сконструированных активных клеток. В некоторых вариантах осуществления кластер является шарообразным или сферическим. В некоторых вариантах осуществления кластер не представляет собой монослой. В некоторых вариантах осуществления кластер характеризуется плотностью приблизительно 500 клеток/см2 или более. В некоторых вариантах осуществления совокупность сконструированных активных клеток (например, сконструированных клеток RPE) размещена на микроносителе (например, грануле или матрице).
В другом аспекте настоящее изобретение относится к субстрату, содержащему совокупность камер, где каждая камера содержит сконструированную активную клетку (например, сконструированную клетку RPE). В некоторых вариантах осуществления каждая камера содержит совокупность сконструированных активных клеток (например, сконструированных клеток RPE). В некоторых вариантах осуществления совокупность предусматривает кластер сконструированных активных клеток (например, сконструированных клеток RPE) и/или они размещены на микроносителе (например, грануле или матрице).
В другом аспекте настоящее изобретение относится к микроносителю, например, грануле или матрице, с размещенной на нем сконструированной активной клеткой (например, сконструированной клеткой RPE).
В другом аспекте настоящее изобретение относится к препарату из сконструированных активных клеток (например, сконструированных клеток RPE), где препарат содержит по меньшей мере приблизительно 10000 сконструированных активных клеток (например, сконструированных клеток RPE), например, по меньшей мере приблизительно 15000; 20000; 25000; 30000; 35000; 40000; 50000; 60000; 70000; 80000; 90000; 100000 или более сконструированных активных клеток (например, сконструированных клеток RPE).
Подробные сведения, касающиеся одного или более вариантов осуществления настоящего изобретения, изложены в данном документе. Другие признаки, объекты и преимущества настоящего изобретения будут очевидны из подробного описания, описания фигур, примеров и формулы изобретения.
Краткое описание графических материалов
ФИГ. 1 представляет собой диаграмму, изображающую количество иллюстративного полипептида, высвобождаемого из инкапсулированных имплантируемых элементов, содержащих сконструированные активные клетки (например, сконструированные клетки RPE), в сравнении с неинкапсулированными активными клетками в различные моменты времени.
ФИГ. 2A-2B представляют собой микрофотографии иллюстративных инкапсулированных имплантируемых элементов, содержащих сконструированные активные клетки (например, сконструированные клетки RPE). Как показано, имплантируемые элементы, содержащие активные клетки, экспрессирующие фактор VIII-BDD, демонстрируют высокий уровень жизнеспособности на протяжении всего эксперимента.
На ФИГ. 3 показана аминокислотная последовательность белка фактора VII-BDD человека, кодируемого в иллюстративной сконструированной клетке RPE (SEQ ID NO:1), при этом сигнальная последовательность подчеркнута.
На ФИГ. 4 показана аминокислотная последовательность белка фактора IX человека дикого типа (SEQ ID NO:2).
На ФИГ. 5А-5Н показан эффект конфигурации клеток на плотность упаковки клеток, жизнеспособность клеток и качество капсул для имплантируемых элементов (например, гидрогелевых капсул), приготовленных с применением суспензий одиночных клеток. ФИГ. 5A-5F представляют собой микрофотографии иллюстративных инкапсулированных имплантируемых элементов, содержащих сконструированные активные клетки (например, сконструированные клетки RPE), приготовленных из суспензий одиночных клеток, содержащих 10, 15, 20, 30, 40 или 50 миллионов клеток/мл раствора альгината (M/мл), на которых жизнеспособность клеток показана путем окрашивания живых/мертвых клеток. На ФИГ. 5G проиллюстрирован эффект концентрации одиночных клеток на общее качество имплантируемого элемента, а на ФИГ. 5Н изображена взаимосвязь между числом клеток, содержащихся в пределах имплантируемого элемента, и его общим качеством.
На ФИГ. 6A-6G показан эффект конфигурации клеток на плотность упаковки клеток, жизнеспособность клеток и качество капсул для имплантируемых элементов (например, гидрогелевых капсул), приготовленных с применением суспензий из капсул для клеток сфероидов. ФИГ. 6A-6E представляют собой микрофотографии иллюстративных инкапсулированных имплантируемых элементов, содержащих сконструированные активные клетки (например, сконструированные клетки RPE), приготовленных из суспензий сфероидов, содержащих 30, 40, 50, 75 или 100 миллионов клеток/мл раствора альгината (M/мл), на которых жизнеспособность клеток показана путем окрашивания живых/мертвых клеток. На ФИГ. 6F проиллюстрирован эффект концентрации сфероидов на общее качество имплантируемого элемента, а на ФИГ. 6G изображена взаимосвязь между числом клеток, содержащихся в пределах имплантируемого элемента, и его общим качеством.
На ФИГ. 7A-7H показан эффект конфигурации клеток на плотность упаковки клеток, жизнеспособность клеток и качество капсул для имплантируемых элементов (например, гидрогелевых капсул), приготовленных с применением суспензий клеток, прикрепленных к микроносителям Cytodex®. ФИГ. 7А-7F представляют собой микрофотографии иллюстративных инкапсулированных имплантируемых элементов, содержащих сконструированные активные клетки (например, сконструированные клетки RPE), приготовленных из суспензий клеток на микроносителе Cytodex® с объемными соотношениями 1:8, 1:4, 1:2, 1:1,5, 1:1 и 1:0,5 (миллилитры осажденных микроносителей:миллилитры раствора альгината), на которых жизнеспособность клеток показана путем окрашивания живых/мертвых клеток. На ФИГ. 7G проиллюстрирован эффект концентрации микроносителя Cytodex® на общее качество имплантируемого элемента, а на ФИГ. 7H изображена взаимосвязь между числом клеток, содержащихся в пределах имплантируемого элемента, и его общим качеством.
На ФИГ. 8A-8H показан эффект конфигурации клеток на плотность упаковки клеток, жизнеспособность клеток и качество капсул для имплантируемых элементов (например, гидрогелевых капсул), приготовленных с применением суспензий клеток, прикрепленных к микроносителям CultiSpher®. ФИГ. 8A-8F представляют собой микрофотографии иллюстративных инкапсулированных имплантируемых элементов, содержащих сконструированные активные клетки (например, сконструированные клетки RPE), приготовленных из суспензий клеток на микроносителе CultiSpher® с объемными соотношениями 1:14, 1:10, 1:8, 1:6, 1:4 и 1:2 (мл осажденных микроносителей:мл раствора альгината), на которых жизнеспособность клеток показана путем окрашивания живых/мертвых клеток. На ФИГ. 8G проиллюстрирован эффект концентрации микроносителя CultiSpher® на общее качество имплантируемого элемента, а на ФИГ. 8H изображена взаимосвязь между количеством клеток, содержащихся в пределах имплантируемого элемента, и его общим качеством.
На ФИГ. 9 показаны уровни in vitro экспрессии полипептида фактора IX человека (F9: hFIX дикого типа; F9p: hFIX-Padua) под управлением различных экзогенных промоторов (CMV, CAP или Ubc) в сконструированных клетках RPE или клетках HS27.
ФИГ. 10 представляет собой схему вектора экспрессии на основе транспозона PiggyBac, применимого для получения сконструированных клеток RPE.
На ФИГ. 11 представлены уровни in vitro экспрессии белка фактора VIII-BDD, показанные на ФИГ. 1, в клетках RPE, сконструированными с кодон-оптимизированной кодирующей последовательностью (CO2, CO3 или CO6), относительно уровня экспрессии того же белка фактора VIII-BDD в клетках, сконструированными с BDD-версией встречающейся в природе нуклеотидной последовательности фактора VIII человека (нативной).
На ФИГ. 12 представлены уровни in vitro экспрессии различных вариантов белка фактора VIII-BDD в клетках RPE, сконструированными с кодон-оптимизированной кодирующей последовательностью FVIII-BDD или без нее, относительно уровня экспрессии белка фактора VIII-BDD, показанного на ФИГ. 1, в клетках RPE, сконструированных с BDD-версией встречающейся в природе нуклеотидной последовательности фактора VIII человека (нативной).
На ФИГ. 13 показаны уровни in vitro экспрессии белка фактора IX человека (FIX-Padua) в клетках RPE, сконструированных с кодон-оптимизированной кодирующей последовательностью FIX-Padua (CO2, CO3 или CO5), относительно экспрессии FIX-Padua в клетках RPE, сконструированных с неоптимизированной кодирующей последовательности (нативной).
На ФИГ. 14 показаны уровни in vitro экспрессии FIX-Padua человека в клетках RPE, сконструированных с транскрипционной единицей, содержащей неоптимизированную кодирующую последовательность FIX (нативную) или с одной или двумя копиями той же транскрипционной единицы, за исключением того, что она содержит кодон-оптимизированную кодирующую последовательность FIX-Padua.
Подробное описание изобретения
Настоящее изобретение относится к композициям на основе средства клеточной терапии, содержащим активные клетки, например, клетки пигментного эпителия сетчатки (RPE) (например, сконструированные клетки RPE) или производные этих клеток, а также композиции на их основе и имплантируемые элементы, содержащие их. В некоторых вариантах осуществления активные клетки, композиции и имплантируемые элементы являются применимыми для предупреждения или лечения заболевания, нарушения или состояния. Активные клетки, описанные в данном документе, проявляют полезные свойства, такие как поддержание клеточной плотности при определенных условиях (т. е. контактное торможение), фагоцитоз соседних клеток и способность жить и расти в различных условиях. В некоторых вариантах осуществления активные клетки сконструированы для продуцирования терапевтического средства (например, терапевтического полипептида), и являются инкапсулированными с помощью материала и/или присутствуют в пределах имплантируемого элемента, применимого для введения субъекту.
Определения
Предусматривается, что следующие термины имеют значения, представленные вслед за ними ниже, и полезны для понимания описания и предполагаемого объема настоящего изобретения.
Используемые в данном документе "собрать данные" или "сбор данных" относятся к получению на хранение величины, например, числовой величины, или фотографии, или физического объекта (например, образца), путем "непосредственного сбора данных" или "опосредованного сбора данных" для величины или физического объекта. "Непосредственный сбор данных" означает выполнение процесса (например, осуществление аналитического метода или протокола) для получения величины или физического объекта. "Опосредованный сбор данных" относится к получению величины или физического объекта от другой стороны или источника (например, лаборатории третьей стороны, которая провела непосредственный сбор данных для физического объекта или величины). Непосредственный сбор данных для величины или физического объекта включает выполнение процесса, который включает физическое изменение физического вещества или применение прибора или устройства. Примеры непосредственного сбора данных для величины включают получение образца от субъекта-человека. Непосредственный сбор данных для величины включает выполнение процесса, в котором применяют прибор или устройство, например, флуоресцентный микроскоп, для сбора данных флуоресцентной микроскопии.
Используемая в данном документе "активная клетка" относится к клетке, имеющей одну или более из следующих характеристик: а) она предусматривает клетку пигментного эпителия сетчатки (RPE) или клетку, полученную из нее, в том числе клетку, полученную из первичной клеточной культуры клеток RPE, клетку выделенную непосредственно (без длительного культивирования, например, менее 5 или 10 пассажей или циклов деления клеток с момента выделения) из встречающихся в природе клеток RPE, например, от человека или другого млекопитающего, клетку, полученную из трансформированной, иммортализованной или долгосрочной (например, более 5 или 10 пассажей или циклов деления клеток) культуры клеток RPE; b) клетка, которая была получена из менее дифференцированной клетки, например, клетки, разработанной, запрограммированной или перепрограммированной (например, in vitro) в клетку RPE, или клетка, которая, за исключением любого генно-инженерного вмешательства, фактически аналогична одной или более встречающимся в природе клеткам RPE, или клетка из первичной или долгосрочной культуры клеток RPE (например, такая активная клетка может быть получена из клетки IPS); или c) клетка, которая характеризуется одним или более из следующих свойств: i) она экспрессирует один или более биомаркеров CRALBP, RPE-65, RLBP, BEST1 или αB-кристаллин; ii) она не экспрессирует один или более биомаркеров CRALBP, RPE-65, RLBP, BEST1 или αB-кристаллин; iii) в норме она обнаруживается в сетчатке и образует монослой над хориоидальными кровеносными сосудами в мембране Бруха; или iv) она отвечает за эпителиальный транспорт, поглощение света, секрецию и иммунную модуляцию в сетчатке. В одном варианте осуществления активная клетка, описанная в данном документе, является сконструированной, например, активная клетка, полученная из менее дифференцированной клетки, может быть сконструированной. В других вариантах осуществления активная клетка не является сконструированной.
В некоторых вариантах осуществления активная клетка, в том числе сконструированная активная клетка, не является островковой клеткой. Островковая клетка, как определено в данном документе, представляет собой клетку, которая предусматривает любую встречающуюся в природе или любую искусственно созданную или модифицированную клетку, которая предназначена для того, чтобы повторять, имитировать, или иным образом проявлять, частично или полностью, функции, частично или полностью, клеток панкреатических островков Лангерганса. Активная клетка, в том числе сконструированная активная клетка, не способна продуцировать инсулин (например, А-цепь инсулина, В-цепь инсулина или проинсулин), например, в количестве, эффективном для лечения диабета или другого заболевания или состояния, которые можно лечить с помощью инсулина. В некоторых вариантах осуществления активная клетка не способна продуцировать инсулин реагирующим на уровень глюкозы образом. Активная клетка, в том числе сконструированная активная клетка, не является индуцированной плюрипотентной клеткой, которая была сконструирована для превращения в дифференцированную инсулин-продуцирующую бета-клетку поджелудочной железы.
Используемые в данном документе "вводить", "осуществление введения" или "введение" относятся к имплантации, всасыванию, проглатыванию, инъекции или иному введению объекта (например, активной клетки, например, сконструированной клетки RPE или композиции на ее основе, или имплантируемого элемента, содержащего активную клетку) или обеспечению им субъекта.
Используемая в данном документе "клетка" относится к сконструированной клетке, например, сконструированной активной клетке, или клетке, которая не является сконструированной, например, несконструированной активной клетке.
Используемые в данном документе "консервативно модифицированные варианты" или "консервативная замена", относятся к варианту эталонного пептида или полипептида, который идентичен эталонной молекуле, за исключением наличия одной или более консервативных аминокислотных замен в его аминокислотной последовательности. В одном варианте осуществления консервативно модифицированный вариант состоит из аминокислотной последовательности, которая на по меньшей мере 70%, 80%, 85%, 90%, 95%, 97%, 98% или 99% идентична эталонной аминокислотной последовательности. Консервативная аминокислотная замена относится к замене аминокислоты аминокислотой, имеющей аналогичные характеристики (например, заряд, размер боковой цепи, гидрофобность/гидрофильность, конформацию и жесткость основной цепи и т. д.) и которая оказывает минимальное влияние на биологическую активность полученного пептида или полипептида, содержащего замену. Таблицы консервативных замен функционально аналогичных аминокислот хорошо известны в данной области техники, и иллюстративные замены, сгруппированные по функциональным признакам, изложены в таблице аминокислот 1 ниже.
Таблица аминокислот 1. Иллюстративные группы консервативных аминокислотных замен.
"Фактически состоит из" и варианты, такие как "фактически состоят из" или "фактически состоящие из", используемые на протяжении всего описания и формулы настоящего изобретения, указывают на включение любых перечисленных элементов или групп элементов и необязательное включение других элементов по природе аналогичных или отличной от перечисленных элементов, которые существенным образом не изменяют основные или новые свойства указанной молекулы, композиции, устройства или способа. В качестве неограничивающего примера, терапевтический белок, который фактически состоит из перечисленной аминокислотной последовательности, может также включать одну или более аминокислот, в том числе добавления на N-конце, С-конце или в пределах перечисленной аминокислотной последовательности одного или более аминокислотных остатков, которые не оказывают существенного влияния на соответствующую биологическую активность терапевтического белка соответственно. В качестве другого неограничивающего примера, промотор, который фактически состоит из перечисленной нуклеотидной последовательности, может содержать один или более дополнительных нуклеотидов, которые существенным образом не изменяют соответствующую биологическую активность промотора, например, количество транскрипции функционально связанной кодирующей последовательности, например, согласно определению посредством количественной оценки соответствующих уровней РНК или белка.
Используемое в данном документе "эффективное количество" относится к количеству композиции на основе активных клеток, например, сконструированных клеток RPE, или средства, например, терапевтического средства, продуцируемого активной клеткой, например, сконструированной клеткой RPE, достаточному для того, чтобы вызвать биологически ответ, например, для лечения заболевания, нарушения или состояния. Как будет понятно специалистам в данной области техники, эффективное количество может варьироваться в зависимости от таких факторов, как требуемая биологическая конечная точка, фармакокинетика терапевтического средства, композиции или имплантируемого элемента, состояние, подлежащее лечению, путь введения, а также возраст и здоровье субъекта. Эффективное количество охватывает терапевтическое и профилактическое лечение. Например, в случае лечения фиброзного состояния эффективное количество соединения может уменьшать фиброз или останавливать рост или распространение фиброзной ткани.
Используемая в данном документе "эндогенная нуклеиновая кислота" представляет собой нуклеиновую кислоту, которая в норме встречается в клетке субъекта.
Используемый в данном документе "эндогенный полипептид" представляет собой полипептид, который в норме встречается в клетке субъекта.
Используемая в данном документе "сконструированная клетка" представляет собой клетку, например, активную клетку с не встречающимся в природе изменением, и она, как правило, содержит последовательность нуклеиновой кислоты (например, ДНК или РНК) или полипептид, не присутствующие (или присутствующие на другом уровне) в остальном аналогичной клетке, которая не является сконструированной (не содержит экзогенную последовательность нуклеиновой кислоты), в аналогичных условиях. В одном варианте осуществления сконструированная клетка содержит экзогенную нуклеиновую кислоту (например, вектор или измененную хромосомную последовательность). В одном варианте осуществления сконструированная клетка содержит экзогенный полипептид. В одном варианте осуществления сконструированная клетка содержит экзогенную последовательность нуклеиновой кислоты, например, последовательность, например, ДНК или РНК, не присутствующую в аналогичной клетке, которая не является сконструированной. В одном варианте осуществления экзогенная последовательность нуклеиновой кислоты представляет собой хромосому, например, экзогенная последовательность нуклеиновой кислоты представляет собой экзогенную последовательность, размещенную в эндогенной хромосомной последовательности. В одном варианте осуществления экзогенная последовательность нуклеиновой кислоты является хромосомной или внехромосомной, например, представляет собой неинтегрированный вектор. В одном варианте осуществления экзогенная последовательность нуклеиновой кислоты предусматривает последовательность РНК, например, mRNA. В одном варианте осуществления экзогенная последовательность нуклеиновой кислоты предусматривает хромосомную или внехромосомную экзогенную последовательность нуклеиновой кислоты, которая содержит последовательность, которая экспрессируется в виде РНК, например, mRNA или регуляторной РНК. В одном варианте осуществления экзогенная последовательность нуклеиновой кислоты предусматривает хромосомную или внехромосомную последовательность нуклеиновой кислоты, которая содержит последовательность, которая кодирует полипептид или которая экспрессируется в виде полипептида. В одном варианте осуществления экзогенная последовательность нуклеиновой кислоты содержит первую хромосомную или внехромосомную экзогенную последовательность нуклеиновой кислоты, которая модулирует конформацию или экспрессию второй последовательности нуклеиновой кислоты, где вторая аминокислотная последовательность может быть экзогенной или эндогенной. Например, сконструированная клетка может содержать экзогенную нуклеиновую кислоту, которая контролирует экспрессию эндогенной последовательности. В одном варианте осуществления сконструированная клетка содержит полипептид, присутствующий на уровне или при распределении, которые отличаются от уровня, обнаруженного в аналогичной клетке, которая не была подвергнута конструированию. В одном варианте осуществления сконструированная клетка предусматривает клетку RPE, сконструированную для обеспечения РНК или полипептида. Например, сконструированная клетка (например, клетка RPE) может содержать экзогенную последовательность нуклеиновой кислоты, предусматривающую хромосомную или внехромосомную экзогенную последовательность нуклеиновой кислоты, содержащую последовательность, которая экспрессируется в виде РНК, например, mRNA или регуляторной РНК. В одном варианте осуществления сконструированная клетка (например, клетка RPE) содержит экзогенную последовательность нуклеиновой кислоты, которая предусматривает хромосомную или внехромосомную последовательность нуклеиновой кислоты, которая содержит последовательность, которая кодирует полипептид или которая экспрессируется в виде полипептида. В одном варианте осуществления полипептид закодирован в кодон-оптимизированной последовательности для достижения более высокой экспрессии полипептида, по сравнению с таковой в случае встречающейся в природе кодирующей последовательности. Кодон-оптимизированную последовательность можно получать с применением коммерчески доступного алгоритма, например, GeneOptimzer (ThermoFisher Scientific), OptimumGeneTM (GenScript, Пискатауэй, Нью-Джерси, США), GeneGPS® (ATUM, Ньюарк, Калифорния, США) или инструмента адаптации кодонов Java (JCat, www.jcat.de, Grote, A. et al., Nucleic Acids Research, Vol 33, Issue suppl_2, pp. W526-W531 (2005). В одном варианте осуществления сконструированная клетка (например, клетка RPE) содержит экзогенную последовательность нуклеиновой кислоты, которая модулирует конформацию или экспрессию эндогенной последовательности.
Используемая в данном документе "экзогенная нуклеиновая кислота" представляет собой нуклеиновую кислоту, которая в норме не встречается в клетке субъекта.
Используемый в данном документе "экзогенный полипептид" представляет собой полипептид, который в норме не встречается в клетке субъекта.
Используемые в данном документе "белок фактора VII" или "белок FVII" означают полипептид, который содержит аминокислотную последовательность встречающегося в природе белка фактора VII или его варианта, который обладает биологической активностью FVII, например, содействует свертыванию крови, согласно определению посредством анализа, общепризнанного в данной области техники, если не указано иное. Встречающийся в природе FVII существует в виде одноцепочечного зимогена, зимогеноподобного двухцепочечного полипептида и полностью активированной двухцепочечной формы (FVIIa). В некоторых вариантах осуществления ссылка на FVII включает его одноцепочечные и двухцепочечные формы, в том числе зимогеноподобную и FVIIa. Белки FVII, которые могут экспрессироваться в активных клетках, описанных в данном документе, например, сконструированных клетках RPE, включают белки приматов (например, человека), свиньи, собаки и мыши дикого типа, а также варианты таких белков дикого типа, в том числе фрагменты, мутанты, варианты с одной или более аминокислотными заменами и/или делециями. В некоторых вариантах осуществления вариантный белок FVII может быть активирован в полностью активированную двухцепочечную форму (фактор VIIa), которая обладает по меньшей мере 50%, 75%, 90% или более (в том числе >100%) активностью фактора VIIa дикого типа. Известны варианты FVII и FVIIa, например, марзептаког-альфа (активированный) (MarzAA) и варианты, описанные в европейском патенте № 1373493, патенте США № 7771996, патенте США № 9476037 и опубликованной заявке на патент США № US20080058255.
Биологическую активность фактора VII можно оценивать количественно посредством анализа, общепризнанного в данной области техники, если не указано иное. Например, биологическую активность FVII в образце биологической жидкости, например, плазмы крови, можно оценивать количественно за счет: (i) измерения количества фактора Xa, продуцируемого в системе, содержащей TF, встроенный в липидную мембрану, и фактор X. (Persson et al. J. Biol. Chem. 272: 19919-19924, 1997); (ii) измерения гидролиза фактора Х в водной системе; (iii) измерения его физического связывания с TF с применением прибора, основанного на поверхностном плазмонном резонансе (Persson, FEBS Letts. 413:359-363, 1997); или (iv) измерения гидролиза синтетического субстрата; и/или (v) измерения образования тромбина в TF-независимой системе in vitro. В одном варианте осуществления активность FVII оценивают с помощью коммерчески доступного хромогенного анализа (BIOPHEN FVII, HYPHEN BioMed, Невиль-сюр-Уаз, Франция), в котором биологический образец, содержащий FVII, смешивают с тромбопластином кальция, фактором X и SXa-11 (хромогенным субстратом, специфичным для фактора Ха).
Используемые в данном документе "белок фактора VIII" или "белок FVIII" означают полипептид, который содержит аминокислотную последовательность встречающегося в природе полипептида фактора VIII или его варианта, который обладает биологической активностью FVIII, например, коагуляционной активностью, согласно определению посредством анализа, общепризнанного в данной области техники, если не указано иное. Белки FVIII, которые могут экспрессироваться в активных клетках, описанных в данном документе, например, сконструированных клетках RPE, включают белки приматов (например, человека), свиньи, собаки и мыши дикого типа, а также варианты таких белков дикого типа, в том числе фрагменты, мутанты, варианты с одной или более аминокислотными заменами и/или делециями, варианты с делецией B-домена (BDD), одноцепочечные варианты и слияния любого из вышеупомянутых белков дикого типа или вариантов с полипептидом, увеличивающим время полужизни. В одном варианте осуществления активные клетки сконструированы так, чтобы кодировать полипептид предшественника фактора VIII (например, содержащий сигнальную последовательность) с полной или частичной делецией B-домена. В одном варианте осуществления активные клетки сконструированы так, чтобы кодировать полипептид одноцепочечного фактора VIII, который содержит вариантный белок FVIII, который предпочтительно характеризуется по меньшей мере 50%, 75%, 90% или более (в том числе >100%) коагуляционной активностью соответствующего фактора VIII дикого типа. Анализы для измерения коагуляционной активности белков FVIII включают одностадийный или двухстадийный анализ коагуляции (Rizza et al., 1982, Coagulation assay of FVIII:C and FIXa в Bloom ed. The Hemophelias. NY Churchill Livingston 1992) или анализ FVIII:C с применением хромогенного субстрата (Rosen, S. 1984. Scand J Haematol 33:139-145, suppl.)
Известен целый ряд вариантов FVIII-BDD, и они включают, например, варианты с полными или частичными делециями B-домена, раскрытые в любом из следующих патентов США: 4868112 (например, от столбца 2 строки 2 до столбца 19 строки 21 и таблица 2); 5112950 (например, столбец 2, строки 55-68, ФИГ. 2 и пример 1); 5171844 (например, от столбца 4 строки 1 22 до столбца 5 строки 36); 5543502 (например, столбец 2, строки 17-46); 5595886; 5610278; 5789203 (например, столбец 2, строки 26-51 и примеры 5-8); 5972885 (например, от столбца 1 строки 25 до столбца 2 строки 40); 6048720 (например, столбец 6, строки 1-22 и пример 1); 6060447; 6228620; 6316226 (например, от столбца 4 строки 4 до столбца 5 строки 28 и примеры 1-5); 6346513; 6458563 (например, столбец 4, строки 25-53) и 7041635 (например, от столбца 2 строки 1 до столбца 3 строки 19, от столбца 3 строки 40 до столбца 4 строки 67, от столбца 7 строки 43 до столбца 8 строки 26 и от столбца 11 строки 5 до столбца 13 строки 39).
В некоторых вариантах осуществления белок FVIII-BDD, экспрессируемый в сконструированных клетках RPE, например, клетках ARPE-19, имеет одну или более из следующих делеций аминокислот в B-домене: (i) большая часть B-домена, за исключением аминоконцевых последовательностей B-домена, необходимых для внутриклеточного процессинга первичного продукта трансляции в две полипептидные цепи (WO 91/09122); (ii) делеция аминокислот 747-1638 (Hoeben R. C., et al. J. Biol. Chem. 265 (13): 7318-7323 (1990)); аминокислот 771-1666 или аминокислот 868-1562 (Meulien P., et al. Protein Eng. 2(4):301-6 (1988); аминокислот 982-1562 или 760-1639 (Toole et al., Proc. Natl. Acad. Sci. U.S.A. 83:5939-5942 (1986)); аминокислот 797-1562 (Eaton et al., Biochemistry 25:8343-8347 (1986)); 741-1646 (Kaufman, WO 87/04187)), 747-1560 (Sarver et al., DNA 6:553-564 (1987)); аминокислот 741-1648 (Pasek, WO 88/00831)), аминокислот 816-1598 или 741-1689 (Lagner (Behring Inst. Mitt. (1988) No 82:16-25, EP 295597); делеция, которая содержит один или более остатков из последовательности распознавания фуринпротеазы, например, LKRHQR, при аминокислотах 1643-1648, в том числе любая из специфических делеций, перечисленных в патенте США № 9956269 от столбца 10 строки 65 до столбца 11 строки 36.
В других вариантах осуществления белок FVIII-BDD сохраняет любую из следующих аминокислот или аминокислотных последовательностей B-домена: (i) один или более сайтов N-связанного гликозилирования в B-домене, например, остатки 757, 784, 828, 900, 963 или необязательно 943, первые 226 аминокислот или первые 163 аминокислоты (Miao, H. Z., et al., Blood 103(a): 3412-3419 (2004), Kasuda, A., et al., J. Thromb. Haemost. 6: 1352-1359 (2008), и Pipe, S. W., et al., J. Thromb. Haemost. 9: 2235-2242 (2011).
В некоторых вариантах осуществления белок FVIII-BDD представляет собой одноцепочечный вариант, полученный путем замены одной или более аминокислот в последовательности распознавания фуринпротеазы (LKRHQR при аминокислотах 1643-1648), что предотвращает протеолитическое расщепление в данном сайте, включая любую из замен в положениях R1645 и/или R1648, описанных в патентах США №№ 10023628, 9394353 и 9670267.
В некоторых вариантах осуществления любой из вышеуказанных белков FVIII-BDD может дополнительно предусматривать один или более из следующих вариантов: замену F309S для улучшения экспрессии белка FVIII-BDD (Miao, H. Z., et al., Blood 103(a): 3412-3419 (2004); слияния с альбумином (WO 2011/020866) и слияния с Fc-областью (WO 04/101740).
Все аминокислотные положения FVIII-BDD, упомянутые в данном документе, относятся к положениям в полноразмерном FVIII человека, если не указано иное.
Используемые в данном документе "белок фактора IX" или "белок FIX" означают полипептид, который содержит аминокислотную последовательность встречающегося в природе белка фактора IX или его варианта, который обладает биологической активностью FIX, например, коагуляционной активностью, согласно определению посредством анализа, общепризнанного в данной области техники, если не указано иное. FIX продуцируется в виде неактивного зимогена, который превращается в активную форму за счет разрезания под действием фактора XIa пептида активации с образованием тяжелой цепи и легкой цепи, удерживаемых вместе одной или более дисульфидными связями. Белки FIX, которые могут экспрессироваться в активных клетках, описанных в данном документе, например, сконструированных клетках RPE, включают белки приматов (например, человека), свиньи, собаки и мыши дикого типа, а также варианты таких белков дикого типа, в том числе фрагменты, мутанты, варианты с одной или более аминокислотными заменами и/или делециями, и слияния любого из вышеупомянутых белков дикого типа или вариантов белков с полипептидом, увеличивающим время полужизни. В одном варианте осуществления активные клетки сконструированы для кодирования полноразмерного полипептида фактора IX человека дикого типа (например, с сигнальной последовательностью) или его функционального варианта. Вариантный белок FIX предпочтительно характеризуется по меньшей мере 50%, 75%, 90% или более (в том числе >100%) коагуляционной активностью фактора FIX дикого типа. Анализы для измерения коагуляционной активности белков FIX включают анализ фактора IX Biophen (Hyphen BioMed) и одностадийный анализ свертывания (активированное частичное тромбопластиновое время (aPTT), например, как описано в ЕР 2032607 В2, анализ времени образования тромбина (TGA) и ротационную тромбоэластометрию, например, как описано в WO 2012/006624.
Известен целый ряд функциональных вариантов FIX, и они могут экспрессироваться в активных клетках по настоящему изобретению, в том числе любой из функциональных вариантов FIX, описанных в следующих международных патентных публикациях: WO 02/040544 A3 на странице 4 строках 9-30 и на странице 15 строках 6-31; WO 03/020764 A2 в таблицах 2 и 3 на страницах 14-24 и на странице 12 строках 1-27; WO 2007/149406 A2 от страницы 4 строки 1 до страницы 19 строки 11; WO 2007/149406 A2 от страницы 19 строки 12 до страницы 20 строки 9; WO 08/118507 A2 от страницы 5 строки 14 до страницы 6 строки 5; WO 09/051717 А2 от страницы 9 строки 11 до страницы 20 строки 2; WO 09/137254 А2 от страницы 2 абзаца [006] до страницы 5 абзаца [011] и от страницы 16 абзаца [044] до страницы 24 абзаца [057]; WO 09/130198 А2 от страницы 4 строки 26 до страницы 12 строки 6; WO 09/140015 А2 от страницы 11 абзаца [0043] до страницы 13 абзаца [0053]; WO 2012/006624; WO 2015/086406.
В определенных вариантах осуществления полипептид FIX содержит последовательность дикого типа или вариантную последовательность, слитую с гетерологичным полипептидным или отличным от полипептидного фрагментом, увеличивающим время полужизни белка FIX. Иллюстративные фрагменты, увеличивающие время полужизни, включают Fc-область, альбумин, последовательность PAS, трансферрин, CTP (С-концевой пептид (CTP) из 28 аминокислот хорионического гонадотропина человека (hCG) с его 4 O-гликанами), полиэтиленгликоль (PEG), гидроксиэтилкрахмал (HES), альбумин-связывающий полипептид, альбумин-связывающие малые молекулы или любую их комбинацию. Иллюстративным полипептидом FIX является белок rFIXFc, описанный в WO 2012/006624, который представляет собой одноцепочечный FIXFc (FIXF c-sc) и одноцепочечную Fc-область (Fc-sc), связанные вместе посредством двух дисульфидных связей в шарнирном участке Fc-области.
Варианты FIX также включают варианты приобретения и потери функции. Примером варианта с приобретением функции является вариант "Padua" FIX человека, который содержит L (лейцин) в положении 338 зрелого белка вместо R (аргинина) (что соответствует аминокислотному положению 384 в SEQ ID NO:2) и характеризуется большей каталитической и коагуляционной активностью по сравнению с FIX человека дикого типа (Chang et al., J. Biol. Chem., 273:12089-94 (1998)). Примером варианта с потерей функции является замена лизина на аланин в положении пятой аминокислоты от начала зрелого белка, что дает белок со сниженным связыванием с коллагеном IV (например, потере функции).
Используемый в данном документе "форм-фактор" относится к одному или более из: числа активных клеток, присутствующих в совокупности активных клеток, формы совокупности активных клеток, уровня контакта между активными клетками в совокупности или уровню клеточных контактов, образованных между активными клетками в совокупности. В одном варианте осуществления совокупность активных клеток обеспечивается в виде кластера, или другого скопления, или другой совокупности, характеризующихся предварительно заданными величинами (или величинами, описанными в данном документе) для одного или более или всех параметров, относящихся к размеру, форме, общему контакту между собой или числу клеточных контактов между собой. Например, в одном варианте осуществления активные клетки в совокупности характеризуются средним минимальным числом клеточных контактов на активную клетку, например, согласно оценке посредством фиксации или микроскопии. В одном варианте осуществления активные клетки могут проявлять форм-фактор в одном или более или во всех следующих случаях: до, во время или после введения или обеспечения субъекту. В одном варианте осуществления активные клетки могут проявлять форм-фактор в одном или более или во всех следующих случаях: до, во время или после введения или обеспечения субъекту. Иллюстративные форм-факторы включают монослои активных клеток, кластеры активных клеток или размещение на микроносителе (например, грануле или матрице).
Используемые в данном документе "белок интерлейкина 2" или "белок IL-2" означают полипептид, содержащий аминокислотную последовательность встречающегося в природе белка IL-2 или его варианта, который обладает биологической активностью IL-2, например, активирует передачу сигналов от рецептора IL-2 в клетках Treg, согласно определению посредством анализа, общепризнанного в данной области техники, если не указано иное. Белки IL-2, которые могут экспрессироваться в активных клетках, описанных в данном документе, например, сконструированных клетках RPE, включают белки приматов (например, человека), свиньи, собаки и мыши дикого типа, а также варианты таких белков дикого типа. Вариантный белок IL-2 предпочтительно характеризуется по меньшей мере 50%, 75%, 90% или более (в том числе >100%) биологической активностью соответствующего IL-2 дикого типа. Анализы биологической активности белков IL-2 описаны в патенте США № 10035836 и включают, например, измерение уровней фосфорилированного белка STAT5 в клетках Treg по сравнению с CD4+CD25-/низкий уровень T-клетками или NK-клетками. Вариантные белки IL-2, которые могут продуцироваться активными клетками по настоящему изобретению (например, сконструированными клетками RPE), включают белки с одной или более из следующих аминокислотных замен: N88R, N88I, N88G, D20H, Q126L, Q126F, а также C125S или C125A.
Используемый в данном документе "имплантируемый элемент" содержит активную клетку, например, совокупность активных клеток, например, кластер активных клеток, где активная клетка или активные клетки полностью или частично размещены в пределах заключающего компонента (при этом заключающий компонент является отличным от активной клетки), например, заключающий компонент предусматривает неклеточный компонент. В одном варианте осуществления заключающий компонент подавляет иммунную атаку или эффект иммунной атаки на заключенную активную клетку или активные клетки. В одном варианте осуществления заключающий компонент предусматривает полупроницаемую мембрану или полупроницаемую полимерную матрицу или покрытие. Как правило, заключающий компонент обеспечивает возможность прохождения малых молекул, например, питательных веществ и продуктов жизнедеятельности. Как правило, заключающий компонент обеспечивает возможность прохождения терапевтического продукта (например, терапевтического полипептида), высвобождаемого активной клеткой, размещенной в пределах заключающего компонента. В одном варианте осуществления размещение в пределах заключающего компонента минимизирует эффект иммунного ответа, например, фиброзного ответа, у субъекта, нацеленного на имплантируемый элемент, например, против активной клетки в пределах имплантируемого элемента, например, по сравнению с аналогичной активной клеткой, которая не размещена в имплантируемом элементе. В одном варианте осуществления заключающий компонент предусматривает фрагмент, например, фрагмент, описанный в данном документе (например, соединение из таблицы соединений 1), который минимизирует эффект иммунного ответа, например, фиброзного ответа, у субъекта, нацеленного на имплантируемый элемент, например, против заключающего компонента или активной клетки в пределах имплантируемого элемента, например, по сравнению с аналогичным имплантируемым элементом, в котором отсутствует фрагмент. В некоторых вариантах осуществления заключающий компонент предусматривает полимерный гидрогель. В некоторых вариантах осуществления полимерный гидрогель содержит альгинат, химически модифицированный с помощью соединения из таблицы соединений 1 (например, соединения 101); в одном варианте осуществления альгинат имеет молекулярную массу <75 кДа. В одном варианте осуществления заключающий компонент представляет собой гидрогелевую капсулу, которая содержит смесь химически модифицированного альгината и немодифицированного альгината; в одном варианте осуществления немодифицированный альгинат имеет молекулярную массу 150 кДа - 250 кДа. В одном варианте осуществления в каждом из химически модифицированного и немодифицированного альгината отношение G:M альгината составляет >1.
В одном варианте осуществления имплантируемый элемент содержит заключающий компонент, который формуется или может быть сформован in situ на активной клетке, например, совокупности активных клеток, например, кластере активных клеток, или клетках на микроносителе, например, грануле или матрице, содержащих активную клетку или активные клетки, или вокруг них (обозначается в данном документе как "инкапсулированный in-situ имплантируемый элемент").
В одном варианте осуществления имплантируемый элемент содержит заключающий компонент, который содержит гибкий полимер, например, альгинат (например, химически модифицированный альгинат), PLA, PLG, PEG, CMC или их смеси (обозначается в данном документе как "инкапсулированное в полимерную оболочку имплантируемое устройство").
Инкапсулированные in-situ имплантируемые устройства и инкапсулированные в полимерную оболочку имплантируемые устройства (эти категории не являются взаимоисключающими) в совокупности обозначаются в данном документе как инкапсулированные имплантируемые элементы.
Иллюстративный инкапсулированный имплантируемый элемент содержит активную клетку, например, совокупность активных клеток, например, кластер активных клеток, или микроноситель, например, гранулу или матрицу, содержащие активную клетку или активные клетки, и заключающий элемент, содержащий покрытие из дериватизированного альгината. В некоторых вариантах осуществления наибольший линейный размерный параметр инкапсулированного имплантируемого элемента составляет не более приблизительно 1,5 мм, 2 мм, 3 мм, 4 мм, 5 мм, 6 мм, 7 мм или 8 мм.
В одном варианте осуществления имплантируемый элемент содержит заключающий компонент, который предварительно сформован перед объединением с заключаемой активной клеткой, например, совокупностью активных клеток, например, кластером активных клеток, или микроносителем, например, гранулой или матрицей, содержащими активную клетку (обозначается в данном документе как имплантируемый элемент на основе устройства или DB-имплантируемый элемент). В одном варианте осуществления имплантируемый элемент на основе устройства содержит заключающий компонент, который содержит полимер или металл. Иллюстративный имплантируемый элемент на основе устройства содержит активную клетку, например, совокупность активных клеток, например, кластер активных клеток, или микроноситель, например, гранулу, содержащую активную клетку или клетки, размещенную в пределах заключающего компонента, предусматривающего предварительно сформованный корпус, например, негибкий полимерный или металлический корпус или гибкий корпус, например, полупроницаемую мембрану. В вариантах осуществления наибольший линейный размерный параметр имплантируемого элемента на основе устройства составляет по меньшей мере 1,5 мм, 2 мм, 3 мм, 4 мм, 5 мм, 6 мм, 7 мм или 8 мм.
Используемые в данном документе "белок паратиреоидного гормона" или "белок PTH" означают полипептид, который содержит аминокислотную последовательность полипептида встречающегося в природе паратиреоидного гормона или его варианта, который обладает биологической активностью PTH, например, согласно определению посредством анализа, общепризнанного в данной области техники. Полипептиды PTH, которые могут экспрессироваться в активных клетках, описанных в данном документе (например, сконструированных клетках RPE), включают полипептиды приматов (например, человека), свиньи, собаки и мыши дикого типа, а также варианты таких полипептидов дикого типа. Такие полипептиды PTH могут фактически состоять из последовательности человека дикого типа в случае полипептида пре-про-PTH (115 аминокислот), полипептида про-PTH (90 аминокислот), зрелого пептида из 84 аминокислот (PTH (1-84)) и их биологически активных вариантов, таких как укороченный вариантный пептид PTH (1-34). Варианты пептидов PTH с одной или более аминокислотными заменами в последовательности человека дикого типа были описаны, например, в патентах США №№ 7410948 и 8563513 и в опубликованной заявке на патент США US20130217630. Вариант PTH предпочтительно характеризуется по меньшей мере 50%, 75%, 90% или более (в том числе >100%) биологической активностью соответствующего PTH дикого типа. Анализ для обнаружения определенных вариантов PTH посредством тандемной масс-спектрометрии описан в патенте США № 8383417. Анализ биологической активности вариантов пептида PTH - стимуляция аденилатциклазы, согласно определению посредством измерения уровней cAMP - описан в патенте США № 7410948.
Используемый в данном документе "полипептид" относится к полимеру, содержащему аминокислотные остатки, связанные посредством пептидных связей, и имеющему по меньшей мере два, а в некоторых вариантах осуществления по меньшей мере 10, 50, 75, 100, 150, 200 или более аминокислотных остатков. Подразумевается, что термин "полипептид" включает любую цепь или цепи из двух или более аминокислот и включает без ограничения пептиды, дипептиды, трипептиды, олигопептиды и белки, и термин "полипептид" можно использовать вместо или взаимозаменяемо с любым из этих терминов. Также подразумевается, что термин "полипептид" обозначает продукты посттрансляционных модификаций полипептида, кодируемого экзогенной нуклеотидной последовательностью в пределах сконструированной клетки, включающих без ограничения: протеолитическое расщепление (например, процессинг полипептида-предшественника в зрелую форму); образование дисульфидных связей; гликозилирование; липидирование; ацетилирование; фосфорилирование и амидирование.
Используемые в данном документе "предупреждение", "предупреждать" и "осуществление предупреждения" относятся к лечению, которое предусматривает введение или применение средства терапии, например, введение активной клетки, например, сконструированной клетки RPE (например, описанной в данном документе), перед манифестацией заболевания, нарушения или состояния, чтоб предотвратить физическое проявление указанного заболевания, нарушения или состояния. В некоторых вариантах осуществления в случае "предупреждения", "предупреждать" и "осуществления предупреждения" требуется, чтобы признаки или симптомы заболевания, нарушения или состояния еще не развились или еще не наблюдались. В некоторых вариантах осуществления лечение предусматривает предупреждение, а в других вариантах не предусматривает.
"Средство заместительной терапии" или "заместительный белок" представляют собой терапевтический белок или его функциональный фрагмент, который заменяет или усиливает белок, который снижен, присутствует в недостаточном количестве, изменен (например, мутирован) или отсутствует у субъекта, у которого имеется заболевание или состояние, связанные со сниженным, измененным или отсутствующим белком. Примеры представляют собой определенные факторы свертывания крови в случае определенных нарушений свертывания крови или определенные лизосомальные ферменты в случае определенных лизосомных болезней накопления. В одном варианте осуществления средство заместительной терапии или заместительный белок обеспечивает функцию эндогенного белка. В одном варианте осуществления аминокислотная последовательность средства заместительной терапии или заместительного белка является такой же, как у встречающегося в природе варианта, например, аллель дикого типа или аллель, не ассоциированный с нарушением, замещаемого белка. В одном варианте осуществления аминокислотная последовательность средства заместительной терапии или заместительного белка отличается от встречающегося в природе варианта, например, аллеля дикого типа или аллеля, не ассоциированного с нарушением, например, аллеля, содержащегося у субъекта, не более чем на приблизительно 1, 2, 3, 4, 5, 10, 15 или 20% аминокислотных остатков.
"Идентичность последовательности" или "процентная идентичность", когда используются в данном документе при упоминании двух нуклеотидных последовательностей или двух аминокислотных последовательностей, означают, что две последовательности являются одинаковыми в пределах указанного участка или имеют одинаковые нуклеотиды или аминокислоты в указанном проценте нуклеотидных или аминокислотных положений в пределах указанного участка, когда две последовательности сравнивают и выравнивают для максимального соответствия по ширине окна сравнения или обозначенного участка. Идентичность последовательности может быть определена с применением стандартных методик, известных в данной области техники, в том числе без ограничения любого из алгоритмов, описанных в US 2017/02334455 A1. В одном варианте осуществления указанный процент идентичных нуклеотидных или аминокислотных положений составляет по меньшей мере приблизительно 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более.
Используемый в данном документе "субъект" относится к человеку или животному, отличному от человека. В одном варианте осуществления субъект представляет собой человека (т. е. мужчину или женщину, например, любой возрастной группы, субъекта детского возраста (например, младенца, ребенка, подростка) или взрослого субъекта (например, взрослого молодого возраста, взрослого среднего возраста или взрослого пожилого возраста)). В одном варианте осуществления субъект представляет собой животное, отличное от человека, например, млекопитающее (например, примата (например, яванского макака или макака-резус). В одном варианте осуществления субъект представляет собой коммерчески значимое млекопитающее, такое как крупный рогатый скот, свинья, лошадь, овца, коза, кошка или собака, или птица (например, коммерчески значимая птица, такая как курица, утка, гусь или индейка). В определенных вариантах осуществления животное является млекопитающим. Животное может быть самцом или самкой и находиться на любой стадии развития. Животное, отличное от человека, может представлять собой трансгенное животное. В одном варианте осуществления субъект представляет собой человека.
"Транскрипционная единица" означает последовательность ДНК, например, присутствующую в экзогенной нуклеиновой кислоте, которая содержит по меньшей мере промоторную последовательность, функционально связанную с кодирующей последовательностью, и также может содержать один или более дополнительных элементов, которые контролируют или усиливают транскрипцию кодирующей последовательности в молекулы РНК или трансляцию молекул РНК в полипептидные молекулы. В некоторых вариантах осуществления транскрипционная единица также содержит сигнальную последовательность полиаденилирования (полиА) и сайт полиА. В одном варианте осуществления транскрипционная единица присутствует в экзогенном, внехромосомном векторе экспрессии, например, как представлено на ФИГ. 5, или присутствует в виде экзогенной последовательности, интегрированной в хромосому сконструированной активной клетки, описанной в данном документе.
Используемые в данном документе "лечение", "лечить" и "осуществление лечения" относятся к одному или более из уменьшения, обращения, облегчения, отсрочки манифестации или подавления прогрессирования одного или более симптомов, проявлений или первопричины заболевания, нарушения или состояния. В одном варианте осуществления лечение предусматривает уменьшение, обращение, облегчение, отсрочку манифестации или подавление прогрессирования симптома заболевания, нарушения или состояния. В одном варианте осуществления лечение предусматривает уменьшение, обращение, облегчение, отсрочку манифестации или подавление прогрессирования проявления заболевания, нарушения или состояния. В одном варианте осуществления лечение предусматривает уменьшение, обращение, облегчение, уменьшение или отсрочку манифестации первопричины заболевания, нарушения или состояния. В некоторых вариантах осуществления в случае "лечения", "лечить" и "осуществления лечения" требуется, чтобы признаки или симптомы заболевания, нарушения или состояния развились или наблюдались. В других вариантах осуществления лечение можно вводить при отсутствии признаков или симптомов заболевания или состояния, например, при профилактическом лечении. Например, лечение можно вводить восприимчивому индивидууму до манифестации симптомов (например, с учетом симптомов в анамнезе и/или с учетом генетических или других факторов восприимчивости). Лечение также может быть продолжено после устранения симптомов, например, для отсрочки или предупреждения рецидива. В некоторых вариантах осуществления лечение предусматривает предупреждение, а в других вариантах не предусматривает.
Используемые в данном документе "белок фактора фон Виллебранда" или "белок vWF" означает полипептид, который содержит аминокислотную последовательность встречающегося в природе полипептида vWF или его варианта, который обладает биологической активностью vWF, например, связывающей активностью FVIII, согласно определению посредством анализа, общепризнанного в данной области техники, если не указано иное. Белки vWF, которые могут экспрессироваться в сконструированных активных клетках, описанных в данном документе, включают белки приматов (например, человека), свиньи, собаки и мыши дикого типа, а также варианты таких белков дикого типа. Активные клетки (например, клетки ARPE-19) можно конструировать так, чтобы они кодировали любой из следующих полипептидов vWF: предшественник vWF из 2813 аминокислот, vWF без сигнального пептида из 22 аминокислот и необязательно препропептид из 741 аминокислоты, зрелый белок vWF из 2050 аминокислот и его усеченные варианты, такие как фрагмент vWF, достаточный для стабилизации уровней эндогенного FVIII у мышей с дефицитом vWF, например, усеченный вариант, содержащий D´D3-участок (аминокислоты 764-1247) или D1D2D´D3-участок; и варианты vWF с одной или более аминокислотными заменами, например, в D´-участке, описываемые в патенте США № 9458223. Вариантный белок vWF предпочтительно характеризуется по меньшей мере 50%, 75%, 90% или более (в том числе >100%) биологической активностью соответствующего белка vWF дикого типа. Анализы, общепризнанные в данной области техники для определения биологической активности vWF, включают определение активности в присутствии кофактора ристоцетина (Federici A B et al. 2004. Haematologica 89:77-85), связывание vWF с GP Ibα из гликопротеинового комплекса тромбоцитов Ib-V-IX (Sucker et al. 2006. Clin Appl Thromb Hemost. 12:305-310), а также связывания коллагена (Kallas & Talpsep. 2001. Annals of Hematology 80:466-471).
В некоторых вариантах осуществления белок vWF, продуцируемый сконструированной активной клеткой по настоящему изобретению, содержит встречающуюся в природе или вариантную аминокислотную последовательность vWF, слитую с гетерологичным полипептидным или неполипептидным фрагментом, увеличивающим время полужизни белка vWF. Иллюстративные фрагменты, увеличивающие время полужизни, включают Fc-область, альбумин, последовательность PAS, трансферрин, CTP (С-концевой пептид (CTP) из 28 аминокислот хорионического гонадотропина человека (hCG) с его 4 O-гликанами), полиэтиленгликоль (PEG), гидроксиэтилкрахмал (HES), альбумин-связывающий полипептид, альбумин-связывающие малые молекулы или любую их комбинацию.
Определения выбранных химических терминов
Определения для конкретных функциональных групп и химических терминов описаны более подробно ниже. Химические элементы идентифицированы в соответствии с периодической таблицей элементов, версия CAS, Handbook of Chemistry and Physics, 75th Ed., форзац, и конкретные функциональные группы в целом определены, как описано в указанном документе. Кроме того, общие принципы органической химии, а также конкретные функциональные группы и реакционная способность, описаны в Thomas Sorrell, Organic Chemistry, University Science Books, Sausalito, 1999; Smith and March, March's Advanced Organic Chemistry, 5th Edition, John Wiley & Sons, Inc., New York, 2001; Larock, Comprehensive Organic Transformations, VCH Publishers, Inc., New York, 1989; и Carruthers, Some Modern Methods of Organic Synthesis, 3rd Edition, Cambridge University Press, Cambridge, 1987.
Сокращения, используемые в данном документе, имеют свое традиционное значение в рамках области химии и биологии. Химические структуры и формулы, изложенные в данном документе, составлены в соответствии со стандартными правилами химической валентности, известными в области химии.
Когда перечислен диапазон значений, подразумевается, что он охватывает каждое значение и поддиапазон в пределах диапазона. Например, подразумевается, что "C1-C6алкил" охватывает C1, C2, C3, C4, C5, C6, C1-C6, C1-C5, C1-C4, C1-C3, C1-C2, C2-C6, C2-C5, C2-C4, C2-C3, C3-C6, C3-C5, C3-C4, C4-C6, C4-C5 и C5-C6алкил.
Используемый в данном документе "алкил" относится к радикалу насыщенной углеводородной группы с прямой или разветвленной цепью, имеющей от 1 до 24 атомов углерода ("C1-C24алкил"). В некоторых вариантах осуществления алкильная группа имеет от 1 до 12 атомов углерода ("C1-C12алкил"), от 1 до 8 атомов углерода ("C1-C8алкил"), от 1 до 6 атомов углерода ("C1-C6алкил"), от 1 до 5 атомов углерода ("C1-C5 алкил"), от 1 до 4 атомов углерода ("C1-C4алкил"), от 1 до 3 атомов углерода ("C1-C3алкил"), от 1 до 2 атомов углерода ("C1-C2алкил") или 1 атом углерода ("C1алкил"). В некоторых вариантах осуществления алкильная группа имеет от 2 до 6 атомов углерода ("C2-C6алкил"). Примеры C1-C6алкильных групп включают метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5) и н-гексил (С6). Дополнительные примеры алкильных групп включают н-гептил (C7), н-октил (C8) и т. п. Каждая отдельная алкильная группа может быть независимо необязательно замещенной, т. е. незамещенной ("незамещенный алкил") или замещенной ("замещенный алкил") одним или более заместителями; например, 1-5 заместителями, 1-3 заместителями или 1 заместителем.
Используемый в данном документе "алкенил" относится к радикалу углеводородной группы с прямой или разветвленной цепью, имеющей от 2 до 24 атомов углерода, одну или более двойных углерод-углеродных связей и не имеющей тройных связей ("C2-C24алкенил"). В некоторых вариантах осуществления алкенильная группа имеет от 2 до 10 атомов углерода ("C2-C10алкенил"), от 2 до 8 атомов углерода ("C2-C8 алкенил"), от 2 до 6 атомов углерода ("C2-C6алкенил"), от 2 до 5 атомов углерода ("C2-C5 алкенил"), от 2 до 4 атомов углерода ("C2-C4алкенил"), от 2 до 3 атомов углерода ("C2-C3алкенил") или 2 атома углерода ("C2алкенил"). Одна или более двойных углерод-углеродных связей могут быть внутренними (как, например, в 2-бутениле) или концевыми (как, например, в 1-бутениле). Примеры C2-C4алкенильных групп включают этенил (C2), 1-пропенил (C3), 2-пропенил (C3), 1-бутенил (C4), 2-бутенил (C4), бутадиенил (C4) и т. п. Примеры C2-C6алкенильных групп включают вышеупомянутые C2-4алкенильные группы, а также пентенил (C5), пентадиенил (C5), гексенил (C6) и т. п. Каждая отдельная алкенильная группа может быть независимо необязательно замещенной, т. е. незамещенной ("незамещенный алкенил") или замещенной ("замещенный алкенил") одним или более заместителями; например, 1-5 заместителями, 1-3 заместителями или 1 заместителем.
Используемый в данном документе термин "алкинил" относится к радикалу углеводородной группы с прямой или разветвленной цепью, имеющей от 2 до 24 атомов углерода, одну или более тройных углерод-углеродных связей ("C2-C24алкинил"). В некоторых вариантах осуществления алкинильная группа имеет от 2 до 10 атомов углерода ("C2-C10алкинил"), от 2 до 8 атомов углерода ("C2-C8 алкинил"), от 2 до 6 атомов углерода ("C2-C6алкинил"), от 2 до 5 атомов углерода ("C2-C5 алкинил"), от 2 до 4 атомов углерода ("C2-C4алкинил"), от 2 до 3 атомов углерода ("C2-C3алкинил") или 2 атома углерода ("C2алкинил"). Одна или более тройных углерод-углеродных связей могут быть внутренними (как, например, в 2-бутиниле) или концевыми (как, например, в 1-бутиниле). Примеры C2-C4алкинильных групп включают этинил (C2), 1-пропинил (C3), 2-пропинил (C3), 1-бутинил (C4), 2-бутинил (C4) и т. п. Каждая отдельная алкинильная группа может быть независимо необязательно замещенной, т. е. незамещенной ("незамещенный алкинил") или замещенной ("замещенный алкинил") одним или более заместителями; например, 1-5 заместителями, 1-3 заместителями или 1 заместителем.
Используемый в данном документе термин "гетероалкил" относится к нециклической стабильной прямой или разветвленной цепи или ее комбинациям, включающим по меньшей мере один атом углерода и по меньшей мере один гетероатом, выбранный из группы, состоящей из O, N, P, Si и S, и где атомы азота и серы необязательно могут быть окисленными, а гетероатом азота необязательно может быть кватернизованным. Гетероатом(-ы) O, N, P, S и Si могут быть расположены в любом положении гетероалкильной группы. Иллюстративные гетероалкильные группы включают без ограничения: -CH2-CH2-O-CH3, -CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -CH2-CH2, -S(O)-CH3, -CH2-CH2-S(O)2-CH3, -CH=CH-O-CH3, -Si(CH3)3, -CH2-CH=N-OCH3, -CH=CH-N(CH3)-CH3, -O-CH3 и -O-CH2-CH3. Не более двух или трех гетероатомов могут быть расположены последовательно, как, например, -CH2-NH-OCH3 и -CH2-O-Si(CH3)3. В тех случаях, когда перечислен "гетероалкил", за которым следует перечисление конкретных гетероалкильных групп, таких как -CH2O, -NRCRD и т. п., следует понимать, что термины гетероалкил и -CH2O или -NRCRD не являются избыточными или взаимоисключающими. Напротив, конкретные гетероалкильные группы перечислены для большей ясности. Таким образом, термин "гетероалкил" не следует толковать в данном документе как исключающий конкретные гетероалкильные группы, такие как -CH2O, -NRCRD и т. п.
Термины "алкилен", "алкенилен", "алкинилен" или "гетероалкилен", отдельно или как часть другого заместителя, означают, если не указано иное, двухвалентный радикал, полученный из алкила, алкенила, алкинила или гетероалкила соответственно. Например, алкиленовая, алкениленовая, алкиниленовая или гетероалкиленовая группа может быть описана, как C1-C6-членный алкилен, C1-C6-членный алкенилен, C1-C6-членный алкинилен или C1-C6-членный гетероалкилен, где термин "членный" относится к отличным от водорода атомам в пределах фрагмента. В случае гетероалкиленовых групп гетероатомы могут также занимать один или оба конца цепи (например, алкиленокси, алкилендиокси, алкиленамино, алкилендиамино и т. п.). Более того, в случае алкиленовых и гетероалкиленовых связывающих групп направление, в котором написана формула связывающей группы, не подразумевает ориентацию связывающей группы. Например, формула -C(O)2R'- может изображать как -C(O)2R'-, так и -R'C(O)2-.
Используемый в данном документе "арил" относится к радикалу моноциклической или полициклической (например, бициклической или трициклической) 4n+2 ароматической кольцевой системы (например, имеющей 6, 10 или 14 π-электронов, обобществленных в циклической структуре), имеющей 6-14 атомов углерода в кольце и нуль гетероатомов, входящих в состав ароматической кольцевой системы ("C6-C14арил"). В некоторых вариантах осуществления арильная группа имеет шесть атомов углерода в кольце ("C6арил"; например, фенил). В некоторых вариантах осуществления арильная группа имеет десять атомов углерода в кольце ("C10арил"; например, нафтил, такой как 1-нафтил и 2-нафтил). В некоторых вариантах осуществления арильная группа имеет четырнадцать атомов углерода в кольце ("C14арил"; например, антрацил). Например, арильная группа может быть описана как C6-C10-членный арил, где термин "членный" относится к отличным от водорода атомам в кольце в пределах фрагмента. Арильные группы включают фенил, нафтил, инденил и тетрагидронафтил. Каждая отдельная арильная группа может быть независимо необязательно замещенной, т. е. незамещенной ("незамещенный арил") или замещенной ("замещенный арил") одним или более заместителями.
Используемый в данном документе термин "гетероарил" относится к радикалу 5-10-членной моноциклической или бициклической 4n+2 ароматической кольцевой системы (например, имеющей 6 или 10 π-электронов, обобществленных в циклической структуре), имеющей атомы углерода в кольце и 1-4 гетероатомов в кольце, входящих в состав ароматической кольцевой системы, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-10-членный гетероарил"). В гетероарильных группах, которые содержат один или более атомов азота, точкой присоединения может быть атом углерода или азота, если позволяет валентность. Гетероарилбициклические кольцевые системы могут включать один или более гетероатомов в одном или обоих кольцах. "Гетероарил" также включает кольцевые системы, в которых гетероарильное кольцо, как определено выше, конденсировано с одной или более арильными группами, где точка присоединения находится либо на арильном, либо на гетероарильном кольце, и в таких случаях число членов кольца обозначает число членов кольца в конденсированной (арильной/гетероарильной) кольцевой системе. В бициклических гетероарильных группах, в которых одно кольцо не содержит гетероатом (например, индолил, хинолинил, карбазолил и т. п.), точка присоединения может находиться на одном из двух колец, т. е. либо на кольце, содержащем гетероатом (например, 2-индолил), либо на кольце, которое не содержит гетероатом (например, 5-индолил). Гетероарильная группа может быть описана, например, как 6-10-членный гетероарил, где термин "членный" относится к отличным от водорода атомам в кольце в пределах фрагмента.
В некоторых вариантах осуществления гетероарильная группа представляет собой 5-10-членную ароматическую кольцевую систему, имеющую атомы углерода в кольце и 1-4 гетероатома в кольце, входящих в состав ароматической кольцевой системы, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-10-членный гетероарил"). В некоторых вариантах осуществления гетероарильная группа представляет собой 5-8-членную ароматическую кольцевую систему, имеющую атомы углерода в кольце и 1-4 гетероатома в кольце, входящих в состав ароматической кольцевой системы, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-8-членный гетероарил"). В некоторых вариантах осуществления гетероарильная группа представляет собой 5-6-членную ароматическую кольцевую систему, имеющую атомы углерода в кольце и 1-4 гетероатома в кольце, входящих в состав ароматической кольцевой системы, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-6-членный гетероарил"). В некоторых вариантах осуществления 5-6-членный гетероарил имеет 1-3 гетероатома в кольце, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероарил имеет 1-2 гетероатома в кольце, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероарил имеет 1 гетероатом в кольце, выбранный из азота, кислорода и серы. Каждая отдельная гетероарильная группа может быть независимо необязательно замещенной, т. е. незамещенной ("незамещенный гетероарил") или замещенной ("замещенный гетероарил") одним или более заместителями.
Иллюстративные 5-членные гетероарильные группы, содержащие один гетероатом, включают без ограничения пирролил, фуранил и тиофенил. Иллюстративные 5-членные гетероарильные группы, содержащие два гетероатома, включают без ограничения имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил и изотиазолил. Иллюстративные 5-членные гетероарильные группы, содержащие три гетероатома, включают без ограничения триазолил, оксадиазолил и тиадиазолил. Иллюстративные 5-членные гетероарильные группы, содержащие четыре гетероатома, включают без ограничения тетразолил. Иллюстративные 6-членные гетероарильные группы, содержащие один гетероатом, включают без ограничения пиридинил. Иллюстративные 6-членные гетероарильные группы, содержащие два гетероатома, включают без ограничения пиридазинил, пиримидинил и пиразинил. Иллюстративные 6-членные гетероарильные группы, содержащие три или четыре гетероатома, включают без ограничения триазинил и тетразинил соответственно. Иллюстративные 7-членные гетероарильные группы, содержащие один гетероатом, включают без ограничения азепинил, оксепинил и тиепинил. Иллюстративные 5,6-бициклические гетероарильные группы включают без ограничения индолил, изоиндолил, индазолил, бензотриазолил, бензотиофенил, изобензотиофенил, бензофуранил, бензоизофуранил, бензимидазолил, бензоксазолил, бензизоксазолил, бензоксадиазолил, бензтиазолил, бензизотиазолил, бензтиадиазолил, индолизинил и пуринил. Иллюстративные 6,6-бициклические гетероарильные группы включают без ограничения нафтиридинил, птеридинил, хинолинил, изохинолинил, циннолинил, хиноксалинил, фталазинил и хиназолинил. Другие иллюстративные гетероарильные группы включают гем и производные гема.
Используемые в данном документе термины "арилен" и "гетероарилен", отдельно или как часть другого заместителя, означают двухвалентный радикал, полученный из арила и гетероарила соответственно.
Используемый в данном документе "циклоалкил" относится к радикалу неароматической циклической углеводородной группы, имеющей от 3 до 10 атомов углерода в кольце ("C3-C10циклоалкил") и нуль гетероатомов в неароматической кольцевой системе. В некоторых вариантах осуществления циклоалкильная группа имеет от 3 до 8 атомов углерода в кольце ("C3-C8циклоалкил"), от 3 до 6 атомов углерода в кольце ("C3-C6циклоалкил") или от 5 до 10 атомов углерода в кольце ("C5-C10циклоалкил"). Циклоалкильная группа может быть описана, например, как C4-C7-членный циклоалкил, где термин "членный" относится к отличным от водорода атомам в кольце в пределах фрагмента. Иллюстративные C3-C6циклоалкильные группы включают без ограничения циклопропил (C3), циклопропенил (C3), циклобутил (C4), циклобутенил (C4), циклопентил (C5), циклопентенил (C5), циклогексил (C6), циклогексенил (C6), циклогексадиенил (C6) и т. п. Иллюстративные C3-C8циклоалкильные группы включают без ограничения вышеупомянутые C3-C6циклоалкильные группы, а также циклогептил (C7), циклогептенил (C7), циклогептадиенил (C7), циклогептатриенил (C7), циклооктил (C8), циклооктенил (C8), кубанил (C8), бицикло[1.1.1]пентанил (C5), бицикло[2.2.2]октанил (C8), бицикло[2.1.1]гексанил (C6), бицикло[3.1.1]гептанил (C7) и т. п. Иллюстративные C3-C10циклоалкильные группы включают без ограничения вышеупомянутые C3-C8циклоалкильные группы, а также циклононил (C9), циклононенил (C9), циклодецил (C10), циклодеценил (C10), октагидро-1H-инденил (C9), декагидронафталенил (C10), спиро[4,5]деканил (C10) и т. п. Как проиллюстрировано в приведенных выше примерах, в определенных вариантах осуществления циклоалкильная группа является либо моноциклической ("моноциклический циклоалкил"), либо содержит конденсированную, мостиковую или спиро-кольцевую систему, такую как бициклическая система ("бициклический циклоалкил"), и может быть насыщенной или может быть частично ненасыщенной. "Циклоалкил" также включает кольцевые системы, в которых циклоалкильное кольцо, как определено выше, конденсировано с одной или более арильными группами, где точка присоединения находится на циклоалкильном кольце, и в таких случаях количество атомов углерода продолжает обозначать количество атомов углерода в циклоалкильной кольцевой системе. Каждая отдельная циклоалкильная группа может быть независимо необязательно замещенной, т. е. незамещенной ("незамещенный циклоарил") или замещенной ("замещенный циклоарил") одним или более заместителями.
Используемый в данном документе "гетероциклил" относится к радикалу 3-10-членной неароматической кольцевой системы, содержащей атомы углерода в кольце и 1-4 гетероатома в кольце, где каждый гетероатом независимо выбран из азота, кислорода, серы, бора и фосфора и кремния ("3-10-членный гетероциклил"). В гетероциклильных группах, которые содержат один или более атомов азота, точкой присоединения может быть атом углерода или азота, если позволяет валентность. Гетероциклильная группа может быть либо моноциклической ("моноциклический гетероциклил"), либо конденсированной, мостиковой или спиро-кольцевой системой, такой как бициклическая система ("бициклический гетероциклил"), и может быть насыщенной или может быть частично ненасыщенной. Гетероциклилбициклические кольцевые системы могут включать один или более гетероатомов в одном или обоих кольцах. "Гетероциклил" также включает кольцевые системы, в которых гетероциклильное кольцо, как определено выше, конденсировано с одной или более циклоалкильными группами, где точка присоединения находится либо на циклоалкильном, либо на гетероциклильном кольце, или кольцевые системы, в которых гетероциклильное кольцо, как определено выше, конденсировано с одной или более арильными или гетероарильными группами, где точка присоединения находится на гетероциклильном кольце, и в таких случаях число членов кольца продолжает обозначать число членов кольца в гетероциклильной кольцевой системе. Гетероциклильная группа может быть описана, например, как 3-7-членный гетероциклил, где термин "членный" относится к отличным от водорода атомам в кольце, т. е. к атомам углерода, азота, кислорода, серы, бора, фосфора и кремния в пределах фрагмента. Каждый отдельный гетероциклил может быть независимо необязательно замещенным, т. е. незамещенным ("незамещенный гетероциклил") или замещенным ("замещенный гетероциклил") одним или более заместителями. В определенных вариантах осуществления гетероциклильная группа представляет собой незамещенный 3-10-членный гетероциклил. В определенных вариантах осуществления гетероциклильная группа представляет собой замещенный 3-10-членный гетероциклил.
В некоторых вариантах осуществления гетероциклильная группа представляет собой 5-10-членную неароматическую кольцевую систему, имеющую атомы углерода в кольце и 1-4 гетероатома в кольце, где каждый гетероатом независимо выбран из азота, кислорода, серы, бора, фосфора и кремния ("5-10-членный гетероциклил"). В некоторых вариантах осуществления гетероциклильная группа представляет собой 5-8-членную неароматическую кольцевую систему, имеющую атомы углерода в кольце и 1-4 гетероатома в кольце, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-8-членный гетероциклил"). В некоторых вариантах осуществления гетероциклильная группа представляет собой 5-6-членную неароматическую кольцевую систему, имеющую атомы углерода в кольце и 1-4 гетероатома в кольце, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-6-членный гетероциклил"). В некоторых вариантах осуществления 5-6-членный гетероциклил имеет 1-3 гетероатома в кольце, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероциклил имеет 1-2 гетероатома в кольце, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероциклил имеет один гетероатом в кольце, выбранный из азота, кислорода и серы.
Иллюстративные 3-членные гетероциклильные группы, содержащие один гетероатом, включают без ограничения азиридинил, оксиранил, тиоренил. Иллюстративные 4-членные гетероциклильные группы, содержащие один гетероатом, включают без ограничения азетидинил, оксетанил и тиетанил. Иллюстративные 5-членные гетероциклильные группы, содержащие один гетероатом, включают без ограничения тетрагидрофуранил, дигидрофуранил, тетрагидротиофенил, дигидротиофенил, пирролидинил, дигидропирролил и пирролил-2,5-дион. Иллюстративные 5-членные гетероциклильные группы, содержащие два гетероатома, включают без ограничения диоксоланил, оксасульфуранил, дисульфуранил и оксазолидин-2-он. Иллюстративные 5-членные гетероциклильные группы, содержащие три гетероатома, включают без ограничения триазолинил, оксадиазолинил и тиадиазолинил. Иллюстративные 6-членные гетероциклильные группы, содержащие один гетероатом, включают без ограничения пиперидинил, пиперазинил, тетрагидропиранил, дигидропиридинил и тианил. Иллюстративные 6-членные гетероциклильные группы, содержащие два гетероатома, включают без ограничения пиперазинил, морфолинил, дитианил, диоксанил. Иллюстративные 6-членные гетероциклильные группы, содержащие два гетероатома, включают без ограничения триазинанил или тиоморфолинил-1,1-диоксид. Иллюстративные 7-членные гетероциклильные группы, содержащие один гетероатом, включают без ограничения азепанил, оксепанил и тиепанил. Иллюстративные 8-членные гетероциклильные группы, содержащие один гетероатом, включают без ограничения азоканил, оксеканил и тиоканил. Иллюстративные 5-членные гетероциклильные группы, конденсированные с C6арильным кольцом (также обозначаемые в данном документе как 5,6-бициклическое гетероциклическое кольцо), включают без ограничения индолинил, изоиндолинил, дигидробензофуранил, дигидробензотиенил, бензоксазолинонил и т. п. Иллюстративные 6-членные гетероциклильные группы, конденсированные с арильным кольцом (также обозначаемые в данном документе как 6,6-бициклическое гетероциклическое кольцо), включают без ограничения тетрагидрохинолинил, тетрагидроизохинолинил и т. п.
Используемый в данном документе "амино" относится к радикалу -NR70R71, где каждый из R70 и R71 независимо представляет собой водород, C1-C8алкил, C3-C10циклоалкил, C4-C10гетероциклил, C6-C10арил и C5-C10гетероарил. В некоторых вариантах осуществления амино относится к NH2.
Используемый в данном документе "циано" относится к радикалу -CN.
Используемый в данном документе "галоген" или "галогенид", независимо или как часть другого заместителя, означает, если не указано иное, атом фтора (F), хлора (Cl), брома (Br) или йода (I).
Используемый в данном документе "гидрокси" относится к радикалу -ОН.
Алкильные, алкенильные, алкинильные, гетероалкильные, циклоалкильные, гетероциклильные, арильные и гетероарильные группы, как определено в данном документе, являются необязательно замещенными (например, "замещенная" или "незамещенная" алкильная, "замещенная" или "незамещенная" алкенильная, "замещенная" или "незамещенная" алкинильная, "замещенная" или "незамещенная" гетероалкильная, "замещенная" или "незамещенная" циклоалкильная, "замещенная" или "незамещенная" гетероциклильная, "замещенная" или "незамещенная" арильная или "замещенная" или "незамещенная" гетероарильная группа). В целом термин "замещенный", независимо от того, предшествует ли ему термин "необязательно" или нет, означает, что по меньшей мере один водород, присутствующий в группе (например, атома углерода или азота), заменен на допустимый заместитель, например, заместитель, который после замещения приводит к стабильному соединению, например, соединению, которое не подвергается самопроизвольной трансформации, такой как перегруппировка, циклизация, отщепление или другая реакция. Если не указано иное, "замещенная" группа имеет заместитель в одном или более замещаемых положениях группы, и если в любой указанной структуре замещено более одного положения, заместитель в каждом положении является одинаковым или различным. Предусматривается, что термин "замещенный" включает замещение всеми допустимыми заместителями органических соединений, такими как любой из заместителей, описанных в настоящем документе, который приводит к образованию стабильного соединения. В настоящем изобретении предусматриваются все без исключения такие комбинации, приводящие к получению стабильного соединения. Для целей настоящего изобретения гетероатомы, такие как азот, могут иметь водородные заместители и/или любой подходящий заместитель, описанный в данном документе, которые удовлетворяют валентностям гетероатомов и приводят к получению стабильного фрагмента.
Два или более заместителей необязательно могут соединяться с образованием арильной, гетероарильной, циклоалкильной или гетероциклильной групп. Как правило, хотя и не обязательно, такие так называемые образующие кольцо заместители присоединены к циклической основной структуре. В одном варианте осуществления образующие кольцо заместители присоединены к смежным членам основной структуры. Например, два образующих кольцо заместителя, присоединенные к смежным членам циклической основной структуры, создают конденсированную кольцевую структуру. В другом варианте осуществления образующие кольцо заместители присоединены к одному члену основной структуры. Например, два образующих кольцо заместителя, присоединенные к одному члену циклической основной структуры, создают спироциклическую структуру. В еще одном варианте осуществления образующие кольцо заместители присоединены к несмежным элементам основной структуры.
Описанные в данном документе соединения могут содержать один или более центров асимметрии и, таким образом, могут существовать в виде различных изомерных форм, например, в виде энантиомеров и/или диастереомеров. Например, соединения, описанные в данном документе, могут находиться в форме отдельного энантиомера, диастереомера или геометрического изомера или могут находиться в форме смеси стереоизомеров, в том числе рацемических смесей и смесей, обогащенных одним или более стереоизомерами. Изомеры могут быть выделены из смесей с помощью способов, известных специалистам в данной области техники, в том числе посредством хиральной жидкостной хроматографии высокого давления (HPLC) и образования и кристаллизации хиральных солей; или предпочтительные изомеры могут быть получены с помощью асимметрического синтеза. См., например, Jacques et al., Enantiomers, Racemates and Resolutions (Wiley Interscience, New York, 1981); Wilen et al., Tetrahedron 33:2725 (1977); Eliel, Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962); и Wilen, Tables of Resolving Agents and Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN 1972). Настоящее изобретение дополнительно охватывает описанные в данном документе соединения в виде отдельных изомеров, фактически не содержащих другие изомеры, и, в качестве альтернативны, в виде смесей различных изомеров.
Используемое в данном документе чистое энантиомерное соединение фактически не содержит другие энантиомеры или стереоизомеры соединения (т. е. присутствует в энантиомерном избытке). Другими словами, "S"-форма соединения фактически не содержит "R"-форму соединения и, таким образом, присутствует в энантиомерном избытке относительно "R"-формы. Термин "энантиомерно чистый" или "чистый энантиомер" обозначает, что соединение содержит более 75% по весу, более 80% по весу, более 85% по весу, более 90% по весу, более 91% по весу, более 92% по весу, более 93% по весу, более 94% по весу, более 95% по весу, более 96% по весу, более 97% по весу, более 98% по весу, более 99% по весу, более 99,5% по весу или более 99,9% по весу данного энантиомера. В определенных вариантах осуществления показатели по весу основаны на общем весе всех энантиомеров или стереоизомеров соединения.
Соединения, описанные в данном документе, также могут содержать одно или более изотопных замещений. Например, Н может присутствовать в любой изотопной форме, в том числе 1H, 2H (D или дейтерий) и 3H (Т или тритий); C может присутствовать в любой изотопной форме, в том числе 12C, 13C и 14C; О может присутствовать в любой изотопной форме, в том числе 16O и 18O; и т. п.
Подразумевается, что термин "фармацевтически приемлемая соль" включает соли активных соединений, которые получают с помощью относительно нетоксичных кислот или оснований, в зависимости от конкретных заместителей, присутствующих в соединениях, описанных в данном документе. Если соединения по настоящему изобретению содержат относительно кислые функциональные группы, могут быть получены соли присоединения основания путем приведения нейтральной формы таких соединений в контакт с достаточным количеством требуемого основания, либо в чистом виде, либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения основания включают соль натрия, калия, кальция, аммония, органического амино или магния или аналогичную соль. Если соединения по настоящему изобретению содержат относительно основные функциональные группы, могут быть получены соли присоединения кислоты путем приведения нейтральной формы таких соединений в контакт с достаточным количеством требуемой кислоты, либо в чистом виде, либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения кислоты включают соли, полученные за счет неорганических кислот, таких как хлористоводородная, бромистоводородная, азотная, угольная, моногидроугольная, фосфорная, моногидрофосфорная, дигидрофосфорная, серная, моногидросерная, йодистоводородная кислота или фосфористая кислоты и т. п., а также соли, полученные за счет органических кислот, такие как уксусная, пропионовая, изомасляная, малеиновая, малоновая, бензойная, янтарная, субериновая, фумаровая, молочная, миндальная, фталевая, бензолсульфоновая, п-толилсульфоновая, лимонная, винная, метансульфоновая и т. п. Также включены соли аминокислот, такие как аргинат и т. п., и соли органических кислот, таких как глюкуроновая или галактуноровая кислоты и т. п. (см., например, Berge et al, Journal of Pharmaceutical Science 66: 1-19 (1977)). Определенные конкретные соединения по настоящему изобретению содержат как основную, так и кислотную функциональные группы, которые позволяют превращать соединения как в соль присоединения основания, так и в соль присоединения кислоты. Такие соли можно получать посредством способов, известных специалистам в данной области техники. Другие фармацевтически приемлемые носители, известные специалистам в данной области техники, применимы по настоящему изобретению.
В дополнение к солевым формам в настоящем изобретении предусмотрены соединения в форме пролекарства. Пролекарствами соединений, описанных в данном документе, являются такие соединения, которые легко подвергаются химическим изменениям в физиологических условиях с обеспечением соединений по настоящему изобретению. Кроме того, пролекарства можно превращать в соединения по настоящему изобретению посредством химических или биохимических способов в условиях ex vivo. .
Определенные соединения по настоящему изобретению могут существовать в виде несольватированных форм, а также в виде сольватированных форм, в том числе гидратированных форм. В целом сольватированные формы эквивалентны несольватированным формам и охватываются объемом настоящего изобретения. Определенные соединения по настоящему изобретению могут существовать в виде нескольких кристаллических или аморфных форм. В целом все физические формы являются эквивалентными для путей применения, предусмотренных в настоящем изобретении, и, предусматривается, что они находятся в пределах объема настоящего изобретения.
Термин "сольват" относится к формам соединения, которые ассоциированы с растворителем, обычно за счет реакции сольволиза. Эта физическая ассоциация может включать образование водородных связей. Традиционные растворители включают воду, метанол, этанол, уксусную кислоту, DMSO, THF, диэтиловый эфир и т. п. Описанные в данном документе соединения могут быть получены, например, в виде кристаллической формы и могут быть сольватированными. Подходящие сольваты включают фармацевтически приемлемые сольваты и дополнительно включают как стехиометрические сольваты, так и нестехиометрические сольваты.
Термин "гидрат" относится к соединению, которое ассоциировано с водой. Как правило, число молекул воды, содержащихся в гидрате соединения, находится в определенном соотношении с числом молекул соединения в гидрате. Следовательно, гидрат соединения может быть представлен, например, общей формулой R∙x H2O, где R представляет собой соединение, и где x составляет число, превышающее 0.
Используемый в данном документе термин "таутомер" относится к соединениям, которые представляют собой взаимозаменяемые формы конкретной структуры соединения и которые отличаются перестановкой атомов водорода и электронов. Таким образом, две структуры могут находиться в равновесии благодаря перемещению π-электронов и атома (обычно H). Например, енолы и кетоны являются таутомерами, потому что они быстро взаимопревращаются при обработке либо кислотой, либо основанием. Таутомерные формы могут иметь значение для достижения оптимальной химической реакционной способности и биологической активности представляющего интерес соединения.
Используемый в данном документе символ "  " относится к связи с объектом, например полимером (например, гидрогельобразующим полимером, таким как альгинат) или имплантируемым элементом (например, устройством или материалом). Связь, представленная как "
" относится к связи с объектом, например полимером (например, гидрогельобразующим полимером, таким как альгинат) или имплантируемым элементом (например, устройством или материалом). Связь, представленная как "  ", может относиться к прямому присоединению к объекту, например, полимеру или имплантируемому элементу, может относиться к связи с объектом через группу присоединения. "Группа присоединения", описываемая в данном документе, относится к фрагменту для связывания соединения формулы (II) с объектом (например, полимером или имплантируемым элементом, описываемым в данном документе) и может предусматривать любую химизм присоединения, известную в данной области техники. Список иллюстративных групп присоединения кратко изложен в Bioconjugate Techniques (3rd ed, Greg T. Hermanson, Waltham, MA: Elsevier, Inc, 2013), который включен в данный документ посредством ссылки во всей своей полноте. В некоторых вариантах осуществления группа присоединения содержит алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил, -C(O)-, -OC(O)-, -N(RC)-, -N(RC)C(O)-, -C(O)N(RC)-, -N(RC)N(RD)-, -NCN-, -C(=N(RC)(RD))O-, -S-, -S(O)x-, -OS(O)x-, -N(RC)S(O)x-, -S(O)xN(RC)-, -P(RF)y-, -Si(ORA)2 -, -Si(RG)(ORA)-, -B(ORA)- или металл, где каждый из RA, RC, RD, RF, RG, x и y независимо являются такими, как описано в данном документе. В некоторых вариантах осуществления группа присоединения содержит амин, кетон, сложный эфир, амид, алкил, алкенил, алкинил или тиол. В некоторых вариантах осуществления группа присоединения представляет собой сшивающее средство. В некоторых вариантах осуществления группа присоединения представляет собой -C(O)(C1-C6алкилен)-, где алкилен замещен R1, а R1 является таким, как описано в данном документе. В некоторых вариантах осуществления группа присоединения представляет собой -C(O)(C1-C6алкилен)-, где алкилен замещен 1-2 алкильными группами (например, 1-2 метильными группами). В некоторых вариантах осуществления группа присоединения представляет собой -C(O)C(CH3)2-. В некоторых вариантах осуществления группа присоединения представляет собой -C(O)(метилен)-, где алкилен замещен 1-2 алкильными группами (например, 1-2 метильными группами). В некоторых вариантах осуществления группа присоединения представляет собой -C(O)CH(CH3)-. В некоторых вариантах осуществления группа присоединения представляет собой -C(O)C(CH3)-.
", может относиться к прямому присоединению к объекту, например, полимеру или имплантируемому элементу, может относиться к связи с объектом через группу присоединения. "Группа присоединения", описываемая в данном документе, относится к фрагменту для связывания соединения формулы (II) с объектом (например, полимером или имплантируемым элементом, описываемым в данном документе) и может предусматривать любую химизм присоединения, известную в данной области техники. Список иллюстративных групп присоединения кратко изложен в Bioconjugate Techniques (3rd ed, Greg T. Hermanson, Waltham, MA: Elsevier, Inc, 2013), который включен в данный документ посредством ссылки во всей своей полноте. В некоторых вариантах осуществления группа присоединения содержит алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил, -C(O)-, -OC(O)-, -N(RC)-, -N(RC)C(O)-, -C(O)N(RC)-, -N(RC)N(RD)-, -NCN-, -C(=N(RC)(RD))O-, -S-, -S(O)x-, -OS(O)x-, -N(RC)S(O)x-, -S(O)xN(RC)-, -P(RF)y-, -Si(ORA)2 -, -Si(RG)(ORA)-, -B(ORA)- или металл, где каждый из RA, RC, RD, RF, RG, x и y независимо являются такими, как описано в данном документе. В некоторых вариантах осуществления группа присоединения содержит амин, кетон, сложный эфир, амид, алкил, алкенил, алкинил или тиол. В некоторых вариантах осуществления группа присоединения представляет собой сшивающее средство. В некоторых вариантах осуществления группа присоединения представляет собой -C(O)(C1-C6алкилен)-, где алкилен замещен R1, а R1 является таким, как описано в данном документе. В некоторых вариантах осуществления группа присоединения представляет собой -C(O)(C1-C6алкилен)-, где алкилен замещен 1-2 алкильными группами (например, 1-2 метильными группами). В некоторых вариантах осуществления группа присоединения представляет собой -C(O)C(CH3)2-. В некоторых вариантах осуществления группа присоединения представляет собой -C(O)(метилен)-, где алкилен замещен 1-2 алкильными группами (например, 1-2 метильными группами). В некоторых вариантах осуществления группа присоединения представляет собой -C(O)CH(CH3)-. В некоторых вариантах осуществления группа присоединения представляет собой -C(O)C(CH3)-.
Активные клетки
В данном документе раскрыты композиции на основе клеток, содержащие активные клетки, например, клетки пигментного эпителия сетчатки (RPE) или клетки, полученные из клеток RPE, в том числе сконструированные клетки RPE или сконструированные клетки, полученные из клеток RPE, композиции на их основе, имплантируемые элементы, содержащие их, и способы получения или изготовления и применения таких клеток, композиций и имплантируемых элементов. В одном варианте осуществления активная клетка, например клетка RPE, представляет собой сконструированную активную клетку, например, сконструированную клетку RPE.
В естественных условиях в организме клетки RPE составляют основной слой эпителия в глазу, образуя монослой из кубических клеток в пределах мембраны Бруха или на ней, непосредственно позади фоторецепторных клеток сетчатки. Клетки RPE играют ключевую роль в обеспечении функционирования субретинального пространства за счет направленного переноса питательных веществ и регулирования ионного баланса, а также предупреждения повреждения окружающей ткани сетчатки за счет захвата рассеянного света и содействия хранению ретиноида (Sparrow, J.R. et al (2010) Curr Mol Med 10:802-823). С аберрантной функцией клеток RPE связана патология при некоторых заболеваниях, таких как дегенерация желтого пятна, центральная серозная хориоретинопатия и пигментный ретинит (Sato, R. et al (2013) Invest Ophthalmol Vis Sci 54:1740-1749).
Сконструированные активные клетки, например, сконструированные клетки RPE или сконструированные клетки, полученные из клеток RPE, описываются в данном документе и характеризуются полезными свойствами, которые могут использоваться в применении настоящего изобретения. Например, в вариантах осуществления активные клетки могут проявлять контактное торможение, и в вариантах осуществления они способны к фагоцитозу соседних клеток, или и то, и другое. В вариантах осуществления или одно или оба из этих свойств обеспечивают гомеостатическую функцию; например, в вариантах осуществления контактное торможение предупреждает или подавляет нежелательный рост, который может нарушить функцию или целостность инкапсулированных активных клеток, в то время как способность к фагоцитозу обеспечивает более свободную среду для деления клеток и замещения мертвых активных клеток. В одном варианте осуществления инкапсулированные активные клетки поддерживают плотность или число клеток, которые не изменяются более чем на приблизительно 10, 20, 30, 40 или 50% в течение предварительно заданного периода времени, в культуре in vitro или будучи имплантированными в субъекта, например, в течение приблизительно 1, 2, 3, 4, 5, 10, 20, 30, 45, 60 или 90 дней.
В одном варианте осуществления активная клетка представляет собой аутологичную, аллогенную или ксеногенную клетку (эти термины относятся к взаимосвязи между клеткой и субъектом, которому данную клетку вводят).
В одном варианте осуществления активная клетка представляет собой иммортализованную клетку или получена из иммортализованной клетки.
В одном варианте осуществления активная клетка представляет собой неиммортализованную клетку или получена из неиммортализованной клетки.
В одном варианте осуществления активная клетка представляет собой клетку, полученную из менее дифференцированной клетки (например, менее дифференцированной, чем клетка RPE), например, плюрипотентной клетки, мультипотентной клетки, стволовой клетки, эмбриональной стволовой клетки, мезенхимальной стволовой клетки, индуцированной плюрипотентной стволовой клетки; перепрограммированной клетки, перепрограммированной стволовой клетки или клетки, полученной из перепрограммированных стволовых клеток. Менее дифференцированная клетка может представлять собой встречающуюся в природе клетку, менее дифференцированную клетку или индуцированную менее дифференцированную клетку, например, стволовую клетку или индуцированную стволовую клетку соответственно.
В одном варианте осуществления активная клетка получена из естественного источника, ксеноткани, аллоткани, трупного материала, клеточной линии или первичной клетки.
Активная клетка может быть сконструированной клеткой, например клеткой, сконструированной для экспрессии белка или нуклеиновой кислоты, или клеткой, сконструированной для продуцирования метаболического продукта. Активная клетка может представлять собой клетку млекопитающего, например, клетку человека. Сконструированная активная клетка может представлять собой клетку млекопитающего, например, клетку человека.
В одном варианте осуществления сконструированная активная клетка представляет собой клетку RPE (или получена из клетки RPE), которая содержит по меньшей мере одну экзогенную транскрипционную единицу, которая может присутствовать в виде внехромосомного вектора экспрессии или интегрироваться в один или более хромосомных сайтов в клетке. В одном варианте осуществления транскрипционная единица содержит промотор, функционально связанный с кодирующей последовательностью для полипептида, где промотор фактически состоит или состоит из SEQ ID NO:23 или нуклеотидной последовательности, которая практически идентична SEQ ID NO:23 например, на по меньшей мере 95%, 96%, 97%, 98%, 99% или более идентична SEQ ID NO:23. В одном варианте осуществления промотор состоит из SEQ ID NO:23. В одном варианте осуществления полипептидная кодирующая последовательность представляет собой встречающуюся в природе последовательность (например, нативную последовательность дикого типа) или кодон-оптимизированную последовательность. В одном варианте осуществления транскрипционная единица дополнительно содержит последовательность трансляции Козак, расположенную непосредственно перед стартовым кодоном ATG в последовательности, кодирующей полипептид (например, последовательность Козак, изложена в нуклеотидах 2094-2099 из SEQ ID NO:26). В одном варианте осуществления транскрипционная единица дополнительно содержит последовательность полиА, которая фактически состоит или состоит из SEQ ID NO:24 или нуклеотидной последовательности, которая практически идентична последовательности SEQ ID NO:24, например, на по меньшей мере 95%, 96%, 97%, 98%, 99% или более идентична SEQ ID NO:24. В одном варианте осуществления транскрипционная единица присутствует в виде внехромосомного вектора экспрессии. В одном варианте осуществления сконструированная клетка содержит две, три, четыре или более копий экзогенной транскрипционной единицы, которые последовательно интегрированы в один и тот же сайт генома клетки. В одном варианте осуществления транскрипционная единица фактически состоит или состоит из SEQ ID NO:27 или SEQ ID NO:28.
В одном варианте осуществления активная клетка получена из культуры, в которой по меньшей мере 10, 20, 30, 40, 50, 60, 79, 80, 90, 95, 98 или 99% клеток в культуре представляют собой активные клетки, например, клетки RPE или сконструированные активные клетки, например, сконструированные клетки RPE. В одном варианте осуществления культура содержит активные клетки, например, клетки RPE или сконструированные клетки RPE, и клетки второго типа, например, питающую клетку или загрязняющую клетку. В одном варианте осуществления активная клетка представляет собой клетку RPE, например, сконструированную или несконструированную клетку RPE, полученную от индивидуума, например, того же самого или другого индивидуума, которому эти клетки вводят.
Активная клетка может быть получена из любой из множества линий. Иллюстративные линии клеток RPE включают клетки ARPE-19, клетки ARPE-19-SEAP-2-neo, клетки RPE-J и клетки hTERT RPE-1. В некоторых вариантах осуществления активная клетка представляет собой клетку ARPE-19 или получена из клетки ARPE-19. В некоторых вариантах осуществления активная клетка представляет собой сконструированную клетку ARPE-19, которая получена из линии клеток ARPE-19 (ATCC® CRL-2302™).
В одном варианте осуществления в активной клетке экспрессируется биомаркер, например, антиген, который характерен для клетки RPE, например, встречающейся в природе клетки RPE. В некоторых вариантах осуществления биомаркер (например, антиген) представляет собой белок. Иллюстративные биомаркеры включают CRALBP, RPE-65, RLBP, BEST1 или αB-кристаллин. В одном варианте осуществления в активной клетка экспрессируется по меньшей мере один из CRALBP, RPE-65, RLBP, BEST1 или αB-кристаллина. В одном варианте осуществления в активной клетке экспрессируется по меньшей мере один из CRALBP и RPE-65.
В одном варианте осуществления совокупность активных клеток (например, клеток RPE), например, сконструированных активных клеток (например, сконструированных клеток RPE), характеризуется или обеспечивается в виде предварительно заданного форм-фактора или форм-фактора, описанного в данном документе. В одном варианте осуществления форм-фактор представляет собой монослой или кластер. Используемый в данном документе "кластер активных клеток, например, кластер клеток RPE" относится к совокупности активных клеток или агрегату активных клеток, как правило, характеризующемуся отношением клеток к площади поверхности форм-фактора, которое меньше, чем такое отношение у монослоя. В некоторых вариантах осуществления кластер активных клеток содержит по меньшей мере приблизительно 2, 3, 4, 5, 10, 50, 100, 200, 300, 400, 500, 1000, 2000, 3000, 4000 или 5000 активных клеток. В некоторых вариантах осуществления кластер активных клеток содержит от 2 до 5000 клеток, от 2 до 1000 клеток, от 5 до 1000 клеток, от 5 до 500 клеток, от 10 до 500 клеток. В некоторых вариантах осуществления кластер активных клеток содержит от 2 до 10 клеток, от 5 до 10 клеток, от приблизительно 5 до 20 клеток, от 5 до 50 клеток или от 10 до 100 клеток. В некоторых вариантах осуществления кластер активных клеток содержит от 50 до 100 клеток, от 50 до 250 клеток, от 100 до 500 клеток, от 100 до 1000 клеток или от 500 до 1000 клеток. В одном варианте осуществления нижняя, верхняя или обе конечные точки диапазона числа клеток представляют собой средние значения и могут варьироваться в пределах 5%. В одном варианте осуществления нижняя, верхняя или обе конечные точки диапазона числа клеток представляют собой средние значения и могут варьироваться в пределах 10%.
В одном варианте осуществления кластер активных клеток имеет сфероидную, глобулярную или эллипсоидную форму или любую другую форму с криволинейной поверхностью. В некоторых вариантах осуществления кластер активных клеток имеет сфероидную форму, где по меньшей мере приблизительно 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60% 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% клеток в кластере активных клеток соответствуют сфероидной форме. В некоторых вариантах осуществления кластер активных клеток имеет глобулярную форму, где по меньшей мере приблизительно 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60% 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% клеток в кластере активных клеток соответствуют глобулярной форме. В некоторых вариантах осуществления кластер активных клеток имеет эллипсоидную форму, где по меньшей мере приблизительно 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60% 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% клеток в кластере активных клеток соответствуют эллипсоидной форме.
В одном варианте осуществления для кластера активных клеток предусмотрены определенные размерные параметры, например, с диапазоном размеров в каждом из размерных параметров x, y или z. В некоторых вариантах осуществления длина по меньшей мере одного из размерных параметров x, y или z независимо составляет более чем приблизительно 10 мкм (например, более чем приблизительно 15 мкм, приблизительно 20 мкм, приблизительно 30 мкм, приблизительно 40 мкм, приблизительно 50 мкм, приблизительно 75 мкм, приблизительно 100 мкм, приблизительно 250 мкм, приблизительно 500 мкм, приблизительно 750 мкм, приблизительно 1 мм, приблизительно 1,1 мм, приблизительно 1,2 мм, приблизительно 1,3 мм, приблизительно 1,4 мм, приблизительно 1,5 мм или более). В некоторых вариантах осуществления длина по меньшей мере одного из размерных параметров x, y или z для кластера активных клеток независимо составляет менее чем приблизительно 2 мм (например, менее чем приблизительно 1,5 мм, приблизительно 1,4 мм, приблизительно 1,3 мм, приблизительно 1,2 мм, приблизительно 1,1 мм, приблизительно 1,0 мм, приблизительно 750 мкм, приблизительно 500 мкм, приблизительно 250 мкм, приблизительно 100 мкм, приблизительно 75 мкм, приблизительно 50 мкм, приблизительно 40 мкм, приблизительно 30 мкм, приблизительно 20 мкм или менее).
В некоторых вариантах осуществления длина по меньшей мере одного из размерных параметров x, y или z для кластера активных клеток независимо составляет от приблизительно 10 мкм до приблизительно 5 мм (например, от приблизительно 20 мкм до приблизительно 4 мм, от приблизительно 50 мкм до приблизительно 2 мм или от приблизительно 100 мкм до приблизительно 1,5 мм). В некоторых вариантах осуществления длина по меньшей мере двух из размерных параметров x, y или z для кластера активных клеток независимо составляет от приблизительно 10 мкм до приблизительно 5 мм (например, от приблизительно 20 мкм до приблизительно 4 мм, от приблизительно 50 мкм до приблизительно 2 мм или от приблизительно 100 мкм до приблизительно 1,5 мм). В некоторых вариантах осуществления длина всех трех из размерных параметров x, y или z для кластера активных клеток независимо составляет от приблизительно 10 мкм до приблизительно 5 мм (например, от приблизительно 20 мкм до приблизительно 4 мм, от приблизительно 50 мкм до приблизительно 2 мм или от приблизительно 100 мкм до приблизительно 1,5 мм).
В некоторых вариантах осуществления каждый из размерных параметров для кластера активных клеток независимо находится в пределах приблизительно 5% (например, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% или приблизительно 95%) от других размерных параметров. Например, размерный параметр x для кластера клеток RPE может составлять приблизительно 5% (например, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% или приблизительно 95%) от обоих размерного параметра y и размерного параметра z. В некоторых вариантах осуществления размерный параметр y для кластера активных клеток может составлять приблизительно 5% (например, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% или приблизительно 95%) от обоих размерного параметра x и размерного параметра z. В других вариантах осуществления размерный параметр z для кластера активных клеток может составлять приблизительно 5% (например, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% или приблизительно 95%) от обоих размерного параметра x и размерного параметра y.
Кластер активных клеток может встраиваться в матрикс, например, внеклеточный матрикс, секретируемый активной клеткой (например, кластер встроенных активных клеток). В некоторых вариантах осуществления кластер активных клеток инкапсулируется матриксом, например, внеклеточным матриксом, секретируемым активной клеткой (например, кластер инкапсулированных активных клеток). В некоторых вариантах осуществления внеклеточный матрикс содержит белки, например, коллаген (например, структурный коллаген или ангиостатический коллаген, например, коллаген IV, коллаген III, коллаген V, коллаген VI, коллаген XVIII), ламинин, эластин, интегрин или фибронектин. Внеклеточный матрикс или его компонент может быть либо встречающимся в природе, либо не встречающимся в природе. В некоторых вариантах осуществления внеклеточный матрикс или его компонент является встречающимся в природе и дополнен не встречающимся в природе компонентом. В других вариантах осуществления внеклеточный матрикс или его компонент является не встречающимся в природе и дополнен встречающимся в природе компонентом.
Активные клетки для применения в композициях и способах, описанных в данном документе, например, для применения в виде совокупности активных клеток, инкапсулированных в гидрогелевую капсулу или характеризующихся предварительно заданным форм-фактором или форм-фактором, описанным в данном документе, например, кластер активных клеток, могут находиться на различных стадиях клеточного цикла. В некоторых вариантах осуществления по меньшей мере одна активная клетка в совокупности или кластере активных клеток подвергается клеточному делению. Деление клеток может быть измерено с применением любого известного в данной области техники способа, например, описанного в DeFazio A et al (1987) J Histochem Cytochem 35:571-577 и Dolbeare F et al (1983) Proc Natl Acad Sci USA 80:5573-5577, каждый из которых включен в данный документ посредством ссылки во всей своей полноте. В одном варианте осуществления по меньшей мере 1, 2, 3, 4, 5, 10 или 20% клеток подвергаются клеточному делению, например, согласно определению посредством анализа с 5-этинил-2'-дезоксиуридином (EdU) или 5-бром-2'-дезоксиуридином (BrdU). В некоторых вариантах осуществления пролиферацию клеток визуализируют или оценивают количественно посредством микроскопии (например, флуоресцентной микроскопии (например, замедленной съемки или оценки образования веретена деления)) или проточной цитометрии. В некоторых вариантах осуществления ни одна из активных клеток в совокупности или кластере активных клеток не подвергается клеточному делению, и все они находятся в состоянии покоя. В одном варианте осуществления менее 1, 2, 3, 4, 5, 10 или 20% клеток подвергаются клеточному делению, согласно определению посредством анализа с 5-этинил-2'-дезоксиуридином (EdU), 5-бром-2'-дезоксиуридином (BrdU), микроскопии (например, флуоресцентной микроскопии (например, замедленной съемки или оценки образования веретена деления)) или проточной цитометрии.
В некоторых вариантах осуществления активные клетки в совокупности или кластере активных клеток способны к аутофагии. Аутофагию можно измерить с применением любого известного в данной области техники способа, например, как описано в Barth et al (2010) J. Pathol 221:117-124 или Zhang, Z. et al. (2016) Curr Protoc Toxicol. 69: 20.12.1-20.1.26, каждый из которых включен посредством ссылки во всей своей полноте. Например, аутофагию можно определить или оценить количественно посредством анализа с 5-этинил-2'-дезоксиуридином (EdU), анализа с 5-бром-2'-дезоксиуридином (BrdU), анализа с катионной амфифильной меткой (CAT), в котором краситель быстро распределяется в клетки и селективно метит вакуоли, ассоциированные с путем аутофагии. В некоторых вариантах осуществления аутофагию визуализируют или оценивают количественно посредством микроскопии (например, флуоресцентной микроскопии (например, замедленной съемки или оценки образования веретена деления)). В некоторых вариантах осуществления аутофагию анализируют посредством одного или более из иммуноблоттинг-анализа LC3 и p62, обнаружения образования аутофагосом с помощью флуоресцентной микроскопии и мониторинга созревания аутофагосом с помощью тандемной флуоресцентной микроскопии mRFP-GFP, например, как описано в Zhang et al. В одном варианте осуществления по меньшей мере 1, 2, 3, 4, 5, 10 или 20% клеток способны к аутофагии, например, согласно определению посредством анализа с 5-этинил-2'-дезоксиуридином (EdU), анализа с 5-бром-2'-дезоксиуридином (BrdU), анализа с катионной амфифильной меткой (CAT) или микроскопии (например, флуоресцентной микроскопии (например, замедленной съемки или оценки образования веретена деления)).
В некоторых вариантах осуществления клетки RPE в совокупности или кластере клеток RPE способны к фагоцитозу. Фагоцитоз можно измерить с применением любого известного в данной области техники способа, например, описываемого в Oda T and Maeda H (1986) J Immunol Methods 88:175-183 и Nuutila J and Lilius EM (2005) Cytometry A (2005) 65:93-102, каждый из которых включен в данный документ посредством ссылки во всей своей полноте. Например, фагоцитоз можно измерить посредством анализа с антителами, меченными флуоресцеином, в котором отслеживают поглощение меченого вещества посредством пути фагоцитоза. В некоторых вариантах осуществления фагоцитоз визуализируют или оценивают количественно посредством микроскопии (например, флуоресцентной микроскопии (например, замедленной съемки или оценки образования веретена деления)) или проточной цитометрии. В одном варианте осуществления по меньшей мере 1, 2, 3, 4, 5, 10 или 20% клеток способны к фагоцитозу, например, согласно определению посредством анализа с антителами, меченными флуоресцеином, микроскопии (например, флуоресцентной микроскопии (например, замедленной съемки или оценки образования веретена деления)) или проточной цитометрии.
В одном варианте осуществления по меньшей мере 1, 2, 3, 4, 5, 10, 20, 40 или 80% клеток RPE в совокупности или кластере являются жизнеспособными. Жизнеспособность клеток может быть измерена с применением любого известного в данной области техники способа, например, описываемого в Riss, T. et al (2013) "Cell Viability Assays" в Assay Guidance Manual (Sittapalam, G.S. et al, eds). Например, жизнеспособность клеток можно измерить или оценить количественно посредством анализа АТФ, анализа с 5-этинил-2'-дезоксиуридином (EdU), анализа с 5-бром-2'-дезоксиуридином (BrdU). В некоторых вариантах осуществления жизнеспособность клеток визуализируют или оценивают количественно посредством микроскопии (например, флуоресцентной микроскопии (например, замедленной съемки или оценки образования веретена деления)) или проточной цитометрии. В одном варианте осуществления по меньшей мере 1, 2, 3, 4, 5, 10, 20, 40 или 80% клеток RPE в совокупности или кластере являются жизнеспособными, например, согласно определению посредством анализа АТФ, анализа с 5-этинил- 2'-дезоксиуридином (EdU), анализа с 5-бром-2'-дезоксиуридином (BrdU), микроскопии (например, флуоресцентной микроскопии (например, замедленной съемки или оценки образования веретена деления)) или проточной цитометрии.
Любой из параметров, описанных в данном документе, может оцениваться с применением стандартных методик, известных специалисту в данной области техники, таких как гистологический анализ, микроскопия и различные функциональные анализы.
В некоторых вариантах осуществления активные клетки, характеризующиеся форм-фактором, например, в виде кластера активных клеток, образуют плотные клеточные контакты друг с другом. В одном варианте осуществления по меньшей мере 1, 2, 3, 4, 5, 10 или 20% клеток характеризуются плотным клеточным контактом с по меньшей мере одной другой активной клеткой из форм-фактора, например, согласно определению посредством известных в данной области техники способов, например, известных в данной области техники анализов с окрашиванием и микроскопией. В некоторых вариантах осуществления активные клетки, характеризующиеся форм-фактором, например, в виде кластера активных клеток, не образуют плотные клеточные контакты друг с другом. В одном варианте осуществления по меньшей мере 1, 2, 3, 4, 5, 10 или 20% активных клеток не имеют плотного клеточного контакта с другой активной клеткой из форм-фактора, например, согласно определению посредством известных в данной области техники способов, например, известных в данной области техники анализов с окрашиванием и микроскопией. В некоторых вариантах осуществления активные клетки, характеризующиеся форм-фактором, например, в виде кластера активных клеток, проявляют полярность. Например, активные клетки, характеризующиеся форм-фактором, могут проявлять свойства полярности in situ в глазу (например, в сетчатке). В одном варианте осуществления по меньшей мере 1, 2, 3, 4, 5, 10 или 20% активных клеток проявляют полярность, например, согласно определению посредством известных в данной области техники способов, например, известных в данной области техники анализов с окрашиванием и микроскопией. В некоторых вариантах осуществления активные клетки, характеризующиеся форм-фактором, например, в виде кластера активных клеток, не проявляют полярность. В одном варианте осуществления по меньшей мере 1, 2, 3, 4, 5, 10 или 20% активных клеток проявляют полярность, например, согласно определению посредством известных в данной области техники способов, например, известных в данной области техники анализов с окрашиванием и микроскопией.
Активная клетка, например клетка RPE (например, сконструированная клетка RPE), может быть размещена на неклеточном носителе (например, микроносителе). В некоторых вариантах осуществления микроноситель представляет собой гранулу. В некоторых вариантах осуществления микроноситель содержит полимер, например, пластик (например, полистирол, полиэтилен, полиэфир, полипропилен), стекло, акриламид, диоксид кремния, силиконовый каучук, целлюлозу, декстран, коллаген (например, желатин) или гликозаминогликан. Форма или конфигурация микроносителя может быть любой, в том числе сферическая (например, гранула), в виде плоского диска, волокна, тканого диска или куба. В некоторых вариантах осуществления микроноситель может иметь полярную поверхность или заряженную поверхность (например, с отрицательным зарядом или положительным зарядом). В некоторых вариантах осуществления микроноситель может иметь гладкую поверхность или шероховатую поверхность. В некоторых вариантах осуществления активная клетка (например, сконструированная активная клетка) прикреплена к микроносителю за счет адсорбции белков клеточной поверхности (например, гликопротеинов, например, фибронектина) к поверхности микроносителя. Размер микроносителя может находиться в диапазоне от приблизительно 10 мкм до приблизительно 5 мм (например, от приблизительно 10 мкм до приблизительно 3 мм, от 10 мкм до приблизительно 1 мм, от 50 мкм до приблизительно 1 мм, от 100 мкм до приблизительно 1 мм, от 100 мкм до приблизительно 500 мкм).
Активная клетка (например, клетка RPE) может быть размещена на микроносителе (например, грануле, например, полистирольной грануле, например, микроносителе Cytodex® 1) с применением любого известного в данной области техники способа (см., например, Nilsson, K. (1988) Biotechnol Engineering Rev 6:404-439. Например, небольшое количество (например, приблизительно 1 г, приблизительно 5 г) микроносителя можно отвесить, промыть буфером и стерилизовать (например, посредством автоклава). Затем стерильный микроноситель можно несколько раз промыть буфером и средой перед введением популяции активных клеток (например, приблизительно 10 миллионов активных клеток, приблизительно 25 миллионов активных клеток, приблизительно 40 миллионов активных клеток, приблизительно 100 миллионов активных клеток). Затем смесь микроносителя и активных клеток можно осторожно перемешать и инкубировать (например, в стационарном инкубаторе) при определенной температуре (например, при 25°С, при 37°С). После инкубации смесь клеток и микроносителя можно перенести в колбу и осторожно перемешивать до объединения в имплантируемый элемент или внутри него (например, имплантируемый элемент, описанный в данном документе).
Терапевтические средства
Настоящее изобретение относится к активной клетке (например, клетке RPE), которая продуцирует или способна продуцировать терапевтическое средство для предупреждения или лечения заболевания, нарушения или состояния, описанных в данном документе. В одном варианте осуществления активная клетка (например, клетка RPE) является сконструированной активной клеткой (например, сконструированной клеткой RPE, сконструированной клеткой ARPE-19). Терапевтическое средство может представлять собой любое биологическое вещество, такое как нуклеиновая кислота (например, нуклеотид, ДНК или РНК), полипептид, липид, сахар (например, моносахарид, дисахарид, олигосахарид или полисахарид) или малая молекула, каждое из которых дополнительно уточняется ниже.
В некоторых вариантах осуществления активные клетки (например, сконструированные клетки RPE) продуцируют нуклеиновую кислоту. Нуклеиновая кислота, продуцируемая активной клеткой, описанной в данном документе, может быть разного размера и содержать один или более нуклеозидов или нуклеотидов, например, больше 2, 3, 4, 5, 10, 25, 50 или более нуклеозидов или нуклеотидов. В некоторых вариантах осуществления нуклеиновая кислота представляет собой, например, короткий фрагмент РНК или ДНК и может применяться в качестве репортер или для диагностических целей. Иллюстративные нуклеиновые кислоты включают один нуклеозид или нуклеотид (например, аденозин, тимидин, цитидин, гуанозин, уридинмонофосфат, инозинмонофосфат), РНК (например, mRNA, siRNA, miRNA, RNAi) и ДНК (например, вектор, хромосомную ДНК). В некоторых вариантах осуществления средняя молекулярная масса нуклеиновой кислоты составляет приблизительно 0,25 кДа, 0,5 кДа, 1 кДа, 1,5 кДа, 2 кДа, 2,5 кДа, 5 кДа, 10 кДа, 25 кДа, 50 кДа, 100 кДа, 150 кДа, 200 кДа или более.
В некоторых вариантах осуществления терапевтическое средство представляет собой пептид или полипептид (например, белок), такой как гормон, фермент, цитокин (например, провоспалительный цитокин или противовоспалительный цитокин), фактор роста, фактор свертывания или липопротеин. Пептид или полипептид (например, белок), продуцируемый клеткой RPE, может иметь встречающуюся в природе аминокислотную последовательность или может содержать мутацию, делецию или добавление аминокислоты относительно встречающейся в природе последовательности. Кроме того, пептид или полипептид (например, белок) для применения по настоящему изобретению может быть модифицирован тем или иным образом, например, посредством химической или ферментативной модификации (например, с помощью гликозилирования, фосфорилирования). В некоторых вариантах осуществления пептид содержит приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 45 или 50 аминокислот. В некоторых вариантах осуществления средняя молекулярная масса белка составляет 5 кДа, 10 кДа, 25 кДа, 50 кДа, 100 кДа, 150 кДа, 200 кДа, 250 кДа, 500 кДа или более.
В некоторых вариантах осуществления белок представляет собой гормон. Иллюстративные гормоны включают антидиуретический гормон (ADH), окситоцин, гормон роста (GH), пролактин, рилизинг гормон гормона роста (GHRH), тиреотропный гормон (TSH), тиреотропин-рилизинг гормон (TRH), адренокортикотропный гормон (ACTH), фолликулостимулирующий гормон (FSH), лютеинизирующий гормон (LH), рилизинг гормон лютеинизирующего гормона (LHRH), тироксин, кальцитонин, паратиреоидный гормон, альдостерон, кортизол, эпинефрин, глюкагон, инсулин, эстроген, прогестерон, тестостерон. В некоторых вариантах осуществления белок представляет собой инсулин (например, А-цепь инсулина, В-цепь инсулина или проинсулин). В некоторых вариантах осуществления белок представляет собой гормон роста, такой как гормон роста человека (hGH), рекомбинантный гормон роста человека (rhGH), гормон роста крупного рогатого скота, метионин-содержащий гормон роста человека, дез-фенилаланин-гормон роста человека и гормон роста свиней. В некоторых вариантах осуществления белок не представляет собой инсулин (например, А-цепь инсулина, В-цепь инсулина или проинсулин).
В некоторых вариантах осуществления белок представляет собой фактор роста, например, фактор роста эндотелия сосудов (VEGF), фактор роста нервов (NGF), фактор роста тромбоцитов (PDGF), фактор роста фибробластов (FGF), фактор роста эпидермиса (EGF) трансформирующий фактор роста (TGF) и инсулиноподобный фактор роста-I и -II (IGF-I и IGF-II).
В некоторых вариантах осуществления белок представляет собой фактор свертывания или фактор коагуляции, например, фактор свертывания крови или фактор коагуляции крови. В некоторых вариантах осуществления белок представляет собой белок, вовлеченный в коагуляцию, т. е. в процесс, при котором кровь превращается из жидкости в твердое вещество или гель. Иллюстративные факторы свертывания и факторы коагуляции включают фактор I (например, фибриноген), фактор II (например, протромбин), фактор III (например, тканевой фактор), фактор V (например, проакселерин, лабильный фактор), фактор VI, фактор VII (например, стабильный фактор, проконвертин), фактор VIII (например, антигемофильный фактор A), фактор VIIIC, фактор IX (например, антигемофильный фактор B), фактор X (например, фактор Стюарта-Прауэр), фактор XI (например, плазменный предшественник тромбопластина), фактор XII (например, фактор Хагермана), фактор XIII (например, фибрин-стабилизирующий фактор), фактор фон Виллебранда, прекалликреин, кофактор гепарина II, высокомолекулярный кининоген (например, фактор Фицджеральда), антитромбин III и фибронектин. В некоторых вариантах осуществления белок представляет собой фактор, препятствующий свертыванию крови, такой как белок С.
В некоторых вариантах осуществления белок представляет собой молекулу антитела. Используемый в данном документе термин "молекула антитела" относится к белку, например, цепи иммуноглобулина или ее фрагменту, содержащему по меньшей мере одну последовательность вариабельного домена иммуноглобулина. Термин "молекула антитела" включает, например, моноклональное антитело (в том числе полноразмерное антитело, которое имеет Fc-область иммуноглобулина). В одном варианте осуществления молекула антитела содержит полноразмерное антитело или полноразмерную цепь иммуноглобулина. В одном варианте осуществления молекула антитела содержит антигенсвязывающий или функциональный фрагмент полноразмерного антитела или полноразмерной цепи иммуноглобулина. В одном варианте осуществления молекула антитела представляет собой молекулу моноспецифического антитела и связывает один эпитоп, например, молекулу моноспецифического антитела, содержащую совокупность последовательностей вариабельных доменов иммуноглобулина, каждая из которых связывает один и тот же эпитоп.
В одном варианте осуществления молекула антитела представляет собой молекулу мультиспецифического антитела, например, она содержит совокупность последовательностей вариабельных доменов иммуноглобулина, где первая последовательность вариабельного домена иммуноглобулина из совокупности характеризуется специфичностью связывания для первого эпитопа, и вторая последовательность вариабельного домена иммуноглобулина из совокупности характеризуется специфичностью связывания для второго эпитопа. В одном варианте осуществления первый и второй эпитопы находятся на одном и том же антигене, например, на одном и том же белке (или субъединице мультимерного белка). В одном варианте осуществления молекула мультиспецифического антитела содержит третий, четвертый или пятый вариабельный домен иммуноглобулина. В одном варианте осуществления молекула мультиспецифического антитела представляет собой молекулу биспецифического антитела, молекулу триспецифического антитела или молекулу тетраспецифического антитела.
Активные клетки, описанные в данном документе, могут продуцировать различные типы молекул антител, в том числе цельные иммуноглобулины любого класса, их фрагменты и синтетические белки, содержащие по меньшей мере антигенсвязывающий вариабельный домен антитела. Молекула антитела может представлять собой антитело, например антитело IgG, такое как IgG1, IgG2, IgG3 или IgG4. Молекула антитела может быть в форме антигенсвязывающего фрагмента, в том числе фрагмента Fab, фрагмента F(ab')2, одноцепочечной вариабельной области и т. п. Антитела могут быть поликлональными или моноклональными (mAb). Моноклональные антитела могут включать "химерные" антитела, у которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных от конкретного вида или принадлежащих конкретному классу или подклассу антител, тогда как оставшаяся часть цепи(-ей) идентична или гомологична соответствующим последовательностям в антителах, полученных от другого вида или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они специфически связывают целевой антиген и/или проявляют требуемую биологическую активность. В некоторых вариантах осуществления молекула антитела представляет собой однодоменное антитело (например, нанотело). Описанные антитела также могут быть модифицированы с помощью рекомбинантных способов, например, с помощью осуществления делеций, добавлений или замен аминокислот для повышения эффективности антитела в опосредовании требуемой функции. Иллюстративные антитела включают антитело к бета-галактозидазе, антитело к коллагену, антитело к CD14, антитело к CD20, антитело к CD40, антитело к HER2, антитело к IL-1, антитело к IL-4, антитело к IL6, антитело к IL-13, антитело к IL17, антитело к IL18, антитело к IL-23, антитело к IL-28, антитело к IL-29, антитело к IL-33, антитело к EGFR, антитело к VEGF, антитело к CDF, антитело к флагеллину, антитело к IFN-α, антитело к IFN-β, антитело к IFN-γ, антитело к маннозному рецептору, антитело к VEGF, антитело к TLR1, антитело к TLR2, антитело к TLR3, антитело к TLR4, антитело к TLR5, антитело к TLR6, антитело к TLR9, антитело к PDF, антитело к PD1, антитело к PDL-1 или антитело к фактору роста нервов. В некоторых вариантах осуществления антитело представляет собой антитело к фактору роста нервов (например, фулранумаб, фасинумаб, танезумаб).
В некоторых вариантах осуществления белок представляет собой цитокин, или цитокиновый рецептор, или химерный белок, включающий цитокины или их рецепторы, в том числе, например, фактор-альфа и -бета некроза опухоли, их рецепторы и их производные, ренин; липопротеины; колхицин; кортикотропин; вазопрессин; соматостатин; липрессин; панкреозимин; леупролид; альфа-1-антитрипсин; атриальный натрийуретический пептид; легочный сурфактант; активатор плазминогена, отличный от активатора плазминогена тканевого типа (t-PA), например, урокиназу; бомбезин; тромбин; энкефалиназу; RANTES (регулируется после активации, в норме экспрессируется и секретируется в Т-клетках); воспалительный белок макрофагов человека (MIP-1-альфа); сывороточный альбумин, такой как сывороточный альбумин человека; мюллеровскую ингибирующую субстанцию; А-цепь релаксина; B-цепь релаксина; прорелаксин; гонадотропин-ассоциированный пептид мыши; хорионический гонадотропин; микробный белок, такой как бета-лактамаза; ДНКазу; ингибин; активин; рецепторы для гормонов или факторов роста; интегрин; белок А или D; ревматоидные факторы; фактор роста тромбоцитов (PDGF); эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF), такой как TGF-α и TGF-β, в том числе TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулиноподобный фактор роста-I и -II (IGF-I и IGF-II); дез(1-3)-IGF-I (IGF-I головного мозга), белки, связывающие инсулиноподобный фактор роста; белки CD, такие как CD-3, CD-4, CD-8 и CD-19; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; интерферон, такой как интерферон-альфа (например, интерферон-альфа-2А), -бета, -гамма, -лямбда и консенсусный интерферон; колониестимулирующие факторы (CSF), например M-CSF, GM-CSF и G-CSF; интерлейкины (IL), например IL-1 - IL-10; супероксиддисмутазу; Т-клеточные рецепторы; поверхностные мембранные белки; фактор распада; транспортные белки; "хоминг"- рецепторы; адрессины; ингибиторы фертильности, такие как простагландины; стимуляторы фертильности; регуляторные белки; антитела (в том числе их фрагменты) и химерные белки, такие как иммуноадгезины; предшественники, производные, пролекарства и аналоги этих соединений и фармацевтически приемлемые соли этих соединений или их предшественники, производные, пролекарства и аналоги. Подходящие белки или пептиды могут быть нативными или рекомбинантными и включать, например, слитые белки, например, аминокислотную последовательность терапевтического полипептида, слитую с последовательностью белка, отличного от терапевтического, например, аминокислотной последовательностью Fc-области (например, SEQ ID NO:34) или аминокислотной последовательностью альбумина (например, SEQ ID NO:35). Такие слитые белки могут содержать спейсерную аминокислотную последовательность между аминокислотными последовательностями терапевтического и отличного от терапевтического белка.
Примеры полипептида (например, белка), продуцируемого активной клеткой (например, клеткой RPE), включают CCL1, CCL2 (MCP-1), CCL3 (MIP-1α), CCL4 (MIP-1β), CCL5 (RANTES), CCL6, CCL7, CCL8, CCL9 (CCL10), CCL11, CCL12, CCL13, CCL14, CCL15, CCL16, CCL17, CCL18, CCL19, CCL20, CCL21, CCL22, CCL23, CCL24, CCL25, CCL26, CCL27, CCL28, CXCL1 (KC), CXCL2 (SDF1a), CXCL3, CXCL4, CXCL5, CXCL6, CXCL7, CXCL8 (IL8), CXCL9, CXCL10, CXCL11, CXCL12, CXCL13, CXCL14, CXCL15, CXCL16, CXCL17, CX3CL1, XCL1, XCL2, TNFA, TNFB (LTA), TNFC (LTB), TNFSF4, TNFSF5 (CD40LG), TNFSF6, TNFSF7, TNFSF8, TNFSF9, TNFSF10, TNFSF11, TNFSF13B, EDA, IL2, IL15, IL4, IL13, IL7, IL9, IL21, IL3, IL5, IL6, IL11, IL27, IL30, IL31, OSM, LIF, CNTF, CTF1, IL12a, IL12b, IL23, IL27, IL35, IL14, IL16, IL32, IL34, IL10, IL22, IL19, IL20, IL24, IL26, IL29, IFNL1, IFNL2, IFNL3, IL28, IFNA1, IFNA2, IFNA4, IFNA5, IFNA6, IFNA7, IFNA8, IFNA10, IFNA13, IFNA14, IFNA16, IFNA17, IFNA21, IFNB1, IFNK, IFNW1, IFNG, IL1A (IL1F1), IL1B (IL1F2), IL1Ra (IL1F3), IL1F5 (IL36RN), IL1F6 (IL36A), IL1F7 (IL37), IL1F8 (IL36B), IL1F9 (IL36G), IL1F10 (IL38), IL33 (IL1F11), IL18 (IL1G), IL17, KITLG, IL25 (IL17E), CSF1 (M-CSF), CSF2 (GM-CSF), CSF3 (G-CSF), SPP1, TGFB1, TGFB2, TGFB3, CCL3L1, CCL3L2, CCL3L3, CCL4L1, CCL4L2, IL17B, IL17C, IL17D, IL17F, AIMP1 (SCYE1), MIF, Areg, BC096441, Bmp1, Bmp10, Bmp15, Bmp2, Bmp3, Bmp4, Bmp5, Bmp6, Bmp7, Bmp8a, Bmp8b, C1qtnf4, Ccl21a, Ccl27a, Cd70, Cer1, Cklf, Clcf1, Cmtm2a, Cmtm2b, Cmtm3, Cmtm4, Cmtm5, Cmtm6, Cmtm7, Cmtm8, Crlf1, Ctf2, Ebi3, Edn1, Fam3b, Fasl, Fgf2, Flt3l, Gdf10, Gdf11, Gdf15, Gdf2, Gdf3, Gdf5, Gdf6, Gdf7, Gdf9, Gm12597, Gm13271, Gm13275, Gm13276, Gm13280, Gm13283, Gm2564, Gpi1, Grem1, Grem2, Grn, Hmgb1, Ifna11, Ifna12, Ifna9, Ifnab, Ifne, Il17a, Il23a, Il25, Il31, Iltifb, Inhba, Lefty1, Lefty2, Mstn, Nampt, Ndp, Nodal, Pf4, Pglyrp1, Prl7d1, Scg2, Scgb3a1, Slurp1, Spp1, Thpo, Tnfsf10, Tnfsf11, Tnfsf12, Tnfsf13, Tnfsf13b, Tnfsf14, Tnfsf15, Tnfsf18, Tnfsf4, Tnfsf8, Tnfsf9, Tslp, Vegfa, Wnt1, Wnt2, Wnt5a, Wnt7a, Xcl1, эпинефрин, мелатонин, трийодтиронин, простагландин, лейкотриен, простациклин, тромбоксан, островковый амилоидный полипептид, мюллеровский ингибирующий фактор или гормон, адипонектин, кортикотропин, ангиотензин, вазопрессин, аргинин-вазопрессин, атриопептин, натрийуретический пептид головного мозга, кальцитонин, холецистокинин, кортистатин, энкефалин, эндотелин, эритропоэтин, фолликулостимулирующий гормон, галанин, желудочный ингибиторный полипептид, гастрин, грелин, глюкагон, глюкагон-подобный пептид-1, гонадотропин-рилизинг гормон, гепцидин, хорионический гонадотропин человека, плацентарный лактоген человека, ингибин, соматомедин, лептин, липотропин, меланоцит-стимулирующий гормон, мотилин, орексин, окситоцин, полипептид поджелудочной железы, пептид, активирующий аденилатциклазу гипофиза, релаксин, ренин, секретин, соматостатин, тромбопоэтин, тиреотропин, тиреотропин-рилизинг гормон, вазоактивный пептид кишечника, андроген, альфаглюкозидазу (также известную как кислотная мальтаза), гликогенфосфорилазу, гликоген-деветвящий фермент, фосфофруктокиназу, фосфоглицераткиназу, фосфоглицератмутазу, лактатдегидрогеназу, карнитинпалимитилтрансферазу, карнитин и миоаденилатдеаминазу.
В некоторых вариантах осуществления белок представляет собой средство заместительной терапии или заместительный белок. В некоторых вариантах осуществления средство заместительной терапии или заместительный белок представляют собой фактор свертывания или фактор коагуляции, например, vWF (предусматривает встречающийся в природе фактор vWF человека или его вариант), фактор VII (например, предусматривает аминокислотную последовательность встречающуюся в природе фактора VII человека или ее вариант), фактор VIII (например, предусматривает аминокислотную последовательность встречающегося в природе фактора VIII человека или ее вариант) или фактор IX (например, предусматривает аминокислотную последовательность встречающегося в природе фактора IX человека или ее вариант).
В некоторых вариантах осуществления активная клетка (например, клетка RPE) сконструирована для экспрессии белка фактора VIII человека, например, рекомбинантного белка фактора VIII. В некоторых вариантах осуществления рекомбинантный белок фактора VIII представляет собой рекомбинантный белок фактора VIII с делецией B-домена (FVIII-BDD) или его вариант. В некоторых вариантах осуществления активная клетка представляет собой сконструированную клетку RPE (например, полученную из линии клеток ARPE-19) и содержит экзогенную последовательность нуклеиновой кислоты, которая кодирует аминокислотную последовательность FVIII-BDD, представленную на ФИГ. 3 (SEQ ID NO: 1), или кодирует одну из одноцепочечных аминокислотных последовательностей FVIII-BDD, изложенных под SEQ ID NO:3, 4, 5 и 6.
В некоторых вариантах осуществления активная клетка (например, клетка ARPE-19) сконструирована для экспрессии белка фактора IX, например, белка фактора IX (FIX) человека дикого типа или его встречающегося в природе полиморфного варианта (например, с заменой треонина на аланин в аминокислотном положении 148 зрелого белка, представленного на ФИГ. 4, что соответствует аминокислотному положению 194 в последовательности предшественника FIX, изложенной под SEQ ID NO:2).
В некоторых вариантах осуществления активная клетка (например, клетка ARPE-19) сконструирована для экспрессии варианта с приобретением функции (GIF) белка FIX дикого типа (FIX-GIF), где вариант GIF характеризуется более высокой специфической активностью, чем соответствующий FIX дикого типа. В некоторых вариантах осуществления активная клетка представляет собой сконструированную клетку RPE (например, полученную из линии клеток ARPE-19) и содержит экзогенную последовательность нуклеиновой кислоты, которая кодирует вариантную аминокислотную последовательность (фактор IX Padua), изложенную под SEQ ID NO: 2.
В некоторых вариантах осуществления активная клетка (например, клетка ARPE-19) сконструирована для экспрессии усеченного варианта vWF, например, состоящего из доменов D1-D3 (например, SEQ ID NO:33) или состоящего из D´D3 (например, SEQ ID NO:32).
В некоторых вариантах осуществления средство заместительной терапии или заместительный белок представляет собой фермент, например, альфа-галактозидазу, альфа-L-идуронидазу (IDUA) или N-сульфоглюкозаминсульфогидролазу (SGSH). В некоторых вариантах осуществления средство заместительной терапии или заместительный белок представляет собой фермент, например, альфа-галактозидазу (например, альфа-галактозидазу А). В некоторых вариантах осуществления средство заместительной терапии или заместительный белок представляет собой цитокин (например, интерлейкин 2, например, SEQ ID NO:29) или антитело. В некоторых вариантах осуществления средство заместительной терапии или заместительный белок представляет собой полипептид паратиреоидного гормона (например, SEQ ID NO:30 или SEQ ID NO:31).
В некоторых вариантах осуществления терапевтическое средство представляет собой сахар, например, моносахарид, дисахарид, олигосахарид или полисахарид. В некоторых вариантах осуществления сахар предусматривает триозный, тетрозный, пентозный, гексозный или гептозный фрагмент. В некоторых вариантах осуществления сахар предусматривает линейный моносахарид или циклизованный моносахарид. В некоторых вариантах осуществления сахар предусматривает глюкозу, галактозу, фруктозу, рамнозу, маннозу, арабинозу, глюкозамин, галактозамин, сиаловую кислоту, маннозамин, глюкуроновую кислоту, галактозуроновую кислоту, маннуроновую кислоту или гулуроновую кислоту. В некоторых вариантах осуществления сахар присоединен к белку (например, N-связанный гликан или O-связанный гликан). Иллюстративные сахара включают глюкозу, галактозу, фруктозу, маннозу, рамнозу, сахарозу, рибозу, ксилозу, сиаловую кислоту, мальтозу, амилозу, инулин, фруктоолигосахарид, галактоолигосахарид, маннан, лектин, пектин, крахмал, целлюлозу, гепарин, гиалуроновую кислоту, хитин, амилопектин или гликоген. В некоторых вариантах осуществления терапевтическое средство представляет собой сахароспирт.
В некоторых вариантах осуществления терапевтическое средство представляет собой липид. Липид может быть гидрофобным или амфифильным и может образовывать третичную структуру, такую как липосома, везикула или мембрана, или может быть встроен в липосому, везикулу или мембрану. Липид может предусматривать жирную кислоту, глицеролипид, глицерофосфолипид, стероидный липид, пренольный липид, сфинголипид, сахаролипид, поликетид или сфинголипид. Примеры липидов, продуцируемых инкапсулированными клетками, включают анандамид, докозагексаеновую кислоту, простагландин, лейкотриен, тромбоксан, эйкозаноид, триглицерид, каннабиноид, фосфатидилхолин, фосфатидилэтаноламин, фосфатидилинозитол, фосфатидную кислоту, церамид, сфингомиелин, цереброзид, ганглиозид, эстроген, андростерон, тестостерон, холестерин, каротиноид, хинон, гидрохинон или убихинон.
В некоторых вариантах осуществления терапевтическое средство представляет собой малую молекулу. Малая молекула может включать природный продукт, продуцируемый клеткой. В некоторых вариантах осуществления малая молекула характеризуется слабой доступностью или не соответствует "правилу пяти" Липински (набор правил, используемых для оценки того, сможет ли малая молекула стать пероральным лекарственным средством для человека; см., например, Lipinski, C.A. et al (2001) Adv Drug Deliv 46:2-36). Иллюстративные природные продукты, являющиеся малыми молекулами, включают антибактериальное лекарственное средство (например, карумонам, даптомицин, фидаксомицин, фосфомицин, испамицин, микрономицина сульфат, миокамицин, мупиоцин, нетилмицина сульфат, тейкопланин, тиенамицин, рифамицин, эритромицин, ванкомицин), противопаразитарное лекарственное средство (например, артемизинин, ивермектин), противораковое лекарственное средство (например, доксорубицин, акларубицин, аминолаевулиновая кислота, арглабин, омацетаксина мепесукцинат, паклитаксел, пентостатин, пепломицин, ромидепсин, трабектдин, актиномицин D, блеомицин, хромомицин А, даунорубицин, лейковорин, неокарзиностатин, стрептозоцин, трабектедин, винбластин, винкристин), антидиабетическое лекарственное средство (например, воглибоз), лекарственное средство для центральной нервной системы (например, L-допа, галантамин, зиконтид), статин (например, мевастатин), противогрибковое лекарственное средство (например, фумагиллин, циклоспорин), 1-дезоксиноиримицин и теофиллин, стерины (холестерин, эстроген, тестерон). Дополнительные природные продукты, являющиеся малыми молекулами, описаны в Newman, D.J. and Cragg, M. (2016) J Nat Prod 79:629-661 и Butler, M.S. et al (2014) Nat Prod Rep 31:1612-1661, каждый из которых включен в данный документ посредством ссылке во всей своей полноте.
В некоторых вариантах осуществления активная клетка (например, клетка RPE) сконструирована для синтеза малой молекулы, отличной от белка или пептида. Например, в одном варианте осуществления активная клетка (например, клетка RPE) может продуцировать статин (например, тауростатин, правастатин, флувастатин или аторвастатин).
В некоторых вариантах осуществления терапевтическое средство представляет собой антиген (например, вирусный антиген, бактериальный антиген, грибковый антиген, растительный антиген, антиген окружающей среды или опухолевый антиген). Специалисты в данной области техники признают, что антиген является иммуностимулирующим, т. е. способен стимулировать иммунный ответ или обеспечивать эффективный иммунитет в отношении организма или молекулы, из которой он происходит. Антиген может представлять собой нуклеиновую кислоту, пептид, белок, сахар, липид или их комбинацию.
Активные клетки, например сконструированные активные клетки, например, сконструированные клетки RPE, описанные в данном документе, могут продуцировать одно терапевтическое средство или совокупность терапевтических средств. В некоторых вариантах осуществления активные клетки (например, клетки RPE) продуцируют одно терапевтическое средство. В некоторых вариантах осуществления кластер активных клеток (например, клеток RPE) содержит активные клетки, которые продуцируют одно терапевтическое средство. В некоторых вариантах осуществления по меньшей мере приблизительно 1%, 5%, 10%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 99% активных клеток (например, клеток RPE) в кластере продуцируют одно терапевтическое средство (например, терапевтическое средство, описанное в данном документе). В некоторых вариантах осуществления активные клетки (например, клетки RPE) продуцируют совокупность терапевтических средств, например, по меньшей мере, 2, 3, 4, 5, 6, 7, 8, 9 или 10 терапевтических средств. В некоторых вариантах осуществления кластер активных клеток (например, клеток RPE) содержит активные клетки, которые продуцируют совокупность терапевтических средств. В некоторых вариантах осуществления по меньшей мере приблизительно 1%, 5%, 10%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 99% активных клеток (например, клеток RPE) в кластере продуцируют совокупность терапевтических средств (например, терапевтическое средство, описанное в данном документе).
Терапевтические средства могут быть родственными или могут образовывать комплекс. В некоторых вариантах осуществления терапевтическое средство секретируется или высвобождается из активной клетки (например, клетки RPE) в виде активной формы. В некоторых вариантах осуществления терапевтическое средство секретируется или высвобождается из активной клетки (например, клетки RPE) в виде неактивной формы, например, в качестве пролекарства. В последнем случае терапевтическое средство может активироваться нижележащим средством, таким как фермент. В некоторых вариантах осуществления терапевтическое средство не секретируется и не высвобождается из активной клетки (например, клетки RPE), а сохраняется внутриклеточно. Например, терапевтическое средство может представлять собой фермент, вовлеченный в детоксикацию или метаболизм нежелательного вещества, а детоксикация или метаболизм нежелательного вещества происходит внутриклеточно.
Имплантируемые элементы
В настоящем изобретении предусмотрены активные клетки (например, сконструированные активные клетки, например, сконструированные клетки RPE), полностью или частично размещенные в пределах имплантируемого элемента или на нем. Имплантируемый элемент может содержать заключающий элемент, который инкапсулирует или покрывает активную клетку (например, клетку RPE), частично или полностью. В одном варианте осуществления имплантируемый элемент содержит заключающий компонент, который формуется или может быть сформован in situ на активной клетке, например, совокупности активных клеток, например, кластере активных клеток или на микроносителе, например, грануле или матрице, содержащих активную клетку или активные клетки или вокруг них (обозначается в данном документе как "инкапсулированный in-situ имплантируемый элемент").
Иллюстративные имплантируемые элементы и заключающие компоненты содержат такие материалы, как металлы, металлические сплавы, керамические материалы, полимеры, волокна, инертные материалы и их комбинации. Имплантируемый элемент можно применять для инкапсуляции активной клетки (например, сконструированной активной клетки, например, сконструированной клетки RPE) или кластера активных клеток (например, сконструированных активных клеток, например, сконструированных клеток RPE). Имплантируемый элемент может полностью состоять из одного типа материала, или может просто обозначать поверхность или поверхность имплантируемого элемента (например, наружную поверхность или внутреннюю поверхность). В некоторых вариантах осуществления имплантируемый элемент химически модифицирован, например, с помощью соединения, описанного в данном документе.
В некоторых вариантах осуществления материал представляет собой металл или металлический сплав. Иллюстративные металлы или металлические сплавы включают титан и сплавы титановой группы (например, нитинол, никель-титановые сплавы, материалы на основе сплавов с термопамятью), платину, сплавы платиновой группы, нержавеющую сталь, тантал, палладий, цирконий, ниобий, молибден, никель-хром, хром-молибденовые сплавы или определенные сплавы кобальта (например, кобальт-хромовые и кобальт-хром-никелевые сплавы, например Elgiloy® и Phynox®). Например, металлическим материал может представлять собой нержавеющую сталь марки 316 (SS 316L) (состоящую из Fe, <0,3% C, 16-18,5% Cr, 10-14% Ni, 2-3% Мо, <2% Mn, < 1% Si, <0,45% P и <0,03% S).
В некоторых вариантах осуществления материал представляет собой керамику. Иллюстративные керамические материалы включают оксиды, карбиды или нитриды переходных элементов, такие как оксиды титана, оксиды гафния, оксиды иридия, оксиды хрома, оксиды алюминия и оксиды циркония. Также можно применять материалы на основе кремния, такие как диоксид кремния.
В некоторых вариантах осуществления материал представляет собой полимер. Полимер может быть линейным, разветвленным или сшитым полимером или полимером с выбранными диапазонами молекулярной массы, степенью полимеризации, вязкостью или скоростью течения расплава. Разветвленные полимеры могут предусматривать один или более из следующих типов: звездообразные полимеры, гребневые полимеры, полимерные щетки, древовидные полимеры, лестничные полимеры и дендримеры. Полимер может представлять собой термочувствительный полимер, например, гель (например, он становится твердым или жидким при воздействии тепла или определенной температуры) или фотосшиваемый полимер. Иллюстративные полимеры включают полистирол, полиэтилен, полипропилен, полиацетилен, поли(винилхлорид) (PVC), полиолефиновые сополимеры, поли(уретан)ы, полиакрилаты и полиметакрилаты, полиакриламиды и полиметакриламиды, поли(метилметакрилат), поли(2-гидроксиэтилметакрилат), сложные полиэфиры, полисилоксаны, полидиметилсилоксаны (PDMS), простые полиэфиры, сложные поли(ортоэфиры), поли(карбонаты), поли(гидроксиалканоат)ы, полифторуглероды, PEEK®, Teflon® (политетрафторэтилен, PTFE), PEEK, силиконы, эпоксидные смолы, Kevlar®, Dacron® (конденсационный полимер, полученный из этиленгликоля и терефталевой кислоты), полиэтиленгликоль, найлон, полиалкены, фенольные смолы, природные и синтетические эластомеры, адгезивы и герметики, полиолефины, полисульфоны, полиакрилонитрил, биополимеры, такие как полисахариды и природный латекс, коллаген, целлюлозные полимеры (например, типы алкилцеллюлозы и т. д.), полиэтиленгликоль и 2-гидроксиэтилметакрилат (HEMA), полисахариды, поли(гликолевую кислоту), поли(L-молочную кислоту) (PLLA), сополимер молочной и гликолевой кислоты (PLGA), полидиоксанон (PDA) или рацемическую поли(молочную кислоту), поликарбонаты (например, полиамиды (например, найлон)), фторопласты, углеродное волокно, агарозу, альгинат, хитозан и их смеси или сополимеры.
В некоторых вариантах осуществления материал представляет собой полиэтилен. Иллюстративные полиэтилены включают полиэтилен сверхнизкой плотности (ULDPE) (например, при этом полимеры характеризуются показателями плотности в диапазоне от 0,890 до 0,905 г/см3 и содержат сомономер); полиэтилен очень низкой плотности (VLDPE) (например, при этом полимеры характеризуются показателями плотности в диапазоне от 0,905 до 0,915 г/см3 и содержат сомономер); линейный полиэтилен низкой плотности (LLDPE) (например, при этом полимеры характеризуются показателями плотности в диапазоне от 0,915 до 0,935 г/см3 и содержат сомономер); полиэтилен низкой плотности (LDPE) (например, при этом полимеры характеризуются показателями плотности в диапазоне от приблизительно 0,915 до 0,935 г/м3); полиэтилен средней плотности (MDPE) (например, при этом полимеры характеризуются показателями плотности в диапазоне от 0,926 до 0,940 г/см3 и могут содержать или не содержать сомономер); полиэтилен высокой плотности (HDPE) (например, при этом полимеры характеризуются показателями плотности в диапазоне от 0,940 до 0,970 г/см3 и могут содержать или не содержать сомономер).
В некоторых вариантах осуществления материал представляет собой полипропилен. Иллюстративные полипропилены включают гомополимеры, статистические сополимеры (гомофазные сополимеры) и ударопрочные сополимеры (гетерофазные сополимеры), например, описываемые в McKeen, Handbook of Polymer Applications in Medicine and Medical Devices, 3- Plastics Used in Medical Devices, (2014):21-53, который включен в данный документ посредством ссылки во всей своей полноте.
В некоторых вариантах осуществления материал представляет собой полистирол. Иллюстративные полистиролы включают полистирол общего назначения или кристаллический полистирол (PS или GPPS), высокоударопрочный (HIPS) и синдиотактический (SPS) полистирол.
В некоторых вариантах осуществления материал представляет собой термопластичный эластомер (TPE). Иллюстративные TPE включают: (i) TPA - полиамидный TPE, содержащий блок-сополимер из чередующихся жестких и мягких сегментов с амидными химическими связями в жестких блоках и эфирными и/или сложноэфирными связями в мягких блоках; (ii) TPC - сополиэфирный TPE, состоящий из блок-сополимера из чередующихся жестких сегментов и мягких сегментов, причем химические связи в основной цепи представляют собой сложноэфирные и/или эфирные; (iii) TPO - олефиновый TPE, состоящий из смеси полиолефина и обычного каучука, причем каучуковая фаза в смеси характеризуется незначительным сшиванием или его отсутствием; (iv) TPS - стирольный TPE, состоящий из по меньшей мере трехблочного сополимера стирола и специфического диена, где два концевых блока (жесткие блоки) представляют собой полистирол, а внутренний блок (мягкий блок или блоки) представляет собой полидиен или гидрогенизованный полидиен; (v) TPU - уретановый TPE, состоящий из блок-сополимера из чередующихся жестких и мягких сегментов с уретановыми химическими связями в жестких блоках и эфирными, сложноэфирными или карбонатными связями или их смесями в мягких блоках; (vi) TPV - вулканизат термопластичного каучука, состоящий из смеси термопластичного материала и обычного каучука, в котором каучук был сшит в процессе динамической вулканизации на стадии составления смеси и смешивания; и (vii) TPZ - неклассифицированный TPE, содержащий любую композицию или структуру, отличную от таковой в группах TPA, TPC, TPO, TPS, TPU и TPV.
В некоторых вариантах осуществления материал представляет собой полимер, а полимер представляет собой альгинат. Альгинат представляет собой полисахарид, состоящий из β-D-маннуроновой кислоты (M) и α-L-гулуроновой кислоты (G). В некоторых вариантах осуществления альгинат представляет собой альгинат с высоким содержанием гулуроновой кислоты (G), и содержание гулуроновой кислоты (G) превышает приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или более. В некоторых вариантах осуществления альгинат представляет собой альгинат с высоким содержанием маннуроновой кислоты (G), и содержание маннуроновой кислоты (G) превышает приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или более. В некоторых вариантах осуществления отношение M:G составляет приблизительно 1. В некоторых вариантах осуществления отношение M:G составляет меньше 1. В некоторых вариантах осуществления отношение M:G больше 1.
Полимер может быть ковалентно или нековалентно связан с заключающим компонентом имплантируемого элемента (например, поверхностью). В некоторых вариантах осуществления полимер ковалентно связан с заключающим компонентом имплантируемого элемента (например, на внутренней поверхности или внешней поверхности имплантируемого элемента). В некоторых вариантах осуществления полимер нековалентно связан с заключающим компонентом имплантируемого элемента (например, на внутренней поверхности или внешней поверхности имплантируемого элемента). Полимер может наноситься посредством целого ряда методик, применимых в данной области техники, в том числе без ограничения распыления, смачивания, окунания, погружения, такого как нанесение покрытия погружением (например, интраоперационное нанесение покрытия посредством погружения), окрашивания или иного способа нанесения гидрофобного полимера на поверхность заключающего компонента или на имплантируемый элемент сам по себе.
Активные клетки (например, клетки RPE), описанные в данном документе, могут быть инкапсулированы или содержаться, частично или полностью, в пределах заключающего компонента или имплантируемого устройства, содержащего материал или целый ряд компонентов или материалов. Иллюстративные компоненты или материалы могут выполнять только структурную, терапевтическую функции или могут предусматривать обе функции. Заключающий компонент или имплантируемый элемент могут содержать компонент, являющийся биомолекулой, например, углевод, например, полисахарид, например, полисахарид морского происхождения, например, альгинат, агар, агарозу, каррагинаны, целлюлозу и амилозу, хитин и хитозан; сшитые полисахариды, например, сшитые с помощью диакрилатов; или полисахарид или его производное/модификацию, описанные, например, в Laurienzo (2010), Mar. Drugs. 8.9:2435-65.
В одном варианте осуществления имплантируемый элемент содержит заключающий компонент, который содержит гибкий полимер, например, альгинат (например, химически модифицированный альгинат), PLA, PLG, PEG, CMC или их смеси (обозначается в данном документе как "инкапсулированное в полимерную оболочку имплантируемое устройство").
В одном варианте осуществления имплантируемый элемент содержит заключающий компонент, который формуется или может быть сформован in situ на активной клетке, например, совокупности активных клеток, например, кластере активных клеток или на микроносителе, например, грануле или матрице, содержащих активную клетку или активные клетки или вокруг них (обозначается в данном документе как "инкапсулированный in-situ имплантируемый элемент").
В варианте осуществления имплантируемый элемент содержит заключающий компонент, который предварительно сформован перед объединением с заключаемой активной клеткой, например, совокупностью активных клеток, например, кластером активных клеток, или микроносителем, например, гранулой или матрицей, содержащей активную клетку (обозначается в данном документе как имплантируемый элемент на основе устройства).
Имплантируемый элемент может включать белок или полипептид, например, антитело, белок, фермент или фактор роста. Имплантируемый элемент может включать активный или неактивный фрагмент белка или полипептида, такого как глюкозооксидаза (например, в случае сенсора глюкозы), киназа, фосфатаза, оксигеназа, гидрогеназа, редуктаза.
Имплантируемые элементы могут включать любой материал, такой как материал, описанный в данном документе. В некоторых вариантах осуществления имплантируемый элемент состоит из одного материала или множества типов материалов. В некоторых вариантах осуществления имплантируемый элемент содержит полимерный (например, гидрогелевый, пластиковый) компонент. Иллюстративные полимеры включают полиэтилен, полипропилен, полистирол, полиэфир (например, PLA, PLG или PGA, полигидроксиалканоаты (PHA) или другие биопоглощаемые пластики), поликарбонат, поливинилхлорид (PVC), полиэфирсульфон (PES), полиакрилат (например, акрил или PMMA), гидрогель (например, акриловый полимер или смесь акриловых и силиконовых полимеров), полисульфон, полиэфирэфиркетон, термопластичные эластомеры (TPE или TPE), термореактивный эластомер (например, силикон (например, силиконовый эластомер)), поли-п-ксилилен (Парилен), фторполимеры (например, PTFE) и полиакрилы, такие как поли(акриловая кислота) и/или поли(акриламид), или их смеси.
Имплантируемые элементы могут содержать неорганические или металлические компоненты или материалы, например, сталь (например, нержавеющую сталь), титан, другой металл или сплав. Имплантируемые элементы могут включать компоненты или материалы, отличные от металлических, например, керамические или гидроксиапатитовые элементы.
Имплантируемые элементы могут включать компоненты или материалы, которые изготовлены из проводящего материала (например, золота, платины, палладия, титана, меди, алюминия, серебра, металлов, любые их комбинации и т. д.).
Имплантируемые элементы могут включать более одного компонента, например, более одного компонента, раскрытого в данном документе, например, более одного из металлического, пластикового, керамического, композитного или гибридного материала.
В металлосодержащих имплантируемых элементах количество металла (например, в % по весу, фактический вес) может составлять по меньшей мере 5%, например, по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или более, например, вес/вес; меньше 20%, например меньше 20%, 15%, 10%, 5%, 1%, 0,5%, 0,1% или менее.
В пластикосодержащих имплантируемых элементах количество пластика (например, в % по весу, фактический вес) может составлять по меньшей мере 5%, например, по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или более, вес/вес; меньше 20%, например, меньше 20%, 15%, 10%, 5%, 1%, 0,5%, 0,1% или менее.
В керамикосодержащих имплантируемых элементах количество керамики (например, в % по весу, фактический вес) может составлять по меньшей мере 5%, например, по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или более, вес/вес; меньше 20%, например, меньше 20%, 15%, 10%, 5%, 1%, 0,5%, 0,1% или менее.
Имплантируемые элементы, включенные в данный документ, включают имплантируемые элементы, которые выполнены с полостью, например, полостью с одним, двумя или более отверстиями, например, трубчатые устройства. Типичный стент является примером устройства, выполненного с полостью и имеющего два отверстия. Другие примеры включают шунты.
Имплантируемые элементы, включенные в данный документ, включают гибкие имплантируемые элементы, например, которые выполнены для соответствия с формой тела.
Имплантируемые элементы, включенные в данный документ, включают компоненты, которые стабилизируют локализацию имплантируемого элемента, например, адгезив или крепежный элемент, например, крепеж на основе крутящего момента или на основе трения, например, винт или штифт.
Имплантируемые элементы, включенные в данный документ, могут быть выполнены с возможностью мониторинга вещества, например, экзогенного вещества, например, терапевтического средства или токсина, или эндогенного продукта в организме, например, инсулина. В некоторых вариантах осуществления имплантируемый элемент выполняет диагностическую функцию.
Имплантируемые элементы, включенные в данный документ, могут быть выполнены с возможностью высвобождения вещества, например, экзогенного вещества, например, терапевтического средства. В некоторых вариантах осуществления терапевтическое средство представляет собой соединение формулы (I) или его фармацевтически приемлемую соль. В некоторых вариантах осуществления терапевтическое средство представляет собой биологический материал. В некоторых вариантах осуществления терапевтическое средство представляет собой клетку, продукт клетки, ткань, продукт ткани, белок, гормон, фермент, антитело, фрагмент антитела, антиген, эпитоп, лекарственное средство, вакцину или любое их производное.
Имплантируемые элементы, описанные в данном документе, могут быть выполнены с возможностью изменения формы в ответ на сигнал или движение тела, например, искусственный сустав, например, коленный, тазобедренный или другой искусственный сустав.
Иллюстративные имплантируемые элементы включают стент, шунт, повязку, глазное устройство, порт, сенсор, устройство ортопедической фиксации, имплантат (например, зубной имплантат, глазной имплантат, силиконовый имплантат, имплантат роговицы, дермальный имплантат, внутрижелудочный имплантат, лицевой имплантат, имплантат тазобедренного сустава, костный имплантат, кохлеарный имплантат, имплантат полового члена, имплантаты для контроля недержания), устройство для покрытия кожи, среды для диализа, устройство для доставки лекарственного средства, искусственный или сконструированный орган (например, селезенку, почку, печень или сердце), дренажное устройство (например, устройство для дренирования мочевого пузыря), систему отбора клеток, адгезив (например, вяжущее средство, зажим, скобу), противозачаточное устройство, внутриматочное устройство, дефибриллятор, дозиметр, электрод, насос (например, инфузионный насос), фильтр, устройство для эмболизации, крепежный элемент, наполнители, фиксатор, графт, слуховой аппарат, кардиоустройство или связанное с сердцем устройство (например, кардиостимулятор, сердечный клапан), батарею или источник питания, гемостатическое средство, устройство, используемое при недержании, устройство для межпозвоночного спондилодеза, внутриротовое устройство, линзу, сетку, иглу, стимулятор нервной системы, пластырь, устройство доступа в брюшную полость, пластину, пробку, устройство для контроля давления, кольцо, транспондер и клапан. Также включены устройства, применяемые в одном или более из анестезиологии, кардиологии, клинической химии, отоларингологии, стоматологии, гастроэнтерологии, урологии, гематологии, иммунологии, микробиологии, неврологии, акушерства/гинекологии, офтальмологии, ортопедии, патологии, физической медицины, радиологии, общей или пластической хирургии, ветеринарной медицины, психиатрии, хирургии и/или клинической токсикологии.
В некоторых вариантах осуществления имплантируемый элемент включает инкапсулированные или захваченные клетки или ткани. Клетки или ткани могут быть инкапсулированы или захвачены в полимер. В некоторых вариантах осуществления имплантируемый элемент включает активную клетку (например, клетку RPE), например, активную клетку (например, клетку RPE), размещенную в пределах полимерного заключающего компонента (например, альгината).
В некоторых вариантах осуществления имплантируемый элемент нацелен или разработан для определенной системы организма, например, нервной системы (например, периферической нервной системы (PNS) или центральной нервной системы (CNS)), сосудистой системы, скелетной системы, дыхательной системы, эндокринной системы, лимфатической системы, репродуктивной системы или желудочно-кишечного тракта. В некоторых вариантах осуществления имплантируемый элемент нацелен на CNS. В некоторых вариантах осуществления имплантируемый элемент нацелен или разработан для определенной части тела, например крови, глаза, головного мозга, кожи, легкого, желудка, рта, уха, ноги, ступни, руки, печени, сердца, почки, кости, поджелудочной железы, селезенки, толстой кишки, тонкой кишки, спинного мозга, мышцы, яичника, матки, влагалища или полового члена.
Имплантируемые элементы, включенные в данный документ, включают устройства FDA класса 1, 2 или 3, например, устройства, которые являются неклассифицируемыми или не классифицированы или классифицированы как устройство для гуманитарного применения (HUD).
Особенности имплантируемых элементов
Компоненты или материалы, применяемые в имплантируемом элементе (или полностью составляющие имплантируемый элемент), могут быть оптимизированы с точки зрения одного или более из биосовместимости (например, для сведения к минимуму иммунного отторжения или фиброза); термостойкости; эластичности; прочности на растяжение; химической устойчивости (например, устойчивость к маслам, смазкам, дезинфицирующим средствам, отбеливателям, технологическим добавкам или другим химическим веществам, применяемым в производстве, применении, очистке, стерилизации и дезинфекции устройства); электрических свойств; поверхностной и объемной проводимости или удельного сопротивления, диэлектрической прочности; сравнительного показателя пробоя; механических свойств; срока годности, способности к стерилизации в течение длительного срока (например, способности выдерживать процессы стерилизации, такие как обработка паром, сухим жаром, этиленоксидом (EtO), электронным лучом и/или гамма-излучением, например, при сохранении свойств для целевого применения устройства, например, термостойкости в условиях автоклава/обработки паром, гидролитической стабильности при стерилизации паром, химической стойкости к EtO, стойкости к высокоэнергетическому излучению (например, к обработке электронным лучом, ультрафиолетом и гамма-излучением) или кристаллической структуры.
Имплантируемый элемент может собираться in vivo (например, представлять собой инъецируемое вещество, которое образует структурированную форму in vivo, например, при температуре тела) или ex vivo.
Имплантируемый элемент может характеризоваться размерными параметрами в нанометровом диапазоне, например, может предусматривать наночастицу, например, наночастицу, изготовленную из полимера, описанного в данном документе, например, PLA. Наночастицы могут представлять собой химически модифицированные наночастицы, например, модифицированные для предупреждения поглощения макрофагами и клетками Купфера (например, процесс, называемый опсонизацией) или изменения периода полувыведения наночастиц из кровообращения. Наночастицы могут включать наночастицы на основе железа (инъецируемые) (например, наночастицы на основе железа Advanced Magnetics). Иллюстративные наночастицы описаны в Veiseh et al (2010) Adv Drug Deliv Rev 62:284-304, который включен в данный документ посредством ссылки во всей своей полноте.
Имплантируемый элемент может быть выполнен с возможностью имплантации, или имплантирован, или размещен в сальнике субъекта, в подкожном жире субъекта, внутримышечно у субъекта. Имплантируемый элемент может быть выполнен с возможностью имплантации, или имплантирован, или размещен на или в следующем: коже; поверхности слизистой оболочки, полости тела, брюшной полости (например, сальниковой сумке); ЦНС, например, головном или спинном мозге; органе, например, сердце, печени, почке, селезенке, легком, лимфатической системе, сосудистом русле, ротовой полости, носовой полости, зубах, деснах, желудочно-кишечном тракте; кости; бедре; жировой ткани; мышечной ткани; циркулирующей крови; глазе (например, внутриглазное размещение); молочной железе, влагалище; матке, суставе, например, коленном или тазобедренном суставе, или позвоночнике. В некоторых вариантах осуществления имплантируемый элемент выполнен с возможностью имплантации или имплантирован или размещен в брюшной полости (например, сальниковой сумке).
Имплантируемый элемент может содержать электрохимический сенсор, например, электрохимический сенсор, включающий рабочий электрод и электрод сравнения. Например, электрохимический сенсор включает рабочий электрод и электрод сравнения, который реагирует с анализируемым веществом для получения результата измерения сенсора, связанного с концентрацией анализируемого вещества в жидкости, в которой находится устанавливаемое в глаз устройство. Имплантируемый элемент может содержать окно, например, из прозрачного полимерного материала, имеющего вогнутую поверхность и выпуклую поверхность, субстрат, например, по меньшей мере частично встроенный в прозрачный полимерный материал. Имплантируемый элемент также может содержать электронный модуль, включающий одно или более их антенны и контроллера, электрически связанного с электрохимическим сенсором и антенной, где контроллер выполнен с возможностью управления электрохимическим сенсором для получения результата измерения сенсора, связанного с концентрацией анализируемого вещества в жидкости, в которой находится имплантируемый элемент, например устанавливаемый имплантируемый элемент, и применения антенны для регистрации результата измерения сенсора.
В некоторых вариантах осуществления средний диаметр или размер имплантируемого элемента составляет больше 1 мм, предпочтительно 1,5 мм или более. В некоторых вариантах осуществления диаметр или размер имплантируемого элемента может достигать 8 мм. Например, размер имплантируемого элемента, описанного в данном документе находится в диапазоне от 1 мм до 8 мм, от 1 мм до 6 мм, от 1 мм до 5 мм, от 1 мм до 4 мм, от 1 мм до 3 мм, от 1 мм до 2 мм, от 1 мм до 1,5 мм, от 1,5 мм до 8 мм, от 1,5 мм до 6 мм, от 1,5 мм до 5 мм, от 1,5 мм до 4 мм, от 1,5 мм до 3 мм, от 1,5 мм до 2 мм, от 2 мм до 8 мм, от 2 мм до 7 мм, от 2 мм до 6 мм, от 2 мм до 5 мм, от 2 мм до 4 мм, от 2 мм до 3 мм, от 2,5 мм до 8 мм, от 2,5 мм до 7 мм, от 2,5 мм до 6 мм, от 2,5 мм до 5 мм, от 2,5 мм до 4 мм, от 2,5 мм до 3 мм, от 3 мм до 8 мм, от 3 мм до 7 мм, от 3 мм до 6 мм, от 3 мм до 5 мм, от 3 мм до 4 мм, от 3,5 мм до 8 мм, от 3,5 мм до 7 мм, от 3,5 мм до 6 мм, от 3,5 мм до 5 мм, от 3,5 мм до 4 мм, от 4 мм до 8 мм, от 4 мм до 7 мм, от 4 мм до 6 мм, от 4 мм до 5 мм, от 4,5 мм до 8 мм, от 4,5 мм до 7 мм, от 4,5 мм до 6 мм, от 4,5 мм до 5 мм, от 5 мм до 8 мм, от 5 мм до 7 мм, от 5 мм до 6 мм, от 5,5 мм до 8 мм, от 5,5 мм до 7 мм, от 5,5 мм до 6 мм, от 6 мм до 8 мм, от 6 мм до 7 мм, от 6,5 мм до 8 мм, от 6,5 мм до 7 мм, от 7 мм до 8 мм или от 7,5 мм до 8 мм. В некоторых вариантах осуществления средний диаметр или размер имплантируемого элемента находится в диапазоне от 1 мм до 8 мм. В некоторых вариантах осуществления средний диаметр или размер имплантируемого элемента находится в диапазоне от 1 мм до 4 мм. В некоторых вариантах осуществления средний диаметр или размер имплантируемого элемента находится в диапазоне от 1 мм до 2 мм.
В некоторых вариантах осуществления имплантируемый элемент содержит по меньшей мере одну пору или отверстие, например, для обеспечения свободного потока материалов. В некоторых вариантах осуществления средний размер пор имплантируемого элемента составляет от приблизительно 0,1 мкм до приблизительно 10 мкм. Например, средний размер пор может составлять от 0,1 мкм до 10 мкм, от 0,1 мкм до 5 мкм, от 0,1 мкм до 2 мкм, от 0,15 мкм до 10 мкм, от 0,15 мкм до 5 мкм, от 0,15 мкм до 2 мкм, от 0,2 мкм до 10 мкм, от 0,2 мкм до 5 мкм, от 0,25 мкм до 10 мкм, от 0,25 мкм до 5 мкм, от 0,5 мкм до 10 мкм, от 0,75 мкм до 10 мкм, от 1 мкм до 10 мкм, от 1 мкм до 5 мкм, от 1 мкм до 2 мкм, от 2 мкм до 10 мкм, от 2 мкм до 5 мкм или от 5 мкм до 10 мкм. В некоторых вариантах осуществления средний размер пор имплантируемого элемента составляет от приблизительно 0,1 мкм до 10 мкм. В некоторых вариантах осуществления средний размер пор имплантируемого элемента составляет от приблизительно 0,1 мкм до 5 мкм. В некоторых вариантах осуществления средний размер пор имплантируемого элемента составляет от приблизительно 0,1 мкм до 1 мкм.
В некоторых вариантах осуществления имплантируемый элемент способен предотвращать прохождение материалов, превышающих определенный размер, через пору или отверстие. В некоторых вариантах осуществления имплантируемый элемент способен предотвращать прохождение материалов, размер которых больше 50 кДа, 75 кДа, 100 кДа, 125 кДа, 150 кДа, 175 кДа, 200 кДа, 250 кДа, 300 кДа, 400 кДа, 500 кДа, 750 кДа, 1000 кДа.
Имплантируемый элемент (например, имплантируемый элемент, описанный в данном документе) может обеспечиваться в виде препарата или композиции для имплантации или введения субъекту. В некоторых вариантах осуществления по меньшей мере 20%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% имплантируемых элементов в препарате или композиции обладают характеристикой, описанной в данном документе, например, средним размером пор.
В некоторых вариантах осуществления имплантируемый элемент можно применять в течение различных периодов времени, находящихся в диапазоне от нескольких минут до нескольких лет. Например, имплантируемый элемент можно применять от приблизительно 1 часа до приблизительно 10 лет. В некоторых вариантах осуществления имплантируемый элемент применяют дольше, чем приблизительно 1 час, 2 часа, 4 часа, 8 часов, 16 часов, 1 день, 48 часов, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 1 неделя, 2 недели, 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 8 месяцев, 10 месяцев, 1 год, 18 месяцев, 2 года, 3 года, 4 года, 5 лет, 6 лет, 7 лет, 8 лет, 9 лет, 10 лет или более. Имплантируемый элемент может быть выполнен с сохранением на период имплантации, например, выполнен для противостояния фиброзной инактивации под действием фиброза в течение всего ожидаемого периода или его части.
В некоторых вариантах осуществления имплантируемый элемент легко извлекается из субъекта, например, не травмируя субъекта или не вызывая значительное разрушение окружающей ткани. В одном варианте осуществления имплантируемый элемент может быть извлечен с помощью минимального хирургического отделения имплантируемого элемента от окружающей ткани или без него, например, за счет минимально инвазивного хирургического вмешательства, экстракции или резекции.
Имплантируемый элемент может быть выполнен с возможностью ограниченного по времени воздействия (например, менее 2 дней, например, менее 2 дней, 1 дня, 24 часов, 20 часов, 16 часов, 12 часов, 10 часов, 8 часов, 6 часов, 5 часов, 4 часов, 3 часов, 2 часов, 1 часа или менее). Имплантируемый элемент может быть выполнен с возможностью длительного воздействия (например, по меньшей мере 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 1 месяц, 2 месяца, 3 месяца, 4 месяцев, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 12 месяцев, 13 месяцев, 14 месяцев, 15 месяцев, 16 месяцев, 17 месяцев, 18 месяцев, 19 месяцев, 20 месяцев, 21 месяц, 22 месяца, 23 месяца, 24 месяца, 1 год, 1,5 года, 2 года, 2,5 года, 3 года, 3,5 года, 4 года или более). Имплантируемый элемент может быть выполнен с возможностью постоянного воздействия (например, по меньшей мере 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 12 месяцев, 13 месяцев, 14 месяцев, 15 месяцев, 16 месяцев, 17 месяцев, 18 месяцев, 19 месяцев, 20 месяцев, 21 месяц, 22 месяца, 23 месяца, 24 месяца, 1 год, 1,5 года, 2 года, 2,5 года, 3 года, 3,5 года, 4 года или более).
В некоторых вариантах осуществления имплантируемый элемент не является имплантируемым элементом, раскрытым в любой из WO2012/112982, WO2012/167223, WO2014/153126, WO2016/019391, US2012-0213708, US 2016-0030359 и US 2016-0030360.
В варианте осуществления имплантируемый элемент содержит активную клетку (например, клетку RPE), описанную в данном документе. В одном варианте осуществления имплантируемый элемент содержит активную клетку (например, клетку RPE), а также другую клетку, например, рекомбинантную клетку или стволовую клетку, которая обеспечивает вещество, например, терапевтическое средство, описанное в данном документе.
В одном варианте осуществления активная клетка представляет собой клетку RPE человека (или клетку, полученную из нее, например, клетку ARPE-19), и полипептид представляет собой полипептид человека. В одном варианте осуществления активная клетка (например, клетка RPE) обеспечивает вещество, которое облегчает заболевание, нарушение или состояние (например, описанное в данном документе).
Химическая модификация имплантируемых элементов
Настоящее изобретение относится к имплантируемому элементу, содержащему активную клетку (например, клетку RPE), где имплантируемый элемент является химически модифицированным. Химическая модификация может придавать имплантируемому элементу улучшенное свойство при введении субъекту, например, модуляцию иммунного ответа у субъекта, по сравнению с немодифицированным имплантируемым элементом.
В некоторых вариантах осуществления поверхность имплантируемого элемента, содержащего сконструированную активную клетку (например, сконструированную клетки RPE), химически модифицирована с помощью соединения. В некоторых вариантах осуществления поверхность предусматривает внешнюю поверхность или внутреннюю поверхность имплантируемого элемента. В некоторых вариантах осуществления поверхность (например, внешняя поверхность) имплантируемого элемента, содержащего сконструированную активную клетку (например, сконструированную клетку RPE), химически модифицирована с помощью соединения. В некоторых вариантах осуществления поверхность (например, внешняя поверхность) ковалентно связана с соединением. В некоторых вариантах осуществления соединение содержит по меньшей мере один гетероарильный фрагмент.
В некоторых вариантах осуществления соединение представляет собой соединение формулы (I):
 (I),
(I),
или его фармацевтически приемлемую соль, где:
А представляет собой алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил, -O-, -C(O)O-, -C(O)-, -OC(O)-, -N(RC)-, -N(RC)C(O)-, -C(O)N(RC)-, -N(RC)C(O)(C1-C6-алкилен)-, -N(RC)C(O)(C1-C6-алкенилен)-, -N(RC)N(RD)-, -NCN-, -C(=N(RC)(RD))O-, -S-, -S(O)x-, -OS(O)x-, -N(RC)S(O)x-, -S(O)xN(RC)-, -P(RF)y-, -Si(ORA)2 -, -Si(RG)(ORA)-, -B(ORA)- или металл, где каждый алкил, алкенил, алкинил, алкилен, алкенилен, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил связан с группой присоединения (например, группой присоединения, определенной в данном документе) и необязательно замещен одним или более R1;
каждый из L1 и L3 независимо представляет собой связь, алкил или гетероалкил, где каждый алкил и гетероалкил необязательно замещен одним или более R2;
L2 представляет собой связь;
М отсутствует или представляет собой алкил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил, каждый из которых необязательно замещен одним или более R3;
P отсутствует или представляет собой циклоалкил, гетероциклил или гетероарил, каждый из которых необязательно замещен одним или более R4;
Z представляет собой водород, алкил, алкенил, алкинил, гетероалкил, -ORA, -C(O)RA, -C(O)ORA, -C(O)N(RC)(RD), -N(RC)C(O)RA, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R5;
каждый RA, RB, RC, RD, RE, RF и RG независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, галоген, азидо, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R6;
или RC и RD, взятые вместе с атомом азота, к которому они присоединены, образуют кольцо (например, 5-7-членное кольцо), необязательно замещенное одним или более R6;
каждый R1, R2, R3, R4, R5 и R6 независимо представляет собой алкил, алкенил, алкинил, гетероалкил, галоген, циано, азидо, оксо, -ORA1, -C(O)ORA1, -C(O)RB1,-OC(O)RB1, -N(RC1)(RD1), -N(RC1)C(O)RB1, -C(O)N(RC1), SRE1, S(O)xRE1, -OS(O)xRE1, -N(RC1)S(O)xRE1, - S(O)xN(RC1)(RD1), -P(RF1)y, циклоалкил, гетероциклил, арил, гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R7;
каждый RA1, RB1, RC1, RD1, RE1 и RF1 независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил необязательно замещен одним или более R7;
каждый R7 независимо представляет собой алкил, алкенил, алкинил, гетероалкил, галоген, циано, оксо, гидроксил, циклоалкил или гетероциклил;
х составляет 1 или 2; и
y составляет 2, 3 или 4.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (I-a):
 (I-a),
(I-a),
или его фармацевтически приемлемую соль, где:
А представляет собой алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил, -O-, -C(O)O-, -C(O)-, -OC(O)-, -N(RC)-, -N(RC)C(O)-, -C(O)N(RC)-, -N(RC)C(O)(C1-C6-алкилен)-, -N(RC)C(O)(C1-C6-алкенилен)-, -N(RC)N(RD)-, -NCN-, -C(=N(RC)(RD))O-, -S-, -S(O)x-, -OS(O)x-, -N(RC)S(O)x-, -S(O)xN(RC)-, -P(RF)y-, -Si(ORA)2 -, -Si(RG)(ORA)-, -B(ORA)- или металл, где каждый алкил, алкенил, алкинил, алкилен, алкенилен, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил связан с группой присоединения (например, группой присоединения, определенной в данном документе) и необязательно замещен одним или более R1;
каждый из L1 и L3 независимо представляет собой связь, алкил или гетероалкил, где каждый алкил и гетероалкил необязательно замещен одним или более R2;
L2 представляет собой связь;
М отсутствует или представляет собой алкил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил, каждый из которых необязательно замещен одним или более R3;
P представляет собой гетероарил, необязательно замещенный одним или более R4;
Z представляет собой алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил, каждый из которых необязательно замещен одним или более R5;
каждый RA, RB, RC, RD, RE, RF и RG независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, галоген, азидо, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R6;
или RC и RD, взятые вместе с атомом азота, к которому они присоединены, образуют кольцо (например, 5-7-членное кольцо), необязательно замещенное одним или более R6;
каждый R1, R2, R3, R4, R5 и R6 независимо представляет собой алкил, алкенил, алкинил, гетероалкил, галоген, циано, азидо, оксо, -ORA1, -C(O)ORA1, -C(O)RB1,-OC(O)RB1, -N(RC1)(RD1), -N(RC1)C(O)RB1, -C(O)N(RC1), SRE1, S(O)xRE1, -OS(O)xRE1, -N(RC1)S(O)xRE1, - S(O)xN(RC1)(RD1), -P(RF1)y, циклоалкил, гетероциклил, арил, гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R7;
каждый RA1, RB1, RC1, RD1, RE1 и RF1 независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил необязательно замещен одним или более R7;
каждый R7 независимо представляет собой алкил, алкенил, алкинил, гетероалкил, галоген, циано, оксо, гидроксил, циклоалкил или гетероциклил;
х составляет 1 или 2; и
y составляет 2, 3 или 4.
В некоторых вариантах осуществления в формулах (I) и (I-a) А представляет собой алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил, -O-, -C(O)O-, -C(O)-, -OC(O) -, -N(RC)C(O)-, -N(RC)C(O)(C1-C6-алкилен)-, -N(RC)C(O)(C1-C6-алкенилен)- или -N(RC)-. В некоторых вариантах осуществления A представляет собой алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил, -O-, -C(O)O-, -C(O)-, -OC(O) - или -N(RC)-. В некоторых вариантах осуществления A представляет собой алкил, алкенил, алкинил, гетероалкил,-O-, -C(O)O-, -C(O)-,-OC(O)- или -N(RC)-. В некоторых вариантах осуществления A представляет собой алкил, -O-, -C(O)O-, -C(O)-, -OC(O) или -N(RC)-. В некоторых вариантах осуществления A представляет собой -N(RC)C(O)-, -N(RC)C(O)(C1-C6-алкилен)- или -N(RC)C(O)(C1-C6-алкенилен)-. В некоторых вариантах осуществления A представляет собой -N(RC)-. В некоторых вариантах осуществления A представляет собой -N(RC) -, а RC и RD независимо представляет собой водород или алкил. В некоторых вариантах осуществления A представляет собой -NH-. В некоторых вариантах осуществления A представляет собой -N(RC)C(O)(C1-C6-алкилен)-, где алкилен замещен R1. В некоторых вариантах осуществления A представляет собой -N(RC)C(O)(C1-C6-алкилен)-, а R1 представляет собой алкил (например, метил). В некоторых вариантах осуществления A представляет собой -N(RC)C(O)(метилен)-, а R1 представляет собой алкил (например, метил). В некоторых вариантах осуществления A представляет собой -NHC(O)CH(CH3)-. В некоторых вариантах осуществления A представляет собой -NHC(O)C(CH3)-.
В некоторых вариантах осуществления в формулах (I) и (I-a) L1 представляет собой связь, алкил или гетероалкил. В некоторых вариантах осуществления L1 представляет собой связь или алкил. В некоторых вариантах осуществления L1 представляет собой связь. В некоторых вариантах осуществления L1 представляет собой алкил. В некоторых вариантах осуществления L1 представляет собой C1-C6алкил. В некоторых вариантах осуществления L1 представляет собой -CH2-, -CH(CH3)-, -CH2CH2CH2 или -CH2CH2-. В некоторых вариантах осуществления L1 представляет собой -CH2- или -CH2CH2-.
В некоторых вариантах осуществления в формулах (I) и (I-a) L3 представляет собой связь, алкил или гетероалкил. В некоторых вариантах осуществления L3 представляет собой связь. В некоторых вариантах осуществления L3 представляет собой алкил. В некоторых вариантах осуществления L3 представляет собой C1-C6алкил. В некоторых вариантах осуществления L3 представляет собой -CH2-. В некоторых вариантах осуществления L3 представляет собой гетероалкил. В некоторых вариантах осуществления L3 представляет собой C1-C6гетероалкил, необязательно замещенный одним или более R2 (например, оксо). В некоторых вариантах осуществления L3 представляет собой -C(O)OCH2-, -CH2(OCH2CH2)2-, -CH2(OCH2CH2)3-, CH2CH2O- или -CH2O-. В некоторых вариантах осуществления L3 представляет собой -CH2O-.
В некоторых вариантах осуществления в формулах (I) и (I-a) М отсутствует или представляет собой алкил, гетероалкил, арил или гетероарил. В некоторых вариантах осуществления M представляет собой гетероалкил, арил или гетероарил. В некоторых вариантах осуществления М отсутствует. В некоторых вариантах осуществления M представляет собой алкил (например, C1-C6алкил). В некоторых вариантах осуществления M представляет собой -CH2-. В некоторых вариантах осуществления M представляет собой гетероалкил (например, C1-C6гетероалкил). В некоторых вариантах осуществления M представляет собой (-OCH2CH2-)z, где z составляет целое число, выбранное от 1 до 10. В некоторых вариантах осуществления z составляет целое число, выбранное от 1 до 5. В некоторых вариантах осуществления M представляет собой -OCH2CH2-, (-OCH2CH2-)2, (-OCH2CH2-)3, (-OCH2CH2-)4 или (-OCH2CH2-)5. В некоторых вариантах осуществления M представляет собой -OCH2CH2-, (-OCH2CH2-)2, (-OCH2CH2-)3 или (-OCH2CH2-)4. В некоторых вариантах осуществления M представляет собой (-OCH2CH2-)3. В некоторых вариантах осуществления M представляет собой арил. В некоторых вариантах осуществления M представляет собой фенил. В некоторых вариантах осуществления M представляет собой незамещенный фенил. В некоторых вариантах осуществления M представляет собой  . В некоторых вариантах осуществления M представляет собой фенил, замещенный R7 (например, 1 R7). В некоторых вариантах осуществления M представляет собой
. В некоторых вариантах осуществления M представляет собой фенил, замещенный R7 (например, 1 R7). В некоторых вариантах осуществления M представляет собой  . В некоторых вариантах осуществления R7 представляет собой CF3.
. В некоторых вариантах осуществления R7 представляет собой CF3.
В некоторых вариантах осуществления в формулах (I) и (I-a) P отсутствует или представляет собой гетероциклил или гетероарил. В некоторых вариантах осуществления Р отсутствует. В некоторых вариантах осуществления в формулах (I) и (I-a) P представляет собой трициклический, бициклический или моноциклический гетероарил. В некоторых вариантах осуществления P представляет собой моноциклический гетероарил. В некоторых вариантах осуществления P представляет собой азотсодержащий гетероарил. В некоторых вариантах осуществления P представляет собой моноциклический азотсодержащий гетероарил. В некоторых вариантах осуществления P представляет собой 5-членный гетероарил. В некоторых вариантах осуществления P представляет собой 5-членный азотсодержащий гетероарил. В некоторых вариантах осуществления P представляет собой тетразолил, имидазолил, пиразолил или триазолил, пирролил, оксазолил или тиазолил. В некоторых вариантах осуществления P представляет собой тетразолил, имидазолил, пиразолил, или триазолил, или пирролил. В некоторых вариантах осуществления P представляет собой имидазолил. В некоторых вариантах осуществления P представляет собой  . В некоторых вариантах осуществления P представляет собой триазолил. В некоторых вариантах осуществления P представляет собой 1,2,3-триазолил. В некоторых вариантах осуществления P представляет собой
. В некоторых вариантах осуществления P представляет собой триазолил. В некоторых вариантах осуществления P представляет собой 1,2,3-триазолил. В некоторых вариантах осуществления P представляет собой  .
.
В некоторых вариантах осуществления P представляет собой гетероциклил. В некоторых вариантах осуществления P представляет собой 5-членный гетероциклил или 6-членный гетероциклил. В некоторых вариантах осуществления P представляет собой имидазолидинонил. В некоторых вариантах осуществления P представляет собой  . В некоторых вариантах осуществления P представляет собой тиоморфолинил-1,1-диоксидил. В некоторых вариантах осуществления P представляет собой
. В некоторых вариантах осуществления P представляет собой тиоморфолинил-1,1-диоксидил. В некоторых вариантах осуществления P представляет собой  .
.
В некоторых вариантах осуществления в формулах (I) и (I-a) Z представляет собой алкил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил. В некоторых вариантах осуществления Z представляет собой гетероциклил. В некоторых вариантах осуществления Z представляет собой моноциклический или бициклический гетероциклил. В некоторых вариантах осуществления Z является кислородсодержащим гетероциклилом. В некоторых вариантах осуществления Z представляет собой 4-членный гетероциклил, 5-членный гетероциклил или 6-членный гетероциклил. В некоторых вариантах осуществления Z представляет собой 6-членный гетероциклил. В некоторых вариантах осуществления Z представляет собой 6-членный кислородсодержащий гетероциклил. В некоторых вариантах осуществления Z представляет собой тетрагидропиранил. В некоторых вариантах осуществления Z представляет собой  или
или  . В некоторых вариантах осуществления Z представляет собой 4-членный кислородсодержащий гетероциклил. В некоторых вариантах осуществления Z представляет собой
. В некоторых вариантах осуществления Z представляет собой 4-членный кислородсодержащий гетероциклил. В некоторых вариантах осуществления Z представляет собой  .
.
В некоторых вариантах осуществления Z представляет собой бициклический кислородсодержащий гетероциклил. В некоторых вариантах осуществления Z представляет собой фталевый ангидрид. В некоторых вариантах осуществления Z представляет собой серосодержащий гетероциклил. В некоторых вариантах осуществления Z представляет собой 6-членный серосодержащий гетероциклил. В некоторых вариантах осуществления Z представляет собой 6-членный гетероциклил, содержащий атом азота и атом серы. В некоторых вариантах осуществления Z представляет собой тиоморфолинил-1,1-диоксидил. В некоторых вариантах осуществления Z представляет собой  . В некоторых вариантах осуществления Z представляет собой азотсодержащий гетероциклил. В некоторых вариантах осуществления Z представляет собой 6-членный азотсодержащий гетероциклил. В некоторых вариантах осуществления Z представляет собой
. В некоторых вариантах осуществления Z представляет собой азотсодержащий гетероциклил. В некоторых вариантах осуществления Z представляет собой 6-членный азотсодержащий гетероциклил. В некоторых вариантах осуществления Z представляет собой  .
.
В некоторых вариантах осуществления Z представляет собой бициклический гетероциклил. В некоторых вариантах осуществления Z представляет собой бициклический азотсодержащий гетероциклил, необязательно замещенный одним или более R5. В некоторых вариантах осуществления Z представляет собой 2-окса-7-азаспиро[3.5]нонанил. В некоторых вариантах осуществления Z представляет собой  . В некоторых вариантах осуществления Z представляет собой 1-окса-3,8-диазаспиро[4.5]декан-2-он. В некоторых вариантах осуществления Z представляет собой
. В некоторых вариантах осуществления Z представляет собой 1-окса-3,8-диазаспиро[4.5]декан-2-он. В некоторых вариантах осуществления Z представляет собой  .
.
В некоторых вариантах осуществления в формулах (I) и (I-a) Z представляет собой арил. В некоторых вариантах осуществления Z представляет собой моноциклический арил. В некоторых вариантах осуществления Z представляет собой фенил. В некоторых вариантах осуществления Z представляет собой монозамещенный фенил (например, 1 R5). В некоторых вариантах осуществления Z представляет собой монозамещенный фенил, где 1 R5 представляет собой азотсодержащую группу. В некоторых вариантах осуществления Z представляет собой монозамещенный фенил, где 1 R5 представляет собой NH2. В некоторых вариантах осуществления Z представляет собой монозамещенный фенил, где 1 R5 представляет собой кислородсодержащую группу. В некоторых вариантах осуществления Z представляет собой монозамещенный фенил, где 1 R5 представляет собой кислородсодержащий гетероалкил. В некоторых вариантах осуществления Z представляет собой монозамещенный фенил, где 1 R5 представляет собой OCH3. В некоторых вариантах осуществления Z представляет собой монозамещенный фенил, где 1 R5 находится в орто-положении. В некоторых вариантах осуществления Z представляет собой монозамещенный фенил, где 1 R5 находится в мета-положении. В некоторых вариантах осуществления Z представляет собой монозамещенный фенил, где 1 R5 находится в пара-положении.
В некоторых вариантах осуществления в формулах (I) и (I-a) Z представляет собой алкил. В некоторых вариантах осуществления Z представляет собой C1-C12алкил. В некоторых вариантах осуществления Z представляет собой C1-C10алкил. В некоторых вариантах осуществления Z представляет собой C1-C8алкил. В некоторых вариантах осуществления Z представляет собой C1-C8алкил, замещенный 1-5 R5. В некоторых вариантах осуществления Z представляет собой C1-C8алкил, замещенный 1 R5. В некоторых вариантах осуществления Z представляет собой C1-C8алкил, замещенный 1 R5, где R5 представляет собой алкил, гетероалкил, галоген, оксо, -ORA1, -C(O)ORA1, -C(O)RB1,-OC(O)RB1 или -N(RC1)(RD1). В некоторых вариантах осуществления Z представляет собой C1-C8алкил, замещенный 1 R5, где R5 представляет собой-ORA1 или -C(O)ORA1. В некоторых вариантах осуществления Z представляет собой C1-C8алкил, замещенный 1 R5, где R5 представляет собой-ORA1 или -C(O)OH. В некоторых вариантах осуществления Z представляет собой -CH3.
В некоторых вариантах осуществления в формулах (I) и (I-a) Z представляет собой гетероалкил. В некоторых вариантах осуществления Z представляет собой C1-C12гетероалкил. В некоторых вариантах осуществления Z представляет собой C1-C10гетероалкил. В некоторых вариантах осуществления Z представляет собой C1-C8гетероалкил. В некоторых вариантах осуществления Z представляет собой C1-C6гетероалкил. В некоторых вариантах осуществления Z представляет собой азотсодержащий гетероалкил, необязательно замещенный одним или более R5. В некоторых вариантах осуществления Z представляет собой азот- или серосодержащий гетероалкил, замещенный 1-5 R5. В некоторых вариантах осуществления Z представляет собой N-метил-2-(метилсульфонил)этан-1-аминил.
В некоторых вариантах осуществления Z представляет собой -ORA или -C(O)ORA. В некоторых вариантах осуществления Z представляет собой -ORA (например, -OH или -OCH3). В некоторых вариантах осуществления Z представляет собой -C(O)ORA (например, -C(O)OH).
В некоторых вариантах осуществления Z представляет собой водород.
В некоторых вариантах осуществления L2 представляет собой связь, а P и L3 независимо отсутствуют. В некоторых вариантах осуществления L2 представляет собой связь, P представляет собой гетероарил, L3 представляет собой связь, а Z представляет собой водород. В некоторых вариантах осуществления P представляет собой гетероарил, L3 представляет собой гетероалкил, а Z представляет собой алкил.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (II):
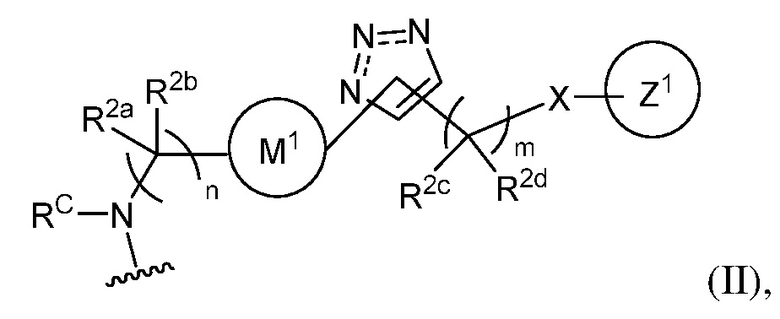
или его фармацевтически приемлемую соль, где кольцо M1 представляет собой циклоалкил, гетероциклил, арил или гетероарил, каждый из которых необязательно замещен 1-5 R3; кольцо Z1 представляет собой циклоалкил, гетероциклил, арил или гетероарил, необязательно замещенные 1-5 R5; каждый из R2a, R2b, R2c и R2d независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, галоген, циано, нитро, амино, циклоалкил, гетероциклил, арил или гетероарил, или каждый из R2a и R2b или R2c и R2d, взятые вместе, образуют оксо-группу; X отсутствует или представляет собой N(R10)(R11), O или S; RC представляет собой водород, алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил, где каждый из алкила, алкенила, алкинила, гетероалкила, циклоалкила, гетероциклила, арила или гетероарила необязательно замещен 1-6 R6; каждый R3, R5 и R6 независимо представляет собой алкил, алкенил, алкинил, гетероалкил, галоген, циано, азидо, оксо, -ORA1, -C(O)ORA1, -C(O)RB1,-OC(O)RB1, -N(RC1)(RD1), -N(RC1)C(O)RB1, -C(O)N(RC1), SRE1, циклоалкил, гетероциклил, арил или гетероарил; каждый из R10 и R11 независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, -C(O)ORA1, -C(O)RB1,-OC(O)RB1, -C(O)N(RC1), циклоалкил, гетероциклил, арил или гетероарил; каждый RA1, RB1, RC1, RD1 и RE1 независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил, где каждый из алкила, алкенила, алкинила, гетероалкила, циклоалкила, гетероциклила, арила, гетероарила необязательно замещен 1-6 R7; каждый R7 независимо представляет собой алкил, алкенил, алкинил, гетероалкил, галоген, циано, оксо, гидроксил, циклоалкил или гетероциклил; каждый m и n независимо составляет 1, 2, 3, 4, 5 или 6; и "  " обозначает связь с группой присоединения или полимером, описанным в данном документе.
" обозначает связь с группой присоединения или полимером, описанным в данном документе.
В некоторых вариантах осуществления соединение формулы (II) представляет собой соединение формулы (II-a):
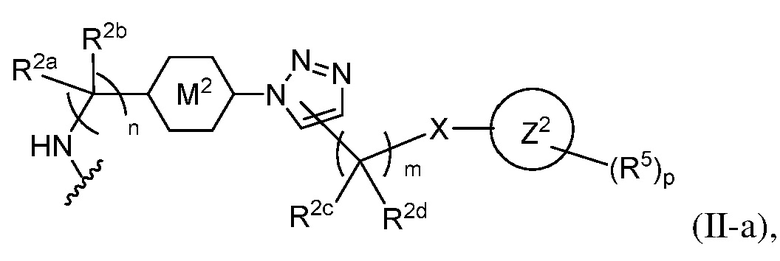
или его фармацевтически приемлемую соль, где кольцо M2 представляет собой арил или гетероарил, необязательно замещенный одним или более R3; кольцо Z2 представляет собой циклоалкил, гетероциклил, арил или гетероарил; каждый из R2a, R2b, R2c и R2d независимо представляет собой водород, алкил, или гетероалкил, или каждый из R2a и R2b или R2c и R2d, взятые вместе, образуют оксо-группу; X отсутствует или представляет собой O или S; каждый R3 и R5 независимо представляет собой алкил, гетероалкил, галоген, оксо, -ORA1, -C(O)ORA1 или -C(O)RB1; или два R5, взятые вместе, образуют 5-6-членное кольцо, конденсированное с кольцом Z2; каждый RA1 и RB1 независимо представляет собой водород, алкил или гетероалкил; каждый m и n независимо составляет 1, 2, 3, 4, 5 или 6; p составляет 0, 1, 2, 3, 4, 5 или 6; и "  " обозначает связь с группой присоединения или полимером, описанным в данном документе.
" обозначает связь с группой присоединения или полимером, описанным в данном документе.
В некоторых вариантах осуществления соединение формулы (II-a) представляет собой соединение формулы (II-b):
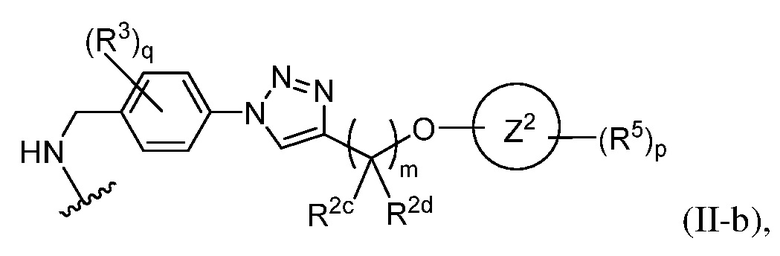
или его фармацевтически приемлемую соль, где кольцо Z2 представляет собой циклоалкил, гетероциклил, арил или гетероарил; каждый R3 и R5 независимо представляет собой алкил, гетероалкил, галоген, оксо, -ORA1, -C(O)ORA1 или -C(O)RB1; каждый RA1 и RB1 независимо представляет собой водород, алкил или гетероалкил; каждый из p и q независимо составляет 0, 1, 2, 3, 4, 5 или 6; и "  " обозначает связь с группой присоединения или полимером, описанным в данном документе.
" обозначает связь с группой присоединения или полимером, описанным в данном документе.
В некоторых вариантах осуществления соединение формулы (II-a) представляет собой соединение формулы (II-с):
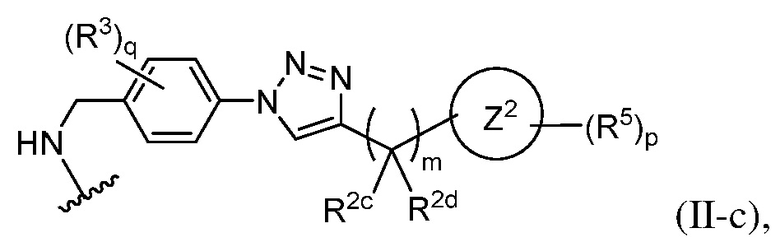
или его фармацевтически приемлемую соль, где кольцо Z2 представляет собой циклоалкил, гетероциклил, арил или гетероарил; каждый из R2c и R2d независимо представляет собой водород, алкил или гетероалкил, или каждый из R2c и R2d, взятые вместе, образуют оксо-группу; каждый R3 и R5 независимо представляет собой алкил, гетероалкил, галоген, оксо, -ORA1, -C(O)ORA1 или -C(O)RB1; каждый RA1 и RB1 независимо представляет собой водород, алкил или гетероалкил; m составляет 1, 2, 3, 4, 5 или 6; каждый из p и q независимо составляет 0, 1, 2, 3, 4, 5 или 6; и "  " обозначает связь с группой присоединения или полимером, описанным в данном документе.
" обозначает связь с группой присоединения или полимером, описанным в данном документе.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (II-d):
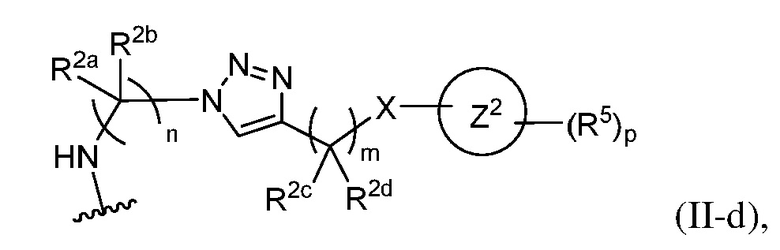
или его фармацевтически приемлемую соль, где кольцо Z2 представляет собой циклоалкил, гетероциклил, арил или гетероарил; X отсутствует или представляет собой O или S; каждый из R2a, R2b, R2c и R2d независимо представляет собой водород, алкил или гетероалкил, или каждый из R2a и R2b или R2c и R2d, взятые вместе, образуют оксо-группу; каждый R5 независимо представляет собой алкил, гетероалкил, галоген, оксо, -ORA1, -C(O)ORA1 или -C(O)RB1; каждый RA1 и RB1 независимо представляет собой водород, алкил или гетероалкил; каждый из m и n независимо составляет 1, 2, 3, 4, 5 или 6; p составляет 0, 1, 2, 3, 4, 5 или 6; и "  " обозначает связь с группой присоединения или полимером, описанным в данном документе.
" обозначает связь с группой присоединения или полимером, описанным в данном документе.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (III):
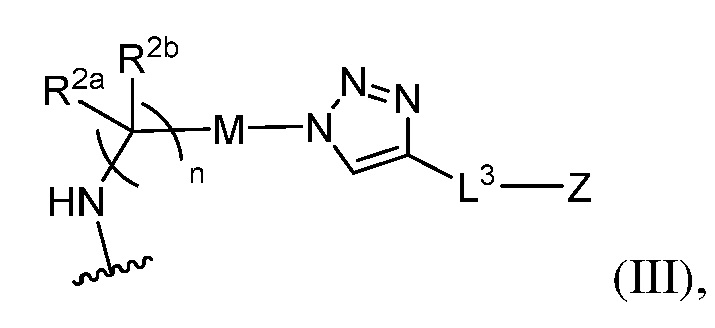
или его фармацевтически приемлемую соль, где M представляет собой алкил или арил, каждый из которых необязательно замещен одним или более R3; L3 представляет собой алкил или гетероалкил, необязательно замещенный одним или более R2; Z представляет собой алкил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил, каждый из которых необязательно замещен одним или более R5; каждый из R2a и R2b независимо представляет собой водород, алкил или гетероалкил, или R2a и R2b, взятые вместе, образуют оксо-группу; каждый R2, R3 и R5 независимо представляет собой алкил, гетероалкил, галоген, оксо, -ORA1, -C(O)ORA1 или -C(O)RB1; каждый RA1 и RB1 независимо представляет собой водород, алкил или гетероалкил; n независимо составляет 1, 2, 3, 4, 5 и 6; и "  " обозначает связь с группой присоединения или полимером, описанным в данном документе.
" обозначает связь с группой присоединения или полимером, описанным в данном документе.
В некоторых вариантах осуществления соединение формулы (III) представляет собой соединение формулы (III-a):
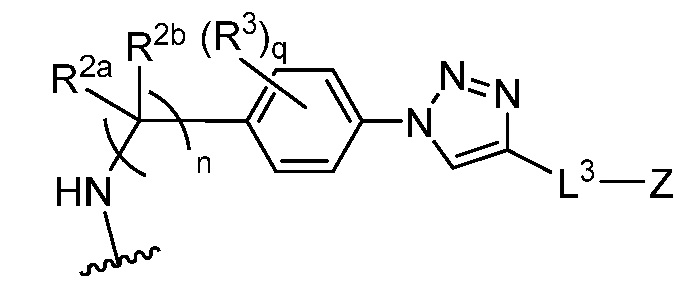 (III-a),
(III-a),
или его фармацевтически приемлемую соль, где L3 представляет собой алкил или гетероалкил, каждый из которых необязательно замещен одним или более R2; Z представляет собой алкил или гетероалкил, каждый из которых необязательно замещен одним или более R5; каждый из R2a и R2b независимо представляет собой водород, алкил или гетероалкил, или R2a и R2b, взятые вместе, образуют оксо-группу; каждый R2, R3 и R5 независимо представляет собой алкил, гетероалкил, галоген, оксо, -ORA1, -C(O)ORA1 или -C(O)RB1; каждый RA1 и RB1 независимо представляет собой водород, алкил, или гетероалкил; n независимо составляет 1, 2, 3, 4, 5 или 6; и "  " обозначает связь с группой присоединения или полимером, описанным в данном документе.
" обозначает связь с группой присоединения или полимером, описанным в данном документе.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (IV):
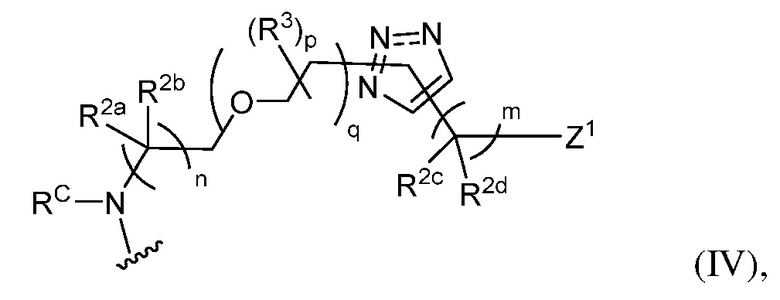
или его фармацевтически приемлемую соль, где Z1 представляет собой алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил, каждый из которых необязательно замещен 1-5 R5; каждый из R2a, R2b, R2cи R2d независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, галоген, циано, нитро, амино, циклоалкил, гетероциклил, арил или гетероарил; или R2a и R2b или R2c и R2d, взятые вместе, образуют оксо-группу; RC представляет собой водород, алкил, алкенил, где каждый из алкила и алкенила необязательно замещен 1-6 R6; каждый из R3, R5 и R6 независимо представляет собой алкил, гетероалкил, галоген, оксо, -ORA1, -C(O)ORA1 или -C(O)RB1; каждый RA1 и RB1 независимо представляет собой водород, алкил или гетероалкил; каждый m и n независимо составляет 1, 2, 3, 4, 5 или 6; q составляет целое число от 0 до 25; и "  " обозначает связь с группой присоединения или полимером, описанным в данном документе.
" обозначает связь с группой присоединения или полимером, описанным в данном документе.
В некоторых вариантах осуществления соединение формулы (IV) представляет собой соединение формулы (IV-a):
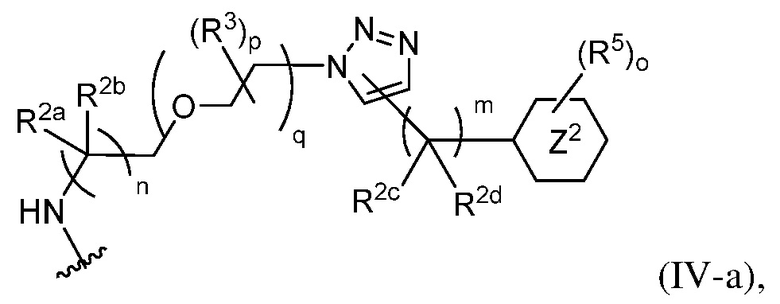
или его фармацевтически приемлемую соль, где кольцо Z2 представляет собой циклоалкил, гетероциклил, арил или гетероарил; каждый из R2a, R2b, R2c и R2d независимо представляет собой водород, алкил, гетероалкил, галоген; или R2a и R2b или R2c и R2d, взятые вместе, образуют оксо-группу; каждый из R3 и R5 независимо представляет собой алкил, гетероалкил, галоген, оксо, -ORA1, -C(O)ORA1 или -C(O)RB1; каждый RA1 и RB1 независимо представляет собой водород, алкил или гетероалкил; каждый m и n независимо составляет 1, 2, 3, 4, 5 или 6; каждый o и p независимо составляет 0, 1, 2, 3, 4 или 5; q составляет целое число от 0 до 25; и "  " обозначает связь с группой присоединения или полимером, описанным в данном документе.
" обозначает связь с группой присоединения или полимером, описанным в данном документе.
В некоторых вариантах осуществления соединение формулы (IV-a) представляет собой соединение формулы (IV-b):
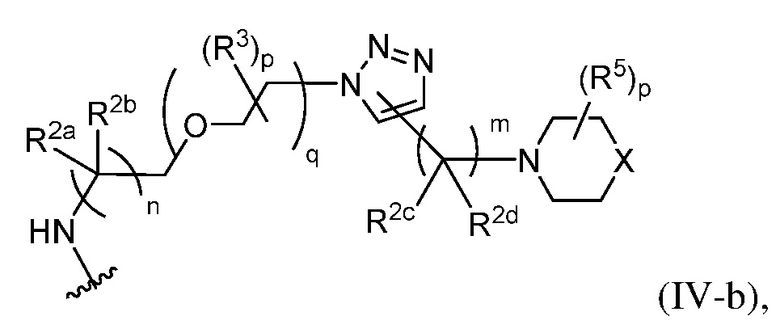
или его фармацевтически приемлемую соль, где X представляет собой C(R')(R"), N(R') или S(O)x; каждый из R' и R" независимо представляет собой водород, алкил, галоген или циклоалкил; каждый из R2a, R2b, R2c и R2d независимо представляет собой водород, алкил, гетероалкил или галоген; или R2a и R2b или R2c и R2d, взятые вместе, образуют оксо-группу; каждый из R3 и R5 независимо представляет собой алкил, гетероалкил, галоген, оксо, -ORA1, -C(O)ORA1 или -C(O)RB1; каждый RA1 и RB1 независимо представляет собой водород, алкил или гетероалкил; каждый m и n независимо составляет 1, 2, 3, 4, 5 или 6; p составляет 0, 1, 2, 3, 4 или 5; q составляет целое число от 0 до 25; x составляет 0, 1 или 2; и "  " обозначает связь с группой присоединения или полимером, описанным в данном документе.
" обозначает связь с группой присоединения или полимером, описанным в данном документе.
В некоторых вариантах осуществления соединение представляет собой соединение формулы (I). В некоторых вариантах осуществления L2 представляет собой связь, а P и L3 независимо отсутствуют. В некоторых вариантах осуществления L2 представляет собой связь, P представляет собой гетероарил, L3 представляет собой связь, а Z представляет собой водород. В некоторых вариантах осуществления P представляет собой гетероарил, L3 представляет собой гетероалкил, а Z представляет собой алкил. В некоторых вариантах осуществления L2 представляет собой связь, а P и L3 независимо отсутствуют. В некоторых вариантах осуществления L2 представляет собой связь, P представляет собой гетероарил, L3 представляет собой связь, а Z представляет собой водород. В некоторых вариантах осуществления P представляет собой гетероарил, L3 представляет собой гетероалкил, а Z представляет собой алкил.
В некоторых вариантах осуществления соединение представляет собой соединение формулы (II-b). В некоторых вариантах осуществления формулы (II-b) каждый из R2c и R2d независимо представляет собой водород, m составляет 1, q составляет 0, p составляет 0, а Z представляет собой гетероциклил (например, кислородсодержащий гетероциклил). В некоторых вариантах осуществления соединение формулы (II-b) представляет собой соединение 100.
В некоторых вариантах осуществления соединение представляет собой соединение формулы (II-c). В некоторых вариантах осуществления формулы (II-c) каждый из R2c и R2d независимо представляет собой водород, m составляет 1, p составляет 1, q составляет 0, R5 представляет собой -CH3, а Z представляет собой гетероциклил (например, азотсодержащий гетероциклил). В некоторых вариантах осуществления соединение формулы (II-с) представляет собой соединение 113.
В некоторых вариантах осуществления соединение представляет собой соединение формулы (II-d). В некоторых вариантах осуществления формулы (II-d) каждый из R2a, R2b, R2c и R2d независимо представляет собой водород, m составляет 1, n составляет 3, X представляет собой O, p составляет 0, а Z представляет собой гетероциклил (например, кислородсодержащий гетероциклил). В некоторых вариантах осуществления соединение формулы (II-d) представляет собой соединение 110 или соединение 114.
В некоторых вариантах осуществления соединение представляет собой соединение формулы (III-a). В некоторых вариантах осуществления формулы (III-a) каждый из R2a и R2b независимо представляет собой, n составляет 1, q составляет 0, L3 представляет собой -CH2(OCH2CH2)2-, а Z представляет собой -OCH3. В некоторых вариантах осуществления соединение формулы (III-a) представляет собой соединение 112.
В некоторых вариантах осуществления соединение представляет собой соединение формулы (IV-a). В некоторых вариантах осуществления формулы (IV-a) каждый из R2a, R2b, R2c и R2d независимо представляет собой водород, каждый из m и n независимо составляет 1, p составляет 0, q составляет 3, o составляет 0 или 1, R5, если присутствует, представляет собой -NH2, а Z представляет собой арил или гетероциклил (например, азотсодержащий гетероциклил). В некоторых вариантах осуществления соединение формулы (IV-a) представляет собой соединение 101 или соединение 102.
В некоторых вариантах осуществления соединение формулы (I) не является соединением, раскрытым в WO2012/112982, WO2012/167223, WO2014/153126, WO2016/019391, WO 2017/075630, US2012-0213708, US 2016-0030359 или US 2016-0030360.
В некоторых вариантах осуществления соединение формулы (I) предусматривает соединение, представленное в таблице соединений 1, или его фармацевтически приемлемую соль.
Таблица соединений 1. Иллюстративные соединения
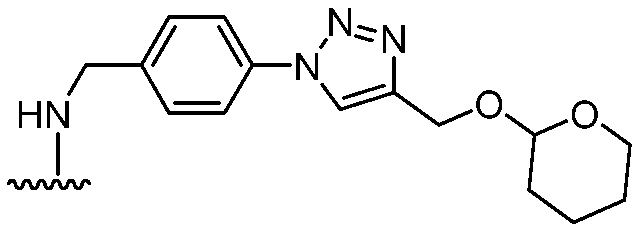
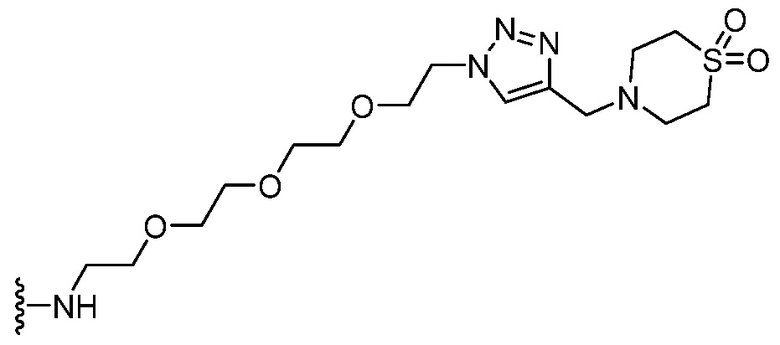
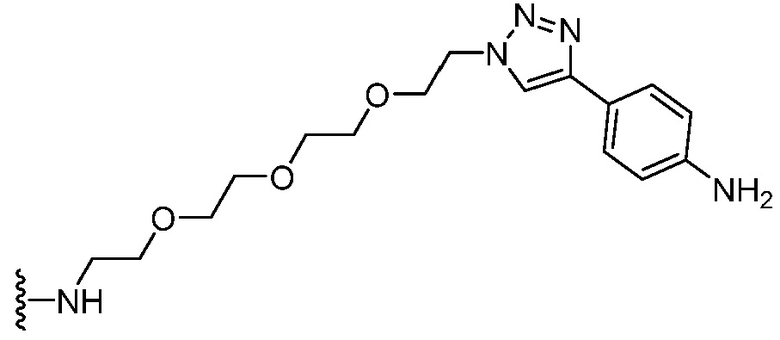
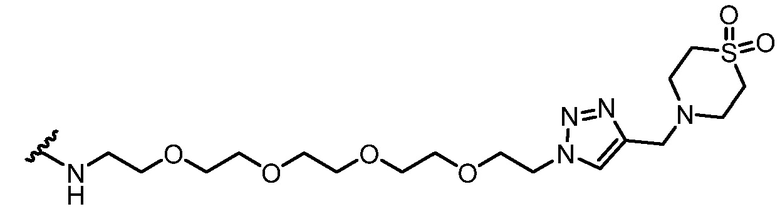
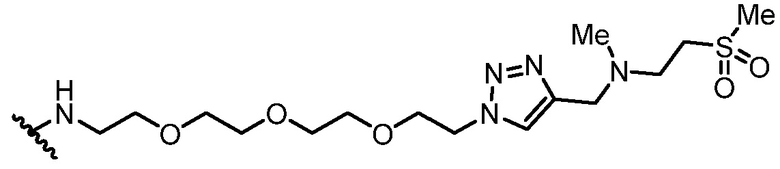
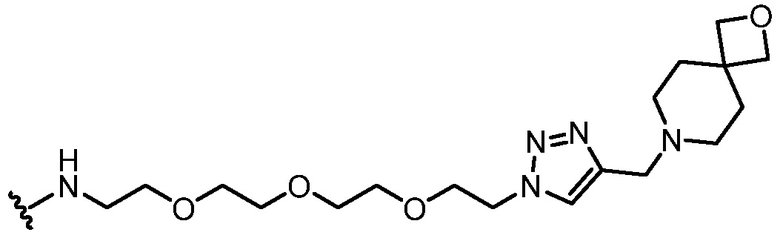
В некоторых вариантах осуществления соединение формулы (I) (например, формул (Ia), (II), (II-b), (II-c), (II-d), (III), (III-a), (IV), (IV-a) или (IV-b)) или его фармацевтически приемлемая соль выбраны из:
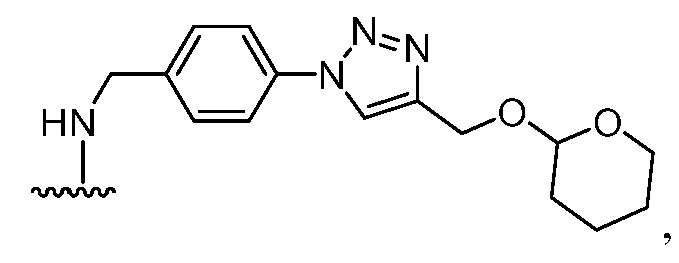
 и
и  или их соли.
или их соли.
В некоторых вариантах осуществления соединение формулы (I), описанное в данном документе, выбрано из:
 ,
,
или фармацевтически приемлемой соли любого соединения.
Особенности химически модифицированных имплантируемых элементов
Имплантируемый элемент может быть покрыт соединением формулы (I) или его фармацевтически приемлемой солью или материалом, содержащим соединение формулы (I) или его фармацевтически приемлемую соль. В одном варианте осуществления соединение формулы (I) размещено на поверхности, например, внутренней или внешней поверхности, имплантируемого элемента. В некоторых вариантах осуществления соединение формулы (I) размещено на поверхности, например, внутренней или внешней поверхности, заключающего компонента, связанного с имплантируемым элементом. В одном варианте осуществления соединение формулы (I) распределено по поверхности равномерно. В одном варианте осуществления соединение формулы (I) распределено по поверхности неравномерно.
В некоторых вариантах осуществления имплантируемый элемент (или, например, его заключающий компонент) покрыт (например, накрыт, частично или полностью) соединением формулы (I) или материалом, содержащим соединение формулы (I) или его фармацевтически приемлемую соль. В некоторых вариантах осуществления имплантируемый элемент (или, например, его включающий компонент) покрыт одним слоем соединения формулы (I). В некоторых вариантах осуществления устройство покрыто несколькими слоями соединения формулы (I), например, по меньшей мере 2 слоями, 3 слоями, 4 слоями, 5 слоями, 10 слоями, 20 слоями, 50 слоями или более.
В одном варианте осуществления первая часть поверхности имплантируемого элемента содержит соединение формулы (I), которое модулирует, например, снижает или повышает, биологическую функции, а вторая часть имплантируемого элемента не содержит соединение, или плотность ее покрытия соединением существенно более низкая.
В одном варианте осуществления первая часть поверхности имплантируемого элемента содержит соединение формулы (I), которое модулирует, например, снижает, иммунный ответ, а вторая часть поверхности содержит второе соединение формулы (I), например, которое повышает иммунный ответ, при этом вторая часть имплантируемого элемента не содержит соединение, или плотность ее покрытия соединением существенно более низкая.
В некоторых вариантах осуществления имплантируемый элемент симметричным образом покрыт или химически дериватизирован соединением формулы (I) или материалом, содержащим соединение формулы (I) или его фармацевтически приемлемую соль. В некоторых вариантах осуществления имплантируемый элемент асимметричным образом покрыт или химически дериватизирован соединением формулы (I) или материалом, содержащим соединение формулы (I), или его фармацевтически приемлемую соль. Например, иллюстративный имплантируемый элемент может быть частично покрыт (например, покрыт на по меньшей мере приблизительно 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 99% или 99,9%) соединением формулы (I) или материалом, содержащим соединение формулы (I) или его фармацевтически приемлемую соль.
Иллюстративные имплантируемые элементы, покрытые или химически дериватизированные соединением формулы (I) или материалом, содержащим соединение формулы (I) или его фармацевтически приемлемую соль, могут быть получены с применением любого способа, известного в данной области техники, как, например, путем самосборки (например, с помощью блок-сополимеров, адсорбции (например, конкурентной адсорбции), разделения фаз, микропроизодства или маскировки).
В некоторых вариантах осуществления имплантируемый элемент содержит поверхность, проявляющую два или более различных физико-химических свойства (например, 3, 4, 5, 6, 7, 8, 9, 10 или более различных физико-химических свойств).
В некоторых вариантах осуществления покрытие или химическая дериватизация поверхности иллюстративного имплантируемого элемента соединением формулы (I), материалом, содержащим соединение формулы (I) или его фармацевтически приемлемую соль, описаны как среднее число прикрепленных молекул соединения на заданную площадь, например, в виде плотности. Например, плотность покрытия или химической дериватизации иллюстративного имплантируемого элемента может составлять 0,01, 0,1, 0,5, 1, 5, 10, 15, 20, 50, 75, 100, 200, 400, 500, 750, 1000, 2500 или 5000 молекул соединения на квадратный мкм или квадратный мм, например, поверхности или внутренней части указанного имплантируемого элемента.
Имплантируемый элемент, содержащий соединение формулы (I) или его фармацевтически приемлемую соль, может обусловливать сниженный иммунный ответ (например, маркер иммунного ответа) по сравнению с имплантируемым элементом, который не содержит соединение формулы (I) или его фармацевтически приемлемую соль. Маркер иммунного ответа представляет собой одно или более из уровня катепсина или уровня маркера иммунного ответа, например, TNF-α, IL-13, IL-6, G-CSF, GM-CSF, IL-4, CCL2 или CCL4, измеряемого, например, посредством ELISA. В некоторых вариантах осуществления имплантируемый элемент, содержащий соединение формулы (I) или его фармацевтически приемлемую соль, обусловливает снижение иммунного ответа (например, маркера иммунного ответа) на приблизительно 1%, приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 99% или приблизительно 100% по сравнению с имплантируемым элементом, который не содержит соединение формулы (I) или его фармацевтически приемлемую соль. В некоторых вариантах осуществления снижение иммунного ответа (например, маркера иммунного ответа) измеряют через приблизительно 30 минут, приблизительно 1 час, приблизительно 6 часов, приблизительно 12 часов, приблизительно 1 день, приблизительно 2 дня, приблизительно 3 дня, приблизительно 4 дня, приблизительно 1 неделю, приблизительно 2 недели, приблизительно 1 месяц, приблизительно 2 месяца, приблизительно 3 месяца, приблизительно 6 месяцев или более. В некоторых вариантах осуществления имплантируемый элемент, содержащий соединение формулы (I), покрыт соединением формулы (I) или инкапсулирует соединение формулы (I).
Имплантируемый элемент, содержащий соединение формулы (I) или его фармацевтически приемлемую соль, может обуславливать повышение иммунного ответа (например, маркера иммунного ответа) по сравнению с имплантируемым элементом, который не содержит соединение формулы (I) или его фармацевтически приемлемую соль. Маркер иммунного ответа представляет собой одно или более из активности катепсина или уровня маркера иммунного ответа, например, TNF-α, IL-13, IL-6, G-CSF, GM-CSF, IL-4, CCL2 или CCL4, измеряемого, например, посредством ELISA. В некоторых вариантах осуществления устройство, содержащее соединение формулы (I) или его фармацевтически приемлемую соль, обуславливает повышение иммунного ответа (например, маркера иммунного ответа) на приблизительно 1%, приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 99%, или приблизительно 100%, или приблизительно 1000% по сравнению с имплантируемым элементом, который не содержит соединение формулы (I) или его фармацевтически приемлемую соль. В некоторых вариантах осуществления повышение иммунного ответа (например, маркера иммунного ответа) измеряют через приблизительно 30 минут, приблизительно 1 час, приблизительно 6 часов, приблизительно 12 часов, приблизительно 1 день, приблизительно 2 дня, приблизительно 3 дня, приблизительно 4 дня, приблизительно 1 неделю, приблизительно 2 недели, приблизительно 1 месяц, приблизительно 2 месяца, приблизительно 3 месяца, приблизительно 6 месяцев или более. В некоторых вариантах осуществления имплантируемый элемент, содержащий соединение формулы (I), покрыт соединением формулы (I) или инкапсулирует соединение формулы (I).
Имплантируемый элемент может иметь гладкую поверхность или может содержать выступ, углубление, лунку, щель или отверстие или любую их комбинацию. Упомянутые выступ, углубление, лунка, щель или отверстие могут быть любого размера, например, от 10 мкм до приблизительно 1 нм, от приблизительно 5 мкм до приблизительно 1 нм, от приблизительно 2,5 мкм до приблизительно 1 нм, от 1 мкм до приблизительно 1 нм, от 500 нм до приблизительно 1 нм или от приблизительно 100 нм до приблизительно 1 нм. Гладкая поверхность или выпуклость, углубление, лунка, щель или отверстие или любая их комбинация могут быть покрыты или химически дериватизированы соединением формулы (I), материалом, содержащим соединение формулы (I) или его фармацевтически приемлемую соль.
Имплантируемый элемент может иметь любую подходящую форму, такую как сфера, сфероид, эллипсоид, диск, цилиндр, тор, куб, стадиумоид, конус, пирамида, треугольник, прямоугольник, квадрат или стержень, или может содержать изогнутый или плоский участок. Имплантируемый элемент любой формы, изогнутый или плоский, может быть покрыт или химически дериватизирован соединением формулы (I), материалом, содержащим соединение формулы (I) или его фармацевтически приемлемую соль.
Способы лечения
В данном документе описаны способы предупреждения или лечения заболевания, нарушения или состояния у субъекта путем введения или имплантации клетки RPE, например, инкапсулированной с помощью материала или устройства, описанных в данном документе. В некоторых вариантах осуществления способы, описанные в данном документе, непосредственно или опосредованно уменьшают или облегчают по меньшей мере один симптом заболевания, нарушения или состояния. В некоторых вариантах осуществления способы, описанные в данном документе, предупреждают или замедлению манифестацию заболевания, нарушения или состояния.
В некоторых вариантах осуществления заболевание, нарушение или состояние поражает определенную систему организма, например нервную систему (например, периферическую нервную систему (PNS) или центральную нервную систему (CNS)), сосудистую систему, скелетную систему, дыхательную систему, эндокринную систему, лимфатическую систему, репродуктивную систему или желудочно-кишечный тракт. В некоторых вариантах осуществления заболевание, нарушение или состояние поражает частью организма, например, кровь, глаз, головной мозг, кожу, легкое, желудок, рот, ухо, ногу, стопу, руку, печень, сердце, почку, кость, поджелудочную железу, селезенку, толстую кишку, тонкую кишку, спинной мозг, мышцу, яичник, матку, влагалище или половой член.
В некоторых вариантах осуществления заболевание, нарушение или состояние представляет собой нейродегенеративное заболевание, диабет, заболевание сердца, аутоиммунное заболевание, рак, заболевание печени, лизосомную болезнь накопления, нарушение свертываемости крови или нарушение коагуляции, ортопедические состояния, нарушение метаболизма аминокислот.
В некоторых вариантах осуществления заболевание, нарушение или состояние представляет собой нейродегенеративное заболевание. Иллюстративные нейродегенеративные заболевания включают болезнь Альцгеймера, болезнь Хантингтона, болезнь Паркинсона (PD), боковой амиотрофический склероз (ALS), рассеянный склероз (MS) и церебральный паралич (CP), дентато-рубро-паллидо-люисову атрофию (DRPLA), болезнь нейрональных внутриядреных гиалиновых включений (NIHID), деменцию с тельцами Леви, синдром Дауна, болезнь Галлервордена-Шпатца, прионные заболевания, деменцию с аргирофильными зеренами, кортокобазальную дегенерацию, деменцию боксеров, диффузные нейрофибриллярные сплетения, болезнь Герстмана-Штраусслера-Шейнкера, болезнь Крейтцфельдта-Якоба, болезнь Ниманна-Пика типа 3, прогрессирующий надъядерный паралич, подострый склерозирующий панэнцефалит, спиноцеребеллярую атаксию, болезнь Пика и дентато-рубро-паллидо-льюисову атрофию.
В некоторых вариантах осуществления заболевание, нарушение или состояние представляет собой аутоиммунное заболевание, например, склеродермию, рассеянный склероз, волчанку или аллергию.
В некоторых вариантах осуществления заболевание представляет собой заболевание печени, например, гепатит B, гепатит C, цирроз печени, NASH.
В некоторых вариантах осуществления заболевание, нарушение или состояние представляет собой рак. Иллюстративные типы рака включают лейкоз, лимфому, меланому, рак легкого, рак головного мозга (например, глиобластому), саркому, рак поджелудочной железы, рак почки, рак печени, рак яичка, рак предстательной железы или рак матки.
В некоторых вариантах осуществления заболевание, нарушение или состояние представляет собой ортопедическое состояние. Иллюстративные ортопедические состояния включают остеопороз, остеонекроз, болезнь Педжета или перелом.
В некоторых вариантах осуществления заболевание, нарушение или состояние представляет собой лизосомную болезнь накопления. Иллюстративные лизосомные болезни накопления включают болезнь Гоше (например, типа I, типа II, типа III), болезнь Тея-Сакса, болезнь Фабри, болезнь Фарбера, синдром Гурлер (также известный как мукополисахаридоз типа I (MPS I)), синдром Хантера, дефицит лизосомальной кислой липазы, болезнь Ниманна-Пика, болезнь Салла, синдром Санфилиппо (также известный как мукополисахаридоз типа IIIA (MPS3A)), множественную сульфатазную недостаточность, синдром Марото-Лами, метахроматическую лейкодистрофию, болезнь Краббе, синдром Шейе, синдром Гурлер-Шейе, синдром Слая, дефицит гиалуронидазы, болезнь Помпе, болезнь Данона, ганглиозидоз или синдром Моркио.
В некоторых вариантах осуществления заболевание, нарушение или состояние представляет собой нарушение свертывания крови или нарушение коагуляции. Иллюстративные нарушения свертывания крови или нарушения коагуляции включают гемофилию (например, гемофилию А или гемофилию В), болезнь Виллебранда, тромбоцитопению, уремию, синдром Бернара-Сулье, дефицит фактора XII, дефицит витамина К или врожденную афибриногенимию.
В некоторых вариантах осуществления заболевание, нарушение или состояние представляет собой нарушение метаболизма аминокислот, например, фенилкетонурию, тирозинемию (например, типа 1 или типа 2), алкаптонурию, гомоцистинурию, гипергомоцистеинемию, болезнь кленового сиропа.
В некоторых вариантах осуществления заболевание, нарушение или состояние представляет собой нарушение метаболизма жирных кислот, например, гиперлипидемию, гиперхолестеринемию, галактоземию.
В некоторых вариантах осуществления заболевание, нарушение или состояние представляет собой нарушение метаболизма пуринов или пиримидинов, например, синдром Леша-Нихена.
В настоящем изобретении дополнительно предусмотрены способы идентификации субъекта, имеющего или предположительно имеющего заболевание, нарушение или состояние, описанное в данном документе, и после такой идентификации введение субъекту имплантируемого элемента, содержащего активную клетку (например, клетку RPE), например, необязательно инкапсулированную в заключающий компонент и необязательно модифицированную соединением формулы (I), как описано в данном документе, или композицией на его основе.
Фармацевтические композиции, наборы и введение
В настоящем изобретении дополнительно предусмотрены имплантируемые элементы, содержащие активные клетки (например, клетки RPE), а также фармацевтические композиции, содержащие вышеуказанное и их наборы.
В некоторых вариантах осуществления фармацевтическая композиция содержит активные клетки (например, клетки RPE) и фармацевтически приемлемый наполнитель. В некоторых вариантах осуществления фармацевтическая композиция содержит сконструированные активные клетки (например, сконструированные клетки RPE, гидрогелевые капсулы, инкапсулирующие сконструированные клетки RPE) и фармацевтически приемлемый наполнитель. В некоторых вариантах осуществления активные клетки (например, клетки RPE) обеспечиваются в фармацевтической композиции в эффективном количестве. В некоторых вариантах осуществления эффективное количество представляет собой терапевтически эффективное количество. В некоторых вариантах осуществления эффективное количество представляет собой профилактически эффективное количество.
Фармацевтические композиции, описанные в данном документе, могут быть получены любым способом, известным в области фармакологии. Обычно такие способы получения включают стадии объединения активных клеток (например, клеток RPE или гидрогелевых капсул, инкапсулирующих клетки RPE, т. е. "активного ингредиента") с носителем и/или одним или более другими вспомогательными ингредиентами, и затем, если необходимо и/или требуется, придания формы и/или упаковки продукта в требуемый однодозовый или многодозовый контейнер.
Фармацевтические композиции можно получать, упаковывать или реализовывать в нерасфасованном виде, в виде единичной стандартной лекарственной формы и/или в виде совокупности стандартных лекарственных форм. Используемая в данном документе "стандартная лекарственная форма" представляет собой дискретное количество фармацевтической композиции, содержащей предварительно заданное количество активного ингредиента. Количество активного ингредиента обычно равно дозе активного ингредиента, которая будет вводиться субъекту, и/или удобной доле такой дозы, такой как, например, половина или одна треть такой дозы.
Относительные количества активного ингредиента, фармацевтически приемлемого вспомогательного вещества и/или любых дополнительных ингредиентов в фармацевтической композиции по настоящему изобретению будут меняться в зависимости от индивидуальных особенностей, размера и/или состояния субъекта, подлежащего лечению, и дополнительно зависят от пути, посредством которого будут вводить композицию. Например, композиция может содержать от 0,1 до 100% (вес/вес) активного ингредиента.
Термин "фармацевтически приемлемое вспомогательное вещество" относится к нетоксичному носителю, адъюванту, разбавителю или наполнителю, который не нарушает фармакологическую активность соединения, с которым оно составлено. Фармацевтически приемлемые вспомогательные вещества, применимые при изготовлении фармацевтических композиций по настоящему изобретению, представляют собой любые из хорошо известных в области получения фармацевтических составов и включают инертные разбавители, диспергирующие и/или гранулирующие средства, поверхностно-активные средства и/или эмульгаторы, дезинтегрирующие средства, связующие средства, консерванты, буферные средства, смазывающие средства и/или масла. Фармацевтически приемлемые вспомогательные вещества, применимые при изготовлении фармацевтических композиций по настоящему изобретению, включают без ограничения ионообменные вещества, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как сульфат протамина, гидрофосфат динатрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, карбоксиметилцеллюлозу натрия, полиакрилаты, воски, блок-сополимеры полиэтилена и полиоксипропилена, полиэтиленгликоль и ланолин.
Активные клетки (например, клетки RPE), имплантируемые элементы и композиции на их основе можно вводить перорально, парентерально (в том числе подкожно, внутримышечно и внутрикожно), местно, ректально, назально, внутрь опухоли, интратекально, буккально, вагинально или с помощью имплантируемого резервуара. В некоторых вариантах осуществления предусмотренные соединения или композиции можно вводить подкожно или посредством имплантата.
В некоторых вариантах осуществления активные клетки (например, клетки RPE), имплантируемые элементы (например, гидрогелевые капсулы, инкапсулирующие клетки RPE) и композиции на их основе можно вводить или имплантировать в определенную область организма, такую как поверхность слизистой оболочки или полость тела, или на нее. Иллюстративные места введения или имплантации включают брюшную полость (например, сальниковую сумку), жировую ткань, сердце, глаз, мышцу, селезенку, лимфатический узел, пищевод, нос, пазуху, зубы, десны, язык, рот, горло, тонкую кишку, толстую кишку, щитовидную железу, кость (например, бедро или сустав), молочную железу, хрящ, влагалище, матку, маточную трубу, яичник, половой член, яички, кровеносный сосуд, печень, почку, центральную нервную систему (например, мозг, спинной мозг, нерв) или ухо (например, улитку).
В некоторых вариантах осуществления активные клетки (например, клетки RPE), имплантируемые элементы и композиции на их основе вводят или имплантируют в место, отличное от центральной нервной системы, например, головного мозга, спинного мозга, нерва. В некоторых вариантах осуществления активные клетки (например, клетки RPE), имплантируемые элементы и композиции на их основе вводят или имплантируют в место, отличное от глаза (например, сетчатки).
Стерильные инъецируемые формы композиций по настоящему изобретению могут представлять собой водную или масляную суспензию. Эти суспензии могут быть составлены в соответствии с методиками, известными в данной области техники, с применением подходящих диспергирующих или смачивающих средств и суспендирующих средств. Стерильный инъекционный препарат также может представлять собой стерильный инъекционный раствор или суспензию в нетоксичном, приемлемом для парентерального введения разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых сред-носителей и растворителей, которые можно использовать, вода, раствор Рингера и изотонический раствор натрия хлорида. Кроме того, стерильные нелетучие масла традиционно используются в качестве растворителя или суспендирующей среды.
В случае офтальмологического применения предусмотренные фармацевтически приемлемые композиции могут быть составлены в виде микронизированных суспензий или в виде мази, такой как вазелин.
Для пролонгирования эффекта активного ингредиента может быть желательно замедлить всасывания лекарственного средства после подкожной или внутримышечной инъекции.
В некоторых вариантах осуществления активные клетки (например, клетки RPE) размещены на микроносителе (например, грануле, например, полистирольной грануле).
Хотя описания фармацевтических композиций, предусмотренных в данном документе, в первую очередь направлены на фармацевтические композиции, которые подходят для введения человеку, специалисту должно быть понятно, что такие композиции обычно подходят для введения животным всех видов. Модификация фармацевтических композиций, подходящих для введения человеку, чтобы получить композиции, подходящие для введения различным животным, хорошо понятна, и обычный опытный ветеринарный фармаколог может разработать и/или выполнить такую модификацию с помощью стандартных экспериментов.
Активные клетки (например, клетки RPE), имплантируемые элементы и композиции на их основе могут быть составлены в виде стандартной дозированной формы, например, единичной стандартной дозированной формы, для простоты введения и однородности дозирования. Однако будет понятно, что решение о суммарной дозе и схемах использования композиций по настоящему изобретению будет принимать лечащий врачом в рамках обоснованного врачебного решения. Конкретный терапевтически эффективный уровень дозы для любого конкретного субъекта или организма будет зависеть от целого ряда факторов, включая заболевание, подлежащее лечению, и тяжесть нарушения; активность конкретного используемого активного ингредиента; конкретную используемую композицию, возраст, массу тела, общее состояние здоровья, пол и рацион субъекта; время введения, путь введения и скорость экскреции конкретного используемого активного ингредиента; продолжительность лечения; лекарственные средства, применяемые в комбинации или одновременно с конкретным используемым активным ингредиентом; и аналогичных факторов, хорошо известные в области медицины.
Точное количество композиции, описанной в данном документе, которое требуется для достижения эффективного количества, будет меняться от субъекта к субъекту в зависимости, например, от вида, возраста и общего состояния субъекта, тяжести побочных эффектов или нарушения, природы конкретного соединения(-ий), пути введения и т. п. Требуемую дозу можно доставлять три раза в день, два раза в день, один раз в день, через день, раз в три дня, каждую неделю, каждые две недели, каждые три недели, каждые четыре недели, каждые три месяца, каждые шесть месяцев, один раз в год или реже. В определенных вариантах осуществления требуемую дозу можно доставлять с применением нескольких введений (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати или более введений). В определенных вариантах осуществления требуемую дозу сконструированных клеток RPE, инкапсулированных в гидрогелевые капсулы, доставляют после удаления всех или практически всех ранее введенных гидрогелевых капсул.
Будет понятно, что композицию, описанную в данном документе, можно вводить в комбинации с одним или более дополнительными фармацевтическими средствами. Соединения или композиции можно вводить в комбинации с дополнительными фармацевтическими средствами, которые улучшают их биодоступность, уменьшают и/или модифицируют их метаболизм, ингибируют их экскрецию и/или модифицируют их распределение в пределах организма. Также будет понятно, что используемое средство терапии может достигать требуемого эффекта в случае одного нарушения и/или может достигать разных эффектов.
Композицию можно вводить одновременно, до или после одного или более дополнительных фармацевтических средств, которые могут быть применимы как, например, в видах комбинированной терапии. Фармацевтические средства включают терапевтически активные средства. Фармацевтические средства также включают профилактически активные средства. Каждое дополнительное фармацевтическое средство можно вводить в дозе и/или по графику, определенным для этого фармацевтического средства. Дополнительные фармацевтические средства также можно вводить вместе друг с другом и/или с соединением или композицией, описанными в данном документе, в виде одной дозы или вводить отдельно в разных дозах. Для конкретной комбинации, используемой в схеме введения, будут учитывать совместимость соединения по настоящему изобретению с дополнительными фармацевтическими средствами и/или требуемый терапевтический и/или профилактический эффект, который должен быть достигнут. В целом, ожидается, что дополнительные фармацевтические средства, используемые в комбинации, следует использовать на уровнях, которые не превышают уровни, при которых они используются отдельно. В некоторых вариантах осуществления уровни, используемые в комбинации, будут ниже, чем уровни при использовании отдельно.
Иллюстративные дополнительные фармацевтические средства включают без ограничения антипролиферативные средства, противораковые средства, антидиабетические средства, противовоспалительные средства, иммунодепрессанты и обезболивающее средство. Фармацевтические средства включают малые органические молекулы, такие как лекарственные соединения (например, соединения, одобренные Управлением по контролю за продуктами и лекарствами США в соответствии со сводом федеральных правил (CFR)), пептиды, белки, углеводы, моносахариды, олигосахариды, полисахариды, нуклеопротеины, мукопротеины липопротеины, синтетические полипептиды или белки, малые молекулы, связанные с белками, гликопротеины, стероиды, нуклеиновые кислоты, ДНК, РНК, нуклеотиды, нуклеозиды, олигонуклеотиды, антисмысловые олигонуклеотиды, липиды, гормоны, витамины и клетки.
В настоящем изобретении также предусмотрены наборы (например, фармацевтические упаковки). Наборы по настоящему изобретению могут быть применимы для предупреждения и/или лечения любых заболеваний, нарушений или состояний, описанных в данном документе. Предусмотренные наборы могут содержать фармацевтическую композицию или устройство по настоящему изобретению и контейнер (например, флакон, ампулу, бутыль, шприц и/или дозирующую упаковку или другой подходящий контейнер). В некоторых вариантах осуществления предусмотренные наборы могут необязательно дополнительно включать второй контейнер, содержащий фармацевтическое вспомогательное вещество для разбавления или получения суспензии фармацевтической композиции или устройства по настоящему изобретению. В некоторых вариантах осуществления фармацевтическая композиция или устройство по настоящему изобретению, обеспечиваемые в контейнере, и второй контейнер объединяют с получением одной стандартной лекарственной формы.
Пронумерованные иллюстративные варианты осуществления
1. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированных клеток RPE), которые продуцируют или высвобождают терапевтическое средство (например, нуклеиновую кислоту (например, нуклеотид, ДНК или РНК), полипептид, липид, сахар (например, моносахарид, дисахарид, олигосахарид или полисахарид) или малую молекулу), где:
а) совокупность сконструированных активных клеток (например, сконструированных клеток RPE) или имплантируемый элемент продуцируют или высвобождают терапевтическое средство в течение по меньшей мере 5 дней, по меньшей мере 10 дней, по меньшей мере одного месяца или по меньшей мере 3 месяцев, например, при имплантировании в субъекта или при оценке посредством эталонного способа, описанного в данном документе, например, полимеразной цепной реакции или in situ гибридизации для нуклеиновых кислот; масс-спектроскопии для липидов, сахаров и малых молекул; микроскопии и других методик визуализации для средств, модифицированных с помощью флуоресцентной или люминесцентной метки, и ELISA или вестерн-блоттинга для полипептидов;
b) совокупность сконструированных активных клеток (например, сконструированных клеток RPE) или имплантируемый элемент продуцируют или высвобождают по меньшей мере 10 пикограммов терапевтического средства в день, например, продуцируют по меньшей мере 10 пикограммов терапевтического средства в день в течение по меньшей мере 5 дней, например, при культивировании in vitro, или при имплантации в субъекта, или при оценке посредством эталонного способа, например, применимого эталонного способа, перечисленного в части а) выше;
c) совокупность сконструированных активных клеток (например, сконструированных клеток RPE) или имплантируемый элемент продуцируют или высвобождают терапевтическое средство при норме, например, по меньшей мере 10 пикограммов терапевтического средства в день, что составляет по меньшей мере 50% (например, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 99%) от нормы, которую продуцируют контрольные клетки, когда, например, они не инкапсулированы в имплантируемый элемент или не встроены или не имплантированы в субъекта, например, согласно оценке посредством применимого эталонного способа, перечисленного в части а) выше;
d) совокупность сконструированных активных клеток (например, сконструированных клеток RPE) или имплантируемый элемент продуцируют или высвобождают терапевтическое средство в течение по меньшей мере 5 дней, и количество средства, высвобождаемого в день, не меняется более чем на 50% (например, по меньшей мере приблизительно 40%, приблизительно 30%, приблизительно 20%, приблизительно 10%, приблизительно 5% или менее), например, согласно оценке посредством применимого эталонного способа, перечисленного в части а) выше;
e) после введения имплантируемого элемента в субъект достаточное количество терапевтического средства продуцируется или высвобождается совокупностью сконструированных активных клеток или имплантируемым элементом, так что локализация, составляющая по меньшей мере приблизительно 5 см, приблизительно 10 см, приблизительно 25 см, приблизительно 50 см, приблизительно 75 см, приблизительно 100 см или приблизительно 150 см от введенного элемента, получает эффективную концентрацию (например, терапевтически эффективную концентрацию) терапевтического средства (например, терапевтически эффективную концентрацию, обнаруживаемую в поджелудочной железе, печени, крови или за пределами глаза), например, согласно оценке посредством применимого эталонного способа, перечисленного в части а) выше;
f) достаточное количество терапевтического средства продуцируется или высвобождается совокупностью сконструированных активных клеток или имплантируемым элементом, так что, например, если элемент встроен или имплантирован в брюшную полость субъекта, выявляемый уровень терапевтического средства, например, 10 пикограммов, обнаруживается в локализации, составляющей по меньшей мере 5 см, 10 см, 25 см, 50 см, 75 см, 100 см или 150 см от сконструированных активных клеток (например, сконструированных клеток RPE), например, согласно оценке посредством применимого эталонного способа, перечисленного в части а) выше;
g) после введения субъекту достаточное количество терапевтического средства продуцируется или высвобождается совокупностью сконструированных активных клеток или имплантируемым элементом, так что приблизительно 50% продуцируемого или высвобождаемого терапевтического средства (приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% или приблизительно 99% продуцируемого или высвобождаемого терапевтического средства) поступает в кровообращение (например, периферическое кровообращение) субъекта, например, согласно оценке посредством применимого эталонного способа, перечисленного в части а) выше;
h) совокупность сконструированных активных клеток (например, сконструированных клеток RPE) способна к фагоцитозу, например, способна к фагоцитозу на уровне приблизительно 99%, приблизительно 95%, приблизительно 90%, приблизительно 85%, приблизительно 80%, приблизительно 75%, приблизительно 70% приблизительно 60% или приблизительно 50% по сравнению с эталонными несконструированными активными клетками (например, несконструированными клетками RPE), например, согласно оценке посредством анализа с антителами, меченными флуоресцеином, микроскопии (например, флуоресцентной микроскопии (например, замедленной съемки или оценки образования веретена деления) или проточной цитометрии;
i) совокупность сконструированных активных клеток (например, сконструированных клеток RPE) способна к аутофагии, например, способна к аутофагии на уровне приблизительно 99%, приблизительно 95%, приблизительно 90%, приблизительно 85%, приблизительно 80%, приблизительно 75%, приблизительно 70%, приблизительно 60% или приблизительно 50% по сравнению с эталонными несконструированными активными клетками (например, несконструированными клетками RPE), например, согласно оценке посредством анализа с 5-этинил-2'-дезоксиуридином (EdU), анализа с 5-бром-2'-дезоксиуридином (BrdU), анализа с катионной амфифильной меткой (CAT) или микроскопии (например, флуоресцентной микроскопии (например, замедленной съемки или оценки образования веретена деления), иммуноблоттинг-анализа LC3 и p62, обнаружения образования аутофагосом с помощью флуоресцентной микроскопии и мониторинга созревания аутофагосом с помощью тандемной флуоресцентной микроскопии mRFP-GFP;
j) совокупность сконструированных активных клеток (например, сконструированных клеток RPE) характеризуется форм-фактором, описанным в данном документе, например, в виде кластера, сфероида или агрегата сконструированных активных клеток (например, сконструированных клеток RPE);
k) совокупность сконструированных активных клеток (например, сконструированных клеток RPE) характеризуется средним минимальным числом клеточных контактов (например, плотных клеточных контактов) на клетку, например, согласно оценке посредством фиксации, микроскопии, или способна к его образованию;
l) совокупность сконструированных активных клеток (например, сконструированных клеток RPE) размещена на неклеточном носителе (например, микроносителе, например, грануле, например, полиэфирной, полистирольной или полимерной грануле);
m) совокупность сконструированных активных клеток (например, сконструированных клеток RPE) пролиферирует или способна пролиферировать после инкапсуляции в имплантируемый элемент, например, согласно определению посредством микроскопии (например, анализа с 5-этинил-2'-дезоксиуридином (EdU));
n) совокупность сконструированных активных клеток (например, сконструированных клеток RPE) не пролиферирует или не способна пролиферировать после инкапсуляции в имплантируемый элемент, например, согласно определению посредством микроскопии (например, анализа с 5-этинил-2'-дезоксиуридином (EdU)); или
o) после внесения, введения или имплантации в субъекта достаточное количество терапевтического средства продуцируется или высвобождается совокупностью сконструированных активных клеток или имплантируемым элементом, так что эффективная концентрация (например, терапевтически эффективная концентрация) терапевтического средства обнаруживается в периферическом кровотоке (например, терапевтически эффективная концентрация обнаруживается в поджелудочной железе, печени, крови или за пределами глаза).
2. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированных клеток RPE), причем каждая клетка в совокупности содержит экзогенную нуклеиновую кислоту, которая стимулирует и/или обеспечивает условия для продуцирования полипептида, например, терапевтического полипептида, где совокупность сконструированных активных клеток (например, сконструированных клеток RPE) продуцирует или высвобождает полипептид в течение по меньшей мере 5 дней, например, при имплантации в субъекта или при оценке посредством эталонного способа, например, ELISA или вестерн-блоттинга.
3. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированных клеток RPE), причем каждая клетка в совокупности содержит экзогенную нуклеиновую кислоту, которая стимулирует и/или обеспечивает условия продуцирования полипептида, например, терапевтического полипептида, где совокупность сконструированных активных клеток (например, сконструированных клеток RPE) продуцирует или высвобождает по меньшей мере 10 пикограммов полипептида в день, например, продуцирует по меньшей мере 10 пикограммов полипептида в день в течение по меньшей мере 5 дней, например, при имплантации в субъекта или при оценке посредством эталонного способа, например, ELISA или вестерн-блоттинга.
4. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированных клеток RPE), причем каждая клетка в совокупности содержит экзогенную нуклеиновую кислоту, которая стимулирует и/или создает условия для продуцирования полипептида, например, терапевтического полипептида, где совокупность сконструированных активных клеток (например, сконструированные клетки RPE) продуцирует или высвобождает полипептид при норме, например, по меньшей мере 10 пикограммов полипептида в день, что составляет по меньшей мере 50% (например, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 99%) от нормы для эталонных клеток, не инкапсулированных в имплантируемый элемент или не встроенных или не имплантированных в субъекта, например, согласно оценке посредством ELISA или вестерн-блоттинга.
5. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированных клеток RPE), причем каждая клетка в совокупности содержит экзогенную нуклеиновую кислоту, которая стимулирует и/или обеспечивает условия для продуцирования полипептида, например, терапевтического полипептида, где совокупность сконструированных активных клеток (например, сконструированных клеток RPE) продуцирует или высвобождает полипептид в течение по меньшей мере 5 дней, и количество полипептида, высвобождаемого в день, не меняется более чем на 50% (например, по меньшей мере приблизительно 40%, приблизительно 30%, приблизительно 20%, приблизительно 10%, приблизительно 5% или менее), например, согласно оценке посредством ELISA или вестерн-блоттинга.
6. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированных клеток RPE), причем каждая клетка в совокупности содержит экзогенную нуклеиновую кислоту, которая стимулирует и/или обеспечивает условия для продуцирования полипептида, например, терапевтического полипептида, где после введения элемент в субъекта продуцируется или высвобождается достаточное количество полипептида, так что локализация, составляющая по меньшей мере приблизительно 5 см, приблизительно 10 см, приблизительно 25 см, приблизительно 50 см, приблизительно 75 см, приблизительно 100 см или приблизительно 150 см от введенного элемента, получает эффективную концентрацию (например, терапевтически эффективную концентрацию) полипептида (например, терапевтически эффективную концентрацию, обнаруживаемую в поджелудочной железе, печени, крови или за пределами глаза).
7. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированных клеток RPE), причем каждая клетка в совокупности содержит экзогенную нуклеиновую кислоту, которая стимулирует и/или обеспечивает условия для продуцирования полипептида, например, терапевтического полипептида, где продуцируется или высвобождается достаточное количество полипептида, так что, что при встраивании или имплантации элемента в брюшную полость субъекта, например, выявляемый уровень полипептида, например, 10 пикограммов, обнаруживается в локализации, составляющей по меньшей мере 5 см, 10 см, 25 см, 50 см, 75 см, 100 см или 150 см от элемента.
8. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированных клеток RPE), причем каждая клетка в совокупности содержит экзогенную нуклеиновую кислоту, которая стимулирует и/или обеспечивает условия для продуцирования полипептида, например, терапевтического полипептида, где после введения элемента в субъекта продуцируется или высвобождается достаточное количество полипептида, так что приблизительно 50% продуцируемого или высвобождаемого полипептида (приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% или приблизительно 99% продуцируемого или высвобождаемого терапевтического полипептида) поступает в кровообращение (например, периферическое кровообращение) субъекта.
9. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированных клеток RPE), причем каждая клетка в совокупности содержит экзогенную нуклеиновую кислоту, которая стимулирует и/или обеспечивает условия для продуцирования полипептида, например терапевтического полипептида, где сконструированные активные клетки (например, сконструированные клетки RPE) способны к фагоцитозу, например, способны к фагоцитозу на уровне приблизительно 99%, приблизительно 95%, приблизительно 90%, приблизительно 85%, приблизительно 80%, приблизительно 75%, приблизительно 70% приблизительно 60% или приблизительно 50% по сравнению с эталонными несконструированными активными клетками (например, несконструированными клетками RPE), например, согласно оценке посредством анализа с антителами, меченными флуоресцеином, микроскопии (например, флуоресцентной микроскопии (например, замедленной съемки или оценки образования веретена деления) или проточной цитометрии.
10. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированных клеток RPE), причем каждая клетка в совокупности содержит экзогенную нуклеиновую кислоту, которая стимулирует и/или обеспечивает условия для продуцирования полипептида, например, терапевтического полипептида, где совокупность сконструированных активных клеток (например, сконструированных клеток RPE) способна к аутофагии, например, способна к аутофагии на уровне приблизительно 99%, приблизительно 95%, приблизительно 90%, приблизительно 85%, приблизительно 80%, приблизительно 75%, приблизительно 70%, приблизительно 60% или приблизительно 50% по сравнению с эталонными несконструированными активными клетками (например, несконструированными клетками RPE), например, согласно оценке посредством анализа с 5-этинил-2'-дезоксиуридином (EdU), анализа с 5-бром-2'-дезоксиуридином (BrdU), анализа с катионной амфифильной меткой (CAT) или микроскопии (например, флуоресцентной микроскопии (например, замедленной съемки или оценки образования веретена деления), иммуноблоттинг-анализа LC3 и p62, обнаружения образования аутофагосом с помощью флуоресцентной микроскопии и мониторинга созревания аутофагосом с помощью тандемной флуоресцентной микроскопии mRFP-GFP.
11. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированных клеток RPE), причем каждая клетка в совокупности содержит экзогенную нуклеиновую кислоту, которая стимулирует и/или обеспечивает условия для продуцирования полипептида, например, терапевтического полипептида, где обеспечивается совокупность сконструированных активных клеток (например, сконструированных клеток RPE), характеризующаяся форм-фактором, описанным в данном документе, например, в виде кластер, сфероид или агрегата сконструированных активных клеток (например, сконструированных клеток RPE).
12. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированных клеток RPE), причем каждая клетка в совокупности содержит экзогенную нуклеиновую кислоту, которая стимулирует и/или обеспечивает условия для продуцирования полипептида, например, терапевтического полипептида, где совокупность сконструированных активных клеток (например, сконструированных клеток RPE) характеризуется средним минимальным числом клеточных контактов на клетку, например, согласно оценке посредством фиксации, микроскопии, или способна к его образованию.
13. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированных клеток RPE), причем каждая клетка в совокупности содержит экзогенную нуклеиновую кислоту, которая стимулирует и/или обеспечивает условия для продуцирования полипептида, например, терапевтического полипептида, где совокупность сконструированных активных клеток (например, сконструированных клеток RPE) размещена на неклеточном носителе (например, микроносителе, например, грануле, например, полиэфирной, полистирольной или полимерной грануле).
14. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированных клеток RPE), причем каждая клетка в совокупности содержит экзогенную нуклеиновую кислоту, которая стимулирует и/или обеспечивает условия для продуцирования полипептида, например, терапевтического полипептида, где совокупность сконструированных активных клеток (например, сконструированных клеток RPE) пролиферирует или способна пролиферировать после инкапсуляции в имплантируемый элемент, например, согласно определению посредством микроскопии.
15. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированную клетку RPE), причем каждая клетка в совокупности содержит экзогенную нуклеиновую кислоту, которая стимулирует и/или обеспечивает условия для продуцирования полипептида, например, терапевтического полипептида, где совокупность сконструированных активных клеток (например, сконструированных клеток RPE) не пролиферирует или не способна пролиферировать после инкапсуляции в имплантируемый элемент, например, согласно определению посредством микроскопии.
16. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированных клеток RPE), причем каждая клетка в совокупности содержит экзогенную нуклеиновую кислоту, которая стимулирует и/или обеспечивает условия для продуцирования полипептида, например, терапевтического полипептида, где после внесения, введения или имплантации в субъекта продуцируется или высвобождается достаточное количество полипептида, так что эффективная концентрация (например, терапевтически эффективная концентрация) полипептида обнаруживается в периферическом кровотоке (например, терапевтически эффективная концентрация обнаруживается в поджелудочной железе, печени, крови или за пределами глаза).
17. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированных клеток RPE), которые продуцируют или высвобождают терапевтическое средство (например, нуклеиновую кислоту (например, нуклеотид, ДНК или РНК), полипептид, липид, сахар (например, моносахарид, дисахарид, олигосахарид или полисахарид) или малую молекулу).
18. Любой из вариантов осуществления 2-17, где экзогенная нуклеиновая кислота представляет собой молекулу РНК (например, mRNA) или молекулу ДНК.
19. Любой из вариантов осуществления 1-18, где полипептид или терапевтическое средство выбраны из группы, состоящей из полипептидов фактора I, фактора II, фактора V, фактора VII, фактора VIII, фактора IX, фактора X, фактора XI и фактора XIII.
20. Имплантируемый элемент по любому из вариантов осуществления 1-19, где полипептид или терапевтическое средство являются полипептидом инсулина (например, А-цепь инсулина, В-цепь инсулина или проинсулин).
21. Имплантируемый элемент по любому из вариантов осуществления 1-18, где полипептид или терапевтическое средство не являются полипептидом инсулина (например, ни одним из А-цепи инсулина, В-цепи инсулина или проинсулина).
22. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированных клеток RPE), причем каждая клетка в совокупности содержит экзогенную нуклеиновую кислоту, которая кодирует аминокислотную последовательность фактора VIII-BDD (FVIII-BDD).
23. Имплантируемый элемент по варианту осуществления 22, где аминокислотная последовательность FVIII-BDD выбрана из группы, состоящей из:
a) SEQ ID NO:1;
b) SEQ ID NO:3;
c) SEQ ID NO:4;
d) SEQ ID NO:5;
e) SEQ ID NO:6;
f) SEQ ID NO:7;
g) SEQ ID NO:7 с аланином вместо аргинина в положении 787 и аланином вместо аргинина в положении 790;
h) варианта последовательности из (a), (b), (c), (d), (f) или (g) с консервативными заменами; и
i) последовательности, характеризующейся по меньшей мере 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности с последовательностями из (a), (b), (c), (d), (f), (g) или (h);
24. Имплантируемый элемент по варианту осуществления 22, где экзогенная нуклеиновая кислота содержит кодирующую последовательность, которая
a) выбрана из группы, состоящей из SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17 и SEQ ID NO:27; или
b) представляет собой нуклеотидную последовательность, которая характеризуется по меньшей мере 98%, 99% или большей идентичностью последовательности с любой из последовательностей, перечисленных в а).
25. Имплантируемый элемент по варианту осуществления 25, где экзогенная нуклеиновая кислота содержит кодирующую последовательность, выбранную из группы, состоящей из SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17 и SEQ ID NO:27.
26. Имплантируемый элемент по любому из вариантов осуществления 22-25, где экзогенная нуклеиновая кислота содержит SEQ ID NO:16 или SEQ ID NO:27.
27. Имплантируемый элемент, содержащий совокупность сконструированных активных клеток (например, сконструированных клеток RPE), причем каждая клетка в совокупности содержит экзогенную нуклеиновую кислоту, которая кодирует аминокислотную последовательность фактора IX (FIX).
28. Имплантируемый элемент по варианту осуществления 24, где аминокислотная последовательность FIX представляет собой SEQ ID NO:2, или ее вариант с консервативными заменами, или последовательность, которая характеризуется по меньшей мере 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности с SEQ ID NO:2 или вариантом с консервативными заменами.
28a. Имплантируемый элемент по варианту осуществления 24, где аминокислотная последовательность FIX представляет собой SEQ ID NO:36, или ее вариант с консервативными заменами, или последовательность, которая характеризуется по меньшей мере 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности с SEQ ID NO:36 или ее вариантом в консервативными заменами.
29. Имплантируемый элемент по любому из вариантов осуществления 27 или 28, где экзогенная нуклеиновая кислота содержит кодирующую последовательность, которая
a) выбрана из группы, состоящей из SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21 и SEQ ID NO:28; или
b) характеризуется по меньшей мере 98%, 99% или большей идентичностью последовательности с любой из последовательностей из (а).
30. Имплантируемый элемент по любому из вариантов осуществления 27-29, где экзогенная нуклеиновая кислота содержит SEQ ID NO:19 или SEQ ID NO:28.
31. Сконструированная активная клетка, например, клетка RPE, или имплантируемый элемент, содержащий активную клетку, где активная клетка содержит экзогенную нуклеиновую кислоту, которая содержит промоторную последовательность, функционально связанную с кодирующей последовательностью для полипептида, где промоторная последовательность фактически состоит или состоит из SEQ ID NO:23 или характеризуется по меньшей мере 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности с SEQ ID NO:23.
32. Сконструированная активная клетка или имплантируемый элемент по варианту осуществления 30, где полипептид содержит, фактически состоит или состоит из аминокислотной последовательности, которая представляет собой:
a) аминокислотную последовательность FVIII-BDD, например, последовательность, выбранную из группы, состоящей из SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7 и SEQ ID NO:7 с аланином вместо аргинина в каждом из положений 787 и 790;
b) аминокислотную последовательность FIX, например, SEQ ID NO:2, или аминокислотную последовательность, характеризующуюся по меньшей мере 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности с SEQ ID NO:2;
с) аминокислотную последовательность интерейкина-2, например, SEQ ID NO:29, или аминокислотную последовательность, характеризующуюся по меньшей мере 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности с SEQ ID NO:29;
с) аминокислотную последовательность паратиреоидного гормона, например, SEQ ID NO:30, или аминокислотную последовательность, характеризующуюся по меньшей мере 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности с SEQ ID NO:30; или
e) аминокислотную последовательность фактора фон Виллебранда, например, SEQ ID NO: 32 или SEQ ID NO:33, или аминокислотную последовательность, характеризующуюся по меньшей мере 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности с SEQ ID NO: 32 или SEQ ID NO:33.
33. Сконструированная активная клетка или имплантируемый элемент по любому из вариантов осуществления 31 или 32, где полипептид содержит SEQ ID NO:10, а кодирующая последовательность содержит SEQ ID NO:16 или последовательность, характеризующуюся по меньшей мере 99% идентичностью последовательности с SEQ ID NO:16.
34. Сконструированная активная клетка или имплантируемый элемент по любому из вариантов осуществления 30-32, где полипептид содержит, фактически состоит или состоит из SEQ ID NO:2, а кодирующая последовательность содержит, фактически состоит или состоит из SEQ ID NO: 19 или последовательности, характеризующейся по меньшей мере 99% идентичностью последовательности с SEQ ID NO:19.
35. Активная клетка или имплантируемый элемент по любому из вариантов осуществления 30-34, где полипептид дополнительно содержит SEQ ID NO:34 или SEQ ID NO:35.
36. Активная клетка или имплантируемый элемент по любому из вариантов осуществления 30-35, где экзогенная нуклеиновая кислота содержит последовательность Козак непосредственно перед кодирующей последовательностью.
37. Активная клетка или имплантируемый элемент по варианту осуществления 36, где последовательность Козак представляет собой нуклеотиды 2094-2099 из SEQ ID NO:26.
38. Активная клетка или имплантируемый элемент по любому из вариантов осуществления 30-37, где промоторная последовательность представляет собой SEQ ID NO:23.
39. Сконструированная клетка RPE (например, сконструированная клетка ARPE-19) или имплантируемый элемент, содержащий сконструированную клетку RPE, где сконструированная клетка RPE содержит экзогенную нуклеиновую кислоту, где экзогенная нуклеиновая кислота содержит кодирующую последовательность, выбранную из группы, состоящей из: SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20 и SEQ ID NO:21.
40. Сконструированная клетка RPE или имплантируемый элемент по варианту осуществления 39, где экзогенная нуклеиновая кислота содержит SEQ ID NO:23, функционально связанную с выбранной кодирующей последовательностью.
41. Сконструированная клетка RPE или имплантируемый элемент по варианту осуществления 40, где экзогенная нуклеиновая кислота содержит последовательность Козак непосредственно перед кодирующей последовательностью.
42. Сконструированная клетка RPE или имплантируемый элемент по любому из вариантов осуществления 39-41, где экзогенная нуклеиновая кислота содержит SEQ ID NO:27 или SEQ ID NO:28.
43. Имплантируемый элемент или сконструированная клетка по любому из предыдущих вариантов осуществления, которую обеспечивают в качестве средства для лечения заболевания.
44. Имплантируемый элемент или сконструированная клетка по варианту осуществления 43, где заболевание представляет собой заболевание свертывания крови или лизосомную болезнь накопления (например, гемофилию (например, гемофилию A или гемофилию B), болезнь Фабри, болезнь Гоше, болезнь Помпе или MPS I).
45. Имплантируемый элемент или сконструированная клетка по любому из предыдущих вариантов осуществления, которую обеспечивают в качестве средства для профилактического лечения.
46. Имплантируемый элемент по любому из предыдущих вариантов осуществления, который составлен для инъекции в субъекта (например, внутрибрюшинной, внутримышечной или подкожной инъекции) или составлен для имплантации в субъекта (например, в брюшную полость, например, сальниковую сумку).
47. Имплантируемый элемент или сконструированная клетка по любому из предыдущих вариантов осуществления, которые имплантируют или вводят в сальниковую сумку, в сальник или в подкожный жир субъекта.
48. Имплантируемый элемент или сконструированная клетка по любому из предыдущих вариантов осуществления, которые вводятся первому субъекту, имеющему меньше приблизительно 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 2% или 1% полипептида (например, фактора свертывания крови, например, фактора I, фактора II, фактора V, фактора VII, фактора VIII, фактора IX, фактора X, фактора XI или фактора XIII) относительно второго субъекта (например, здорового субъекта), например, согласно определению посредством анализа крови.
49. Имплантируемый элемент или сконструированная клетка по любому из предыдущих вариантов осуществления, где уровень биомаркера (например, биомаркера сыворотки крови) у субъекта контролируется, например, для определения уровня эффективности лечения.
50. Имплантируемый элемент по любому из предыдущих вариантов осуществления, который содержит кластер сконструированных активных клеток (например, кластер сконструированных клеток RPE) или микроноситель (например, гранулу или матрицу, содержащие сконструированную активную клетку (например, сконструированную клетку RPE) или совокупность сконструированных активных клеток (например, сконструированных клеток RPE)).
51. Имплантируемый элемент по варианту осуществления 50, где совокупность сконструированных активных клеток (например, сконструированных клеток RPE) или микроноситель (например, гранула или матрица, содержащие совокупность сконструированных активных клеток (например, сконструированных клеток RPE)) продуцируют совокупность полипептидов.
52. Имплантируемый элемент по любому из предыдущих вариантов осуществления, где имплантируемый элемент содержит заключающий компонент.
53. Имплантируемый элемент по варианту осуществления 52, где заключающий компонент сформован in situ на сконструированной активной клетке (например, сконструированной клетке RPE), совокупности сконструированных активных клеток (например, сконструированных клеток RPE) или микроносителе (например, грануле или матрице), содержащем активную клетку или активные клетки, или вокруг них.
54. Имплантируемый элемент по п. 52, где заключающий компонент предварительно сформован перед объединением с заключаемой сконструированной активной клеткой (например, сконструированной клеткой RPE), совокупностью сконструированных активных клеток (например, сконструированных клеток RPE) или микроносителем (например, гранулой или матрицей), содержащим активную клетку или активные клетки.
55. Имплантируемый элемент по любому из вариантов осуществления 52-54, где заключающий компонент предусматривает гибкий полимер (например, PLA, PLG, PEG, CMC или полисахарид, например, альгинат).
56. Имплантируемый элемент по любому из вариантов осуществления 52-54, где заключающий компонент предусматривает негибкий полимерный или металлический корпус.
57. Имплантируемый элемент по любому из предыдущих вариантов осуществления, который является химически модифицированным.
58. Имплантируемый элемент по любому из вариантов осуществления 52-57, где заключающий компонент является химически модифицированным.
59. Имплантируемый элемент по любому из предыдущих вариантов осуществления, где имплантируемый элемент или его заключающий компонент модифицированы с помощью соединения формулы (I):
или его соли, где:
А представляет собой алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил, -O-, -C(O)O-, -C(O)-, -OC(O)-, -N(RC)-, -N(RC)C(O)-, -C(O)N(RC)-, -N(RC)C(O)(C1-C6-алкилен)-, -N(RC)C(O)(C1-C6-алкенилен)-, -N(RC)N(RD)-, -NCN-, -C(=N(RC)(RD))O-, -S-, -S(O)x-, -OS(O)x-, -N(RC)S(O)x-, -S(O)xN(RC)-, -P(RF)y-, -Si(ORA)2 -, -Si(RG)(ORA)-, -B(ORA)- или металл, где каждый алкил, алкенил, алкинил, алкилен, алкенилен, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил связан с группой присоединения (например, группой присоединения, определенной в данном документе) и необязательно замещен одним или более R1;
каждый из L1 и L3 независимо представляет собой связь, алкил или гетероалкил, где каждый алкил и гетероалкил необязательно замещен одним или более R2;
L2 представляет собой связь;
М отсутствует или представляет собой алкил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил, каждый из которых необязательно замещен одним или более R3;
P отсутствует или представляет собой циклоалкил, гетероциклил или гетероарил, каждый из которых необязательно замещен одним или более R4;
Z представляет собой водород, алкил, алкенил, алкинил, гетероалкил, -ORA, -C(O)RA, -C(O)ORA, -C(O)N(RC)(RD), -N(RC)C(O)RA, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R5;
каждый RA, RB, RC, RD, RE, RF и RG независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, галоген, азидо, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R6;
или RC и RD, взятые вместе с атомом азота, к которому они присоединены, образуют кольцо (например, 5-7-членное кольцо), необязательно замещенное одним или более R6;
каждый R1, R2, R3, R4, R5 и R6 независимо представляет собой алкил, алкенил, алкинил, гетероалкил, галоген, циано, азидо, оксо, -ORA1, -C(O)ORA1, -C(O)RB1,-OC(O)RB1, -N(RC1)(RD1), -N(RC1)C(O)RB1, -C(O)N(RC1), SRE1, S(O)xRE1, -OS(O)xRE1, -N(RC1)S(O)xRE1, - S(O)xN(RC1)(RD1), -P(RF1)y, циклоалкил, гетероциклил, арил, гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R7;
каждый RA1, RB1, RC1, RD1, RE1 и RF1 независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил необязательно замещен одним или более R7;
каждый R7 независимо представляет собой алкил, алкенил, алкинил, гетероалкил, галоген, циано, оксо, гидроксил, циклоалкил или гетероциклил;
х составляет 1 или 2; и
y составляет 2, 3 или 4.
60. Имплантируемый элемент по варианту осуществления 59, где соединение формулы (I) представляет собой соединение формулы (II):
(II),
или его фармацевтически приемлемую соль, где:
кольцо M1 представляет собой циклоалкил, гетероциклил, арил или гетероарил, каждый из которых независимо замещен 1-5 R3;
кольцо Z1 представляет собой циклоалкил, гетероциклил, арил или гетероарил, необязательно замещенный 1-5 R5;
каждый из R2a, R2b, R2c и R2d независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, галоген, циано, нитро, амино, оксо, циклоалкил, гетероциклил, арил или гетероарил;
X отсутствует или представляет собой N(R10)(R11), O или S;
RC представляет собой водород, алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил, где каждый из алкила, алкенила, алкинила, гетероалкила, циклоалкила, гетероциклила, арила или гетероарила необязательно замещен 1-6 R6;
каждый из R3, R5 и R6 независимо представляет собой алкил, алкенил, алкинил, гетероалкил, галоген, циано, азидо, оксо, -ORA1, -C(O)ORA1, -C(O)RB1,-OC(O)RB1, -N(RC1)(RD1), -N(RC1)C(O)RB1, -C(O)N(RC1), SRE1, циклоалкил, гетероциклил, арил или гетероарил;
каждый из R10 и R11 независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, -C(O)ORA1, -C(O)RB1,-OC(O)RB1, -C(O)N(RC1), циклоалкил, гетероциклил, арил или гетероарил; каждый RA1, RB1, RC1, RD1 и RE1 независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил, где каждый из алкила, алкенила, алкинила, гетероалкила, циклоалкила, гетероциклила, арила, гетероарила необязательно замещен 1-6 R7;
каждый R7 независимо представляет собой алкил, алкенил, алкинил, гетероалкил, галоген, циано, оксо, гидроксил, циклоалкил или гетероциклил;
каждый из m и n независимо составляет 0, 1, 2, 3, 4, 5 или 6;
и "  " обозначает связь с группой присоединения или полимером, описанным в данном документе.
" обозначает связь с группой присоединения или полимером, описанным в данном документе.
61. Имплантируемый элемент по варианту осуществления 60, где соединение формулы (II) представляет собой соединение формулы (II-a):
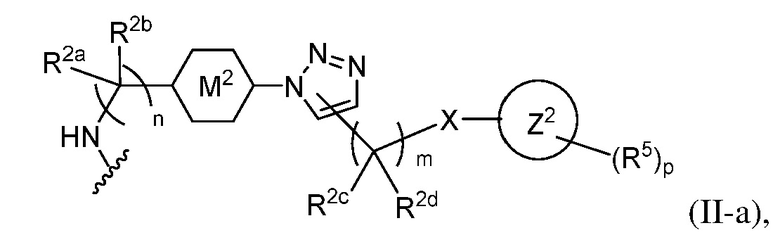
или его фармацевтически приемлемую соль, где:
кольцо M2 представляет собой арил или гетероарил;
кольцо Z2 представляет собой циклоалкил, гетероциклил, арил или гетероарил;
каждый из R2a, R2b, R2c и R2d независимо представляет собой водород, алкил, гетероалкил или оксо;
X отсутствует или представляет собой O или S;
каждый R5 независимо представляет собой алкил, гетероалкил, галоген, оксо, -ORA1, -C(O)ORA1, -C(O)RB1, -N(RC1)(RD1), -N(RC1)C(O)RB1 или -C(O)N(RC1);
или два R5, взятые вместе, образуют 5-6-членное кольцо, конденсированное с кольцом Z2;
каждый RA1, RB1, RC1, RD1 и RE1 независимо представляет собой водород, алкил, гетероалкил;
каждый m и p независимо составляет 0, 1, 2, 3, 4, 5 или 6; и
"  " обозначает связь с имплантируемым элементом или его заключающим компонентом (например, имплантируемым элементом или заключающим его компонентом).
" обозначает связь с имплантируемым элементом или его заключающим компонентом (например, имплантируемым элементом или заключающим его компонентом).
62. Имплантируемый элемент по варианту осуществления 60, где соединение формулы (II-а) представляет собой соединение формулы (II-b):
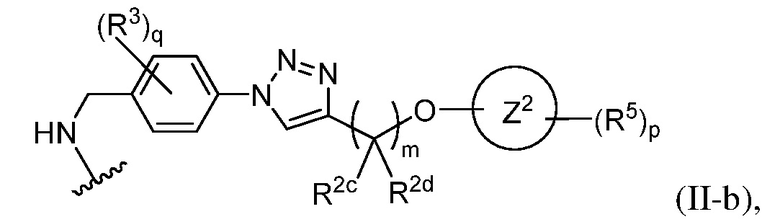
или его фармацевтически приемлемую соль, где:
кольцо Z2 представляет собой циклоалкил, гетероциклил, арил или гетероарил;
каждый R3 и R5 независимо представляет собой алкил, гетероалкил, галоген, оксо, -ORA1, -C(O)ORA1 или -C(O)RB1;
каждый RA1 и RB1 независимо представляет собой водород, алкил или гетероалкил;
каждый из p и q независимо составляет 0, 1, 2, 3, 4, 5 или 6;
и "  " обозначает связь с группой присоединения или полимером, описанным в данном документе.
" обозначает связь с группой присоединения или полимером, описанным в данном документе.
63. Имплантируемый элемент по варианту осуществления 60, где соединение формулы (II-а) представляет собой соединение формулы (II-с):
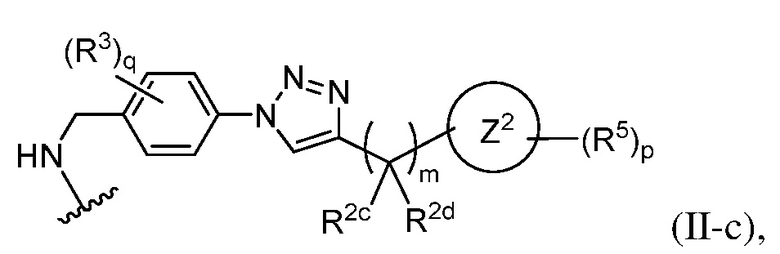
или его фармацевтически приемлемую соль, где:
кольцо Z2 представляет собой циклоалкил, гетероциклил, арил или гетероарил;
каждый из R2c и R2d независимо представляет собой водород, алкил или гетероалкил, или каждый из R2c и R2d, взятые вместе, образуют оксо-группу;
каждый R3 и R5 независимо представляет собой алкил, гетероалкил, галоген, оксо, -ORA1, -C(O)ORA1 или -C(O)RB1;
каждый RA1 и RB1 независимо представляет собой водород, алкил или гетероалкил;
m составляет 1, 2, 3, 4, 5 или 6;
каждый из p и q независимо составляет 0, 1, 2, 3, 4, 5 или 6;
и "  " обозначает связь с группой присоединения или полимером, описанным в данном документе.
" обозначает связь с группой присоединения или полимером, описанным в данном документе.
64. Имплантируемый элемент по варианту осуществления 60, где соединение формулы (II-а) представляет собой соединение формулы (II-d):
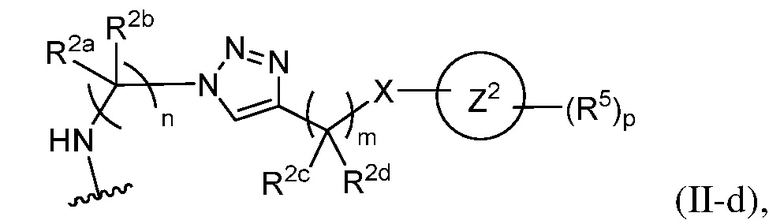
или его фармацевтически приемлемую соль, где:
кольцо Z2 представляет собой циклоалкил, гетероциклил, арил или гетероарил;
X отсутствует или представляет собой O или S;
каждый из R2a, R2b, R2c и R2d независимо представляет собой водород, алкил или гетероалкил, или каждый из R2a и R2b или R2c и R2d, взятые вместе, образуют оксо-группу;
каждый R5 независимо представляет собой алкил, гетероалкил, галоген, оксо, -ORA1, -C(O)ORA1 или -C(O)RB1;
каждый RA1 и RB1 независимо представляет собой водород, алкил или гетероалкил;
каждый из m и n независимо составляет 1, 2, 3, 4, 5 или 6;
p составляет 0, 1, 2, 3, 4, 5 или 6;
и "  " обозначает связь с группой присоединения или полимером, описанным в данном документе.
" обозначает связь с группой присоединения или полимером, описанным в данном документе.
65. Имплантируемый элемент по варианту осуществления 59, где соединение формулы (I) представляет собой соединение формулы (III-a):
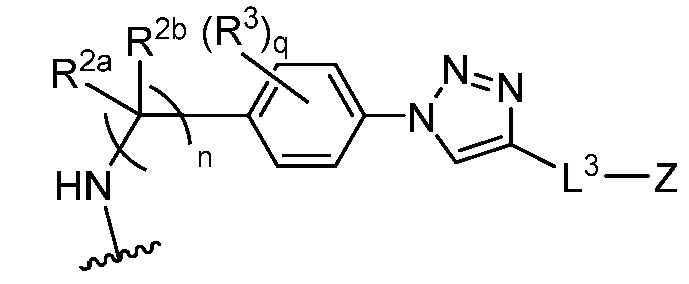 (III-a),
(III-a),
или его фармацевтически приемлемую соль, где
L3 представляет собой алкил или гетероалкил, каждый из которых необязательно замещен одним или более R2;
Z представляет собой алкил или гетероалкил, каждый из которых необязательно замещен одним или более R5;
каждый из R2a и R2b независимо представляет собой водород, алкил или гетероалкил, или R2a и R2b, взятые вместе, образуют оксо-группу;
каждый R2, R3 и R5 независимо представляет собой алкил, гетероалкил, галоген, оксо, -ORA1, -C(O)ORA1 или -C(O)RB1;
каждый RA1 и RB1 независимо представляет собой водород, алкил или гетероалкил;
n независимо составляет 1, 2, 3, 4, 5 или 6;
и "  " обозначает связь с группой присоединения или полимером, описанным в данном документе.
" обозначает связь с группой присоединения или полимером, описанным в данном документе.
66. Имплантируемый элемент по варианту осуществления 59, где соединение формулы (I) представляет собой соединение формулы (IV-a):
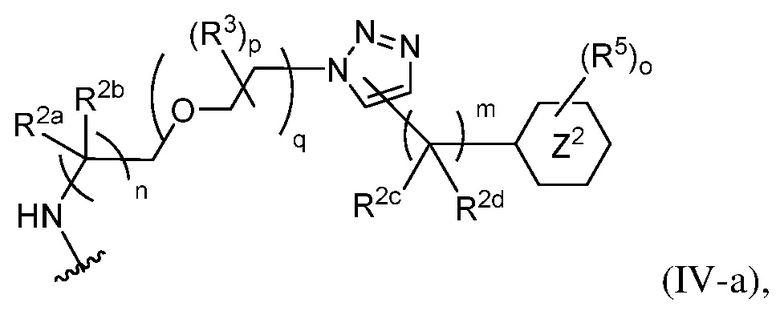
или его фармацевтически приемлемую соль, где
кольцо Z2 представляет собой циклоалкил, гетероциклил, арил или гетероарил;
каждый из R2a, R2b, R2c и R2d независимо представляет собой водород, алкил, гетероалкил, галоген; или R2a и R2b или R2c и R2d, взятые вместе, образуют оксо-группу;
каждый из R3 и R5 независимо представляет собой алкил, гетероалкил, галоген, оксо, -ORA1, -C(O)ORA1 или -C(O)RB1; каждый RA1 и RB1 независимо представляет собой водород, алкил или гетероалкил;
каждый m и n независимо составляет 1, 2, 3, 4, 5 или 6;
каждый o и p независимо составляет 0, 1, 2, 3, 4 или 5;
q составляет целое число от 0 до 25;
и "  " обозначает связь с группой присоединения или полимером, описанным в данном документе.
" обозначает связь с группой присоединения или полимером, описанным в данном документе.
67. Имплантируемый элемент по любому из вариантов осуществления 59-66, где соединение формулы (I) представляет собой соединение, представленное в таблице соединений 1.
68. Имплантируемый элемент по любому из вариантов осуществления 59-67, где соединение выбрано из:
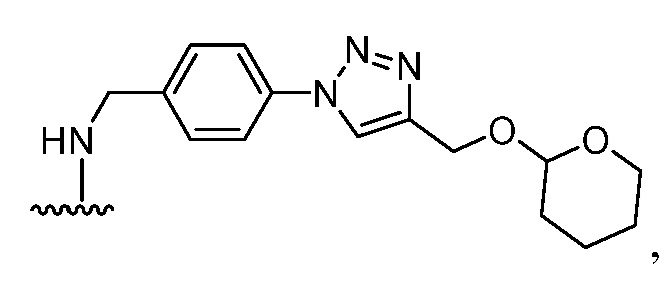
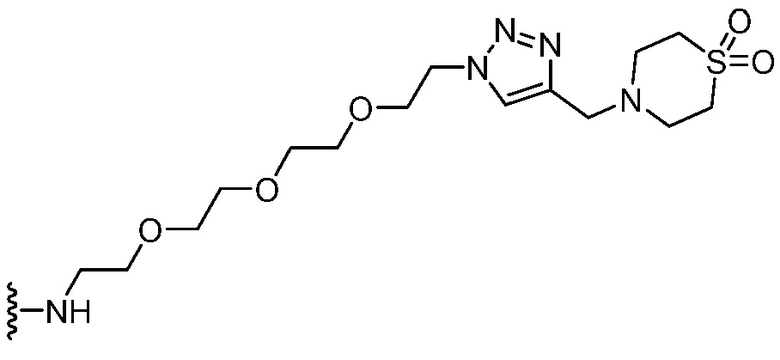 и
и
 или их соли.
или их соли.
69. Имплантируемый элемент по любому из вариантов осуществления 59-67, где соединение выбрано из соединения 110, соединения 112, соединения 113 или соединения 114 из таблицы соединений 1.
70. Имплантируемый элемент по любому из предыдущих вариантов осуществления, где имплантируемый элемент практически не разрушается после имплантации в субъекта в течение по меньшей мере 30 дней, 2 месяцев, 3 месяцев, 6 месяцев, 9 месяцев или 12 месяцев.
71. Имплантируемый элемент по любому из предыдущих вариантов осуществления, где имплантируемый элемент может быть удален из субъекта без значительного повреждения окружающей ткани, например, через приблизительно 5 дней после имплантации.
72. Способ лечения субъекта или снабжение субъекта продуктом (например, терапевтическим продуктом), предусматривающий:
введение или обеспечение у субъекта имплантируемого элемента или сконструированной активной клетки по любому из вариантов осуществления 1-69, за счет чего обеспечивается лечения субъекта или снабжение субъекта продуктом (например, терапевтическим продуктом).
73. Способ по варианту осуществления 72, предусматривающий лечение субъекта.
74. Способ по варианту осуществления 73, предусматривающий снабжение субъекта продуктом (например, терапевтическим продуктом).
75. Способ по любому из вариантов осуществления 72-74, где субъектом является человек.
76. Способ по любому из вариантов осуществления 72-75, где сконструированные активные клетки (например, сконструированные клетки RPE) представляют собой клетки человека (например, клетки RPE человека).
77. Способ по любому из вариантов осуществления 72-76, где полипептид представляет собой антитело (например, антитело к фактору роста нервов); фермент (например, альфа-галактозидазу) или фактор свертывания крови (например, фактор свертывания крови, например, активированный фактор свертывания крови).
78. Способ по любому из вариантов осуществления 72-77, где совокупность сконструированных активных клеток (например, сконструированных клеток RPE) или имплантируемый элемент обеспечивается в качестве средства для лечения заболевания.
79. Способ по варианту осуществления 78, где заболевание представляет собой заболевание свертывания крови или лизосомную болезнь накопления (например, гемофилию (например, гемофилию A или гемофилию B), болезнь Фабри, болезнь Гоше, болезнь Помпе или MPS I).
80. Способ по варианту осуществления 78, где заболевание представляет собой диабет.
81. Способ по варианту осуществления 78, где заболевание не является диабетом.
82. Способ по любому из вариантов осуществления 72-77, где имплантируемый элемент вводят первому субъекту, имеющему меньше приблизительно 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 2% или 1% полипептида (например, фактора свертывания крови, например, фактора I, фактора II, фактора V, фактора VII, фактора VIII, фактора IX, фактора X, фактора XI или фактора XIII) относительно второго субъекта (например, здорового субъекта), например, согласно определению посредством анализа крови.
83. Способ по любому из вариантов осуществления 72-82, где уровень биомаркера (например, биомаркера сыворотки крови) у субъекта контролируют, например, для определения уровня эффективности лечения.
84. Способ по любому из вариантов осуществления 72-83, где имплантируемый элемент вводят, имплантируют или обеспечивают в месте, отличном от центральной нервной системы, головного мозга, позвоночника, глаза или сетчатки.
85. Способ по любому из вариантов осуществления 72-83, где имплантируемый элемент вводят, имплантируют или обеспечивают в месте, удаленном на по меньшей мере приблизительно 1, 2, 5 или 10 см от центральной нервной системы, головного мозга, позвоночника, глаза или сетчатки.
86. Способ создания или производства имплантируемого элемента, содержащего совокупность сконструированных активных клеток (например, сконструированных клеток RPE), предусматривающий:
обеспечение совокупности сконструированных активных клеток (например, сконструированных клеток RPE), например, сконструированных активных клеток, описанных в данном документе, и
размещение совокупности сконструированных активных клеток (например, сконструированных клеток RPE) в заключающем компоненте, например, в заключающем компоненте, описанном в данном документе,
за счет чего обеспечивается создание или производство имплантируемого элемента.
87. Способ оценки имплантируемого элемента, содержащего совокупность сконструированных активных клеток (например, сконструированных клеток RPE), предусматривающий:
обеспечение имплантируемого элемента, содержащего совокупность сконструированных активных клеток (например, сконструированных клеток RPE), описанных в данном документе; и
оценку структурного или функционального параметра имплантируемого элемента или совокупности сконструированных активных клеток (например, сконструированных клеток RPE),
за счет чего обеспечивается оценка имплантируемого элемента.
88. Способ по варианту осуществления 87, предусматривающий культивирование совокупности сконструированных активных клеток (например, сконструированных клеток RPE) in vitro или культивирование сконструированной активной клетки (например, сконструированной клетки RPE) или совокупности сконструированных активных клеток (например, сконструированных клеток RPE) в животном, например, отличном от человека животном, или в субъекте-человеке.
89. Способ по варианту осуществления 87 или 88, предусматривающий оценку совокупности сконструированных активных клеток (например, сконструированных клеток RPE) в отношении одного или более из:
жизнеспособности;
продуцирования сконструированного полипептида;
продуцирования сконструированной РНК;
поглощение питательного вещества или кислорода; или
продуцирования продуктов жизнедеятельности.
90. Способ по любому из вариантов осуществления 87-89, дополнительно предусматривающий составление имплантируемого элемента в лекарственный продукт, если одно или более из жизнеспособности; продуцирования сконструированного полипептида; продуцирования сконструированной РНК; поглощения питательного вещества или кислорода или продуцирования продуктов жизнедеятельности соответствует заранее заданному значению.
91. Способ по любому из вариантов осуществления 87-90, предусматривающий оценку параметра клеток, касающегося форм-фактора, например, форм-фактора, описанного в данном документе.
92. Способ по любому из вариантов осуществления 87-91, где оценку выполняют через по меньшей мере 1, 5, 10, 20, 30 или 60 дней после размещения совокупности сконструированных активных клеток (например, сконструированных клеток RPE) в имплантируемом элементе.
93. Способ по любому из вариантов осуществления 72-79, где оценку выполняют через по меньшей мере 1, 5, 10, 20, 30 или 60 дней после начала культивирования сконструированных активных клеток (например, сконструированных клеток RPE).
94. Способ мониторинга имплантируемого элемента по любому из вариантов осуществления 1-70, предусматривающий:
получение, например, посредством тестирования субъекта или образца из него, уровня компонента (например, полипептида), высвобождаемого совокупностью сконструированных активных клеток (например, сконструированных клеток RPE) у субъекта, или
получение, например, посредством тестирования субъекта или образца из него, уровня продукта, зависимого от активности компонента,
за счет чего обеспечивается мониторинг имплантируемого элемента.
95. Способ по варианту осуществления 94, где компонент измеряют в периферическом кровообращении, например, в периферической крови.
96. Способ по любому из вариантов осуществления 91-95, где уровень компонента (например, полипептида) сравнивают с эталонным значением.
97. Способ по любому из вариантов осуществления 91-96, где с учетом уровня или сравнения субъекта классифицируют, например, как нуждающегося или не нуждающегося в дополнительном имплантируемом элементе или дополнительных сконструированных активных клетках (например, сконструированных клетках RPE).
98. Способ по любому из вариантов осуществления 91-97, причем способ предусматривает (например, с учетом уровня или сравнения) извлечение имплантируемого элемента или сконструированных активных клеток (например, сконструированных клеток RPE) из субъекта.
99. Способ по любому из вариантов осуществления 91-98, где уровень определяют от приблизительно 1 часа до приблизительно 30 дней после введения (например, имплантации или инъекции) имплантируемого элемента или сконструированных активных клеток (например, сконструированных клеток RPE) или от приблизительно 1 часа до 30 дней после предварительной оценки.
100. Совокупность активных клеток (например, клеток RPE), характеризующаяся предварительно заданным форм-фактором или форм-фактором, раскрытым в данном документе.
101. Совокупность активных клеток (например, клеток RPE) по варианту осуществления 100, где форм-фактор предусматривает кластер сконструированных активных клеток (например, клеток RPE).
102. Совокупность активных клеток (например, клеток RPE) по варианту осуществления 101, где кластер содержит по меньшей мере приблизительно 100, 200, 300, 400 или 500 активных клеток (например, клеток RPE).
103. Субстрат, содержащий совокупность камер, причем каждая камера из совокупности содержит активную клетку (например, клетку RPE) или сконструированную активную клетку (например, сконструированную клетку RPE).
104. Субстрат по варианту осуществления 103, где каждая камера из совокупности камер содержит совокупность активных клеток (например, клеток RPE) или сконструированных активных клеток (например, сконструированных клеток RPE), например, совокупность сконструированных клеток RPE, характеризующихся форм-фактором, описанным в данном документе, например, кластером.
105. Микроноситель (например, гранула или матрица) с размещенной на нем сконструированной активной клеткой, описанной в данном документе (например, клеткой RPE, например, сконструированной клеткой RPE), или кластером активных клеток (например, клеток RPE, например, сконструированных клеток RPE).
106. Микроноситель по варианту осуществления 105, где микроноситель предусматривает полистирольную гранулу.
107. Препарат из сконструированных активных клеток (например, сконструированных клеток RPE), где препарат содержит по меньшей мере приблизительно 10000; 15000; 20000; 25000; 30000; 40000; 50000; 60000 или 75 000 сконструированных активных клеток (например, сконструированных клеток RPE, описанных в данном документе).
108. Фармацевтическая композиция, содержащая совокупность имплантируемых элементов или сконструированных активных клеток по любому из вариантов осуществления 1-70.
Примеры
Для более полного понимания настоящего изобретения, описанного в данном документе, изложены следующие примеры. Примеры, описанные в данной заявке, предоставлены, чтобы проиллюстрировать активные клетки (например, клетки RPE), имплантируемые элементы, а также композиции и способы, предусмотренные в данном документе, и никоим образом не должны быть истолкованы как ограничивающие их объем.
Пример 1. Культивирование активных клеток
Клетки ARPE-19 можно культивировать в соответствии с любым способом, известным в данной области техники, например, в соответствии со следующим протоколом. Клетки ARPE-19 (из ATCC) в культуральном флаконе 75 см2 аспирировали для удаления культуральной среды и клеточный слой быстро ополаскивали с помощью 0,05% (вес/объем) раствора трипсина/0,53 мМ EDTA ("трипсин-EDTA") для удаления всех следовых количеств сыворотки, которая содержит ингибитор трипсина. 2-3 мл раствора трипсина/EDTA добавляли во флакон и клетки наблюдали под инвертированным микроскопом до тех пор, пока клеточный слой не диспергировался, как правило, в течение 5-15 минут. Чтобы избежать слипания клеток, их обрабатывали с осторожностью и не допускали ударения или встряхивания флакона во время периода диспергирования. Если клетки не отделялись, флаконы помещали при 37oC для облегчения диспергирования. После завершения диспергирования клеток добавляли 6-8 мл полной ростовой среды и клетки аспирировали путем осторожного пипетирования. Суспензию клеток переносили в центрифужную пробирку и центрифугировали при примерно 125 x g в течение 5-10 для удаления трипсина-EDTA. Супернатант отбрасывали и клетки ресуспендировали в свежей ростовой среде. Подходящие аликвоты суспензии клеток вносили в новые культуральные сосуды, которые инкубировали при 37oC. Среду обновляли 2-3 раза в неделю.
Пример 2A. Получение кластеров активных клеток
Сфероидные кластеры активных клеток (например, клеток RPE) получали с применением планшетов для культивирования сфероидов AggreWell™ (STEMCELL Technologies) и протокола, кратко изложенного в данном документе. В день 1 раствор для полоскания (4 мл) добавляли в каждый планшет и планшеты центрифугировали в течение 5 минут при 3000 об/мин в большой центрифуге. Раствор для полоскания удаляли с помощью пипетки и добавляли 4 мл полной ростовой среды. Клетки RPE высевали в планшеты из расчета требуемой плотности клеток и сразу же пипетировали для предотвращения агрегации, при этом общая эмпирическая закономерность такова, что 3,9 миллиона клеток на лунку будут образовывать кластеры диаметром 150 мкм, а требуемый средний диаметр кластеров для инкапсуляции в гидрогелевую капсулу составляет от приблизительно 100 до 150 мкм. Планшет центрифугировали в течение 3 минут при 800 об/мин и планшет помещали в инкубатор на ночь. В день 2 планшет извлекали из инкубатора. Клетки осторожно пипетировали, применяя наконечники пипеток с широким просветом для того, чтобы отделить сфероидные кластеры. Кластеры фильтровали через сито для клеток с размером пор 40 мкм или 80 мкм для удаления лишних неприкрепленных отдельных клеток и затем центрифугировали в центрифуге 2×1 минуту. Кластеры осторожно ресуспендировали с применением наконечников пипеток с широким просветом и осторожно перемешивали, чтобы распределить их по всему объему среды или другого материала (например, альгината).
В качестве альтернативы сфероидные кластеры ARPE-19 можно получать с применением следующего протокола. В день 1 планшеты AggreWell™ извлекают из упаковки в стерильном вытяжном шкафу с ламинарным потоком воздуха. В каждую лунку добавляют по 2 мл раствора для полоскания Aggrewell™. Планшет центрифугируют при 2000 g в течение 5 минут для удаления пузырьков воздуха. Удаляют из лунок раствор для полоскания AggreWell™ и ополаскивают каждую лунку с помощью 2 мл полной ростовой среды. В каждую лунку вносят 2 миллиона клеток ARPE-19 в 3,9 мл полной ростовой среды. Планшет центрифугируют при 100 g в течение 3 минут. Клетки инкубируют при 37ᵒC в течение 48 часов. В день 3 тот же протокол, описанный выше, применяют для отделения сфероидных кластеров.
Пример 2B. Получение активных клеток на микроносителях
Отдельные клетки ARPE-19 можно высевать на коммерчески доступные микроносители (например, микроносители Cultispher®, микроносители Cytodex®, микроносители с улучшенным прикреплением Corning) в соответствии со следующим протоколом.
Требуемое число клеток ARPE-19 (например, 20 миллионов клеток) и питательную среду добавляют к микроносителям (необязательно покрытых коллагеном) в конической пробирке для достижения требуемого общего объема (например, 10 мл). Микроносители необязательно покрывают коллагеном путем объединения требуемого количества стерильных микроносителей с 0,1 мг/мл коллагена I типа из хвостов крыс в фосфатно-солевом буфере (PBS) в конической пробирке и затем встряхивают пробирку при 200 об/мин при RT в течение по меньшей мере 2 часов. Покрытые коллагеном микроносители промывают с помощью PBS трижды, а затем с помощью питательной среды дважды с обеспечением возможности осаждения микроносителей в течение приблизительно 5 минут после каждой промывки перед удалением супернатанта.
Коническую пробирку, содержащую клетки и микроносители, осторожно встряхивают до гомогенного состояния содержимого, а затем помещают в стационарный инкубатор при 37 C на приблизительно 25 минут, и эти стадии встряхивания и инкубирования повторяют один раз. Клетки и микроносители из конической пробирки вносят во флакон с мешалкой, который содержит требуемое количество (например, 70 мл) питательной среды, которую предварительно нагревают до 37 C, и добавляют дополнительное количество питательной среды, чтобы довести объема во флаконе до требуемого конечного объема (например, 90 мл). Затем клетки и микроноситель инкубируют при 37 C с перемешиванием в течение приблизительно 4 дней. Требуемый объем композиции из микроносителей/среды переносят в микроцентрифужную пробирку и микроносители промывают один раз в буфере Кребса, не содержащем Ca, перед суспендированием в требуемом растворе альгината для инкапсуляции.
Пример 3. Синтез иллюстративных соединений для получения химически модифицированных имплантируемых элементов
Общие протоколы
В приведенных ниже процедурах описаны способы получения иллюстративных соединений для получения химически модифицированных имплантируемых элементов. Соединения, предусмотренные в данном документе, можно получать из легкодоступных исходных материалов с применением модификаций конкретных протоколов синтеза, изложенных ниже, которые будут хорошо известны специалистам в данной области техники. Будет понятно, что в случаях, когда приведены типичные или предпочтительные условия процесса (т. е. значения температуры реакции, значения времени, значения мольного соотношения реагентов, растворителей, значения давления и т. д.), можно также применять другие условия процесса, если не указано иное. Оптимальные условия реакции могут меняться в зависимости от конкретных применяемых реагентов или растворителей, но такие условия могут быть определены специалистом в данной области техники с помощью традиционных процедур оптимизации.
Кроме того, как будет очевидно специалистам в данной области техники, традиционные защитные группы могут понадобиться, чтобы предотвратить нежелательные реакции у определенных функциональных групп. Выбор подходящей защитной группы для конкретной функциональной группы, а также подходящие условия для введения защитных групп и удаления защитных групп широко известны из уровня техники. Например, многочисленные защитные группы, а также их введение и удаление описаны в Greene et al., Protecting Groups in Organic Synthesis, Second Edition, Wiley, New York, 1991 и в цитируемых там ссылках.
Циклоприсоединение Хьюсгена для получения 1,4-замещенных триазолов
Катализируемое медью циклоприсоединение Хьюсгена [3+2] применяли для получения соединений на основе триазола и их композиций, устройств и материалов. Область применения и типичные протоколы были предметом многих обзоров (например, Meldal, M. and Tornoe, C. W. Chem. Rev. (2008) 108:2952-3015; Hein, J. E. and Fokin, V. V. Chem. Soc. Rev. (2010) 39(4):1302-1315; оба из которых включены в данный документ посредством ссылки).
В примере, показанном выше, азид представляет собой реакционноспособную группу во фрагменте, содержащем соединительный элемент A, тогда как алкин представляет собой реакционноспособный компонент боковой группы Z. Как показано ниже, эти функциональные группы можно менять местами для получения структурно родственного триазольного продукта. Получение этих альтернатив является аналогичным и не требует отдельного рассмотрения.
Типичная процедура циклоприсоединения Хьюсгена, начиная с йодида, кратко изложена ниже. В некоторых случаях йодиды преобразуют в азиды во время протекания реакции для безопасности.
Раствор азида натрия (1,1 экв.), аскорбата натрия (0,1 экв.), транс-N, N'-диметилциклогексан-1,2-диамина (0,25 экв.), йодида меди(I) в метаноле (1,0 М, лимитирующий реагент) дегазировали с помощью барботирования азотом и обрабатывали ацетиленом (1 экв.) и арилйодидом (1,2 экв.). Данную смесь перемешивали при комнатной температуре в течение 5 минут, затем нагревали до 55oC в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры, фильтровали через воронку и осадок на фильтре промывали метанолом. Объединенные фильтраты концентрировали и очищали с помощью флэш-хроматографии на силикагеле (120 г диоксида кремния, градиент от 0 до 40% (3% водный гидроксид аммония, 22% метанол, остальная часть - дихлорметан) в дихлорметане с получением требуемого целевого материала.
Типичная процедура циклоприсоединения Хьюсгена, начиная с азида, кратко изложена ниже.
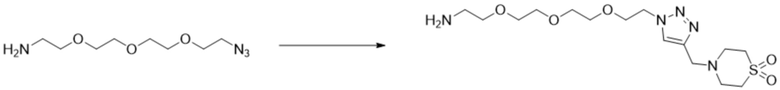
Раствор трис[(1-бензил-1H-1,2,3-триазол-4-ил)метил]амина (0,2 экв.), триэтиламина (0,5 экв.), йодида меди(I) (0,06 экв.) в метаноле (0,4 М, лимитирующий реагент) обрабатывали ацетиленом (1,0 экв.) и охлаждали до 0oC. Обеспечивали нагревание реакционной смеси до комнатной температуры в течение 30 минут, затем нагревали до 55oC в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, концентрировали и очищали с помощью HPLC (колонка C18, градиент от 0 до 100% (3% водный гидроксида аммония, 22% метанол, остальная часть - дихлорметан) в дихлорметане с получением требуемого целевого материала.
Циклоприсоединение Хьюсгена для получения 1,5-замещенных триазолов
Циклоприсоединение Хьюсгена [3+2] также осуществляли с помощью рутениевых катализаторов для получения преимущественно 1,5-дизамещенных продуктов (например, как описано в Zhang et al, J. Am. Chem. Soc., 2005, 127, 15998-15999; Boren et al, J. Am. Chem. Soc., 2008, 130, 8923-8930, каждый из которых включен в данный документ посредством ссылки во всей своей полноте).
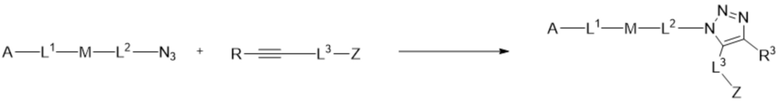
Как описано ранее, азидные и алкиновые группы можно менять местами для образования триазолов, аналогичных тем, которые изображены ниже. 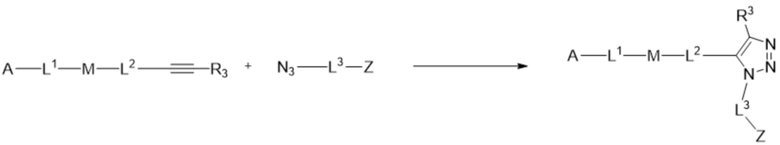
Типичная процедура описана следующим образом: раствор алкина (1 экв.) и азида (1 экв.) в диоксане (0,8 М) добавляли по каплям в раствор пентаметилциклопентадиенилбис(трифенилфосфин)рутения(II) хлорида (0,02 экв.) в диоксане (0,16 М). Колбу продували азотом, герметизировали и смесь нагревали до 60oC в течение 12 ч. Полученную смесь концентрировали и очищали с помощью флэш-хроматографии на силикагеле с получением необходимого соединения.
Экспериментальная процедура для (4-(4-((4-метилпиперазин-1-ил)метил)-1H-1,2,3-триазол-1-ил)фенил)метанамина (3)
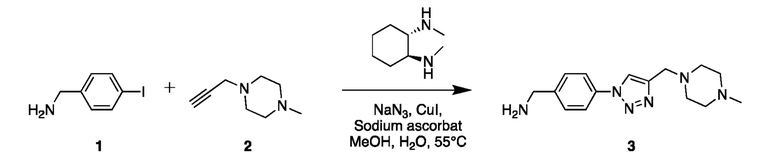 ,
,
где Sodium ascorbat означает аскорбат натрия.
Смесь (4-йодофенил)метанамина (1, 843 мг, 3,62 ммоль, 1,0 экв.), (1S,2S)-N1,N2-диметилциклогексан-1,2-диамина (74 мкл, 0,47 ммоль, 0,13 экв.), аскорбата натрия (72 мг, 0,36 ммоль, 0,1 экв.), йодида меди (69 мг, 0,36 ммоль, 0,1 экв.), азида натрия (470 мг, 7,24 ммоль, 2,0 экв.) и 1-метил-4-(проп-2-ин-1-ил)пиперазина (2, 0,5 г, 3,62 ммоль, 1,0 экв.) в метаноле (9 мл) и воде (1 мл) продували азотом в течение 5 минут и нагревали до 55°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, концентрировали при пониженном давлении и коричневатую взвесь экстрагировали с помощью дихлорметана. К объединенным дихлорметановым фазам добавляли целит и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали на силикагеле (80 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония), в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 7,5% с получением (4-(4-((4-метилпиперазин-1-ил)метил)-1H-1,2,3-триазол-1-ил)фенил)метанамина (3, 0,45 г, 43%). LCMS масса/заряд: [M+H]+ Рассч. для C15H22N6 287,2; Найденное значение 287,1.
Экспериментальная процедура для N-(4-(4-((4-метилпиперазин-1-ил)метил)-1H-1,2,3-триазол-1-ил)бензил)метакриламида (4)
Раствор (4-(4-((4-метилпиперазин-1-ил)метил)-1H-1,2,3-триазол-1-ил)фенил)метанамина (3, 1,2 г, 4,19 ммоль, 1,0 экв.) и триэтиламина (0,70 мл, 5,03 ммоль, 1,2 экв.) в CH2Cl2 (50 мл) охлаждали до 0°C с помощью ледяной бани и добавляли метакрилоилхлорид (0,43 мл, 4,40 ммоль, 1,05 экв. в 5 мл CH2Cl2). Реакционную смесь перемешивали в течение дня при охлаждении с помощью ледяной бани. Добавляли десять (10) граммов целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (80 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 7,5%. Растворитель удаляли при пониженном давлении и полученное твердое вещество растирали с диэтиловым эфиром, фильтровали и промывали несколько раз диэтиловым эфиром с получением N-(4-(4-((4-метилпиперазин-1-ил)метил)-1H-1,2,3-триазол-1-ил)бензил)метакриламида (4, 0,41 г, выход 28%) в виде белого твердого вещества. LCMS масса/заряд: [M+H]+ Рассч. для C19H26N6O 355,2; Найденное значение 355,2.
Экспериментальная процедура для (4-(4-((2-(2-метоксиэтокси)этокси)метил)-1H-1,2,3-триазол-1-ил)фенил)метанамина (6)
 ,
,
где Sodium ascorbat означает аскорбат натрия.
Смесь (4-йодофенил)метанамина (1, 2,95 г, 12,64 ммоль, 1,0 экв.), (1S,2S)-N1,N2-диметилциклогексан-1,2-диамина (259 мкл, 1,64 ммоль, 0,13 экв.), аскорбата натрия (250 мг, 1,26 ммоль, 0,1 экв.), йодида меди (241 мг, 1,26 ммоль, 0,1 экв.), азида натрия (1,64 г, 25,29 ммоль, 2,0 экв.) и 1-метил-4-(проп-2-ин-1-ил)пиперазина (5, 2,0 г, 12,64 ммоль, 1,0 экв.) в метаноле (40 мл) и воде (4 мл) продували азотом в течение 5 минут и нагревали до 55°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток растворяли в дихлорметане, фильтровали и концентрировали с помощью целита (10 г). Неочищенный продукт очищали с помощью хроматографии на силикагеле (220 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 6,25% с получением (4-(4-((2-(2-метоксиэтокси)этокси)метил)-1H-1,2,3-триазол-1-ил)фенил)метанамина (6, 1,37 г, 35%). LCMS масса/заряд: [M+H]+ Рассч. для C15H22N4O3 307,2; Найденное значение 307,0.
Экспериментальная процедура для N-(4-(4-((2-(2-метоксиэтокси)этокси)метил)-1H-1,2,3-триазол-1-ил)бензил)метакриламида (7)
Раствор 4-(4-((2-(2-метоксиэтокси)этокси)метил)-1H-1,2,3-триазол-1-ил)фенил)метанамина (6, 1,69 г, 5,52 ммоль, 1,0 экв.) и триэтиламина (0,92 мл, 6,62 ммоль, 1,2 экв.) в CH2Cl2 (50 мл) охлаждали до 0°C с помощью ледяной бани и добавляли по каплям метакрилоилхлорид (0,57 мл, 5,79 ммоль, 1,05 экв.). Реакционную смесь перемешивали в течение 4 ч при комнатной температуре. Добавляли десять (10) граммов целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (80 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 1,25% с получением N-(4-(4-((2-(2-метоксиэтокси)этокси)метил)-1H-1,2,3-триазол-1-ил)бензил)метакриламида (7, 1,76 г, выход 85%) в виде белого твердого вещества. LCMS масса/заряд: [M+H]+ Рассч. для C19H26N4O4 375,2; Найденное значение 375,0.
Экспериментальная процедура для 3-(проп-2-ин-1-илокси)оксетана (9)
Суспензию гидрида натрия (27,0 г, 675 ммоль, чистота 60%) в THF (200 мл) охлаждали с помощью ледяной бани. Оксетан-3-ол (8, 25 г, 337 ммоль) добавляли по каплям и перемешивали в течение 30 минут при 0°C. Затем добавляли по каплям 3-бромпроп-1-ин (9, 41,2 мл, 371 ммоль, чистота 80%). Смесь перемешивали на протяжении ночи, при этом обеспечивали ее нагревание до комнатной температуры. Смесь фильтровали через целит, промывали с помощью THF и концентрировали с помощью целита при пониженном давлении. Неочищенный продукт очищали на силикагеле (220 г) и элюировали с помощью гексанов/EtOAc. Концентрацию EtOAc в подвижной фазе увеличивали от 0 до 25% с получением желтого масла (9, 18,25 г, 48%).
Экспериментальная процедура для 3-(4-((оксетан-3-илокси)метил)-1H-1,2,3-триазол-1-ил)пропан-1-амина (11)
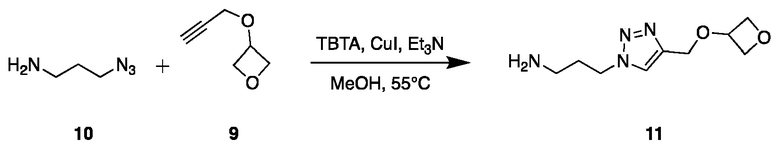
Смесь 3-(проп-2-ин-1-илокси)оксетана (9, 7,96 г, 71 ммоль, 1,0 экв.), 3-азидопропан-1-амина (10, 7,82 г, 78 ммоль, 1,1 экв.), трис[(1-бензил-1H-1,2,3-триазол-4-ил)метил]-амина (8,29 г, 15,6 ммоль, 0,22 экв.), йодида меди (1,35 г, 7,1 ммоль, 0,1 экв.) и триэтиламина (2,47 мл, 17,8 ммоль, 0,25 экв.) в метаноле (80 мл) нагревали до 55°C и перемешивали в течение ночи в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, добавляли целит (20 г) и концентрировали при пониженном давлении. Неочищенный продукт очищали на силикагеле (220 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 15% с получением 3-(4-((оксетан-3-илокси)метил)-1H-1,2,3-триазол-1-ил)пропан-1-амина (11, 11,85 г, 79%) в виде желтого масла. LCMS масса/заряд: [M+H]+ Рассч. для C9H16N4O2 213,1; Найденное значение 213,0.
Экспериментальная процедура для N-(3-(4-((оксетан-3-илокси)метил)-1H-1,2,3-триазол-1-ил)пропил)метакриламида (12)
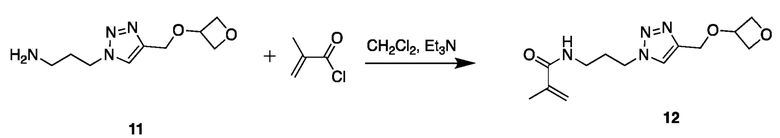
Раствор 3-(4-((оксетан-3-илокси)метил)-1H-1,2,3-триазол-1-ил)пропан-1-амина (11, 3,94 г, 18,56 ммоль, 1,0 экв.) и триэтиламина (3,1 мл, 22,28 ммоль, 1,2 экв.) в CH2Cl2 (100 мл) охлаждали до 0°C с помощью ледяной бани и добавляли по каплям метакрилоилхлорид (1,99 мл, 20,42 ммоль, 1,1 экв.). Реакционную смесь перемешивали в течение ночи, при этом обеспечивали нагревание до комнатной температуры. Добавляли 20 граммов целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (220 г) с применением дихлорметана/метанола в качестве подвижной фазы. Концентрацию метанола постепенно увеличивали от 0% до 5% с получением N-(3-(4-((оксетан-3-илокси)метил)-1H-1,2,3-триазол-1-ил)пропил)метакриламида (12, 3,22 г, выход 62%) в виде твердого вещества. LCMS масса/заряд: [M+H]+ Рассч. для C13H20N4O3 281,2; Найденное значение 281,0.
Экспериментальная процедура для N-(4-(1H-1,2,3-триазол-1-ил)бензил)метакриламида (14)
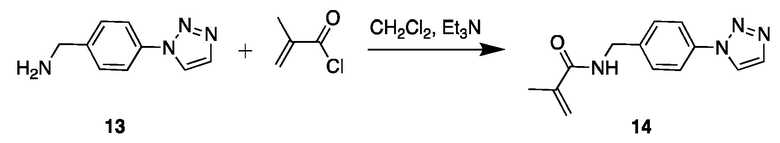
К раствору (4-(1H-1,2,3-триазол-1-ил)фенил)метанамина (13, получен от WuXi, 1,2 г, 5,70 ммоль, 1,0 экв.) и триэтиламина (15 мл, 107,55 ммоль, 18,9 экв.) в CH2Cl2 (100 мл) медленно добавляли по каплям метакрилоилхлорид (893 мг, 8,54 ммоль, 1,5 экв.). Реакционную смесь перемешивали в течение ночи. Добавляли 20 граммов целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 1,25% с получением N-(4-(1H-1,2,3-триазол-1-ил)бензил)метакриламида (14, 1,38 г, выход 40%).
Экспериментальная процедура для (4-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)фенил)метанамина (15)
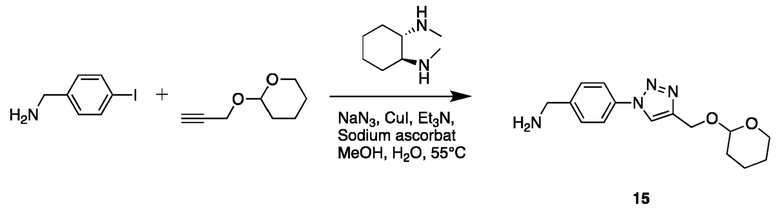 ,
,
где Sodium ascorbat означает аскорбат натрия.
Смесь (4-йодофенил)метанамина гидрохлорида (5,0 г, 18,55 ммоль, 1,0 экв.), (1S,2S)-N1,N2-диметилциклогексан-1,2-диамина (0,59 мл 3,71 ммоль, 0,2 экв.), аскорбата натрия (368 мг, 1,86 ммоль, 0,1 экв.), йодида меди (530 мг, 2,78 ммоль, 0,15 экв.), азида натрия (2,41 г, 37,1 ммоль, 2,0 экв.), Et3N (3,11 мл, 22,26 ммоль, 1,2 экв.) и 2-(проп-2-ин-1-илокси)тетрагидро-2H-пирана (2,6 г, 18,55 ммоль, 1,0 экв.) в метаноле (50 мл) и воде (12 мл) продували азотом в течение 5 минут и нагревали до 55°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры и фильтровали через фильтровальную бумагу 413. Добавляли целит, и растворитель удаляли при пониженном давлении, и остаток очищали на силикагеле (120 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 6,25% с получением (4-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)фенил)метанамина (15, 3,54 г, 66%) в виде белого твердого вещества. LCMS масса/заряд: [M+H]+ Рассч. для C15H20N4O2 289,2; Найденное значение 289,2.
Экспериментальная процедура для N-(4-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)бензил)метакриламида (16)
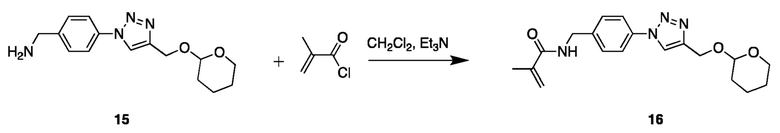
Раствор (4-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)фенил)метанамина (15, 3,46 г, 12,00 ммоль, 1,0 экв.) и триэтиламина (2,01 мл, 14,40 ммоль, 1,2 экв.) в CH2Cl2 (40 мл) охлаждали до 0°C с помощью ледяной бани и добавляли по каплям метакрилоилхлорид (1,23 мл, 12,60 ммоль, 1,05 экв., разбавленный в 5 мл CH2Cl2). Охлаждающую баню удаляли и реакционную смесь перемешивали в течение 4 ч. Добавляли 20 граммов целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (80 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 3,75% с получением N-(4-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)бензил)метакриламида (16, 2,74 г, выход 64%) в виде белого твердого вещества. LCMS масса/заряд: [M+H]+ Рассч. для C19H24N4O3 357,2; Найденное значение 357,3.
Экспериментальная процедура для N-(4-(4-(гидроксиметил)-1H-1,2,3-триазол-1-ил)бензил)метакриламида (17)
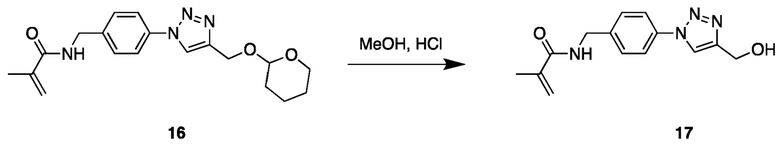
Раствор N-(4-(4-(гидроксиметил)-1H-1,2,3-триазол-1-ил)бензил)метакриламида (16, 1,2 г, 3,37 ммоль, 1,0 экв.) растворяли в метаноле (6 мл) и HCl (1 н., водн., 9 мл) в течение ночи при комнатной температуре. Добавляли целит и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью хроматографии на силикагеле (24 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 12,5% с получением N-(4-(4-(гидроксиметил)-1H-1,2,3-триазол-1-ил)бензил)метакриламида (17, 0,85 г, выход 92%) в виде белого твердого вещества. LCMS масса/заряд: [M+H]+ Рассч. для C14H16N4O2 273,1; Найденное значение 273,1.
Экспериментальная процедура для (4-(((тетрагидро-2H-пиран-2-ил)окси)метил)бензил)карбамата (19)
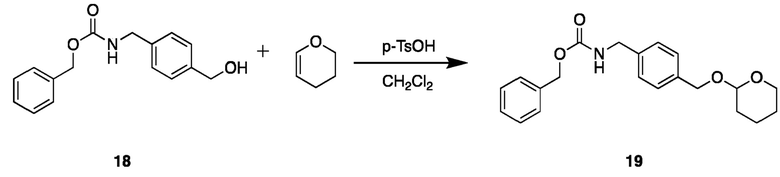
Бензил(4-(гидроксиметил)бензил)карбамат (2,71 г, 10 ммоль, 1 экв.), 3,4-дигидро-2H-пиран (1,81 мл, 20 ммоль, 2 экв.), моногидрат п-толуолсульфоновой кислоты (285 мг, 1,5 ммоль, 0,15 экв.) в дихлорметане (100 мл) перемешивали при комнатной температуре в течение ночи. Добавляли целит и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали на силикагеле (24 г) с применением гексанов/EtOAc в качестве элюента, начиная со 100% гексанов и постепенно увеличивая концентрацию EtOAc до 100%, с получением бензил-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)бензил)-карбамата (19, 2,4 г, 68%) в виде бесцветного масла. LCMS масса/заряд: [M+Na]+ Рассч. для C21H25NO4 378,17 Найденное значение 378,17.
Экспериментальная процедура для (4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-фенил)метанамина (20)
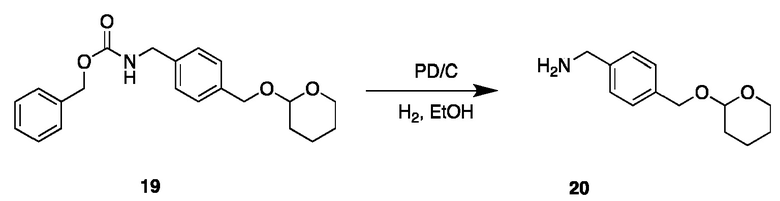
(4-(((Тетрагидро-2H-пиран-2-ил)окси)метил)бензил)карбамат (19, 1,5 г, 4,2 ммоль, 1 экв.), палладий на угле (160 мг, 10 вес. %) в EtOH быстро вакуумировали и затем добавляли водород через баллон и смесь перемешивали в течение 1 часа при комнатной температуре. Добавляли целит и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали на силикагеле (12 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 25% с получением (4-(((тетрагидро-2H-пиран-2-ил)окси)метил)фенил)метанамина (20, 890 мг, 95%) в виде бесцветного масла. LCMS масса/заряд: [M+H]+ Рассч. для C13H19NO2 222,15 Найденное значение 222,14.
Экспериментальная процедура для N-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)бензил)-метакриламида (21)
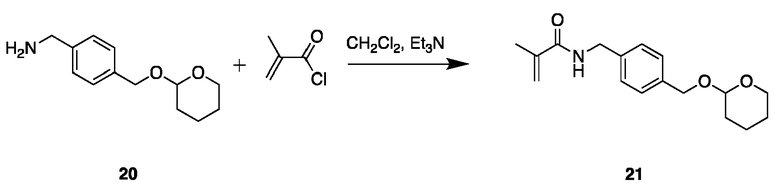
Раствор (4-(((тетрагидро-2H-пиран-2-ил)окси)метил)фенил)метанамина (20, 0,5 г, 2,26 ммоль, 1,0 экв.) и триэтиламина (0,47 мл, 3,39 ммоль, 1,5 экв.) в CH2Cl2 (10 мл) быстро вакуумировали и продували азотом. Добавляли по каплям метакрилоилхлорид (0,33 мл, 3,39 ммоль, 1,5 экв.). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Добавляли десять (10) граммов целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (12 г) с применением гексанов/EtOAc в качестве элюента, начиная со 100% гексанов и постепенно увеличивая концентрацию EtOAc до 100% с получением N-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)бензил)метакриламида (21, 0,47 г, выход 72%) в виде бесцветного твердого вещества. LCMS масса/заряд: [M+Na]+ Рассч. для C17H23NO3 312,16; Найденное значение 312,17.
Экспериментальная процедура для (4-(4-(2-((тетрагидро-2H-пиран-2-ил)окси)этил)-1H-1,2,3-триазол-1-ил)фенил)метанамина (22)
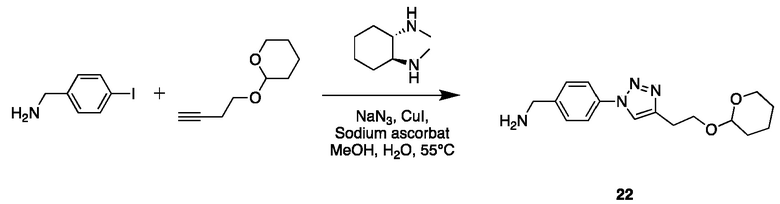 ,
,
где Sodium ascorbat означает аскорбат натрия.
Смесь (4-йодофенил)метанамина (5,0 г, 21,45 ммоль, 1,0 экв.), (1S,2S)-N1,N2-диметилциклогексан-1,2-диамина (0,44 мл, 2,79 ммоль, 0,13 экв.), аскорбата натрия (425 мг, 2,15 ммоль, 0,1 экв.), йодида меди (409 мг, 2,15 ммоль, 0,1 экв.), азида натрия (2,79 г, 42,91 ммоль, 2,0 экв.) и 2-(бут-3-ин-1-илокси)тетрагидро-2H-пирана (3,36 мл, 21,45 ммоль, 1,0 экв.) в метаноле (20 мл) и воде (5 мл) продували азотом в течение 5 минут и нагревали до 55°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры и фильтровали через фильтровальную бумагу 413. Добавляли целит (10 г), и растворитель удаляли при пониженном давлении, и остаток очищали на силикагеле (220 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 5% с получением (4-(4-(2-((тетрагидро-2H-пиран-2-ил)окси)этил)-1H-1,2,3-триазол-1-ил)фенил)метанамина (22, 3,15 г, 49%) в виде твердого вещества. LCMS масса/заряд: [M+H]+ Рассч. для C16H22N4O2 303,18; Найденное значение 303,18.
Экспериментальная процедура для N-(4-(4-(2-((тетрагидро-2H-пиран-2-ил)окси)этил)-1H-1,2,3-триазол-1-ил)бензил)метакриламида(23)
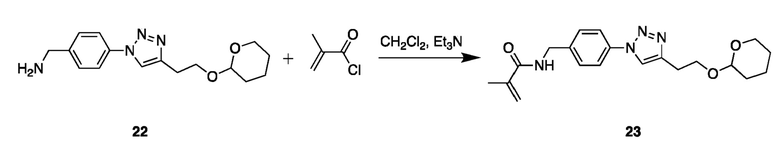
Раствор (4-(4-(2-((тетрагидро-2H-пиран-2-ил)окси)этил)-1H-1,2,3-триазол-1-ил)фенил)метанамина (22, 3,10 г, 10,25 ммоль, 1,0 экв.) и триэтиламина (1,71 мл, 12,30 ммоль, 1,2 экв.) в CH2Cl2 (55 мл) охлаждали до 0°C с помощью ледяной бани и добавляли по каплям метакрилоилхлорид (1,05 мл, 12,30 ммоль, 1,2 экв., разбавленный в 5 мл CH2Cl2). Охлаждающую баню удаляли и реакционную смесь перемешивали в течение 4 ч. Добавляли 8 граммов целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (80 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 2,5% с получением N-(4-(4-(2-((тетрагидро-2H-пиран-2-ил)окси)этил)-1H-1,2,3-триазол-1-ил)бензил)метакриламида (23, 2,06 г, выход 54%) в виде белого твердого вещества. LCMS масса/заряд: [M+H]+ Рассч. для C20H26N4O3 371,2078; Найденное значение 371,2085.
Экспериментальная процедура для (4-(1-(2-((тетрагидро-2H-пиран-2-ил)окси)этил)-1H-1,2,3-триазол-4-ил)фенил)метанамина (24)
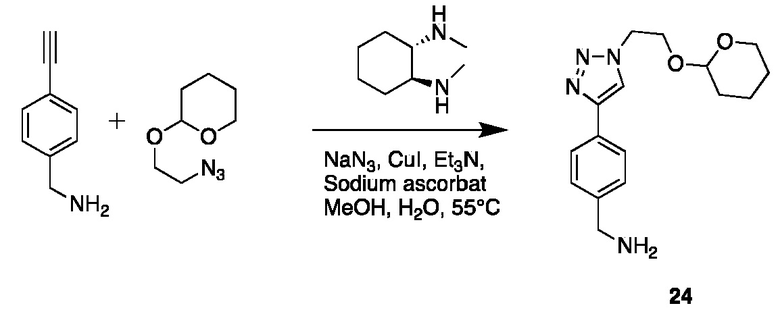 ,
,
где Sodium ascorbat означает аскорбат натрия.
Смесь (4-этинилфенил)метанамина (2,36 г, 18,00 ммоль, 1,0 экв.), (1S,2S)-N1,N2-диметилциклогексан-1,2-диамина (0,56 мл, 3,60 ммоль, 0,2 экв.), аскорбата натрия (357 мг, 1,80 ммоль, 0,1 экв.), йодида меди (514 мг, 2,70 ммоль, 0,15 экв.) и 2-(2-азидоэтокси)тетрагидро-2H-пирана (3,08, 18,00 ммоль, 1,0 экв.) в метаноле (24 мл) и воде (6 мл) продували азотом в течение 5 минут и нагревали до 55°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, и фильтровали через целит, и ополаскивали с помощью MeOH (3×50 мл). Растворитель удаляли при пониженном давлении и остаток повторно растворяли в дихлорметане, добавляли целит (20 г), и растворитель удаляли при пониженном давлении, и остаток очищали на силикагеле (120 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 25% с получением (4-(1-(2-((тетрагидро-2H-пиран-2-ил)окси)этил)-1H-1,2,3-триазол-4-ил)фенил)метанамина (24, 3,51 г, 64%) в виде желтоватого масла. LCMS масса/заряд: [M+H]+ Рассч. для C16H22N4O2 303,1816; Найденное значение 303,1814.
Экспериментальная процедура для N-(4-(1-(2-((тетрагидро-2H-пиран-2-ил)окси)этил)-1H-1,2,3-триазол-4-ил)бензил)метакриламида (25)
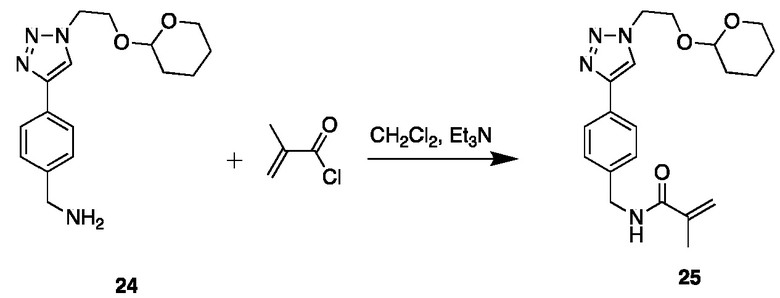
Раствор (4-(1-(2-((тетрагидро-2H-пиран-2-ил)окси)этил)-1H-1,2,3-триазол-4-ил)фенил)метанамина (24, 1,5 г, 4,96 ммоль, 1,0 экв.) и триэтиламина (1,04 мл, 7,44 ммоль, 1,5 экв.) в CH2Cl2 (30 мл) быстро вакуумировали и продували азотом. Добавляли по каплям метакрилоилхлорид (0,72 мл, 7,44 ммоль, 1,5 экв.). Реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Добавляли десять (10) граммов целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (40 г) с применением гексанов/EtOAc в качестве элюента, начиная со 100% гексанов и постепенно увеличивая концентрацию EtOAc до 100%, с получением N-(4-(1-(2-((тетрагидро-2H-пиран-2-ил)окси)этил)-1H-1,2,3-триазол-4-ил)бензил)метакриламида (25, 0,9 г, выход 49%) в виде бесцветного твердого вещества. LCMS масса/заряд: [M+Na]+ Рассч. для C20H26N4O3 371,2078; Найденное значение 371,2076.
Экспериментальная процедура для 1-(4-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)фенил)этан-1-амина (26)
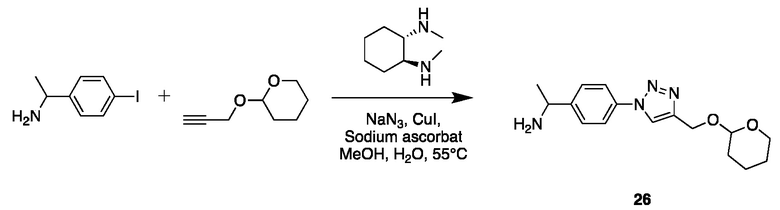 ,
,
где Sodium ascorbat означает аскорбат натрия.
Смесь 1-(4-йодофенил)этан-1-амина гидрохлорида (1,0 г, 4,05 ммоль, 1,0 экв.), (1S,2S)-N1,N2-диметилциклогексан-1,2-диамина (0,08 мл, 0,53 ммоль, 0,13 экв.), аскорбата натрия (80 мг, 0,40 ммоль, 0,1 экв.), йодида меди (77 мг, 0,40 ммоль, 0,1 экв.), азида натрия (526 г, 8,09 ммоль, 2,0 экв.) и 2-(проп-2-ин-1-илокси)тетрагидро-2H-пирана (0,57 г, 4,05 ммоль, 1,0 экв.) в метаноле (9 мл) и воде (1 мл) продували азотом в течение 5 минут и нагревали до 55°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры и растворитель удаляли при пониженном давлении. Остаток повторно растворяли в дихлорметане и фильтровали через пробку из целита. К фильтрату добавляли целит и растворитель удаляли при пониженном давлении. Остаток очищали на силикагеле (40 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 5% с получением 1-(4-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)фенил)этан-1-амина (26, 0,62 г, 51%) в виде желтоватого твердого вещества. LCMS масса/заряд: [M+H]+ Рассч. для C16H22N4O2 303,2; Найденное значение 303,2.
Экспериментальная процедура для N-(1-(4-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)фенил)этил)метакриламида (27)
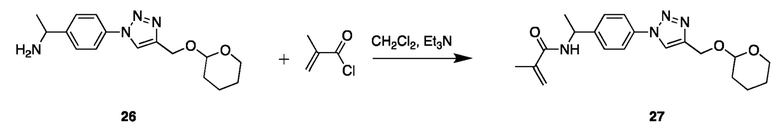
Раствор 1-(4-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)фенил)этан-1-амина (26, 0,52 г, 1,7 ммоль, 1,0 экв.) и триэтиламина (0,29 мл, 2,1 ммоль, 1,2 экв.) в CH2Cl2 (11 мл) охлаждали до 0°C с помощью ледяной бани и добавляли по каплям метакрилоилхлорид (0,18 мл, 1,8 ммоль, 1,05 экв., разбавленный в 11 мл CH2Cl2). Охлаждающую баню удаляли и реакционную смесь перемешивали в течение 4 ч. Добавляли пять (5) граммов целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (40 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 2,5% с получением N-(1-(4-(4-(((тетрагидро-2H-пиран-2-ил)окси) метил)-1H-1,2,3-триазол-1-ил)фенил)этил)метакриламида (27, 0,49 г, выход 76%) в виде белого твердого вещества. LCMS масса/заряд: [M+H]+ Рассч. для C20H26N4O3 371,2078; Найденное значение 371,2087.
Экспериментальная процедура для (4-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)-2-(трифторметил)фенил)метанамина (28)
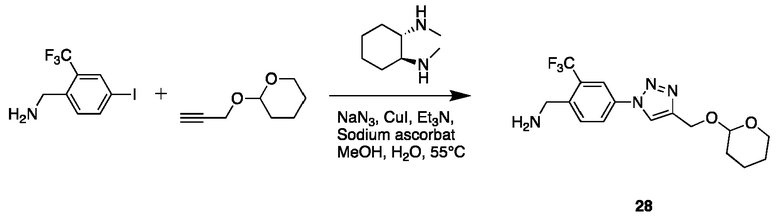 ,
,
где Sodium ascorbat означает аскорбат натрия.
Смесь (4-йод-2-(трифторметил)фенил)метанамина (3,0 г, 9,97 ммоль, 1,0 экв.), (1S,2S)-N1,N2-диметилциклогексан-1,2-диамина (0,31 мл 1,99 ммоль, 0,2 экв.), аскорбата натрия (197 мг, 1,00 ммоль, 0,1 экв.), йодида меди (285 мг, 1,49 ммоль, 0,15 экв.), азида натрия (1,30 г, 19,93 ммоль, 2,0 экв.), Et3N (1,67 мл, 11,96 ммоль, 1,2 экв.) и 2-(проп-2-ин-1-илокси)тетрагидро-2H-пирана (1,40 г, 9,97 ммоль, 1,0 экв.) в метаноле (24 мл) и воде (6 мл) продували азотом в течение 5 минут и нагревали до 55°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, и фильтровали через пробку из целита, и ополаскивали с помощью метанола (3×50 мл). К фильтрату добавляли целит и растворитель удаляли при пониженном давлении. Остаток очищали на силикагеле (120 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 25% с получением (4-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)-2-(трифторметил)фенил)метанамина (28, 2,53 г, 71%) в виде зеленого масла. LCMS масса/заряд: [M+H]+ Рассч. для C16H19N4O2F3 357,2; Найденное значение 357,1.
Экспериментальная процедура для N-(4-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)-2(трифторметил)бензил)метакриламида (29)
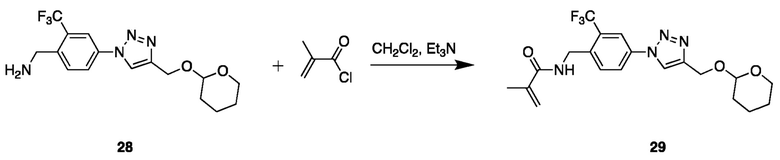
Раствор (4-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)-2-(трифторметил)фенил)метанамина (28, 1,0 г, 2,81 ммоль, 1,0 экв.) и триэтиламина (0,59 мл, 4,21 ммоль, 1,5 экв.) в CH2Cl2 (25 мл) быстро вакуумировали и продували азотом. Добавляли по каплям метакрилоилхлорид (0,41 мл, 4,21 ммоль, 1,5 экв.). Реакционную смесь перемешивали в течение 6 ч при комнатной температуре. Добавляли десять (10) граммов целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (40 г) с применением гексанов/EtOAc в качестве элюента, начиная со 100% гексанов и постепенно увеличивая концентрацию EtOAc до 100%, с получением N-(4-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)-2(трифторметил)бензил)метакриламида (29, 0,65 г, выход 55%) в виде бесцветного твердого вещества. LCMS масса/заряд: [M+H]+ Рассч. для C20H23N4O3F3 425,2; Найденное значение 425,1.
Экспериментальная процедура для 3-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)пропан-1-амина (30)
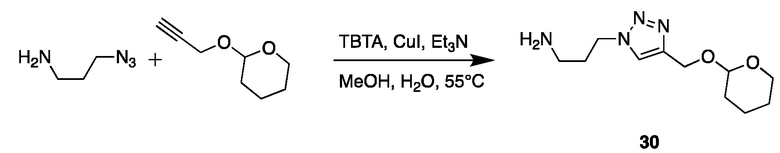
Смесь 3-азидопропан-1-амина гидрохлорида (1,5 г, 14,98 ммоль, 1,0 экв.), трис[(1-бензил-1H-1,2,3-триазол-4-ил)метил]-амина (1,99 г, 3,75 ммоль, 0,25 экв.), йодида меди (0,29 г, 1,50 ммоль, 0,1 экв.) и триэтиламина (0,52 мл, 3,75 ммоль, 0,25 экв.) в метаноле (50 мл) и воде (6 мл) продували азотом в течение 5 минут и охлаждали до 0 C. Добавляли 2-(проп-2-ин-1-илокси)тетрагидро-2H-пиран (2,10 г, 14,98 ммоль, 1,0 экв.) и реакционную смесь нагревали до 55°C и перемешивали в течение ночи в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, фильтровали через пробку из целита и ополаскивали с помощью метанола (3×50 мл). К фильтрату добавляли целит (20 г), растворитель удаляли при пониженном давлении. Остаток очищали на силикагеле (120 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 20% с получением 3-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)пропан-1-амина (30, 2,36 г, 66%). LCMS масса/заряд: [M+H]+ Рассч. для C11H20N4O2 241,2; Найденное значение 241,2.
Экспериментальная процедура для N-(3-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)пропил)метакриламида (31)
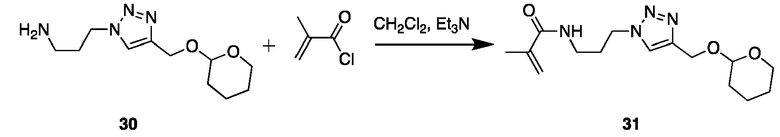
Раствор 3-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)пропан-1-амина (30, 1,0 г, 4,16 ммоль, 1,0 экв.) и триэтиламина (0,58 мл, 4,16 ммоль, 1,0 экв.) в CH2Cl2 (20 мл) быстро вакуумировали и продували азотом. Добавляли по каплям метакрилоилхлорид (0,40 мл, 4,16 ммоль, 1,0 экв.). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли десять (10) граммов целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (40 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 20% с получением N-(3-(4-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1H-1,2,3-триазол-1-ил)пропил)метакриламида (31, 0,96 г, выход 75%) в виде бесцветного масла. LCMS масса/заряд: [M+H]+ Рассч. для C15H24N4O3 309,2; Найденное значение 309,4.
Экспериментальная процедура для (4-(4-((оксетан-3-илокси)метил)-1H-1,2,3-триазол-1-ил)фенил)метанамина (32)
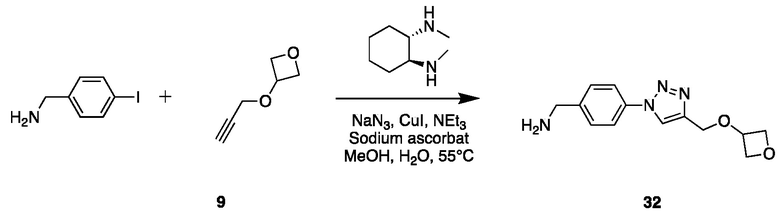 ,
,
где Sodium ascorbat означает аскорбат натрия.
Смесь (4-йодофенил)метанамина гидрохлорида (2,64 г, 9,80 ммоль, 1,0 экв.), (1S,2S)-N1,N2-диметилциклогексан-1,2-диамина (0,31 мл, 1,96 ммоль, 0,2 экв.), аскорбата натрия (198 мг, 0,98 ммоль, 0,1 экв.), йодида меди (279 мг, 1,47 ммоль, 0,15 экв.), азида натрия (1,27 г, 19,59 ммоль, 2,0 экв.) , Et3N (1,64 мл, 11,75 ммоль, 1,2 экв.) и 3-(проп-2-ин-1-илокси)оксетана (9, 1,10 г, 9,80 ммоль, 1,0 экв.) в метаноле (24 мл) и воде (6 мл) продували азотом в течение 5 минут и нагревали до 55°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, и фильтровали через пробку из целита, и ополаскивали с помощью метанола (3×50 мл). К фильтрату добавляли целит и растворитель удаляли при пониженном давлении. Остаток очищали на силикагеле (120 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 25% с получением (4-(4-((оксетан-3-илокси)метил)-1H-1,2,3-триазол-1-ил)фенил)метанамина (32, 1,43 г, 56%) в виде масла. LCMS масса/заряд: [M+H]+ Рассч. для C13H16N4O2 261,1346; Найденное значение 261,1342.
Экспериментальная процедура для N-(4-(4-((оксетан-3-илокси)метил)-1H-1,2,3-триазол-1-ил)бензил)метакриламида (33)
Раствор (4-(4-((оксетан-3-илокси)метил)-1H-1,2,3-триазол-1-ил)фенил)метанамина (32, 0,58 г, 2,23 ммоль, 1,0 экв.) и триэтиламина (0,47 мл, 3,34 ммоль, 1,5 экв.) в CH2Cl2 (20 мл) быстро вакуумировали и продували азотом. Добавляли по каплям метакрилоилхлорид (0,32 мл, 3,34 ммоль, 1,5 экв.). Реакционную смесь перемешивали в течение 6 ч при комнатной температуре. Добавляли десять (10) граммов целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (24 г) с применением гексанов/EtOAc в качестве элюента, начиная со 100% гексанов и постепенно увеличивая концентрацию EtOAc до 100%, с получением N-(4-(4-((оксетан-3-илокси)метил)-1H-1,2,3-триазол-1-ил)бензил)метакриламида (33, 0,48 г, выход 66%) в виде бесцветного твердого вещества. LCMS масса/заряд: [M+H]+ Рассч. для C17H20N4O3 329,1608; Найденное значение 329,1611.
Экспериментальная процедура для этил-1-(2-метакриламидоэтил)-1H-имидазол-4-карбоксилата (35)
Раствор этил-1-(2-аминоэтил)-1H-имидазол-4-карбоксилата (34, 2,0 г, 10,91 ммоль, 1,0 экв.) и триэтиламина (3,80 мл, 27,29 ммоль, 2,5 экв.) в CH2Cl2 (20 мл) быстро вакуумировали и продували азотом. Добавляли по каплям метакрилоилхлорид (1,60 мл, 16,37 ммоль, 1,5 экв.). Реакционную смесь перемешивали в течение 3 ч при комнатной температуре. Добавляли пятнадцать (15) граммов целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (40 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 25% с получением этил-1-(2-метакриламидоэтил)-1H-имидазол-4-карбоксилата (35, 1,28 г, выход 47%) в виде бесцветного твердого вещества. LCMS масса/заряд: [M+H]+ Рассч. для C12H17N3O3 252,1; Найденное значение 252,1.
Экспериментальная процедура для N-(4-(1,1-диоксидотиоморфолино)бензил)метакриламида (37)
К раствору 4-(4-(аминометил)фенил)тиоморфолин-1,1-диоксида гидрохлорида (36, 1,15 г, 4,15 ммоль, 1,0 экв.) и триэтиламина (1,39 мл, 9,97 ммоль, 2,4 экв.) в CH2Cl2 (80 мл) добавляли по каплям раствор метакрилоилхлорида (0,43 мл, 4,36 ммоль, 1,05 экв., в CH2Cl2, 5 мл). Реакционную смесь перемешивали в течение 22 ч при комнатной температуре. Добавляли восемь (8) граммов целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (80 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 3,75% с получением N-(4-(1,1-диоксидотиоморфолино)бензил)метакриламида (37, 0,32 г, выход 25%) в виде твердого вещества.
Экспериментальная процедура для N-метил-N-(2-(метилсульфонил)этил)проп-2-ин-1-амина (38)
 ,
,
где Amberlyst означает Амберлист.
К смеси 1-метилсульфонилэтилена (4,99 г, 47,03 ммоль, 4,13 мл) и Амберлист -15 (30% вес/вес) добавляли по каплям N-метилпроп-2-ин-1-амин (2,6 г, 37,62 ммоль). Смесь перемешивали при комнатной температуре в течение 12 часов. Катализатор удаляли посредством фильтрации и фильтрат концентрировали при пониженном давлении с получением N-метил-N-(2-(метилсульфонил)этил)проп-2-ин-1-амина (38, 6,43 г, 98%) в виде масла. LCMS масса/заряд: [M+H]+ Рассч. для C7H13NSO2 176,11; Найденное значение 176,1.
Экспериментальная процедура для N-((1-(2-(2-(2-(2-аминоэтокси)этокси)этокси)этил)-1H-1,2,3-триазол-4-ил)метил)-N-метил-2-(метилсульфонил)этан-1-амина (40)
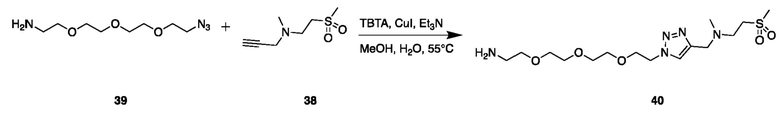
Смесь N-метил-N-(2-(метилсульфонил)этил)проп-2-ин-1-амина (38, 5,02 г, 28,64 ммоль, 1,25 экв.), трис[(1-бензил-1H-1,2,3-триазол-4-ил)метил]-амина (3,04 г, 5,73 ммоль, 0,25 экв.), йодида меди (436 мг, 2,29 ммоль, 0,1 экв.) и триэтиламина (0,8 мл, 5,7 ммоль, 0,25 экв.) в метаноле (50 мл) и воде (6 мл) вакуумировали и продували азотом (3 раза) и охлаждали с помощью ледяной бани. Добавляли по каплям 2-(2-(2-(2-азидоэтокси)этокси)этокси)этан-1-амин (39, 5,02 г, 22,91 ммоль, 1,0 экв.), охлаждающую баню удаляли и смесь перемешивали в течение 5 минут. Реакционную смесь нагревали до 55°C и перемешивали в течение ночи в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, добавляли целит (20 г) и концентрировали при пониженном давлении. Неочищенный продукт очищали на силикагеле (220 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 25% с получением N-((1-(2-(2-(2-(2-аминоэтокси)этокси)этокси)этил)-1H-1,2,3-триазол-4-ил)метил)-N-метил-2-(метилсульфонил)этан-1-амина (40, 4,98 г, 55%) в виде масла. LCMS масса/заряд: [M+H]+ Рассч. для C15H31N5O5S 394,2; Найденное значение 394,2.
Экспериментальная процедура для N-(2-(2-(2-(2-(4-((метил(2-(метилсульфонил)этил) амино)метил)-1H-1,2,3-триазол-1-ил)этокси)этокси)этокси)этил)метакриламида (41)
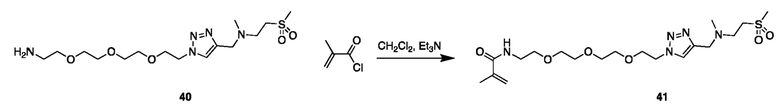
К раствору N-((1-(2-(2-(2-(2-аминоэтокси)этокси)этокси)этил)-1H-1,2,3-триазол-4-ил)метил)-N-метил-2-(метилсульфонил)этан-1-амина (40, 1,0 г, 2,54 ммоль, 1,0 экв.) и триэтиламина (0,43 мл, 3,05 ммоль, 1,2 экв.) в CH2Cl2 (15 мл) добавляли по каплям раствор метакрилоилхлорида (0,30 мл, 3,05 ммоль, 1,5 экв.). Реакционную смесь перемешивали в течение 5 ч при комнатной температуре. Добавляли целит и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (40 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 12,5% с получением N-(2-(2-(2-(2-(4-((метил(2-(метилсульфонил)этил)амино)метил)-1H-1,2,3-триазол-1-ил)этокси)этокси)этокси)этил)метакриламида (41, 0,86 г, выход 73%) в виде масла. LCMS масса/заряд: [M+H]+ Рассч. для C19H35N5O6S 462,2; Найденное значение 462,2.
Экспериментальная процедура для 7-(проп-2-ин-1-ил)-2-окса-7-азаспиро[3,5]нонана (42)
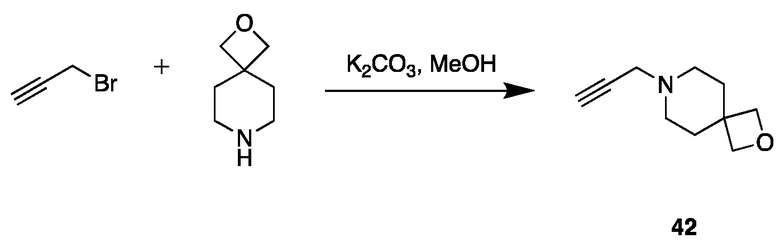
3-Бромпроп-1-ин (4,4 мл, 39,32 ммоль 1,0 экв.) добавляли к смеси 2-окса-7-азаспиро[3,5]нонана (8,54 г, 39,32 ммоль, 1,0 экв.), карбоната калия (17,9 г, 129,7 ммоль, 3,3 экв.) в метаноле (200 мл) и перемешивали в течение ночи при комнатной температуре. Смесь фильтровали, добавляли целит и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (220 г) с применением дихлорметана/метанола в качестве подвижной фазы. Концентрацию метанола постепенно увеличивали от 0% до 5% с получением 7-(проп-2-ин-1-ил)-2-окса-7-азаспиро[3,5]нонана (42, 4,44 г, 68%) в виде масла.
Экспериментальная процедура для 2-(2-(2-(2-(4-((2-окса-7-азаспиро[3,5]нонан-7-ил)метил)-1H-1,2,3-триазол-1-ил)этокси)этокси)этокси)этан-1-амина (43)
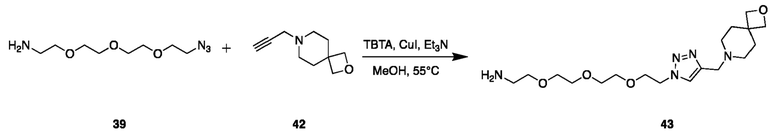
Смесь 7-(проп-2-ин-1-ил)-2-окса-7-азаспиро[3,5]нонана (42, 2,5 г, 15,13 ммоль, 1,0 экв.), трис[(1-бензил-1H-1,2,3-триазол-4-ил)метил]-амина (1,77 г, 3,33 ммоль, 0,22 экв.), йодида меди (288 мг, 1,51 ммоль, 0,1 экв.) и триэтиламина (0,53 мл, 3,8 ммоль, 0,25 экв.) в метаноле (50 мл) охлаждали с помощью ледяной бани. Добавляли по каплям 2-(2-(2-(2-азидоэтокси)этокси)этокси)этан-1-амин (39, 3,86 г, 17,70 ммоль, 1,17 экв.), охлаждающую баню удаляли и смесь перемешивали в течение 5 минут. Реакционную смесь нагревали до 55°C и перемешивали в течение ночи в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, добавляли целит (10 г) и концентрировали при пониженном давлении. Неочищенный продукт очищали на силикагеле (220 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 10% с получением 2-(2-(2-(2-(4-((2-окса-7-азаспиро[3,5]нонан-7-ил)метил)-1H-1,2,3-триазол-1-ил)этокси)этокси)этокси)этан-1-амина (43, 4,76 г, 82%) в виде масла. LCMS масса/заряд: [M+H]+ Рассч. для C18H33N5O4 384,3; Найденное значение 384,2.
Экспериментальная процедура для N-(2-(2-(2-(2-(4-((2-окса-7-азаспиро[3.5]нонан-7-ил)метил)-1H-1,2,3-триазол-1-ил)этокси)этокси)этокси)этил)метакриламида (44)
Раствор 2-(2-(2-(2-(4-((2-окса-7-азаспиро[3.5]нонан-7-ил)метил)-1H-1,2,3-триазол-1-ил)этокси)этокси)этокси)этан-1-амина (43, 2,65 г, 6,91 ммоль, 1,0 экв.) и триэтиламина (1,16 мл, 8,29 ммоль, 1,2 экв.) в CH2Cl2 (100 мл) охлаждали с помощью ледяной бани в атмосфере азота. Добавляли по каплям метакрилоилхлорид (0,74 мл, 7,6 ммоль, 1,1 экв.). Охлаждающую баню удаляли и реакционную смесь перемешивали в течение 4 ч при комнатной температуре. Добавляли десять (10) граммов целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (120 г) с применением дихлорметана/метанола в качестве подвижной фазы. Концентрацию метанола постепенно увеличивали от 0% до 10% с получением N-(2-(2-(2-(2-(4-((2-окса-7-азаспиро[3.5]нонан-7-ил)метил)-1H-1,2,3-триазол-1-ил)этокси)этокси)этокси)этил)метакриламида (44, 1,50 г, выход 48%) в виде бесцветного масла. LCMS масса/заряд: [M+H]+ Рассч. для C22H37N5O5 452,29; Найденное значение 452,25.
Экспериментальная процедура для 4-((1-(2-(2-аминоэтокси)этил)-1H-1,2,3-триазол-4-ил)метил)тиоморфолин-1,1-диоксида (45)
Смесь 4-(проп-2-ин-1-ил)тиоморфолин-1,1-диоксида (1,14 г, 6,58 ммоль, 1,0 экв.), трис[(1-бензил-1H-1,2,3-триазол-4-ил)метил]-амина (768 мг, 1,45 ммоль, 0,22 экв.), йодида меди (125 мг, 0,66 ммоль, 0,1 экв.) и триэтиламина (0,23 мл, 1,65 ммоль, 0,25 экв.) в метаноле (20 мл) охлаждали с помощью ледяной бани. Добавляли по каплям 2-(2-азидоэтокси)этан-1-амин (1,00 г, 7,70 ммоль, 1,17 экв.), охлаждающую баню удаляли и смесь перемешивали в течение 5 минут. Реакционную смесь нагревали до 55°C и перемешивали в течение ночи в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, добавляли целит (10 г) и концентрировали при пониженном давлении. Неочищенный продукт очищали на силикагеле (40 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 9,5% с получением 4-((1-(2-(2-аминоэтокси)этил)-1H-1,2,3-триазол-4-ил)метил)тиоморфолин-1,1-диоксида (45, 1,86 г, 93%) в виде белого твердого вещества. LCMS масса/заряд: [M+H]+ Рассч. для C11H21N5O4S 304,1438; Найденное значение 304,1445.
Экспериментальная процедура для N-(2-(2-(4-((1,1-диоксидотиоморфолино)метил)-1H-1,2,3-триазол-1-ил)этокси)этил)метакриламида (46)
Раствор 4-((1-(2-(2-аминоэтокси)этил)-1H-1,2,3-триазол-4-ил)метил)тиоморфолин-1,1-диоксида (45, 1,32 г, 4,35 ммоль, 1,0 экв.) и триэтиламина (0,73 мл, 5,22 ммоль, 1,2 экв.) в CH2Cl2 (100 мл) охлаждали с помощью ледяной бани в атмосфере азота. Добавляли по каплям метакрилоилхлорид (0,47 мл, 4,8 ммоль, 1,1 экв.). Охлаждающую баню удаляли и реакционную смесь перемешивали в течение 4 ч при комнатной температуре. Добавляли десять (10) граммов целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (120 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 1,25% с получением N-(2-(2-(4-((1,1-диоксидотиоморфолино)метил)-1H-1,2,3-триазол-1-ил)этокси)этил)-метакриламида (46, 0,90 г, выход 56%) в виде бесцветного масла. LCMS масса/заряд: [M+H]+ Рассч. для C15H25N5O4S 372,17; Найденное значение 372,15.
Экспериментальная процедура для 4-((1-(2-(2-(2-аминоэтокси)этокси)этил)-1H-1,2,3-триазол-4-ил)метил)тиоморфолин-1,1-диоксида (47)
Смесь 4-(проп-2-ин-1-ил)тиоморфолин-1,1-диоксида (4,6 г, 26,55 ммоль, 1,0 экв.), трис[(1-бензил-1H-1,2,3-триазол-4-ил)метил]-амина (3,1 г, 5,84 ммоль, 0,22 экв.), йодида меди (506 мг, 2,66 ммоль, 0,1 экв.) и триэтиламина (0,93 мл, 6,64 ммоль, 0,25 экв.) в метаноле (80 мл) охлаждали с помощью ледяной бани. Добавляли по каплям 2-(2-(2-азидоэтокси)этокси)этан-1-амин (5,00 г, 28,68 ммоль, 1,08 экв.), охлаждающую баню удаляли и смесь перемешивали в течение 5 минут. Реакционную смесь нагревали до 55°C и перемешивали в течение ночи в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, добавляли целит и концентрировали при пониженном давлении. Неочищенный продукт очищали на силикагеле (220 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 10% с получением 4-((1-(2-(2-(2-аминоэтокси)этокси)этил)-1H-1,2,3-триазол-4-ил)метил)тиоморфолин-1,1-диоксида (47, 5,26 г, 57%) в виде желтоватого масла. LCMS масса/заряд: [M+H]+ Рассч. для C13H25N5O4S 348,1700; Найденное значение 348,1700.
Экспериментальная процедура для N-(2-(2-(2-(4-((1,1-диоксидотиоморфолино)метил)-1H-1,2,3-триазол-1-ил)этокси)этокси)этил)метакриламида (48)
Раствор 4-((1-(2-(2-(2-аминоэтокси)этокси)этил)-1H-1,2,3-триазол-4-ил)метил)тиоморфолин-1,1-диоксида (47, 1,49 г, 4,29 ммоль, 1,0 экв.) и триэтиламина (0,72 мл, 5,15 ммоль, 1,2 экв.) в CH2Cl2 (50 мл) охлаждали с помощью ледяной бани в атмосфере азота. Добавляли по каплям метакрилоилхлорид (0,46 мл, 4,7 ммоль, 1,1 экв.). Охлаждающую баню удаляли и реакционную смесь перемешивали в течение 4 ч при комнатной температуре. Добавляли десять (10) граммов целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (80 г) с применением дихлорметана/метанола в качестве подвижной фазы. Концентрацию метанола постепенно увеличивали от 0% до 5% с получением N-(2-(2-(2-(4-((1,1-диоксидотиоморфолино)метил)-1H-1,2,3-триазол-1-ил)этокси)этокси)этил)-метакриламида (48, 0,67 г, выход 38%) в виде бесцветного масла. LCMS масса/заряд: [M+H]+ Рассч. для C17H29N5O5S 416,20; Найденное значение 416,20.
Экспериментальная процедура для 4-((1-(14-амино-3,6,9,12-тетраоксатетрадецил)-1H-1,2,3-триазол-4-ил)метил)тиоморфолин-1,1-диоксида (49)
Смесь 4-(проп-2-ин-1-ил)тиоморфолин-1,1-диоксида (5,0 г, 28,86 ммоль, 1,0 экв.), трис[(1-бензил-1H-1,2,3-триазол-4-ил)метил]-амина (3,37 г, 6,35 ммоль, 0,22 экв.), йодида меди (550 мг, 2,89 ммоль, 0,1 экв.) и триэтиламина (1,01 мл, 7,22 ммоль, 0,25 экв.) в метаноле (90 мл) охлаждали с помощью ледяной бани. Добавляли по каплям 14-азидо-3,6,9,12-тетраоксатетрадекан-1-амин (8,86 г, 33,77 ммоль, 1,17 экв.), охлаждающую баню удаляли и смесь перемешивали в течение 5 минут. Реакционную смесь нагревали до 55°C и перемешивали в течение ночи в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, добавляли целит (15 г) и концентрировали при пониженном давлении. Неочищенный продукт очищали на силикагеле (220 г) с применением дихлорметана/(метанола, содержащего 12% (объем/объем) водного гидроксида аммония) в качестве подвижной фазы. Концентрацию (метанола, содержащего 12% (объем/объем) водного гидроксида аммония) постепенно увеличивали от 0% до 10% с получением 4-((1-(14-амино-3,6,9,12-тетраоксатетрадецил)-1H-1,2,3-триазол-4-ил)метил)тиоморфолин-1,1-диоксида (49, 7,56 г, 60%) в виде масла. LCMS масса/заряд: [M+H]+ Рассч. для C17H33N5O6S 436,2224; Найденное значение 436,2228.
Экспериментальная процедура для N-(14-(4-((1,1-диоксидотиоморфолино)метил)-1H-1,2,3-триазол-1-ил)-3,6,9,12-тетраоксатетрадецил)метакриламида (50)
Раствор 4-((1-(14-амино-3,6,9,12-тетраоксатетрадецил)-1H-1,2,3-триазол-4-ил)метил)тиоморфолин-1,1-диоксида (49, 1,95 г, 4,79 ммоль, 1,0 экв.) и триэтиламина (0,80 мл, 5,74 ммоль, 1,2 экв.) в CH2Cl2 (50 мл) охлаждали с помощью ледяной бани в атмосфере азота. Добавляли по каплям метакрилоилхлорид (0,51 мл, 5,26 ммоль, 1,1 экв.). Охлаждающую баню удаляли и реакционную смесь перемешивали в течение 4 ч при комнатной температуре. Добавляли десять (10) граммов целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (80 г) с применением дихлорметана/метанола в качестве подвижной фазы. Концентрацию метанола постепенно увеличивали от 0% до 5% с получением N-(14-(4-((1,1-диоксидотиоморфолино)метил)-1H-1,2,3-триазол-1-ил)-3,6,9,12-тетраоксатетрадецил)метакриламида (50, 0,76 г, выход 32%) в виде бесцветного масла. LCMS масса/заряд: [M+H]+ Рассч. для C21H37N5O7S 504,25; Найденное значение 504,20.
Пример 4. Химическая модификация альгината для инкапсуляции клеток
Полимерный материал может быть химически модифицирован с помощью соединений формулы (I) (или их фармацевтически приемлемой соли) перед инкапсуляцией активных клеток (например, клеток RPE), как описано ниже в примере 5. Протоколы синтеза иллюстративных соединений для модификации полимерных материалов кратко изложены выше в примере 3. Эти соединения или иные можно применять для химической модификации любого полимерного материала.
Полимерный материал может быть химически модифицирован с помощью соединения формулы (I) (или его фармацевтически приемлемой соли) перед образованием устройства, описанного в данном документе (например, гидрогелевой капсулы, описанной в данном документе), с применением способов, известных из области техники.
Например, в случае альгината, альгинатную карбоновую кислоту активируют для связывания с одним или более функционализированными аминогруппой соединениями для обеспечения альгината, модифицированного с помощью соединения с противофиброзным действием, например, соединения формулы (I). Альгинатный полимер растворяли в воде (30 мл/грамм полимера) и обрабатывали с помощью 2-хлор-4,6-диметокси-1,3,5-триазина (0,5 экв.) и N-метилморфолина (1 экв.). К данной смеси добавляли раствор представляющего интерес соединения (например, соединения 101, представленного в таблице 2) в ацетонитриле (0,3 М).
Количества добавляемого соединения и реагента для сочетания зависят от требуемой концентрации соединения, связываемого с альгинатом, например, плотности конъюгации. Для получения полимерного раствора CM-LMW-Alg-101-средней плотности, растворенный немодифицированный низкомолекулярный альгинат (приблизительная MW <75 кДа, отношение G:M ≥ 1,5) обрабатывали с помощью 2-хлор-4,6-диметокси-1,3,5-триазина (5,1 ммоль/г альгината), и N-метилморфолина (10,2 ммоль/г альгината), и соединения 101 (5,4 ммоль/г альгината). Для получения полимерного раствора CM-LMW-Alg-101-высокой плотности, растворенный немодифицированный альгинат с низкой молекулярной массой (приблизительно MW < 75 кДа, соотношение G:M ≥ 1,5) обрабатывали с помощью 2-хлор-4,6-диметокси-1,3,5-триазина (5,1 ммоль/г альгината) и N-метилморфолина (10,2 ммоль/г альгината) и соединения 101 (5,4 ммоль/г альгината).
Реакционную смесь нагревали до 55oC в течение 16 ч, затем охлаждали до комнатной температуры и осторожно концентрировали с помощью ротационного выпаривания, затем остаток растворяли в воде. Смесь фильтровали через слой модифицированного цианогруппами силикагеля (Silicycle) и осадок на фильтре промывали с помощью воды. Затем полученный раствор подвергали интенсивному диализу (мембрана с MWCO 10000) и раствор альгината концентрировали с помощью лиофилизации для получения требуемого химически-модифицированного альгината в виде твердого вещества или концентрировали с применением любой методики, подходящей для получения раствора химически модифицированного альгината с вязкостью от 25 сП до 35 сП.
Плотность конъюгации с химически модифицированным альгинатом измеряли с помощью органического элементного анализа в отношении процента азота. Образец получали путем диализа раствора химически модифицированного альгината против воды (мембрана с MWCO 10000) в течение 24 часов с заменой воды дважды с последующей лиофилизацией до постоянного веса.
Для применения в получении гидрогелевых капсул, описанных в примерах ниже, химически модифицированные альгинатные полимеры получали с помощью соединения 101 (представленного в таблице 1), конъюгируемого с низкомолекулярным альгинатом (приблизительна MW <75 кДа, отношение G:M ≥1,5) при средней (от 2% до 5% N) или высокой (от 5,1% до 8% N) плотности, как определено путем органического элементного анализа в отношении процента азота, и они обозначаются в данном документе как CM-LMW-Alg-101-средней плотности и CM-LMW-Alg-101-высокой плотности. Если не указано иное, химически модифицированный альгинат в капсулах, изготовленных в приведенных ниже примерах, представляет собой CM-LMW-Alg-101-средней плотности.
Пример 5. Образование инкапсулированных in situ имплантируемых элементов
Кластеры активных клеток (например, клеток RPE) инкапсулировали в альгинат с образованием инкапсулированных in-situ имплантируемых элементов, выполненных в виде гидрогелевых капсул в соответствии с протоколом, описанным в данном документе. Инкапсулирующий альгинат представлял собой смесь немодифицированного высокомолекулярного альгината (PRONOVATM SLG100, NovaMatrix, Саннвика, Норвегия, № по кат. 4202106, приблизительная MW 150 кДа - 250 кДа, отношение G:M ≥1,5) и TMTD-модифицированного альгината, который представлял собой низкомолекулярный альгинат (альгинат PRONOVA™ VLVG, NovaMatrix® № по кат. 4200506, приблизительная MW <75 кДа, отношение G:M ≥1,5) (химически модифицированный с помощью соединения 101 из таблицы 1 с применением способа, аналогичного описанному в примере 4). TMTD-альгинат сначала растворяли из расчета 5% веса на объем в 0,8% солевом растворе или 0,9% солевом растворе, а затем смешивали с 3% веса на объем SLG100 (также растворенного в 0,8% солевом растворе или 0,9% солевом растворе соответственно) при объемном соотношении 80% TMTD-альгината и 20% SLG100 или 70% TMTD-альгината и 30% SLG100.
Перед изготовлением инкапсулированных in-situ имплантируемых элементов буферы стерилизовали путем автоклавирования, а растворы альгинатов стерилизовали путем фильтрации через 0,2-мкм фильтр с применением асептических процессов. Электростатический генератор капель настраивали следующим образом: серия ES 0-100 кВ, высоковольтный генератор мощностью 20 Вт (серия Gamma ES, Gamma High-Voltage Research, Флорида, США) соединяли с верхней частью и нижней частью иглы с тупым концом (SAI Infusion Technologies, Иллинойс, США). Данную иглу присоединяли к 5-мл шприцу Люэра (BD, Нью-Джерси, США), который прикрепляли зажимом к шприцевому насосу (Pump 11 Pico Plus, Harvard Apparatus, Массачусетс, США), который был ориентирован вертикально. Шприцевой насос выкачивает альгинат в стеклянную чашку, содержащую 20 мМ раствор для сшивания, содержащий барий (25 мМ буфер HEPES, 20 мМ BaCl2 и 0,2 М маннит). В некоторых экспериментах раствор для сшивания также содержал 0,01% полоксамера 188. Шприцевой насос PicoPlus характеризовался следующими параметрами: диаметр 12,06 мм и расход от приблизительно 0,16 мл/мин до 0,2 мл/мин в зависимости от целевого размера для гидрогелевой капсулы. Инкапсулированные in-situ имплантируемые элементы (размер сферы 0,5 мм) получали с помощью тупой иглы 25G, напряжения 5 кВ и расхода 200 мкл/мин. Для образования 1,5 мм сфер (например, капсул) применяли иглу с тупым концом 18 калибра (SAI Infusion Technologies) при расходе 0,16 мл/мин или 10 мл/ч и регулированием напряжения в диапазоне 5-9 кВ до получения 12 капель в 10 секунд.
Непосредственно перед инкапсуляцией культивируемые отдельные клетки (полученные практически так, как описано в примере 1), кластеры активных клеток (полученные практически так, как описано в примере 2A) или клетки на микроносителях (полученные практически так, как описано в примере 2B) центрифугировали при 1400 об/мин в течение 1 мин и промывали с помощью буфера Кребса-Хенселейта (KH), не содержащего кальций (4,7 мМ KCl, 25 мМ HEPES, 1,2 мМ KH2PO4, 1,2 мМ MgSO4 × 7H2O, 135 мМ NaCl, pH ≈ 7,4, ≈ 290 мОсм). После промывания клетки центрифугировали снова и весь супернатант аспирировали. Затем осадок клеток ресуспендировали в одном из растворов TMTD-альгината: SLG100 (описанных выше) при диапазоне значений плотности отдельных клеток, кластеров или микроносителей (например, числа отдельных клеток или кластеров или объема микроносителей на мл раствора альгината). Инкапсулированные in-situ имплантируемые элементы сшивали с применением раствора для сшивания, содержащего BaCl2, и их размеры контролировали, как описано выше. Непосредственно после сшивания инкапсулированные in-situ имплантируемые элементы (гидрогелевые капсулы) промывали с помощью буфера HEPES (NaCl 15,428 г, KCl 0,70 г, MgCl2·6H2O 0,488 г, 50 мл буферного раствора HEPES (1 М) (Gibco, Life Technologies, Калифорния, США) в 2 литрах деионизированной воды) четыре раза и хранили при 4°C до применения. После образования и перед применением инкапсулированные in-situ имплантируемые элементы анализировали с помощью световой микроскопии, чтобы определить размер и оценить качество капсул.
Чтобы исследовать качество капсул в композиции на основе капсул, аликвоту, содержащую по меньшей мере 200 капсул, отбирали из композиции и переносили в луночный планшет, и аликвоту целиком исследовали в отношении качества с помощью световой микроскопии путем подсчета количества сферических капсул от общего количества.
Пример 6. Секреция фактора VIII-BDD их инкапсулированных in situ имплантируемых элементов
Клетки ARPE-19 трансфицировали с помощью вектора, кодирующего фактор VIII-BDD человека, с применением стандартных методик трансфекции. Вектор также содержал ген устойчивости к зеоцину. Через два дня после трансфекции линию клеток культивировали в виде отдельных клеток при 37oC в полной ростовой среде, дополненной зеоцином, и затем культивируемые клетки инкапсулировали в виде отдельных клеток в 1,5 мм альгинатные имплантируемые элементы, как кратко изложено в примере 5.
Чтобы определить количество доступного фактора VIII-BDD, инкапсулированные клетки (Cap) центрифугировали и супернатант собирали и анализировали с помощью ELISA (набор для ELISA антигена FVIII VisuLize, Affinity Biologicals, Inc.) в отношении присутствия фактора VIII-BDD человека через 4 часа, 24 часа, 48 часов и 72 часа после трансфекции. Эти результаты сравнивали с результатами для неинкапсулированных активных клеток (клетки RPE, культура), и они представлены на ФИГ. 1.
Имплантируемые элементы дополнительно исследовали под микроскопом для оценки жизнеспособности клеток, как представлено на ФИГ. 2A-2B. Как показано, имплантируемые элементы, содержащие активные клетки, экспрессирующие фактор VIII-BDD, демонстрируют высокий уровень жизнеспособности на протяжении всего эксперимента.
Пример 7. Оценка инкапсулированных имплантируемых элементов in vivo
Инкапсулированные имплантируемые элементы, содержащие сконструированные активные клетки (например, сконструированные клетки RPE), оценивали у мышей в соответствии с процедурой, приведенной ниже.
Подготовка. Мышей готовили к операции, проводя анестезию в виде непрерывного потока 1-4% изофлурана с кислородом при 0,5 л/мин. Перед операцией всем мышам подкожно вводили дозу бупренорфина из расчета 0,05-0,1 мг/кг веса тела в качестве предоперационного анальгетика, а также 0,5 мл 0,9% солевого раствора подкожно для предотвращения дегидратации. Машинку для стрижки с лезвием №40 применяли для удаления волос, чтобы обнажить область приблизительно 2 см × 2 см на вентральной средней линии брюха животного. Всю выбритую область готовили асептически с помощью минимум 3 циклов очистки повидином (по возможности в направлении наружу к краям от центра места разреза) с последующим ополаскиванием с помощью 70% спирта. Повидин также применяли в качестве финальной обработки кожи. После дезинфекции верхней поверхности стола 70% этанолом операционное поле обкладывали стерильной одноразовой бумагой, чтобы исключить контакт окружающей шерсти с операционным полем. Бригада использовала надлежащие PPE, защитную одежду и хирургические перчатки.
Хирургическая процедура. Острое хирургическое лезвие или ножницы применяли для того, чтобы выполнить 0,5-0,75 см срединный разрез через кожу и белую линию для доступа в брюшную полость подопытных мышей. Хирург пытался максимально уменьшить размер разреза, при этом наибольший возможный размер разреза составлял 0,75 см. Стерильную пластиковую пипетку применяли для переноса альгинатных микрокапсул (с клетками или без них) в брюшную полость. Мышцы живота закрывали путем наложения швов с помощью черного шелка Ethicon 5-0 или монофиламентной рассасывающейся нити 5,0-6,0 из рассасывающегося PDS, а наружный слой кожи закрывали с применением скоб для ран. Эти скобы для ран удаляли через 7-10 дней после операции, когда подтверждалось полное заживление. Остатки крови и тканей удаляли с хирургических инструментов между процедурами и инструменты также повторно стерилизовали в интервале между животными с применением шарикового стерилизатора. После операции животных помещали обратно в клетку на грелку или под нагревательную лампу и контролировали, пока они не выходили из наркоза.
Интраоперационный уход. Животных содержали в тепле с применением изотермической подушки Deltaphase. Глаза животных увлажняли стерильной глазной мазью во время периода операции. Принимали меры для предотвращения смачивания операционного поля, чтобы избежать гипотермии. Постоянно контролировали частоту и характеристики дыхания. Если показатели жизненно важных функций указывали на сильную боль и дистресс, животное подвергали эвтаназии посредством цервикальной дислокации.
В требуемый момент времени после операции животное подвергали эвтаназии путем асфиксии с помощью CO2 и альгинатные капсулы собирали путем перитонеального смыва.
Иллюстративные линии мышей, применяемые в этих экспериментах, включают AKXL37/TyJ; линию B6.129P2-F9tm1Dws/J с дефицитом фактора IX; линию с дефицитом фактора VIII, описанную в Bi, L et al (1995) Nature 10:119-121); линию B6;129-Glatm1Kul/J с дефицитом альфа-галактозидазы, описанную в Ohshima, T et al. (1997) Proc Nat'l Sci USA 94:2540-2544); и линию с дефицитом фактора IX, описанную в Lin, H-F et al. (2017) Blood 90: 3962-3966.
Пример 8. Сравнение конфигурации сконструированных активных клеток при инкапсуляции
Исследование со сравнением инкапсуляции в альгинатные гидрогелевые капсулы отдельных сконструированных активных клеток (например, отдельных клеток RPE или отдельных производных клеток RPE), кластеров сконструированных активных клеток (например, кластеров сконструированных клеток RPE или кластеров производных клеток RPE) и сконструированных активных клеток, связанных с микроносителем (например, сконструированных клеток RPE, связанных с микроносителем), проводили для оценки продуцирования терапевтического средства (например, белка) и жизнеспособности клеток. Для каждой конфигурации определяли максимальную загрузку клеток и проводили сравнения разных конфигураций при одинаковой загрузке клеток и при максимальной загрузке клеток для каждой конфигурации. Загрузку клеток, жизнеспособность, строение и секрецию белков оценивали in vitro и in vivo. Для in vivo фармакокинетического анализа капсулы имплантировали IP в мышей в соответствии с протоколом, кратко изложенным в примере 7, и в указанные моменты времени содержание белка в крови выявляли с помощью ELISA, и капсулы эксплантировали для определения жизнеспособности клеток.
Когда вышеуказанное исследование проводили с применением клеток ARPE-19, сконструированных для экспрессии белка FVIII-BDD и инкапсулированных в 1,5 мм гидрогелевые капсулы, как описано в примере 5, уровни экспрессии FVIII-BDD и жизнеспособность клеток были практически одинаковыми независимо от того, были ли клетки инкапсулированы в виде отдельных клеток, кластеров клеток или клеток, связанных с микроносителем (данные не показаны).
Пример 9. Сравнение конфигурации несконструированных активных клеток при инкапсуляции
Эффект клеточной конфигурации на плотность упаковки клеток, жизнеспособность клеток и качество капсул исследовали с применением альгинатных гидрогелевых капсул (1,5 мм), в которые инкапсулировали клетки ARPE-19 дикого типа (т. е. несконструированные) в одной из следующих конфигураций: отдельные клетки, сфероидные кластеры, клетки на микроносителях Cytodex® 1 (Sigma-Aldrich, C0646), клетки на микроносителях Cultispher®-S (Sigma-Aldrich, M9043).
Гидрогелевые капсулы формовали из раствора альгината (смесь модифицированного альгината и немодифицированного альгината), как описано в примере 5, за исключением того, что раствор альгината готовили путем смешивания в объемном соотношении 70% TMTD-альгината и 30% SLG100, а затем суспендирования в растворе альгината одной из конфигураций ARPE-19 при различных концентрациях. Композиции на основе гидрогелевых капсул получали из следующих суспензий: (1) суспензий отдельных клеток, содержащих 10, 15, 20, 30, 40 или 50 миллионов клеток/мл раствора альгината (М/мл); суспензий сфероидов, содержащих 30, 40, 50, 75 и 100 миллионов клеток/мл раствора альгината (М/мл); суспензий микроносителя Cytodex при объемном отношении 1:8, 1:4, 1:2, 1:1,5, 1:1 и 1:0,5 (миллилитров осажденных микроносителей:миллилитров раствора альгината); суспензий микроносителя CultiSpher при объемном отношении 1:14, 1:10, 1:8, 1:6, 1:4 и 1:2 (мл осажденных микроносителей:мл раствора альгината).
Аликвоту каждой из композиций на основе гидрогелевых капсул помещали в луночный планшет и луночный планшет хранили в инкубаторе при 37°C в течение нескольких часов, а затем оценивали жизнеспособность инкапсулированных клеток путем окрашивания живых/мертвых клеток (Thermo Fisher Scientific, №L3224) с последующей визуализацией окрашенных клеток посредством флуоресцентной микроскопии при увеличении 4x: жизнеспособные клетки окрашивались в зеленый цвет, а мертвые клетки окрашивались в красный цвет. Качество капсул определяли путем исследования аликвоты из по меньшей мере 100 капсул и расчета процентной доли сферических капсул в аликвоте. Количество жизнеспособных клеток на капсулу определяли посредством анализа CellTiter-Glo® 2.0 (Promega, G9242). Результаты этих оценок представлены на фигуре 5 (отдельные клетки), фигуре 6 (сфероиды), фигуре 7 (микроносители Cytodex) и фигуре 8 (микроносители Cultispher).
Как представлено на ФИГ. 5A, сферические капсулы, содержащие жизнеспособные клетки, формировались при всех значениях концентрации суспензий отдельных клеток. Однако по мере увеличения концентрации инкапсулированных клеток общее качество препарата в виде капсул уменьшалось от почти 100% сферических капсул в случае 10 М/мл до менее 90% сферических капсул в случае 50 М/мл (ФИГ. 5B). Количество жизнеспособных клеток на капсулу увеличивалось с увеличением загрузки клеток в растворе альгината; однако это сочеталось со снижением качества капсул (ФИГ. 5C).
Если гидрогелевые капсулы получали с применением суспензий сфероидных кластеров, то сферические капсулы, содержащие жизнеспособные клетки, формировались при всех значениях концентрации клеток, как представлено на ФИГ. 6A. Однако по мере увеличения концентрации инкапсулированных клеток общее качество препарата в виде капсул уменьшалось от 97% сферических капсул в случае 30 М/мл до примерно 93% сферических капсул в случае 100 М/мл (ФИГ. 6B). Число жизнеспособных клеток на капсулу увеличивалось с увеличением загрузки клеток в растворе альгината; однако наибольшее число жизнеспособных клеток наблюдали при промежуточной концентрации клеток 50 М/мл, при которой также получали >98% сферических капсул. Качество капсул не коррелировало напрямую с числом клеток (ФИГ. 6C).
Сферические капсулы, содержащие жизнеспособные клетки, также формировались при каждом из тестируемых значений концентрации микроносителя, как представлено на ФИГ. 7A и ФИГ. 8A.
Однако, как представлено на ФИГ. 7B, общее качество капсул в препарате снижалось с увеличением концентрации микроносителей Cytodex, т. е. общее качество партии капсул снижалось от примерно 98% сферических капсул при наиболее низкой концентрации суспензии (1:8) до всего лишь 70% сферических капсул при наивысшей концентрации суспензии 1:0,5 (ФИГ. 7B). Хотя число жизнеспособных клеток на капсулу увеличивалось с увеличением концентрации микроносителя в суспензии альгината, это сочеталось со снижением качества капсул (ФИГ. 7C).
Напротив, для препаратов в виде капсул, изготовленных из суспензий микроносителя Cultispher, общее качество капсул оставалось относительно постоянным по мере увеличения концентрации микроносителей, находясь в диапазоне 91-97% без явной тенденции, зависящей от концентрации клеток (ФИГ. 8B). Число жизнеспособных клеток на капсулу увеличивалось с увеличением загрузки микроносителя в растворе альгината (ФИГ. 8C).
Пример 10. Клетки ARPE-19 проявляют контактное ингибирование in vitro.
Клетки ARPE-19 высевали в 96-луночные планшеты из расчета 1000 и 40000 клеток/лунку. Гидрогелевые милликапсулы, инкапсулирующие кластеры ARPE19 wt, получали, как описано в примерах 2A и 5. В случае высеянных клеток в 1 и 7 дни после посева клетки инкубировали с 10 мкМ 5-этинил-2'-дезоксиуридина (EdU) в течение 72 часов в свежей среде. В дни 1, 7, 21 и 28 после инкапсуляции инкапсулированные кластеры инкубировали с 10 мкМ EdU в течение 72 часов в свежей среде. Через каждые 72 часа инкубации клетки фиксировали в 4% параформальдегиде. Образцы высеянных клеток и капсул окрашивали для выявления включения EdU, чтобы идентифицировать клетки, реплицирующие ДНК в течение 72-часового периода инкубации, посредством окрашивания с помощью набора Click-iT EdU (Thermo Fisher, C10337), а все ядра окрашивали с помощью красителя для нуклеиновой кислоты DAPI. Образцы визуализировали с помощью флуоресцентной микроскопии.
Клетки, которые высевали при малой плотности (1000 клеток/лунка) или большой плотности (40000 клеток/лунка), имели много EdU-положительных клеток в день 1 после высевания; однако в день 7 большее число клеток были EdU-положительными и было больше пролиферирующих клеток в лунках, изначально засеянных из расчета 1000 клеток, по сравнению с теми, которые засевали из расчета 40000 клеток (данные не показаны). Это демонстрирует, что клетки ARPE-19 останавливают пролиферацию (например, проявляют контактное ингибирование), по мере увеличения их плотности in vitro. В день 1 после инкапсуляции пролиферация клеток в инкапсулированных кластерах была меньшей, чем у высеянных клеток; в день 7 и позже пролиферирующих клеток не наблюдали (данные не показаны). Таким образом, в инкапсулированных кластерах клеток ARPE-19 проявлялось контактное ингибирование in vitro.
Пример 11. Сравнение действия различных промоторов на продуцирования гетерологичного белка в сконструированных клетках RPE.
Векторы экспрессии создавали на основе транспозона PiggyBac, при этом они содержали один из нескольких тестируемых промоторов, функционально связанных с кодирующей последовательностью фактора IX. Линии клеток ARPE-19 и HS27 выращивали при 5% CO2 и 37°C, трансфицировали с помощью 2,5 мкг каждой конструкции для экспрессии ДНК на основе транспозона PiggyBac+0,5 мкг Cherry-CAG-HyPBase с помощью способа с применением липофектамина. Для создания стабильных популяций клеток клетки ARPE-19 отбирали с помощью пуромицина. Клетки хранили и размножали в течение приблизительно 3 недель и на протяжении данного периода времени через каждые три дня добавляли свежую среду со средством для отбора. Чтобы оценить специфическую для клеток продуктивность выбранных клонов, 500000 клеток высевали в двух повторностях в 6-луночный планшет. Через 4 часа среду меняли и заменяли свежей средой. Через 24 часа собирали супернатантную среду и оценивали плотность жизнеспособных клеток. Специфическую для клеток продуктивность (пг/клетка/день) определяли путем построения зависимости концентрации FIX (определенной с применением ELISA в отношении hFIX) от числа жизнеспособных клеток.
Как представлено на ФИГ. 9, клетки ARP-19, сконструированные с различными промоторами, продуцировали разные уровни продукта экспрессии FIX. Клетки, трансфицированные с помощью вектора экспрессии, содержащего промотор CAG, функционально связанный с FIX-кодирующей последовательностью, демонстрировали лучшие результаты, чем клетки, трансфицированные с помощью того же вектора экспрессии, но с промотором CMV или Ubc, функционально связанным с FIX-кодирующей последовательностью. Неожиданным образом экспрессия FIX под контролем промотора CAG в клетках ARPE-19 происходила на более высоком уровне, чем в клеточной линии фибробластов HS27. Осуществляли мониторинг долгосрочной in vitro экспрессии FIX в клетках ARPE-19 с конструкцией CAG-FIX (1 месяц), и продуктивность линии клеток оставалась неизменной в отсутствие пуромицина (данные не показаны), что указывает на то, что экспрессия FIX в сконструированных клетках ARPE-19 является стабильной.
Пример 11. Иллюстративный вектор экспрессии для конструирования клеток RPE
Клетки RPE, например, клетки ARPE-19, могут быть сконструированы для экспрессии экзогенного полипептида с применением системы транспозона PiggyBac, которая предусматривает совместную трансфекцию клеток RPE с помощью двух плазмид: (1) транспозонного вектора, содержащего транскрипционную единицу, способную экспрессировать представляющий интерес полипептид, встроенный между элементами инвертированных концевых повторов (ITR), распознаваемых транспозазой PiggyBac, и (2) плазмиды, которая экспрессирует фермент транспозазу PiggyBac. Система PiggyBac опосредует перенос генов посредством механизма "вырезать и вставить", за счет чего транспозаза интегрирует транскрипционную единицу и ITR в хромосомные сайты TTAA клеток RPE. В качестве альтернативы клетки RPE можно сконструированы так, чтобы они экспрессировали представляющий интерес полипептид с внехромосомного вектора путем трансфекции клеток с помощью только транспозонного вектора.
Иллюстративный транспозонный вектор для конструирования клеток RPE представлен на ФИГ. 10 (SEQ ID NO:26) и имеет векторные элементы, описанные в таблице векторов ниже. Перед трансфекцией клеток RPE транскрипционную единицу, подлежащую интеграции в хромосомные сайты RPE, создают путем встраивания представляющей интерес кодирующей последовательности непосредственно после последовательности Козак и в функциональной связи с промотором pCAG.
Иллюстративные компоненты транспозонного вектора
мРНК, транскрибируемой за счет РНК-полимеразы Pol II.
PiggyBacTM
pUC
Пример 12. Оптимизация кодонов усиливает экспрессию FVIII в сконструированных клетках RPE.
Кодон-оптимизированные (CO) последовательности, кодирующие рекомбинантную аминокислотную последовательность FVIII-BDD человека, представленную на ФИГ. 1 (SEQ ID NO:1), получали с применением коммерчески доступного алгоритма. Последовательность дикого типа (например, неоптимизированную) (SEQ ID NO:8), кодирующую такой же полипептид FVIII-BDD, применяли в качестве контроля (нативная). Каждую из CO- и нативной последовательности встраивали в транспозонный вектор экспрессии из ФИГ. 10, при этом сайт встраивания находился непосредственно после последовательности Козак. Клетки ARPE-19 совместно трансфицировали с помощью вектора, несущего транспозазу PiggyBac, и транспозонного вектора с нативной последовательностью или транспозонного вектора с CO-последовательностью и продуцирование белка (пг/клетка/день) в полученных сконструированных клетках оценивали с помощью ELISA. На ФИГ. 11 показано кратное увеличение продуцирования FVIII-BDD за счет 3 наиболее эффективных конструкций с CO-последовательностью относительно продуцирования FVIII-BDD в клетках, сконструированных с помощью кодирующей последовательности дикого типа.
Чтобы оценить эффект применения кодон-оптимизированной последовательности у других вариантов белка FVIII-BDD, последовательность rhFVIII-BDD CO6 (SEQ ID NO:15) модифицировали (путем замен или добавлений нуклеотидов, в зависимости от случая) с получением кодон-оптимизированной последовательности, кодирующей вариант rhScFVIII-BDD 2 (rhScFVIII-BDD CO, SEQ ID NO:16) или одноцепочечный вариант BDD-белка с возвратной мутацией (rhScFVIII-BDD CO с возвратной мутацией; SEQ ID NO:17). Контрольные кодирующие последовательности представляли собой кодирующие последовательности дикого типа (например, неоптимизированные), которые кодируют исходный вариант полипептида FVIII-BDD (SEQ ID NO:1) (нативный), четыре различных варианта одноцепочечных BDD (SEQ ID NO: 3-6) и вариант FVIII с возвратной мутацией (SEQ ID NO:7). Каждый CO-вариант и контрольную кодирующую последовательность встраивали в транспозонный вектор экспрессии из ФИГ. 10, при этом сайт встраивания находился непосредственно после последовательности Козак. Клетки ARPE-19 совместно трансфицировали с помощью вектора, содержащего транспозазу PiggyBac, и транспозонного вектора. Продуцирование белка FVIII (пг/клетка/день) в полученных сконструированных клетках оценивали с помощью ELISA. На ФИГ. 12 показано изменение продуцирования одноцепочечных вариантов BDD и вариантов FVIII-BDD с возвратной мутацией по сравнению с продуцированием rhFVIII-BDD (SEQ ID NO:1).
Пример 13. Оптимизация кодонов усиливает экспрессию FIX в сконструированных клетках RPE.
Кодон-оптимизированные (CO) последовательности (SEQ ID NO: 19-21), кодирующие рекомбинантный вариантный полипептид FIX-Padua человека (SEQ ID NO:2), получали с применением коммерчески доступного алгоритма. Последовательность дикого типа (например, неоптимизированную) (SEQ ID NO:18), кодирующую такой же полипептид FIX-Padua, применяли в качестве контроля (нативная). Каждую из CO- и нативной последовательности встраивали в транспозонный вектор экспрессии из ФИГ. 10, при этом сайт встраивания находился непосредственно после последовательности Козак. Клетки ARPE-19 совместно трансфицировали с помощью вектора, содержащего транспозазу PiggyBac, и транспозонного вектора. Продуцирование белка FIX (пг/клетка/день) в полученных сконструированных клетках оценивали с помощью ELISA. На ФИГ. 13 показано продуцирование FIX-Padua в клетках, сконструированных с помощью CO-последовательности, по сравнению с продуцированием в клетках, сконструированных с кодирующей последовательностью (нативной) дикого типа (например, неоптимизированной).
Пример 14. Трансфекция клеток RPE с несколькими транскрипционными единицами FIX увеличивает экспрессию FIX в сконструированных клетках RPE.
Клетки RPE сконструировали для экспрессии FIX-Padua (SEQ ID NO:2) посредством совместной трансфекции клеток с помощью вектора, содержащего транспозазу PiggyBac, и транспозонного вектора экспрессии (ФИГ. 10), содержащего кодирующую последовательность дикого типа (нативную), транспозонного вектора экспрессии (ФИГ. 10) с кодон-оптимизированной последовательностью (SEQ ID NO:19) или такого же транспозонного вектора экспрессии, за исключением дупликации кодон-оптимизированной транскрипционной единицы, т. е. промотора pCAG, последовательности Козак, SEQ ID NO:19 и последовательности rBG pA. Продуцирование белка FIX (пг/клетка/день) в полученных сконструированных клетках оценивали с помощью ELISA и результаты представлены на ФИГ. 14.
Эквиваленты и объем изобретения
Данная заявка обращается к различным выданным патентам, опубликованным заявкам на патенты, журнальным статьям и другим публикациям, все из которых включены в данный документ посредством ссылки. Если существует противоречие между любой из включенных ссылок и описанием настоящего изобретения, необходимо руководствоваться описанием изобретения. Кроме того, любой конкретный вариант осуществления настоящего изобретения, который относится к предшествующему уровню техники, может быть в явной форме исключен из любого одного или более пунктов формулы изобретения. Поскольку считается, что такие варианты осуществления известны специалисту в данной области техники, они могут быть исключены, даже если исключение не изложено в явной форме в данном документе. Любой конкретный вариант осуществления настоящего изобретения может быть исключен из любого пункта формулы изобретения по какой-либо причине, не зависимо от того, относится ли он к существующему предшествующему уровню техники или нет.
Специалисты в данной области техники распознают или смогут установить, применяя всего лишь обычные эксперименты, многие эквиваленты конкретных вариантов осуществления, описанных в данном документе. Предусматривается, что объем вариантов осуществления настоящего изобретения, описанных в данном документе, не ограничивается приведенным выше описанием, фигурами или примерами, а изложен в прилагаемой формуле изобретения. Специалисты в данной области техники будут понимать, что различные изменения и модификации данного описания могут быть выполнены без отступления от сущности или объема настоящего раскрытия, определяемого в следующей формуле изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> SIGILON THERAPEUTICS, INC.
<120> СПОСОБЫ, КОМПОЗИЦИИ И ИМПЛАНТИРУЕМЫЕ ЭЛЕМЕНТЫ, СОДЕРЖАЩИЕ
АКТИВНЫЕ КЛЕТКИ
<130> S2225-7015WO
<140>
<141>
<150> 62/652,882
<151> 2018-04-04
<150> 62/652,881
<151> 2018-04-04
<150> 62/563,877
<151> 2017-09-27
<160> 36
<170> PatentIn версия 3.5
<210> 1
<211> 1457
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический
полипептид"
<220>
<221> Сайт
<222> (1)..(19)
<223> /примечание="Сигнальная последовательность"
<400> 1
Met Gln Ile Glu Leu Ser Thr Cys Phe Phe Leu Cys Leu Leu Arg Phe
1. 5 10 15
Cys Phe Ser Ala Thr Arg Arg Tyr Tyr Leu Gly Ala Val Glu Leu Ser
20 25 30
Trp Asp Tyr Met Gln Ser Asp Leu Gly Glu Leu Pro Val Asp Ala Arg
35 40 45
Phe Pro Pro Arg Val Pro Lys Ser Phe Pro Phe Asn Thr Ser Val Val
50 55 60
Tyr Lys Lys Thr Leu Phe Val Glu Phe Thr Asp His Leu Phe Asn Ile
65 70 75 80
Ala Lys Pro Arg Pro Pro Trp Met Gly Leu Leu Gly Pro Thr Ile Gln
85 90 95
Ala Glu Val Tyr Asp Thr Val Val Ile Thr Leu Lys Asn Met Ala Ser
100 105 110
His Pro Val Ser Leu His Ala Val Gly Val Ser Tyr Trp Lys Ala Ser
115 120 125
Glu Gly Ala Glu Tyr Asp Asp Gln Thr Ser Gln Arg Glu Lys Glu Asp
130 135 140
Asp Lys Val Phe Pro Gly Gly Ser His Thr Tyr Val Trp Gln Val Leu
145 150 155 160
Lys Glu Asn Gly Pro Met Ala Ser Asp Pro Leu Cys Leu Thr Tyr Ser
165 170 175
Tyr Leu Ser His Val Asp Leu Val Lys Asp Leu Asn Ser Gly Leu Ile
180 185 190
Gly Ala Leu Leu Val Cys Arg Glu Gly Ser Leu Ala Lys Glu Lys Thr
195 200 205
Gln Thr Leu His Lys Phe Ile Leu Leu Phe Ala Val Phe Asp Glu Gly
210 215 220
Lys Ser Trp His Ser Glu Thr Lys Asn Ser Leu Met Gln Asp Arg Asp
225 230 235 240
Ala Ala Ser Ala Arg Ala Trp Pro Lys Met His Thr Val Asn Gly Tyr
245 250 255
Val Asn Arg Ser Leu Pro Gly Leu Ile Gly Cys His Arg Lys Ser Val
260 265 270
Tyr Trp His Val Ile Gly Met Gly Thr Thr Pro Glu Val His Ser Ile
275 280 285
Phe Leu Glu Gly His Thr Phe Leu Val Arg Asn His Arg Gln Ala Ser
290 295 300
Leu Glu Ile Ser Pro Ile Thr Phe Leu Thr Ala Gln Thr Leu Leu Met
305 310 315 320
Asp Leu Gly Gln Phe Leu Leu Phe Cys His Ile Ser Ser His Gln His
325 330 335
Asp Gly Met Glu Ala Tyr Val Lys Val Asp Ser Cys Pro Glu Glu Pro
340 345 350
Gln Leu Arg Met Lys Asn Asn Glu Glu Ala Glu Asp Tyr Asp Asp Asp
355 360 365
Leu Thr Asp Ser Glu Met Asp Val Val Arg Phe Asp Asp Asp Asn Ser
370 375 380
Pro Ser Phe Ile Gln Ile Arg Ser Val Ala Lys Lys His Pro Lys Thr
385 390 395 400
Trp Val His Tyr Ile Ala Ala Glu Glu Glu Asp Trp Asp Tyr Ala Pro
405 410 415
Leu Val Leu Ala Pro Asp Asp Arg Ser Tyr Lys Ser Gln Tyr Leu Asn
420 425 430
Asn Gly Pro Gln Arg Ile Gly Arg Lys Tyr Lys Lys Val Arg Phe Met
435 440 445
Ala Tyr Thr Asp Glu Thr Phe Lys Thr Arg Glu Ala Ile Gln His Glu
450 455 460
Ser Gly Ile Leu Gly Pro Leu Leu Tyr Gly Glu Val Gly Asp Thr Leu
465 470 475 480
Leu Ile Ile Phe Lys Asn Gln Ala Ser Arg Pro Tyr Asn Ile Tyr Pro
485 490 495
His Gly Ile Thr Asp Val Arg Pro Leu Tyr Ser Arg Arg Leu Pro Lys
500 505 510
Gly Val Lys His Leu Lys Asp Phe Pro Ile Leu Pro Gly Glu Ile Phe
515 520 525
Lys Tyr Lys Trp Thr Val Thr Val Glu Asp Gly Pro Thr Lys Ser Asp
530 535 540
Pro Arg Cys Leu Thr Arg Tyr Tyr Ser Ser Phe Val Asn Met Glu Arg
545 550 555 560
Asp Leu Ala Ser Gly Leu Ile Gly Pro Leu Leu Ile Cys Tyr Lys Glu
565 570 575
Ser Val Asp Gln Arg Gly Asn Gln Ile Met Ser Asp Lys Arg Asn Val
580 585 590
Ile Leu Phe Ser Val Phe Asp Glu Asn Arg Ser Trp Tyr Leu Thr Glu
595 600 605
Asn Ile Gln Arg Phe Leu Pro Asn Pro Ala Gly Val Gln Leu Glu Asp
610 615 620
Pro Glu Phe Gln Ala Ser Asn Ile Met His Ser Ile Asn Gly Tyr Val
625 630 635 640
Phe Asp Ser Leu Gln Leu Ser Val Cys Leu His Glu Val Ala Tyr Trp
645 650 655
Tyr Ile Leu Ser Ile Gly Ala Gln Thr Asp Phe Leu Ser Val Phe Phe
660 665 670
Ser Gly Tyr Thr Phe Lys His Lys Met Val Tyr Glu Asp Thr Leu Thr
675 680 685
Leu Phe Pro Phe Ser Gly Glu Thr Val Phe Met Ser Met Glu Asn Pro
690 695 700
Gly Leu Trp Ile Leu Gly Cys His Asn Ser Asp Phe Arg Asn Arg Gly
705 710 715 720
Met Thr Ala Leu Leu Lys Val Ser Ser Cys Asp Lys Asn Thr Gly Asp
725 730 735
Tyr Tyr Glu Asp Ser Tyr Glu Asp Ile Ser Ala Tyr Leu Leu Ser Lys
740 745 750
Asn Asn Ala Ile Glu Pro Arg Ser Phe Ser Gln Asn Pro Pro Val Leu
755 760 765
Lys Arg His Gln Arg Glu Ile Thr Arg Thr Thr Leu Gln Ser Asp Gln
770 775 780
Glu Glu Ile Asp Tyr Asp Asp Thr Ile Ser Val Glu Met Lys Lys Glu
785 790 795 800
Asp Phe Asp Ile Tyr Asp Glu Asp Glu Asn Gln Ser Pro Arg Ser Phe
805 810 815
Gln Lys Lys Thr Arg His Tyr Phe Ile Ala Ala Val Glu Arg Leu Trp
820 825 830
Asp Tyr Gly Met Ser Ser Ser Pro His Val Leu Arg Asn Arg Ala Gln
835 840 845
Ser Gly Ser Val Pro Gln Phe Lys Lys Val Val Phe Gln Glu Phe Thr
850 855 860
Asp Gly Ser Phe Thr Gln Pro Leu Tyr Arg Gly Glu Leu Asn Glu His
865 870 875 880
Leu Gly Leu Leu Gly Pro Tyr Ile Arg Ala Glu Val Glu Asp Asn Ile
885 890 895
Met Val Thr Phe Arg Asn Gln Ala Ser Arg Pro Tyr Ser Phe Tyr Ser
900 905 910
Ser Leu Ile Ser Tyr Glu Glu Asp Gln Arg Gln Gly Ala Glu Pro Arg
915 920 925
Lys Asn Phe Val Lys Pro Asn Glu Thr Lys Thr Tyr Phe Trp Lys Val
930 935 940
Gln His His Met Ala Pro Thr Lys Asp Glu Phe Asp Cys Lys Ala Trp
945 950 955 960
Ala Tyr Phe Ser Asp Val Asp Leu Glu Lys Asp Val His Ser Gly Leu
965 970 975
Ile Gly Pro Leu Leu Val Cys His Thr Asn Thr Leu Asn Pro Ala His
980 985 990
Gly Arg Gln Val Thr Val Gln Glu Phe Ala Leu Phe Phe Thr Ile Phe
995 1000 1005
Asp Glu Thr Lys Ser Trp Tyr Phe Thr Glu Asn Met Glu Arg Asn
1010 1015 1020
Cys Arg Ala Pro Cys Asn Ile Gln Met Glu Asp Pro Thr Phe Lys
1025 1030 1035
Glu Asn Tyr Arg Phe His Ala Ile Asn Gly Tyr Ile Met Asp Thr
1040 1045 1050
Leu Pro Gly Leu Val Met Ala Gln Asp Gln Arg Ile Arg Trp Tyr
1055 1060 1065
Leu Leu Ser Met Gly Ser Asn Glu Asn Ile His Ser Ile His Phe
1070 1075 1080
Ser Gly His Val Phe Thr Val Arg Lys Lys Glu Glu Tyr Lys Met
1085 1090 1095
Ala Leu Tyr Asn Leu Tyr Pro Gly Val Phe Glu Thr Val Glu Met
1100 1105 1110
Leu Pro Ser Lys Ala Gly Ile Trp Arg Val Glu Cys Leu Ile Gly
1115 1120 1125
Glu His Leu His Ala Gly Met Ser Thr Leu Phe Leu Val Tyr Ser
1130 1135 1140
Asn Lys Cys Gln Thr Pro Leu Gly Met Ala Ser Gly His Ile Arg
1145 1150 1155
Asp Phe Gln Ile Thr Ala Ser Gly Gln Tyr Gly Gln Trp Ala Pro
1160 1165 1170
Lys Leu Ala Arg Leu His Tyr Ser Gly Ser Ile Asn Ala Trp Ser
1175 1180 1185
Thr Lys Glu Pro Phe Ser Trp Ile Lys Val Asp Leu Leu Ala Pro
1190 1195 1200
Met Ile Ile His Gly Ile Lys Thr Gln Gly Ala Arg Gln Lys Phe
1205 1210 1215
Ser Ser Leu Tyr Ile Ser Gln Phe Ile Ile Met Tyr Ser Leu Asp
1220 1225 1230
Gly Lys Lys Trp Gln Thr Tyr Arg Gly Asn Ser Thr Gly Thr Leu
1235 1240 1245
Met Val Phe Phe Gly Asn Val Asp Ser Ser Gly Ile Lys His Asn
1250 1255 1260
Ile Phe Asn Pro Pro Ile Ile Ala Arg Tyr Ile Arg Leu His Pro
1265 1270 1275
Thr His Tyr Ser Ile Arg Ser Thr Leu Arg Met Glu Leu Met Gly
1280 1285 1290
Cys Asp Leu Asn Ser Cys Ser Met Pro Leu Gly Met Glu Ser Lys
1295 1300 1305
Ala Ile Ser Asp Ala Gln Ile Thr Ala Ser Ser Tyr Phe Thr Asn
1310 1315 1320
Met Phe Ala Thr Trp Ser Pro Ser Lys Ala Arg Leu His Leu Gln
1325 1330 1335
Gly Arg Ser Asn Ala Trp Arg Pro Gln Val Asn Asn Pro Lys Glu
1340 1345 1350
Trp Leu Gln Val Asp Phe Gln Lys Thr Met Lys Val Thr Gly Val
1355 1360 1365
Thr Thr Gln Gly Val Lys Ser Leu Leu Thr Ser Met Tyr Val Lys
1370 1375 1380
Glu Phe Leu Ile Ser Ser Ser Gln Asp Gly His Gln Trp Thr Leu
1385 1390 1395
Phe Phe Gln Asn Gly Lys Val Lys Val Phe Gln Gly Asn Gln Asp
1400 1405 1410
Ser Phe Thr Pro Val Val Asn Ser Leu Asp Pro Pro Leu Leu Thr
1415 1420 1425
Arg Tyr Leu Arg Ile His Pro Gln Ser Trp Val His Gln Ile Ala
1430 1435 1440
Leu Arg Met Glu Val Leu Gly Cys Glu Ala Gln Asp Leu Tyr
1445 1450 1455
<210> 2
<211> 461
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> Сайт
<222> (1)..(28)
<223> /примечание="Сигнальная последовательность"
<400> 2
Met Gln Arg Val Asn Met Ile Met Ala Glu Ser Pro Gly Leu Ile Thr
1. 5 10 15
Ile Cys Leu Leu Gly Tyr Leu Leu Ser Ala Glu Cys Thr Val Phe Leu
20 25 30
Asp His Glu Asn Ala Asn Lys Ile Leu Asn Arg Pro Lys Arg Tyr Asn
35 40 45
Ser Gly Lys Leu Glu Glu Phe Val Gln Gly Asn Leu Glu Arg Glu Cys
50 55 60
Met Glu Glu Lys Cys Ser Phe Glu Glu Ala Arg Glu Val Phe Glu Asn
65 70 75 80
Thr Glu Arg Thr Thr Glu Phe Trp Lys Gln Tyr Val Asp Gly Asp Gln
85 90 95
Cys Glu Ser Asn Pro Cys Leu Asn Gly Gly Ser Cys Lys Asp Asp Ile
100 105 110
Asn Ser Tyr Glu Cys Trp Cys Pro Phe Gly Phe Glu Gly Lys Asn Cys
115 120 125
Glu Leu Asp Val Thr Cys Asn Ile Lys Asn Gly Arg Cys Glu Gln Phe
130 135 140
Cys Lys Asn Ser Ala Asp Asn Lys Val Val Cys Ser Cys Thr Glu Gly
145 150 155 160
Tyr Arg Leu Ala Glu Asn Gln Lys Ser Cys Glu Pro Ala Val Pro Phe
165 170 175
Pro Cys Gly Arg Val Ser Val Ser Gln Thr Ser Lys Leu Thr Arg Ala
180 185 190
Glu Thr Val Phe Pro Asp Val Asp Tyr Val Asn Ser Thr Glu Ala Glu
195 200 205
Thr Ile Leu Asp Asn Ile Thr Gln Ser Thr Gln Ser Phe Asn Asp Phe
210 215 220
Thr Arg Val Val Gly Gly Glu Asp Ala Lys Pro Gly Gln Phe Pro Trp
225 230 235 240
Gln Val Val Leu Asn Gly Lys Val Asp Ala Phe Cys Gly Gly Ser Ile
245 250 255
Val Asn Glu Lys Trp Ile Val Thr Ala Ala His Cys Val Glu Thr Gly
260 265 270
Val Lys Ile Thr Val Val Ala Gly Glu His Asn Ile Glu Glu Thr Glu
275 280 285
His Thr Glu Gln Lys Arg Asn Val Ile Arg Ile Ile Pro His His Asn
290 295 300
Tyr Asn Ala Ala Ile Asn Lys Tyr Asn His Asp Ile Ala Leu Leu Glu
305 310 315 320
Leu Asp Glu Pro Leu Val Leu Asn Ser Tyr Val Thr Pro Ile Cys Ile
325 330 335
Ala Asp Lys Glu Tyr Thr Asn Ile Phe Leu Lys Phe Gly Ser Gly Tyr
340 345 350
Val Ser Gly Trp Gly Arg Val Phe His Lys Gly Arg Ser Ala Leu Val
355 360 365
Leu Gln Tyr Leu Arg Val Pro Leu Val Asp Arg Ala Thr Cys Leu Leu
370 375 380
Ser Thr Lys Phe Thr Ile Tyr Asn Asn Met Phe Cys Ala Gly Phe His
385 390 395 400
Glu Gly Gly Arg Asp Ser Cys Gln Gly Asp Ser Gly Gly Pro His Val
405 410 415
Thr Glu Val Glu Gly Thr Ser Phe Leu Thr Gly Ile Ile Ser Trp Gly
420 425 430
Glu Glu Cys Ala Met Lys Gly Lys Tyr Gly Ile Tyr Thr Lys Val Ser
435 440 445
Arg Tyr Val Asn Trp Ile Lys Glu Lys Thr Lys Leu Thr
450 455 460
<210> 3
<211> 1457
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> Сайт
<222> (1)..(19)
<223> /примечание="Сигнальная последовательность"
<400> 3
Met Gln Ile Glu Leu Ser Thr Cys Phe Phe Leu Cys Leu Leu Arg Phe
1. 5 10 15
Cys Phe Ser Ala Thr Arg Arg Tyr Tyr Leu Gly Ala Val Glu Leu Ser
20 25 30
Trp Asp Tyr Met Gln Ser Asp Leu Gly Glu Leu Pro Val Asp Ala Arg
35 40 45
Phe Pro Pro Arg Val Pro Lys Ser Phe Pro Phe Asn Thr Ser Val Val
50 55 60
Tyr Lys Lys Thr Leu Phe Val Glu Phe Thr Asp His Leu Phe Asn Ile
65 70 75 80
Ala Lys Pro Arg Pro Pro Trp Met Gly Leu Leu Gly Pro Thr Ile Gln
85 90 95
Ala Glu Val Tyr Asp Thr Val Val Ile Thr Leu Lys Asn Met Ala Ser
100 105 110
His Pro Val Ser Leu His Ala Val Gly Val Ser Tyr Trp Lys Ala Ser
115 120 125
Glu Gly Ala Glu Tyr Asp Asp Gln Thr Ser Gln Arg Glu Lys Glu Asp
130 135 140
Asp Lys Val Phe Pro Gly Gly Ser His Thr Tyr Val Trp Gln Val Leu
145 150 155 160
Lys Glu Asn Gly Pro Met Ala Ser Asp Pro Leu Cys Leu Thr Tyr Ser
165 170 175
Tyr Leu Ser His Val Asp Leu Val Lys Asp Leu Asn Ser Gly Leu Ile
180 185 190
Gly Ala Leu Leu Val Cys Arg Glu Gly Ser Leu Ala Lys Glu Lys Thr
195 200 205
Gln Thr Leu His Lys Phe Ile Leu Leu Phe Ala Val Phe Asp Glu Gly
210 215 220
Lys Ser Trp His Ser Glu Thr Lys Asn Ser Leu Met Gln Asp Arg Asp
225 230 235 240
Ala Ala Ser Ala Arg Ala Trp Pro Lys Met His Thr Val Asn Gly Tyr
245 250 255
Val Asn Arg Ser Leu Pro Gly Leu Ile Gly Cys His Arg Lys Ser Val
260 265 270
Tyr Trp His Val Ile Gly Met Gly Thr Thr Pro Glu Val His Ser Ile
275 280 285
Phe Leu Glu Gly His Thr Phe Leu Val Arg Asn His Arg Gln Ala Ser
290 295 300
Leu Glu Ile Ser Pro Ile Thr Phe Leu Thr Ala Gln Thr Leu Leu Met
305 310 315 320
Asp Leu Gly Gln Phe Leu Leu Phe Cys His Ile Ser Ser His Gln His
325 330 335
Asp Gly Met Glu Ala Tyr Val Lys Val Asp Ser Cys Pro Glu Glu Pro
340 345 350
Gln Leu Arg Met Lys Asn Asn Glu Glu Ala Glu Asp Tyr Asp Asp Asp
355 360 365
Leu Thr Asp Ser Glu Met Asp Val Val Arg Phe Asp Asp Asp Asn Ser
370 375 380
Pro Ser Phe Ile Gln Ile Arg Ser Val Ala Lys Lys His Pro Lys Thr
385 390 395 400
Trp Val His Tyr Ile Ala Ala Glu Glu Glu Asp Trp Asp Tyr Ala Pro
405 410 415
Leu Val Leu Ala Pro Asp Asp Arg Ser Tyr Lys Ser Gln Tyr Leu Asn
420 425 430
Asn Gly Pro Gln Arg Ile Gly Arg Lys Tyr Lys Lys Val Arg Phe Met
435 440 445
Ala Tyr Thr Asp Glu Thr Phe Lys Thr Arg Glu Ala Ile Gln His Glu
450 455 460
Ser Gly Ile Leu Gly Pro Leu Leu Tyr Gly Glu Val Gly Asp Thr Leu
465 470 475 480
Leu Ile Ile Phe Lys Asn Gln Ala Ser Arg Pro Tyr Asn Ile Tyr Pro
485 490 495
His Gly Ile Thr Asp Val Arg Pro Leu Tyr Ser Arg Arg Leu Pro Lys
500 505 510
Gly Val Lys His Leu Lys Asp Phe Pro Ile Leu Pro Gly Glu Ile Phe
515 520 525
Lys Tyr Lys Trp Thr Val Thr Val Glu Asp Gly Pro Thr Lys Ser Asp
530 535 540
Pro Arg Cys Leu Thr Arg Tyr Tyr Ser Ser Phe Val Asn Met Glu Arg
545 550 555 560
Asp Leu Ala Ser Gly Leu Ile Gly Pro Leu Leu Ile Cys Tyr Lys Glu
565 570 575
Ser Val Asp Gln Arg Gly Asn Gln Ile Met Ser Asp Lys Arg Asn Val
580 585 590
Ile Leu Phe Ser Val Phe Asp Glu Asn Arg Ser Trp Tyr Leu Thr Glu
595 600 605
Asn Ile Gln Arg Phe Leu Pro Asn Pro Ala Gly Val Gln Leu Glu Asp
610 615 620
Pro Glu Phe Gln Ala Ser Asn Ile Met His Ser Ile Asn Gly Tyr Val
625 630 635 640
Phe Asp Ser Leu Gln Leu Ser Val Cys Leu His Glu Val Ala Tyr Trp
645 650 655
Tyr Ile Leu Ser Ile Gly Ala Gln Thr Asp Phe Leu Ser Val Phe Phe
660 665 670
Ser Gly Tyr Thr Phe Lys His Lys Met Val Tyr Glu Asp Thr Leu Thr
675 680 685
Leu Phe Pro Phe Ser Gly Glu Thr Val Phe Met Ser Met Glu Asn Pro
690 695 700
Gly Leu Trp Ile Leu Gly Cys His Asn Ser Asp Phe Arg Asn Arg Gly
705 710 715 720
Met Thr Ala Leu Leu Lys Val Ser Ser Cys Asp Lys Asn Thr Gly Asp
725 730 735
Tyr Tyr Glu Asp Ser Tyr Glu Asp Ile Ser Ala Tyr Leu Leu Ser Lys
740 745 750
Asn Asn Ala Ile Glu Pro Arg Ser Phe Ser Gln Asn Pro Pro Val Leu
755 760 765
Lys His His Gln Arg Glu Ile Thr Arg Thr Thr Leu Gln Ser Asp Gln
770 775 780
Glu Glu Ile Asp Tyr Asp Asp Thr Ile Ser Val Glu Met Lys Lys Glu
785 790 795 800
Asp Phe Asp Ile Tyr Asp Glu Asp Glu Asn Gln Ser Pro Arg Ser Phe
805 810 815
Gln Lys Lys Thr Arg His Tyr Phe Ile Ala Ala Val Glu Arg Leu Trp
820 825 830
Asp Tyr Gly Met Ser Ser Ser Pro His Val Leu Arg Asn Arg Ala Gln
835 840 845
Ser Gly Ser Val Pro Gln Phe Lys Lys Val Val Phe Gln Glu Phe Thr
850 855 860
Asp Gly Ser Phe Thr Gln Pro Leu Tyr Arg Gly Glu Leu Asn Glu His
865 870 875 880
Leu Gly Leu Leu Gly Pro Tyr Ile Arg Ala Glu Val Glu Asp Asn Ile
885 890 895
Met Val Thr Phe Arg Asn Gln Ala Ser Arg Pro Tyr Ser Phe Tyr Ser
900 905 910
Ser Leu Ile Ser Tyr Glu Glu Asp Gln Arg Gln Gly Ala Glu Pro Arg
915 920 925
Lys Asn Phe Val Lys Pro Asn Glu Thr Lys Thr Tyr Phe Trp Lys Val
930 935 940
Gln His His Met Ala Pro Thr Lys Asp Glu Phe Asp Cys Lys Ala Trp
945 950 955 960
Ala Tyr Phe Ser Asp Val Asp Leu Glu Lys Asp Val His Ser Gly Leu
965 970 975
Ile Gly Pro Leu Leu Val Cys His Thr Asn Thr Leu Asn Pro Ala His
980 985 990
Gly Arg Gln Val Thr Val Gln Glu Phe Ala Leu Phe Phe Thr Ile Phe
995 1000 1005
Asp Glu Thr Lys Ser Trp Tyr Phe Thr Glu Asn Met Glu Arg Asn
1010 1015 1020
Cys Arg Ala Pro Cys Asn Ile Gln Met Glu Asp Pro Thr Phe Lys
1025 1030 1035
Glu Asn Tyr Arg Phe His Ala Ile Asn Gly Tyr Ile Met Asp Thr
1040 1045 1050
Leu Pro Gly Leu Val Met Ala Gln Asp Gln Arg Ile Arg Trp Tyr
1055 1060 1065
Leu Leu Ser Met Gly Ser Asn Glu Asn Ile His Ser Ile His Phe
1070 1075 1080
Ser Gly His Val Phe Thr Val Arg Lys Lys Glu Glu Tyr Lys Met
1085 1090 1095
Ala Leu Tyr Asn Leu Tyr Pro Gly Val Phe Glu Thr Val Glu Met
1100 1105 1110
Leu Pro Ser Lys Ala Gly Ile Trp Arg Val Glu Cys Leu Ile Gly
1115 1120 1125
Glu His Leu His Ala Gly Met Ser Thr Leu Phe Leu Val Tyr Ser
1130 1135 1140
Asn Lys Cys Gln Thr Pro Leu Gly Met Ala Ser Gly His Ile Arg
1145 1150 1155
Asp Phe Gln Ile Thr Ala Ser Gly Gln Tyr Gly Gln Trp Ala Pro
1160 1165 1170
Lys Leu Ala Arg Leu His Tyr Ser Gly Ser Ile Asn Ala Trp Ser
1175 1180 1185
Thr Lys Glu Pro Phe Ser Trp Ile Lys Val Asp Leu Leu Ala Pro
1190 1195 1200
Met Ile Ile His Gly Ile Lys Thr Gln Gly Ala Arg Gln Lys Phe
1205 1210 1215
Ser Ser Leu Tyr Ile Ser Gln Phe Ile Ile Met Tyr Ser Leu Asp
1220 1225 1230
Gly Lys Lys Trp Gln Thr Tyr Arg Gly Asn Ser Thr Gly Thr Leu
1235 1240 1245
Met Val Phe Phe Gly Asn Val Asp Ser Ser Gly Ile Lys His Asn
1250 1255 1260
Ile Phe Asn Pro Pro Ile Ile Ala Arg Tyr Ile Arg Leu His Pro
1265 1270 1275
Thr His Tyr Ser Ile Arg Ser Thr Leu Arg Met Glu Leu Met Gly
1280 1285 1290
Cys Asp Leu Asn Ser Cys Ser Met Pro Leu Gly Met Glu Ser Lys
1295 1300 1305
Ala Ile Ser Asp Ala Gln Ile Thr Ala Ser Ser Tyr Phe Thr Asn
1310 1315 1320
Met Phe Ala Thr Trp Ser Pro Ser Lys Ala Arg Leu His Leu Gln
1325 1330 1335
Gly Arg Ser Asn Ala Trp Arg Pro Gln Val Asn Asn Pro Lys Glu
1340 1345 1350
Trp Leu Gln Val Asp Phe Gln Lys Thr Met Lys Val Thr Gly Val
1355 1360 1365
Thr Thr Gln Gly Val Lys Ser Leu Leu Thr Ser Met Tyr Val Lys
1370 1375 1380
Glu Phe Leu Ile Ser Ser Ser Gln Asp Gly His Gln Trp Thr Leu
1385 1390 1395
Phe Phe Gln Asn Gly Lys Val Lys Val Phe Gln Gly Asn Gln Asp
1400 1405 1410
Ser Phe Thr Pro Val Val Asn Ser Leu Asp Pro Pro Leu Leu Thr
1415 1420 1425
Arg Tyr Leu Arg Ile His Pro Gln Ser Trp Val His Gln Ile Ala
1430 1435 1440
Leu Arg Met Glu Val Leu Gly Cys Glu Ala Gln Asp Leu Tyr
1445 1450 1455
<210> 4
<211> 1457
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> Сайт
<222> (1)..(19)
<223> /примечание="Сигнальная последовательность"
<400> 4
Met Gln Ile Glu Leu Ser Thr Cys Phe Phe Leu Cys Leu Leu Arg Phe
1. 5 10 15
Cys Phe Ser Ala Thr Arg Arg Tyr Tyr Leu Gly Ala Val Glu Leu Ser
20 25 30
Trp Asp Tyr Met Gln Ser Asp Leu Gly Glu Leu Pro Val Asp Ala Arg
35 40 45
Phe Pro Pro Arg Val Pro Lys Ser Phe Pro Phe Asn Thr Ser Val Val
50 55 60
Tyr Lys Lys Thr Leu Phe Val Glu Phe Thr Asp His Leu Phe Asn Ile
65 70 75 80
Ala Lys Pro Arg Pro Pro Trp Met Gly Leu Leu Gly Pro Thr Ile Gln
85 90 95
Ala Glu Val Tyr Asp Thr Val Val Ile Thr Leu Lys Asn Met Ala Ser
100 105 110
His Pro Val Ser Leu His Ala Val Gly Val Ser Tyr Trp Lys Ala Ser
115 120 125
Glu Gly Ala Glu Tyr Asp Asp Gln Thr Ser Gln Arg Glu Lys Glu Asp
130 135 140
Asp Lys Val Phe Pro Gly Gly Ser His Thr Tyr Val Trp Gln Val Leu
145 150 155 160
Lys Glu Asn Gly Pro Met Ala Ser Asp Pro Leu Cys Leu Thr Tyr Ser
165 170 175
Tyr Leu Ser His Val Asp Leu Val Lys Asp Leu Asn Ser Gly Leu Ile
180 185 190
Gly Ala Leu Leu Val Cys Arg Glu Gly Ser Leu Ala Lys Glu Lys Thr
195 200 205
Gln Thr Leu His Lys Phe Ile Leu Leu Phe Ala Val Phe Asp Glu Gly
210 215 220
Lys Ser Trp His Ser Glu Thr Lys Asn Ser Leu Met Gln Asp Arg Asp
225 230 235 240
Ala Ala Ser Ala Arg Ala Trp Pro Lys Met His Thr Val Asn Gly Tyr
245 250 255
Val Asn Arg Ser Leu Pro Gly Leu Ile Gly Cys His Arg Lys Ser Val
260 265 270
Tyr Trp His Val Ile Gly Met Gly Thr Thr Pro Glu Val His Ser Ile
275 280 285
Phe Leu Glu Gly His Thr Phe Leu Val Arg Asn His Arg Gln Ala Ser
290 295 300
Leu Glu Ile Ser Pro Ile Thr Phe Leu Thr Ala Gln Thr Leu Leu Met
305 310 315 320
Asp Leu Gly Gln Phe Leu Leu Phe Cys His Ile Ser Ser His Gln His
325 330 335
Asp Gly Met Glu Ala Tyr Val Lys Val Asp Ser Cys Pro Glu Glu Pro
340 345 350
Gln Leu Arg Met Lys Asn Asn Glu Glu Ala Glu Asp Tyr Asp Asp Asp
355 360 365
Leu Thr Asp Ser Glu Met Asp Val Val Arg Phe Asp Asp Asp Asn Ser
370 375 380
Pro Ser Phe Ile Gln Ile Arg Ser Val Ala Lys Lys His Pro Lys Thr
385 390 395 400
Trp Val His Tyr Ile Ala Ala Glu Glu Glu Asp Trp Asp Tyr Ala Pro
405 410 415
Leu Val Leu Ala Pro Asp Asp Arg Ser Tyr Lys Ser Gln Tyr Leu Asn
420 425 430
Asn Gly Pro Gln Arg Ile Gly Arg Lys Tyr Lys Lys Val Arg Phe Met
435 440 445
Ala Tyr Thr Asp Glu Thr Phe Lys Thr Arg Glu Ala Ile Gln His Glu
450 455 460
Ser Gly Ile Leu Gly Pro Leu Leu Tyr Gly Glu Val Gly Asp Thr Leu
465 470 475 480
Leu Ile Ile Phe Lys Asn Gln Ala Ser Arg Pro Tyr Asn Ile Tyr Pro
485 490 495
His Gly Ile Thr Asp Val Arg Pro Leu Tyr Ser Arg Arg Leu Pro Lys
500 505 510
Gly Val Lys His Leu Lys Asp Phe Pro Ile Leu Pro Gly Glu Ile Phe
515 520 525
Lys Tyr Lys Trp Thr Val Thr Val Glu Asp Gly Pro Thr Lys Ser Asp
530 535 540
Pro Arg Cys Leu Thr Arg Tyr Tyr Ser Ser Phe Val Asn Met Glu Arg
545 550 555 560
Asp Leu Ala Ser Gly Leu Ile Gly Pro Leu Leu Ile Cys Tyr Lys Glu
565 570 575
Ser Val Asp Gln Arg Gly Asn Gln Ile Met Ser Asp Lys Arg Asn Val
580 585 590
Ile Leu Phe Ser Val Phe Asp Glu Asn Arg Ser Trp Tyr Leu Thr Glu
595 600 605
Asn Ile Gln Arg Phe Leu Pro Asn Pro Ala Gly Val Gln Leu Glu Asp
610 615 620
Pro Glu Phe Gln Ala Ser Asn Ile Met His Ser Ile Asn Gly Tyr Val
625 630 635 640
Phe Asp Ser Leu Gln Leu Ser Val Cys Leu His Glu Val Ala Tyr Trp
645 650 655
Tyr Ile Leu Ser Ile Gly Ala Gln Thr Asp Phe Leu Ser Val Phe Phe
660 665 670
Ser Gly Tyr Thr Phe Lys His Lys Met Val Tyr Glu Asp Thr Leu Thr
675 680 685
Leu Phe Pro Phe Ser Gly Glu Thr Val Phe Met Ser Met Glu Asn Pro
690 695 700
Gly Leu Trp Ile Leu Gly Cys His Asn Ser Asp Phe Arg Asn Arg Gly
705 710 715 720
Met Thr Ala Leu Leu Lys Val Ser Ser Cys Asp Lys Asn Thr Gly Asp
725 730 735
Tyr Tyr Glu Asp Ser Tyr Glu Asp Ile Ser Ala Tyr Leu Leu Ser Lys
740 745 750
Asn Asn Ala Ile Glu Pro Arg Ser Phe Ser Gln Asn Pro Pro Val Leu
755 760 765
Lys Ala His Gln Ala Glu Ile Thr Arg Thr Thr Leu Gln Ser Asp Gln
770 775 780
Glu Glu Ile Asp Tyr Asp Asp Thr Ile Ser Val Glu Met Lys Lys Glu
785 790 795 800
Asp Phe Asp Ile Tyr Asp Glu Asp Glu Asn Gln Ser Pro Arg Ser Phe
805 810 815
Gln Lys Lys Thr Arg His Tyr Phe Ile Ala Ala Val Glu Arg Leu Trp
820 825 830
Asp Tyr Gly Met Ser Ser Ser Pro His Val Leu Arg Asn Arg Ala Gln
835 840 845
Ser Gly Ser Val Pro Gln Phe Lys Lys Val Val Phe Gln Glu Phe Thr
850 855 860
Asp Gly Ser Phe Thr Gln Pro Leu Tyr Arg Gly Glu Leu Asn Glu His
865 870 875 880
Leu Gly Leu Leu Gly Pro Tyr Ile Arg Ala Glu Val Glu Asp Asn Ile
885 890 895
Met Val Thr Phe Arg Asn Gln Ala Ser Arg Pro Tyr Ser Phe Tyr Ser
900 905 910
Ser Leu Ile Ser Tyr Glu Glu Asp Gln Arg Gln Gly Ala Glu Pro Arg
915 920 925
Lys Asn Phe Val Lys Pro Asn Glu Thr Lys Thr Tyr Phe Trp Lys Val
930 935 940
Gln His His Met Ala Pro Thr Lys Asp Glu Phe Asp Cys Lys Ala Trp
945 950 955 960
Ala Tyr Phe Ser Asp Val Asp Leu Glu Lys Asp Val His Ser Gly Leu
965 970 975
Ile Gly Pro Leu Leu Val Cys His Thr Asn Thr Leu Asn Pro Ala His
980 985 990
Gly Arg Gln Val Thr Val Gln Glu Phe Ala Leu Phe Phe Thr Ile Phe
995 1000 1005
Asp Glu Thr Lys Ser Trp Tyr Phe Thr Glu Asn Met Glu Arg Asn
1010 1015 1020
Cys Arg Ala Pro Cys Asn Ile Gln Met Glu Asp Pro Thr Phe Lys
1025 1030 1035
Glu Asn Tyr Arg Phe His Ala Ile Asn Gly Tyr Ile Met Asp Thr
1040 1045 1050
Leu Pro Gly Leu Val Met Ala Gln Asp Gln Arg Ile Arg Trp Tyr
1055 1060 1065
Leu Leu Ser Met Gly Ser Asn Glu Asn Ile His Ser Ile His Phe
1070 1075 1080
Ser Gly His Val Phe Thr Val Arg Lys Lys Glu Glu Tyr Lys Met
1085 1090 1095
Ala Leu Tyr Asn Leu Tyr Pro Gly Val Phe Glu Thr Val Glu Met
1100 1105 1110
Leu Pro Ser Lys Ala Gly Ile Trp Arg Val Glu Cys Leu Ile Gly
1115 1120 1125
Glu His Leu His Ala Gly Met Ser Thr Leu Phe Leu Val Tyr Ser
1130 1135 1140
Asn Lys Cys Gln Thr Pro Leu Gly Met Ala Ser Gly His Ile Arg
1145 1150 1155
Asp Phe Gln Ile Thr Ala Ser Gly Gln Tyr Gly Gln Trp Ala Pro
1160 1165 1170
Lys Leu Ala Arg Leu His Tyr Ser Gly Ser Ile Asn Ala Trp Ser
1175 1180 1185
Thr Lys Glu Pro Phe Ser Trp Ile Lys Val Asp Leu Leu Ala Pro
1190 1195 1200
Met Ile Ile His Gly Ile Lys Thr Gln Gly Ala Arg Gln Lys Phe
1205 1210 1215
Ser Ser Leu Tyr Ile Ser Gln Phe Ile Ile Met Tyr Ser Leu Asp
1220 1225 1230
Gly Lys Lys Trp Gln Thr Tyr Arg Gly Asn Ser Thr Gly Thr Leu
1235 1240 1245
Met Val Phe Phe Gly Asn Val Asp Ser Ser Gly Ile Lys His Asn
1250 1255 1260
Ile Phe Asn Pro Pro Ile Ile Ala Arg Tyr Ile Arg Leu His Pro
1265 1270 1275
Thr His Tyr Ser Ile Arg Ser Thr Leu Arg Met Glu Leu Met Gly
1280 1285 1290
Cys Asp Leu Asn Ser Cys Ser Met Pro Leu Gly Met Glu Ser Lys
1295 1300 1305
Ala Ile Ser Asp Ala Gln Ile Thr Ala Ser Ser Tyr Phe Thr Asn
1310 1315 1320
Met Phe Ala Thr Trp Ser Pro Ser Lys Ala Arg Leu His Leu Gln
1325 1330 1335
Gly Arg Ser Asn Ala Trp Arg Pro Gln Val Asn Asn Pro Lys Glu
1340 1345 1350
Trp Leu Gln Val Asp Phe Gln Lys Thr Met Lys Val Thr Gly Val
1355 1360 1365
Thr Thr Gln Gly Val Lys Ser Leu Leu Thr Ser Met Tyr Val Lys
1370 1375 1380
Glu Phe Leu Ile Ser Ser Ser Gln Asp Gly His Gln Trp Thr Leu
1385 1390 1395
Phe Phe Gln Asn Gly Lys Val Lys Val Phe Gln Gly Asn Gln Asp
1400 1405 1410
Ser Phe Thr Pro Val Val Asn Ser Leu Asp Pro Pro Leu Leu Thr
1415 1420 1425
Arg Tyr Leu Arg Ile His Pro Gln Ser Trp Val His Gln Ile Ala
1430 1435 1440
Leu Arg Met Glu Val Leu Gly Cys Glu Ala Gln Asp Leu Tyr
1445 1450 1455
<210> 5
<211> 1453
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> Сайт
<222> (1)..(19)
<223> /примечание="Сигнальная последовательность"
<400> 5
Met Gln Ile Glu Leu Ser Thr Cys Phe Phe Leu Cys Leu Leu Arg Phe
1. 5 10 15
Cys Phe Ser Ala Thr Arg Arg Tyr Tyr Leu Gly Ala Val Glu Leu Ser
20 25 30
Trp Asp Tyr Met Gln Ser Asp Leu Gly Glu Leu Pro Val Asp Ala Arg
35 40 45
Phe Pro Pro Arg Val Pro Lys Ser Phe Pro Phe Asn Thr Ser Val Val
50 55 60
Tyr Lys Lys Thr Leu Phe Val Glu Phe Thr Asp His Leu Phe Asn Ile
65 70 75 80
Ala Lys Pro Arg Pro Pro Trp Met Gly Leu Leu Gly Pro Thr Ile Gln
85 90 95
Ala Glu Val Tyr Asp Thr Val Val Ile Thr Leu Lys Asn Met Ala Ser
100 105 110
His Pro Val Ser Leu His Ala Val Gly Val Ser Tyr Trp Lys Ala Ser
115 120 125
Glu Gly Ala Glu Tyr Asp Asp Gln Thr Ser Gln Arg Glu Lys Glu Asp
130 135 140
Asp Lys Val Phe Pro Gly Gly Ser His Thr Tyr Val Trp Gln Val Leu
145 150 155 160
Lys Glu Asn Gly Pro Met Ala Ser Asp Pro Leu Cys Leu Thr Tyr Ser
165 170 175
Tyr Leu Ser His Val Asp Leu Val Lys Asp Leu Asn Ser Gly Leu Ile
180 185 190
Gly Ala Leu Leu Val Cys Arg Glu Gly Ser Leu Ala Lys Glu Lys Thr
195 200 205
Gln Thr Leu His Lys Phe Ile Leu Leu Phe Ala Val Phe Asp Glu Gly
210 215 220
Lys Ser Trp His Ser Glu Thr Lys Asn Ser Leu Met Gln Asp Arg Asp
225 230 235 240
Ala Ala Ser Ala Arg Ala Trp Pro Lys Met His Thr Val Asn Gly Tyr
245 250 255
Val Asn Arg Ser Leu Pro Gly Leu Ile Gly Cys His Arg Lys Ser Val
260 265 270
Tyr Trp His Val Ile Gly Met Gly Thr Thr Pro Glu Val His Ser Ile
275 280 285
Phe Leu Glu Gly His Thr Phe Leu Val Arg Asn His Arg Gln Ala Ser
290 295 300
Leu Glu Ile Ser Pro Ile Thr Phe Leu Thr Ala Gln Thr Leu Leu Met
305 310 315 320
Asp Leu Gly Gln Phe Leu Leu Phe Cys His Ile Ser Ser His Gln His
325 330 335
Asp Gly Met Glu Ala Tyr Val Lys Val Asp Ser Cys Pro Glu Glu Pro
340 345 350
Gln Leu Arg Met Lys Asn Asn Glu Glu Ala Glu Asp Tyr Asp Asp Asp
355 360 365
Leu Thr Asp Ser Glu Met Asp Val Val Arg Phe Asp Asp Asp Asn Ser
370 375 380
Pro Ser Phe Ile Gln Ile Arg Ser Val Ala Lys Lys His Pro Lys Thr
385 390 395 400
Trp Val His Tyr Ile Ala Ala Glu Glu Glu Asp Trp Asp Tyr Ala Pro
405 410 415
Leu Val Leu Ala Pro Asp Asp Arg Ser Tyr Lys Ser Gln Tyr Leu Asn
420 425 430
Asn Gly Pro Gln Arg Ile Gly Arg Lys Tyr Lys Lys Val Arg Phe Met
435 440 445
Ala Tyr Thr Asp Glu Thr Phe Lys Thr Arg Glu Ala Ile Gln His Glu
450 455 460
Ser Gly Ile Leu Gly Pro Leu Leu Tyr Gly Glu Val Gly Asp Thr Leu
465 470 475 480
Leu Ile Ile Phe Lys Asn Gln Ala Ser Arg Pro Tyr Asn Ile Tyr Pro
485 490 495
His Gly Ile Thr Asp Val Arg Pro Leu Tyr Ser Arg Arg Leu Pro Lys
500 505 510
Gly Val Lys His Leu Lys Asp Phe Pro Ile Leu Pro Gly Glu Ile Phe
515 520 525
Lys Tyr Lys Trp Thr Val Thr Val Glu Asp Gly Pro Thr Lys Ser Asp
530 535 540
Pro Arg Cys Leu Thr Arg Tyr Tyr Ser Ser Phe Val Asn Met Glu Arg
545 550 555 560
Asp Leu Ala Ser Gly Leu Ile Gly Pro Leu Leu Ile Cys Tyr Lys Glu
565 570 575
Ser Val Asp Gln Arg Gly Asn Gln Ile Met Ser Asp Lys Arg Asn Val
580 585 590
Ile Leu Phe Ser Val Phe Asp Glu Asn Arg Ser Trp Tyr Leu Thr Glu
595 600 605
Asn Ile Gln Arg Phe Leu Pro Asn Pro Ala Gly Val Gln Leu Glu Asp
610 615 620
Pro Glu Phe Gln Ala Ser Asn Ile Met His Ser Ile Asn Gly Tyr Val
625 630 635 640
Phe Asp Ser Leu Gln Leu Ser Val Cys Leu His Glu Val Ala Tyr Trp
645 650 655
Tyr Ile Leu Ser Ile Gly Ala Gln Thr Asp Phe Leu Ser Val Phe Phe
660 665 670
Ser Gly Tyr Thr Phe Lys His Lys Met Val Tyr Glu Asp Thr Leu Thr
675 680 685
Leu Phe Pro Phe Ser Gly Glu Thr Val Phe Met Ser Met Glu Asn Pro
690 695 700
Gly Leu Trp Ile Leu Gly Cys His Asn Ser Asp Phe Arg Asn Arg Gly
705 710 715 720
Met Thr Ala Leu Leu Lys Val Ser Ser Cys Asp Lys Asn Thr Gly Asp
725 730 735
Tyr Tyr Glu Asp Ser Tyr Glu Asp Ile Ser Ala Tyr Leu Leu Ser Lys
740 745 750
Asn Asn Ala Ile Glu Pro Arg Ser Phe Ser Gln Asn Pro Pro Val Leu
755 760 765
Lys Glu Ile Thr Arg Thr Thr Leu Gln Ser Asp Gln Glu Glu Ile Asp
770 775 780
Tyr Asp Asp Thr Ile Ser Val Glu Met Lys Lys Glu Asp Phe Asp Ile
785 790 795 800
Tyr Asp Glu Asp Glu Asn Gln Ser Pro Arg Ser Phe Gln Lys Lys Thr
805 810 815
Arg His Tyr Phe Ile Ala Ala Val Glu Arg Leu Trp Asp Tyr Gly Met
820 825 830
Ser Ser Ser Pro His Val Leu Arg Asn Arg Ala Gln Ser Gly Ser Val
835 840 845
Pro Gln Phe Lys Lys Val Val Phe Gln Glu Phe Thr Asp Gly Ser Phe
850 855 860
Thr Gln Pro Leu Tyr Arg Gly Glu Leu Asn Glu His Leu Gly Leu Leu
865 870 875 880
Gly Pro Tyr Ile Arg Ala Glu Val Glu Asp Asn Ile Met Val Thr Phe
885 890 895
Arg Asn Gln Ala Ser Arg Pro Tyr Ser Phe Tyr Ser Ser Leu Ile Ser
900 905 910
Tyr Glu Glu Asp Gln Arg Gln Gly Ala Glu Pro Arg Lys Asn Phe Val
915 920 925
Lys Pro Asn Glu Thr Lys Thr Tyr Phe Trp Lys Val Gln His His Met
930 935 940
Ala Pro Thr Lys Asp Glu Phe Asp Cys Lys Ala Trp Ala Tyr Phe Ser
945 950 955 960
Asp Val Asp Leu Glu Lys Asp Val His Ser Gly Leu Ile Gly Pro Leu
965 970 975
Leu Val Cys His Thr Asn Thr Leu Asn Pro Ala His Gly Arg Gln Val
980 985 990
Thr Val Gln Glu Phe Ala Leu Phe Phe Thr Ile Phe Asp Glu Thr Lys
995 1000 1005
Ser Trp Tyr Phe Thr Glu Asn Met Glu Arg Asn Cys Arg Ala Pro
1010 1015 1020
Cys Asn Ile Gln Met Glu Asp Pro Thr Phe Lys Glu Asn Tyr Arg
1025 1030 1035
Phe His Ala Ile Asn Gly Tyr Ile Met Asp Thr Leu Pro Gly Leu
1040 1045 1050
Val Met Ala Gln Asp Gln Arg Ile Arg Trp Tyr Leu Leu Ser Met
1055 1060 1065
Gly Ser Asn Glu Asn Ile His Ser Ile His Phe Ser Gly His Val
1070 1075 1080
Phe Thr Val Arg Lys Lys Glu Glu Tyr Lys Met Ala Leu Tyr Asn
1085 1090 1095
Leu Tyr Pro Gly Val Phe Glu Thr Val Glu Met Leu Pro Ser Lys
1100 1105 1110
Ala Gly Ile Trp Arg Val Glu Cys Leu Ile Gly Glu His Leu His
1115 1120 1125
Ala Gly Met Ser Thr Leu Phe Leu Val Tyr Ser Asn Lys Cys Gln
1130 1135 1140
Thr Pro Leu Gly Met Ala Ser Gly His Ile Arg Asp Phe Gln Ile
1145 1150 1155
Thr Ala Ser Gly Gln Tyr Gly Gln Trp Ala Pro Lys Leu Ala Arg
1160 1165 1170
Leu His Tyr Ser Gly Ser Ile Asn Ala Trp Ser Thr Lys Glu Pro
1175 1180 1185
Phe Ser Trp Ile Lys Val Asp Leu Leu Ala Pro Met Ile Ile His
1190 1195 1200
Gly Ile Lys Thr Gln Gly Ala Arg Gln Lys Phe Ser Ser Leu Tyr
1205 1210 1215
Ile Ser Gln Phe Ile Ile Met Tyr Ser Leu Asp Gly Lys Lys Trp
1220 1225 1230
Gln Thr Tyr Arg Gly Asn Ser Thr Gly Thr Leu Met Val Phe Phe
1235 1240 1245
Gly Asn Val Asp Ser Ser Gly Ile Lys His Asn Ile Phe Asn Pro
1250 1255 1260
Pro Ile Ile Ala Arg Tyr Ile Arg Leu His Pro Thr His Tyr Ser
1265 1270 1275
Ile Arg Ser Thr Leu Arg Met Glu Leu Met Gly Cys Asp Leu Asn
1280 1285 1290
Ser Cys Ser Met Pro Leu Gly Met Glu Ser Lys Ala Ile Ser Asp
1295 1300 1305
Ala Gln Ile Thr Ala Ser Ser Tyr Phe Thr Asn Met Phe Ala Thr
1310 1315 1320
Trp Ser Pro Ser Lys Ala Arg Leu His Leu Gln Gly Arg Ser Asn
1325 1330 1335
Ala Trp Arg Pro Gln Val Asn Asn Pro Lys Glu Trp Leu Gln Val
1340 1345 1350
Asp Phe Gln Lys Thr Met Lys Val Thr Gly Val Thr Thr Gln Gly
1355 1360 1365
Val Lys Ser Leu Leu Thr Ser Met Tyr Val Lys Glu Phe Leu Ile
1370 1375 1380
Ser Ser Ser Gln Asp Gly His Gln Trp Thr Leu Phe Phe Gln Asn
1385 1390 1395
Gly Lys Val Lys Val Phe Gln Gly Asn Gln Asp Ser Phe Thr Pro
1400 1405 1410
Val Val Asn Ser Leu Asp Pro Pro Leu Leu Thr Arg Tyr Leu Arg
1415 1420 1425
Ile His Pro Gln Ser Trp Val His Gln Ile Ala Leu Arg Met Glu
1430 1435 1440
Val Leu Gly Cys Glu Ala Gln Asp Leu Tyr
1445 1450
<210> 6
<211> 1454
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> Сайт
<222> (1)..(19)
<223> /примечание="Сигнальная последовательность"
<400> 6
Met Gln Ile Glu Leu Ser Thr Cys Phe Phe Leu Cys Leu Leu Arg Phe
1. 5 10 15
Cys Phe Ser Ala Thr Arg Arg Tyr Tyr Leu Gly Ala Val Glu Leu Ser
20 25 30
Trp Asp Tyr Met Gln Ser Asp Leu Gly Glu Leu Pro Val Asp Ala Arg
35 40 45
Phe Pro Pro Arg Val Pro Lys Ser Phe Pro Phe Asn Thr Ser Val Val
50 55 60
Tyr Lys Lys Thr Leu Phe Val Glu Phe Thr Asp His Leu Phe Asn Ile
65 70 75 80
Ala Lys Pro Arg Pro Pro Trp Met Gly Leu Leu Gly Pro Thr Ile Gln
85 90 95
Ala Glu Val Tyr Asp Thr Val Val Ile Thr Leu Lys Asn Met Ala Ser
100 105 110
His Pro Val Ser Leu His Ala Val Gly Val Ser Tyr Trp Lys Ala Ser
115 120 125
Glu Gly Ala Glu Tyr Asp Asp Gln Thr Ser Gln Arg Glu Lys Glu Asp
130 135 140
Asp Lys Val Phe Pro Gly Gly Ser His Thr Tyr Val Trp Gln Val Leu
145 150 155 160
Lys Glu Asn Gly Pro Met Ala Ser Asp Pro Leu Cys Leu Thr Tyr Ser
165 170 175
Tyr Leu Ser His Val Asp Leu Val Lys Asp Leu Asn Ser Gly Leu Ile
180 185 190
Gly Ala Leu Leu Val Cys Arg Glu Gly Ser Leu Ala Lys Glu Lys Thr
195 200 205
Gln Thr Leu His Lys Phe Ile Leu Leu Phe Ala Val Phe Asp Glu Gly
210 215 220
Lys Ser Trp His Ser Glu Thr Lys Asn Ser Leu Met Gln Asp Arg Asp
225 230 235 240
Ala Ala Ser Ala Arg Ala Trp Pro Lys Met His Thr Val Asn Gly Tyr
245 250 255
Val Asn Arg Ser Leu Pro Gly Leu Ile Gly Cys His Arg Lys Ser Val
260 265 270
Tyr Trp His Val Ile Gly Met Gly Thr Thr Pro Glu Val His Ser Ile
275 280 285
Phe Leu Glu Gly His Thr Phe Leu Val Arg Asn His Arg Gln Ala Ser
290 295 300
Leu Glu Ile Ser Pro Ile Thr Phe Leu Thr Ala Gln Thr Leu Leu Met
305 310 315 320
Asp Leu Gly Gln Phe Leu Leu Phe Cys His Ile Ser Ser His Gln His
325 330 335
Asp Gly Met Glu Ala Tyr Val Lys Val Asp Ser Cys Pro Glu Glu Pro
340 345 350
Gln Leu Arg Met Lys Asn Asn Glu Glu Ala Glu Asp Tyr Asp Asp Asp
355 360 365
Leu Thr Asp Ser Glu Met Asp Val Val Arg Phe Asp Asp Asp Asn Ser
370 375 380
Pro Ser Phe Ile Gln Ile Arg Ser Val Ala Lys Lys His Pro Lys Thr
385 390 395 400
Trp Val His Tyr Ile Ala Ala Glu Glu Glu Asp Trp Asp Tyr Ala Pro
405 410 415
Leu Val Leu Ala Pro Asp Asp Arg Ser Tyr Lys Ser Gln Tyr Leu Asn
420 425 430
Asn Gly Pro Gln Arg Ile Gly Arg Lys Tyr Lys Lys Val Arg Phe Met
435 440 445
Ala Tyr Thr Asp Glu Thr Phe Lys Thr Arg Glu Ala Ile Gln His Glu
450 455 460
Ser Gly Ile Leu Gly Pro Leu Leu Tyr Gly Glu Val Gly Asp Thr Leu
465 470 475 480
Leu Ile Ile Phe Lys Asn Gln Ala Ser Arg Pro Tyr Asn Ile Tyr Pro
485 490 495
His Gly Ile Thr Asp Val Arg Pro Leu Tyr Ser Arg Arg Leu Pro Lys
500 505 510
Gly Val Lys His Leu Lys Asp Phe Pro Ile Leu Pro Gly Glu Ile Phe
515 520 525
Lys Tyr Lys Trp Thr Val Thr Val Glu Asp Gly Pro Thr Lys Ser Asp
530 535 540
Pro Arg Cys Leu Thr Arg Tyr Tyr Ser Ser Phe Val Asn Met Glu Arg
545 550 555 560
Asp Leu Ala Ser Gly Leu Ile Gly Pro Leu Leu Ile Cys Tyr Lys Glu
565 570 575
Ser Val Asp Gln Arg Gly Asn Gln Ile Met Ser Asp Lys Arg Asn Val
580 585 590
Ile Leu Phe Ser Val Phe Asp Glu Asn Arg Ser Trp Tyr Leu Thr Glu
595 600 605
Asn Ile Gln Arg Phe Leu Pro Asn Pro Ala Gly Val Gln Leu Glu Asp
610 615 620
Pro Glu Phe Gln Ala Ser Asn Ile Met His Ser Ile Asn Gly Tyr Val
625 630 635 640
Phe Asp Ser Leu Gln Leu Ser Val Cys Leu His Glu Val Ala Tyr Trp
645 650 655
Tyr Ile Leu Ser Ile Gly Ala Gln Thr Asp Phe Leu Ser Val Phe Phe
660 665 670
Ser Gly Tyr Thr Phe Lys His Lys Met Val Tyr Glu Asp Thr Leu Thr
675 680 685
Leu Phe Pro Phe Ser Gly Glu Thr Val Phe Met Ser Met Glu Asn Pro
690 695 700
Gly Leu Trp Ile Leu Gly Cys His Asn Ser Asp Phe Arg Asn Arg Gly
705 710 715 720
Met Thr Ala Leu Leu Lys Val Ser Ser Cys Asp Lys Asn Thr Gly Asp
725 730 735
Tyr Tyr Glu Asp Ser Tyr Glu Asp Ile Ser Ala Tyr Leu Leu Ser Lys
740 745 750
Asn Asn Ala Ile Glu Pro Arg Ser Phe Ser Gln Asn Pro Pro Val Leu
755 760 765
Lys Arg Glu Ile Thr Arg Thr Thr Leu Gln Ser Asp Gln Glu Glu Ile
770 775 780
Asp Tyr Asp Asp Thr Ile Ser Val Glu Met Lys Lys Glu Asp Phe Asp
785 790 795 800
Ile Tyr Asp Glu Asp Glu Asn Gln Ser Pro Arg Ser Phe Gln Lys Lys
805 810 815
Thr Arg His Tyr Phe Ile Ala Ala Val Glu Arg Leu Trp Asp Tyr Gly
820 825 830
Met Ser Ser Ser Pro His Val Leu Arg Asn Arg Ala Gln Ser Gly Ser
835 840 845
Val Pro Gln Phe Lys Lys Val Val Phe Gln Glu Phe Thr Asp Gly Ser
850 855 860
Phe Thr Gln Pro Leu Tyr Arg Gly Glu Leu Asn Glu His Leu Gly Leu
865 870 875 880
Leu Gly Pro Tyr Ile Arg Ala Glu Val Glu Asp Asn Ile Met Val Thr
885 890 895
Phe Arg Asn Gln Ala Ser Arg Pro Tyr Ser Phe Tyr Ser Ser Leu Ile
900 905 910
Ser Tyr Glu Glu Asp Gln Arg Gln Gly Ala Glu Pro Arg Lys Asn Phe
915 920 925
Val Lys Pro Asn Glu Thr Lys Thr Tyr Phe Trp Lys Val Gln His His
930 935 940
Met Ala Pro Thr Lys Asp Glu Phe Asp Cys Lys Ala Trp Ala Tyr Phe
945 950 955 960
Ser Asp Val Asp Leu Glu Lys Asp Val His Ser Gly Leu Ile Gly Pro
965 970 975
Leu Leu Val Cys His Thr Asn Thr Leu Asn Pro Ala His Gly Arg Gln
980 985 990
Val Thr Val Gln Glu Phe Ala Leu Phe Phe Thr Ile Phe Asp Glu Thr
995 1000 1005
Lys Ser Trp Tyr Phe Thr Glu Asn Met Glu Arg Asn Cys Arg Ala
1010 1015 1020
Pro Cys Asn Ile Gln Met Glu Asp Pro Thr Phe Lys Glu Asn Tyr
1025 1030 1035
Arg Phe His Ala Ile Asn Gly Tyr Ile Met Asp Thr Leu Pro Gly
1040 1045 1050
Leu Val Met Ala Gln Asp Gln Arg Ile Arg Trp Tyr Leu Leu Ser
1055 1060 1065
Met Gly Ser Asn Glu Asn Ile His Ser Ile His Phe Ser Gly His
1070 1075 1080
Val Phe Thr Val Arg Lys Lys Glu Glu Tyr Lys Met Ala Leu Tyr
1085 1090 1095
Asn Leu Tyr Pro Gly Val Phe Glu Thr Val Glu Met Leu Pro Ser
1100 1105 1110
Lys Ala Gly Ile Trp Arg Val Glu Cys Leu Ile Gly Glu His Leu
1115 1120 1125
His Ala Gly Met Ser Thr Leu Phe Leu Val Tyr Ser Asn Lys Cys
1130 1135 1140
Gln Thr Pro Leu Gly Met Ala Ser Gly His Ile Arg Asp Phe Gln
1145 1150 1155
Ile Thr Ala Ser Gly Gln Tyr Gly Gln Trp Ala Pro Lys Leu Ala
1160 1165 1170
Arg Leu His Tyr Ser Gly Ser Ile Asn Ala Trp Ser Thr Lys Glu
1175 1180 1185
Pro Phe Ser Trp Ile Lys Val Asp Leu Leu Ala Pro Met Ile Ile
1190 1195 1200
His Gly Ile Lys Thr Gln Gly Ala Arg Gln Lys Phe Ser Ser Leu
1205 1210 1215
Tyr Ile Ser Gln Phe Ile Ile Met Tyr Ser Leu Asp Gly Lys Lys
1220 1225 1230
Trp Gln Thr Tyr Arg Gly Asn Ser Thr Gly Thr Leu Met Val Phe
1235 1240 1245
Phe Gly Asn Val Asp Ser Ser Gly Ile Lys His Asn Ile Phe Asn
1250 1255 1260
Pro Pro Ile Ile Ala Arg Tyr Ile Arg Leu His Pro Thr His Tyr
1265 1270 1275
Ser Ile Arg Ser Thr Leu Arg Met Glu Leu Met Gly Cys Asp Leu
1280 1285 1290
Asn Ser Cys Ser Met Pro Leu Gly Met Glu Ser Lys Ala Ile Ser
1295 1300 1305
Asp Ala Gln Ile Thr Ala Ser Ser Tyr Phe Thr Asn Met Phe Ala
1310 1315 1320
Thr Trp Ser Pro Ser Lys Ala Arg Leu His Leu Gln Gly Arg Ser
1325 1330 1335
Asn Ala Trp Arg Pro Gln Val Asn Asn Pro Lys Glu Trp Leu Gln
1340 1345 1350
Val Asp Phe Gln Lys Thr Met Lys Val Thr Gly Val Thr Thr Gln
1355 1360 1365
Gly Val Lys Ser Leu Leu Thr Ser Met Tyr Val Lys Glu Phe Leu
1370 1375 1380
Ile Ser Ser Ser Gln Asp Gly His Gln Trp Thr Leu Phe Phe Gln
1385 1390 1395
Asn Gly Lys Val Lys Val Phe Gln Gly Asn Gln Asp Ser Phe Thr
1400 1405 1410
Pro Val Val Asn Ser Leu Asp Pro Pro Leu Leu Thr Arg Tyr Leu
1415 1420 1425
Arg Ile His Pro Gln Ser Trp Val His Gln Ile Ala Leu Arg Met
1430 1435 1440
Glu Val Leu Gly Cys Glu Ala Gln Asp Leu Tyr
1445 1450
<210> 7
<211> 1474
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> Сайт
<222> (1)..(19)
<223> /примечание="Сигнальная последовательность"
<400> 7
Met Gln Ile Glu Leu Ser Thr Cys Phe Phe Leu Cys Leu Leu Arg Phe
1. 5 10 15
Cys Phe Ser Ala Thr Arg Arg Tyr Tyr Leu Gly Ala Val Glu Leu Ser
20 25 30
Trp Asp Tyr Met Gln Ser Asp Leu Gly Glu Leu Pro Val Asp Ala Arg
35 40 45
Phe Pro Pro Arg Val Pro Lys Ser Phe Pro Phe Asn Thr Ser Val Val
50 55 60
Tyr Lys Lys Thr Leu Phe Val Glu Phe Thr Asp His Leu Phe Asn Ile
65 70 75 80
Ala Lys Pro Arg Pro Pro Trp Met Gly Leu Leu Gly Pro Thr Ile Gln
85 90 95
Ala Glu Val Tyr Asp Thr Val Val Ile Thr Leu Lys Asn Met Ala Ser
100 105 110
His Pro Val Ser Leu His Ala Val Gly Val Ser Tyr Trp Lys Ala Ser
115 120 125
Glu Gly Ala Glu Tyr Asp Asp Gln Thr Ser Gln Arg Glu Lys Glu Asp
130 135 140
Asp Lys Val Phe Pro Gly Gly Ser His Thr Tyr Val Trp Gln Val Leu
145 150 155 160
Lys Glu Asn Gly Pro Met Ala Ser Asp Pro Leu Cys Leu Thr Tyr Ser
165 170 175
Tyr Leu Ser His Val Asp Leu Val Lys Asp Leu Asn Ser Gly Leu Ile
180 185 190
Gly Ala Leu Leu Val Cys Arg Glu Gly Ser Leu Ala Lys Glu Lys Thr
195 200 205
Gln Thr Leu His Lys Phe Ile Leu Leu Phe Ala Val Phe Asp Glu Gly
210 215 220
Lys Ser Trp His Ser Glu Thr Lys Asn Ser Leu Met Gln Asp Arg Asp
225 230 235 240
Ala Ala Ser Ala Arg Ala Trp Pro Lys Met His Thr Val Asn Gly Tyr
245 250 255
Val Asn Arg Ser Leu Pro Gly Leu Ile Gly Cys His Arg Lys Ser Val
260 265 270
Tyr Trp His Val Ile Gly Met Gly Thr Thr Pro Glu Val His Ser Ile
275 280 285
Phe Leu Glu Gly His Thr Phe Leu Val Arg Asn His Arg Gln Ala Ser
290 295 300
Leu Glu Ile Ser Pro Ile Thr Phe Leu Thr Ala Gln Thr Leu Leu Met
305 310 315 320
Asp Leu Gly Gln Phe Leu Leu Phe Cys His Ile Ser Ser His Gln His
325 330 335
Asp Gly Met Glu Ala Tyr Val Lys Val Asp Ser Cys Pro Glu Glu Pro
340 345 350
Gln Leu Arg Met Lys Asn Asn Glu Glu Ala Glu Asp Tyr Asp Asp Asp
355 360 365
Leu Thr Asp Ser Glu Met Asp Val Val Arg Phe Asp Asp Asp Asn Ser
370 375 380
Pro Ser Phe Ile Gln Ile Arg Ser Val Ala Lys Lys His Pro Lys Thr
385 390 395 400
Trp Val His Tyr Ile Ala Ala Glu Glu Glu Asp Trp Asp Tyr Ala Pro
405 410 415
Leu Val Leu Ala Pro Asp Asp Arg Ser Tyr Lys Ser Gln Tyr Leu Asn
420 425 430
Asn Gly Pro Gln Arg Ile Gly Arg Lys Tyr Lys Lys Val Arg Phe Met
435 440 445
Ala Tyr Thr Asp Glu Thr Phe Lys Thr Arg Glu Ala Ile Gln His Glu
450 455 460
Ser Gly Ile Leu Gly Pro Leu Leu Tyr Gly Glu Val Gly Asp Thr Leu
465 470 475 480
Leu Ile Ile Phe Lys Asn Gln Ala Ser Arg Pro Tyr Asn Ile Tyr Pro
485 490 495
His Gly Ile Thr Asp Val Arg Pro Leu Tyr Ser Arg Arg Leu Pro Lys
500 505 510
Gly Val Lys His Leu Lys Asp Phe Pro Ile Leu Pro Gly Glu Ile Phe
515 520 525
Lys Tyr Lys Trp Thr Val Thr Val Glu Asp Gly Pro Thr Lys Ser Asp
530 535 540
Pro Arg Cys Leu Thr Arg Tyr Tyr Ser Ser Phe Val Asn Met Glu Arg
545 550 555 560
Asp Leu Ala Ser Gly Leu Ile Gly Pro Leu Leu Ile Cys Tyr Lys Glu
565 570 575
Ser Val Asp Gln Arg Gly Asn Gln Ile Met Ser Asp Lys Arg Asn Val
580 585 590
Ile Leu Phe Ser Val Phe Asp Glu Asn Arg Ser Trp Tyr Leu Thr Glu
595 600 605
Asn Ile Gln Arg Phe Leu Pro Asn Pro Ala Gly Val Gln Leu Glu Asp
610 615 620
Pro Glu Phe Gln Ala Ser Asn Ile Met His Ser Ile Asn Gly Tyr Val
625 630 635 640
Phe Asp Ser Leu Gln Leu Ser Val Cys Leu His Glu Val Ala Tyr Trp
645 650 655
Tyr Ile Leu Ser Ile Gly Ala Gln Thr Asp Phe Leu Ser Val Phe Phe
660 665 670
Ser Gly Tyr Thr Phe Lys His Lys Met Val Tyr Glu Asp Thr Leu Thr
675 680 685
Leu Phe Pro Phe Ser Gly Glu Thr Val Phe Met Ser Met Glu Asn Pro
690 695 700
Gly Leu Trp Ile Leu Gly Cys His Asn Ser Asp Phe Arg Asn Arg Gly
705 710 715 720
Met Thr Ala Leu Leu Lys Val Ser Ser Cys Asp Lys Asn Thr Gly Asp
725 730 735
Tyr Tyr Glu Asp Ser Tyr Glu Asp Ile Ser Ala Tyr Leu Leu Ser Lys
740 745 750
Asn Asn Ala Ile Glu Pro Arg Ser Phe Ser Gln Asn Ala Thr Asn Val
755 760 765
Ser Asn Asn Ser Asn Thr Ser Asn Asp Ser Asn Val Ser Pro Pro Val
770 775 780
Leu Lys Arg His Gln Arg Glu Ile Thr Arg Thr Thr Leu Gln Ser Asp
785 790 795 800
Gln Glu Glu Ile Asp Tyr Asp Asp Thr Ile Ser Val Glu Met Lys Lys
805 810 815
Glu Asp Phe Asp Ile Tyr Asp Glu Asp Glu Asn Gln Ser Pro Arg Ser
820 825 830
Phe Gln Lys Lys Thr Arg His Tyr Phe Ile Ala Ala Val Glu Arg Leu
835 840 845
Trp Asp Tyr Gly Met Ser Ser Ser Pro His Val Leu Arg Asn Arg Ala
850 855 860
Gln Ser Gly Ser Val Pro Gln Phe Lys Lys Val Val Phe Gln Glu Phe
865 870 875 880
Thr Asp Gly Ser Phe Thr Gln Pro Leu Tyr Arg Gly Glu Leu Asn Glu
885 890 895
His Leu Gly Leu Leu Gly Pro Tyr Ile Arg Ala Glu Val Glu Asp Asn
900 905 910
Ile Met Val Thr Phe Arg Asn Gln Ala Ser Arg Pro Tyr Ser Phe Tyr
915 920 925
Ser Ser Leu Ile Ser Tyr Glu Glu Asp Gln Arg Gln Gly Ala Glu Pro
930 935 940
Arg Lys Asn Phe Val Lys Pro Asn Glu Thr Lys Thr Tyr Phe Trp Lys
945 950 955 960
Val Gln His His Met Ala Pro Thr Lys Asp Glu Phe Asp Cys Lys Ala
965 970 975
Trp Ala Tyr Phe Ser Asp Val Asp Leu Glu Lys Asp Val His Ser Gly
980 985 990
Leu Ile Gly Pro Leu Leu Val Cys His Thr Asn Thr Leu Asn Pro Ala
995 1000 1005
His Gly Arg Gln Val Thr Val Gln Glu Phe Ala Leu Phe Phe Thr
1010 1015 1020
Ile Phe Asp Glu Thr Lys Ser Trp Tyr Phe Thr Glu Asn Met Glu
1025 1030 1035
Arg Asn Cys Arg Ala Pro Cys Asn Ile Gln Met Glu Asp Pro Thr
1040 1045 1050
Phe Lys Glu Asn Tyr Arg Phe His Ala Ile Asn Gly Tyr Ile Met
1055 1060 1065
Asp Thr Leu Pro Gly Leu Val Met Ala Gln Asp Gln Arg Ile Arg
1070 1075 1080
Trp Tyr Leu Leu Ser Met Gly Ser Asn Glu Asn Ile His Ser Ile
1085 1090 1095
His Phe Ser Gly His Val Phe Thr Val Arg Lys Lys Glu Glu Tyr
1100 1105 1110
Lys Met Ala Leu Tyr Asn Leu Tyr Pro Gly Val Phe Glu Thr Val
1115 1120 1125
Glu Met Leu Pro Ser Lys Ala Gly Ile Trp Arg Val Glu Cys Leu
1130 1135 1140
Ile Gly Glu His Leu His Ala Gly Met Ser Thr Leu Phe Leu Val
1145 1150 1155
Tyr Ser Asn Lys Cys Gln Thr Pro Leu Gly Met Ala Ser Gly His
1160 1165 1170
Ile Arg Asp Phe Gln Ile Thr Ala Ser Gly Gln Tyr Gly Gln Trp
1175 1180 1185
Ala Pro Lys Leu Ala Arg Leu His Tyr Ser Gly Ser Ile Asn Ala
1190 1195 1200
Trp Ser Thr Lys Glu Pro Phe Ser Trp Ile Lys Val Asp Leu Leu
1205 1210 1215
Ala Pro Met Ile Ile His Gly Ile Lys Thr Gln Gly Ala Arg Gln
1220 1225 1230
Lys Phe Ser Ser Leu Tyr Ile Ser Gln Phe Ile Ile Met Tyr Ser
1235 1240 1245
Leu Asp Gly Lys Lys Trp Gln Thr Tyr Arg Gly Asn Ser Thr Gly
1250 1255 1260
Thr Leu Met Val Phe Phe Gly Asn Val Asp Ser Ser Gly Ile Lys
1265 1270 1275
His Asn Ile Phe Asn Pro Pro Ile Ile Ala Arg Tyr Ile Arg Leu
1280 1285 1290
His Pro Thr His Tyr Ser Ile Arg Ser Thr Leu Arg Met Glu Leu
1295 1300 1305
Met Gly Cys Asp Leu Asn Ser Cys Ser Met Pro Leu Gly Met Glu
1310 1315 1320
Ser Lys Ala Ile Ser Asp Ala Gln Ile Thr Ala Ser Ser Tyr Phe
1325 1330 1335
Thr Asn Met Phe Ala Thr Trp Ser Pro Ser Lys Ala Arg Leu His
1340 1345 1350
Leu Gln Gly Arg Ser Asn Ala Trp Arg Pro Gln Val Asn Asn Pro
1355 1360 1365
Lys Glu Trp Leu Gln Val Asp Phe Gln Lys Thr Met Lys Val Thr
1370 1375 1380
Gly Val Thr Thr Gln Gly Val Lys Ser Leu Leu Thr Ser Met Tyr
1385 1390 1395
Val Lys Glu Phe Leu Ile Ser Ser Ser Gln Asp Gly His Gln Trp
1400 1405 1410
Thr Leu Phe Phe Gln Asn Gly Lys Val Lys Val Phe Gln Gly Asn
1415 1420 1425
Gln Asp Ser Phe Thr Pro Val Val Asn Ser Leu Asp Pro Pro Leu
1430 1435 1440
Leu Thr Arg Tyr Leu Arg Ile His Pro Gln Ser Trp Val His Gln
1445 1450 1455
Ile Ala Leu Arg Met Glu Val Leu Gly Cys Glu Ala Gln Asp Leu
1460 1465 1470
Tyr
<210> 8
<211> 4374
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 8
atgcaaatag agctctccac ctgcttcttt ctgtgccttt tgcgattctg ctttagtgcc 60
accagaagat actacctggg tgcagtggaa ctgtcatggg actatatgca aagtgatctc 120
ggtgagctgc ctgtggacgc aagatttcct cctagagtgc caaaatcttt tccattcaac 180
acctcagtcg tgtacaaaaa gactctgttt gtagaattca cggatcacct tttcaacatc 240
gctaagccaa ggccaccctg gatgggtctg ctaggtccta ccatccaggc tgaggtttat 300
gatacagtgg tcattacact taagaacatg gcttcccatc ctgtcagtct tcatgctgtt 360
ggtgtatcct actggaaagc ttctgaggga gctgaatatg atgatcagac cagtcaaagg 420
gagaaagaag atgataaagt cttccctggt ggaagccata catatgtctg gcaggtcctg 480
aaagagaatg gtccaatggc ctctgaccca ctgtgcctta cctactcata tctttctcat 540
gtggacctgg taaaagactt gaattcaggc ctcattggag ccctactagt atgtagagaa 600
gggagtctgg ccaaggaaaa gacacagacc ttgcacaaat ttatactact ttttgctgta 660
tttgatgaag ggaaaagttg gcactcagaa acaaagaact ccttgatgca ggatagggat 720
gctgcatctg ctcgggcctg gcctaaaatg cacacagtca atggttatgt aaacaggtct 780
ctgccaggtc tgattggatg ccacaggaaa tcagtctatt ggcatgtgat tggaatgggc 840
accactcctg aagtgcactc aatattcctc gaaggtcaca catttcttgt gaggaaccat 900
cgccaggcgt ccttggaaat ctcgccaata actttcctta ctgctcaaac actcttgatg 960
gaccttggac agtttctact gttttgtcat atctcttccc accaacatga tggcatggaa 1020
gcttatgtca aagtagacag ctgtccagag gaaccccaac tacgaatgaa aaataatgaa 1080
gaagcggaag actatgatga tgatcttact gattctgaaa tggatgtggt caggtttgat 1140
gatgacaact ctccttcctt tatccaaatt cgctcagttg ccaagaagca tcctaaaact 1200
tgggtacatt acattgctgc tgaagaggag gactgggact atgctccctt agtcctcgcc 1260
cccgatgaca gaagttataa aagtcaatat ttgaacaatg gccctcagcg gattggtagg 1320
aagtacaaaa aagtccgatt tatggcatac acagatgaaa cctttaagac tcgtgaagct 1380
attcagcatg aatcaggaat cttgggacct ttactttatg gggaagttgg agacacactg 1440
ttgattatat ttaagaatca agcaagcaga ccatataaca tctaccctca cggaatcact 1500
gatgtccgtc ctttgtattc aaggagatta ccaaaaggtg taaaacattt gaaggatttt 1560
ccaattctgc caggagaaat attcaaatat aaatggacag tgactgtaga agatgggcca 1620
actaaatcag atcctcggtg cctgacccgc tattactcta gtttcgttaa tatggagaga 1680
gatctagctt caggactcat tggccctctc ctcatctgct acaaagaatc tgtagatcaa 1740
agaggaaacc agataatgtc agacaagagg aatgtcatcc tgttttctgt atttgatgag 1800
aaccgaagct ggtacctcac agagaatata caacgctttc tccccaatcc agctggagtg 1860
cagcttgagg atccagagtt ccaagcctcc aacatcatgc acagcatcaa tggctatgtt 1920
tttgatagtt tgcagttgtc agtttgtttg catgaggtgg catactggta cattctaagc 1980
attggagcac agactgactt cctttctgtc ttcttctctg gatatacctt caaacacaaa 2040
atggtctatg aagacacact caccctattc ccattctcag gagaaactgt cttcatgtcg 2100
atggaaaacc caggtctatg gattctgggg tgccacaact cagactttcg gaacagaggc 2160
atgaccgcct tactgaaggt ttctagttgt gacaagaaca ctggtgatta ttacgaggac 2220
agttatgaag atatttcagc atacttgctg agtaaaaaca atgccattga accaagaagc 2280
ttctcccaaa acccaccagt cttgaaacgc catcaacggg aaataactcg tactactctt 2340
cagtcagatc aagaggaaat tgactatgat gataccatat cagttgaaat gaagaaggaa 2400
gattttgaca tttatgatga ggatgaaaat cagagccccc gcagctttca aaagaaaaca 2460
cgacactatt ttattgctgc agtggagagg ctctgggatt atgggatgag tagctcccca 2520
catgttctaa gaaacagggc tcagagtggc agtgtccctc agttcaagaa agttgttttc 2580
caggaattta ctgatggctc ctttactcag cccttatacc gtggagaact aaatgaacat 2640
ttgggactcc tggggccata tataagagca gaagttgaag ataatatcat ggtaactttc 2700
agaaatcagg cctctcgtcc ctattccttc tattctagcc ttatttctta tgaggaagat 2760
cagaggcaag gagcagaacc tagaaaaaac tttgtcaagc ctaatgaaac caaaacttac 2820
ttttggaaag tgcaacatca tatggcaccc actaaagatg agtttgactg caaagcctgg 2880
gcttatttct ctgatgttga cctggaaaaa gatgtgcact caggcctgat tggacccctt 2940
ctggtctgcc acactaacac actgaaccct gctcatggga gacaagtgac agtacaggaa 3000
tttgctctgt ttttcaccat ctttgatgag accaaaagct ggtacttcac tgaaaatatg 3060
gaaagaaact gcagggctcc ctgcaatatc cagatggaag atcccacttt taaagagaat 3120
tatcgcttcc atgcaatcaa tggctacata atggatacac tacctggctt agtaatggct 3180
caggatcaaa ggattcgatg gtatctgctc agcatgggca gcaatgaaaa catccattct 3240
attcatttca gtggacatgt gttcactgta cgaaaaaaag aggagtataa aatggcactg 3300
tacaatctct atccaggtgt ttttgagaca gtggaaatgt taccatccaa agctggaatt 3360
tggcgggtgg aatgccttat tggcgagcat ctacatgctg ggatgagcac actttttctg 3420
gtgtacagca ataagtgtca gactcccctg ggaatggctt ctggacacat tagagatttt 3480
cagattacag cttcaggaca atatggacag tgggccccaa agctggccag acttcattat 3540
tccggatcaa tcaatgcctg gagcaccaag gagccctttt cttggatcaa ggtggatctg 3600
ttggcaccaa tgattattca cggcatcaag acccagggtg cccgtcagaa gttctccagc 3660
ctctacatct ctcagtttat catcatgtat agtcttgatg ggaagaagtg gcagacttat 3720
cgaggaaatt ccactggaac cttaatggtc ttctttggca atgtggattc atctgggata 3780
aaacacaata tttttaaccc tccaattatt gctcgataca tccgtttgca cccaactcat 3840
tatagcattc gcagcactct tcgcatggag ttgatgggct gtgatttaaa tagttgcagc 3900
atgccattgg gaatggagag taaagcaata tcagatgcac agattactgc ttcatcctac 3960
tttaccaata tgtttgccac ctggtctcct tcaaaagctc gacttcacct ccaagggagg 4020
agtaatgcct ggagacctca ggtgaataat ccaaaagagt ggctgcaagt ggacttccag 4080
aagacaatga aagtcacagg agtaactact cagggagtaa aatctctgct taccagcatg 4140
tatgtgaagg agttcctcat ctccagcagt caagatggcc atcagtggac tctctttttt 4200
cagaatggca aagtaaaggt ttttcaggga aatcaagact ccttcacacc tgtggtgaac 4260
tctctagacc caccgttact gactcgctac cttcgaattc acccccagag ttgggtgcac 4320
cagattgccc tgaggatgga ggttctgggc tgcgaggcac aggacctcta ctga 4374
<210> 9
<211> 4374
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 9
atgcaaatag agctctccac ctgcttcttt ctgtgccttt tgcgattctg ctttagtgcc 60
accagaagat actacctggg tgcagtggaa ctgtcatggg actatatgca aagtgatctc 120
ggtgagctgc ctgtggacgc aagatttcct cctagagtgc caaaatcttt tccattcaac 180
acctcagtcg tgtacaaaaa gactctgttt gtagaattca cggatcacct tttcaacatc 240
gctaagccaa ggccaccctg gatgggtctg ctaggtccta ccatccaggc tgaggtttat 300
gatacagtgg tcattacact taagaacatg gcttcccatc ctgtcagtct tcatgctgtt 360
ggtgtatcct actggaaagc ttctgaggga gctgaatatg atgatcagac cagtcaaagg 420
gagaaagaag atgataaagt cttccctggt ggaagccata catatgtctg gcaggtcctg 480
aaagagaatg gtccaatggc ctctgaccca ctgtgcctta cctactcata tctttctcat 540
gtggacctgg taaaagactt gaattcaggc ctcattggag ccctactagt atgtagagaa 600
gggagtctgg ccaaggaaaa gacacagacc ttgcacaaat ttatactact ttttgctgta 660
tttgatgaag ggaaaagttg gcactcagaa acaaagaact ccttgatgca ggatagggat 720
gctgcatctg ctcgggcctg gcctaaaatg cacacagtca atggttatgt aaacaggtct 780
ctgccaggtc tgattggatg ccacaggaaa tcagtctatt ggcatgtgat tggaatgggc 840
accactcctg aagtgcactc aatattcctc gaaggtcaca catttcttgt gaggaaccat 900
cgccaggcgt ccttggaaat ctcgccaata actttcctta ctgctcaaac actcttgatg 960
gaccttggac agtttctact gttttgtcat atctcttccc accaacatga tggcatggaa 1020
gcttatgtca aagtagacag ctgtccagag gaaccccaac tacgaatgaa aaataatgaa 1080
gaagcggaag actatgatga tgatcttact gattctgaaa tggatgtggt caggtttgat 1140
gatgacaact ctccttcctt tatccaaatt cgctcagttg ccaagaagca tcctaaaact 1200
tgggtacatt acattgctgc tgaagaggag gactgggact atgctccctt agtcctcgcc 1260
cccgatgaca gaagttataa aagtcaatat ttgaacaatg gccctcagcg gattggtagg 1320
aagtacaaaa aagtccgatt tatggcatac acagatgaaa cctttaagac tcgtgaagct 1380
attcagcatg aatcaggaat cttgggacct ttactttatg gggaagttgg agacacactg 1440
ttgattatat ttaagaatca agcaagcaga ccatataaca tctaccctca cggaatcact 1500
gatgtccgtc ctttgtattc aaggagatta ccaaaaggtg taaaacattt gaaggatttt 1560
ccaattctgc caggagaaat attcaaatat aaatggacag tgactgtaga agatgggcca 1620
actaaatcag atcctcggtg cctgacccgc tattactcta gtttcgttaa tatggagaga 1680
gatctagctt caggactcat tggccctctc ctcatctgct acaaagaatc tgtagatcaa 1740
agaggaaacc agataatgtc agacaagagg aatgtcatcc tgttttctgt atttgatgag 1800
aaccgaagct ggtacctcac agagaatata caacgctttc tccccaatcc agctggagtg 1860
cagcttgagg atccagagtt ccaagcctcc aacatcatgc acagcatcaa tggctatgtt 1920
tttgatagtt tgcagttgtc agtttgtttg catgaggtgg catactggta cattctaagc 1980
attggagcac agactgactt cctttctgtc ttcttctctg gatatacctt caaacacaaa 2040
atggtctatg aagacacact caccctattc ccattctcag gagaaactgt cttcatgtcg 2100
atggaaaacc caggtctatg gattctgggg tgccacaact cagactttcg gaacagaggc 2160
atgaccgcct tactgaaggt ttctagttgt gacaagaaca ctggtgatta ttacgaggac 2220
agttatgaag atatttcagc atacttgctg agtaaaaaca atgccattga accaagaagc 2280
ttctcccaaa acccaccagt cttgaaacac catcaacggg aaataactcg tactactctt 2340
cagtcagatc aagaggaaat tgactatgat gataccatat cagttgaaat gaagaaggaa 2400
gattttgaca tttatgatga ggatgaaaat cagagccccc gcagctttca aaagaaaaca 2460
cgacactatt ttattgctgc agtggagagg ctctgggatt atgggatgag tagctcccca 2520
catgttctaa gaaacagggc tcagagtggc agtgtccctc agttcaagaa agttgttttc 2580
caggaattta ctgatggctc ctttactcag cccttatacc gtggagaact aaatgaacat 2640
ttgggactcc tggggccata tataagagca gaagttgaag ataatatcat ggtaactttc 2700
agaaatcagg cctctcgtcc ctattccttc tattctagcc ttatttctta tgaggaagat 2760
cagaggcaag gagcagaacc tagaaaaaac tttgtcaagc ctaatgaaac caaaacttac 2820
ttttggaaag tgcaacatca tatggcaccc actaaagatg agtttgactg caaagcctgg 2880
gcttatttct ctgatgttga cctggaaaaa gatgtgcact caggcctgat tggacccctt 2940
ctggtctgcc acactaacac actgaaccct gctcatggga gacaagtgac agtacaggaa 3000
tttgctctgt ttttcaccat ctttgatgag accaaaagct ggtacttcac tgaaaatatg 3060
gaaagaaact gcagggctcc ctgcaatatc cagatggaag atcccacttt taaagagaat 3120
tatcgcttcc atgcaatcaa tggctacata atggatacac tacctggctt agtaatggct 3180
caggatcaaa ggattcgatg gtatctgctc agcatgggca gcaatgaaaa catccattct 3240
attcatttca gtggacatgt gttcactgta cgaaaaaaag aggagtataa aatggcactg 3300
tacaatctct atccaggtgt ttttgagaca gtggaaatgt taccatccaa agctggaatt 3360
tggcgggtgg aatgccttat tggcgagcat ctacatgctg ggatgagcac actttttctg 3420
gtgtacagca ataagtgtca gactcccctg ggaatggctt ctggacacat tagagatttt 3480
cagattacag cttcaggaca atatggacag tgggccccaa agctggccag acttcattat 3540
tccggatcaa tcaatgcctg gagcaccaag gagccctttt cttggatcaa ggtggatctg 3600
ttggcaccaa tgattattca cggcatcaag acccagggtg cccgtcagaa gttctccagc 3660
ctctacatct ctcagtttat catcatgtat agtcttgatg ggaagaagtg gcagacttat 3720
cgaggaaatt ccactggaac cttaatggtc ttctttggca atgtggattc atctgggata 3780
aaacacaata tttttaaccc tccaattatt gctcgataca tccgtttgca cccaactcat 3840
tatagcattc gcagcactct tcgcatggag ttgatgggct gtgatttaaa tagttgcagc 3900
atgccattgg gaatggagag taaagcaata tcagatgcac agattactgc ttcatcctac 3960
tttaccaata tgtttgccac ctggtctcct tcaaaagctc gacttcacct ccaagggagg 4020
agtaatgcct ggagacctca ggtgaataat ccaaaagagt ggctgcaagt ggacttccag 4080
aagacaatga aagtcacagg agtaactact cagggagtaa aatctctgct taccagcatg 4140
tatgtgaagg agttcctcat ctccagcagt caagatggcc atcagtggac tctctttttt 4200
cagaatggca aagtaaaggt ttttcaggga aatcaagact ccttcacacc tgtggtgaac 4260
tctctagacc caccgttact gactcgctac cttcgaattc acccccagag ttgggtgcac 4320
cagattgccc tgaggatgga ggttctgggc tgcgaggcac aggacctcta ctga 4374
<210> 10
<211> 4374
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 10
atgcaaatag agctctccac ctgcttcttt ctgtgccttt tgcgattctg ctttagtgcc 60
accagaagat actacctggg tgcagtggaa ctgtcatggg actatatgca aagtgatctc 120
ggtgagctgc ctgtggacgc aagatttcct cctagagtgc caaaatcttt tccattcaac 180
acctcagtcg tgtacaaaaa gactctgttt gtagaattca cggatcacct tttcaacatc 240
gctaagccaa ggccaccctg gatgggtctg ctaggtccta ccatccaggc tgaggtttat 300
gatacagtgg tcattacact taagaacatg gcttcccatc ctgtcagtct tcatgctgtt 360
ggtgtatcct actggaaagc ttctgaggga gctgaatatg atgatcagac cagtcaaagg 420
gagaaagaag atgataaagt cttccctggt ggaagccata catatgtctg gcaggtcctg 480
aaagagaatg gtccaatggc ctctgaccca ctgtgcctta cctactcata tctttctcat 540
gtggacctgg taaaagactt gaattcaggc ctcattggag ccctactagt atgtagagaa 600
gggagtctgg ccaaggaaaa gacacagacc ttgcacaaat ttatactact ttttgctgta 660
tttgatgaag ggaaaagttg gcactcagaa acaaagaact ccttgatgca ggatagggat 720
gctgcatctg ctcgggcctg gcctaaaatg cacacagtca atggttatgt aaacaggtct 780
ctgccaggtc tgattggatg ccacaggaaa tcagtctatt ggcatgtgat tggaatgggc 840
accactcctg aagtgcactc aatattcctc gaaggtcaca catttcttgt gaggaaccat 900
cgccaggcgt ccttggaaat ctcgccaata actttcctta ctgctcaaac actcttgatg 960
gaccttggac agtttctact gttttgtcat atctcttccc accaacatga tggcatggaa 1020
gcttatgtca aagtagacag ctgtccagag gaaccccaac tacgaatgaa aaataatgaa 1080
gaagcggaag actatgatga tgatcttact gattctgaaa tggatgtggt caggtttgat 1140
gatgacaact ctccttcctt tatccaaatt cgctcagttg ccaagaagca tcctaaaact 1200
tgggtacatt acattgctgc tgaagaggag gactgggact atgctccctt agtcctcgcc 1260
cccgatgaca gaagttataa aagtcaatat ttgaacaatg gccctcagcg gattggtagg 1320
aagtacaaaa aagtccgatt tatggcatac acagatgaaa cctttaagac tcgtgaagct 1380
attcagcatg aatcaggaat cttgggacct ttactttatg gggaagttgg agacacactg 1440
ttgattatat ttaagaatca agcaagcaga ccatataaca tctaccctca cggaatcact 1500
gatgtccgtc ctttgtattc aaggagatta ccaaaaggtg taaaacattt gaaggatttt 1560
ccaattctgc caggagaaat attcaaatat aaatggacag tgactgtaga agatgggcca 1620
actaaatcag atcctcggtg cctgacccgc tattactcta gtttcgttaa tatggagaga 1680
gatctagctt caggactcat tggccctctc ctcatctgct acaaagaatc tgtagatcaa 1740
agaggaaacc agataatgtc agacaagagg aatgtcatcc tgttttctgt atttgatgag 1800
aaccgaagct ggtacctcac agagaatata caacgctttc tccccaatcc agctggagtg 1860
cagcttgagg atccagagtt ccaagcctcc aacatcatgc acagcatcaa tggctatgtt 1920
tttgatagtt tgcagttgtc agtttgtttg catgaggtgg catactggta cattctaagc 1980
attggagcac agactgactt cctttctgtc ttcttctctg gatatacctt caaacacaaa 2040
atggtctatg aagacacact caccctattc ccattctcag gagaaactgt cttcatgtcg 2100
atggaaaacc caggtctatg gattctgggg tgccacaact cagactttcg gaacagaggc 2160
atgaccgcct tactgaaggt ttctagttgt gacaagaaca ctggtgatta ttacgaggac 2220
agttatgaag atatttcagc atacttgctg agtaaaaaca atgccattga accaagaagc 2280
ttctcccaaa acccaccagt cttgaaagcc catcaagcgg aaataactcg tactactctt 2340
cagtcagatc aagaggaaat tgactatgat gataccatat cagttgaaat gaagaaggaa 2400
gattttgaca tttatgatga ggatgaaaat cagagccccc gcagctttca aaagaaaaca 2460
cgacactatt ttattgctgc agtggagagg ctctgggatt atgggatgag tagctcccca 2520
catgttctaa gaaacagggc tcagagtggc agtgtccctc agttcaagaa agttgttttc 2580
caggaattta ctgatggctc ctttactcag cccttatacc gtggagaact aaatgaacat 2640
ttgggactcc tggggccata tataagagca gaagttgaag ataatatcat ggtaactttc 2700
agaaatcagg cctctcgtcc ctattccttc tattctagcc ttatttctta tgaggaagat 2760
cagaggcaag gagcagaacc tagaaaaaac tttgtcaagc ctaatgaaac caaaacttac 2820
ttttggaaag tgcaacatca tatggcaccc actaaagatg agtttgactg caaagcctgg 2880
gcttatttct ctgatgttga cctggaaaaa gatgtgcact caggcctgat tggacccctt 2940
ctggtctgcc acactaacac actgaaccct gctcatggga gacaagtgac agtacaggaa 3000
tttgctctgt ttttcaccat ctttgatgag accaaaagct ggtacttcac tgaaaatatg 3060
gaaagaaact gcagggctcc ctgcaatatc cagatggaag atcccacttt taaagagaat 3120
tatcgcttcc atgcaatcaa tggctacata atggatacac tacctggctt agtaatggct 3180
caggatcaaa ggattcgatg gtatctgctc agcatgggca gcaatgaaaa catccattct 3240
attcatttca gtggacatgt gttcactgta cgaaaaaaag aggagtataa aatggcactg 3300
tacaatctct atccaggtgt ttttgagaca gtggaaatgt taccatccaa agctggaatt 3360
tggcgggtgg aatgccttat tggcgagcat ctacatgctg ggatgagcac actttttctg 3420
gtgtacagca ataagtgtca gactcccctg ggaatggctt ctggacacat tagagatttt 3480
cagattacag cttcaggaca atatggacag tgggccccaa agctggccag acttcattat 3540
tccggatcaa tcaatgcctg gagcaccaag gagccctttt cttggatcaa ggtggatctg 3600
ttggcaccaa tgattattca cggcatcaag acccagggtg cccgtcagaa gttctccagc 3660
ctctacatct ctcagtttat catcatgtat agtcttgatg ggaagaagtg gcagacttat 3720
cgaggaaatt ccactggaac cttaatggtc ttctttggca atgtggattc atctgggata 3780
aaacacaata tttttaaccc tccaattatt gctcgataca tccgtttgca cccaactcat 3840
tatagcattc gcagcactct tcgcatggag ttgatgggct gtgatttaaa tagttgcagc 3900
atgccattgg gaatggagag taaagcaata tcagatgcac agattactgc ttcatcctac 3960
tttaccaata tgtttgccac ctggtctcct tcaaaagctc gacttcacct ccaagggagg 4020
agtaatgcct ggagacctca ggtgaataat ccaaaagagt ggctgcaagt ggacttccag 4080
aagacaatga aagtcacagg agtaactact cagggagtaa aatctctgct taccagcatg 4140
tatgtgaagg agttcctcat ctccagcagt caagatggcc atcagtggac tctctttttt 4200
cagaatggca aagtaaaggt ttttcaggga aatcaagact ccttcacacc tgtggtgaac 4260
tctctagacc caccgttact gactcgctac cttcgaattc acccccagag ttgggtgcac 4320
cagattgccc tgaggatgga ggttctgggc tgcgaggcac aggacctcta ctga 4374
<210> 11
<211> 4362
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 11
atgcaaatag agctctccac ctgcttcttt ctgtgccttt tgcgattctg ctttagtgcc 60
accagaagat actacctggg tgcagtggaa ctgtcatggg actatatgca aagtgatctc 120
ggtgagctgc ctgtggacgc aagatttcct cctagagtgc caaaatcttt tccattcaac 180
acctcagtcg tgtacaaaaa gactctgttt gtagaattca cggatcacct tttcaacatc 240
gctaagccaa ggccaccctg gatgggtctg ctaggtccta ccatccaggc tgaggtttat 300
gatacagtgg tcattacact taagaacatg gcttcccatc ctgtcagtct tcatgctgtt 360
ggtgtatcct actggaaagc ttctgaggga gctgaatatg atgatcagac cagtcaaagg 420
gagaaagaag atgataaagt cttccctggt ggaagccata catatgtctg gcaggtcctg 480
aaagagaatg gtccaatggc ctctgaccca ctgtgcctta cctactcata tctttctcat 540
gtggacctgg taaaagactt gaattcaggc ctcattggag ccctactagt atgtagagaa 600
gggagtctgg ccaaggaaaa gacacagacc ttgcacaaat ttatactact ttttgctgta 660
tttgatgaag ggaaaagttg gcactcagaa acaaagaact ccttgatgca ggatagggat 720
gctgcatctg ctcgggcctg gcctaaaatg cacacagtca atggttatgt aaacaggtct 780
ctgccaggtc tgattggatg ccacaggaaa tcagtctatt ggcatgtgat tggaatgggc 840
accactcctg aagtgcactc aatattcctc gaaggtcaca catttcttgt gaggaaccat 900
cgccaggcgt ccttggaaat ctcgccaata actttcctta ctgctcaaac actcttgatg 960
gaccttggac agtttctact gttttgtcat atctcttccc accaacatga tggcatggaa 1020
gcttatgtca aagtagacag ctgtccagag gaaccccaac tacgaatgaa aaataatgaa 1080
gaagcggaag actatgatga tgatcttact gattctgaaa tggatgtggt caggtttgat 1140
gatgacaact ctccttcctt tatccaaatt cgctcagttg ccaagaagca tcctaaaact 1200
tgggtacatt acattgctgc tgaagaggag gactgggact atgctccctt agtcctcgcc 1260
cccgatgaca gaagttataa aagtcaatat ttgaacaatg gccctcagcg gattggtagg 1320
aagtacaaaa aagtccgatt tatggcatac acagatgaaa cctttaagac tcgtgaagct 1380
attcagcatg aatcaggaat cttgggacct ttactttatg gggaagttgg agacacactg 1440
ttgattatat ttaagaatca agcaagcaga ccatataaca tctaccctca cggaatcact 1500
gatgtccgtc ctttgtattc aaggagatta ccaaaaggtg taaaacattt gaaggatttt 1560
ccaattctgc caggagaaat attcaaatat aaatggacag tgactgtaga agatgggcca 1620
actaaatcag atcctcggtg cctgacccgc tattactcta gtttcgttaa tatggagaga 1680
gatctagctt caggactcat tggccctctc ctcatctgct acaaagaatc tgtagatcaa 1740
agaggaaacc agataatgtc agacaagagg aatgtcatcc tgttttctgt atttgatgag 1800
aaccgaagct ggtacctcac agagaatata caacgctttc tccccaatcc agctggagtg 1860
cagcttgagg atccagagtt ccaagcctcc aacatcatgc acagcatcaa tggctatgtt 1920
tttgatagtt tgcagttgtc agtttgtttg catgaggtgg catactggta cattctaagc 1980
attggagcac agactgactt cctttctgtc ttcttctctg gatatacctt caaacacaaa 2040
atggtctatg aagacacact caccctattc ccattctcag gagaaactgt cttcatgtcg 2100
atggaaaacc caggtctatg gattctgggg tgccacaact cagactttcg gaacagaggc 2160
atgaccgcct tactgaaggt ttctagttgt gacaagaaca ctggtgatta ttacgaggac 2220
agttatgaag atatttcagc atacttgctg agtaaaaaca atgccattga accaagaagc 2280
ttctcccaaa acccaccagt cttgaaagaa ataactcgta ctactcttca gtcagatcaa 2340
gaggaaattg actatgatga taccatatca gttgaaatga agaaggaaga ttttgacatt 2400
tatgatgagg atgaaaatca gagcccccgc agctttcaaa agaaaacacg acactatttt 2460
attgctgcag tggagaggct ctgggattat gggatgagta gctccccaca tgttctaaga 2520
aacagggctc agagtggcag tgtccctcag ttcaagaaag ttgttttcca ggaatttact 2580
gatggctcct ttactcagcc cttataccgt ggagaactaa atgaacattt gggactcctg 2640
gggccatata taagagcaga agttgaagat aatatcatgg taactttcag aaatcaggcc 2700
tctcgtccct attccttcta ttctagcctt atttcttatg aggaagatca gaggcaagga 2760
gcagaaccta gaaaaaactt tgtcaagcct aatgaaacca aaacttactt ttggaaagtg 2820
caacatcata tggcacccac taaagatgag tttgactgca aagcctgggc ttatttctct 2880
gatgttgacc tggaaaaaga tgtgcactca ggcctgattg gaccccttct ggtctgccac 2940
actaacacac tgaaccctgc tcatgggaga caagtgacag tacaggaatt tgctctgttt 3000
ttcaccatct ttgatgagac caaaagctgg tacttcactg aaaatatgga aagaaactgc 3060
agggctccct gcaatatcca gatggaagat cccactttta aagagaatta tcgcttccat 3120
gcaatcaatg gctacataat ggatacacta cctggcttag taatggctca ggatcaaagg 3180
attcgatggt atctgctcag catgggcagc aatgaaaaca tccattctat tcatttcagt 3240
ggacatgtgt tcactgtacg aaaaaaagag gagtataaaa tggcactgta caatctctat 3300
ccaggtgttt ttgagacagt ggaaatgtta ccatccaaag ctggaatttg gcgggtggaa 3360
tgccttattg gcgagcatct acatgctggg atgagcacac tttttctggt gtacagcaat 3420
aagtgtcaga ctcccctggg aatggcttct ggacacatta gagattttca gattacagct 3480
tcaggacaat atggacagtg ggccccaaag ctggccagac ttcattattc cggatcaatc 3540
aatgcctgga gcaccaagga gcccttttct tggatcaagg tggatctgtt ggcaccaatg 3600
attattcacg gcatcaagac ccagggtgcc cgtcagaagt tctccagcct ctacatctct 3660
cagtttatca tcatgtatag tcttgatggg aagaagtggc agacttatcg aggaaattcc 3720
actggaacct taatggtctt ctttggcaat gtggattcat ctgggataaa acacaatatt 3780
tttaaccctc caattattgc tcgatacatc cgtttgcacc caactcatta tagcattcgc 3840
agcactcttc gcatggagtt gatgggctgt gatttaaata gttgcagcat gccattggga 3900
atggagagta aagcaatatc agatgcacag attactgctt catcctactt taccaatatg 3960
tttgccacct ggtctccttc aaaagctcga cttcacctcc aagggaggag taatgcctgg 4020
agacctcagg tgaataatcc aaaagagtgg ctgcaagtgg acttccagaa gacaatgaaa 4080
gtcacaggag taactactca gggagtaaaa tctctgctta ccagcatgta tgtgaaggag 4140
ttcctcatct ccagcagtca agatggccat cagtggactc tcttttttca gaatggcaaa 4200
gtaaaggttt ttcagggaaa tcaagactcc ttcacacctg tggtgaactc tctagaccca 4260
ccgttactga ctcgctacct tcgaattcac ccccagagtt gggtgcacca gattgccctg 4320
aggatggagg ttctgggctg cgaggcacag gacctctact ga 4362
<210> 12
<211> 4365
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 12
atgcaaatag agctctccac ctgcttcttt ctgtgccttt tgcgattctg ctttagtgcc 60
accagaagat actacctggg tgcagtggaa ctgtcatggg actatatgca aagtgatctc 120
ggtgagctgc ctgtggacgc aagatttcct cctagagtgc caaaatcttt tccattcaac 180
acctcagtcg tgtacaaaaa gactctgttt gtagaattca cggatcacct tttcaacatc 240
gctaagccaa ggccaccctg gatgggtctg ctaggtccta ccatccaggc tgaggtttat 300
gatacagtgg tcattacact taagaacatg gcttcccatc ctgtcagtct tcatgctgtt 360
ggtgtatcct actggaaagc ttctgaggga gctgaatatg atgatcagac cagtcaaagg 420
gagaaagaag atgataaagt cttccctggt ggaagccata catatgtctg gcaggtcctg 480
aaagagaatg gtccaatggc ctctgaccca ctgtgcctta cctactcata tctttctcat 540
gtggacctgg taaaagactt gaattcaggc ctcattggag ccctactagt atgtagagaa 600
gggagtctgg ccaaggaaaa gacacagacc ttgcacaaat ttatactact ttttgctgta 660
tttgatgaag ggaaaagttg gcactcagaa acaaagaact ccttgatgca ggatagggat 720
gctgcatctg ctcgggcctg gcctaaaatg cacacagtca atggttatgt aaacaggtct 780
ctgccaggtc tgattggatg ccacaggaaa tcagtctatt ggcatgtgat tggaatgggc 840
accactcctg aagtgcactc aatattcctc gaaggtcaca catttcttgt gaggaaccat 900
cgccaggcgt ccttggaaat ctcgccaata actttcctta ctgctcaaac actcttgatg 960
gaccttggac agtttctact gttttgtcat atctcttccc accaacatga tggcatggaa 1020
gcttatgtca aagtagacag ctgtccagag gaaccccaac tacgaatgaa aaataatgaa 1080
gaagcggaag actatgatga tgatcttact gattctgaaa tggatgtggt caggtttgat 1140
gatgacaact ctccttcctt tatccaaatt cgctcagttg ccaagaagca tcctaaaact 1200
tgggtacatt acattgctgc tgaagaggag gactgggact atgctccctt agtcctcgcc 1260
cccgatgaca gaagttataa aagtcaatat ttgaacaatg gccctcagcg gattggtagg 1320
aagtacaaaa aagtccgatt tatggcatac acagatgaaa cctttaagac tcgtgaagct 1380
attcagcatg aatcaggaat cttgggacct ttactttatg gggaagttgg agacacactg 1440
ttgattatat ttaagaatca agcaagcaga ccatataaca tctaccctca cggaatcact 1500
gatgtccgtc ctttgtattc aaggagatta ccaaaaggtg taaaacattt gaaggatttt 1560
ccaattctgc caggagaaat attcaaatat aaatggacag tgactgtaga agatgggcca 1620
actaaatcag atcctcggtg cctgacccgc tattactcta gtttcgttaa tatggagaga 1680
gatctagctt caggactcat tggccctctc ctcatctgct acaaagaatc tgtagatcaa 1740
agaggaaacc agataatgtc agacaagagg aatgtcatcc tgttttctgt atttgatgag 1800
aaccgaagct ggtacctcac agagaatata caacgctttc tccccaatcc agctggagtg 1860
cagcttgagg atccagagtt ccaagcctcc aacatcatgc acagcatcaa tggctatgtt 1920
tttgatagtt tgcagttgtc agtttgtttg catgaggtgg catactggta cattctaagc 1980
attggagcac agactgactt cctttctgtc ttcttctctg gatatacctt caaacacaaa 2040
atggtctatg aagacacact caccctattc ccattctcag gagaaactgt cttcatgtcg 2100
atggaaaacc caggtctatg gattctgggg tgccacaact cagactttcg gaacagaggc 2160
atgaccgcct tactgaaggt ttctagttgt gacaagaaca ctggtgatta ttacgaggac 2220
agttatgaag atatttcagc atacttgctg agtaaaaaca atgccattga accaagaagc 2280
ttctcccaaa acccaccagt cttgaaacgc gaaataactc gtactactct tcagtcagat 2340
caagaggaaa ttgactatga tgataccata tcagttgaaa tgaagaagga agattttgac 2400
atttatgatg aggatgaaaa tcagagcccc cgcagctttc aaaagaaaac acgacactat 2460
tttattgctg cagtggagag gctctgggat tatgggatga gtagctcccc acatgttcta 2520
agaaacaggg ctcagagtgg cagtgtccct cagttcaaga aagttgtttt ccaggaattt 2580
actgatggct cctttactca gcccttatac cgtggagaac taaatgaaca tttgggactc 2640
ctggggccat atataagagc agaagttgaa gataatatca tggtaacttt cagaaatcag 2700
gcctctcgtc cctattcctt ctattctagc cttatttctt atgaggaaga tcagaggcaa 2760
ggagcagaac ctagaaaaaa ctttgtcaag cctaatgaaa ccaaaactta cttttggaaa 2820
gtgcaacatc atatggcacc cactaaagat gagtttgact gcaaagcctg ggcttatttc 2880
tctgatgttg acctggaaaa agatgtgcac tcaggcctga ttggacccct tctggtctgc 2940
cacactaaca cactgaaccc tgctcatggg agacaagtga cagtacagga atttgctctg 3000
tttttcacca tctttgatga gaccaaaagc tggtacttca ctgaaaatat ggaaagaaac 3060
tgcagggctc cctgcaatat ccagatggaa gatcccactt ttaaagagaa ttatcgcttc 3120
catgcaatca atggctacat aatggataca ctacctggct tagtaatggc tcaggatcaa 3180
aggattcgat ggtatctgct cagcatgggc agcaatgaaa acatccattc tattcatttc 3240
agtggacatg tgttcactgt acgaaaaaaa gaggagtata aaatggcact gtacaatctc 3300
tatccaggtg tttttgagac agtggaaatg ttaccatcca aagctggaat ttggcgggtg 3360
gaatgcctta ttggcgagca tctacatgct gggatgagca cactttttct ggtgtacagc 3420
aataagtgtc agactcccct gggaatggct tctggacaca ttagagattt tcagattaca 3480
gcttcaggac aatatggaca gtgggcccca aagctggcca gacttcatta ttccggatca 3540
atcaatgcct ggagcaccaa ggagcccttt tcttggatca aggtggatct gttggcacca 3600
atgattattc acggcatcaa gacccagggt gcccgtcaga agttctccag cctctacatc 3660
tctcagttta tcatcatgta tagtcttgat gggaagaagt ggcagactta tcgaggaaat 3720
tccactggaa ccttaatggt cttctttggc aatgtggatt catctgggat aaaacacaat 3780
atttttaacc ctccaattat tgctcgatac atccgtttgc acccaactca ttatagcatt 3840
cgcagcactc ttcgcatgga gttgatgggc tgtgatttaa atagttgcag catgccattg 3900
ggaatggaga gtaaagcaat atcagatgca cagattactg cttcatccta ctttaccaat 3960
atgtttgcca cctggtctcc ttcaaaagct cgacttcacc tccaagggag gagtaatgcc 4020
tggagacctc aggtgaataa tccaaaagag tggctgcaag tggacttcca gaagacaatg 4080
aaagtcacag gagtaactac tcagggagta aaatctctgc ttaccagcat gtatgtgaag 4140
gagttcctca tctccagcag tcaagatggc catcagtgga ctctcttttt tcagaatggc 4200
aaagtaaagg tttttcaggg aaatcaagac tccttcacac ctgtggtgaa ctctctagac 4260
ccaccgttac tgactcgcta ccttcgaatt cacccccaga gttgggtgca ccagattgcc 4320
ctgaggatgg aggttctggg ctgcgaggca caggacctct actga 4365
<210> 13
<211> 4374
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 13
atgcagatcg agctgtctac ctgcttcttc ctgtgcctgc tgcggttctg cttcagcgcc 60
accagaagat attacctggg cgccgtggaa ctgagctggg actacatgca gtctgacctg 120
ggagagctgc ccgtggacgc tagatttcct ccaagagtgc ccaagagctt ccccttcaac 180
acctccgtgg tgtacaagaa aaccctgttc gtggaattca ccgaccacct gttcaatatc 240
gccaagcctc ggcctccttg gatgggactg ctgggaccta caattcaggc cgaggtgtac 300
gacaccgtgg tcatcaccct gaagaacatg gccagccatc ctgtgtctct gcacgccgtg 360
ggagtgtctt actggaaggc ttctgagggc gccgagtacg acgatcagac aagccagaga 420
gagaaagagg acgacaaggt tttccctggc ggcagccaca cctatgtctg gcaggtcctg 480
aaagaaaacg gccctatggc ctccgatcct ctgtgcctga catacagcta cctgagccac 540
gtggacctgg tcaaggacct gaattctggc ctgatcggag ccctgctcgt gtgtagagaa 600
ggcagcctgg ccaaagagaa aacccagaca ctgcacaagt tcatcctgct gttcgccgtg 660
ttcgacgagg gcaagagctg gcacagcgag acaaagaaca gcctgatgca ggacagggat 720
gccgcctctg ctagagcttg gcctaagatg cacaccgtga acggctacgt gaacagaagc 780
ctgcctggac tgatcggctg ccacagaaag tccgtgtact ggcacgtgat cggcatgggc 840
acaacacctg aggtgcacag catctttctg gaaggacaca ccttcctcgt gcggaaccat 900
agacaggcca gcctggaaat cagccctatc accttcctga ccgctcagac cctgctgatg 960
gatctgggcc agtttctgct gttctgccac atcagctccc accagcacga tggcatggaa 1020
gcctacgtga aggtggacag ctgccccgaa gaaccccagc tgcggatgaa gaacaacgag 1080
gaagccgagg actacgacga cgacctgacc gactctgaga tggacgtcgt cagattcgac 1140
gacgataaca gccccagctt catccagatc agaagcgtgg ccaagaagca ccccaagacc 1200
tgggtgcact atatcgccgc cgaggaagag gactgggatt acgctcctct ggtgctggcc 1260
cctgacgaca gaagctacaa gagccagtac ctgaacaacg gccctcagcg gatcggccgg 1320
aagtataaga aagtgcggtt catggcctac accgacgaga cattcaagac cagagaggcc 1380
atccagcacg agagcggaat tctgggccct ctgctgtatg gcgaagtggg cgatacactg 1440
ctgatcatct tcaagaacca ggccagcaga ccctacaaca tctaccctca cggcatcacc 1500
gatgtgcggc ccctgtattc tagaaggctg cccaagggcg tgaagcacct gaaggacttc 1560
cctatcctgc ctggcgagat cttcaagtac aagtggaccg tgaccgtgga agatggcccc 1620
accaagagcg accctagatg tctgacacgg tactacagca gcttcgtgaa catggaacgc 1680
gacctggcca gcggcctgat tggacctctg ctgatctgct acaaagaaag cgtggaccag 1740
cggggcaacc agatcatgag cgacaagcgg aacgtgatcc tgtttagcgt gttcgatgag 1800
aaccggtcct ggtatctgac cgagaacatc cagcggtttc tgcccaatcc tgctggcgtg 1860
cagctggaag atcctgagtt ccaggcctcc aacatcatgc actccatcaa tggctatgtg 1920
ttcgacagcc tgcagctgag cgtgtgcctg cacgaagtgg cctactggta catcctgagc 1980
attggcgccc agaccgactt cctgtccgtg ttctttagcg gctacacctt caagcacaag 2040
atggtgtacg aggataccct gacactgttc ccattcagcg gcgagacagt gttcatgagc 2100
atggaaaacc ccggcctgtg gatcctgggc tgtcacaaca gcgacttccg gaacagaggc 2160
atgacagccc tgctgaaggt gtccagctgc gacaagaaca ccggcgacta ctacgaggac 2220
agctatgagg acatcagcgc ctacctgctg agcaagaaca atgccatcga gcctcggagc 2280
ttcagccaga atcctcctgt gctgaagcgg caccagcgcg agatcaccag aacaaccctg 2340
cagagcgacc aagaggaaat cgattacgac gacaccatca gcgtcgagat gaagaaagaa 2400
gatttcgaca tctacgacga ggacgagaat cagagcccca gaagctttca gaaaaagacc 2460
cggcactact tcattgccgc cgtcgagaga ctgtgggact acggcatgtc tagcagccct 2520
cacgtgctga gaaatagagc ccagagcggc agcgtgcccc agttcaagaa agtggtgttc 2580
caagagttca ccgacggcag cttcacccag ccactgtata gaggcgagct gaacgagcat 2640
ctgggcctgc tgggccctta tatcagagcc gaagtggaag ataacatcat ggtcaccttc 2700
cggaatcagg cctctcggcc ctacagcttc tacagctccc tgatcagcta cgaagaggac 2760
cagagacagg gcgctgagcc cagaaagaac ttcgtgaagc ccaacgagac taagacctac 2820
ttttggaagg tgcagcacca catggcccct acaaaggacg agttcgactg caaggcctgg 2880
gcctactttt ccgatgtgga tctggaaaag gacgtgcaca gcgggctcat cggaccactg 2940
cttgtgtgcc acaccaacac actgaacccc gctcacggca gacaagtgac agtgcaagag 3000
ttcgccctgt tcttcaccat cttcgacgaa acaaagagct ggtacttcac cgagaatatg 3060
gaacggaact gcagagcccc ttgcaacatc cagatggaag atcccacctt caaagagaac 3120
taccggttcc acgccatcaa cggctacatc atggacacac tgcccggcct ggttatggct 3180
caggatcaga gaatccggtg gtatctgctg tccatgggct ccaacgagaa tatccacagc 3240
atccacttca gcggccacgt gttcaccgtg cggaaaaaag aagagtacaa aatggccctg 3300
tacaatctgt accctggggt gttcgaaacc gtggaaatgc tgccttccaa ggccggcatt 3360
tggagagtgg aatgtctgat tggagagcac ctccacgccg gaatgagcac cctgtttctg 3420
gtgtacagca acaagtgtca gacccctctc ggcatggcct ctggacacat cagagacttc 3480
cagatcaccg cctctggcca gtacggacag tgggctccta aactggctcg gctgcactac 3540
agcggcagca tcaatgcctg gtccaccaaa gagcccttca gctggatcaa ggtggacctg 3600
ctggctccca tgatcatcca cggaatcaag acccagggcg ccagacagaa gttcagcagc 3660
ctgtacatca gccagttcat catcatgtac agcctggacg gcaagaagtg gcagacctac 3720
agaggcaaca gcaccggcac actcatggtg ttcttcggca acgtggactc cagcggcatt 3780
aagcacaaca tcttcaaccc tccaatcatt gcccggtaca tccggctgca ccccacacac 3840
tacagcatcc ggtctaccct gagaatggaa ctgatgggct gcgacctgaa cagctgcagc 3900
atgcccctcg gaatggaaag caaggccatc agcgacgccc agatcacagc cagcagctac 3960
ttcaccaaca tgttcgccac ttggagcccc tccaaggcta gactgcatct gcagggcaga 4020
agcaacgctt ggaggcccca agtgaacaac cccaaagagt ggctgcaggt cgactttcaa 4080
aagaccatga aagtgaccgg cgtgaccaca cagggcgtca agtctctgct gacctctatg 4140
tacgtgaaag agttcctgat ctccagcagc caggacggcc atcagtggac cctgtttttc 4200
cagaacggca aagtgaaagt gttccagggc aatcaggaca gcttcacacc cgtggtcaac 4260
tccctggatc ctccactgct gaccagatac ctgcggattc accctcagtc ttgggtgcac 4320
cagatcgctc tgcggatgga agtgctgggc tgtgaagctc aggacctcta ctga 4374
<210> 14
<211> 4374
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 14
atgcagatcg agctgagcac ctgcttcttc ctgtgcctgc tgcgcttctg cttcagcgcc 60
acccgccgct actacctggg cgccgtggag ctgagctggg actacatgca gagcgacctg 120
ggcgagctgc ccgtggacgc ccgcttcccc ccccgcgtgc ccaagagctt ccccttcaac 180
accagcgtgg tgtacaagaa gaccctgttc gtggagttca ccgaccacct gttcaacatc 240
gccaagcccc gccccccctg gatgggcctg ctgggcccca ccatccaggc cgaggtgtac 300
gacaccgtgg tgatcaccct gaagaacatg gccagccacc ccgtgagcct gcacgccgtg 360
ggcgtgagct actggaaggc cagcgagggc gccgagtacg acgaccagac cagccagcgc 420
gagaaggagg acgacaaggt gttccccggc ggcagccaca cctacgtgtg gcaggtgctg 480
aaggagaacg gccccatggc cagcgacccc ctgtgcctga cctacagcta cctgagccac 540
gtggacctgg tgaaggacct gaacagcggc ctgatcggcg ccctgctggt gtgccgcgag 600
ggcagcctgg ccaaggagaa gacccagacc ctgcacaagt tcatcctgct gttcgccgtg 660
ttcgacgagg gcaagagctg gcacagcgag accaagaaca gcctgatgca ggaccgcgac 720
gccgccagcg cccgcgcctg gcccaagatg cacaccgtga acggctacgt gaaccgcagc 780
ctgcccggcc tgatcggctg ccaccgcaag agcgtgtact ggcacgtgat cggcatgggc 840
accacccccg aggtgcacag catcttcctg gagggccaca ccttcctggt gcgcaaccac 900
cgccaggcca gcctggagat cagccccatc accttcctga ccgcccagac cctgctgatg 960
gacctgggcc agttcctgct gttctgccac atcagcagcc accagcacga cggcatggag 1020
gcctacgtga aggtggacag ctgccccgag gagccccagc tgcgcatgaa gaacaacgag 1080
gaggccgagg actacgacga cgacctgacc gacagcgaga tggacgtggt gcgcttcgac 1140
gacgacaaca gccccagctt catccagatc cgcagcgtgg ccaagaagca ccccaagacc 1200
tgggtgcact acatcgccgc cgaggaggag gactgggact acgcccccct ggtgctggcc 1260
cccgacgacc gcagctacaa gagccagtac ctgaacaacg gcccccagcg catcggccgc 1320
aagtacaaga aggtgcgctt catggcctac accgacgaga ccttcaagac ccgcgaggcc 1380
atccagcacg agagcggcat cctgggcccc ctgctgtacg gcgaggtggg cgacaccctg 1440
ctgatcatct tcaagaacca ggccagccgc ccctacaaca tctaccccca cggcatcacc 1500
gacgtgcgcc ccctgtacag ccgccgcctg cccaagggcg tgaagcacct gaaggacttc 1560
cccatcctgc ccggcgagat cttcaagtac aagtggaccg tgaccgtgga ggacggcccc 1620
accaagagcg acccccgctg cctgacccgc tactacagca gcttcgtgaa catggagcgc 1680
gacctggcca gcggcctgat cggccccctg ctgatctgct acaaggagag cgtggaccag 1740
cgcggcaacc agatcatgag cgacaagcgc aacgtgatcc tgttcagcgt gttcgacgag 1800
aaccgcagct ggtacctgac cgagaacatc cagcgcttcc tgcccaaccc cgccggcgtg 1860
cagctggagg accccgagtt ccaggccagc aacatcatgc acagcatcaa cggctacgtg 1920
ttcgacagcc tgcagctgag cgtgtgcctg cacgaggtgg cctactggta catcctgagc 1980
atcggcgccc agaccgactt cctgagcgtg ttcttcagcg gctacacctt caagcacaag 2040
atggtgtacg aggacaccct gaccctgttc cccttcagcg gcgagaccgt gttcatgagc 2100
atggagaacc ccggcctgtg gatcctgggc tgccacaaca gcgacttccg caaccgcggc 2160
atgaccgccc tgctgaaggt gagcagctgc gacaagaaca ccggcgacta ctacgaggac 2220
agctacgagg acatcagcgc ctacctgctg agcaagaaca acgccatcga gccccgcagc 2280
ttcagccaga acccccccgt gctgaagcgc caccagcgcg agatcacccg caccaccctg 2340
cagagcgacc aggaggagat cgactacgac gacaccatca gcgtggagat gaagaaggag 2400
gacttcgaca tctacgacga ggacgagaac cagagccccc gcagcttcca gaagaagacc 2460
cgccactact tcatcgccgc cgtggagcgc ctgtgggact acggcatgag cagcagcccc 2520
cacgtgctgc gcaaccgcgc ccagagcggc agcgtgcccc agttcaagaa ggtggtgttc 2580
caggagttca ccgacggcag cttcacccag cccctgtacc gcggcgagct gaacgagcac 2640
ctgggcctgc tgggccccta catccgcgcc gaggtggagg acaacatcat ggtgaccttc 2700
cgcaaccagg ccagccgccc ctacagcttc tacagcagcc tgatcagcta cgaggaggac 2760
cagcgccagg gcgccgagcc ccgcaagaac ttcgtgaagc ccaacgagac caagacctac 2820
ttctggaagg tgcagcacca catggccccc accaaggacg agttcgactg caaggcctgg 2880
gcctacttca gcgacgtgga cctggagaag gacgtgcaca gcggcctgat cggccccctg 2940
ctggtgtgcc acaccaacac cctgaacccc gcccacggcc gccaggtgac cgtgcaggag 3000
ttcgccctgt tcttcaccat cttcgacgag accaagagct ggtacttcac cgagaacatg 3060
gagcgcaact gccgcgcccc ctgcaacatc cagatggagg accccacctt caaggagaac 3120
taccgcttcc acgccatcaa cggctacatc atggacaccc tgcccggcct ggtgatggcc 3180
caggaccagc gcatccgctg gtacctgctg agcatgggca gcaacgagaa catccacagc 3240
atccacttca gcggccacgt gttcaccgtg cgcaagaagg aggagtacaa gatggccctg 3300
tacaacctgt accccggcgt gttcgagacc gtggagatgc tgcccagcaa ggccggcatc 3360
tggcgcgtgg agtgcctgat cggcgagcac ctgcacgccg gcatgagcac cctgttcctg 3420
gtgtacagca acaagtgcca gacccccctg ggcatggcca gcggccacat ccgcgacttc 3480
cagatcaccg ccagcggcca gtacggccag tgggccccca agctggcccg cctgcactac 3540
agcggcagca tcaacgcctg gagcaccaag gagcccttca gctggatcaa ggtggacctg 3600
ctggccccca tgatcatcca cggcatcaag acccagggcg cccgccagaa gttcagcagc 3660
ctgtacatca gccagttcat catcatgtac agcctggacg gcaagaagtg gcagacctac 3720
cgcggcaaca gcaccggcac cctgatggtg ttcttcggca acgtggacag cagcggcatc 3780
aagcacaaca tcttcaaccc ccccatcatc gcccgctaca tccgcctgca ccccacccac 3840
tacagcatcc gcagcaccct gcgcatggag ctgatgggct gcgacctgaa cagctgcagc 3900
atgcccctgg gcatggagag caaggccatc agcgacgccc agatcaccgc cagcagctac 3960
ttcaccaaca tgttcgccac ctggagcccc agcaaggccc gcctgcacct gcagggccgc 4020
agcaacgcct ggcgccccca ggtgaacaac cccaaggagt ggctgcaggt ggacttccag 4080
aagaccatga aggtgaccgg cgtgaccacc cagggcgtga agagcctgct gaccagcatg 4140
tacgtgaagg agttcctgat cagcagcagc caggacggcc accagtggac cctgttcttc 4200
cagaacggca aggtgaaggt gttccagggc aaccaggaca gcttcacccc cgtggtgaac 4260
agcctggacc cccccctgct gacccgctac ctgcgcatcc acccccagag ctgggtgcac 4320
cagatcgccc tgcgcatgga ggtgctgggc tgcgaggccc aggacctgta ctga 4374
<210> 15
<211> 4374
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 15
atgcagattg agctgagcac ctgtttcttc ctgtgcctgc tgagattttg cttctcagct 60
acccgcaggt actacctggg agccgttgag ctgtcctggg attacatgca gtcagatctg 120
ggggagctgc ctgtggacgc tcggtttccc cccagagtgc caaagtcctt tcccttcaac 180
accagcgtgg tgtacaaaaa gacacttttt gttgaattta ctgaccactt gttcaacatc 240
gccaagccac gacccccatg gatgggcctg ctggggccaa ccattcaggc agaggtttac 300
gacacagtcg tgatcacact gaagaacatg gcctcccatc cagtgtctct gcacgccgtc 360
ggtgtgtcct actggaaagc atccgagggc gccgagtatg acgaccagac cagccagaga 420
gagaaagagg acgacaaagt gttccctgga ggcagccaca cctacgtgtg gcaggtgttg 480
aaggaaaatg ggcccatggc cagtgaccct ttgtgtctga cttactcata cctgtctcat 540
gtggatctag tcaaggacct gaattctgga ctgattgggg cactgcttgt gtgccgcgaa 600
ggcagcctgg ccaaagaaaa gacacagacc cttcacaagt tcatcctgct gttcgccgtg 660
ttcgacgaag gcaaatcctg gcactcagaa accaaaaact cactgatgca ggaccgggat 720
gccgcctctg cccgcgcatg gccaaaaatg cacaccgtca acggctatgt caatagaagt 780
ttgcccggcc tcattggatg tcacaggaaa agcgtctatt ggcatgtaat cgggatggga 840
accacacctg aggtccacag catatttctg gaaggccaca catttctggt gagaaatcat 900
cgccaggctt ccctggaaat ttcccccatc accttcttga ccgcccagac actgctcatg 960
gatcttgggc agtttctgct gttttgtcat atttcttctc accaacacga cggaatggag 1020
gcctacgtta aggtcgatag ttgccctgaa gaacctcagc tgaggatgaa gaacaacgag 1080
gaagccgagg actacgatga cgatttgacc gattccgaaa tggacgtggt gcgctttgat 1140
gatgacaatt ctccatcctt cattcagatt agatccgtcg ccaagaagca ccccaagacc 1200
tgggtgcact acattgcagc cgaggaggag gattgggact acgcccccct ggtgctggca 1260
cccgacgacc gaagctacaa atctcagtac ctgaacaatg gtccacaacg gatcggcagg 1320
aagtacaaga aagtgcggtt catggcctat acagacgaaa ccttcaaaac cagggaggct 1380
atccagcacg agtctgggat tctgggacca ctcctgtacg gcgaagtggg cgacaccttg 1440
ttaattatct tcaagaacca ggctagtaga ccttataaca tttatcccca cggcattacc 1500
gatgtgcggc ctctctactc taggcggctt ccaaaggggg tgaaacacct gaaggacttt 1560
cccatcctcc ctggcgaaat ctttaagtat aagtggacag tgaccgtgga ggatggacca 1620
accaagagcg accccaggtg cctgacacgc tattattcaa gcttcgtgaa tatggaaagg 1680
gacctcgcat ctggcttgat cggccctctg ctgatatgtt acaaggaaag cgtcgatcag 1740
agaggaaatc agatcatgtc agacaaaagg aatgtgatcc tgttctccgt cttcgatgaa 1800
aacaggagct ggtatctgac agagaacatc cagagattcc tgccaaatcc cgccggcgtc 1860
cagctggagg acccggagtt tcaggcatct aacatcatgc attccattaa tggttacgtg 1920
ttcgactccc tgcagctgag cgtgtgcctc cacgaggtgg cctactggta catcttgagc 1980
atcggcgccc agaccgactt tctgagcgtc tttttctccg ggtatacttt caaacataag 2040
atggtgtacg aagatactct gacgctgttc cctttctctg gggagactgt gtttatgtct 2100
atggagaacc ctggactgtg gattctcgga tgccacaaca gtgactttcg taatagaggg 2160
atgactgcac tgctgaaggt gtccagctgt gataaaaata ctggcgacta ctacgaagat 2220
agctatgagg atatctcagc atacctgctg agcaagaata acgccatcga gccccgaagc 2280
ttctcacaga atccccctgt cctcaagagg caccagcgag agatcacaag gaccacactc 2340
cagtccgacc aggaggagat tgactacgat gacacgattt ctgtggagat gaaaaaagag 2400
gactttgaca tctacgatga ggatgaaaac cagagcccta ggtcgttcca gaagaaaaca 2460
aggcactact tcattgccgc cgtggagaga ctgtgggact acggaatgag tagttcccca 2520
cacgtgttgc ggaacagagc ccagagtggg tccgtcccac agttcaagaa ggttgttttc 2580
caggagttca cagatggctc cttcactcag ccactgtatc gcggcgagct gaatgagcac 2640
ttgggcttat tgggccccta cattcgcgca gaagtcgaag ataatattat ggtgaccttc 2700
cgcaaccagg ccagccggcc ttactcattc tactcctctc tcatctctta tgaggaggat 2760
cagcgccagg gcgccgaacc ccggaagaac tttgtgaagc ccaatgaaac caaaacttac 2820
ttttggaagg tgcagcacca tatggcgccg acgaaagacg aatttgactg caaagcctgg 2880
gcctacttca gcgacgtcga cttggagaag gacgtccaca gcggcctgat tggccctttg 2940
ttggtctgcc ataccaatac actcaaccct gcccacggga ggcaggtgac cgtgcaggag 3000
tttgccttgt tcttcaccat cttcgacgaa accaagagct ggtacttcac agagaacatg 3060
gagaggaact gcagagcacc ctgtaacatc cagatggagg accctacttt caaggaaaat 3120
tacaggttcc atgccattaa tggctacatc atggataccc tccccgggct tgtgatggct 3180
caggaccagc gcatccgctg gtacctgctc tcaatgggct ccaacgagaa cattcatagc 3240
atccacttta gtggccacgt gtttaccgtg cgcaagaagg aggagtacaa gatggcactg 3300
tacaacctgt accctggcgt gtttgagaca gtggagatgc tgccatccaa ggccggcatc 3360
tggcgcgtgg agtgcctcat tggggagcac ctccatgctg gcatgtctac actgttcctg 3420
gtgtacagca acaagtgtca gactccactc ggaatggcct ccgggcatat ccgcgatttt 3480
cagatcacgg cctctggcca gtatggccaa tgggctccca agctggccag gctgcactac 3540
agtgggagta tcaacgcttg gagcaccaag gagcctttct cctggatcaa ggtggacctg 3600
cttgccccca tgattattca cggcattaag acacaggggg ccaggcagaa attctcctcc 3660
ctgtacatct cccagttcat catcatgtac agtctggacg gcaaaaagtg gcagacctac 3720
cgcgggaaca gtaccgggac attgatggtg ttcttcggga acgtggactc tagcggcatt 3780
aaacacaaca ttttcaaccc ccccatcatt gctaggtata tcaggctcca tcccacccac 3840
tatagcatca ggtccactct gcggatggag ctgatgggct gcgaccttaa ttcatgcagc 3900
atgccgctgg gcatggagtc aaaggccatc tccgacgccc aaatcaccgc ctccagctac 3960
ttcaccaata tgttcgccac ctggagcccc agcaaggccc ggctgcacct gcagggccgc 4020
agcaacgcct ggcggcctca ggtgaacaac cccaaggagt ggctgcaggt ggacttccag 4080
aaaaccatga aggtgactgg ggtcaccacc cagggagtca agagcctgct gaccagcatg 4140
tatgtgaagg agttcttgat cagctcgtca caggatggcc accagtggac tttgttcttt 4200
cagaacggta aggtgaaagt gttccaggga aaccaagatt cctttacacc agtggtcaac 4260
tctctggatc ctcccctgct gacacggtac ctgcggatcc atccccagtc atgggtgcac 4320
cagattgctc tgcgcatgga ggtgcttggc tgcgaggccc aggacctgta ctga 4374
<210> 16
<211> 4374
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 16
atgcagattg agctgagcac ctgtttcttc ctgtgcctgc tgagattttg cttctcagct 60
acccgcaggt actacctggg agccgttgag ctgtcctggg attacatgca gtcagatctg 120
ggggagctgc ctgtggacgc tcggtttccc cccagagtgc caaagtcctt tcccttcaac 180
accagcgtgg tgtacaaaaa gacacttttt gttgaattta ctgaccactt gttcaacatc 240
gccaagccac gacccccatg gatgggcctg ctggggccaa ccattcaggc agaggtttac 300
gacacagtcg tgatcacact gaagaacatg gcctcccatc cagtgtctct gcacgccgtc 360
ggtgtgtcct actggaaagc atccgagggc gccgagtatg acgaccagac cagccagaga 420
gagaaagagg acgacaaagt gttccctgga ggcagccaca cctacgtgtg gcaggtgttg 480
aaggaaaatg ggcccatggc cagtgaccct ttgtgtctga cttactcata cctgtctcat 540
gtggatctag tcaaggacct gaattctgga ctgattgggg cactgcttgt gtgccgcgaa 600
ggcagcctgg ccaaagaaaa gacacagacc cttcacaagt tcatcctgct gttcgccgtg 660
ttcgacgaag gcaaatcctg gcactcagaa accaaaaact cactgatgca ggaccgggat 720
gccgcctctg cccgcgcatg gccaaaaatg cacaccgtca acggctatgt caatagaagt 780
ttgcccggcc tcattggatg tcacaggaaa agcgtctatt ggcatgtaat cgggatggga 840
accacacctg aggtccacag catatttctg gaaggccaca catttctggt gagaaatcat 900
cgccaggctt ccctggaaat ttcccccatc accttcttga ccgcccagac actgctcatg 960
gatcttgggc agtttctgct gttttgtcat atttcttctc accaacacga cggaatggag 1020
gcctacgtta aggtcgatag ttgccctgaa gaacctcagc tgaggatgaa gaacaacgag 1080
gaagccgagg actacgatga cgatttgacc gattccgaaa tggacgtggt gcgctttgat 1140
gatgacaatt ctccatcctt cattcagatt agatccgtcg ccaagaagca ccccaagacc 1200
tgggtgcact acattgcagc cgaggaggag gattgggact acgcccccct ggtgctggca 1260
cccgacgacc gaagctacaa atctcagtac ctgaacaatg gtccacaacg gatcggcagg 1320
aagtacaaga aagtgcggtt catggcctat acagacgaaa ccttcaaaac cagggaggct 1380
atccagcacg agtctgggat tctgggacca ctcctgtacg gcgaagtggg cgacaccttg 1440
ttaattatct tcaagaacca ggctagtaga ccttataaca tttatcccca cggcattacc 1500
gatgtgcggc ctctctactc taggcggctt ccaaaggggg tgaaacacct gaaggacttt 1560
cccatcctcc ctggcgaaat ctttaagtat aagtggacag tgaccgtgga ggatggacca 1620
accaagagcg accccaggtg cctgacacgc tattattcaa gcttcgtgaa tatggaaagg 1680
gacctcgcat ctggcttgat cggccctctg ctgatatgtt acaaggaaag cgtcgatcag 1740
agaggaaatc agatcatgtc agacaaaagg aatgtgatcc tgttctccgt cttcgatgaa 1800
aacaggagct ggtatctgac agagaacatc cagagattcc tgccaaatcc cgccggcgtc 1860
cagctggagg acccggagtt tcaggcatct aacatcatgc attccattaa tggttacgtg 1920
ttcgactccc tgcagctgag cgtgtgcctc cacgaggtgg cctactggta catcttgagc 1980
atcggcgccc agaccgactt tctgagcgtc tttttctccg ggtatacttt caaacataag 2040
atggtgtacg aagatactct gacgctgttc cctttctctg gggagactgt gtttatgtct 2100
atggagaacc ctggactgtg gattctcgga tgccacaaca gtgactttcg taatagaggg 2160
atgactgcac tgctgaaggt gtccagctgt gataaaaata ctggcgacta ctacgaagat 2220
agctatgagg atatctcagc atacctgctg agcaagaata acgccatcga gccccgaagc 2280
ttctcacaga atccccctgt cctcaaggcc caccaggcgg agatcacaag gaccacactc 2340
cagtccgacc aggaggagat tgactacgat gacacgattt ctgtggagat gaaaaaagag 2400
gactttgaca tctacgatga ggatgaaaac cagagcccta ggtcgttcca gaagaaaaca 2460
aggcactact tcattgccgc cgtggagaga ctgtgggact acggaatgag tagttcccca 2520
cacgtgttgc ggaacagagc ccagagtggg tccgtcccac agttcaagaa ggttgttttc 2580
caggagttca cagatggctc cttcactcag ccactgtatc gcggcgagct gaatgagcac 2640
ttgggcttat tgggccccta cattcgcgca gaagtcgaag ataatattat ggtgaccttc 2700
cgcaaccagg ccagccggcc ttactcattc tactcctctc tcatctctta tgaggaggat 2760
cagcgccagg gcgccgaacc ccggaagaac tttgtgaagc ccaatgaaac caaaacttac 2820
ttttggaagg tgcagcacca tatggcgccg acgaaagacg aatttgactg caaagcctgg 2880
gcctacttca gcgacgtcga cttggagaag gacgtccaca gcggcctgat tggccctttg 2940
ttggtctgcc ataccaatac actcaaccct gcccacggga ggcaggtgac cgtgcaggag 3000
tttgccttgt tcttcaccat cttcgacgaa accaagagct ggtacttcac agagaacatg 3060
gagaggaact gcagagcacc ctgtaacatc cagatggagg accctacttt caaggaaaat 3120
tacaggttcc atgccattaa tggctacatc atggataccc tccccgggct tgtgatggct 3180
caggaccagc gcatccgctg gtacctgctc tcaatgggct ccaacgagaa cattcatagc 3240
atccacttta gtggccacgt gtttaccgtg cgcaagaagg aggagtacaa gatggcactg 3300
tacaacctgt accctggcgt gtttgagaca gtggagatgc tgccatccaa ggccggcatc 3360
tggcgcgtgg agtgcctcat tggggagcac ctccatgctg gcatgtctac actgttcctg 3420
gtgtacagca acaagtgtca gactccactc ggaatggcct ccgggcatat ccgcgatttt 3480
cagatcacgg cctctggcca gtatggccaa tgggctccca agctggccag gctgcactac 3540
agtgggagta tcaacgcttg gagcaccaag gagcctttct cctggatcaa ggtggacctg 3600
cttgccccca tgattattca cggcattaag acacaggggg ccaggcagaa attctcctcc 3660
ctgtacatct cccagttcat catcatgtac agtctggacg gcaaaaagtg gcagacctac 3720
cgcgggaaca gtaccgggac attgatggtg ttcttcggga acgtggactc tagcggcatt 3780
aaacacaaca ttttcaaccc ccccatcatt gctaggtata tcaggctcca tcccacccac 3840
tatagcatca ggtccactct gcggatggag ctgatgggct gcgaccttaa ttcatgcagc 3900
atgccgctgg gcatggagtc aaaggccatc tccgacgccc aaatcaccgc ctccagctac 3960
ttcaccaata tgttcgccac ctggagcccc agcaaggccc ggctgcacct gcagggccgc 4020
agcaacgcct ggcggcctca ggtgaacaac cccaaggagt ggctgcaggt ggacttccag 4080
aaaaccatga aggtgactgg ggtcaccacc cagggagtca agagcctgct gaccagcatg 4140
tatgtgaagg agttcttgat cagctcgtca caggatggcc accagtggac tttgttcttt 4200
cagaacggta aggtgaaagt gttccaggga aaccaagatt cctttacacc agtggtcaac 4260
tctctggatc ctcccctgct gacacggtac ctgcggatcc atccccagtc atgggtgcac 4320
cagattgctc tgcgcatgga ggtgcttggc tgcgaggccc aggacctgta ctga 4374
<210> 17
<211> 4425
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 17
atgcagattg agctgagcac ctgtttcttc ctgtgcctgc tgagattttg cttctcagct 60
acccgcaggt actacctggg agccgttgag ctgtcctggg attacatgca gtcagatctg 120
ggggagctgc ctgtggacgc tcggtttccc cccagagtgc caaagtcctt tcccttcaac 180
accagcgtgg tgtacaaaaa gacacttttt gttgaattta ctgaccactt gttcaacatc 240
gccaagccac gacccccatg gatgggcctg ctggggccaa ccattcaggc agaggtttac 300
gacacagtcg tgatcacact gaagaacatg gcctcccatc cagtgtctct gcacgccgtc 360
ggtgtgtcct actggaaagc atccgagggc gccgagtatg acgaccagac cagccagaga 420
gagaaagagg acgacaaagt gttccctgga ggcagccaca cctacgtgtg gcaggtgttg 480
aaggaaaatg ggcccatggc cagtgaccct ttgtgtctga cttactcata cctgtctcat 540
gtggatctag tcaaggacct gaattctgga ctgattgggg cactgcttgt gtgccgcgaa 600
ggcagcctgg ccaaagaaaa gacacagacc cttcacaagt tcatcctgct gttcgccgtg 660
ttcgacgaag gcaaatcctg gcactcagaa accaaaaact cactgatgca ggaccgggat 720
gccgcctctg cccgcgcatg gccaaaaatg cacaccgtca acggctatgt caatagaagt 780
ttgcccggcc tcattggatg tcacaggaaa agcgtctatt ggcatgtaat cgggatggga 840
accacacctg aggtccacag catatttctg gaaggccaca catttctggt gagaaatcat 900
cgccaggctt ccctggaaat ttcccccatc accttcttga ccgcccagac actgctcatg 960
gatcttgggc agtttctgct gttttgtcat atttcttctc accaacacga cggaatggag 1020
gcctacgtta aggtcgatag ttgccctgaa gaacctcagc tgaggatgaa gaacaacgag 1080
gaagccgagg actacgatga cgatttgacc gattccgaaa tggacgtggt gcgctttgat 1140
gatgacaatt ctccatcctt cattcagatt agatccgtcg ccaagaagca ccccaagacc 1200
tgggtgcact acattgcagc cgaggaggag gattgggact acgcccccct ggtgctggca 1260
cccgacgacc gaagctacaa atctcagtac ctgaacaatg gtccacaacg gatcggcagg 1320
aagtacaaga aagtgcggtt catggcctat acagacgaaa ccttcaaaac cagggaggct 1380
atccagcacg agtctgggat tctgggacca ctcctgtacg gcgaagtggg cgacaccttg 1440
ttaattatct tcaagaacca ggctagtaga ccttataaca tttatcccca cggcattacc 1500
gatgtgcggc ctctctactc taggcggctt ccaaaggggg tgaaacacct gaaggacttt 1560
cccatcctcc ctggcgaaat ctttaagtat aagtggacag tgaccgtgga ggatggacca 1620
accaagagcg accccaggtg cctgacacgc tattattcaa gcttcgtgaa tatggaaagg 1680
gacctcgcat ctggcttgat cggccctctg ctgatatgtt acaaggaaag cgtcgatcag 1740
agaggaaatc agatcatgtc agacaaaagg aatgtgatcc tgttctccgt cttcgatgaa 1800
aacaggagct ggtatctgac agagaacatc cagagattcc tgccaaatcc cgccggcgtc 1860
cagctggagg acccggagtt tcaggcatct aacatcatgc attccattaa tggttacgtg 1920
ttcgactccc tgcagctgag cgtgtgcctc cacgaggtgg cctactggta catcttgagc 1980
atcggcgccc agaccgactt tctgagcgtc tttttctccg ggtatacttt caaacataag 2040
atggtgtacg aagatactct gacgctgttc cctttctctg gggagactgt gtttatgtct 2100
atggagaacc ctggactgtg gattctcgga tgccacaaca gtgactttcg taatagaggg 2160
atgactgcac tgctgaaggt gtccagctgt gataaaaata ctggcgacta ctacgaagat 2220
agctatgagg atatctcagc atacctgctg agcaagaata acgccatcga gccccgaagc 2280
ttctcacaga atgccaccaa cgtgagcaac aacagcaaca ccagcaacga cagcaacgtg 2340
agcccccctg tcctcaaggc ccaccaggcg gagatcacaa ggaccacact ccagtccgac 2400
caggaggaga ttgactacga tgacacgatt tctgtggaga tgaaaaaaga ggactttgac 2460
atctacgatg aggatgaaaa ccagagccct aggtcgttcc agaagaaaac aaggcactac 2520
ttcattgccg ccgtggagag actgtgggac tacggaatga gtagttcccc acacgtgttg 2580
cggaacagag cccagagtgg gtccgtccca cagttcaaga aggttgtttt ccaggagttc 2640
acagatggct ccttcactca gccactgtat cgcggcgagc tgaatgagca cttgggctta 2700
ttgggcccct acattcgcgc agaagtcgaa gataatatta tggtgacctt ccgcaaccag 2760
gccagccggc cttactcatt ctactcctct ctcatctctt atgaggagga tcagcgccag 2820
ggcgccgaac cccggaagaa ctttgtgaag cccaatgaaa ccaaaactta cttttggaag 2880
gtgcagcacc atatggcgcc gacgaaagac gaatttgact gcaaagcctg ggcctacttc 2940
agcgacgtcg acttggagaa ggacgtccac agcggcctga ttggcccttt gttggtctgc 3000
cataccaata cactcaaccc tgcccacggg aggcaggtga ccgtgcagga gtttgccttg 3060
ttcttcacca tcttcgacga aaccaagagc tggtacttca cagagaacat ggagaggaac 3120
tgcagagcac cctgtaacat ccagatggag gaccctactt tcaaggaaaa ttacaggttc 3180
catgccatta atggctacat catggatacc ctccccgggc ttgtgatggc tcaggaccag 3240
cgcatccgct ggtacctgct ctcaatgggc tccaacgaga acattcatag catccacttt 3300
agtggccacg tgtttaccgt gcgcaagaag gaggagtaca agatggcact gtacaacctg 3360
taccctggcg tgtttgagac agtggagatg ctgccatcca aggccggcat ctggcgcgtg 3420
gagtgcctca ttggggagca cctccatgct ggcatgtcta cactgttcct ggtgtacagc 3480
aacaagtgtc agactccact cggaatggcc tccgggcata tccgcgattt tcagatcacg 3540
gcctctggcc agtatggcca atgggctccc aagctggcca ggctgcacta cagtgggagt 3600
atcaacgctt ggagcaccaa ggagcctttc tcctggatca aggtggacct gcttgccccc 3660
atgattattc acggcattaa gacacagggg gccaggcaga aattctcctc cctgtacatc 3720
tcccagttca tcatcatgta cagtctggac ggcaaaaagt ggcagaccta ccgcgggaac 3780
agtaccggga cattgatggt gttcttcggg aacgtggact ctagcggcat taaacacaac 3840
attttcaacc cccccatcat tgctaggtat atcaggctcc atcccaccca ctatagcatc 3900
aggtccactc tgcggatgga gctgatgggc tgcgacctta attcatgcag catgccgctg 3960
ggcatggagt caaaggccat ctccgacgcc caaatcaccg cctccagcta cttcaccaat 4020
atgttcgcca cctggagccc cagcaaggcc cggctgcacc tgcagggccg cagcaacgcc 4080
tggcggcctc aggtgaacaa ccccaaggag tggctgcagg tggacttcca gaaaaccatg 4140
aaggtgactg gggtcaccac ccagggagtc aagagcctgc tgaccagcat gtatgtgaag 4200
gagttcttga tcagctcgtc acaggatggc caccagtgga ctttgttctt tcagaacggt 4260
aaggtgaaag tgttccaggg aaaccaagat tcctttacac cagtggtcaa ctctctggat 4320
cctcccctgc tgacacggta cctgcggatc catccccagt catgggtgca ccagattgct 4380
ctgcgcatgg aggtgcttgg ctgcgaggcc caggacctgt actaa 4425
<210> 18
<211> 1386
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 18
atgcagcgcg tgaacatgat catggcagaa tcaccaggcc tcatcaccat ctgcctttta 60
ggatatctac tcagtgctga atgtacagtt tttcttgatc atgaaaacgc caacaaaatt 120
ctgaatcggc caaagaggta taattcaggt aaattggaag agtttgttca agggaacctt 180
gagagagaat gtatggaaga aaagtgtagt tttgaagaag cacgagaagt ttttgaaaac 240
actgaaagaa caactgaatt ttggaagcag tatgttgatg gagatcagtg tgagtccaat 300
ccatgtttaa atggcggcag ttgcaaggat gacattaatt cctatgaatg ttggtgtccc 360
tttggatttg aaggaaagaa ctgtgaatta gatgtaacat gtaacattaa gaatggcaga 420
tgcgagcagt tttgtaaaaa tagtgctgat aacaaggtgg tttgctcctg tactgaggga 480
tatcgacttg cagaaaacca gaagtcctgt gaaccagcag tgccatttcc atgtggaaga 540
gtttctgttt cacaaacttc taagctcacc cgtgctgaga ctgtttttcc tgatgtggac 600
tatgtaaatt ctactgaagc tgaaaccatt ttggataaca tcactcaaag cacccaatca 660
tttaatgact tcactcgggt tgttggtgga gaagatgcca aaccaggtca attcccttgg 720
caggttgttt tgaatggtaa agttgatgca ttctgtggag gctctatcgt taatgaaaaa 780
tggattgtaa ctgctgccca ctgtgttgaa actggtgtta aaattacagt tgtcgcaggt 840
gaacataata ttgaggagac agaacataca gagcaaaagc gaaatgtgat tcgaattatt 900
cctcaccaca actacaatgc agctattaat aagtacaacc atgacattgc ccttctggaa 960
ctggacgaac ccttagtgct aaacagctac gttacaccta tttgcattgc tgacaaggaa 1020
tacacgaaca tcttcctcaa atttggatct ggctatgtaa gtggctgggg aagagtcttc 1080
cacaaaggga gatcagcttt agttcttcag taccttagag ttccacttgt tgaccgagcc 1140
acatgtcttc tgtctacaaa gttcaccatc tataacaaca tgttctgtgc tggcttccat 1200
gaaggaggta gagattcatg tcaaggagat agtgggggac cccatgttac tgaagtggaa 1260
gggaccagtt tcttaactgg aattattagc tggggtgaag agtgtgcaat gaaaggcaaa 1320
tatggaatat ataccaaggt atcccggtat gtcaactgga ttaaggaaaa aacaaagctc 1380
acttaa 1386
<210> 19
<211> 1386
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 19
atgcagcgcg tgaacatgat tatggccgag tctcccggcc tgatcaccat ctgtctgctg 60
ggctatctgc tgagcgccga gtgcaccgtg tttctggatc acgagaacgc caacaagatc 120
ctgaacagac ccaagcggta caacagcggc aagctggaag agttcgtgca gggcaacctg 180
gaacgcgagt gcatggaaga gaagtgcagc ttcgaagagg ccagagaggt gttcgagaac 240
accgagagaa ccaccgagtt ctggaagcag tacgtggacg gcgatcagtg cgagagcaac 300
ccttgtctga atggcggcag ctgcaaggac gacatcaaca gctacgagtg ctggtgcccc 360
ttcggcttcg agggcaagaa ttgcgagctg gacgtgacct gcaacatcaa gaacggcaga 420
tgcgagcagt tctgcaagaa cagcgccgac aacaaggtcg tgtgctcctg cacagagggc 480
tacagactgg ccgagaacca gaagtcttgc gagcccgctg tgccctttcc atgtggcaga 540
gtgtctgtgt cccagaccag caagctgacc agagccgaga cagtgttccc cgacgtggac 600
tacgtgaaca gcaccgaggc cgagacaatc ctggacaaca tcacccagag cacccagtcc 660
ttcaacgact tcaccagagt cgtcggcggc gaggatgcta agcctggaca gtttccttgg 720
caagtggtgc tgaacggcaa ggtggacgct ttttgtggcg gctccatcgt gaacgagaag 780
tggatcgtga ccgccgctca ctgtgtggaa accggcgtga agattacagt ggtggccggc 840
gagcacaaca tcgaggaaac agagcacacc gagcagaaac ggaacgtgat cagaatcatc 900
cctcaccaca actacaacgc cgccatcaac aagtacaacc acgatatcgc cctgctggaa 960
ctggacgagc ccctggtcct gaactcttac gtgaccccta tctgtatcgc cgacaaagag 1020
tacaccaaca tctttctgaa gttcggcagc ggctacgtgt ccggctgggg aagagttttc 1080
cacaagggca gatcagccct ggtgctgcag tacctgagag tgcccctggt ggatagagcc 1140
acatgcctgc tgagcaccaa gttcaccatc tacaacaaca tgttctgcgc cggcttccac 1200
gaaggcggca gagattcttg tcaaggcgat tctggcggcc ctcacgtgac agaggttgag 1260
ggcacaagct ttctgaccgg catcatcagc tggggcgaag agtgtgccat gaaggggaag 1320
tacggcatct acaccaaggt gtccagatac gtgaactgga tcaaagaaaa gaccaagctc 1380
acctga 1386
<210> 20
<211> 1386
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 20
atgcagcgcg tgaacatgat catggccgag agccccggcc tgatcaccat ctgcctgctg 60
ggctacctgc tgagcgccga gtgcaccgtg ttcctggacc acgagaacgc caacaagatc 120
ctgaaccgcc ccaagcgcta caacagcggc aagctggagg agttcgtgca gggcaacctg 180
gagcgcgagt gcatggagga gaagtgcagc ttcgaggagg cccgcgaggt gttcgagaac 240
accgagcgca ccaccgagtt ctggaagcag tacgtggacg gcgaccagtg cgagagcaac 300
ccctgcctga acggcggcag ctgcaaggac gacatcaaca gctacgagtg ctggtgcccc 360
ttcggcttcg agggcaagaa ctgcgagctg gacgtgacct gcaacatcaa gaacggccgc 420
tgcgagcagt tctgcaagaa cagcgccgac aacaaggtgg tgtgcagctg caccgagggc 480
taccgcctgg ccgagaacca gaagagctgc gagcccgccg tgcccttccc ctgcggccgc 540
gtgagcgtga gccagaccag caagctgacc cgcgccgaga ctgtgttccc cgacgtggac 600
tacgtgaaca gcaccgaggc cgaaacgatc ctggacaaca tcacccagag cacccagagc 660
ttcaacgact tcacccgcgt ggtgggcggc gaggacgcca agcccggcca gttcccctgg 720
caggtggtgc tgaacggcaa ggtggacgcc ttctgcggcg gcagcatcgt gaacgagaag 780
tggatcgtga ccgccgccca ctgcgtggaa accggcgtga agatcaccgt ggtggccggc 840
gagcacaaca tcgaggaaac cgagcacacc gagcagaagc gcaacgtgat ccgcatcatc 900
ccccaccaca actacaacgc cgccatcaac aagtacaacc acgacatcgc cctgctggag 960
ctggacgagc ccctggtgct gaacagctac gtgaccccca tctgcatcgc cgacaaggag 1020
tacaccaaca tcttcctgaa gttcggcagc ggctacgtga gcggctgggg ccgcgtgttc 1080
cacaagggcc gcagcgccct ggtgctgcag tacctgcgcg tgcccctggt ggaccgcgcc 1140
acctgcctgc tgagcaccaa gttcaccatc tacaacaaca tgttctgcgc cggcttccac 1200
gagggcggcc gcgacagctg ccagggcgac agcggcggcc cccacgtgac cgaggtggag 1260
ggcaccagct tcctgaccgg catcatcagc tggggcgagg agtgcgccat gaagggcaag 1320
tacggcatct acaccaaggt gagccgctac gtgaactgga tcaaggagaa aaccaagctg 1380
acctaa 1386
<210> 21
<211> 1386
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 21
atgcagcggg tgaacatgat catggccgag agccccgggc tgatcaccat ctgtctgctg 60
gggtacctgc tgtccgccga gtgcaccgtg ttcctggacc acgagaacgc caacaagatc 120
ctgaatcgcc ccaagagata caattccgga aagctggaag agtttgtgca gggcaacctg 180
gagagagagt gcatggaaga gaagtgctcc ttcgaggagg cccgggaggt gttcgagaat 240
actgaacgga caacagagtt ctggaagcag tatgtggacg gcgaccagtg tgagagcaac 300
ccctgtctga acggcgggag ctgcaaggac gacattaatt cctacgaatg ctggtgccca 360
ttcggcttcg agggcaagaa ctgcgagctg gacgtgacct gcaacatcaa gaacggccgc 420
tgcgagcagt tttgcaagaa ctccgccgac aacaaggtgg tgtgttcttg caccgagggc 480
taccgcctgg ccgaaaacca gaagagctgt gagcctgccg tgcccttccc ctgcggccgg 540
gtgtctgtgt cccagacctc caagctgacc agagccgaaa ccgtgtttcc agatgtggac 600
tacgtgaata gcaccgaggc cgagactatc ctcgacaaca tcacccagtc cacccagagc 660
tttaacgact tcacccgcgt ggtgggcggc gaggacgcca agcccggcca gttcccctgg 720
caggtggtgc tcaacggaaa ggtggacgcc ttctgcggag gcagcatcgt gaatgaaaag 780
tggatcgtga cagccgccca ctgcgtggaa acaggggtga agatcaccgt ggtggctgga 840
gagcacaaca tcgaggagac agagcacacc gaacagaaga ggaatgtgat caggatcatc 900
ccccaccaca actataatgc cgccatcaac aagtacaacc acgacatcgc cctgctggag 960
ctggatgagc ccctggtgct caacagctac gtgaccccca tctgcatcgc tgacaaggag 1020
tacaccaaca tcttcctgaa gttcggctcc ggctacgtgt ctggctgggg ccgcgtgttc 1080
cacaagggaa gaagcgccct cgtgctgcag tacctgcggg tgccactggt ggacagggcc 1140
acctgcctgc tgagcactaa gttcaccatt tacaacaaca tgttctgcgc cggcttccac 1200
gagggcggca gggactcctg ccagggcgac agcggcggcc cccatgtgac cgaggtggag 1260
ggcacctcct ttctgactgg cattatctcc tggggcgagg agtgcgccat gaaggggaag 1320
tatggcatct acaccaaggt gtcccgctac gtgaactgga ttaaggagaa aaccaagctg 1380
acctga 1386
<210> 22
<211> 313
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 22
ttaaccctag aaagatagtc tgcgtaaaat tgacgcatgc attcttgaaa tattgctctc 60
tctttctaaa tagcgcgaat ccgtcgctgt gcatttagga catctcagtc gccgcttgga 120
gctcccgtga ggcgtgcttg tcaatgcggt aagtgtcact gattttgaac tataacgacc 180
gcgtgagtca aaatgacgca tgattatctt ttacgtgact tttaagattt aactcatacg 240
ataattatat tgttatttca tgttctactt acgtgataac ttattatata tatattttct 300
tgttatagat atc 313
<210> 23
<211> 1733
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 23
ctcgacattg attattgact agttattaat agtaatcaat tacggggtca ttagttcata 60
gcccatatat ggagttccgc gttacataac ttacggtaaa tggcccgcct ggctgaccgc 120
ccaacgaccc ccgcccattg acgtcaataa tgacgtatgt tcccatagta acgccaatag 180
ggactttcca ttgacgtcaa tgggtggagt atttacggta aactgcccac ttggcagtac 240
atcaagtgta tcatatgcca agtacgcccc ctattgacgt caatgacggt aaatggcccg 300
cctggcatta tgcccagtac atgaccttat gggactttcc tacttggcag tacatctacg 360
tattagtcat cgctattacc atggtcgagg tgagccccac gttctgcttc actctcccca 420
tctccccccc ctccccaccc ccaattttgt atttatttat tttttaatta ttttgtgcag 480
cgatgggggc gggggggggg ggggggcgcg cgccaggcgg ggcggggcgg ggcgaggggc 540
ggggcggggc gaggcggaga ggtgcggcgg cagccaatca gagcggcgcg ctccgaaagt 600
ttccttttat ggcgaggcgg cggcggcggc ggccctataa aaagcgaagc gcgcggcggg 660
cgggagtcgc tgcgcgctgc cttcgccccg tgccccgctc cgccgccgcc tcgcgccgcc 720
cgccccggct ctgactgacc gcgttactcc cacaggtgag cgggcgggac ggcccttctc 780
ctccgggctg taattagcgc ttggtttaat gacggcttgt ttcttttctg tggctgcgtg 840
aaagccttga ggggctccgg gagggccctt tgtgcggggg gagcggctcg gggggtgcgt 900
gcgtgtgtgt gtgcgtgggg agcgccgcgt gcggctccgc gctgcccggc ggctgtgagc 960
gctgcgggcg cggcgcgggg ctttgtgcgc tccgcagtgt gcgcgagggg agcgcggccg 1020
ggggcggtgc cccgcggtgc ggggggggct gcgaggggaa caaaggctgc gtgcggggtg 1080
tgtgcgtggg ggggtgagca gggggtgtgg gcgcgtcggt cgggctgcaa ccccccctgc 1140
acccccctcc ccgagttgct gagcacggcc cggcttcggg tgcggggctc cgtacggggc 1200
gtggcgcggg gctcgccgtg ccgggcgggg ggtggcggca ggtgggggtg ccgggcgggg 1260
cggggccgcc tcgggccggg gagggctcgg gggaggggcg cggcggcccc cggagcgccg 1320
gcggctgtcg aggcgcggcg agccgcagcc attgcctttt atggtaatcg tgcgagaggg 1380
cgcagggact tcctttgtcc caaatctgtg cggagccgaa atctgggagg cgccgccgca 1440
ccccctctag cgggcgcggg gcgaagcggt gcggcgccgg caggaaggaa atgggcgggg 1500
agggccttcg tgcgtcgccg cgccgccgtc cccttctccc tctccagcct cggggctgtc 1560
cgcgggggga cggctgcctt cgggggggac ggggcagggc ggggttcggc ttctggcgtg 1620
tgaccggcgg ctctagagcc tctgctaacc atgttcatgc cttcttcttt ttcctacagc 1680
tcctgggcaa cgtgctggtt attgtgctgt ctcatcattt tggcaaagaa ttg 1733
<210> 24
<211> 522
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 24
tcctcaggtg caggctgcct atcagaaggt ggtggctggt gtggccaatg ccctggctca 60
caaataccac tgagatcttt ttccctctgc caaaaattat ggggacatca tgaagcccct 120
tgagcatctg acttctggct aataaaggaa atttattttc attgcaatag tgtgttggaa 180
ttttttgtgt ctctcactcg gaaggacata tgggagggca aatcatttaa aacatcagaa 240
tgagtatttg gtttagagtt tggcaacata tgcccatatg ctggctgcca tgaacaaagg 300
ttggctataa agaggtcatc agtatatgaa acagccccct gctgtccatt ccttattcca 360
tagaaaagcc ttgacttgag gttagatttt ttttatattt tgttttgtgt tatttttttc 420
tttaacatcc ctaaaatttt ccttacatgt tttactagcc agatttttcc tcctctcctg 480
actactccca gtcatagctg tccctcttct cttatggaga tc 522
<210> 25
<211> 235
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 25
ttaaccctag aaagataatc atattgtgac gtacgttaaa gataatcatg cgtaaaattg 60
acgcatgtgt tttatcggtc tgtatatcga ggtttattta ttaatttgaa tagatattaa 120
gttttattat atttacactt acatactaat aataaattca acaaacaatt tatttatgtt 180
tatttattta ttaaaaaaaa acaaaaactc aaaatttctt ctataaagta acaaa 235
<210> 26
<211> 6164
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 26
ttaaccctag aaagatagtc tgcgtaaaat tgacgcatgc attcttgaaa tattgctctc 60
tctttctaaa tagcgcgaat ccgtcgctgt gcatttagga catctcagtc gccgcttgga 120
gctcccgtga ggcgtgcttg tcaatgcggt aagtgtcact gattttgaac tataacgacc 180
gcgtgagtca aaatgacgca tgattatctt ttacgtgact tttaagattt aactcatacg 240
ataattatat tgttatttca tgttctactt acgtgataac ttattatata tatattttct 300
tgttatagat atcatcaact ttgtatagaa aagttgctcg acattgatta ttgactagtt 360
attaatagta atcaattacg gggtcattag ttcatagccc atatatggag ttccgcgtta 420
cataacttac ggtaaatggc ccgcctggct gaccgcccaa cgacccccgc ccattgacgt 480
caataatgac gtatgttccc atagtaacgc caatagggac tttccattga cgtcaatggg 540
tggagtattt acggtaaact gcccacttgg cagtacatca agtgtatcat atgccaagta 600
cgccccctat tgacgtcaat gacggtaaat ggcccgcctg gcattatgcc cagtacatga 660
ccttatggga ctttcctact tggcagtaca tctacgtatt agtcatcgct attaccatgg 720
tcgaggtgag ccccacgttc tgcttcactc tccccatctc ccccccctcc ccacccccaa 780
ttttgtattt atttattttt taattatttt gtgcagcgat gggggcgggg gggggggggg 840
ggcgcgcgcc aggcggggcg gggcggggcg aggggcgggg cggggcgagg cggagaggtg 900
cggcggcagc caatcagagc ggcgcgctcc gaaagtttcc ttttatggcg aggcggcggc 960
ggcggcggcc ctataaaaag cgaagcgcgc ggcgggcggg agtcgctgcg cgctgccttc 1020
gccccgtgcc ccgctccgcc gccgcctcgc gccgcccgcc ccggctctga ctgaccgcgt 1080
tactcccaca ggtgagcggg cgggacggcc cttctcctcc gggctgtaat tagcgcttgg 1140
tttaatgacg gcttgtttct tttctgtggc tgcgtgaaag ccttgagggg ctccgggagg 1200
gccctttgtg cggggggagc ggctcggggg gtgcgtgcgt gtgtgtgtgc gtggggagcg 1260
ccgcgtgcgg ctccgcgctg cccggcggct gtgagcgctg cgggcgcggc gcggggcttt 1320
gtgcgctccg cagtgtgcgc gaggggagcg cggccggggg cggtgccccg cggtgcgggg 1380
ggggctgcga ggggaacaaa ggctgcgtgc ggggtgtgtg cgtggggggg tgagcagggg 1440
gtgtgggcgc gtcggtcggg ctgcaacccc ccctgcaccc ccctccccga gttgctgagc 1500
acggcccggc ttcgggtgcg gggctccgta cggggcgtgg cgcggggctc gccgtgccgg 1560
gcggggggtg gcggcaggtg ggggtgccgg gcggggcggg gccgcctcgg gccggggagg 1620
gctcggggga ggggcgcggc ggcccccgga gcgccggcgg ctgtcgaggc gcggcgagcc 1680
gcagccattg ccttttatgg taatcgtgcg agagggcgca gggacttcct ttgtcccaaa 1740
tctgtgcgga gccgaaatct gggaggcgcc gccgcacccc ctctagcggg cgcggggcga 1800
agcggtgcgg cgccggcagg aaggaaatgg gcggggaggg ccttcgtgcg tcgccgcgcc 1860
gccgtcccct tctccctctc cagcctcggg gctgtccgcg gggggacggc tgccttcggg 1920
ggggacgggg cagggcgggg ttcggcttct ggcgtgtgac cggcggctct agagcctctg 1980
ctaaccatgt tcatgccttc ttctttttcc tacagctcct gggcaacgtg ctggttattg 2040
tgctgtctca tcattttggc aaagaattgc aagtttgtac aaaaaagcag gctgccaccg 2100
aattcgcggc cgctaaaccc agctttcttg tacaaagtgg caactttatt atacatagtt 2160
gatcctcagg tgcaggctgc ctatcagaag gtggtggctg gtgtggccaa tgccctggct 2220
cacaaatacc actgagatct ttttccctct gccaaaaatt atggggacat catgaagccc 2280
cttgagcatc tgacttctgg ctaataaagg aaatttattt tcattgcaat agtgtgttgg 2340
aattttttgt gtctctcact cggaaggaca tatgggaggg caaatcattt aaaacatcag 2400
aatgagtatt tggtttagag tttggcaaca tatgcccata tgctggctgc catgaacaaa 2460
ggttggctat aaagaggtca tcagtatatg aaacagcccc ctgctgtcca ttccttattc 2520
catagaaaag ccttgacttg aggttagatt ttttttatat tttgttttgt gttatttttt 2580
tctttaacat ccctaaaatt ttccttacat gttttactag ccagattttt cctcctctcc 2640
tgactactcc cagtcatagc tgtccctctt ctcttatgga gatccctcga cctgcagccc 2700
aagcttggat ccctcgagtt aattaacgag agcataatat tgatatgtgc caaagttgtt 2760
tctgactgac taataagtat aatttgtttc tattatgtat aggttaagct aattacttat 2820
tttataatac aacatgactg tttttaaagt acaaaataag tttatttttg taaaagagag 2880
aatgtttaaa agttttgtta ctttatagaa gaaattttga gtttttgttt ttttttaata 2940
aataaataaa cataaataaa ttgtttgttg aatttattat tagtatgtaa gtgtaaatat 3000
aataaaactt aatatctatt caaattaata aataaacctc gatatacaga ccgataaaac 3060
acatgcgtca attttacgca tgattatctt taacgtacgt cacaatatga ttatctttct 3120
agggttaaat aatagtttct aattttttta ttattcagcc tgctgtcgtg aataccgagc 3180
tccaattcgc cctatagtga gtcgtattac aattcactgg ccgtcgtttt acaacgtcgt 3240
gactgggaaa accctggcgt tacccaactt aatcgccttg cagcacatcc ccctttcgcc 3300
agctggcgta atagcgaaga ggcccgcacc gatcgccctt cccaacagtt gcgcagcctg 3360
aatggcgaat gggacgcgcc ctgtagcggc gcattaagcg cggcgggtgt ggtggttacg 3420
cgcagcgtga ccgctacact tgccagcgcc ctagcgcccg ctcctttcgc tttcttccct 3480
tcctttctcg ccacgttcgc cggctttccc cgtcaagctc taaatcgggg gctcccttta 3540
gggttccgat ttagtgcttt acggcacctc gaccccaaaa aacttgatta gggtgatggt 3600
tcacgtagtg ggccatcgcc ctgatagacg gtttttcgcc ctttgacgtt ggagtccacg 3660
ttctttaata gtggactctt gttccaaact ggaacaacac tcaaccctat ctcggtctat 3720
tcttttgatt tataagggat tttgccgatt tcggcctatt ggttaaaaaa tgagctgatt 3780
taacaaaaat ttaacgcgaa ttttaacaaa atattaacgc ttacaattta ggtggcactt 3840
ttcggggaaa tgtgcgcgga acccctattt gtttattttt ctaaatacat tcaaatatgt 3900
atccgctcat gagacaataa ccctgataaa tgcttcaata atattgaaaa aggaagagta 3960
tgagtattca acatttccgt gtcgccctta ttcccttttt tgcggcattt tgccttcctg 4020
tttttgctca cccagaaacg ctggtgaaag taaaagatgc tgaagatcag ttgggtgcac 4080
gagtgggtta catcgaactg gatctcaaca gcggtaagat ccttgagagt tttcgccccg 4140
aagaacgttt tccaatgatg agcactttta aagttctgct atgtggcgcg gtattatccc 4200
gtattgacgc cgggcaagag caactcggtc gccgcataca ctattctcag aatgacttgg 4260
ttgagtactc accagtcaca gaaaagcatc ttacggatgg catgacagta agagaattat 4320
gcagtgctgc cataaccatg agtgataaca ctgcggccaa cttacttctg acaacgatcg 4380
gaggaccgaa ggagctaacc gcttttttgc acaacatggg ggatcatgta actcgccttg 4440
atcgttggga accggagctg aatgaagcca taccaaacga cgagcgtgac accacgatgc 4500
ctgtagcaat ggcaacaacg ttgcgcaaac tattaactgg cgaactactt actctagctt 4560
cccggcaaca attaatagac tggatggagg cggataaagt tgcaggacca cttctgcgct 4620
cggcccttcc ggctggctgg tttattgctg ataaatctgg agccggtgag cgtgggtctc 4680
gcggtatcat tgcagcactg gggccagatg gtaagccctc ccgtatcgta gttatctaca 4740
cgacggggag tcaggcaact atggatgaac gaaatagaca gatcgctgag ataggtgcct 4800
cactgattaa gcattggtaa ctgtcagacc aagtttactc atatatactt tagattgatt 4860
taaaacttca tttttaattt aaaaggatct aggtgaagat cctttttgat aatctcatga 4920
ccaaaatccc ttaacgtgag ttttcgttcc actgagcgtc agaccccgta gaaaagatca 4980
aaggatcttc ttgagatcct ttttttctgc gcgtaatctg ctgcttgcaa acaaaaaaac 5040
caccgctacc agcggtggtt tgtttgccgg atcaagagct accaactctt tttccgaagg 5100
taactggctt cagcagagcg cagataccaa atactgttct tctagtgtag ccgtagttag 5160
gccaccactt caagaactct gtagcaccgc ctacatacct cgctctgcta atcctgttac 5220
cagtggctgc tgccagtggc gataagtcgt gtcttaccgg gttggactca agacgatagt 5280
taccggataa ggcgcagcgg tcgggctgaa cggggggttc gtgcacacag cccagcttgg 5340
agcgaacgac ctacaccgaa ctgagatacc tacagcgtga gctatgagaa agcgccacgc 5400
ttcccgaaga gagaaaggcg gacaggtatc cggtaagcgg cagggtcgga acaggagagc 5460
gcacgaggga gcttccaggg ggaaacgcct ggtatcttta tagtcctgtc gggtttcgcc 5520
acctctgact tgagcgtcga tttttgtgat gctcgtcagg ggggcggagc ctatggaaaa 5580
acgccagcaa cgcggccttt ttacggttcc tggccttttg ctggcctttt gctcacatgt 5640
tctttcctgc gttatcccct gattctgtgg ataaccgtat taccgccttt gagtgagctg 5700
ataccgctcg ccgcagccga acgaccgagc gcagcgagtc agtgagcgag gaagcggaag 5760
agcgcccaat acgcaaaccg cctctccccg cgcgttggcc gattcattaa tgcagctggc 5820
acgacaggtt tcccgactgg aaagcgggca gtgagcgcaa cgcaattaat gtgagttagc 5880
tcactcatta ggcaccccag gctttacact ttatgcttcc ggctcgtatg ttgtgtggaa 5940
ttgtgagcgg ataacaattt cacacaggaa acagctatga ccatgattac gccaagctcg 6000
aaattaaccc tcactaaagg gaacaaaagc tggtacctcg cgcgacttgg tttgccattc 6060
tttagcgcgc gtcgcgtcac acagcttggc cacaatgtgg tttttgtcaa acgaagattc 6120
tatgacgtgt ttaaagttta ggtcgagtaa agcgcaaatc tttt 6164
<210> 27
<211> 6721
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 27
ctcgacattg attattgact agttattaat agtaatcaat tacggggtca ttagttcata 60
gcccatatat ggagttccgc gttacataac ttacggtaaa tggcccgcct ggctgaccgc 120
ccaacgaccc ccgcccattg acgtcaataa tgacgtatgt tcccatagta acgccaatag 180
ggactttcca ttgacgtcaa tgggtggagt atttacggta aactgcccac ttggcagtac 240
atcaagtgta tcatatgcca agtacgcccc ctattgacgt caatgacggt aaatggcccg 300
cctggcatta tgcccagtac atgaccttat gggactttcc tacttggcag tacatctacg 360
tattagtcat cgctattacc atggtcgagg tgagccccac gttctgcttc actctcccca 420
tctccccccc ctccccaccc ccaattttgt atttatttat tttttaatta ttttgtgcag 480
cgatgggggc gggggggggg ggggggcgcg cgccaggcgg ggcggggcgg ggcgaggggc 540
ggggcggggc gaggcggaga ggtgcggcgg cagccaatca gagcggcgcg ctccgaaagt 600
ttccttttat ggcgaggcgg cggcggcggc ggccctataa aaagcgaagc gcgcggcggg 660
cgggagtcgc tgcgcgctgc cttcgccccg tgccccgctc cgccgccgcc tcgcgccgcc 720
cgccccggct ctgactgacc gcgttactcc cacaggtgag cgggcgggac ggcccttctc 780
ctccgggctg taattagcgc ttggtttaat gacggcttgt ttcttttctg tggctgcgtg 840
aaagccttga ggggctccgg gagggccctt tgtgcggggg gagcggctcg gggggtgcgt 900
gcgtgtgtgt gtgcgtgggg agcgccgcgt gcggctccgc gctgcccggc ggctgtgagc 960
gctgcgggcg cggcgcgggg ctttgtgcgc tccgcagtgt gcgcgagggg agcgcggccg 1020
ggggcggtgc cccgcggtgc ggggggggct gcgaggggaa caaaggctgc gtgcggggtg 1080
tgtgcgtggg ggggtgagca gggggtgtgg gcgcgtcggt cgggctgcaa ccccccctgc 1140
acccccctcc ccgagttgct gagcacggcc cggcttcggg tgcggggctc cgtacggggc 1200
gtggcgcggg gctcgccgtg ccgggcgggg ggtggcggca ggtgggggtg ccgggcgggg 1260
cggggccgcc tcgggccggg gagggctcgg gggaggggcg cggcggcccc cggagcgccg 1320
gcggctgtcg aggcgcggcg agccgcagcc attgcctttt atggtaatcg tgcgagaggg 1380
cgcagggact tcctttgtcc caaatctgtg cggagccgaa atctgggagg cgccgccgca 1440
ccccctctag cgggcgcggg gcgaagcggt gcggcgccgg caggaaggaa atgggcgggg 1500
agggccttcg tgcgtcgccg cgccgccgtc cccttctccc tctccagcct cggggctgtc 1560
cgcgggggga cggctgcctt cgggggggac ggggcagggc ggggttcggc ttctggcgtg 1620
tgaccggcgg ctctagagcc tctgctaacc atgttcatgc cttcttcttt ttcctacagc 1680
tcctgggcaa cgtgctggtt attgtgctgt ctcatcattt tggcaaagaa ttgcaagttt 1740
gtacaaaaaa gcaggctgcc accatgcaga ttgagctgag cacctgtttc ttcctgtgcc 1800
tgctgagatt ttgcttctca gctacccgca ggtactacct gggagccgtt gagctgtcct 1860
gggattacat gcagtcagat ctgggggagc tgcctgtgga cgctcggttt ccccccagag 1920
tgccaaagtc ctttcccttc aacaccagcg tggtgtacaa aaagacactt tttgttgaat 1980
ttactgacca cttgttcaac atcgccaagc cacgaccccc atggatgggc ctgctggggc 2040
caaccattca ggcagaggtt tacgacacag tcgtgatcac actgaagaac atggcctccc 2100
atccagtgtc tctgcacgcc gtcggtgtgt cctactggaa agcatccgag ggcgccgagt 2160
atgacgacca gaccagccag agagagaaag aggacgacaa agtgttccct ggaggcagcc 2220
acacctacgt gtggcaggtg ttgaaggaaa atgggcccat ggccagtgac cctttgtgtc 2280
tgacttactc atacctgtct catgtggatc tagtcaagga cctgaattct ggactgattg 2340
gggcactgct tgtgtgccgc gaaggcagcc tggccaaaga aaagacacag acccttcaca 2400
agttcatcct gctgttcgcc gtgttcgacg aaggcaaatc ctggcactca gaaaccaaaa 2460
actcactgat gcaggaccgg gatgccgcct ctgcccgcgc atggccaaaa atgcacaccg 2520
tcaacggcta tgtcaataga agtttgcccg gcctcattgg atgtcacagg aaaagcgtct 2580
attggcatgt aatcgggatg ggaaccacac ctgaggtcca cagcatattt ctggaaggcc 2640
acacatttct ggtgagaaat catcgccagg cttccctgga aatttccccc atcaccttct 2700
tgaccgccca gacactgctc atggatcttg ggcagtttct gctgttttgt catatttctt 2760
ctcaccaaca cgacggaatg gaggcctacg ttaaggtcga tagttgccct gaagaacctc 2820
agctgaggat gaagaacaac gaggaagccg aggactacga tgacgatttg accgattccg 2880
aaatggacgt ggtgcgcttt gatgatgaca attctccatc cttcattcag attagatccg 2940
tcgccaagaa gcaccccaag acctgggtgc actacattgc agccgaggag gaggattggg 3000
actacgcccc cctggtgctg gcacccgacg accgaagcta caaatctcag tacctgaaca 3060
atggtccaca acggatcggc aggaagtaca agaaagtgcg gttcatggcc tatacagacg 3120
aaaccttcaa aaccagggag gctatccagc acgagtctgg gattctggga ccactcctgt 3180
acggcgaagt gggcgacacc ttgttaatta tcttcaagaa ccaggctagt agaccttata 3240
acatttatcc ccacggcatt accgatgtgc ggcctctcta ctctaggcgg cttccaaagg 3300
gggtgaaaca cctgaaggac tttcccatcc tccctggcga aatctttaag tataagtgga 3360
cagtgaccgt ggaggatgga ccaaccaaga gcgaccccag gtgcctgaca cgctattatt 3420
caagcttcgt gaatatggaa agggacctcg catctggctt gatcggccct ctgctgatat 3480
gttacaagga aagcgtcgat cagagaggaa atcagatcat gtcagacaaa aggaatgtga 3540
tcctgttctc cgtcttcgat gaaaacagga gctggtatct gacagagaac atccagagat 3600
tcctgccaaa tcccgccggc gtccagctgg aggacccgga gtttcaggca tctaacatca 3660
tgcattccat taatggttac gtgttcgact ccctgcagct gagcgtgtgc ctccacgagg 3720
tggcctactg gtacatcttg agcatcggcg cccagaccga ctttctgagc gtctttttct 3780
ccgggtatac tttcaaacat aagatggtgt acgaagatac tctgacgctg ttccctttct 3840
ctggggagac tgtgtttatg tctatggaga accctggact gtggattctc ggatgccaca 3900
acagtgactt tcgtaataga gggatgactg cactgctgaa ggtgtccagc tgtgataaaa 3960
atactggcga ctactacgaa gatagctatg aggatatctc agcatacctg ctgagcaaga 4020
ataacgccat cgagccccga agcttctcac agaatccccc tgtcctcaag gcccaccagg 4080
cggagatcac aaggaccaca ctccagtccg accaggagga gattgactac gatgacacga 4140
tttctgtgga gatgaaaaaa gaggactttg acatctacga tgaggatgaa aaccagagcc 4200
ctaggtcgtt ccagaagaaa acaaggcact acttcattgc cgccgtggag agactgtggg 4260
actacggaat gagtagttcc ccacacgtgt tgcggaacag agcccagagt gggtccgtcc 4320
cacagttcaa gaaggttgtt ttccaggagt tcacagatgg ctccttcact cagccactgt 4380
atcgcggcga gctgaatgag cacttgggct tattgggccc ctacattcgc gcagaagtcg 4440
aagataatat tatggtgacc ttccgcaacc aggccagccg gccttactca ttctactcct 4500
ctctcatctc ttatgaggag gatcagcgcc agggcgccga accccggaag aactttgtga 4560
agcccaatga aaccaaaact tacttttgga aggtgcagca ccatatggcg ccgacgaaag 4620
acgaatttga ctgcaaagcc tgggcctact tcagcgacgt cgacttggag aaggacgtcc 4680
acagcggcct gattggccct ttgttggtct gccataccaa tacactcaac cctgcccacg 4740
ggaggcaggt gaccgtgcag gagtttgcct tgttcttcac catcttcgac gaaaccaaga 4800
gctggtactt cacagagaac atggagagga actgcagagc accctgtaac atccagatgg 4860
aggaccctac tttcaaggaa aattacaggt tccatgccat taatggctac atcatggata 4920
ccctccccgg gcttgtgatg gctcaggacc agcgcatccg ctggtacctg ctctcaatgg 4980
gctccaacga gaacattcat agcatccact ttagtggcca cgtgtttacc gtgcgcaaga 5040
aggaggagta caagatggca ctgtacaacc tgtaccctgg cgtgtttgag acagtggaga 5100
tgctgccatc caaggccggc atctggcgcg tggagtgcct cattggggag cacctccatg 5160
ctggcatgtc tacactgttc ctggtgtaca gcaacaagtg tcagactcca ctcggaatgg 5220
cctccgggca tatccgcgat tttcagatca cggcctctgg ccagtatggc caatgggctc 5280
ccaagctggc caggctgcac tacagtggga gtatcaacgc ttggagcacc aaggagcctt 5340
tctcctggat caaggtggac ctgcttgccc ccatgattat tcacggcatt aagacacagg 5400
gggccaggca gaaattctcc tccctgtaca tctcccagtt catcatcatg tacagtctgg 5460
acggcaaaaa gtggcagacc taccgcggga acagtaccgg gacattgatg gtgttcttcg 5520
ggaacgtgga ctctagcggc attaaacaca acattttcaa cccccccatc attgctaggt 5580
atatcaggct ccatcccacc cactatagca tcaggtccac tctgcggatg gagctgatgg 5640
gctgcgacct taattcatgc agcatgccgc tgggcatgga gtcaaaggcc atctccgacg 5700
cccaaatcac cgcctccagc tacttcacca atatgttcgc cacctggagc cccagcaagg 5760
cccggctgca cctgcagggc cgcagcaacg cctggcggcc tcaggtgaac aaccccaagg 5820
agtggctgca ggtggacttc cagaaaacca tgaaggtgac tggggtcacc acccagggag 5880
tcaagagcct gctgaccagc atgtatgtga aggagttctt gatcagctcg tcacaggatg 5940
gccaccagtg gactttgttc tttcagaacg gtaaggtgaa agtgttccag ggaaaccaag 6000
attcctttac accagtggtc aactctctgg atcctcccct gctgacacgg tacctgcgga 6060
tccatcccca gtcatgggtg caccagattg ctctgcgcat ggaggtgctt ggctgcgagg 6120
cccaggacct gtactgaaat tcgcggccgc taaacccagc tttcttgtac aaagtggcaa 6180
ctttattata catagttgat cctcaggtgc aggctgccta tcagaaggtg gtggctggtg 6240
tggccaatgc cctggctcac aaataccact gagatctttt tccctctgcc aaaaattatg 6300
gggacatcat gaagcccctt gagcatctga cttctggcta ataaaggaaa tttattttca 6360
ttgcaatagt gtgttggaat tttttgtgtc tctcactcgg aaggacatat gggagggcaa 6420
atcatttaaa acatcagaat gagtatttgg tttagagttt ggcaacatat gcccatatgc 6480
tggctgccat gaacaaaggt tggctataaa gaggtcatca gtatatgaaa cagccccctg 6540
ctgtccattc cttattccat agaaaagcct tgacttgagg ttagattttt tttatatttt 6600
gttttgtgtt atttttttct ttaacatccc taaaattttc cttacatgtt ttactagcca 6660
gatttttcct cctctcctga ctactcccag tcatagctgt ccctcttctc ttatggagat 6720
c 6721
<210> 28
<211> 3733
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 28
ctcgacattg attattgact agttattaat agtaatcaat tacggggtca ttagttcata 60
gcccatatat ggagttccgc gttacataac ttacggtaaa tggcccgcct ggctgaccgc 120
ccaacgaccc ccgcccattg acgtcaataa tgacgtatgt tcccatagta acgccaatag 180
ggactttcca ttgacgtcaa tgggtggagt atttacggta aactgcccac ttggcagtac 240
atcaagtgta tcatatgcca agtacgcccc ctattgacgt caatgacggt aaatggcccg 300
cctggcatta tgcccagtac atgaccttat gggactttcc tacttggcag tacatctacg 360
tattagtcat cgctattacc atggtcgagg tgagccccac gttctgcttc actctcccca 420
tctccccccc ctccccaccc ccaattttgt atttatttat tttttaatta ttttgtgcag 480
cgatgggggc gggggggggg ggggggcgcg cgccaggcgg ggcggggcgg ggcgaggggc 540
ggggcggggc gaggcggaga ggtgcggcgg cagccaatca gagcggcgcg ctccgaaagt 600
ttccttttat ggcgaggcgg cggcggcggc ggccctataa aaagcgaagc gcgcggcggg 660
cgggagtcgc tgcgcgctgc cttcgccccg tgccccgctc cgccgccgcc tcgcgccgcc 720
cgccccggct ctgactgacc gcgttactcc cacaggtgag cgggcgggac ggcccttctc 780
ctccgggctg taattagcgc ttggtttaat gacggcttgt ttcttttctg tggctgcgtg 840
aaagccttga ggggctccgg gagggccctt tgtgcggggg gagcggctcg gggggtgcgt 900
gcgtgtgtgt gtgcgtgggg agcgccgcgt gcggctccgc gctgcccggc ggctgtgagc 960
gctgcgggcg cggcgcgggg ctttgtgcgc tccgcagtgt gcgcgagggg agcgcggccg 1020
ggggcggtgc cccgcggtgc ggggggggct gcgaggggaa caaaggctgc gtgcggggtg 1080
tgtgcgtggg ggggtgagca gggggtgtgg gcgcgtcggt cgggctgcaa ccccccctgc 1140
acccccctcc ccgagttgct gagcacggcc cggcttcggg tgcggggctc cgtacggggc 1200
gtggcgcggg gctcgccgtg ccgggcgggg ggtggcggca ggtgggggtg ccgggcgggg 1260
cggggccgcc tcgggccggg gagggctcgg gggaggggcg cggcggcccc cggagcgccg 1320
gcggctgtcg aggcgcggcg agccgcagcc attgcctttt atggtaatcg tgcgagaggg 1380
cgcagggact tcctttgtcc caaatctgtg cggagccgaa atctgggagg cgccgccgca 1440
ccccctctag cgggcgcggg gcgaagcggt gcggcgccgg caggaaggaa atgggcgggg 1500
agggccttcg tgcgtcgccg cgccgccgtc cccttctccc tctccagcct cggggctgtc 1560
cgcgggggga cggctgcctt cgggggggac ggggcagggc ggggttcggc ttctggcgtg 1620
tgaccggcgg ctctagagcc tctgctaacc atgttcatgc cttcttcttt ttcctacagc 1680
tcctgggcaa cgtgctggtt attgtgctgt ctcatcattt tggcaaagaa ttgcaagttt 1740
gtacaaaaaa gcaggctgcc accatgcagc gcgtgaacat gattatggcc gagtctcccg 1800
gcctgatcac catctgtctg ctgggctatc tgctgagcgc cgagtgcacc gtgtttctgg 1860
atcacgagaa cgccaacaag atcctgaaca gacccaagcg gtacaacagc ggcaagctgg 1920
aagagttcgt gcagggcaac ctggaacgcg agtgcatgga agagaagtgc agcttcgaag 1980
aggccagaga ggtgttcgag aacaccgaga gaaccaccga gttctggaag cagtacgtgg 2040
acggcgatca gtgcgagagc aacccttgtc tgaatggcgg cagctgcaag gacgacatca 2100
acagctacga gtgctggtgc cccttcggct tcgagggcaa gaattgcgag ctggacgtga 2160
cctgcaacat caagaacggc agatgcgagc agttctgcaa gaacagcgcc gacaacaagg 2220
tcgtgtgctc ctgcacagag ggctacagac tggccgagaa ccagaagtct tgcgagcccg 2280
ctgtgccctt tccatgtggc agagtgtctg tgtcccagac cagcaagctg accagagccg 2340
agacagtgtt ccccgacgtg gactacgtga acagcaccga ggccgagaca atcctggaca 2400
acatcaccca gagcacccag tccttcaacg acttcaccag agtcgtcggc ggcgaggatg 2460
ctaagcctgg acagtttcct tggcaagtgg tgctgaacgg caaggtggac gctttttgtg 2520
gcggctccat cgtgaacgag aagtggatcg tgaccgccgc tcactgtgtg gaaaccggcg 2580
tgaagattac agtggtggcc ggcgagcaca acatcgagga aacagagcac accgagcaga 2640
aacggaacgt gatcagaatc atccctcacc acaactacaa cgccgccatc aacaagtaca 2700
accacgatat cgccctgctg gaactggacg agcccctggt cctgaactct tacgtgaccc 2760
ctatctgtat cgccgacaaa gagtacacca acatctttct gaagttcggc agcggctacg 2820
tgtccggctg gggaagagtt ttccacaagg gcagatcagc cctggtgctg cagtacctga 2880
gagtgcccct ggtggataga gccacatgcc tgctgagcac caagttcacc atctacaaca 2940
acatgttctg cgccggcttc cacgaaggcg gcagagattc ttgtcaaggc gattctggcg 3000
gccctcacgt gacagaggtt gagggcacaa gctttctgac cggcatcatc agctggggcg 3060
aagagtgtgc catgaagggg aagtacggca tctacaccaa ggtgtccaga tacgtgaact 3120
ggatcaaaga aaagaccaag ctcacctgaa attcgcggcc gctaaaccca gctttcttgt 3180
acaaagtggc aactttatta tacatagttg atcctcaggt gcaggctgcc tatcagaagg 3240
tggtggctgg tgtggccaat gccctggctc acaaatacca ctgagatctt tttccctctg 3300
ccaaaaatta tggggacatc atgaagcccc ttgagcatct gacttctggc taataaagga 3360
aatttatttt cattgcaata gtgtgttgga attttttgtg tctctcactc ggaaggacat 3420
atgggagggc aaatcattta aaacatcaga atgagtattt ggtttagagt ttggcaacat 3480
atgcccatat gctggctgcc atgaacaaag gttggctata aagaggtcat cagtatatga 3540
aacagccccc tgctgtccat tccttattcc atagaaaagc cttgacttga ggttagattt 3600
tttttatatt ttgttttgtg ttattttttt ctttaacatc cctaaaattt tccttacatg 3660
ttttactagc cagatttttc ctcctctcct gactactccc agtcatagct gtccctcttc 3720
tcttatggag atc 3733
<210> 29
<211> 153
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> Сайт
<222> (1)..(20)
<223> /примечание="Сигнальная последовательность"
<400> 29
Met Tyr Arg Met Gln Leu Leu Ser Cys Ile Ala Leu Ser Leu Ala Leu
1. 5 10 15
Val Thr Asn Ser Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu
20 25 30
Gln Leu Glu His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile
35 40 45
Asn Asn Tyr Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Phe Lys Phe
50 55 60
Tyr Met Pro Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu
65 70 75 80
Glu Glu Leu Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys
85 90 95
Asn Phe His Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile
100 105 110
Val Leu Glu Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala
115 120 125
Asp Glu Thr Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe
130 135 140
Cys Gln Ser Ile Ile Ser Thr Leu Thr
145 150
<210> 30
<211> 65
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> Сайт
<222> (1)..(25)
<223> /примечание="Сигнальная последовательность"
<400> 30
Met Ile Pro Ala Lys Asp Met Ala Lys Val Met Ile Val Met Leu Ala
1. 5 10 15
Ile Cys Phe Leu Thr Lys Ser Asp Gly Lys Ser Val Lys Lys Arg Ser
20 25 30
Val Ser Glu Ile Gln Leu Met His Asn Leu Gly Lys His Leu Asn Ser
35 40 45
Met Glu Arg Val Glu Trp Leu Arg Lys Lys Leu Gln Asp Val His Asn
50 55 60
Phe
65
<210> 31
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> Сайт
<222> (1)..(25)
<223> /примечание="Сигнальная последовательность"
<400> 31
Met Ile Pro Ala Lys Asp Met Ala Lys Val Met Ile Val Met Leu Ala
1. 5 10 15
Ile Cys Phe Leu Thr Lys Ser Asp Gly Lys Ser Val Lys Lys Arg Ser
20 25 30
Val Ser Glu Ile Gln Leu Met His Asn Leu Gly Lys His Leu Asn Ser
35 40 45
Met Glu Arg Val Glu Trp Leu Arg Lys Lys Leu Gln Asp Val His Asn
50 55 60
Phe Val Ala Leu Gly Ala Pro Leu Ala Pro Arg Asp Ala Gly Ser Gln
65 70 75 80
Arg Pro Arg Lys Lys Glu Asp Asn Val Leu Val Glu Ser His Glu Lys
85 90 95
Ser Leu Gly Glu Ala Asp Lys Ala Asp Val Asn Val Leu Thr Lys Ala
100 105 110
Lys Ser Gln
115
<210> 32
<211> 506
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> Сайт
<222> (1)..(22)
<223> /примечание="Сигнальная последовательность"
<400> 32
Met Ile Pro Ala Arg Phe Ala Gly Val Leu Leu Ala Leu Ala Leu Ile
1. 5 10 15
Leu Pro Gly Thr Leu Cys Ser Leu Ser Cys Arg Pro Pro Met Val Lys
20 25 30
Leu Val Cys Pro Ala Asp Asn Leu Arg Ala Glu Gly Leu Glu Cys Thr
35 40 45
Lys Thr Cys Gln Asn Tyr Asp Leu Glu Cys Met Ser Met Gly Cys Val
50 55 60
Ser Gly Cys Leu Cys Pro Pro Gly Met Val Arg His Glu Asn Arg Cys
65 70 75 80
Val Ala Leu Glu Arg Cys Pro Cys Phe His Gln Gly Lys Glu Tyr Ala
85 90 95
Pro Gly Glu Thr Val Lys Ile Gly Cys Asn Thr Cys Val Cys Arg Asp
100 105 110
Arg Lys Trp Asn Cys Thr Asp His Val Cys Asp Ala Thr Cys Ser Thr
115 120 125
Ile Gly Met Ala His Tyr Leu Thr Phe Asp Gly Leu Lys Tyr Leu Phe
130 135 140
Pro Gly Glu Cys Gln Tyr Val Leu Val Gln Asp Tyr Cys Gly Ser Asn
145 150 155 160
Pro Gly Thr Phe Arg Ile Leu Val Gly Asn Lys Gly Cys Ser His Pro
165 170 175
Ser Val Lys Cys Lys Lys Arg Val Thr Ile Leu Val Glu Gly Gly Glu
180 185 190
Ile Glu Leu Phe Asp Gly Glu Val Asn Val Lys Arg Pro Met Lys Asp
195 200 205
Glu Thr His Phe Glu Val Val Glu Ser Gly Arg Tyr Ile Ile Leu Leu
210 215 220
Leu Gly Lys Ala Leu Ser Val Val Trp Asp Arg His Leu Ser Ile Ser
225 230 235 240
Val Val Leu Lys Gln Thr Tyr Gln Glu Lys Val Cys Gly Leu Cys Gly
245 250 255
Asn Phe Asp Gly Ile Gln Asn Asn Asp Leu Thr Ser Ser Asn Leu Gln
260 265 270
Val Glu Glu Asp Pro Val Asp Phe Gly Asn Ser Trp Lys Val Ser Ser
275 280 285
Gln Cys Ala Asp Thr Arg Lys Val Pro Leu Asp Ser Ser Pro Ala Thr
290 295 300
Cys His Asn Asn Ile Met Lys Gln Thr Met Val Asp Ser Ser Cys Arg
305 310 315 320
Ile Leu Thr Ser Asp Val Phe Gln Asp Cys Asn Lys Leu Val Asp Pro
325 330 335
Glu Pro Tyr Leu Asp Val Cys Ile Tyr Asp Thr Cys Ser Cys Glu Ser
340 345 350
Ile Gly Asp Cys Ala Cys Phe Cys Asp Thr Ile Ala Ala Tyr Ala His
355 360 365
Val Cys Ala Gln His Gly Lys Val Val Thr Trp Arg Thr Ala Thr Leu
370 375 380
Cys Pro Gln Ser Cys Glu Glu Arg Asn Leu Arg Glu Asn Gly Tyr Glu
385 390 395 400
Cys Glu Trp Arg Tyr Asn Ser Cys Ala Pro Ala Cys Gln Val Thr Cys
405 410 415
Gln His Pro Glu Pro Leu Ala Cys Pro Val Gln Cys Val Glu Gly Cys
420 425 430
His Ala His Cys Pro Pro Gly Lys Ile Leu Asp Glu Leu Leu Gln Thr
435 440 445
Cys Val Asp Pro Glu Asp Cys Pro Val Cys Glu Val Ala Gly Arg Arg
450 455 460
Phe Ala Ser Gly Lys Lys Val Thr Leu Asn Pro Ser Asp Pro Glu His
465 470 475 480
Cys Gln Ile Cys His Cys Asp Val Val Asn Leu Thr Cys Glu Ala Cys
485 490 495
Gln Glu Pro Gly Gly Leu Val Val Pro Pro
500 505
<210> 33
<211> 1247
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> Сайт
<222> (1)..(22)
<223> /примечание="Сигнальная последовательность"
<400> 33
Met Ile Pro Ala Arg Phe Ala Gly Val Leu Leu Ala Leu Ala Leu Ile
1. 5 10 15
Leu Pro Gly Thr Leu Cys Ala Glu Gly Thr Arg Gly Arg Ser Ser Thr
20 25 30
Ala Arg Cys Ser Leu Phe Gly Ser Asp Phe Val Asn Thr Phe Asp Gly
35 40 45
Ser Met Tyr Ser Phe Ala Gly Tyr Cys Ser Tyr Leu Leu Ala Gly Gly
50 55 60
Cys Gln Lys Arg Ser Phe Ser Ile Ile Gly Asp Phe Gln Asn Gly Lys
65 70 75 80
Arg Val Ser Leu Ser Val Tyr Leu Gly Glu Phe Phe Asp Ile His Leu
85 90 95
Phe Val Asn Gly Thr Val Thr Gln Gly Asp Gln Arg Val Ser Met Pro
100 105 110
Tyr Ala Ser Lys Gly Leu Tyr Leu Glu Thr Glu Ala Gly Tyr Tyr Lys
115 120 125
Leu Ser Gly Glu Ala Tyr Gly Phe Val Ala Arg Ile Asp Gly Ser Gly
130 135 140
Asn Phe Gln Val Leu Leu Ser Asp Arg Tyr Phe Asn Lys Thr Cys Gly
145 150 155 160
Leu Cys Gly Asn Phe Asn Ile Phe Ala Glu Asp Asp Phe Met Thr Gln
165 170 175
Glu Gly Thr Leu Thr Ser Asp Pro Tyr Asp Phe Ala Asn Ser Trp Ala
180 185 190
Leu Ser Ser Gly Glu Gln Trp Cys Glu Arg Ala Ser Pro Pro Ser Ser
195 200 205
Ser Cys Asn Ile Ser Ser Gly Glu Met Gln Lys Gly Leu Trp Glu Gln
210 215 220
Cys Gln Leu Leu Lys Ser Thr Ser Val Phe Ala Arg Cys His Pro Leu
225 230 235 240
Val Asp Pro Glu Pro Phe Val Ala Leu Cys Glu Lys Thr Leu Cys Glu
245 250 255
Cys Ala Gly Gly Leu Glu Cys Ala Cys Pro Ala Leu Leu Glu Tyr Ala
260 265 270
Arg Thr Cys Ala Gln Glu Gly Met Val Leu Tyr Gly Trp Thr Asp His
275 280 285
Ser Ala Cys Ser Pro Val Cys Pro Ala Gly Met Glu Tyr Arg Gln Cys
290 295 300
Val Ser Pro Cys Ala Arg Thr Cys Gln Ser Leu His Ile Asn Glu Met
305 310 315 320
Cys Gln Glu Arg Cys Val Asp Gly Cys Ser Cys Pro Glu Gly Gln Leu
325 330 335
Leu Asp Glu Gly Leu Cys Val Glu Ser Thr Glu Cys Pro Cys Val His
340 345 350
Ser Gly Lys Arg Tyr Pro Pro Gly Thr Ser Leu Ser Arg Asp Cys Asn
355 360 365
Thr Cys Ile Cys Arg Asn Ser Gln Trp Ile Cys Ser Asn Glu Glu Cys
370 375 380
Pro Gly Glu Cys Leu Val Thr Gly Gln Ser His Phe Lys Ser Phe Asp
385 390 395 400
Asn Arg Tyr Phe Thr Phe Ser Gly Ile Cys Gln Tyr Leu Leu Ala Arg
405 410 415
Asp Cys Gln Asp His Ser Phe Ser Ile Val Ile Glu Thr Val Gln Cys
420 425 430
Ala Asp Asp Arg Asp Ala Val Cys Thr Arg Ser Val Thr Val Arg Leu
435 440 445
Pro Gly Leu His Asn Ser Leu Val Lys Leu Lys His Gly Ala Gly Val
450 455 460
Ala Met Asp Gly Gln Asp Val Gln Leu Pro Leu Leu Lys Gly Asp Leu
465 470 475 480
Arg Ile Gln His Thr Val Thr Ala Ser Val Arg Leu Ser Tyr Gly Glu
485 490 495
Asp Leu Gln Met Asp Trp Asp Gly Arg Gly Arg Leu Leu Val Lys Leu
500 505 510
Ser Pro Val Tyr Ala Gly Lys Thr Cys Gly Leu Cys Gly Asn Tyr Asn
515 520 525
Gly Asn Gln Gly Asp Asp Phe Leu Thr Pro Ser Gly Leu Ala Glu Pro
530 535 540
Arg Val Glu Asp Phe Gly Asn Ala Trp Lys Leu His Gly Asp Cys Gln
545 550 555 560
Asp Leu Gln Lys Gln His Ser Asp Pro Cys Ala Leu Asn Pro Arg Met
565 570 575
Thr Arg Phe Ser Glu Glu Ala Cys Ala Val Leu Thr Ser Pro Thr Phe
580 585 590
Glu Ala Cys His Arg Ala Val Ser Pro Leu Pro Tyr Leu Arg Asn Cys
595 600 605
Arg Tyr Asp Val Cys Ser Cys Ser Asp Gly Arg Glu Cys Leu Cys Gly
610 615 620
Ala Leu Ala Ser Tyr Ala Ala Ala Cys Ala Gly Arg Gly Val Arg Val
625 630 635 640
Ala Trp Arg Glu Pro Gly Arg Cys Glu Leu Asn Cys Pro Lys Gly Gln
645 650 655
Val Tyr Leu Gln Cys Gly Thr Pro Cys Asn Leu Thr Cys Arg Ser Leu
660 665 670
Ser Tyr Pro Asp Glu Glu Cys Asn Glu Ala Cys Leu Glu Gly Cys Phe
675 680 685
Cys Pro Pro Gly Leu Tyr Met Asp Glu Arg Gly Asp Cys Val Pro Lys
690 695 700
Ala Gln Cys Pro Cys Tyr Tyr Asp Gly Glu Ile Phe Gln Pro Glu Asp
705 710 715 720
Ile Phe Ser Asp His His Thr Met Cys Tyr Cys Glu Asp Gly Phe Met
725 730 735
His Cys Thr Met Ser Gly Val Pro Gly Ser Leu Leu Pro Asp Ala Val
740 745 750
Leu Ser Ser Pro Leu Ser His Arg Ser Lys Arg Ser Leu Ser Cys Arg
755 760 765
Pro Pro Met Val Lys Leu Val Cys Pro Ala Asp Asn Leu Arg Ala Glu
770 775 780
Gly Leu Glu Cys Thr Lys Thr Cys Gln Asn Tyr Asp Leu Glu Cys Met
785 790 795 800
Ser Met Gly Cys Val Ser Gly Cys Leu Cys Pro Pro Gly Met Val Arg
805 810 815
His Glu Asn Arg Cys Val Ala Leu Glu Arg Cys Pro Cys Phe His Gln
820 825 830
Gly Lys Glu Tyr Ala Pro Gly Glu Thr Val Lys Ile Gly Cys Asn Thr
835 840 845
Cys Val Cys Arg Asp Arg Lys Trp Asn Cys Thr Asp His Val Cys Asp
850 855 860
Ala Thr Cys Ser Thr Ile Gly Met Ala His Tyr Leu Thr Phe Asp Gly
865 870 875 880
Leu Lys Tyr Leu Phe Pro Gly Glu Cys Gln Tyr Val Leu Val Gln Asp
885 890 895
Tyr Cys Gly Ser Asn Pro Gly Thr Phe Arg Ile Leu Val Gly Asn Lys
900 905 910
Gly Cys Ser His Pro Ser Val Lys Cys Lys Lys Arg Val Thr Ile Leu
915 920 925
Val Glu Gly Gly Glu Ile Glu Leu Phe Asp Gly Glu Val Asn Val Lys
930 935 940
Arg Pro Met Lys Asp Glu Thr His Phe Glu Val Val Glu Ser Gly Arg
945 950 955 960
Tyr Ile Ile Leu Leu Leu Gly Lys Ala Leu Ser Val Val Trp Asp Arg
965 970 975
His Leu Ser Ile Ser Val Val Leu Lys Gln Thr Tyr Gln Glu Lys Val
980 985 990
Cys Gly Leu Cys Gly Asn Phe Asp Gly Ile Gln Asn Asn Asp Leu Thr
995 1000 1005
Ser Ser Asn Leu Gln Val Glu Glu Asp Pro Val Asp Phe Gly Asn
1010 1015 1020
Ser Trp Lys Val Ser Ser Gln Cys Ala Asp Thr Arg Lys Val Pro
1025 1030 1035
Leu Asp Ser Ser Pro Ala Thr Cys His Asn Asn Ile Met Lys Gln
1040 1045 1050
Thr Met Val Asp Ser Ser Cys Arg Ile Leu Thr Ser Asp Val Phe
1055 1060 1065
Gln Asp Cys Asn Lys Leu Val Asp Pro Glu Pro Tyr Leu Asp Val
1070 1075 1080
Cys Ile Tyr Asp Thr Cys Ser Cys Glu Ser Ile Gly Asp Cys Ala
1085 1090 1095
Cys Phe Cys Asp Thr Ile Ala Ala Tyr Ala His Val Cys Ala Gln
1100 1105 1110
His Gly Lys Val Val Thr Trp Arg Thr Ala Thr Leu Cys Pro Gln
1115 1120 1125
Ser Cys Glu Glu Arg Asn Leu Arg Glu Asn Gly Tyr Glu Cys Glu
1130 1135 1140
Trp Arg Tyr Asn Ser Cys Ala Pro Ala Cys Gln Val Thr Cys Gln
1145 1150 1155
His Pro Glu Pro Leu Ala Cys Pro Val Gln Cys Val Glu Gly Cys
1160 1165 1170
His Ala His Cys Pro Pro Gly Lys Ile Leu Asp Glu Leu Leu Gln
1175 1180 1185
Thr Cys Val Asp Pro Glu Asp Cys Pro Val Cys Glu Val Ala Gly
1190 1195 1200
Arg Arg Phe Ala Ser Gly Lys Lys Val Thr Leu Asn Pro Ser Asp
1205 1210 1215
Pro Glu His Cys Gln Ile Cys His Cys Asp Val Val Asn Leu Thr
1220 1225 1230
Cys Glu Ala Cys Gln Glu Pro Gly Gly Leu Val Val Pro Pro
1235 1240 1245
<210> 34
<211> 232
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 34
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
1. 5 10 15
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
20 25 30
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
35 40 45
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
50 55 60
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
65 70 75 80
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
85 90 95
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
100 105 110
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
115 120 125
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
130 135 140
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
145 150 155 160
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
165 170 175
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
180 185 190
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
195 200 205
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
210 215 220
Ser Leu Ser Leu Ser Pro Gly Lys
225 230
<210> 35
<211> 585
<212> БЕЛОК
<213> Homo sapiens
<400> 35
Asp Ala His Lys Ser Glu Val Ala His Arg Phe Lys Asp Leu Gly Glu
1. 5 10 15
Glu Asn Phe Lys Ala Leu Val Leu Ile Ala Phe Ala Gln Tyr Leu Gln
20 25 30
Gln Cys Pro Phe Glu Asp His Val Lys Leu Val Asn Glu Val Thr Glu
35 40 45
Phe Ala Lys Thr Cys Val Ala Asp Glu Ser Ala Glu Asn Cys Asp Lys
50 55 60
Ser Leu His Thr Leu Phe Gly Asp Lys Leu Cys Thr Val Ala Thr Leu
65 70 75 80
Arg Glu Thr Tyr Gly Glu Met Ala Asp Cys Cys Ala Lys Gln Glu Pro
85 90 95
Glu Arg Asn Glu Cys Phe Leu Gln His Lys Asp Asp Asn Pro Asn Leu
100 105 110
Pro Arg Leu Val Arg Pro Glu Val Asp Val Met Cys Thr Ala Phe His
115 120 125
Asp Asn Glu Glu Thr Phe Leu Lys Lys Tyr Leu Tyr Glu Ile Ala Arg
130 135 140
Arg His Pro Tyr Phe Tyr Ala Pro Glu Leu Leu Phe Phe Ala Lys Arg
145 150 155 160
Tyr Lys Ala Ala Phe Thr Glu Cys Cys Gln Ala Ala Asp Lys Ala Ala
165 170 175
Cys Leu Leu Pro Lys Leu Asp Glu Leu Arg Asp Glu Gly Lys Ala Ser
180 185 190
Ser Ala Lys Gln Arg Leu Lys Cys Ala Ser Leu Gln Lys Phe Gly Glu
195 200 205
Arg Ala Phe Lys Ala Trp Ala Val Ala Arg Leu Ser Gln Arg Phe Pro
210 215 220
Lys Ala Glu Phe Ala Glu Val Ser Lys Leu Val Thr Asp Leu Thr Lys
225 230 235 240
Val His Thr Glu Cys Cys His Gly Asp Leu Leu Glu Cys Ala Asp Asp
245 250 255
Arg Ala Asp Leu Ala Lys Tyr Ile Cys Glu Asn Gln Asp Ser Ile Ser
260 265 270
Ser Lys Leu Lys Glu Cys Cys Glu Lys Pro Leu Leu Glu Lys Ser His
275 280 285
Cys Ile Ala Glu Val Glu Asn Asp Glu Met Pro Ala Asp Leu Pro Ser
290 295 300
Leu Ala Ala Asp Phe Val Glu Ser Lys Asp Val Cys Lys Asn Tyr Ala
305 310 315 320
Glu Ala Lys Asp Val Phe Leu Gly Met Phe Leu Tyr Glu Tyr Ala Arg
325 330 335
Arg His Pro Asp Tyr Ser Val Val Leu Leu Leu Arg Leu Ala Lys Thr
340 345 350
Tyr Glu Thr Thr Leu Glu Lys Cys Cys Ala Ala Ala Asp Pro His Glu
355 360 365
Cys Tyr Ala Lys Val Phe Asp Glu Phe Lys Pro Leu Val Glu Glu Pro
370 375 380
Gln Asn Leu Ile Lys Gln Asn Cys Glu Leu Phe Glu Gln Leu Gly Glu
385 390 395 400
Tyr Lys Phe Gln Asn Ala Leu Leu Val Arg Tyr Thr Lys Lys Val Pro
405 410 415
Gln Val Ser Thr Pro Thr Leu Val Glu Val Ser Arg Asn Leu Gly Lys
420 425 430
Val Gly Ser Lys Cys Cys Lys His Pro Glu Ala Lys Arg Met Pro Cys
435 440 445
Ala Glu Asp Tyr Leu Ser Val Val Leu Asn Gln Leu Cys Val Leu His
450 455 460
Glu Lys Thr Pro Val Ser Asp Arg Val Thr Lys Cys Cys Thr Glu Ser
465 470 475 480
Leu Val Asn Arg Arg Pro Cys Phe Ser Ala Leu Glu Val Asp Glu Thr
485 490 495
Tyr Val Pro Lys Glu Phe Asn Ala Glu Thr Phe Thr Phe His Ala Asp
500 505 510
Ile Cys Thr Leu Ser Glu Lys Glu Arg Gln Ile Lys Lys Gln Thr Ala
515 520 525
Leu Val Glu Leu Val Lys His Lys Pro Lys Ala Thr Lys Glu Gln Leu
530 535 540
Lys Ala Val Met Asp Asp Phe Ala Ala Phe Val Glu Lys Cys Cys Lys
545 550 555 560
Ala Asp Asp Lys Glu Thr Cys Phe Ala Glu Glu Gly Lys Lys Leu Val
565 570 575
Ala Ala Ser Gln Ala Ala Leu Gly Leu
580 585
<210> 36
<211> 415
<212> БЕЛОК
<213> Homo sapiens
<400> 36
Tyr Asn Ser Gly Lys Leu Glu Glu Phe Val Gln Gly Asn Leu Glu Arg
1. 5 10 15
Glu Cys Met Glu Glu Lys Cys Ser Phe Glu Glu Ala Arg Glu Val Phe
20 25 30
Glu Asn Thr Glu Arg Thr Thr Glu Phe Trp Lys Gln Tyr Val Asp Gly
35 40 45
Asp Gln Cys Glu Ser Asn Pro Cys Leu Asn Gly Gly Ser Cys Lys Asp
50 55 60
Asp Ile Asn Ser Tyr Glu Cys Trp Cys Pro Phe Gly Phe Glu Gly Lys
65 70 75 80
Asn Cys Glu Leu Asp Val Thr Cys Asn Ile Lys Asn Gly Arg Cys Glu
85 90 95
Gln Phe Cys Lys Asn Ser Ala Asp Asn Lys Val Val Cys Ser Cys Thr
100 105 110
Glu Gly Tyr Arg Leu Ala Glu Asn Gln Lys Ser Cys Glu Pro Ala Val
115 120 125
Pro Phe Pro Cys Gly Arg Val Ser Val Ser Gln Thr Ser Lys Leu Thr
130 135 140
Arg Ala Glu Thr Val Phe Pro Asp Val Asp Tyr Val Asn Ser Thr Glu
145 150 155 160
Ala Glu Thr Ile Leu Asp Asn Ile Thr Gln Ser Thr Gln Ser Phe Asn
165 170 175
Asp Phe Thr Arg Val Val Gly Gly Glu Asp Ala Lys Pro Gly Gln Phe
180 185 190
Pro Trp Gln Val Val Leu Asn Gly Lys Val Asp Ala Phe Cys Gly Gly
195 200 205
Ser Ile Val Asn Glu Lys Trp Ile Val Thr Ala Ala His Cys Val Glu
210 215 220
Thr Gly Val Lys Ile Thr Val Val Ala Gly Glu His Asn Ile Glu Glu
225 230 235 240
Thr Glu His Thr Glu Gln Lys Arg Asn Val Ile Arg Ile Ile Pro His
245 250 255
His Asn Tyr Asn Ala Ala Ile Asn Lys Tyr Asn His Asp Ile Ala Leu
260 265 270
Leu Glu Leu Asp Glu Pro Leu Val Leu Asn Ser Tyr Val Thr Pro Ile
275 280 285
Cys Ile Ala Asp Lys Glu Tyr Thr Asn Ile Phe Leu Lys Phe Gly Ser
290 295 300
Gly Tyr Val Ser Gly Trp Gly Arg Val Phe His Lys Gly Arg Ser Ala
305 310 315 320
Leu Val Leu Gln Tyr Leu Arg Val Pro Leu Val Asp Arg Ala Thr Cys
325 330 335
Leu Arg Ser Thr Lys Phe Thr Ile Tyr Asn Asn Met Phe Cys Ala Gly
340 345 350
Phe His Glu Gly Gly Arg Asp Ser Cys Gln Gly Asp Ser Gly Gly Pro
355 360 365
His Val Thr Glu Val Glu Gly Thr Ser Phe Leu Thr Gly Ile Ile Ser
370 375 380
Trp Gly Glu Glu Cys Ala Met Lys Gly Lys Tyr Gly Ile Tyr Thr Lys
385 390 395 400
Val Ser Arg Tyr Val Asn Trp Ile Lys Glu Lys Thr Lys Leu Thr
405 410 415
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Т-КЛЕТКИ С ДВУМЯ ХИМЕРНЫМИ АНТИГЕННЫМИ РЕЦЕПТОРАМИ CAR | 2021 |
|
RU2839662C1 |
| КЛЕТКИ ДЛЯ ИММУНОТЕРАПИИ, СКОНСТРУИРОВАННЫЕ ДЛЯ НАЦЕЛИВАНИЯ НА АНТИГЕН, ПРИСУТСТВУЮЩИЙ ОДНОВРЕМЕННО НА ИММУННЫХ КЛЕТКАХ И НА ПАТОЛОГИЧЕСКИХ КЛЕТКАХ | 2015 |
|
RU2714258C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ УСИЛЕНИЯ РАЗМНОЖЕНИЯ И ЦИТОТОКСИЧНОСТИ КЛЕТОК, ЯВЛЯЮЩИХСЯ НАТУРАЛЬНЫМИ КИЛЛЕРАМИ | 2020 |
|
RU2839702C2 |
| ИСКУССТВЕННЫЕ АНТИГЕНПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2763798C1 |
| АНТИ-CLL1-СПЕЦИФИЧЕСКИЕ ОДНОЦЕПОЧЕЧНЫЕ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ (scCAR) ДЛЯ ИММУНОТЕРАПИИ РАКА | 2016 |
|
RU2731543C2 |
| CD123-СПЕЦИФИЧЕСКИЕ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ ДЛЯ ИММУНОТЕРАПИИ РАКА | 2015 |
|
RU2727290C2 |
| МОДИФИЦИРОВАННЫЕ НЕПРИРОДНЫЕ ЛИГАНДЫ NKG2D, КОТОРЫЕ ИЗБИРАТЕЛЬНО ДОСТАВЛЯЮТ ПРИСОЕДИНЕННЫЕ ГЕТЕРОЛОГИЧНЫЕ МОЛЕКУЛЫ К НЕПРИРОДНЫМ РЕЦЕПТОРАМ NKG2D НА CAR-КЛЕТКАХ | 2020 |
|
RU2823728C2 |
| Химерные антигенные рецепторы, нацеливающиеся на CD70 | 2019 |
|
RU2801824C2 |
| HPV-СПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2018 |
|
RU2804664C2 |
| ГЕНЕТИЧЕСКИ СКОНСТРУИРОВАННЫЕ КЛЕТКИ, ЧУВСТВИТЕЛЬНЫЕ К КЛОСТРИДИАЛЬНЫМ НЕЙРОТОКСИНАМ | 2020 |
|
RU2824389C2 |
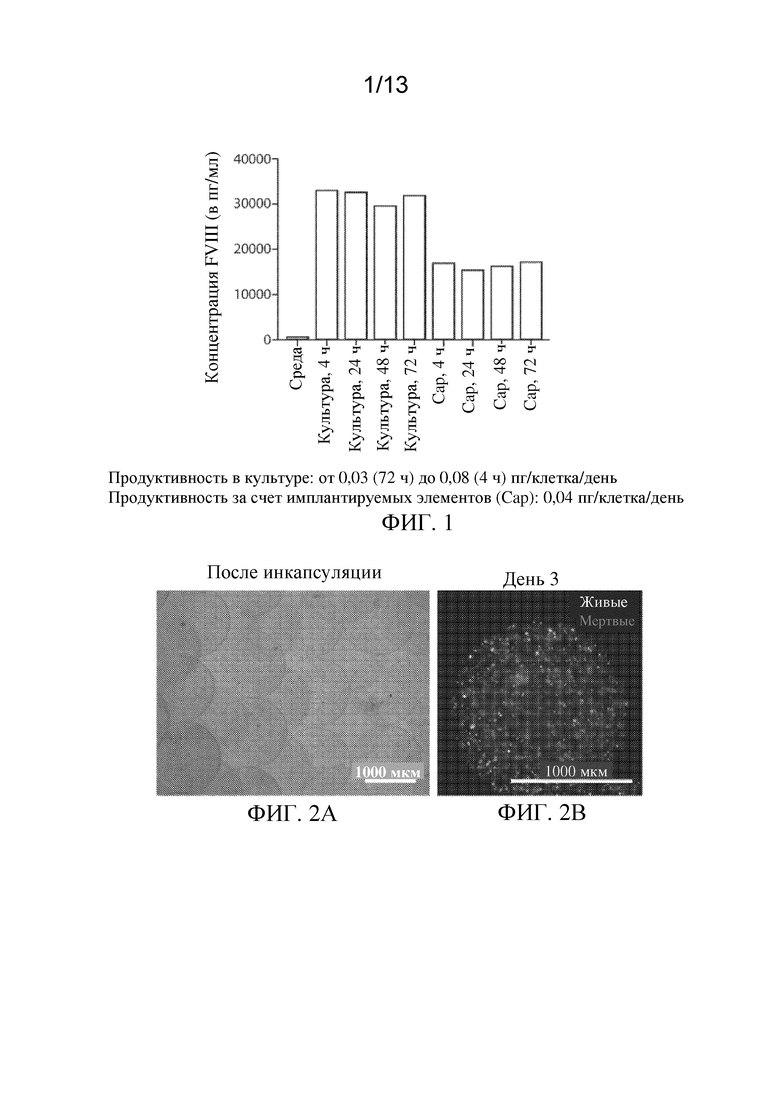

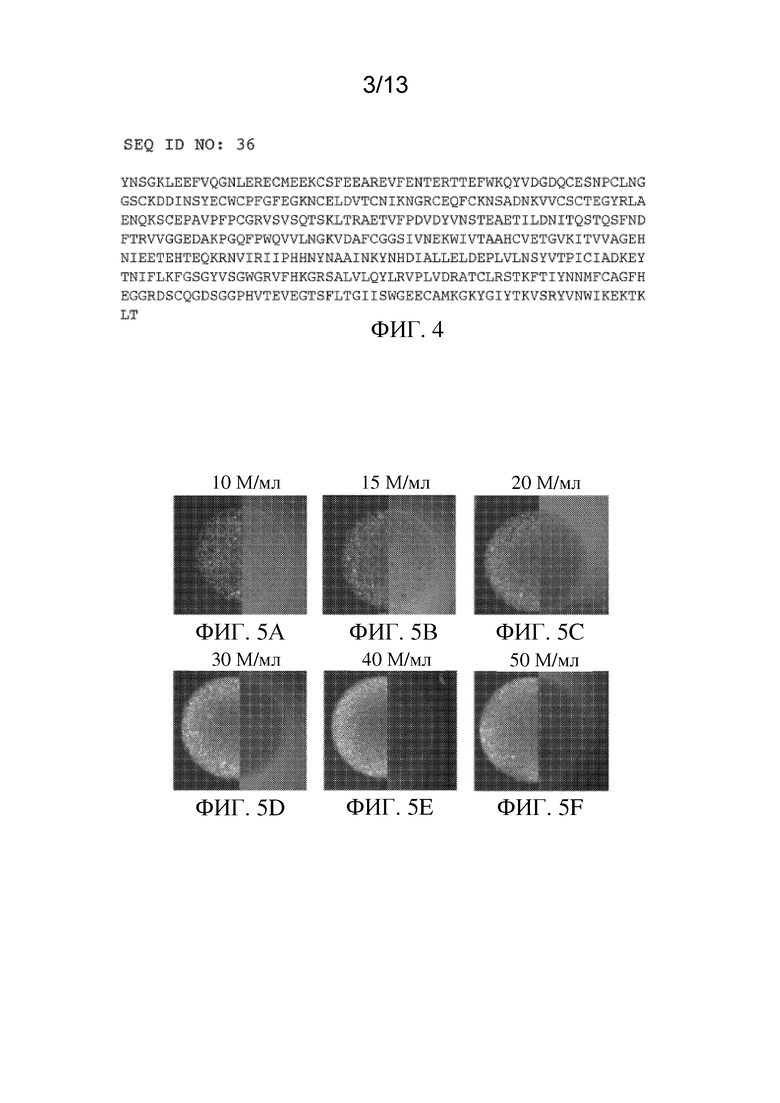
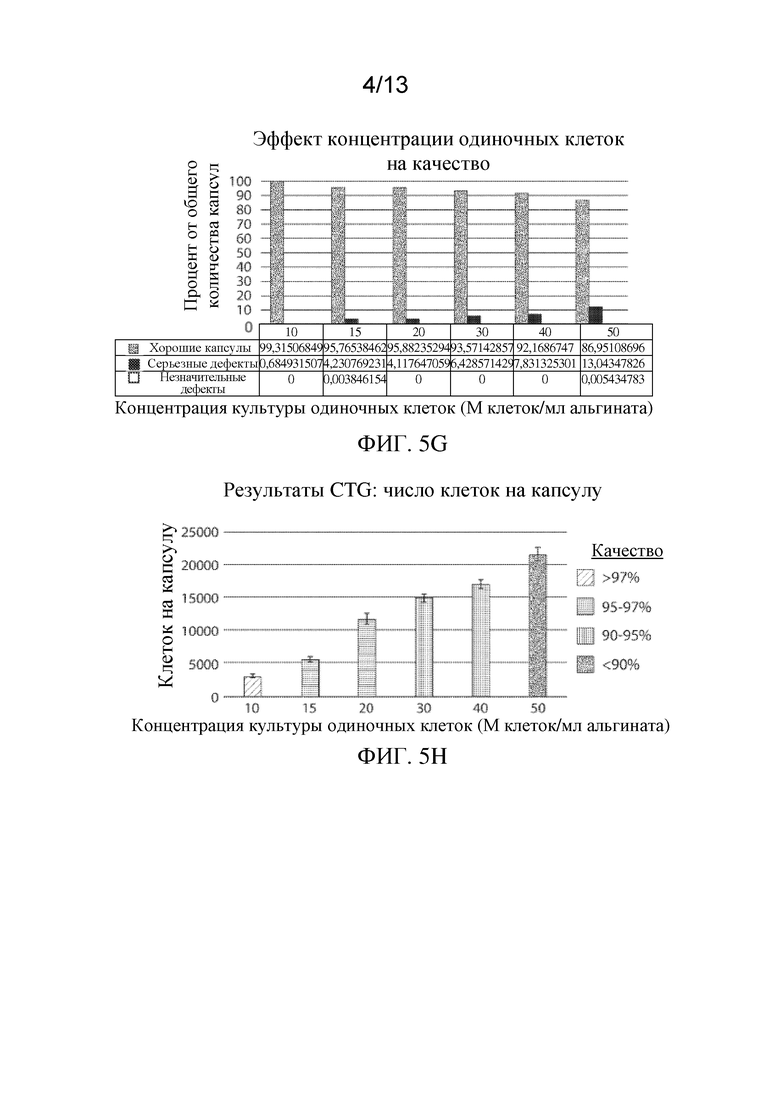

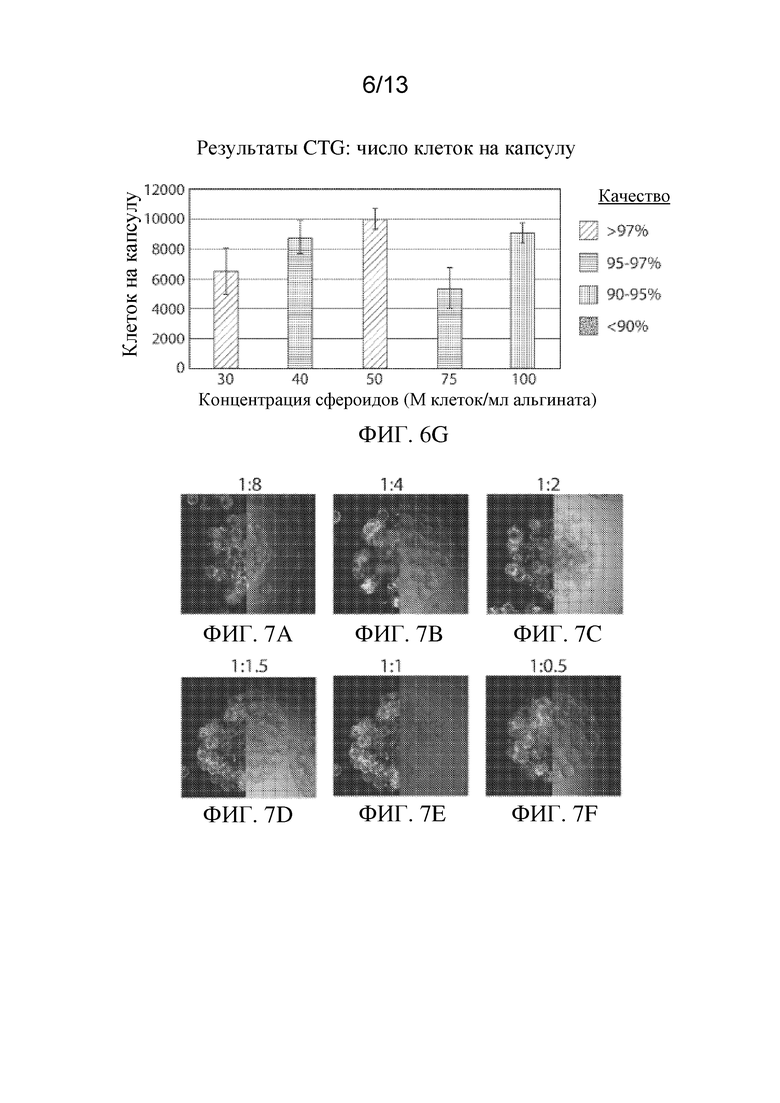
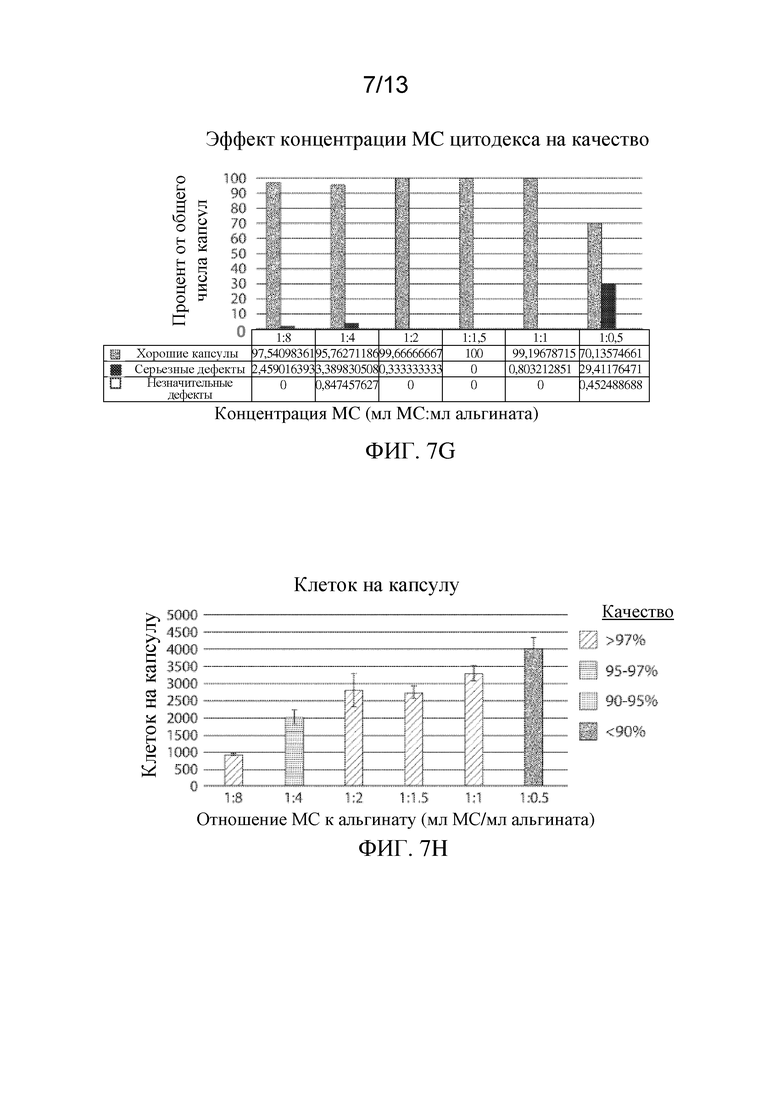
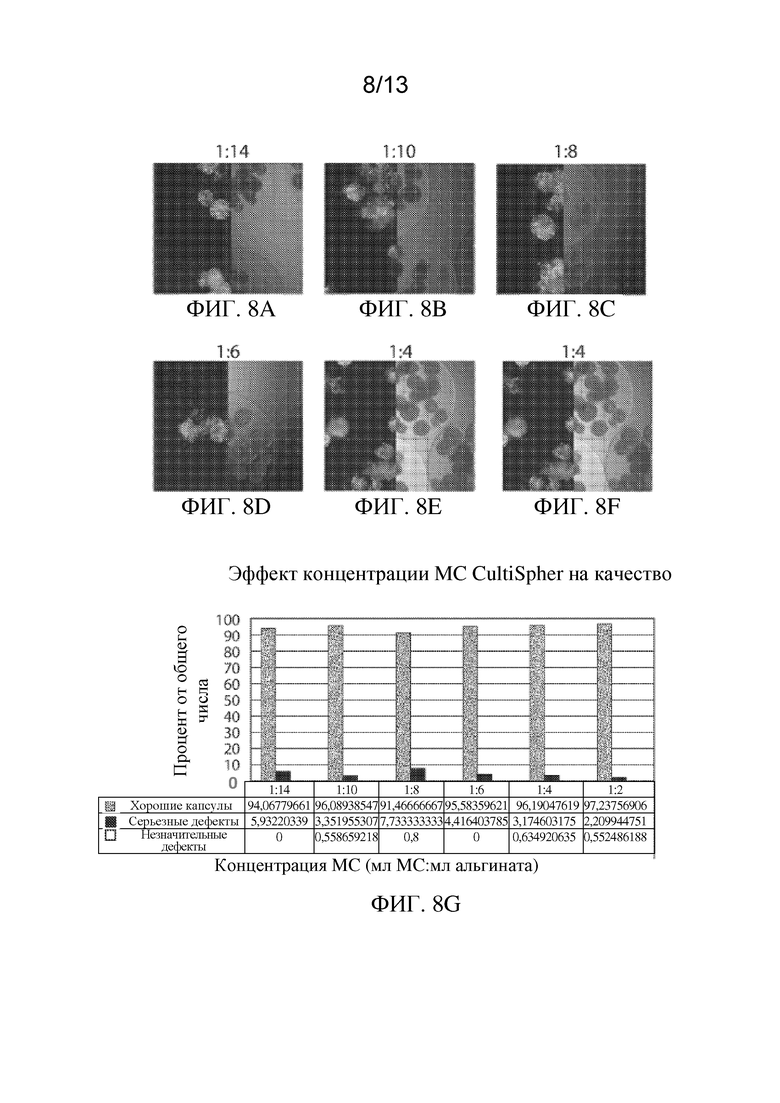
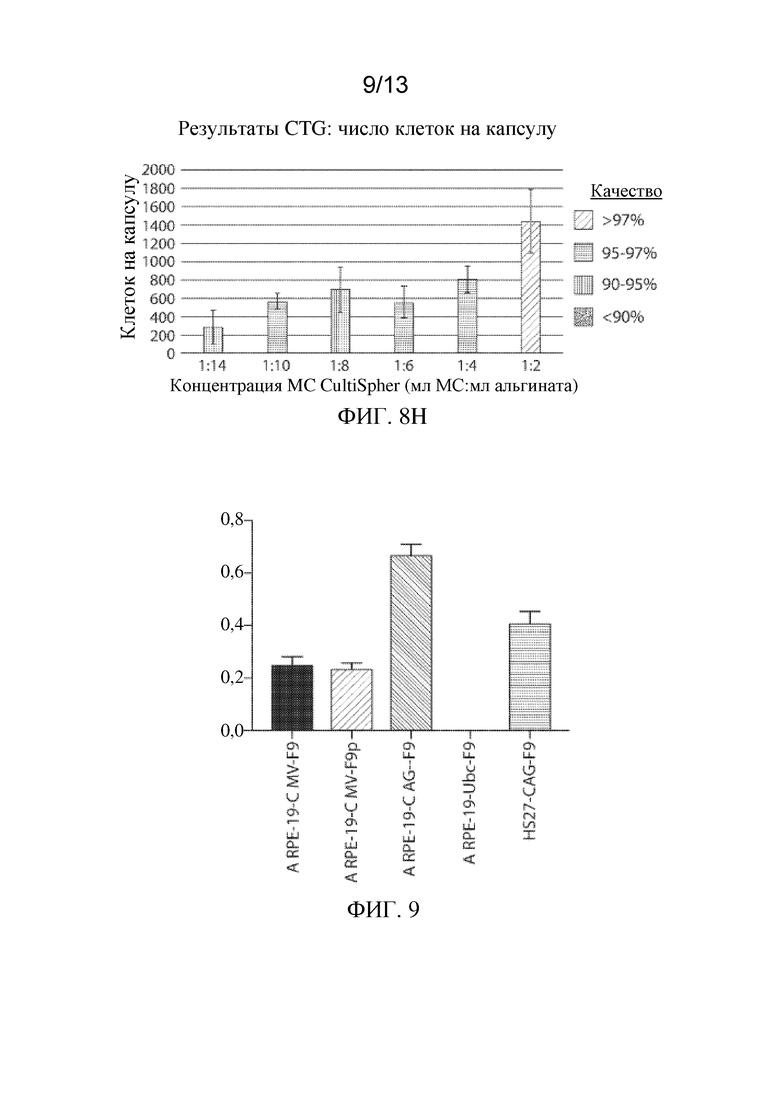
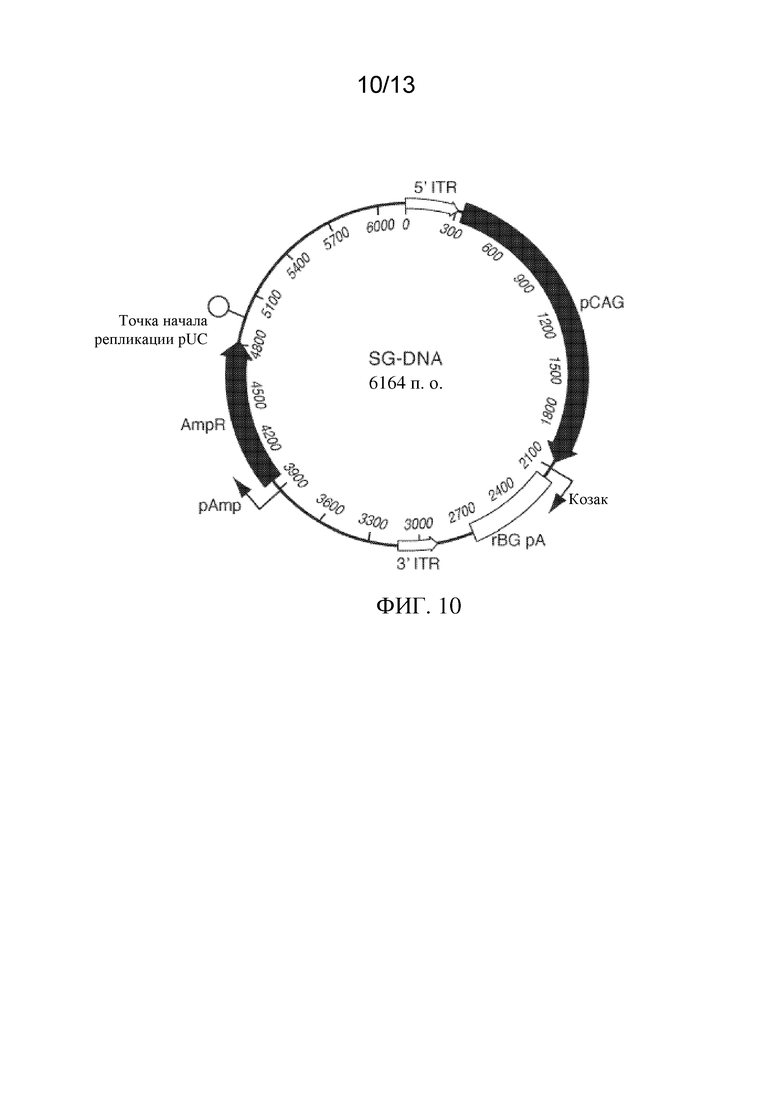
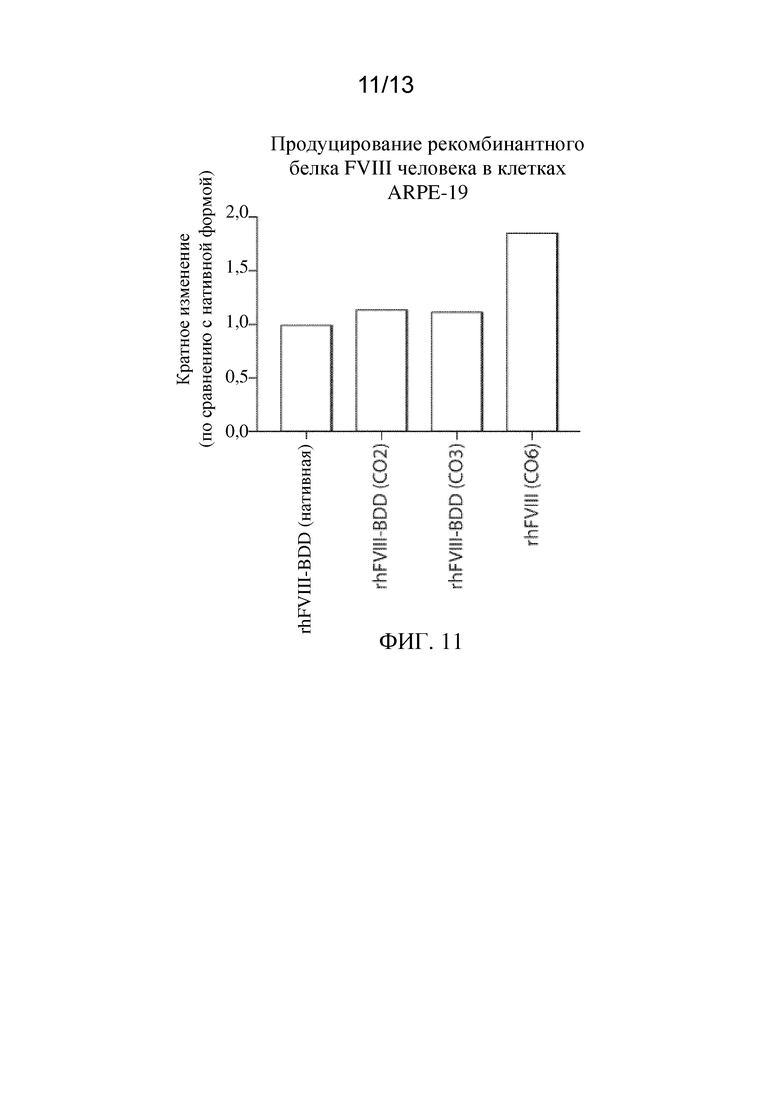
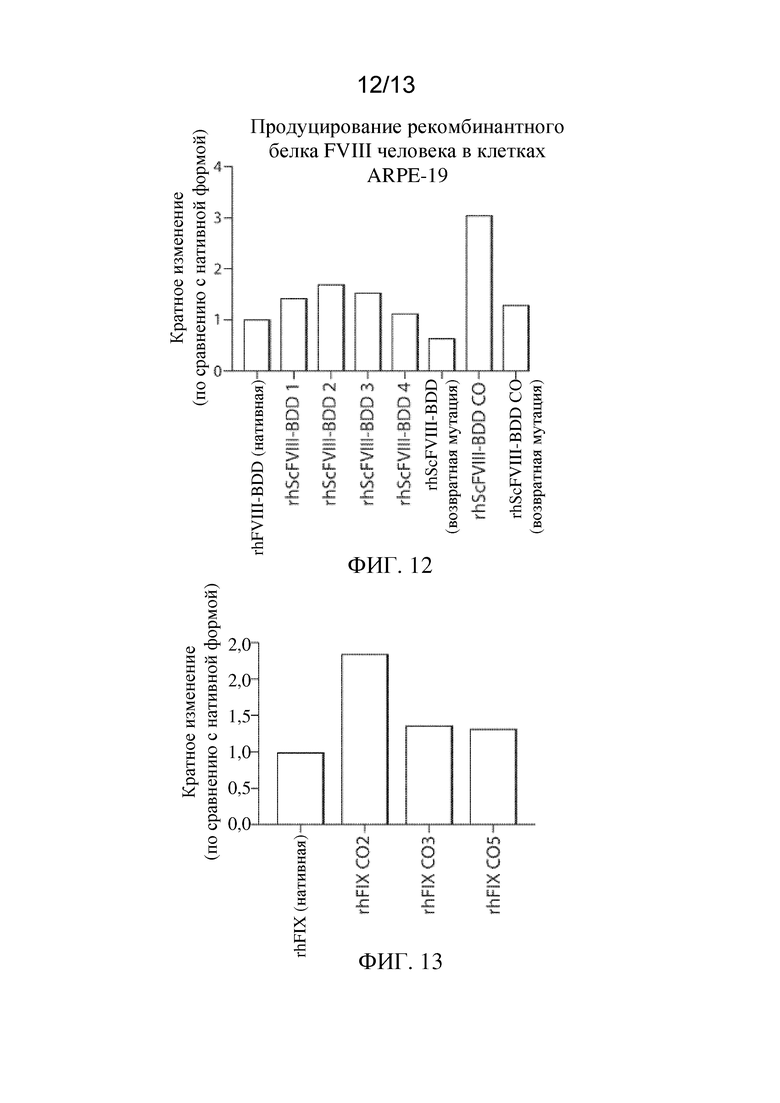
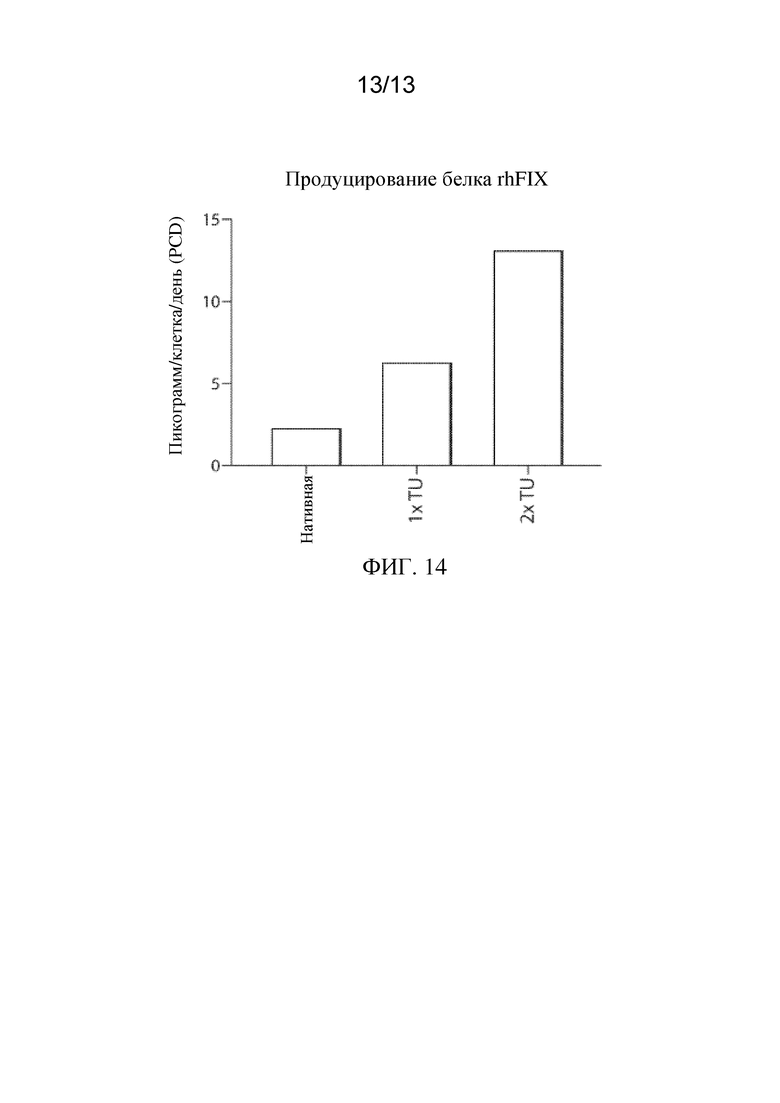
Группа изобретений относится к биотехнологии. Представлены: биосовместимый имплантируемый элемент для доставки полипептида субъекту, который содержит сконструированную активную клетку или множество сконструированных активных клеток, которая представляет собой сконструированную клетку пигментного эпителия сетчатки (RPE) или сконструированную клетку, полученную из клетки RPE, при этом сконструированная активная клетка содержит экзогенную нуклеиновую кислоту, которая кодирует полипептид и содержит определенные нуклеотидные последовательности, а также раскрыт биосовместимый имплантируемый элемент для доставки полипептида субъекту, который содержит сконструированную клетку ARPE-19 или множество сконструированных клеток ARPE-19, где имплантируемый элемент содержит заключающий компонент, окружающий сконструированную клетку ARPE-19 или множество сконструированных клеток ARPE-19, где заключающий компонент содержит альгинат и способ получения биосовместимого имплантируемого элемента. Также раскрыты: фармацевтическая композиция для доставки полипептида пациенту, содержащая совокупность биосовместимых имплантируемых элементов, и способы лечения гемофилии А и В у субъекта-человека, включающие введение или предоставление субъекту биосовместимого имплантируемого элемента. Изобретение может быть использовано для лечения гемофилии А и В у нуждающегося в этом субъекта. 6 н. и 34 з.п. ф-лы, 14 ил., 3 табл., 14 пр.
1. Биосовместимый имплантируемый элемент для доставки полипептида субъекту, где биосовместимый имплантируемый элемент содержит сконструированную активную клетку или множество сконструированных активных клеток, где сконструированная активная клетка представляет собой сконструированную клетку пигментного эпителия сетчатки (RPE) или сконструированную клетку, полученную из клетки RPE, и где сконструированная активная клетка содержит экзогенную нуклеиновую кислоту, которая кодирует полипептид, где экзогенная нуклеиновая кислота содержит следующие нуклеотидные последовательности:
а) промоторную последовательность, которая по существу состоит или состоит из (i) SEQ ID NO:23 или (ii) последовательности, характеризующейся по меньшей мере 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности с SEQ ID NO:23; и
b) кодирующую последовательность, которая кодирует полипептид,
где промоторная последовательность функционально связана с кодирующей последовательностью, и где имплантируемый элемент содержит заключающий компонент, окружающий сконструированную активную клетку или множество сконструированных активных клеток, и заключающий компонент модифицирован соединением Формулы (I):
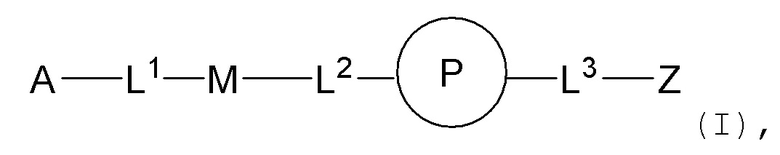
или его солью, где
A представляет собой алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил, –O–, –C(O)O–, –C(O)–, –OC(O)–, –N(RC)–, –N(RC)C(O)–, –C(O)N(RC)–, -N(RC)C(O)(C1-C6-алкилен)–, -N(RC)C(O)(C1-C6-алкенилен)–, –N(RC)N(RD)–, –NCN–, –C(=N(RC)(RD))O–, –S–, –S(O)x–, –OS(O)x–, –N(RC)S(O)x–, –S(O)xN(RC)–, –P(RF)y–, –Si(ORA)2 –, –Si(RG)(ORA)–, –B(ORA)–, или металл, где каждый алкил, алкенил, алкинил, алкилен, алкенилен, гетероалкил, циклоалкил, гетероциклил, арил и гетроарил связан с группой присоединения и необязательно замещен одним или более R1;
каждый из L1 и L3 независимо представляет собой связь, алкил или гетероалкил, где каждый алкил и гетероалкил необязательно замещен одним или более R2;
L2 представляет собой связь;
M отсутствует или представляет собой алкил, гетроалкил, циклоалкил, гетроциклил, арил или гетероарил, где каждый необязательно замещен одним или более R3;
P отсутствует или представляет собой циклоалакил, гетроциклил или гетероарил, каждый из которых необязательно замещен одним или более R4;
Z представляет собой водород, алкил, алкенил, алкинил, гетроалкил, –ORA, –C(O)RA, –C(O)ORA, –C(O)N(RC)(RD), –N(RC)C(O)RA, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетороалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R5;
каждый RA, RB, RC, RD, RE, RF и RG независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, галоген, азидо, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R6;
или RC и RD вместе с атомом азота, к которому они присоединены, формируют кольцо, необязательно замещенное одним или более R6;
каждый R1, R2, R3, R4, R5 и R6 независимо представляет собой алкил, алкенил, алкинил, гетероалкил, галоген, циано, азидо, оксо, –ORA1, –C(O)ORA1, –C(O)RB1,–OC(O)RB1, –N(RC1)(RD1), –N(RC1)C(O)RB1, –C(O)N(RC1), SRE1, S(O)xRE1, –OS(O)xRE1, –N(RC1)S(O)xRE1, – S(O)xN(RC1)(RD1), –P(RF1)y, циклоалкил, гетероциклил, арил, гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R7;
каждый RA1, RB1, RC1, RD1, RE1 и RF1 независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил необязательно замещен одним или более R7;
каждый R7 независимо представляет собой алкил, алкенил, алкинил, гетероалкил, галоген, циано, оксо, гидроксил, циклоалкил или гетероциклил;
x составляет 1 или 2; и
y составляет 2, 3 или 4.
2. Биосовместимый имплантируемый элемент по п. 1, где заключающий компонент содержит (i) гибкий полимер или (ii) негибкий полимер или металлический корпус.
3. Биосовместимый имплантируемый элемент по п. 1 или 2, где заключающий компонент представляет собой альгинатную гидрогелевую капсулу.
4. Биосовместимый имплантируемый элемент по любому из пп. 1-3, где полипептид представляет собой полипептид FVIII-BDD, и кодирующая последовательность содержит, по существу состоит или состоит из:
a) SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17 и SEQ ID NO:27; или
b) нуклеотидной последовательности, которая характеризуется по меньшей мере 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности с любой из кодирующих последовательностей, перечисленных в а).
5. Биосовместимый имплантируемый элемент по любому из пп. 1-4, где полипептид представляет собой полипептид FVIII-BDD, и кодирующая последовательность по существу состоит или состоит из SEQ ID NO:15 или SEQ ID NO:16.
6. Биосовместимый имплантируемый элемент по любому из пп. 1-4, где полипептид представляет собой полипептид FIX, и кодирующая последовательность содержит, по существу состоит или состоит из:
a) SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20 или SEQ ID NO:21; или
b) нуклеотидной последовательности, которая характеризуется по меньшей мере 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности с любой из кодирующих последовательностей, перечисленных в а).
7. Биосовместимый имплантируемый элемент по любому из пп. 1-6, где сконструированная активная клетка представляет собой клетку ARPE-19.
8. Биосовместимый имплантируемый элемент по любому из пп. 1-7, который содержит множество сконструированных активных клеток.
9. Биосовместимый имплантируемый элемент для доставки полипептида субъекту, где имплантируемый элемент содержит сконструированную клетку ARPE-19 или множество сконструированных клеток ARPE-19,
где имплантируемый элемент содержит заключающий компонент, окружающий сконструированную клетку ARPE-19 или множество сконструированных клеток ARPE-19,
где заключающий компонент содержит альгинат, модифицированный соединением Формулы I(a):
или его фармацевтически приемлемую соль, где:
А представляет собой алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил, -O-, -C(O)O-, -C(O)-, -OC(O)-, -N(RC)-, -N(RC)C(O)-, -C(O)N(RC)-, -N(RC)C(O)(C1-C6-алкилен)-, -N(RC)C(O)(C1-C6-алкенилен)-, -N(RC)N(RD)-, -NCN-, -C(=N(RC)(RD))O-, -S-, -S(O)x-, -OS(O)x-, -N(RC)S(O)x-, -S(O)xN(RC)-, -P(RF)y-, -Si(ORA)2 -, -Si(RG)(ORA)-, -B(ORA)- или металл, где каждый алкил, алкенил, алкинил, алкилен, алкенилен, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил связан с группой присоединения и необязательно замещен одним или более R1;
каждый из L1 и L3 независимо представляет собой связь, алкил или гетероалкил, где каждый алкил и гетероалкил необязательно замещен одним или более R2;
L2 представляет собой связь;
М отсутствует или представляет собой алкил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил, каждый из которых необязательно замещен одним или более R3;
P представляет собой гетероарил, необязательно замещенный одним или более R4;
Z представляет собой алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил, каждый из которых необязательно замещен одним или более R5;
каждый RA, RB, RC, RD, RE, RF и RG независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, галоген, азидо, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R6;
или RC и RD, взятые вместе с атомом азота, к которому они присоединены, образуют кольцо, необязательно замещенное одним или более R6;
каждый R1, R2, R3, R4, R5 и R6 независимо представляет собой алкил, алкенил, алкинил, гетероалкил, галоген, циано, азидо, оксо, -ORA1, -C(O)ORA1, -C(O)RB1,-OC(O)RB1, -N(RC1)(RD1), -N(RC1)C(O)RB1, -C(O)N(RC1), SRE1, S(O)xRE1, -OS(O)xRE1, -N(RC1)S(O)xRE1, - S(O)xN(RC1)(RD1), -P(RF1)y, циклоалкил, гетероциклил, арил, гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R7;
каждый RA1, RB1, RC1, RD1, RE1 и RF1 независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил необязательно замещен одним или более R7;
каждый R7 независимо представляет собой алкил, алкенил, алкинил, гетероалкил, галоген, циано, оксо, гидроксил, циклоалкил или гетероциклил;
х составляет 1 или 2; и
y составляет 2, 3 или 4; и
где сконструированная клетка ARPE-19 содержит экзогенную нуклеиновую кислоту, которая содержит промоторную последовательность, функционально связанную с кодирующей последовательностью для полипептида, где промоторная последовательность по существу состоит или состоит из SEQ ID NO:23 или характеризуется по меньшей мере 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности с SEQ ID NO:23.
10. Биосовместимый имплантируемый элемент по п. 9, где полипептид содержит, по существу состоит или состоит из SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5 или SEQ ID NO:6.
11. Биосовместимый имплантируемый элемент по п. 9, где полипептид содержит SEQ ID NO:4, и кодирующая последовательность содержит SEQ ID NO:16 или последовательность, характеризующуюся по меньшей мере 99% идентичностью последовательности с SEQ ID NO:16.
12. Биосовместимый имплантируемый элемент по п. 9, где полипептид содержит SEQ ID NO:1, и кодирующая последовательность содержит SEQ ID NO:15 или последовательность, имеющую по меньшей мере 99% идентичность последовательности SEQ ID NO:15.
13. Биосовместимый имплантируемый элемент по п. 9, где полипептид содержит, по существу состоит или состоит из SEQ ID NO:36, и кодирующая последовательность содержит SEQ ID NO: 19 или последовательность, имеющую по меньшей мере 99% идентичность последовательности SEQ ID NO:19.
14. Биосовместимый имплантируемый элемент по любому из пп. 9-13, где полипептид дополнительно содержит SEQ ID NO:34 или SEQ ID NO:35.
15. Биосовместимый имплантируемый элемент по любому из пп. 9-14, где экзогенная нуклеиновая кислота содержит последовательность Козак непосредственно перед кодирующей последовательностью, где последовательность Козак представляет собой нуклеотиды 2094-2099 последовательности SEQ ID NO:26.
16. Биосовместимый имплантируемый элемент по любому из пп. 9-16, где экзогенная нуклеиновая кислота содержит сигнальную последовательность полиА, функционально связанную с кодирующей последовательностью, где сигнальная последовательность полиА по существу состоит или состоит из нуклеотидов 2163-2684 из SEQ ID NO:26.
17. Биосовместимый имплантируемый элемент по любому из предыдущих пунктов, где промоторная последовательность состоит из SEQ ID NO:23.
18. Биосовместимый имплантируемый элемент по любому из предыдущих пунктов, где экзогенная нуклеиновая кислота интегрирована в хромосому сконструированной клетки.
19. Биосовместимый имплантируемый элемент по любому из пп. 1-3 или 9, где полипептид выбран из группы, состоящей из антитела, фактора роста, гормона, цитокина, фермента и фактора свертывания крови.
20. Биосовместимый имплантируемый элемент по любому из пп. 1-3 или 9, где полипептид представляет собой полипептид инсулина.
21. Биосовместимый имплантируемый элемент по любому из пп. 1-3 или 9, где полипептид не является полипептидом инсулина.
22. Биосовместимый имплантируемый элемент по п. 1 или 2, где заключающий компонент содержит гибкий полимер.
23. Биосовместимый имплантируемый элемент по п. 22, где гибкий полимер представляет собой полимолочную кислоту (PLA), сополимер молочной и гликолевой кислоты (PLG), полиэтиленгликоль (PEG), карбоксиметилцеллюлозу (CMC) или полисахарид.
24. Биосовместимый имплантируемый элемент по пп. 9-16, где заключающий компонент модифицирован с помощью соединения формулы (I):
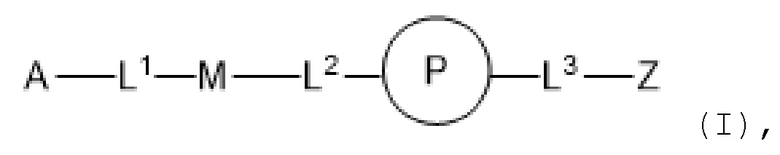
или его соли, где:
А представляет собой алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил, -O-, -C(O)O-, -C(O)-, -OC(O)-, -N(RC)-, -N(RC)C(O)-, -C(O)N(RC)-, -N(RC)C(O)(C1-C6-алкилен)-, -N(RC)C(O)(C1-C6-алкенилен)-, -N(RC)N(RD)-, -NCN-, -C(=N(RC)(RD))O-, -S-, -S(O)x-, -OS(O)x-, -N(RC)S(O)x-, -S(O)xN(RC)-, -P(RF)y-, -Si(ORA)2 -, -Si(RG)(ORA)-, -B(ORA)- или металл, где каждый алкил, алкенил, алкинил, алкилен, алкенилен, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил связан с группой присоединения и необязательно замещен одним или более R1;
каждый из L1 и L3 независимо представляет собой связь, алкил или гетероалкил, где каждый алкил и гетероалкил необязательно замещен одним или более R2;
L2 представляет собой связь;
М отсутствует или представляет собой алкил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил, каждый из которых необязательно замещен одним или более R3;
P отсутствует или представляет собой циклоалкил, гетероциклил или гетероарил, каждый из которых необязательно замещен одним или более R4;
Z представляет собой водород, алкил, алкенил, алкинил, гетероалкил, -ORA, -C(O)RA, -C(O)ORA, -C(O)N(RC)(RD), -N(RC)C(O)RA, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R5;
каждый RA, RB, RC, RD, RE, RF и RG независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, галоген, азидо, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R6;
или RC и RD, взятые вместе с атомом азота, к которому они присоединены, образуют кольцо, необязательно замещенное одним или более R6;
каждый R1, R2, R3, R4, R5 и R6 независимо представляет собой алкил, алкенил, алкинил, гетероалкил, галоген, циано, азидо, оксо, -ORA1, -C(O)ORA1, -C(O)RB1,-OC(O)RB1, -N(RC1)(RD1), -N(RC1)C(O)RB1, -C(O)N(RC1), SRE1, S(O)xRE1, -OS(O)xRE1, -N(RC1)S(O)xRE1, - S(O)xN(RC1)(RD1), -P(RF1)y, циклоалкил, гетероциклил, арил, гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R7;
каждый RA1, RB1, RC1, RD1, RE1 и RF1 независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил необязательно замещен одним или более R7;
каждый R7 независимо представляет собой алкил, алкенил, алкинил, гетероалкил, галоген, циано, оксо, гидроксил, циклоалкил или гетероциклил;
х составляет 1 или 2; и
y составляет 2, 3 или 4.
25. Биосовместимый имплантируемый элемент по любому из пп. 1-8 или 24, где соединение формулы (I) представляет собой соединение, представленное в таблице соединений 1.
26. Биосовместимый имплантируемый элемент по любому из пп. 1-8 или 24, где соединение выбрано из:
 ,
,  и
и
или их соли.
27. Биосовместимый имплантируемый элемент по любому из пп. 1-8 или 24, где соединение выбрано из соединения 110, соединения 112, соединения 113 или соединения 114 из таблицы соединений 1.
28. Биосовместимый имплантируемый элемент по любому из пп. 9-16, где заключающий компонент представляет собой альгинатную гидрогелевую капсулу.
29. Биосовместимый имплантируемый элемент по любому из предыдущих пунктов, который содержит по меньшей мере приблизительно 10000, 15000 или 20000 сконструированных клеток ARPE-19.
30. Биосовместимый имплантируемый элемент по любому из предыдущих пунктов, где заключающий компонент содержит альгинат, ковалентно модифицированный соединением
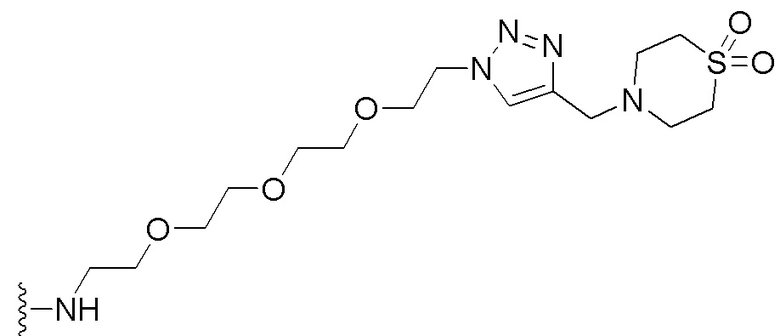 .
.
31. Биосовместимый имплантируемый элемент по любому из пп. 1-3, 9 или 30, где полипептид представляет собой альфа-галактозидазу А, альфа-L-идуронидазу или N-сульфоглюкозаминсульфогидролазу.
32. Биосовместимый имплантируемый элемент по любому из пп. 1-31, где клетки RPE размещены на микроносителе.
33. Биосовместимый имплантируемый элемент по любому из пп. 1-32, где имплантируемый элемент имеет средний диаметр, который составляет от 1 мм до 2 мм.
34. Фармацевтическая композиция для доставки полипептида пациенту, содержащая совокупность биосовместимых имплантируемых элементов по любому из предыдущих пунктов и фармацевтически приемлемый носитель.
35. Способ лечения гемофилии А у субъекта-человека, включающий введение или предоставление субъекту биосовместимого имплантируемого элемента по любому из пп. 4, 5, 10, 11 и 12.
36. Способ лечения гемофилии В у субъекта-человека, включающий введение или предоставление субъекту биосовместимого имплантируемого элемента по п. 6 или 13.
37. Способ получения или производства биосовместимого имплантируемого элемента, содержащего множество сконструированных клеток RPE, включающий:
предоставление множества сконструированных клеток RPE и размещение множества сконструированных клеток RPE в заключающем компоненте,
таким образом получая или производя биосовместимый имплантируемый элемент, где заключающий компонент модифицирован соединением Формулы (I):
 (I),
(I),
или его солью, где
A представляет собой алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил, –O–, –C(O)O–, –C(O)–, –OC(O)–, –N(RC)–, –N(RC)C(O)–, –C(O)N(RC)–, -N(RC)C(O)(C1-C6-алкилен)–, -N(RC)C(O)(C1-C6-алкенилен)–, –N(RC)N(RD)–, –NCN–, –C(=N(RC)(RD))O–, –S–, –S(O)x–, –OS(O)x–, –N(RC)S(O)x–, –S(O)xN(RC)–, –P(RF)y–, –Si(ORA)2 –, –Si(RG)(ORA)–, –B(ORA)–, или металл, где каждый алкил, алкенил, алкинил, алкилен, алкенилен, гетероалкил, циклоалкил, гетероциклил, арил и гетроарил связан с группой присоединения и необязательно замещен одним или более R1;
каждый из L1 и L3 независимо представляет собой связь, алкил или гетероалкил, где каждый алкил и гетероалкил необязательно замещен одним или более R2;
L2 представляет собой связь;
M отсутствует или представляет собой алкил, гетроалкил, циклоалкил, гетроциклил, арил или гетероарил, где каждый необязательно замещен одним или более R3;
P отсутствует или представляет собой циклоалакил, гетроциклил или гетероарил, каждый из которых необязательно замещен одним или более R4;
Z представляет собой водород, алкил, алкенил, алкинил, гетроалкил, –ORA, –C(O)RA, –C(O)ORA, –C(O)N(RC)(RD), –N(RC)C(O)RA, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетороалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R5;
каждый RA, RB, RC, RD, RE, RF и RG независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, галоген, азидо, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R6;
или RC и RD вместе с атомом азота, к которому они присоединены, формируют кольцо, необязательно замещенное одним или более R6;
каждый R1, R2, R3, R4, R5 и R6 независимо представляет собой алкил, алкенил, алкинил, гетероалкил, галоген, циано, азидо, оксо, –ORA1, –C(O)ORA1, –C(O)RB1, –OC(O)RB1, –N(RC1)(RD1), –N(RC1)C(O)RB1, –C(O)N(RC1), SRE1, S(O)xRE1, –OS(O)xRE1, –N(RC1)S(O)xRE1, – S(O)xN(RC1)(RD1), –P(RF1)y, циклоалкил, гетероциклил, арил, гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил и гетероарил необязательно замещен одним или более R7;
каждый RA1, RB1, RC1, RD1, RE1 и RF1 независимо представляет собой водород, алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклил, арил, гетероарил необязательно замещен одним или более R7;
каждый R7 независимо представляет собой алкил, алкенил, алкинил, гетероалкил, галоген, циано, оксо, гидроксил, циклоалкил или гетероциклил;
x составляет 1 или 2; и
y составляет 2, 3 или 4,
где сконструированные активные клетки содержат экзогенную нуклеиновую кислоту, кодирующую полипептид, где экзогенная нуклеиновая кислота содержит следующие нуклеотидные последовательности:
a) промоторную последовательность, которая по существу состоит или состоит из (i) SEQ ID NO:23 или (ii) последовательности, характеризующейся по меньшей мере 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности с SEQ ID NO:23; и
b) кодирующую последовательность, которая кодирует полипептид,
где промоторная последовательность функционально связана с кодирующей последовательностью.
38. Способ по п. 37, где заключающий компонент содержит альгинат, модифицированный соединением:
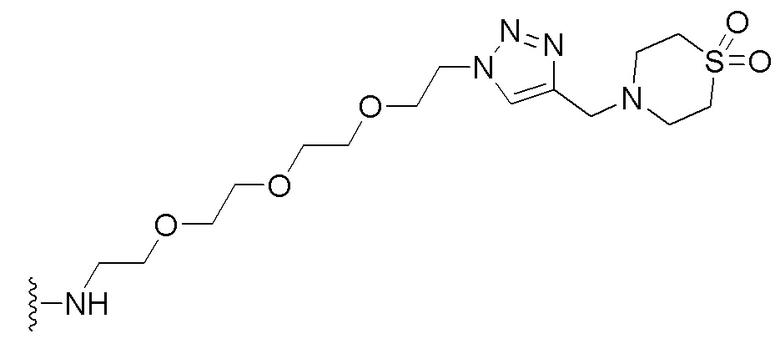 ,
,
или его соль.
39. Способ по п. 37 или 38, где сконструированные клетки RPE содержат промоторную последовательность, функционально связанную с SEQ ID NO:15 или SEQ ID NO:19.
40. Способ по любому из пп. 38, 39, где промоторная последовательность представляет собой SEQ ID NO:23.
| WO 2015143418 A2, 24.09.2015 | |||
| WO 2017072498 A1, 04.05.2017 | |||
| US 9447168 B2, 20.09.2016 | |||
| NIALL BARRON et al | |||
| Targeted genetic modification of cell lines for recombinant protein production, Cytotechnology, 2007, 53(1-3): 65-73, doi: 10.1007/s10616-007-9050-y | |||
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ АМИЛОИДА БЕТА ПРИ ГЛАЗНЫХ ЗАБОЛЕВАНИЯХ | 2008 |
|
RU2542967C2 |
Авторы
Даты
2024-09-05—Публикация
2018-09-27—Подача