сн -ЮУк(сНз)2 J
- ш )2 , RZ и ; (СИ.), , R,- CgHs; к.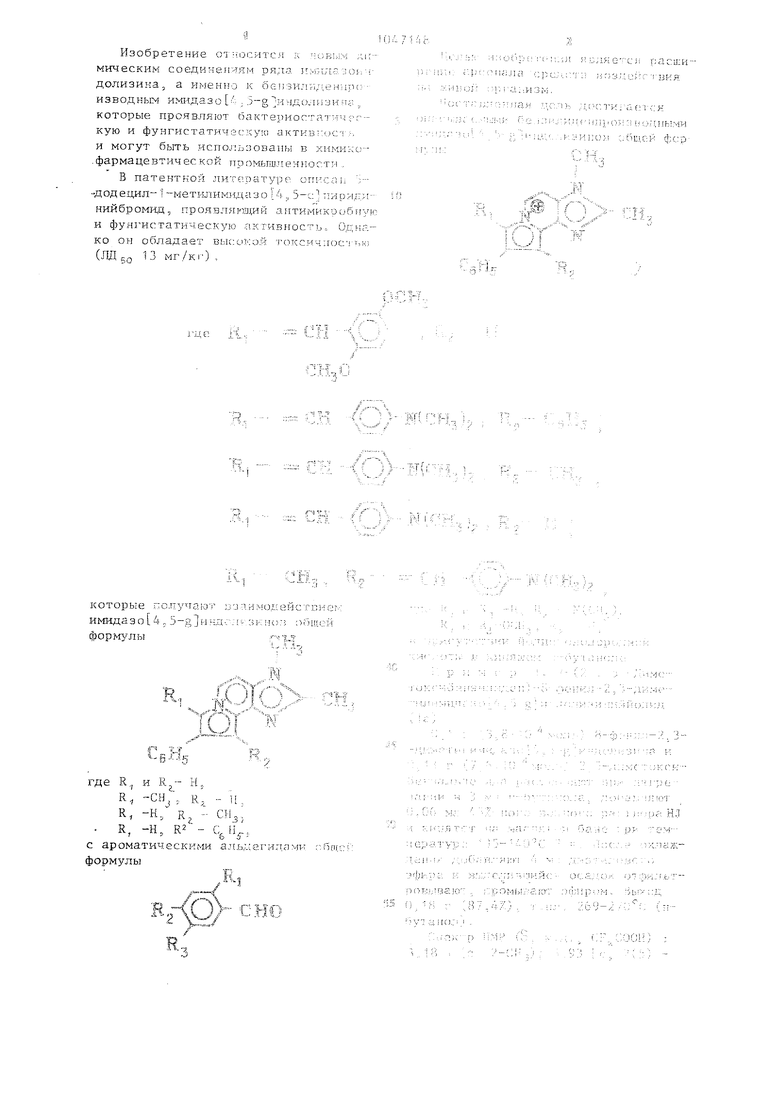

Бензилиденпроизводные ииидазо 5 5-g индолизинов общей формулы С (g Н Е. 2(О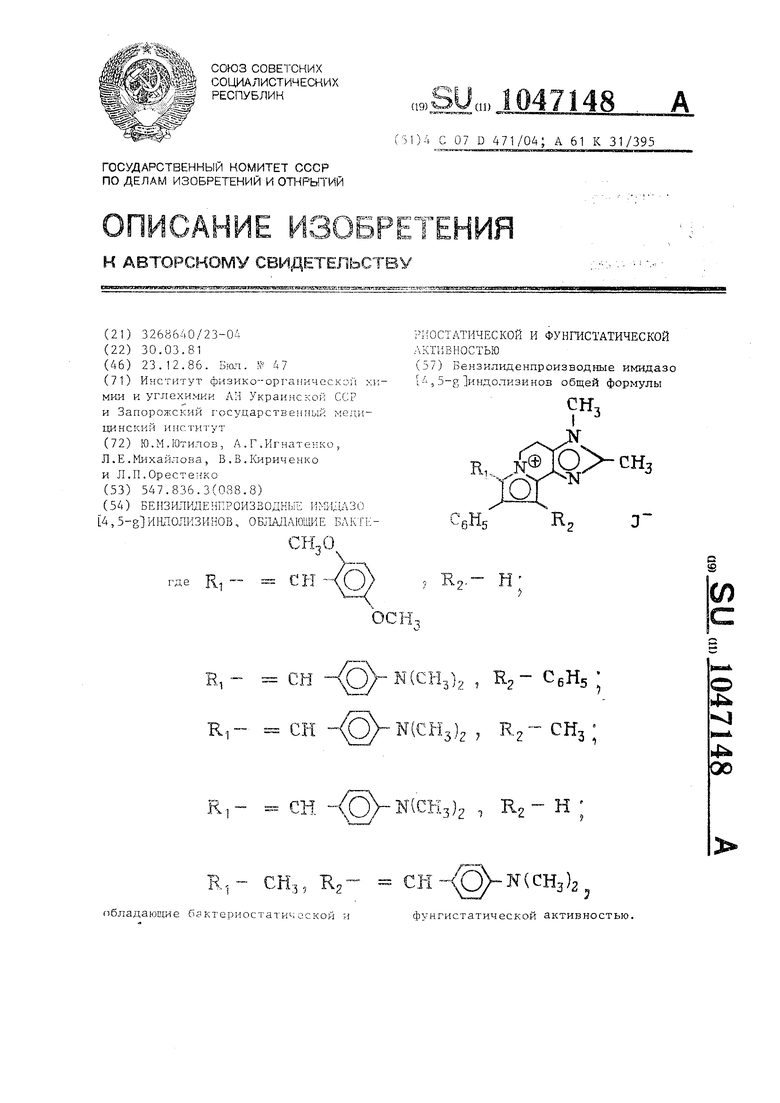
СНз, Кг™
пбладающие бзктериостатич с.ской и
/;
К(СНз)2
фунгистатической активностью.
Изобретение oi мосится i-. -ciEbiM химическим соединениям ряда ими/га :;оьчдолизика, а имен1ю к беи зил:- ;:енир(:изводным имидазо ; 3-g .иэин;:: которые проявляют бактеииостат-тч ;:-гкую и фунгистатическу ; активт:.к; , и могут быть испо.1:ь:5ова11ы в хими;-;)-,фармацевтической ттромьпшшниостн ,
В патент 1ой jTHTenaTyDe ornCiiii .додецил -метш1имидазо f 4 , 5-с ттиридинийбромид. проявляющий антимикоибгп-и и фунгистатическую чкгнвность. Однако он обладает в ;К:с11:ой чоксичпос; ьк5 ( 13 мг/кг) ,
которь-е получают ; имидазо 4 „ .; формулы
1си;игде R.и R.,- Н,
,. R .- 1;
R,-Н/ R., - Cl,,
R,-H, R2 - Q H.-.
с ароматическими аль,1;еги;1амрт формулы
../
t::H(}
y
Hi J
310
, 4,00 с, 5(2)-OCHJ, 4,24 (с, 5-СН,,); 6,18 (с, 7-СН-); 6,757,80 (м, ароматические протоны).
Найдено, %: С 58,3; Н 4,2; N 8,2; 3 23,4.
б Л1 Вычислено, 1-. С 58,1; Н 4,5;
N 7,9; 3 ,6.
П р и : е р 2. 7(п-К , К -ДикетиламинобензилидерО -8,9-дифенил-2,3-диметилимидазо 4,5-glиндолияиниййодид (16).
Получен аналогично примеру 1, исходя из 0,091 г (3. моль) 8,9-дифенил-2.3-диметилимидазо 4,5-gJ индолизина и 0.1 г (7 - Ю моль) п-диметилами нобензальдегида. Вькод 0,088 г (55,3%), т.пл. 300°С (с разложением ii-буганол) .
Спектр ПМР (о, М.Д., ):
3,20 (с, 2-СН,), 3,46 С,ЧЧСН,)„ ; 4,23 (с, 6,16 (с, 7-СН-) , 7.00-8510 (м, ароматические npororibi)
Найдено, %: С 64,3; Н 5,1; N9,4; 20,9.
Вычислено, %: С 64,4, Н 4,9, N 9,4, а 21,3.
При м ер 3. 7-(n-N , N -Диметиламигюбензилиден)-8-фснил-2,3,9-триметилим1- дазо 4, 5-g индoлизинийЙОД1ВД (1 з) .
Получен аналогично примеру 1, исходя из 0. 1 г (3,6-10 моль) 8--фенил-2, 3 , 9-триметилимидазо 4,5-g индолизина и 0,1 г (7 10моль) п-диметиламинобенза ;ьдегида, гзыход 0,16 г (82,5%), т.пл. (с разложением, н-буга;1ол) .
Спектр IMP (S, М.Д., CF, СООН) :
2,15 (с, ,) ; 2,75 (с, 2-СН,) ; 2,87 с, К(СН.). J , 3,74 (с, З-СН) ; 6,8 1-7,1 6 ;, ароматические протоны), 7,69 д. 4 (5)-и; J 6 TiiJ, 8,36 д, 5(4)-Н, J 6 Гц.,
Найдено, %: С 60,6,- Н 5,4; N 10,7; 3 23,5.
Вычис;ено, С 60,/; Н 5,1; N 10,5; -J 23,7.,50
Пример 4. 7-(n-N , N -Диметиламинобензилиден)-8-фенил-2,3-диметилимидазо 4 , 5-g 1и1щолизиниййоди.д (1г).
аналогично примеру 1,55
исходя из 0,1 г (3,8 Ю моль) 8-феншт-2 5 З-диметклимидазо 4 . 5-§Ъ ;ц;олизина и 0,12 г (810 моль) п-диметилАВ4
ам1 нобеи--;альдегида . Выход 0,19 г (95;). т.п::. 319-320°С (н-бутанол).
Спектр (5, м.д., CF, СООН) : 3,20 (с, 2-CHJ, 3,44 с%ЧСП), , Д,25 (с, 3-СН.) ; 6,16 (с, 7-СН-); 7,10-8,05 (м, ароматические протоны)
Найдено, %: С 57,7; Н 5,4, N 10,0; Л 23,2.
,,,N 1
Bbr-iHcneVo, %: С 58,0; Н 5,1; К 10,4-; J 23,6.
Пример 5. 9-(n-N , N -Диметиламинобензилиден)-8-фенил-2,3,7-тримети.лимидазо 4,5-g HHAonH3HHHftйодид (1д) .
Получен аналогично примеру 1, исходя из 0,1 г (3,6- моль) 8-фенил-2,3,7-триметилимида30 4,5-glиндолизина и 0,1 г ( 7 1 О моль) п-диметилами:обензальдегида. Выход 1,5 г (77,3%), т.пл. 300°С (с раэложение,:. ri-бутанол) .
Спектр ПМР (S, М.Д., CFjCOOH) : 2,16 (с, 7-CHJ; 2,75 (с, 2-СН5)-, 2,84 с, ЧСП),, 3,77 (с, З-СН) , 6,80-7,00 (м, ароматические протоны) 7,99 Гд, 4(5)-Н; J 6 Гц, 8,52 д, 5(4)-Н, J бгд.
Найдено, %: С 60,5; Н 5,3;N 10,2, 3 23,4.
c.fi.-.i
Вычислено, %: С 60,7j Н 5,1; N 10,5; а 23,7.
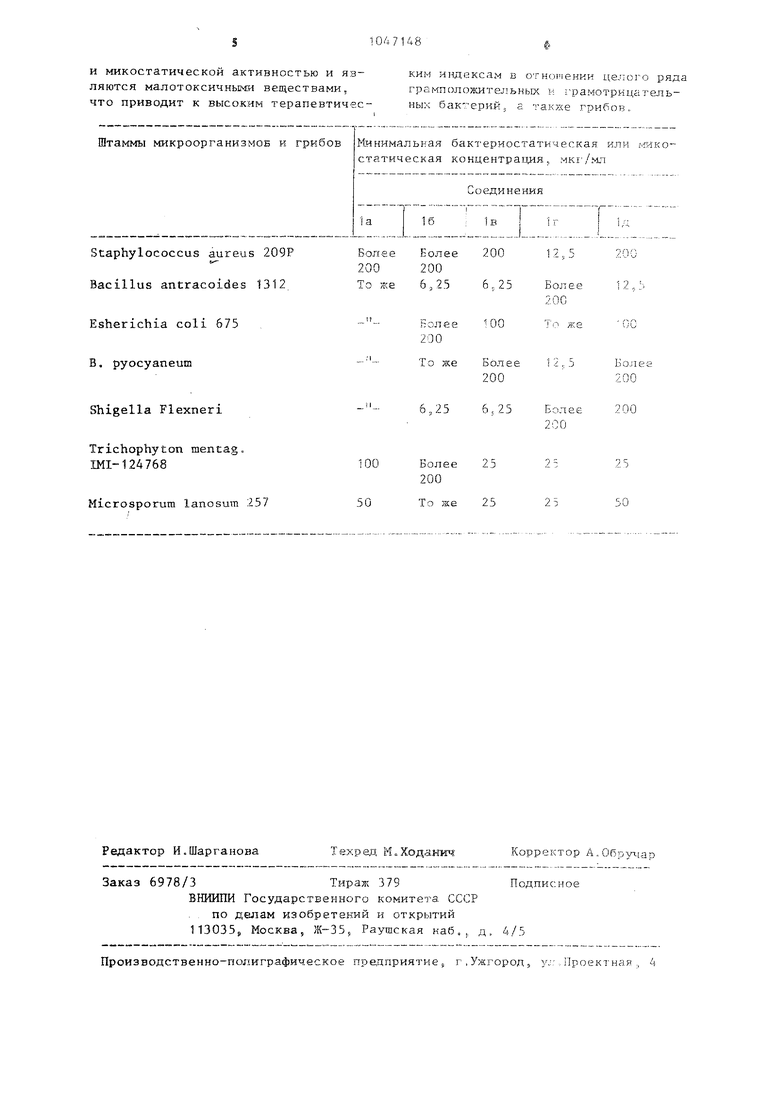
1зактериостатическую активность соединений изучали методом двукратных разведений на жидкой среде. Для культивирования бактерий использова.-ги бульон Хоттингера (рН 7,2-7,4). Микробная нагрузка для бактерий 5 х X 10 клеток агаровой 18-ч. культуры 3 1 мл среды. Максимальная из испытанных концентращлй 200 мкг/мл.
Д.ьч выращивания грибов использовали среду Сабуро (рН 6,0-6,8). Нагрузка 500 тыс. репродуктивных телец в 1 . Максимальная из испытанных концентраций 200 мкг/мл. Антимикробную .активность соединений оценивали по :иг имальной бактериостатической или никоетатической концентрации,
Результаты испытаний приведены в таб.шце.
LDjo соединений 1а-1д составляет 7710-419, 6510±377, , 3500 + ±148, 1040±76 мг/кг соответственно.
Таким образом, бензилиденпроизводные имидазо 4,5-g индoлизинoв обладают высокой бактериостатической
и микостатической активностью и являются малотоксичными веществами. что приводит к высоким терапевтичесШтаммы микроорганизмов и грибов
Staphylococcus aureus 209Р Bacillus antracoides 1312
Esherichia coli 675 B. pyocyaneum
Shigella Flexneri
Trichophyton mentag. Ш1-124768
Microsporum lanosum 257
КИ1.) индексам в отнсяченки целого ряда грамлоложительных и грамотрицательных бактерий, а также грибов,.
Минимальвая бактериостатическая или микостатическая концентрация, мкг/мл
L, о единения
Т
16
1в
Более Более 200
200 200
То же 6,25 6,25
ь ол е е 200
6,.25
100 Более 25 200
25
То же
Авторы
Даты
1986-12-23—Публикация
1981-03-30—Подача