ния соединения общей формулы I, где . имеют указанные значения, а и Rg, Rj fc образуют вместе . связь, а Rg - С;,-С--алкил, или соединение общей формулы I, где Rj - алкоксикарбонил, гидролизутот и целевой продукт выделяют в виде основания или соли.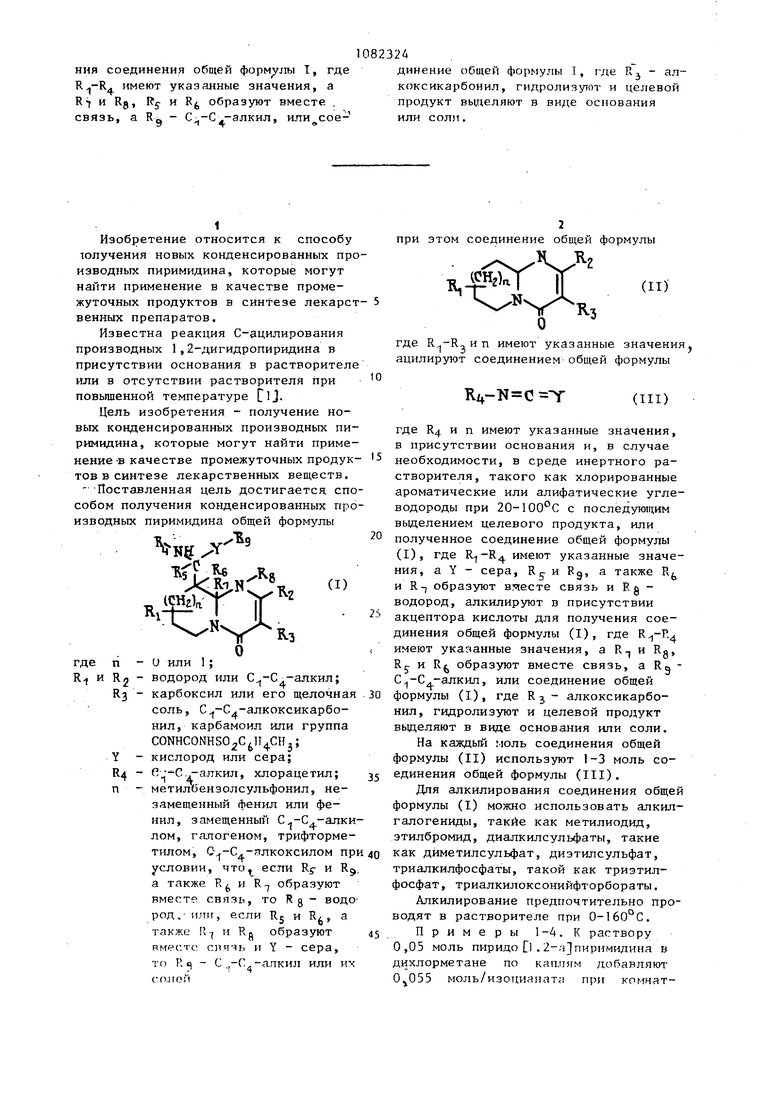







| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения конденсированных производных пиримидина в виде рацематов или оптических изомеров | 1978 |
|
SU1181546A3 |
| Способ получения геминальных дигалоидных производных конденсированных пиримидин-4-онов,рацематов или оптически активных антиподов | 1980 |
|
SU1151210A3 |
| Способ получения производных пиридо (1,2- @ ) пиримидина или их кислотно-аддитивных солей | 1978 |
|
SU1022659A3 |
| Способ получения 9-формилпроизводных пиридо @ 1,2- @ пиримидина или их оптически активных антиподов | 1982 |
|
SU1245260A3 |
| Способ получения конденсированных производных пиримидина или их солей | 1978 |
|
SU999974A3 |
| Способ получения производных пиридо/1,2-а/пиримидина или их солей с щелочными металлами или их оптических изомеров | 1980 |
|
SU1024007A3 |
| Способ получения производных пиридо /1,2-а/ пиримидина или их оптических изомеров, или их гидратов, или их солей | 1980 |
|
SU980622A3 |
| Способ получения конденсированных пиримидинов или их солей,или их оптических изомеров | 1977 |
|
SU969165A3 |
| Способ получения производных пиридо (1,2-а) пиримидина или их фармацевтически приемлемых солей или их оптически активных изомеров | 1978 |
|
SU999973A3 |
| Способ получения производных пиридо(1,2-а)-пиримидина или их солей | 1974 |
|
SU566524A3 |
Способ получения конденсированных производных пиримидина общей формулы I где п - О или 1; R и 2 водород или С -С -алкил; RT, - карбоксил или его щелочная соль, -алкоксикарбопил, карбамоил или группа - CONH-CONHSO C H CH Y - кислород или сера; R, - С -С -апкил, хлорацетил; п - метилбензолсульфонил, незамещенный фенил или фенил. замещенный С .-С.-алкилом, галогеном, трифторметилом, С -Сф-алкоксилом при условии, что, если Rj и Rg, а также R и R образуют вместе связь, то RO - водород или, если Rj и R (, а также Ry и Rg образуют вместе связь и Y - сера, то Rg С -С -алкил; или их солей, отличающийс я тем, что соединение общей формулы II СО С где и п имеют указанные значения, ацилируют соединением общей формулы III где Rj и Y имеют указанные значепия, в присутствии основания и, в случае необходимости в среде инертного растворителя, такого как хлорированные, ароматические или алифатические углеводороды при 20-100 С с последующим выделением целевого продукта, или полученное соединение общей формулы I, где имеют указанные значения, а Y - сера, Rg и RQ, а также R и R-J образуют вместе связь и Rg - водород, алкилир тот в присутствии акцептора кислоть Щ1я получе

Изобретение относится к способу юлучения новых конденсированных про изводных пиримидина, которые могут найти применение в качестве промежуточных продуктов в синтезе лекарст венных препаратов. Известна реакция С-ацилирования производных 1,2-дигидропиридина в присутствии основания в растворителе или в отсутствии растворителя при повьппенной температуре flj. Цель изобретения - получение новых конденсированных производных пиримидина, которые могут найти применение -в качестве промежуточных продуктовв синтезе лекарственных веществ, - Поставленная цель достигается спо собом получения конденсированных про изводных пиримидина общей формулы где п - и или 1; R-I и Ял - водород или .-алкил; R3 - карбоксил или его щелочная соль, ,-алкоксикарбонил, карбамоил или группа CONHCONHS02C ; Y - кислород или сера; R4 .С.д-алкил, хлорацетил; п - метилбензолсульфонил, незамещенный фенил или фенил, замещенный .-алки лом, гапогеном, трифторметилом, .-алкоксилом пр условии, что если Rj- и R а также R и R-j образуют вместе связь, то Rg - водо род,- или, если Rj и Ri, а также Ц и Н. образуют вместе спячь и Y - сера, то R с| - С.,-Сд алкил или их со.пеп при этом соединение общей формулы B,-f I Xxlv R, где R -RTип имеют указанные значения ацилируют соединением-общей формулы Ri, где R и п имеют указанные значения, в присутствии основания и, в случае необходимости, в среде инертного растворителя, такого как хлорированные ароматические или алифатические углеводороды при 20-100°С с последующим выделением целевого продукта, или полученное соединение общей формулы (I), где имеют указанные значения, а Y - сера, R. и Rg, а также R и R-J образуют вяесте связь и Rg водород, алкилируют в присутствии акцептора кислоты для получения соединения общей формулы (I), где имеют указанные значения, а R-, и Rg, Rj. и R образуют вместе связь, а RQ .-алкил, или соединение общей формулы (I), где RJ - алкоксикарбонил, гидролизуют и целевой продукт выделяют в виде основания или соли. На каждый моль соединения общей формулы (II) используют 1-3 моль соединения общей формулы (III). Для апкилирования соединения общей формулы (I) можно использовать алкилгалогениды, такие как метилиодид, этилбромид, диалкилсульфаты, такие как дйметилсульфат, диэтилсульфат, триалкилфосфаты, такой как триэтилфосфат, триалкилоксонийфторбораты. Алкилирование предпочтительно проводят в растворителе при 0-160°С. Примеры 1-4. К раствору 0,05 моль пиридо 1 .2-с-)пиримидина в дихлорметане по кашигм добавляют моль/изоциаиата при комнатной температуре. Реакционную смесь кипятят в течение 10 ч и на 2 дня оставляют стоять при комФенилизо- 3-Этоксикар- 46 200-201 цианат бонил-6-меЗ-Этоксикарбонил-6- Хлораце-метил-4-оксо-6,7,8J тилизо9-тетрагидро-4Н-пи- цианат ридо D,2-а пиримидин
Тозилизо- 3-Этоксикар- 80 182-183
цианат
3-Аминок арбонил -6-метш1-4-оксо-6,7,8|9 -тетрагидро-4Н-пиридо Cl,2-а пиримидин
натной температуре, после чего растворитель отгоняют. Полученные соединения приведены в ТсГбл, 1.
Таблица. 1
тил-9-(К-фениламинокарбонш1)-4-оксо-6,7,8,9-.. . тетрагидро-4Н-пиридо1,2-а пиримнцин
158-160
74
9
бонил-6-меТИЛ-9-ТОЗИЛаминокарбоНИЛ-4-ОКСО-6,7,8,9-тет
рагидро-4НпиридоС,2-aJ
пиримидин
3-Тозиламино
карбонил-б-метил-9-тозиламинокарбонил-4-оксо
6,758,9-тетрагидро-4Нпиридо tl ,2-а
пиримидин
2
So
Н а 1 моль исходного вещества
П р им еры 5-9. Смесь 23,6 г 3-этоксикарбонил-6-метил-4-оксо-4Н-пиридоС,2-а пиримидина и 0,1 моль JQ изоцианата,оеремешИвагот в течение 72 ч при 40-50 С. Образующуюся вязкую реакционную смесь суспендируют в
Продолжение табл. 1
64,21/63,95 5,95/5,81 11,83/11,65
50,63/51,02 5,06/5,02 11,80/11,69
55,42/55,92 5,35/5,30 9,69/2,72
51,90/52,28 4,52/4,48 11,64/11,51
применяют 2,1 моль изоциапата.
200 мл этанола, фильтруют и промьшают
этанолом. (В томслучае, если используют Н-бутилизоцианат, реакцию проводят при 80-100°С).
Полученные соединен 1я представлены в табл, 2.
З-Этоксикарбонил-6-метилн-Бутилизо- , -9-(Н-бутиламинкарбонил)цианат-4-ОКСО-6,7,8,9-тетрагидро-4Н-пиридо f 1,2-а пиримидин
б Фенилизоцианат 3-Этоксикарбонил-6-:метил- 74 198-200 -9-фениламинокарбонил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо f 1,2-а пиримидин
З-Этоксикарбонил-6-метил- 82 206-10
4-Хлорфенил- -(4-хлорфениламинокарбоизоцианатнил)-4-ОКСО-6,,9-тетрагидро-4Н-пиридо 1,2-а1пиримидин
З-Этоксикарбонил-6-метил- 78 194-198
3-Хлорфенил-9-(3-хлорфениламинокаризоцианатбонил ) -4-ОКСО-6,7,8,9-тетрагидро-4Н-пиридо l ,2-с( пиримидин
З-Этоксикарбонил-6-метил3,4-Дихлорфе-9-(3,4-дихлорфенш1амиионилизоциаиаткарбоиил)-4-оксо-1,6,7,8-тетрагидро-4Н-пирндо11 -, 2- а пиримидин
1
S7V3
6
CieV3°4 i
C.-1TNO С1 58,50/58,21 5,13/5,05 10,78/10,61 20 э 4
, 58,80/53,28 4,48/4,40 9,90/9,78
Таблица 2
35 152-155
79 208-212
Продолжение табл. 2
60,90/60,25 7,47/7,41 12,52/12,40
Нет снижения т.пл. с продуктом примера 20
58,50/58,10 5,13/5,07 10,73/10,59 Пример 10. Смесь 2,0 г 3-ам нокарбони«г1--2,6-:диметил-4-оксо-6,7,8 9 тетрагидро-4Н-пиридо 1 2-а}пиримидина и 2,2 г фенилизоцйаната нагрева ют до 80°С и полученньп раствор пере мегаивают при 50-60°С, Реакционную смесь после охлаждения обрабатывают 30 мл эфира, выпавшие кристаллы растворяют в этаноле, фильтруют и фил рат подвергают кристаллизации в холо рильнике, выпавшие кристаллы отфильтровывают и промьюают этанолом. Получают 1,4 г З-аминокарбонил-9-фенил аминокарбонил-2,6-диметил-4-оксо-6,,7,8,9-тетрагидро-4Н-пиридо 1 ,2-а пиримидина, которьй плавится при 187-188 С. Найдено, %: С 63,49;. Н 6,00;, N 16,26. CiaH2o 4Q3 Вычислено; %: С 63.,5; Н 5,92; N 16,46. Пример 11. Растворяют 1,6 г гидрохлорида калия в 20 г«ш этанола, К этанольному раствору гидрохлорида калия -добавляют этанольный раствор 3,6 г З-этоксикарбонил-9-фениламинокарбонил-6--метил-4 оксо-6,7,8,9-тет рагидро-4Н пиридо ,2-а пиримидина. Реакционную смесь кипятят в течение 30 ч и выпавпие после охлаждения -i, криста.плы отфильтровывают, промывают Хлороформом5 высутивают. Получают 3,1 г 9 фениламинокарбонил-6-метил-4 -оксо-б.7,8,9-тетрагидро-4Н-пирид t1;2 а гшримидин-3-карбоксилата калия, который плавится с разложением при 276-280 С. Найдено, %: С 56,02; Н 4,50; N 1,42, С,,,.К Вьмислено, %: С 55,88; Н 4,41; N.11,50 Пример 12. Растворяют 3,1 г 9-фениламинокарбонил-б-метил-4-оксо-6,7,8,9 тетрагидро-4Н-пиридо 1 ,2-а гдаримидин-3-карбоксилата калия в воде 250 мл при нагревании, доводят до рН 1 при добавлением 38 вес.% раствора соляной кислоты. Вьшавшие при охлаждении кристаллы отфильтровывают, промывают водой, высушивают. Получают 2,2 г кристаллов которые кристаллизуют из ацетонитрила.. Получают 9-фениламинокарбонил-3-карбокси-6 метил-4-оксо-6,7 р859-тетрагидро-4Н-пиридо 1 ,2-а ПИРИМИ7-1ИН с выходо -( 25%. Найдено, %: С 62,18; Н 5,18; N 12,45. Вьмислено, %V С 62,37; Н 5,24; N 12,84. Пример 13. Растворяют 0,416 г З-этоксикарбонил-4-оксо-5,6,7,8-тетрагидропирролоС1,2-а1пиримидина в 4 мл бензола и в раствор добавляют 0,24 г фенилизоцйаната. Реакционную смесь оставляют стоять в течение 5 дн, при комнатной температуре, после этого выпавшие кристаллы отфильтровывают и промьшают бензолам Получают 0,50 г (76,5% от теории) 3-зтоксикарбонил-9-(М-фениламинокарбонил)-4-ОКСО-5,6,7,8-тетрагидропирролоС1,2-а пиримидина, который плавится при 240-241°С. Павдено, %: С 62,51; Н 5515; N 12,90. С,,Н,КзО Вычислено, %: С 62,38; Н 5,23; N 12,84, Пример 14. О,66 г масляной суспензии гидрида натрия добавляют в 50 МП бензола,, после чего добавляют каплями раствор 4,72 г 3-этоксикарбонил-8-метил-4-оксо-6,7 58,9-тетрагидро-4Н-пиридо 1,2-аj пиримцдина в 15 мл бензола. После 30 мин перемешивания добавляют при 25-35. С в течение 10 мин раствор 2,96 г метилтиоизоцианата в 10 мл бензола. Реакционную смесь перемешивают в течение 2 ч и затем после добавления 80 мл эфира получают натриевую соль 3-этоксикарбон1-ш-6-метил-9-метиламинотиокарбонил-4-оксо-6,7,8,9-тетрагидро-4Н пиридо Cl ,2-аЗ пирими,дина 3 виде масла. Растворитель декантируют, растирают остаток с эфиром и сушат в вакуум-сушильном шкафу. Получают 3-этоксикарбонил-6-метил-9-метиламинотиокарбонил 4 оксо-6,7,8,9-тетрагидро-4Н-пиридо 1,2-аЗпиримидин в виде натриевой соли. Пример 15. К полученной по примеру 14 натриевой соли 3-этоксикарбонил-6-метил-9-метиламинотиокарбонил4-оксо-6,7,8,9-тетрагидро-4Н-пиридо С 1,2-а пиримидина,добавляют 15 мл ацетона, затем 130 мл воды и устанавливают с помощью уксусной кислоты рН 3-4. Вьщелившиеся кристаллы фильтруют, промывают водой, сушат, кристаллизуют из этанола и получают 3.2 г (52%) З-этоксикарбонил-6-ме Тил-9- метиламинотиокарбонип-4-оксо -6,7,8,9-тетрагидро-4Н-пнридо 1 ,2-я пиримидин, т.пл. 199-200 С. .Найдено; %: С 54,55; Н 6,18; N 13,72. Вычислено, %: С 54,35; Н 6,19; N 13,58. Пример 16. 0,66 г 90%-ной масляной суспензии гидрида натрия добавляют к 50 мл бензола, затем добавляют по каплям в 15 мл бензола 4,72 г 3-этоксикарбонил-6-метил-4 -оксо-6,7,8,9-тетрагидро-4Н-пиридо, L1,2-а пиримидина. После перемешивания в течение 30 мин добавляют при 25-35 с в течение 10 мин 5,4 г фенил тиоизоцианата в 10 мл бензола. Реакционную смесь перемешивают в течение 2 ч и после добавления 80 мл эфи ра выделяется натриевая соль 3-этоксикарбонил-6-метил-9-фениламинотиокарбонил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо 1 ,2-а пиримидина в виде масла. Растворитель декантируют, рас тирают остаток с эфиром и сушат в вакууме. Получают натриевую соль 3-этоксикарбонил-6-метил-9-фениламинотиокарбонил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо 1 ,2-а пиримидина, выход 6.1г (76%). Пример 17. К полученной по примеру 16 натриевой соли 3-этоксикарбонил-6-метил-9-фениламинотиокарбонил-4-оксо-б,7,8,9-тетрагидро-4Н-пиридо 1 ,2-а пиримидина добавляют 15 МП ацетона и 130 мл воды и устанавливают с помощью уксусной кислоты рН 3-4. Выделившиеся кристаллы фильт руют, промьшают водой, сушат и кристаллизуют из ацетонитрила. Получают 3.2г (52%) З-этоксикарбоннл-6-метил -9-фениламинотиокарбонил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо l,2-а пиримидина, т.пл. 173-175°С. Найдено, %: С 61,75; Н 5,57; N 11,40. Вычислено, %: С 61,44; Н 5,70; N 11,31. Пример 18. Действуют также как описано в примерах 5-9, но в качестве изоцианата применяют 4-метоксифенилизоцианат. Получают 3-этоксикарбонил-9 fN-(4-мeтoкcифeнил)-aминoкарбонил2-6-метил-4-оксо-6,7,8,9-тет рагидро-4 Н-пиридо 1 7 2-а пиримидин, выход 52%, т.пл. 183-184°С. Найдено, %: С 62,45; И 6,00; N 10,85. CjoK NjOВычислено, %: С 62,33; Н 6,02; N 10,90. Пример 19. Действуют также как описано в примерах 5-9, но в качестве исходного вещества используют 3-метоксикарбонил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо 1,2-а пиримидин и фенилизоцианат. Получают 3-метоксикарбонил-9-(фениламинокарбонил)-4-оксо-1 ,6,7,8-тетрагидро-4Н-пиридо.1 ,2-aJ пиримидин, выход 71%, т.пл. 173-175С. Найдено, %: С 62,47; Н 5,21; N 12,79. -17Нп«з04 Выиислено, %: С 62,38; Н 5,25; N 12,84. Пример 20. Действуют как в примерах 5-9, но в качестве исходного соединения используют З-метоксикарбонил-6-метил-4-оксо-6,7,8 4,9-тетрагидро-4Н-пиридо 1 ,-2-а пиримидин и фенилизоцианат. Получают 3-метоксикарбонш1-9-фениламинокарбонил-6-меТИЛ-4-ОКСО-6,7,8,9-тетрагидро-4Н-пиридо 1,2-аЗпиримидин, выход 74%, т.пл. 199-200С. Найдено; %: С 63,21; Н 5,70; N 12,32. C gHi9N304 Вычислено, %: С 63,33; Н 5,61; N 12,31 Пример 21. Действуют как в примерах 5-9, но в качестве исходного вещества используют 3-этоксикарбонил-7-метил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо 1,2-а пиримидин и фенилизоцианат. Получают 3-этоксикарбонил-9-фениламинокарбонил-7-метил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо 1,2-аj пиримидин, выход 55%, т.пл. 216217°С. Найдено, %:-С 64,34; Н 5,88; N 11,90. ClsS AВычислено, %: С 64,21; Н 5,95; N 11,83. Пример 22. Действуют как описано в примерах 11-12, но в качестве исходного материала используют 3-этoкcикapбoнил-9- N-(4-мeтoкcифeнил)-аминокарбонил3-6-метил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо |,2-а пиримидин. Выход 44%, т.пл. 201202°С. С 60,38; И 5,19; Найдено, % i N I1,85. , Вычислено, %: С 60,5С; Н N 11 ,67 Пример 23 10 ммоль 3-эток сикарбонил-6-метил-9-метиламинотиокарбонил-4-оксо-В7758,9-тетрагидро-пиридо 1 ,2-а Зпиримидина, 10 ммоль ацетата натрия и 3 мл йодистого метила кипятят в этаноле в течение 30 мин и сгущают при пониженном дав лении. К остатку добавляют 10 мл во и 60 мл диэтилового эфира. После 20 мин перемешивания эфирную фазу отделяют и после сушки безводным сульфатом натрия и фильтрования сме сгущают до опалесденции и кристалли зуют при , Отфильтрованные крис таллы перекристаллизовывают из эфир Получают 3-этоксикарбонил-6-метил 9 (метш1тиометиламино)-метилен1-4-ок со-6 5 7,8 9-тетрагидро-4Н-пиридо 1,2 -а пиримидин, выход 65%, т.пл. 168170°С. Найдено, %: С 56, Н 6„Об; N 12,78. 15- 20 з Вьпшслено, %: С 55,53| Н 6,2 N12,95, П р и м е р 24, Работают как олисано в примере 23, но в качестве неходкого вещества применяют 3-эток сикарбонил-6-метиЛ-9этиламинотиокар бонил 4--оксо 6,7,8,9-тетрагидро-4Н--пнридо 1 5 2-а пиримидин. Получают 3-этоксикарбонил-6-метил-9 (метилтиоэтиламино)метилен -4-оксо-6,7,8, -тетрагидро-4Н-пиридо 1,2-а пиримид . с выходом 53%, т.пл. 119 На1щено, %: С 57,40; Н N 12 ,,42. Вычислено, %: С 57,12; Н 6,89; N 12,49. 25. Работают как оп и м е р 23, но в качестве ис примере ходного вещества применяют 3-этокси : карбонил-6-метил-9-фениламинотиокар бонил-4-оксо-б,7,8,9-тетрагидро-4Н-пиридо 1,2-а пиримидин. Получают 3-этоксикарбонил-6-метил-9- (метилтиофениламино)метиленJ-4-оксо-6,7,8 -тетрагидрс1-4Н-пнридо 1 ,2-а пиримид с выходом 36%, т.пл. 11 О-112С. Найдено, %: С 62,64; Н 5,81; . N 1,01 . Il27f 3« Вычислено, %: С 62,46; Н 5,77; N 10,93. Пример 26. Работают как описано в примере 11 и 12, но в качестве исходного вещества применяют 3-этоксикарбонил-6-метил-9-фениламинотиокарбонил-4-оксо-6,7,8,9-тетрагидг1-щро-4Н-пиридо 1 ,2-aJ пиримидин. Получают 9-фениламинотиокарбонил-З-карбоксил-6 метил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо : 1 ,2-а пиримидин с выходом 58%, т.пл. П9-121с (разл.), Найдено, %: С 59,03; Н 5,03; N 12,31. C,,,H,, , Вычислено, %: С 59,45; Н 4,99; N 12,23. Пример 27. Работают как в описано в примере 14 и 15, но в ка-, естве изодианата применяют этилизотиодианат. Получают 3-этоксикарбонил 6-метил-9-этиламинотиокарбонил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо 1,2-а пиримидин с выходом 32%, который перекристаллизовывают из этилацетата, т.пл. 179-18 с, Навдено, %; С 55,60| Н 6,42 N 13,07, S ;,95. C,5H2,Nj03S Вьиислено, %: С 55,71; Н 6,54; N 12,99, S 9,91 I, Пример 28. Поступают как в примерах 5-9,. но в качестве исходного продукта применяют оптически активный (-)-З-этоксикарбонил-б-метил-4-ОКСО-6,7,8,9-тетрагидро-4Н-пирио D , 2-aJ пиримидин -111°, (с 2, метанол} и фенилизодианат, Получ;ают (-) -З-этоксикарбонил-6-метил-9-фениламинокарбонил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо 1,2-а иримз дин, выход 45%, т.пл. 174176 С (после перекристаллизации из этанола), ci -62 хлороJ) орм/метанол : 1) . Найдено, %: С 64,11; И 6,03; N. 11 ,84. Ci9H2,N30 Вычислено, %: С 64,21; Н 5,95; N 11 ,83. Пример 29. Поступают как в примерах 5-9, но в качестве исходного продукта применяют оптически активный (+)-3-этоксикар5онил-6-метил-4-ОКСО-6,7,8,9-тетр т ги-дро-4Н-пиридо 1 5 2-а пирим11дина oi г 1 10°, (с 2, метанол) и фенилизопианат. По
| J | |||
| Knaus Е | |||
| Е | |||
| etal | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| - Can | |||
| J | |||
| Pharm | |||
| Sci, 1976, II | |||
Авторы
Даты
1984-03-23—Публикация
1980-03-20—Подача