2. Способ по п. 1,отличающ и и с я тем, что в качестве растворителя используют нитрил карбоновой кислоты, алканол, хлорированный углеводород или диметилсульфоксид.
3. Способ по п. 1,отличающ и и с я тем, что в качестве акцептора галогенводорода используют третичный амин или пиридин.


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения геминальных дигалоидных производных конденсированных пиримидин-4-онов,рацематов или оптически активных антиподов | 1980 |
|
SU1151210A3 |
| Способ получения производных пиридо /1,2-а/ пиримидина или их оптических изомеров, или их гидратов, или их солей | 1980 |
|
SU980622A3 |
| Способ получения конденсированных производных пиримидина или их солей | 1980 |
|
SU1082324A3 |
| Способ получения конденсированных производных пиримидина в виде рацематов или оптических изомеров | 1978 |
|
SU1181546A3 |
| Способ получения производных пиридо (1,2- @ ) пиримидина или их кислотно-аддитивных солей | 1978 |
|
SU1022659A3 |
| Способ получения производных пиридо/1,2-а/пиримидинов или их солей,или их оптически активных изомеров | 1978 |
|
SU906379A3 |
| Способ получения производных пиридо-(1,2-а) пиримидина или их фармацевтически приемлемых солей,или их оптически активных изомеров | 1978 |
|
SU999972A3 |
| Способ получения конденсированных пиримидинов или их солей,или их оптических изомеров | 1977 |
|
SU969165A3 |
| Способ получения 9-формилпроизводных пиридо @ 1,2- @ пиримидина или их оптически активных антиподов | 1982 |
|
SU1245260A3 |
| Способ получения производных пиридо (1,2-а) пиримидина или их фармацевтически приемлемых солей или их оптически активных изомеров | 1978 |
|
SU999973A3 |
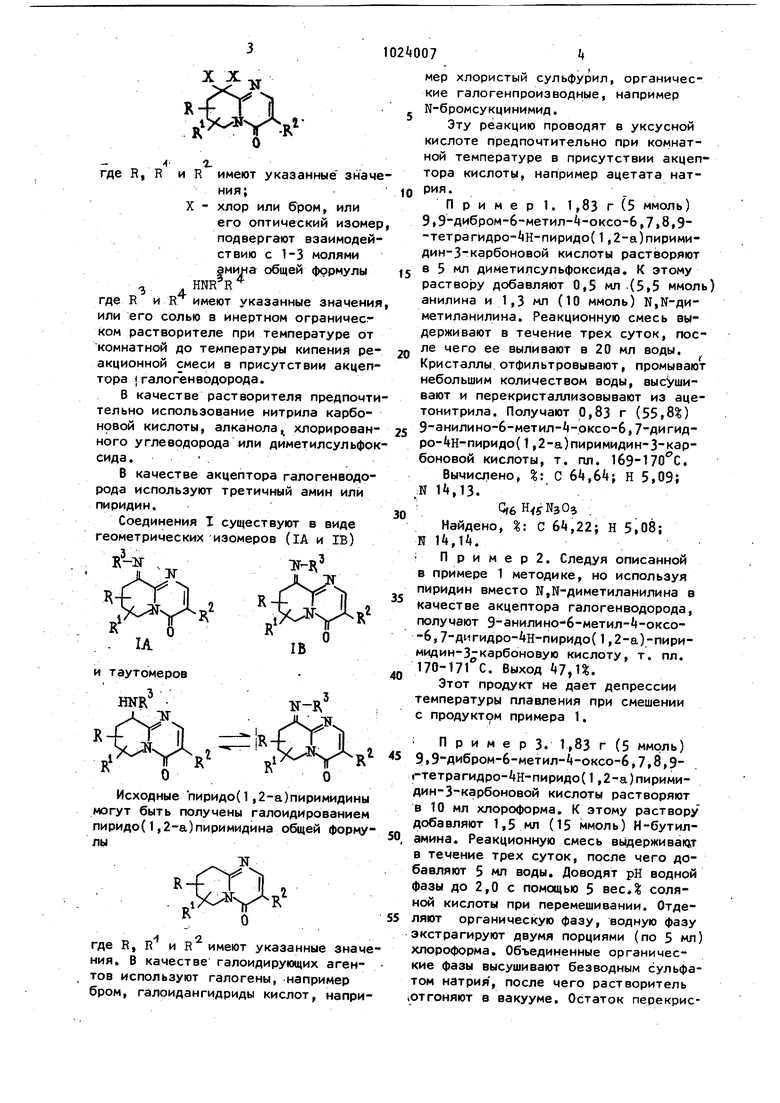
1. Способ получения производных пиридо

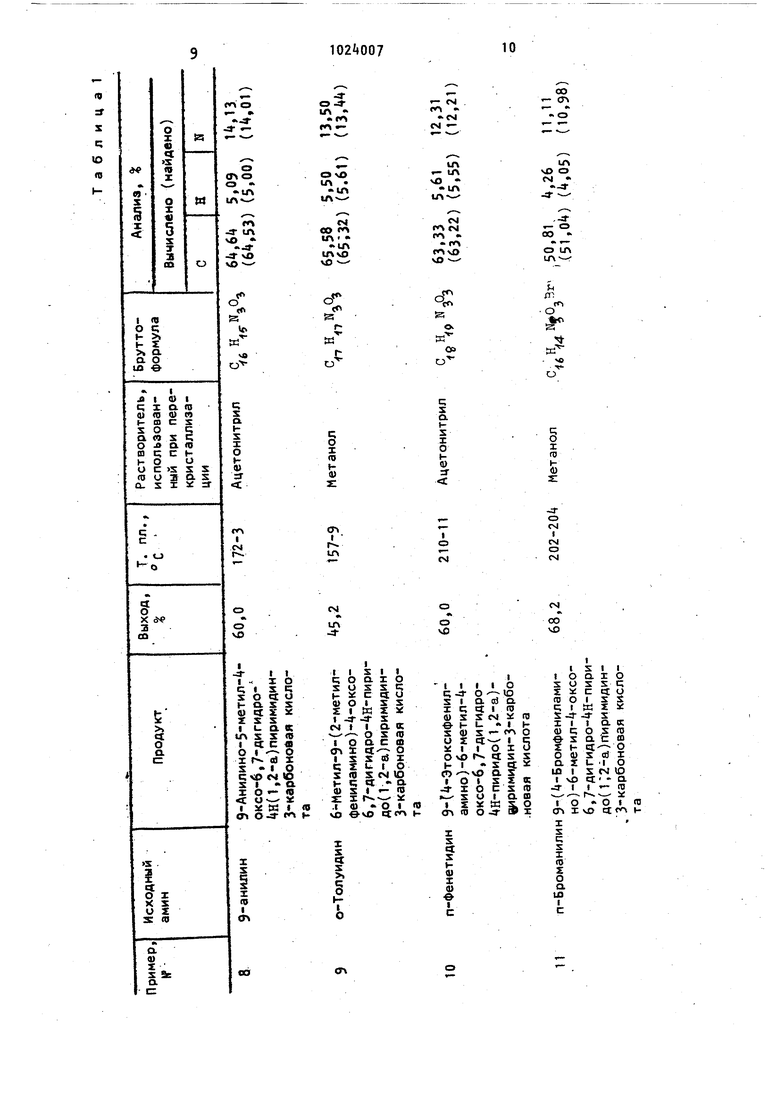
Изобретение относится к способу получения производных пиридо(1,2-а)пиримидина, обладающих антиаллергической и антиастматической активностью, которые могут найти применение в медицине. Известен способ получения производных пиридо(1,2-а)пиримидина общей формулы где R, R и R - водород или ал кил с - атомами углеро„ да; R - карбоксил, карбамоил, алкоксикарбонил, где алкил с -k атомами углерода, карбонитрил; R - алкил незамещенный или замещенный арил, пиридил, тетразолил, их солей и оптических изомеров, заключающийся в том, что 9 бромпиридо(1,2-а)пиримидин формулы где R , R и R имеют указанные значения, подвергают взаимодействию с амином : 40 общей формулы HNRRгде R и R имеют указанные значения, в инертном органическом растворителе в присутствии акцептора галогенводо- 45 род го ли, ет ни дук ход что вод фор где или или гал фор а с последующим выделением целевопродукта в виде основания или соили оптического изомера СОВыход целевых продуктов составля26-60%. Недостатком способа является сравельно невысокий выход целевых протов. Цель изобретения - повышение выа целевых продуктов. Поставленная цель достигается тем, согласно способу получения произных пиридо(1,2-а)пиримидина общей мулы R N ir R, R и R - водород или алкил с 1-А атомами угле рода; R - карбоксил, карбамоил, где алкил с 1- атомами углероо да, или карбонитрил; R - алкил с 1-А атомами углерода, бензил, незамещенный фенил или замещенный фенилом, алкокси- или . алкилгруппой, в которых алкил с 1-4 атомами углерода, одним или двумя галоидами, нитро-, окси- или карбоксигруппой; пиридил или тетразолил, их солей со щелочными металлами, их оптических изомеров 9,9-ДИогенпиридо(1,2-а)пиримидин общей мулы X X .ИГЛ г. где R, R MR имеют указанные знач ния; X - хлор или бром, или его оптический изоме подвергают взаимодей ствию с 1-3 молями амина общей формулы где R и R имеют указанные значени или его солью в инертном ограничесг ком растворителе при температуре от комнатной до температуры кипения ре акционной смеси в присутствии акцеп тора галогенводорода. В качестве растворителя предпочт тельно использование нитрила карбонрвой кислоты, алканола хлорирован ного углеводорода или диметилсульфо сида. В качестве акцептора галогенводорода используют третичный амин или пиридин. Соединения I существуют в виде геометрических изомеров (lA и IB) К и таутомеров ШК Исходные пиридо(1,2-а)пиримидины могут быть получены галоидированием лиридо(1,2-а)пири миди на общей форму лы где R, R и R имеют указанные знач ния. В качестве галоидирующих агентов используют галогены, например бром, галоидангидриды кислот, напри мер хлористый сульфурия, органические галогенпроизводиые, например N-бромсукцинимид. Эту реакцию проводят в уксусной кислоте предпочтительно при комнатной температуре в присутствии акцептора кислоты, например ацетата натР П р и м е р 1. 1,83 г (5 ммоль) 9 9 Дибром-6-метил-4-оксо-6,,9-тетрагйдро-АН-пиридо(1,2-а)пиримидин-3-карбоновой кислоты растворяют в 5 мл диметилсульфоксида. К этому раство|эу добавляют 0,5 мл .( ммоль) анилина и 1,3 мл (10 ммоль) Н,К-диметиланилина. Реакционную смесь выдерживают в течение трех суток, после чего ее выливают в 20 мл воды. Кристаллы отфильтровывают, промывают небольшим количеством воды, высУшивают и перекристаллизовывают из ацетонитрила. Получают 0,83 г (55,8) 9-анилино-6-метил-|-оксо-6,7-ДИГидро-Ш-пиридоС1,2-а)пиримидин-3-карбоновой кислоты, т. пл. 169-170 С, Вычислено, %: С б , Н 5,09; N Н,13. QfeH fNaOa ; Найдено, %: С 6,22; Н 5,08; N 14,И. П р и м е р 2. Следуя описанной в примере 1 методике, но используя пиридин вместо Ы,Ы-диметиланилина в качестве акцептора галогенводорода, получают ЭЭнилино-б-метил- -оксо-6,7-Дигидро-4н-пиридо(1,2-а)-пиримидин-3-карбоновую кислоту, т. пл. 170-171 С. Выход Ц7,П. Этот продукт не дает депрессии JI4 температуры плавления при смешении с продуктом примера 1. Примерз. 1,83 г (5 ммоль) 9.9 Дибром-6-метил-(-оксо-6,7,8,9гтетрагидро-4н-пиридо(1,2-а)пиримидин-3-карбоновой кислоты растворяют в 10 мл хлороформа. К этому раствору добавляют 1,5 мл (15 ммоль) Н-бутиламина. Реакционную смесь выдерживак},т в течение трех суток, после чего добавляют 5 мл воды. Доводят рН водной фазы до 2,0 с помощью 5 вес,% соляной кислоты при перемешивании. Отделяют органическую фазу, водную фазу экстрагируют двумя порциями (по 5 мл) хлороформа. Объединенные органические фазы высушивают безводным сульфатом натрия , после чего растворитель OTгоняют в вакууме. Остаток перекристаллизовывают из метанола. Получают 0,5 г (36,1) 9-( бутиламино)-6-ме тил- -оксо-6,7-Дигидро- Н-пиридо(1,2-а)пиримидин-3 карбоновой кислоты, т. пл. 135-13f С. Вычислено, %: С 60,63; Н 6,91} N 15,15. C-( Найдено, : С 60,92; Н 7,00; N 15,20. Пример4.В15мл метанола суспендируют 1,83 г (Б ммоль) 9, бром-6-метил- -оксо-6,7,8,Этетрагидро-4н-пиридо{1,2-а)пиримидин-3-карбоновой кислоты и 1, мл (15 ммоль) анилина. Смесь нагревают при перемешивании до получения раствора. Этот раствор охлаждают до комнатной температуры и перемешивают в течение трех суток. Выпавшие кристал лы отфильтровывают и промывают метанолом. Получают 0,8 г (53,8%) 9 анилино:-6-метил- -оксо-6,7 Дигидро- Н-пиридо( 1,2-а)пиримидин-3-карбоновой кис лоты, т. пл. 172-17 С. Этот продукт не дает депрессии температуры плавления при смешивании с продуктом примера 1 или примера 2, П р и м е р 5. Растворяют в 30 мл абсолютного этанола 3,9 г этилового эфира (10 ммоль) 9,9-Дибром-6-метил- -оксо-6,7,8,9 тетрагидро- Ш-пиридо-(1,2-а)пиримидин-3-карбоновой кис лоты. К этому раствору добавляют 3,3 мл (30 ммоль) N-метиланилина, после чего реакционную смесь капятят С обратным холодильником в течение 8 ч. Когда реакция завершается, раство ритель отгоняют при пониженном давле нии. К остатку добавляют 40 мл 5%-но соляной кислоты и продукт экстрагируют двумя порциями (по 15 мл) )слоро форма. Объединенные органические фазы высушивают над безводной гидроокксью натрия и выпаривают в вакууме. Остаток перекристаллизовывают из метанола. Получают 2,6 г (76,6%) этилового эфира 6-мeтил-9-(N-мeтил-aнилинo)-i -оксо-6,7-дигидро- Н-пиридо( 1,2-а)пи римидин-3-карбоновой кислоты, т, пл, Ul-1l42C. Вычислено %: С 67, Н 6,23; N 12,38. .. CygH-i N Oe Найдено, %: С 67,50; Н 6,36; 12,it1. N П р и м е р 6. Следуя описанной в примере 5 методике, но используя вместо этилового эфира 9,9 дибром-6-метил- -оксо-6,7,8,9-тетрагидро-«Н-пиридоС 1 ,2-а) пиримидин-3-карбоновой кислоты 9 9-Дибром-6-метил-4-оксо-6,7,8,9-тет ра гидро- Н-пи ридо (1,2-а)пиримидин-3-карбоиовую кислоту, получают 6-метил-9-(11 метиланилино}-4-оксо-6,7-ДИГидро-4Н-пиридо{1,2-а)пиримидин-3-карбоновую кислоту, т. пл. 170-171€. Вычислено, %: С 65,58; Н 5,50; 13,9. Найдено, % С 65,22; Н 13,37. П р и м е р 7. Растворяют в ЧО мл диметилсульфоксида 19,7 г (50 ммоль) этилового эфира 9,9-Дибром-6-метил-it-oKCo-6,7, В, 9-тeтpaгидpo-4H-пиpидo( 1,2-а)пиримидин-3-карбоновой кислоты, после чего добавляют 13,7 мл (150 ммоль) анилина. Этот раствор выдерживают в течение трех суток. После выдерживания раствор разбавляют 100 мл воды и встряхивают с тремя порциями (по 30 мл) бензола. Объединенные органические фазы высушивают безводным сульфатом натрия и выпаривают в вакууме. Перекристаллизация остатка из этанола дает 9,5 г (58,t) этилового эфира 9 анилино-6-метил- -оксо-6,7-Дигидро- Н-пиридо(1,2-а)пиримидин-3 карбоновой кислоты, т. пл. 119-120 0. Вычислено, .%: С 66,5; Н 5,89; Н 12,91. : С 66,28; Н 5,81; Найдено, N 12,82. р ы 8-19. Приме Растворяют в 5 мл диметилсульфоксида 3,7 г (10 ммоль) 9,9 дибром-6-метил- -оксо-6,7,8,9-тетрагидро-Ан-пиридо(1,2-а)пиримидин-3 карбоновой кислоты. К этому раствору добавляют 30 ммоль ароматического амина. Реакционную смесь выдерживают при комнатной температуре в течение трех суток. Выпавшие в осадок кристаллы отфильтровывают. Если кристаллизация не происходит, то продукт осаждают из реакционной смеси, добавляя 20 мл воды или 20 мл метанола). Продукт перекристаллизовывают из растворителя.
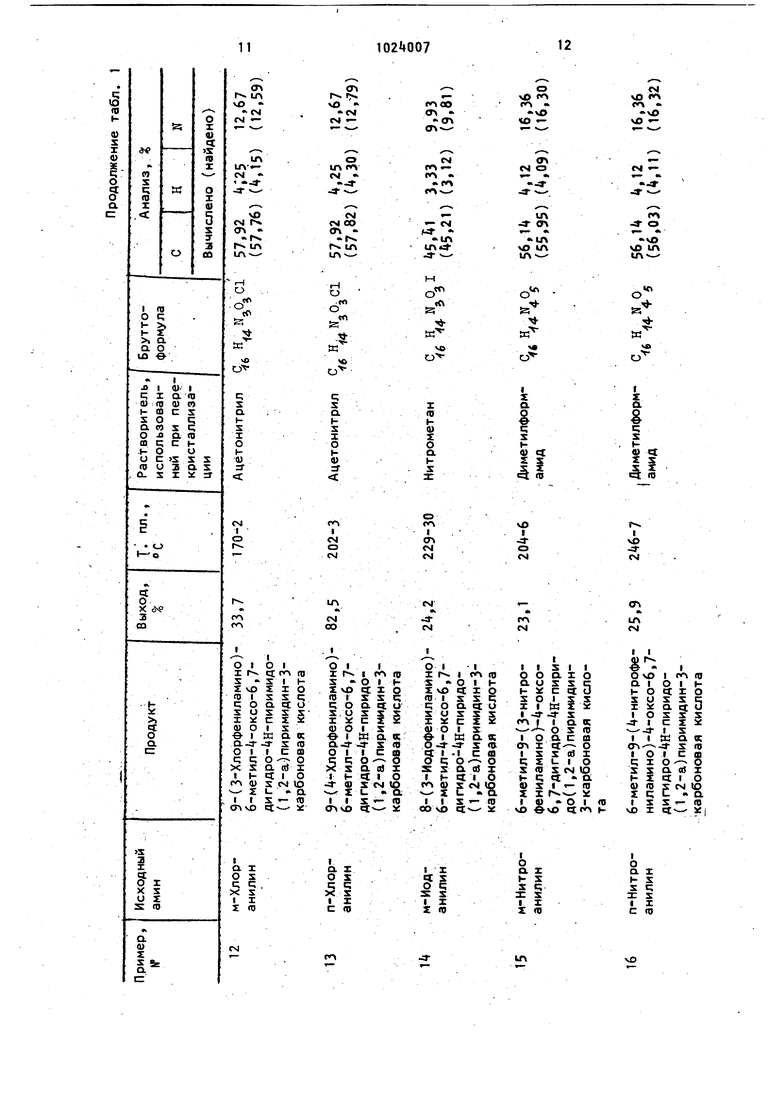
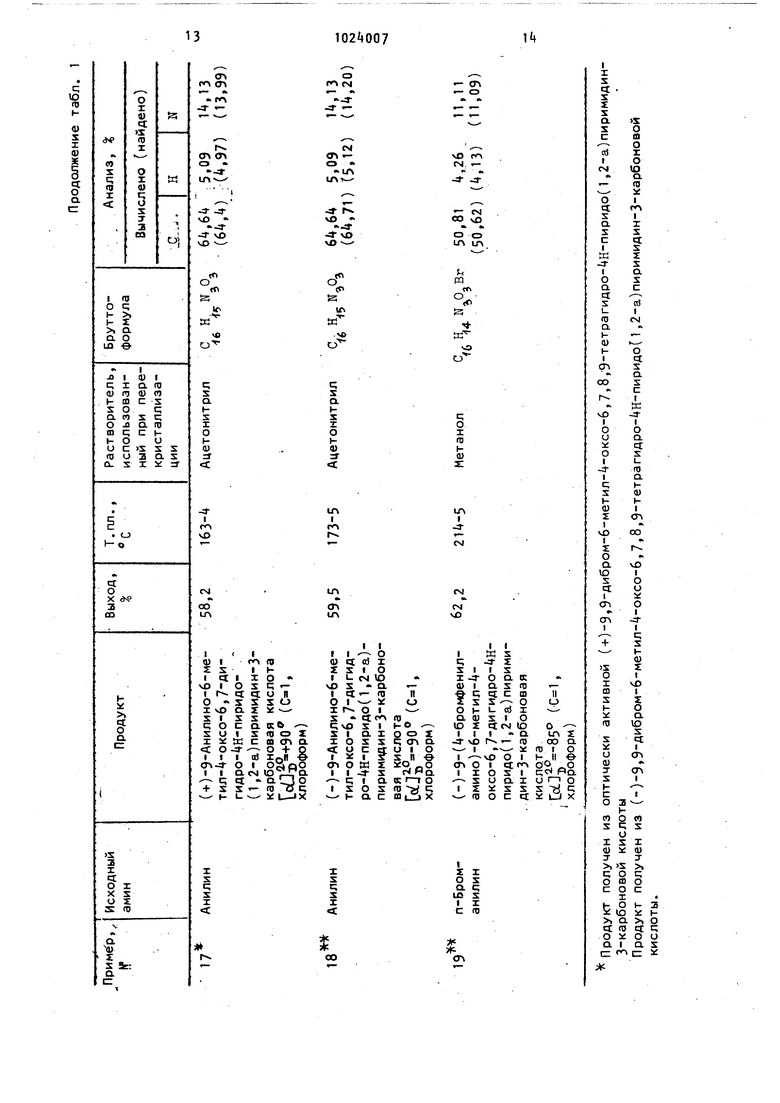
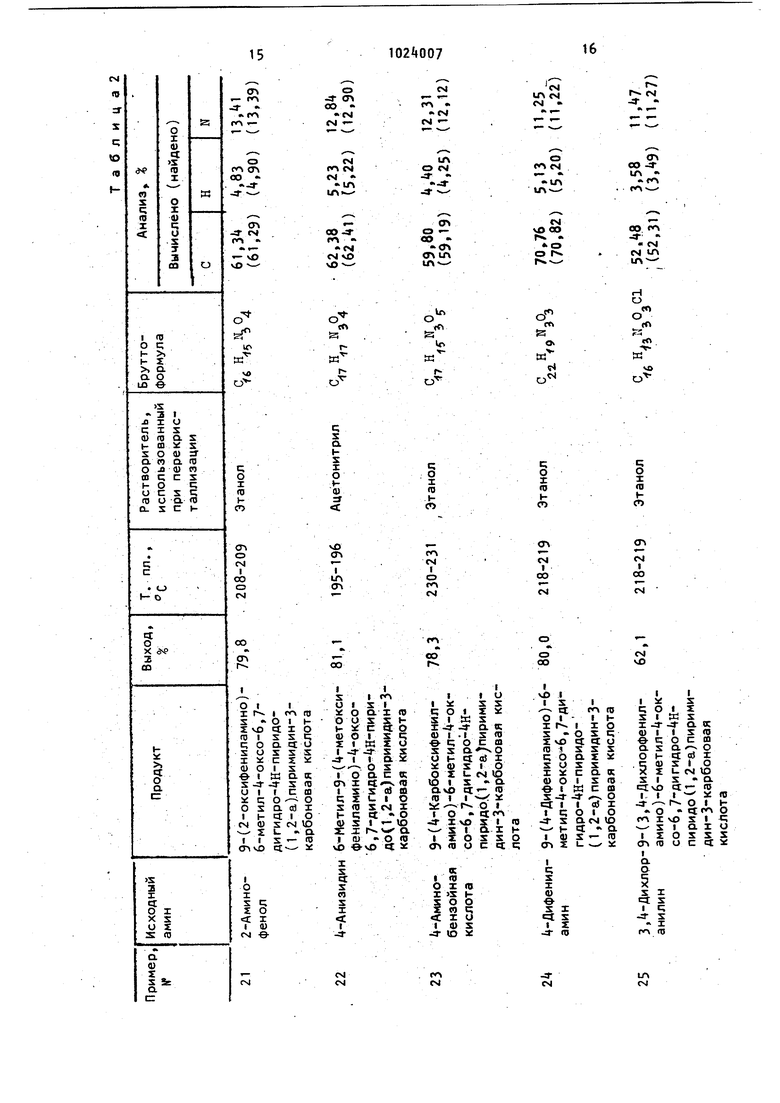
Характеристика соединений формулы I, полученных согласно примерам 8-19, представлена в табл. 1./
Пример 20. Следуя описанной в примере 8 методике, но заменяя
9,9 Дибром-6-метил-|-оксо-6,718,9 -тетрагидро- Н-пиридо( 1,2-а) пиримидин-3-карбоновую кислоту на 9,9 дибром-4-оксо-6,7,8,9-тетрагидро- Н пиридо( 1 ,/.-а)пиримидин-3-карбоновую кислоту, получают 9-(фениламино)- -оксо-6,7-дигидро-4н-пиридо(1,2-а)пиримидин-3 карбоновую кислоту, т. пл. (ацетонитрил). Выход, 60,5%.
Вычислено, %: С 63,60; Н ,63; N И,83.
С ,
Найдено, %: С 63,2; Н «,59; N И,70.
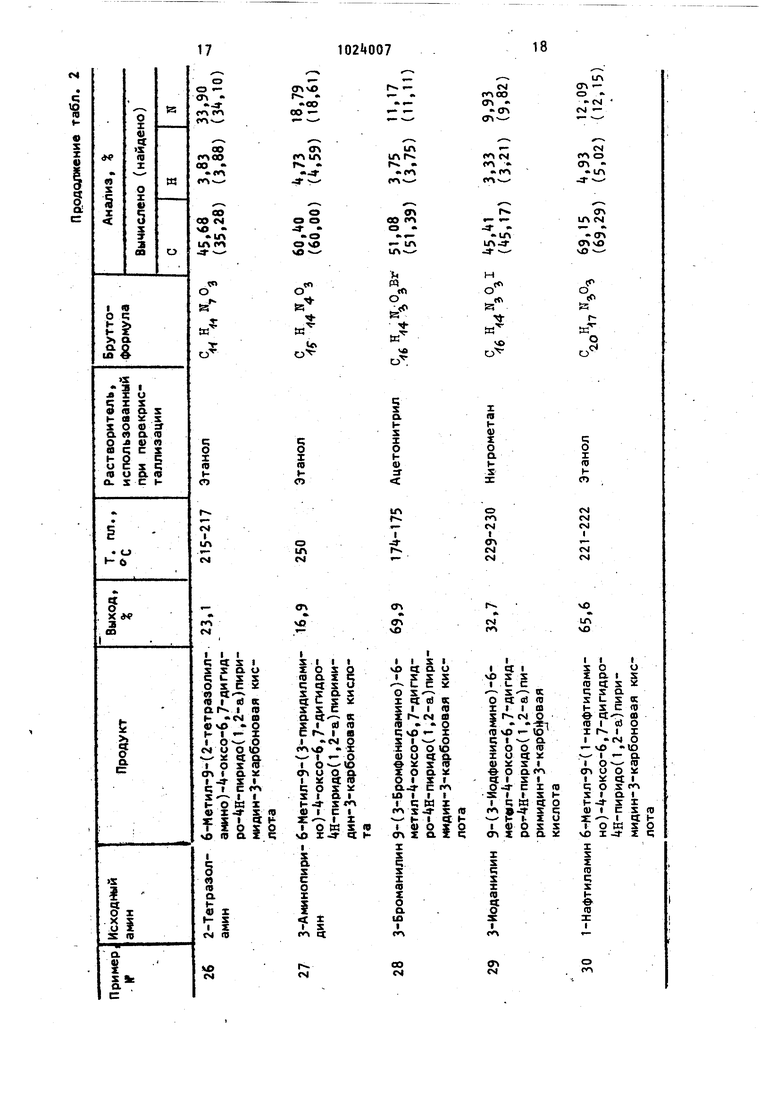
Примеры 21-30.
Используя методику, описанную в примерах 8-19, получают соединения, указанные в табл. 2.
Л)
If
X
t;
(О
ffi
r r so
ем
CM -
ir f
ем
-
CM oo
0 -t
r 1Л
1Л -
H
о
w
o
a
(- s
о a
«v
I
CM
о
CM
in
a z
0s
5i
1X
с e
о
VD l«
С1Л
«vO
-NO
so
CM -
CM «.
ГЛ
in -4- О j- r
V
w-
SO
u SO in o u
Ы
.C
D« cO
EE;
VO
O
k
I
s
4) et
i§ т Ч «
so I
r
I
vD
-a CM о
CM
r
CM
kx
о
X
о.X
1
I- S
f-s
s t;
sc;
X s
Xs
kl
IX
in
vO
4)
s:
V
ef. О a.
c:
-3- СП 00
см «м rf с4 м
ITl
00
гл см
см so vO-trt
12
W
и
с;
a
I- з:
о
0)
vO
сг
гп сгч
см
см
г
см
г см 1Л см - см
Г1
со -ясо см
1Г
i
in
со vO QO
p
см
o
см ш
о r
1Л-
н о
о
-J
сО
W ч
Щ
о
о
о та со
(О
н п
г
г
см
см I
I
со
со
см
см
РЛ см
-3tn см
см
«
-со
со -
«л
« ил г
--Чо
о о
о
о ч
О ь
«
о
(О
ь о
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Патент Бельгии If , кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
Авторы
Даты
1983-06-15—Публикация
1980-05-08—Подача