Изобретение относится к новой гетероциклической системе, а именно -4-амино-6,6-диметил-5,6-дигидро-8Н-пирано[4',3':4, 5)пирроло [2,3-d]пиримидину формулы I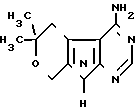 который может найти применение в синтезе биологически активных соединений.
который может найти применение в синтезе биологически активных соединений.
Известны пирроло[2,3-d]пиримидины, обладающие гипотензивным, снотворным, противосудорожным и расслабляющим мускулатуру действием.
Целью изобретения является новая гетероциклическая система.
Поставленная цель достигается гетероциклической системой 4-амино-6,6-диметил-5,6-дигидро-8Н-пирано[4',3':4,5]пирро- ло [2,3-d]пиримидином, который получают взаимодействием 2,2-диметилтетрагидропиран-4-она с этиловым эфиром муравьиной кислоты. Полученный 2,2-диметил- 5-оксиметилентетрагидропиран-4-он без выделения вводят во взаимодействие с хлористым фенилдиазонием. Образованный монофенилгидразон 2,2-диметилтетрагидропиран-4,5-диона (II) восстанавливают в 5-ацетамидо-2,2-диметил-тетрагидропиран-4-он (III). Взаимодействием последнего с динитрилом малоновой кислоты получают 2-амино-1-ацетил-5,5-диметил-3-циан-4,5,6, 7-тетрагидропирроло [2,3-c]пиран (IV), который вводят во взаимодействие с ортомуравьиным эфиром с образованием 1-ацетил-5,5-диметил-4,5,6,7-тетрагидро-3- циан-2-этоксиметиленаминопирроло[2,3- c] пирана (V). Взаимодействием последнего с концентрированным водным раствором аммиака получают 2-аминометиленамино-5,5-диметил-4,5,6,7-тетрагидро-3-цианпир- роло [2,3-c]пиран (VI), который циклизуют в присутствии метилата натрия в 4-амино-6,6-диметил-5,6-дигидро-8Н-пирано[4', 3':4,5]-пирроло[2,3-d] пиримидин (I). Синтез проводят по следующей схеме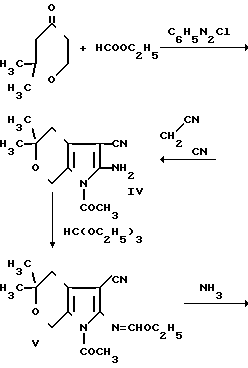
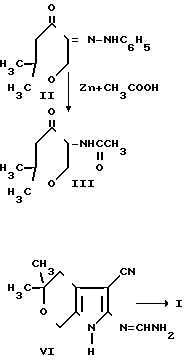
Строение полученных соединений доказано методами ИК-, ПМР-спектроскопии и масс-спектрометрически.
П р и м е р 1. 5-Монофенилгидразон-2,2-диметилтетрагидропиран-4,5-диона (II).
К смеси 12,8 г (0,1 моль) 2,2-диметилтетрагидропиран-4-она и 11,1 г (0,15 моль) этилового эфира муравьиной кислоты, охлажденной до 0-5оС при перемешивании прибавляют раствор метилата натрия в метиловом спирте, приготовленный из 2,3 г (0,1 г-атом) натрия и 23 мл метилового спирта. Выпавшее натриевое производное формилтетрагидропиранона оставляют на ночь при комнатной температуре, затем осадок растворяют, прибавляя к реакционной смеси при 0-(-5)оС 50 мл воды. Полученный раствор приливают к охлажденному до 0оС водному раствору хлористого фенилдиазония, приготовленному обычным способом из 9,3 г (0,1 моль) анилина, 30 мл концентрированной соляной кислоты и 6,9 г (0,1 моль) нитрита натрия и доведенному до рН 5,0-6,0 ацетатом натрия. Выпавшие кристаллы отфильтровывают, промывают холодной водой и сушат. Выход 19,0 (81,9%). Т.пл. 67-68оС (этиловый спирт).
Найдено, C 67,19; H 6,98; N 12,09.
C13H16N2O2.
Вычислено, C 67,21; H 6,94; N 12,05.
В ИК-спектре имеются следующие полосы поглощения,
ν, см-1: 1650 (С=О), 3260-3280 (NH).
ПМР-спектр (CCl4), δ м. д. 1,30 (6Н, с); 2,40 (2Н, с); 4,65 (2Н, с); 7,10-7,25 (5Н, д); 13,60 (1Н, с).
П р и м е р 2. 5-Ацетамидо-2,2-диметилтетрагидропиран-4-он (III).
К смеси 46,4 г (0,2 моль) 5-монофенилгидразона, 2,2-диметилтетрагидропиран-4,5-диона (II), 20,5 г (0,24 моль) плавленного ацетата натрия, 55,0 (0,54 моль) уксусного ангидрида и 200 мл уксусной кислоты, нагретой до 40оС, при энергичном перемешивании прибавляют небольшими порциями 40,0 г (0,6 г-атом) цинковой пыли. Затем реакционную смесь перемешивают 1,5 ч при кипении, отфильтровывают шлам, промывают его горячей уксусной кислотой и уксуснокислый раствор упаривают при пониженном давлении. К остатку прибавляют воду, выпавший ацетанилид отфильтровывают, а водный раствор упаривают в вакууме. К остатку прибавляют хлороформ, отфильтровывают ацетат цинка, отгоняют хлороформ. Продукт перегоняют. Выход 27,1 г (73,3%).
Т.кип. 113-114оС/1 мм.
Найдено, C 58,32; H 8,11; N 7,59.
C9H15NO3.
Вычислено, C 58,36; H 8,16; N 7,56.
В ИК-спектре имеются следующие полосы поглощения, ν, см-1: 1680 (O=C-NH); 1730 (C=O); 3200-3400 (NH).
ПМР-спектр (CCl4), δ, м.д. 1,20 и 1,40 (6Н, с); 2,00 (3Н, с), 2,40-2,80 (2Н, т); 3,20-3,60 (1Н, т); 4,10-4,50 (2Н, т); 7,0 (1Н, с). М=185 (масс-спектрометрически).
П р и м е р 3. 2-Амино-1-ацетил-5,5-диметил-3-циан-4,5,6,7-тетрагидропирроло- [2,3-c]пиран (IV).
Смесь 118,5 г (0,1 моль) 5-ацетамидо-2,2-диметилтетрагидропиран-4-она (III), 6,6 г (0,1 моль) динитрила малоновой кислоты, 2 мл диэтиламина, 1 мл уксусной кислоты, 100 мл абсолютного бензола кипятят с водоотделителем в течение одного часа. Выпавшие кристаллы отфильтровывают, промывают 30 мл бензола и сушат. Выход 20,0 г (86,1%). Т.пл. 180-181оС (этиловый спирт).
Найдено, C 61,69; H 6,50; N 17,98.
C12H15N3O2.
Вычислено, C 61,80; H 6,48; N 18,01.
В ИК-спектре имеются следующие полосы поглощения, ν, см-1: 1630 (C=C), 1720 (N-C=O), 2230 (C=N); 3220, 3310, 3410 (NH2). ПМР-спектр (CDCl3), δ, м. д. 1,30 (6Н, с); 2,35 (3Н, с); 2,40 (2Н, с); 4,60 (2Н, с); 6,10 (2Н, с).
М=233 (масс-спектрометрически).
П р и м е р 4. 1-Ацетил-5,5-диметил-4,5,6,7-тетрагидро-3-циан-2-этоксиметилен- аминопирроло [2,3-c]пиран (V).
К суспензии 2,3 г (0,01 моль) 2-амино-1-ацетил-5,5-диметил-3-циан-4,5,6,7-тетрагид- ропирроло [2,3-c] пирана (IV) в 25 мл ортомуравьинового эфира прибавляют 2 капли уксусного ангидрида. Смесь кипятят 2 ч с обратным холодильником, затем растворитель отгоняют в вакууме досуха. К остатку прибавляют петролейный эфир. Образовавшиеся кристаллы отфильтровывают и сушат. Выход 2,7 г (93,4%). Т.пл. 82-83оС (петролейный эфир этиловый спирт, 1:3).
Найдено, C 62,29; H 6,59; N 14,55.
C15H19N3O3.
Вычислено, C 62,27; H 6,62; N 14,52.
В ИК-спектре имеются следующие полосы поглощения, ν см-1: 1150 (С-О-С); 1630 (С=С), 1720 (N-C=O), 2225 (C=N).
ПМР-спектр (CDCl3), δ, м.д. 1,20-1,60 (9Н, т); 2,50 (2Н, с); 2,60 (3Н, с); 4,20-4,60 (2Н, к); 4,80 (2Н, с); 8,20 (1Н, с).
М=289 (масс-спектрометрически).
П р и м е р 5. 2-Аминометиленамино-5,5-диметил-4,5,6,7-тетрагидро-3-цианопирро-ло [2,3-c]пиран (VI).
К раствору 2,9 г (0,01 моль) 1-ацетил-5,5-диметил-4,5,6,7-тетрагидро-3-циан-2-эток- симетиленаминопирроло [2,3-c] пирана (V) в 25 мл этилового спирта прибавляют 10 мл концентрированного водного раствора аммиака. Смесь выдерживают 2 дня при комнатной температуре. Образовавшиеся кристаллы фильтруют, промывают водой и сушат. Выход 1,5 г (71,4%).
Т.пл. 300-302оС (ДМФА).
Найдено, C 60,52; H 6,43; N 25,61. C11H14N4O.
Вычислено, C 60,55; H 6,46; N 25,67.
В ИК-спектре имеются следующие полосы поглощения, ν, см-1: 1630 (C=C), 2230 (C=N); 3200, 3250, 3360 (NH2).
M=218 (масс-спектрометрически).
П р и м е р 6. 4-Амино-6,6-диметил-5,6-дигидро-8Н-пирано[4',3':4,5] пирроло[2,3-d] пиримидин (I).
Смесь 2,2 г (0,01 моль) 2-аминометиленамино-5,5-диметил-4,5,6,7-тетрагидро-3-цианпирроло [2,3-c]пирана (VI), 0,54 г (0,01 моль) метилата натрия, 30 мл метанола кипятят на водяной бане 1,5 ч. После охлаждения образовавшиеся кристаллы отфильтровывают, промывают метиловым спиртом и сушат. Выход 1,9 г (87,5%). Т.пл. 364-365оС с разложением (пиридин).
Найдено, C 60,51; H 6,48; N 25,72.
C11H14N4O.
Вычислено, C 60,55; H 6,46; N 25,67.
В ИК-спектре имеются следующие полосы поглощения, ν, см-1: 1630 (C=N); 3205, 3310, 3440 (NH2).
ПМР-спектр (DMCO-d6), δ м.д. 1,20 (6Н, с); 2,40 (2Н, с); 4,40 (2Н, с); 7,10 (2Н, с); 7,90 (1Н, с); 8,70 (1Н, с).
М=218 (масс-спектрометрически).
4-АМИНО-6,6-ДИМЕТИЛ-5,6-ДИГИДРО-8Н-ПИРАНО (4′,3′:4,5) ПИРРОЛО [2,3-D] ПИРИМИДИН формулы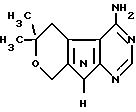
| Патент США N 3037980, кл | |||
| Прибор для периодического прерывания электрической цепи в случае ее перегрузки | 1921 |
|
SU260A1 |
Авторы
Даты
1995-10-27—Публикация
1982-11-03—Подача