Изобретение относится к способу получения новых антибиотиков цефалоспоринового ряда, а именно производных цефалоспорин-1-оксида, которые могут найти применение в качестве лекарственных средств в медицине. Известен способ получения биологически активных 3,7- дизамещенных цефалоспоринов, в частности (2аминотиазолил-4)-2-алкоксииминоацетамидо -3-(1-замещенный тетразолил-5) тиометил-З-цефем-4-карбоновых кислот заключающийся в том, что защищенную 7-амино-З-гапоидметил-З-цефем 4-карбоновую кислоту подвергают ацилированию 2-(2-защищенный аминотиазолил4)-2-алкоксииминоуксусной кислотой в среде инертного органического раст ворителя в присутствии карбодиимида и органического или неорганического основания при охлаждении или при комна ной температуре, образующийся продук подвергают взаимодействие с соответT- d-iNч t °t где R и R - метил или R и R2 вместе - 1,3-пропилен; RJ- 1Н-1,2,4-триаэол-3-ил; i 5-амино-1Н-1,2,4-триазол-3-ил, 2-амино- . 1,3,4-тиадиазол-5-Ш1, 2-меркапто-1,3,4-тиадиазол-5-ил или 3-оксипиридил-2в виде сан-изомеров ацилированием трет.бутилового эфира 7-амино-Збромметил-З-цефем-4-карбоновой кислоты I-оксида кислотой общей формулы II Кщ}УН $ ,(J-COOH 1 Нв N RI o- -doo ct-cJH, Ff CJH, в виде сан-изомера, где RI и R имеют указанные значения;R -группа, завроцакщая ами ногруппу, такая как тритил, в виде сйн-изомера. ствующим 1-замещенным тетразолил5-тиолом в среде инертного органического растворителя в присутствии органического или неорганического основания при комнатной температуре или при нагревании с последующим снятием защитных групп lJ , Zj Целью изобретения является получение новых антибиотиков цефалоспоринового ряда, расширяющих,арсенал средств воздействия на живой организм, с более низкими значениями минимгшьной ингибирующей концентрации. Эта цель достигается основным на известных в ряду цефалоспоринов; реакциях ацилирования 7-аминогруппы и обмена галоида на гетероциклическую тиогруппу в 3-метильном заместителе способом получения производных цефалоспорин-t-оксида формулы I т-Г J-NY «2-S-K3 JooH I -в среде инерного органического растворителя, такого как метиленхлорид, в п рисутствии карбодиимнда и органического основания при комнатной температуре, взаимодействием полученного продукта с гетероциклическим тиолом формулы III где R имеет указанные значения, в среде инертного органического растворителя, такого как диметипформамид, в присутствии неорганического или органического основания при комнатной температуре с иоследуюпрт . снятием групп, згицздакщих амино- и карбоксигрупгал кислотньв4 гидролизом и вьюелением целевого продукта. Продукты цефалоспоринового ряда не имеют четкой тоЧки плавления, а при помоор только температур точки разложения их не удается pxapjKTjev ризовать, поэтому они харшетеризуются при помощи их спектра ядерного магнитного резонанса, зафиксированного в диапазоне 60 МГц, а в качестве внутреннего эталона исполь зуется гексаметилдиснлоксан.
3
в приведенных примерах используются следующие сокращения: С синглет; Д - дублет; Т - триплет: К - квадруплет; ДЦ - дублет дублета; Ш.С. - широкий синглет; М - мул типлет; АВ - система АВ; J - представляет постоянную связи.
KpQMe того, в каждом случае проводился элементарный микроанализ; полученные данные находились в полном соответствии с указанными формулами.
Пример 1. (2-Амино-Атиазолш1)-2-(2-ка рбокси-2-пропилоксиимино)-ацетамидо -3- l Н 1,2,4триазол-3-илтиометил1-З-цефем-18-оксид-4-карбоновая кислота, синизомер (СМ 40 765)
N-NH
Rj CHj;
Ч
N
a), (2-Тритш1амино-4-тиазол1ш)-2-(.бутоксикарбонш1-2пропилоксиимино)-aцeтaмидoJ -3-броммегил-3-цефем-4-карбоксилат трет.бутил f-S-оксид, син-изомер.
(V) R,
СНВ раствор 5 г хлоргидрата 7-амино-3-бромметил-3-цефем-4-карбоксилаta трет.бутил t-S-оксида в 90 мл мётнленхлорида добавляют 1,72 мл трйэтиламина, 7,57 г 2- 2-тритиламино-4-тиазолнл -2- трет.бутоксикарбонил-2-пропилоксиимино уксусной кислоты, 2,84 г дициклогексилкарбодатмида и 0,1 г оксибензотриазола. Смесь перемешивают в течение 15ч при окружающей температуре, затем отделяют фильтрацией образовавшееся дициклогексилированное соединение.
-. „ - -- . . , - 4-V После выпаривания растворителя
остаток подвергают хроматографическому разделению при помощи колонны силикагеля (50 г). Используя в качестве элюеата смесь гексан-этилацетат(50-50,о/о) получают. 4,3 г ис«сомого продукта.
J, .- Спектр ЯМР (в растворе обрабо- тайном дейтрием дчметилсульфокси-1Й. де7: 1Н с 8.70.РРШ СШ-Trit, С - 1Н с 8.07 ррш (NH-CO, Д, 3 9 Гц).15Н с 7,25 ррш (Н trit С) - 1Н с 6.72 (Н тиазол, С) - 1Н с 5.88 ррш (Ну, ДД, :, 9 Гц; 1г 4 Гц) - 1R с 4,96 ррт (Hg, Д, 1 4 Гц) - 2Н с 4,50 ррт (, АВ,дв - 12Гц) 2Й с 3,77 ррш (СН2 в 2, Ш.С.) - 9Н
143384
с 1,45 ррт (CHj, С) - 6Н с 1,37 ррт-с-сн
1
CHj (-9H с 1,27 ppm
СН,
1
.0.
-С-СН, I СН.
Б). (2-Тритш1амино-4-тиазо0 |Лил)-2-(2-третичн.бутоксикарбонил2-пропилоксиимино)-ацетамидо -3- 1Н1,2,4-триазол-3-илтиометил -3-цёфем- карбоксилат-4-третичн.-бутил-1-Sоксид, син-изомерМ NH
СН
R, R
2
3
В раствор 2,8 г бромсодержащего производного, полученного в примере IQ.B 20 мл Ы,Н-диметилацетамида
0 добавляют 0,308 г 3-меркапто 1Н
1,2,4-триазола, затем 0,4 мл триэтил амина. Спустя 3 ч, в течение которого осуществляют перемешивание при окружающей температуре, раствори5 тель выпаривают под вакуумом, а остаток растворяют в 80 мл хлорида метилена. Далее осуществляют обработку при помощи хроматографии на колонне, содержащей 120 г силикаQ геля. При элюировании этштацетатом получают 2,3 г искомого продукта. с). СМ 40.765.
Перемешивают в течение 30 мин при окружающей температуре 1,06 г продукта, полученного в примере 1Ь
в 10 мл трифторуксусной кислоты. Смесь выпаривают под вакуумом до объема 5-6 мл, затем осаждают добавлением 200 мл безводного простого эфира. Осадок собирают, промывают ангидридом простого эфира и сушат. Повторяют еще один раз предьщущую «I операцию и получают аналогичным образом 0,6 г искомого продукта.
ЯМР-спектр: 5Н с 9-10,5 ррт (NH триазол, NH, 2 СООН, ш.с.) - 2Н с 8,40 ррт (NHCO, Н триазол.М) - 1Н с 6,87 ррш (И триазол,С) - 1Н с5,97ррп (Нг. М) - 1Н с 4,92 ррт (Н, Д, - 4 HZ) - tH с 4,5 ppm (CHjS-, A системы АВ, 1дц 13 Гц) - 1Н с 4,30 ррт (CHjS, В системы АВ, J - 13 Гц) 2Н с 3,80 ррш (CH,, ш.с.) - 6Н с
/СН,.
С),
(-С
СН
П р и М е р 2. (2-Лмино-4тнаэолил)-2-(2-карбокси-2-пропилоксиимияо)-ацетам1здо|-З- 2 амино1,3,4-тяадиаэол-5-ил и)метил1 -3-цефем-1-8-оксяд-4-карбояовая кислота, син-изомер /СМ ) (I) R, - Rj- CH.jjRj -l a). 7-|jZ-(2-TpirTKiiaMHHo-4-гназоли . бутрксикарбоюшоксиимшюацетамидоЗ -3-С2-амино-, 3,4 тиадиазол-5ялтиометип -3-цефем-4- сарбоксялаттретичн.-бутил-1-8-окс1ща, син-изомерN-N Rj«Ke-tiH3i в течение 16 ч при окружающей тем пературе перемешивают смесь t г бромированного производного по iipitMeру 1 а) 0,18 г 2-амино-4-мер1еаято1,3,4-тиадиазола я 0,12 г бикарбоната калия в 10 мл дяметялформамяда. Растворитель выпаривают под вакуумом я остаток растворяют в метяленхлориде. Раствор промывают водой, за тем насыщенным водным раствором хлоридз натрия. Сушат над сульфатом магния, затем раствор концентряруют до объема 5 мл. Далее осуществляют обработку на хроматографической колонне с сяликагелем (25 г). При помощи злюирования смесью этилацеЙ Ч О
Xid-
1
х Н,
р-|С-СООКСООН
№
ГЬмФр продукта R
ji,.-..
3 40.804N-N
-t. Д н
Г
О НУ НГЙЯМР-спектр
ТТц) 1Н с 8,40 ррт (НИО), Д,J 4Н с 8,5-tO ррт (N«2, 2 СООН) - 1Н с 6,83 рри (Н тиазол. С) - 1Н с 5,96 ррт (Н, ДЯ, i 9 Гц, Jg 4 Гц) - 1Н с 4,93 ррш (Hg, Д,1 - - 4 Гц) - 1Н с 4,60 ррт (CHjS, А системы АВ,Здв 13 Г) - 1Н с 4,05 ррт (CHjS, В системы АВ,Тдв « 13 Гц) - 2Н с 3,81 ррт (CHjS- O
,CHj
ш.с.(- 6Н с 1,42 ррт) - С; С).
СНз тат/гексан 90-10 (о/о) получают 1 г искомого продзгкта. Ь). СМ 40.803. В течение 45 мин при 20 С пepe fвогавают смесь 0,55 г продукта, полу1чеяного по примеру 12в, и 6 UI тряфторуксусиой кислоты. Смесь концент;ряруют под вакуумом до объема 3 мл, (атем осаждают добавлеяяем простого . Твердое вещество отделяют я сушат над фосфор1Шм ангидридом. Получают 0,39 г искомого продукта. ЯМР-спектр: 1Н с 8.5 ррш (№СО,Д j 9 Гц) - 6Н с 6,5-8,5 ррт (2NH, 2 СООН, М) - Ш с 6,90 ррт (Н-тиазол,С) - 1Н с 5,97 ррт (Ну, М) 1Н с 4,96 ррт (Н, fl,) - 1Н с 4,45 ррт (CHjS. А системы АВ, 1д0 П Гц) - 1Н с 3,90 рют (CHgS, В системы АВ,Здв « 13 Гц) - 2Н с 3,85 ррт (CH., ш.с.) - 6Н с ,СЙ5. 1,45 ррт (-С С) Примеры 3l-5. Действуют как в примере 2а), исходя из бромсодержащего прояэводиого из npimepa }о), варьируя вид используемого тиола. Осуществляют удаление заарггных групп полученных продуктов, как ука зано в примере- 2р) получают различные -соедянания формулы (Х), сведенные в табл. 1. Таблица1
При4ер I Шфр продукта
440.
AjjxJ-NHa
НО
540.953
П
XiiJ
H с 8.43 ppm (NHCO, Д, I 9 Гц).
Продолжение табл. I
ЯМР -спектр
7Н с 8-10 ррт (NH тиазол, 2 СООН, ш.с.) - 1Н с 8,45 ррт (ШСО Д,J 9 Гц) - 1Н с 6,85 ррт (Н тйазол. С) - 1Н с 5,97 ррга (Н|. ДП, J, Гц, 1г Гц) - 1Н с 4,95 ррт (Н, Д,7 4 Гц) - 1Н с 4,30 ррт (CH2S, А системы АВ, 1д9 3 Гц) V/Lirf V « rav- ъ л лл-г у -. - 1Н с 3.90 ррго (СНлЗ. В системы АВ,
1Н с 3,90 ррт (СНлЗ, В системы ««, 3fte 13 Гц) - 2Н с 3.85 ррт
/снз.
ш.с.) - 6Н с 1,45 ррт (-С С
S
сн,
5Н с 9.0 ррт (2 СООН, NH2, ОН М) 1Н с 7.87 ррт (П(, пиридин, М) - ЗН с 6,95 ррт (Н4 и Hj пиридин, Н тиазол, М) - 1Н с 5,95 ррт (Н, ДЦ, J, 9 Гц, J2 - 5 Гц) - 1Н с 4.95 ррт (Hg, Д,J 5 Гц) - 1Н с 4,60 ррт (CH2S, А системы АВ, 13 Гц) ЗН с 3,80 ррт (CHjS- O и CHjS, В
11 f J J v iirtu f xy eyi-j
-.- AT -- « 4 Л С,
системы AB, M) - 6H с 1,45 ppm
(-С.с).
CH.
П p и M e, p 6. (2-Амино-4|Гиазолии)-2-(карбокси-1-циклобутилоксяилшо) ацетамидоЛ-З- З-окси-2-nftРНДинилтиометилЗ -3-цефем-1-5-оксид-4 карбоновая кислота, син-изомер (СМ4Г646).
НО
RnVCcHi).) -R..
ei) (2-Тритиламино-4-тиазоЛвл)-2-(t-тре ичн.-бутилоксфсарбойЯ t-циклобутилоксиимино)ацетамидо| 3-бромметил 3-цефемкарбоксйдат-4третичн, -З-оксвда, син-иэо . мер RI + R (GHg)3.
is раствор 4,4 г хлор гидрата 7ажвдо-3-бромметил-3-цефем-4--кар- . божсилата-третичн.-бутил-1-S-оксида в 70 мл безводного метиленхлорида добавляют в атмосфере азота 1,5 мл: триэтиламина, 5,1 г 2-( т1шаминь-4-тиазолил)-2-(1-третичн.6утоксикарбонял-1-хдаклобутилокриимино)уксусной кислоты, син-изомера 2,4 г дициклогексилкарбодиимида и
0,,1 г 1-оксйбензотриазола. Смесь .пег ремешивают в течение 1 ч npiroKpy- жающей температуре, затем вьщеляют фильтрацией образовавшееся дициклогексшшрованное соединение, а раствор концентрируют до объема 20 мл под вакуумом.
Далее раствор обрабатывают на хроматографической колонне из силикагеля (150 г). При помощи злюирования смесью гексанэтилацетат 40-60 .(объем/рб- ж) получают после . 5 {выпаривания растворителя 4,8 г ис. комого продукта.
ЯМР-спектр:1Н с 7,90 ррт (NHCO, A,J - 9 Гц) - 15Н с 7,26 ррт (ароматические Н, С) - 1Н с 6,97 ррт (NH-тритил, ш.с.)- 1Н с 6,65 ррт (Н тиазол,С) - |Н с 6,18 ррт (Н, ДЦ, Jt « 9 Гц, 1г 4,5 Гц) - 2Н с . 3,4 ррт (, ш.с.) - 6Н с 1,52,6 ррт (циклобутнл, М) - 9Н с
jHs
1,46 ррш|
doQH-dH3,
Ьнз (Нз,с/. 1,36 ррт в). (2-Tpитилaминo-4-тиaзoлил ) -2-(1-третичн.-бутоксикарбонйл1-циклобутил-оксиимино)-ацетамидо 3- з-окси72-пиридинилтиометш1Д-3йефем-4-карбоксилат-трет.бутил-1-Sоксида, сйн-иэомер. В раствор 0,164 г 3-окси 2-меркаптопиридина в 6 мл диметилформами да добавляют 0,12в г бикарбоната ка лия, а затем 1 г бромсодержащего пр изводного, полученного в примере бя Смесь перемешивают в течение 16 ч п окружающей температуре, затем сливают в 50 мл ледяной воды. Осадок и влекают и промывают водой. Твердое вещество растворяют в метиленхпориде, раствор сушат над сульфатом маг ния и концентрируют до объема 5 мл. Затем осуществляют обработку на хро матографической колонне с 20 г сили кагеля. При помощи элюирования смесью гексан-этилацетат 40-60 (объ ем/объем) получают 0,85 г искомого продукта. С) СМ 41646. При окружающей температуре выдер живают в течение 45 мин раствор 0,8 г продукта, полученного в примере 68) в 8 мл трифторуксусной кис лоты. Раствор выпаривают до сухого состояния под вакуумом и .остаток )а.стирают с простым эфиром. Твердое вещество извлекают и сушат под вакуумом в присутствии фосфорного ангидрида с целью«получения 0,5 г искомого продукта. ЯМР-спектр: 1Н с 10,40 ррт (ОН, т.е.) - 1Н с 8,70 ррт (NHCO, Д 3-8 Гц), VH с 7,80 ррт (Н пиридин, Д, J 5 Гц) - 2Н с 7,1,0 ррт (NHj,. ш.с.) - 2Н с 6,95 (Н4 и Н, пи ридин, М) - 1Н с 6,80 ррга (Н тиазол. С) - 1Н с 5,90 ррт (, ДЦ, J, 3810 « 8 rn,h 5 Гц) - 1Н с А,95 ррш (Н., ДЛ 5 Гц) - 1Н с 4,б5.ррт (CH.,S, Д, : U Гц) - ЗН с 3,80 ррт (CHjS- O и , М) АН с 2,40 ррт (С% СООН, М) СН2Н с 1,90 ррт (Гр „). Продукты формулы (I) исследуются с целью изучения их фармакологических свойств, а более точно - их бактериостатического действия. Бактериостатическре действие в пробирке определялось в твердой среде методом разбавлений. Полученные результаты выражаются в минимальных подавляющих концентрациях (МПК мг/мл) и относятся к различньм видам энтеробактерий и Pseudomonas. В качестве сравнения приводятся также результаты, полученные для двух близких продуктов 2, а именно (2-амино-4-тиазолил)-2-карбоксиметоксииминоацетамидоЗ -3- 2-пиридилтиометилД-З-цефем-1-5-оксид-4карбоновая кислота, б1ш-изомер H-T- i-io-wH „,.л;т1 oTv-b..e-U; odHiCooH eotw (соединение А) и (2-амино-4-тиазолил)-2-ме токсииминоацетамидоЗ-3- триазол1,2,4,3-илтиометилЗ -3-цефем- t-S-oKсид-4-карбоновая кислота, син-изомер i V Н- j-e-HH-T-гК Ч- и,. еоон (соединение В) В табл. 2 представлены минимальные составляющие концентрации исследуемых соединений (мг/мл). Эти результаты показывают активность продуктов цефалоспоринового ряда к видам бактерий, которые в общем случае мало чувствительны к антибиотикам семейства цефалоспоринов, а именно Enterobacteries и Peeu oroonas. Таблица2
В отличие от продуктов А и В продукты формулы {I) проявляют активность к видам Pseudomonas, хорошую активность к Enterovacter, а также обладают равной с соединениями А и I активностью к Proteus, Serratia,.Escheriehiacoli.
i В то же время, испытания, проведенные на животных, не дали никаких признаков токсичности исследуемых продуктов.
Таким образсш, эти продукты могут быть использованы в качестве анти;биотиков в медицине или ветеринарии.
Их можно также использовать против любьвс бактериальных инфекций в чув|ствительных к этим соединениям источниках
Фармацевтические композиции реализуются в виде смесей, содержапрсх соедянения (I) в форме кислоты или, когда их растворимость не достаточна, в форме соли.
Такие фармацевтические композиции могут быть твердыми или жидкими и могут находиться, в форме таблеITOK, пилнхль, гранул, мазей, кремов, гелей или препаратов для инъекций.
Дозы могут варьироваться в широких пределах, в частности в зависимости от вида и серьезности инфекции, а также в зависимости от способа применения. В общем случае для взрослого пациента при применении в виде инъекций эта доза изменяется .в пределах 0,250 - 4 г в день. Например, можно приготовить ампулы дл инъекций, содержащие: СМ 40.953, г1
Вода для инъекций, мл 5
Достаточное количество
карбоната натрия с рН -6,5

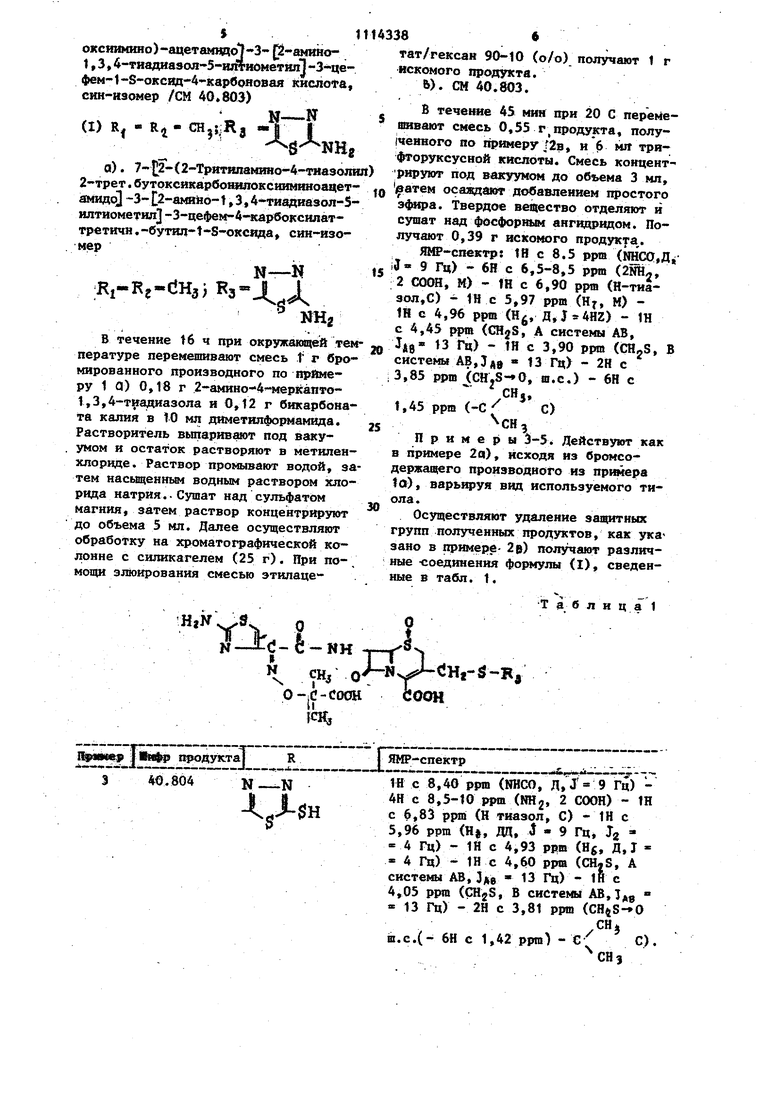



СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ЦЕФАЛОСПОРИН-1-ОКСВДА общей формулы t г HfN -A ;-fe-HH v; « еоон а-с-соон 4, где R, и R - метил или R и R вместе - ,3-пропилен; R - 1Н-1,2,4-триазол-З-ил, 5-амиио-1Н-1,2,4-триазол-3-ип, 2-амино-1,3,4-тиади.азол-5-ш1, 2-Ч еркапто1,3,4-тиадиазол-5-Ш1 :шга З-оксипирндил-2, . в виде син-изомеров о т л и ч а ющ и и с я тем, что сложный трет.бутиловый эфир 7-амино-З-бромметил-Зцефем-4-карбоновой кислоты-1-оксид подвергают ацилированию кислотой общей формулы .S . еоон СН R. н. О-cJ-doo-d-cJH, Rt СНз где R. и Rj имеют указанные значения; R.-группа, защищающая аминогруппу, такая как тритил, в виде син-изрмера, в среде инертного органического ряст ворителя, такого как метиленхлорид, в присутствии карбодиимида и органического основания при комнатной температуре, образующийся продукт .подвергают взаимодействию с гетероциклическим тиолом формулы RjSH, где Rj имеет указанные значения, СО в среде инертного органического 00 00 растворителя, такого как диметилформамид, в присутствии неорганического или органического основания при комнатной температуре с последующим снятием групп, защищающих амино- и карбоксигруппы, кислотным гидролизом и вьщелением целевого продукта.
| t | |||
| Устройство для образования скважин в мерзлом грунте | 1988 |
|
SU1602965A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Рыбозащитное устройство водозаборного сооружения | 1980 |
|
SU866038A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1984-09-15—Публикация
1982-11-30—Подача