Изобретение относится к способу получения нафталин-, бензофуран- или бензо-СьЗ-тиофенкарбоновых кислот общей формулы (I)
где :/ присоединен к кольца А и означает -СООН, СОО(С -С -алкил), х-0, S или R присоединен к атому углерода кольца Bj означает водород, галоид, С -С -алкил или 8(С -С -алкил)i имидазол-1-ил-метш1ьная группа присоединена к атому углерода кольца В, или их фармацевтически допустимых солей.
Соединения формзгаы (I) и их фармацевтически допустимые соли избирательно ингибируют действие фермента тромбоксан-синтетазы, не оказывая существенного неблагоприятного влияния на действие ферментов простациклин-синтетазы или циклооксигеназы.
Цель изобретения - синтез новых соединений, обладающих ценными свойствами для лечения множества клинических состояний, которые характеризуются дисбалансом простациклин/тромбоксан AJ.
Эти состояния включают тромбозы, ишe mчecкyю болезнь сердца, сердечные приступы, переходящие ишемически приступы, мигрень, болезни периферических сосудов, рак, сосудистые осложнения диабета и эндотоксинового шока.
Исследования показали, что в большинстве тканей основным продуктом метаболизма арахидоновой кислоты является одно из двух неустойчивых веществ: тромбоксан А СТХАд) или простациклин (PGI.i). В большинстве случаев простагландины PGE, PGFj и PGD оказываются сравнительно менее важными побочными продуктами при таком направлении процессов биосинтеза. Обнаружение тромбоксана А и простациклина- существенно расширяет понимание процессов гомеостаза сосудов . Например , простациклин является мощным вазодилатором и ингибитором агрегации тромбоцитов и в этом отношении является наиболее мощным из выявленных до сих пор эндогенных веществ. Фермент простациклин-синтетаза располагается в эндотелиальном
слое сосудистой сети, и может снабжаться эндоперекисями, высвобождаемыми тромбоцитами крови, соприкасающимися со стенкой сосудов. Продуцируемый таким путем простациклин весьма важен для предотвращения отложения тромбоцитов на стенки сосудов.
Тромбоксан А2 синтезируется с помощью фермента тромбоксан-синтетазы, которьм имеется, например, в тромбоцитах крови. Тромбоксан А. является мощным вазоконстриктором и проагрегирующйй веществом. Его действие, как таковое, прямо противоположно действию простациклина. Если по какой-либо причине ухудшается выработка простациклина сосудистой сетью продуцируемые контактирукицими со стенкой сосудов тромбоцитами эндо. перекиси преобразуются в тромбоксан, а не преобразуются эффективным путем в простациклин. Изменение равновесия простациклин/тромбоксан в сторону последнего вещества может приводить к агрегации тромбоцитов,, т.е. к вазоспазму и повышенной чувствительности к атеротромбозу. Известно также, что в экспериментальном атеросклер-озе подавляется выраротка простациклина и усиливается производство тромбоксана А г. Тем самым, тромбоксан А1 признан как основной причинныйд агент в различных разновидностях стенокардии, инфаркта ьдаокарда, внезапного смертельного исхода на почве сердечной недостаточности и приступов. Исследования на кроликах показали, что.ЭКГ-изменения, характерные для этих состояний, возникают в случае, когда свежеприготовленный тромбоксан AT. впрыскивают непосредственно в сердце животного. Эта.методология считается уникальной животной моделью сердечных приступов пациентов с коронарной недостаточностью и использована для демонстрации того, что введение соединения, предположительно являющегося антагонистом эффектов тромбоксана А, защищает кроликов от фатальных последствий инъекции тромбоксана А.
Другой областью, где дисбаланс
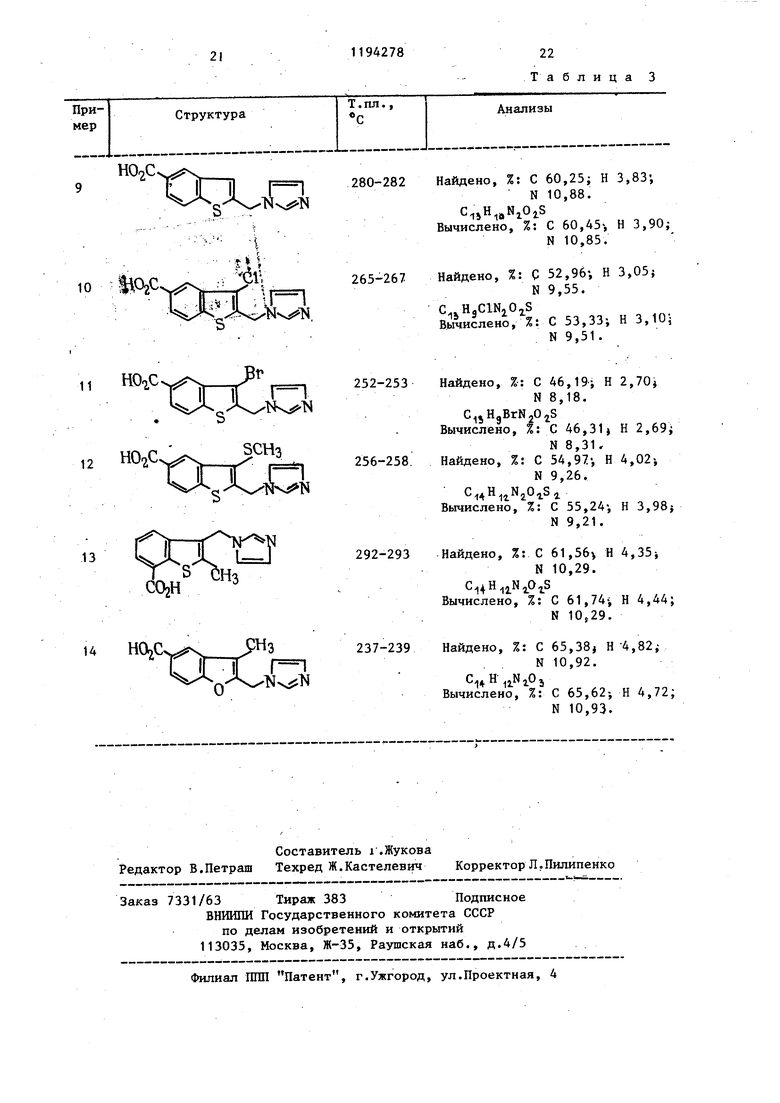
PGIi/TxAj считается важным составным фактором, является мигрень. Головная боль при мигрени связана с изменениями внутри- и внемозговрго кроветока в частности предшествующим головной боли уменьшением мозгового кроветока с последующим распространением на об
сосудистые области на протяжений фазы головной боли. Перед развитием головной боли повышается уровень содержания 5-гидрокситрипамина в крови и.это свидетельствует о существовании агрегации in vivo и высвобождении аминов из тромбоцитных запасов. Известно, что тромбоциты крови пациентов, склонных к мигрени, более подвержены агрегации, чем у нормальных индивидов. Кроме того, в последнее время постулировано, что аномалия функции тромбоцитов является не просто главным фактором в патогенезе приступов мигрени, но фактически оказывается их основной причиной. Таким образом, препарат, который избирательно модифицирует функцию тромбоцитов в направлении ингиёирования образования тромбоксана А Мог бы дать-значительный положительный зффект в терапии мигрени.
Аномалии поведения тромбоцитов обнаружены у пациентов с сахарным диабетом. Известно, что больные диабетом особенно чувствительны к микрососудистым осложнениям, атеросклерозу и тромбозу, и тромбоцитная гиперреактивность считается причиной подобной ангиопатии. Диабетические тромбоциты продуцируют повышенные количества и малонового диальдегида. Кроме того, показано, что у крыс с экспериментальным диабетом вьфаботка сосудистого простацикпина ухудшена и усиливается синтез ТхА из тромбоцитов. Таким образом, считается, что дисбаланс между простациклином и ТхА ответственен за микрососудистые осложнения диабета. Поэтому ингибитор ТхА2-синтетазы был бы клинически полезен для профилактики этих сосудистых осложнений.
Аспирин и большинство других нестероидных противовоспалительных препаратов ингибируют фермент циклооксигеназу. Эффектом этого оказывается прекращение выработки PGGj/Hjr3Hдоперекисей и снижение в результате этого уровней содержания и простациклина, и тромбоксана А. Аспирин и аспириноподобные препараты оценивались клинически с точки зрения предотвращения сердечных приступов.
Несмотря на то, что при использовании этих препаратов были получены некоторые обнадеживающие результаты, для лечения подобных клинических состояний более ценным было бы соединение, которое обеспечивает специфическое ингибирование образования тромбоксана А, оставляя в неприкосновенности биосинтез простациклина.
Способность первичных новообразований давать метастазы является основной причиной неудач в лечении рака у человека. Предполагалось, что метастатические опухолевые клетки
могут изменять критическое равновесие PGI-TxAj, благоприятствуя тромбозу. Недавно показано, что простациклин является мощным антиметастатическим агентом благодаря своему
тромбоцит-антиагрегационному действию. Этот результат говорит о том, что ингибитор ТхА,(-синтетазы может действовать- как антиметастатйческий агент in vivo.
Шок, вызываемый бактериальными
эндотоксинами,- связан с тромбоцитопенией, рассеянным внутрисосудистым свертыванием, лизосомной лабилизацией и вазоконструкцией легочной и
брыжеечной артерий. Кроме того, показано, .что заметно повьш1ается уровень содержания тромбоксана в плазне. Введение имидазольных ингибиторов TxAjj синтетазы экспериментальным животным до эндотоксина приводило к снижению симптоматики шока и существенному повышению нормы выживания. Воздействие соединений формулы (I) на фермент тромбоксак-синтетазу , и ферменты простациклин-синтетазу и
циклооксигеназу. измеряют с помощью
следующих ферментных анализов in v vitro.
1.Циклооксигеназа. Микросомы семенных пузырьков дарана инкубируют с арахидоновой кислотой (100 мкмоль;.1 мин при 22 С) для получения PGH2 и пробы реакционной смеси вливают в поток бикарбоната по Кребсу при (содержащего
смесь антагонистов и индометацина, который используют для перфузии вырезанной по спирали полоски аорты кролика) .
Способность соединения ингибировать фермент измеряют сравнением уве личения изометрического нап1; яжения, создаваемого PGHj в отсутствии испытуемого соединения, и вслед за предварительным инкубированием фермента с испытуемым соединением в течение 5 мин.
2.Простациклин (PGIj)-CHHTeTa3a. Микросомы аорты свиньи инкубируют (30 с; 22°С) с PGH, полученным, как описано вьше, и реакцию прекращают, используя пять объемов этанола. Выработку PGI2 оценивают путем измерения его стабильного продукта распада, 6-кето PGF, используя специфичный радиоиммунноанализ PGI-производство может быть полностью ингибирова но предварительным инкубированием фермента с избирательном ингибитором PGIj-синтетазы, 15-гидропероксиарахидоновой кислотой Испытуемое соеди нение предварительно инкубируют с ферментом в течение 5 мин и измеряют его способность предотвращать выработку РСХз (6-кето PGF). 3. Тромбоксан Aj (ТхА,)-синтетаза Предварительно обработанные индо- метацином мякросомы человеческих тромбоцитов инкубируют (2 мин5 ) с PGH. (полученным аналогично описан ному вьше) и реакцию прекращают с по мощью пяти объемов этанола Выработк TxAj оценивают путем измерения его стабильного метаболита ТхВ„ , используя спещ1фический радиоиммунноанализ Испытуемое соединение предварительно инкубируют с ферментом в течение 5 мин, и его способность ингибировать фермент-тромбоксан-синтетазу измеряют как снижение выработки ). Показано,,что испытанные рассмотренным путем.соединения формулы (I) способны избирательно ингибировать фермент тромбоксан-синтетазу. В дополне 1ие к указанному вьше описан анализ для измерения ингибйрования агрегации тромбоцитов человеческой крови, и он может считаться прогнозным Для оценки клинической антитромбической эффективности. В . этом испытании оба клинически эффективных препарата, аспирин и сульфинпиразон, .проявляют ингибирующую активность in vitro в отношении множества агрегирующих агентов. Описан также ряд тестов in vivo на животных для оценки потенциальных антитромбических лекарственных препаратов. Методика Патроно и соавторов приспособлена для изучения выработки TxBj в образцах цельной крови, взятой у животных перед обработкой лекарствен ным препаратом и после нее. Образцы крови отбирают в стеклянные пробирки 11 86 и оставляют при для свертьшания. . Сыворотку отделяют цeнтpифyг poвaнием и образцы хранят при -40 С до проведения анализа на ТхВ, когда подходящие разбавления депротеинизированных этанолом образцов анализируют с помощью радиоиммуноанализа. Эта методика используется в экспериментах с испытуемыми соединениями для определения силы действия при внутривенном введении анестезированным кроликам. Ане:стезированные кролики. Белые кролики-самцы New Zealand (2,6-6,6 кг) использованы для анестезии пентобарбитоном натрия (30 мг/кг внутривенно), а затем уретаном (500 мг/кг внутрибрюшинно). После канюлирования трахеи сонную артерию катетеризируют для сбора образцов крови. Катетер оставляют незакрытым путем медпенной инфузии (0,2 мл/мин) стерильного солевого раствора. Контрольные пробы сонноартериальной крови отбирают за 30 и 5 мин до введения испытуемого соединения или среды (0,9 вес./об. % J 0,2 мл/кг) через краевую ушную вену. Используют три группы кроликов. Первая группа получает испытуемого соединения 0,03 мг/кг, а затем, спустя 1 час, 0,1 мг/кг. Аналогично, вторая группа получает 0,3 мг/кг, затем 1 мг/кг. Третья группа получает среду-носитель с последующей еще одной инъекцией среды-носителя спустя 1 ч. Пробы сонноартериальной крови отбирают спустя 15 и 45 мин после введения любых доз. В момент отбора в стеклянную пробирку отбирают 1 мл образца крови, без антикоагулянта, для определения ТхВ.. С э+ой целью 1 пробе крови дают возможность свернуться на протяжении 2-часового инкубирования при (для этого времени предварительные эксперименты показали максимальную выработку TxBj) и сьшоротку получают центрифугированием. Образцы сыворотки затем обрабатывают методом радиоиммуноанализа на TxBj после депротеинизацииэтанолом и разбавления буфером ИзогельТрис. Данные по активности сведены в табл.1. Внутривенное вливание арахидоновой кислоты вызывает смерть кроликов в результате агглютинации тромбоцитов и эмболизации в легких.. Клинически эффективные аспирин и сульфинпщ азон защищают кроликаот летального действия инъекции Показано так же, что сульфинпиразон препятствует агрегации тромбоцитов-в экстракорпоральном контуре абдоминальной аорты крью in vivo. .Соединения могут быть введены орально в виде таблеток или капсул, содержащих единичную дозу соединения .вместе с такими индифферентными составляющими, как кукурузный крахмал, карбондт кальция, дикальцийфосфат, альгиновая кислота, лактоза, стеарат магния, Примогель (торговая марка) или тальк. Таблетки обычно готовят совместным гранулированием ингредиентов и прессованием результирующей смеси с получением таблеток требуемо го размера. Капсулы обычно готовят совместным гранулированием ингредиен тов и наполнением ими желатиновых капсул подходящего размера с заполне нием требуемой дозой. Соединения могут быть введены .также парэнтерально, например, с по|мощью внутрШФшечЬой, внутривенной или подкожной инъекции. Для парэнтерального введения их лучше всего использовать в виде стерильного водного раствора, который может содержать и другие растворенные вещества, таки как регуляторы тонического давления и рН. Соединения могут быть добавлены в дистиллированную воду и рН доводят до 3-6 используя кислоту, таку как лимонная, молочная или хлористоводородная кислота. Для обеспечения изотонического характера раствора могут быть добавлены достаточные ко.личества растворённых веществ, таких как декстроза или соль. Результирующий раствор может быть затем стерилизован и помещен в стерильные стеклянные ампулы подходящего размера, содержащие требуемый объем.раствора. Соединения согласно изобретению могу (быть также введены инфузией парентерального состава, описанного выше, . в вену. Для орального приема людьми суточная дозировка соединения формулы. ,(1) составляет 0,1-20 мг/кг в сутки для типичного взрослого пациента (70 кг). Для парентерального введения суточная дозировка соединения формулы (I) составляет 0,01-0,5 мг/кг в сутки для типичного взрослого па. 788 циента. Так, таблетки или капсулы содержат 5-150 мг активного соеди-. нения для орального приема до 3 раз в сутки. Дозы для парентерального введения содержат 0,5-0,35 мг актив ного соединения. Типичная ампула представляет собой ампулу на 10 мп,: jсодержащую 5 мг активного соединения в 6-1,0 мл раствора. Следует иметь в виду, что в любом случае врач сам определяет фактическую дозировку, наиболее подходящую для пациента с учетом возраста, веса и его реакции. Указанные дозировки являются усредненными примерами, могут быть индивидуальные случаи« в которых более эффективны более высокие или низкие дозировки. .; Данные сравнения активности полученных Соединений со структурным анйлогом сведены в табл.2. Пример 1. Этиловый зфир 2-(1-имида3олилметил)-3-метилбенз60J -тиофен-5-карбоновой кислоты , (1) Этиловый зфир 2-хлорметил-З-метилбензоСьЗтиофен-5-карбоновойкислоты. Газообразный хлористый водород пропускают в течение 30 мин через смесь этилового эфира 3-метилбензо Сь тиофен-5-карбоновой кислоты (5,50 г), безводного хлористого цинка (1,25г) и параформальдегнда (1,50 г) в хлороформе (50 мл). Полученную смесь перемешивают в течение 8ч, затем хлороформовый раствор декантируют до резиноподобного остатка, тщательно про1« 1вают водой и осушают (). Упаривание растворителя дает сырой этиловь эфир 2-хлорметил-3-метилбензоСъЗ-тиофен-5-карбоновой кислоты, который непосредственио используют на следующей стадии. (ii) Этиловый эфир 2-(1-имидазолилметил)-3-метипбензоГЬ}тиофен-5-карбоновой кислоты. Гидрид натрия (0,5г, 50% дисперсии в минеральном масле) добавляют порциями .к перемешиваемому раствору, имядазола (0,68 г), в сухом Н,Н-диметилформамиде (30 мл).и смесь перемет шивают при комнатной температуре в течение 30 мин.. Добавляют раствор этилового эфира 2-хпорметил-З-метилбензоСЬ гтиофен-5-карбоновой кислоты (2,70 г) в сухом N,N-pimeTH№ формамиде (5 мп). Смесь перемешива9ют в течение 2 ч, а затем упаривают Остаток растворяют в этилацетате, раствор тщательно промьшают водой и осушают (). Упаривание растворителя дает масло, которое хроматографируют на силикагеле. Элюирование хлороформом/петролейным.эфиром (т.кип.40-60 с) 3:1 вначале дает некоторые примеси, а затем чистый продукт. Упаривание фракций, содержащий продукт, дает твердое в вещество, кото рое кристаллизуют из зтилацетата/бен зина (т.кип.60-80 С) с получением этилового эфира 2-(1-имидазолилметил)-3-метш1бензоСь1-тиофен-5-карбоновой кислоты (1,40 г), т.пл. 126127С. Найдено, Z: С 64,39, Н 5,37i N 9,46. Вычислено, %: С 63,97; Н 5,37; N 9,33., П р и м е р 2, 2-(1-Имидазолилметил)-3-метилбензо ЬЗтиофен-5-карбоновой кислоты гидрохлорид. Смесь этилового эфира 2-(1-имидазолилметш1)-3-метш1бензрСЬ тиофен-5-карбоновой кислоты (1,0 г) и 6н. хлористоводородной кислоты (80 мл) нагревают на паровой бане в течение 5 ч, а затем охлалЕдают. Твердое вещество отфильтррвывают, сушат и крис таллизуют из этанола/эфира с получением 2-(1-имидазолш1метил)-3-метилбензоСьЗтиофен-5-карбоновой кислоты гидрохлорида (0,72 г), т.пл. 298299С. Найдено, %: С 54,61, Н 4,19, N 9,21. C 4HnNjO S-HCl Вычислено, %: С 54,45, Н 4,24, N 9,07. Пример 3. Метиловый эфир 2-(1-имидазолилметил)-бензо Ь тиофен-5-карбоновой кислоты. (i) 2-МетилбензоСЬ Зтиофен-5-карбо новая кислота. Конверсия 5-бром-2-метилбензо ь тиофека в реактив Гриньяра с последу ющим реагированием с двуокисью углерода по методике примера 3(1) Европейского патентного описания № 0073663 дает 2-метилбензоСьЗтиофен -5-карбоновую кислоту, т.пл. 220222С. Найдено, %: С 62,06, Н 4,07. C,5H,OjS Вычислено, %: С 62,14, Н . 7810 (ii) Метиловый эфир 2-метилбензо ЪЗтиофен-З-карбоновой кислоты.. Раствор 2-метш1бе.нзо Ь тиофен-5-карбоновой кислоты (17,4 г) в мета- ; ноле (-250 мл) насьщают хлористым водородом, а затем нагревают с обратным холодильником в течение 30 мин. Вьжристаллизованное при охлаждении твердое вещество отфильтровьшают и сушат с получением метилового эфира 2-метилбензоСьЗ-тиофен-5-карбоновой кислоты (16,7 г), т.пл. 97-98С. Найдено, %:,С 64,39, И 4,94. C,i,,0,S Вычислено, %: С 64,05, Н 4,89. (iii) Метиловый эфир 2-бромметилбензоСьЗтиофен-5-карбоновой кислоты. Обработка метилового эфира 2-метилбензо Ь тиофен-5-карбоновой кислоты N-бромсукцинимидом и азобисизобутиронитрилом в четыреххлористом углероде по методике примера 3 (iii) Европейского патента дает метиловый эфир 2-бромметш1бензоСь -тиофен-5- -карбоновой кислоты, т .пл. 106-107 С. Найдено, %: С 45,89, Н 3,11. C HgBrOjiS Вычислено, %: С 46,33, Н 3,18. (iv) Метиловый эфир 2-(1-имидазолилметил) бензо1ь.-тиофен-5-карбоновой кислоты. Смесь метилового эфира 2-6poMMiEтилбенэоСЬЗтиофен-5-карбоновой кислоты (1,71 г), имидазола (4,08 г) и бикарбоната натрия (0,55 г) в ацетоне (50 мл) нагревают до кипения с обратным холодильником в течение 3 ч, а затем упаривают. Остаток делят между этилацетатом и водой. Органический слой промьшают водой, осушают .(NajSO) и упаривают t получением твердого вещества, которое хроматографируют на силикагеле. Элюирование ршороформрмдает вначале не- большое количество исходного материала, а затем продукт. Упаривание фракций, содержащих продукт, дает твердое вещество, которое кристаллизуют из этилацетата/бензина (т.кип. 60-80с) с получением метилового эфира 2-(1-имидазолилметил)беизо bj тиофен-5-карбоновой кислоты (0,81 т), т.пл. 127-128с. Найдено, %: С 61,49, Н 4,52, N 10,40. ,,,S Вычислено, %: С 61,75, Н 4,44, N 10,29. 111 Пример 4. Метиловый эфир З-хлор-2- (1 -имидазолилметил ) бензо Ь -тиофец,-5-карбоновой кислоты.. (i) Метиловый эфир З-хлор-2-метилбензо Ь}тиофен-5-карбоновой кисСульфурилхлориД (3,38 г) добавляют каплями к перемешиваемому раствору метилового эфира 2-метилбензо b}тиофен-5-карбоновой кислоты (5,15 г) в хлороформе (50 мл). Полу/ченный раствор нагревают до кипения с обратным холодильником в течение 2ч, охлалдают, промывают водой, осушают () и упаривают.. Остаток кристаллизуют из метанола/воды с получением метилового зфира 3-хлор-2-метш1бензоСЬ тиофен-5-карбоновойкислоты (3,00 г), т.пл. 85-86 С. Найдено, %: С 55,06; Н 3,64. СГ OjS Вычислено, % С 54,09, Н 3,77. (ii) Метиловый эфир 2-бромметш1-3-хлорбензо ЬЗ-тиофен-5-карбоновойкислоты. Обработка метилового эфира 3-хлор -2-метилбензо Ь -тиофен-5-карбоновой кислоты N-бромсукцинимидом и азобиси зобутиронитрилом в четьфеххлористом углероде по методике примера 3 (iii) указанного Европейского патента, дает метиловый эфир 2-бромметил-З-хлор бензоСЬ Зтиофен-5-карбоновой кислоты, т.пл. 144-145 С. Найдено, %: С 41,53; Н 2,56, C HgBrClOjS Вычислено, %: С 41,33; Н 2,52. (iii) Метиловый эфир 3-xлop-2-(1-имидaзoJП лмeтил ) бензо Ь -тиофен- 5-карбоновой кислоты. Обработка метилового эфира 2-бpoм мeтил-3-xлopбeнзo b -тиoфeн-5-кapбoнoвoй кислоты имидазолом и бикарбона том натрия по методике примера 3 (IV дает метиловый эфир З-хлор-2-(1-имидазолилметил)бензо ЬЗтиофен-5-карбоновой кислоты, т.пл. 138-139с (из этилацетата/бензина т.кип. 60-80 С). Найдено, %: С 54,74 Н 3,38, N 9,39.: . С 4 Н Вычислено, %: С 54,81; Н 3,61; N 9,13.. Пример 5. Метиловый эфир 3-бром-2-(1-имидазолилметил)бензо ГьЗ -тиофен-5-карбоновой кислоты, (i) Метиловый зфир З-бром-2-метип бензоСЬ тиофен-5-карбоновой кислоты. 8 Бром (2,08 г) добавляют каплями к перемешиваемой смеси метилового эфира 2-метилбензоГь) тиофен-5-карбоновой кислоты (2,40 г) в хлороформе (50 мп). Смесь перемешивают в течение 2 ч при комнатной температуре, затем промьшают водой, раствором бикарбоната натрия и осушают (Na.SO). Отгонка хлороформа дает твердое вещество, которое перекристаллизовывают из метанола/воды с получением метилового эфира З-бром-2-метилбензоСЬ тиофен-5-карбоновой кислоты (2,00 г), т.пл. 84-85С. Найдено, %: С 46,22; Н 3,01. C HgBrOjS Вычислено, %: С 46,33 Н 3,18. (ii) Метиловый эфир З-бром-2-бромметилбензо Ь -тиофен-5-карбоновой кислоты. Обработка метилового зфира 3-бром-2-метилбензо Ь -тиофен-5-карб6ноБой кислоты N-бромсукцинимидом и азобисизобутиронитрилом в четыреххлористом углероде по методике при-; мера 3 (iii) указанного Европейского патента дает метиловый эфир 3-бром-2-бромметш1бензо Ь тиофен-5-карбо-. новой кислоты, т.пл. 173-174 С (из . этилацетата/бензина, т.кип. 60-80 С). Найдено, Z: С 36,22; Н 2,24. С HjBr202 S Вычислено, %: С 36,29$ Н 2,21. (iii) Метиловый эфир 3-бром-2-(1-имидазолилметил) бензо Ъ }-тиофен.-5-карбоновой кислоты. Обработка метилового эфира 3-бром-2-бромметилбензоСьЗтнофен-5ткарбоновой кислоты имидазолом и бикарбонатом натрия по методике примера 3 (iv) дает метиловый эфир 3-бром-2-(1-ими дазолнлметил)бензо СЬ}тиофен-5-карбоновой кислоты, т.пл. 146-147 0 (из зтилацетата/бензина, т.кип. 60-80 С), Найдено, %: С 48,01; Н 2,98; .,07. C H BrNjO S Вычислено, %: С 47,88i Н 3,14; N 7,98. Пример 6. Метиловый эфир 2-(1-имидазолилметил)-З-метилтиобент зо ь -тиофен-5-карбоновой кислоты. (i) 5-Бром-3-метилтиобензо Ь тисфен. Раствор Н-бутшшития в гексане (35 мг 1,55 М раствора) добавляют каплями к перемешиваемому раствору 3,5-дибромбензо ь1тиофена (14,6 г) в сухом эфире (600 мл) при -70 С в атмосфере сухого азота. Смесь перемешивают при в течение 30 мин, после чего на протяжении 5 Ш1Н добавляют ра:створ диметилсульфида (4,90 г) в 10 мл сухого эфира. -Результируящую смесь перемешивают при в течение 4 ч, а затем дают возможноста прогреваться до комнатной температуры; Добавляют воду (50 мл) и отделяют органический слой, промывают водой и осушают (). Отгонка эфира дает масло, которое хроматографируют на силикагеле.. Элюирование петролейным эфиром (т.кип. 40-60С) дает небольшое / количество примесей, а затем чистый продукт. Содержащие продукты ,фракции упаривают и остаток дистиллируют с получением 5-бром-З-метилтиобензо Сь тиофена (10,36 г), т.кип, 140144 С при 0,6 мм рт.ст., т.пл. 5657 С. Найдено, %: С 41,87$ Н 2,62. C. Вычислено; %: С 41,70,. Н 2,72. (ii) 3-Метилтиобензо Ь тиофен-5-карбоновая кислота. Раствор 3-бром-3-метилтиобензо ь тиофена (2,60 г) и метилиодида (4,80 г) в сухом эфире (50 мл) добав ляют к перемешиваемой смеси магния (1,50 г) и сухого (10 мл) с та ким расходом, чтобы сохранялось осторожное кипение с обратным холодил ником. Смесь нагревают с обратным холодильником в течение 30 мин, затем охлаждают и выпивают на смесь и мельченного сухого льда и эфира. Пос ле испарения всей двуокиси углерода смесь встряхивают с 2н.хлористоводородной кислотой и слои разделяют. Эфирный слой несколько раз экстрагируют 2н.раствором гидроокиси натрия и скомбинированные экстракты подкисляют уксусной кислотой. Твердое вещество отфильтровывают, промывают водой и перекристаллизовывают из эт нола/воды с получением 3-метилтиобе зо Ъ тиофен-5-карбоновой кислоты (1,24 г), т.пл. 205-207 С. Найдено, %: С 53,23; Н 3,53. Вычислено, %: С 53,55j Н 3,60. Этиловый .эфир З-метилтиобензо Ь тиофен-5-карбоновой кислоты. Смесь 3-метилтиобензо1 ьЗтиофен-5 -карбоновой кислоты (5,62 г) и окси хлорида фосфора (2 мл) в этаноле 814, (200 мл) нагревают при кипении с обратным холодильником в течение 18 ч, а затем упаривают. Остаток растворяют в эфире и раствор промывают раствором бикарбоната натрия, водой и осушают (Naj SO). Упаривание растворителя дает твердое вещество, которое перекристаллизовьшают из этанола с получением этилового эфира З-метилтиобензо ьЗтиофен-5-карбоновой кислоты (5,84 г), т.пл. 67-69 с. Найдено, %: С 57,25; Н 4,76. Si nOzSiВычислено, %: С 57,11i Н 4,79. (iv) Этиловый эфир 2-хлорметил-З-метш1Тиобензо ь тиофен-5-карбоновойкислоты. Хлористый водород пропускают в течение 2 ч через перемешиваемую смесь этилового эфира 3-метилтиобензо Ь -тиофен-5-карбоновой кислоты (1,0 г), параформальдегида (0,24 г) и безводного хлористого цинка (0,2 г) в хлороформе (30 мл) при . Результирующую смесь перемешивают при комнатной температуре в течение 18 ч, затем промывают водой. Органический слой отделяют, осушают () и упаривают с получением масла, которое хроматографируют на силикагеле. Элюирование толуолом дает твердое вещество которое перекристаллизуют из петролейного эфира (т.кип.60-80Ь) с получением этилового эфира 2-хлорметил-З-метилтиобензоСЬ тиофен-5-карбоновой кислоты (0,42 г), т.пл. 95-9бС. . Найдено, %: С 51,95 Н 4,31. г H-i CIOjS 2. Вычислено, %: С 51,90, Н 4,35. (v) Этиловый э4н1р 2-(1-ймидазолилметил)-3-метилтирбензоСЬ тиофен-5-карбоновой кислоты. Обработка этилового эфира 2-хлорметил-3-метилтиобензоСь5-тиофен-5-карбоновой кислоты имидазолом и бикарбонатом натрия по методике примера 4 (iv) дает этиловый эфир 2-(1-иьдадазолил-метил)-З-метилтиобензо ь тиофен-5-карбоновой кислоты, т.пл. 105-107 С (из этилацетата/ бензина, т.кип. 60-80° С). Найдено, %: С 57,73; Н 4,82} N 8,55.. c ieHli%OlS2 Вычислено, %: С 57,80-, Н 4,85; N 8,43. Пример 7. Метиловый эфир 3-метил-2-(1-имидазолилметил)бензофуран-5-карбоновой кислоты. (i) 2-гидроксиметил-З-метилбензо фуран-5-карбоновая кислота. Раствор 5-бром-2-гидроксиметш1-3-метилбензофурана в сухом эфире (50 мл) добавляют каплями к перемешиваемому раствору н -бутиллития (12,90 мл 1,55 М раствора в гексане в сухом эфире, (50 мл) йри ОС в атмосфере сухого азота. Смесь перемешивают при в 2ч, а затем выпивают на смесь измельченного сухого льда и эфира. Когда вся двуокись углерода испарится, смесь встряхивают с водой. Водный слой отделяют, промывают эфиром и подкис ляют концентрированной хлористоводо родной кислотой. Твердое вещество отфильтровьшают, промьгаают водой, сушат и кристаллизуют иэ изопропанол/бензйна (т,кип, 80-100 С) с получением 2-гидроксиметил-З-метилбензофуран-5-карбоновой кислоты (0,50 г), т,пл. 220-222 С, Найдено, %: С 64,31i Н 4,96, , Вычислено, %: С 64,08; Н 4,89, (ii) Метиловый эфир 2-гидрокси-З-метилбензофуран-5-карбоновой кис Раствор 2-гидрокси-3-метш1бензрф ран-5-карбоновой кислоты (0,69 г) в метаноле (250 мп) обрабатывают избы ком эфирного раствора диазометана. Раствор оставляют стоять в течение 1,5 ч при ОС, а затем избыток диаз метана разлагают капельным добавлен ем уксусной кислоты до прекращения дальнейшего бурного вьщеления газа. Раствор промывают бикарбонатом натр осушают () и упаривают с дост жением количественного выхода метил вого эфира 2-гидроксиметил-З-метилбензофуран-5-карбоновой кислоты, т,ш1, 96-98 0 (из этилацетата/бензи на), Найдено, %: С 65,28; Н 5,49. Вычислено, %: С 65,44; Н 5,49. (iii) Метиловый эфир 2-хлорметил -З-метилбензофуран-5-карбоновой кис лоты. Тионилхлорид (0,25 мл) добавляют каплями к перемешиваемому раствору метилового эфира 2-гидроксиметил-З-метилбензофуран-5-карбоновойкислоты (0,20 г) и пиридина (2 капт ли) в хлороформе (5 мп), Раствор перемешивают при комнатной температуре в течение 30 мин, после чего промьшают последовательно водой, раствором бикарбоната натрия и осушают Na-SO. Отгонка растворителя дает сырой метиловый эфир 2-хлорметил-З-метнлбензофуран-5-карбоновой кислоты (0,18 г), т,пл. 114-115 С, кото- . рый непосредственно используют на последующей стадии, (iv) Метиловый эфир 2-(1-имидазолилметил)-3-метилбензофуран-5-карбоновой кислоты. Обработка метилового эфира 2-хлорметил-З-метилбензофуран-5-карбоновойкислоты имидазолом и бикарбонатом натрия по методике примера 3 (iv) дает метиловый эфир 2-(1-имидазблш1метил)-3-метил-бензофуран-5-карбоновой кислоты, т,пл, 135-136 С. Пример 8, 3-С1 Имидазолилметил 3-2-метилбензо tb j тиофен-7 - карбоновой кислоты метиловый эфир. (i) 2-Метилбензо Ь тиофен-7-карбоновой кислоты метиловый эфир4 Раствор 2-метилбензоСЬ тиофен-7-карбоновой кислоты (5,1 г) в метаноле (too мл) насыщают хлористым водородом, а затем нагревают с обратным холодильником в течение 18 ч. Раствор упаривают и остаток растворяют в эфире. Эфирный раствор промывают раствором карбоната натрия и осушают (NajSO ; Отгонка эфира дает метиловый эфир 2-метш1бензо Ь тиофен-7-карбоновой кислоты (4,7 г), т,пл. 48-49 С, (ii) 3-Хлорметил-2-метш1бензоСЪ/ тиофен-7-карбоновой кислоты метиловый эфир,. Газообразный хлористый водород пропускают в течение 30 мин через перемешиваемую смесь метилового эфиipa 2-метилбензо Ь тиофен-7-карбойовой кислоты (4,50 г), параформальдегида (1,23 г) и безводного хлористого цинка (1,03 г) в хлороформе (50 мл). Смесь перемешивают при комнатной температуре в течение 5 ч, а затем оставляют стоять в течение 18 ч. После этого смеСь несколько раз промывают водой и органический слой осушают () и упаривают. Остаток перекристаллизовывают из хлороформа/бензина (т.кип.60-80 С) ; получением метилового эфира 3хлорметил-2-метилбенз оСЬ}тиофбн-7-карбоновой кислоты (4,10 г), т.пл. 125-12бс.
(iii) Метиловый эфир 3-С1 имидазолилметил -2-метилбензоСЬ тиофен-7-карбоновбй кислоты.
Последовательная обработка имидазола гидридом натрия и метилового эфира 3-хлорм етил-2-метш1бензо Ь тиофен-7-карбоновой кислоты в N,Nдиметилформамиде по методике примера 1 (ii) дает метиловый эфир 3-,Г1-имидазолилметйл -2-метилбензоСЬ тиофен-7-карбоновой кислоты, т.пл. иВ-иЭ С.
Найдено, %: С 62,60; Н 4,90; .N9,72.
С,уН
Вычислено, %: С 62,91j Н 4,93; 9,79.
.N
9-14. В табл.3 Прим
еры приведен перечень карбоновых кислот, получаемых гидролизом соответствую 1цих сложных эфиров при использовании KOH(CHgOH)H2q и температуре дефлегмации по методике примера 3 (v) указанного Европейского патента.
Пример 15. 2-(1-Имидазолш1метил)нафталин-б-Карбоновая кислота.
Сложный метиловый эфир 2-бромметилнафталин-6-карбоновой кислоты.
Обрабатывая сложный метиловый эфир 2-метилнафталин-6-карбоновой кислоты Н-бромсукцинимидом и раствором азобисизобутиронитрила в че Ыреххлористом углероде по способу, описанному в примере 3 (III) указанного Европейского патента, получают сложный метиловый эфир 2-бромметилнафталин-6-карбоновой кислоты, т.пл. ЮЗ-ЮбС.
Найдено, %: С 55,45, Н 4,02.
Вычислено, %: С 55,93, Н 3,97.
Сложный метиловый эфир 2-(1-имидазолилметил)-нафталин-6-карбоновой кислоты.
В результате последовательной обработки имидазола гидридом натрия и раствором сложного метилового эфира 2-бромметилнафтапин 6-карбоновой кислоты в Ы,Н-диметилформамиде по способу, описанному в примере 1 (II), получают сложньй метиловый эфир 2-(1-имидазолилметил)нафталин-6-карбоновой кислоты, т.пл. 148-149 С.
Найдено, %: С 71,79; Н 5,31; N 10,50. -C.H.
Вычислено, %: С 72,16-, Н 5,30;. N 10,52.
2-(1-Имидазолилметил)нафталин-6-карбоновая кислота.
5 Осуществляя гидролиз сложного метилового эфира 2-(1-имидазолилметилнафталин-6-карбоновой кислоты, используя NaOH(CHipH)H26 при температуре дефлегмации по способу, опиQ санному в примере 3(V) указанного Европейского патента, получают 2-(1-имидазолилметил)нафталин-6-карбоновую кислоту, т.пл. 275-278с.
Найдено, %: С 71,36i Н 4,84j
N 10,84.
5 г
%: С 71,41, Н 4,79,
Вычислено, :N 11,10. Таблица 1









Способ ползгчения нафталин-, бензофуран- или бензо- Ь -тиофенкарбоновых кислот общей формулы где у присоединен к кольцу А, и означает -СООН, -СОО(С -С -алкил), X-0,S или , R .присоединен к атом углерода кольца В, означает водород. где R и X имеют указанные -значения;. Q - галоид, С -С -алкилсульфонилокси или ArSOjO, где Аг - фенил, возможно g замещенный 1 или 2 заместителями, выбранными из группы С -С -алкила, СП С -С -алкокси и галоида, а группы (С -С -алкш1)-0-С , и CHjQ присоединены соответственно к атому углерода колец А и В, подвергают взаимодейS ствию либо с имидазолом в присутствии дополнительного основания, либо с металлсодержащей солью имидазола, ;О 4 после чего при необходимости полученный продукт переводят в соединение формулы I, где Y- группа -СОСИ, ьо м путем кислотного или щелочного гидролиза или соединение формулы I пере00 водят в фармацевтически допустимую соль.
,. 0,1
.
О
С1
НОгр
m
,к
10098
98
95
94
ХНз
г
1ГТ °
V
0,3 0,1 0.3
Нз
OiC
irf -Л- °
о - 0,3
См.примечание
Пример 2 по ЕР 3901 гГ Пример 1 по ЕР 3901 н снз ,0 Пример 9
HOOCs
г
ГпГ
2
Пример 11 .х .2 7-108
Н Г
Примечание. Процент ингибирования и концентрация
I 9996
10099
100
9795
98
4737
6531
83
Таблица 2
1,0.101,210-е98% и 10
lt
Nv.
1,7-10 2,0-10 10- Таблица 3
с,. H,C1N,
Вычислено, %: С 53,33; Н 3,10N 9,51.
11
иI I
.
2 HO-jC.
13
14 Щ
53 Найдено, %: С 46,19i Н 2,70
N 8,18. C jHgBrNjO S Вычислено, %: С 46,31$ Н 2,69;
N 8,ЗЬ
N 9,26.
C.
Вычислено, %: С 55,24-, Н 3,98j N 9,21.
293 Найдено, %: С 61,56 Н 4,35j
N 10,29. C,4H,
Вычислено, %: С 61,74-, Н 4,44; .N 10,29.
39 Найдено, %: С 65,38, Н 4,82;
N 10,92.
с,н-,
Вычислено, %: С 65,62-, Н 4,72; N 10,93.
| ПРИБОР ДЛЯ АВТОМАТИЧЕСКОГО ПРИВЕДЕНИЯ В ДЕЙСТВИЕ ПЕСОЧНИЦ У ВЕДУЩИХ ПОДВИЖНОЙ СОСТАВ ПОВОЗОК | 1926 |
|
SU3901A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
1985-11-23—Публикация
1983-06-16—Подача