Изобретение относится к ветеринарной микробиологии и представляет собой аттенуированный штамм Salmonella dublin для приготовления живых вакцин против сальмонеллеза телят.
Целью изобретения является аттенуированный штамм Salmonella dublin ВГНКИ N 9-16/2, обладающий стабильной низкой остаточной вирулентностью, высокой иммунногенностью и используемый для приготовления моно- и бивалентной вакцины против сальмонеллеза телят.
Аттенуированный штамм Salmonella dublin N 6 получен путем селекции из вирулентного штамма Salmonella dublin N 373.
Аттенуированный штамм Salmonella dublin N 6 депонирован в коллекции микроорганизмов Всесоюзного государственного научно-контрольного института ветеринарных препаратов под N 9-16/2.
Особенностью штамма является наличие в его геноме двух мутаций (в гене su-str и стрептомициновом локусе), независимо одна от другой снижающих вирулентность и обеспечивающих стабильность низкой остаточной вирулентности.
Аттенуированный штамм Salmonella dublin ВГНКИ N 9-16/2 характеризуется следующими признаками.
Морфологические признаки. Микроб представляет собой мелкие грамотрицательные палочки без спор и капсул. Длина палочек 1,5-2 мк, ширина 0,3-0,5 мк. Клетки подвижные с перетрихиально расположенными жгутиками.
Культуральные свойства. На мясопептонном бульоне образует равномерное помутнение через 8-10 ч роста при температуре 37оС; на мясопептонном агаре 24-26 ч роста при температуре 37оС образует колонии диаметром 1-2 мм в s-форме: прозрачные, круглые, гладкие, мелкозернистые, выпуклые. Штамм растет на питательных средах, содержащих 500 ед/см3 стрептомицина.
Ферментативные свойства. Сбраживает с образованием кислоты и газа глюкозу, мальтозу, маннит, арабинозу, сорбит, ксилозу, образует сероводород; не сбраживает сахарозу, лактозу, раффинозу, не свертывает молоко, не разжижает желатину, не образует индол.
Антигенная структура. Агглютинируется монорецепторными О-сыворотками: 1, 9, 12 и Н-сывороткой первой фазы - gp.
Аттенуированный штамм Salmonella dublin N 9-16/2 по морфологическим признакам, ферментативным свойствам и антигенной структуре не отличается от родительского штамма Salmonella dublin N 373.
Вирулентные свойства. Остаточная вирулентность аттенуированного штамма, выраженная в LD50 при подкожном заражении белых мышей массой 14-16 г, составляет 2,4 х 107 ±0,2 х 107 клеток. LD50 исходного вирулентного штамма 12,8±3,2 клеток. Таким образом, остаточная вирулентность аттенуированного штамма для белых мышей в 2,0 х 106 раз ниже по сравнению с вирулентностью исходного штамма.
Стабильность остаточной вирулентности установлена путем 10-кратного пассажа через организм белых мышей и 5-кратного - через организм телят. Остаточную вирулентность аттенуированного штамма после многократных пассажей повысить не удалось. Данные приведены в табл. 1.
Разница в значении LD50 аттенуированного штамма до и после пассажа статистически незначима (Р < 0,01).
Иммуногенные свойства. Иммуногенность аттенуированного штамма изучали в сравнении с иммуногенностью гретых клеток вирулентного штамма. Белых мышей массой 14-16 г иммунизировали однократно подкожно в дозе 1 млн микробных клеток. Заражали через 21 день после иммунизации вирулентным штаммом Salmonella dublin N 373 в дозах 0,01; 0,1; 1 и 10 тыс. микробных клеток, используя на каждую дозу по 10 животных. Иммуногенность оценивали по индексу эффективности, представляющему собой отношение LD50 в опытной группе к LD50 в контрольной группе. Иммуногенность аттенуированного штамма была в среднем выше в 12 раз иммуногенности инактивированных клеток (индексы эффективности соответственно 199 и 16).
П р и м е р 1. Аттенуированный штамм Salmonella dublin ВГНКИ N 9-16/2 выращивают в реакторе в бульоне Хоттингера, содержащем 100-120 ед/см3 стрептомицина, в течение 10-12 ч при температуре 37оС с постоянным перемешиванием (120-180 об/мин мешалки) и непрерывной аэрацией из расчета обогащения 1 л питательной среды воздухом в соотношении 1:2. Оптимальная посевная доза составляет 20-25 млн. микробных клеток на 1 см3 питательной среды.
Наличие стрептомицина в составе среды культивирования обеспечивает получение чистой культуры, значительно упрощает технологию изготовления и исключает выбраковку вакцины из-за контаминации.
Культивирование прекращают в начале стационарной фазы роста, когда количество живых бактерий перестает увеличиваться, накопление бактерий по оптическому стандарту к этому времени обычно составляет 40-60 млрд. в 1 см3 бульона. Стационарная фаза роста при предложенных режимах культивирования наступает через 10-12 ч. В этот срок при данных условиях удается получить максимальное количество живых микробных клеток вакцинного штамма. Культивирование в большие сроки ведет к переходу культуры в фазу отмирания и резкому сокращению числа живых клеток.
Выращенную культуру осаждают на центрифуге, разводят в 18-20-литровых баллонах средой высушивания, состоящей из сахарозы (8-10% ), желатины (1,5-2%) и воды (остальное), до концентрации 100-120 млрд. микробных клеток в 1 см3 по оптическому стандарту и расфасовывают в стерильные ампулы по 2 или 4 см3. Вакцину в ампулах высушивают методом сублимации в вакууме. Количество живых бактерий в 1 см3 вакцины составляет 40-60 млрд.
Полученная вакцина имеет следующий состав, об.%:
Штамм Salmonella
dublin ВГНКИ
N 9-16/2 (живые
микробные клетки, 40-60 млрд/см3) 28-36 Среда высушивания 64-72
Вакцину контролируют по следующим показателям: внешнему виду; концентрации микробных клеток в 1 см3 вакцины по стандарту мутности; чистоте и типичности роста вакцинного штамма; количеству живых микробных клеток в 1 см3 вакцины; массовой доли влаги в %; растворимости таблетки; наличии вакуума в ампулах; безвредности, иммуногенности.
Разработанные методы контроля вакцины на чистоту, безвредность и иммуногенность заключаются в следующем. Чистоту вакцины проверяют в пяти ампулах путем высева из каждой ампулы 0,2 см3 взвеси вакцины на мясопептонный бульон, мясопептонный агар, мясопептонный бульон под вазелиновым маслом, агар Сабуро в две пробирки каждой среды и засевают по 3-4 чашки с МПА по Дригальскому. Посевы выдерживают в течение 10 суток при температуре 37оС на среде Сабуро - при 20-24оС. Вакцина не должна содержать посторонних микробов. При росте вакционного штамма на среде Эндо через 24-26 ч должны вырасти бесцветные, прозрачные, гладкие, гомогенные колонии в s-форме, на МПБ через 12-14 ч - равномерное помутнение.
Для определения безвредности вакцины используют смесь препарата из пяти ампул. Сухую вакцину разводят стерильным физиологическим раствором до концентрации 20 млн. микробных клеток в 1 см3 по оптическому стандарту мутности и вводят белым мышам массой 14-16 г подкожно, в области спины, в дозе 10 млн. микробных клеток в объеме 0,5 см3. Вакцину считают безвредной, если из 10 белых мышей в течение 10 суток остаются живыми не менее восьми.
Для испытания вакцины на иммуногенную активность используют 20 морских свинок массой 350-400 г, из них 10 морским свинкам вакцину вводят подкожно в области паха в дозе 100 млн. живых микробных клеток в 1 см3. Через 14-16 суток иммунизированных и контрольных свинок заражают смертельной дозой оттитрованной культуры вирулентного штамма Salmonella dublin N 373, используя по 10 опытных и 10 контрольных свинок. В течение срока наблюдения все или не менее 8 контрольных свинок должны погибнуть, а из 10 иммунизированных остаться живыми не менее 8.
П р и м е р 2. Полученную вакцину вводят подкожно телятам 10-12-дневного возраста однократно в дозе 2±0,1 млрд. микробных клеток, в объеме 1,5-2 см3.
Оптимальная иммунизирующая доза живой вакцины установлена путем титрования на телятах 10-12-дневного возраста. Животных иммунизировали однократно подкожно возрастающими дозами вакцины, заражали внутрибрюшинно через 21 день после иммунизации оттитрованной смертельной дозой (20 млрд) вирулентного штамма Salmonella dublin N 373. Результаты титрования дозы вакцины приведены в табл. 2.
Из данных, приведенных в таблице, видно, что эффективными дозами, обеспечивающими 100%-ное выживание телят, были 2 и 3 млрд. клеток. В дальнейших исследованиях для иммунизации телят использовали дозу вакцины 2 млрд. клеток.
Количество живых бактерий в одной дозе вакцины различных серий варьировало не более 5,0% . Различий в иммуногенной активности различных серий вакцин не установлена (Р < 0,05).
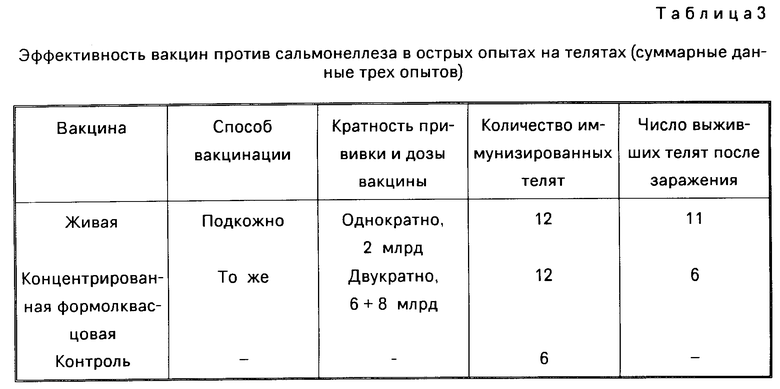
П р и м е р 3. Иммуногенные свойства вакцины в сравнении с концентрированной формолквасцовой изучали на телятах 10-12-дневного возраста. В качестве контроля использовали неиммунизированных животных аналогичного возраста. Схема вакцинации и дозы приведены в табл. 3. Животных заражали через 21 день после иммунизации внутрибрюшинно, оттитрованной смертельной дозой вирулентного штамма Salmonella dublin N 373 (20 млрд. клеток).
У девяти телят, иммунизированных инактивированной вакциной, через 48-72 ч после заражения появилась ярко выраженная диарея, шесть телят из 12 пали через 6-12 дней после заражения.
В группе, иммунизированной живой вакциной, пал один теленок из 12; у трех телят отмечена умеренная диарея в течение 2-3 дней. Все телята в контрольной группе погибли в течение восьми дней после заражения. Средний период выживания животных составил пять дней. Диагноз на сальмонеллез ставили на основании клинических, патологоанатомических признаков и бактериологических исследований.
По сравнению с вакциной "Бовисальораль" вакцина из аттенуированного штамма Salmonella dublin ВГНКИ N 9-16/2 обладает более высокой иммуногенностью, обеспечивает высокую (90%) сохранность телят в острых опытах.
Вакцина "Бовисальораль", испытанная в хозяйстве, стационарно неблагополучном по сальмонеллезу, показала низкую эффективность, обеспечив сохранность животных на 64,7%.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНА ПРОТИВ САЛЬМОНЕЛЛЕЗА МОЛОДНЯКА | 1984 |
|
SU1197187A1 |
| ВАКЦИНА ПРОТИВ САЛЬМОНЕЛЛЕЗА СВИНЕЙ, СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ И СПОСОБ ПРОФИЛАКТИКИ САЛЬМОНЕЛЛЕЗА СВИНЕЙ | 1988 |
|
RU1577116C |
| ВАКЦИНА ПРОТИВ САЛЬМОНЕЛЛЕЗА СВИНЕЙ | 2003 |
|
RU2255763C2 |
| ВАКЦИНА ПРОТИВ САЛЬМОНЕЛЛЕЗА КУР И СПОСОБ ПРОФИЛАКТИКИ САЛЬМОНЕЛЛЕЗА КУР | 1992 |
|
RU2030916C1 |
| ШТАММ БАКТЕРИЙ Salmonella dublin №19, ИСПОЛЬЗУЕМЫЙ ДЛЯ ИЗГОТОВЛЕНИЯ ВАКЦИН И ДИАГНОСТИЧЕСКИХ ПРЕПАРАТОВ | 2002 |
|
RU2218176C2 |
| АССОЦИИРОВАННАЯ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ ПУШНЫХ ЗВЕРЕЙ | 2001 |
|
RU2194530C1 |
| ПРЕПАРАТ ПРОТИВ САЛЬМОНЕЛЛЕЗА КУР И СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ САЛЬМОНЕЛЛЕЗА КУР | 1992 |
|
RU2026082C1 |
| ШТАММ БАКТЕРИЙ Salmonella enteritidis № 22, ИСПОЛЬЗУЕМЫЙ ДЛЯ ИЗГОТОВЛЕНИЯ ВАКЦИН И ДИАГНОСТИЧЕСКИХ ПРЕПАРАТОВ | 2002 |
|
RU2218177C2 |
| ИНАКТИВИРОВАННАЯ ЭМУЛЬСИН-ВАКЦИНА ПРОТИВ САЛЬМОНЕЛЛЕЗА ТЕЛЯТ | 1997 |
|
RU2154495C2 |
| ШТАММ БАКТЕРИЙ SALMONELLA DUBLIN 160, ИСПОЛЬЗУЕМЫЙ ДЛЯ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ ПРОТИВ САЛЬМОНЕЛЛЕЗА ТЕЛЯТ | 1986 |
|
SU1378389A1 |
Штамм бактерий Salmonella dublin ВГНКИ N 9 - 16/2, используемый для изготовления вакцины против сальмонеллеза телят.
| Авторское свидетельство СССР N 949961, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1994-11-30—Публикация
1984-09-04—Подача