Изобретение относится к первому представителю нового класса циклических дитерпенов, а именно к (IS, 2R, 11S, 12R, 15Ю-2,7,7,11,15-пентаме- тилтетрацикло (10.2.1. .0 тадека-3(8)-ену формулы
5, в
1
пен(I)
10
Целью изобретения является разработка нового тетрациклического дитер- пена формулы I, представителя нового структурного класса, содержащего неизвестный для тетрациклических дитерпенов углеродный скелет благодаря сочленению октагидронафталиновой и бидиклогептановой систем, новому расположению связей.
Углеводород формулы I получают путём дегидратации (1R, 2S, 7S, 10S,
11R, 12S)-2,6,6,10,12-пентаметйлтет- рацикло l0.2.1 .. пентадекан11-ола формулы
(Б)
смесью серной и муравьиной кислот,
Углеводород формулы 1 можно получить также путем хщклизации маноола фторсульфоновой кислотой в среде фторхлористого сульфурила.
Новая система образуется в результате перегруппировки углеродного скелета исходного спирта, происходящей при его дегидратации под действием смеси серной и муравьиной кислот или же при катализируемой кислотой цикло- дегидратации бициклического спирта маноола.
Изобретение поясняют следующие примеры.
Пример 1. К 500 мг исходного спирта формулы II добавляют 50 мл 10%-ного раствора концентрированной серной кислоты в 99%-нбй муравьиной кислоте и реакционную смесь вьщержи- вают при комнатной температуре 48 ч. Затем к ней приливают 50 мл 5%-ного едкого натра и экстрагируют трижды эфиром. Эфирньй экстракт промывают
5
0
5
0
5
0
5
0
5
водой, насыщенным раствором бикарбоната натрия, снова водой, высушивают безводным сульфатом натрия, а растворитель отгоняют. Остаток (504 мг) хроматографируют на колонке с 15 г сшшкагеля, импрегнированного азотнокислым серебром, Петролейным эфиром элюируют 144 мг углеводорода 1, oi + S.Z (с 2,6; СНС1,). Дальней- шим хроматографированием получают еще 100 мг чистого целевого продукта из смеси его с более полярными продуктами. Общий выход около 52%.
Найдено, %: С 88,38; Н 11,78.
.
Вьиислено, %: С 88,16; Н 11,84.
ИК-спектр (СС, ): 1353 и 1373 с(СН,)г .
ПМР-спектр (СС1; TMC,S , м.д,): 0,76 (с,ЗН, 0,80 (с, ЗН), 0,86 (с, 6Н), 0,88 (с,ЗН)Ч4 метильНые группы при четвертичных и одна при третичном атомах углерода).
Масс-спектр (m/z, интенсивность в %): 272 (М, 36), 257(28), 243(7), 229(5), 203(8), 190(100), 175(45).
Пример 2. К раствору 1,88 г фторсульфоновой кислоты в 7,3 г фтор- хлористого сульфурила добавляют в течение 15 мин при перемешивании, выдерживая температуру минус 110 - минус 115 С, небольшими порциями 250 мг кристаллического маноола. Реакционную смесь морозят в жидком азоте, затем постепенно оттаивают и при перемешивании выливают в раствор 4,8 мл ди- этилового .эфира в 12 мл метанола. Продолжая перемешивание, к полученной смеси приливают 45 мл 17%-ного раствора карбоната натрий, затем 50 мл воды и экстрагируют трижды эфиром. Эфирньй экстракт промывают водой, высушивают над безводным сульфатом натрия, отфильтровьшают и растворитель отгоняют. Остаток (192 мг) хроматографируют на колонке, с 5 г силикаге- ля. Петролейным эфиром элюируют 49,8 мг смеси углеводорода формулы I с более полярным углеводородом. Выход целевого продукта около 15%.
П р и м.е р 3. Озонолиз углеводорода формулы I.
Через раствор 646 мг углеводорода формулы I в 15 мл сухого дихлормета- на и 0,6 МП сухого пиридина пропускают ток озонированного воздуха при минус 70 - минус 65 С до насыщения (18 ч). Разбавляют реакционную смесь
312137004
50 мл 10%-ного раствора серной кисло- группы при третичном атоме углерода, ты и экстрагируют трижды эфиром. Тетразамещенная двойная связь нахо- ЭФирный экстракт промывают водой, дится в месте сочленения двух циклов, насыщенным раствором бикарбоната нат- В масс-спектре углеводорода формулы 1 рия, снова водой, высушивают, отфиль- 5 имеются пики с т/2 257,243,190 и 175, тровывают и растворитель отгоняют. подтверждающие его строение.. Получить Остаток (661 мг) хроматографируют под давлением на колонке с 18 г сили- кагеля смесью петролейного эфира и
fO
этнлацетата (19:1), элюируют 530 мг основного продукта - эпоксида по связи и 80 мг дикетона форшулы
О
(III)
Т.пл. t48-149,5°C (из петролейного эфира oi +45,5 (с 1,9,CHClj). Найдено, %: С 78,76; Н 10,48.
СЛОгВычислено, %: С 78,90; Н 10,59.
ИК-спектр (СС14, ): 1678 и 1688 (), 1353 и 1373 (C(CH,)J .
ПМР-спектр (СС, ТМС,8, м.д.): 0,85 (с,ЗН), 0,93 (с, ЗН), 1,02 (с, ЗН), 1,05 (с, 6Н) (5 мётильных групп при четвертичных атомах углерода. Масс-спектр (m/z, интенсивность в%): 304 (M 14), 276 (44), 261 (3), 248 .(4), 195 (36), 137 (93), 108 (100).
Строение углеводор ода формулы I доказывают вышеприведенные данные и данные элементного анализа. В спеккристаллический комплекс углеводорода формулы I с солями палладия и серебра для рентгеноструктурного анализа не удалось. Поэтому рентгенострук- турному анализу был подвергнут продукт формулы III озонолитического расщепления исследуемого углеводорода, так как известно, что озон окис- 5 ляет только двойные связи, давая карбонильные соединения, и не затрагивает остаток углеродного скелета. .
20
25
30
Полный рентгеноструктурный анализ кристалла соединения формулы III показал следукмцие кристаллографические данные: ромбическая сингония, а 6,83 8 (1),Ь 10,682 (4), с 24,397 (6)А, федоровская группа -2..2. V - 1080 X, de, 1,07 г/см . Структура вещества формулы III, а также длины связей даны на чертеже. Стандартные отклонения для длин связей равны 0,01 А.
Таким образом, целевой продукт имеет структуру, переданную формулой I, и представляет собой бесцветную вязкую жидкость, растворимую в петролейном эфире, ацетоне, бенэоле .
Таким образом, целевой продукт имеет структуру, переданную формулой I, и представляет собой бесцветную вязкую жидкость, растворимую в петролейном эфире, ацетоне, бенэоле .
тре ПНР присутствуют.сигналы при
0,76, 0,80 и 0,86 и 0,88 м.д. четных 35хлороформе, диэтиловом эфире, трудно
мётильных групп при четвертичных ато-р астворимую в метаноле, ацетонитриле,
мах углерода, а также одной метильнойэтаноле и нерастворимую в воде.
группы при третичном атоме углерода, Тетразамещенная двойная связь нахо- дится в месте сочленения двух циклов, В масс-спектре углеводорода формулы 1 имеются пики с т/2 257,243,190 и 175, подтверждающие его строение.. Получить
кристаллический комплекс углеводорода формулы I с солями палладия и серебра для рентгеноструктурного анализа не удалось. Поэтому рентгенострук- турному анализу был подвергнут продукт формулы III озонолитического расщепления исследуемого углеводорода, так как известно, что озон окис- ляет только двойные связи, давая карбонильные соединения, и не затрагивает остаток углеродного скелета. .
Полный рентгеноструктурный анализ кристалла соединения формулы III показал следукмцие кристаллографические данные: ромбическая сингония, а 6,83 8 (1),Ь 10,682 (4), с 24,397 (6)А, федоровская группа -2..2. V - 1080 X, de, 1,07 г/см . Структура вещества формулы III, а также длины связей даны на чертеже. Стандартные отклонения для длин связей равны 0,01 А.
Таким образом, целевой продукт имеет структуру, переданную формулой I, и представляет собой бесцветную вязкую жидкость, растворимую в петролейном эфире, ацетоне, бенэоле .

(1S, 2R, IIS, 12R, 15R)-2,7,7, 11,15-Пентаметш1тетр;ацикло l 0.2. 1.. пентадека-ЗСё)-ен формулы (Л tsd 00 i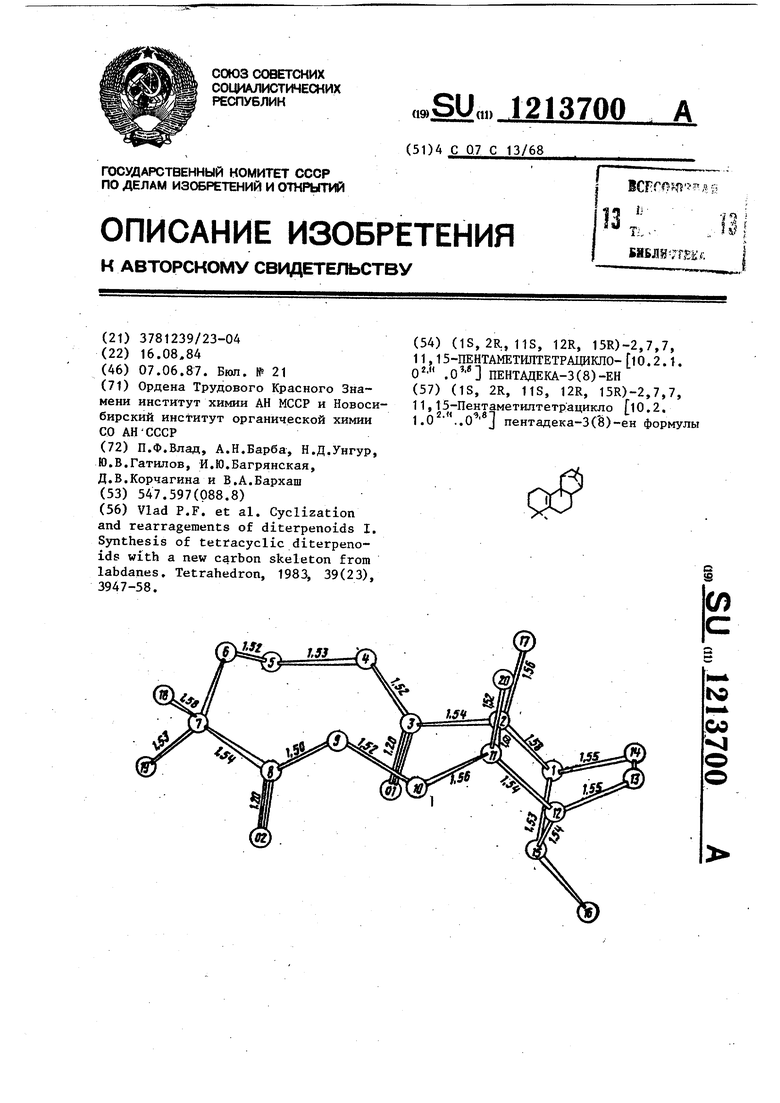
Составитель Г.Гуляева Редактор А.Купрякова Техред Н.Глущенко Корректор А.Ильин .
Заказ 2681/1 Тираж 371 Подписное ВНИИПИ Государственного комитета СССР
по делам изобретений и открытий 113035, Москва, Ж-35, Раушская наб., д. 4/5
Производственно-полиграфическое предприятие, г. Ужгород, ул. Проектная, 4
| Vlad P.F | |||
| et al | |||
| Cyclization and rearragements of diterpenoids I | |||
| Synthesis of tetracyclic diterpenoids with a new carbon skeleton from labdanes | |||
| Tetrahedron, 1983, 39(23), 3947-38. |
Авторы
Даты
1987-06-07—Публикация
1984-08-16—Подача