.
Изобретение относится к получению новых производных 1,2-дигидро-ЗН- -пирроло(1,2-а)пиррол-1-карбоновых кислот общей формулы
L Y
ЛХ.соо«г
О
где Rj - водород или , алкил;
.3 - хлор или бром; L - водород, С,-С4алкил;
алкоксигруппа, бром, хлор, фтор или SRj, где R - С -С алкил,
которые могут быть использованы в качестве противовоспалительных и обезболивающих агентов.
Цель изобретения - разработка на основе известных методов .способа получения новых соединений, обладающих ценными фармакологическими свойствами.
Пример 1. Метил-6-хлор-1,2- -дигидро-ЗН-пирроло(1,2-а)пиррол-1- -карбоксилат.
Действуя в атмосфере аргона 2,52 г 50%-ного раствора гидрида натрия в минеральном масле (0,053 моль) промывают сухим гексаном (2x20 мл) для освобождения от носителя. После этого в Смесь добавляют 150 мл безводного диметилформамида и охлаждают ее до 0°С. В эту смесь при перемешивании добавляют 16,4 метил-1-{2-йод- этил)-4-хлорпиррол-2-ацетата (0,05 моль), растворенного в 50 мл диметилформамида. Реакционную смесь оставляют на 2 ч при комнатной температуре, после чего в нее добавляют насыщенный водный раствор хлористого натрия, и полученный продукт экстрагруют в бензол (3x200 мл). Органический экстракт промьтают водой (2x100 мл) высущивают над сульфатом натрия и выпаривают в условиях вакуума. Сырой продукт (8,52 г) очищают с помощью хроматографии на колонках из силика- геля (245 г) с использованием смеси гексана и этилацетата (90:10) в качестве, элюирующего растворителя, что позволяет получить метил-6-хлор-1,2- -дигидро-ЗН-пирроло(1,2-а)пиролл-1- -карбоксилат, представляющий масло со следующими физическими характеристиками: ультрафиолетовая спектроско- пия 224, 279, 286 нм ( 6760, 7420, 6920); инфракрасная спектроскопия
1725 (CHCIj); спектроскопия ЯМР (CDCfj) 2,37-2,75 (m, 2Н); 3,62 (S, ЗН); 3,53-4,07. (га, ЗН) ; 5,85 (т, 1Н); 6,45 (т, Ш); масс-спектроскопия
201, 199 (М).
Пример 2. Метил-6-бром-1,2- -дигидро-ЗН-пирроло( 1, 2-а ) пиррол-1- -карбоксилат.
Раствор гидрида натрия в минеральном масле (50%, 0,65 г, 13,6 ммоль) промывают гексаном для освобождения от носителя, покрывают безводным диметилформамидом (20 мл) и затем охлаждают до 0°С при перемешивании
5 в атмосфере азота. В эту смесь по
каплям добавляют раствор метансульфо- ната (4,4 г, 12,9 ммЪль), полученньш в соответствии с приготовлением УП в 10 мл сухого диметилформамида. Реак0 ционную смесь оставляют на 3 ч при температуре О , и в течение этого периода добавляют насыщенный соляной раствор (30 мл). Продукт экстрагируют в бензол, экстракт промывают водой,
5 высушивают и вьшаривают. Остаток очищают посредством тонкослойной хроматографии на силикагеле с использованием - смеси гексана и этилацетата (4:1) в качестве выделяющего растворителя.
0 Это позволяет получить -1,56 г (49%) масла, которое представляет сырой метил-6-бром-1,2-дигидро-ЗН-пирроло- (1,2-а)пиррол-1-карбоксилат.
Пример 3. Метил-5-бензоил- -6-хлор-1,2-дигидро-ЗН-пирроло-, -(1,2-а)пиррол-1-карбоксилат.
Раствор 1,10 г метш1-6-хлор-1,2- -дигидро-ЗН-пирроло(1,2-а)пиррол-1- -карбоксилата (5,5 ммоль) в сухом ксилоле (25 мл), содержащий 2,32 г хлористого бензоила (16,5 ммоль), нагревают в течение 50 ч при температуре кипения с обратным холодильником. Растворитель удаляют в условиях вакуума, остаток растворяют в дихлорметане (50 мл), раствор последовательно промывают насьщенным раствором хлористого натрия, 10%-кым раствором бикарбоната натрия и снова насьш1енным раствором хлористого натрия..Органическую фазу высущивают над сульфатом натрия, выпаривают в условиях вакуума, а остаток подвергают воздействию хроматографии на колонках из сили5 кагеля (50:1) с использованием смеси гексана и этилацетата (9:1), в качестве элюирующего растворителя. .Растворитель удаляют, а продукт вы5
0
0
3-
кристаллизовывают из гексана, в ре- зультате чего образуется метил-5- -бензоил-6-хлор-1,2-дигидро-ЗН-пир- роло(1,2-а)пиррол-1-карбоксилат, т.пл. 106°С.
Пример 4. Метил-5-бензоил- -6-бром-1,2 -дигидрс-ЗН-пирроло- ,(1,2-а) -пиррол-1 -карбоксилат.
Раствор 0,98 мл хлористого бен- зоила (8,4 ммоль) в 5 мл сухого ксилола по каплям добавляют в кипящий раствор пирролоС1,2-а)пиррол- -1-карбоксилата, полученного в соответствии с примером 2 (0,685 г; 2,8 ммоль) в 20 мл сухого ксилола, находящегося в атмосфере аргона. Этот раствор нагревают при температуре кипения с обратным холодильником еще в течение 48 ч. Растворитель удаляют в условиях вакуума, остаток растворяют в этилацетате, полученный раствор последовательно промывают водой, 10%-ным раствором бикарбоната натрия и насьщенньм соляным раствором. Органическую фазу высушивают над сульфатом натрия и выпаривают в условиях вакуума. Остаток (1,33 г) подвергают воздействию хроматографии на колонках из силикагеля с использованием смеси гексана и этилацетата (4:1) для элюирования продукта. Растворитель удаляют, в результате .чего получают 0,79 г продукта, из которого после выкристаллизации из смеси дихлорме- тана и гексана образуется метил- -5-бензоил-6-бром-1,2-дигидро-ЗН- -пирроло(1,2-а)-пиррол-1-карбоксилат, т.пл. 93 С.
Пример 5. А. 5-Бензоил-Ь- -хлор-1,2-дигидро-ЗН-пирроло(1,2-а)- пиррол-1-карбоновая кислота.
Раствор метил-5-бензоил-6-хлор- -1,2-дигидро-ЗН-пирроло(1,2-а)пиррол -1-карбоксштата (1,10 г) в 30 мл метанола, содержащий 2 мол.экв. карбоната калия в 10 мл воды, нагревают в течение 3 ч при. тем- пературе кипения с обратным холодиль НИКОМ. Метанол удаляют в условиях вакуума, к остатку добавляют воду., Раствор экстрагируют этилацетатом, водную фазу охлаждают до 0° и подкисляют 20%-ным раствором соляной кислоты. Осажда ющееся твердое вещество собирают фильтрованием, промывают холодной водой и высушивают в условиях вакуума. Остаток вьжристаллизовы- вают из смеси метанола и воды с обра04
зованием 5-бензоил-6-хлор-1,2-дигидро- -ЗН-пирроло(1,2-а)пиррол-1-карбоновой кислоты, т. пл. 190°С.
В. 5-Бензоил-6-бром-1,2-дигидро- -ЗН-пирроло(1,2-а)пиррол-1-карбоно- вая кислота.
Выполняя в основном процедуру, представленную в части А примера, но заменяя метил-5-бензоил-6-хлор-1, 2-дигид1)о-ЗН-пирроло (1,2-а) пиррол-1-карбоксилат на метил-5-бензоил- -6-бром-1,2-дигидро-ЗН-пирроло(1,2-а) пиррол-1-карбоксилат, после выкристаллизации из смеси этилацетата и гексана получают 5-бензоил-6-б1 ом-1,2
-дигидро-ЗН-пирроло(1,2-а)пиррол-1- -карбоновую кислоту, т.пл. 199 С.
Пример 6. А. Метил-5-замещенный бензоил-6-хлор-1,2-дигидро- -ЗН-пирроло(1,2-а)пиррол-1-карбокси- латы.
Выполняя в основном процедуру, представленную в примере 3 (часть А), но заменяя хлористый бензоил следующими замещенными хлористыми бензои- лами: хлористый m -фторбензоил; хлористый о-фторбензоил; хлористый р-фторбензоил; хлористый m -хлорбен- зоил; хлористый о -хлорбензоил; хлористый р -хлорбензоил; хлористый т-метилбензоил; хлористый о -метил- бензоил; хлористый р -метилбензоил; хлористьй р -бутилбензоил; хлористый т-метоксибензоил; хлористый О -ме Лзк- сибензоил; хлористый р -метоксибензоил; хлористый р -бутоксибензоил; хлористый m -метилтиобензоил; хлористый ,р-метилтиобензоил; хлористый р-метил- тиобензоил и хлористый р -бутнлтио- бензоил можно получить следующие соединения , .
I метил-4-т-фторбензоил-6-хлор-1,2-. -дигидро-ЗН-пирроло(1,2-а)пиррол-1- -карбоксилат;
метил-5-о-фторбензоил-6-хлор- -1,2-дигидро-ЗН-пирроло(1,2-а)пиррол- 1 -карбоксилат;
метил-5-р-фторбензоил-6-хлор-1,2- -дигидро-ЗН-пирроло(1,2-а)пиррол-1- карбоксилат (т.пл. ); метил-З-п хлорбензоил-б-хлор-,2- -дигидро-ЗН-пирроло(1,2-а)пиррол-1- -карбоксилат;
метил-5-о хлорбензоил-6-хлор-1,2- -дигидро-ЗН-пирроло(1,2-а)пиррол-1- -карбоксилат;
метил-6-р-хлорбензоил-6-хлор-1,2- -дигидро-ЗН-пирроло(1.2-а)пиррол-1- -карбоксилат(т.пл. 85 С);
метил-5-т-метилбензоил-6-хлор- -1,2-дигияро-ЗН-пирроло(1,2-а) пиррол- 1 -карбоксилат;
метил-5-0-метилбензоил-6-хлор- -1,2-дигидро-ЗН-пирроло(1,2-а)пиррол- 1 -карбоксилат ;
метил-5-р-метилбЛ13оил-6-хлор- -1,2-дигидро-ЗН-пирроло(1,2-а)пиррол- 1 -карбоксилат (т.пл. );
метил-5-р-бутилбензоил-6-хлор- -1,2-дигидро-ЗН-пирроло(1,2-а)пир- рол-1-карбоксилат;
/ метил-5- Т1-метоксибензоил-6-хлор- -1,2-дигидро-ЗН-пирроло(1,2-а)пир- рол-1-карбоксилат;
метил-5-О-метоксибензоил-6-хлор- -1,2-дигидро-ЗН-пирроло(1,2-а)пир- рол-1-карбоксилат;
метил-5-р-метоксибензоил-6-хлор- -1,2-дигидро-ЗН-пирроло(1,2-а)пиррол- 1 -карбоксилат (т. пл. 111 С);
метил-5-р-бутоксибензоил-6-хлор- -1,2-дигидро-ЗН-пирроло(1,2-а)пир- рол-1-карбоксилат;
метил-5-т-метилтиобензош1-6-хлор- -1,2-дигидро-ЗН-дирроло(1,2-а)пиррол- 1-карбоксилат;
метил-5-о-метилтиобензоил-6-хлор- -1,2-дигидро-ЗН-пирроло(1,2-а)пиррол- 1 -карбоксилат;
метил-5-р-метилтиобензоил-6-хлор- -1,2-дигидро-ЗН-пирроло-(1,2-а)пиррол- 1 -карбоксилат (т.пл. );
метил-5-р г-бутилтиобензоил-6-хлор- -1,2-дигидро-ЗН-пирроло(1,2-а)пиррол- 1 -карбоксилат .
В. Метил-5-замещенный бензоил-6- -бром-1,2-дигидро-ЗН-пирроло(1, 2-а)- пиррол-1-карбоксилат.
Выполняя в основном процедуру, представленную в части А примера, но заменяя метил-6-хлор-1,2-дигидро-ЗН- пирролоС1,2-а)пиррол-1-карбоксилат метил-6-бром-1,2-дигидро-ЗН-пирроло (1,2-а)пиррол-1-карбоксилатом в соответствии с примером 2, получают 6- -бромзамещенные соединения, которые соответствуют 6-хлорзамещенным соединениям, перечисленным в части А:
метил-5-Ш-фторбензоил-6-бром-1,2- -дигидро-ЗН-пирроло(1,2-а)пиррол-1- -карбоксилат;
метил-5-р-фторбензоил-6-бром-1,2- -дигидро-ЗН-пирроло(1,2-а)пиррол-1- -карбоксилат, т.пл. 131 С (смесь ди- хлорметана и гексана),и т.д.
Пример 7. А. 5-Замещенный бензоил-6-хлор-1,2-дигидро-ЗН-пир0
роло(1,2-а)пиррол-1-карбоновые кислоты.
Выполняя в-основном процедуру, представленную в примере 5, но заме- ня я метилбензоил-6-хлор-1, 2-дигидро- -ЗН-пирроло(1,2-а)пиррол-1-карбоксилат сложными эфирами, полученными в примере 6 (часть А) получают „ 5- п-фторбензоил-6-хлор-1,2-дигидро-ЗН-пирроло (1,2-а)пиррол-1-карбо- новую кислоту;
5-Р-фторбензоил-6-хлор-1,2-дигидро-ЗН-пирроло ( 1,2-а)пиррол-1-карбо- новую кислоту;
5-р-фторбензоил-6-хлор-1,2-дигидро-ЗН-пирроло (1,2-аУпиррол-1-карбоно- вую кислоту (т.пл. 206°С);
5-т-хлорбензоил-6-хлор-1,2-дигидро-ЗН-пирроло ( 1,2-а)пиррол-1-карбоно- вую кислоту;
5-о-хлорбензоил-6-хлор-1,2-дигид- ро-ЗН-пирроло(1,2-а)пиррол-1-карбо- новую кислоту;
5-р-хлорбензоил-6-хлор-1,2-дигид- ро-ЗН-пирроло(1,2-а)пиррол-1-карбо- новую кислоту (т. пл. 200°С);
5-т-метилбензоил-6-хлор-1,2-дигидро-ЗН-пирроло ( 1,2-а)пирроло-1-кар- боновую кислоту;
5-о-метилбензоил-6-хлор-1,2-дигидро-ЗН-пирроло ( 1,2-а)пиррол-1-карбоно- вую кислоту;
5-р-метилбензоил-6-хлор-1,2-дигид- 5 ро-ЗН-пирроло(1,2-а)пиррол-1-карбоно- вую кислоту (т.пл. );
5-р-бутилбензоил-6-хлор-1,2-дигидро-ЗН-пирроло (1 ,2-а)пиррол-1-карбо- новую кислоту;
5-)тг-метоксибензоил-6-хлор-1,2-дигидро-ЗН-пирроло (1,2-а)пиррол-1-кар- . боновую кислоту;
5
0
5-0-мет6ксибензоил-6-хлор-1,2-ди- тидро-ЗН-пирроло(1,2-а)пиррол-1- -карбоновую кислоту;
5-р-метоксибензоил-6-хлор-1,2-дигидро-ЗН-пирроло (1,2-а)пиррол-1-кар- боновую кислоту (т.пл. );
5-р-бутоксибензоил-6-хлор-1,2-ди- гидро-ЗН-пирроло(1,2-а)пиррол-1-кар- боновую кислоту;
5-т-метилтиобензоил-6-хлор-1,2- -дигидро-ЗН-пирроло(1,2-а)пиррол-1- -карбоновую кислоту;
5-о-метилтиобензоил-6-хлор-1,2- -дигидро-ЗН-пирроло(1,2-а)пиррол-1- -карбоновую кислоту;
5-р-метилтиобензоил-6-хлор-1,2- -дигидро-ЗН-пирроло(1,2-а)пиррол-1- -карбоновую кислоту (т.пл. 97°С):
5-р-бутилтиобензоил-6-хлор-1,2-ди гидро-ЗН-пирроло-(1,2-а)пиррол-1-кар боновую кислоту.
В. Замещенный бензоил-6-бром-1,2- -дигидро-ЗН-пирроло(1,2-а)пиррол-1- -карбоновой кислоты.
Аналогичным образом, вьтолняя в основном пргоцедуру, представленную в части А примера, соединения, которые получены в соответствии с примером 6 (часть В), можно превратить в соответствующие кислоты:
5-т-фторбензош1-6-бром-1,2-дигид- ро-ЗН-пиррол(1,2-а)пиррол-1-карбо- новая кислота;
5-р-фторбензош1-6-бром-1,2-дигид- ро-ЗН-пиррол(1,2-а)пиррол-1-карбоно- вая кислота, т.пл. 217 С (этилаце- тат) и т.д.
Пример 8. А. 5(4-Метилсуль- финилбензоил)-6-хлор-1,2-дигидро-ЗН- -пирроло(1,2-а)пиррол-1-карбоновая кислота.
Выполняя в основном процедуру, представленную в примере 5, но заменяя метилбензоил-6-хлор-1,2-дигидро- -ЗН-пирроло(1,2-а)пиррол-1-карбокси- лат метил-5-(4-метилсульфинилбензо- ил)-6-хлор-1,2-дигидро-ЗН-пирроло- (1,2-а)пиррол-1-карбоксилатом, можно получить 5-(4-метилсульфинш1бен- зоил)-6-хлор-1,2-дигидро-ЗН-пирроло- (1,2-а)пиррол-1-карбоновую кислоту.
В. 5-(4-Метилсульфинилбензошт)- -6-бром-1,2-дигидро-ЗН-пирроло- . . (1,2-а)пиррол-1-карбоновая кислота. Выполняя в основном процедуру, представленную в примере 5, но заменяя метилбензоил-6-хлор-1,2-дигидро- -ЗН-пирроло(1,2-а)пиррол-1-карбокси- лат метш1-5-(4-метш1сульфинилбензо- ил)-6-бром-1,2-дигидро-ЗН-пирроло- (1,2-а)пиррол-1-карбоксилатом,можно получить 5-(4-метилсульфинилбензоил) -6-бром-1,2-дигидро-ЗН-пирроло- (1,2-а)пиррол-1-карбоновую кислоту.
Пример 9. Метил-5-р-метил- бензоил-6-хлор-1,2-дигидро-ЗН-пир- роло(1,2-а)пиррол-1-карбоксилат.
В круглодонную трехгорлую колбу, снабженную магнитной мешалкой и входной трубкой для поступления аргона (или азота), помещают 1,63 г (10 ммоль) Н,Н-диметил-р-толуамида, 0,01 мл (10 ммоль) оксихлорида фос0
5
0
5
0
5
0
5
0
5
фора и 15 мл безводного 1,2-дихлор- этапа. Смесь перемешивают при температуре кипячения с обратным холодильником в атмосфере аргона в течение 1 ч, а затем добавляют раствор метил-6-хлоро-1,2-дигидро-ЗН-пирро- ло(1,2-а)пиррол-1-карбоксилата (0,998 г, 5 ммоль) в 15 мп 1,2-ди- хлорэтана, Тгри этом перемешивание при температуре кипячения с обратным холодильником продолжают еще в течение В ч. Смесь охлаждают до ком- натной температуры и добавляют раствор ацетаттригидрата (6, 8 г) в 30 МП воды. Затем смесь перемешивают при температуре кипячения с обратным холодильником еще в течение 2 ч. Смесь охлаждают, отделяют органическую фазу и соединяют ее с дихлормета- новым экстрактом водной фазы. Экстракт промывают насьщенным раствором соли, высушивают над сульфатом натрия и выпаривают в вакууме. Остаток разделяют с помощью тонкослойной хроматографии на силикагеле гексан- этилацетат (7:3) с получением метил- -5-р-метилбензоил-6-хлор-1,2-дигидро-ЗН-пирроло ( 1,2-а)пиррол-1-карбок- силата с т.пл. 86°С после кристаллизации из смеси дихлорметана и гек- сана.
Пример -10. 5-(4-Метилсуль- фонилбензоил)-6-хлор- и 6-бром-1,2- -дигидро-ЗН-пирроло(1,2-а)пиррол-1- -карбоновая кислота.
Вьтолняя в основном процедуру, представленную в примере 5 (часть А), но заменяя метил-5-бензоил-6-хлор- -1,2-дигидро-ЗН-пирроло(1,2-а)пиррол- -1-карбоксилат сложными эфирами, получают
5-р-метилсульфонштбензоил-6-хлор- -1,2-дигидро-ЗН-пирроло(1,2-а)пирролг -1-карбоновую кислоту и
5-р-метилсульфоннлбензоил-б-бром- -1,2-дигидро-ЗН-пирроло(1,2-а)пиррол- 1 -карбоновую кислоту.
П р и м е р 11. Раствор 200 мг 5-бензоил-6-хлор-1,2-дигидро-ЗН- -пиррол(1,2-а)пиррол-1-карбоновой кислоты в 5 МП дихлорметана обраба- тьшают избыточным количеством эфирного диазометана и вьщерживают реакционную смесь в течение 30 мин при комнатной температуре. Растворители и избыток реагента удаляют при пониженном давлении, а остаток кристаллизуют из смеси зтилацетата и метанола с образованием метил-5-бензо- ил-1,2-дигидро-ЗН-пирроло(1,2-а)- пиррол-1-карбоксилата,
Аналогичным образом, но используя вместо диазометана диазоэтан, диазо- пропан и диазобутан, соответственно получают
зтил-5-бензоил-6-хлор-1,2-дигидро -ЗН-пирроло(1,2-а)пиррол-1-карбокси- лат;
пропил-5-бензоил-6-хлор-1,2-дигид ро-ЗН-пирроло(1,2-а)пиррол-1-карбок- силат и
бутил-5-бенэоил-6-хлор-1,2-дигид- ро-ЗН-пирроло(1,2-а)пиррол-1-карбоксилат.
Подобным образом и остальные свободные кислоты, полученные в примерах 5, 7, 9 и 11, можно, превратить в соответствующий сложный метиловый, этиловьй, пропиловый и бутиловый эфир
Пример 12. Раствор 300 мг 5-р-хлорбензоил-6-хлор-1,2- -дигидро-ЗН-пирроло(1,2-а)пиррол- -1-карбоновой кислоты в 5 мл изоами- лового спирта насьпцают хлористым водородом. Через 24 ч избыток спирта отгоняют в вакууме, и остаток очищают посредством хроматографии на глиноземе, в результат чего образуется изоамил-5-р-толуоил-1,2- -дигидро-ЗН-пирроло(1,2-а)пиррол-1- -карбоксилат.
Аналогичным образом можно получить другие сложные эфиры, например пентиловьм, гексиловый, октиповый, нониловьй, додециловьй, в результате замещения изоамилового спирта другими спиртами, например пентиловым, гексиловым, октиловым, нониловым, додециловым спиртом, например
пентил-5-р-хлорбензоил-6-хлор- -1,2-дигидро-ЗН-пирроло(Т,2-а)пиррол- 1 -карбоксилат;
гексил-5-р-хлорбензоил-6-хлор- -1,2-дигидро-ЗН-пирроло(1,2-а)пир- рол-1-карбоксилат;
октил-5-р-хлорбензоил-6-клор-1,2- -дигидро-ЗН-пирроло(1,2-а)пиррол- -1-карбоксилат;
- нонил-5-р-хлорбензоил-6-хлор-1,2- -дигидро-ЗН-пирроло(1,2-а)пиррол-1- -карбоксилат;
додецил-5-р-хлорбензош1-6-хлор- -1,2-дигидро-ЗН-пирроло(1,2-а)пир- . рол-1-карбоксилат.
Таким образом, свободные кислоты, полученные в примерах 5, 7, 9 и 11,
iD
5
0
3
0
5
fi
5
этерифицируют соответствующим спиртом, в результате чего получают соответствующие сложные эфиры.
Пример 13. В раствор 300мг 5- 3-хлорбензоил-6-хлор-1,2-дигидро- -ЗН-пирроло(1,2-а)пиррол-1-карбоно- вой кислоты в 5 мл метанола добавляют 1 мол.экв. едкого натра в виде 0,1 к. раствора. Растворитель растворяют в 2 мл метанола с последующим осажд,ением простым эфиром, в результате чего обарзуется сырой 5-.р-хлор- -бензоил-6-хлор-1,2-дигидро-ЗН-пир- роло(1,2-а)пиррол-1-карбоксилат натрия, который можно выкристаллизо- вать из смеси этилацетата и гексана.
Аналогичным образом в результате замены гидроокиси натрия гидроокисью аммония и гидроокисью калия можно получить другие соли, пример аммони- евую и калиевую соль 5-р-хлорбензоил-о -6-хлор-1,2-дигидро-ЗН-пирроло,. (1,2-а)пиррол-1-карбоновой кислоты.
Таким же образом, соединения 5- -замещенный-6-хлор- или 6-бром-1,2- -дигидро-ЗН-пирроло(1,2-а)пиррол- -1-карбоновой кислоты,полученные в примерах 5,7,9 и 11, можно прев- ратить в соответствующие соли натрия, калия и аммония.
Пример 14. В раствор 175мг 5-р-хлорбензоил 6-хлор-1,2-дигидро- -ЗН-пирроло(1,2-а)пиррол-1-карбоно-, вой кислоты в 5 мл метанола добавляют 1 мол. экв. гидроокиси калия в виде 0,1 н раствора, в результате чего образуется раствор, содержащий 5-р-хлорбензоил-6-хлор-1,2-дигидро-ЗН-пирроло ( 1,2-а)пиррол-1- -карбоксилат калия. Раствор 40 мг карбоната кальция, растворенного в минимальном количестве 1 н раст- . вора соляной кислоты, необходимом для воздействия на раствор карбоната кальция, титруют 100 мг твердого хлористого аммония с последующим добавлением еще 5 мл воды. Полученный таким образом титрованный раствор кальция затем вводят в раствор 5-р-хлорбензош1-6-хлор-1,2-дигидро-ЗН-пирроло (1,2-а)пиррол-1 - -карбоксилата калия, образующийся осадок собирают посредством фильтрования, промьшают водой и высушивают воздухом, в результате чего образуется 5-р-хлорбензоило-6-хлор-1,2- -дигидро-ЗН-пирроло(1,2-а)пиррол-1- -карбоксилат кальция «
Также в результате замены карбоната кальция карбонатом магния можно получить 5-р-хлорбензоил-6-хлор- -1,2-дигидро-ЗН-пирроло(1,2-а)пиррол- 1-карбоксилат магния.
Аналогичным образом в результате замены 5-р-хлорбензоил-6-хлор-1,2- -дигидро-ЗН-пирроло(1,2-а)пиррол- -1-карбоновой кислоты другими кар- боновыми кислотами, полученными в примерах 5, 7, 9 и 11, можно получить соответствующие соли кальция и магния.
Пример 15. В раствор 200мг 5-р-хлорбензоил-6-хлор-1,2-дигидро- -ЗН-пирроло(1,2-а)пиррол-1-карбоно- вой кислоты в 5 мл метанола добавляют 1 мол. эвк. гидроокиси калия в виде 0,1 н раствора. Растворитель удаляют, а остаток растворяют в 5мл воды. Полученный таким образом водный раствор 5-р-хлорбензоил-6-хлор- -1,2-дигидро-ЗН-пирроло(1,2-а)пиррол -t-карбоксилата калия вводят в раствор 150 мг тригидрата азотно-кислой меди в 5 мл воды. Образовавшийся осадок собирают, промьшают водой и высушивают воздухом, в результате чего получают 5-р-хлорбен зоил-6-хлор -1,2-дигидро-ЗН-пирроло(1,2-а)пиррол -1-карбоксилат меди.
Аналогичным образом соединения свободных кислот, полученные в примерах 5, 6, 9 и 11, можно превратить в соответствующие соли меди.
Пример 16. Раствор 200 мг ,5-р-хлорбензоил-6-хлор-1,2-дигидро- -ЗН-пирроло(1,2-а)пиррол-1-карбоно- вой кислоты в 15 мл горячего бензола обрабатывают 60 мг изопропиламина. Этот раствор оставляют для охлаждения до комнатной температуры, после чего продукт отфильтровывают,промывают простым эфиром и высушивают с образованием изоп1зопиламиновой соли 5-р-хлорбензош1-6-хлор-1,2-дигидро- ЗН-пирроло(1,2-а)пиррол-1-карбоновой кислоты.
Аналогичным образом получают другие соли амина, например соли диэтил амина, этаноламина, пиперидина, тро- метамина, холина и кофеина 5-р-хлор- бензоил-6-хлор-1,2-дигидро-ЗН-пирро- ло(1,2-а)пиррол-1-карбоноБой кислоты заменяя изопропиламин любым из ука- занньк аминов.
Таким же образом соединения свободных кислот, полученные в приме
pax 5, 7, 9 и 11, можно превратить в соответствующие соли изопропиламина, диэтиламина, этаноламина, пиперидина, трометамина, холина и кофеина.
Исследования в отношении противовоспалительного действия.
Противовоспалительное действие при введении препарата через рот определяется по отношению к случаю воспаления в лапе у крысы, вызванного карагенином.
Использовали самок крыс весом 80-90 г. Испытуемые вещества вводили принудительно через рот в 1 мл водного носителя, и с этого момента вели отсчет времени испытания. Через 1 ч в правую заднюю лапу впрыскивали 1% раствора карагенина (в 0,9% растворе NaCf). Эта инъекция вызывала в лапе воспаление. Через Д ч после начала испытания крыс умертв- ляли, у них удаляли обе задние лапы и взвешивали их отдельно. Конечная точка испытания. Процентное увеличение; размера лапы высчитывали следукнцим образом. Вес правой лапы - вес левой лапы „,,
вес левой лапы
Чем меньше % увеличения размера лапы, тем меньше степень воспаления и тем больше противовоспалительное - действие.
Предлагаемые соединения характеризуются относительно высоким противовоспалительным действием в этом испытании, что видно из табл. 1. Представленные в табл. 1 соединения имеют формулу (1), в которой И представляет Ct, а L имеет значение, указанное в табл. 1. А и Б известные соединения, взятые для сравнения. Воздействие этих соединений сравнивается с фенилбутозоном (PBZ), которому произвольно присвоено значение 1, и сравнение других соединений ведется относительно этого значения.
.Таблица 1.
Продолжение табл.
Ct Cl
с: сг
50
15
200
10
Исследования в отношении обезболивающего действия,
Обезболивающее действие препарата при введении его через рот определя- ;ется путем проверки не обезболива- ние (отсутствие судорог) у мышей.
Испытуемое вещество вводили принудительно через рот в водном носителе самцам мышей весом 18-20 г, относящимся к швейцарским ткачикам, и с этого момента вели отсчет времени испытания. Через 20 мин в брюшную полость впрыскивали 0,25 мл 0,02%-ного раствора фенилхинона. Этот раствор вызывает судороги.
Конечная точка испытания.
Общее число мышей, которые испы- тьшают судороги, и среднее число судорог у одной показывают активность испытуемого соединения, меньшее число судорог у мыши указывает, не большую активность препарата.
Предлагаемые соединения характеризуются относительно высоким обезболивающим действием в этом испытании, что видно из табл. 2. Эти соединения сравниваются с аспирином (ASP) которому произвольно присвоено значение 1. Соединения, имеющие значение, превьш1ающее этот показатель у аспирина, показывают, что они являются более активными, чем аспирин.
Составитель И. Бочарова Редактор Н, Ёобкова Техред Т.Тулик Корректор И. Эрдейи
Заказ 1007/62 Тираж 379Подписное
ВНИШШ Государственного комитета СССР
по делам изобретений и открытий 113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП Патент, г. Ужгород, ул. Проектная, 4
Таблица 2
СН,
13-0
Исследование дозы, приводящей к смерти 50% особей у мьшей.
В первый день испытания группе из шести самцов мышей весом 20-25 г, относящихся к швейцарским ткачикам, через рот вводили 1, 3, 10 иЗОмг/кг 5-р-хлорбензош1-6-хлор-1,2-дигидро- -ЗН-пирроло(1,2-а)пиррол-1-карбоно- вой кислоты в носителе из карбокси- метилцеллюлозы. В течение 21 дня за мьш1ами вели . наблюдение в отношении смертности (табл. 3).
Таблица 3 .
30 Доза, мг/кг
Количество, смертей, количество/6
О (только носи- тепь)
1 3
10 30
О
О О 2
Исходя из этих данных был сделан вывод о том, что доза, приводящая к смерти 50% особей, превьш1ает 30 мг/кг.






Способ получения 6-хлор-(или бром)-1,2-дигидро-ЗН-пирроло-(1,2-а)- пиррол-1-карбоновых кислот общей формулы Y т ,. 1 .. L И П О I-I. где Rj - водород или алкил; Y - хлор или бром; L - водород, С -С алкил; С -С - алкоксигруппа, бром, хлор, фтор или SR.J , где RJ - С -С алкил, или их фармацевтически приемлемых солей, отличающийся тем, что соединение общей формулы Y COOI -Nгде RJ и Y имеют вышеуказанные значения, подвергают взаимодействию с амидом общей формулы или с хлорангидридом .кислоты общей формулы СЛ с coci, где L имеет вышеуказанные значения, и целевой продукт вьщеляют в свободном виде или в виде соли или подвергают гидролизу, когда Rj - низший С -С„-алкил или этерификации, когда RJ - водород. го |С о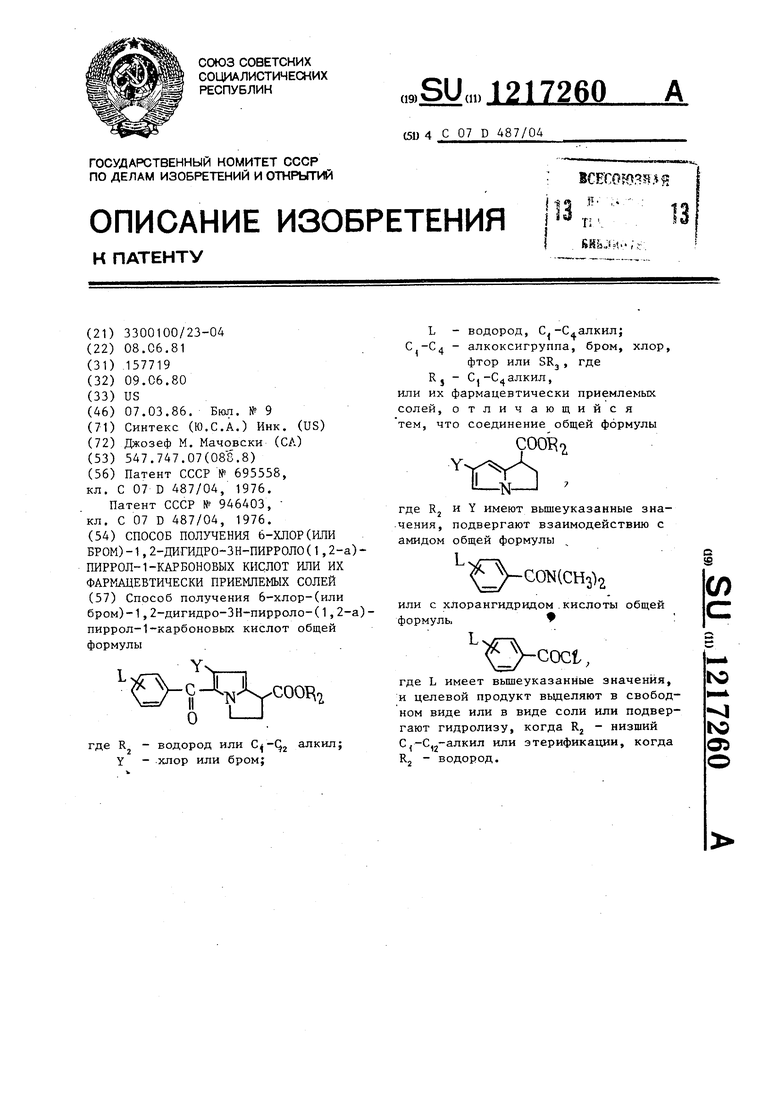
Авторы
Даты
1986-03-07—Публикация
1981-06-08—Подача