Изобретение относится к биохимии, в частности к методам выделения биологически активных веществ.
Целью изобретения является повышение выхода катепсина В и одновременного выделения ингибитора катепсина .
Способ осуществляют следующим образом.
Пример-ЗОг структурированной (в цельном куске) ткани почки человека подвергают аутолизу в течение 24 ч при 37 С. Затем ткань гомогене- зируют в 100 мл дистиллированной воды, в гомогенат добавляют дитиотре- итол в концентрации 4 мМ, гомогенат помещают на 2 ч в термостат при , затем центрифугируют при 1500 g 30 мин при . Полученный экстракт ткани осаждают сульфатом аммония (0,4 от насыщения), осадок отбрасывают, а белки надосадочной жидкости вновь осаждают сульфатом аммония (0,7 от насьщения). Белки, выпадающие в осадок при такой концентрации сульфата аммония, используют для вьщеле- ния катепсина В, а надосадочную жидкость после диализа (против 50-кратного объема дистиллированной воды) - для очистки эндогенного ингибитора цистеиновых протеиназ. После диализа проводят кислотное фракционирование: термообработка 20 мин при рН 2,5 и температуре , нейтрализация раствора 0,1 и NaOH и отделение осадка центрифугированием при 22500 §30 мин. Полученную надосадочную жидкость подвергают афинной хроматографии на колонке 2,3-1,5 см с папаин-сефарозой.
0
J5
рожно перемешивают на шейкере 2 ч при комнатной температуре. Для удаления избытка неспецифически адсорбированного белка проводят последова- тельнзпо отмывку геля 0,5 М NaCl в О,1 М бикарбонатном буфере, рН 8,3, затем - 0,5 М NaCl в 0,01 М ацетатном буфере рН 4,0 и 20 мМ калий-фосфатным буфером, рН 6,0. Пригодность папаин-сефарозы контролируют по ее способности гидролизовать БАЛНА.
Связывание ингибитора с лигандом проводят статическим методом, несвязавшиеся белки элюируют 0,02 М фосфатным буфером, содержащим 0,5 М хлорида натрия. Ингибитор элюируют 10 мМ соляной кислотой, затем нейтрализуют 0,01 н NaOH до рН 6,0. Пассаж супернатанта после кислотного фракционирования через колонку с папаин-сефарозой проводят 3-4 раза (до исчезновения в растворе ингибирую- щей активности). Полученный после афинной хроматографии раствор ингибитора подвергают концентрированию в диализных мешочках на сухой сахарозе . Ингибирующую активность в процессе вьщеления определяют по инги- бированию очищенного гель-фильтрацией на сефадексе G-75 папаина (К.Ф. 3.4.22.2). Единица ингибирования соот ветствует угнетению 1 мг фермента. Ферментативную активность папаина и катепсина В измеряют по расщеплению 35 р-нйтроанилида об -Ы-бензоил-Ь,Д-арги- нина.
При вьщелении катепсина В осадок после фракционирования сульфатом ам20
25
30
Обработку BrCN-активированной сефаро- мония (0,7 до насыщения) ресуспензизы проводят строго по рекомендации фирмы-изготовителя (Farmacia Fine Chemidils) 4,0 г BrCN-сефарозы отмывают 600,0 мл 1 мМ НС1 и оставляют 1 сут на фильтре из матиро- ванного стекла. Приготозление папаин- сефарозы проводят по способу (Komina- mi Е., Wakamateu М. Biochem. and Biophys. Res Сопшшп. 1981, 99, № 2, p. 568-575). 100 мг папаина в 0,1 М бикарбонатном буфере с 0,5 М NaCl рН 8,3 смешивают с гелем на шейкере 2 ч при комнатной температуре. Затем несвязавшийся папани отмывают 0,1 М бикарбонатным буфером с 0,5 М NaCl рН 8,3. Для блокирования оставшихся активных групп в гель добавляют 100 мл 0,2 М глицина рН 8,0 и осто
рожно перемешивают на шейкере 2 ч при комнатной температуре. Для удаления избытка неспецифически адсорбированного белка проводят последова- тельнзпо отмывку геля 0,5 М NaCl в О,1 М бикарбонатном буфере, рН 8,3, затем - 0,5 М NaCl в 0,01 М ацетатном буфере рН 4,0 и 20 мМ калий-фосфатным буфером, рН 6,0. Пригодность папаин-сефарозы контролируют по ее способности гидролизовать БАЛНА.
Связывание ингибитора с лигандом проводят статическим методом, несвязавшиеся белки элюируют 0,02 М фосфатным буфером, содержащим 0,5 М хлорида натрия. Ингибитор элюируют 10 мМ соляной кислотой, затем нейтрализуют 0,01 н NaOH до рН 6,0. Пассаж супернатанта после кислотного фракционирования через колонку с папаин-сефарозой проводят 3-4 раза (до исчезновения в растворе ингибирую- щей активности). Полученный после афинной хроматографии раствор ингибитора подвергают концентрированию в диализных мешочках на сухой сахарозе . Ингибирующую активность в процессе вьщеления определяют по инги- бированию очищенного гель-фильтрацией на сефадексе G-75 папаина (К.Ф. 3.4.22.2). Единица ингибирования соответствует угнетению 1 мг фермента. Ферментативную активность папаина и катепсина В измеряют по расщеплению р-нйтроанилида об -Ы-бензоил-Ь,Д-арги- нина.
При вьщелении катепсина В осадок после фракционирования сульфатом ам
мония (0,7 до насыщения) ресуспензи
0
5
руют в 0,01 М фосфатном буфере рН6,9 с 10 мМ ЭДТА и наносят на колонку 56x2,3 см/с сефадексом G-75, уравновешенную этим же буфером. В результате хроматографии получают два пика ферментативной активности: первый пик содержит нетиоловые гидролазы (не ингибируются р-хлормеркурийбензоатом- ПХМБ в концентрации 1 мМ), фракции второго пика, чувствительные к ПХМБ, объединяют и обозначают катепсином В.
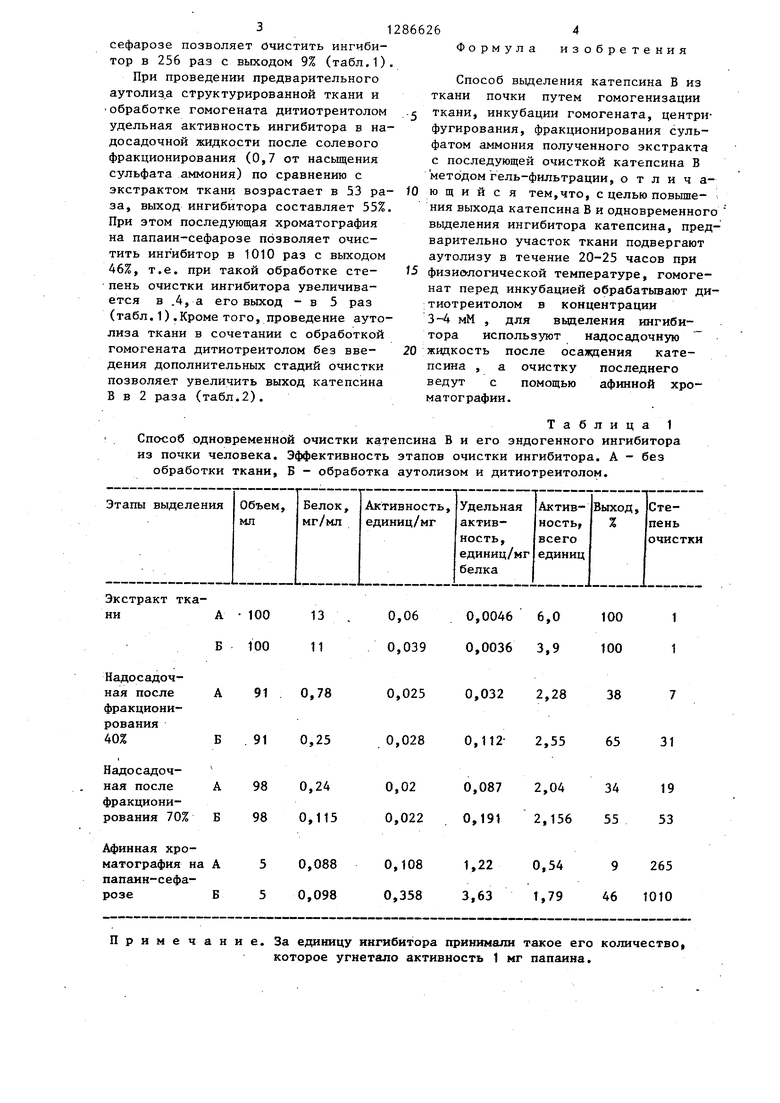
В используемой для вьщеления ингибитора надосадочной жидкости удельная активность ингибитора в 19 раз вьш1е, чем в исходном экстракте ткани,- выход ингибитора на этом этапе составляет 34%. Применение последующей афинной хроматографии на папаинсефарозе позволяет очистить ингибитор в 256 раз с выходом 9% (табл.1).
При проведении предварительного аутолиза структурированной ткани и
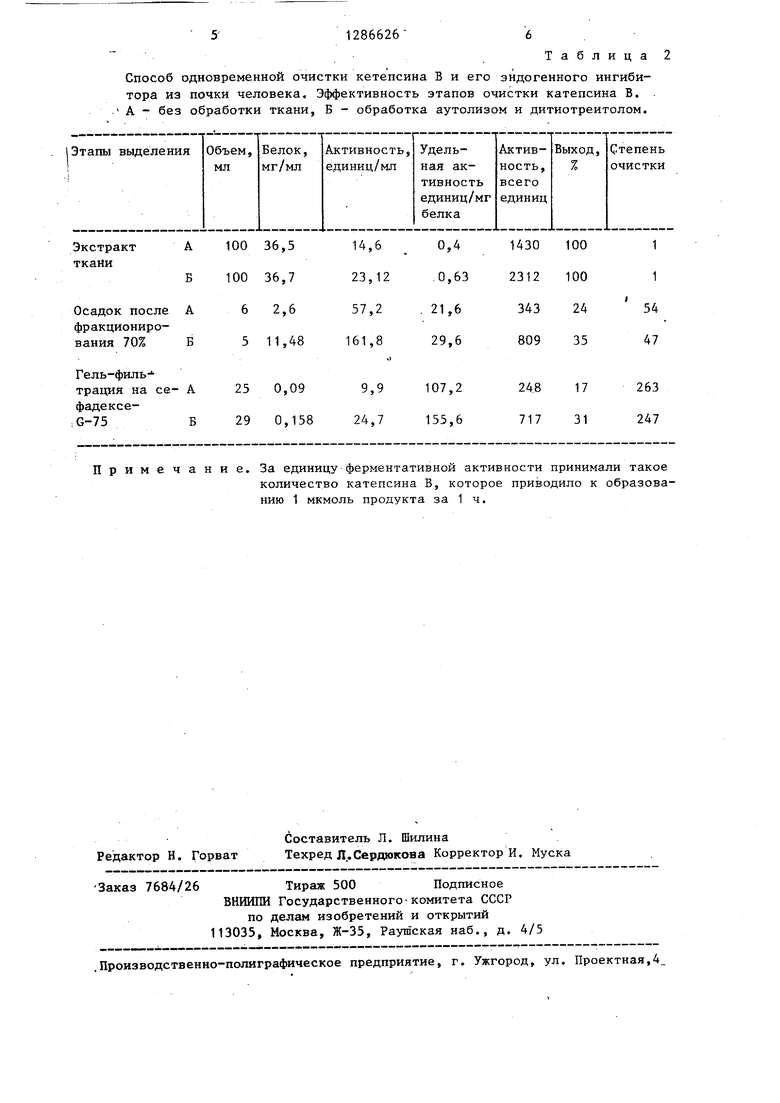
обработке гомогената дитиотреитолом удельная активность ингибитора в на- досадочной жидкости после солевого фракционирования (0,7 от насыщения сульфата аммония) по сравнению с экстрактом ткани возрастает в 53 раза, выход ингибитора составляет 55%. При этом последующая хроматография на папаин-сефарозе позволяет очистить ингибитор в 1010 раз с выходом 46%, т.е. при такой обработке степень очистки ингибитора увеличивается в .4, а его выход - в 5 раз (табл.1).Кроме того, проведение аутолиза ткани в сочетании с обработкой гомогената дитиотреитолом без введения дополнительных стадий очистки позволяет увеличить выход катепсина В в 2 раза (табл.2).
Таблица 1
Способ одновременной очистки катепсина В и его эндогенного ингибитора из почки человека. Эффективность этапов очистки ингибитора. А - без обработки ткани, Б - обработка аутолизом и дитиотреитолом.
Экстракт тканиА
100
13
Примечание. За единицу ингибитора принимали такое его количество,
которое угнетало активность 1 мг папаина.
Формула изобретения
Способ вьщеления катепсина В из ткани почки путем гомогенизации ткани, инкубации гомогената, центрифугирования, фракционирования сульфатом аммония полученного экстракта с последующей очисткой катепсина В методом гель-фильтрации, о т л и ч аю щ и и с я тем,что, с целью повыше- ния выхода катепсина В и одновременного выделения ингибитора катепсина, предварительно участок ткани подвергают аутолизу в течение 20-25 часов при
физиологической температуре, гомоге- нат перед инкубацией обрабатьшают дитиотреитолом в концентрации 3-4 мМ , для выделения ингибитора используют надосадочную
жидкость после осаждения катепсина , а очистку последнего ведут с помощью афинной хроматографии.
0,06 0,0046 6,0 100
51286626 6
Таблица2
Способ одновременной очистки кетепсина В и его эндогенного ингибитора из почки человека. Эффективность этапов очистки катепсина В. . А - без обработки ткани, Б - обработка аутолизом и дитиотреитолом.
Примечание. За единицу ферментативной активности принимали такое
количество катепсина В, которое приводило к образованию 1 мкмоль продукта за 1 ч.
Редактор Н. Горват
Составитель Л. Шилина
Техред Л,.Сердюкова Корректор И, Муска
Заказ 7684/26 Тираж 500 Подписное ВНИИПИ Государственного комитета СССР
по делам изобретений и открытий 113035, Москва, Ж-35, Раушская наб., д. 4/5
.Производственно-полиграфическое предприятие, г. Ужгород, ул. Проектная,4
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ одновременной очистки протеолитического фермента и его обратимого ингибитора | 1979 |
|
SU962302A1 |
| Способ получения ридулозодифосфаткарбоксилазы-оксигеназы | 1977 |
|
SU691461A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЛАЦЕНТАРНОГО ПРОТЕИНА | 1991 |
|
RU2007419C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЛАЦЕНТАРНОГО ПРОТЕИНА | 1991 |
|
RU2007417C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА, СОДЕРЖАЩЕГО КОМПЛЕКС БЕЛКОВ ТЕПЛОВОГО ШОКА 70,90,96, АССОЦИИРОВАННЫХ С АНТИГЕННЫМИ ПЕПТИДАМИ | 2005 |
|
RU2287339C1 |
| Способ выделения никотинамидадениндинуклеотид-глутаматдегидрогеназы из хлореллы | 1981 |
|
SU958502A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЛАЦЕНТАРНОГО ПРОТЕИНА | 1991 |
|
RU2007421C1 |
| Способ получения фосфопротеинфосфатазы | 1984 |
|
SU1182078A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЛАЦЕНТАРНОГО ПРОТЕИНА | 1991 |
|
RU2007422C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЛАЦЕНТАРНОГО ПРОТЕИНА | 1991 |
|
RU2007420C1 |
Изобретение относится к биохимии, в частности к методам выделения биологически активных веществ. Целью является повьшение выхода ка- тепсина В и одновременного вьщеления ингибитора катепсина. Образец ткани почки подвергают аутолизу в течение 20-25 ч при температуре 37 С, гомогенизируют, гомогенат обрабатывают 3-4 мМ дитиотреитолом, центрифугируют. Полученный экстракт ткани осаждают сульфатом аммония (0,4 от насыщения), осадок отбрасывают, белки не- доосадочной жидкости вновь осаждают сульфатом аммония (0,7 от насыщения). Белки, выпадающие в осадок при такой концентрации сульфата аммония, используют для выделения катепсина В, а надосадочную жидкость после диализа - для очистки эндогенного ингибитора цистеиновых протеиназ. Последующее применение афинной хроматографии на папаин-сефарозе позволяет очистить ингибитор в 1010 раз с выходом 46%. Степень очистки катепсина В в результате хроматографии на сефадексе G-75 в 247 раз с удельной активностью 155,6 ед/мг белка.2 табл. ko

Авторы
Даты
1987-01-30—Публикация
1985-05-21—Подача