1.1316553
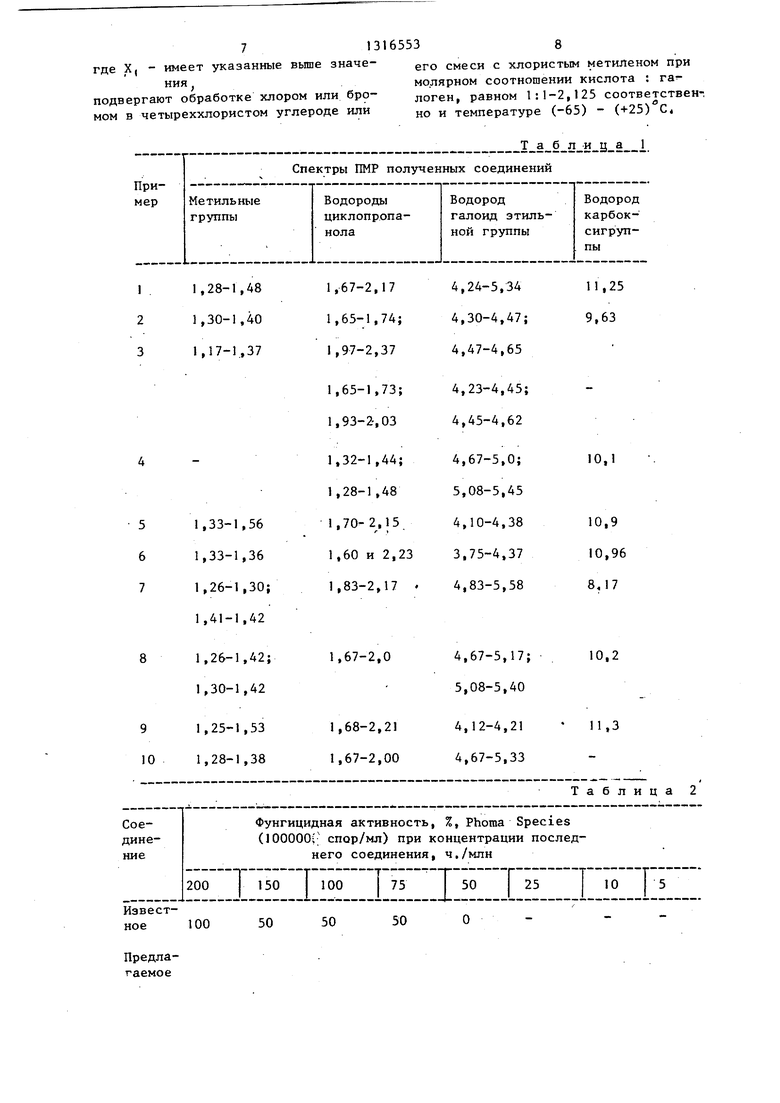
Изобретение относится к органической химии, конкретно к способу получения новых галоидзамещенных цикло- пропанкарбоновых кислот формулы
п
5 В
СНз.СНз
г Х1
Хг с -
Xi
н н
где X. - фтор или хйор или бром;
Xj - хлбр или бром, которые обладают фунгицидными свойствами,
Целью изобретения является разработка способа получения новых производных циклопропанкарбоновых кислот, обладающих фунгицидным и бактерицид- ным действием.
Пример 1, 1К,цис-2,2-Диме- тил-3-(1,2,2 ,2 -тетрабромэтил)- циклопропан-1-карбоновая кислота (соединение 1),
В 150 мл тетрахлорметана вводят 19,4 г 1К,цис-2,2-диметил 3-(2,2- дибромвинил) циклопропан-1 -карб оно- вой кислоты, прибавляют 10,4 г бро- ма в растворе в 22 мл тетрахлорметана, встряхивают в течение одного часа при 20°С, концентрируют досуха перегонкой под уменьшенным давлением и получают 31,4 г сырого продукта (Т.пл, 145°С). Этот сырой продукт перекристаллизовывают из 110 мл тетрахлорметана и получают 22,12 г 1R, цис-2,2-диметил 3-(1,2,2,2 -тет- рабромэтил)циклопропан-1-карбоновой кислоты, (Т,пл, 150°С),
Этот продукт является смесью двух оптических изомеров (А) и (В), которые выявляются спектром ЯМР, Спектр ЯМР позволяет обнаружить соединение (соответствующее приблизительно 2/3 смеси), проявляющее пнзш при 1,31-1,43 м,д,, соответствующие водородам сдвоенных метилов, и пики при 5,33 - 5,66 м,д,, соответствующие водороду, находящемуся на моно- бромированном асимметрическом углероде, и другое соединение (соответствующее приблизительно 1/3 смеси), проявляющее пики при 1,28-1,48 м,д,, соответствующие ,водородам сдвоенных метилов, и пики при 4,24 - 5,34 м,д, соответствующие водороду на монобро- мированном асимметрическом углероде,
В смеси обнаруживают, кроме того, пики при 1,67 -2,17 м,д, (водороды в пЪложении 1 и 3 циклопропана) и
пики около 11,25 м.д. (подвижной водород кислотной функции, Т.пл.
150 С.
5
Вычислено, %: С 20,99; Н 2,20; 5 Вг 69,82,
CgH,(457,804).
Найдено, %: С 20,9; Н 2,2; Вг 70,2,
П р и м е р 2, 1К,транс-2,2-Ди- метил-3-(l ,2,2,2 -тетрабромэтил)- циклопропан-1-карбоновая кислота (соединение 2) .
Это соединение получается бромиро- ванием 19,7 г 1К,транс-2,2-диметил- 3-(2,2 -дибромвинил)-циклопропан-1- карбоновой кислоты в виде смеси изомеров А и В аналогично методу, рассмотренному в примере 1. Выход 21,9 г,
П р и м е р 3, 1К,транс-2,2-Ди- 0 метил-3-(2,2 -дихлор-1 ,2 -дибpoм- этил ) -циклопропан- 1-карбоновая кислота (соединение 3),
Действием брома на 61.,0 г 1R, транс-2,2-диметил-З-(2,2 -дихлорви- нил)циклопропан-1-карбоновой кислоты получают 1R,транс-2,2-диметил-З- (2, 2-дихлор-l ,2 -дибромзтил)циклопропан-1-карбоновую кислоту - смесь изомеров А и В в количестве 107,5 г,
Пример 4, 1К,цис-2,2-диметил-З- (2 ,2 -дибром-1 ,2 -дихлор этил)-циклопропан-1-карбоновая кис- , лота (соединение 4),
5 В 30 см тетрахлорметана вводят барботированием при -15 С 11,8 г хлора, а затем медленно прибавляют при раствор 24 г 1К,цис-2,2it
диметил-3-(2 ,2 -дибромвинил)цикло0 пропан-1-карбоновой кислоты в 37 см хлористого метилена, встряхивают в течение 1 ч 30 мин при и в течение 2 ч при 25 С, концентрируют под уменьшенным давлением, очищают крис5 таллизацией из тетрахлорметаиа и получают 7,4 г 1Е,дис-2,2-диметШ1-3- (2,2 -дибром-1 ,2 -дихлорэтил)-циклопропан- 1-карбоновой кислоты, т,пл, 134 с (смесь изомеров А и В).
0 И р и м е р 5, 1П,транс-2,2-Диме- тил-3-(2,2 -дибром-1 ,2 -дихлор- этил)-циклопропан-1-карбоновая кислота (соединение 5).
В смесь 20 мл тетрахлорметана и
5 20 мл хлористого метилена вводят 24 г IR,транс-2,2-диметил-З-(2, дибромвинил)-циклопропан-1-карбоновой кислоты, охлаждают до , на- сьш1ают раствор хлором, устанавливают
3131
на реакционный сосуд прямой холодильник, питаемый жидкостью при -60 С (метанол-сухой лед), чтобы избежать потери хлора, встряхивают в течение 2 ч 30 мин при -10°С, а затем в течение 1ч 30 мин при +10 С, дают испариться избытку хлора, удаляют растворители, перегонкой под уменьшенным давлением, очищают остаток (35,5 г) хроматографическим способом на сили- кагеле, элюируя смесью циклогексан- этиловый эфир уксусной кислоты-ук- сусная кислота (75-25-1), а затем смесью тех же растворителей в отношениях (80-20-1) и получают 16,3 г 1К,транс-2,2-диметил-3-(2 ,2 -дибром- 1 ,2 -дихлорэтил)циклопропан-1-кар- боновой кислоты,
Пример 6, 1К,транс-2,2-Ди- метил-3-(2,2 -дифтор-1 ,2 -дибром- этил)-циклопропан-1-карбоновая кислота (соединение 6).
Действуя аналогично примеру 5, но при -60 С, и подвергая 26,4 г 1R, транс-2,2-диметил-3-(2,2 -дифторви- нил) циклопропан-1-карбоновую кислоту воздействию брома, получают 14,09г 1R, траНс-2,2-диметил-3-(2 ,2 -дифтор- 1 ,2 -дибромэтил)-циклопропан-1-карбоновую кислоту, т.пл.122 с (смесь изомеров А и В),
Пример 7. 1К,цис-2,2-Диме- тил-3-(2 ,2 -дихлор-1,2 -дибромэтил)- циклопропан-1-карбоновая кислота, . Действием брома на 250,0 г 1R, цис-2,2-диметил 3-(2,2 -дихлорви- нил)-циклопропан-1-карбоновую кислоту получают 421,0 г 1К,цис-2,2-диме- тил-3-(2 ,2 -дихлор-1 ,2 -дибромэтил)-циклопропан-2-карбоновой кис- лоты (смесь изомеров А и В),
Пример 8. 1К,цис-2,2-Диме- тил-3-(2 ,2,2 ,1 -тетрахлорэтил)- циклопропан-1-карбоновая кислота (соединение 8),
В-30 мл тетрахлорметана барботи- руют хлор до насьпчения (растворяют 11,8 г хлора), вводят в течение около 30 мин раствор 16,7 г 1Я,цис-2,2- диметил-3-(2 ,2 -дихлорвинил)-цикло- ,пропан-1-карбоновой кислоты в 40 мл хлористого метилена при температуре ниже ОС, встряхивают в течение 24 ч при ОС, доводят температуру реакци- ;онной смеси до ±25 С, встряхивают при этой температуре в течение 3ч, удаляют избыток хлора барботирова- нием азота, концентрируют досуха пе34
регонкой под уменьшенным давлением, очища ют остаток хроматографическим способом на силикагеле, элюируя смесью циклогексанэтиловый эфир уксусной кислоты (8-2), кристаллизуют из петролейного эфира (т.кип.35-75 С) и получают 3,14 г 1К,цис-2,2-диметил- 3-(2 ,2 ,2,1 -тетрахлорэтил)-циклопропан-1-карбоновой кислоты (т.пл.
144 С).
Вычислено, %: С 34,3; Н 3,6; С1 50,6.
CgH,o (279,98).
Найдено, %: 34,4; Н 3,7; С1 50,3.
Пример 9. 1Я,транс-2,2-Ди- метил-3-(2,2 ,2,1 -тетрахлорэтил)- циклопропан-1-карбоновая кислота (соединение 9) .
В 30 мл тетрахлорметана растворяют при -10 С 13,25 г хлора, прибавляют в течение 15 мин около 18,8 г 1К,транс-2,2-диметил-3-(2,2 -дихлорвинил) -циклопропан-1-карбоновой кислоты в растворе 30 мл хлористого метилена, причем реакционный сосуд снабжен холодильником, в котором циркулируют жидкость при -60 С, для того, чтобы конденсировать хлор, который не реагировал, встряхивают в течение 1 ч 30 мин при -10 С, а затем в течение 1 ч 30 мин при 0°С, удаляют избыток хлора при 20 С барботиро- ванием азота, концентрируют досуха род уменьшенным давлением, очищают
остаток хроматографическим способом на силикагеле, элюируя смесью цик-- логексанэтиловый эфир уксусной кислоты (7-3), и получают 23 г 1R, транс-2,2-диметил-3-(2,2 ,2,l тетрахлорэтил)-циклопропан-1-тетрахлорэтил ) -циклопропан- 1-карбоновой .кислоты.
Пример 10. lR,циc-2,2-Ди- метил-3-(2, 2 -дифтор-l ,2 ,2 -дибромэтил)-циклопропан-1-карбоновая кислота (соединение 10) .
В 120 мл хлористого метилена вводят 17 г IR,циc-2,2-димeтил-3-(2, 2 -дифторвинил)-циклопропан-1-карбоновой кислоты, при в течение двух часов вводят 15,2 г брома в растворе 40 мл тетрахлорметана, встряхивают в течение 2 ч 30 мин при 65°С, температуре подняться до 20°С, концентрируют досуха перегонкой под уменьшенным давлением, растворяют осадок в горячем виде в 50 мл тетрахлорметана, охлаждают до
0С, встряхивают при этой температуре в течение 45 мин, удаляют нерастворимое вещество фильтрацией, концентрируют фильтрат досуха перегонкой под уменьшенным давлением, растворяют остаток в АО мл тетрахлорме- тана, встряхивают в течение 30 мин при -10 С, удаляют.нерастворимое вещество фильтрацией, концентрируют фильтрат досуха перегонкой под уменьшенным давлением, очищают остаток хроматографически на силикагеле, элюируя смесью циклогексан - .этиловый эфир укс усной кислоты (75-25), кристаллизуют из петролейного эфира (т.кип.35-75°С) и получают 1,465 г 1К,цис-2,2-диметил-3-(2 ,2 -дифтор1 ,2 -дибромэтил)-циклопропан-1-кар- боновой-кислоты (т.пл,),
Спектры ПНР полученных соединений (растворитель дейтерохлороформ) сведены в табл.1.
П р и м е р 11, Исследование антигрибковой активности соединений; 1Е,цис-2,2-диметил-З-(2,2 -дибром Г ,2 -дихлорэтил)-циклопропан-1-кар- боновой кислоты (соединение 4);
1R,транс-2,2,-диметил-З-(2,2- дифтор 1,2 -дибромэтил)-циклопропан 1-карбоновой кислоты (соединение 6);
1К,цис-2,2-диметил-З-(2 ,2 -ди- хлор 1 ,2 -дибромэтил)-циклопропан- 1-карбоновой кислоты (соединение 7);
1R,транс-2,2-диметил-З-(2,2,2,
1-тетрабрсмэтил)-циклопропан-1-кар- боновой кислоты (соединение 2);
1К,цис-2,2-диметил-3-(2,2 ,2, 1 -тетрахлорэтил)-циклопропан-1-кар- боновой кислоты (соединение 8);
1К,цис-2,2-диметил-3-(2 ,2,2 , 1 -тетрабромэтил)-циклопропан- -кар- боновой кислоты (соединение 1);
1R,транс-2,2-диметш1-3-(2 ,2 -ди- хлор 1,2 -дибромэтил)-циклопропан- 1-карбоновой кислоты (соединение 3), а также соединений 5 и 9 и известного соединения X - 1К,цис-2,2-диме-.:; тил-3-(2,2 -дибромвинил)-диклопро- пан-1-карбоновой кислоты.
Фунгистатическая эффективность предлагаемого соединения исследуется путем ввода 0,5 см раствора соединения и 0,5 см суспензии спор уничтожаемого грибка, содержащей 100000-спор на см , в 4 см питательной среды СТАРОЙ.
Отсчет производится после 7 дн. инкубации при помощи визуальной проверки развития грибка или отсутствия этого развития (О или 100% эффективности) .
Питательная среда СТАРОЙ имеет 5 следующий состав: глюкоза 20 г; пептон 6 г; дрожжевой экстракт 1 г; выжимка из кукурузы 4 г; хлористьй натрий 0,5 г; первичный фосфат калия 1 г; сернокислый магний 0,5 г; сер- 0 нокислое железо (II) 10 мг в 1 л воды.
Согласно указанной методике найдены следующие фунгистатические пороги (табл.2). f5
П-р и м е р 12, Исследование био- цидной активности соединений 1-4, 6-10 на клее.
В раствор 3 г карбоксиметилкрах0 мала в 91 г воды вводят исследуемое соединение в 1 см ацетонового раствора, прибавляют 5 см прививки, содержащей смесь спор Aerobacter-Aero- genes, Pseudomonos aeroginosa, Eseherichia coli, serratia morcescens. Bacillus subtiles, Staphylococcus anreus. Ставят эту смесь в сушильную камеру при 37 С в течение 48 ч, а затем при 20°С в течение 6 дн,
Популяция бактерий проверяется после 48 ч и 8 дн.обработки и заражения способом разведений в сьшоротке и введения в агарный бульон.
Результаты бактерицидной активнос5 ти соединений приведены в табл.3.
Формула изобретения
Способ получения циклопропанкар- - 0 боновых кислот в виде К,цис- или R, транс-изомеров общей формулы
Y Y i/CH-i Г)
2, V о -с-СИ / СОН
5
ХгС-СН
k «
и
где X, - атом фтора или хлора или
брома;
Хд - атом хлора или брома, отличающийся тем, что . соответствующую кислоту общей формулы
X
СНз СНз о
n
Х{
/
,с шсон
713165538
где X, - имеет указанные вьппе значе- gpQ смеси с хлористым метиленом при
ния Jмолярном соотношении кислота : га подвергают обработке хлором или бро- логен, равном 1:1-2,125 соответствен- мом в четыреххлористом углероде или „о и температуре (-65) - (+25) С«
Продолжение табл.2
11
Число колоний бактерий на мл субстрата
через 48 ч после обработки и заражения при разведении в сыворотке
0,05 О О О
о
п
025
0,0
12 10 О
30 -10 О
47 -10 О
Редактор В, Данко
Составитель М.Кулиш Техред В.Кадар Корректор. Колб
Заказ 2375/58 Тираж 371Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий 113035, Москва, Ж-35, Раушская наб., д.4/5
Производственно-полиграфическое предприятие, г, Ужгород, ул. Проектная, 4
131655312
Продолжение табл.3
через 8 дн. после обработки и заражения приразведении в сыво-. ротке
025
0,05
0,025
16 10
12 -10
О
51 10


Изобретение касается циклокар- боновых кислот, в частности замещенных циклопропанкарбоновых кислот общей формулы (1): (хо х с-шх -сн-с н-сююн, СНс СИ-т где X(-F, 01, Вг; Xj-Cl,Br,B видеЯ,цис- или R , транс-изомеров, которые как обладающие фунгицидными свойствами могут быть использованы в сельском хозяйстве . Для выявление активности получены новые замещенные (I) новым способом. Процесс ведут обработкой ди- галоидвинилциклопропанкарбоновой кислоты (II) хлором или бромом (III) в Среде СС1 или его смеси с при молярном соотношении (II):(111) 1: (1-2,125) и -емпературе (-65) - - (+25)С в течение 1 ч. Целевой (I) вьщеляют кристаллизацией. Фунгиста- тическая активность против грибков в питательной среде СТАРОН находится в пределах 150-200 млн для lR,циc- 2,2-диметш1-з 2 ,2 -дибром-1 ,2 -ди- хлорэтил -циклопропан-1-карбоновой кислоты. 3 табл. О) со о сд сд оо ы

| СПОСОБ ИЗМЕРЕНИЯ СКОРОСТИ КОРРОЗИИ МЕТАЛЛОВ И СПЛАВОВ | 2000 |
|
RU2185612C2 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Приспособление для склейки фанер в стыках | 1924 |
|
SU1973A1 |
Авторы
Даты
1987-06-07—Публикация
1981-03-12—Подача