Изобретение относится к новьм соединениям - простым эфирам оксима формулы
триметилен.
(CH2V C- -0-A--N
сII
сн
R
где в случае, если п 4, А - триметилен, а R и
R
Нг (I)
р
R.
дый означает изопропил, или вместе с атомами азота образуют N-фе- нилпиперазин, или R - фенил, А этилен, а R.
и
Rj или R - 4-хлорфенил, А -триметилен, а R, и R - изопропил, или R - 4-хлорфенил, А - этилен.
а R,
и R2 5,
и Rj 6, R
фенил, А - этилен, или R - фе- R, и R если
если п лен, R пил; если п
R и Rj - изопропил, НИЛ, А - триметилен, метил, с тем условием, что, п 5 5 R - фенил, А - этилен, а R, и Rj - изопропил, то соединение формулы (I) имеет Z,E-KOH- фигурацию, а во всех остальных случаях соединение общей формулы (I) имеет Е,Е-конфигурацию, их гидрохлоридам или бутендиоатам, обладающим антиаритмической активностью.
Соединения общей формулы (I), где п 4, R - фенил, А - триметилен, R и Rj - изопропил или совместно с атомом азота образуют N-фенил- пиперазин п 5, R - фенил, А - эти- , IX I-I 1, - метил или изопропил;
R, и Rj - метил, их гидрохлориды или бутендиоаты, обладают дополнительно обезболивающим действием.
Цель изобретения - выявление новых производных в ряду оксимоэфиров, обладающих более высокой антиаритмической активностью и дополнительно 10 проявлянлцие усиливающее наркоз и обезболивающее действие.
Пример 1. Получение 2- (Е)- фенил, -фенилметилен - -(Е)-(4 -фенилпипе- каж- . разинил-пропоксиимино) -циклогексана. 15 В аппарат, снабженный мешалкой, отвешивают 50 мл воды, 40 г гидроокиси натрия и 10 г гидроокиси калия. изопропил. После полного растворения добавляют раствор 20,1 г (0,1 моль) 2-(Е)-фе- 20 нил-метиленциклогексан-1-он(Е)-оксима в 30 мл диметилсульфоксида, причем добавляют туда же 32,73 г (0,105 моль) К-фенил-Н -(3-хлорпро- пил)-пиперазиндигидрохлорида несколь- 25 кими порциями. Во время добавления температура поднимается до 50-55 С. Реакционную смесь оставляют для дальнейшего прохождения реакции при комнатной температуре на несколько 30 часов, выливают в 150 г ледяной воды и экстрагируют бензолом. Получают 33,09 г целевого соединения, выход 82%. Гидрохлорид плавится при 189,5- 193, моЛоМ. 440,04.
С 70,97; Н 7,79i
метил;
R фенил, А - эти- метил или изопро35
40
лен, R и Rj
п 6, R - фенил, А - этилен, R, и Rj - изопропил, или R - фенил, А - триметилен, R; и R, - метилу п 4,
45
Вычислено, С1 8,06; N 9,55.
CitHj ClN O.
Найдено, %: С 70,97; Н 7,98 С1 7,94; N 9,46.
Пример 2„ Лолучение 2-Г(Е)- -(т-хлорфенилметилен) -1- (Е)-(4 - -бензилпиперазинил-пропоксиимино) - -циклогептана.
В аппарат, описанный в примере 1, отвешивают 50 мл воды, и 50 г гидроокиси калия. После полного растворения добавляют 24,97 г (0,1 моль) 2- - (Е)-(м-хлорфенилметш1ен) -циклогептан-1-он-(Е)-оксима в 25 мл ацетонит- рила. После часовой выдержки при 60°С для дальнейшего прохождения реакции добавляют небольшими порциями 35,72 г (0,11 моль) Ы-бензил-Ы -(3- 55 -хлорпропил)-пиперазинадигидрохлори- да. По окончании добавления реакционную смесь подвергают дальнейшей реакции при бО с на несколько часов, выливают на 100 г дробленого льда.
R - 4-хлорфенил, А - этилен, R,
и
R, метил, при указанном ограничении для Z,E или Е,Е-конфигурации, облещают дополнительно усиливающим наркоз действием.
Соединения общей формулы (I), где п 4, R - фенил, А - триметилен, R и RJ - изопропил или совместно с атомом азота образуют Ы фенилпйпе- разин, или R - 4-хлорфенил, А - трипи А метилен, R г изопропил;
R.
6, R - фенил, А - этилен, х, Rj - изопропил, или R - фенил.
1353774
триметилен.
гидрохлорид дают дополн действием.
С 70,97; Н 7,79i
Вычислено, С1 8,06; N 9,55.
CitHj ClN O.
Найдено, %: С 70,97; Н 7,98 С1 7,94; N 9,46.
Пример 2„ Лолучение 2-Г(Е)- -(т-хлорфенилметилен) -1- (Е)-(4 - -бензилпиперазинил-пропоксиимино) - -циклогептана.
В аппарат, описанный в примере 1, отвешивают 50 мл воды, и 50 г гидроокиси калия. После полного растворения добавляют 24,97 г (0,1 моль) 2- - (Е)-(м-хлорфенилметш1ен) -циклогептан-1-он-(Е)-оксима в 25 мл ацетонит- рила. После часовой выдержки при 60°С для дальнейшего прохождения реакции добавляют небольшими порциями 35,72 г (0,11 моль) Ы-бензил-Ы -(3- -хлорпропил)-пиперазинадигидрохлори- да. По окончании добавления реакционную смесь подвергают дальнейшей реакции при бО с на несколько часов, выливают на 100 г дробленого льда.
1353774
дихлорэтаном и органииg 2 л ч в с 10
ческий слой выпаривают. Получают 36 г целевого соединения, выход 79,8%.
2-(Е)-Бутендиоат (1/2) плавится при 196-199 0, мол. м. 684,20.
Вычислено, %: С 61,44; Н 6,18; С1 5,18; N 6,14.
CjjH ClNjO.
Найдено, %: С 61,58; Н 6,34; С1 5,21 N 6,24.
УФ: Лмикс. 274 нм (g 137006).
Пример 3. Получение 2- (Е) -(п-хлорфенилметилен)-1- (Е)-(З - -диизопропиламино-пропоксиимино)}- -циклогексана.
В аппарат, снабженный мешалкой.
14196). Пример 5. Получение 2- L(Z)отвешивают 50 мл водь1, 40 г гидроокиси натрия и 10 г гидроокиси калия. 20 Фенилметилен -1-1(Е)-(2 -диизопро- После полного растворения добавляют -пиламиноэтоксиимино) -циклогептана. при 50-60 С раствор 23,57 г (0,1 моль) I 2- (Е)-(п-хлорфенш1метилен) -цикло- гексан-1-он (Е)-оксима в 30 мл диме- тилсульфоксида и 15,65 г (0,1 моль) 1-бром-3-хлорпропана, Реакционную смесь оставляют стоять при этой температуре несколько часов. Отделяют верхнюю маслообразную фазу (26,5 г), добавляют 100 мл диметилформамида и 20,2 г (0,2 моль) Ы,К-диизопропйл- амина. Смесь перемешивают при
В аппарат, снабженный мешалкой, отвешивают 21,53 г (0,1 моль).2-(г)- -фенилметиленциклогептан-1-он (Е)25 -оксима и 22,02 г (0,11 моль) 1-ди- изопропиламино-2 -хлорэтангидрохло- - рида. К смеси добавлюят 150 мл ксилола и 18,9 г (0,35 моль) метилата натрия, включают мешалку и отгоняют
30 30 мл смеси ксилола и метанола при атмосферном давлении, реакционную смесь перемешивают при кипении несколько часов, выливают на 200 г дробленого льда, отделяют ксилольную
30 30 мл смеси ксилола и метанола при атмосферном давлении, реакционную смесь перемешивают при кипении несколько часов, выливают на 200 г дробленого льда, отделяют ксилольну
5 ч, выливают на 200 г ледяной воды, экстрагируют бензолом, бензольньй слой промьшают до нейтральной реак- фазу и выпаривают. Получают 31,3 г ции и выпаривают. Получают 32,05 г целевого соединения в виде бледно- целевого соединения в форме бледно- желтого масла, выход 91,4%. 2-(Е)желтого масла,выход 85%. 2-(Е)-Бутен- диоат (1/1) плавится при 87-89,5 С мол.м. 493,06.
Вычислено, %: С 63,34; Н 7,56J С1 7,19; N 5,68.
C2tHj, ClNjOf.
Найдено, %: С 63,28j Н 7,6; С1 7,15; N 5,63.
У.Ф.: Л«йкс. 280 нм (Е 17456).
Точка плавления 2-(Е)-бутендйоат. (1/1/1) соли достигает 117-119 С, мол.м. 511,05.
Вычислено, %: С 61,10; Н 7,69; С1 6,94; N 5,48.
CitHjjClNiOi.
Найдено, %: С 61,15; Н 7,73; С1 6,95; N 5,43. .
Пример 4. Получение )- -фенилметилен -1- С(Е)-(3 -диизопропиламино-пропоксиимино) -циклогекса-. на.
-Бутендиоат (1/1) в виде соли плави ся при 117-120 С, мо.л.м. 458,6. 40 Вычислено, %: С 68,09; Н 8,35; . N6,11.
CuHjeNzOs
Найдено, %: С 67,92; Н 8,42}
N 6,07.
45 У.Ф- А«с,кс. 258 нм ( 11182).
в Примерб. Получение 2-С(Е) -фёнилметилен -1- ЦЕ)-З -диизопропи амино-пропоксиимино) -циклогексана Следуют примеру 1, однако в качестве исходного материала применяю 20,13 г (0,1 моль) 2-(Е)-фенилмети- ленциклогексан-1-он(Е)-оксима и 23,55 г (0,11 моль) 1-диизопропилам
gg но-3-хлорпропангидрохлорида. Получа ют 31,99 г целевого соединения, вы- . ход 93,4%, 2-(Е)-бутендиоат (1/1) плавится при 128,5-131,, мол.м ,458,61.
50
Поступают, как указано в примере 3, с тем отличием, что в качестве исходного материала используют 20,13 г (0,1 моль) 2-(Е)-фенилмети- ленциклогексан-1-он(Е)-оксим. Получают 28,47 г целевого соединения, выход 83,1%. 2-(Е)-Бутендиоат (1/1) соль плавится при 129-131 С, мол.м. 58,61.
Вычислено, %: С 68,09; Н 8,35; N 6,10.
Cj HjeNjOs-.
Найдено, %: С 67,94; Н 8,47;
N 6,15. У.Ф.:
«яке.
275 нм (Е
14196). Пример 5. Получение 2- L(Z) Фенилметилен -1-1(Е)-(2 -диизопро- -пиламиноэтоксиимино) -циклогептана.
Фенилметилен -1-1(Е)-(2 -диизопро- -пиламиноэтоксиимино) -циклогептана.
В аппарат, снабженный мешалкой, отвешивают 21,53 г (0,1 моль).2-(г)- -фенилметиленциклогептан-1-он (Е)-оксима и 22,02 г (0,11 моль) 1-ди- изопропиламино-2 -хлорэтангидрохло- - рида. К смеси добавлюят 150 мл ксилола и 18,9 г (0,35 моль) метилата натрия, включают мешалку и отгоняют
30 мл смеси ксилола и метанола при атмосферном давлении, реакционную смесь перемешивают при кипении несколько часов, выливают на 200 г дробленого льда, отделяют ксилольную
фазу и выпаривают. Получают 31,3 г целевого соединения в виде бледно- желтого масла, выход 91,4%. 2-(Е)-Бутендиоат (1/1) в виде соли плавится при 117-120 С, мо.л.м. 458,6. Вычислено, %: С 68,09; Н 8,35; . N6,11.
CuHjeNzOs
Найдено, %: С 67,92; Н 8,42}
N 6,07.
У.Ф- А«с,кс. 258 нм ( 11182).
Примерб. Получение 2-С(Е)- -фёнилметилен -1- ЦЕ)-З -диизопропил- амино-пропоксиимино) -циклогексана. Следуют примеру 1, однако в качестве исходного материала применяют 20,13 г (0,1 моль) 2-(Е)-фенилмети- ленциклогексан-1-он(Е)-оксима и 23,55 г (0,11 моль) 1-диизопропиламино-3-хлорпропангидрохлорида. Получают 31,99 г целевого соединения, вы- ход 93,4%, 2-(Е)-бутендиоат (1/1) плавится при 128,5-131,, мол.м. 458,61.
С 68,09, Н 8,35;
68,28; Н 8,35; 275 нм (
. Получение 2-Г(Е)-(п-хлорфенш1метилен) (Е)-(3 - -диизопропиламино-пропоксиимино) - -циклогексана.
Поступают, как указано в примере 1, с той разницей, что исходным ма- териалом служит 23,57 г (0,1 моль) 2-(Е)-(п-хлорфе нилме тиле н -цикло ге сан-1-он (Е)-оксима и 23,55 г (0,11 моль) 1-диизопропш1амино-3- -хлорпропанагидрохлорида. Получают 35,63 г целевого соединения, выход 94,5%. 2-(Е)-Бутендиоат (1/1) пла- 87-89,5 С, мол., м. 493,06
Вычислено, %: С 63,34; Н 7,56; С1 7,19; N 5,68.
Cj.Hj..
Найдено, %: С 63,30; Н 7,54; С1 7,13; N 5,60..
У.Ф.: / мо-кс 280 нм ( 8 17456).
Пример 8. Получение 2-(E)- -фeншlмeтилeн J-1- С(Е)-(2 -диметилами- но-2 -метил-1-этоксиимино)3 -цикло- гептана.
К суспензии 2,4 г (0,1 моль) гидрида натрия в 50 мл безводного толуола добавляют каплями при посто ЯННОМ перемешивании при 85°С раствор 21,53 г (0,1 моль) 2-(Е)-фенш1мети- ленциклогептай-1-он-(Е)-оксима и 200 мл безводного толуола. Смесь нагревают до кипения 2ч, после чего добавляют раствор 16,6 г (0,105 моль) 2-димётиламино-2-метил-1-хлорэтана и 30 мл безводноготолуола. Реакционную смесь нагревают до кипения дополнительно 6 ч, охлаждают до , промьшают 100 мл воды и экстрагируют водным раствором 15 г (0,1 моль)
виннокаменной кислоты (или 0,15-молярным разбавленным водным раствором хлористоводородной кислоты) .Реакцию водной фазы доводят до щелочной до рН 10 посредством гидроокиси аммония, отделившееся основное маслообразное вещество экстрагируют дихлорэтаном
и растворитель выпаривают. Получают 20,49 г целевого соединения в виде масла слабой желтоватой окраски, вы1353774
ход 68,2%. 2-(Е)-Бутендиоат (1/1) плавится при 121-123°С, мол.м. 416,51, Вычислено, %: С 66,32; Н 7,75;
N 6,73.
5
0
5
0
5
0
0
CzjHjzNjOj.
N
С 66,48; Н 7,95; 262 нм (Е
Найдено, %: 6,70.
У.Ф.: А макс.
17595).
П р и м е р , 9. Получение 2-t(E)- -фенилметилен -1 - (Е)-(2 -диметштами- но-2 -метил-1-этоксиимино) -циклогексана.
Поступают, как указано в примере 2,с той разницей, что исходным материалом служат 20,13 г (0,1 моль) 2-(Е)-фенилметиленциклогексан-1-он- -(Е)-оксима и 16,6г (0,105 моль) 2- -диметиламино-2-метил-1-хлорзтана. Получают 26,9 г целевого соединения, выход 93,9%. 2-(Е)-Бутендиоат в виде соли (1/1) плавится при 113-117 С, мол.м. 402,48.
С 69,54; Н
7,5П
макс.
С 65,98,- Н 7
273 нм
,60; ( Вычислено, N 6,96.
CjjHioNjOs Найдено, %;
N 7,00.
У.Ф.: 13475).
Пример 10. Получение 2-(Е)- фенилметилен -1- (Е)-(2 -диизопропил- аминоэтоксиимино) -циклооктана.
Действуют по примеру 5, однако в качестве исходных материалов используют 22,93 г (0,1 моль) 2-(Е)-фенил- метиленциклооктан-1-он-(Е)-оксима и 22,02 г (0,11 моль) 1-диизопропил- амино-2-хлорзтана. Получают 32,22 г целевого соединения, выход 93,2%. Гидрохлорид плавится при 159-161 0, мол. м. 393,0.
Вычислено, %: С 70,29; Н 9,47; 5 С1 9,02; N 7,13. ,
,
Найдено, %: С 69,78, Н 9,32, С1 9,11, N 7,32.
У.Ф.: . 276 нм (f 14170).
Пример 11. Получение 2-(Е)- -фенилметилен) -1- (Е)-(З -диметил- амино-пропоксиимино)3 -циклооктана.
Действуют по примеру 8, однако в качестве исходных веществ применяют 5 22,93 г (0,1 моль) 2-(Е)-феноксиме- тиленциклооктан-1-он-(Е)-оксима и 17,39 г (0,1 моль) 1-диметиламино-З- -хлорпропангидрохлорида и добавляют 3,9 г (0,1 моль) амида натрия. Таким
обр-гзом, получают 19,14 г целевого соединения, выход 63,7%. 2-(Е)-бутен- диоат плавится при 136-139 С, мол.м. 416,52.
Вычислено, %: С 66,32; Н.7,75; N 6,73.
C2,H,,N,0.
Найдено, %: С 66,74; Н 7.96j N 6,65.
У.Ф.: Д„с,кс. 276 им ( 14395).
Пример 12. Получение 2-(Е)- -фенилметиленЗ-1-Г(Е)-(2 -диметилами- ноэтоксиимино)-циклогептана.
Действуют по примеру 2, однако здесь исходными материалами служат 21,53 г (0,1 моль) 2-(Е)-фенш1мети- ленциклопентан-1-он-(Е)-оксима и 18,07 г (0,105 моль) 1-диметиламино- -2-хлорэтангидрохлорида. Получают 28,99 г целевого соединения, выход 92,2%..2-(Е)-Бутендиоат (1/1) плавится при 86-88 С,
N
Вычислено, 6,51.
С24Нз4 20,.
МОЛ. м. 430,53. С 66,95; Н 7,96;
С 67,12; Н 8,06j 264 нм (Е
Найдено, % N 6,46.
У.Ф.: Имокс, 16395).
Пример 13. Получение 2-(Е -фенш1метилен -1- С(Е)-(2 -диизопро- пиламиноэтоксиимино) -циклогексана.
Поступают по примеру 2,однако исхоными веществами здесь служат 20,13 г (0,1 моль) 2-(Е)-фенилметиленцикло- гексан-1-он- (Е)-оксим и 22,02 г (0,11 моль) 1-диизопропш1аминохлор- этангидрохлорида. Получают 30,99 г целевого соединения, выход 94,3%. Соль 2-(Е)-бутендиоата (1/1) плавится при 103-104°С, мол.м. 444,58.
Вычислено, %: С 67,54; Н 8,16; N 6,30.
5
%:
макс,
С 67,54; Н 8,34; . 275 нм (
Найдено, N 6,34.
У.Ф.: Д 17304).
Пример 14. Получение 2-(Е) -(п-хлорфенилметилен) -1-С(Е)-(2 - -диметиламиноэтоксиимино) -циклогек- сана.
Поступают по примеру 1 с тем отличием, что исходными материалами здесь служат 23,57 г (0,1 моль)
0
5
0
5
0
5
0
45
0
55
2- (Е)-(п-хлорфенилметилен) -цикло- гексан-1-он-(Е)-оксима и 12,24 г (0,105 моль) 1-диметиламино-2-хлор- этана. Получают 28,60 г целевого соединения, выход 93,2%. 2-(Е)-Бутен- диоат (1/1) плавится при 169-171 С, мол. м. 422,92.
Вычислено, %: С 59,64j Н 6,44; С1 8,38; N 6,62.
C.H ClNjO,,.
Найдено, %: С 59,42; Н 6,38; С1 8,27; N 6,67.
У Ф-: 275 нм ( е 19292).
Соединения общей формулы (1) обладают ценными свойствами, заключающимися в усилении наркоза, обезболивании и способности нормализовать римт сокращения сердечной мышцы.Флр-i макологическая активность предлагае- мых соединений демонстрируется еле- дующими стандартными испытаниями.
Острая токсичность при испытании на мьшах.
Острую токсичность определяют на самцах и самках белой мьши породы CFLP. Масса тела животных находится в пределах 18-24 г. Испытуемое соединение . вводят через рот при дозировке 20 мл/кг. После обработки животных помещают в предназначенную для них коробку и выдерживают на подстилке, позволякнцей ее царапать при комнатной температуре. Животные получают предназначенньй для мышей корм и водопроводную воду в неограниченных количествах. После обработки животных наблюдают в продолжение 4 дней и показатели токсичности определяют графическим методом.
Действие усиления наркоза.
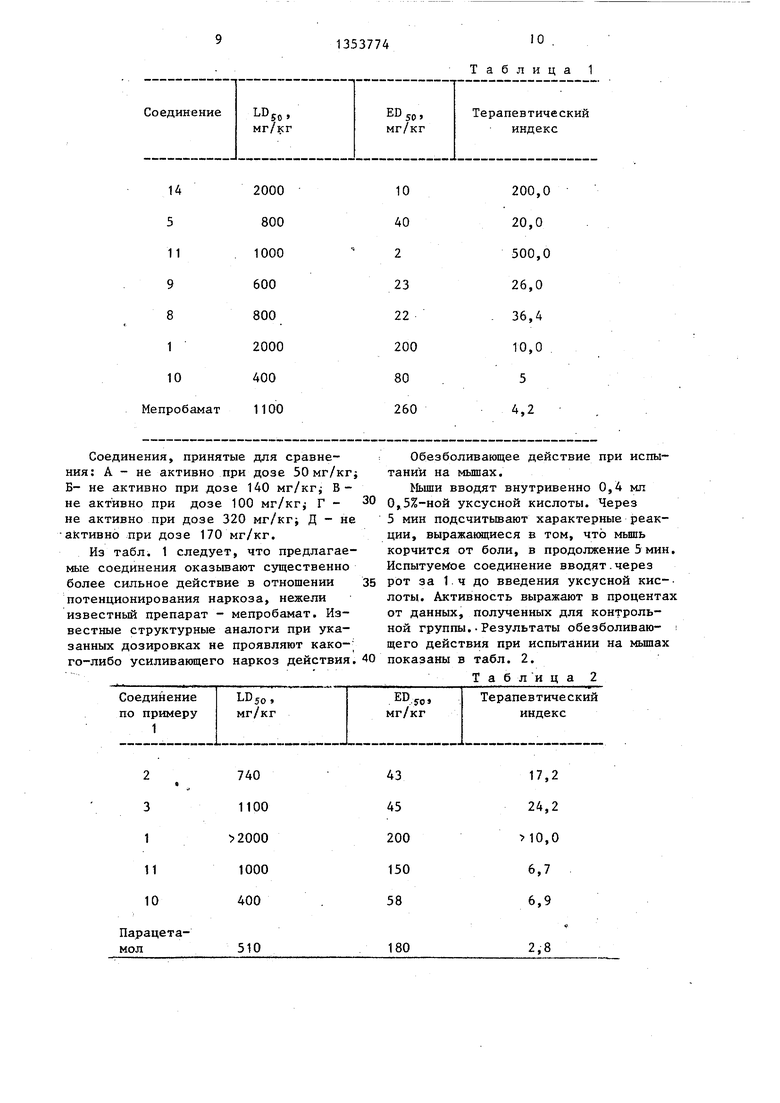
Мышам массой тела 20-24.г вводят внутривенно гексобарбитал в дозе 40 мл/кг. Измеряют длительность сна у обработанных и необработанных животных. Испытуемые соединения прояв-i ляют эффект усиления наркоза если средняя продолжительность сна у обработанных животных становится в 2,5 раза большей по сравнению с сред-, ним значением таковой у контрольной группы. Значения ЕВ вычисляют на основании полученных данных, которые представлены в табл. 1.
Соединения, принятые для сравнения: А - не активно при дозе 50 мг/кг Б- не активно при дозе 140 мг/кг; В- не активно при дозе 100 мг/кг Г - не активно при дозе 320 мг/кг Д - не akтивнo при дозе 170 мг/кг.
Из табл. 1 следует, что предлагаемые соединения оказьшают существенно более сильное действие в отношении потенционирования наркоза, нежели известный препарат - мепробамат. Известные структурные аналоги при указанных дозировках не проявляют какого-либо усиливающего наркоз действия.
Таблица 1
Обезболивающее действие при испытании на мьшах.
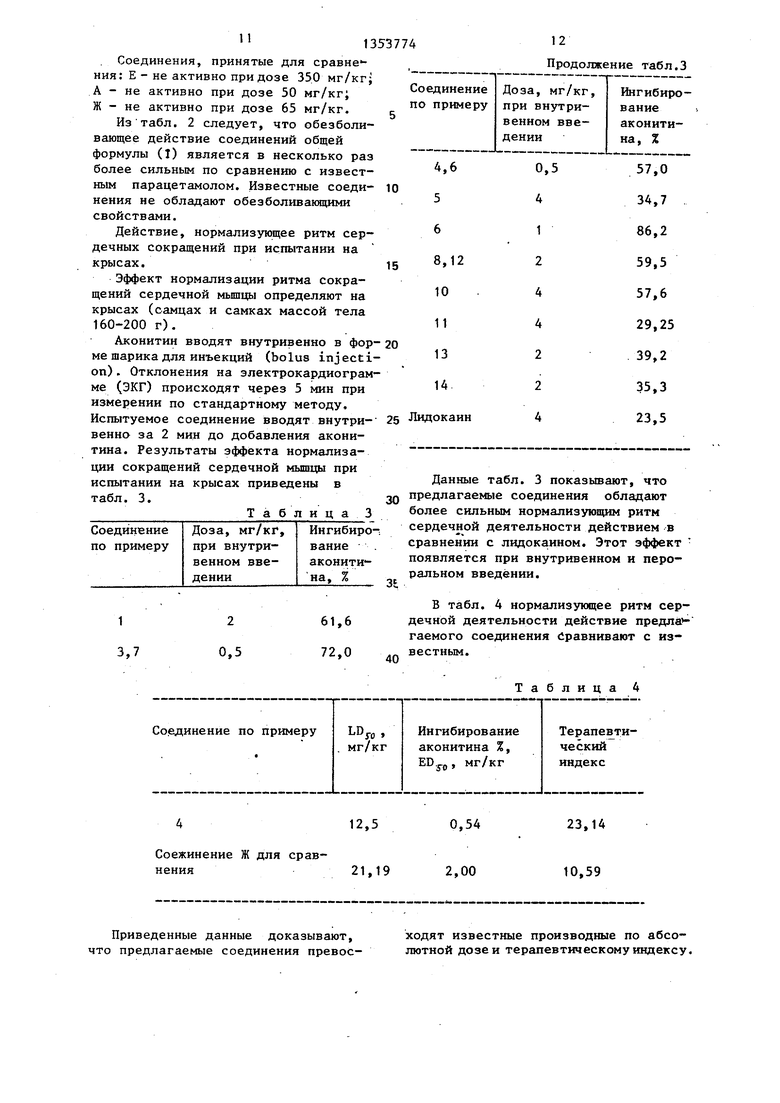
Мыши вводят внутривенно 0,4 мл 0,5%-ной уксусной кислоты. Через 5 мин подсчитьтают характерные реакции, выражакщиеся в том, что мьшь корчится от боли, в продолжение 5 мин. Испытуемое соединение вводят.через рот за 1. ч до введения уксусной кис-- лоты. Активность выражают в процентах от данных, полученных для контрольной группы.Результаты обезболиваю- щего действия при испытании на мышах показаны в табл. 2.
Таблица 2
135
. Соединения, принятые для сравне - ния: Е - не активно при дозе 350 мг/кг; А - не активно при дозе 50 мг/кг; Ж - не активно при дозе 65 мг/кг.
Из табл. 2 следует, что обезболивающее действие соединений общей формулы (I) является в несколько раз более сильным по сравнению с известным парацетамолом. Известные соединения не обладают обезболивающими свойствами.
Действие, нормализующее ритм сердечных сокращений при испытании на крысах.
Эффект нормализации ритма сокращений сердечной мышцы определяют на крысах (самцах и самках массой тела 160-200 г).
Аконитин вводят внутривенно в форме шарика для инъекций (bolus injection) . Отклонения на электрокардиограмме (ЭКГ) происходят через 5 мин при измерении по стандартному методу. Испытуемое соединение вводят внутривенно за 2 мин до добавления аконитина. Результаты эффекта нормализации сокращений сердечной мышцы при испытании на крысах приведены в табл. 3.
ТаблицаЗ
1 3,7
0,5
61,6 72,0
412,5
Соежинение Ж для сравнения
Приведенные данные доказывают, что предлагаемые соединения превос12Продолжение табл.3
Данные табл. 3 показывают, что предлагаемые соединения обладают более сильным нормализующим ритм сердечной деятельности действием в сравнении с лидокаином. Этот эффект появляется при внутривенном и перо- ральном введении,
В табл, 4 нормализующее ритм сердечной деятельности действие предла - гаемого соединения Сравнивают с известным.
Таблица 4
0,54 2,00
23,14 10,59
ходят известные производные по абсолютной дозе и терапевтическому индексу.
31
При указанных испытаниях применяют следующие соединения, принятые для сравнения: мепробамат - 2-метил- -2-н-пропш1-1,3-пропандиолдикарбамат парацетамол - 4-оксиацетанилид, ли- докаин - Н,М-диэтш1-2, 6-диметил-ацетанилид.
Для сравнения приняты соединения А - 2-бензш1-1-(3 -диметиламино-про- поксиимино)-циклогексан; соединение Б - 1- 2 -метил-З -(4 -метилпипера- зинил)-пропоксиимино -2-(п-метокси- бензил)-циклогексан, соединение В - 1-(2 -метил-З -диметиламино-пропок- сиимино)-2-(о-метоксибензаль)-циклогексан; соединение Г - 2-(п-хлорбен- зил)-1-ГЗ -(4 -метилпиперазинил)- -пропоксииминр}-циклогексан5 соединение Д - 1-(3 -диметиламино-пропок- сиимино)-2-(п-хлорбензил)-циклогекса соединение Е - 1-(3 -диметиламино- пропоксиимино)-2-(п-метоксибензаль) - -циклогексан-, соединение Ж - 2-бен- заль-1-(2 -диизопропиламиноэтокси- имино)-циклогептан.
Формула изобретенля
1. Постыв эфиры оксима формулы
R,
(I)
де в случае,
сли п 4, R - фенил, А
триметилен, а R и Rj каждый означает изопропил, или вместе с атомом азота образуют N-фенилпипера- зин, или R - фенил, А - этилен, а R и Rj - изопропил; или R - 4-хлор- фенил, А - триметилен, а R и Rj - изопропил; или R - 4-хлорфенил, А - этилен, а R, и Rj - метил; .если п 5, R - фенил, А - этилен.
R, и R,
- метил или изоп
пропил;
6, R - фенил, А - этилен, R и R2 - изопропил; п 6, R - фенил, А - триметилен, RI и Rj - ме.14
тил, с тем условием, что, если п 5, R - фенил, А - этилен, а R, и R - изопропил то соединение формулы (I) имеет Z,E- конфигурацию, а во всех остальных случаях соединение общей формулы (I) имеет Е,Е-конфигурацию, их гидрохлориды, или бутендиоаты, обладающие антиаритмической активностью.. 2, Простые эфиры оксима общей фор мулы
RI
(СН2 C K-0-A-TSlC
Y
сн я
(I)
п А, R - фенил, А - триметилен, R и R, - изопропил или совместно с атомом азота образуют Ы-фенилпиперазиН1 п . 5, R - фенил, А - этилен, R
и R пил-.
метил или изопроп 6, R - фенил, А - этилен, R., .
и RJ - изопропилJ п 6, R - фенил, А - триметилен,
R., и Rj - метил; п 4, R -, 4-хлорфенил, А - эти- лен, R и 2 метил,
при условии, что если п 5, R - фенил, А - этилен, R., и R - изопропил, соединение формулы (I) имеет Z,E-кoнфигypaцию, а во
всех остальных случаях соединение формулы (I) име- имеет Е,Е-конфигурацию, обладающие антиаритмическим и усили- вающим наркоз действием.
3. Простые эфиры-оксима общей формулы
(CHzV VN-O-A--NC
С- 1 (I)
И
сн R
где п А, R - фенил, А - триметилен, R, и RJ - изопропил или совместно с атомом азота образуют N-фенилпиперазин;
1353774
п 4, R - 4-:хлорфенил, А - три- п 6, R - фенил, А - триметилен, метилен, R и Rj - иэо-R и R,f - метил,
пропил обладающие антиаритмическим и обезбоп 6, R - фенил, А - этилен, R g ливающим действием, и R - изопропил;




| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения основных простых эфиров оксимов или их солей | 1984 |
|
SU1304747A3 |
| Способ получения @ -алкилоксимов или их солей | 1984 |
|
SU1299502A3 |
| Способ получения оксимэфиров или их солей | 1980 |
|
SU927111A3 |
| Способ получения производных циклоалкилиденгидразина | 1983 |
|
SU1274620A3 |
| Способ получения производных циклододекана или их оптическиАКТиВНыХ изОМЕРОВ B СВОбОдНОМ ВидЕ,B ВидЕ СОли или чЕТВЕРТич-НыХ АММОНиЕВыХ пРОизВОдНыХ | 1979 |
|
SU833157A3 |
| N-замещенные лактамы, проявляющие мнезическую, антигипоксическую и сердечную активность | 1978 |
|
SU937450A1 |
| Способ получения трикарбоцианиновых красителей | 1987 |
|
SU1533305A1 |
| ЗАМЕЩЕННЫЕ БЕНЗИЛАМИНЫ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ДЕПРЕССИИ | 1997 |
|
RU2179553C2 |
| Способ получения оксимэфиров, их солей или их четвертичных аммониевых солей | 1976 |
|
SU633472A3 |
| Способ получения производных 12Н-дибензо( @ , @ )(1,3,6)диоксазоцина в виде их кислотно-аддитивных солей | 1988 |
|
SU1641190A3 |
Изобретение касается простых эфиров оксимов (ПЭОК), в частности получения соединений общей формулы (СН 2)„ -С (CHR)-c N-0-A-NR Rj,, где в случае: 1) п 4, а) R .; А (снр. R Rj CjH,- или (Hi + + R2)N N-фенилпиперазин-, б) .A (CH2)2 R-, Rj B) R . 4-С1-СбН4; A (CHj)3- R, R2 CjH, -i, r) R 4-Cl-C H4i A (CH); R Rj СНз , 2) n 5; R.r. A (CH2)2; Ri R сНэ или CjH, -i; 3) n 6i a) R A ( R. RZ CgH - ii 6) R A (СН2)з и R, RZ CH, причем 2-ПЭОК имеет Z, E - конфигурацию, a 1-ПЭОК и 3-ПЭОК имеют E, E- конфигурацию, a также их гидрохлори -, .дов или бутендиоатов, которые обладают антиаритмической активностью. Соединения 1а-ПЭОК, 2-ПЭОК и Зб-ПЭОК обладают антиаритмическим и усиливающим наркоз действием, а соединения 1а-ПЭОК, 16-ПЭОК, За- и Зб-ПЭОК - антиаритмическим и обезболивающим действием. Цель - создание более активных с дополнительными положительными эффектами веществ указанного класса. Их синтез ведут реакцией соответствующего оксима и N-фенил-N -(3-хлор- пропил)-пиперазина дигидрохлорида или бутендиоата в присутствии КОН в среде диметилсульфоксида. Новые соединения имеют токсичность LD уо 400-1000 мг/кг, терапевтический ин- деке по усилению наркоза 5-500 при эффективной дозе 10-200 мг/кг, а по обезболивающему действию 6,7-24,2 и 43-200 мг/кг соответственно, причем все они обладают антиаритмическим действием. Ингибирование аконитина при дозе 0,5-4 мг/кг (внутривенно) составляет 35,3-86,2%. В целом их активность лучше известных аналогов - мепробамата, парацетамо- : ла и лидокаина. 3 с.п. ф-лы, 4 табл. (Л со ел со sj 4;:


| СТЕРЖНЕВАЯ СМЕСЬ | 0 |
|
SU162298A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Способ получения оксимэфиров, их солей или их четвертичных аммониевых солей | 1976 |
|
SU633472A3 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1987-11-23—Публикация
1984-02-08—Подача