Изобретение относится к области биотехнологии и молекулярной биологии и касается получения ДНК-полимераз из вируса миелобластоза птиц путем хроматографического выделения ДНК-полимеразы, которая может быть использована в биохимических исследованиях и генной инженерии.
Целью изобретения является повышение активности выделяемого фермента и его стабильности при последующем хранении.
Способ заключается в следующем.
Вирусную суспензию обрабатывают лизирующей смесью с последующим центрифугированием и хроматографией полученного раствора на ДЕАЕ- и КМ-целлюлозе в присутствии диизопропилфторфосфата в концентрации 10-4-10-5 М.
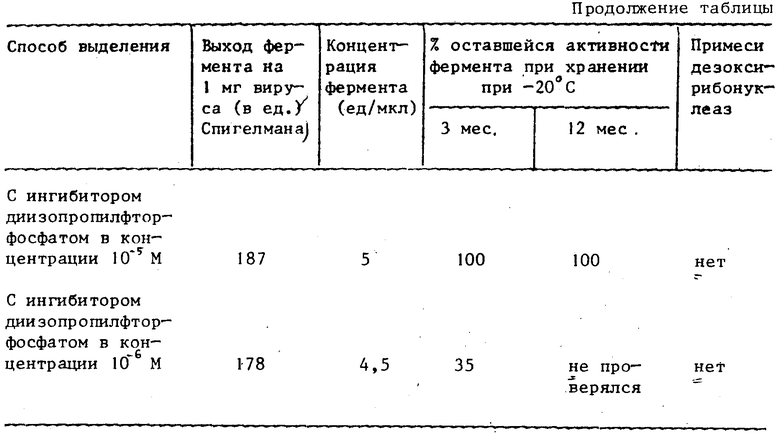
Использование на стадии хроматографирования неспецифического ингибитора протеаз более широкого спектра действия - диизопропилфторфосфата - приводит к резкому падению гидролиза протеазами целевого фермента, вследствие этого к уменьшению образования нуклеаз, увеличению активности фермента и стабильности его при хранении при -20оС в течение 12 мес.
П р и м е р 1. Выделение и очистку ревертазы проводят из 40 мг вируса птичьего миелобластоза. Вирус в объеме 6 мл разрушают добавлением лизирующей смеси: 1 мл 10% тритона Х-100, 0,6 мл 15% дезоксихолата натрия, 3 мл 4М раствора KCl. Смесь инкубируют 20 мин при 0оС, центрифугируют при 12000 об/мин, в течение 20 мин. Надосадочную жидкость разбавляют до 100 мл 10 мМ калий-фосфатным буфером (рН 7,5), содержащим 2 мМ дитиотрейтола (ДТТ), 0,2% тритона Х-100, 10-5 М диизопропилфторфосфата, 10% глицерина (буфер А), и наносят на колонку с ДЕАЕ-целлюлозой размером 0,9х10 см, уравновешенную тем же буфером. Колонку промывают 50 мл буфера А. Элюцию проводят 0,3 М калий-фосфатным буфером с теми же добавками. Активные фракции (активность определяют по Спигелману) объединяют, разбавляют в 7 раз буфером А и наносят на колонку с КМ-целлюлозой размером 0,9 х 6 см, уравновешенную буфером А. Колонку промывают 30 мл буфера А, элюируют линейным градиентом фосфата калия от 0 до 0,3 М в том же буфере. Активные фракции объединяют и помещают в диализный мешок. Диализ проводят в течение 12 ч против 0,2 М калий-фосфатного буфера, содержащего 2 мМ ДТТ, 0,2% тритона Х-100, 50% глицерина при 4оС.
Активность полученного фермента 5 ед/мкл (по Спигелману). Общее количество 7500 ед. Фермент не содержит нуклеазных примесей и сохраняет 100% ферментативную активность при хранении при -20оС в течение 12 мес.
П р и м е р 2. Выделение в очистку ревертазы проводят из 45 мг вируса птичьего миелобластоза. Вирус в объеме 6 мл разрушают добавлением лизирующей смеси: 1 мл 10% тритона Х-100, 0,6 мл 15% дезоксихолата натрия, 3 мл 4 М раствора KCl. Смесь инкубируют 20 мин при 0оС, центрифугируют при 12000 об/мин в течение 20 мин. Надосадочную жидкость разбавляют до 100 мл 10 мМ калийфосфатным буфером (рН 7,5), содержащим 2 мМ дитиотрейтола (ДТТ), 0,2% тритона Х-100, 10-4 М диизопропилфторфосфата, 10% глицерина (буфер В), и наносят на колонку с ДЕАЕ-целлюлозой размером 0,9 х 10 см, уравновешенную тем же буфером. Колонку промывают 50 мл буфера В, элюцию проводят 0,3 М калий-фосфатным буфером с теми же добавками. Активные фракции (по Спигелману) объединяют, разбавляют в 7 раз буфером В и наносят на колонку с КМ-целлюлозой размером 0,9 х 6 см, уравновешенную буфером В. Колонку промывают 30 мл буфера В, элюируют линейным градиентом фосфата калия от 0 до 0,3 М в том же буфере. Активные фракции объединяют и помещают в диализный мешок. Диализ проводят в течение 12 ч против 0,2 М калий-фосфатного буфера, содержащего 2 мМ ДТТ, 0,2% тритона Х-100, 50% глицерина при 4оС.
Активность полученного фермента 5 ед/мкл (по Спигелману). Общее количество 8235 ед. Фермент не содержит нуклеазных примесей и сохраняет 100% ферментативную активность при хранении при -20оС в течение 12 мес.
П р и м е р 3. Выделение и очистку ревертазы проводят из 50 мг вируса птичьего миелобластоза. Вирус в объеме 6 мл разрушают добавлением лизирующей смеси: 1 мл 10% тритона Х-100, 0,6 мл 15% дезоксихолата натрия, 3 мл 4 М раствора KCl. Смесь инкубируют 20 мин при 0оС, центрифугируют при 12000 об/мин в течение 20 мин. Надосадочную жидкость разбавляют до 100 мл 10 мМ калий-фосфатным буфером (рН 7,5), содержащим 2 мМ дитиотрейтола (ДТТ), 0,2% тритона Х-100, 10-4 М диизопропилфторфосфата, 10% глицерина (буфер С), и наносят на колонку с ДЕАЕ-целлюлозой размером 0,9 х 10 см, уравновешенную тем же буфером. Колонку промывают 50 мл буфера С, элюацию проводят 0,3М калий-фосфатным буфером с теми же добавками. Активные фракции (по Спигелману) объединяют, разбавляют в 7 раз буфером С и наносят на колонку с КМ-целлюлозой размером 0,9 х 6 см, уравновешенную буфером С. Колонку промывают 30 мл буфера С, элюируют линейным градиентом фосфата калия от 0 до 0,3 М в том же буфере. Активные фракции объединяют и помещают в диализный мешок.
Диализ проводят в течение 12 ч против 0,2 М калий-фосфатного буфера, содержащего 2 мМ ДТТ, 0,2% тритона Х-100, 50% глицерина при 4оС.
Активность полученного фермента 4,5 ед/мкл (по Спигелману). Общее количество 8000 ед. Фермент не содержит нуклеазных примесей и сохраняет 35% ферментативной активности при хранении при -20оС в течение 3 мес.
Сопоставительные данные по влиянию ингибиторов протеаз на процесс выделения ДНК-полимераз представлены в таблице.
Как видно из таблицы, полученный предлагаемым способом препарат фермента имеет концентрацию около 5 ед/мкл, не теряет активности во время хранения при -20оС в течение 12 мес, а также не содержит ДНКазных примесей, что было показано инкубацией фермента с одноцепочечной ДНК фага М13. (56) Ставерская О. В. , Добровольская Г. Н. , Кавсан В. М. , Ищенко И. Д. , Рындич А. В. , Назаренко Л. А. Выделение обратной транскриптазы вируса миелобластоза птиц в препаративных количествах - Украинский биохимический журнал, 1984, т. 56, N 5, с. 503-514.
Тhach R. E. , Robertson D. L. , Bacnziger N. L. , Dobbertin D. C. "Reverse Transcriptase Associated with A-type Particles from Murine Myeloma Cells", In: Symp. Quant. Biol. , Cold. Spring Harbour Labaratories, N-Y. , 1974, v. 39, part 2, p. 963-973.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛАЗЫ E. CO R11 | 1984 |
|
SU1311253A1 |
| Штамм бактерий BacILLUS SтеаRотнеRморнILUS - продуцент рестриктазы BSS TI | 1989 |
|
SU1686000A1 |
| Способ выделения РНК-зависимой ДНК-полимеразы | 1982 |
|
SU1108105A1 |
| Способ получения эндонуклеазы рестрикции Fок1 из FLаVовастеRIUм океаNокоIтеS | 1986 |
|
SU1406160A1 |
| Способ получения фермента днк-цитозин-метилазы 1 из клеток | 1977 |
|
SU737443A1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК РТТG КM2, КОДИРУЮЩАЯ СИНТЕЗ РЕКОМБИНАНТНОГО ИММУННОГО ИНТЕРФЕРОНА ЧЕЛОВЕКА, ШТАММ ESCHERICHIA COLI T3G - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ИММУННОГО ИНТЕРФЕРОНА ЧЕЛОВЕКА И СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ИММУННОГО ИНТЕРФЕРОНА ЧЕЛОВЕКА | 1996 |
|
RU2097428C1 |
| Штамм SтRертомYсеS FRaDIae - продуцент рестриктазы SFR I | 1988 |
|
SU1645300A1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ФАКТОРА НЕКРОЗА ОПУХОЛЕЙ-БЕТА ЧЕЛОВЕКА | 1997 |
|
RU2132385C1 |
| Рекомбинантная плазмидная ДНК, кодирующая кор-антиген вируса гепатита В, лишенный ДНК 39С концевых аминокислот с экспонированным на его поверхности эпитопом pRe S @ / 1-55/, способ ее конструирования и штамм бактерий ЕSснеRIснIа coLI - продуцент кор-антигена, вируса гепатита В, лишенного 39 С концевых аминокислот с экспонированным на его поверхности эпитопом pRe S @ /1-55/ | 1989 |
|
SU1713930A1 |
| Штамм бактерий ВRеVIвастеRIUм IммотUм - продуцент эндонуклеазы рестрикции В @ 1 | 1988 |
|
SU1532584A1 |

Изобретение относится к области биотехнологии и молекулярной биологии, в частности к способу получения ДНК-полимераз. Целью предложения является повышение активности выделяемого фермента и его стабильности при последующем хранении. Для получения высокоактивного и стабильного фермента вирусную суспензию лизируют, центрифугируют и проводят хроматографическую очистку продукта на ДЕАЕ- и КМ-целлюлозе в присутствии 10-4-10-5 И диизопропилфторфосфата. Способ позволяет получить фермент, не содержащий примесей нуклеаз, стабильной при хранении при -20С в течение года. 1 табл.
СПОСОБ ВЫДЕЛЕНИЯ РНК-ЗАВИСИМОЙ ДНК-ПОЛИМЕРАЗЫ ИЗ ВИРУСА МИЕЛОБЛАСТОЗА ПТИЦ, предусматривающий добавление к вирусной суспензии лизирующей смеси и ингибиторов протеаз, инкубирование ее, отделение нерастворимого осадка от жидкой фазы с последующим хроматографическим выделением из нее целевого продукта на ДЕАЕ- и КМ-целлюлозе в присутствии ингибиторов, отличающийся тем, что, с целью повышения активности выделяемого фермента и его стабильности при последующем хранении, в качестве ингибитора протеаз используют диизопропилфторфосфат в концентрации 10-4 -10-5 на всех стадиях хроматографического выделения.
Авторы
Даты
1994-01-30—Публикация
1986-02-17—Подача