Изобретение относится к биотехнологии, а именно к области получения иммобилизованных органоидов клетки и ферментов , и может найти применение при получении биокатализаторов, а также в химическом, клиническом и токсикологическом анализе
Целью изобретения является улучшение характеристик препарата для определения моноаминов за счет повышения активности моноаминооксидазы (МАО), механической прочности и антимикробных свойств пленки.
Способ заключается во введении ферментного препарата (гомогената. митохондрий печени) в водный раствор желатина с последующим добавлением террилитина в количестве 1-10 проте- олитических единиц на 1 нп объема суспензии, немедленном нанесении полученной суспензии на нерастворимую подложку, высушивании суспензии на воздухе и обработке полученной пленки глутаровым альдегидом (предпочтительно в течение 3-5 мин). Введение террилитина приводит к частичному
4; со сд оэ
Ь
разрушению митохондриальных мембран, что увеличивает активность моноамино- оксидазы. Кратковременность воздействия террилитина на моноаминооксидазу (до высушивания пленки) позволяет избежать ее инактивации за счет протео- лиза. Способ позволяв получить целевой продукт с улучшенными характеристиками: активность иммобилизованной ю ет 1 цмоль субстрата за 1 мин при моноаминооксидазы возрастает в 1,5 ра- +25 С и рН 7,0,
цикла работы препарат высушивается на воздухе и взвешивается.
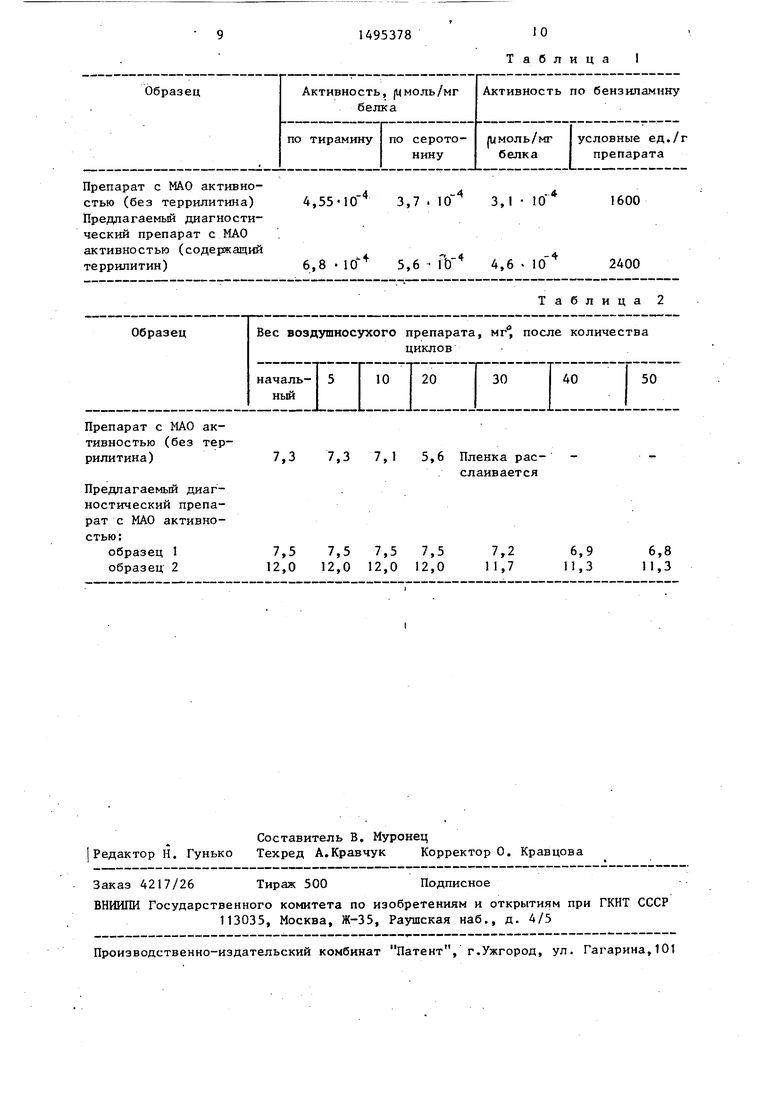
Характеристики препаратов приве ны в табл. 1.
ъ
За единицу протелитической акти ности террилитина принято такое ко личество фермента, которое расщепл
ет 1 цмоль субстрата за 1 мин при +25 С и рН 7,0,
цикла работы препарат высушивается на воздухе и взвешивается.
Характеристики препаратов приведены в табл. 1.
ъ
За единицу протелитической активности террилитина принято такое количество фермента, которое расщепля



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ количественного определения биогенных моноаминов | 1987 |
|
SU1518375A1 |
| Способ получения ферментсодержащих пленок для определения моноаминов | 1987 |
|
SU1564187A1 |
| ИНГИБИТОРЫ МОНОАМИНООКСИДАЗЫ, ЛЕКАРСТВЕННОЕ СРЕДСТВО И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2007 |
|
RU2366430C2 |
| Ингибитор фермента моноаминооксидазы | 1988 |
|
SU1578125A1 |
| Способ получения малатдегидрогеназы из митохондрий головного мозга | 1983 |
|
SU1165402A1 |
| Способ лечения фобий | 1990 |
|
SU1768167A1 |
| Способ выделения моноаминоксидазы | 1983 |
|
SU1165714A1 |
| Способ определения активности моноаминоксидаз в биологическом материале | 1977 |
|
SU739381A1 |
| Способ выделения @ -зависимой супероксиддисмутазы из печени крысы | 1981 |
|
SU979506A1 |
| Способ определения активности моноаминооксидазы | 1987 |
|
SU1521761A1 |
Изобретение относится к биотехнологии, а именно к получению иммобилизованных органоидов клетки и ферментов, и может найти применение при получении биокатализаторов, а также в химическом, клиническом и токсилогическом анализе. Цель изобретения - улучшение характеристик препарата для определения моноаминов за счет повышения активности моноаминооксидазы, механической прочности и антимикробных свойств пленки. Способ заключается во введении ферментного препарата с моноаминооксидазной активностью (гомогенат митохондрий печени) в водный раствор желатина с последующим добавлением террилитина в количестве 1-10 протеолитических единиц на 1 мл суспензии, немедленном нанесении суспензии на нерастворимую подложку, высушивании суспензии на воздухе и обработке полученной пленки в течение 3-5 мин глутаровым альдегидом. Полученный препарат обладает повышенными механической прочностью и антимикробными свойствами, а также в 1,5 раза более высокой активностью моноаминооксидазы. 1 з.п. ф-лы. 2 табл.
за, увеличивается также прочность
пленки и ее бактериостатическое дей- с твие.
Пример 1о 0,2 г желатина помещают в стаканчик с 4 мл дистиллированной воды для набухания. Затем туда же добавляют 5 мл 0,05 М фосфатного буфера с рН 7,4 и нагревают при
желатина. Далее раствор охлаждают до +25 С и вносят в него 2 г гомогёната
перемешивании до полного растворения 20 могената митохондрий печени свиньи
в 0,07 М фосфатном буфере, рН 7,4. К полученной суспензии добавляют 1 мл митохондрий печени свиньи в 0,05 Мраствора террилитина в воде с активфосфатном буфере, рН 7,4 и перемети- ностью 100 ПЕ, т„е. 10 ПЕ/1 мл. Не- вают. К полученной суспензии добавля-25 медленно из полученной смеси 5 мл вы- ют 1 мл раствора террилитина в воделивают на алюминиевую фольгу, 5 мл с суммарной активностью 10 протеоли- тических единиц (ПЕ), т.е. 1 ПЕ/1 мл состава. Смесь немедленно порциями по 5 мл выпивают на ровную поверхность 30 случаях обрабатывают 5 мл 8%-ного полиэтиленовой пластины и высушивают раствора ГА в течение 5 мин. После в потоке воздуха в течение 1,5 ч. Су- этого избыт.ок раствора ГА сливают, а . хую пленку желатина обрабатываютгшенки многократно промьшают водой
10 мл 2%-ного раствора глутаровогои 0,05 М фосфатным буфером, рН 7,5.
альдегида (ГА) в течение 3 мин. После 35 Капроновую сетку с желатиновой плен- этого избыток раствора ГА сливают, акой осторожно снимают с поверхности
пленку многократно прогфшают водой икафеля. Обе пленки высушивают в по0,05 М фосфатным буфером, рН 7,4, итоке воздуха при +25 с в течение 1 ч.
на кафель, на котором натянута капроновая сетка, и сушат в потоке воздуха в течение 2 ч. Сухую пленку в обоих
снова высушивают в потоке воздуха в течение 1 ч. Сухие препараты хранят в холодильнике при 4-10 С. МАО активность диагностического препарата:
6,83-10 Е/мг белка (по тирамину);
5,60-10 Е/мг белка (по серотони -4
Е/мг белка (по бензилну);
4,65-10
амину).
Активность препарата сохраняется в течение года.
Кактериостатическая активность. Задержка роста культуры кишечной палочки в пробах с пленкой полученного диагностического препарата по сравнению с контролем 86J4%.
Механическая сохранность в условиях многократного использования: препарат стабилен в 50 циклах работы Один цикл работы пять дней по пять определений в день. После каждого
Пример 2. О,7 г желатина обливают 4 мл дистиллированной воды дпя набухания. Затем туда же добавля- ют 5 мл 0,05 М фосфатного буфера, рН 7,4 и нагревают при перемешивании до полного растворения желатина. Далее раствор охлаждают до +20 С и вносят в него при перемешивании 1 г гослучаях обрабатывают 5 мл 8%-ного раствора ГА в течение 5 мин. После этого избыт.ок раствора ГА сливают, а гшенки многократно промьшают водой
на кафель, на котором натянута капроновая сетка, и сушат в потоке воздуха в течение 2 ч. Сухую пленку в обоих
-4
10 Е/мг белка (по тирамину);
,-Ч
Е/мг белка (по серото5
МА.О активность диагностического 0 препарата:
6,85
5,50 10
Нину); 4
4,52 10 Е/мг белка (по бензипамину).
Бактериостатическая активность. Задержка роста культуры кишечной папочки в пробах с пленкой диагностического препарата по сравнению с контролем без пленки 86,0%. Препарат стабилен в 50 циклах работы.
Пример 3. 0,5г желатина обливают 4 мл дистиллированной воды дпя набухания. Затем туда же добавляют 5 мл 0,05 М фосфатного буфера.
0
5
рН 7,4 и нагревают при перемешивании до полного растворения желатина. Далее раствор охлаждают до +20 С и вносят в него при перемешивании 2 г гомогената митохондрий печени крысы (АО мг белка) в 0,07 М фосфатном буфере, рН 7,4. К полученному раствору добавляют 1 мл раствора террилитина в воде с сзт марной активностью 50 ПЕ, т.е. 5 ПЕ/1 мл. Смесь перемешивают и по 5 мл выливают на полимерную мембрану и капроновую сетку, натянутую на кафель, и высушивают в потоке воздуха при 20 С в течение 1 ч. Сухую пленку обрабатывают 5 мл 8%-ного раствора ГА в течение 4 мин. После этого избыток ГА сливают, а пленку многократно промьгоают водой и 0,05 М фосфатным буфером, рН 7,5. Капроновую сетку с желатиновой пленкой снимают с поверхности кафеля. Пленки высушивают в потоке воздуха при +25 С в течение 1ч.
МАО активность полученного диагностического препарата:
6,7610 Е/мг белка (по тирамину);
5, Е/мг белка (по серотонину);
,
4,71-10 Е/мг белка (по бензил- амину)
Бактериостатическая активность. Задержка роста культуры кишечной палочки в пробах с пленкой диагностического препарата по сравнению с контролем без пленки 85,9%.
Препарат стабилен в 50 циклах работы.
Пример 4. 0,8 г желатина обливают 9 мл воды для набухания. Затем добавляют 10 мл фосфатного бу- .фера с рН 7,4 и нагревают при перемешивании до растворения. Далее раствор охлаждают до +20 С и вносят в него при перемешивании 2 г суспензии митохондрий в фосфатном буфере, рН 7,4. К полученному раствору добавляют 1 мл раствора террилитина в воде с суммарной концентрацией 10 ПЕ т.е. 0,5 ПЕ/1 мл. Смесь перемешивают, и выливают на полимерной мембране, Высушивают в потоке воздуха в течени 1 ч. Сухую пленку обрабатывают раствором ГА в течение 2 мин и промьшают аналогично примеру 3..
МАО активность диагностического препарата.
4,55-1 О Е/мг белка (по тирамиру) 3,7 10 Е/мг белка (по серото- нину) ; .
3, 1 10 Е/мг белка (по бензил- амину) .
0
0
5
0
5
0
5
0
5
Бактериостати {еская активность. Задержка роста культуры в пробах с пленкой по сравнению с контролем 74,2%.
. Препарат пригоден дпя 20 циклов работы.
Пример 5. 1,6г желатина обливают 15,6 мл воды для набухания. Затем добавляют 20 мл 0,05 М фосфатного буфера, рН 7,4 и нагревают при перемешивании до растворения. Далее раствор охлаждают до +20 С и вносят в него при перемешивании 4 г суспензии митохондрий в фосфатном буфере, рН 7,4. К полученному раствору добавляют 4,4 мл раствора террилитина в воде с суммарной протеолитической активностью, равной 440 единиц, т.е. 11 ПЕ/1 мл. Смесь перемешивают и выливают на нерастворимую подложку. Высушива от в потоке воздуха в течение 1 ч. Сухую пленку обрабатывают 8%-ным раствором ГА в течение 6 мин и промывают.
МАО активность диагностического препарата:
4,50-10 Е/мг белка (по тирамину);
3,7210 Е/мг белка (по серотонину);
3,2 10 Е/мг белка (по бензил- амину) .
Бактериостатическая активность. Задержка роста культуры в пробах с пленкой по сравнению с контролем 67,8%.
Пленка имеет жесткую структуру, что проявляется как повьптенная хрупкость. Препарат расслаивается после 18-20 циклов работы.
Пример 6. 0,2г желатина помещают в пробирку с 2 мл дистиллированной воды для набухания. Затем туда же добавляют I мл стандартного фосфатного буфера, рН 6,86, нагревают, перемешивая до кипения, при котором происходит полное растворение желатина. Далее раствор охлаждают до +35 С и вносят в него при перемешивании 0,4 мл гомогената митохондрий печени крыс (таких же, как в примере 3). Добавляют 1,6 мл раствора террилитина с активностью 50 ПЕ, Затем в пробирку со смесью опускают чувствительную головку электрода, слегка подсушивают (I мин) его в струе воздуха при +20 С и снова опускают в раствор. Оперлцип повторяют 5 раз, после чего высуглшают пленку
на поверхности электрода в струе воздуха в течение 15 мин при +20°С. Далее электрод с сухой пленкой опускают на 4 мин в 5%-ный раствор глутаро вого альдегида. Затем вынимают электрод и тщательно промывают его водой и фосфатным буфером, Поверхность электрода с планкой высушивают в струе воздуха при +20°С в течен-ие 15 мин и хранят в холодипьнике при 4-10°С. Дпя градуировки и в период работы электрод вымачивают в фосфатном буфере при рН 7,4 и хранят в нем в холодильнике,
МАО активность электрода: 6,7 10 Е/мг белка (по триамину) 5,45-10 Е/мг белка (по серото- нину);
4,0 1- 10 Е/мг белка (по бензил- амину).
МАО активность электрода сохраняется в течение года. Желатиновая пленка на электроде механически стабильна в условиях использования и может применяться для определения моноаминов в течение года. Предел обнаружения 4,55 10 моль/л.
Бактериостатическая характеристика пленки на электроде аналогична примерам 1, 2, 3.
МАО активность диагностического препарата в Е/мг, т,е. ju моль/мг белка по всем субстратам определяют электрохимическим методом с помощью электрода с газовым затвором по количеству образовавшегося йродукта ферментативной реакции - аммиака, )
Бактериостатическую активность определяют и рассчитывают по задержке роста культуры кишечной палочки в присутствии желатиновых пленок без добавок, с- добавкой МАО и с добавкой МАО и террилитина. Для этих проб по сравнению с контролем задержка составляет соответственно 57, 75 и 86%.
- Предел обнаружения моноаминов с помощью ползгченных препаратов МАО
составляет 4,410 - 4,5510 М.
Значительно возрастает активность целевого продукта по всем субстратам за счет добавления террилитина при иммобилизации (табл, 1), Улучшаются также механические свойства пленок,
Q что позволяет длительно использовать их для проведения анализа.
Таким образом, использование предлагаемого способа позволяет получить препараты пленок для определения мо5 ноаминов с улучшенными характеристиками за .счет повьш1ения активности МАО в 1,5 раза, увеличения механической прочности пленок и их антимикробного действия (от 75 до 86%).
0 Формула изобретений
0
ю щ и и с я
тем, что обработку
пленки глутаровым альдегидом ведут в течение 3-5 мин.
Препарат с МАО активностью (без террилитина) Предлагаемый диагностический препарат с МАО активностью (содержащий террилитин)
4,55 «10 3,7 . Ю 3,1 10
6,8 10 5,6 ft) 4,6 . 10
- 4
Препарат с МАО активностью (без террилитина )
Предлагаемый диагностический препарат с МАО активностью:
7,3 7,3 7,1 5,6 Пленка расслаивается
Таблица
1600
- 4
2400
Таблица 2
| Авторское свидетельство СССР № 1146322, кл | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Durand Р | |||
| et al | |||
| An enzyme electrode Biophys | |||
| - Biochim Acta, 1978, 527 | |||
| ПАРОПЕРЕГРЕВАТЕЛЬ ДЛЯ ЛОКОМОБИЛЬНЫХ КОТЛОВ | 1912 |
|
SU277A1 |
Авторы
Даты
1989-07-23—Публикация
1987-07-27—Подача