Изобретение относится к производным З-фтор-З-дезокси-В-арабинофура- нрзы формулы
СбНдСНгО- /0.(I)
№ oV оснз
vr
F
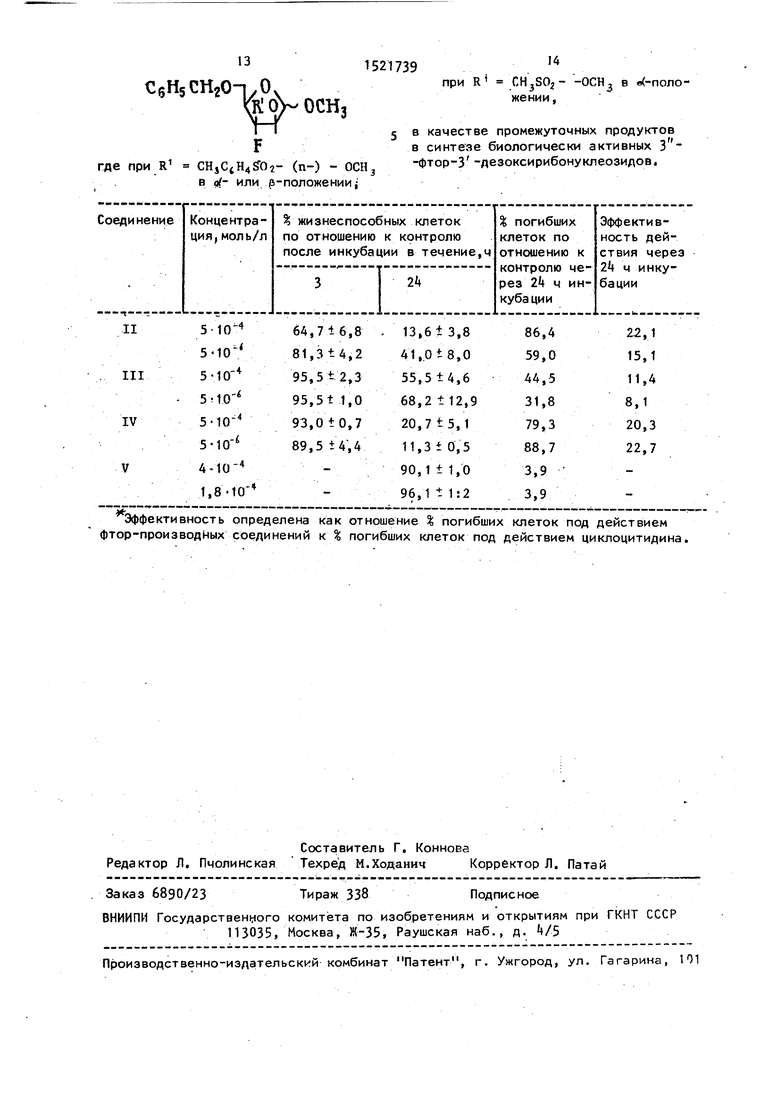
а)о;-ОСНз, R CHjCgH4SOQ-(n-),
б)|5-ОСНз, R CH3CtH4SO -(n-),
в)о(-ОСН,, R CH,SO, являющимся промежуточными продуктами в синтезе новых 3 -фтор-З -дезокси- рибонуклеозидов, проявляющих цитостатическую активность, большую, чем известный структурный аналог - цикло- цитидин.
Цель изобретения - получение новых фторпроизводных арабинофуранозы в качестве- промежуточных соединений в синтезе 3 -фтор-З -дезокси-0-и-рибо- фуранозидов аденина (II), гуанина (Ш) и цитозина (IV).
Пример 1. Метил 5-0-бензил- -3-фтор-3-дезокси-2-0-п-толуолсульфо- нил-о -Б-арабинофураноза (la).
К раствору 2,9 г (11,31 ммоль) метил 5-0- бензил-3-фтор-3-дезокси- -с -В-арабинофуранозы в 50 мл пиридина добавляют 5,0 г (26,22 ммоль)
ел ю
-а
оо со
n-толуолсульфохлорида, реакционную смесь перемешивают 28 ч при . Реакционную смесь выливают-при перемешивании в смесь льда и 5 -ного раствора бикарбоната натрия (200 мл) и экстрагируют хлороформом (3x50 мл). Органический слой отделяют и промывают 2н. раствором соляной кислоты (100мл), водой (200 мл), сушат безводным сульфатом натрия и упаривают досуха. Остаток хроматографируют на силикагеле L 100/400 (200 см). Колонку элюируют смесью растворителей гексан - этил - ацетат с постепенным увеличением содержания этилаце- тата в соотношении от 17:3 до (общий обгем 1 л). Фракции, содержащие соединение (la), собирают и упаривают. Получают 4,32 г (93) метил- -5-0-бензил-3 Фтор-3-дезокси-2-0-п- -толуолсульфонил -с -В-арабинофуранозы (la) в виде сиропа.
Спектр ПНР (CDClj), f, ч.на млн; 7,80-7,28 (м., 9Н, ароматика);,9б (с., 1Н, H-1)i 4,86 (м., 1Н, Н-3); 4,83 (м., 1Н, Н-2); 4,56 (м., 2Н, CH,jPh)j 4,26 (м., 1Н, Н-4); 3,61 (м. 2Н, H-5,5)i 3,30 (с., ЗН, ОСИ з)-,2,45 (с., ЗН, СНзРЬ).
Найдено,%: С 58,18; И 5,52$ 87,60 F 4,70.
С,,Н,зО,8Г Вычислено,%; 7,81; F 4,62. Пример
С 58,52; И 5,64;
40
.45
, Метил 5 0-бензил- -З-фтор-З-дезокси-2-О-п-толуолсульфо- нил-/з-В-арабинофураноза : (16).
К раствору 3,9 г (15,21 ммоль) метил 5-0-бензил-3-фтор-3-дезокси-/з- -D-арабинофуранозы в 50 мл пиридина добавляют 6,0 г (31,47 ммоль) п-то- луолсульфонилхлорида и перемешивают 48 ч при . Реакционную смесь при перемешивании выливают в смесь лед - вода (300 мл). Выпавший осадок отфиль- тровывают, промывают водой (100 мл), растворяют в 300 мл хлороформа, про- мывают 5%-ным раствором бикарбоната натрия (2x50 мл), водой (50 мл) и сушат безводным сульфатом натрия. Рас- 50 твор упаривают досуха, остаток кристаллизуют из этанола. Получают 5,54 г (88,7) метил 5-0-бензил-З-фтор-З- дезокси-2-0-п-толуолсульфонил-р В-арабинофуранозы (16), т.пл. С
Спектр ПМР (CDClj), f , ч. на млн: 7,85-7,25 (м. , 9Н, ароматика)) 5,06 (м., 1Н, Н-3)-, 4,95 (м., 1.Н, Н-2);
55
0
5
о
5
0
0
5
0
С 58,52., и 3,64-,
4,85 (м., 1Н, Н-1), 4,55 (м., 2Н, );4,19 (м., 1Н, Н-4); 3,57 (д.д. 1Н, Н-5); 3,53 (д.д., 1Н, H-5)j 3,25, с., ЗН, ОСНз); 2,45 (с., ЗН, CHjPh).
Найдено,%: С 58,30; Н 5,60; S 7,71j F 4,58.
С
Вычислено,%: S 7,81; F 4,62.
Пример 3. Метил 5-0-бензил- -З-фтор-З-дезокси-2-О-метаносульфо- нил-(/-В-арабинофураноза (1в).
К раствору 3,2 г (12,48 ммоль) метил З-О-бензил-З-фтор -З-дезокси-о - -D-арабинофуранозы в 50 мл пиридина добавляют 1,95мл (2,88 г, 25,13ммоль) метансульфохлорида и реакционную смесь перемешивают 3 сут при 20°С. В реакционную смесь добавляют 5,0 г льда, выдерживают 40 мин и упаривают раствор досуха. Остаток растворяют в 200 мл хлороформа, промывают 5%-ным раствором бикарбоната натрия (50 мл), водой (2x100 мл) и сушат безводным сульфатом натрия. Раствор упаривают досуха, остаток хроматографируют на силикагеле L 100/400 (150 см). Колонку элюируют смесью растворителей гексан - этилацетат с постепенным увеличением содержания этилацетата в соотношении от 99:1 до 1:1 (общий об-ьем 1 л). Фракции, содержащие сое- .динение (1в), собирают и упаривают. Получают 3,86 (92,4%) метил 5-0-бен- зил-3 фтор-3-дезокси-2-0-метансуль- фонил-о -В-арабинофуранозы в виде сиропа.
Спектр ПМР (CDCla), , ч. на млн: 7,39-7,28 (м., 5Н, ароматика); 5,11 (с., 1Н, H-1)j 5,08 (м., 1Н, Н-3) 5,06 (м., 1Н, Н-2); 4,61 (м., 2Н, CHaPh); 4,28 (м., 1Н, Н-4), 3,72 (д., 2Н, Н-5,5)-, 3,44 (с., ЗН, OCHJ ,3,00 (с., ЗН, CHjSOi).
Найдено,%: С 50,60-, Н 5,80-, 89,70,- F 5,52.
С„Н ,906SF
Вычислено,; D 9,58; F 5,68.
С 50,29; Н 5,72;
Полученные производные (la-в) используются в синтезе 3 -фтор-З -дез- оксирибонуклеозидов (II)- (IV), включающем 6 стадий: замещение тозилат (мезилат)-иона бензоат-анионом, удаление бензильной защиты, бензоилиро- вание 5 -гидроксила, замещение ацетат-ионом метоксигруппы у гликозид 152
ного атома углерода, гликозилирова- ние и деблокирование.
Пример Ц. Метил 5-П-6енэил- -2-0-бензоил-3-фтор-3 дезокси-с/-В- -рибофураноза (V).
К раствору 0, г (1,07 ммоль) метил-5-0-бензил-3-фтор-3-дезокси-2- -О-п-толуолсульфонил-о -В-арабинофу- ранозы (la) в 10 мл диметилсульфоксида добавляют 6,6 г (12,67 ммоль) комплекса дибензо-18-краун-6 с бензоа- том калия (1:1) и кипятят 7 ч. Реакционную смесь выливают в 100 мл воды и.экстрагируют хлороформом (3 х X 50 мл). Органический слой отделяют, сушат безводным сульфатом натрия и упаривают. Остаток хроматографи- руют на силикагеле L ЮОДОО ОЗОсм) Колонку элюируют смесью растворите- лей гексан - этилацетат с постепенным увеличением содержания этилаце- тата от 1 д о 25 об.|. Фракции, содержащие соединение (V), собирают и упаривают. Получают 0,13 г (33,6%) ме- тил 5-0-бензил-2-0-бензоил-3-фтор- -3 дезокси-о -В-рибофуранозы (V) в виде сиропа.
Найдено,: С 66,70) Н 5,90j F5,17.
CjoH i05F
Вычислено,%: С 66,65; Н 5,S7i F 5,27.
Из 0,66 г (1,97 ммоль) метил -бёнзил-3-фтор-3 дезокси-2-Огметан- сульфонил-(/-В-арабинофуранозы (Ш) и смеси 1,0 г комплекса (1:1) дибен зо-18-краун-6 с бензоатом калия (1,92 ммоль) и 1,0 г (6,2 -ммоль) бензоата калия в 10 мл диметидсуль- фоксида аналогично получают 0,15 г (20%) соединения (V).
Пример 5. Метил 5 0-бензил- -2-0-бензоил-3 фтор-3 дезокси-р-В- -рибофураноза (VI).
Смесь 1,23 г (2,99 ммоль) метил 5-0-бензил-3 фтор-3-дезокси-2-0-п- -толуолсульфонйл-/ь-в-арабинофуранозы (16), t,5 г (28,08 ммоль) бензоата калия и Ц,5 г (8,64 ммоль) дибензо- -Т8-круана-6 в А5 мл сухого диметил- сульфоксида нагревают при С k ч. Раствор охлаждают, добавляют к нему 30 мл воды и экстрагируют хлороформом (Vx50 мл). Органический сло отделяют, сушат безводным сульфатом натрия и упаривают досуха. Остаток растворяют в 5 мл пиридина, добавляют 0,2 МП (0,24 г, 1,7 ммоль) хлористого бензоила и выдерживают смесь
при 20 С 2 ч. К раствору добавляют 0,2 мл метанола и спустя 10 мин раствор упаривают. Остаток хроматографи- руют на силикагеле L 100/400 (120 см Колонку элюируют смесью растворителей гексан - этилацетат . с постепенным увеличением содержания этилацета- та от 10 до .50 об.%. Фракции, содержащие соединение (VI), собирают и упаривают. Получают 0,8 г (75%) метил 5-0-бензил-2-0-бензоил-3 фтор-3-дез- окси-р-В-рибофуранозы (VI) в виде сиропа, мол. масса ЗбО,38.
Найдено,%: С 66,80/ Н 5,91; F5,05
Cj.HjiOfF
д 5 0 5
0
0
5
0
5
Вычислено,%: С 66,65; Н 5,87 F 5,27.
Пример 6. Метил 2-0-бензоил- -3-фтор-3 дезокси- -В-рибофураноза (VII).
К раствору 1,7 г (4,71 ммоль) метил 5-0-бензил-2-0-бензоил-3-фтор- -З-дезокси-с -В-рибофуранозы (V) добавляют 1,7 г 10%-ного Pd/C и перемешивают смесь в атмосфере водорода 72 ч. Катализатор отфильтровывают, пpoмывaюt спиртом (50 мл), спиртовой раствор упаривают. Остаток кристаллизуют из эфира.
Получают 1,24 г (97,2%) соединения (VII), т.пл. 104-105 С.
Найдено,%: С 57,60j Н 5,49; F7,06
C,,H,sOsF
Вычислено,%: С 57,77; Н 5,59; F 7,02.
Пример 7. Метил 2-0-бензоил- -З Фтор-З-дезокси-р-В-рибофураноза (VIII).
Из 1,36 г (3,77 ммоль) метил 5-0- -бензил-2-бензоил-З-фтор-З-дезокси- -р-В-рибофуранозы (VI) и 1,4 г10%-но- го Pd/C аналогично получают 1,0 г (98%) соединения (VIII) в виде сиропа.
Найдено,%: С 57,80; Н 5,65; F6,98.
CijH ijOjF
Вычислено,%: С 57,77-, Н 5,59; F 7,02.
Пример 8. Метил 2,5-ди-О- -бензоил-3-фтор-3 дезокси-/з-В-рибо- фураноза (IX)..
К раствору 1,3 г (4,81 ммоль) метил 2-0-бензоил-3 Фтор-3-дезокси-а(- -В-рибофуранозы (VII) в 12 МП пиридина при охлаждении до и перемешивании добавляют по каплям 1,3 мл (1,58 г, 11,23 ммоль) хлористого бензоила и перемешивают 10 ч при .
Реакционную смесь выливают в 50 г смеси лед - вода и экстрагируют хлороформом (3x100 мл). Органический слой отделяют, сушат безводным сульфатом натрия и упаривают. Остаток хроматографируют на силикагеле L ЮОАОО (200 см). Колонку элю- ируют смесью растворителей гексан - этилацетат с постепеннь1м увеличением содержания этилацетата до 25 об.|. Фракции, содержащие соединение (IX), собирают и упаривают.
Получают 1,7 г (Э,%) метил .,5- -ди-0-бензоил-3-фтор-3 дезокси о - -D-рибофуранозы (iX) в виде сиропа.
Найдено,%: С ,36; Н 5,01; F5,02
C,H,,0,F
Вычислено,: С 6, 16; Н 5,11; F 5,07.
Пример 9. Метил 2,5-ди-О- -бензоил-3-фтор-3-дезокси-/1-В-рибо- фураноза (Х).
Из 1,0 г (3,7 ммоль) метил 2-0- -бензоил-З-фтор-З-дезокси-р-В-рибр- фуранозы (VIII) и 0,5 t мл (0,65 г, ,6 ммоль) бензоилхлорида получают 1,12 г (81,1%) соединения (Х) в виде сиропа.
Найдено,:. С б ,АО, Н 5,21-,F4,98
Вычислено,: С б , 16; Н 5,11} F 5,07.
Пример 10. 1-0-Ацетил-2,5- -ди-О-бензоил-З-фтор-З-дезокси-О-ри- бофураноза (XI).
К раствору 1,3 г (3,7 ммоль) ме- тил 2,5-ди-О-бензоил-З-фтор-З-дез- окси-о -В-рибофуранозы (IX) в смеси 10 мл уксусной кислоты и 1,2 мл ук- сусного ангидрида добавляют 0,7 мл концентрированной серной кислоты и перемешивают 20 ч при 20 С. Реакционную смесь выливают в насыщенный раствор бикарбоната натрия (100 мл), содержащего 50 г льда. Смесь экстрагируют хлороформом (2x1 on мл), органический слой отделяют, сушат безводным сульфатом натрия и упаривают. Остаток хроматографируют на силикагеле L 100/400 (100 см). Колонку элюиру- ют смесью растворителей гексан - эфир с постепенным увеличением содержания эфира от 1 до 50 об.. Фракции, содежащие соединение (XI), объединяют и упаривают.
Получают 1,31 г (93,8%) 1-0-ацет тил-2,5-Ди-0-бензоил-3-фтор-3-дезокс-В-рибофуранозь1-(XI) в виде сиропа.
Найдено,%: С 62,80; Н i,8l-, F4,69.
C,,H,gO,F
Вычислено,%: С 62,68; Н 4,75; F 4,72.
Из 0,5 г (1,33 ммоль) метил 2,5- -ди-0-бензоил-3-фтор-3-дезокси-/з-В- -рибофуранозы (XI) действием смеси 2,1 мл уксусного ангидрида, 3,0 мл уксусной кислоты и 0,03 мл концентрированной серной кислоты получают 0,8 г (89,3%) соединения (XI).
Пример 11. 6-Н-Бензоил-9- -(2 ,5 -ди-0-бензойл-3 -фтор-3 -дез- окси-р-0-рибофуранозил)аденин (XII).
Смесь 1,7 г С,22 ммоль) соединения (XI), 1,6 г (А,17 ммоль) бис-три- метилсилильного производного 6-Н-бен- зоиладенина и 0,97 мл (2,16 г 8,31 ммоль) четыреххлористого олова в 26 мл дихлорэтана перемешивают 18ч при 20°С. Реакционную смесь разбавляют хлороформом до 70 мл и выливают в АО мл насыщенного раствора бикарбоната натрия. Водный слой отделяют и промывают; хлороформом (2x30 мл). Хлороформные растворы объединяют сушат безводным сульфатом натрия и упаривают. Остаток хроматографируют на силикагеле L lOO/itOO (300 см). Колонку элюируют смесью растворителей хлороформ:метаНОЛ с постепенным увеличением содержания метанола от 2 до 12 об.%. Фракции, содержащие нукле- озидный продукт, собирают и упаривают.
Получают 1,99 г (82%) б-Н-бензоил- -9-(2,5 -ДИ-0-бензоил-3 -фтор-3 -дезокси- -В-рибофуранозил)аденина (XII) в виде сиропа.
Уф-спектр (lg), А,л«кс нм: 232 (i,56)-, 280 (А,30).
Найдено,%: С 63,90; Н i,00j N 11,90i F 3,21.
C3,H 4}NsOiFI
Вычислено,%: С 64,G2j Н A,15; N 12,04, F 3,26.
Пример 12. 2-Н-Ацетил-9- -(2 ,5 -ди-О-бензоил-3 -фтор-3 -дез- окси- ;ггО-рибоАуранозил)гуанин (XIII).
Смесь.1,7 г (А,32 ммоль) соединения (XI) и триметилсилильного производного 2,9-N,N -ацетилгу нина, полученного {сипячением в течение 3 ч из 1,2 г (5,10 ммоль) 2,9-N,N -аце- тилгуанина в 30 мл гексаметилдисила- зана, 0,91 мл (1,11 г 5,0 ммоль) три- метилсилилтрифторметансульфоната в 50 мл дихлорэтана кипятят 1,5 ч. Ре91521739
акционную смесь упаривают, остаток
10
НайденоД; С 60,8П; Н i, N9,30; F 4,10. - С зИгвМзО Р
Вычислено,%: С 60,92; Н A, N 9,26} F 4,18.
Пример И. 9-(3 -Фтор-3 - -дезокси-/з-П-рибофуранозил)аденин(11). Растворяют 1,1 г (1,89 ммоль) сое- 10 динения (XII) в 20 МП 0,3 М раствора метилата натрия в метаноле, выдерживают при 20°С 10 ч. Реакционную смесь нейтрализуют добавлением 0,3 мл уксусной кислоты и упаривают досуха.
ацетил-9-(2,5-ди-0-бензоил-3-фтор- is Остаток хроматографируют на ионооб- 3-дезокси-р-В-рибофуранозил)гуанинаменной смоле Дауэкс 1x8 (ОН -форма,,
растворяют в 150 мл хлороформа и промывают насыщенным раствором бикарбоната натрия (2x50 мл), водой (2x50 мл). Хлороформный раствор сушат безводным сульфатом натрия, упаривают и хроматографируют на силикагеле L40/100 (200 см). Колонку элюируют смесью хлороформ - метанол с постепенным увеличением содержания метанола от 2 до 6 об.. Фракции, содержащие нук- леозидный продукт, собирают и упаривают. Получают 1,44 г (62,2%) 2-N(XIII) в виде аморфного порошка (после высаждения в гексан), т.пл. 133- 138 С.
УФ-спектр (IgE), мо-кс нм: 23 (4,53); 259 (4,32); 280 (4,22).
Найдено,: С 58,40; Н 3,97j N 12,87} F 3,28.
C,i.,,;0,F
Вычислено,: G 58,31; Н. i,1it; N 13,07; F 3,54.
П p и м e р 13. 1 -(2,5-Ди-0-бен- зрил-3-Фтор-3-дезокси-/з-В-рибофура- нозил) цитозин (XIV),
Смесь 1,1 г (2,73 ммоль) соединения (Х1) и трйметилсил ильного про-: изводного цитозина, полученного кипячением 0,3 г (2,70 ммоль) цитози 300 см) .Колонку элюируют сначала водой, затем смесью метанол - вода ). Фракции, содержащие нуклеозидный про- 20 дукт, собирают и упаривают. Остаток кристаллизуют из этанола.
Получают 0,38 г (7,6) 9-(3 -фтор- -З -дезокси-р -В-рибофуранрзил)аденина (II), т.пл. 211-2124.„ 25 УФ-спектр (IgS), ,« нм: 260 (Мб).
ПМР (DMCO-di), с/ , ч. на млн: 8,37 . и 8,15 (с., по 1Н, Н-2 и H-8)i 7, «О . -(у.с., 2Н, m-i); 5,96 (д., 1Н, Н-1 , 30 Л, г 7,8 Гц), 5,92 (д., 1Н, 2-ОН, Лсн,г 6,0 Гц); 5,78 (д.д., 1Н, 5- -ОН, .s- JOH.S 6,0 Tu)v 5,10 (д.д., 1Н, Н-3 , J3M - ,2 Гц,Л,, 54,6 Гц); 4,95 (м., 1Н, Н-2 ,
ПМР (DMCO-di), с/ , ч. на млн: 8,37 . и 8,15 (с., по 1Н, Н-2 и H-8)i 7, «О . -(у.с., 2Н, m-i); 5,96 (д., 1Н, Н-1 , 30 Л, г 7,8 Гц), 5,92 (д., 1Н, 2-ОН, Лсн,г 6,0 Гц); 5,78 (д.д., 1Н, 5- -ОН, .s- JOH.S 6,0 Tu)v 5,10 (д.д., 1Н, Н-3 , J3M - ,2 Гц,Л,, 54,6 Гц); 4,95 (м., 1Н, Н-2 ,
на в смеси 1,0 мл триметил.хлорсила- „ j,, 7,8 ГЦ, Гц,
..- .. с л ..„ ,..„,.... 26,4 Гц); 4,31 {м., 1Н, H-4 ,
J4 , 3,0 Гц, J4 ,F 27,6 Гц);
на и 5,0 мл гексаметилдисилазана в течение 2 ч, 0,5 мл (0,61 г, 2,70 ммоль) триметилсилилтрифторме- т.ансульфоната в.25 мл дихлорэтана кипятят 1--Ч. Раствор упаривают, остаток растворяют в 100 мл хлороформа и промывают насыщенным раствором бикарбоната натрия (2x30 мл) и водой (2x20 мл). Хлороформный раствор су
3,68 (м., 2Н, Н-5 , Н-5 ).
Найдено,: С 44,66, Н 4,521 N 40 25,80; F 7,08.
C,,H,,Ns03F
Вычислено,: С 44,61; Н 4,49; N 26,01v F 7,05.
П РИМ ер 15, 9(3 -фтор- Ъ - шат безводным сульфатом натрия, упа- дд -дезокси-(5-0-рибофуранозил)гуанин ривают и хроматографируют на силика-(III).
геле L 40/100 (150 см). Колонку элюируют смесью хлороформ - метанол с постепенным увеличением содержания метанола от 2 до 10 об.%. фракции, содержащие нуклеозидный продукт.
Растворяют 1,2 г (2,24 ммоль) соединения (XIII) в 50 мл насыщенного при раствора аммиака в метаноле, 50 выдерживают 3 сут при и упаривают. Остаток растирают с 50 мл этанола, осадок отфильтровывают и кристаллизуют из воды.
собирают и упаривают. Остаток кристаллизуют из этанола.
Получают 0,92 г (75,П) 1-(2,5Растворяют 1,2 г (2,24 ммоль) со единения (XIII) в 50 мл насыщенного при раствора аммиака в метаноле 50 выдерживают 3 сут при и упарив ют. Остаток растирают с 50 мл этано ла, осадок отфильтровывают и криста лизуют из воды.
Получают 0,45 г (70,4%) 9-(3 -ди-О-бензоил-З-фтор-З-дезокси-р-В--фтор-3 -дезокси-/ -0-рибоФуранозил)
-рибофуранозил)цитозина (XIV), т.пл 203-205°С.etcи
УФ-спектр (Igf), Д . нм: 231 (4,69); 269 (4,13).
гуанина (III), т.пл. 289-291 0 (с разл.)..
УФ-спектр (IgC), А макс , нм: 253 (4,l4)i 269 плечо (4,00).
10
Остаток хроматографируют на ионооб- менной смоле Дауэкс 1x8 (ОН -форма,,
300 см) .Колонку элюируют сначала водой, затем смесью метанол - вода ). Фракции, содержащие нуклеозидный про- дукт, собирают и упаривают. Остаток кристаллизуют из этанола.
Получают 0,38 г (7,6) 9-(3 -фтор- -З -дезокси-р -В-рибофуранрзил)аденина (II), т.пл. 211-2124.„ УФ-спектр (IgS), ,« нм: 260 (Мб).
ПМР (DMCO-di), с/ , ч. на млн: 8,37 и 8,15 (с., по 1Н, Н-2 и H-8)i 7, «О -(у.с., 2Н, m-i); 5,96 (д., 1Н, Н-1 , Л, г 7,8 Гц), 5,92 (д., 1Н, 2-ОН, Лсн,г 6,0 Гц); 5,78 (д.д., 1Н, 5- -ОН, .s- JOH.S 6,0 Tu)v 5,10 (д.д., 1Н, Н-3 , J3M - ,2 Гц,Л,, 54,6 Гц); 4,95 (м., 1Н, Н-2 ,
j,, 7,8 ГЦ, Гц,
J4 , 3,0 Гц, J4 ,F 27,6
3,68 (м., 2Н, Н-5 , Н-5 ).
Найдено,: С 44,66, Н 4,5 25,80; F 7,08.
Растворяют 1,2 г (2,24 ммоль) соединения (XIII) в 50 мл насыщенного при раствора аммиака в метаноле, выдерживают 3 сут при и упаривают. Остаток растирают с 50 мл этанола, осадок отфильтровывают и кристаллизуют из воды.
Получают 0,45 г (70,4%) 9-(3 -фтор-3 -дезокси-/ -0-рибоФуранозил)
-фтор-3 -дезокси-/ -0-рибоФуранозил)
гуанина (III), т.пл. 289-291 0 (с разл.)..
УФ-спектр (IgC), А макс , нм: 253 (4,l4)i 269 плечо (4,00).
Спектр ПНР (DMCO-d), t/ , ч.на млн: 7,91 (с., 1Н, Н-8); 6,Б (с., 2Н, NHj); 5,88 (У.С., 1Н, З -ОН); 5,75 (д., 1Н, Н-1 , ,.,2 8,4 Гц) ; 5,2 (У.С., 1Н, 2 -OH)i 5,04 (д.д., 1Н, Н-3 . Л ,а 4,8 Гц) J3.,F 54,0 Гц), «,75 (м., 1Н, Н-2, J24/ 8,i Гц, Jj.p- 25,2 Гц); г,20 (м., 2Н, ,
J 4,S 3,7 Гц, J4 ,F
3,Й (д., 2Н, Н-5 , Н-5).
Найдено,: С 42,30 Н 1,17} N 24,25; F 6,56.
меняли в концентрациях 5 10 5 1П моль/л в виде раствора.в 0, ном растворе хлорида натрия, В контрольных опытах вместо растворовi препарата в пробирки добавляли раствор хлорида натрия. После инкубирования в течение 3 и 24 ч в каждом опыте подсчитывали общее количество 27,6 Гц), о леток в 1 мл взвеси, содержание жизнеспособных клеток и отношение его к содержанию жизнеспособных клеток в контрольном опыте. Цифровые данные обрабатывали методом вариационной статистики.
С 42,10v Н 4,24; N 15
.
Вычислено,%: 24,55} F 6,66.
Пример 1б 1-(3 -фтор-3 - -дезокси-д-В-рибофуранозил)цитозин (IV).
неспособных клеток и отношение его к содержанию жизнеспособных клеток в контрольном опыте. Цифровые данны обрабатывали методом вариационной с тистики.
Производное аденозина (II) проя ляло четко выраженный эффект уже че рез 3 ч инкубации, содержание жизне способных клеток по отношению
Растворяют 0,41 г (0,9 ммоль) сое-20 контролю (контроль 100%) соснм: 270 30
динения (XIV) в 30 мл насыщенного при раствора аммиака в метаноле, выдерживают в 2 сут и упаривают. Остаток растирают с 30 мл эфира, отфильтровывают и кристаллизуют из эта- 25 нола.
Получают 0,18 г (81,2%) 1-(3 - -фтор-З -дезокси -/з-В-рибоф ура нозил) цитозина (IV), т.пл. 221-223 С.
УФ-спектр (IgO, Л III (3,92).
Спектр ПНР (DMCO-d), сГ, ч. на млн 7,73 (д., 1Н, Н-6, Js5 7,2 Гц), 7,24;(у.с., 1H,NH)J 7,18 (у.с., 1Н, NH)} 5,92 (д., 1Н, Н-Г , J,. .,,7,8 Гц), 5,78 (д., 1Н, Н-5, Jsi 7, 2 Гц)} 4,92 (д.д, 1Н, Н-3 , J3 ,,8 Гц, Jj .F 54,6 Гц.), 4,25 (м., 1Н, Н-2 , J3 , 7,8 Гц, Jj 3 -.S Гц, J2 r 24,0 Гц); 4,13 (м., 1Н, Н-4 , j, J4 . 3,6 Гц, J4 ,F 27,0 Гц); 3,55(м., 2Н, Н-5 , Н-5).
Найдено,%: С 43,97} Н 4,88; N 17,01} F 7,57.
,35
40
тавляло 64,7 ± 6,8 и 81,3 ± 4,2% при концентрации препарата соответственно. Спустя 24 ч инкубации эффект подавления лейкозных клеток L-1210 наблюдался при де ствии всех фторсодержащих нуклеози дов.
Данные представлены в Таблице, Известный противолейкозный препа рат - циклоцитидин (V) начинал проявлять цитостатический эффект толь после 24 ч инкубации, а содержание погибших лейкозных клеток составлял лишь 3,9% по отношению к контролю.
Представленные результаты свидетельствуют о том, что соединения (I (IV) в сравнении с циклоцитидином (IV) в сравнимой концентрации прояв ляют цитостатическое действие быстр (через 3 и 24 ч, а эффективность их действия превосходит эффективность циклоцитидина в 22, 11 и 20 раз -соо ветственно.
Таким образом, 2-сульфонильные производные метил 5 -бензил-3-фтор- -З-дезокси-о/- и (b-D-арабинофуранозы (1а-в) синтезируются из доступных реагентов и могут служить полупроду тами при получении З -фтор-З -дезок сирибонуклеозидов аденина, гуанина и цитозина, обладающих биологической активностью.
CgH.NjO.F
Вычислено,%: С 44,08; И 4,93; N 17,13;- F 7,74.
Цитостатическую активность 9(3 -фтор-3-дезокси-/5-и-рибофура нозил) аденина (II), 9(3-фтор-3-дезокси- -/ь-О-рибофуранозил)гуанина (III) и 1-(3-фтор-3-дезокси-/з-В-рибофурано- зил)цитозина (IV) исследовали в системе in vitro при инкубировании суспендированной культуры асцитичес- кой лейкозной опухоли штамма лимфо- лейкоза L-1210. В каждом опыте исползовали по 2 мл взвеси, содержащей 1-10 лейкозных клеток. Препарат применяли в концентрациях 5 10 5 1П моль/л в виде раствора.в 0, ном растворе хлорида натрия, В контрольных опытах вместо растворов препарата в пробирки добавляли раствор хлорида натрия. После инкубирования в течение 3 и 24 ч в каждом опыте подсчитывали общее количество леток в 1 мл взвеси, содержание жизнеспособных клеток и отношение его к содержанию жизнеспособных клеток в контрольном опыте. Цифровые данные обрабатывали методом вариационной сттистики.
Производное аденозина (II) проявляло четко выраженный эффект уже через 3 ч инкубации, содержание жизнеспособных клеток по отношению
контролю (контроль 100%) сос
тавляло 64,7 ± 6,8 и 81,3 ± 4,2% при концентрации препарата 5 соответственно. Спустя 24 ч инкубации эффект подавления лейкозных клеток L-1210 наблюдался при действии всех фторсодержащих нуклеози- дов.
Данные представлены в Таблице, Известный противолейкозный препарат - циклоцитидин (V) начинал проявлять цитостатический эффект только после 24 ч инкубации, а содержание погибших лейкозных клеток составляло лишь 3,9% по отношению к контролю.
Представленные результаты свидетельствуют о том, что соединения (II)- (IV) в сравнении с циклоцитидином (IV) в сравнимой концентрации проявляют цитостатическое действие быстрее (через 3 и 24 ч, а эффективность их действия превосходит эффективность циклоцитидина в 22, 11 и 20 раз -соответственно.
Таким образом, 2-сульфонильные производные метил 5 -бензил-3-фтор- -З-дезокси-о/- и (b-D-арабинофуранозы (1а-в) синтезируются из доступных реагентов и могут служить полупродуктами при получении З -фтор-З -дезок- сирибонуклеозидов аденина, гуанина и цитозина, обладающих биологической активностью.
55
о р м у л а
изобретения
2-0-Сульфонаты метил 5-О-бензил -З-фтор-З-дезокси-В-арабинозы формулы
13
СбНдСНгО-п/О.
1(ОШз
F
где при R СН4С4Н4 02- (п-) - ОСН .в 11 или (5-положении
1521739
14
при R -ОСН в «(-положении ,
5 в качестве промежуточных продуктов в синтезе биологически активных -фтор-3 -дезоксирибонуклеозидов.





Изобретение касается сахаров, в частности метил-5-О-бензил-3-фтор-3-дезокси-2-О-п-толуолсульфонил-α-Д-арабинофуранозы, метил-5-О-бензил-3-фтор-3-дезокси-2-О-п-толуолсульфонил-β-Д-арабинозы и метил-5-О-бензил-3-фтор-3-дезокси-2-О-метансульфонил-α-Д-арабинофуранозы-промежуточных продуктов для синтеза новых биологически активных 3Ъ-фтор-3Ъ-дезоксирибонуклеозидов, проявляющих цитостатическую активность. Цель - создание новых промежуточных веществ указанного назначения. Синтез ведут реакцией метил-5-О-бензил-3-фтор-3-дезокси-α (илиβ)-Д-арабинофуранозы с п-толуол (или метан)сульфохлоридом в среде пиридина. Выход, %
т.пл., °С
брутто-ф-ла: а) 93
сироп
C20H29O6SF
б) 88,7
73-74
C20H23O6SF
в) 92,4
сироп
C14H19O6SF. 1 табл.
Эффективность определена как отношение % погибших клеток под действием фтор-производных соединений к погибших клеток под действием циклоцитидина.
| Kowollik G., Caertner К., Langen P | |||
| Nucleosides of fluorocar- bohydrates | |||
| XIII | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| - J | |||
| Car- bohydr., Nucleosides, nucleotides, 1975, V | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Устройство непрерывного автоматического тормоза с сжатым воздухом | 1921 |
|
SU191A1 |
Авторы
Даты
1989-11-15—Публикация
1987-12-18—Подача