иэводных дипептидов,полученных из D-фенилаланина и D- аргинина. На аффинном сорбенте., синтезированном из аминогексилагарозы и названных пеп- тидов, тромбин адсорбируется существенно сильнее примесей, которые можно вымывать из колонки до десорбции тромбина. Тромбин вымывается в совместных градиентах хлористого натрия и изопропилового спирта.
Пример 1. Синтез аффинных колонок 20 г аминогексилагарозы (приблизительно 65 мл геля) промьшют на стеклянном фипьтре последовательно водой (400 мл), 0,1 М раствором , (200мл), водой (200 мл), переводят в динетипсульфоксид (ДМСО). Для этого гель промьгеают последовательно 26-, 50-, 75- и 100%-ными раст ворами ДМСО по 200 мл. Применяют ДОСО который вьщерживают в течение суток над гранулами КОН и перегоняют под уменьшенным давлением над гранулами КОН, 4 г карбобензоксипроизводного дипептидов В-фенилаланил-В-аргинина или В-аргинил-В-фенилаланина растворяют в 60 мл ДМСО. В полученном растворе суспендируют аминогексилагарозу и прибавляют 4 г дициклогексилкарбо- диимида. Продолжительность проведения реакции при постоянном перемешивании на качалке при комнатной температуре 15 ч. Полученный сорбент промывают на стеклянном фильтре последе- вательно ДМСО, этанолом, 50%-ным этанолом и водой (каждого по 300 мл).
Пример 2. Соответственно примеру 1 синтезируют аффинные сорбенты со следующими лигандами:карбобензокси -В-фенилаланил-В-аргинии и карбобен- зокси-В-аргинип-О-фенилаланин. Полученными сорбентами заполняют колонки размерами 1, см, которые уравновешивают 0,05 М и трис-НС с 0,1 М NaCl.
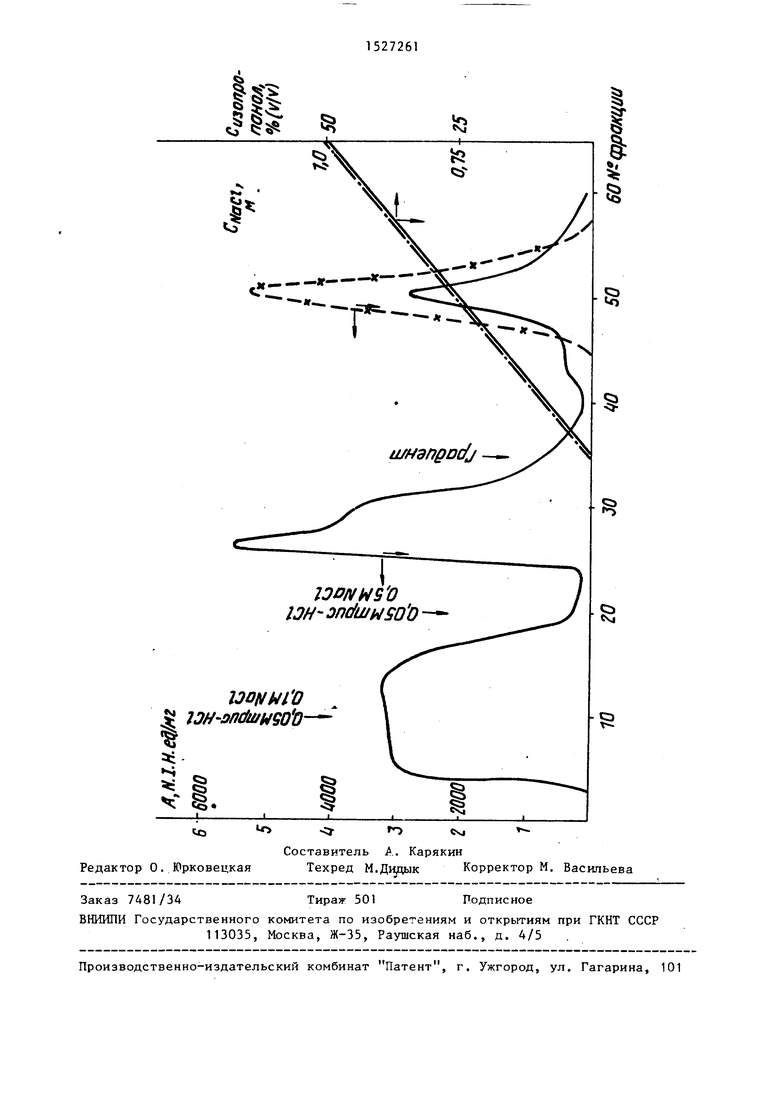
Протромбин получают из плазмы донорской крови исходным из III фракций по Кону. Протромбин активируют добавлением суспензии тромопластина в при- сутствии CaClj при 37 С в течение 30 мин, рН 7,4. Затем нерастворимую часть отделяют иа ультрацентрифуге УАС-25 при 15000 об/мин в течение 20 мии. Полученный раствор диализуют против 0,05 М и трис-НС с 0,1 М NaC рН 8,0 и наносят на колонку. После нанесения пробы колонки промьшают 0,05 М и трис-НС буфером, содержащим 0,5 М NaCl, рН 8,0. Адсорбированный тромбин вымьшают из колонок с совместными градиентами хлористого натрия (0,5-1,0 М) и изопропилового спирта (0-50%) на 100 мл 0,05 М трис-НС с 0,5 М NaC, рН 8,0 и 100 мл 0,05 М трис-НС с 1 ,0 1 NaC в 50%-ном изопропиловом спирте, рН 8,0. Собирают фракции по 6 мл. Ак/ тивность тромбина в первоначальном растворе и во фракциях определяют по скорости свертывания 0,1%-ного раствора фибриногена под действием фермента. В 1 мл раствора фибриногена в 0,001 М трис-НС буфере с 0,15 М NaC, рН 7,4 добавляют 20 мкл исследуемого раствора тромбина и определяют время свертывания.
На чертеже показана калибровочная кривая активности тромбина, которая построена по данным, полученным тромбином с известной активностью.
Фракции, содержащие тромбин, объединяют и определяют оптическую плотность при 280 нм и ферментативную активность. Полученные результаты представлены в табл.1(объем наносимой пробы 50 мл). При расчете содержания тромбина в миллиграмма учитывают, что его 1%-ный раствор имеет при 280 нм оптическую плотность 18,7.
Из табл. 1 видно, что при проведении аффинной хроматографии при комнатной температуре происходит некоторое уменьшение выхода по активности и получаемые препараты тромбина менее активны. Однако их активность превышает активность известных препаратов.
Пример 3. Колонку с размерами 1, см заполняют аффинным сорбентом, синтезированным по примеру 1 и имеющим в качестве пептидного лиганда карбобензокси-В-аргинил-В-фе нилаланин. Колонку уравновешивают 0,05 М и трис-НС буфером с 0,1 М NaC. рН растворов уравновешивания, нанесения пробы и вымывания адсорбированных веществ изменяют в пределах 7,2-8.5. Все операции проводят при комнатной температуре. Перед нанесением пробы из раствора удаляют осадок центрифугированием. Порядок нанесения пробы и элюирование не отличаются от приведенного в примере 2. Объем пика тромбина 24 мл. Результаты разделения представлены в табл.2 (очистка тромбина на аффинной колонк с карбобензокси-В-аргинип-В-апанни- агарозой, объем наносимой пробы 15 мл, исходная активность 2600 N.J.H ед./мл, 9,00).
Из приведенных в табл.2 данных видно, что предлагаемая аффинная колонка позволяет получить высокоактивный препарат тромбина с хорошим выходом лишь в узком интервале рН.
Предлагаемый способ позволяет получать в одну стадию с выходом 90- 99% препарат тромбина с удельной активностью до 6000 N. 1.Н ед./мг.
Сорбенты, используемые при предлагаемом способе, обеспечивают достаточно высокий выход фермента. Ранее для получения тромбина эти сорбенты не использовались.
Предлагаемый способ технологичен, сорбенты можно использовать многократно. Их сорбционные свойства восстанавливаются после промывания колонки градиентом изопропипового спирта от 50 до 0%.
Формула изобретения
Способ получения тромбина из активированной протромбиновой фракции сыворотки крови путем аффинной хроматографии, проводя нанесение пробы в 0,05 М трис-НС1 буфере, содержащем 0,1 М NaCl, с последующей злюцией тромбина, о тличающий- с я тем, что, с целью увеличения выхода и активности целевого продукта, аффинную хроматографию осуществляют при рН 7,9-8,1 на аминогексипагарозе, модифицированной карбобен- зоксипроизводными дипептидов D-феннп- аланил-В-аргинина или. В-аргинил-В- -фенилаланина, проведением после нанесения пробы отмывки сорбента с одновременным удалением балластных белков 0,05 М трис-НС1 буфером, содержащем 0,5 М NaCl, осуществлением элюции тромбина тем же буфером с совместными линейными градиентами хлористого натрия 0,5-1,0 М и изопропи- лового спирта 0-50%.
Таблица 1

| название | год | авторы | номер документа |
|---|---|---|---|
| 5-(N @ -сукцинил-аланил-аланил-пролил-фенилаланил)-аминонафталин-I-(N-пропил) сульфамид в качестве АНСА-субстрата для определения химотрипсина и 5-(N @ -бензилоксикарбонил-аланил-аланил-пролил-фенилаланил)-аминонафталин-I-(N-пропил)сульфамид в качестве полупродукта для его получения | 1990 |
|
SU1771478A3 |
| ПРОИЗВОДНЫЕ АМИНОНАФТАЛИНСУЛЬФАМИДОВ В КАЧЕСТВЕ СУБСТРАТОВ ДЛЯ ОПРЕДЕЛЕНИЯ АКТИВНОГО ПРОТЕИНА С (АПС) | 1991 |
|
RU2013426C1 |
| Способ получения РНК-лигазы | 1979 |
|
SU910762A1 |
| СПОСОБ ДООЧИСТКИ ХИМОПАПАИНА | 1990 |
|
RU2074891C1 |
| Белковая смесь для связывания стероидных гормонов в биологических жидкостях и способ ее получения | 1979 |
|
SU758742A1 |
| Способ выделения ферредоксина | 1985 |
|
SU1255640A1 |
| 5-(Тозилглицил-L-пролил-L-аргинил)аминонафталин-1-метилсульфонамид в качестве АНСА - субстрата для определения тромбина | 1990 |
|
SU1825800A1 |
| Способ очистки трипсина | 1989 |
|
SU1742329A1 |
| Способ получения биоспецифических адсорбентов для выделения фибронектина и коллагеназ | 1986 |
|
SU1419717A1 |
| Способ определения @ -субъединицы фактора роста нервов | 1989 |
|
SU1707540A1 |
Изобретение относится к производству ферментных препаратов, а именно к способу получения тромбина, применяемого в биоорганической химии. Цель изобретения - увеличение выхода и активности целевого продукта. Согласно предлагаемому способу получение тромбина из активированной протромбиновой сыворотки крови проводят методом аффинной хроматографии на аминогексилагарозе, модифицированной карбобензоксипроизводными дипептидов D-фенилаланил-D-аргинина или D-аргинил-D-фенилаланина, осуществляя адсорбцию белков из 0,05 М трис-буфера в присутствии 0,1 М NACL при PH 7,9-8,1, промывая колонку 0,5 М раствором NACL и вымывая адсорбированный тромбин из колонки совместными линейными градиентами хлористого натрия от 0,5 до 1,0 М и изопропилового спирта от 0 до 50% при PH 7,9-8,1. 2 табл., 1 ил.
Таблица 2
Редактор О, Юрковецкая
О ГгоCsj
Составитель А. Карякин Техред М.Двдык
Корректор М. Васильева
| Hatton M.W.C., Regoeczi Е | |||
| The affinity of human, rabbit and bovine thrcmbine for sepharose-lysine and other conjugates.Biochem | |||
| Biophys, Acta, 1976, V.421, p | |||
| ПОДОГРЕВАТЕЛЬ ДЛЯ ИСПОЛЬЗОВАНИЯ ТЕПЛОТЫ ВЫХЛОПНЫХ ГАЗОВ ДЛЯ НАГРЕВА ВОДЫ | 1924 |
|
SU575A1 |
| Yu X.I., Fischer A.M | |||
| et al | |||
| Affinity chromatography of thrombin on modified polystyrene resins.-J.Chro- mat, 1986, v.376, p.429-435 | |||
Авторы
Даты
1989-12-07—Публикация
1988-03-21—Подача