Изобретение относится к усовершенствованному способу получения оптически активной оЈ-арилалкановой кислоты формулы
сн3
jp5r v-CH-COOH СН30 (I)
или ее фармацевтически приемлемой нариевой соли или ее С -С4 алкилового или С|-С4-гидроксиалкилового сложного эфиров, которые обладают биологической активность и применяются в медицине и сельском хозяйстве.
Целью изобретения является упрощение процесса.
Указанная цель достигается обработкой катализирующим агентом оптически активного соединения формулы
О
II
С-СН-СНз Z
снго
(II)
где-Z - оксигруппа, ацетоксигруппа, галоген или группа формулы - ,, где R - С -С -алкил, фенил, незамещенный или замещенный .-алкилом, полученного путем взаимодействия ме- таллорганического соединения формулы
MX
или
СН30
(II), магний или
1 (III)
марганец
цинк;
хлор или бром, ски активным соединением
°
снз-сн-ci
Z
(IV)
имеет указанные значения; галоген или группа
/-N
XJ
ИЛИ
в инертном растворителе при температуре от 0 до -70°С, причем в качестве, кетализирующего агента берут или три-(С1-С4 алкилортоформиат и обработку соединения формулы (II) ведут .в присутствии кислотного катализатора в спиртовом растворителе при темпе
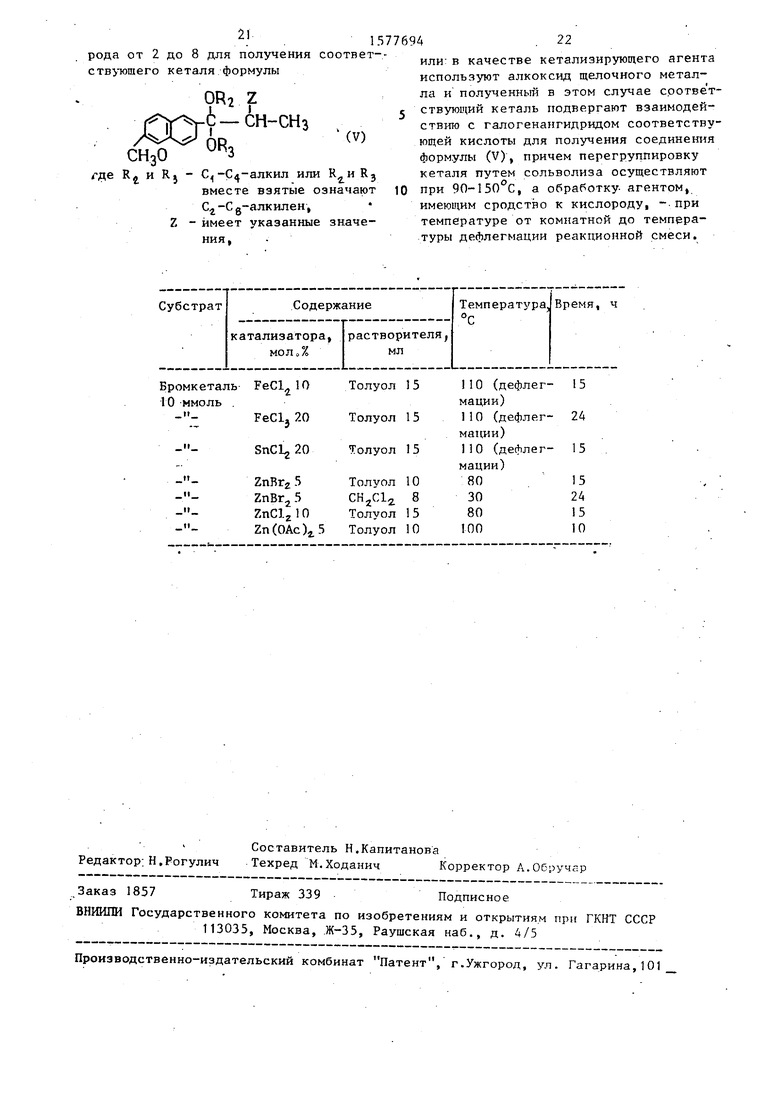
ратуре от 0°С до температуры дефлегмации реакционной смеси, или диатом- ный спирт с числом атомов углерода от 2 до 8 и обработку соединения формулы (II) ведут в инертном растворителе при температуре от 0°С до температуры дефлегмации реакционной смеси, для поручения Соответствующего кеталя формулы
5
СН30
0
5
0
5
5
где
N
0
5
0
С,-П -алкил или R2 и R
вместе взятые означают
Сг-Сд-алкилен; Z имеет указанные значе ния,
или в качестве кеталичирующего агента используют алкоксид щелочного металла и полученный в этом случае соответствующий кеталь подвергают взаимодействию с галогенангидридом соответствующей кислоты для получения соединения формулы (V), причем перегруппировку кеталя путем сольволиза в протеином или полярном апротонном растворителе в присутствии основания осуществляют при 90-)50°С, или лерегруппировку кеталя формулы (V) ведут путем обработки агентом, имеющим сродство к кислороду, в апротонном растворителе при тейпературе от ком-, натной до температуры дефлегмации реакционной смеси.
| Пример 1, 120 г (З)-этиллак- тата и I20 г триэтиламина с перемешиванием растворяют в 500 мл толуола, после чего раствор охлаждают примерно до 10-15°С. Затем в течение ,5 ч с поддержанием этой температуры медленно добавляют 120-г метансульфонилхло- рида. Наблюдается образование триэтил- амингидрохлорида в виде осадка. Раствору затем дают нагреваться до 20°С, после чего его выливают в воду. Водный и органический слои разделяют, а органический слой сушат над сульфатом магния и упаривают. Остаток перегоняют примерно при 110°С под давлением 2 мм рт„ст„ с получением 161 г (S)- этил-2-метансульфонилоксипропионата, проявляющего оптическое вращение
,
Это соединение проявляет
характерный ЯМР-спектр, Ј; 1,28 (триплет, J-2,2); 1,57 (дублет, J-2,3);
3,12 4,23 (квартет, J-2,2); 5,12 (квартет, J-2,3).
Пример 2, Раствор 75 г (S)- этил-2-метансульфонилоксипропионата в 250 мл метанола и 100 мл воды охлаж цают примерно до 15 С, Для поддержания рН до 10,5 медленно добавляют 40%-ный водный раствор гидроокиси натрия. Ввиду того, что реакция про- текает с резким падением значения рН приходится продолжать добавление раствора гидроокиси натрия до того, пока значение рН не начнет падать медленно или в основном не останется постоян- ным. После этого добавляют концентрированную НС1 до достижения рН 1,9. Затем удаляют метанол под пониженным давлением и оставшийся водный слой экстрагируют метиленхлоридом. Полу- ченный органический экстракт выпарл- вают с получением 49 г маслянистой (3)-2-метансульфонилоксипропионовой кислоты с оптическим вращением Г°0г5
-53.3°.
П р и м е р 3. 84,85 г (5)-этил2-метансульфонилоксипропионята растворяют в растворе 180 мл метанола и 80 мл воды. Полученный таким образом раствор охлаждают до -15 С. Затем для поддержания рН около 10,5 или ниже медленно добавляют 35%-ный водный раствор NaOH, Добавление его продолжают до того, пока рН не останется постоянным. После этого в целях под- кисления раствора до рН 1,8 добавляют концентрированную НС1. Потом упа-- ривают метанол под пониженным давлением. Водный слой экстрагируют несколько раз этилацетатом и полученные органические экстракты сушат под сульфатом магния, В результате выпаривания органического экстракта досуха получают 51 г (5)-2-метансульфонилок- сипропионовой кислоты с оптическим вращением в метиленхлориде cl , -54°. Это соединение после кристаллизации из толуола имеет т.пл. 72-75°С и характерные ЯМР-спектры, 0; 1,62 (дублет, J-2,3); 3,09, 5,11 (квартет, J-2,3).
Пример 4. Смесь, содержащую 40 г (8)-2-метансульфонилоксипропио новой кислоты, 32 г тионилхлорида и одну каплю диметилАормамида, нагревают примерно до 50°С, при которой на- блюдается выделение газа. Смесь медленно нагревают до 70 С, которую выдерживают в течение 1 ч. После пере-, гонки при 11 О С под давлением
5 1Q 20
5
5
5
0
5
0
0
1,5 мм рт.ст. получают 31,2 г (S)-2- метансульфонилоксипропионилхлорида с оптическим вращением в метиленхлориде оГ 2t -36,9 . Соединение имеет
о
характерные ЯМР-спектры, 0 : 1,68 (дублет, J-2,3); 3,15, 5,25 (квартет J-2,3).
Пример 5. Поступая, как указано в примере 4, но применяя эквивалентное количество тионилбромида, получают (S)-2-метансульфонилоксипропи- онилбромид.
Пример 6. Поступая, как указано в примере 1, но применяя эквивалентное количество р толуолеульфо- нилхлорида, нагревая смесь 8 ч при 60°С и поступая затем, как указано в примерах 3 и 4, получают (S)-2-p- толуолсульфонилоксипропионилхлорид. Это соединение проявляет оптическое вращение c(J2 -32° в хлороформе и характерные ЯМР-спектры, S: 1,8 (триг-, .плет, J-2,2); 1,A8 (дублет, J-2); 2,45, 4,13 (квартет, J-2,2); 4,96 (квартет, J-2); 7,28-8,03 (мульти- плет),
Пример 7. Заменяя метансуль- фонилхлорид по примеру 1 соответствую- щим количеством бензолсульфонилхло- рида и работая сначала по примеру 1 с нагревом при 30-40°С в течение 5-6 ч и после этого по примерам 3 и 4 соответственно, получают (8)-2-бензолсуль- фонилоксипропионилхлорид.
Пример 8, Используя соответствующее количество (П)-этиллактата и работая по примеру 1 и потом по примерам 2 и 4, получают (И)-2-метан- сульфонилоксипропионилхлорид.
Пример 9. 0г 2-бром-6-мет- оксинафталина, растворенного в 40 мл тетрагидрофурана (ТГФ), медленно добавляют к 3,6 г металлического магния при температуре дефлегмации ТГФ (около 60-62 С). По завершении добавления смесь перемешивают при темпера- .туре дефлегмации в течение около 1 ч- после чего избыточный магний отфильт- ровывают„ В результате получают раствор соединения Гриньяра - (6-меток- си-2-нафтил)-бромида магния в ТФГ.
Пример 10. Раствор (6-мет- окси-2-нафтил)-бромида магния,, полученного в примере 9, медленно добавляют к 8 г (8)-2-метансульйонилокси- пропионилхлорида, растворенного в 40 мл ТГФ, охлажденного до -iO°C, и
выдерживают температуру смеси на уровне около
реакционной Смесь
40°Г.
перемешивают еще 1 ч при этой температуре, затем ее выливают в 200 мл 5%-ной хлористоводородной кислоты. Затем к реакционной смеси добавляют 100 мл этилового эфира. Осадок отфильтровывают и промывают 30 мл ледяного этилового эфира с получением 6,46 г (8)-2-метансульфонилокси-1- (6-метокси-2-нафтил)-пропан-1-она с т.пл. 149-151 С и оптическим вращением в хлороформе -33°. Это соединение имеет характерные ЯМР-спект- ры в дейтерохлороформе, б : 1,65 (дублет, J-2,1); 3,10, 3,9, 6,17 (квар- тет, J-2,1); 8,55-7,10 (мультиплет).
Пример 11. Применяя эквивалентное количество (8)-2-р-толуолт сульфонилоксипропионилхлорида в прие ме по примеру 10 с проведением реак- ции сочетания при -78 С, получают (8)-1-(6-метокси-2-наЛтил)-2-р-толуол- сульфонилоксипропан-1-он, т.пл. 117- 119°C,VJ25 +24.2° в хлороформе. (Это соединение имеет характерные ЯМР-спектры, S: 1,67 (дублет, J-2,2); 2,37, 3,98, 5,92 (квартет, J-2,2); 7,14-8,44 (мультиплет), , Пример 12. Применяя эквива- шентное количество (8)-2-бензолсуль- фонилоксипропионилхлорида в приеме по примеру 10, получают (8)-2-бензол- сульфонилокси-1-(6-метокси-2-нафтил)- пропан-1-он,
, Пример 13. Применяя эквива- лентное количество (К)-2-метансуль- фонилоксипропионилхлорида в приеме по примеру 10, получают (К.)т-2-метан сульфонилокси-1-(6-метокси-2-нафтил)- пропан-1-он.
Пример 14. Применяя эквивалентное количество (К)-2-р-толуолсуль фонилоксипропионилхлорида в приеме по
примеру 10, получают (К)-1-(6-мет- окси-2-нафтил)-2-р-толуолсульфонил- г оксипропан-1-он.
Пример 15 Используя соответствующее количество (К)-2-бенэолсульфонилоксипропионилхлорида в способе по примеру 10, получают (К)-2-бензол- сульфонилокси-1-(6-метокси-2-нафтил)- пропан-1-он
Пример 16. Взвесь 4,6 г (8)-2-метансульфонилокси-1-(6-меток си-2-нафтил)-пропан-1-она в 50 мл ме- танола обрабатывают 50 г триметилорто формиата и 2 г концентрированной серной кислоты. Затем полученную смесь нагревают примерно до 55°С и выдерживают при этой температуре в течение 15 ч. Смесь затем охлаждают и выливают в водный раствор бикарбоната натрия и экстрагируют с 120 мл диэти- лового эфира. Потом органический слой отделяют, сушат сульфатом магния и отфильтровывают. Путем упаривания эфира под пониженным давлением получают 4,8 г (8)-1,1-диметокси-1-(6-метокси- 2-нафтил)-проп-2-ил-метансульфоната с т.пл о П2-115°С, оптическим вращением -23,9° (С-1, хлороформ) и ЯМР-спектрами в дейтерохлороформе, 6: 9,0 (дублет, J-2); 6,85, 6,70, 6,61, 6,07, 4,89 (квартет, J-2); 1,99 2,88 (мультиплет).
Пример 17, К раствору 7 г ацетата натрия D 50 мл уксусной кислоты добавляют 3 г (8)-1,1-диметокси- 1-(6-метокси-2-нафтил)-проп-2-ил-ме- тансульфоната. Потом полученную смесь нагревают до 110 С в течение полутора часов и выливают в 300 мл воды. Полученный осадок фильтруют и промывают метанолом с получением (8)-метил- 2-(6-метокси-2-нафтил)-пропиона- та с т.пл, Р5-87°С и оптическим вращением +65,4° (С-1, хлороформ) , Вещество имеет оптическую чистоту примерно в 92%.
Пример 18. Применяя соответствующее количество (8)-1-(6-мет- ок с и-2-нафтил)-2-р-толуолс ульфонил- оксипропан-1-она по примеру 16 получают (8)-1,-диметокси-1-(6-метокси- 2-нафтил)-проп-2-ил-р-толуольсуль- фонат. Обрабатывая это вещество, как указано в примере 17, получают (8)- метил-2-(6-метокси-2-нафтил)-пропио нат„
Пример 19. Применяя соответствующее количество (8)-2-бензолсуль- фонилокси-1-(6-ме.токси- 2-нафтил) -пропан- 1-она по примеру 16 и работая, как там указано, получают (8)-1,1-ди- метокси-1-(6-метоксит2-нафтил)-проп- -2-ил-бензолсульфонат, Отрабатывая это вещество, как указано в примере 17, получают (8)-метил-2-(6-метокси- 2-нафтил)-пропионат.
Пример 20. (К)-2-метансульфонилокси-1-(6-метокси-2-нафтил)-пропан- 1 -он, полученный в примере 13, обрабатывают 1,5 М избытком раствора метоксида натрия в метаноле. Смесь затем перемешивают 1 ч при комнатной температуре, после чего при 50°С отгоняют метанол в ротационном выпарном
аппарате до тех пор, пока не удалено 80% метанола. Полученную в результате реакционную смесь резко охлаждают в воде и экстрагируют метиленхлори дом. Затем отделяют органический слой сушат над сульфатом магния и выпаривают под пониженным давлением с получением (S)-l,1-диметокси-(6-метокси- 2-нафтил)-пропан-2-ола. Это вещество затем растворяют в метиленхлориде, содержащем триэтиламин, реакционную смесь охлаждают до /v5°C и с выдерживанием температуры в пределах 5-10 С медленно добавляют один эквивалент метансульфонилхлорида. По завершении добавления метансульфонилхлорида смес перемешивают еще полчаса. После этого для удаления кристаллов триэтиламин- гидрохлорида отфильтровывают раствср, а фильтрат выливают в воду. Отделяют органический слой и высушивают сульфатом магния„ После выпаривания органического слоя под пониженным давлением получают (S)-I,1-диметокси- - (6-метокси-2-нафтил)-проп 2-ил-метан- сульфонат. Вещество обрабатывают, как указано в примере 17, после чего получают (8)-метил-2-(6-метокси-2-наф- тил)-пропионат„
Пример 21. Заменяя (8)-2-ме тансульфонилоксипропионилхлорид в примере 10 эквивалентным количеством (S)-2-хлорпропионилхлорида, (S)- 2- бромпропионилхлорида, (К)-2-хлорпро пионилхлорида и (К)-2-бромпропионил хлорида соответственно, и работая, как указано в примере 10, получают соответственно: (8)-2-хлор-1-(6-меток- си- 2-нафтил) -пропан- 1-он; (5).-2-бром- -(6-метокси-2-нафтил)-пропан-1-он; (К)-2-хлор-1-(6-метокси-2-нафтил)- пропан-1-он и (К)-2-бром-1-(6-меток- си-2-нафтил)-пропан-1-он.
Пример 22. (5)-2-хлор-1 , 1-г- диэтокси-1-(6-мгтокси-2-нафтил)-пропан.
Смесь (5)-2-хлор-1-(6-метокси-2- .нафтил)-пропанона (10 г, 40,2 ммоль), триэтилового ортоформиата (20 г. 135 ммоль), серной кислоты (0,4 г, 4,1 ммопь) и 50 мл абсолютного этанола нагревают при 45-58 С в течение 4 ч. После охлаждения полученный раствор выливают в водный раствор карбо- ната натрия и экстрагируют 70 мл ме- тиленхлорида. Раствор метиленхлорида сушат над сульфатом магния и растворитель выпаривают с получением (S)-215
20
JQ 30
0
5
хлор-1,1-диэтокси-1-(6-метокси-2-нафтил) -пропана Р виде масла.
(3)-2-хлор-1,1-диметокси-1 - (6- метокси-2-нафтил)-пропан.
Смесь (5)-2-хлор-1т(6-метоксн- 2-нафтил)-пропанона (10 г, 40,2 ммоль) триметилового ортоформиата (14,3 г, 135 ммоль), серной кислоты (0,4 г, 4,1 ммоль) и 50 мл метанола нагревают при 45-48°С в течение 4 ч. После охлаждения полученный раствор выливают в водный раствор карбоната натрия и экстрагируют 70 мл метиленхлорида. Раствор метиленхлорида сушат над сульфатом магния и растворитель выпаривают с получением (8)-2-хлор-1,1-диметокси- 1 -(6-метокси-2-нафтил)-пропана в виде масла.
(5)-этиленацеталь-2-хлор-1-(6-мет- окси-2-нафтил)-пропан-1-она,
Смесь (Я)-2-хлор-1-(6-метокси-2- нафтил)-пропан-I-она (8 г, 32, 2 ммоль), этиленгликоля (42 г, 677 ммоль), мо- 25 ногидрата р-толуолсульфоновой кислоты (1,3 г, 6,8 ммоль) и толуола (65 мл) нагревают с обратным холодильником, и слой РОДНОГО раствора этиленгликоля удаляют с помощью сепаратора типа Дина-Старка. Для завершения реакции необходимо прибавить этиленгликоль. По завершении реакции реакционную смесь охлаждают и ее прибавляют к водному раствору карбоната натрия с сильным перемешиванием. Слои разделяют, и слой толуола сушат над сульфатом магния и испаряют с получением (S)- этиленгликоля-2-хлор-1-(6-метокси-2- нафтил)-пропан-1-она.
(5)-пропиленацеталь-2-хлор-1-(6- метокси-2-нафтил)-пропан-1-она.
Смесь (5)-2-хлор-1-(6-метокси-2нафтил)-пропан-1-она (Юг, 40, 2 ммоль) 1,3-пропандиола (28 г, 368 ммоль), моногидрата р-толуолсульфоновой кислоты (1,6 г, 8,4 ммоль) и 85 мл толуола нагревают до температуры дефлегмации.
Воду удаляют с помощью сепаратора типа Дина-Старка до получения теорети-- . ческого количества. Реакционную смесь охлаждают и прибавляют к водному раствору карбоната натрия с сильным перемешиванием. Слои разделяют, и раствор толуола сушат над сульфатом магния. В результате выпаривания раствора получают (S)-пропиленацеталь-2-хлор-1- (6-метокси-2-нафтил)-пропан-1-она. (S)l,2-диметилэтиленацеталь 2 хлор1-(6-метокси-2-нафтил j-пропан- -она.
35
40
5
11
Смесь (S)-2-хлор-1-(6-метокси-2157769412
Пример 24, (S)-l,1-диметокнафтил)-пропан-1-она (Юг, 40,2 ммоль) си-1-(6-метокси-2-нафтил)-пропан-2- 2,3-бутандиола (33,2 г, 368 ммоль), ол. моногидрата р-толуолсульфоновой кислоты (1,6 г, 8,4 ммоль) -и 85 мл толу10
15
30
ола нагревают до температуры дефлегмации. Воду удаляют с помощью сепаратот- ра типа Дина-Старка до получения теоретического количества (примерно че- рез 8 ч). Реакционную смесь обрабатывают, как описано в предыдущем примере, с получением (S)-l,2-диметил- зтиленацеталя-2-хлор-1-(6-метокси- 2-нафтил)-пропан-1-она.
С помощью тех же самых процедур с применением следующих количеств бромкетона, можно -осуществить катали- зацию :(5)-2-бром-1-(6-метокси-2-наф- тил)-пропан-1-она, (5)-2-бром-1,1-ди- 20 метокси-(6-метокси-2-нафтил)-пропан; бромкетон. (Н,8 г, 40,2 ммоль); (3)-2-бром-1,1-диэтокси-(6-метокси- 2-нафтил)-пропан : бромкетон (11,8 г, 40,1 ммоль); (8)-этиленацеталь-2- 25 бром-1-(6-метокси-2-нафтил)-пропан- 1-она: бромкетон (9,4 г, 32,2 ммоль); (5)- -пропиленацеталь 2-бром-1 -(6-метокси- 2-нафтил)-пропан-1-она: бромкетон (11,8 г 40,2 ммоль); (8)т1,2-ди- нетилэтиленацеталь 2-бром-1-(6-меток- си-2-нафтил)-пропан-1-она: бромкетон (11,8 г, 40,2 ммоль).
i
Пример 23. Оптически актив- ный бромкеталь или хлрркеталь, полу.ченный согласно примеру 22, растворяют в указанном в таблице растворителе и прибавляют необходимое количество катализатора. Реакционную смесь нагревают при указанной в таблице температуре в течение указанного времени в целях осуществления перегруппировки. Раствор охлаждают, и присутствующее в соответствующем случае количество, нерастворимого катализатора отфильтровывают. Полученный раствор промывают двумя порциями 0,5 М водного раствора соляной кислоты и водой. Полученные растворы сушат над сульфатом магния, фильтруют и подвергают выпариванию с получением сырых (З)-напроксе- новых сложных эфиров, которые можно подвергать гидролизу известными методами (кислотный гидролиз).
Подобные реакции перегруппировки можно осуществлять с помощью хлорке- талей,
35
40
45
50
55
В колбу вводят (R)-2-хлор-1-(6-мет окси-2-нафтил)-пропан-1-он (10 г, 40,2 ммоль) и 150 мл безводного метанола. Этот раствор выдерживают при 2хС, и медленно прибавляют порошкообразный метоксид натрия (4,6 г, 85 ммоль) в виде твердого вещества, придерживая температуру при 25 С путем охлаждения. По завершении прибавления реакционную смесь перемешивают в течение 1 ч и выливают ее в водный раствор карбоната натрия. Органические вещества экстрагируют метиленхлоридом и сушат над сульфатом магния о В результате вЪтаривания растворителя получают (Я)- 1,1-димет- окси-1 -(6-метокси- 2-нафтил )-пропан - 2-ола со специфическим углом вращения VJ -5,6° (СНгС1), т.пл. 49- 55°С.
Поступая описанным образом, с тем исключением, что используют 11,8 г бромкетона, при этом получают (R-)-2- бром-1-(6-метокси-2-нафтил)-пропан- 1-он.
Пример 25. (S)-l,1-димет- оКси-1-(6-метокси-2-нафтил)-пропан- 2-ол обрабатывают молярным избытком (до л;50%) метансульфонилхлорида в присутствии молярного избытка триэтил амина (равному молярному избытку метансульфонилхлорида или выше) в ме- тиленхлориде с получением (5)-1,1-ди- метокси-1-(6-метокси-2-нафтил)-проп- 2-ил-метансульфоната. Последний превращают в (S)-метил-2-(6-метокси-2- нафтил)-пропионат аналогично примеру 17.
Пример 26. (S)-l,1-димет- окси-1-(6-метокси-2-нафтил)-пропан- 2-ол обрабатывают молярным избытком р-толуолеульфонилхлорида в при- .сутствии молярного избытка триэтилами . на по способу, аналогичному описанному в примере 25, с получением (S)- 1,1-диметокси-2-(6-метокси-2-нафтил)- проп-2-ил-р-толуолсульфоната Последний превращают в (8)-метил-2-(6-метокси- 2-нафтил) -пропионат по методу, аналогичному методу, описанному в при мере 17.
Пример 27. Повторяют процесс описанный в примере 26, заменяя р-то- луолсульфо нилхло рид бензолеульфо нил- хлоридом, и получают (S)-l,1-димет157769412
Пример 24, (S)-l,1-диметокси-1-(6-метокси-2-нафтил)-пропан-2- ол.
0
5
0
0 5
5
0
5
0
5
В колбу вводят (R)-2-хлор-1-(6-мет- окси-2-нафтил)-пропан-1-он (10 г, 40,2 ммоль) и 150 мл безводного метанола. Этот раствор выдерживают при 2хС, и медленно прибавляют порошкообразный метоксид натрия (4,6 г, 85 ммоль) в виде твердого вещества, придерживая температуру при 25 С путем охлаждения. По завершении прибавления реакционную смесь перемешивают в течение 1 ч и выливают ее в водный раствор карбоната натрия. Органические вещества экстрагируют метиленхлоридом и сушат над сульфатом магния о В результате вЪтаривания растворителя получают (Я)- 1,1-димет- окси-1 -(6-метокси- 2-нафтил )-пропан - 2-ола со специфическим углом вращения VJ -5,6° (СНгС1), т.пл. 49- 55°С.
Поступая описанным образом, с тем исключением, что используют 11,8 г бромкетона, при этом получают (R-)-2- бром-1-(6-метокси-2-нафтил)-пропан- 1-он.
Пример 25. (S)-l,1-димет- оКси-1-(6-метокси-2-нафтил)-пропан- 2-ол обрабатывают молярным избытком (до л;50%) метансульфонилхлорида в присутствии молярного избытка триэтил- амина (равному молярному избытку метансульфонилхлорида или выше) в ме- тиленхлориде с получением (5)-1,1-ди- метокси-1-(6-метокси-2-нафтил)-проп- 2-ил-метансульфоната. Последний превращают в (S)-метил-2-(6-метокси-2- нафтил)-пропионат аналогично примеру 17.
Пример 26. (S)-l,1-димет- окси-1-(6-метокси-2-нафтил)-пропан- 2-ол обрабатывают молярным избытком р-толуолеульфонилхлорида в при- .сутствии молярного избытка триэтилами- . на по способу, аналогичному описанному в примере 25, с получением (S)- 1,1-диметокси-2-(6-метокси-2-нафтил)- проп-2-ил-р-толуолсульфоната Последний превращают в (8)-метил-2-(6-метокси- 2-нафтил) -пропионат по методу, аналогичному методу, описанному в примере 17.
Пример 27. Повторяют процесс, описанный в примере 26, заменяя р-то- луолсульфо нилхло рид бензолеульфо нил- хлоридом, и получают (S)-l,1-диметокси 1-(6-метокси-2-нафтил)-проп-2- ил-бензолсульфонат. Последний превращают в (5)-метил-2-(6-метокси-2-наф- тил)-пропионат по примеру 17.
Пример 28, Раствор 6 мл безводного метиленхлорида и 1,0 ммоль (S)-1,1-диметокси-1-(6-метокси-2 наф- тил)-проп-2-ил-р-толуолсульфоната по каплям добавляют к перемешиваемой смеси 0,20 мл иодтриметилсилана и I капли циклогексена в 8 мл безводного метиленхлорида при комнатной температуре в атмосфере аргона. Смесь пеполучая 22 г бесцветной жидкости. ЯМР-анализ подтверждает идентичност желаемого продукта.
Получение 1 -(-)-оЈ-ацетокси-1 (б- метокси-2-нафтил)-пропан-1-она.
14,8 г 1-(-)-оЈ-ацетоксипропионил хлорида растворяют в 90 мл ТГФ и ох лаждают до -30°С. В этот раствор в ТО течение 4 ч добавляют 70 мл 1,28 М раствора ТГФ, полученного из 2-бром 6-метоксинафталина. По завершении добавления прибавляют еще 100 мл во
продукт можно получить с выходом 70
0
ды и 70 мл этилового эфира. Слои ремешивают 1 ч при комнатной темпера- J5 разделяют, растворитель упаривают, туре, после чего добавляют 10 мл насы- получая полутвердый продукт. Чистый щенного водного бикарбоната натрия. Органический и водный слои разделяют. Органический слой затем подряд промывают 5 мл 10%-ного водного тиосульфата натрия, 5 мл воды, 5 мл водного бикарбоната натрия и 5 мл воды. Орга20
и диапазоном плавления 114-115 С пу тем перекристаллизации из метанола. Исследования сдвига ЯМР указывают на полное сохранение оптической чистоты.
нический слой затем высушивают сульфатом магния и после выпаривания растворителя получают (5)-метил-2-(6-мет- окси-2-нафтил)-пропионат.
I Пример 29. Приемом, подоб ным примеру 28, (S)-l,1-диметокси-1- (6-метокси-2-нафтил)-проп-2-или-р- .толуолсульфонат переводят в (S) метил-2- (6-метокси-2-нафтил)-пропионат.
Пример 30. Приемом, подобным примеру 28, (S)-l,1-диметокси-1- (6-метокси-2-нафтил)-проп-2-ил-бензол сульфонат переводят в (5)-метил-2-(6- метокси-2-нафтил)-пропионат.
Пример 31. Получение -(-)- Ot-ацетоксипропионовой кислоты.
50 мл (50%) 1-(-)-натрийлактата разбавляют 40 мл воды и охлаждают до 20-22°С, Затем по каплям добавляют 40 г ангидрида уксусной кислоты в течение Зч, перемешивая затем при 20°С в течение еще 1 ч. Полученный водный раствор экстрагируют трижды хлористым метиленом порциями по 150 мл. Эк- ,стракты сушат над сульфатом магния и упаривают, продукт перегоняют при 190-НО°С/2 мм ртост. Выход 90% 1(26,5 г).
Получение 1-(-)-с(гацетоксипропио- нилхлорида„
24,5 г 1-(-3-#-ацетоксипропиона- вой кислоты обрабатывают 25 г тионил- хлорида и 4 каплями ДМФ, Смесь нагревают до 35°С и наконец до 50°С до прекращения выделения газа. Продукт перегоняют при 110 С/25 мм рт.ст.,
получая 22 г бесцветной жидкости. ЯМР-анализ подтверждает идентичность желаемого продукта.
Получение 1 -(-)-оЈ-ацетокси-1 (б- метокси-2-нафтил)-пропан-1-она.
14,8 г 1-(-)-оЈ-ацетоксипропионил- хлорида растворяют в 90 мл ТГФ и охлаждают до -30°С. В этот раствор в течение 4 ч добавляют 70 мл 1,28 М раствора ТГФ, полученного из 2-бром- 6-метоксинафталина. По завершении добавления прибавляют еще 100 мл вопродукт можно получить с выходом 70%
0
ды и 70 мл этилового эфира. Слои разделяют, растворитель упаривают, получая полутвердый продукт. Чистый
и диапазоном плавления 114-115 С путем перекристаллизации из метанола. Исследования сдвига ЯМР указывают на полное сохранение оптической чистоты.
Гидролиз ацетата до -(-)-сЈ-окси- 1-(6-метокси-2-нафтил)-пропан-1-она.
Вышеназванный ацетат в количестве 18,2 г растворяют в 70 мл ТГФ и 30 мл воды. Затем при комнатной температуре медленно добавляют 4tl г гидроокиси натрия, реакционную смесь перемешивают в течение 5 ч при 25 С,
5
фазы отделяют о Упариванием растворителя получают масло, которое согласно ЯМР-спектроскопии представляет собой 1 - (-) -pi-окси-1 - (6-метокси 2-наф- тил)-пропан-1-он. Выход 95%.
Пример 32. Получение 4-J(S)- Ci-2-окси-1-оксопропил -морфолина,
Трехгорлую колбу емкостью 250 мл, содержащую вращающуюся магнитную ме0 шалку, оснащают термометром и перегоночной головкой,затем продувают азотом. Добавляют 100,00 г (0,8465 моль) этил-Ь-(+)-лактата и 73,75 г (0,8465 моль) морфолина. Смесь нагре5 вают в течение 30 ч при П5°С, удаляя этанол, затем 24 ч нагревают при температуре диапазона от 124 до . Вакуумной перегонкой получают 113,45 г продукта в виде очень бледно-желтого
0 масла с т.кип. 147-175°С (большая порция 162-170°с) при 20 мм рт.ст. Выход 84,2%.
Получение 4- l(S)-0Ј-2( 1-этоксиэток- си)-1-оксопропил -морфолина.
Трехгорлую колбу емкостью 250 мл, содержащую вращающуюся магнитную мешалку, оснащают термометром и капельной воронкой, продувая затем азотом. После этого добавляют 2,5 мм
(0,0325 моль) трифторуксусной кислоты и 81,11 г (0,5095 моль) 4-(S)-2- окси-(1-оксипропил)1 -морфолина с последующим добавлением 20 мл этилового4 эфира для облегчения перемешивания. В капельную воронку помещают 58,5 мл (0,6117 моль) этилвинилового эфира, добавляя в течение 80 мин при 17°С. Смесь перемешивают полтора часа при 17°С и еще раз полтора часа при 25°С, Черно-красную смесь разбавляют дихло- ридом метилена в количестве 250 мл, промывая затем насыщенным водным
15
7694
10
новой кислоты и 400 мл толуола нагре вают до температуры дефлегмации. Затем удаляют азеотроп толуола, воды и этиленгликоля. После охлаждения отделяют воду и этиленгликоль и с помощью сепаратора Дина-Стар ка удаляют их. Реакционную смесь азеотропно сушат в течение 5 ч, после чего ее охлаждают. Охлажденную смесь выпивают в избыток водного бикарбоната натрия. Толуоль- ный слой отделяют и сушат над сульфатом магния.
Толуол упаривают, а твердый оста








| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения замещенных алкановых кислот или их сложных эфиров (его варианты) | 1981 |
|
SU1340580A3 |
| Способ получения альфасульфонилоксикетонацеталей | 1982 |
|
SU1331425A3 |
| 1-ФЕНИЛАЛКАНОНЫ - НОВЫЕ ЛИГАНДЫ 5-НТ-РЕЦЕПТОРА | 1994 |
|
RU2170228C2 |
| ПРОИЗВОДНЫЕ АМИДОВ, ЯВЛЯЮЩИЕСЯ ИНГИБИТОРАМИ МАТРИЧНЫХ МЕТАЛЛОПРОТЕАЗ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2132851C1 |
| Способ получения производных тиоэтиановой кислоты | 1979 |
|
SU1052161A3 |
| Способ получения производных тетрагидроизохинолина или их фармацевтически приемлемых кислотно-аддитивных солей | 1986 |
|
SU1598875A3 |
| Способ получения оптически активных кеталей | 1985 |
|
SU1431678A3 |
| Способ получения 6-хлор/или бром/-1,2-дигидро-3 @ -пирроло/1,2- @ / пиррол-1-карбоновых кислот или их фармацевтически приемлемых солей | 1981 |
|
SU1217260A3 |
| МОСТИКОВЫЕ ИНДОЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ МАТРИЧНЫХ МЕТАЛЛОПРОТЕАЗ | 1996 |
|
RU2191779C2 |
| Способ получения @ -арилалкановых кислот | 1986 |
|
SU1574167A3 |
Изобретение касается оптически активных кислот, в частности получения α-арилалкановой кислоты ф-лы CH=CH-C(OCH 3)=CH-C=C-CH=CK-CH=CH, где K-CH(CH 3)-C(O)OH, или ее фармацевтически приемлемой соли, или ее C 1-C 4-алкилового эфира, или C 1-C 4-гидроксилалкилового эфира, применяемых в медицине или сельском хозяйстве в качестве биологически активных веществ. С целью упрощения процесса используют соединение, содержащее вместо группы K заместитель K 1 - C(O)-CHZ-CH 3, при Z-OH, галоген, ацетоксигруппа или -OS(O) 2R 1, где R 1-C 1-C 4-алкил, фенил, C 1-C 4-алкилфенил. Исходное вещество получают реакцией металл (MN 2+, MG 2+ или ZN 2+)галоидного(CL или BR) соответствующего органического соединения с оптически активным соединением ф-лы CH 3-CHZ-C(O)Y, где Z см.выше, Y - галоид, или - N-(CH 2) 2-O-(CH 2) 2-, или -N-CH 2-CH=N-CH 2, в среде инертного растворителя при 0-(-70)°С. Процесс кетализации полученного указанным способом вещества ведут при температуре от 0°С до т.кип. реакционной смеси с помощью три(C 1-C 4)алкилортоформиата в присутствии кислотного катализатора в среде спирта, или с помощью C 2-C 8-двухатомного алкилового спирта, или с помощью алкоксида щелочного металла с последующей обработкой галогенангидридом соответствующей кислоты. Дальнейшую перегруппировку кеталя ведут сольволизом в протонном или полярном апротонном растворителе при 90 - 150°С в присутствии основания или при температуре от комнатной до температуры дефлегмации реакционной смеси в присутствии агента, имеющего сродство к кислороду, в среде апротонного растворителя. Эти условия обеспечивают стереоселективное получение желаемого изомера без необходимости разделения смеси R- и S-изомеров с выходом до 90%. 1 табл.
бикарбонатом натрия с последующей суш- и ток перемешивают в метаноле, фильтру- кой безводным карбонатом калия. За счет вакуумной перегонки получают 83,54 г желтого масла с т.киП. 97- 104°С при 0,2-0,4 мм рт.ст., быстро становящегося коричневым. Повторной перегонкой из карбоната калия получают 70,89 г бледно-желтого масла центральной фракции т.кип. 104-1 О6С 0,3 мм рт„ст. Выход 60,2%.
Получение 1-(-)-Ј 6-окси-1- (б-мет- окси-2-нафтил)-пропан-1-она.
Трехгорлую колбу емкостью 250 мл, содержащую магнитную вращающуюся мешалку, оснащают обратным холодильниют и получают (S)-1-(6-метокси-2-наф- тил)-2-метансульфонилокси-пропан- -он этиленацеталь с оптическим вращением ГоО1 +6,1° (, хлороформ) и 20 характерными ЯМР-спектрами в дейтеро- хлороформе, о : 1,35 (дублет, J-2), 2,78, 3,83, 3,98-3,68 (мультиплет); 4,28-4,0 (мультиплет)J 4,98 (квартет, J-2); 8-7 (мультиплет),
Пример 34. В подходящий автоклав помещают 6,4 г (5)-1-(6-метокси- 2-нафтил)-2-метансульфонилоксипропан 1-он-этиленацеталя, 60 мл 1,2-диэтокси- этана, 50 мл воды и 3 г карбоната
25
ком и капельной воронкой, затем нагре- on кальция, Смесь с перемешиванием нагре- о f
вают с одновременным продувом азотом. R колбу вводят 20,00 г (0,0865 моль) 4- (5)-2-(1-этоксиэтокси)-1-оксопро- пил -морфолина и 70 мл ТГФ, полученного перегонкой с натрием. В капельную воронку помещают 60 мл ТГФ и 2- бром-6-метоксинафталина Гриньяра в количестве 1,2 М ТГФ, 74,0 мл, 0,0888 моль. Колбу охлаждают на ледяной бане, а раствор Гриньяра добавляют в течение 55 минс Охлаждающую баню удаляют, раствору дают медленно нагреваться до 20°С в течение 45 мин. Смесь перемешивают в течение полуто- ра часов при 20-22йС с последующим добавлением 200 мл 1 н, соляной кислоты при 20-25°С. перемешивая 2 ч, Смесь экстрагируют толуолом трижды порциями по 200 мл, соединенные экстракты, промывают рассолом и сушат над безводным сульфатом натрия. После удаления растворителя упариванием получают 19,92 г сырого продукта в виде рыжеватого масла, медленно отверждаю- щегося при комнатной температуре.
Пример 33. Смесь 90 г этиленгликоля, 30 г (5)-1-(6-метокси-2- нафтил)2-метансульфонилоксипропан-1- она, 6 г моногидрата р-толуолсульфо40
вают при 120 С в течение 36 ч при 2,95 кг/смг. Затем ее охлаждают и отфильтровывают соли кальция. Добавляют концентрированную соляную кислоту и полученную смесь еще раз нагревают в
течение 3 ч при 95 С, После этого отгоняют 1,2-диэтоксиэтан с получением твердого вещества, которое экстрагируют этиловым эфиром. Органический слой экстрагируют водным бикарбонатом натрия, после чего разделяют водный и органический слои. Водный слой подкисляют соляной кислотой и после фильтрации получают (5)-2-(6-метокси- 2-нафтил)-пропионовую кислоту т.пл, 147-1506С и оптическим вращением +62,2° в хлороформе.
Пример 35. Работают по примеру 34 с использованием диметилформами- да (ДМФ) вместо 1,2-диметоксиэтана.
Полученную смесь нагревают до 110°С под атмосферным давлением в течение суток. В результате обработки путем препаративной ТСХ получают (8)-2-окси- зтил-2-(6-метоксй 2-нафтил)-пропио55 нат, который имеет значение +72,5 и ЯМР-спектры в.дейтерохло- роформе,f : 1,49 (дублет, J-2,3)f 3,67 (нультиплечО; 3,85, 3,89 (кварток перемешивают в метаноле, фильтру-
ют и получают (S)-1-(6-метокси-2-наф- тил)-2-метансульфонилокси-пропан- -он этиленацеталь с оптическим вращением ГоО1 +6,1° (, хлороформ) и характерными ЯМР-спектрами в дейтеро- хлороформе, о : 1,35 (дублет, J-2), 2,78, 3,83, 3,98-3,68 (мультиплет); 4,28-4,0 (мультиплет)J 4,98 (квартет, J-2); 8-7 (мультиплет),
Пример 34. В подходящий автоклав помещают 6,4 г (5)-1-(6-метокси- 2-нафтил)-2-метансульфонилоксипропан 1-он-этиленацеталя, 60 мл 1,2-диэтокси- этана, 50 мл воды и 3 г карбоната
f
0
вают при 120 С в течение 36 ч при 2,95 кг/смг. Затем ее охлаждают и отфильтровывают соли кальция. Добавляют концентрированную соляную кислоту и полученную смесь еще раз нагревают в
течение 3 ч при 95 С, После этого отгоняют 1,2-диэтоксиэтан с получением твердого вещества, которое экстрагируют этиловым эфиром. Органический слой экстрагируют водным бикарбонатом натрия, после чего разделяют водный и органический слои. Водный слой подкисляют соляной кислотой и после фильтрации получают (5)-2-(6-метокси- 2-нафтил)-пропионовую кислоту т.пл, 147-1506С и оптическим вращением +62,2° в хлороформе.
Пример 35. Работают по примеру 34 с использованием диметилформами- да (ДМФ) вместо 1,2-диметоксиэтана.
Полученную смесь нагревают до 110°С под атмосферным давлением в течение суток. В результате обработки путем препаративной ТСХ получают (8)-2-окси- зтил-2-(6-метоксй 2-нафтил)-пропио5 нат, который имеет значение +72,5 и ЯМР-спектры в.дейтерохло- роформе,f : 1,49 (дублет, J-2,3)f 3,67 (нультиплечО; 3,85, 3,89 (квар7
тет, J-2,3); 4,1/ (мультиплет), 7,77-t 7,07 (мультиплет).
Пример 36.В сухом сосуде в атмосфере азота готовят раствор 20,98 ммоль (5)-2-метансульфонилокси- пропионовой кислоты, 20,95 ммоль три- этиламина и 48 мл безводного ТГФ и охаждают его до -30 С. Затем раствор перемешивают при -30°С в течение 5 мин, после чего добавляют 231,23 ммоль триметилацетилхлорида, в результате чего образуется белый осадок. Затем нагревают смесь до -20 С и перемешивают ее при этой температуре в течение 30 мин. Полученную белую взвесь охлаждают до -70°С и обавляют 20,98 ммоль реактива Гринь- яра, полученного из 2-бром-б-меток- си-нафталина в ТГФ, в течение 1 ч. олученную смесь перемешивают 4 ч при -70 С, а затем нагревают до -20 С. Потом ее выливают в 150 мл разбавленной НС1 и экстрагируют метиленхло- ридом. Органические экстракты выпа- рив.ают досуха и оставшееся вещество экстрагируют диэтиловым эфиром. Полученную таким образом взвесь фильтруют с получением (S)-l-(6-метокси-2- нафтил)-2-метансульфонилоксипропан-1- она т-.пл. 150-154° С.
Пример 37, Смесь 47,2 ммоль хлористого лития и 21,3 ммоль хлористого марганца в 50 мл безводного ТГФ перемешивают при 25 С до образования желтого раствора. При -30°С затем добавляют реактив Гриньяра, полученный из 19,8 ммоль 6-метокси-2- бромнафталина в ТГФ. Смесь перемешивают 1,5 ч при -30°С и затем 20 мин при 25°С. Раствор хлористого-(6-мет- окси-2-нафтил)-марганца при -20°С обавляют к 22,3 ммоль (5)-2-метан- сульфонилоксипропионилхлорида в 30 мл ТГФ. Смесь перемешивают 1 ч при -20 С, потом ей дают нагреваться до 25 С и при этой температуре ее перемешивают еще 1 ч. После этого смесь выивают в 150 мл разбавленной водной НС1 и экстрагируют метиленхлоридом. оследний упаривают под пониженным давлением, после чего добавляют этиловый эфир. Эфирную взвесь отфильтровывают с получением (8)-.1-(6-мет- окси-2-нафтил)-2-метансульфонилоксипропан- 1 -она т.пл. 148-150°С.
Пример 38. В сухую колбу помещают 80,6 ммоль имидаэола и 50 мл безводного ТГФ. Затем по каплям обавляют раствор 40,3 ммоль (S)-2
- - хС- и - --
,
577694
18
10
15
25
метансульфонилоксипропионилхлорида в 50 мл ТГФ при комнатной темпера- турес во время чего начинает выпадать в осадок белое твердое вещество Смесь перемешивают при комнатной температуре в течение 2,5 ч. Полученную белую взвесь отфильтровывают в целях удаления имидазолгидрохлорида. Фильтрат, содержащий 1-(2-метансуль- фонилоксипропионил)-имидазол, охлаждают до-Ю°С в атмосфере азота и затем при (-70) - (-60) С по каплям добавляют 40,0 ммоль магниево- го реактива Гриньяра, полученного из 2-бром-б-метоксинафталина в ТГФ. Смесь перемешивают 40 мин, затем ей дают нагреваться до 10 С, после чего ее выливают в 50 мл разбавленной 2Q НС1 о Смесь экстрагируют метиленхлоридом, а органические экстракты выпаривают досуха. Полученное твердое вещество промывают этиловым эфиром и высушивают с. получением (S)-l- (6-метокси-2-нафтил)-2-метансульфонилоксипропан- 1 -она со значением Х -29,2 в метиленхлориде.
Пример 39.В сухой сосуд соответствующих размеров загружают 20 г магниевой стружки и 15 мл безводного ТГФ. Перемешанную смесь нагревают до 50-60 С и обрабатывают раствором 16,6 г 2-бром-6-метоксинафталина в 35 мл безводного ТГФ. Затем смесь перемешивают I ч при 50-60°С. Получен- 35 ный раствор реактива Гриньяра переводят в другой сухой сосуд и охлаждают до 25°С. Затем к перемешанному раствору реактива Гриньяра добавляют 4,8 г порошкообразного хлористого цинка, 40 Температуру полученной смеси повышают до 45-50°С с получением раствора, содержащего ди-(6-метокси-2-наф- тил)-цинк.
Пример 40. Раствор 5,7 г 45 (5)-2-метансульфонилоксипропионилхло- рида в 94 мл сухого ТГФ с перемешиванием охлаждают до -60°С. Затем в течение 4 ч добавляют полученный по примеру 39 раствор ди-(б-метокси-2- 50 нафтил)-цинка. По завершении процесса добавления реакционную смесь 15 ч нагревают до 25°С, Полученную смесь добавляют к перемешанной смеси, содержащей 30 мл концентрированной НС1 и 55 200 мл воды. Затем добавляют 50 мл диэтилового эфира. Полученную таким образом взвесь фильтруют и высуши30
вают под пониженным давлением при 40 С с получением (S)-1-(6-метокси19
15
2-нафтил)-2-метансульфонилоксипррпан- 1-она.
Пример 41. Смесь 3,07 г (S)- 1,1-диметокси-1-(6-метокси-2-нафтил)- проп-2-ил-метансульфоната, 1,0 г карбоната кальция, 100 мл ДМФи 25 мл воды нагревают до 110°С и выдерживают при этой температуре в течение 5 ч. Затем полученную смесь охлаждают и нерастворимые компоненты удаляют фильтрациейс Фильтрат выливают в избыток воды и полученное твердое вещество отфильтровывают. В-результате отделения хроматографией получа- мт метил-2-(6-метокси-2-нафтил)-про- пионат со значением di ,s +77° в хлороформе и оптической чистотой выше 99%.
Пример 42. Смесь, полученную добавлением 23 г (8)-2-(6-метокси-2- нафтил)-пропионовой кислоты, приготовленной по примеру 23, к 4 г Nat)H в 500 мл водного метанола, перемешивают 3 ч при комнатной температуре. Затем смесь выпаривают G получением 2-(б- метокси-2-нафткгм-пропионата натрия. Потом этот продукт переводят в толуол выделяют центрифугированием и до высушивания промывают гексаном.
Полученный продукт плавится при 255 С с разложением. Его ИК-спектры показывают максимумы при 1260, 1600, 1625 и 1725 .Выход составляет 95%, считая на 5-2-(6-метокси-2- нафтил)-пропионовую кислоту.
Предлагаемый способ, представляющий собой стереоселективный способ, позволяет получать 2-(6-метокси-2- нафтил)-пропионовую кислоту в виде желаемого изомера, исходя из соедине-п ния формулы (IV), подходящей конфигурации и таким образом упростить процесс по сравнению с известным способом вследствие исключения стадии разделения смеси R- и S-изомеров путем обратного растворения. / «Формула изобретения
Способ получения оптически активной /-арилалкановой кислоты формулы
Н3
сн-соон
СН30
(I)
или ее фармацевтически приемлемой нат. риевой соли, или ее Cj-С -алкилового7
20
или С ,-С4 гидроксиалкилового сложного эфиров, обработкой 2-замещенного 1- (6-метокси-2-нафтил)-пропан-1-она ке- тализирующим агентом в инертном растворителе при температуре от О С до температуры дефлегмации реакционной смеси, перегруппировкой полученного таким образом соответствующего кеталя путем сольволиэав протонном или полярном апротонном растворителе в присутствии основания при повышенной температуре или путем обработки агентом, имеющим сродство к кислороду, в апро, тонном растворителе, отличающийся тем, что, с целью упрощения процесса, в качестве 2-замещенного 1-(6-метокси-2-нафтил)-пропан-1-она, используют оптически активное соеди- .
Q нение формулы Q
Цн-СН3, (11, СН30 z
где Z - оксигруппа, ацетоксигруппа, галоген или группа формулы - OS02R, где R -С -С -алкил,, фенил, незамещенный или замещенный Сц-С,(.-алкилом, полученное путем взаимодействия ме- таллорганического соединения формулы
мх ,
4 - I (Ц)
снго сн3о /г(1Ш
где М - марганец (II), магний или
цинк;
X - хлор или бром,
с оптически активным соединением формулы
5
0
5
Ч
0
снз-сн-сг
5Z
где Z имеет указанные значения; Y - галоген или группа
(IV)
х
или
/-N
4J
в инертном растворителе при температуре от 0 до -70аС, в качестве кета- лизирующего агента берут .}- алкилортоформиат и обработку соединения формулы (II) в этом случае проводят в присутствии кислотного катализатора в спиртовом растворителе, или диатомный спирт с числом атомов угле211577694
рода от 2 до 8 для получения соответ-ствующего кеталя формулы
AD (V)
СН30
R4 и RJ - С -С -алкил или R и R3 вместе взятые означают C -Cg-алкилен, Z - имеет указанные значения.
22
или в качестве кетализирукэдего агента используют алкоксид щелочного металла и полученный в этом случае соответствующий кеталь подвергают взаимодействию с галогенангидридом соответствующей кислоты для получения соединения формулы (V), причем перегруппировку кеталя путем сольволиза осуществляют при 90-150°С, а обработку- агентом, имеющим сродство к кислороду, - при температуре от комнатной до температуры дефлегмации реакционной смеси.
| Способ получения замещенных алкановых кислот или их сложных эфиров (его варианты) | 1981 |
|
SU1340580A3 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1990-07-07—Публикация
1982-12-10—Подача