Изобретение относится к фосфорорганической химии, в частности к новым фосфорилированным 4,5-дигидро-6-оксо-1,2,4- триазинам общей формулы I где R - втор-C4H9 (cоединение Ia), (С2H5O)2P(S)SCH2 - (соединение Iб), проявляющим инсектицидные и акарицидные свойства, которые могут найти применение в сельском хозяйстве.
где R - втор-C4H9 (cоединение Ia), (С2H5O)2P(S)SCH2 - (соединение Iб), проявляющим инсектицидные и акарицидные свойства, которые могут найти применение в сельском хозяйстве.
Цель изобретения - новое азотсодержащее гетероциклическое производное дитиофосфорной кислоты, обладающего повышенной инсектоакарицидной активностью и меньшей токсичностью для теплокровных, по сравнению со структурным аналогом и аналогом по действию -4,5-дигидро-4-(0,0-диэтилтиофосфорил) -5-метил-1,2,4-триазин-6-оном (соединение II).
П р и м е р 1. Получение 1-(диэтокситиофосфорилтиометил)-4- втор-бутил -5-метил-4,5-дигидро-6-оксо-1,2,4-триазина.
К смеси 2,9 г концентрированной H2SO4 и 0,72 г льда при 0-3oC прибавили по каплям раствор 1,86 г диэтилдитиофосфорной кислоты и 1,5 г 4-втор-бутил-5-метил-4,5-дигидро-6-оксо-1,2,4-триазина в 15 мл хлороформа. Затем внесли 0,36 г параформа при 30oC. Реакционную массу выдержали при 40oC в течение 2,5 ч, вылили в ледяную воду, отделили органический слой, водный слой проэкстрагировали хлороформом. Объединенный органический раствор промыли раствором NaHCO3 и водой, высушили над CаСl2. Растворитель упарили, полученное коричневое масло в количестве 2,57 г подвергли хроматографической очистке на колонке с силикагелем, элюируя примеси бензолом. Из смеси растворителей гексан-ацетон 5: 1 выделили продукт с выходом 30% , nD20 1,5311.
Найдено, % : С 42,14; Н 7,16; N 11,37; Р 8,64; S 17,17.
C3Н26N3O3PS2.
Вычислено, % : C 42,49; Н 7,13; N 11,44; Р 8,43; S 17,45.
П р и м е р 2. Получение 1,4-бис-(диэтокситиофосфорилтиометил) -5-метил-4,5-дигидро-6-оксо-1,2,4-триазина.
К суспензии 1,36 г 5-метил-4,5-дигидро-6-оксо-1,2,4-триазина и 2,3 г диэтилдитиофосфорной кислоты в 30 мл хлороформа добавили 1,4 мл НСl кислоты при -3-0oC. Затем при 5oC добавили 0,376 г параформа. Реакционную массу выдержали при 25oC в течение 2 ч до исчезновения по ТСХ исходного триазина, промыли водой, раствором NaHCO3 до рН 7, снова водой, высушили над CаСl2. Упарили хлороформ, полученное масло в количестве 1,5 г подвергли хроматографической очистке на пластинках с силикагелем, элюировали смесью растворителей гексан-ацетон 2: 1.
Из реакционной массы наряду с продуктами монофосфорилирования по N1 и N4 атомам азота цикла выделен целевой продукт в количестве 0,4 г (выход 20% ), Rf 0,42; nD20 1,5644.
Найдено, % : C 33,03; Н 5,77; N 8,57; Р 12,02; S 25,08.
С14Н29N3O5P2S4.
Вычислено, % : С 32,99; H 5,74; N 8,25; H 12,16; S 25,17.
П р и м е р 3. Получение 1,4-бис (диэтокситиофосфорилтиометил)-5-метил- 4,5-дигидро-6-оксо-1,2,4-триазина.
Суспензию 1,13 г (0,01 моля) 5-метил-4,5-дигидро-6-оксо-1,2,4-триазина, 0,9 г (0,03 моля) параформа и 5,58 г (0,03 моля) диэтилдитиофосфорной кислоты в 30 мл хлороформа выдержали при перемешивании при 50oC в течение 6 ч, осуществляя хроматографический контроль за ходом реакции. Реакционную массу охладили, разбавили 100 мл хлороформа, добавили поташ, перемешивали 20 мин, профильтровали, фильтрат промыли водой, высушили над CаСl2, растворитель упарили. Полученное густое масло в количестве 5,15 г подвергли хроматографическому разделению на пластинках с силикагелем, элюировали смесь растворителей гексан - ацетон 2: 1. Из реакционной массы наряду с целевым продуктом, полученным с выходом 33% , также выделен продукт монофосфорилирования по N4-атому азота цикла с выходом 32% .
Строение соединений формулы I доказано с помощью ИК, ЯМР1Н, 31Р и масс-спектрометрии.
В масс-спектре соединения I (R - втор-C4H9) присутствует пик молекулярного иона с интенсивностью 18% , отвечающий вычисленной молекулярной массе.
В ИК-спектрах соединений, снятых в тонкой пленке или в хлороформе, присутствуют полосы валентных колебаний следующих групп (см-1): 650-670 (Р= S); 960, 1010 (РОС2H5); 1630-1640 (С= N); 1670 (С= O).
В спектрах ПМР соединений помимо сигналов протонсодержащих групп, присутствующих в исходных триазинах (1,31 м. д. дублет, 5-СH3; 6,7-6,8 м. д. , дублет С3H; 3,98, квартет, С5H), наблюдаются также сигналы этоксигрупп, связанных с атомом фосфора (1,32, триплет, СH3; 4,16, квартет, СH2OP). Сигналы протонов группы -NCH2SP(S)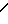 одной или двух соответственно проявляются в виде сложных мультиплетов в области 4,98-5,02 м. д. , что объясняется диастереотопностью (неэквивалентностью) протонов этих групп.
одной или двух соответственно проявляются в виде сложных мультиплетов в области 4,98-5,02 м. д. , что объясняется диастереотопностью (неэквивалентностью) протонов этих групп.
В спектрах ЯМР 31Р присутствуют соответственно один (90,7 м. д. ) или два сигнала (90 и 91,7 м. д. ) атомов фосфора.
Токсичность соединений I для теплокровных животных ЛД50 150-200 мг/кг.
Соединения формулы I проявляют инсектицидную активность в таком же широком спектре, как и их ближайший структурный аналог, а бисфосфорилированный триазин по спектру действия превосходит его. Соединения формулы I являются более эффективными акарицидами, чем известный аналог. Сравнение описываемых соединений с эталонами (фозалоном, фталофосом, карбофосом) показывает преимущества новых соединений по активности против жуков рисового долгоносика и свекловичной тли.
П р и м е р 4. Испытания соединений формулы I на инсектицидную активность.
Жуков рисового долгоносика опрыскивают 2,5 мл водно-ацетонового раствора испытуемого вещества в концентрации 0,15% д. в.
Учет гибели проводят через 48 ч.
Свекловичную тлю подсаживают в чашки, опрыскнутые 2,5 мл водно-ацетонового раствора испытуемого вещества в концентрации 0,015% д. в. Учет гибели тли проводят через 24 ч.
Гусениц непарного шелкопряда опрыскивают 2,5 мл водно-ацетонового раствора испытуемого вещества в концентрации 0,015 д. в. Учет гибели гусениц проводят через 24 ч.
Для соединений, давших 100% -ную гибель насекомых, определяют СК50 и сравнивают с СК50 эталонов.
Результаты испытаний приведены в таблице.
П р и м е р 5. Определение токсичности соединений для белокрылки оранжерейной.
Подсадка имаго на обработанные зеленые растения.
Срезанное растение фасоли обрабатывают (окунанием) 0,1% -ным по д. в. водно-ацетоновым (1: 1) раствором вещества. После подсыхания растения помещают в небольшие стаканчики с водой, помещают 20-25 взрослых особей белокрылки и накрывают экспозиметром. Каждое соединение или концентрацию испытывают в двукратной повторности. Учет гибели проводят через 24 ч. СК50 определяют по стандартной методике (коэффициент разбавле- ния - 4х).
Результаты приведены в таблице.
П р и м е р 6. Испытания соединений формулы I на акарицидную активность.
Стандартные высечки листьев фасоли с подсаженными на них клещами опрыскивают 2,5 мл водно-ацетонового раствора испытуемого вещества в концентрации 0,05% д. в. После высыхания капельно-жидкой влаги высечки с обработанными клещами помещают во влажную камеру.
Учет гибели клещей проводят через 48 ч.
Результаты испытаний приведены в таблице.
Таким образом, вновь полученные соединения показали высокую инсектицидную активность при сравнении с известными инсектицидами фозазолоном и фталофосом.
Соединение Iа превосходит в 2,5 раза фозазолон для свекловичной тли, однако несколько уступает ему по активности для жуков рисового долгоносика. Соединение Iб превышает активность фозазолона в 10 раз для жуков рисового долгоносика и в 3 раза - для свекловичной тли.
Активность соединения Iа превышает таковую фталофоса в 1,5 раза для жуков рисового долгоносика и в 5 раз для свекловичной тли.
Соединение Iб активнее фталофоса в 25 раз для жуков рисового долгоносика и в 7 раз для свекловичной тли.
Оба соединения обладают выраженной акарицидной активностью, тогда как фозалон обладает весьма слабыми акарицидными свойствами. Соединение Iб в 1,5 раза превышает акарицидную активность фталофоса для паутинного клеща на фасоли. (56) Патент США N 4616015, кл. С 07 D 253/06, 1986.
Европейский патент N 0150677, кл. С 07 D 253/06, 1985.
Авторское свидетельство СССР N 1527872, кл. С 07 D 253/06, 1988.
| название | год | авторы | номер документа |
|---|---|---|---|
| 4,5-ДИГИДРО-4-(О,О-ДИЭТИЛТИОФОСФОРИЛ)-5-МЕТИЛ-1,2,4-ТРИАЗИН-6-ОН, ОБЛАДАЮЩИЙ ИНСЕКТИЦИДНОЙ И АКАРИЦИДНОЙ АКТИВНОСТЬЮ | 1988 |
|
SU1527872A1 |
| ФОСФОРИЛИРОВАННЫЕ 2-АЛКИЛАМИНОДИГИДРО-1,3-ТИАЗИНЫ, ОБЛАДАЮЩИЕ ИНСЕКТИЦИДНОЙ АКТИВНОСТЬЮ | 1983 |
|
SU1157831A1 |
| ФОСФОРИЛИРОВАННЫЕ N-АЛКИЛБЕНЗАМИДОКСИМЫ, ОБЛАДАЮЩИЕ ИНСЕКТИЦИДНОЙ И ИНСЕКТОАКАРИЦИДНОЙ АКТИВНОСТЬЮ | 1983 |
|
SU1189067A1 |
| 3- ИЛИ 5-АМИДО-1-[ДИЭТОКСИ(ТИО)ФОСФОРИЛ]ПИРАЗОЛЫ, ОБЛАДАЮЩИЕ ИНСЕКТОАКАРИЦИДНОЙ АКТИВНОСТЬЮ | 1986 |
|
SU1383757A1 |
| ТИОФОСФОРИЛИРОВАННЫЕ ОКСИМЫ ЛАКТАМОВ, ОБЛАДАЮЩИЕ ИНСЕКТОАКАРИЦИДНОЙ АКТИВНОСТЬЮ | 1990 |
|
SU1732666A1 |
| 0-ЭТИЛ-S-[(N-КАРБАЛКОКСИ-N-КАРБАЛКОКСИАЛКИЛ)АМИНОМЕТИЛ] МЕТИЛТИО- ИЛИ ДИТИОФОСФОНАТЫ, ОБЛАДАЮЩИЕ АКАРИЦИДНОЙ И ИНСЕКТОАКАРИЦИДНОЙ АКТИВНОСТЬЮ | 1982 |
|
SU1100896A1 |
| Фосфорилированные триметилизомочевины, обладающие инсектоакарицидной активностью | 1978 |
|
SU707233A1 |
| Инсектоакарицид | 1974 |
|
SU488527A1 |
| 2-АРИЛИМИНО-3-ДИЭТОКСИФОСФОРИЛ-5-МЕТИЛТИАЗОЛИДИНЫ, ОБЛАДАЮЩИЕ ИНСЕКТИЦИДНОЙ АКТИВНОСТЬЮ | 1984 |
|
SU1235196A1 |
| @ -Этинильные эфиры дитиофосфорной кислоты,обладающие инсектоакарицидной активностью | 1980 |
|
SU948107A1 |

Изобретение относится к гетероциклическим соединениям, в частности к 1-( диэтилтиофосфорилтио )метил -5- метил -2,5- дигидро -6- оксо- 1,2,4- триазинам ф-лы 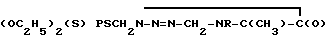 C7H9, где R - втор- (C2H5O)2P(S)SCH2, проявляющим инсектицидные и акарицидные свойства. Цель - выявление более активных соединений. Получение ведут реакцией соответствующего 4,5-дигидро-6-оксо-1, 2, 4-триазина с параформом и диэтилдитиофосфорной кислотой в присутствии минеральной кислоты в среде хлороформа. ЛД50=150-200 мг/кг = 150 - 200 мг/кг. 1 табл.
C7H9, где R - втор- (C2H5O)2P(S)SCH2, проявляющим инсектицидные и акарицидные свойства. Цель - выявление более активных соединений. Получение ведут реакцией соответствующего 4,5-дигидро-6-оксо-1, 2, 4-триазина с параформом и диэтилдитиофосфорной кислотой в присутствии минеральной кислоты в среде хлороформа. ЛД50=150-200 мг/кг = 150 - 200 мг/кг. 1 табл.
1-(Диэтилтиофосфорилтио)метил-5-метил-4,5-дигидро-6-оксо-1,2,4-триазины общей формулы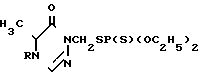
где R-втор-C4H9 или (C2H5O)2 P (S) SCH2,
обладающие инсектицидной и акарицидной активностью.
Авторы
Даты
1994-02-28—Публикация
1989-06-08—Подача