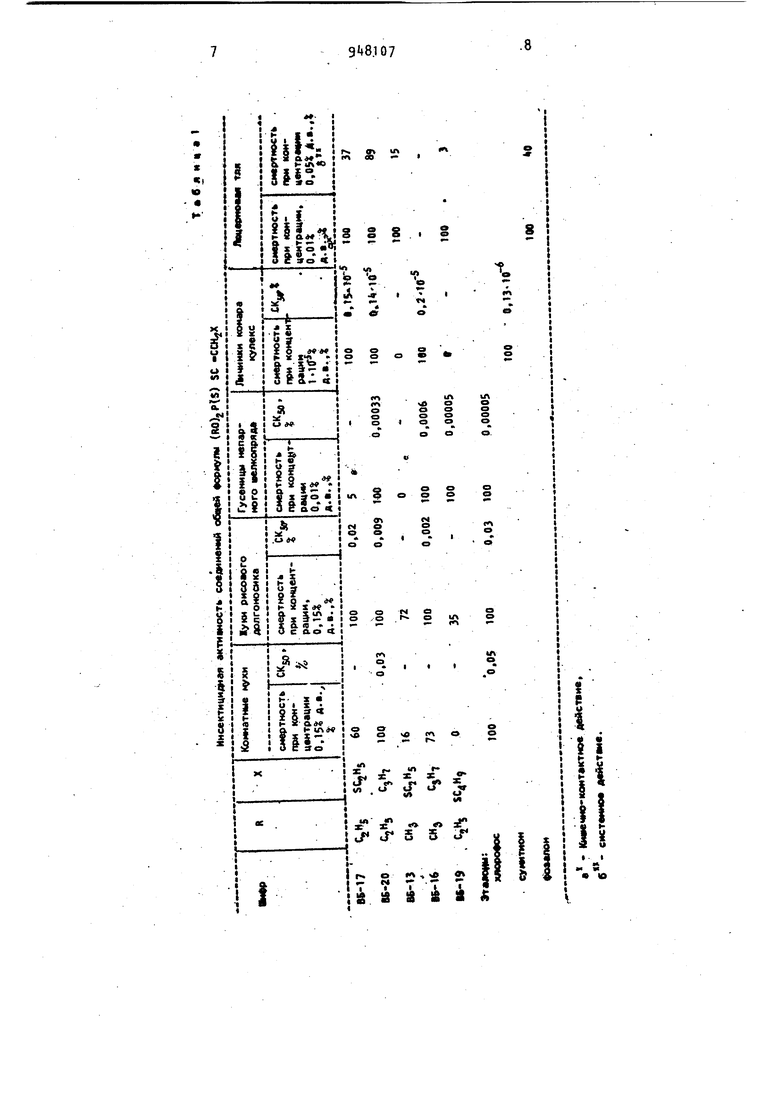
Изобретение относится к области химии фосфорорганических соединений а именно к новым S-этинильныМ эфирам дитиофосфорной кислоты общей форму g (KO -P-SCsCCH X (Tl где R - метил или .этил; X - этилмеркапто, бутилмеркапто или пропил, обладающим инсектоакарицидной активностью, которые могут найти применение в сельском хозяйбтве в борьбе против комнатных мух, жуков рисового долгоносика, люцерновой тли, гусениц непарного шелкопряда, личинок кома-, ра кулекс, паутинного клеща фасоли,. Соединения формулы (t) .и их свойства в литературе не описаны. Известно использование в сельском хозяйстве в качестве инсектициду хло рофоса о ,0.-диметил- (1-окси-2,2,2-тр хлорэтилЬфосфоната .ij , в качестве , инсектоакарицидов- сумитиона 0,0-ди етил-О- (-нитро-3-метилфенид(тиофос фата 2 и фозалона .0,0-диэтил-5-{6-хлорбензоксазолинон-2-ил-3-метил )дитиофосфата з . Известны 5-этинильные эфиры дитиофосфорной кислоты общей формулы (RO). P-SCsCK,i .I где. R - метил или этил, X - метил или фенил И. Однако они обладают только инсектицидной активностью. Ближайшими известными структурными аналогами описываемых соединений формулы (I), обладающими инсектоакарицидной активностью , являются S-этинильные эфиры тиофосфорной кислоты sl . I. Однако их эффективность недостаточно высокая. Целью .изобретения является расширение арсенала средств воздействия на жи вой ор ганизм. Поставленная цель достигается описываемыми S-этинильными эфирами дитиофосфорной кислоты формулы (1), обладающими инсектоакарицидной активностью. Описываемые соединения формулы (I в отличие от известных 5-этинильных эфиров дитиофосфорной кислоты и содержат в своей молекуле сульфидную серу или гексиновый радик1ал, что приводит не только к усилению инсектициднои, но и появлению значительной акарицидной активности. Описываемые соединения формулы (1) в отличие от S-этинильных эфиров тиофосфорной кислоты ОБЪЯВЛЯЮТСЯ производными дитиокйслот фосфора. Это структурйое отличие приводит к значительному снижению токсичности для теплокровных. Так, для 0,0-диэтил-5-(гекс-1-инил)-дитиофосфата и 0,0-диэтил-S- ( -этилмеркаптопроп-1-инил )дитиофосфата величина ЬД оУвеличивается в 520 и 60 раз соответственно {см. табл. 2) по сравнению е ранее описанными монотиоаналогами J5, а именно, О ,0-диэтил-5-(гекс- -инил )-тиофосфатом (LArgOi S мг/кг) и 0,0-диэтил-5-{у-этилмеркаптопроп-1-инил )-тиофосфатом (,5 мг/кг). S-Этинильные эфиры дитиофосфорной кислоты формулы (I) получают взаимодействием соответствующих литийаце.тиленовых производных с диалкокситиофосфорилдисульфидами в среде органического растворителя при комнатной температуре.- 8 качестве растворителя в реакции могут быть использованы обычные органические растворители - ,как алифатические так и ароматические углеводороды. Реакция проходит в мягких условиях и с хорошими выходами (до 90), а исходные реагенты яв|ляются легкодоступными веществами. Очистку всех веществ производят на хроматографической колонке с силикагелем rtj 1бО/100 . В качестве элюЭнта используют гексан-эфир 10:1. Строение и чистота соединений формулы (I) подтверждены данными элементного анализа, молекулярной рефракции и спектров комбинационного рассеяния. В КР-спектрах всех веществ присутствует полоса поглощения в области 2192-2200 см-(). Пример. Получение 0,0-диэтил-S-{У -этилмеркаптопроп-1-инил)-дитиофосфата. К 0,09 моль бутиллития в гексане в токе аргона добавляют 9,8 г (0,098 моль) EtSСН2С5СН в 25 мл абсолютного эфира, смесь перемешивают 1 ч при 20 С, а затем ее добавляют к 29,6, г (0,08 моль) диэтилтиофосфорилдисульфида в 100 мл абс.эфира при . При этой температуре реакционную смесь перемешиваютеще 2 ч, после чего 1зыливают в холодную воду и промывают органический слой до нейтральной реакции, сушат сульфатом натрия. Растворитель упаривают, остаток очи щают хроматографированием на колонке , получают 19,3 г (85 % от Teop.j 0,0-диэтил-$-( у-этилмерк топроп-1-инил)дитиофосфата с . df 1.0271, MRHa5.75,98; МКвыг7б.25. Найдено,: С 38,70; Н 6,12; Р 10,67; S 33,65. СрНпРО-$з. Вычислено, %: С 38,02; Н 5,98; Р 10,91; S 33,81. П Р и м е Р 2. Получение 0,0-дим тил-$-(У-этилмеркаптопроп-1-инил )-д тиофосфата. К О,9 моль бутиллития в гексане в токе аргона добавляют 9,8 г (0,098 моль) EtS CHjC СН в 25 мл абс. эфира, смесь перемешивают 1 ч при 20С, затем добавляют ее к 25,1 (0,08 моль) диметилтиофосфорилдисул фида в 100 мл. асб.эфира при 20 С.Р акционную смесь перемешивают 2 ч,об работку ведут аналогично примеру 1 получают 15,5 г (75% от теор.) 0,0 -диметйл-5-(у-этилмеркаптопроп-1-инил)дитиофосфата с ,5б70, df 1,2381, ,52; МК,,67.01. Найдено, %: С 32,2б; Н i,96; Р 12,56. 7 в i 3 Вычислено,: С 32,2; Н 5,00; Р 12,11 . Пример 3. Получение 0,0-диме тил-S-(гекс-1-инил)-дитиофосфата. К 0,09 моль бутиллития в гексане Э токе аргона добавляют 8,2 г (0,1 моль) гексина-1 в 25 мл абс. эфира, смесь перемешивают 1 ч при 20 С, затем ее добавляют к 29,6 г (0,08 моль) диэтилтиофосфорилсуль :фида в 100 мл. абс. эфира при Реакционную смесь обрабатывают как примере 1, получают Т, г (81% от теор.) О,0-диэтил-5-(гекс-1-инил)д тиофосфата с п 1,5140 , d4 1,0797, МКнаЙд/З Э, МЯвыч73,18. Найдено, %: С 4i,20; Н 7,3tj Р 11,75; S 2it,8l. 1 Вычислено,%: С 45,11; Н 7,89; Р 11,65; S 2,06. П Р и м е Р 4. Получение 0,0-ди метил-5-(гекс-1-инил )дитиофосфата. Из 0,09 моль бутиллития 8,2 г (0,1 моль) гексина-1 и 25,1 г (0,08 моль) диметилтиофосфорилдисульфида аналогично примеру 3 полу чают 14,7 г (78% от теор.) 0,0-диметил-$-(гекс-1-ЙНИЛ)дитиофосфата с п 1 ,5215, d|° 1,115, MR 64,18; MRH...63,94. Найдено, %: С 40,6l; Н 6,39; Р 12,70; S 26,70. CgH|50PS. Вычислено,%: С 40,33; Н 6,30; Р 13,02; S 26,88. П Р и м е Р 5. Получение 0,0-диметил-S-(у-бутилмеркаптопроп-1-инил)дитиофосфата. Из 0,09 моль бутиллития 12,1 г (0,095 моль) В и и 29,6 г (0,08 моль) диэтилтиофосфорилсульфида аналогично примеру 1 получают 17,5 г (70% от теор.) 0,0-да1этил-$-(у-бутилмеркаптопроп-1-инил)дитиофосфата с п 1,5426, d 4 1,1545, МК«айл85.08; MRj,,85,13. Найдено,%: С 41,98: Н 6,67; Р 9,81; S 30,45. qiH2,0,PS. Вычислено, %: С 42,02; Н 6,73; Р 9,94; S 30,75. Испытания инсектицидной активности описываемых соединений определяют на комнатных мухах (М. domestica Z.), жуках рисового долгоносика ,(С. oryzae), гусеницах непарного шелкопряда (C.dispar L.), личинках комара кулекс (С. pipiens molestus F.) и люцерновой тле (Aphis craccivora Koch.), акарицидной активности- на паутинном клеще на фасоли (Т. urtiсае Kosh. ). П Р и м е р.6. Определение инсектицидной активности. Комнатных мух и жуков рисового долгоносика опрыскивают 2,5 мл водно-ацетонового раствора испытуемого вещества в концентрации 0,15%д.в. Учет гибели насекомых проводят через 24 и 48 ч. Гусениц непарного шелкопряда опрыскивают 2,5 мл водноацетонового раствора испытуемого вещества в концентрации 0,01% д.в. Учет гибели гусениц проводят через 24 ч. Личинок комара кулекс 2-ой(возраст ) помещают в раствор с испытуемым веществом в концентрации 10 . Учет гибели личинок проводят через 24 ч. Люцерновая тля. В стеклянные стаканы емкостью 200 см помещаютпо одному листу хлопчатника и на него отсаживают по 25-30.самок люцерновой тли, после чего сразуже проводят
S9 8107
опрыскивание. Учет и наблюдение прдво-центрация 0,05%). Затем отчленяют лидят через один день. При системномстьп от черешков и экспонируют на них
способе воздействия растения хлоп-тлю по описанной выше методике.Учет
чатника (с одним-двумя настоящими ли-смертности проводят я сравнении с контстьями) в течение 2 ч настаивают в 5ролем (расчет ведут по формуле Аббота).
рабочих жидкостях соединений (кон-Результаты испытаний приведены в табл.1. Пример. Определение акарицидной активности. В чашки Петри на тонкий слой увла ненной ваты помещают свежеотчлененный лист хлопчатника, на йего наносят кольцо из садового клея и внутрь кольца отсаживают по 10-15 самок паутинного клеща. Через 2k ч проводят поедварительный учет и рпрыскивание
Акарицидная активность и величины 1Д (мыши) соединений общей формулы;
5 : :
(ко),р-5снссн2Х ; соответствующими разведениями. Учет проводят через один и два дня после постановки опыта. При системном способе воздействия опыт проводят алогично опыту на тле. Результаты испытаний приведены в табл. 2. Таблица2






| название | год | авторы | номер документа |
|---|---|---|---|
| Фосфорилированные триметилизотиомочевины, обладающие инсектоакарицидной активностью | 1978 |
|
SU707232A1 |
| @ -Этинильные эфиры тиофосфорной кислоты, обладающие инсектоакарицидной активностью, и способ их получения | 1979 |
|
SU772154A1 |
| -Хлорбутиновые эфиры дитикислот фосфора, проявляющие инсектоакарицидную активность | 1977 |
|
SU671281A1 |
| 1-( ДИЭТИЛТИОФОСФОРИЛТИО )МЕТИЛ -5- МЕТИЛ - 4,5 - ДИГИДРО -6- ОКСО - 1,2,4 - ТРИАЗИНЫ, ОБЛАДАЮЩИЕ ИНСЕКТИЦИДНОЙ И АКАРИЦИДНОЙ АКТИВНОСТЬЮ | 1989 |
|
SU1621453A1 |
| Функционально замещенные бутиновые эфиры проявляющие инсектоакарицидную активность | 1976 |
|
SU630860A1 |
| 3- ИЛИ 5-АМИДО-1-[ДИЭТОКСИ(ТИО)ФОСФОРИЛ]ПИРАЗОЛЫ, ОБЛАДАЮЩИЕ ИНСЕКТОАКАРИЦИДНОЙ АКТИВНОСТЬЮ | 1986 |
|
SU1383757A1 |
| S-(2,2,5-Триметилоксазолидинил-3-карбонилметил)-0,0-диалкилтио-, или дитиофосфаты, или О-диалкилтиофосфонаты, обладающие афицидной активностью | 1988 |
|
SU1530629A1 |
| Фосфорилированные триметилизомочевины, обладающие инсектоакарицидной активностью | 1978 |
|
SU707233A1 |
| 4,5-ДИГИДРО-4-(О,О-ДИЭТИЛТИОФОСФОРИЛ)-5-МЕТИЛ-1,2,4-ТРИАЗИН-6-ОН, ОБЛАДАЮЩИЙ ИНСЕКТИЦИДНОЙ И АКАРИЦИДНОЙ АКТИВНОСТЬЮ | 1988 |
|
SU1527872A1 |
| ТИОФОСФОРИЛИРОВАННЫЕ ОКСИМЫ ЛАКТАМОВ, ОБЛАДАЮЩИЕ ИНСЕКТОАКАРИЦИДНОЙ АКТИВНОСТЬЮ | 1990 |
|
SU1732666A1 |

а - кишечно-контактное действие, б - системное действие . Кроме того, обнаружено, что при . скармливании гусеницам озимой совки второго возраста обработанных (0, раствор д.&.) листьев хлопчатника уже через 2 дня наблюдается 1001ная гибель вредителя от 0,0-диметил-5-(гекс-1-инил )дитиофосфата и kS%- ная - от О,0-диметил-5-(у -этилмеркаптопроп-1-инил )дитиофосфата. Описываемые соединения формулы (I) являются биологически активными веществами, в частности, инсектицидами. Все описываемые соединения при ки шечно-контактном воздействии в концентрации 0,OU так же, как фсзалон, вызывают 1 0%-ную гибель тли. Одновременно описываемые соединения обладают и системным действием по отношению к тле. Так, наиболее активными оказались 0,0-диэтил-5-(у-этилмеркаптопроп-1-йнил )-дитиофосфат и О ,0-диэтил-5-(гекс-1-инил )-дитиофосфат. Последний превосходит систем ную .активность фозалона в 2 раза. При опрыскивании жуков рисового долгоносика ацетоновым раствором препаратов О, 0-диэтил- и О,0-димeтил-S-(гeкc-1-инил )дитиофосфатов величины С%дсоставляют 0,009 и 0,002%, т.е. превышают активность этанола хлорофоса (CKjo 0,03) в 3,5 и 15 раз соответственно. Токсичность для гусениц непарного шелкопряда 0,0-дизтил-5-(-буТилмеркаптопроп-1-инил )-дитиофосфата равна эталону хлорофосу (см. табл. 1 ), Соединения ВБ-17, ВБ-20 и ВБ-16 так же, как и эталон.сумитион, вызывают гибель личинок комаров кулекс. Кроме того, описываемые соединения формулы (1 ) обладают значительной акарицидной активностью (см. табл. 2). По силе кишечно-контактного воздействия на паутинного клеща их активность находится на уровне эталона фозалона (в настоящее время широко применяемого на хлопчатнике), a по силе системного действия значительно превосходит эталон. Так, фоэалон в концентрации 0,05% не обладает системным действием на паутинного клеща, в то время, как ВБ-17 и ВБ-20 в этой концентрации вызывают гибель вредителей на Э и 95 % соответственно.
Следует отметить, что испытанные соединения обладают меньшей токсичностью для теплокровных по сравнению с применяемым фозалоном (см. табл. 2).
В табл. 3 представлены данные инсектоакарицидной активности О, О-диэтил-S- (гекс-1 -инил )-дитио-. фосфата, в сравнении с инсектоакарицидной активностью известных соединений.
€
m
t u
e
о
0 «1
;
I-
ол
« f
15
Как видно из данных табл. 3 уровне в отношении личинок ко0,0-диэтил-5-(гекс-1-инил )-тиофосфатмара кулекс, тли и паутинного
уступает по своей активности 0,0-ди-клеща. Однако токсичность описыэтил-5-(гекс-1-инил )-дитиофосфату вваемых соединений в сотни раз
отношении комнатных мух и жуков ри-5 ниже, чем токсичность известных соесового долгоносика и находится надинений.
Авторы
Даты
1983-06-15—Публикация
1980-12-30—Подача