Изобретение относится к способу получения нового комплексного соединения платины, обладающего противоопухолевой активностью.
Цель изобретения - получение нового платиноорганического комплексного соединения с более высокой активностью и более
низкой токсичностью по сравнению с известными противоопухолевыми препаратами.
Получают предлагаемое соединение Pt- ДНК следующим образом.
Предварительно нагретые до температуры плавления нативной ДНК (н-ДНК) водные растворы цис-дихлородиамминплатины (II) (ДДП) и дезоксирибонуклеиновой кислоты смешивают в молярном соотношении Pt:P 6:4 и смесь термостатируют при той же температуре до окончания реакции: 6 п цис-Р:С12(МН3}2 + н-ДНК + + 12п Н20 (МНзХН20)2 б}п-ДНК + + 6n NH4CI(I)
Температуру плавления н-ДНК определяют спектрофотометрическим методом. Для приготовления раствора ДДП используют воду, нагретую в термостате. Раствор готовят непосредственно перед началом реакции. Препарат н-ДНК растворяют в воде при комнатной температуре и раствор нагревают в термостате.
Окончание реакции определяют спектрофотометрически по достижению УФ-спектра соединения Pt-ДНК, характеризуемого максимумом поглощения Амакс 268,8 ± 0,1 нм и максимальным молярным коэффициентом экстинкции Е2б8,е 10000 ± 100л .
Для выделения предлагаемого вещества как индивидуального соединения в твердом виде образующийся в ходе реакции (I) аммоний хлористый и избыток воды удаляют лиофильной сушкой,
П р и м е р 1. На спектрофотометре Specord M40 с использованием держателя кюветы с блоком управления температурой и программы измерений, обеспечивающей линейное возрастание температуры, определяют Т.пл. н-ДНК. Регистрируют экстинк- цию как функцию температуры в диапазоне 60-95°С при градиенте температуры 1°С в минуту. Применяемая для получения предлагаемого соединения н-ДНК имеет Т.пл. 78°С. По паспортным данным прибора погрешность ± 0,5 С.
Раствор 675 мг цис-Р1С12()2 в 375 мл воды, нагретый до 78 ± 0,5°С (концентрация раствора 1800 мкг/мл). добавляют к раствору 500 мг н-ДНК в 375 мл воды (концентрация раствора 1330 мкг /мл), предварительно нагретому до 78 ± 0,5°С с равномерным повышением температуры со скоростью 1°С в минуту, как при плавлении ДНК. Смесь реагентов с молярным соотношением Pt:P 6:4 тщательно перемешивают и выдерживают в термостате в течение 15 мин, охлаждают до температуры окружающей среды.
П р и м е р 2. Опыт повторяют, как в примере 1. только после охлаждения реакционную смесь подвергают лиофильной сушке по методике, используемой в производстве сухой плазмы крови. Лиофилиза- цию проводят следующим образом. Раствор соединения Pt-ДНК при постоянном вращении охлаждают до 40°С в течение 40 мин. i затем выдерживают при этой температуре 12 ч. После этого температуру повышают до - 0°С и образец откачивают в течение 40 ч,
нагревают до 40°С и снова откачивают 26 ч. Полученное после лиофильной сушки соединение Pt-ДНК в дальнейшем хранится в закрытой стеклянной посуде в холодильнике или на воздухе. Выход продукта Pt-ДНК соответствует теоретическому.
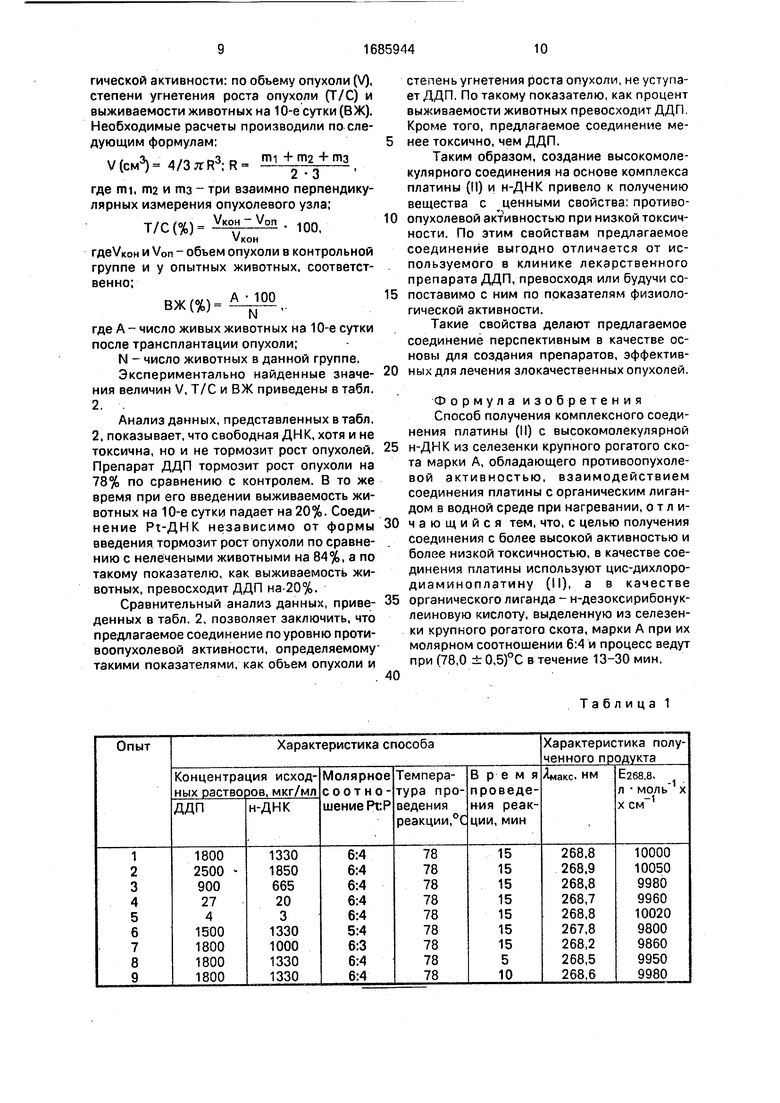
Для экспериментальной проверки предлагаемого способа получения соединения Pt-ДНК проведено 18 опытов, восемь из -которых показали положительные резульгаты. В положительных опытах получен продукт с параметрами УФ-спектра, характерными для предлагаемого соединения. Результаты опытов сведены в табл. 1, где представлены характеристики полученных
продуктов в зависимости от способа их получения, а именно: выбора концентрации исходных растворов ДДП и н-ДНК, молярных соотношений компонентов, времени и температуры проведения реакции,
Из табл. 1 следует, что выбор исходных
концентраций ДДП и н-ДНК в пределах ошибки опыта не влияет на характеристики полученного продукта. Максимальная концентрация ДДП ограничена ее растворимостью в . эта величина составляет 2523 мкг/мл при комнатной температуре. Минимальная концентрация ДДП ограничена ми- нимально возможной для хорошей спектрофотометрической регистрации концентрацией н-ДНК, которая составляет 3,0 мкг/мл.
Отклонение от соотношения Pt:P - 6:4, как в сторону избытка ДДП, так и в сторону избытка н-ДНК. не позволяет получить целевое соединение Pt-ДНК с указанными параметрами УФ-спектра.
Время, необходимое для окончания реакции, определяют из графика зависимости Амакс УФ-спектра поглощения реакционной
смеси ДДП с н-ДН К от времени термостати- рования при 78 ± 0,5°С. Минимальное время, которое требуется для окончания реакции, равно времени достижения УФ- спектра смеси ДДП с н-ДНК, характеризуемого максимумом поглощения Амакс- 268,8 нм и Е268.8 ЮООО л . Это время составляет 12,5 мин. Увеличение времени термостатирования до 30 мин не влияет на параметры Ямакс продукта реакции.
Из табл. 1 также следует, что температура проведения реакции существенно влияет на такой параметр продукта реакции, как Е2688. Для получения предлагаемого соединения Pt-ДНК термостатироеание реакционной смеси надо вести при 78,0 ± 0,5°С так как только в указанном интервале температур достигается значение E2G8.8 10000 ± 100 л см .
Приведенные данные позволяют за- ключить, что смешение предварительно нагретых до температуры плавления н-ДНК водных растворов ДДП и н-ДНК при молярном соотношении Pt:P 6:4 и термостатиро- вании реакционной смеси при этой температуре в течение времени, необходимого для окончания реакции, позволяет получить соединение, характеризуемое формулой (NH3)(H20) -ДНК с описанными физико-химическими и биологиче- скими свойствами. Отклонение от указанных параметров способа получения: соотношения реагентов, температуры и времени проведения реакции, не дает возможности получить предлагаемое соедине- ние с указанными характеристиками.
Вновь синтезированное химическое соединение Pt-ДНК представляет собой биологически активное вещество, которое способно эффективно тормозить рост опу- холи при меньшей токсичности, чем у ДДП. Оно отличается от ДДП по виду токсичности, лимитирующей дозу препарата, по таким показателям биологической активности, как степень угнетения роста опухоли, не уступает ДДП, а по выживаемости животных превосходит ДДП.
Предлагаемое соединение Pt-ДНК как индивидуальный препарат представляет собой мелкокристаллическое порошкообраз- ное вещество желтого цвета. Оно устойчиво в водном растворе и на воздухе, способно в течение года храниться без изменения свойств при комнатной температуре и в холодильнике. Его состав и строение уста- новлены элементным анализом и физико- химическими исследованиями в водном растворе и в твердом виде.
Элементный анализ мелкокристаллического образца подтверждает состав синте- зированного целевого соединения Pt-ДНК.
Найдено, %: Pt38,46; CI 7,38; С 15,61; N 9.36; Н 3,09; Р 4,67.
Вычислено, %: Pt 38,11; CI 6,94; 015,25; N9,58; Н 2,97; Р 4,17.
Рассчитанная исходя из молекулярной массы соединения Pt-ДНК и массы мономерной единицы этого полимера, имеющей эмпирическую формулу
PtCI(NH3) (Н20) Сзэ Н49 Оз2 Nis P4, среднестатистическая величина п составляет 1900 ± 90. Следовательно, в среднем примерно на 1900 нуклеотидных квартетов ДНК, состоящих из пар аденин-тимин, гуанин-цитозин, приходится примерно 11400 платиносодержащих комплексов PtCI (МНз) (Н20)2Г.
УФ-спектр поглощения водного раство ра Pt-ДНК имеет максимум поглощения при 268,8 нм, в то время как свободная н-ДНК в том же растворителе максимально поглощает свет при 258,0 нм. В расчете на 1 моль нуклеотида молярный коэффициент поглощения соединения Pt-ДНК Ё2бза 10000 л , а свободной ДНК Е258.0 7000 л см. Смещение максимума поглощения в длинноволновую область на 10,8 нм у соединения Pt-ДНК по сравнению с нативной ДНК говорит о том. что ДНК в соединении находится в связанном состоянии благодаря образованию ко валентных связей между атомами платины (II) и донорными атомами азота оснований ДНК. Повышение интенсивности поглощения, т.е. гиперхромный эффект, при этом составляет около 30%. что свидетельствует о сильных конформационных изменениях двойной спирали ДНК при присоединении металла.
Идентичность УФ-спектров поглощения соединения Pt-ДНК, полученного в растворе, и выделенного в индивидуальном состоянии, указывает нз одинаковый химический состав вещества в растворе и в твердом виде. Об этом же свидетельствуют одинаковые результаты биологических испытаний вещества, приготовленного в растворе или выделенного в чистом виде. Однако после выделения препарата как индивидуального соединения его водораство- римость понижается. Так растворимость мелкокристаллического порошка Pt-ДНК при 20°С в воде составляет всего 0,002%, что в 125 раз меньше максимально достижимой концентрации соединения в водном растворе. Поэтому при биологических испытаниях индивидуального соединения Pt- ДНК оно вводилось животным в виде водной суспензии.
Водный раствор индивидуального соединения практически не проводит электрический ток, что говорит о неэлектролитной природе Pt-ДНК.
Изменение в ИК-спектрах соединения Pt-ДНК по сравнению со свободной ДНК указывают, что металл в соединении Pt-ДНК связывается не только с азотистыми основаниями ДНК, но и с атомами кислорода фосфатных групп. Полосы при 1090 и 1240 соответствуют валентным колебаниям фос- фодиэфирных мостиков ДНК, полосы в области 1500-1700 - валентным колебаниям групп , , азотистых
оснований, полосы в области 3100-3700см 1 - валентным колебаниям групп С-Н, N-H, 0-Н, входящих в состав ДНК и молекул воды. Кроме того, при 340 наблюдается валентное колебание Pt-CI, а при 1320 - деформационное колебание N-H координированной молекулы МНз.
По данным термического анализа твердый образец соединения Pt-ДНК при нагревании до 200°С теряет две молекулы воды на один атом платины. Высокая температура, необходимая для удаления молекул воды, свидетельствует о вхождении молекул воды во внутреннюю координационную сферу платины.
Спектры отражения твердого соединения Pt-ДН К имеют значения коэффициентов спектрального отражения R(%) в экстремальных точках отличающиеся от значений R для 4HC-PtCl2(NH3)2. Для Pt-ДН К R248.3 4,60; Рззз,з 12,3; R400,6 22,4; Rsi4,4 60,1, а для цис-РЮ2(МНз)2 ,2 9,7; R269.7 13,6; R333.3 10,4; R340 17,10: R414.6 14,80; Rsi4,4 50,57. Спектры отражения подтверждают, что взаимодействие цис- PtCl2(NH3J2 с н-ДНК сопровождается изменением состава координационной сферы платины за счет замещения одного иона хлора и одной молекулы аммиака фрагментами ДНК.
Данные элементного анализа, вискозиметрии, кондуктометрии, УФ- и ИК-спект- ров поглощения и спектров отражения свидетельствуют о том, что синтезированное соединение действительно в ысокомолекулярное вещество - хлоро- амминодиакваплатина (II), связанная с дезоксирибунуклеиновой кислотой в соотношении Pt:P 6:4, формулы (МНз) (Н2ОШп ДНК, где п 1900 ± 90,
Предлагаемое новое химическое соединение представляет собой высокомолекулярное платиносодержащее вещество, которое не менее эффективно, чем ДДП, тормозит рост опухоли, не менее токсично и повышает процент выживаемости животных.
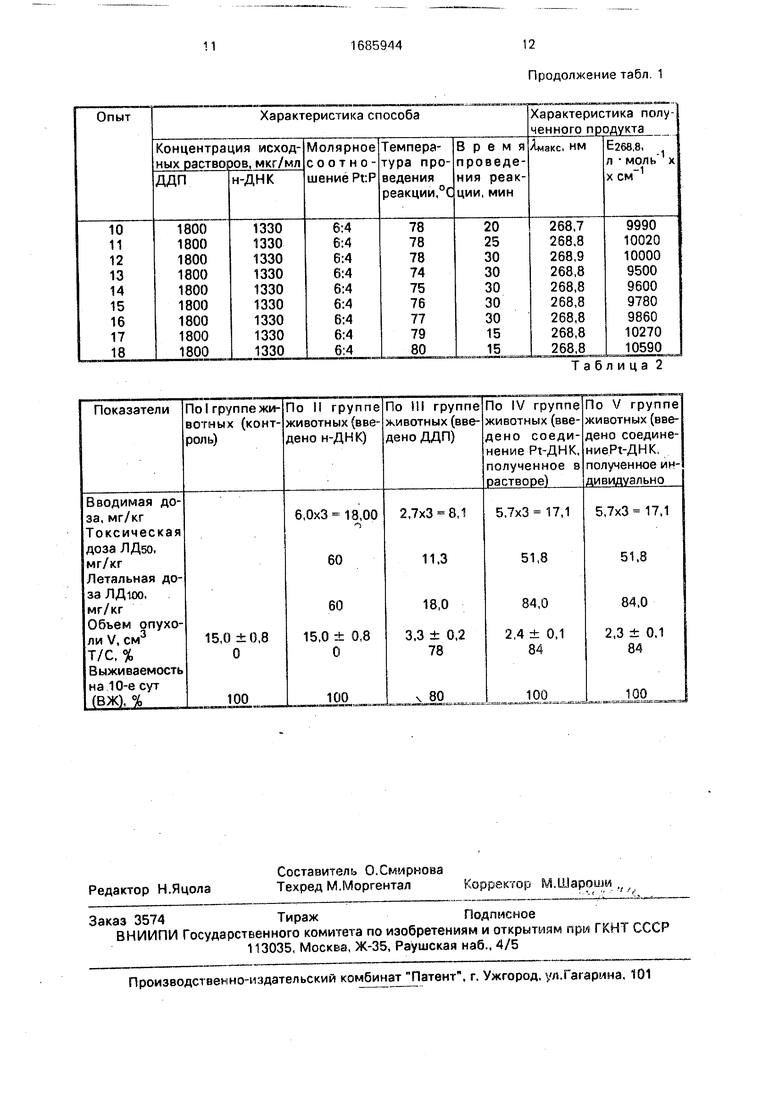
В табл. 2 представлены результаты исследований токсичности и противоопухолевой активности н-ДНК, ДДП и предлагаемого соединения, полученного в растворе и индивидуально.
Опыты проводили на мышах и крысах обоих полов. Токсичность изучали на группах животных из половозрелых нелинейных мышей весом 30,0 ± 2,0 г, прошедших карантин 20 дн. (в каждой группе было по 10 животных). Препараты вводили трехкратно внутрибрюшинно с интервалами в 2 ч по 0,5
мл. Инъекции ДДП и н-ДНК детали в водном растворе, соединения Pt-ДНК - в виде водного раствора и водной суспензии. Суммарные дозы составляли для ДДП 8; 16 и 18
мг/кг, для ДНК 20; 40 и 60 мг/кг, а для соединения Pt-ДНК 34; 68 и 84 мг/кг. Через 24-48 ч после введения препаратов отмечали количество погибших и выживших животных в каждой группе. Расчет токсической
дозы (ЛДво) проводили по известной методике. Летальную дозу, ЛДюо. определяли экспериментально.
В результате проведенных опытов установлено, что для ДДП ЛДбо равно 11,3 мг/кг,
ЛДюо равно 18 мг/кг, а для соединения Pt- ДНК ЛДбО равно 51,8 мг/кг, ЛДюо равно 84,0 мг/кг независимо от формы введения. ДНК оказалась нетоксичной даже в дозе 60 мг/кг. Из сравнения приведенных величин
следует, что токсичность соединения Pt- ДНК в 4,6 раза ниже, чем токсичность ДДП. Согласно гистологическим исследованиям гибель животных, получавших токсические дозы препаратов, обусловлена
различными причинами. При введении ДДП наблюдается нефроз разной степени выраженности и дистрофия внутренних органов. При введении соединения Pt-ДНК в почках отмечен1., незначительные изменения: небольшой отек стромы, зернистая дистрофия канальцев, единичные мелкоочаговые кровоизлияния, но имеет место выраженная дисплазия клеток эпителия кишечника, нарушение его регенераторной функции, сокрэщение количества митозов. Однако энтеротоксичность поддается коррекции в большей степени, чем нефротоксичность.
Противоопухолевую активность каждого из препаратов оценивали из экспериментов, проведенных на пяти группах животных (в каждой группе по 10 животных). Белым беспородным крысам весом 150-200 г под кожу бедра трансплантировали 2 108- -2 1010 клеток перевивного штамма лейкоза Швеца. Животные первой группы служили для контроля, вторая группа получала н-ДНК, а третья, четвертая и пятая группы - соответственно ДДП, и соединение Pt-ДНК, полученное в растворе и в чистом виде. Препараты вводили внутрибрюшинно трехкратно: первый раз - на 4-6 сут после трансплантации опухоли, т.е. в период логарифмической фазы ее роста; второй и третий раз - с интервалами 24-28 ч соответственно. Суммарная доза ДНК составила 18 мг/кг, ДДП 8,1 мг/кг, соединения Pt-ДНК 17 мг/кг.
Противоопухолевую активность оценивали по следующим показателям физиологической активности: по обьему опухоли (V), степени угнетения роста опухоли (Т/С) и выживаемости животных на 10-е сутки (В Ж). Необходимые расчеты производили по следующим формулам:
VfcM3)- m1 +™2+ тз .
где mi, и тз - три взаимно перпендикулярных измерения опухолевого узла;
VKOH - Von
Т/С(%)100,
VKOH
гдеУкон и V0n - объем опухоли в контрольной группе и у опытных животных, соответственно;
А 100
ВЖ(%)
N
где А - число живых животных на 10-е сутки после трансплантации опухоли;
N - число животных в данной группе.
Экспериментально найденные значения величин V, Т/С и ВЖ приведены в табл, 2.
Анализ данных, представленных в табл, 2, показывает, что свободная ДНК, хотя и не токсична, но и не тормозит рост опухолей. Препарат ДДП тормозит рост опухоли на 78% по сравнению с контролем. В то же время при его введении выживаемость животных на 10-е сутки падает на 20%. Соединение Pt-ДНК независимо от формы введения тормозит рост опухоли по сравнению с нелечеными животными на 84%, а по такому показателю, как выживаемость животных, превосходит ДДП на 20%,
Сравнительный анализ данных, приве денных в табл. 2, позволяет заключить, что предлагаемое соединение по уровню противоопухолевой активности, определяемому такими показателями, как объем опухоли и
-
10
15
20
25
30
35
40
степень угнетения роста опухоли, не уступает ДДП. По такому показателю, как процент выживаемости животных превосходит ДДП. Кроме того, предлагаемое соединение менее токсично, чем ДДП.
Таким образом, создание высокомолекулярного соединения на основе комплекса платины (II) и н-ДНК привело к получению вещества с ценными свойства: противоопухолевой активностью при низкой токсичности. По этим свойствам предлагаемое соединение выгодно отличается от используемого в клинике лекарственного препарата ДДП, превосходя или будучи сопоставимо с ним по показателям физиологической активности.
Такие свойства делают предлагаемое соединение перспективным в качестве основы для создания препаратов, эффективных для лечения злокачественных опухолей.
Формула изобретения Способ получения комплексного соединения платины (II) с высокомолекулярной н-ДНК из селезенки крупного рогатого скота марки А, обладающего противоопухолевой активностью, взаимодействием соединения платины с органическим лиган- дом в водной среде при нагревании, отличающийся тем. что, с целью получения соединения с более высокой активностью и более низкой токсичностью, в качестве соединения платины используют цис-дихлоро- диаминоплатину (II), а в качестве органического лиганда - н-дезоксирибонук- леиновую кислоту, выделенную из селезенки крупного рогатого скота, марки А при их молярном соотношении 6:4 и процесс ведут при (78,0 ± 0,5)°С в течение 13-30 мин.



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения комплексного соединения платины (II) с Н-ДНК, обладающего противоопухолевой активностью | 1988 |
|
SU1754722A1 |
| Способ получения комплексного соединения платины (II) с Н-ДНК, обладающего противоопухолевой активностью | 1988 |
|
SU1813089A3 |
| ЦИС-ХЛОРДИАММИН-1,3-ДИМЕТИЛКСАНТИНПЛАТИНЫ (II) ХЛОРИД ДИГИДРАТ, ПРОЯВЛЯЮЩИЙ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 1990 |
|
SU1790190A1 |
| ЦИС-ХЛОРО-N, -(2' -ТЕТРАГИДРОФУРИЛ) -5-ФТОРУРАЦИЛАТОДИАММИНПЛАТИНА II, ПРОЯВЛЯЮЩАЯ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 1992 |
|
RU2028301C1 |
| КОМПЛЕКСНОЕ СОЕДИНЕНИЕ ЦИС-ДИАММИНОПЛАТИНЫ (П) С СОПОЛИМЕРОМ NA-СОЛИ МАЛЕИНОВОЙ КИСЛОТЫ И 1,4-ДИИЗОПРОПОКСИБУТЕНА-2, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ С ШИРОКИМ ИНТЕРВАЛОМ ТЕРАПЕВТИЧЕСКИХ ДОЗ ПРИ ПОЛНОМ ОТСУТСТВИИ НЕФРОТОКСИЧНОСТИ И ИММУНОДЕПРЕССАНТНОГО ДЕЙСТВИЯ | 1990 |
|
RU2034856C1 |
| КОМПЛЕКСНОЕ СОЕДИНЕНИЕ ЦИС-ДИАМИНОПЛАТИНЫ (II) С СОПОЛИМЕРОМ NA-СОЛИ МАЛЕИНОВОЙ КИСЛОТЫ И ФУРАНА, ОБЛАДАЮЩЕЕ ИММУНОСТИМУЛИРУЮЩЕЙ И ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ, С ШИРОКИМ ИНТЕРВАЛОМ ТЕРАПЕВТИЧЕСКИХ ДОЗ ПРИ НИЗКОЙ НЕФРОТОКСИЧНОСТИ | 1990 |
|
RU2033998C1 |
| БИСИМИДАЗОЛ-(1,10)-ФЕНАНТРОЛИНПЛАТИНА (III) ДИХЛОРИД, ПРОЯВЛЯЮЩИЙ ЦИТОСТАТИЧЕСКУЮ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 1995 |
|
RU2089555C1 |
| КОМПОЗИЦИЯ ДЛЯ ПРИГОТОВЛЕНИЯ ПРОТИВООПУХОЛЕВОГО СРЕДСТВА И СПОСОБ ПРИГОТОВЛЕНИЯ ПРОТИВООПУХОЛЕВОГО СРЕДСТВА НА ЕЕ ОСНОВЕ | 2016 |
|
RU2667128C2 |
| Цис-дихлороаквогуанозинплатина ( @ ),моноэтанол,проявляющая антиканцерогенную активность | 1980 |
|
SU886472A1 |
| Применение полиакрилата золота в качестве ингибитора роста клеток меланомы человека | 2018 |
|
RU2708626C1 |
Изобретение касается платиновых комплексов, в частности получения комплекса платины (2+) с н-ДН К (высокомолекулярной, выделенной из селезенки крупного рогатого скота марки А), обладающего противоопухолевой активностью, что может быть использовано в фармакологической промышленности. Цель - повышение активности и снижение токсичности целевого комплекса. Синтез последнего ведут реакцией цис-дихлордиаминоплатины (2+) с н-дезоксирибонуклеиновой кислотой (выделенной из селезенки крупного рогатого скота марки А при их молярном соотношении 6:4 и 78 ± 0,5°С (13-30 мин) в среде воды. В этих условиях полученный комплекс в сравнении с исходной цис-дихлордиами- ноплатиной (2+) способен эффективно тормозить рост опухоли и по степени выживаемости и меньшей токсичности превосходит указанное соединение платины (LDso 51,8 мг/кг, LDioo 84 мг/кг против 11,3 мг/кг и 18 мг/кг, а степень выживаемости на 10-е сутки 100% против 80%). 2 табл. Ё О 00 ел Ч Ј
Таблица 1
Продолжение табл 1
Таблица 2
Авторы
Даты
1991-10-23—Публикация
1988-06-06—Подача