Изобретение относится к получению госсипола путем его кристаллизации из растворителей.
Целью изобретения является улучшение качества разделения, в результате чего получают отдельные кристаллические образцы госсипола для контроля качествафар- маколейного госсипола.
Поставленная цель достигается путем растворения госсипола в эфире до концентрации 0,04-0,1 мг/мл, со следующим добавлением в раствор гвксвна в количестве 0,5-2,8 от объема эфире, нагретого до 30- 32°С, и дальнейшим осаждением в диапазоне температур 10-27°С для различных кристаллических форм с последующим осуществлением контроля путем сравнения дифрактогрэмм.
На фиг. 1-5 приведены дифрактограммы контроля качества фармакопейного госсипола, который проводят обычным путем сравнения дифрактограммы образца с дифрактограммами пяти таким способом пол ученных индивидуальных кристаллических форм.
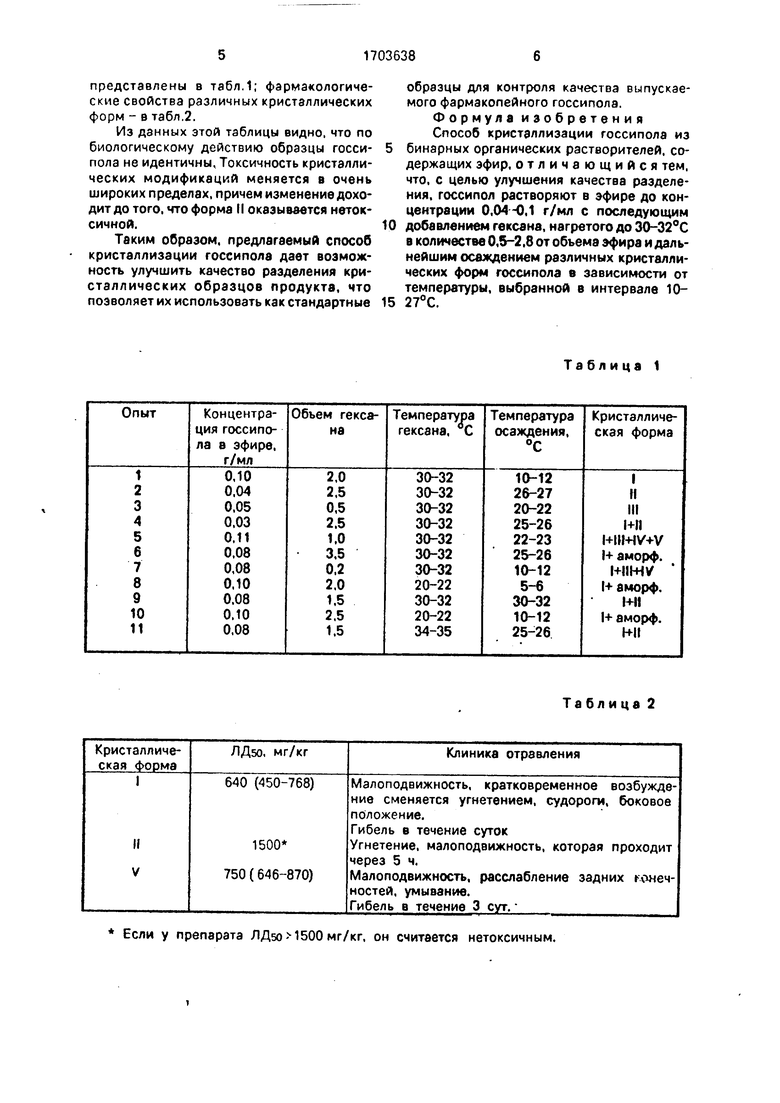
П р им е р 1. Госсипол в количестве 1 г отвечающий требованиям временной фармакопейной статьи ВФС-42-366-74 (ВФС), растворяют в 10 мл серного эфира, предварительно очищенного от перекиси, но не от влаги, и добавляют 20 мл гексэна, нагретого до 30-32°С, оставляют в холодильнике или термостате при на 24 ч. Выпавший осадок отфильтровывают, сушат под вакуумом при 50-60°С в течение 5 ч. При этом выход продукта, имеющего кристаллическую форму I, составляет 820 мг (82%). Диф- рактограмма этой формы приведена на фиг.1.
Госсипол в этой кристаллической модификации плавится из-за разложения в широком диапазоне температур (177-184°С). Результаты термогравиметрического анализа и ЯМР-исследования наряду с фактом
«Л
гС
vi
о
со о со со
получения кристаллов i оссипола в этой форме из-за смесей эфир-ксилол и хлористый метилен-гексан свидетельствуют о несоль- ватном характере этой кристаллической модификации госсипола. Продукт в этой полиморфной модификации является наиболее растворимым. Фармакопейный гос- сипол имеет именно эту кристаллическую форму.
П р и м е р 2, Берут 1 г фармакопейного госсипола, растворяют в 25 мл эфира, очищенного как в примере 1, добавляют 65-70 мл нагретого до 30-32°С гексана, оставляют при 26-27°С в термостате до образования достаточного количества монокристаллов пластинчатого габитуса, отделяют их фильтрацией, слегка сушат на воздухе, растирают в порошок и снимают дифрэктограмму, которая приведена на фиг.2.
Госсипол, кристаллизующийся в этой полиморфной модификации II, плавится при 214°С. Согласно результатам рентгено- структурного анализа монокристаллов гос- сипол этой модификации не содержит молекул растворителя в кристаллической решетке. Посредством межмолекулярных водородных связей молекулы госсипола упакованы наиболее плотно по сравнению с другими кристаллическими формами. Кристаллические образцы формы II имеют наи- меньшую растворимость как в полярных, так и в слабополярных растворителях.
Пример 3.1г госсипола растворяют в 20 мл эфира, добавляют 10 мл гексана. имеющего температуру 30-32°С, оставляют до образования монокристаллов игольчатого габитуса, отделяют их фильтрацией, не производя сушки растирают в порошок и сразу же снимают дифрактограмму. которая представлена на фиг.З.
Согласно исследованиям структуры этих кристаллов методом рентгеноструктур- ного анализа, в их решетку входит эфир в соотношении госсипол: эфир 1:1. Кристаллы госсипола в этой кристаллической модифи- кации III неустойчивы, при стоянии начинают терять молекулы растворителя. Однако скорость десольватации сильно зависит от размеров кристаллов, практически доходя до нуля для достаточно крупных (0,02 х 0,1 х 0,4 мм3) монокристаллов. v
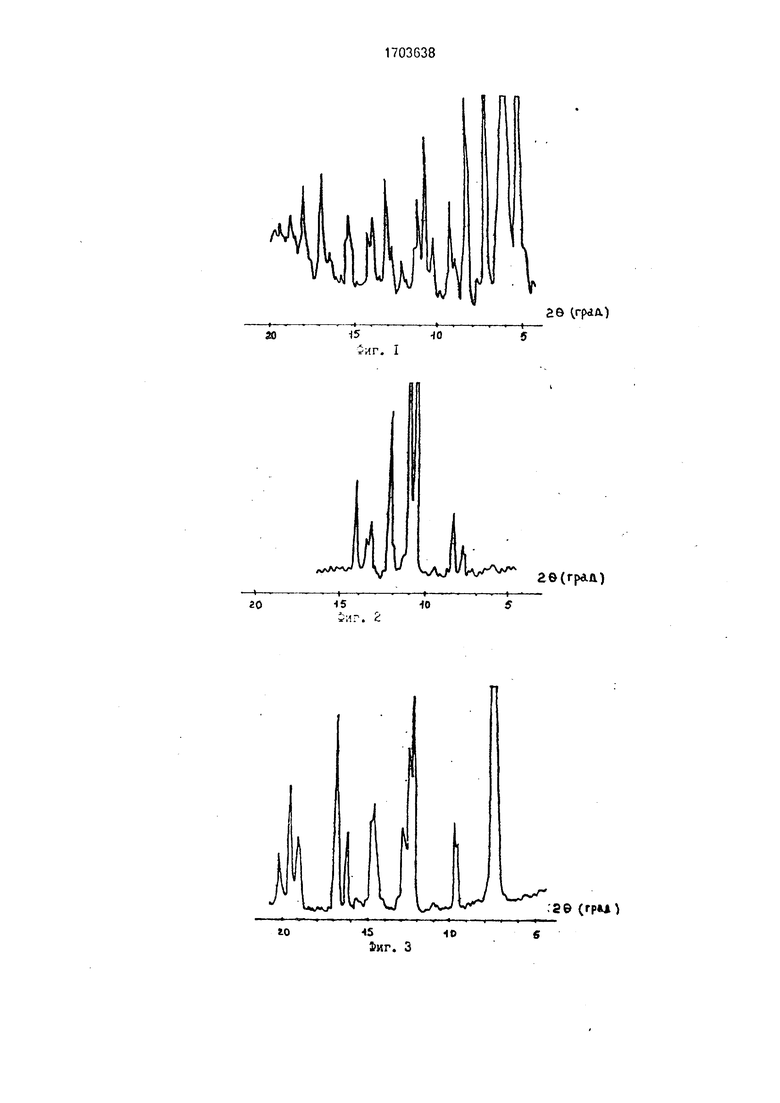
П р и м е р 4. Берут монокристаллы формы III, тщательно растирают в порошок и сушат под вакуумом в течение 2-4 ч при постоянном перемешивании, контролируя исчезновение на дифрактограмме пика формы III при угле 7,22° (фиг.4). Необходимост контроля диктуется тем, что время, требуемое для завершения перехода формы III в
форму IV, зависит от степени измельчения и совершенства кристаллов формы III.
Данные рентгеноструктурных исследований монокристаллов этой формы свидетельствуют о том, что и эта кристаллическая модификация госсипола является кристал- лосольватом, однако, с содержанием эфира в кристаллической решетке вдвое меньше. Образец в этой кристаллической форме также является неустойчивым и медленно переходит в результате десольватации к очередной форме V, уже не содержащей эфир.
П р и м е р 5. Берут образец, полученный в примере 4, или тщательно измельченные монокристаллы формы III подвергают сушке под вакуумом при 80-100°С и постоянном перемешивании в течение 10-12 ч, снова контролируя с помощью дифрзктограммы исчезновение характеристического пика формы IV при угле 7,78°. Полученный таким образом продукт не содержит растворителя.
Однако не всегда удается добиться осуществления полного фазового перехода, так как из-за разного качества (дефектности) кристаллов исходной формы 111 десольвата- ция происходит при разных режимах температуры и времени. В таких случаях получают монокристаллы формы III более дефектными за счет более интенсивного испарения растворителя, так как дальнейшее увеличение температуры сушки нежелательно в связи с тем, что. при этом госсипол может частично окисляться. Дифрактограмма формы V приведена на фиг.5.
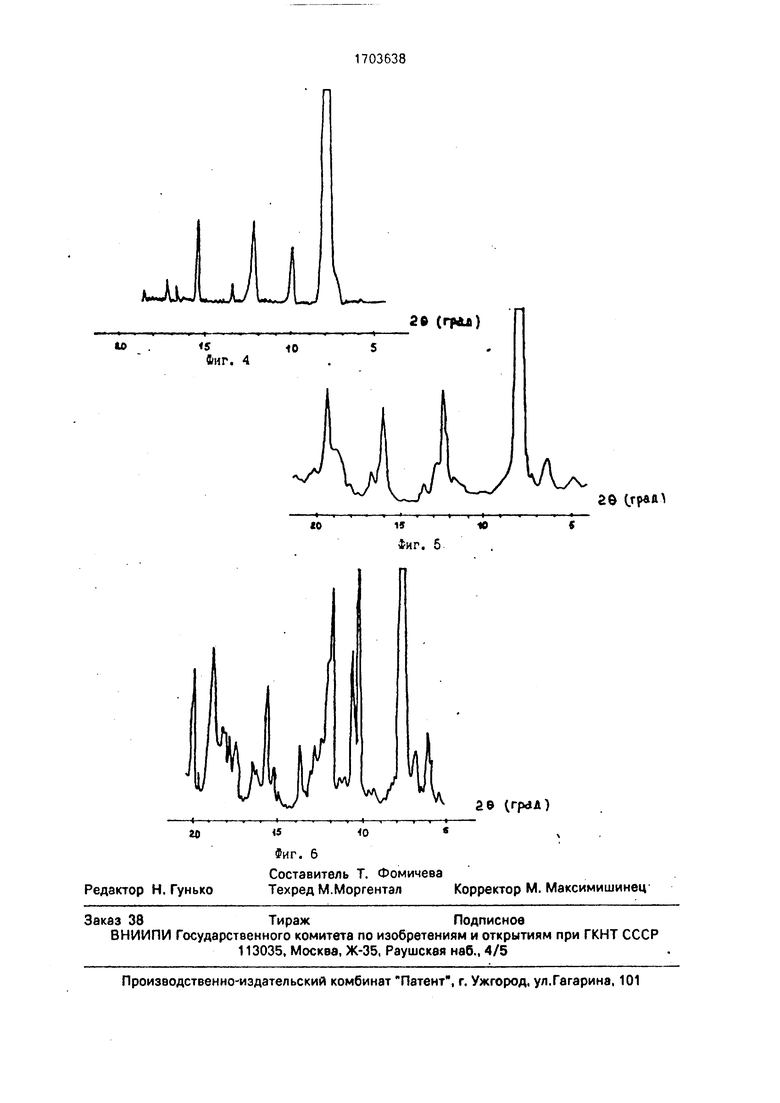
П р и м е р б. Этот пример иллюстрирует контроль качества фармакопейного госсипола. На фиг.б показана дифрактограмма одной из партий фармакопейного госсипола. Данный продукт представляет собой смесь форм I-IV. Наличие в образце форм II4 и IV свидетельствует о его относительно низкой чистоте. Поскольку максимальное содержание госсипола в кристаллической форме III составляет 88%, а в форме IV - 94%, чистота данного образца не отвечает требованиям ВФС. Измеренная температура плавления образца 179-183°С отвечает этим требованиям, хотя налицо неоднофаз- ность продукта. Измерение коэффициента при тщательной сушке в связи с мелкодис- персностью и качеством микрокристалликов форм III и IV свидетельствует о соответствии значению, приведенному в ВФС. Поэтому, на основе измерения значений этих параметров данную партию госсипола принимают за фармакопейную.
Зависимость фазового состава госсипола от параметров и условий кристаллизации
представлены в табл.1; фармакологические свойства различных кристаллических форм - в табл.2.
Из данных этой таблицы видно, что по биологическому действию образцы госси- пола не идентичны. Токсичность кристаллических модификаций меняется в очень широких пределах, причем изменение доходит до того, что форма II оказывается нетоксичной.
Таким образом, предлагаемый способ кристаллизации госсипола дает возможность улучшить качество разделения кристаллических образцов продукта, что позволяет их использовать как стандартные
образцы для контроля качества выпускаемого фармакопейного госсипола. Формула изобретения Способ кристаллизации госсипола из
бинарных органических растворителей, содержащих эфир, отличающийся тем. что, с целью улучшения качества разделения, госсипол растворяют в эфире до концентрации 0,04-0,1 г/мл с последующим
добавлением гексана, нагретого до 30-32 С в количестве 0,5-2,8 от объема эфира и дальнейшим осаждением различных кристаллических форм госсипола в зависимости от температуры, выбранной в интервале 1027°С.

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОДИФИКАЦИИ ПРОЦЕССА ФОРМИРОВАНИЯ КРИСТАЛЛОВ ЛЕКАРСТВЕННОГО ВЕЩЕСТВА | 2004 |
|
RU2388757C2 |
| ПОЛИМОРФЫ ДОЦЕТАКСЕЛА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2437875C2 |
| СПОСОБ ОЧИСТКИ ТЕХНИЧЕСКОГО β-КАРОТИНА | 1999 |
|
RU2152929C1 |
| АМИННЫЙ СОЛЬВАТ ИНГИБИТОРА НАТРИЙ-ГЛЮКОЗНОГО КОТРАНСПОРТЕРА И СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2017 |
|
RU2710230C1 |
| ПОЛИМОРФЫ И СОЛЬВАТЫ ГИДРОХЛОРИДА 4-[2-[[5-МЕТИЛ-1-(2-НАФТАЛИНИЛ)-1Н-ПИРАЗОЛ-3-ИЛ]ОКСИ]ЭТИЛ]МОРФОЛИНА | 2011 |
|
RU2560150C2 |
| КРИСТАЛЛИЧЕСКИЙ СОЛЬВАТ И НЕСОЛЬВАТИРОВАННЫЕ ФОРМЫ 6,6'-[[3,3',5,5'-ТЕТРАКИС(1,1-ДИМЕТИЛЭТИЛ)-[1,1'-БИФЕНИЛ]-2,2'-ДИИЛ]БИС(ОКСИ)]БИС-ДИБЕНЗО[D,F][1,3,2]-ДИОКСАФОСФЕПИНА | 2012 |
|
RU2660899C2 |
| Способ определения госсипола в биологических материалах | 1983 |
|
SU1126872A1 |
| КРИСТАЛЛИЧЕСКАЯ ФОРМА IV ТИЛОРОНА ДИГИДРОХЛОРИДА И ПРОМЫШЛЕННЫЙ СПОСОБ ЕЕ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 2012 |
|
RU2509074C2 |
| НОВЫЕ ПОЛИМОРФЫ И СОЛИ | 2011 |
|
RU2573384C2 |
| Кристаллическая модификация 2-[(4-хлорфенил)фенилацетил]-1h-инден-1,3(2h)-диона (хлорфацинон) с повышенными характеристиками токсичности и способ ее получения | 2020 |
|
RU2748259C1 |
Изобретение относится к ароматическим альдегидам, в частности к кристаллизации госсипола. Цель изобретения улучшение качества разделения. Кристаллизацию из бинарных органических растворителей, содержащих эфир, ведут растворением госсипола в эфире до концентрации 0,04-0,1 г/м с последующим добавлением гексана, нагретого до 30-32°С в количестве 0.5-2,8 от объема эфира. Затем проводят осаждение различных кристаллических форм госсипола в зависимости от температуры, выбранной в интервале 10- 27°С. Способ обеспечивает улучшение качества разделения образцов продукта, что позволяет использовать их как стандартные образцы для контроля качества выпускаемого фармакопейного гиссигюла. 2 табл 6 ил.
Кристалличе- ская форма
ЛДбо, мг/кг
II V
640 (450-768)
1500 750 (646-870)
Если у препарата ЛДбо 1500 мг/кг, он считается нетоксичным.
Таблица 1
Таблица 2
Клиника отравления
Малоподвижность, кратковременное возбуждение сменяется угнетением, судороги, боковое положение.
Гибель в течение суток
Угнетение, малоподвижность, которая проходит через 5 ч.
Малоподвижность, расслабление задних конечностей, умывание. Гибель в течение 3 сут.
SO
5-tQ
УИГ. I
го
15
in г. 2
&o
29 О)
гв(град)
10
:SQ (ГРМ)
4510
Ьиг. З
со
2 в (rpaU
15
Фиг. 5
2 в (град)
| СПОСОБ ПОЛУЧЕНИЯ ГОССИПОЛА | 0 |
|
SU212245A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Приводный механизм в судовой турбинной установке с зубчатой передачей | 1925 |
|
SU1965A1 |
Авторы
Даты
1992-01-07—Публикация
1986-07-18—Подача