Изобретение относится к медицинской микробиологии, в частности к способам определения способности холерных вибрионов к деструкции лецитина куриного желтка с использованием этого эффекта для идентификации возбудителя и для оценки его патогенных свойств.
Цель изобретения - ускорение способа и повышение его чувствительности.
Способ заключается в подготовке агарной среды с добавлением лецитинового субстрата, исследуемого материала в виде центрифугата. фильтрата или суточной культуры холерного вибриона в лунки диаметром 5-10 мм в объеме 0,1 мл,инкубировании
и визуальном определении лецитиназной активности по зонам расщепления лецитина ферментом. Причем в качестве лецитинового субстрата используют предварительно очищенный фильтрацией и подвергнутый замораживанию-оттаиванию лецитовител- лин в соотношении 1:25-1:30 к объему среды.
Способ позволяет получить четкие результаты определения лецитиназной активности уже через 24 ч за счет использования в качестве субстрата лецитовителлина вместо эмульсии куриного желтка.
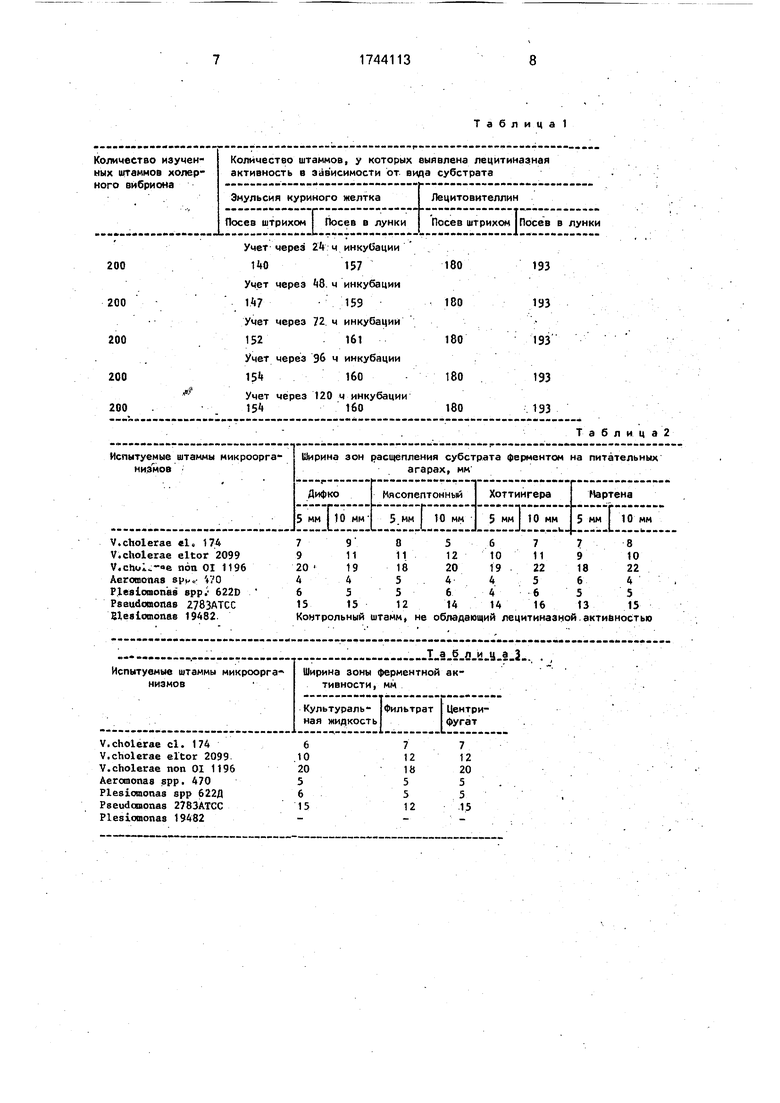
Из табл. 1 видно, что использование в качестве субстрата лецитовителлинз и по|
ш&
w
сев в лунки существенно повышают чувствительность метода определения лецити- назной активности у штаммов холерного вибриона,
Одновременно значительно сокращается время учета результата определения ферментной активности.
Способ осуществляют следующим образом.
Для получения лецитовителлина два свежих куриных желтка растирают в небольшом количестве физиологического раствора (5-10 мл). К эмульсии прибавляют 315 мг уксуснокислого кальция и 20 г каолина при постоянном помешивании. Затем добавляют 500 мл физраствора и в течение 1 ч смесь эмульгируют с использованием магнитной мешалки. Эмульсию центрифугируют при 2°С в течение 30-40 мин при 6000 об/мин. Надосадочную жидкость стерилизуют через фильтры Зейтца. Владипор или Миллипор (с диаметром пор 0,45 //) и разливают порциями по 10-50 мл во флаконы или колбы, которые хранят при температуре (-4)-(-20)°С. По мере необходимости субстрат размораживают и используют для определения лецитиназной активности микроорганизмов.
Для получения ферментсодержащего препарата в пробиоку с 5 мл 1 % пептонной воды засевают .к./мл приготовленной на физиологическом растворе взвеси испытуемого штамма и инкубируют в термостате при 37°С в течение 18-24 ч. Выросшую культуру центрифугируют при 6000 об/мин в течение 30 мин при температуре 0-2°С или же фильтруют через фильтры с диаметром пор 0,45//. В качестве ферментсодержащего препарата может использоваться как взвесь 24-часовой культуры холерного вибриона в1% пептонной воде, так и фильтрат или центрифугат этой культуры
Питательный агар для культивирования холерного вибриона, рН 7,8 {мясопептон- ный, Дифко, Мартена, Хоттингера) плавят в колбе на кипящей водяной бане, охлаждают до 45°С и вносят на 100 мл агара 3-4 мл лецитовителлина. После этого агар тщательно перемешивают встряхиванием и разливают в стерильные чашки Петри по 25 мл. Розлив необходимо проводить на строго горизонтальной поверхности, чтобы толщина агарового слоя, содержащего субстрат, была равномерной по всей поверхности чашки, После полного застывания агаровых пластин металлическим пробойником делают лунки диаметром 0,5-1,0 см, на дно которых закапывают по 1-2 капли расплавленного агара. На одной чашке можно расположить 6 8 лунок В лунки агаровых пластин вносят по 0,1 мл ферментного препарата изучаемых штаммов в виде культуральной жидкости, центрифугата или
фильтрата Чашки помещают в термостат при 37°С на 24 ч. Просмотр чашек проводят в проходящем свете. Вокруг лунок в случае положительного результата появляются ореолы, имеющие в зависимости от использованного питательного агара вид двух-или трехконтурного кольца. На агаре Дифко, в частности, просматривается1 внутренняя прозрачная зона, которая образуется возможно за счет действия протеолитических
ферментов, На других агарах такая зона, как правило, отсутствует О специфической активности лецитиназы свидетельствует образование вокруг лунки матового кольца с металлическим блеском за счет образования свободного фосфора, окруженное снаружи зоной просветления, образованной в результате растворения продуктов липо- лиза лецитина, входящего в состав лецитовителлина. Ширину зоны активности
фермента можно измерять при помощи мил- лиметровой линейки от края лунки.
Способ иллюстрируется следующими примерами.
Пример 1. Готовят с лецитовителлином две чашки питательного агара Дифко, мясопептонного, Хоттингера и Мартена Соотношение лецитовителлина и агара 1:25. В одной из пластин каждого из агаров делают пробойником по 6 лунок диаметром 5 мм. в
другой - диаметром 10 мм. Далее в каждую из лунок вносят по 0,1 мл суточной культуры в 1 % пептонной воде одного из 6 испытуемых штаммов. Инкубирование проводят при 37°С в течение 1 сут, после чего учитывают
результаты по наличию и размерам зон расщепления субстрата ферментом лецитина- зой.
В табл. 2 представлены данные о ферментативной активности изученных штаммов при использовании различных питательных агаров.
Как видно из табл. 2, все шесть испытуемых штэммов обла дали лецитиназной активностью. При этом ширина зон активности фермента имела значительные колебания в зависимости от использованной питательной среды и от диаметра лунок.
Пример 2. В 3 чашки Петри с агаром Дифко и с лецитовителлином делают по шесть лунок диаметром 5 мм. В лунке одной из агаровых пластин вносят по 0,1 мл культуральной жидкости каждого из шести испытуемых штаммов, в лунки другой г|ластины - по 0,1 мл фильтрата тех же культур, в лунки третьей пластины - по 0,1 мл центрифугата.
В табл.3 представлены сравнительные данные о ферментативной активности изу- ценных штаммов в зависимости от характе- ра используемого ферментного препарата.
Как следует из табл. 3, величина зоны ферментативной активности не обнаружила значительных колебаний в зависимости от того, использовалась ли в качестве фермен- тного препарата суточная культура микроорганизма в жидкой питательной среде или же центрифугат, или же фильтрат этой культуры.
Пример 3. Готовят 10 чашек Петри с разными соотношениями лецитовителлина и агара Дифко. В каждой из чашек в агаровой пластине делают пробойником по 2 лунки диаметром 10 мм и в каждую из лунок вносят по 0,1 мл суточной культуры в 1% пептонной воде после инкубирования испы- туемых штаммов холерного вибриона.
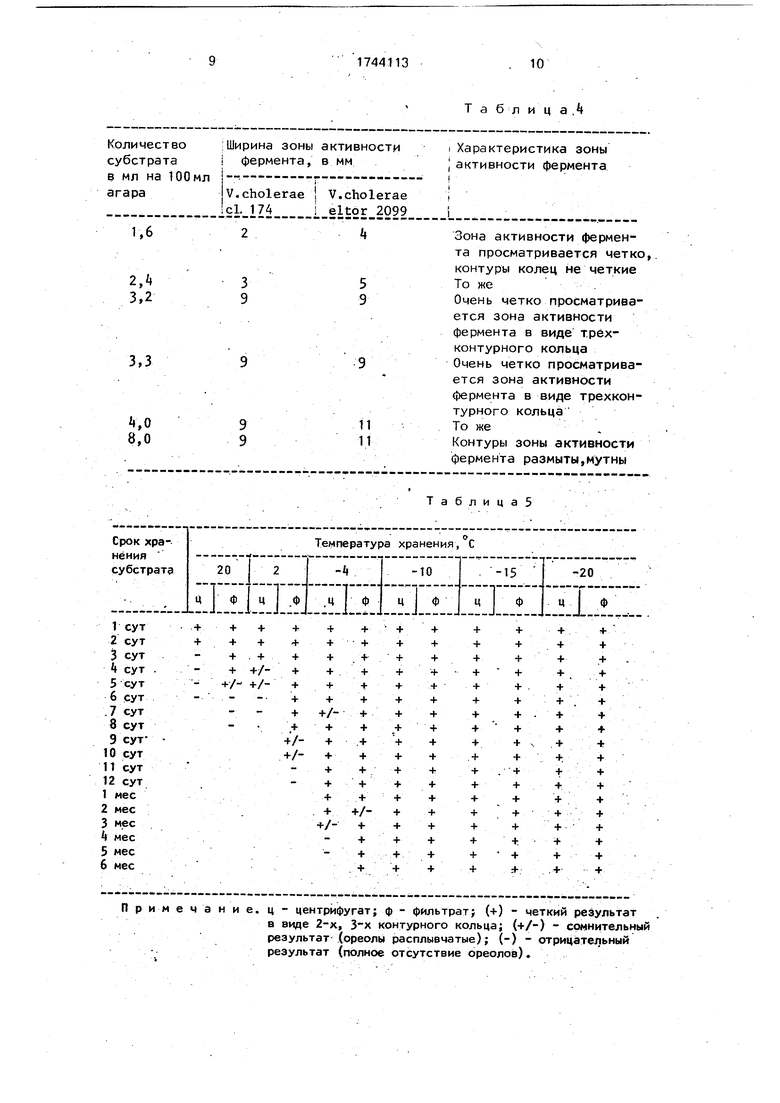
В табл. 4 представлены данные о ферментативной активности изученных штаммов при различных соотношениях лецитовителлина и агара Дифко.
Представленные в табл. 4 данные свидетельствуют о том, что оптимальным соот- ношением лецитовителлина и-агара является 1:25 или 1:30.
Пример 4.Два свежих куриных- желтка растирают в небольшом количестве физиологического раствора (5-10 мл). К эмульсии прибавляют 315 мг уксуснокислого кальция и 20 г каолина при постоянном помешивании. Затем добавляют 500 мл физраствора и в течение 1 ч смесь эмульгируют с использованием магнитной мешалки. Полученный препарат центрифугируют при 2°С в течение 30-40 мин при 6000 об/мин. Часть надосадочной жидко- сти фильтруют через фильтр Владипор (диаметр пор 0,45 ft). Лецитовителлин в виде центрифугата и фильтрата разливают по 10- 50 мл во флаконы и колбы и помещают в холодильную камеру при температуре 2; -4; -10; -15. -20°С. Качество субстрата контролируют ежедневно в течение первых 10 дн, хранения при разных температурах, а в последующем ежемесячно в течение 6 мес.
В качестве ферментного препарата ис- пользуют центрифугат холерного вибриона биовара эльтор 2099.
При использовании лецитовителлина хранящегося в холодильной камере при 2°С, ореолы, свидетельствующие о наличии лецитиназной активности, появляются в течение 3 дн при использовании в качестве субстрата центрифугата и 8 дн.- фильтрата.
По истечении этих сроков центрифугат и фильтрат лецитовителлина становятся
мутными. При высеве из них появляется по- стоянная микрофлора, а зоны вокруг лунок не появляются, что свидетельствует о разрушении субстрата. Хранение полученного субстрата при комнатной температуре приводит к резкому изменению его свойств уже в первые сутки (1-4 дн}.
Хранение лецитовителлина как в виде центрифугата, так и фильтрата в замороженном состоянии позволяет получить четкие ореолы в виде 2- и 3- контурного кольца в течение 2-6 мес.
Результаты определения лецитиназной активности штамма холерного вибриона № 2099 в зависимости от температуры и срока хранения лецитовителлина приведены в таблице 5.
Пример 5. Готовят две группы чашек Петри по 9 чашек в каждой с агаром Дифко. В качестве субстрата используют лецитовителлин разного срока хранения при температуре -4°-(-20)0С. В качестве ферментного препарата используют культуральную жидкость двух штаммов холерного вибриона, вносимую в количестве 0.1 мл в лунки диаметром 10 мм.
В табл. 6 представлена зависимость величины ферментативной активности изучаемых штаммов от срока хранения лецитовителлина.
Как следует из табл. 6. максимальные показатели ферментативной активности регистрируют при использовании в качестве субстрата лецитовителлина. который хранят в замороженном состоянии не более 6 мес.
Таким образом, способ позволяет сократить время определения лецитиназной активности холерных вибрионов и повысить чувствительность.метода.
Формула изобретения Способ определения лецитиназной активности холерных вибрионов, предусматривающий внесение исследуемого материала в плотную питательную среду, содержащую лецитиновый субстрат, инкубирование и определение лецитиназной активности по образованию зон просветления, отличающийся тем, что, с целью ускорения способа и повышения его чувствительности, в качестве лецитинового субстрата используют предварительно очищенный фильтрацией и подвергнутый замораживанию-оттаиванию лецитовителлин, взятый в соотношении 1:25-1:30 к объему среды, а исследуемый материал вносят в лунки в агаровой среде диаметром 5-10 мм в виде центрифугата, или фильтрата, или суточной культуры холерного вибриона в объеме 0,1 мл.
Таблица 1



| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИФФЕРЕНЦИАЦИИ ШТАММОВ VIBRIO CHOLERAE 0139 СЕРОГРУППЫ ПО АЛКИЛСУЛЬФАТОЗНОЙ АКТИВНОСТИ | 2011 |
|
RU2473697C2 |
| Способ внутривидовой дифференциации @ @ биотипа Эль Тор | 1981 |
|
SU1030410A1 |
| Питательная среда для определения лецитиназной активности синегнойной палочки | 1981 |
|
SU1067042A1 |
| Питательная среда для определения амилолитической активности вибрионов | 1977 |
|
SU637430A1 |
| Штамм бактерий VIвRIо сноLеRас еLтоR-продуцент умеренного фага П серотипа у1 гетероиммунной категории | 1986 |
|
SU1388423A1 |
| Способ повышения чувствительности холерных вибрионов к антибактериальным препаратам | 2018 |
|
RU2688165C1 |
| Реагент для идентификации вибрионов | 1982 |
|
SU1129235A1 |
| Штамм бактерий VIвRIо сноLеRае еLтоR-источник умеренного фага ХШ серовара УП гетероиммунной категории | 1987 |
|
SU1454849A1 |
| Штамм бактерий VIвRIо сноLеRае еLтоR - источник умеренного фага х1 серотипа 1х гетероиммунной категории | 1988 |
|
SU1551735A1 |
| СПОСОБ ОЦЕНКИ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ ЛАКТОБАЦИЛЛ И БИФИДОБАКТЕРИЙ ОТНОСИТЕЛЬНО ХОЛЕРНЫХ ВИБРИОНОВ IN VITRO | 2012 |
|
RU2487943C1 |
Изобретение относится к медицинской микробиологии, в частности к способам определения способности холерных вибрионов к деструкции лецитина куриного желтка с использованием этого эффекта для идентификации возбудителя и для оценки его патогенных свойств. Цель изобретения - ускорение способа определения лецитиназ- ной активности холерных вибрионов и повышение его чувствительности. Способ заключается в подготовке агаровой среды с добавлением лецитинового субстрата, внесении исследуемого материала в виде цент- рифугата, фильтрата или суточной культуры холерного вибриона в лунки диаметром 5- 10 мм в объеме 0,1 мл, инкубировании и .визуальном определении лецитиназной активности по зонам расщепления лецитина ферментом. Причем в качестве лецитинового субстрата используют предварительно очищенный фильтрацией и подвергнутый замораживанию - оттаиванию лецитовител- лин в соотношении 1:25-1:30 к объему среды. Способ позволяет получить четкие результаты определения лецитиназной активности уже через 24 ч. 6 табл. (Л С
Таблицэ2
Количество Ширина зоны активности субстрата фермента, в мм
в мл на 100мл ;
агараV.cholerae V.cholerae
cl. 174: eltor 2099
1,6
2,4 3,2
3 9
3,3
Примечание, ц- центрифугат; ф - фильтрат; (+) - четкий результат
в виде 2-х, 3-х контурного кольца; (+/-) - сомнительный результат (ореолы расплывчатые); (-) - отрицательный результат (полное отсутствие ореолов).
Таблица Л
Характеристика зоны активности фермента
)
Зона активности фермента просматривается четко, контуры колец не четкие То же
Очень четко просматривается зона активности фермента в виде трех- контурного кольца Очень четко просматривается зона активности фермента в виде трехкон- турного кольца
7 6 8 9 7 6 6 V
Т а 6 л и Ц а 6
11 10 12 10
9 11

| Mac Farlane M.G., Knight B.C., The biochemistry of bacterial toxins | |||
| The Lecitlnase actlvityo Cl | |||
| Welchii toxins | |||
| Blochem.J.,1941, v.35, p.884-896 Домарадский Н.В | |||
| и др | |||
| Микробиология и лабораторная диагностика холеры | |||
| Ростов н/Д, 1975, с | |||
| Аппарат для радиометрической съемки | 1922 |
|
SU124A1 |
Авторы
Даты
1992-06-30—Публикация
1989-06-05—Подача