Изобретение относится к биологии и медицине и может быть использовано преимущественно для диагностики рака простаты, а также для дифференциальной диагностики других заболеваний с использованием иммуноферментного анализа на ранних стадиях заболевания.
Известно получение простатической кислой фосфатазы из ткани простаты, включающее гомогенизирование ткани с твином 80, центрифугирование, осаждение сульфатом аммония 30% насыщения, затем повторное осаждение центрифугированием, растворение осадка дистиллированной водой, длительный диализ (16 ч) и последующую очистку хроматографией и изоэлектрофокусирование.
Однако конечный продукт получается с низкой удельной активностью. Процесс получения препарата длителен из-за многократного переосаждения, центрифугирования и длительного диализа.
Известен также способ получения простатической кислой фосфатазы (далее по тексту ПКФ) из эякулята человека.
Наиболее близким к предлагаемому является способ получения простатической кислой фосфатазы, включающий выделение из эякулята спермоплазмы центрифугированием, экстракцию суммарной белковой фракции и ее хроматографическую очистку на фенилсефарозе GL-4B с элюцией снижающимся градиентом сульфата аммоний от 1 до 0,1 М, на сефадексе G-200 и на целлюлозе ДЕ-52 с элюцией возрастающим градиентом хлористого натрия от 0,05 до 1 М.
Недостатками этого способа являются недостаточная экспрессность получения препарата из-за многостадийной хроматог- рафической очистки, большой расход сырья и реагентов. Кроме того, из одной пробы
vj
Jb
ч|
Ш 00
такого дефицитного сырья получают только один инградиент - ПКФ.
Целью изобретения является расширение технических возможностей способа путем одновременного выделения специфического простатического антитела.
Поставленная цель достигается тем, что согласно способу, включающему получение эякулята, выделение из него спермоплазмы, фракционирование на фенилсефарозе GL- 4В и последующую хроматографическую очистку полученных фракций, после фракционирования на фенилсефарозе выделяют две фракции, содержащие простатическую кислую фосфатазу и простатический антиген, соответственно, и подвергают фракцию, содержащую простатическую кислую фосфатазу хроматографической очистке на голубой сефарозе в 0,01 М трис-HCt буфере, рН 7,4 и на сефадексе G-150, а фракцию, содержащую простатический специфический антиген, подвергают хроматографической очистке последовательно на сефадексах G-150 и G-100.
Способ выполняют следующим образом.
Получают эякулят человека, из которого затем получают спермоплазму путем центрифугирования эякулята. Затем к спермоп- лазме добавляют сульфат аммония (ЬЖфЗСМ) до концентрации 1 М (2,7 г) и проводят гидрофобную хроматографию на колонке с фенилсефарозой GL-4B. Элюцию белков проводят ступенчатым градиентом снижающихся концентраций сульфата аммония. Затем фракции, элюированные 0,4 М (NN4)2804 и содержащие ПКФ-активность, сливают вместе и концентрируют ультрафильтрацией. Фракции, элюированные 0,01 М трис-HCI буфером и содержащие ПСА-ак- тивность, объединяют и концентрируют ультрафильтрацией. Затем фракцию, содержащую ПКФ-активность, диализуют против 0,01 М трис-буфера и вносят в колонку с голубой сефарозхой, уравновешенную тем же буфером. ПКФ-активность обнаруживалась вофракциях, не сорбировавшихся на обменнике. Эти фракции объединяют и концентрируют. Сконцентрированный материал подвергают гель-фильтрации на колонке с сефадексомС-150, уравновешенной 0,15 м3 раствором NaCl в 0,01 М трис-НС буфере.
Для дальнейшей очистки ПСА сконцентрированный материал наносят на колонку с сефадексом G-150, подвергают гель-фильтрации на колонке с сефадексом, уравновешенной 0,01 М трис-HCI буфером. Фракции, содержащие ПСА-активность объединяют, концентрируют и повторно подвергают
гель-фильтрации на колонке с сефадексом G-100.
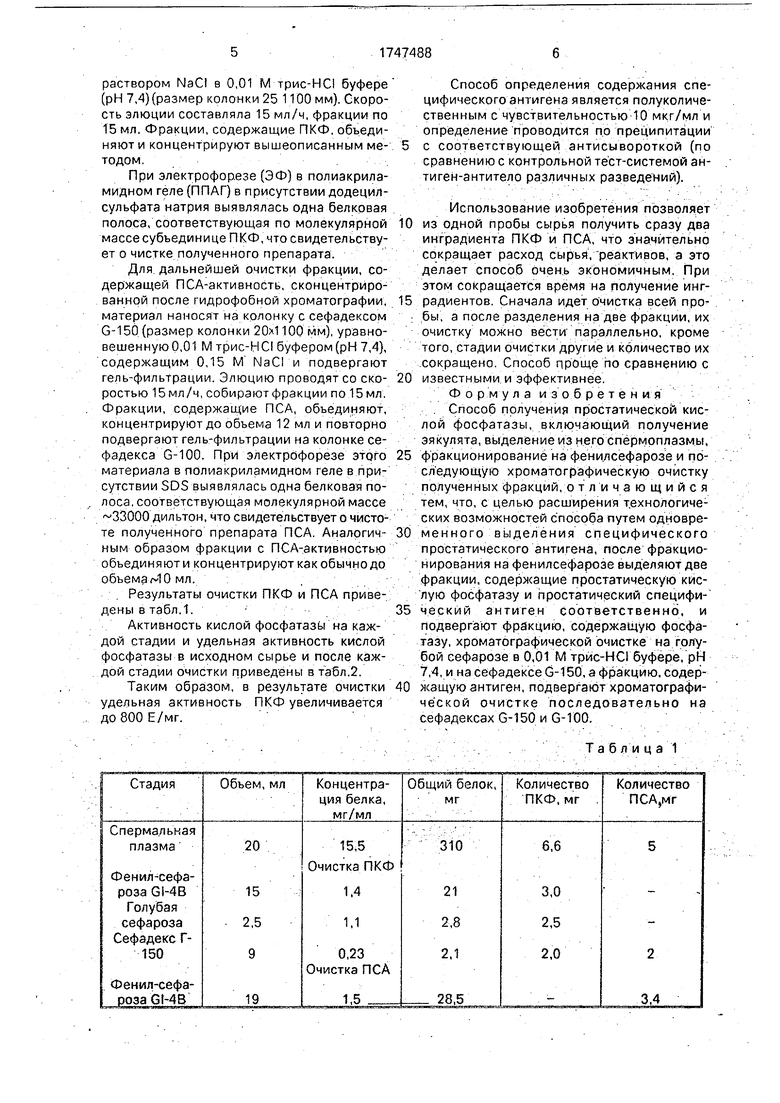
Пример. Берут 20 мл эякулята. Этот объем центрифугируют 15 мин при 1000 g
для отделения спермоплазмы от клеточных элементов эякулята. Затем к полученной спермоплазме добавляют сульфат аммония до концентрации 1 М (2,7 г) и проводят гидрофобную хроматографию на колонке с фе0 нилсефарозой GL-4B (размер колонки 30 100 мм), уравновешенную 1 М (NN4)2804 в 0,01 М трис-НС буфере (рН 7,4) Элюцию белков проводят ступенчатым градиентом снижающихся концентраций сульфата ам5 мония в следующем порядке: 1 М - 150 мл; 0,8 М - 100 мл; 0,5 М - 100 мл, 0,4 М - 300 мл, далее 0,01 М трис-HCI буфером (рН 7,4). Скорость элюции - 100 мл/ч, фракции по 15 мл. В этой и последующих хроматографиче0 ских процедурах полученные фракции анализируют в иммунопреципитационном анализе со специфическим тест-системами для ПКФ и ПСА. Фракции, элюированные 0,4 М (NH/j)2S04, содержащие ПКФ-актив5 ность-были слиты вместе и сконцентрированы ультрафильтрацией на фильтре УМ-10 (Amicon) до объема 12 мл, Фракции, элюированные 0,01 М трис-HCI буфером и содержащие ПСА -активность, объединяют и
0 концентрируют, как указано выше, до объема 12 мл,
Сконцентрированные материалы подвергают анализу на содержание белка по методу Лоури и полуколичественной оценке
5 на содержание инградиентов (ПКФ и ПСА) в преципитзционных тест-системах с чувствительностью 3 мкг/мл. Кроме того, на конечном этапе была определена ферментативная активность препарата
0 ПКФ (данные приведены в таблице).
Таким образом, получают две фракции, одна из которых содержит ПКФ-активность, а другая - ПСА-активность. Далее берут одну из фракций, например содержащую
5 ПКФ-активность, диализуют в течение ночи против 0.01 М трис-буфера (рН 7,4) Отдиа- лмзованный материал вносят в колонку с голубой сефарозой (размеры колонки 20 160 мм), уравновешенную тем же буфером. Э л ю0 цию проводят 0,01 М трис-НС буфером (рН 7,4). В этих условиях ПКФ не сорбировали на колонке. Скорость колонки 20 мл/ч, фракции по 15 мл.
ПКФ-активность обнаруживалась во
5 фракциях, не сорбировавшихся на обменнике. Эти фракции объединяют и концентрируют до объема 12 мл, как описано выше, Сконцентрированный материал подвергают гель-фильтрации на колонке с сефадексом G-150, уравновешенной 0,15 М
раствором NaCI в 0,01 М трис-HCI буфере (рН 7,4)(размер колонки 25 1100 мм). Скорость элюции составляла 15 мл/ч, фракции по 15 мл. Фракции, содержащие ПКФ, объединяют и концентрируют вышеописанным методом,
При электрофорезе (ЭФ) в полиакрила- мидном геле (ППАГ) в присутствии додецил- сульфата натрия выявлялась одна белковая полоса, соответствующая по молекулярной массе субъединице ПКФ, что свидетельствует о чистке полученного препарата.
Для дальнейшей очистки фракции, содержащей ПСА-активность, сконцентрированной после гидрофобной хроматографии, материал наносят на колонку с сефадексом G-150 (размер колонки 20x1100 мм), уравновешенную 0,01 М трис-HCI буфером (рН 7,4), содержащим 0,15 М NaCI и подвергают гель-фильтрации. Элюцию проводят со скоростью 15 мл/ч, собираютфракции по 15 мл, Фракции, содержащие ПСА, объединяют, концентрируют до объема 12 мл и повторно подвергают гель-фильтрации на колонке се- фадекса G-100. При электрофорезе этого материала в полиакриламидном геле в присутствии SDS выявлялась одна белковая полоса, соответствующая молекулярной массе 33000 дильтон, что свидетельствует о чистоте полученного препарата ПСА. Аналогичным образом фракции с ПСА-активностью объединяюти концентрируют как обычно до объема МО мл.
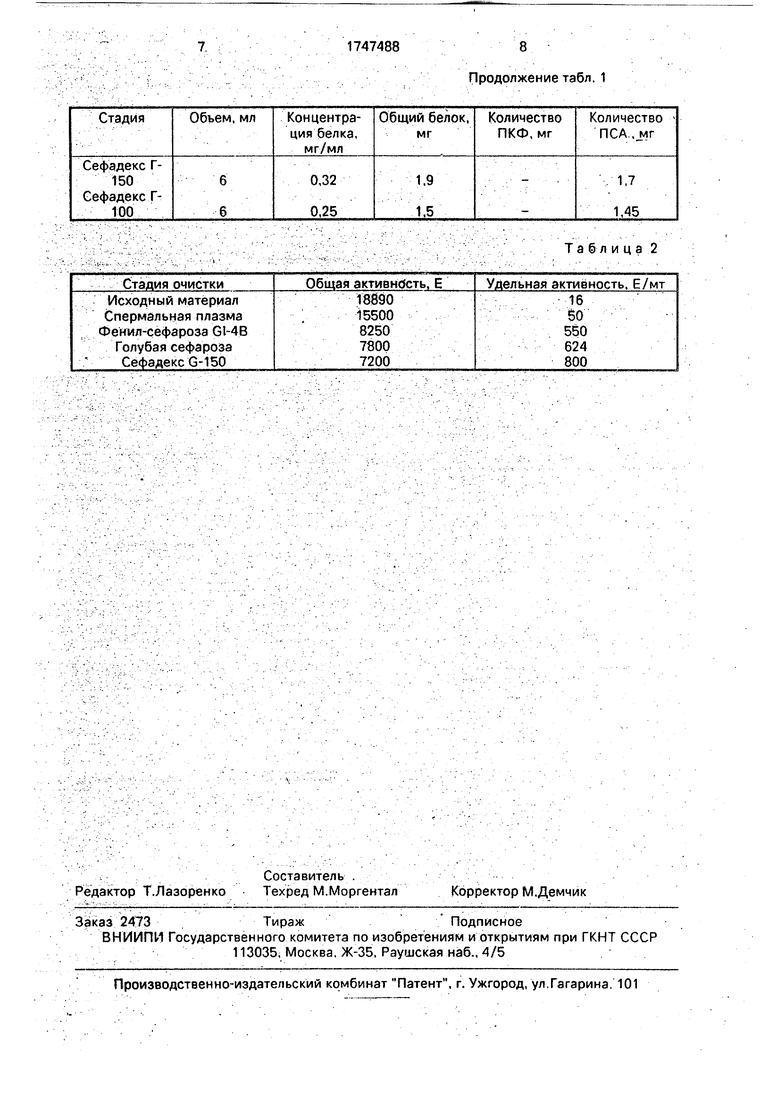
Результаты очистки ПКФ и ПСА приведены в табл.1.
Активность кислой фосфатазы на каждой стадии и удельная активность кислой фосфатазы в исходном сырье и после каждой стадии очистки приведены в табл.2.
Таким образом, в результате очистки удельная активность ПКФ увеличивается до 800 Е/мг.
Способ определения содержания специфического антигена является полуколичественным с чувствительностью 10 мкг/мл и определение проводится по преципитации с соответствующей антисывороткой (по сравнению с контрольной тест-системой антиген-антитело различных разведений).
Использование изобретения позволяет
из одной пробы сырья получить сразу два инградиента ПКФ и ПСА, что значительно сокращает расход сырья, реактивов, а это делает способ очень экономичным, При этом сокращается время на получение инградиентов. Сначала идет очистка всей пробы, а после разделения на две фракции, их очистку можно вести параллельно, кроме того, стадии очистки другие и количество их сокращено. Способ проще по сравнению с
известными и эффективнее.
Формула изобретения Способ получения простатической кислой фосфатазы, включающий получение эякулята, выделение из него спермоплазмы,
фракционирование на фенилсефарозе и последующую хроматографическую очистку полученных фракций, отличающийся тем, что, с целью расширения технологических возможностей способа путем одновременного выделения специфического простатического антигена, после фракционирования на фенилсефарозе выделяют две фракции, содержащие простатическую кислую фосфатазу и простатический специфический антиген соответственно, и подвергают фракцию, содержащую фосфатазу, хроматографической очистке на голубой сефарозе в 0,01 М трис-HCI буфере, рН 7,4, и на сефадексе G-150, а фракцию, содержащую антиген, подвергают хроматографи- чёской очистке последовательно на сефадексах G-150 и G-100.
Таблица 1
Продолжение табл. 1

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выделения кислой фосфатазы | 1988 |
|
SU1576564A1 |
| Способ очистки щелочной фосфатазы | 1988 |
|
SU1554377A1 |
| Способ выделения ингибитора ангиотензин-1-превращающего фермента из яда животного происхождения | 1990 |
|
SU1730088A1 |
| Способ получения эхинококкового диагностического антигена для иммуноферментного анализа | 1985 |
|
SU1363564A1 |
| Способ получения эндонуклеазы рестрикции @ | 1988 |
|
SU1634713A1 |
| СПОСОБ ПОЛУЧЕНИЯ α -ГЛОБУЛИНА ПУЗЫРНОЙ ЖИДКОСТИ, АССОЦИИРОВАННОГО С ИСТИННОЙ ПУЗЫРЧАТКОЙ | 1993 |
|
RU2043117C1 |
| Способ получения фосфоэстераз гриба РеNIсILLIUм вRеVI-сомрастUм | 1986 |
|
SU1402619A1 |
| Способ получения щелочной фосфатазы | 1990 |
|
SU1713265A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИЗОСТАФИНА | 2007 |
|
RU2342430C1 |
| Способ выделения раковоэмбрионального антигена | 1984 |
|
SU1363562A1 |
Использование: диагностика рака простаты, ранняя дифференциальная диагностика с использованием иммуноферментного анализа. Сущность изобретения: фракционирование спермоплазмы на фенилсефарозе и хроматографическая очистка фракций. Фракцию с кислой фосфатазой очищают методами аффинной хроматографии и гельп- роникающей хроматографией (ГПХ). Фракцию с простатическим специфическим антигеном очищают методом ГПХ. Из 20 мл спермоплазмы получают 2 мг кислой фосфа- тазы с удельной активностью 800 ед/мг и 1,45 мг простатического специфического антигена. 2 табл.
Таблица 2
| Vinko P., Kentturi М., Kerhonen L.K | |||
| Isolation and characterisation of acid phosphatase fron prostate | |||
| - Clinical Chemistry, 1978, № 3, p | |||
| Электромагнитное реле | 1922 |
|
SU466A1 |
| Способ выделения кислой фосфатазы | 1988 |
|
SU1576564A1 |
Авторы
Даты
1992-07-15—Публикация
1990-01-05—Подача