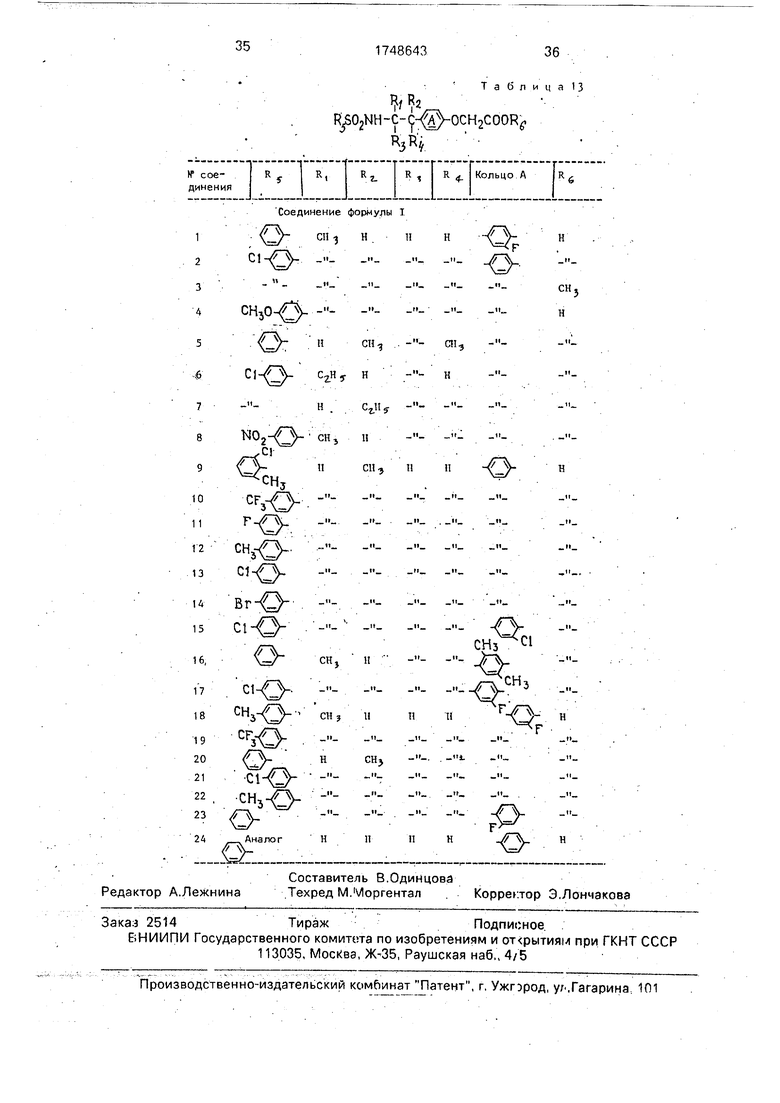
Изобретение относится к замещенным амидам арилсульфокислот, а именно к способу получения производных феноксиуксус- ной кислоты общей формулы
R 2 R5S02NH-C- C- -OCH COOfy
Яз ty -,
или их фармацевтически-приемлемых солей, где один или два Ri, Ra, Яз, Ri - низший алкил, а другие - водород;
кольцо А - фенилен, которая может иметь один или два заместителя, выбранных из группы: галоген, низший алкил;
RS - фенил, который может иметь один или два заместителя, выбранных из группы: галоген, нитро тригалогенметил, низший алкил, низший алкокси;
Re - водород, низший алкил.
Соединения формулы I проявляют агрегационную активность и могут найти применение в медицине.
Целью изобретения является разработка способа получения новых соединений, проявляющих бепее пысокую агрегационную активность и обладающих низкой токсичностью.
П р и м е р 1. (1) Смесь 4,64 г гидробромида (±Н-(2-аг/ин-1-м(ггилэтил)фенола, 100
2
00 Os JV GO
СО
мл этилацетата, 6,92 г карбоната калия, 40 мл воды и 3,75 г хлорида бензилоксикарбо- нила перемешивают при комнатной температуре в течение ночи, после чего отделяют слой этилацетата, промывают, высушивают и выпаривают при пониженном давлении для удаления растворителя. Получают 4,82 г (±)-4-(2-бензилоксикарбониламин-1-метил- этил)фенола в виде бледно-желтого масла. Выход 85%.
Масса (м/э): 285 (М44)
ИК v чистый макс, см 1: 3350, 1690.
(2)Смесь 4,72 г продукта, полученного выше, 2,53 г метилбромацетата, 50 мл ацетона и 3,43 г карбоната калия перемешивают при комнатной температуре в течение ночи. По окончании реакции смесь выпаривают для удаления ацетона и к остатку добавляют воду, Водную смесь экстрагируют с хлороформом, а затем экстракт высушивают и выпаривают при пониженном давлении и получают 5,68 г метил (±)-4-(2- бензилоксикарбонил-амин-1-метил этил)фе- ноксиацетата в виде масла.
Выход 96% Масса (м/э): 357 (М4) ИК v чистый макс, 3200-3500, 1755, 1712.
(3)5,36 г полученного вещества растворяют в 60 мл метанола и добавляют 2 мл концентрированной хлористоводородной кислоты. Смесь подвергают каталитической гидрогенизации в присутствии 0,6 г 10%-ного Pd/C при комнатной температуре при пониженном давлении, По окончании реакции ката- лизатор отфильтровывают и фильтрат выпаривают при пониженном давлении. Остаток перекристаллизовывают из смеси изопро- пилового спирта и эфира и получают 3,06 г гидрохлорида метил (±)-4(2-амин-1-метилэ- тил) феноксиацетата в виде бесцветных кристаллов.
Выход 79%,
Т.пл.99-104°С.
Масса (м/э): 223 (М4)
ИК v макс (см 1): 2400-2800, 1732,
(4)Смесь 2,0 г полученного выше продукта, 60 мл этилацетата, 2,06 г карбоната калия, 20 мл воды и 2,05 г 4-нитрофенил- сульфонилхлорида перемешивают при комнатной .температуре 2,5 ч. По окончании реакции отделяют слой этилацетата, высушивают и выпаривают при пониженном давлении. Остаток растирают с изопро- пиловым эфиром и получают 2,95 г метил (±)(4-нитрофенил) сульфониламин-1- метилэтил феноксиацетата в виде бледно- желтого твердого вещества. Выход 94%, Т.пл. 128,5-130,5°С. Растворяют в 20 мл метанола и добавляют 15 мл 11 1-водного раствора гидроокиси натрия, Смесь оставляют на 1 ч. Затем смесь выпаривают для удаления метанола, доводят рН до 1 10%-ной хлористоводородной кислотой и экстрагируют с хлороформом. Экстракт хлороформа высушивают и выпаривают для удаления растворителя получают2,82г(±)(4-нит- рофенил) сульфониламин-1-метилэтил фё- ноксиуксусной кислоты в виде вязкого масла.
Выход 100%. Масса (м/э): 394 (М4), HKv CHCIa макс, (см 1): 1730. Натриевая соль: призма Т.пл. 226- 228,5°С (перекристаллизация из воды и изо- пропилового спирта).
Пример 2-4 (получение исходных соединений общей формулы II). ч (1) Соответствующие исходные соединения реагируют как указано в примере 1 - (1), (2) и (3) и получают соединения, указанные в табл. 1.
(2) Соответствующие исходные соедине-,
ния реагируют, как указано в примере 1 - (4) и
,(5), получают соединения, указанные в табл. 2,
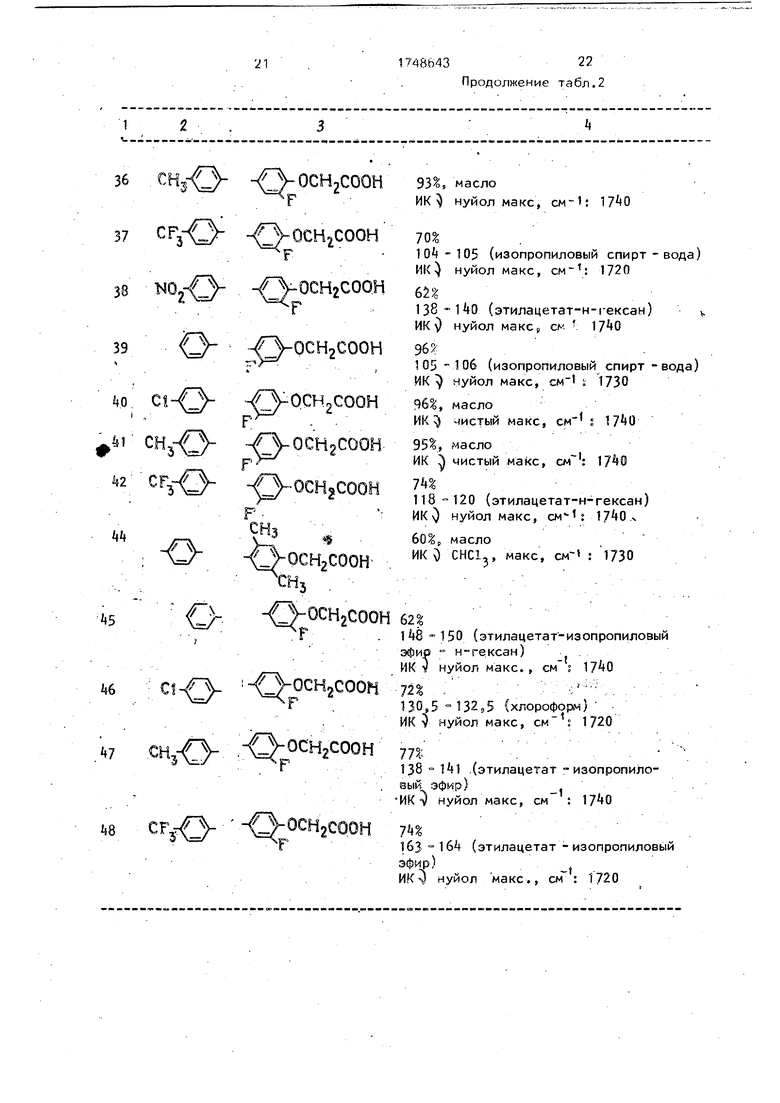
| Примеры 5-48. Соответствующие
i исходные соединения реагируют, как указано в примере 1, и получают соединения, .указанные в табл. 2.. -
П ри мер49. Смесь 1,56 г гидрохлорида метил (±)-4-(2-аминопропил)-феноксиацета- та, 48 мл этилацетата, 2,07 г карбоната калия, 16 мл воды и 1,6 г хлорида 4-нитрофе- нилсульфонила перемешивают при комнатной температуре в течение ночи Отделяют слой этилацетата, высушивают и выпарива- ют при пониженном давлении для удаления растворителя. Остаток перекристаллиэовы- вают из смеси этилацетата и н-гексана и получают 2,14 г метил (±)(4-нитрофе- нил)сульфониламинопропил(Ьеноксиацета та в виде бледно-желтой призмы.
Выход 87%.
Т.пл. 127,5-128°С,
Масса (м/э): 408 (М4)
ИК v нуйол макс, 3320, 3280, 1740.
ЯМР (CDCb, 5): 1,21 (ЗН, д, J 6,4 Гц);
2,5-2,7 (2Н, м); 3,3-3,7 (1Н, м), 3,81 (ЗН, с);
4,58 (2Н, с); 6,67 (2Н, д, J 8,3 Гц); 6,91 (2Н. д,
J 8,3 Гц); 7,78 (2Н, д, J 8,7 Гц): 8,22 (2Н, д,
J 8,7 Гц).
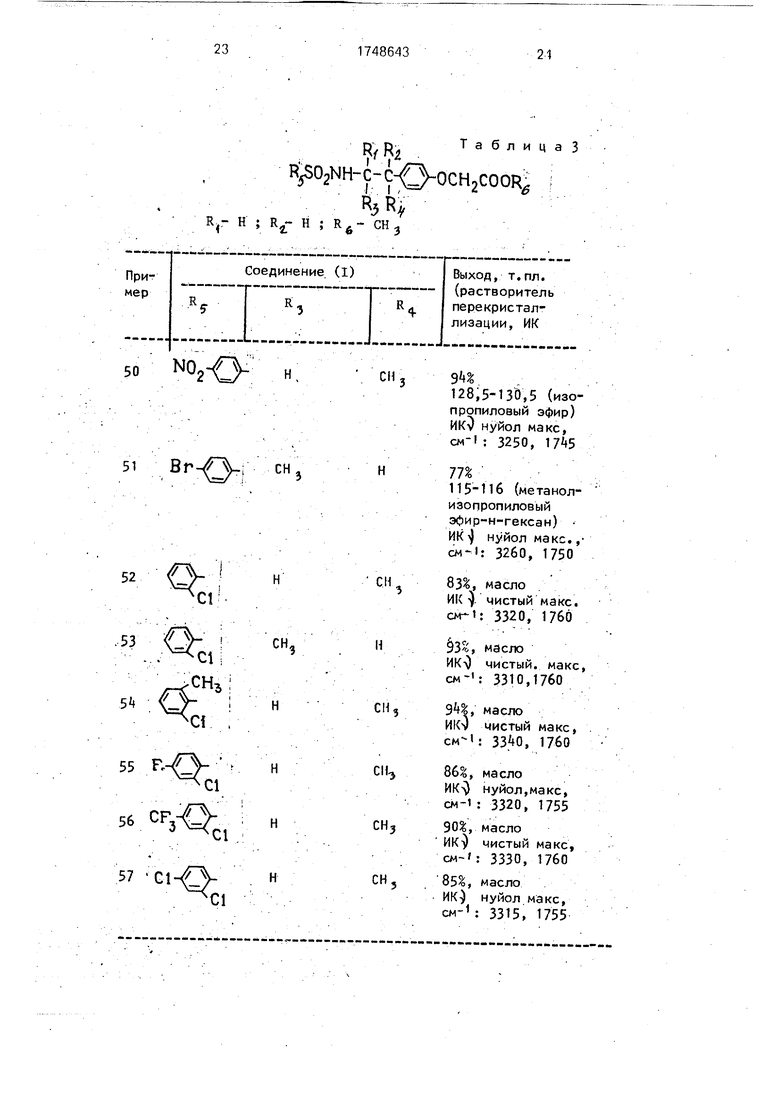
Примеры 50-57. Соответствующие исходные соединения реагируют, как описано в примере 49, и получают соединения, указанные в табл. 3.
П р и м е р 58. (1) 23,1 г (±)-4-(2-ацетила- мин-1-метилэтил)фенола растворяют в 400 мл ацетона, добавляют 19,9 г метилброма- цетата и 18 г карбоната калия и смесь перемешивают в течение ночи. Добавляют еще 7,96 г метилбромацетата и 7,2 г карбоната калия и смесь перемещивают 3 дня. По окончании реакции смесь выпаривают при пониженном давлении и к остатку добавляют воду. Затем остаток экстрагируют с помощью этилацетата, промывают насыщенным водным раствором хлорида «атрия, высушивают, конденсируют до сухости, пол- учают31,б гметил (±)-4-(2-ацетиламин-1-ме- тилэтил)феноксиацетата в виде желтого масла.
Масса (м/э): 265 (М4).
ИК Унуйол макс, см 1: 3310, 1760, 1650.
(2)Полученное выше вещество растворяют в 200 мл 6М-хлористоводородной кислоты и раствор нагревают с обратным холодильником 7,5 ч, По окончании реакции отфильтровывают растворитель и остаток кристаллизуют с тетрагидрофураном и получают 19 г гидрохлорида (±)-4-(2-амин-1-ме- тилэтил) феноксиуксусной кислоты в виде бесцветных твердых веществ.
Т.пл. 220,5-223°С. Масса (м/э): 209 (М 179. ИК vнуйол макс, см 1: 1730,
(3)Смесь 2,95 г полученного вещества, 3,65 г карбоната калия, 30 мл воды и 2,45 г хлорида 4-фторфенилсульфонила перемешивают при 80°С 2 ч. После охлаждения рН доводят до 1 бМ-хлористоводородной кислотой и экстрагируют с помощью этилацетата. Экстракт конденсируют до сухости и полученную (±)(4-фторфенил)сульфо- ниламин-1-метилэтил феноксиуксусную кислоту в качестве остатка обрабатывают Ш-водным раствором гидроокиси натрия для преобразования в соль натрия. Затем указанную соль натрия очищают колоночной хроматографией с НР-20 и получают 2,82 г натрий (±)(4-фторфенил)сульфо- нил&мин-1-метилэтил феноксиацетата в виде порошка.
Выход 60%.
Т.пл. 213-214,5°С (бесцветная призма, перекристаллизированная из смеси воды и изопропилового спирта),
(4)1,95 г полученного вещества растворяют в 30 мл воды и рН доводят до 1 с помощью 10%-ной хлористоводородной кислоты. Смесь экстрагируют хлороформом. Экстракт хлороформа высушивают и выпаривают для удаления растворителя. Полученный остаток перекристаллизовыва- ют из смеси этилацетата и н-гексана и получают 1,65 г (±)(4-фторфенил)сульфо- ниламин-1-метилэтил феноксиуксусной кислоть в виде бесцветной призмы.
Выход 111,5-114°С.
5Н1-ЯМР(СОС(з, 5):1.19(ЗН,д,,2Гц),
2,6-3,3 (ЗН, м); 4,63 (2Н, с); 6,6-7,3 (7Н, м) 7,6-7,9 (2Н, м).
ИК v нуйол макс, см 1: 3300, 1740. Масса (м/э):367 (М4).
10 Примеры 59-61, Соответствующие исходные соединения реагируют, как указано в примере 58, и получают соединения, указанные в табл. 4.
Пример 62. Смесь 2,95 г гидрохлорида 15 (±)-4-(2-амин-1-метилэтил)феноксиуксусной кислоты, 3,82 г карбоната натрия, 30 мл воды и 3,1 г хлорида 2,5-дихлорфенилсуль- фонила перемешивают при 80°С 3 ч. Реагирующую смесь обрабатывают тем же 0 способом, что и в примере 43, после чего получают (±)(2,5-дихлорфенил)сульфо- ниламин-1-метилэтил феноксиуксусную кислоту.
Т.пл, 111,5-116,5°С (разлож.) (перекри- 5 сталлизация из смеси этилацетата и н-гексана).
ИК V нуйол макс, 3320, 1740, 1710.
Н1-ЯМР(СОС1з,(5):1,20(ЗН,д б,4Гц);
2,7-3,3 (ЗН, м); 4,65 (2Н, с); 4,95 (1Н. м); 6,82
0 (2Н, д, J 9 Гц); 7,04 (2Н, д, J 9 Гц); 7,3-7,5
(2Н, м); 7,9-8,1 (1Н м).
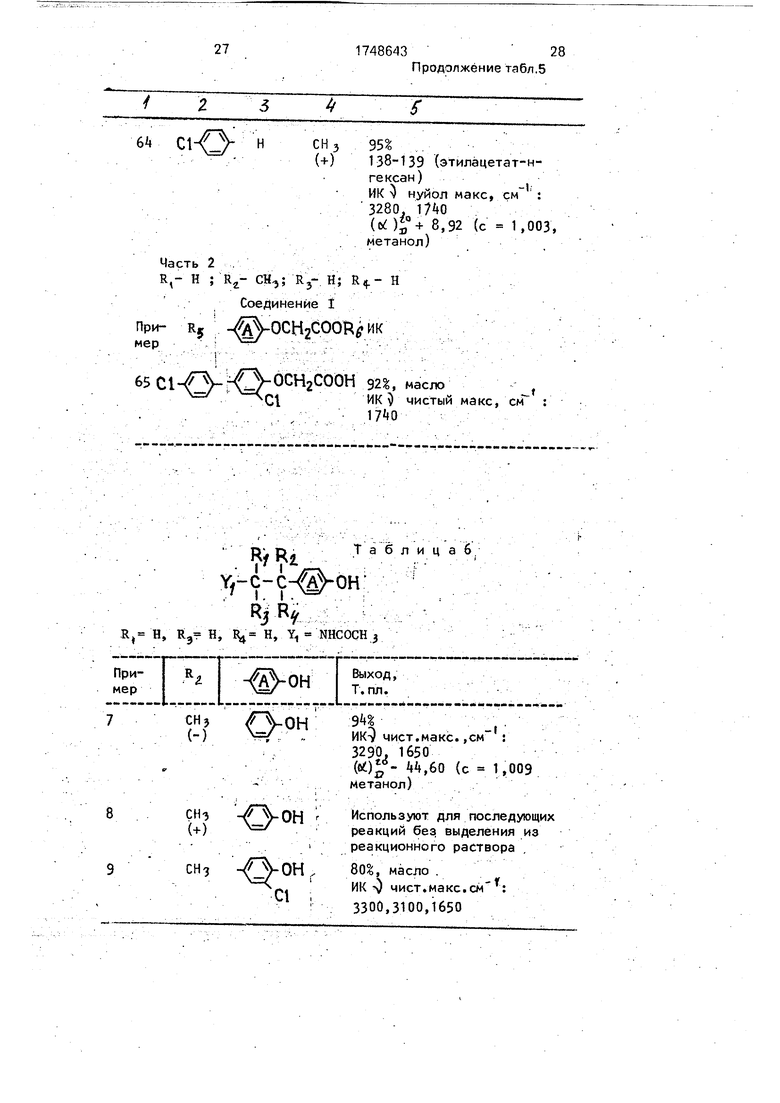
Примеры 63-65. Соответствующие исходные соединения подвергают реакции, описанной в примере 58 - (1) и (2). Пол- 5 ученные свободные карбоновые кислоты реагируют с метанолом для получения соответственных метиловых эфиров, которые затем реагируют, как описано в примере 1 - (3). Получают соединения, указанные в табл. 5. 0 Приготовление исходных соединений. Приготовление 1
(1)Раствор диметоксибутана 5,25 г трет- бутоксида калия добавляют по каплям к раствору диметоксиэтана, содержащего 3,23 г
5 2-фтор-4-метоксиацетофенона и 4,57 г пара- толуолсульфонилметиизоцианида. Это добавление по каплям осуществляют при температуре ниже 10°С. По окончании реакции смесь добавляют к ледяной воде и экс0 трагируют эфиром. Экстракт промывают, высушивают и конденсируют до сухости. Остаток очищают силикэгелевой колоночной хроматографией, что дает 3,83 г 2-(2-фтор-4- метоксифенил)-2-метилэтаннитрила в виде
5 бесцветного масла. Выход 83%. ИК v чистый макс 2250.
(2)15 мл скелетного никелевого катализатора гидрирования добавляют к раствору
этанола из 5,05 г вышеполучеш-гого раствора и при температуре 40-50°С по каплям добавляют 30 г моногидрата гидразина, после чего отфильтровывают катализатор и выпаривают фильтрат. Остаток добавляют к 15%-уксусной и хлористоводородной кислот и смесь выпаривают для удаления растворителя. Остаток перекристаллизовы- вают из смеси метанола и изопропилового эфира, получают 4,23 г гидрохлорида 1- амин-2- 2-фтор-4-метоксифенилЗпропана в виде бесцветных кристаллов.
Выход 75%.
Т.пл. 147-149°С.
Приготовление 2. Соответствующие йс- ходные соединения реагируют, как описано в приготовлении 1, и получают 1-амкн-2- 3- фтор-4-метоксифенил -пропан.
Выход 99%.
ИК v чистый макс, см : 3270.
Приготовление 3,
(1)504 мг 60% гидрида натрия добавляют к тетрагидрофурану, а затем добавляют раствор 2,47 г триэтилфосфоноацетата при атмосфере аргона. Смесь перемешивают при комнатной температуре. Затем добавляют раствор 1,85 г З-хлор-4-метокси-ацето- фенона в тетрагидрофуране и смесь перемешивают при комнатной температуре.
По окончании реакции к смеси добавляют воду и отделяют органический слой. Водный слой экстрагируют с помощью этилацетата. Соединяют органические растворы и выпаривают для удаления растворителя. Остаток очищают силикагелевой колоночной хроматографией и получают 1.47 г 3-(3-хлор-4-метоксифенил)изокрото- ната и 0,18 г 3-(3-хлор-4-метоксифенил)кро- тоната.
3-(3-хлор-4-метрксифенил)изокротона- та
Выход 57,7%.
Т.пл. 67-68°С.
ИК V макс, см- 1: 1700.
3-(3-хлор-4-метоксифенил)кротонат
Выход 7,1%.
Масло
MKV чистый макс, 1710.
(2)0,3 г 10% Pd/C добавляют к раствору уксусной кислоты, содержащему 1,41 г 3-(3- хлор-4-мето ксифенил)изокротоната и смесь подвергают каталитической гидрогенизации при комнатной температуре при атмосферном давлении. После завершения реакции отфильтровывают катализатор, а фильтрат подвергают конденсации, К остатку добавляют метанол и водный раствор гидроокиси натрия и смесь перемешивают.
0
5
5
0 5
0
5
0
5
0
Затем отгоняют растворитель и остаток делают кислотным хлористоводородной кислотой. Водную смесь экстрагируют с помощью этилацетата. Экстракт промывают водой, высушивают и конденсируют до сухости. Остаток чистят колоночной хроматографией на силикагеле, перекристаллизо- вывают из н-гексана, получают 807 мг 3-(3-хлор-4-метоксифенил)масляной кислоты в виде бесцветного масла.
Выход 64%.
Т.пл. 73,5-75°С.
(3)Раствор 12,23 г полученного выше вещества, 6,49 г триэтиламина и 17,66 г ди- фенилфосфорилазида в толуоле перемешивают при комнатной температуре, а затем нагревают с обратным холодильником. Добавляют 11,58 г бензилового спирта и смесь снова нагревают с обратным холодильником. К реагирующей смеси добавляют эти- лацетат и смесь промывают, высушивают и конденсируют до сухости. Получают 17,85 г 1-бензилоксикарбониламин-2-(3-хлор-4-ме- токсифенил)пропана в виде масла.
Выход 100%,
(4)33 мл водного раствора 25%-ной гид- робромидуксусной кислоты добавляют по каплям к раствору уксусной кислоты, содержащей 16,42 г полученного выше вещества, После перемешивания к смеси добавляют эфир, фильтруют выделившиеся кристаллы. Получают 10,33 г гидробромида 1-амин-2- (3-хлор-4-метоксифенил)пропана.
Выход 78%.
Т.пл. 163,5-165°С
Приготовление 4.
4,19 г гидрохлорида 1-амин-2-(2-фтор-4- метоксифенил)пропана нейтрализуют смесью хлороформа и водного раствора бикарбоната натрия. Отделяют слой хлороформа и конденсируют до сухости. К остатку добавляют бромистоводородную кислоту и смесь нагревают с обратным холодильником. Затем реагирующую смесь выпаривают и остаток перекристаллизовывают из смеси изопропилового спирта и изопропилового эфира. Получают 4,53 г гидробромида 3-фтор-4-(2-амин-1 -метилэтил)фенола.
Выход 95%.
Т.пл. 182-183,5°С.
Приготовление 5
Гидрохлорид 1-амин-2-(3-фтор-4-меток- си-фенйл)пропана обрабатывают, как описано в приготовлении 4, и получают бромгидрат2-фтор-4-(2-1-метилэтил)фенола в виде бесцветных игл.
Выход 85%.
I/IK v чистый макс, 3190, 1590.
Приготовление 6.
(1)Смесь 19,8 г(±)-1-амин-2-(4-метокси- фенил)пропана, 200 мл этилацетата, 200 мл воды и 84 г бикарбоната натрия охлаждают до 5-10°С при перемешивании и добавляют по каплям 18,8 г хлористого ацетила в 100 мл этилацетата при той же температуре, после чего отделяют слой этилацетата, промывают, высушивают и конденсируют до сухости при пониженном давлении, получают 24,8 г (±)-1-ацетиламин-2-(4-метоксифе- нил)пропана в виде масла.
Масса (м/э): 207 ().
ИК v чистый макс, 3290, 1650.
(2)Полученное выше вещество растворяют в 750 мл хлорида метилена. После охлаждения до -60°С добавляют, перемешивают по каплям в течение 1,5 ч при той же температуре раствор хлорида метилена из 69 г трибромида бора. После перемешивания смеси при комнатной температуре ее опять охлаждают от -50 до -60°С.
К смеси добавляют воду и хлорид метилена. Затем отделяют органический слой и промывают водным раствором бикарбоната натрия и насыщенным раствором хлорида натрия. Соединяют водные слои, нейтрализуют водным раствором бикарбоната натрия и выпаривают при пониженном давлении. Полученный масляный остаток экстрагируют с помощью этилацетата. Экстракт высушивают и выпаривают при пониженном давлении, что дает 23,1 г (±)-4-(2-ацетиламин-1-метилэтил)фенола в виде масла.
Выход 100%. Масса (м/э): 193 (М4).
ИК V чистый макс, см 1: 3290, 3020, 1655.
Приготовления 7-9.
Соответствующие исходные соединения обрабатывают, как указано в приготовлении 6, и получают соединения, указанные в табл. 6.
Испытания по биологической активности.
Эксперимент 1,
Воздействие на скопление тромбоцита, вызванного коллагеном (in vitro).
Девять объемов крови, взятых у здорового человека, смешивают с одним объемом 3,13% (вес/объем) раствора цитрата тринат- рия и смесь центрифугируют для получения богатой тромбоцитом плазмы (БТП) в качестве плавающей на поверхности. Нижний слой еще раз центрифугируют и получают ненасыщенную тромбоцитом плазму (НТП) в качестве плавающей на поверхности. БТП разбавляют НТП и число тромбоцита составляет около 4 х 10 клеток/мм . 25 мл
раствора испытываемого соединения, содержащего эквимолярное количество би- карЗоната натрия, добавляют к 200 мл указанной разбавленной БТП. После пере- 5 мешивания смеси в течение 2 мин при температуре 37°С добавляют раствор коллагена (25-29 мг/мл) раствора, чтобы вызвать скопление тромбоцита. Степень скопления тромбоцита определяют мето- 0 дом Борна и определяют активность сдерживания скопления тромбоцита испытываемого соединения. Активность сдерживания скопления тромбоцита испытываемого соединения выражают как Сво. 5 т.е. концентрация соединения, требуемого для вызывания 50% сдерживания скопления тромбоцита, вызванного коллагеном. Результаты приведены в табл. 7. Эксперимент 2.
0 Воздействие на эмболию легочной артерии, вызванную арахидоновой кислотой (in vivo).
Опытное соединение (суспендированное или растворение в водном бикарбонате
5 натрия и 0,25%-ном растворе карбоксиме- тилцеллюлозы) орально вводят самцам мышей (возраст которых 5 недель, 10 мышей на группу), не кормленных в течение ночи. Через три часа вводят в хвостовую вену инъек0 цию арахидоновой кислоты (125 мг/2,5 мл 1 %-ного раствора NaHCOa + 7,5 мл 0,9%-но- го водного хлорида натрия кг) для того, чтобы вызвать эмболию легочной артерии, и время (минуты) восстановления способно5 сти передвигаться у мышей (т.е. период от инъекции арахидоновой кислоты до момента, когда мыши отошли от расстройства дыхания и стали ходить) было сравнено с временем восстановления контрольной
0 группы мышей, которым был введен водный 0,25%-ный раствор CMC вместо опытного соединения. Эффект торможения каждого опытного соединения эмболии легочной артерии, вызванной арахидоновой кислотой,
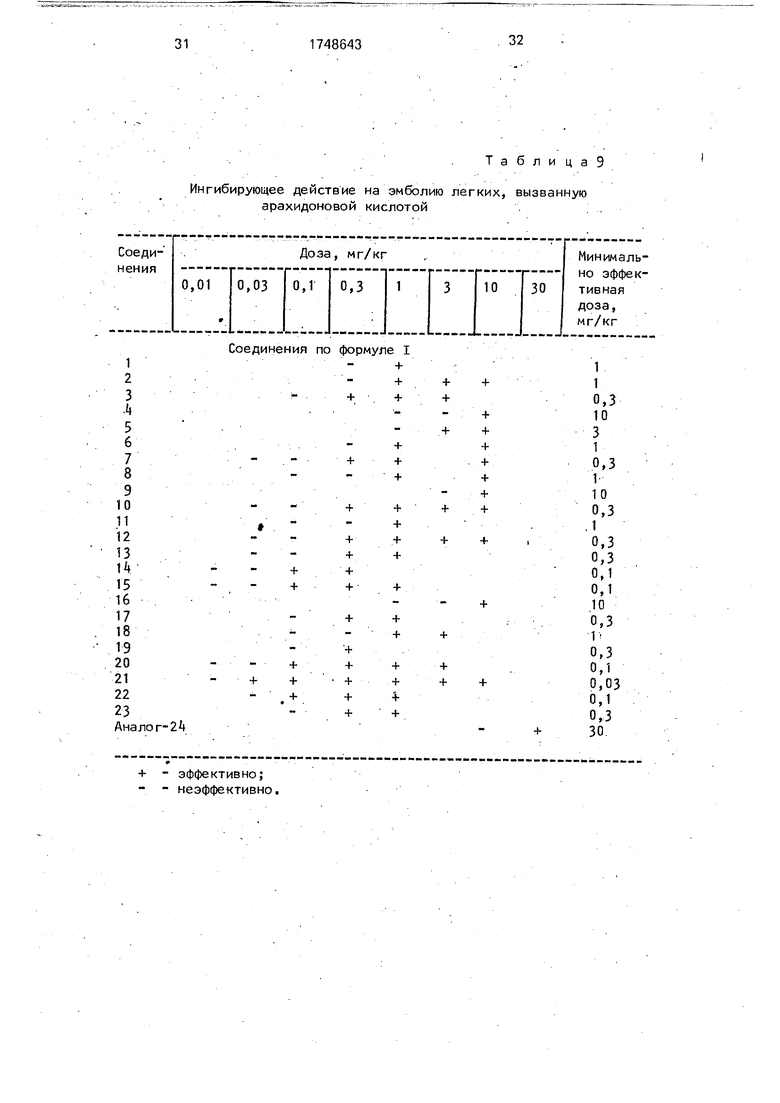
5 определяют с учетом минимальной дозы, т.е. доза, необходимая для сокращения времени восстановления, по крайней мере на 15% по сравнению с контрольной группой. Результаты приведены в табл. 8.
0 Эксперимент 3.
Воздействие на время кровотечения (in vivo).
Соединение опыта (суспендированное или растворенное в водном 0,25%-ном рас5 творе карбоксиметилцеллюлозы) орально вводят самцам мышей (возраст которых 5 недель, 10 мышей в группе), не кормленных в течение ночи. Через три часа отрезают кончик хвоста (2 мм) псд действием эфира и хвост немедленно погружают в физиологический раствор хлористого наГрия (37°С). Время кровотечения (секунды) подопытной группы сравнивают с временем кровотечения контрольной группы мышей, которой вводят вместо опытного соединения водный 0,25%- ный раствор CMC. Длительность воздействия каждого опытного соединения на время кровотечения определяют с учетом минимально эффективной дозы, т.е. необходимой дозы, чтобы вызвать по крайней мере 50% увеличение времени кровотечения по сравнению с контрольной группой.
А, Действие на эмболию легких, вызываемую арахидоновой кислотой (в стеклянной посуде).
Испытуемое соединение (суспендированное или растворенное в водном бикарбонате натрия и 0,25%-ном растворе карбоксиметилцеллюлозы) вводят через рот самцу мыши (возрастом 5 недель, по 10 мышей в группе), закрепленных на всю ночь. Тремя часами позже арахидоновую кислоту (125 мг/2,5 мл 1 %-ного раствора МаНСОз + 7,5 мл 0,9%-ного водного хлорида/1 кг) вводят инъекцией в хвостовую вену мыши для возбуждения эмболии легких. Далее время восстановления (мин) двигательной активности мыши (т.е. продолжительность промежутка времени от иньекции арахидоновой
кислоты до времени восстановления, считая от расстройства дыхания до ходьбы) сравнивают с таковым у контрольной группы мышей, которым вводят 0,25%-ный водный раствор карбоксиметилцеллюлозы взамен
раствора испытуемого соединения. Ингиби- рующее действие каждого испытуемого соединения на эмболию легких, вызванную арахидоновой кислотой, определяют на основании полученных данных соответственно следующих критериев.











Изобретение относится к замещенным амидам арилсульфокислот, конкретно к способу получения производных феноксиуксус- ной кислоты общей формулы RsS02NH - C(Ri)(R3) C(R2)(P/i)-A-OCH2COOR6 или их фармацевтически приемлемых солей, где один или два Ru R2, Ra и R/j - низший алкил, а другие - водород; А - фенилен, который может иметь один или два заместителя, выбранных из групп; галоген, низший алкил; RS - фенил, который может иметь один или два заместителя, выбранных из группы: галоген, нитро, тригалогенметил, низший алкил, низший алкокси; Re - водород, низший алкил, которые проявляют агрегационную активность. Синтез ведут взаимодействием соответствующего замещенного амина с ре- акционноспособным остатком арилсульфо- нила. Целевые продукты более чем в три раза эффективнее по агрегационной активности обладаюг максимальной толерантной дозой 1000 мг/кг. 13 табл. v Ё
D г Время восстановления (среднее значение) лекарственной группы. .QQ L Время восстановления (среднее значение) контрольной группы J
Если значение показателя D составляет не менее, чем 15, испытуемое соединение оценивают как эффективное. С другой стороны, если значение показателя D составляет менее 15, то испытуемое соединение оценивают как неэффективное.
В. Действие на агрегирование пластинок, вызываемое коллагеном.
9 объемов крови, собранной у здорового человека, смешиваютс 1 объемом 3,13%-но- го (по весу на объем) раствора тринатрий фосфата и смесь центрифугируют, что приводит к плазме, обогащенной пластинками (PRP) в виде всплывшего слоя. Нижний слой дополнительно центрифугируют, что дает плазму, обедненную пластинками (РРР) в виде всплывшего слоя. PRP разбавляют РРР таким образом, чтобы счет пластинок составил около 4 х 105 клеток/мм3. 25 мкл раствора испытуемого соединения, содержащего эквимолекулярное количество бикарбоната натрия, добавляют к 200 мкл упомянутого разбавленного РРР. После перемешивания смеси 2 мин при 37°С добавляют раствор коллагена (25-29 мкг/мл) к смеси, чтобы вызвать агрегирование пластинок, Степень агрегирования пластинок исследуют по методу Борна.
-F
:Время кровотечения (среднее значение) у лекарственной группы Время кровотечения (среднее значение)чу контрольной группы I
Активность испытуемого соединения в части ингибирования агрегирования пластинок выражают как ICso, т.е. концентрация испытуемого соединения, требуемого
для возбуждения 50%-ного ингибирования агрегирования пластинок, возбуждаемого коллагеном.
С. Действие на длительность кровотечения (на живом организме).
Испытуемое соединение (суспендированное или растворенное в водном 0,25%- ном растворе карбоксиметилцеллюлозы) вводят с лечебной целью через рот самцу мыши (возраст 5 недель, 10 мышей в группе),
закрепляют на всю ночь. Тремя часами позже отрезают кончик хвоста (около 2 мм) при анестезии эфиром, и упомянутый хвост погружают в физиологический солевой раствор (37°С) сразу же.
Длительность кровотечения (секунды) обработанной лекарством группы мышей сравнивают с таковой у контрольной группы мышей, которым дают 0,25%-ный раствор
CMC взамен раствора испытуемого соединения. Пролонгированное действие каждого испытуемого соединения на время кровотечения определяют по времени кровотечения (секунды) соответственно следующим критериям.
Если значения показателя D превышает 1,5, то испытуемое соединение оценивается как эффективное. С другой стороны, если значение показателя D составляет менее 1,5, то испытуемое соединение оценивают как неэффективное
м
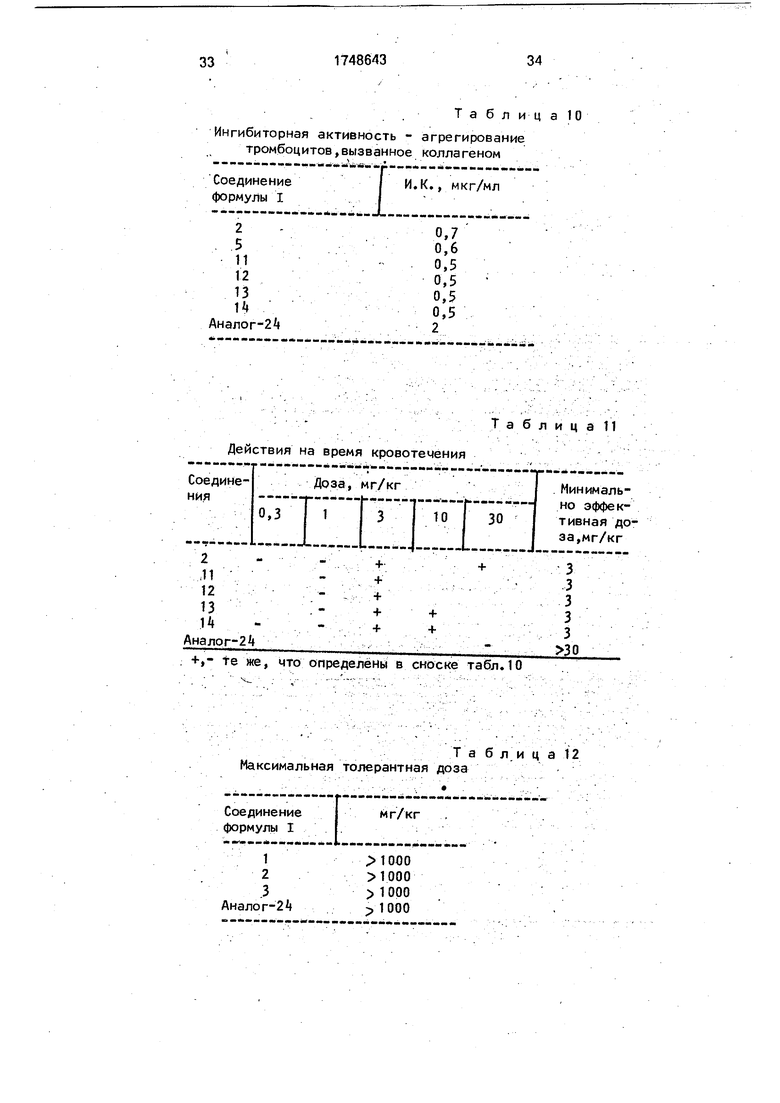
D. Выносливость по отношению к максимальной дозе.
Испытуемое соединение, растворенное или суспендированное в физиологическом солевом растворе или в водяном растворе, содержащем поверхностно-активное вещество, вводят с лекарственной целью внутривенно самцу мыши (около 20 г). Выносливость по отношению к максимальной дозе испытуемого соединения определяют в единицах максимальной дозы, не вызывающей гибель мышей за 2-суточный период наблюдения (таблицы 9-12)
Соединения, примененные в данных экспериментах, показаны в табл. 13
Таким образом, предлагаемый способ позволяет получать соединения формулы I более, чем в 3 раза эффективнее, чем известные соединения в единицах ингибирую- щего действия на легочный эмболизм, вызываемый архидоновой кислотой на агрегирование кровяных пластинок, вызываемое коллагеном. При этом соединения обладают низкой токсичностью.
Т а б л и ц а 1
9 Р
Y-C- C- -OCH2COORtf/ R3RV
А - фениленовая группа; R,- H; R - Н;
Rsr mz
CtH f
Формула изобретения Способ получения производных фенок сиуксусной кислоты общей формулы
2
%S02NH-C- )-ОСН2СОО
з fy
или их фармацевтически приемлемых солей где один или два Ri, R2, Ra и R4 - низший алкил, а другие - водород,
кольцо А - фенилен, который может иметь один или два заместителя, выбранных из группы: галоген, низший алкил;
Нб - фенил, который может иметь один или два заместителя, выбранных из группы галоген, нитро, тригалогенметил, низший алкил, низший алкокси,
Re водород, низший алкил, отличающийся тем, что соединение общей формулы { Ј2
H2N-C-C- -oCH2COOR R5 Rf
или его соль, где Ri-R4, А и Re приведены выше, подвергают взаимодействию с соединением общей формулы RsSOaZ, где RS приведено выше,
Z - реакционноспособный остаток, с последующим выделением целевого продукта в свободном виде или в виде фармацевтически приемлемой соли
53%
98-100flC (оксалат)
R,S02NH-C C-®™OCH2COOR
У||
Таб
Таблица
17
12 CF3-O
Ооль натрия
100%
99-Ю2°С (разл.этилацетат-н-гексан)f
ИК нуйол макс, см : 3280, 1730,
1730
Т. пл. 226,5 -229 С
13 - Н
сн.
iif У- сн.
Н Н
,- Масло
ИК- чистый макс, см 1: 3280, 1730
ЦН7 Масло,
ИК чистый макс, см : 3280,1730
CJU Масло1
ИК чистый макс, см : 3280,1730
С Ит 137-138 (этилацетат-н-гексан) 3 ИК нуйол макс, см 1:3300,
СН а Масло
(-)(оС) - 11 2б (с 1,039, метанол)
СН з Масло
(+)(OOZ° +11,10 (с 1,020, метанол)
174864318
Продолжение табл.2 5
Бесцветная карамель
ИКл) СНС1Э макс, см : 1780
Т.пл. 131 -132 С (ацетон-нгексан)
ИК нуйол макс, : 3285,
Т. пл. 92 -93°С
(изопропил-эфир-метилен-хлорид ИК нуйол, 3315, 3215, то. 1705 (bi )Ј- 12,01 (с 1,
Т.пл. 89 -91°С и
ИК нуйол макс, см : 3315,
3215, то, 1705
+11,90 (с 1,008, метанол)
Масло
И|О СНС13 макс, см
Пасло
ИК} СНС13 макс, см : 3380, 1
132 (хлорофорй-н-гексан ИК ) нуйол макс, , 32 1730
13 -137 (этилацетат-н-гексан) ИК нуйол макс, 3290,
Масло
ИК СНСЦ макс, 1730
2Э
tl-f
30Br-O
31Br-f
снэ
(+)
1725, 1700
(eOJ,°-17,33 (с 1,027, метанол)
Н 132,5-133 (изопропиловый эфир- хлороформ)
ИК V нуйол макс, см : 3300, 3275, 1725, 1700 Ы)+17,Ь7 (с - 1,007, метанол)
СН3 ,5 -150 (изопропиловый (-) хлороформ)
(hO|°- 7,8А ( с 0,790, метанол)
СМ з 150,5-152 (изопропиловый спирт - (+) хлороформ)
(ftЈ )|.0+8,07 (с 1,016, метанол)
Часть 2 Кольцо А - группа фенилена, R,- Н, H
32
, масло
ИК ) нуйол макс, 1738
33
С1Ч
Ч
СН3
Часть k Rt- Н, Rg- CH3: R - Н: H
Пример
Соединение I
R г 2уг оснгсо(жб
-О-ОСН2СООН
У i р
35 СГ
HQbOCH2cooH
Т.пл. 177-178 (этилацетат-н-гексан) ИК V нуйол макс, сми : 3300, 1730, Т/10
Выход
Т.пл. (растворитель перекристалли-,
зации) ИК и/или оптическое вращение
90%
9-51 (изопропиловый спирт - вода)
ИКV нуйол макс,
90
106,5 -108,5 (этилацетат-н-гексан)
ИК нуйол макс,
45
ОСН2СООН 62%
f« (. h
148
46
У
Г
л
« «Ю-
F
W CF5-t « (. h
148-150 (этилацетат-изопропиловы
эфир - н-гексан)
ИК у нуйол макс., см ; 1740
721
130,5 132Э5 (хлороформ)
ИК нуйол макс, см г 1720
77
138-141 (этилацетат-изопропиловый эфир). ИК ) нуйол макс, см : 1740
74
1бЗ - 164 (этилацетат - изопропилов
эфир)
ИК нуйол макс., см : 1720
Г Г
R3S02NH-C-C- J-OCH2COOR
R Н ; R H
R3R,
R6- CH3
50
NO,-fV н
2
51 , СН
52
ct
Ci СН5
С
СН,
55 МЗ
С1
Л
56
Cl
57 С1-/Л
kCl
R nТ а б л и ц а 3
Г Г
C-C- J-OCH2COOR
R3R,
9
128,5-130,5 (изо- пропиловый эфир) ИКу нуйол макс, см-1: 3250,
77%
(метанол- изопропиловый эфир-нтексан) ИК нуйол макс., 3260, 1750
83, масло
ИК чистый макс 3320, 1760
§3«, масло
ИК-0 чистый, макс, 3310,1760
, масло
MKv чистый макс, см- : , 1760
86, масло
ИК нуйол,макс, см- : 3320, 1755
Э0%, масло
ИК} чистый макс, 3330, 1760
85%, масло
ИК нуйол макс, см-1: 3315, 1755
Таблица
; R 02NH-C-C- §VOCH2COORЈ
I I . R R
A - группа фенилена, - H, R- H, H)
60
C1-T
61
Вг-П
RTJТаб
1 Кг
КЈ02МН-С - C-®-OCH2COOR 6 ij
Rj Ry
Часть 1 (кольцо А - группа фенилена, Rt - Н; Нг - H; R6 - Н)
HlO нуйол макс, см 3270,
118 - 119,5 (разлож. этилацетат-н-гексан) ИК1)) нуйол, см 3263,
.,
131 -133 (этилацетат-н- гексан)
И«9 нуйол макс, см 3280, 1750
-1
137-138 (этилацетат-н- гексан) ИК V нуйол макс, см : 3280,
(«)§ -.8,63 (с 1,019, метанол)
Лг- С1Ц; Кэ- Н; H
Соединение I
- -OCH2COORЈ ИК
f -OCH2COOH 92j, масло f
1ИК ) чистый макс, см
R/ RI г i д
Таблица 6
Yf-C-C- -OH R3Ry
Н, R3 Н, % Н, Y,
NHCOCH
Пример
п
-он
СН3 (-)
fVOH
С1
гексан)
ИК
нуйол макс, см
(eOi% 8,92 (с 1,003,
метанол)
Выход, Т.пл.
.1
ИК- чист.макс. ,см :
(fif)J5- Mt,60 {с 1,009 Метанол)
Используют для последующ реакций без выделения из реакционного раствора
80%, масло
ИК -0 чист.макс.см :
3300,3100,1650
Таблица
Активность поглощения скопления тромбоцита, вызванного коллагеном (in vitro)
Химическое название каждого соединения: соединение 1: (Ј}-4-t2- (4-хлорфенил) сульфониламинопропил}феноксиуксусная кислота;
соединение 2: (t-)-4-C2-(4 хлорфенил/ суль фенилам ин-1 -метилэтигОфенокси- уксусная кислота;
соединение 3: (Ј)- |-2-{ |-бромфенкл) сульфониламин- -метилэтил фенокси- уксуснэя кислота;
известное соединение: Ц- (2-бенэол- сульфониламиноэтил)фекоксиуксуная кислота.
Таблицав
Эффект торможения эмболии легочной артерии, вызванной арэхидоновой кислотой
Опытные соединения
Химическое название каждого опытного соедиения:
соединение 4: (±)-4-(2-бензолсульфонил- амин-1 -метилэтил)-2-фторОеноксиуксусная кислота;
соединение 5: (±)- (-12-((-хлорОенил) сульфониламин--1-метилэтил }-2-фторОенил- уксусная кислота;
соединения 1-3 и известное соединение - соединения, указанные в эксперименте 1.
Минимально эффективная доза, мг/кг
ТаблицаЭ
Ингибирукидее действие на эмболию легких, вызванную арахидоновой кислотой
+ - эффективно; - - неэффективно.
Таблица 10
Ингибиторная активность - агрегирование тромбоцитов,вызванное колла геном
t
Соединение I И.К., мкг/мл формулы I I
2- 0,7
50,6
110,5
120,5
130,5
140,5 Аналог-2 2
1
Таблица 11 Действия на время кровотечения
оедине-Доза, мг/кгМинимальияр-Н-1«к-- но эффек0,3131030тивная доза,мг/кг
- -- ------ --- ---U..(. J..
2--++3
11-+3
12-+з
13-f+з
14---f4-3
на лог- 2fr
+,- те же, что определены в сноске табл.10
Таблица 12 Максимальная толерантная доза
Соединение формулы I
1 2
3 Аналог-2
мг/кг
1000 1000 1000 ; 1000
tyRa RjS02NH -С- f- -OCH2COORf
j
Таблица 13
| Устройство для измерения периода электрических колебаний | 1933 |
|
SU35910A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Полые фанерные дверные полотна и оконные переплеты | 1924 |
|
SU927A1 |
Авторы
Даты
1992-07-15—Публикация
1988-07-12—Подача