Изобретение относится к производным феноксиуксусной кислоты, конкретно к способу получения новых соединений феноксиуксусной кислоты формулы:
RsSO NH-C-C- OCHiCOORer % R
где RS фенильная группа, или фе- нильная группа, имеющая 1-2-замести- теля выбранных из группы: галоген, низший алкокси, низший алкил, трига- логенметил, нитро;
А - фенилен или фенилен, имеющий 1-2 заместителя,выбранных из атома галогена, низшего алкила
R,, Rj, R4 одна или две группы низший алкил, а другие атом водорода;
водород, низший алкил, . которые могут найти применение в фармацевтических целях в свободной форме либо в форме соли.
Эти соли могут быть получены реакцией указанного соединения с стехио- метрическим эквиМолярным количеством соответствующего органического или неорганического основания,,
о
4
С5
СМ
Указанное соединение и его соль применяют ор.гльно и 1таренте.рально, а также в виде фармацевтического препарата, содержащего это соединение в смеои с фармацевтической средой для лекарства, подходящей для орального или парентерального применения , Например, таблетки, капсулы, суппозитории, растворы, суспензии, эмульсии или инъекции
I
Соединение и его соль показывают сильнодействующее торможение скопления тромбошита и полезны при лечении, улучшении и/или профилактике различных тромбов шш эмболимов, например тромб головного мозга, венечной артерии, легочной артерии, эмболом легочной артерии, периферийных сосудов, тромбангиит и т.д.
Соединение и его соль обладают низкой токсичностью и являются безопасными для применения в медицине.
Пример 1.
I)о 4,74 г 1-бензолсульфониламин- 2-(4-бензилоксифенил)-.-пропанол расворяют в смеси 100 мл щавелевой кислоты. Смесь подвергают каталитической гидрогенизации в присутствии 10% углерода палладия при атмосфере газообразного водорода (3,5 атома) при 40-50 С в течение ночи. По окончании реакции катализатор отфильтровывают, фильтрат выпаривают при пониженном .давлении. К остатку добавляют этил- ацетат и смесь промьшают водным раствором бикарбоната натрия и насыщенны водным раствором хлорида натрия последовательно. Раствор этилацетата судшт, выпаривают при пониженном дав лешш. Остаток перекристалл из овывают из смеси этилацетата и п-гексена, после чего получают 2,96 г 4-(1-ме- тил-2-бензолсульфониляминоэтш1)фенола в виде бесцветных иголочек. Выход 85%о Т.пл. t62,5-164« Co
2)0 2,96 г полученного продукта растворяют в 25 мл ацетона. Добавляют 1,54 г карбоната калия и 1,87 г этилбрсмацетата и смесь перемешивают при комнатной температуре 6,5 ч„ Затем еще добавляют 0,57 г карбоната калия и 0,68 г этилбромацетата и смесь перемепшвают в течение ночи После завершения реакции выпаривают при пониженном давлении ацетон и остаток экстрагируют с помощью этил- ацетата. Экстракт промывают водой и насыщенным водным раствором хлори
да натрия, затем сушат. Экстракт этилацетата выпаривают при пониженном давлении и остагок очищают колоночной хроматографией (растворитель, толуол-или толуол:этилацетат 20:1 и 10:1), после чего получают 2,04 г этил 4-(1-метил-2-бензолсульфонил- аминоэтил)феноксиацетат в виде бесцветного масла. Выход 53%. Масса, м/э: 377 (М).
;ЧисТын
ИК
см : 3300, t750.
ЯМР (CDCl.,),-S : 1J9 (ЗИ, т,
15 J 7 Гц)- 1,30 (ЗН, д, J 7 Гц): 2,6-3,3 (ЗН, м); 4,28 (2Н, к, J 7 Гц) 4,59 (2Н, с); 6,7-7,9 (9Н,м).
3). Т,55 г полученного продукта растворяют в 16 мл этанола. Добав20 ляют 6,2 мл 1 N-водного раствора гидроокиси натрия и смесь перемешивают при комнатной температуре 2ч. Смесь выпаривают при пониженном давлении и остаток растворяют в 6 мл
5 воды и пропускают через колонку с не- йонной адсорбционной смолой (НР-20), Колонну промывают водой и элюируют водным 50%-ным patTBopoM метанола„ Собирают фракции, содержащие желаQ. емый продукт, и выпаривают для удаления растворителя. К остатку добавляют изопропиловый спирт, после чего получают натрий 4-(1-метш1-2-бензол- сульфониламиноэтил)феноксиацетат в виде бесцветного порошка. Выход 74%„
5 Т.Ш1. .
Масса, м/э: 394 ( 372 ()., .
ИК маьа, см : 3280.
0 о . Д, J 7 2,6-3,1 (ЗН, м); 4,43 (2Н, с); 6,77,1 (4Н, м), 7,4-7,8 (5Н, м).
Свободная карбоновая кислота: бесцветная карамель о 5 Масса, м/э: 349 (М), 179„
-сисе, , см- : 1740
ЯМР (С&СН),(У : 1,t9 (ЗН, д, J 6,5 Гц); 2,86-3,29 (ЗН, м), 4,63 (2Нс); 6,67-7,83 (9Н, м). 0 И р и м е р 2.
t). 11,13 г d 1-4-(2-аминопропил)- фенол гидробромида добавляют к смеси 3,18 г карбоната натрия, 100 мл этилацетата и 100 мл водьи К указан- 5 ной смеси по каплям при при перемешивании добавляют раствор 9,71 г хлорида бензолсульфоила в 50 МП этилацетата и раствор 3,18 г . карбоната натрия в 30 мл воды ПоГц);
еле перемешивания при 10°С в тече ние 0,5 ч смесь нейтрализуют хлористоводородной кислотой. Отделяют органический слой , а водный слой |Экстрагир5тот хлороформом Смешивают органический слой и экстракт хлороформа и смесь выпаривают при пониженном давлении для удаления растворителя. Остаток перекристаллизуют из н-гексана, после чего получают 7,48 г d 1-4-(2-бензолсульфонилами- нопропил фенола в виде бесцветной призмы. Выхрд 86%. Т.пл. 97-99 С. Масса, м/э:: 291 (М).
- ичел
см ): 3480; 3440,
ЯМР (CDClj - D2.0), 8 : 1,08 (ЗН, д, J 6 Гц); 2,59 (2Н, д, J 6 Гц); .3,23-3,72 (1Н, м); 6,67 (2Н, д , J 9 Гц); 6,84 (2Н, д, J 9 Гц); 7,3-7,57 (ЗН, м); 7,6-7,8 (2Н, м).
2)о 7,4 г полученного продукта и 3,51 г карбоната калия добавляют к 140 мл ацетона. Добавляют раствор 4,66 г этилбромацетата в W мл ацетона и раствор перемешивают 18 ч при комнатной температуре. После реакции раствор конденсируют до объема около
16147606
ЯМР (CDCVD O); 1,06 (ЗН, д, J 7 Гц)| 2,61 (2Н, д, J 7 Гц); 3,20-3,75 (1Н, м); 4,55 (2Н, с); 6,77 (2Н, д, J 9 Гц); 6,93 (2Н, д J 9 Гц); 7,22-7,60 (ЗН, м); 7,63- 7,82 (2Н, м).
Соль натрия: бесцветный порошок (перекристаллизованный из этанола). 0 Т.што 192-194 с.
Масса, м/э: 394 См). 372 ()
ч НиСЛ (
ИК,,д, , см- : 3290, 1615.
ЯМР (DMSO-de, ), : 0,85 (ЗН, д,
15 J 6,5 Гц); 2,24-2,70 (2Н, м)| 3,04-3,54 (1Н, м); 3,40 (1Н, с);
- 4,10 (2Н, c)j 6,70 (2Н, д, J 9 Гц) 6,88 (2Н, д, J 9 Гц); 7,40-7,90 (5Н, м).
20 Н р и м е р 3.
1) 5,043 г (Ю-1-(4-метоксифенил) 2-а шнопропана и 8,40 г бикарбоната натрия добавляют к смеси 50 мл хлори да метилена и 50 мл воды. К смеси
25 добавляют по каплям раствор 4,86 г хлорида бензолсульфонила в хлориде метилена при- и перемешивают при комнатной температуре 2 ч. После завершения реакции отделяют слой хло
50 мл при пониженном давлении и оста- 30 ряда метилена, а водный слой экстраток очищают силикагелевой колоночной хроматографией (растворитель;хлоро- форм:метанол: 50:1 и 20:1) и получают 8,50 г этил d 1-4-(2-бензолсульфонил аминопропил)феноксиацетат в виде бес- 35 цветных кристаллов. Выход 88,5%. То пл. 80-84°С (эфир-изопропнловый эфир).
Масса, м/э: 377 (М),
чиспым , HK,N мокс , см- : 3270, 1745.
3). 8,5 г полученного продукта добавляют к 100 мл 10% водного раствора гидроокиси натрия. Раствор перемешивают 5 мин при , а затем . 30 мин при комнатной температуре, доводят рН до 3 с помошрью концентрированной хлористоводородной кислоты. Раствор экстрагируют хлороформом Экстракт су1яат и выпариваю.т, после чего получают 6,88 г d . (2-бензол- сульфониламинопропил)феноксиуксусную кислоту в виде бесцветного порошка. Выход 87%. Т.пл, 131-132 0 (перекристаллизован из смеси ацетона и н-гек- сана).
Масса, м/э: 349 (М ).
гируют хлоридом метилена. Соединяют растворы хлорида метилена, сушат и выпаривают при пониженном давлении. Остаток чистят силикагелевой колоночной хроматографией (растворитель: хло роформ и хлороформ-метанол 50:1) и перекристаллизуют из смеси изопропи лового эфира и метанола, после чего получают 6,76 г (К)-1-(4-метоксифе- 40 нил)-2-бензолсульфониламинопроцана
в виде бесцветной призмьь Выход 88,6% Т.пл. 75-75,5 С.
(t4)J°- 18,84° (,072, метанол). 2) Раствор 14,3 г трибромида бора 45 в 20 мл хлорида метилена добавляют по каплям к 120 мл хлорида метилена, .содержащего 6,10 г ранее полученного продукта. Указанное добавление осуществляют в атмосфере аргона при 50 7б С. После того как раствор находился 1,5 ч при комнатной температуре, к нему добавляют 20 мл воды при охлаждении. Отделяют слой хлорида метилена,, промывают нacьш eнным водным раствором хлорида натрия, сушат и выпаривают при пониженном давлениио Остаток перекристаллизуют из смеси хлороформа и изопропилового эфира, после чего получают 5,59 г (R)-455
-I
см : 3285, 1730,
6147606
ЯМР (CDCVD O); 1,06 (ЗН, д, J 7 Гц)| 2,61 (2Н, д, J 7 Гц); 3,20-3,75 (1Н, м); 4,55 (2Н, с); 6,77 (2Н, д, J 9 Гц); 6,93 (2Н, д, J 9 Гц); 7,22-7,60 (ЗН, м); 7,63- 7,82 (2Н, м).
Соль натрия: бесцветный порошок (перекристаллизованный из этанола). 0 Т.што 192-194 с.
Масса, м/э: 394 См). 372 ().
ч НиСЛ (
ИК,,д, , см- : 3290, 1615.
ЯМР (DMSO-de, ), : 0,85 (ЗН, д,
15 J 6,5 Гц); 2,24-2,70 (2Н, м)| 3,04-3,54 (1Н, м); 3,40 (1Н, с);
- 4,10 (2Н, c)j 6,70 (2Н, д, J 9 Гц): 6,88 (2Н, д, J 9 Гц); 7,40-7,90 (5Н, м).
20 Н р и м е р 3.
1) 5,043 г (Ю-1-(4-метоксифенил)- 2-а шнопропана и 8,40 г бикарбоната натрия добавляют к смеси 50 мл хлорида метилена и 50 мл воды. К смеси
25 добавляют по каплям раствор 4,86 г хлорида бензолсульфонила в хлориде метилена при- и перемешивают при комнатной температуре 2 ч. После завершения реакции отделяют слой хло30 ряда метилена, а водный слой экстра30 ряда метилена, а водный слой экстра35
гируют хлоридом метилена. Соединяют растворы хлорида метилена, сушат и выпаривают при пониженном давлении. Остаток чистят силикагелевой колоночной хроматографией (растворитель: хлороформ и хлороформ-метанол 50:1) и перекристаллизуют из смеси изопропи- лового эфира и метанола, после чего получают 6,76 г (К)-1-(4-метоксифе- . 40 нил)-2-бензолсульфониламинопроцана
в виде бесцветной призмьь Выход 88,6%„ Т.пл. 75-75,5 С.
(t4)J°- 18,84° (,072, метанол). 2) Раствор 14,3 г трибромида бора 45 в 20 мл хлорида метилена добавляют по каплям к 120 мл хлорида метилена, .содержащего 6,10 г ранее полученного продукта. Указанное добавление осуществляют в атмосфере аргона при 50 7б С. После того как раствор находился 1,5 ч при комнатной температуре, к нему добавляют 20 мл воды при охлаждении. Отделяют слой хлорида метилена,, промывают нacьш eнным водным раствором хлорида натрия, сушат и выпаривают при пониженном давлениио Остаток перекристаллизуют из смеси хлороформа и изопропилового эфира, после чего получают 5,59 г (R)-45
(2-беизолсульфониламикопролил)фенола в виде бесцветн1,1х пластин о Выход 9о,1%. Т.пл, 92-92,5 С„
(Юэ - 22,5 (С 1,00, метанол).
3) 3,24 г полученного продукта, 3,31 г этилбромацетата и 2,49 г карбоната калия добавляют к t50 мл ацетона и раствор перемешивают при ком- |натной температуре 19 ч„ Затем еще Добавляют 0,6 г этилбромацетатао По- сле перемешивания в течение 8 ч филь |руют неорганические вещества, а филь JpaT выпаривают при пониженном давлении. Остаток чистят силикагелевсй колоночной хроматографией (растворитель, хлороформ, метанол 100:1). и .перекристаллизуют из смеси .хлорофор- Иа и изопропилового эфира, после чего получают 5,05 г этил (Р)-4-(2- :бензолсульфониламинопропил) фенокси- |ацетат в виде бесцветных иголок.
|Выход 74,3%о Т.пл. 108,5-109 €о
() - 11,03 (,015,. метанол) -ч нцел
ИК V i 7 макс
I Масса, м/э: 377 I 4) 4,68 г полученного продукта |растворяют в смеси 1 г гидроокиси натрия, ВО мл тетрагидрофурана и :10 мл воды. Смесь перемешивают при комнатной температуре в течение 1,5 По окончании реакции выпаривают тет- рагидрофуран при пониженном давлении Остаток делают кислотным с помощью 10% хлористоводородной кислоты и экстрагируют с хлороформом. Экстракт хлороформа промывают насьш1енным водным раствором хлорида натрия, cyniaT и выпаривают при пониженном давлении Остаток перекристаллизуют из смеси изопропилового эфира и хлорида метилена, после чего получают 4,2 г (R)- 4-(2-бензолсульфониламинопропил)фено ксиуксусной кислоты в виде бесцвет- Выход 97%. Т,пл. 92-93°С
см- : 3300, 1750. (М).
()J
ик.5;Ткс
ных иголок.
-12,01 (С 1,074, метанол)
см- :, 3315, 3215j 1740, 1705.
Масса, ЯМР данные этого продукта идентичны данным продукта полученном в примере 1 (3).
Соль натрия: бесцветный порошок (перекристаллизованный из этанола).
Т.пл, 193-196 С.
(d) 15,4Г(С 1,012, метанол
Пример 4.
1)о (8)-1-(4-метоксифенш1)-2-аминопропан подвергают реакции, указанной в примере 3 (1), после чего получают (3)-1-(4-метоксифенил)-2-бе:Нзол- сульфониламинопропан.
(O)|f -18,60°(С 1,00, метанол). 2). Полученный выше продукт подвергают реакции, описанной в примере 3 (2), и получают (5)-4-(2-бензолсуль- фониламинопропил) фенол. Выход 90,2%, ТоПЛ. 92-94 С.
W - 22,00 (С Т,00, метанол). 3) . Полученный вьш1е продукт подвергают реакции, описанной в примере 3 (3), и получают этил (8)-4-(2-бензол- сульфониламинопропил)феноксиацетат„ Выход 75%. Т.пл. 109-110,. W - 10, (С 1,00, метанол) „ 4)„ Полученный .вьш1е продукт под- вергают реакции, описанной в примере 3 (4), и получают (5)-4-(2-бензол- сульфонипаминопропил)феноксиуксусную кислоту. Выход 99%. Т.пл, 89-9Гс. (.) -11,90° (С 1,008, мета- нол)....
ИК, см- : 3315, 3215, 1740, 1705. Масса и ЯМР данные этого продукта идентичны данным Продукта, полученного в примере 2 (3). Соль натрия: бес- цветный порошок (перскристаллизирован- ный из этанола). Т.пл. 192-t95 C.
.(Ю5)° - 15, (С 1,004, метанол) „
И р и м е р 5о
1)о Смесь 2,32 г (±)-4-(2-амино- пропил)фенол д ндробромида, 4,2 г бикарбоната натрия, 50 мл воды, 100 мл этилацетата и 2,06 г хлорида 4-метоксифенш1сульфонила перемешива- к)т при комнатной температуре 3 ч. По окончании реакции отделяют слой этилацетата, сушат и выпаривают дпя удаления растворителя и получают 2,4 г (+)(4-метоксифенил)суль- фонил амин опропил фенол а в виде ::
коричневого масла. Выход 75%. Т.пло 119-120,5.С (перекристаллизация из н-гексана).
, см : 3420, 3260.
2). Смесь 2,37 г полученного продукта, 1,21 г метилбромацетата, 1 г карбоната калия и 30 мл ацетона перемешивают при комнатной температуре 24 ч. По .окончании реакции отфильтровывают ацетоно К остатку добавляют воду и смесь экстрагируют с этилаце-. татом. Экстракт выпаривают при пониженном давлении для удаления этилаце
тата« Полученный (+)(4-метокси феннл) сульфоннламинопропил фенокси- ацетат в качестве -сырого продукта растворяют в 30 мл метанола и добавляют 15 мл 10% водного раствора гидроокиси натрияо Смесь находится при комнатной температуре 1 ч. Затем смесь подкисляют 10%-ной хлористоводородной кислотой и экстрагируют с хлороформом. Экстракт сушат и выпаривают для удаления растворителя. Остаток чистят силикагелевой колоночной хроматографией (растворитель хлороформ и хлороформгметанол 19:1) и получают 2,01 г (±)(Д-мето- ксифенил)сульфониламинопропил1фено- ксиуксусной кислоты в виде масла, Выход 77%. Масса, м/э: 379 (М).
л 11 у ft
K AaкcV 5 3680, 1738.
ЯМР (CDClj), : 1,06 /ЗН, д, j 7,3 Гц): 2,58 (2Н, д, J 6,6 Гц); 3,83 (ЗН, с); 3,2-3,6 (1Н, м); 4,60 (6,6-7,0 (6Н, м); 7,61 (2Н, д, J 9 Гц)„
3)„ 1,7 г полученного вещества растворяют в 10 мл метанола и добавляют 5 мл 1 N-водного раствора гидроокиси натрияо Раствор выпаривают для удаления растворителя. Остаток раЬтворяют в 10 мл воды, чистят колоночной хроматографией, перекристаллизуют из смеси изопропило- вого спирта и воды и получают 1,43 г натрий ()(4-метоксифенил)суль- фониламинопропил феноксиацетата в виде бесцветных гранул Т„пл. 177- Масса, м/э: 424 -Na, 402 (м н)
як (П,0), 8: 1,14 (ЗН, т, J 6 Гц); 2,38 (1Н, д, J 14 Гц, J 9 Гц); 2,62 (1Н, д, J 14 Гц, J 5,5 Гц); 3,1-3,5 (1Н, м)j 3,84 (ЗН, с); 6,62 (2Н, д, J 9 Гц); 6,85 (2Н, д, J 8 Гц); 6,86 (2РГ,д, J 9 Гц);. 7,44 (2Н, д, J 8 Гц). Пример 6.
1)о Смесь 2,69 г (±)-1-(4-метоксй- фенил)-2-аминобутана, 6,3 г бикарбоната натрия, 60 мл воды, 120 мл этил- ацетата и 2,65 г хлорида бензолсульфо- нила перемешивают при комнатной температуре 3 ч. По завершении реакции отделяют слой этилацетата, сушат и выпаривают при пониженном давлении. Полученный масляный остаток растворяют в 50 мл .хлорида метилена. Добавляют по каплям при температуре от -50 до раствор 9,02 г трибромида
/
10
1476010
бора в 10 мл хлорида метилена. Смесь перемешивают при комнатной температуре 2 ч. По окончании реакции смесь охлаждают, избыточный трибромид бора разлагают волой и добавляют 50 мл хлороформа. Отделяют органический слой, сушат и выпаривают длй удаления растворителя. Остаток чистят силикагелевой колоночной хроматографией (растворитель, этилацетат:н-гексан- 1:9 до 1i3) и получают 3,70 г (+)-4-(2- бензолсульфониламинобутил)фенола в виде бледно-хелтого масла. Выход 81%, Масса, м/э: 305 (М)
ч СН С.. ,
.с,, (см Ъ: 3600, 3380, 1608,
2). Полученный продукт подвергают реакции по примеру 5 (2) и получают 20 (±)-4-(2-бензолсульфониламинобутил)- феноксиуксусную кислоту в виде масла Выход 68%.
СИСЕ,
15
С CHCEi , , см- : 3380, 1738.
2 Примеры 7-20. Исходные соединения получают аналогично примерам 5 (1) или 6 (1), Данные сведены в табЛо 1 (+- и - выражают оптическую активность каждого полученного соеди30 нения).
2)„ Полученные таким образом исходные соединения реагируют, как в примере 5 (2), и получают соединения указанной формулы 1, данные приведе- 35 Ь1 в табл. 2 и 3.
Пример 59.
1)о 1,98 г 4-(2-амино-2-метилпро- пил)фенолоксалата суспендируют в 40.мл 4Q хлорида метилена и 6,5 г хлорида 4- хпорфенштсульфонила. Суспензию нагревают с обратным холодильником 5 ч. После завершения реакции отфильтровывают растворитель. Остаток раство- 45 ряют в 50 Nm метанола, добавляют
35 мл 10%-ного водного раствора гид- роокиси натрия и раствор нагревают с обратным холодильником 40 мин. Раствор реакции выпаривают для удаления 0 растворителя, подкисляют 10%-ной хло- .ристоводородной кислотой и экстрагируют этилацетатомо Экстракт промывают водой, разбавленньм раствором бикарбоната натрия и насыщенным водным раствором хлорида натриЯо Затем экстракт сутпат и выпаривают. Полученный остаток очищают силикагелевой колоночной хроматографией (растворитель: хлороформ и хлороформ-метанол 50:1)
и перекристаллизовывают из смеси этилацетата и н-гексана, после чего получают 1,40 г (4-хлорфенил)- сульфонилаьтн-2-метилпропил фенола -в виде бледно-желтой призмы. Выход 33%. Т.пло 131,5-133,З Со Масса, м/э: 339 (М).
i -ч НЦЙЛ ,
I , см- : 3450, 3310.
2). 1,50 г полученного вещества растворяют в 20 мл ацетона и добав- |ляют 0,91 г карбоната калия Перемешивают при комнатной температуре, |добавляют раствор 0,84 г метилбромаце тата в 20 мл ацетона и смесь переме- |шивают 24 ч. Смесь реакции выпари- вают дпя удаления растворителя и ос- :таток растворяют в смеси этилацетата :И воды. Раствор этилацетата промывают водой и насьго1енным водным раствором хлорида натрия, сутат и затем выпаривают для удаления растворителя. Полученный остаток перекристаллизовывают из смеси этилацетата и н-гексана и получают (А-хлорфенил)сульфонш1- |амин-2-метилпропил1феноксиацетат в виде бледно-желтой призмыо Выход 194%. Т.пЛо 133-135 Со } Масса, м/э: 411 (М) . .
о. «чел t HKS)wft, . см- 3270, 1750, 1230.
30
I (CDCl), : 1,16 (6Н, с)} 12,78 (2Н, с); 3,81 (ЗН, с)} 4,52 1Н, c)j 4,63 (2Н, с); 6,85 (2Н, д, J 8,8 Гц); 7,15 (2Н, д, J 8,8 Гц); 5 7,41 (2Н, д, J 9 Гц); 7,75 (2Н, д, J 9 Гц)«.
i 3)0 Полученное вещество подверга- |ют реакции, описанной в примере 2 (3), и получают (4-хпорфенш1)сульфо- ниламин-2-метилпропил 1феноксиуксус- ную.кис.лоту. Т„Ш1. 177-178 С (пере- кристаллизованная ия смеси этилацетата и н-гексана)о
Масса, м/э:; 397 (М).
, 3300, 1730, 1710. Н -ЯМ (CDClpMSO - db), : 1,13
(6Н, с); 2,79 (2Н, с); 4,58 (2Н, с);
5,67 (1Н, с), 6,81 (2Н; д, J 8,8 Гц) ;.Q
7,16 (2Н д, J .8,8 Гц); 7,3-7,8 (4Н, м).
Пример 60. .
1), 10,7 г (+)-1-(4-метокси-3-ме- тилфенил)-2-аминопропана растворяют гс в 300 мл этилацетата и добавляют раствор 16,5 г хлорида бензолсульфо- ниЛа в 100 мл .зтилацетата и смесь перемешивают 4 мин. Отделяют слой этил
, 5
0
5
°
Q
с
ацетата, сушат и выпаривают для удаления растворителя. Остаток очищают хроматографией на колонке силикаге- лем (растворитель:хлороформ), после чего получают 16,6 г (±)-1-(4-мето- кси-3-метилфенил)-2-бензолсульфонш1- аминопропана в виде вязкого масла.
2). 16,48 г полученного вещества растворяют в 300 мл хлорида метилена и охлаждают до . При перемешивании по каплям добавляют 29,7 г три- бромида бора и смесь перемешивают при комнатной температуре 1 ч. Смесь реакции охлаждают, экстрагируют хлороформом.. .После сушки выпаривают экстракт для-удаления растворителя. Коричневое масло остатка растворяют в 320 мл ацетона и добавляют 10,7 г карбоната калия и 7,89 г метилбромацетата. Смесь перемешивают в течение ночи. Смесь экстрагируют с помощью этилацетата. Экстракт этилацетата промывают, сушат и выпаривают для удаления растворителя. Остаток растворяют в метаноле, добавляют 1%-ный водный раствор гидроокиси натрия и смесь перемешивают 1 ч. После окончания реакции отфильтровывают метанол. Остаток подкисляют 10%-ным раствором соляной кислоты, экстрагируют этилацетатом. Экстракт концентрируют почти досуха и остаток очищают силикагелевой колоночной хро- матографией (растворитель:хлороформ; метанол ЮООН, 100:1, 10:1), по- i еле чего получают 13,5 г (±)-2-метил- 4-(2-бензолсульфониламинопропил)фе- ноксиуксусной кислоты в виде масла. Выход 72%. Масса, м/э: 363 (М),
л сна, .
, , см- : 1730.
И р им еры 61-65, Соответствующие исходные соединения реагируют, как в примере 60, и получают соединения, указанные в табл.4. Пример 66о 4-(2-бензолсуль- фониламинопропйл)фенил (1,46 г) растворяют в 1 н. NaOH (5 мл) и метаноле (10 мл) и смесь ректифицируют при пониженном давлении для тщательного удаления метанола и воды, Результи - рующий смолоподобный остаток обрабатывают диэтиловым эфиром с получением порошкового продукта. После.удаления диэтилового эфира декантированием порошковый продукт тщательно сушат при пониженном давлении, К порошку добавляют ацетон (40 мл) и этилбром- ацетат (1,00 г) и смесь перемешивают 15 ч при комнатной температуре. После
реагирования к реакционной смеси добавляют воду (5 мл) после чего смесь перемешивают еще 30 мин. После отгонки ацетона при пониженном давлении остаток доводят до рН Т добавлением 1% НС1, после чего экстрагируют этилацетатомо Экстракт промывают на- сьпценным водным раствором хлорида натрия и осушают над сульфатом магния После отгонки этилацетата при пониженном давлении остаток кристаллизуют из хлороформа-/н-гексана и кристаллизуют из хлороформа-н-гекса- на. кристаллы отбирают фильтрованием
10
растворитель далее отгоняют. Получ ный остаток гтерекристаллизовывают смеси хлороформ-изопропиловый эфир гексан, получая А-(2-бензолсульфон аминопропил фенокс1-гуксусную кислот (1,31 г) в виде бесцветных призмат ческих кристаллов. Выход 85%, т.шт 128-129(;.
1цел ( - 3240, 1735.
Приготовление исходных соединен
1) 78 г 1-(4-бензилоксифенил)-2 хлорэтанола и 63 г гексагаша раств ряют в 2,2 л хлороформа и смесь пе
., J jJjav-1 ojuim UlUilpcllU l ШИЛЬТрОВаНИеМ{ i..i 1 f} , i. ji лли ;1 иир1Чс1 tl CMKCb JIS
получением 4-(2-бензолсульфонилами- мешивают при комнатной температуре
нопропил)феноксиуксусной кислоты (1,22 г, выход 69,8%),
Пример 67. 62,9% NaH (0,21 г) промывают н-гексаном и к нему добавляют раствор 4-(2-бензолсульфонил- аминопропил)фенола (1,63 г) в тетра- гидрофуране (20 мл) и смесь 30 мин кипятят с обратным холодильником и перемешиванием. Тетрагидрофуран отгоняют при пониженном давлении с получением натриевой соли 4- 2-бензол- сульфонипаминопропил)фенола в виде :бесцветного порошка, К продукту до- бавляют ацетон (50 мл), карбонат калия (0,81 г) и этилбромацетат (0,98 г), и смесь перемешивают при комнатной температуре 13 ч. После реагирования ацетон отгоняют и остаток экстрагируют этилацетатом. Экстракт промывают 10% НС1 и насыщенным водным раствором хлорида натрия, затем осушают над сульфатом магния После отгонки этилацетата при пониженном давлении остаток очищают хроматографией в колонке на силикагеле (элюирование СНС15: н-гексаном;этил- ацетатом 3:2:1), затем кристаллизуют из диэтилового эфира-диизопро- пилового эфира с получением 4-(2-бен- золсульфонилам инопропш1)феноксиаце- тата (1,26 г, выход 50,3%) в виде бесцветных кристаллов, Т,пЛо 80-84 С, ИК-спектр: 3290, 1750„ Пример 68 о Смесь 4-(2-бен- золсульфониламинопропил)фенола (1,45 г) бромуксусной кислоты (0,84 г) и гидроокиси натрия (0,60 г) в диме- тилсульфоксиде перемешивают при комнатной температуре в течение t ч. После окончания реакции в реакционную смесь вводят воду и 10%-ную со- I ляную кислоту с последующим экстрагированием смеси этилацетатомо Полученный экстракт промывают, сугпат, а
20
25
30
35
40
45
50
55
в течение ночи. Смесь конденсируют до объема 1,1 л и нагревают с обра ным холодильником 3 ч. После охлаж дения собирают выделившиеся кристал лы фильтрацией, промывают и высупш- вают. Полученные бесцветные кристал лы добавляют к смеси 750 мл этанола и 120 мл концентрированной хлористо водородной кислоты и смесь нагреваю с обратным холодильником 50 мин. По охлаждения собирают фильтрацией выд лившиеся кристаллы, про п 1вают и выс шивают. Получают 55,6 г 2-амино-Т-( бензилокси-фенил)этанола в виде бес цветных кристаллов. Выход 67%, Т,пл 225 С (разлож,),
2) 1,11 г полученного вещества растворяют в смеси 10 Nm тетрагид- рофурана и 5 мл воды. По каплям добавляют раствор 1,11 г карбоната кaлIiя в 10 мл воды и раствор 1,41 г хлорида бензолсульфошша в 10 мл тетрагидрофурана. Экстракт этилацет та промывают, высушивают и выпарива ют для удаления растворителя. Остаток перекристагшизуют из этилацетат и получают 1,34 г 2-бензолсульфонил- амин-1-(4-бензилоксифенил)этанола в виде бесцветных иголок. Выход 89%о Т,Ш1. 148-149 С,
3) 4,37 г магния суспендир тот в 180 мл высушенного эфира и добавляют 4 капли 1,2-дибромэтана. После перемешивания смеси при комнатной темпер туре в течение 30 мин добавляют по каплям 18,3 г метинодиода в 50 мл эфира о К указанной смеси при переме-- щивании и охлаждении добавляют по ка лям раствор 7,6 г 2-бензолсульфонил- амин-1-(4-бензилоксифенил)этанола в 150 мл тетрагидрофурана. Смесь перемешивают при комнатной температуре в течение ночи, а затем нагревают с обратным холодильником 2 ч. После
If) 14760
растворитель далее отгоняют. Полученный остаток гтерекристаллизовывают .из смеси хлороформ-изопропиловый эфир- гексан, получая А-(2-бензолсульфонил- аминопропил фенокс1-гуксусную кислоту (1,31 г) в виде бесцветных призматических кристаллов. Выход 85%, т.шт. 128-129(;.
1цел ( - 3240, 1735.
Приготовление исходных соединений.
1) 78 г 1-(4-бензилоксифенил)-2- хлорэтанола и 63 г гексагаша растворяют в 2,2 л хлороформа и смесь пере{ i..i 1 f} , i. ji лли ;1 иир1Чс1 tl CMKCb JIS
мешивают при комнатной температуре
20
25
30
35
0
5
0
5
в течение ночи. Смесь конденсируют до объема 1,1 л и нагревают с обратным холодильником 3 ч. После охлаждения собирают выделившиеся кристаллы фильтрацией, промывают и высупш- вают. Полученные бесцветные кристаллы добавляют к смеси 750 мл этанола и 120 мл концентрированной хлористоводородной кислоты и смесь нагревают с обратным холодильником 50 мин. После охлаждения собирают фильтрацией выделившиеся кристаллы, про п 1вают и высушивают. Получают 55,6 г 2-амино-Т-(4- бензилокси-фенил)этанола в виде бесцветных кристаллов. Выход 67%, Т,пл, 225 С (разлож,),
2) 1,11 г полученного вещества растворяют в смеси 10 Nm тетрагид- рофурана и 5 мл воды. По каплям добавляют раствор 1,11 г карбоната кaлIiя в 10 мл воды и раствор 1,41 г хлорида бензолсульфошша в 10 мл тетрагидрофурана. Экстракт этилацетата промывают, высушивают и выпаривают для удаления растворителя. Остаток перекристагшизуют из этилацетата и получают 1,34 г 2-бензолсульфонил- амин-1-(4-бензилоксифенил)этанола в виде бесцветных иголок. Выход 89%о Т,Ш1. 148-149 С,
3) 4,37 г магния суспендир тот в 180 мл высушенного эфира и добавляют 4 капли 1,2-дибромэтана. После перемешивания смеси при комнатной температуре в течение 30 мин добавляют по каплям 18,3 г метинодиода в 50 мл эфира о К указанной смеси при переме-- щивании и охлаждении добавляют по каплям раствор 7,6 г 2-бензолсульфонил- амин-1-(4-бензилоксифенил)этанола в 150 мл тетрагидрофурана. Смесь перемешивают при комнатной температуре в течение ночи, а затем нагревают с обратным холодильником 2 ч. После
10
15 . Т61Д760
охлаждения к смеси добавляют разбав- , ленный водный раствор хпорида аммо- пи п и смесь экстрагируют с помощью этилацетата. Экстракт промывают, су- niaT и затем выпаривают при пониженном давления. Остаток чистят силикагеле- вой колоночной хроматографией (раст- во)итель, хлороформ и хлороформ:мета- Hojn 50:1) и перекристаллизуют из этилацетата и н-гексана, что 4,92 г 1-бензолсульфониламин-2- (4 -бензилоксифенил)-2-пропанола в ви|це бесцветных кристаллов. Выход 625. Т.шт. ISO-ISI C
1) Раствор диметоксибутана, 5,25 г трет-бутоксида калия добавляют по кайлим к раствору диметоксиэтана, содержащего 3,93 г 2-фтор-4-метокси- а1 |етофенона и 4,57 г пара-толуолсуль- фо|нилметилизоцианида. Это добавление по| каплям осзтцествляют при температу-
t5
ре ниже 10 Со После окончания реакции смесь добавляют к ледяной воде и экстрагируют эфиром. Экстракт про- 25 мывают, сугаат и конденсируют до су- хостио Остаток чистят силикагелевой колоночной хроматографией, что дает 3,j83 г 2-(2-фтор-4-метоксифенил)-2- ме|тилэтаннитрила в виде бесцветного м4сла, Выход 83%,
MMCTlblW,
, см
ИК
(лакс. - 2250.
I 2) 15 мл склетного никелевого катализатора гидрирования добавляют к ipacTBOpy этанола из 5,05 г вьше- пслученного раствора и при 40-50 С net каплям добавляют 30 г моногидрата гидразина. После чего отфильтровывают катализатор и выпаривают фильтрат 0(1
вой хлористоводородной кислоте и Cfjiecb выпаривают для удаления раст- вфрителяо Остаток перекристаллизуют иф смеси метанола и изопропилового эфира, что дает 4,23 г гидрохлорида 1 амин-2-(2-фтор-4-метоксифенил) пропана в виде бесцветных кристаллов. Выход 757. 147-149°Со
бавляют к тетрагидрофурану, а затем добавляют раствор 2,47 г триэтилфос- фоноацетата при атмосфере аргона. Смесь перемешивают при комнатной температуре Затем добавляют раствор 1,85 г З-хлор-4-метокси-ацетофенона в тетрагидрофуране и смесь перемешивают при комнатной температуре. После окончания реакгщи к смеси добавляют воду и отделяют органический слой Водный слой экстрагируют с помощью этилацетата. Соединяют органические растворы и выпариваютдля удаления растворителя,, Остаток чистят силикагелевой колоночной хроматографией и получают 1 ,47 этил 3-(3-хлор-4-меток.:и.- фенил)изопротоната и 0,18 г 3-(3- хлор-4-метоксифенил) кротоната.
3-(3-Хлор-4-метоксифенил)изокро- тонат. Выход 57,7%. Т.пл. 67-68 с.
ИКглакс1 , см : 1700,, 3-(3-Хлор-4-метоксифенил)кротонат. Выход 7,1%. Масло.
Oi4M- ;7biu , , , см- : 1710„
2) 10%-ный палладированный углерод (0,3 г) добавляют к раствору уксусной кислоты, содержащему 1,41 г
30 3-(3-хлор-4-метоксифенил) изокротона- та и смесь подвергают каталитической гидрогенизации при комнатной температуре при атмосферном давлении. После завершения реакции отфильтровывают
2J катализатор, а фильтрат подвергают конденсациио К остатку добавляют метанол и водный раствор .гидроокиси натрия, смесь перемешивают. Затем отгоняют растворитель и остаток де-
таток добавляют к 15%-ной метаноле- ° кислотным хлористоводородной
кислотой. Водную смесь экстрагируют с помощью этилацетата. Экстракт промывают воДой, сущат и конденсируют до сухости Остаток чистят силикаге- 45 левой колоночной хроматографией и перекрйсталлизируют из н-гексана, что делает 807 мг 3-(3-хлор-4-метоксифе- нил)масляной кислоты в виде бесцветного масла. Выход 64%. Т.пл. 73,
3). Раствор 12,23 г полученного вьше вещества, 6,49 г триэтиламина и 17,66 г дифенилфосфорилазида в толуоле перемешивают при комнатной
Приготовление 3,
Соответствующие исходные соедине- кия реагируют, как описано в приготовлении 2 и получают 1-амин-2-(3- фтор-4-меток сифенил)пропан„ Выход 99%.
ЧйС.Тыи4 . о,7П
глашс. , см : 3270.
Приготовление 4 о
1) .504 г 60% гидрида натрия до50
55
температуре, а затем нагревают с обратным холодильником. Добавляют 11,58 г бензилового спирта и смесь снова нагревают с обратным холодильником. К реагирующей смеси добавляют этилацетат, смесь промывают, сушат
температуре, а затем нагревают с обратным холодильником. Добавляют 11,58 г бензилового спирта и смесь снова нагревают с обратным холодильником. К реагирующей смеси добавляют этилацетат, смесь промывают, сушат
1/ 16
и конденсируют до сухости. Получают 17,85 г 1-бензилоксикарбониламин-2- (3-хлор-4-метоксиЛенил)пропана в виде масла. Выход 100%.
4). 33 мл водного раствора 25%.-ной гидробромидуксусной кислоты добавляют по каплям к раствору уксусной кислоты, содержащей 6,42 г полученного вьше вещества. После перемешивания к смеси добавляют эфир и собирают фильтрацией выделившиеся кристаллы. Получают 10,33 г гидробромида 1-амин- 2-(З-хлор-4-метоксифенил)пропана. Выход 78%. Топл. 163,5-165 с.
Воздействие на скопление тромбоцита, вызванного коллагеном (in vitro) ,
Девять объемов крови, взятые у здорового человека, смешивают с одним объемом 3,13% (вес/объем) раствора цитрата тринатрия и смесь центрифугируют для получения богатой тромбоци- том плазмы (БТП) в качестве плавающей на поверхности Нижний слой еще раз центрифугируют и получают ненасы0
4760
щенную тромбош1том плазму (НТП) в качестве плавающей на поверхности. БТП разбавляют НТП и число тромбоцита около 4x10 кло/мм 25 мл раство- ра испытываемого соединения, содержащего эквимолярное количество бикарбоната натрия, добавляют к 200 мл указанной разбавленной БТП. После перемешивания смеси в течение 2 мин при 37° С -добавляют раствор каллогена (25-29 мг/мл .раствора), чтобы вызвать скопление тромбоцитао Степень скопления тромбоцита определяют методом Борна и определяют активность сдерживания скопления тромбоцита испытываемого соединения . Активность сдерживания скопления тромбоцита испытваемо- го соединения выражают как 1C50 т.е. концентрации соединения, требуемого для вызывания 50% сдерживания скопления тромбоцита, вызванного коллагеном. Результаты приведены ниже. Активность поглощения скопления тромбоцита, вызванного коллагеном (in vitro) :
5
0
5












Изобретение относится к замещенным сульфидам, в частности к получению производных феноксиуксусной кислоты формулы R5SO2NH-C(R1)(R3)-C(R2)(R4)-N-A-OCH2COOR6, где R5 - фенильная группа или фенильная группа, имеющая 1-2 заместителя, выбранных из групп : галоген, низший алкокси, низший алкил, тригалогенметил, нитро
A - фенилен или фенилен, имеющий 1-2 заместителя, выбранных из атома галогена, низшего алкила
одна или две группы R1, R2, R3, R4 - низший алкил, а другие - атом водорода
R6 - H, низший алкил, или их фармацевтически приемлемых солей. Цель - разработка способа получения указанных соединений. Получение ведут реакцией соединения R5SO2NH-(CR1)(R3)-C(R2)(R4)-N-A-OH, где A, R1 - R5 - указано выше, с соединением формулы XCH2COOR61, где X - галоген
R61 - низший алкил, H, с последующим выделением целевого продукта в свободном виде или в виде фармацевтически приемлемой соли. 8 табл.
Соединение
. (+) 4- 2- (4-хлорфенил) сульфониламинопропил - феноксиуксусная кислота (+)4- р.-(4-хлорфенил)сульфониламин- 1 -метилзтил феноксиуксусная кислота (+) (4-бромфенил) сульфониламин-1- метилэтилЗфеноксиуксусная кислота 4-(2-бензолсульфониламинэтил)- феноксиуксусная кислота
Воздействие на эмболию легочной артерии, вызванную арахидоновой кислотой (in vitro) .
Опытное соединение (суспендированное или растворенное в водном бикарбонате натрия и 0,25% раствора карбокс иметилцеллюлоза) орально вводят самцам мьшеи (возраст которы 5 нед, 10 мышей на группу), не кормленных в течение ночи а Через 3ч вводят в хвостовую вену инъекцию арахидоновой кислоты (125 мг/кг), 2,5 МП 1%-ного раствора NaHCOj 7,5 мл 0,9%-ного водного хлорида натрия (кг) для того, чтобы.вызвать эмболию легочной артерии. Время (минуты) восстановления спо.собности
ICgo мг/мл
0,7 0.5 0,5 2.
5
0
передвигаться у мышей (т.е. период от инъекции арахидоновой кислоты до момента, когда мьши отошли от расстройства дыхания и стали ходить) сравнивают со временем восстановления контрольной группы мьшей, которым введен водный 0 25%-ный раствор CMC вместо опытного соединения. Эффект торможения каждого опытного соединения амболии легочной артерии, вызванной арахидоновой кислотой, определяют с учетом минимальной дозы, т.е. доза, необходимая для сокращения времени восстановления, по крайней мере на 15% по сравнению с контрольной группой. Результаты приве- дены ниже;
Опытные соединения
(+)(4-хлорфенил)сульфонил- аминопропил феноксиуксусная кислота . (+) -4- 2- (4-хлорфенил) сульфониламин- 1-метилэтил1феноксиуксусная кислота (.+)-4- 12-(4-бромфенил)сульфониламин- 1-метилэтил феноксиуксусная кислота (+)4-(2-бен золсульфониламин-1-метил- этил) 2-фторфеноксиуксусная кислота (±)-4-Ь(4-хлорфенил)сульфониламин1-метил-этил1-2-фторфеноксиуксуснаякислота
4- (-2-бензолсульфониламинэтил)- феноксиуксусная кислота
Воздействие на время кровоточе- иия (in vitro).
Соединение опыта (суспендированное 20 |пи растворенное в водном 0,25%-ном астворе карбоксиметилцеллюлозы) вально вводят самцам мьшей (возраст Ьторых 5 нед 10 мьппей в группе)
кормленных в течение ночи.-Через 25 ч отрезают кончик хвоста (2 мм) |од действием эфира и хвост немедлено погружают в физиологический растор хлористого натрия (37 с). Время |ровотечения (секунды) подопытной группы сравнивают со временем кровотечения контрольной группы мышей, |оторой вводят вместо опытного соеди- водный 0,25%-ный ,раствор CMC. Длительность воздействия каждого фгытнсго соединения на времякровоте- ения определяют с учетом минимально Эффективной дозы, т.е. необходимая Доза, чтобы вызвать по крайней мере 30% увеличения времени кровотечения ПО сравнению с контрольной группой.
В экспериментах минимально эффективная ДОза соединений 1-3 3, 10 н 10 мг/кг соответственно , в то йремя.как минимально эффективная до- 4-(2-бензолсульфониламиноэтил)фе- ноксиуксусной кислоты 30 мг/кг.
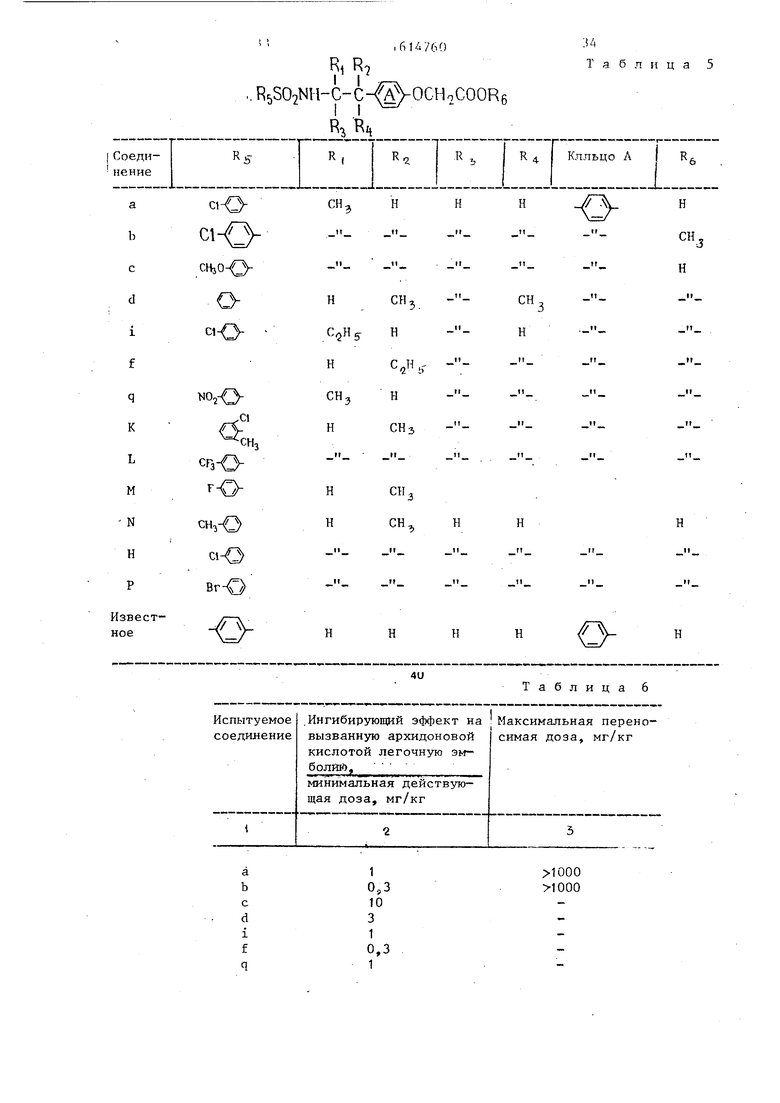
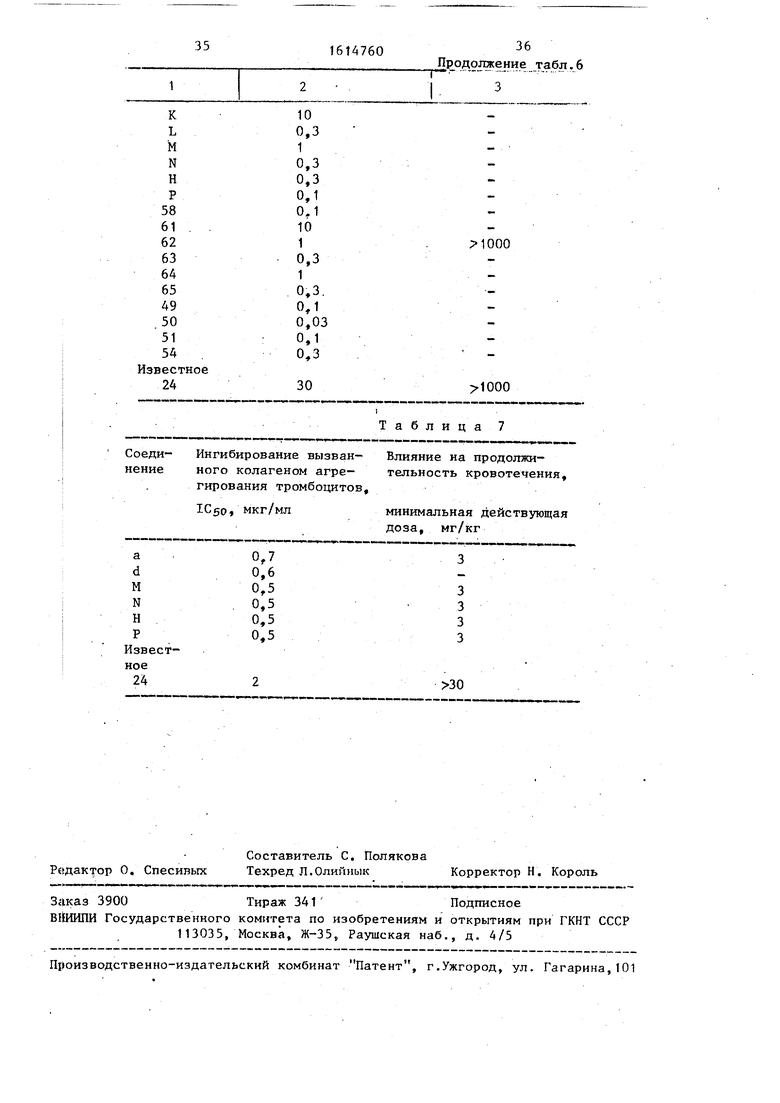
В табл. 5 приведены значения радикалов соединений, получаемых, данньм способом; в табл. 6 - данные по i |5иологической активности и токсичности, для этих соединений и соединений.- полученных по примерам 49-51, 5.4, 58, 61-65; в табЛо 7 - данные по ингиби- :рованию тромбоцитов.
Таким образом, способ позволяет по- .(тучать Новые производные феноксиук- сусной кислоты, проявляющие противо- тромбоцитную активность, которые мо30
35
40
45
.
0
5
0
5
Минимально эффективная доза, мг/кг
1,0 , .
0,3
0,1
0,1
0,03
|гут найти применение в медицине при лечении и/или профилактики различных тромбов или эмболомов, например, тромб головного мозга, венечной артерии, легочной артерии, эмболом легочной артерии, периферийных сосудов, тромбангиит и т.д. Соединения, получаемые данным способом, проявляют активность в дозах 0,03-10 мг/кг против 30 мг/кг для известного соединения. Все получаемые соединения явлйют- ся малотоксичньми и имеют максимально переносимую дозу 1000 мг/кг.
Формула изобретения
Способ получения производных фе- ноксиуксусной кислоты общей формулы
RI R R5S02NH-C-CR R
ОСН СООВб
5
где RS фенильная группа, или фенильная группа, имеющая 1-2 заместителя, выбранных из группы: галЬген, низший ah-- кокси, низший алкил, трига- логенметил, нитро;
А - фениген или , имеющий 1-2 заместителя, выбранных из атома галогена, низшего алкила, одна или две группы R, R«, R3 низший ал- . кил, а другие - водород,
I
RQ - водород, низший алкил, или их фармацевтически приемлемых солей, отличающийся тем.
вза1тодействию соеди
RrR, C-CHgy-OH
Из k
RI R
RcSOnNH-C-C- bOH t) z , , /
Нз RV
20
Кольцо А-группа фенилена, , Е.
О- Н CHj 87. 135-136
где Rf-RjrHMeroT указанные значения, с соединением формулы где X - галоген;
К - низший алкил,.водород, с последуюрщм выделением целевого продукта в свободном виде или в виде фармацевтически приемлемой соли.
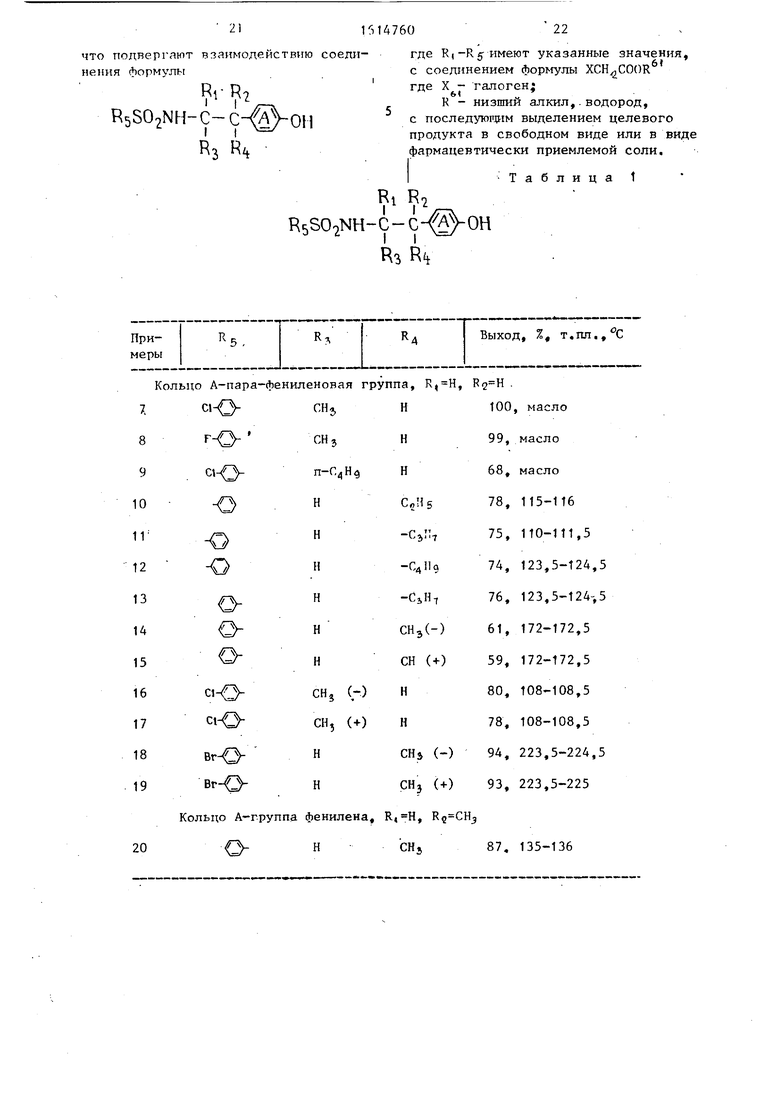
Т а б л и ц а 1
231614760
R,R7 RsSOiNH-C-fJ- OCHiCOORg (
«jR
Примеры
R
R.
.....
Кольцо А- группа-фенилена, R Н, R Н, R, н
;)
.)
ClF-С1-/Л
сн.
сн.
п-С41 9Н
50, 132-135 (хло
.- нчел I ./лакс
72, 134-137 (эти
ИК
ицел
см
:
73, масло
Vj/ /Л
n-C4Hq i-CiH-,
14
15
16
17
18
о
О
С1-/Л
ВГ-/Л
СН,
СН,, (-)Н
чвО
СВ., (-) 50, масло (о{)° - И,26 (С 1,039, метанол)
40
СН (-f) 51, масло (с) 11, (С 1,020, метанол)
60, 132-133 (этилацетат-н-гексан)
, см- ; 5300, 3275, . 1725, 1700 (0()«,° 17,33, (с 1,027, метанол)
. 52 132,5-133 (изопропиловый эфирхлороформ) нуел J
ИК VMOKC , см J 3300, 3275, 1725, 1700
()° 17,47(С 1,007, метанол)
CHj (-)149,5-150 (иэопроггаловый спиртхлороформ) (С) - 7,84 (С 0,790, метанол)
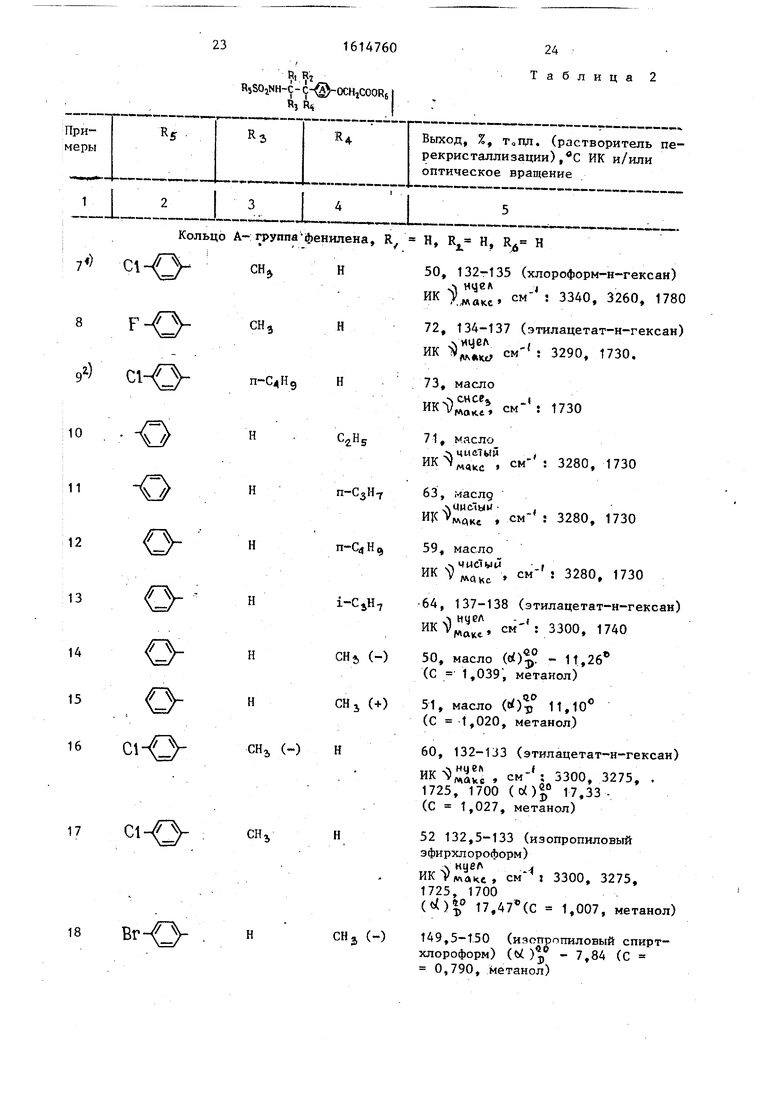
Таблица 2
Выход, %, Тогщ. (растворитель перекристаллизации) ,C ИК и/или оптическое вращение
50, 132-135 (хлороформ-н-гексан)
.- нчел I ./лакс 3340, 3260, 1780
72, 134-137 (этилацетат-н-гексан)
ИК
ицел
см
: 3290, 1730.
73, масло
ИК) см- : 1730
71, масло
чие.7ы5 . ИК N, , см- : 3280, 1730
63, маслд
. . см 5 3280, 1730
59, масло
. -- 3280, 1730
64, 137-138 (этилацетат-н-ге HKS)j, см : 3300, 1740
чвО
50, масло (о{)° - И,26 (С 1,039, метанол)
40
) ета
25
СН () 150,5-152 С (изопроп спиртхлороформ) (с )
19 BrnQ)- Н
(С 1,016, метанол) Кольцо А-группа фенилена, R Н, R, Н/, R СН«,
О-, Н сн,
20
9А, масло
,. ицсл I . 173
21
22
23
Кольцо А-группа фенилена, R Н, R. Н, R6 Н, R ОН
Br-(J
С1-О С1
i
2
CH,
CcHs
H
CH
140,5-142 (этилацета ИК SlStc , CM- 329
126-128 (этилацетат TK M«M, CM- ; 3270
Масло
.СИСЕз
ИК
.f
V/naK/ . CM- : 173
100, масло sCHCe
25 V
CH,
26
H
Cl
27
CH,
Cl СНз
Cl F-/1
H
Cl
30
3 Cl-O-H
CV
,
H
1614760
26
11родол5кенпе таОл. 2
СН () 150,5-152 С (изопропиловый спиртхлороформ) (с ) .р 8,07
(С 1,016, метанол) Н, R, Н/, R СН«,
9А, масло
,. ицсл I . 1738
Н, R. Н, R6 Н, R ОН
140,5-142 (этилацетат-н-гексан) ИК SlStc , CM- 3290, 1730
126-128 (этилацетатн-гексан) , CM- ; 3270, 3180, 1780
Масло
.СИСЕз
ИК
.f
V/naK/ . CM- : 1735
100, масло sCHCe
MOKt
93 178-179 (этилацетат-н-гексан)
XHyOft,.
KN;.j, CM- : 3280, 1730
лч cHce, j
ИК V..., 1730
CH.
100, масло
KKStHa J, CM- : 3300, 1730
100, масло
. CM- : 3300, 1730
-
100, масло
, см- : 3320, 1735
100, мясло
oiCHce. .
HKN;v e Kc, CM- : 3500, 3300, 1735
3500, 3300, 1730
100, масло CHce «акс.
, CM- : 3500, 3380, 1735
CHv
100, 99-102 (разл.этилацетат- н-гексан)
280, 1730, 1710
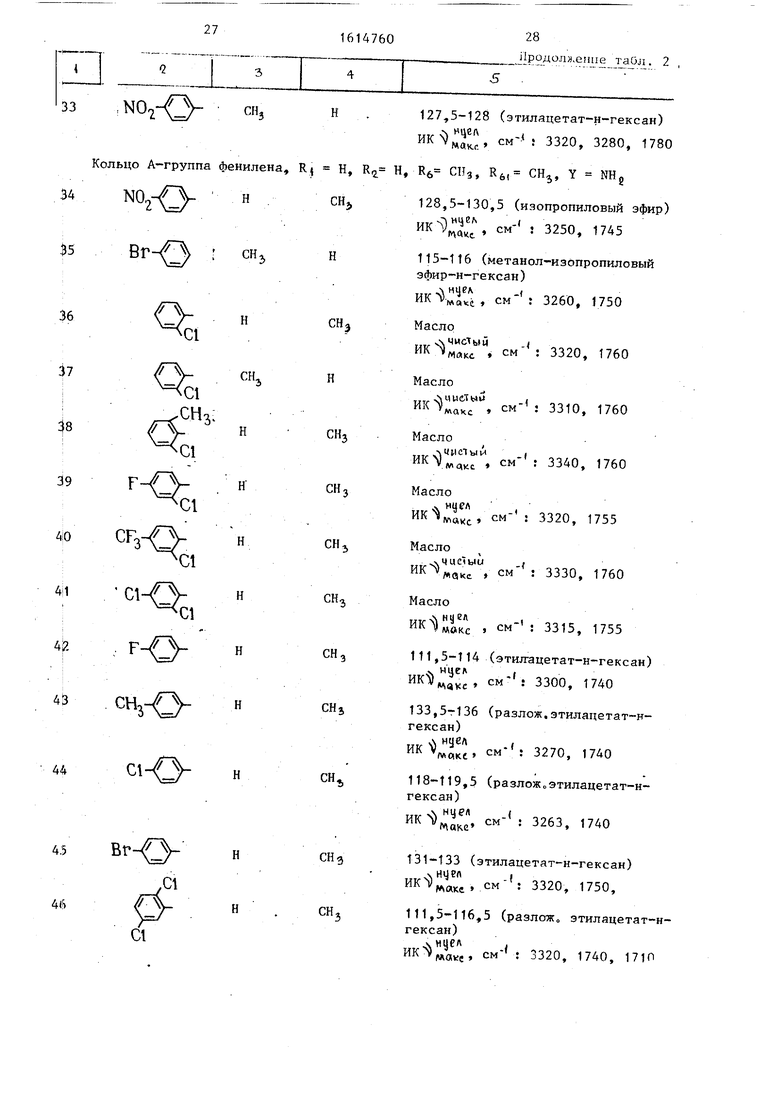
34
Кольцо А-группа фенилена,
, Н
N0,
R Н, К Н, Кб СНз, R, СН, Y
CH,
128,5-130,5 (изопропи 3250,
35
ВГ-/3 : СНз
H
36
ct
CH,
37
CH,
С1
СНз:
С1
H
CH,
39
H
CH,
ci-/
Cl
Н Cl
1
H
H
CH.
CH,
42
F
H
CH.
43
H
CHj
44
Cl
H
CH,
Вг-/Л
CHg
,ct
46
f
Cl
CH,
,.. 2
27,5-128 (этилацетат-н-гексан) ™ 3320, 3280, 1780
NH,
128,5-130,5 (изопропиловый 3250, 1745
115-116 (метанол-изопропило
эфир-н-гексан)
„.. л нцеА,
., , см- : 3260, 1750
MOfci Масло
...sN чистым(
. см- : 3320, 1760 Масло
, см- : 3310, 1760
махе
Масло
ччпетыи
АЛ OIKC
Масло
HI
VI«KC
CM- : 3340, 1760
л УРЛ ИК ил,,.,. , см
3320, 1755
Масло
„.о.чие7ыи,
, см : 3330, 1760
Масло
.,.,4 ну en,
ИК VWOKC . см- : 3315, 1755
111,5-114 (этил-ацетат-н-гексан)
V нцел.
savjc см- : 3300, 1740
133,5-г136 (разлож.этилацетат-н- гексан)
Л«. см- : 3270, 1740
118-119,5 (разложоэтилацетат-н- гексан)
. -- 3263, 1740
131-133 (этилацетат-н-гексан)
чНуел I лакс см- : 3320, 1750,
111,5-116,5 (разложо этилацетатгексан)
.
, см- : 3320, 1740, 1710
47
Cl-/
48
Cl
-И
этиловый эфир соединения примера 7: т.пл, 107-108 С. Соль натрия соединения примера 9: . 187-188 С. vT, плд солей натрия 226-228,, /т, пл солей натрия 127- 131 С (разложо)
i
ь)
т. пл. солей натрия 206-207« С,
О
То тщ, солей натрия 226,5-229 С,
RiR2
- C- -OCHjCOORe; R, Я ,
49
50
51
R Н, R2 СНз, Кз Н, R4 Н
VOCHoCOOH 90. (изопропиловый спирт-вода) иЦРл,
Г-ИК-,, , см- 1740
f VoCHoCOOH 90, 106,5-108,5 (этилацетат-н-гексан) мцеА
Ч„v (
, см- : 1740
ОСН2СООН93, масло
Чр......
.
CF,3
v y-OCH2COOH 70, 104-105 (иропропиловый спирт-вода)
4i-V мцел,
,, cм-. 1720
53
Q,
ОСН2СООН 62, 138-140 (этилацетат-н-гексан)
. М11РЛ
Гч ИЦРЛ,
ИК УИД С. см- : 1740
54
55 С1
/ ОСНоСООН96, 105-106 (изопропиловый спирт-вода)
,, см : 1730
-О-ОСН2СООН96, масло
/-. чистый ,
,,, см- : 1740
(-) 137-138 (этилацетат-н-гексан) HKS), 3280, 1740 (5)J -8,63(С 1,019, метанол)
(+) 138-139 (этилацетат-н-гексан) , см- : 3280, 1740 (6/) 8,(С 1,008, метанол).
Таблица 3
93, масло
......
.
36 СНз-О
57CF3-O
58Cl-f
-О ОСН7СООН95, масло
Р HUCTfefU,
ИКЛ/„аке см : t740
- ОСН2СООН7А, 113-120 (этилацетат-н-гексан)
FHKSl S c, см ; 1740
-ОкОСН СООНМасло
С1.ИК ,, см- : 1740
При- |меры
R,
fAVOCHoCOORc ькод, %, т.пл. (раст.перекристалли - D чятши ) Г
зации),С
1
2
О /л
.RI CHj, Н, Кэ ч, R4 Н
й
О-ОСН СООН60,
СНз
ОСН2СООН Т
ик:
CHCt
«акс С
62, 148-150 эфир-н-гекс
ик«::.с
ик«::.см-м74о
(VOCH2COOH 72, 130,5-132,5 (хлороформ)
л ,
макс, ск- Г1720
ик V
СНз-О
.cooH Ц-; г
77, 1
4
/.,
65 СГзнГ
Yj OCH2COOH- 163-164 (этилацетатизопропиловый эфир).
. см- : 1720
Таблица 4
ькод, %,
чятши ) Г
зации),С
60,
ик:
CHCt
«акс СМ I 1730
62, 148-150 (этилацетат-изопропиловый эфир-н-гексан)
ик«::.см-м74о
л
макс
ик V
Ц-;
77, 138-141 (этилацетатизопропиловый
4
Ц-;
/.,
см- ; 1740
,61/4760
R,R,
C-C- AVoCHoCOORfi I , /
R R
а b с d i f
q к
L
M
N
H
P
звестое
ClCH.
ci- 3CHjO
C1NOo
H
C HgCH,
Cl
ч;но
сГзО
T -Qснэ-Оci-O
Br-O
H H
34 Таблица 5
H
CH
H
3
CH
CH
H
H
H
H
H
4U
Таблица 6
Ингибирование вызван- Влияние на продолжи- ного колагеном агре- тельность кровотечения, гирования тромбоцитов,
IC50, мкг/мл mнимaльнaя действующая
доза, мг/кг
Таблица 7
3 3 3 3
| Biochim.Biophys Acta, 1969, 186, 254„ Патент США 4258058, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| опублик, 1981, | |||
Авторы
Даты
1990-12-15—Публикация
1987-08-05—Подача