Изобретение относится к способу получения новых тиокетеноных нроиз- вопньгх пиперидина общей формулы
N О
I R
(1)
(I)
где R, - водород, С - C,Q -алкил, С; - С4.-алкенил, фенил, группа (,1 Y, где .Y - фенил, незамещенный или заме- DienHbirt галогеном. С ,, - Г,4- алкилом, (1, - С4-алкокси, нитро, амужо, бензилоксикар- бопиламино,
Кл водород, С - С.-алкил, С(- С -алкоксикарбонил, А - группа формулы или CHCCOOR,), где R, - С - 0:4- алкил, или в случае когда Y - аминофенил - их гидро- хлоридоБ или гидробромидов, которые проявляют гепатоза- щитные свойства.
Цель изобретения - разработка на основе известного метода способа получения новых производных диоксопипе ридина, проявляюи1их ценные фармаколо гические свойства при низкой токсичности.
Пример 1.
1. Смесь 15,1 г 2,А-диоксопипери- дин, 30 МП метилортоформиата и 3,0 г п-толуолсульфокислоты в 300 мл метанола кипятят в течение 1 ч с обратны холодильником. После выпаривания растворителя остаток растворяют в бензоле и кипятят с обратным холодильнико в течение 5 ч, В раствор добавляют 9,0 г карбоната калия и смесь перемешивают в течение ночи при комнатной температуре, а затем фильтруют. Фильтрат перегоняют, чтобы удалить растворитель. Остаток перекристалли- зовывают из смеси этилацетата с изо- пропиловым спиртом, в результате чего получают 12,3 г (выход 72,5%) 4-метокси-5,6-дигидро-2-(1 И)-пиридоп
в виде бесцветных призматических кристаллов г т.пл. 115-117 С.
2. 447 мг гидрида натрия в форме 60%-ной дисперсии в масле суспенди0
5 0
5 0
,с
д0 45 Q
55
руют в 10 мл N,N-диметилфориамида и добавляют в суспензию по каплям раствор 1,29 I- 4-метокси-5,(1-дигидро- -2(1Н)-пиридона в 30 m К,М-диметил- формамида.
Смесь перемешивают с охлаждением льдом в течение 30 мин, после чего в
нее по каплям добавляют 0,97 мл йодистого этила. Эту смесь перемешивают с охлаждением льдом в течение 30 мин, а затем при комнатной температуре в течение еще 2,5 ч. Реакционную смесь вьшивают в воду и подвергают экстрак1у1онной обработке хлороформом. Экстракт промывают насыщенным раствором хлористого натрия и сушат. После выпаривания растворителя остаток растворяют в 120 мл этанола и добавляют в раствор 60 мл 10%-ной соляной кислоты, а затем смеси дают постоять при 25 (; в течение 5 ч. После отгонки под пониженным давлением растворителя остаток растворяют в хлороформе, промывают 5%-ным водным раствором бикарбоната натрия и водой с последующей сушкой. Растворитель отгоняют с получением 1,12 г (выход 78%) 1-ЭТИЛ-2,4-диоксопиперидина.
3. 1,06 г 1-этил-2,4-диоксопипе- ридина растворяют в 50 мл Ы,К-диме- тилформамида и раствор добавляют по каплям в суспензию 60%-ной дисперсии 332 мг гидрида натрия в масле в 50 мл Ы,М-диметилформамида при охлаждении льдом. Смесь перемешивают в течение 20 мин, а затем в нее добавляют 1,89 г 2-метилтио-1,3-дитиолиййо- да. После перемешивания при комнатной температуре в течение ночи реакционную смесь выливают в воду и подвергают экстракционной обработке этилацетатом. Экстракт проьс.1вают водой, сушат и перегоняют для удаления растворителя. Остаток очищают хроматографической обработкой в колонке с силикагелем с использованием в качестве проявителя этилацетата, после чего перекристаллизовывают из смеси этилацетаты с изопропиловым эфиром, получая в виде бледно-желтых иглоподобных кристаллов 1,10 г 1-этил-3-(1,3-дитиол-2-илиден)-2,4- -диоксопиперидин с т.пл. 114,5-117 С.
ИК-спектрограмма, , 1585, 1620.
ЯМР-спектрограмма (CDClj), О ; 1,21 (т, J 7,2 Гц, ЗН), 3,58 (к, J 7,2 Гц, 2Н), 7,28 (с, 2Н).
5
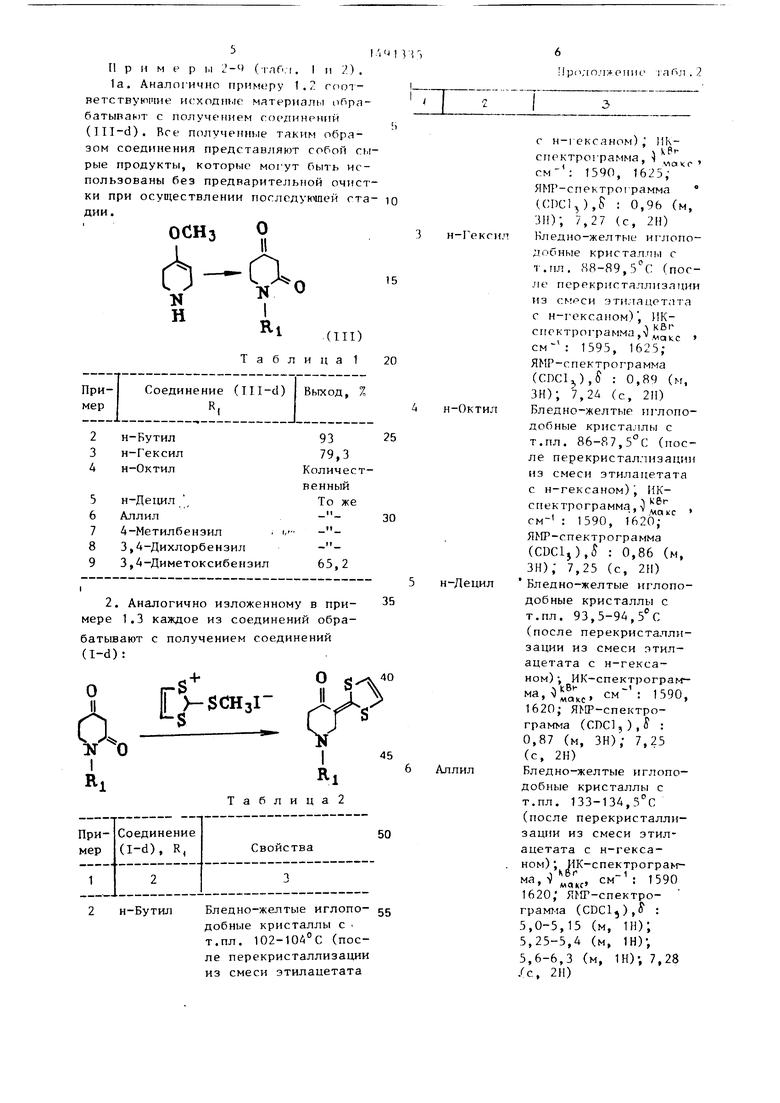
Пример ы 2-Ч (тлОл. I п 2), 1а. Аналогично примеру 1.2 гоог- ветствуюшие исходнме материалы оПра- батываит с получе 1ием ггзединрний (Ill-d). Все полученные таким образом соединения представляют собой сырые продукты, которые могут быть использованы без предварительтюй очистки при осуществлении последующей ста- дин.
ОСНз О
(III) Таблица 1
Ч 1 , 3
1р(; олжоп1и 1 аПл . 2
3
5
0
5
0
и-Гексил
с н-гексаном) ИК- спектрограмма, , см- : 1590, 1625,- ЯМ1 -спектрО1-рамма (CDC,),S : 0,96 (м, 311); 7,27 (с, 2Н) Бледно-желтые иглопо- добные кристаллы с т.пл. 88-89, ЗЧ; (после перекристаллизации из этилацртпта с H-roKcaiiOM), ИК- спектрограмма, } ,д(, , 1595, 1625; ЯМР-спектрограмма (СПСЦ), : 0,89 (f, ЗН); 7,2А (с, 211) Бледно-желтые иглопо- добные кристаллы с т.пл. 86-87,5°С (после перекристаллизации из смеси этилацетата
с н-гексаном), ПК- кВг спектрограмма, V :.„,
макс
см
1590, 1620,













Изобретение касается гетероциклических соединений, в частности тиокетеновых производных пиперидина [ТПП] общей формулы C[O]-CR2-A-NR1-C[O]-C=C-S-CH=CH-S, где R1-H, C1-C10 - алкил, C2-C4 - алкенил, фенил, CH2-Y, при Y-фенил [он может быть замещен галогеном, C1-C4-алкилом, C1-C4-алкоксилом, NO2, NH2, бензилоксикарбониламиногруппами], R2-H, C1-C4-алкил, C1-C4-алкоксикарбонил, A=-CH2- или -CH-C[O]OR3, при R3-C1-C4-алкил
или в случае, когда Y-аминофенил, фармацевтически приемлемых аддитивных солей кислот, таких которые проявляют гепатозащитные свойства, что может быть использовано в медицине. Синтез ТПП ведут реакцией соединений формул C[O]-CR2-A-NR1-C[O]-CH2 и [S(CH3)-C=S+-CH=CH-S] X1, где X1-галоген
R1, R2 и A указаны выше. Целевой продукт выделяют непосредственно или в случае, когда в ТПП а) R1-H, алкилируют его соединением общей формулы R4-X2, где X2-галоген, R4-C1-C10-алкил, C2-C4-алкенил или -CH2-Y, при Y-фенил [он может быть замещен галогеном, C1-C4-алкилом, C1-C4-алкокси-, NO2, NH2, бензилоксикарбониламиногруппами], б)Y-нитрофенил, восстанавливают NO2, NH2 в) Y-бензилоксикарбониламинофенил, удаляют защитную бензилоксикарбонильную группу
г) Y-аминофенил, целевой продукт выделяют в виде гидрохлорида или гидробромида. ТПП подавляют увеличение печени при отравлении CCL4 на 44-100% (для аналогов 11%). 4 табл.
Бутил Бледно-желтые иглопо- 55 добные кристаллы с . т.пл. 102-104°С (после перекристаллизации из смеси этилацетата
5
5
н-Децил
Аллил
ЯМР-спектрограмма (CDClj),( : 0,86 (м, ЗН); 7,25 (с, 2И) Бледно-желтые иглопо- добные кристаллы с т.пл. 93,5-9А,5 С (после перекристаллизации из смеси этил- ацетата с н-гексаном) ; ИК-спектрограм-
ма,
VBf
маис
СМ
1590,
1620; ЯМР-спектро- грамма (end, ) ,S : 0,87 (м, ЗН); 7,25 (с, 2Н)
Бледно-желтые иглопо- добные кристаллы с т.пл. 133-134, (после перекристаллизации из смеси этил- ацетата с н-гексаном) ; ИК-спектрограм Кр 14 с
мя. ма.с см : 1590 1620; ЯМГ-спектро- rpaMf.ia (CDCl,), : 5,0-5,15 (м, 1Н); 5,25-5,4 (м, 1Н)-, 5,6-6,3 (м, 1Н); 7,28 /с, 2Н)
Продолжение табл. 2
I:T:I
4-Метил- бензил
3,А-Дихлорбензил
Бледно-желтые иглопо- добные кристаллы с т.пл. 137-138°С (после перекристаллизации из изопропилового 10 спирта); ИК-спектро- грамма, макс : 1590, 1625; ЯМ1 -спек- трограмма (CDClj),S :
2,31 (с, ЗН); 4,68 15 (с, 2Н); 7,25 (с, 2Н) Бледно-желтые иглопо- добные кристаллы с т.пл. 175-176,5°С (после перекристалли-20 зации из этилацета- та), ИК-спектрограмма,
net /лаке
СМ
1590,
3,4-Димет- оксибензил
1625; Я {Р-спектро- грамма (CDCl,),fi : 5 4,69 (с, 2Н); 7,34 (с, 2Н)
Бледно-желтые иглопо- добные кристаллы с т.пл. 195-196,5°С30
(после перекристаллизации из смеси этил- ацетата с н-гекса- ном), ИК-спектрограмм.. 1590,35 1625; ЯМР-спектрограмма (CDCl), : 3,86 (с, 6Н); 4,68
(с, 2Н), 7,35 (с, 2Н) 40
П р и м е р 10. 60%-ную дисперсию 0 мг гидрида натрия в масле суспен- ируют I; 10 мл тетрагидрофурана и доавляют в нее 200 мг 1-бензил-2,4-ди-, 45 оксопиперидина и 273 мг 2-метилтио- -1,3-дитиолиййодида. Эту смесь перемешивают при комнатной температуре в течение 30 мин. Затем реакционную смесь выпивают в воду и подвергают экстракционной обработке хлороформом. Экстракт промьшают насьпценным раствором хлористого натрия, сушат и затем перегоняют для удаления растворителя. Остаток очищают в хроматографической колонке с силикагелем с использованием в качестве элюента смеси этилаце- тата с н-гексаном в соотношении 1:1 и перекристаллизов ывают из изопропи50
55
5
0
5
0
5
лового спирта, получая в виде бледно-желтых иглоподобных кристаллов 262 мг (выход 87,8%) 1-бензил-3-(1, З-дитиол-2-илиден)-2,4-диоксопиперидина с т.пл. 122-124 С.
...л хлоросуорм |
ИК-спектрограмма, , см :
1590, 1630.
ЯМ1 -спектрограмма (СПСЦ),5 :
4,75 (с, 2Н); 7,25 (с, 8Н). Пример 11.
т.кип. 124-127 С (под остаточным давлением 1,2 мм рт.ст.).
в хлороформе и раствор промьгаают насыщенным раствором хлористого натрия, сушат, а затем отгоняют для удаления
растворителя, и pi iv;i ьт.ч i f чп i виде маг. ктподоОнпгч) iiptvtvKTn ю.чуча- ют 3,62 Г (выход HfS,) 1-ф1 И. тип- -2,4-диоксоииперидииа.
Феиетил представляет собой Ппедно желтые иглоподобные кристаллы с т.пл 147-148 С (после перекристаллизации из изопропилового спирта); ИК-спект- рограмма, , см : 1585, 1625; ЯМР-спектрограмма (СПС1 ,) ,{ : 7,24 (с, 7Н).
Пример 12. 60%-ную дисперсию 83 мг гидрида натрия в масле суспендируют в 10 мл диметоксиэтана, после чего в суспензию добавляют 200 мг 2,4-диоксопиперидина, Эту смесь перемешивают при комнатной температуре в течение 10 мин, затем в нее добавляют 489 мг 2-метилтио-1,3-дитиолий- йодида. Смесь перемешивают при 50°С в течение 2,5 ч и в нее добавляют 49 мг дополнительного 2-метилтио-1,3 -дитиолиййодида. После отгонки из не растворителя под пониженным давлени- ем к остатку добавляют воду. Смесь подвергают экстракционной обработке хлороформом и экстракт промывают насыщенным раствором хлористого натрия а затем сушат. После отгонки растворителя остаток перекристаллизовывают из метанола, получая в виде бледно- желтых иглоподобных кристаллов 284 мг (выход 75%) 3-(1,3-дитиoл-2-илидeн)- -2,4-диoкcoпипepидин с т,пл, 277- 279 С,
Пример 13, 60%-ную дисперсию 226 мг гидрида натрия в масле суспендируют в 10 мл К,Ы-диметилформамида и в эту суспензию по каплям добавляю раствор 1,0 г 3-(1,3-дитиoл-2-или- дeн)-2,4-диoкcoпипepидинa, который готовят по примеру 12, в 100 мл N,N- -диметилформаьтда при одновременном
охлаждении до 0-5°С, Смесь перемеши- вают в течение 10 мин при той же температуре, после чего в нее по каплям добавляют 861 мг йодистого метила, конечную смесь вновь перемешивают при 0-2 С в течение 1,5 ч. После отгонки растворителя под пониженным давлением остаток очищают хроматогра- фической обработкой и колонке с сили- кагелем с использованием в качестве
v4iiU HTn и-1Ч К(ЧТИЛ с- птилл цс 1 л том м
(0(1 ГИ011|СН1П1 1:1 и 1ГГ 11(КРИС Я.Ч IIII40I1I. нают с получением н пиле Ьчедно-жем- тых иглоподоОпых кригта. 1Л 1н ь Vi мг ( рьгхол 9,5) 1-ru-rii.M- l-М , -лнтинч- -/ -илид мО -2 , . мпшерипина с т,пл, 148,5-153 ;,
ч HL L «,- I
ИК-спектрограмма , N , , гм : 1595, 1630.
ЯМР-спектрогрлмма (СПС1),1 : 3,11 (г, ЗН); 7,28 (с, 210.
П р и м е р ы 14 и 15. 11роводят реакцик 3-( 1, 3-дитиол-2-илиден)-2,4- -диоксопиперилина, получен)1ого согласно примеру 12, с го11третстпуюпа1м исходным материа.пом, аналогичным в примере 13, н результате полч- ают соединение 1-с1. Данные представлены в табл. 3,
Т а б л и ц а 3
0 5 Q
5
0
5
144-Хлорбен- Бледно-желтые иглопо- зилдобные кристаллы с
т,пл, 143-149 С (после перекристаллизации из этанола); ИК-спек- трограмма,ГГГГР , см- : 1585, 1620; , ЯМР-спектрограмма (СОСЦ), S : 4,72 (с, 211); 7,28 (с, 4Н); 7,32 (с, 2Н)
154-Метокси- Бледно-желтые иглопо- бензилдобные кристаллы с
т.пл. 160-162°С (после перекристаллизации из этилацетата с изопропиловым эфиром) ; НК-спектрограмл .лоро рорлл
Адакс
см- : 1585, 1625;
ЯМР-спектрограмма (CDCl,), : 3,77 (с, ЗН); 4,67 (с, 2Н); 7,28 (с, 2Н).
Пример 16, 60%-ную дисперсию 47 мг гидрида натрия в масле суспендируют в 2 мл Ы,К-диметилформамида, в эту суспензию по каплям добавляют раствор 220 мг 3-(1,3-дитиол-2-или- ден)-2,4-диоксопиперидина в 16 мл М,Ы-диметилформамида. Эту смесь перемешивают в течение 10 мин, после чего в нее добавляют 0,12 мл бензилб1 мида и смесь подвергают дальнеишему пе- р1емеип1ванию в течение 1 ч. По завершении реакции реакционную смесь перегоняют для удаления растворителя под пониженным давлением, а остаток растворяют в хлороформе, Хлороформ}Т1Л раствор промывают насыщенным водным раствором хлористого натрия, сушат, а затем отгоняют растворитель. Остаток перекристаллиэовывают из изопро- пилового спирта с получением в виде бледно-желтых иглоггодобных кристаллов 176 мг (л.1ход 62%) 1 бензил-3-( 1, 3- -дитиол-2-илиден)-2,4-диоксопи11ери- дина с т.пл. 122-124°С. Пример 17.
нергают экстракшюнной обработке бензолом и водный слой нейтрализуют 10%-ной соляной кислотой, после чего вновь подвергают экстракционной обра- ботке хлороформом. Экстракт сушат и перегоняют для удаления растворителя, в результате чего в виде маслоподобного продукта получают 8,50 г (количественный выход) метил-1-(3-пиридил- метил)-2,4-диоксопиперидина-З-карбок- силата.
0
5
0
5
0
5
0
ИК-спектрограмма,
N ЖИДКОСТЬ
ма КС
1720, 1650, 1590.
ЯМР-спектрограмма (С1)СЦ),й : 3,90 (с, ЗН); 4,61 (с, 2Н) . Масс-спектрограмма (м/е): 262 (М ) . 4, Смесь 8,50 г метил-1-(3-пири- дилметил)-2,4-дио1;сопиперидин-3-кар- боксилата, 100 мп ацетонитрила и 1,4 МП воды кипятят с обратным холодильником в течение 1 ч. Эту смесь перегоняют для удаления растворителя, в результате чего получают 6,66 г (количественный выход) кристаллического 1-(З-пиридилметил)-2,4-диоксо- пиперидина с т.пл. 55-60°С.
ИК-спектрограмма, ;) ;; „аà . м : 1730, 1660,
ЯМР-спектрограмма (СВСЦ),о :4,71 (с, 2Н).
Масс-спектрограмма (м/е): 204 (М ). 5. 2,01 г 1-(З-пиридилметил)-2,4- -диоксопиперидин обрабатывают аналогично изложенному в примере 1.3, в результате чего в виде желтых плас- 1инчатых кристаллов получают 1,50 г (выход 50,1%) 1-(3-пиридилметил)-3- -(1,3-этил-2-илиден)-2,4-диоксопипе- ридина, т.пл. 131,5-133°С.
ИК-спектрограмма, -) , : 1620, 1580,
ЯМР-спектрогра жа (СВС,), : 4,75 (с, 2Н); 7,31 (с, 2Н).
Полученное соединение обрабатывают соляной кислотой - простым эфиром и получают соответствующий гидрохлорид в виде бледно-желтых игольчатых кристаллов, т,пл. 243,5°С (разложение, перекристаллизован из метанола), Пример 18, 1, 93 г анилина растворяют в 500 мл этанола, в этот раствор по каплям с охлаждением льдом добавляют 100 г этилацетата. Смесь перемешивают при 50 С в течение 3 ч, затем кипятят с обратным холодильником в течение 8 ч. Далее смесь перегоняют для удаления из нее растворителя. Остаток
перегоняют под пониженным даплением, в результате получают 26,6 г N-фе- нил-бета-аланинэтилового эфира т.пл, 119-120 С при остаточном давлении 2 мм рт.ст.
ИК-спектрограмма, ДТ . : 1725.
70 МП метанола и смесь добавляют по каплям в раствор метоксида натрия (приготовленный с использованием . 3,90 г натрия) и 70 мл метанола при 50 С. Смесь перемешивают при 50 С в течение 2 ч и перегоняют для удаления растворителя. Остаток растворяют в воде и водный раствор подвергают экстракционной обработке этилаце- татом. Водньй слой нейтрализуют 10%-ной соляной кислотой и подвергаю экстракционной обработке этилацето- ном. Экстракт промьгоают насьпценным водным раствором хлористого натрия, сушат, а затем перегоняют для удаления растворителя. Остаток очищают в хроматографической колонке с силика- гелем с использованием в качестве растворителя смеси этилацетата с н- гексаном в соотношении 1:2, в результате в виде маслоподобного продукта получают 23,87 г (выход 81,6%) 1-фе- нш1-3-ацетил-2,4-диоксопиперидинс .
ИК-спектрограмма, J,a tc° 1665.
ЯМР-спектрограмма (CDClj),S : 2,58 (с, ЗН)..
Масс-спектрограмма (м/е): 231 (М )
30 мл 10%-ной соляной кислоты. Смесь кипятят с обратным холодильником в течение 7 ч. Далее эту смесь перегоняют для удаления растворителя, а полученный остаток растворяют в этил- ацетате. Раствор промывают насьпценным водным раствором хлористого натрия, сушат, а затем перегоняют для удаления растворителя, получая 1,12 г
0
5
0
5
0
5
0
5
0
5
с:ыро1Ч1 1 -фени.;1-2, j-диокгопиперидина . 1,12 г укатанног о ri,tpor o гоединения растворяют в 50 кп диметоксиэтана, по каплям добавляют в суспензию 60%-ной дисперсии 52Д мг гидрида натрия в масле в ТО L7 диметоксиэта- на. Указанную операцию добавления проводят в условиях охлаж,тения льдом Смесь перемеигивают при той же температуре в течение 40 мин. В эту dwei смесь добавляют 1,64 г 2-этилтио- -1,3-дитиолиййодида, затем ее перемешивают при комнатной температуре в течение 3 ч. Далее смесь выливают в воду и подвергают экстракционной обработке этилацетатом. Экстракт промывают водой, сушат, а затем перегоняют для удаления растворителя. Остаток очищают в хроматографической колонке с силикагелем с использованием в качестве элюёнта смеси этилацетата с н-гексаном в соотношении 1,1, после чего перекристаллизовывают из смеси этилацетата с н-гексаном, получая в результате в виде желтых иглоподоб- ных кристаллов 354 мг 1-фенил-3-(1,3- -дитиол-2-илиден)-2,4-диоксопипериди- на с т.пл. 150,5-152°С.
R I
ИК-спектрограмма,, см : 1630, .1660.
ЯМР-спектрограмма (CDCl,), : 7,3-7,6 (м, 7Н); 2,91 (т, J 6,5 Гц, 2Н); 3,92 (т, J 6,5 Гц, 2Н).
Масс-спектрограмма (м/е): 289 (М ).
Пример 19.
Смесь подкисляют 10%-ной соляной кислотой и подвергают экстракционной обработке этилацетатом. Водный слой нейтрализуют 10%-ной гидроокисью натрия и подвергают экстракционной обработке этилацетатом. Экстракт промывают насьпценным раствором хлористого натрия,,сушат, а затем перегоняют для удаления растворителя. Остаток растворяют в диэтиловом эфире и добавляют раствор соляной кислоты в диэтиловом эфире. Остаток собирают и перекристаллизовывают из метанола с
получением в виде бледно-желтых пласс
тинчатых кристаллов 1,95 г (выход 71,1%) N-(п-нитpoбeнзил)-бeтa-aлaнин- метилового эфира гидрохлорида с т.пл. 219,5-220°С (с разложением).
ИК-спектрограмма,
ло елиновов масло макс
см : 1730.
ЯМР-спектрограмма (ДМСО-), 5 : 4,33 (с, 2Н).
14
натрия и водой, сушат, а затем перегоняют для удаления растворителя, в результате чего в виде желтого масл подобного продукта получают ДО,А г (выход 96,4%) этил- н-(п-нитробен- зил)-N-(метоксикарбонилэтил)-карба- моил -ацетата.
..... жидкость
ИК-спектрограмма, s о,,(. ,
см
1735,
ЯМР-спектрограмма (CDClj),0 :4,7 (с, 2Н).
Масс-спектрограмма (м/е): 352 (М
20 -CHj/T COOC Hs
10
25
91335
нейтрализуют 10%-ной соляной кислотой и подвергают экстракционной обработке этилацетатом. Экстракт промывают насьпценным раствором хлористого натрия, сушат, а затем перегоняют для удаления растворителя, в результате получают в виде желтого маслоподоб- ного продукта 8,03 г (выход 88,4%) этил-1-(п-нитробензил)-2,4-диоксопи- перидин-3-карбоксилата.
ИК-спектрограмма, , см :
макс 1720, 1645.
ЯМР-спектрограмма (CDCl), : 4,70 (с, 2Н).
Масс-спектрограмма (м/е): 320 (М ).
15
20
5
0
5
0
Масс-спектрограмма (м/е) ; 248 (мЪ .
562 мг полученного таким образом продукта обрабатьгоают аналогично примеру 1.3, в результате получают в виде желтых иглоподобньпс кристаллов 446 мг (выход 56,9%) 1-(п-нитробен- зил)-3-(1,3-дитиол-2-илиден)-2,4-ди- оксопиперидина с т.пл. 192-193 С (после перекристаллизации из этилаце- тата).
ИК-спектрограмма,V,
: 1620,.1580.
ЯМР-спектрограмма (CDC1),S : 4,85 (с, 2Н); 7,34 (с, 2Н).
Масс-спектрограмма (м/е): 348 (М ).
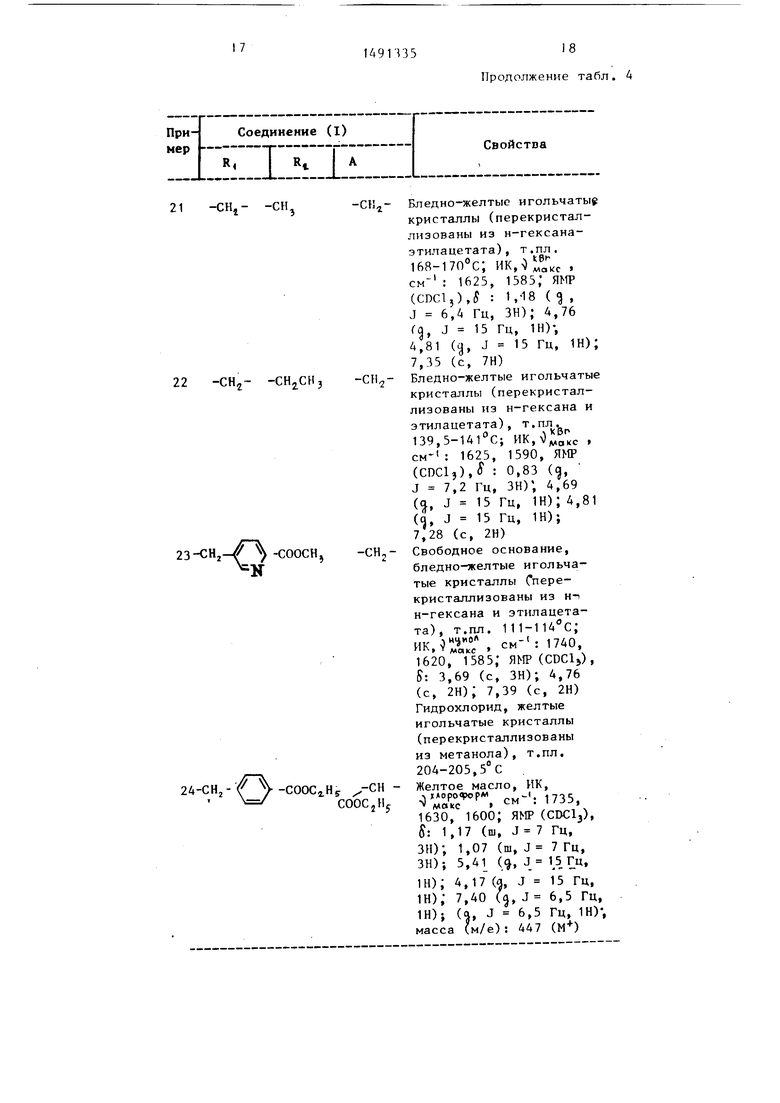
Примеры 20-24. Из соответствующих исходных соединений способом, описанным в примере 19, получены следующие соединения (см. табл. 4).
Таблица4
ЬазеАиновое масло
Бледно-желтые кристаллы (перекристаллизованы из н-гексана и этилацетата), т.пл. 127-129°С-, ИК, S. м- : 1730, 1630, 1595; ЯМР (CDClj). : 4,83 (, J 15 Гц, IH); 4,63 (, J 15 Гц, 1Н); 7,32 (с, 2Н); масса (м/е): 375 (М)
21
-CHj- -СИ,
22
-CHj-СНз СИз
23-СН
N
-соосн
24-СН,
-СООС2.Н5 -СН COOCjHj
Продолжение табл. 4
сн сн Бледно-желтые игольчаты кристаллы (перекристаллизованы из н-гексана- этилацетата), т.пл.
168-170°с; ик,) ,
: 1625, 1585; Я№ (CDCl,), : 1,-18 ( g , J 6,4 Гц, ЗН); 4,76 ((, J 15 Гц, 1Н)-, 4,81 (, J 15 Гц, 1Н); 7,35 (с, 7Н)
Бледно-желтые игольчатые кристаллы (перекристаллизованы из н-гексана и
сн,СН jHj
этилацетата), т.пл
139,5-141°С; ИК,)
кЬг
VCIKC
см
1625, 1590, ЯМР (CDCl,), : 0,83 (g, J 7,2 Гц, ЗН); 4,69 (, J 15 Гц, 1Н); 4,81 (q, J 15 Гц, 1Н); 7,28 (с, 2Н) Свободное основание, бледно-желтые игольчатые кристаллы Спере- кристаллизованы из H-I н-гексана и этилацетата) , т.пл. 111-114 с; ИК,ГДГ . см- : 1740, 1620, 1585; ЯМР (CDCl,), S: 3,69 (с, ЗН); 4,76 (с, 2Н); 7,39 (с, 2Н) Гидрохлорид, желтые игольчатые кристаллы (перекристаллизованы из метанола), т.пл. 204-205,
Желтое масло, ИК, л, (. ..с макс , см . I /JJ,
1630, 1600; ЯМР (CDClp, S: 1,17 (ш, J 7 Гц, ЗН); 1,07 (ш, J 7 Гц, ЗН); 5,41 (9, J Гц,
1Н); 4,17 (а, J 15 Гц, 1Н); 7,40 (, J 6,5 Гц, 1Н); (С1, J 6,5 Гц, 1Н)-,
масса См/е): 447 (М)
Пример 25. 100 мг 1-(п-нитро- бензил)-3-(1,3-дитиол-2-илидеи)-2,4- -диоксопиперидина растворяют в 20 мл этанола, в этот раствор добавляют 100 мл 10%-ного палладия на угле. Смесь подвергают каталитическому восстановлению под атмосферным давлением. Далее эту смесь фильтруют для удаления катализатора. Фильтрат пере- гоняют для удаления растворителя, в результате чего в виде кристаллов получают 92 мг (количественньш выход) 1-(п-аминобензил)-3-(1,3-дитиол-2- -илиден)-2,4-диоксопиперидина с т.пл. 156,5-158,5°С (после перекристаллизации из этанола), ИК-спектрограмма,;) 3440, 3355, 1625, 1585.
ЯМР-спектрограмма (CDCl),o : 4,64 (с, 2Н); 7,26 (д, J 6 Гц, 111), 7,32 (д, J 6 Гц, 1Н).
Масс-спектрограмма (м/е): 318 (М ).
Гидрохлорид.
Бледно-желтые иглоподобные крис- таллы, т.пл. (с разложением после перекристаллизации из смеси ме- .танола с диэтиловым эфиром).
П р и м е р 26.
ИК-спектрограмма, ;) 1735, 1640. .
Масс-опектрограмма (м/е): 322 (М )
10 мл воды при 8 С с одновременным -перемешиванием. Далее смесь перемешивают при той же температуре в течение 30 мин, а затем подвергают экстракционной обработке этилацетатом, экстракт промывают водой, сушат, за- тем перегоняют для удаления растворителя. Остаток очищают в хроматогра- фической колонке с силикагелем с использованием в качестве элюента смеси этилацетата с бензолом в соотношении 3:7, в результате получают в виде бесцветного маслоподобного про дукта 1,08 г (выход 94,2%) этил- N- -(п-(N-бензоилоксикарбониламино)-бензил )-N-( метоксикарбонил этил) -к арбг- моил -ацетата.
ИК-спектрограмкл, ) 1720, 1630.
ЯМР-спектрограмма (CDCl), : 5,17 (с, 2Н).
Масс-спектрограмма (м/е): 456 (Н )
ИК-спектрограмма,),диновое ллооло
см- : 1725, 1640, 1600.
ЯМР-спектрограмма (CDCl),tf : 4,56 (с, 2Е).
Масс-спектрограмма (м/е): 424 (М )
Масс-спектрограмма (м/е): 352.
660 мг полученного таким образом продукта обрабатывают аналогично примеру 1.3, в результате получают в виде бледно-желтых пластинчатых кристаллов 518 мг (выход 62,0%) ( N- бензилоксикарбонил амине) -бензил -3- -(1,3-дитиол-2-илиден)-2,4-диоксопи-: перидина с т.пл. 175-176,5 с (после перекристаллизации из этилацетата).
ИК-спектрограмма, ) см- : 1725, 1620, 1580.
ЯМР-спектрограмма (СГ)С1,),Ь : 4,69 (с, 2Н); 5,18 (с, 2Н) 7,15-7,5 (м, 11Н).
Масс-спектрограмма (м/е): 452 (М )
П р и м е р 27. 100 мг ((п- -бензилкарбамоиламино)-бензил -3- -(1,З-дитиол-2-илиден)-2,4-диоксопи- перидина растворяют в 2 мл уксусной кислоты, в раствор добавляют 0,5 мл 25%-ного раствора бромистого водорода в уксусной кислоте. Смесь перемешивают при комнатной температуре в течение 40 мин, а затем при температуре 40-50°С в течение 1 ч. После охлаждения смеси в нее добавляют ди- этиловый эфир. Выпавшие в осадок кристаллы собирают фильтрованием и пе- рекристаллизовывают из смеси метанола с диэтиловым эфиром, в результате получают в виде бледно-желтых иглопо- добных кристаллов 70 мг (выход 79,3%) 1-(п-аминобензил)-3-(1,3-дитиол-2- -илиден)-2,4-диоксопиперидингидробро- мида с т.пл. 210-214 С (с разложением) .
ИК-спектрограмма,-} ЛТ ° , 1620, 1580.
ЯМР-спектрограмма (ДМСО-), S : 4,69 (с, 2Н)-, 7,68 (д, J 6 Гц, 1И); 7,74 (д, 6 Гц, 1Н).
Масс-спектрограмма (м/е): 318 (М )
Пример 28. Раствор 1,28 г 1-(4-хлорбензил)-2,4-диоксопипериди- на в 20 мл диметилформамида добавляют в смесь 238 мг гидрида натрия (в виде 60%-ной масляной дисперсии) с 10 мл диметилформамида с одновремен- йым охлаждением льдом. Смесь перемешивают в течение 10 мин, затем в нее добавляют 1,50 г 1,3-дитиолйодида. Далее смесь перемешивают, при комнатной температуре в течение 3 ч. Реакционную смесь выливают в смесь воды со льдом и раствор экстрагируют этил- ацетатом. Экстракт промывают водой, сушат, а затем выпаривают для удаления из него растворителя. Остаток перекристаллизовывают из этанола, получая 1,23 г 1(4-хлор-бензил)-3-(1,3- -дитиoл-2-илидeн)-2,4-диoкcoпипepи- динa в виде бледно-желтых иглоподоб- ных кристаллов. Выход 68%, т.пл. 143-149°С.
ИК-спектрограмма, ) , : 1585, 1620.
ЯМР-спектрограмма (CDCl,), : 4,72 (с, 2Н); 7,28 (с, 4Н); 7,32 (с, 2Н).
П р и м е р ы 29 и 30. Аналогично примеру 28 из соответствуюпо1Х исходных материалов получают следующие соединения (см. табл. 5).
Т а б л и ц а 5
29 -CHi-O ° Выход 71%, бледно- желтые иглоподобные кристаллы, т.пл. 160-162°С (после перекристаллизации из
смеси этилацетата с изопропиловым эфиром); ИК-спектрограмма,-ГГР- см- : 1585, 1625,
ЯМР-спектрограмма (СОСЦ), : 3,77 (с, ЗН), 4,67 (с, 2Н), 7,28 (с, 2Н)
ЗО-СН -О Выход 60%, бледно- желтые иглоподобные кристаллы, т.пл. 156,5-158,54 (после перекристаллизации из этанола);
ИК-спектрограмма, ч ваъелмнобое масло
макс
, -« ,
СМ- : 3440, 3355, 1585, 1625; ЯМР- спектрограмма (CDClj), : 4,64 (с, 2Н); 7,26 (д, 6,0 Гц, 1Н); 7,32 (д, 6,0 Гц, 1Н)
5
0
5
Пример 31. В смесь 226 мг гидрида натрия (в 60%-ной масляной дисперсии) с 10 мл диметилформамида при 0-5°С добавляют раствор 1,0 г 3-(1,З-дитиол-2-илиден)-2,4-ди- оксопиперидина. Эту смесь перемешивают при той же температуре в течение 20 мин, а затем в нее добавляют 681 мг аллилбромида. Далее смесь перемети-. вают при 0-5 С в течение 2 ч. Реакционную смесь выпаривают для удаления из нее растворителя. Остаток растворяют в воде и раствор подвергают экстракционной обработке хлороформом. Экстракт промывают водой, сушат и затем вьшаривают для удаления из него растворителя. Остаток очищают хрома- тографической обработкой в колонке
с силикагелем (растворитель: смесь э тилацетата с н-гексаном в соотношении 1:1). В результате получают в виде бледно-желтых кристаллов 774 мг 1-аллил-3-(1,З-дитиол-2-илиден)-2,4- -диоксопиперидина. Выход 65%, т.пл. 133-134, (после перекристаллизации из смеси этилацетата с н-гексаном) .
32н-Октил
33
-CHi-Q-
34
-сн,-(3-«0д
35 -CHj-O
36
-сн,
П р и м е р ы. 32-37. Аналогично примеру 31 с использованием соответствующих исходных материалов получают следующие соединения. Для примеров 32 и 34 символом X обозначен атом брома, а для примеров 33 и 35 - атом хлора. Данные приведены в табл .6
Таблицаб
Выход 55%, бледно-желтые игло- подобные кристаллы, т.пл, 86- 87,5 С (после перекристаллизации из смеси этилацетата с н- гексаном), ИК-спектрограмма, ТаТс . см- : 1590, 1625 ЯМР-спектрограмма (CDCl.,),(5 : 0,86 (м, ЗН)-, 7,25 (с, 2Н) Выход 51%, бледно-желтые игло- подобные кристаллы, т.пл. 137- (после перекристаллизации из изопропанола)1 ИК-спекЛ БРОМИД КОАИЯ-1
трограмма, -О (акс, см
1590, 1625, ЯМР-спектрограмма (CDC1.,),S : 2,31 (с, ЗН); 4,68 (с, 2Н)
Выход 43%, желтые иглоподобные кристаллы, т.пл. 192-193 с (после перекристаллизации из
этилацетата); ИК-спектрограм- .,,. N вагелимовое масло „..1 . ° Алакс 1580, 1620, ЯМР-спектрограмма (CDCl,), : 4,85 (с, 2Н); 7,34 (с, 2Н)
Выход 46%, физиохимические свойства идентичны свойствам соединения, полученного по примеру 3
Выход 47%, бледно-желтые иглоподобные кристаллы, т.пл. 175- 176,5 С (после перекристаллизации из этилацетата): ИК вазе А и МО Вое спектрограмма, V
1580, 1620, 1725: ЯМР- спектрограмма (CDCl),o : 4,69 (с, 2Н); 5,18 (с, 2Н); 7,15- 7,50 (м, 11Н)
37
-СН, Символом 7. и примере 36 обозначен бенэилоксикарбо- нил.
Эксперимент 1. Защтта от острого гепатитног о повреждения, вызываемого действием четыреххлористого углерода.
Методика. Испытуемые соединения суспендировали в О,5%-ном растворе карбоксиметилцеллншозы и суспензию (с содержанием испытуемого соединения -100 мг/100 мл/кг) через рот вводили самцам мышей разновидности ddY (возраст 5-6 недель, вес 25-30 г, в составе каждой группы особи), после чего животным не давали корма. По истечении 3 ч животным через рот вводили раствор четыреххлористого углерода в оливковом масле в дозировке по 50 мкл (5 мл оливкового масла/кг). По истечении 3 ч через рот животным вводили испытуемое соединение в той же дозировке. Вес животных измеряли по истечении 24 ч после введения че- тьфеххлористого углерода, после чего животньк убивали. Сразу же после этого у них удаляли печень, взвешивали ее и подвергали макроскопическому
Средний относительньш вес печени в группе животных, получивших испытываемое соединение
печени
1 Средний относительный вес печени у животных контрольной группы, получив- UIMX четыреххлористый углерод
При оценке использовали критерии, перечисленные в табл. 7.
Продолжение табл.Ь
61%, желтые пластинчатые кристаллы, т.пл, 131,5-133 С (после перекристаллизации из. смеси этилацетата с н-гексаном); ИК-спектрограмма, ва елииобое масло |
V мопс
1590, 1620; ЯМР-спектрограмма
(CDClj}J : 4,75 (с, 2И) ; 7,31 (с, 2Н)
исследованию. Животным контрольной группы вместо суспензии испытуемого соединения и раствора четьфеххлорис- того углерода вводили 0,5%-ный раствор карбоксиметилцеллюлозы и оливковое масло (перорально). Кроме того, использовали контрольную группу животных, которым вводили раствор че- тьфеххлористого углерода и 0,5%-ный раствор карбоксиметилцеллюлозы.
Терапевтическое действие испытуемых соединений на эффект повреждения печени оценивали как степень подавления (в процентах) относительного увеличения веса печени, рассчитанного с помощью Н1гжеследующего уравнения, и основного - на макроскопическом исследовании печени, как это.показано в табл. 7. Термин относительный вес печени обозначает вес (в
граммах) печени на 100 г живого веса животного.
Подавление, в %, увеличения относительного веса
Средний относительный вес печени у животных нормальной контрольной группы
X 100.
Средний относительный вес печени у животных нормальной контрольной группы
То же, что и у животных нормальной контрольной группы
Признак улучшения относительно животных контрольной группы с четы- реххлористым углеродом Тот же цвет или внешний вид, что и у животных контрольной группы с четыреххлористым углеродом
Примечани
е: АА - заметная эффективностьJ А, В и С - эффективность; D - отсутствие эффективности.
Результаты указанного эксперименПредлагаемые соединения
1-Метил-3-(1,3-ДИТИОЛ-2-ИЛИ- ден)-2,4-диоксопиперидин АА 44,0
1-Этил-3-(1,3-ДИТИОЛ-2-ИЛИден)-2,4-диоксопиперидин АА 3,4 2-и-Бутил-3-(1,3-дитиoл- -2-илидeн) -2,4-диоксопиперидинАА 100,0
1-н-Гексил-3-(1,3-дитиол-2-илиден)-2,4-диоксопиперидинАА 100,0
1-Аллил-3-(1,3-ДИТИОЛ-2-ИЛИден)-2,4-диоксопиперидин АА 58,2 16 1-Бензил-3-(1,З-дитиол-2-илиден)-2,4-диоксопиперидин АА 61,6
1-(4-Хлорбензил)-3-(1,3-ди- тиол-2-ил иден) -2,4-диоксопиперидинАА 80,0
1-(4-Метоксибензил)-3-(1,3- -дитиол-2-илиден)2,4-диоксолиперидинАА 62,0
Т а Г) л и ц я 7 (критерии)
С
D
D
та приведены в табл. 8.
Таблица
.0U9133f)30
Продолжение табл. 8
::::::::z::;:::::::::;;ri:;i;i;:
1-(4-Метилбензил)-3-(1,3-ДИ- тиол-2-илиден)-2,4-диоксипиперидинАА 100,0
1-Фенетил-3-(1,З-дитиол-2-илиден)-2,А-диоксопиперидин АА 91,9
1-(3-Пиридилметил)-3-(1,3- -дитиол-2-илиден)-2,4-диоксопиперидинАА 87,0
1-Фенил-3-(1,3-дитиол-2-или- ден)-2,4-диоксопиперидин АА 64,3
1-Бенэил-3-(1,З-дитиол-2-или- ден)-5-метил-2,4-диоксопнперидин, АА 100,0
1-Бензил-3-(1,3-дитиол-2-или- ден)-5-ЭТИЛ-2,4-диоксопиперидинАА 54, 1
1-Бензил-5-(1,3-дитиoл-2-или- дeн) -4 , 6-дноксопиперидин-л -2,3-дикарбоновая кислота, диэтиловый эфирАА 63,,4
Этиловый сложный эфир 1-бен- зил-5-( 1,3-дитиол-2-илид ен-4-диоксопиперидин-З-карбоно- ДА 53,9 вой кислоты
1-(4-Нитробензил)-3-(1,3-ди- тиол-2-илиден) -2,4-диок сопиперидинАА 53,9
1-(4-Аминобензил)-3-(1,3-ди- тиол-2-илиден)-2,4-диоксопиперидинДА 96,1
1-(3,4-Диметоксибензил)-3-(1-дитиол-2-шщден)-2,А-диоксапиперидин А 64,2
55
Эксперимент 2. Действие против Методика. Раствор четьфеххлористоострого гепатитного повреждения, вы-го углерода в оливковом масле подзванного четьфеххлористым углеродом.кожно вводили самцам крыс разновидмости SI) (возраст 6 недель, вес 1 7П- 2lO г, в состве группы 5 особей) в дозировке 1 MJi/кг (четыреххлоригтый углерод 0,5 мл/кг) по одному разу в течение 4 дней подряд. В то же время через рот животным давали суспензию испытуемого соединения в 0,5%- ном растворе карбоксиметилцеллюлозы по одному разу в течение четырех дней (испытуемое соединение 100 мг/10 мл/ /кг). Спустя 24 ч после последнего введения в организм суспензии испытуемого соединения из нижней полой вены животных собирали кровь. Непо- средственно после этого удаляли пеЭксперимент 3. Острая токсичность, Метод. Испытуемое соединение суспендировали в 0,5%-ном растворе карбоксиметилцеллюлозы и суспензию применяли стоматическим способом самцам мыши d4y (возраст 5 недель, в одной
1-Бензил-3-( 1,3- -ДИТИОЛ-2-ИЛИ- ден)-2,А-диоксо- пиперидин
Из полученных данных видно, что максимальные толерантные дозы составляют для 1-бензил-3-(1,З-дитиол-2- -илиден)-2,4-диоксопиридина более 1500 мг/кг.
Используемые соединения суспенди- ровали в 0,5%-ном карбоксиметилцелчень. Из крови выделяли плазму и оп-| ределяли активность ГПТ и ГЩТ в плазме. Определяли также содержание три- глицерида (ТГ) в печени. Животным нормальной контрольной группы вместо раствора четыреххлористого углерода и суспензии испытуемого соединения давали оливковое масло и 0,5%-ный раствор карбоксиметилцеллюлозы. Кроме того, животным контрольной группы с четыреххлористым углеродом давали раствор четьфеххлористого углерода и 0,5%-ный раствор карбоксиметилцеллюлозы.
Результаты сведены в табл. 9.
Таблица9
группе 3 мыши) и за мышами наблюдали в течение 7 дней после применения испытуемого соединения.
I
Результаты приведенного эксперимента приведены в табл. 10.
ТаблицаЮ
I
1500
0/3
люлозном растворе и суспензию орально вводили самцам мышей ddy (8-9-не- дельные, в одной группе 2-3 животн гх) и мышей обследовали через 7 дней после введения испытуемого соединения. Полученные результаты приведены в табл. 11.
Способ получения тиокетеновьгх производных пиперидина общей формулы (I)
е R, - водород, С, - С,о-алкил,
С - С -алкенил, фенил, группа Y, где Y - фенил, незамещенный или замещенный галогеном, С - С -алкилом, С - С -алкокси, нитро, ами- но, бензилоксикарбониламино, водород, С( - С4-алкил, С - Сф-алкоксикарбонил, группа формулы или CHCCOORj),
R. А R - С - С -алкил, или в случае, когда Y - аминофенил - их фармацевтически приемлемых аддитивных солей кислот, таких как гидрохлорид или гидробромид.
Т а б JT и на 11
К
1
где R,, R и А имеют указанные значения,
подвергают взаимодействию с соединением формулы
40
SCH3
5
0
где X, - галоген,
с последующим вьделением целевого
продукта или, в случае, когда RI водород, алкилированием соединением
общей формулы R - Х,
где Х - галоген;
R С - С,о-алкил, С С -алкенил или групга -CHj- Y, где Y - фенил, незамещенный или замещенный атомом галогена, С - С -алкилом, С - кокси, нитро, амино, бензил оксикарбоНИЛаминогруппами, или когда Y - нитрофенил, восстановлением до Y -- аминофенил, или когда Y - бензилоксикарбонилами35
нофенил, удалением защитной бензилок- dHKap6oHmibHoft группы, или когда Y - аминофенил, целевой продукт выделяют в виде фармацевтически приемлемой аддитивной соли кислоты, такой как гидрохлорид или гидробромид.
Приоритет 1А.01.84 при
по признакам:
1335
R.
10
36
водород; C - С,д-алкил,
группа
С Сл-алкенил или
Ctijj- Y, где Y - фенил, незамещенный или замещенный С - С4-алкилом, одним или двумя атомами галогена, одной или двумя С, - С4-алкок- сигруппамч, R водород, А - СН,


| Rioult Р., Vialle J | |||
| Composes organiques Sulfures.- Bull | |||
| See | |||
| Chem | |||
| France, 1968, N 11, p | |||
| ЗАПОРНОЕ ПРИСПОСОБЛЕНИЕ ДЛЯ ШИПОВЫХ ЗАТВОРОВ ДВЕРЕЙ ТОВАРНЫХ ЖЕЛ.-ДОР. ВАГОНОВ | 1926 |
|
SU4477A1 |
| Nakayame J., Watale Y., Hoshino M | |||
| Heterofulvalence | |||
| I | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Chem | |||
| Japan, 1978, v | |||
| Способ запрессовки не выдержавших гидравлической пробы отливок | 1923 |
|
SU51A1 |
| Батарейная сушилка | 1919 |
|
SU1427A1 |
| Nakayame J., Imuro M., Hoshino | |||
| Heterofulvalence | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Chem | |||
| Soc | |||
| Japan, 1980, v | |||
| Веникодробильный станок | 1921 |
|
SU53A1 |
| Рельсовый башмак | 1921 |
|
SU166A1 |
Авторы
Даты
1989-06-30—Публикация
1985-01-14—Подача