Изобретение относится к биотехнологии и касается способа получения конъюгированного термостабильного энтеротоксина кишечной палочки и может быть использовано в производстве вакцинных пре- паратов против колибактериоза и смешанной инфекции (колибактериоз, рота, коронавирусная инфекция).
Кишечная палочка, которая выделяется от больных и павших телят, в основном продуцирует термостабильный энтеротоксин и в малой степени термолабильный. Термостабильный энтеротоксин не обладает им- муногенными свойствами. Он приобретает эти свойства лишь в сочетании с носителем с большей молекулярной массой.
Наиболее близким техническим решением является способ получения конъюгированного энтеротоксина из термостабильного и термолабильного энтеротоксинов E.coli с помощью 1 этил 3/3 диметиламинопропил/ кар- бодиимида Предварительно очищенный термостабильный и термолабильный энтеро- токсины с помощью хроматографии (амбер- лит НАД-2), ацетонного фракционирования, последовательной гельфильтрации на сефа- дексе G25, конъюгировали в 0,1 М фосфатном буфере (рН 7,0) в течение 96 часов при 4°С. с последующим диализом против НгО в течение 48 ч при 4 °С.
Однако известный способ имеет следующие недостатки: термостабильный и терХ|
СЛ О Ч) О
молабильный энтеротоксины подвергали длительной очистке с использованием дорогостоящего оборудования и реактивов: хроматографии (амберлит НАД-2), ацетонного фракционирования последовательной гель- фильтрации на сефадексе G25 и ионнооб- менной хроматографии (ДАЕ сефацил), повторной хроматографии на сефадексе G25. Вследствие больших потерь токсинов на этапах очистки, особенно на этапах ион- нообменной и тонкослойной хроматографии не удается собрать достаточного количества токсинов, необходимых для проведения всего комплекса исследований по конъюгированию и для иммунизации боль- ших групп животных. Конъюгацию энтеро- токсинов осуществляют с использованием дорогостоящего реактива 1 этил 3/3 диме- тиламинопропил/ карбодиимида, который в нашей стране не производится. Метод тре- бует строгого соблюдения оптимального соотношения карбодиимида и энтеротокси- нов при конъюгации. Так при повышении этого соотношения до 100:1 резко снижается антигенность коныогата. Увеличение времени конъюгации существенно не влияет на увеличение процента содержания термостабильного энтеротоксина в конечном конъюгате. При сокращении времени конъюгации менее 18 ч резко снижается анти- генность конъюгата. Нз весь процесс конъюгации энтеротоксинов затрачивается более 260 ч.
Цель изобретения - повышение имму- ногенности целевого продукта, ускорение и упрощение способа.
Поставленная цель достигается тем, что культивирование штаммов E.cotl, продуцирующих термостабильный и термолабильный энтеротоксины, осуществляется на среде, содержащей: перевар Хоттингера 80-250 мл (1000 мг% аминного азота), магний сернокислый 3,0-3,8 г, натрий фосфорнокислый однозамещенный 6,0-6,8, калий фосфорнокислый однозамещенный 3,0-3,8, глюкоза 5,0-7,0 (только для термостабильного энтеротоксина), вода дистиллированная до 1 л.
18-24-часовые культуры центрифугируют при 6000-8000 об/мин, в течение 30-40 мин, удаляют биомассу, токсиносодержа- щий материал осаждают сульфатом аммония из расчета 650 г/л, Осажденный токсиносодержащий материал центрифугируют при 6000-8000 об/мин, в течение 30- 40 мин на холоду, надосадок удаляют, а суммарные белковыэ фракции энтеротоксинов обрабатывают смесью этанол-эфир (1:1) для удаления липидов. Центрифугируют при 6000-8000 об/мин в течение 10-20
мин при 2-4°С. Верхний слой отбрасывали, а осадок перерастворяли в 0,05 М трис-НС буфере из расчета 1/10 от начального объема.
Обессоливание и фракционирование суммарной белковой фракции термостабильного энтеротоксина проводят на хрома- тографических колонках с сефадексом G-25, а термолабильного - G-150. Элюцию проводили 0,15 н NaCI. В ходе фракционирования выделяют 5 белковых фракций термостабильного и термолабильного энтеротоксинов.
Концентрацию белка в выделенных фракциях определяют с помощью спектрофотометра СФ-26 при 260 и 280 нм по методу Варбурга и Христиана.
Для электрофоретического контроля гомогенности выделенных фракций их разводят в 50 мкл фосфатно-солевого буфера, содержащего 5% ДСП. Биологическую активность фракций термостабильного энтеротоксина определяют с помощью теста анальной пробы на мышатах-сосунах, а термолабильного - с помощью теста отека лап белых мышей и Бикентеста.
Белковые фракции термостабильного и термолабильного энтеротоксинов, обладающие наибольшей биологической активностью, концентрируют против ПЭГ и используют для конъюгации.
Готовят смесь термостабильного и термолабильного энтеротоксинов в соотношении 1001 в фосфатно-солевом буфере (рН 7,0-7,2). К смеси добавляют 25%-ный раствор глутарового альдегида до конечной концентрации 1-3 г/л, полученную смесь выдерживают 1-2 ч при 18-20°С, и получают конъюгат. Конъюгат диализируют против фосфатно-солевого буфера (рН 7,0-7,2) в течение ч при 2-4°С. Проводят повторный диализ против 0,05 М трис-HCI буфера (рН 8,0-8,2) в течение 20-24 ч при 2-4°С,
С помощью диализных мешочков происходит задержка всего конъюгированного энтеротоксина и выделяется непрореагировавший термостабильный энтеротоксин и глутара/ ьдегид.
Количество связанного термостабильного энтеротоксина в конъюгате определяют посредством суммирования возрастания количества белка (по Лоури), присутствующего в диализате сверх количества термолабильного токсина, первоначально добавленного в конъюгат. Для увеличения имму- ногенной активности полученного конъюгата к нему добавляют раствор трис-HCI буфера, содержащий бычий сывороточный альбумин из расчета 10 г/л, рН 8,0-8,2.
Полученный конъюгат при необходимости концентрируют до 1/10 объема прошв ПЭГ.
Термостабильный и термолзбильный энтеротоксины концентрируют и очищают с 5 помощью более мягкого способа сульфатом аммония, в отличие от более грубого ацетон- ного фракционирования в прототипе, что зачастую приводит к значительным потерям активности токсиносодержащего материа- 10 лэ, вследствие денатурации белковых молекул.
Для конъюгации термостабильного и термолабильного энтеротоксинов в предлагаемом способе используют глутаральде- 15 гид, который является не только хорошим сдваивающим агентом, но и веществом, значительно снижающим токсические свойства конъюгата, при полном сохранении антигенных детерминант его составляющих. 20 Использование глутаральдегида для конъюгации энтеротоксинов E.coli позволяет сократить время конъюгации почти в 30 раз, по сравнению с прототипом.
Предлагаемый способ позволяет пол- 25 учать конъюгированный энтеротоксин E.coli в количествах, достаточных для иммунизации больших групп животных, а также добиться увеличения на 10-20% выхода конечного продукта,30
Добавление к новому молекулярному образованию, конъюгированному энтеро- токсину E.coli, бычьего сывороточного альбумина позволяет значительно увеличить его иммуногенную активность.35
Использование в заявляемом решении легкодоступных реактивов и оборудования позволяет ускорить способ получения конъ- югированного энтеротоксина E.coli более чем в 2 раза.40
Способ осуществляют следующим образом.
Пример. Культуры кишечной палочки, выделенные от павших животных, продуцирующие термостабильный и 45 термолабильный энтеротоксины, высевают раздельно на питательную среду, содержащую следующие компоненты: перевар Хот- тингера 200 мл (содержание аминного азота 1000 мг%); калий фосфорнокислый одноза- 50 мещенный 3,5 г; натрий фосфорнокислый однозамещенный 6,5; сульфат магния 3,5; глюкоза 6,0 (только для культивирования термолабильного штамма E.coli), вода дистиллированная до 1 л, рН 7,14 и культивиру- 55 ют в течение 20 ч при 37°С в условиях аэрации. Бульонные культуры центрифугируют при 8000 об/мин при 4°С в течение 40 мин и получают надосадочную жидкость, содержащую энтеротоксины.
Токсиносочержащий материал осаждают медленным добавлением сульфата аммония из расчета 650 г/л и оставляют на 20 ч при непрерывном встряхивании при 4°С. Через 2 ч токсиносодержащий материал осаждают центрифугированием при 8000 об/мин в течение 30 мин на холоду. Осадки суммарных белковых фракций знтеротокси- нов обрабатывают смесью этанол-эфир (1:1) с целью удаления липидов. Центрифугируют при 8000 об/мин в течение 20 мин, верхнюю эфирсодержащую фазу удаляют, а осадок перерастворяют в 0-.05 М трис-HCI буфере (рН 8,0) из расчета 1/10 от начального объема.
Материал, содержащий термостабильный энтеротоксин, обессоливают и фракционируют на хроматографической колонке с сефадексом G-25, а термолабильный энтеротоксин - на колонке с сефадексом G-150. Элюцию проводят 0,15 н NaCI (рН 7,0), скорость удаления жидкости из колонки 2-3 капли в минуту. Элюатсобираютфракциями по 5 мл. Количество белка в каждой фракции определяют на спектрофотометре СФ-26 при 260 и 280 нм по методу Варбурга и Христиана.
Для электрофоретического контроля гомогенности выделенных фракций их разводят в 50 мкл фосфатно-солевого буфера, содержащего 5% ДСН.
Биологическую активность выделенных фракций термостабильного энтеротоксина определяют с помощью теста анальной пробы на мышатах-сосунах, а термолабильного - с помощью отека лап белых мышей и Бик- кентеста.
Белковые фракции, обладающие наибольшей биологической активностью, концентрируют против ПЭГ до 1/10 объема и используют для конъюгации.
Готовят смесь термостабильного и термолабильного энтеротоксинов в фосфатно- солевом буфере рН 7,0 в соотношении 100:1. К смеси добавляют 25%-ный раствор глутарового альдегида до конечной концентрации 2 г/л, полученную смесь выдерживают в течение 2 ч при 20°С и получают крнъюгат. Конъюгат диализируют против фосфатно-солевого буфера рН 7,0 в течение 20 ч при 4°С. Проводят повторный диализ против 0,05 М трис-HCI буфера рН 8,0 в течение 20 ч при 4°С.
Количество связанного термостабильного энтеротоксина в конъюгате определяют посредством суммирования возрастания количества белка (по Лоури), присутствующего в диализате сверх количества термолабильного энтеротоксина, первоначально добавленного в конъюгат. Для увеличения
иммуногенной активности полученного конъюгата к нему добавляют раствор трис- HCI буфера, содержащего бычий сывороточный альбумин из расчета 10 г/л, рН 8,0.
Полученный конъюгат при необходимости концентрируют до 1/10 объема против ПЭГ.
Контроль стерильности и безвредности полученного препарата осуществляют по общепринятой методике.
Иммуногенность препарата вместе с адъювантом (раствор гидроокиси алюминия) проверяют на белых мышах массой 16 г. Вакцинирующий материал вводят двукратно, подкожно в дозе 0,3 и 0,5 мл с интервалом в 7 дней. Через 20 дней после второй прививки животных заражают летальными дозами термостабильного и термолабильного энтеротоксинов и культурами гомологических и гетерологических штаммов E.coli.
Вакцинированные животные в 95% случаев проявляют устойчивость против 2 ДЛМ токсинов и ЛДбО культур гомблогичного и в 80% случаев защита оставила против 2 ДЛМ токсинов и ЛДбо культур гетерологичных штаммов Е.соП.
В контрольных группах мыши, которых заражают 2 ДЛМ токсинов и ЛДво культур, пали в 90% случаев.
Сенсибилизирующую активность пр ё- пйрата исследуют в тесте активной системной анафилаксии на морских свинках по методу Немова.
Пример 2. Культивирование токси- генных штаммов Е.со, получение нативных токсинов, их концентрирование и очистку, контроль гомогенности и определение биологической активности проводят аналогично примеру 1.
Готовят смесь термостабилъното и термолабильного энтеротоксинов в фосфатно- солевом буфере в соотношении 50:1 (рН 7,0). К смеси добавляют 25%-ный раствор глутарового альдегида до конечной концентрации 2 г/л, полученную смесь выдерживают при 20°С в течение 2 ч. Полученный конъюгат диализируют против фосфатно-солевого буфера (рН 7,0) в течение 20 ч при 4°С. Повторно диализируют против 0,05 М трис- HCI буфера (рН 8-0) в течение 20 ч при 4°С. В конъюгат добавляют трис-HCI буфер, содержащий БСА.
Пример 3. Культивирование кишечной палочки продуцирующей термостабильный и термолабильный энтеротоксины, получение и очистку, определение гомогенности и биологической активности осуществляли как в примере 1. В данном примере готовят смесь термостабильного и термолабильного энтеротоксинов в соотношении 150:1 в фосфатно-солевом буфере рН 7,0 Конъюгацию проводят аналогично примеру 1.
5Пример 4. В примере 4 изменена
концентрация глутарового альдегида с 2 г/л до 1,5 г/л. Смесь термостабильного и термолабильного энтеротоксинов готовят в соотношении 100:1 в фосфатно-солевом буфере
0 рН 7,0. В дальнейшем конъюгацию проводят аналогично примерам 1-3.
Пример 5. В этом примере концентрация глутарового альдегида взята 2,5 г/л. Термостабильный и термолабильный энте5 ротоксины берут в соотношении 100:1. Режим конъюгации тот же, что и в примере 1. Данные, иллюстрирующие выше изложенные примеры, приведены в табл. 1-6. Изменение соотношения компонентов
0 питательной среды, времени культивирования бакмассы и изменение температуры культивирования оказывают существенное значение на содержание энтеротоксинов в культуральной жидкости.
5 П.р и м е р 6. Культуры кишечной палочки, выделенные от павших животных, продуцирующие термостабильный и термолабильный энтеротоксины, высевают раздельно на питательную среду, содержащую сле0 дующие компоненты: перевар Хоттингера - 80 мл (содержание аминного азота 1000 мг%), калий фосфорнокислый однозаме- щенный 3,0 г; натрий фосфорнокислый од- нозамещенный 6,0 г; сульфат магния 3,0 г;
5 глюкоза 5,0 г; вода дистиллированная до литра, рН 7,14 и культивируют в течение 18 ч при 36°С в условиях аэрации. Бульонные культуры центрифугируют при 6000 об/мин при 2°С в течение 40 мин и получают над0 осадочную жидкость, содержащую энтеротоксины.
Количество белка в на досад очной жидкости, содержащей энтеротоксины, составляет 9000 мкг/мл.
5
Пример 7, Культуры кишечной палочки высевают раздельно на питательную среду, содержащую следующие компоненты: перевар Хоттингера 250 мл (содержание
0 аминного азота 1000 мг%), калий фосфорнокислый однозамещенный 3,8 г; натрий фосфорнокислый однозамещенный 6,8 г; магний сернокислый 3,8 г; глюкоза 7,0 г: вода дистиллированная - до литра, рН сре5 ды 7,14 и культивируют в течение 24 ч при 38°С, в условиях аэрации, Бульонные культуры центрифугируют при 6000 об/мин при 3°С, в течение 40 мин и получают надосадоч- ную жидкость, содержащую энтеротоксины. Количество белка в надосадочной жидкости,
содержащей энтеротоксины, составляет 7000 мкг/мл.
Максимальное содержание белка в над- осадочной жидкости (11000 мкг/мл) отмечается при оптимальном соотношении компонентов питательной среды, времени и температуре культивирования, как в приме- ре 1, а наименьшее содержание белка - при соотношении компонентов, как в примере 7.
Изменение режима центрифугирования бульонных культур с 6000 до 8000 об/мин, позволяет добиться более полного осаждения бактериальных частиц. Увеличение скорости центрифугирования более 8000 об/мин не оказывает существенного влияния на полноту осаждения. Поэтому-оптимальным режимом центрифугирования выбрана скорость 8000 об/мин.
Пример 8. После центрифугирования и определения биоактивности термостабильного и термолабильного энтеротокси- нов, в надосадочной жидкости по методике Романенковой Н.И. и в Биккен-тесте, токси- носодержащий материал осаждают медленным добавлением сульфата аммония до 65% насыщения для термолабильного и до 90% насыщения для термостабильного зн - теротоксинов и оставляют на 18 ч при 2аС. Осадок, содержащий термостабильный эн- теротоксин, перерастворяют в 0,05 М трис- НС1 буфере (рН 8,0), а термолабильный - в дистиллированной воде из расчета 1/10 от начального объема. Растворенные осадки диалиэируют против дистиллированной воды в течение 48 ч.
После определения гомогенности полученных энтеротоксинов с помощью диск- электрофореза в полнакриламидном геле готовя смесь термостабильного и термолабильного энтеротокеинов в соотношении 100:1 в фосфатно-солевом буфере (рН 7,0). К смеси добавляют 25%-ный раствор глутаро- вого альдегида до конечной концентрации 2 г/я, реакционную смесь выдерживают 1 ч при 25°С. Конъюгационную смесь подвергают диализу против фосфатно-солевого буфера (рН 7) в течение 18ч при 4°С.
Уменьшение времени высаливания с 20 до 18 ч привадит, в некоторых случаях, к недоосаждению части энтеротоксинов. Диализ перерастворенных осадков токсинов, в течение 48 ч позволяет добиться полного освобождения материала от сернокислого аммония. Полноту освобождения от следов сульфат-ионов контролируют в реакции с 10%-ным BaCla.
Выдерживание реакционной смеси, энтеротоксинов и глутарового альдегида, в течение 1 ч, достаточно для получения конъюгата, однако инкубация смеси в течение 2 ч позволяет добиться более полного соединения термостабипьного и термолабильного энтеротоксинов.
Увеличение температуры при реакции 5 конъюгации с 20 до 25°С существенно не влияет на скорость связывания термостэ- бильного и термолабильного энтеротоксинов, однако, увеличение или уменьшение данного режима температур ведет к задер10 жке конъюгации и требует увеличения времени реакции.
Конъюгат термостабильного и термолабильного энтеротоксинов представляет собой прозрачную жидкость бурого цвета (рН
5 8,0) без запаха, он не токсичен и безвреден для животных, не обладает анафилактоген- ными свойствами. Контроль стерильности и безвредности полученного конъюгата осуществляют по общепринятой методике.
0 Полученный конъюгат по своей биологической активности значительно превосходит прототип. Предлагаемый способ ускоряет получение препарата в 3 раза (вместо 260 ч, около 70). Он существенно сокра5 щает рабочее время, занятое соответствующими операциями. Число процедур минимально, они лишены трудоемкости. Упрощена и ускорена процедура получения и очистки энтеротоксинов, а также самой
0 конъюгации.
Предлагаемый способ не нуждается в дорогостоящем и мало доступном оборудовании и реактивах: амберлит НАД-2, сефа- декс G-25. ДАН сефацил, 1 этил 3 /3 диметил5 аминопропил/ карбодиимид и др. Привитые конъюгатом лабораторные животные прояв- « ляют высокую активность (95%) против ле- f тальных доз термолабильного и термостабильного энтеротоксинов и культур гомоло0 гичных и гетерологических штаммов кишечной палочки.
Формула изобретения Способ получения конъюгированного
5 энтеротоксина Eschertchla colt, включающий культивирование штамма-продуцента в жидкой питательной среде, отделение ток- синосодержащего супернатанта центрифугированием с последующим осаждением,
0 очисткой и конъюгацией энтеротоксина сшивающим агентом, отличающийся тем, что, с целью повышения иммуногенно- сти целевого продукта, ускорения и упрощения способа культивирование осущест5 вляют в течение 18-24 ч в жидкой питательной среде следующего состава, г/л: перевар Хоттингера 80-250; сернокислый магний 3,0-3,8; однозамещенный фосфорнокислый натрий 6,0-6,8, однозэмещенный фосфорнокислый калий 3,0-3,Р. глюкоза 5 0-7,0;
дистиллированная вода до 1 л, токсиносо- держащий супернатант делят на две части, из одной осаждают термолабильный токсин раствором сульфата аммония при 60-65% насыщения, из другой - термостабильный токсин при 85-90% насыщения, каждый из полученных преципитатов выдерживают 18-20 ч при 2-4°С в режиме встряхивания, центрифугируют при 6000-8000 об/мин в течение 30-40 мин при 2-4°С, далее осадок термостабильного токсина растворяют в дистиллированной воде, а осадок термолабильного токсина - в 0,05 М трис-НС буфере из расчета 1/10 от начального объе
5
ма, очистку токсинов проводят диализом, затем их объединяют в объемном соотношении 100:1 соответственно в фисфатном буфере рН 7,0-7,2, конъюгацию проводят 25%-ным раствором глутарового альдегида при конечной концентрации 2 г/л при 20- 25°С в течение 1-2 ч, далее конъюгат двукратно диализуют против фосфатного буфера рН 7,0-7,2 в течение 18-20 ч при 2-4°С, а затем против 0,05 М трис-HCI буфера в течение 18-20 ч при 2-4 С, в полученный конъюгат добавляют раствор трис-HCI буфера, содержащий бычий сывороточный альбумин в концентрации 10 г/л.
Таблица 1





| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения энтеротоксина еSснеRIснIа coLI | 1990 |
|
SU1835294A1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ ЭШЕРИХИЙ | 1996 |
|
RU2117041C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ ЭШЕРИХИЙ | 1997 |
|
RU2142506C1 |
| Иммуноферментная тест-система для серологической диагностики анаэробной энтеротоксемии животных и контроля напряженности поствакцинального иммунитета | 2016 |
|
RU2625031C1 |
| ШТАММ БАКТЕРИЙ ESCHERICHIA COLI РНМВ, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ЗАЩИТЫ ПУШНЫХ ЗВЕРЕЙ ОТ ТОКСИКОЗОВ, ВЫЗВАННЫХ ЭНТЕРОТОКСИНАМИ КИШЕЧНЫХ БАКТЕРИЙ, И ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКИЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ | 2003 |
|
RU2259213C2 |
| ТЕСТ-КОМПЛЕКТ ДЛЯ ВЫЯВЛЕНИЯ ХОЛЕРНОГО ТОКСИНА В СРЕДЕ КУЛЬТИВИРОВАНИЯ | 2020 |
|
RU2737776C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДЕЗОКСИРИБОНУКЛЕОТИДА | 1993 |
|
RU2077589C1 |
| СОСТАВ ДЛЯ КУЛЬТИВИРОВАНИЯ ЭШЕРИХИЙ | 1997 |
|
RU2142505C1 |
| Способ определения энтеротоксина энтеробактерий в биологическом материале | 1987 |
|
SU1388422A1 |
| ШТАММ БАКТЕРИЙ ESCHERICHIA COLI № РПМБ, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ЗАЩИТЫ ПУШНЫХ ЗВЕРЕЙ ОТ ТОКСИКОЗОВ, ВЫЗВАННЫХ ЭНТЕРОТОКСИНАМИ КИШЕЧНЫХ БАКТЕРИЙ | 2003 |
|
RU2250780C1 |
Изобретение относится к биотехнологии и может быть использовано для получения конъюгированного термостабильного энтеротоксина кишечной палочки. Сущность изобретения: культивирование токси- генных штаммов осуществляют на среде следующего состава, г/л: перевар Хоттинге- ра 80-250; сернокислый магний 3,0-3.8: однозамещенный фосфорнокислый натрий 6,0-6,8; однозамещенный фосфорнокислый калий 3,0-3.8; глюкоза 5#-7,0; дистиллиро ванная вода до 1 л, отделяют токсиносодер- жащий супернатант, термолабильный и термостабильный токсины осаждают сульфатом аммония при разной степени насыщения, выдерживают преципитаты 18-20 ч при 2-4°С, центрируют осадки термолабильного и термостабильного токсинов, растворяют в дистиллированной воде и трис-HCI буфере соответственно и диализу- ют, после чего «х объединяют в соотношении 100:1 и конъюгируют глутаровым альдегидом до конечной концентрации 2 г/л, конъюгат диализуют сначала против фосфатного буфера, а затем против трис- HCI буфера, конъюгат растворяют в трис- HCI буфере, содержащем бычий сывороточный альбумин. 6 табл. Ън Ё
Влияние соотношения термостабильный/термола- бильный энтеротоксины на % содержаний термостабильного знтеротоксина в конечном конъюгате.
Влияние соотношения глутаральдегид/общий белок
на % термостабильного энтеротоксина в конечном
конъюгате
Таблица 2
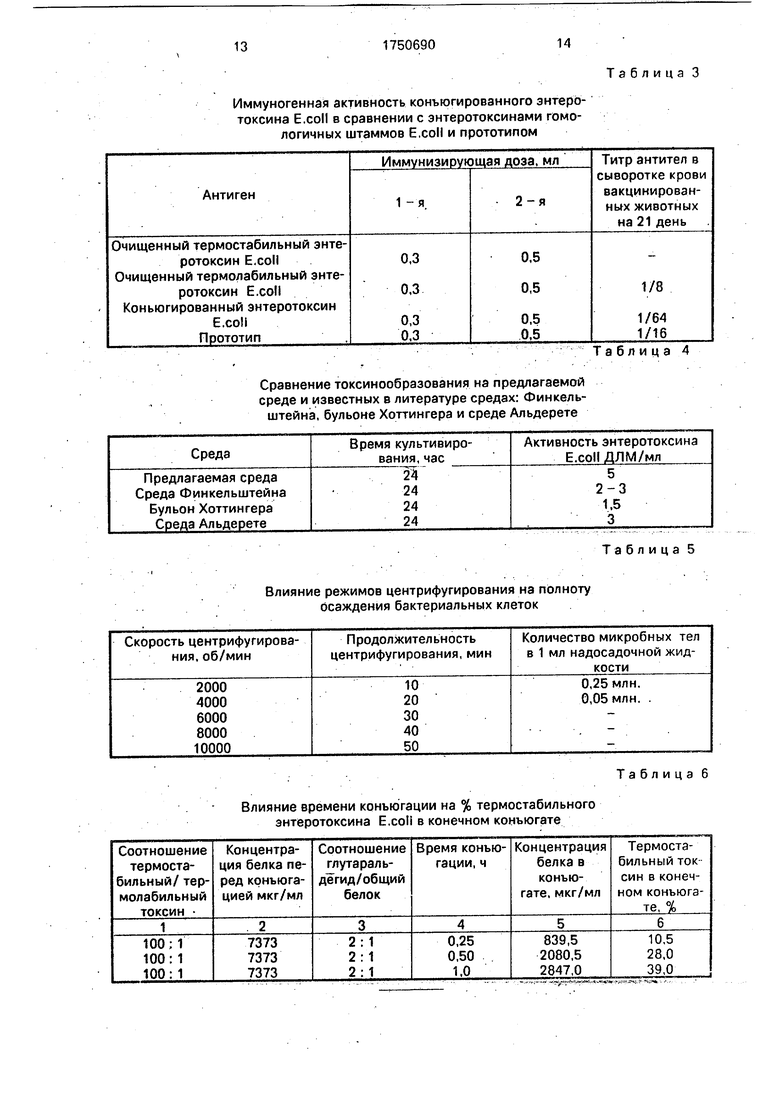
Иммуногенная активность конъюгированного энтеро- токсина E.coll в сравнении с энтеротоксинами гомологичных штаммов E.coll и прототипом
Сравнение токсинообразования на предлагаемой
среде и известных в литературе средах: Финкельштейна, бульоне Хоттингера и среде Альдерете
Влияние режимов центрифугирования на полноту осаждения бактериальных клеток
Влияние времени конъюгации на % термостабильного энтеротоксина E.coli в конечном конъюгате
Таблица 3
Таблица 4
Таблица 5
Таблица 6
Продолжение табл.6.
| Патент США № 4411888, КЛ.А61 К 39/108, 1983. |
Авторы
Даты
1992-07-30—Публикация
1989-12-19—Подача